Результат интеллектуальной деятельности: ТАПЕНТАДОЛ ДЛЯ ЛЕЧЕНИЯ В СВЯЗИ С ОСТЕОАРТРОЗОМ
Вид РИД
Изобретение
Изобретение относится к применению тапентадола для лечения боли в связи с остеоартрозом.
Остеоартроз (артроз, деформирующий артроз) является наиболее распространенным заболеванием суставов человека. Оно является динамическим, но медленно прогрессирующим, дегенеративным заболеванием хряща или другого тканевого комплекса сустава, особенно у пожилых людей, с периодическими воспалительными эпизодами. Оно может отличаться от других ревматических заболеваний отсутствием воспалительных параметров, ограниченной подвижностью, кратковременной тугоподвижностью суставов и их рентгенологическими признаками.
Остеоартроз или изнашивание и старение суставов является повреждением суставов, которое начинается с деградации хряща суставов. В тяжелых случаях оно в конечном итоге приводит к процессу трансформации в смежной кости, и поверхность сустава разрушается. Поэтому следствиями заболевания являются боль и тугоподвижность суставов с ограниченным движением. Суставы могут стать деформированными и становятся, в конце концов, полностью окостенелыми. Остеоартроз, как правило, прогрессирует медленно. В результате, оболочка хряща становится, прежде всего, тоньше и хондроциты становятся более метаболически активными. Изменения субхондральной трабекулы приводят к уменьшению разгрузки губчатой кости.
Восстанавливающаяся ткань подвергается большей нагрузке и по мере продвижения заболевания меняется равновесное состояние по отношению к разрушению. Рентгенограмма выявляет сужение поверхности сустава и формирование остеофитов по краям. Для дальнейших деталей является возможным, например, сослаться на D Höffler et al., AVP Therapieernpfehlungen der Arzneimittelkommission der Deutschen Ärzteschaft, Arzneiverordnung in der Praxis, "Degenerative Gelenkerkrankungen", 2nd Edition 2001; and H Bröll et al., CliniCum, Special Edition September 2001, Konsensus-Statement, "Arthrose - Diagnostik % Therapie".
В принципе, все суставы могут быть подвержены артротическим изменениям. Однако наиболее часто подвергаются коленные суставы (гонартроз) и тазобедренные суставы (коксартроз), которые должны нести большое количество веса. Заболевание также часто возникает в малых позвоночных суставах (спондилоартроз) и в суставах пальцев. МКБ-10 (Международная классификация болезней 10-й редакции) определяет остеоартрозы тазобедренных суставов и коленных суставов как первичные заболевания хряща, связанные с болевыми ограничениями движения (боль, следующая за периодами пассивности, боль весовой нагрузки) или сложностями при ходьбе. Воспаление, такое как синовит, может быть, но не обязательно, установленным.
Основными и ранними симптомами остеоартроза являются боли (ранняя триада: боль, следующая за периодами пассивности, боль, вызванная усталостью, боль весовой нагрузки; поздняя триада: постоянная боль, ночная боль, мышечная боль). Указанное сопровождается ограничениями в движении, чувствительностью к изменениям погоды и хрустом. Случаи боли при остеоартрозе являются, во-первых, результатом раздражения в периартикулярных сухожилиях и соединительных связках, во-вторых, воспаления, растяжения капсулы суставов, реактивного выпота, повышенным давлением в субхондральной кости и микротрещин.
На ранних стадиях боль возникает только на весовую нагрузку и проходит, если движение продолжается, например при дальнейшей ходьбе, после нескольких минут. Когда сопровождается воспалением, типичными симптомами активированного остеоартроза является следующее: суставы являются болезненными, ощущается жар, и являются припухшими. Подвижность ограничена. Воспаление часто проходит даже без лечения. Это объясняет в основном эпизодическое течение остеоартроза: фазы более тяжелой боли и ограниченного движения чередуются фазами меньшей боли и хорошей подвижности. По мере продвижения заболевания признаки изнашивания и старения усиливаются, одна болевая фаза идет за другой более быстро. В конце концов, боль становится постоянной.
Существует вид пригодного лекарственного и нелекарственного лечения, которое может быть применено отдельно или в сочетании:
- общепринятые меры, например плавание, езда на велосипеде, целенаправленная гимнастика, применение технических вспомогательных средств, диет, и т.д.;
- физиотерапевтическое лечение, например, прогревающие компрессы, электротерапия и кинезотерапия, и т.д.;
- фармакотерапия;
- ортопедические средства, например бандажи, ортезы, и т.д.; и
- оперативное лечение, например трансплантация аутологичных хрящевых клеток, замена искусственных суставов, и т.д.
Европейская лига против ревматизма (EULAR) рекомендует для определения успеха специального лечения применять индекс Лекена, т.е. общую оценку врачом и оценку боли пациентом. В дополнение, к оценке припухлости, покраснения и сопротивления давлению сустава, Управление по контролю за продуктами питания и лекарственными средствами рекомендует, чтобы боль и функция были оценены посредством индекса остеоартроза университетов Западного Онтарио и МакМастера (WOMAC) и индекса Лекена. Для лекарственных средств, применяемых для симптоматического лечения остеоартроза, Общество исследования остеоартроаза рекомендует шкалы для оценки болевого синдрома WOMAC как основного критерия и шкалы ограничения подвижности WOMAC, или индекс Лекена как второго критерия, дополнительно общую оценку врачом и пациентом.
Фармакотерапевтический спектр групп действующих веществ, пригодных для лечения остеоартроза, включает
- неопиоидные анальгетики, например парацетамол;
- нестероидные противовоспалительные лекарственные средства (НПВС), например ацеметацин, ацетилсалициловая кислота, ацеклофенак, диклофенак, ибупрофен, кетопрофен, мефенамовая кислота; тиапрофеновая кислота, индометацин, лоназолак, напроксен, проглуметацин, мелоксикам, пироксикам, рофекоксиб, целекоксиб;
- опиоидные анальгетики, например дигидрокодеин, трамадол, тилидин-налоксон, морфин, бупренорфин, оксикодон, фентанил и гидроморфон;
- подкожно вводимые антивоспалительные и гиперемические вещества;
- глюкокортикостероидные кристаллические суспензии для внутрисуставных инъекций; и
- другие действующие вещества для перорального приема или внутрисуставных инъекций, например глюкозамин, адеметионин, оксацепрол, гиалуроновая кислота, и т.д.
Опиоидные анальгетики не относятся к обычному спектру лекарственных средств для лечения остеоартроза, но являются неизбежными в определенных ситуациях. Однако традиционные опиоидные анальгетики иногда имеют значительные побочные эффекты, в частности запор, тошноту, рвоту, головную боль, седативный эффект, усталость, угнетение дыхания, и иногда падение кровяного давления. Эти побочные эффекты усложняют длительное лечение боли в связи с остеоартрозом. Поэтому лечение традиционными опиоидными анальгетиками в основном показаны, когда все другие варианты выбора лечения были исчерпаны, например в случае пациентов, которые не могут быть подвержены операции, но страдают от исключительной боли в состоянии покоя, которая не реагирует на другие вещества с анальгезирующим действием.
Существует условие для альтернативных фармакотерапевтических методов остеоартроза, характеризующихся эффективным контролем боли и сниженным профилем побочных эффектов.
Поэтому целью изобретения было найти композиции, которые являются эффективными в контролировании боли в связи с остеоартрозом и имеющие преимущества перед традиционными анальгетиками.
Указанная цель достигнута с помощью предмета формулы изобретения.
Изобретение относится к применению тапентадола для изготовления лекарственного средства для лечения боли в связи с остеоартрозом.
Неожиданно было выявлено, что тапентадол, предпочтительно в качестве композиции пролонгированного высвобождения (ПВ) (синоним композиции продленного высвобождения (ПВ)), т.е. композиции с продленным высвобождением в значении Европейской Фармакопеи, сочетающей отличную эффективность в лечении боли в связи с остеоартрозом, с пониженным спектром побочных эффектов. Продленное высвобождение обычно понимается в значении модифицированного высвобождения, которое отличается от высвобождения традиционных лекарственных форм, вводимых тем же путем. Модификация высвобождения обычно достигается специальной конструкцией лекарственной формы или специальным способом изготовления.
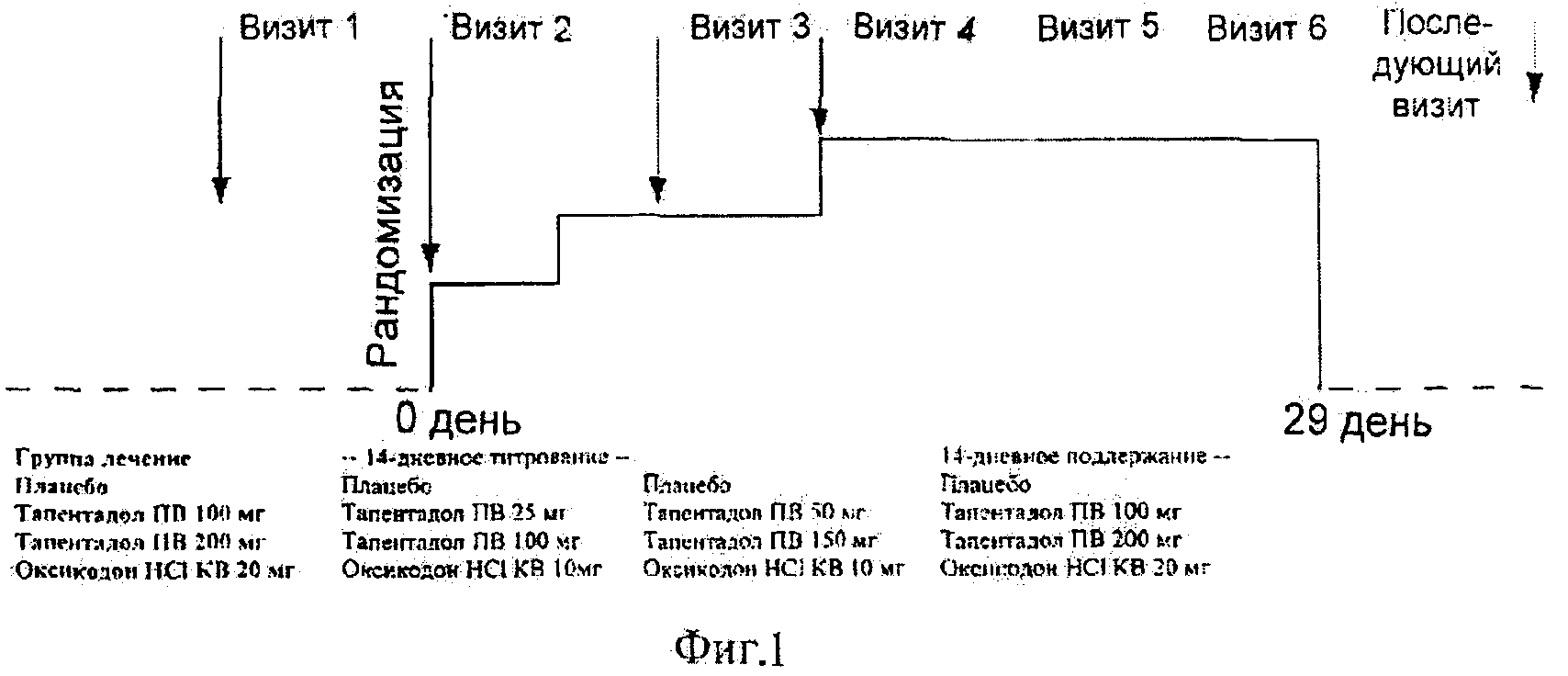
Фигура 1 показывает схематическое представление схемы титрования, примененной в течение исследования эффективности тапентадола для лечения боли в связи с остеоартрозом.
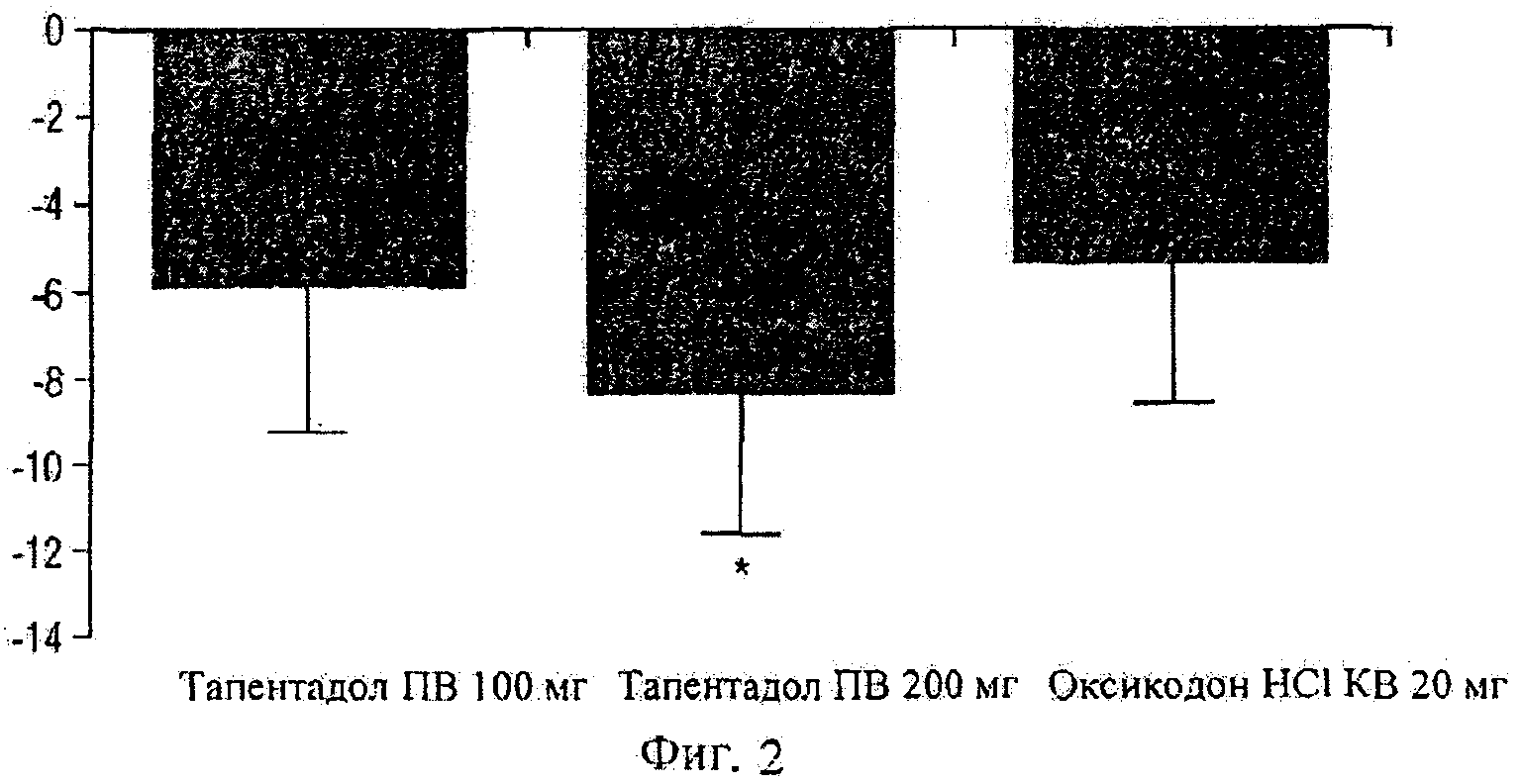
Фигура 2 показывает схематическое представление эффективности тапентадол (100 мг и 200 мг) в сравнении с плацебо и оксикодоном.
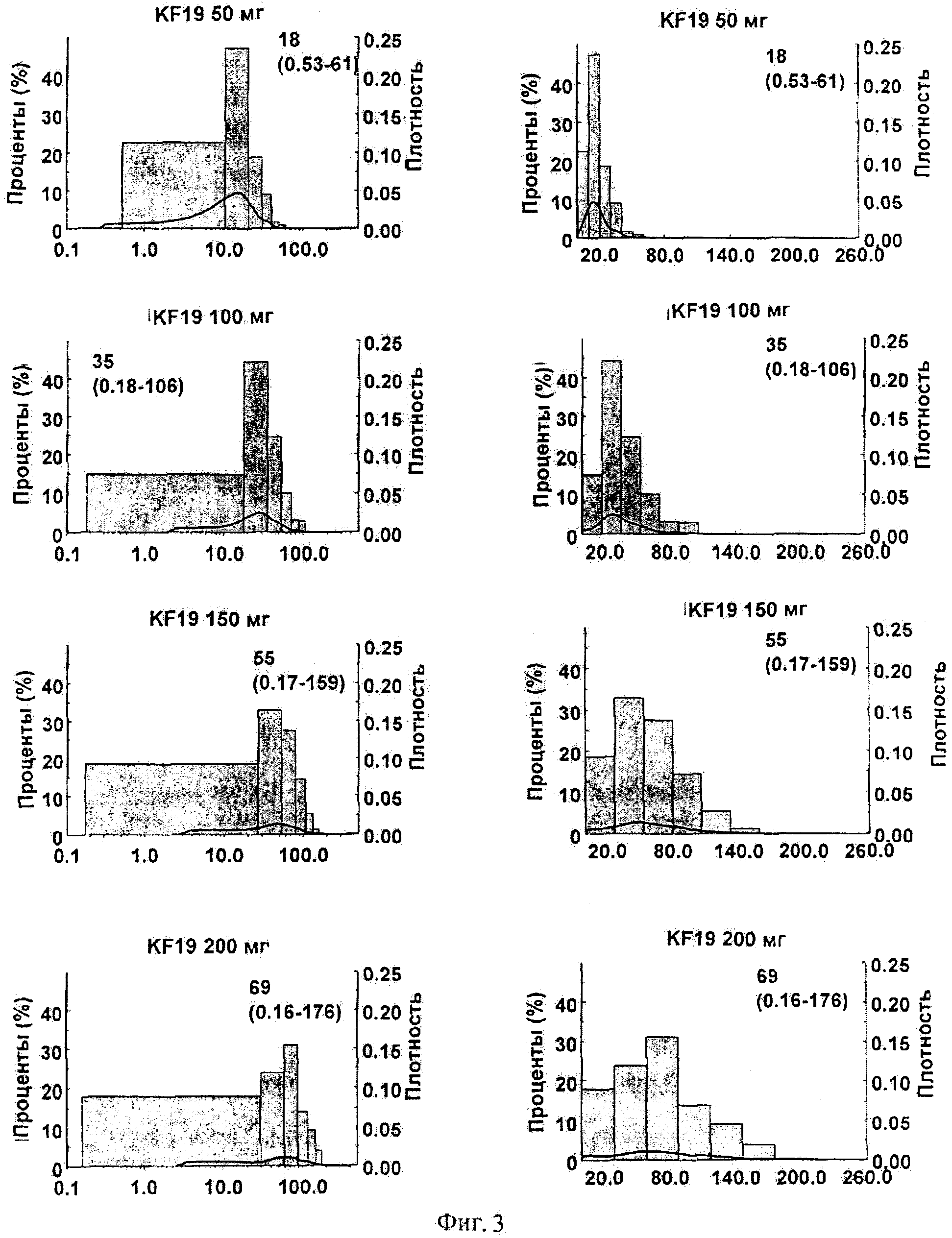
Фигура 3 показывает математический анализ распределения сывороточных концентраций в пределах группы больных, следующих приему различных доз тапентадола.
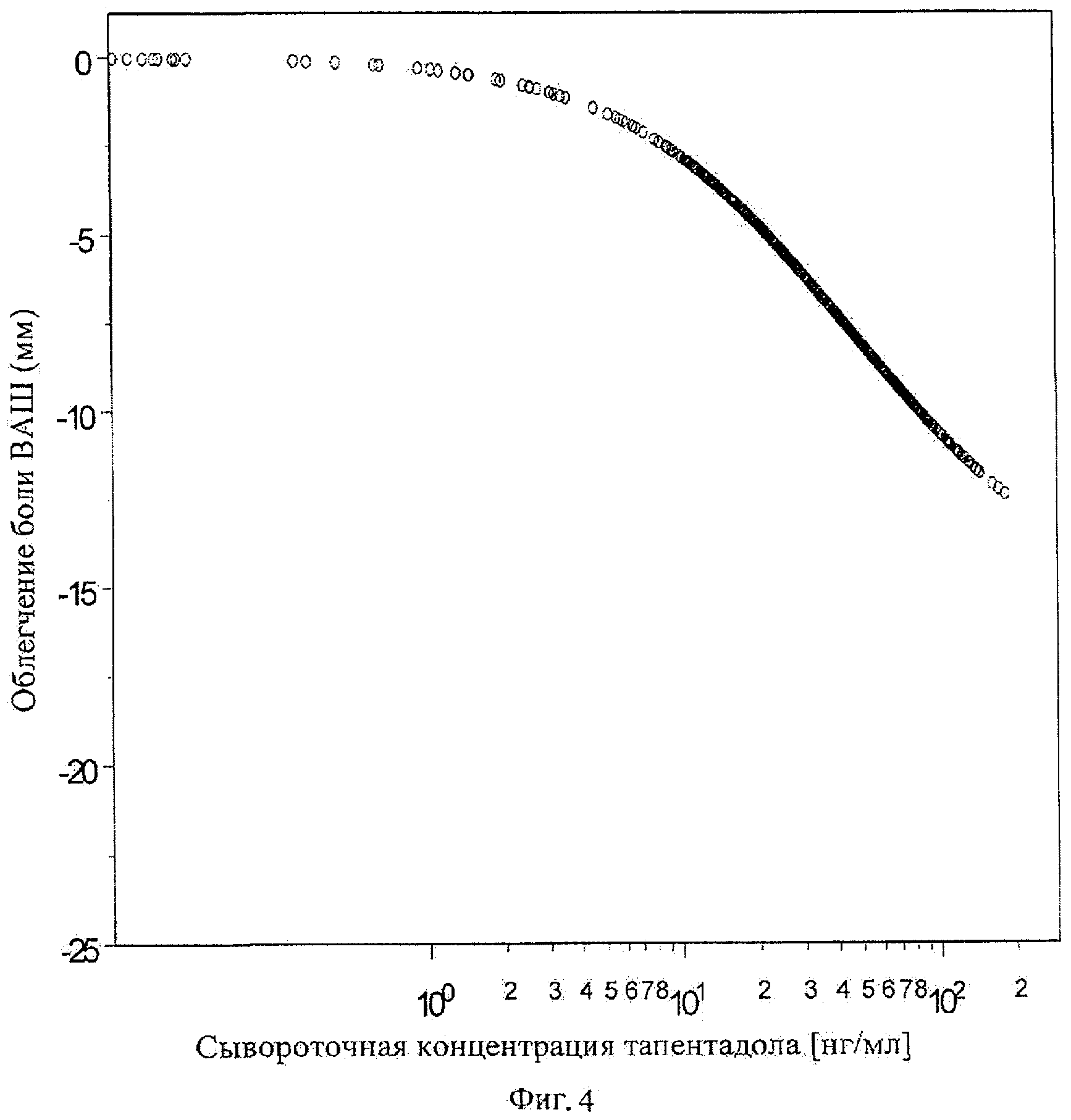
Фигура 4 показывает математический анализ связи между сывороточными концентрациями тапентадола и его эффектом в отношении облегчения боли в группе больных на основе данных различных клинических исследований.
Тапентадол, т.е. (-)-(1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол, является синтетическим, центрально действующим анальгетиком, который является эффективным в лечении от умеренной до тяжелой, острой или хронической боли.
Тапентадол демонстрирует двойной механизм действия, с одной стороны, как агонист µ-опиоидного рецептора, и с другой стороны, как ингибитор переносчика норадреналина. У людей сродство тапентадола к рекомбинантно полученному µ-опиоидному рецептору является в 18 раз меньше, чем у морфина. Однако клинические исследования показали облегчающее боль действие тапентадола, которое является только в два или в три раза меньше, чем у морфина. Только слегка пониженная анальгезирующая эффективность с одновременно в 18 раз пониженным сродством к рекомбинантому µ-опиоидному рецептору показывает, что свойство тапентадола ингибировать переносчик норадреналина также содействует его анальгезирующей эффективности. Следовательно, можно придти к заключению, что тапентадол имеет анальгезирующую эффективность, подобную чистым агонистам µ-опиоидного рецептора, но имеет гораздо меньше побочных эффектов, связанных с µ-опиоидным рецептором. Композиция может быть применена в форме ее свободного основания, или в качестве соли, или сольвата. Изготовление свободного основания известно, например, из EP-A 693475.
Для целей описания, "тапентадол" означает (-)-(1R,2R)-3-(3-диметиламино-1-этил-2-метил-пропил)-фенол и соответствующие фармацевтически приемлемые соли и сольваты.
Подходящие фармацевтически приемлемые соли включают соли неорганических кислот, таких как, например, соляной кислоты, бромводорода и серной кислоты, и соли органических кислот, таких как метан сульфоновой кислоты, фумаровой кислоты, малеиновой кислоты, уксусной кислоты, щавелевой кислоты, янтарной кислоты, яблочной кислоты, винной кислоты, миндальной кислоты, молочной кислоты, лимонной кислоты, глютаминовой кислоты, ацетилсалициловой кислоты, никотиновой кислоты, аминобензойной кислоты, альфа-кислоты, гиппуровой кислоты и аспарагиновой кислоты. Предпочтительной солью является хлористоводородная.
В предпочтительном варианте осуществления, лекарственное средство является твердой лекарственной формой. Предпочтительно, лекарственное средство составлено для перорального приема. Однако другие лекарственные формы являются также возможными, например трансбуккальные, подъязычные, трансмукозальные, ректальные, внутрипоясничные, внутрибрюшинные, трансдермальные, внутривенные, внутримышечные, внутриягодичные, внутрикожные и подкожные.
В зависимости от лекарственной формы, лекарственное средство предпочтительно содержит подходящие аддитивы и/или вспомогательные вещества. Подходящие аддитивы и/или вспомогательные вещества, для целей изобретения, все являются веществами для достижения галеновых композиций, известных специалисту из уровня техники. Выбор из этих вспомогательных веществ и их количества осуществляется в зависимости от того, как лекарственное средство принимается, т.е. перорально, внутривенно, внутрибрюшинно, внутрикожно, внутримышечно, интраназально, трансбуккально или местно.
Подходящими для перорального применения являются лекарственные средства в форме таблеток, жевательных таблеток, драже, капсул, гранул, каплей, экстрактов или сиропов; подходящими для парентерального, наружного и ингаляторного приема являются растворы, суспензии, легко растворимые сухие лекарственные средства и спреи. Дополнительной возможностью являются суппозитории для ректального применения. Применение в депорастворенной форме фольги-носителя или пластыря, дополнительно с добавлением веществ, которые активируют проникновение через кожу, являются примерами подходящих форм применения для подкожного введения.
Примерами вспомогательных веществ и аддитивов для пероральных форм приема являются разрыхлители, лубриканты, связующие вещества, наполнители, формирующие высвобождение агенты, дополнительно растворители, отдушки, сахар, в особенности носители, разбавители, красители, антиокислители и т.д.
Для суппозиторий возможно применение, в числе других, восков и сложных эфиров жирной кислоты и для парентеральных способов приема, носителей, консервантов, замедляющих добавок и т.д.
Вспомогательными веществами могут быть, например: вода, этанол, 2-пропанол, глицерин, этиленгликоль, пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, глюкоза, фруктоза, лактоза, сахароза, декстроза, меласса, крахмал, модифицированный крахмал, желатин, сорбитол, инозитол, маннитол, микрокристаллическая целлюлоза, метилцеллюлоза, карбоксиметилцеллюлоза, ацетатцеллюлоза, шеллак, цетиловый спирт, поливинилпирролидон, парафины, воски, природные и синтетические смолы, смола акации, альгинаты, декстран, насыщенные и ненасыщенные жирные кислоты, стеариновая кислота, стеарат магния, стеарат цинка, глицерилстеарат, лаурилсульфат натрия, пищевые масла, сезамовое масло, кокосовое масло, арахисовое масло, соевое масло, лецитин, лактат натрия, полиоксиэтиленовые и полипропиленовые эфиры жирной кислоты, эфиры сорбитата и жирной кислоты, сорбиновая кислота, бензойная кислота, лимонная кислота, аскорбиновая кислота, дубильная кислота, натрий хлорид, калий хлорид, магний хлорид, кальций хлорид, оксид магния, оксид цинка, диоксид кремния, оксид титана, диоксид титана, магний сульфат, сульфат цинка, сульфат кальция, поташ, фосфат кальция, дикальцийфосфат, бромид калия, калий йодид, тальк, каолин, пектин, кросповидон, агар и бентонит.
Изготовление этого лекарственного средства и фармацевтических композиций выполняется с помощью средств, устройств, способов и процессов, которые хорошо известны в уровне техники технологии приготовления лекарственных средств, таких, как описано, например, в "Remington's Pharmaceutical Sciences", ed. AR Gennaro, 17th edition, Mack Publishing Company, Easton, pa. (1985), в особенности в части 8, разделы 76-93.
Например, для твердой композиции, такой как таблетка, действующее вещество лекарственного средства может быть гранулировано с применением фармацевтического носителя, например традиционных компонентов таблетки, таких как кукурузный крахмал, лактоза, сахароза, сорбитол, тальк, стеарат магния, дикальцийфосфат, или фармацевтически приемлемых смол и фармацевтических разбавителей, таких как вода, например, для того, чтобы сформировать твердую композицию, содержащую действующее вещество в гомогенном распределении. Гомогенное распределение понимается здесь в том значении, что действующее вещество является однородно распределенным по всей композиции, таким образом, что может легко быть поделено на равно эффективные отдельные лекарственные формы, такие как таблетки, капсулы, драже. Твердая композиция затем разделяется на отдельные лекарственные формы. Таблетки или пилюли также могут быть покрыты, или составлены несколько иным способом, с целью обеспечения лекарственной формы с отсроченным высвобождением. Подходящими покрывающими композициями, в числе других, являются полимерные кислоты и смеси полимерных кислот с такими материалами как шеллак, например цетиловый спирт и/или ацетатцеллюлоза.
Количество тапентадола, надлежащее для приема пациентами, отличается в зависимости от веса пациента, способа приема и тяжести заболевания. В предпочтительном варианте осуществления, лекарственное средство содержит тапентадол в количестве 10-300 мг, более предпочтительно 20-290 мг, еще более предпочтительно 30-280 мг, наиболее предпочтительно 40-260 мг, в качестве эквивалентной дозы, основанной на свободном основании.
Отсроченное высвобождение тапентадола возможно из композиций для перорального, ректального или подкожного приема. Предпочтительно, лекарственное средство составлено для приема один раз в день, для приема дважды в день (bid) или для приема три раза в день, с особенно предпочтительным приемом дважды в день (bid).
Отсроченное высвобождение тапентадола может, например, быть достигнуто ретардацией с помощью матрикса, покрытия или систем высвобождения с осмотическим действием (смотри, например, US-A-2005-58706).
В предпочтительном варианте осуществления, среднее значение сывороточных концентраций тапентадола, следуя приему лекарственного средства дважды в день в течение периода, по крайней мере, трех дней, более предпочтительно, по крайней мере, четырех дней и, в частности, по крайней мере, пяти дней, является в среднем, по крайней мере, 5,0 нг/мл, по крайней мере, 10,0 нг/мл, по крайней мере, 15,0 нг/мл, или, по крайней мере, 20,0 нг/мл, более предпочтительно, по крайней мере, 25,0 нг/мл, или, по крайней мере, 30,0 нг/мл, еще более предпочтительно, по крайней мере, 35,0 нг/мл, или, по крайней мере, 40,0 нг/мл, наиболее предпочтительно, по крайней мере, 45,0 нг/мл, или, по крайней мере, 50,0 нг/мл и, в частности, по крайней мере, 55,0 нг/мл, или, по крайней мере, 60,0 нг/мл. Это означает, что тапентадол принимается в течение периода, по крайней мере, трех дней дважды в день и затем, предпочтительно через 2 ч после приема сывороточные концентрации измеряются. Достоверная числовая величина затем достигается как средняя величина для всех исследуемых пациентов.
В предпочтительном варианте осуществления, среднее значение сывороточных концентраций тапентадола в наибольшее 50% группы больных, которая предпочтительно содержит, по крайней мере, 100 пациентов, более предпочтительно в наибольшее 40%, еще более предпочтительно в наибольшее 30%, наиболее предпочтительно в наибольшее 20% и, в частности, в наибольшее 10% группы больных, следующих приему дважды в день, в течение периода, по крайней мере, трех дней, более предпочтительно, по крайней мере, четырех дней и, в частности, по крайней мере, пяти дней, является в среднем меньше, чем 5,0 нг/мл, предпочтительно меньше, чем 7,5 нг/мл, еще более предпочтительно меньше, чем 10,0 нг/мл, наиболее предпочтительно меньше, чем 15,0 нг/мл и, в частности, меньше, чем 20,0 нг/мл.
В предпочтительном варианте осуществления, среднее значение сывороточных концентраций тапентадола в наибольшее 50% группы больных, содержащей предпочтительно, по крайней мере, 100 пациентов, более предпочтительно в наибольшее 40%, еще более предпочтительно в наибольшее 30%, наиболее предпочтительно в наибольшее 20% и, в частности, в наибольшее 10% группы больных, следующих приему дважды в день, в течение периода, по крайней мере, трех дней, более предпочтительно, по крайней мере, четырех дней и, в частности, по крайней мере, пяти дней, является в среднем больше, чем 300,0 нг/мл, более предпочтительно больше, чем 275,0 нг/мл, еще более предпочтительно больше, чем 250,0 нг/мл, наиболее предпочтительно больше, чем 225,0 нг/мл и, в частности, больше, чем 200,0 нг/мл.
Предпочтительно, среднее значение сывороточных концентраций тапентадола в, по крайней мере, 50% или 55% группы больных, которая предпочтительно содержит, по крайней мере, 100 пациентов, более предпочтительно в, по крайней мере, 60% или 65%, еще более предпочтительно в, по крайней мере, 70% или 75%, наиболее предпочтительно в, по крайней мере, 80% или 85% и, в частности, в, по крайней мере, 90% или 95% группы больных, следующих приему дважды в день, в течение периода, по крайней мере, трех дней, более предпочтительно, по крайней мере, четырех дней и, в частности, по крайней мере, пяти дней, является в среднем в промежутке от 1,0 нг/мл до 500,0 нг/мл, более предпочтительно в промежутке от 2,0 нг/мл до 450,0 нг/мл, еще более предпочтительно в промежутке от 3,0 нг/мл до 400,0 нг/мл, наиболее предпочтительно в промежутке от 4,0 нг/мл до 350,0 нг/мл и, в частности, в промежутке от 5,0 нг/мл до 300,0 нг/мл.
В предпочтительном варианте осуществления, процент стандартного отклонения (коэффициент отклонения) среднего значения сывороточных концентраций тапентадола, предпочтительно в группе больных из 100 пациентов, следующих приему лекарственного средства дважды в день, в течение периода, по крайней мере, трех дней, более предпочтительно, по крайней мере, четырех дней и, в частности, по крайней мере, пяти дней, является наибольшее ±90%, более предпочтительно наибольшее ±70%, еще более предпочтительно наибольшее ±50%, наибольшее ±45%, или наибольшее ±40%, наиболее предпочтительно наибольшее ±35%, наибольшее ±30%, или наибольшее ±25% и, в частности, наибольшее ±20%, наибольшее ±15%, или наибольшее ±10%.
Предпочтительно, сывороточные концентрации являются средними величинами, полученными на основе измерений в группе больных из предпочтительно, по крайней мере, 10, более предпочтительно, по крайней мере, 25, еще более предпочтительно, по крайней мере, 50, еще более предпочтительно, по крайней мере, 75, наиболее предпочтительно, по крайней мере, 100 и, в частности, по крайней мере, 250 пациентов. Квалифицированный специалист знает, как определить сывороточные концентрации тапентадола. В этом контексте, дается ссылка, например, на ТМ Tschentke et al., Drugs of the Future, 2006, 31(12), 1053.
В предпочтительном варианте осуществления
- лекарственное средство составлено для перорального приема;
- лекарственное средство является твердой и/или прессованной, и/или покрытой пленкой лекарственной формой; и/или
- лекарственное средство тапентадол имеет отсроченное освобождение из матрикса; и/или
- содержит лекарственное средство тапентадол в количестве от 0,001 до 99,999 мас.%, более предпочтительно 0,1-99,9 мас.%, еще более предпочтительно 1,0-99,0 мас.%, еще более предпочтительно 2,5-80,0 мас.%, наиболее предпочтительно 5,0-50,0 мас.% и, в особенности, 7,5-40,0 мас.% от общей массы лекарственного средства; и/или
- лекарственное средство содержит фармацевтически приемлемый носитель и/или фармацевтически приемлемые вспомогательные вещества; и/или
- лекарственное средство имеет общую массу в диапазоне от 25 до 2000 мг, более предпочтительно 50-1800 мг, еще более предпочтительно 60-1600 мг, еще более предпочтительно 70-1400 мг, наиболее предпочтительно 80-1200 мг и, в частности, 100-1000 мг; и/или
- лекарственное средство выбрано из группы, состоящей из таблеток, капсул, пеллет и гранул.
Лекарственное средство может быть обеспечено как простая таблетка или как покрытая таблетка (например, как покрытая пленкой таблетка или драже). Таблетки являются обычно круглыми и двояковыпуклыми, но удлиненные формы являются также возможными. Гранулы, сфероиды, пеллеты, или микрокапсулы, которые применяются для заполнения саше или капсул, или спрессованы в распадающиеся таблетки, являются также возможными.
Лекарственные средства, содержащие, по крайней мере, 0,001-99,999% тапентадола, в частности низкие, активные дозы, являются предпочтительными для целей избежания побочных эффектов. Лекарственное средство содержит предпочтительно от 0,01% от массы до 99,99% от массы тапентадола, более предпочтительно 0,1-90,0% от массы, еще более предпочтительно 0,5-80,0% от массы, наиболее предпочтительно 1,0-50,0% от массы и, в частности, 5,0-20,0% от массы. Для избежания побочных эффектов может быть полезно в начале лечения повышать количество принимаемого тапентадола постепенно (титрование), чтобы дать человеку медленно привыкнуть к действующему веществу. Предпочтительно, тапентадол принимается вначале в дозе, которая является ниже анальгезирующе активной дозы.
Особенно предпочтительно, лекарственное средство имеет пероральную лекарственную форму, которая составлена для приема дважды в день, и содержит тапентадол в количестве от 20 до 260 мг в качестве эквивалентной дозы, основанной на свободном основании.
В предпочтительном варианте осуществления, лекарственное средство имеет пероральную лекарственную форму с немедленным высвобождением тапентадола.
В соответствии с изобретением, тапентадол применяется для лечения боли в связи с остеоартрозом. Предпочтительно, остеоартроз выбирается из группы, состоящей из гонартроза, коксартроза и спондилоартроза.
Предпочтительно, болевой остеоартроз является остеоартрозом, как определено в соответствии с МКБ-10 (Международная статистическая классификация болезней и проблем, связанных со здоровьем, издание ВОЗ, предпочтительно текст 2007 г.). Предпочтительно, остеоартроз выбирается из полиартроза [М15], коксартроза [М16], гонартроза [М17], остеоартроза первого пястно-запястного сустава [М18], другого вида остеоартроза [М19] и спондилеза [М47]. Ссылки в квадратных скобках относятся к номенклатуре МКБ-10.
Если остеоартроз является полиартрозом [М15], то предпочтительно выбирается из группы, состоящей из первичного генерализированного (остео)артроза [М15.0], узлов Гербедена (с артропатией) [М15.1], узлов Бушара (с артропатией) [М15.2], вторичного множественного остеоартроза (посттравматический полиартроз) [М15.3], эрозивного (остео)артроза [М15.4], другого полиартроза [М15.8] и полиартроза неуточненного (генерализированный (остео)артроз не уточненный иначе) [М15.9].
Если остеоартроз является коксартрозом [М16], то предпочтительно выбирается из группы, состоящей из первичного коксартроза двустороннего [М16.0], другого первичного коксартроза (одностороннего, или не уточненного иначе) [М16.1], коксартроза в результате дисплазии двустороннего [М16.2], других диспластических коксартрозов (односторонних, или не уточненных иначе) [М16.3], посттравматического коксартроза двустороннего [М16.4], других посттравматических коксартрозов (односторонних, или не уточненных иначе) [М16.5], других вторичных коксартрозов двусторонних [М16.6], других вторичных коксартрозов (односторонних, или не уточненных иначе) [М16.7] и коксартрозов неуточненных [М16.9].
Если остеоартроз является гонартрозом [М17], то предпочтительно выбирается из группы, состоящей из первичного гонартроза двустороннего [М17.0], другого первичного гонартроза (одностороннего, или не уточненного иначе) [М17.1], посттравматического гонартроза двустороннего [М17.2], других посттравматических гонартрозов (односторонних, или не уточненных иначе) [М17.3], других вторичных гонартрозов двусторонних [М17.4], других вторичных гонартрозов (односторонних, или не уточненных иначе) [М17.5] и гонартроза неуточненного [М17.9].
Если остеоартроз является остеоартрозом первого запястно-пястного сустава
[М18], то предпочтительно выбирается из группы, состоящей из первичного остеоартроза первого запястно-пястного сустава двустороннего [М18.0], других первичных остеоартрозов первого запястно-пястного сустава (односторонних, или не уточненных иначе) [М18.1], посттравматического остеоартроза первого запястно-пястного сустава двустороннего [М18.2], других посттравматических остеоартрозов первого запястно-пястного сустава (односторонних, или не уточненных иначе) [М18.3], других вторичных остеоартрозов запястно-пястного сустава двусторонних [М18.4], других вторичных остеоартрозов первого запястно-пястного сустава (односторонних, или не уточненных иначе) [М18.5] и остеоартроза первого запястно-пястного сустава неуточненного [М18.9].
Если остеоартроз является другим видом остеоартроза [М19], то предпочтительно выбирается из группы, состоящей из первичного остеоартроза других суставов (первичный остеоартроз не уточненный иначе) [М19.0], посттравматического остеоартроза других суставов (посттравматический остеоартроз не уточненный иначе) [М19.1], вторичного остеоартроза других суставов (вторичный остеоартроз не уточненный иначе) [М19.2], другого уточненного остеоартроза [М19.8] и остеоартроза неуточненного [М19.9].
Предпочтительно, боль является от умеренной до сильной. В предпочтительном варианте осуществления, боль выбирается из группы, состоящей из боли, следующей за периодами пассивности, боли весовой нагрузки, боли, вызванной усталостью, околосуставной боли при нагрузке, иррадиирующей боли (например, боль коленного сустава при коксартрозе), боли в состоянии покоя после проведения длительного времени в той же позиции, постоянной боли, спонтанной боли, боли при движении, ночной боли, мышечной боли, боли в конце амплитуды движения, костной боли как спонтанной боли и боли в состоянии покоя.
Даже если лекарственные средства в соответствии с изобретением проявляют только несколько побочных эффектов, для того чтобы избежать определенных видов зависимости, может быть полезным, например, также в дополнение к тапентадолу применять антагонисты морфина, в частности налоксон, налтрексон и/или леваллорфан.
Изобретение, кроме того, относится к способу лечения боли в связи с остеоартрозом, в котором тапентадол вводится пациенту в фармацевтически приемлемом количестве.
Следующие Примеры служат для дальнейшего объяснения изобретения, но не должны толковаться как ограничивающие.
Пример 1:
Объект:
Эффективность и переносимость тапентадола с пролонгированным высвобождением (ПВ) и оксикодона HCl с контролированным высвобождением (KB) сравнивались с плацебо у пациентов с от умеренной до тяжелой боли в связи с остеоартрозом коленного сустава.
Способы (рандомизированное двойное слепое, плацебо-контролируемое исследование):
Пациенты (N=670) были произвольно выбраны и подвержены лечению на протяжении 28 дней дважды в день тапентадолом ПВ 100 мг, тапентадолом ПВ 200 мг, оксикодоном HCl KB 20 мг или плацебо. Доза титровалась в начале лечения. Основным критерием эффективности было среднее восприятие боли в течение предшествующих 24 часов во время последнего медицинского обследования (последний визит), основанное на визуальной аналоговой 100-мм шкале (ВАШ, 0 мм = отсутствие боли, 100 мм = невыносимая боль).
Исследование состояло из 14-дневной, двойной слепой фазы титрования (3 дня → 11 дней), за которым следовала 14-дневная двойная слепая поддерживающая фаза (при наивысшей дозе схемы титрования в каждом случае; смотри Фигуру 1):
- тапентадол ПВ 100 мг: 25 мг (bid) → 50 мг (bid) → 100 мг (bid);
- тапентадол ПВ 200 мг: 100 мг (bid) → 150 мг (bid) → 200 мг (bid);
- оксикодон HCl KB 20 мг: 10 мг (bid) → 10 мг (bid) → 20 мг (bid).
Результаты:
Отличие от вычисленной среднеквадратической ошибки (± стандартная ошибка) в среднем значении интенсивности боли в сравнении с плацебо было значительным для тапентадола ПВ 200 мг (- 8,4 мм [±3,30]; Р=0,021). Отличия от вычисленных среднеквадратических ошибок (± стандартная ошибка) в среднем значении интенсивности боли в сравнении с плацебо были следующие: для тапентадола ПВ 100 мг - 5,9 мм (±3,34; Р=0,142) и для оксикодона HCl KB 20 мг - 5,4 мм (±3,22; Р=0,091), т.е. тапентадол ПВ 100 и оксикодон HCl KB 20 мг показывают подобное поведение (смотри Фигуру 2).
Во всех группах, желудочно-кишечные нарушения (включающие тошноту, запор и рвоту) и нарушения нервной системы (включающие усталость и головокружение) были наиболее общими побочными эффектами:
|
Математический анализ распределения сывороточных концентраций в пределах группы больных, следующих приему различных доз тапентадола, показан на Фигуре 3.
Клинические данные подтверждают, что тапентадол ПВ 200 мг является эффективным на протяжении 4 недель в лечении умеренной до тяжелой хронической боли в связи с остеоартрозом. В отношении желудочно-кишечных побочных эффектов и побочных эффектов, связанных с центральной нервной системой, клинические данные показывают, что тапентадол является лучше переносимым, чем оксикодон HCl.
Математический анализ связи между сывороточными концентрациями тапентадола и эффективностью в отношении облегчения боли в группе больных основан на данных различных клинических исследований, показан на Фигуре 4.
Примеры 2-4:
Объект:
Эффективность и переносимость тапентадола с немедленным высвобождением (НВ) и оксикодона HCl с немедленным высвобождением (НВ) были сравнены с плацебо у пациентов с от умеренной до тяжелой боли в связи с остеоартрозом коленного сустава или тазобедренного сустава.
Пример 2:
Способы (90-дневная III фаза, рандомизированное двойное слепое, с активным контролем гибкой дозы исследование)
Пациентам (N=878) в случайном порядке было назначено в соотношении 4:1 получать тапентадол НВ (50 или 100 мг каждые 4-6 часов, в зависимости от потребности; до 600 мг/день), или оксикодон HCl НВ (10 или 15 мг каждые 4-6 часов, в зависимости от потребности; до 90 мг/день).
Интенсивность боли на протяжении 24 часов до каждого визита фиксировалась от даты первого приема исследования до последнего визита включительно, используя показатели числовой шкалы с 11-ю делениями (0 = отстутствие боли, 10 = невыносимая боль). Переносимость была с первого дня лечения до второго дня после последнего дня исследования лечения.
Результаты:
Все 679 пациентов в группе тапентадола НВ и 170 пациентов в группе оксикодона HCl НВ были включены в анализирование эффективности и безопасности. Показания интенсивности боли были сходны между двумя группами в динамике времени. Средние показания интенсивности исходного уровня боли составляли 7,0 для группы тапентадола НВ и 7,2 для группы оксикодона HCl НВ. Эти величины понижались к концу двойного слепого периода до 4,9 и 5,2 для группы тапентадола НВ и группы оксикодона HCl НВ соответственно. Наиболее общими побочными эффектами были тошнота, рвота, головокружение, запор, головная боль и сонливость. Пациенты в группе тапентадола НВ имели значимо (Р<0,001 для всех измерений) ниже случаев тошноты (18%), рвоты (17%) и запора (13%) в сравнении с группой оксикодона HCl НВ (тошноты 29%; рвоты 30%; запора 27%), в то время как случаи сонливости, головокружения и головной боли были подобны в обеих группах. Серьезные побочные эффекты были зарегистрированы для 0,7% пациентов в группе тапентадола НВ и 1,8% пациентов в группе оксикодона HCl НВ. Однако указанное не относилось к используемому действующему веществу.
Пример 3:
Способы (III фаза, рандомизированое двойное слепое исследование)
878 пациентам в случайном порядке было назначено принимать тапентадол НВ (50 или 100 мг; максимум 600 мг/день), или оксикодон HCl НВ (активный контроль; 10 или 15 мг; максимум 90 мг/день) каждые 4-6 часов на протяжении 90 дней. Группы лечения сравнивались с использованием критерия Кохрана-Мантеля-Хенселя.
Результаты:
Анализ включал 679 пациентов в группе тапентадола НВ и 170 пациентов в группе оксикодона HCl НВ. Пациенты, которые испытали действие опиоидов (т.е. пациенты, которые принимали опиоиды, по крайней мере, 5 дней в неделю на протяжении 30 дней перед скринингом), насчитывали 49,0% пациентов в группе тапентадола НВ и 48,2% пациентов в группе оксикодона HCl НВ. Средние значения показаний боли понижались от исходного уровня до конца исследования от 7,0 до 4,9 для тапентадола НВ и от 7,2 до 5,2 для оксикодона HCl НВ. Наиболее общими побочными эффектами были тошнота, рвота, головокружение, запор, головная боль и сонливость. Значимо реже (Р<0,001) желудочно-кишечные побочные эффекты появлялись в группе тапентадола НВ (тошнота 18%; рвота 17%; запор 13%), чем в группе оксикодона HCl НВ (тошнота 29%; рвота 30%; запор 27%), в то время как случаи головной боли, головокружения и сонливости были аналогичными в обеих группах. В основном, пациенты, которые не применяли опиоиды, имели больше побочных эффектов, хотя эта тенденция была менее выражена для тапентадола НВ, чем для оксикодона HCl НВ.
У пациентов, которые испытали действие опиоидов, рвота появлялась в 18% группы тапентадола НВ и в 39% группы оксикодона HCl НВ, в то время как тошнота была зафиксирована в 22% группы тапентадола НВ и 35% группы оксикодона HCl НВ. У пациентов с опытом применения опиоидов рвота была зафиксирована в 16% группы тапентадола НВ и 21% группы оксикодона HCl НВ, в то время как, с другой стороны, тошнота появлялась в 14% группы тапентадола НВ и 23% группы оксикодона НСl НВ. Опыт применения опиоидов не привел к снижению количества случаев запора в любой из двух групп (тапентадол НВ: опыт применения опиоида, 12%; отсутствие опыта применения опиоида, 14%) (оксикодон HCl НВ: опыт применения опиоида, 27%; отсутствие опыта применения опиоида, 27%).
Пример 4:
Способы (III фаза, рандомизированное двойное слепое, плацебоконтроллируемое исследование)
674 пациентам в случайном порядке было назначено принимать плацебо, тапентадол НВ 50 или 75 мг, или оксикодон HCl НВ 10 мг каждые 4-6 часов во время часов бодрствования. Результаты исследования включали суммарную величину интенсивности боли (SPID) на протяжении 5 дней (основная конечная точка), оценку переносимости и анализ возраста и стати для исследования потенциальных отличий между подгруппами группы людей.
Результаты:
666 случайно выбранных пациентов было включено в анализирование безопасности; 659 пациентов было включено в анализирование эффективности. В сравнении с плацебо, тапентадол НВ 50 и 75 мг продемонстрировал значимое улучшение уменьшения боли на основе оценки показателя 5-дневной SPID (Р<0,001). Группа оксикодона HCl НВ 10 мг также продемонстрировала значимые улучшения в отношении оценки показателя 5-дневной SPID (Р<0,001) в сравнении с плацебо группой, таким образом подтверждая точность теста. Основываясь на предварительно установленных критериях 5-дневной SPID, тапентадол НВ 50 и 75 мг были, по крайней мере, настолько эффективны, как и оксикодон HCl НВ 10 мг. Во всех группах активного лечения показатели 5-дневной SPID были подобны между пациентами <65 и ≥65 лет, и между подгруппами мужчин и женщин. Общие побочные эффекты включали желудочно-кишечные побочные эффекты и побочные эффекты, связанные с центральной нервной системой. В целом, количество случаев желудочно-кишечных побочных эффектов продемонстрировало зависимость от дозы для тапентадола НВ 50 и 75 мг (29% и 40% соответственно), которая была ниже, чем для оксикодона НСl НВ 10 мг (69%). Эта тенденция также была замечена в пределах подгрупп. Пациенты <65 и ≥65 лет отмечали меньше желудочно-кишечных побочных эффектов с тапентадолом НВ 50 мг (25% и 36% соответственно), чем с 75 мг (42% и 38% соответственно) и в обоих случаях они были ниже, чем с оксикодоном HCl НВ 10 мг (66% и 74% соответственно). В подгруппах мужчин и женщин желудочно-кишечные побочные эффекты были зафиксированы в 21% и 39% случаев соответственно с тапентадолом НВ 50 мг и 28% и 54% случаев соответственно с тапентадолом НВ 75 мг, в сравнении с 58% и 81% соответственно для оксикодона HCl НВ 10 мг.
Выводы
Клинические данные являются доказательством эффективности тапентадола НВ для лечения от умеренной до тяжелой боли в связи с остеоартрозом. В отношении желудочно-кишечных побочных эффектов, клинические данные показывают лучшую переносимость тапентадола в сравнении с оксикодоном HCl.