Результат интеллектуальной деятельности: БИОМАТЕРИАЛ ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ
Вид РИД
Изобретение
Изобретение относится к медицине, в частности к материалам, предназначенным для использования при реконструктивно-пластических операциях в онкологии, травматологии, ортопедии, челюстно-лицевой хирургии в качестве имплантатов для замещения костных дефектов или 3D матриксов для мультипотентных мезенхимальных стромальных клеток (ММСК) в тканевой инженерии костной ткани.
Известен способ очистки кораллов и коралл, полученный этим способом, включающий очистку коралла от органических остатков жидкостью или смесью жидкостей (этанол, ацетон) в сверхкритических условиях при температуре меньше 270°C и давлении, превышающем давление жидкости (US 7608283). Однако при осуществлении указанного режима очистки возможна фиксация органических остатков внутри структуры коралла, что может привести к возникновению эффекта иммуногенности при использовании коралла в медицинских целях.
Известен также биоматериал, который обладает свойством медленного выпускания биологически активного вещества, пригодного для регенерации костных клеток. В качестве носителя биологически активного вещества использованы гидроксиапатит (ГА), фосфат кальция, коралл и др., в качестве биологически активного вещества - полифосфорная кислота, ее соли или BMP (US 20100040686). Однако результативность использования известного биоматериала в качестве имплантатов для замещения костных дефектов вызывает сомнения по следующим причинам.
1. При использовании синтетических керамических материалов и натуральных кораллов, модифицированных биоактиваторами остеогенеза (BMP), велика вероятность стимулирования метастазирования. По этой причине невозможно использование известного биоматериала у онкологических больных в процессе оперативного вмешательства.
2. Биоактивация остеогенеза с помощью модификации поверхности химическим путем - обработкой полифосфорной кислотой или ее солями - направлена на формирование на поверхности материала тонкого слоя ГА, что улучшает биосовместимость материала. В то же время авторами заявляемого изобретения установлено, что биорезорбция коралла в SBF (body stimulation fluid) и в организме идет спонтанно через фазу формирования на его поверхности гранул, состоящих из кристаллитов ГА.
Наиболее близким к заявляемому материалу по числу совпадающих признаков является биоинженерная конструкция для замещения костного дефекта, изготовленная из очищенного скелета коралла Acropora cervicornis, модифицированная аутологичными мультипотентными мезенхимальными стромальными клетками ММСК (полезная модель RU 86455). Недостатками известной конструкции, препятствующими достижению перечисленных ниже технических результатов, является то обстоятельство, что процесс изготовления известной биоинженерной конструкции включает не технологичный и не дозируемый этап - первичную очистку скелета кораллов от загрязнений с помощью щетки с жесткой щетиной под струей проточной воды, а также инвазивную процедуру - предварительный забор костного мозга, выделение, продолжительное культивирование кораллового имплантата с ММСК - в течение 2-10 суток.
Заявляемое изобретение направлено на решение задачи оптимизации процессов репаративного остеогенеза и органотипического замещения дефектов костной ткани (ДКТ).
Использование в клинической практике заявляемого биоматериала позволяет достичь нескольких технических результатов:
- повышение степени очистки коралловых фрагментов от загрязнений за счет дополнительной обработки раствором гипохлорита натрия, ультразвукового воздействия и стерилизации путем γ-облучения;
- сокращение общей продолжительности изготовления имплантата;
- ускорение адгезии и распластывания клеток на коралловых имплантатах, а также усиление их остеоиндуктивных свойств за счет активирования поверхности лизатом аутологичных тромбоцитов (ЛАТ).
Указанные технические результаты при осуществлении изобретения достигаются за счет того, что так же, как известный биоматериал для замещения, ДКТ представляет собой фрагмент скелета натурального коралла (НК), очищенный от коралловой пыли и микроорганизмов путем грубой механической обработки поверхности, замачивания и промывки в проточной воде с последующей стерилизацией.
Особенность заявляемого биоматериала заключается в том, что биоматериал выполнен из натурального коралла, принадлежащего семейству Acroporidae, или Pocillporidae, или Favhdae естественного происхождения или выращенного в марикультуре. Материал выполнен в виде цельных фрагментов или в гранулированной форме, причем стадия очистки коралловых фрагментов от органических загрязнений включает дополнительную обработку раствором гипохлорита натрия, ультразвуковым воздействием и стерилизацию путем γ-облучения.
Поверхность материала может быть дополнительно активирована ЛАТ.
Сущность изобретения заключается в следующем.
Авторами заявляемого изобретения были проведены биомедицинские и физико-химические исследования коллекция кораллов, относящихся к двум классам стрекающих кишечнополостных (Anthozoa, Hydrozoa), 3 отрядам, 10 семействам, 12 родам и 23 видам (21 вид гермативных, 2 вида агермативных) образцов: Oculinidae (1 вид), Caryophyllidae (1 вид), Acroporidae (8 видов), Fungiidae (1 вид), Faviidae (1 вид), Pocilloporidae (8 видов), Agariciidae (1 вид), Merulinidae (1 вид), Helioporidae (1 вид) и Milleporidae (1 вид)), собранных в Индонезии в акватории Большого Барьерного Рифа. В табл.1 представлена таксономическая принадлежность и внешний вид образцов кораллов, подготовленных для медико-биологических испытаний.
Кроме того, были исследованы кораллы, выращенные в марикультуре в Индо-Тихоокеанской зоне Мирового Океана (Acropora nobilis, Acropora hyacinthus, Acropora abrotanoidaes, Acropora Samoensis, Pocillopora verrucosa). В табл.2 представлена таксономическая принадлежность и внешний вид скелета НК, выращенных в марикультуре.
Были проведены биомедицинские испытания всех перечисленных видов кораллов в их естественной форме, а также с поверхностью, биоактивированной ЛАТ.
Биомедицинские испытания включали: оценку их цитотоксичности (in vitro, на модели фибробластов человека, МТТ-тест); матриксных для клеток свойств, способность поддерживать пролиферацию клеток (in vitro на модели фибробластов человека, МТТ-тест), пролиферацию и остеодифференцировку клеток (in vitro, на модели ММСК человека, крысы, МТТ-тест), биосовместимость (подкожный тест, мыши, в динамике до 16 недель, гистологические исследования на сроках 4, 8, 12, 16 недель), способность замещать ДКТ у лабораторных животных (крысы, бараны, метод оценки - рентген, гистологические исследования в динамике до 1 года после операции).
Физико-химические исследования кораллов включали изучение их химического (в т.ч. примесного) состава, пористости, кристаллической решетки, архитектоники поверхности.
В ходе скрининговых исследований in vitro было показано, что 22 из 23 видов кораллов, растущих в диком состоянии (за исключением образца НК Heliopora coerulea), и все виды кораллов, растущие в марикультуре, были не токсичны для клеток и обладали выраженными матриксными свойствами поверхности, т.е. способствовали активной адгезии клеток и их длительной пролиферации. Было установлено, что для основной совокупности исследованных образцов НК прирост клеточной популяции за время наблюдения (14 суток) составил 200-300% (в сравнении с контролем - полистиреном).
Эти показатели характеризуют перечисленные виды кораллов как исключительно перспективный биоматериал для дальнейших биомедицинских исследований. В то же время, принимая во внимание распространенность определенных семейств НК, скорость роста их колоний, глубину ареала обитания, для дальнейшего этапа исследований топографии поверхности и особенностей физико-химического состава было отобрано 8 образцов видов НК, принадлежащих к четырем семействам: 1) сем. Acroporidae (Acropora sp 2, Acropora sp 3, Montipora digitata), 2) сем. Fungiidae (Fungia cf. horrida),3) сем. Faviidae (Goniastrea retiformis), 4) сем. Pocilloporidae (Pocilloppora damicornis, Pocillopora eydouxi, Pocillopora cf. meandrina) и все перечисленные выше кораллы, растущие в марикультуре (табл.2).
Методами спектрального анализа, ИК-спектороскопии, СЭМ было установлено, что по фазовому составу образцы всех НК представлены хорошо закристаллизованным арагонитом, за исключением видов Montipora digitata и Pocillopora eydouxi, которые представляют собой железозамещенный арагонит. По химическому составу: все образцы содержат примеси переходных металлов на уровне предельно допустимых значений (стандарт ASTM 1185). Наименьшее содержание токсичных для организма человека переходных металлов (железо, никель, кобальт) обнаружено в образце кораллов вида Fungia cf. horrida. Основным примесным элементом является стронций, содержание которого в исследованных образцах не превышает 0,81 масс %, что укладывается в стандарт ASTM 1185. Наличие стронция в указанных концентрациях рассматривается авторами как положительный факт, так как известно, что стронций - один из важнейших элементов, регулирующих метаболические процессы в костной ткани. Положительным, с точки зрения авторов, является факт отсутствия в составе всех образцов НК (за пределом обнаружения использованными методами анализа) таких элементов, как свинец, висмут, мышьяк и сурьма, суммарное количество которых в медицинских материалах для имплантации ограничено существующими нормативными документами величиной 5.10-4% (стандарты ASTM на ГА медицинского назначения).
По микроструктуре и морфологической организации все исследуемые кораллы соответствуют строению трабекулярной кости человека. Однако, учитывая результаты исследования химического и фазового состава данных образцов, для определения скорости биорезорбции и испытаний биосовместимости и остеозамещающих потенций in vivo были отобраны образцы НК, принадлежащие к трем семействам: 1) сем. Acroporidae (Acropora sp.2, Montipora digitata), 2) сем. Faviidae (Goniastrea retiformis), 3) сем. Pocilloporidae (Pocillopora damicornis и Pocillopora cf. meandrina) и все кораллы перечисленных выше семейств и видов, растущие в марикультуре. Дополнительно к этим образцам НК в исследование по биодеградации в качестве эталона был отобран образец НК Acropora cervicornis.
В результате исследований биодеградации НК было установлено, что кинетика растворения данных образцов НК в изотоническом растворе характеризуется переходом во времени от логарифмического закона растворения к экспоненциальному, соответствующему кинетике скоростей реакций первого порядка, и, далее, к линейному закону растворения. Выявлено, что кинетика изменения концентрации кальция в растворе SBF - жидкости, аналогичной по свойствам жидкостям тела, существенно отличается от кинетики ее изменения в изотоническом растворе и характеризуется наличием минимума, что, по-видимому, связано с протеканием двух конкурирующих процессов: растворения и осаждения. При сравнении скорости биорезорбции шести образцов НК обнаружено, что у всех исследуемых образцов интенсивность растворения приблизительно одинакова. Наиболее растворимым (по величине концентрации ионов кальция в изотоническом растворе в момент установления равновесия) является образец Acropora cervicornis, наименьшую растворимость имеет образец Montipora digitata. По данным сканирующей электронной микроскопии на поверхности всех кораллов в процессе биорезорбции спонтанно формируется слой апатитоподобной фазы из раствора SBF, что свидетельствует об их высокой биоактивности.
Эксперименты in vivo подтвердили это положение. Прежде всего, установлено, что при подкожной имплантации гранулы кораллов не отторгаются организмом мыши и не вызывают реакции воспаления. В динамике наблюдения обнаружено, что данные образцы НК подвергаются частичной биодеградации, при этом принципиальных различий в подгруппах между образцами НК разных семейств и видов не выявлено.
В модельных экспериментах по замещению ДКТ (краевая резекция большеберцовой кости крысы) коралловыми имплантатами в гранулированной форме продемонстрированы остеопластические свойства НК отобранных семейств и видов: постепенная биодеградация, близкая к скорости неоостеогенеза, остеокондуктивные потенции, обеспечивающие формирование органотипически организованной костной ткани в реципиентном ложе, уникальные архитектоника и микротопография поверхности, способствующие эффективной адгезии клеток и белков (включая костные морфогенетические белки и факторы роста из ЛАТ, контролирующие остеодифференцировку) и прорастанию сосудов.
Обработка образцов НК ЛАТ значительно ускорила адгезию, пролиферацию фибробластов человека in vitro и усилила остеоиндуктивные свойства поверхности НК в отношении ММСК in vitro, a in vivo значительно ускорила процессы регенеративной регенерации в зоне имплантации НК в область травмы.
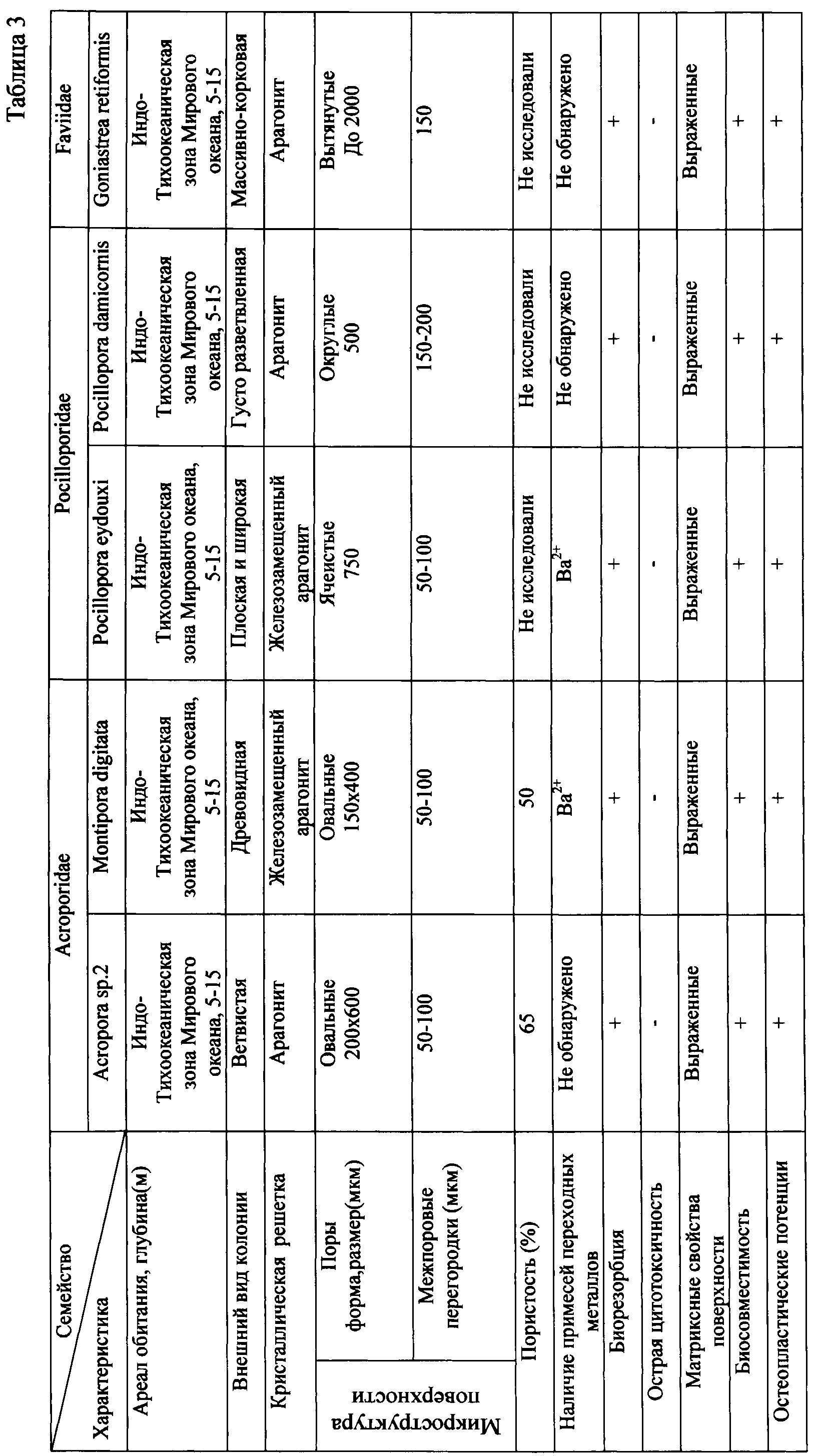
В таблице 3 представлена сравнительная характеристика натуральных кораллов, отобранных для замещения ДКТ: Acropora sp.2, Montipora digitata, Pocillopora eudouxi, Pocillopora damicornis, Goniastrea retiforrnis.
Таким образом, в результате поэтапного исследования НК из достаточно представительной коллекции образцов авторы пришли к выводу о целесообразности использования 5 видов НК, принадлежащих к семействам Acroporidae, Pocilloporidae и Faviidae или кораллов, выращенных в марикультуре (Асrороrа nobilis, Acropora hyacinthus, Acropora abrotanoidaes, Acropora samoensis, Pocillopora verrucosa), для использования в качестве биоматериалов при реконструктивно-пластических операциях в онкологии, травматологии, ортопедии, челюстно-лицевой хирургии для замещения костных дефектов или 3D матриксов в тканевой инженерии костной ткани.
Заявляемый материал в качестве имплантата при реконструктивно-пластических операциях может быть использован в следующих видах:
- фрагмент скелета НК или коралла, выращенного в марикультуре, предварительно смоделированный по форме костного дефекта;
- НК в гранулированной форме (гранулы изготовлены из фрагментов кораллов, указанных видов и семейств, растущих в диком состоянии или марикультуре);
- натуральный коралл любой формы, поверхность которого активирована ЛАТ.
Схема и пример конкретного исполнения.
На первом этапе путем рентгенологического исследования оценивают величину имеющегося (или который сформируется после хирургического вмешательства) ДКТ и решают вопрос о типе планируемого к использованию имплантата - цельный или в гранулированной форме (гранулы диаметром до 0,3-0,6 мм). В случае планирования использования цельного имплантата из фрагмента НК (указанных семейств и видов) выпиливают имплантат, соответствующий по конфигурации костному дефекту. В случае планирования использования для заполнения ДКТ гранулята оценивают его требуемый объем.
Для приготовления материала для имплантации (МИ) проводят ряд процедур по предварительной очистке и обработке НК.
Ветви НК замачивают в водопроводной воде на 24 часа, затем тщательно очищают от загрязнений и водорослей жесткой щеткой под проточной водой. Органические загрязнения удаляют обработкой 3% раствором гипохлорита натрия при комнатной температуре в течение 2-х часов, при сильном загрязнении проводят дополнительно от 2-х до 4-х обработок свежим раствором гипохлорита натрия.
На следующем этапе НК тщательно отмывают в водопроводной воде, чередуя отмывку в проточной воде в течение 10 минут с периодами замачивания (в десятикратном объеме воды) в течение 1 часа. Всего проводят 3 цикла отмывки. Промытые ветви НК высушивают при 50°C в течение 24 часов и более.
Далее подготовленный материал подвергается механической обработке. Для получения гранулята ветви НК измельчают в планетарной шаровой мельнице и с помощью системы сит разделяют на фракции по определенным размерам гранул. Цельный имплантат, имеющий конфигурацию, соответствующую ДКТ, выпиливают с помощью инструментов, используемых в хирургии костной ткани.
Дополнительную очистку МИ от органических остатков после этапа формования проводят путем замачивания в 3% растворе гипохлорита натрия при комнатной температуре в течение 3-х минут, завершая тремя циклами тщательной отмывки в проточной воде в течение 10 минут и замачивания в течение 1 часа (в десятикратном объеме воды).
Для очистки пор от пылевидных частиц готовые МИ (гранулят и цельные имплантаты) обрабатывают в ультразвуковой мойке (например, FinnSonic m80 «Финбио», Финляндия) в дистиллированной воде в течение 3-5 минут (частота ультразвукового воздействия 40кГц) и дополнительно трехкратно ополаскивают в большом объеме дистиллированной воды (соотношение по объему коралла и воды 1:10).
Далее МИ высушивают в термостате при 50°C в течение 24 часов (по необходимости), затем помещают в чистые стеклянные флаконы или упаковочный материал и стерилизуют путем γ-облучения (суммарная доза 25 кГр). В случаях планирования использования МИ с активированной поверхностью (костные дефекты у пожилых, и/или дефекты по размерам больше критических или близкие к критическим, и/или у больных с иммунодефицитными состояниями, например, после химио- и/или лучевой терапии) стерильный МИ обрабатывают в стерильных условиях ЛАТ, приготовленным по специальной методике. Для этого МИ помещают в жидкий ЛАТ не менее чем на 3 часа при соотношении объемов МИ/ЛАТ не менее 1/3.
В процессе оперативного вмешательства размещают МИ (цельный или гранулированный имплантат; нативный из стерильной упаковки или с активированной поверхностью из флаконов с ЛАТ) в зоне дефекта, фиксируя МИ в соответствии с общепринятыми правилами, принятыми при использовании цельных или гранулированных имплантатов. Иммобилизацию костно-мышечных структур в зоне оперативного вмешательства также осуществляют общепринятыми методами.
Контроль стабильности конструкции в зоне дефекта и динамику биорезорбции МИ с его замещением собственной костной тканью осуществляют путем рентгенологического исследования.
Все вышесказанное демонстрируется следующим примером.
Половозрелым крысам-самкам линии Wistar массой 180-200 гр (15 животных в группе) осуществляли под наркозом операцию (краевая резекция большеберцовой кости). Для этого на границе верхней и средней трети кости посредством бора формировали плоскостной «окончатый» дефект следующего размера: длина 6-8 мм, ширина 1,5-2,0 мм, глубина 1,5 -2,0 мм с проникновением в костный канал. В область дефекта, в соответствии с протоколом исследования, закладывали стерильные гранулы НК интактные или обработанные ЛАТ. Через 3, 6, 9, 12, 20 недель всем крысам проводили морфологические исследования оперированных конечностей: в указанные сроки по 2 крысы выводили из эксперимента с применением летальной дозы эфирного наркоза. Производили вырезку (распил большеберцовой кости) и костный фрагмент с дефектом помещали в 10% раствор формалина для фиксации (7 суток), затем материал декальцинировали в 0,3 М растворе ЭДТА (25-30 суток). На протяжении всего этого этапа осуществляли контроль за ходом декальцинации и производили замену декальцинирующей жидкости на свежую порцию. Когда материал становился эластичным, производили удаление остатков ЭДТА путем быстрого ополаскивания в проточной воде, осуществляли дегидратацию образцов и заключение в парафин. После приготовления срезов их окрашивали гематоксилин-эозином и проводили световую микроскопию.
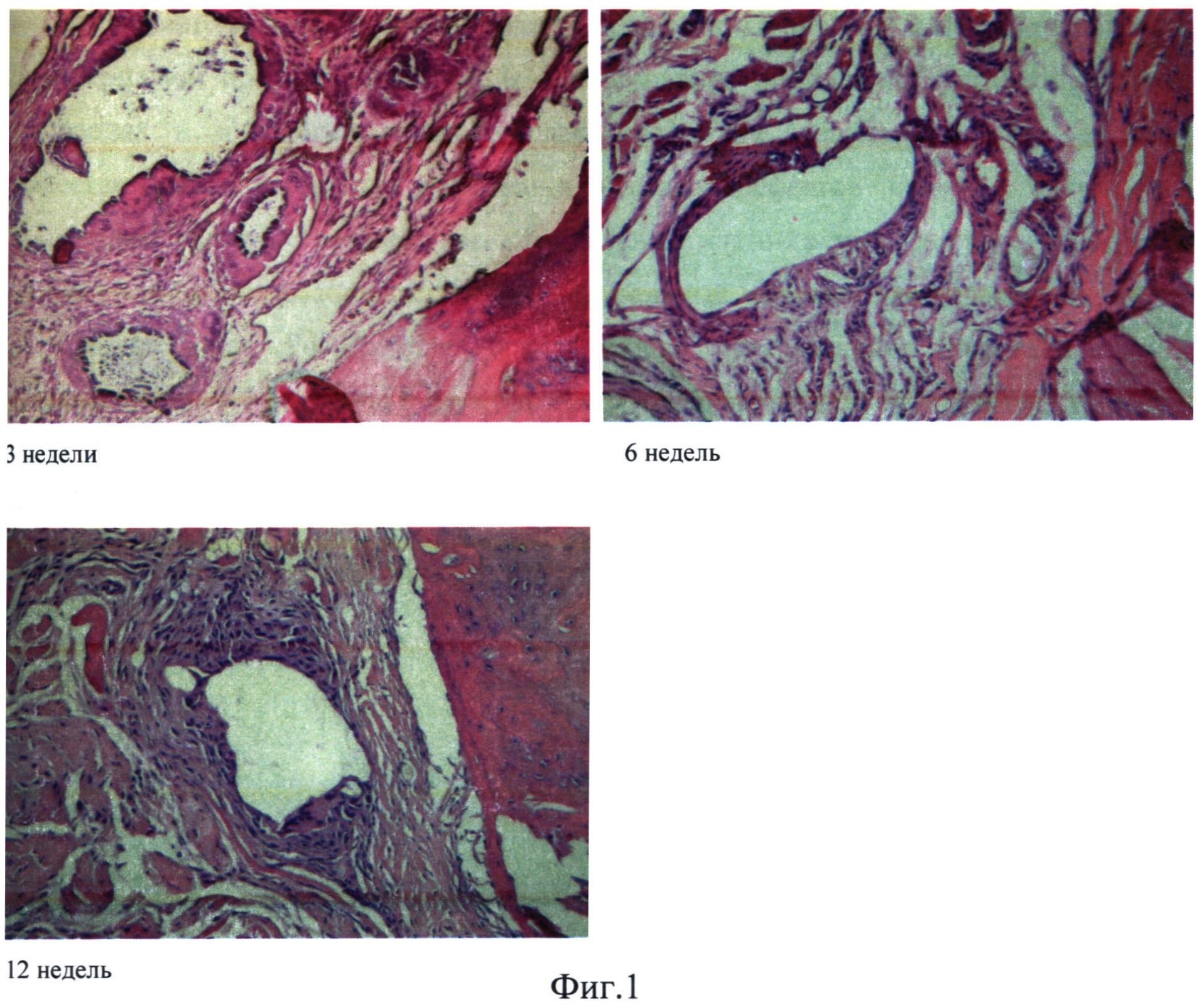
При анализе гистологических препаратов выявлено, что, начиная с трех недель после операции, контуры гранул НК (пустоты вследствие декальцинации) в реципиентном ложе окружаются ободком соединительной ткани, в отдельных полях зрения встречаются многоядерные клетки инородных тел, остеокласты, присутствие которых можно косвенно связать с резорбцией вещества НК. На биодеградацию образцов НК указывает также существенное уменьшение площади контуров гранул НК в динамике наблюдения. В эти сроки (3, 6 недель) отмечен также процесс репаративной регенерации костной ткани, нарастающий со временем: на микропрепаратах на ранних сроках наблюдения (3 недели) промежутки между гранулами заполняются молодой костной тканью. Таким образом, уже в этот срок отмечаются признаки репарации костной ткани, при этом остеогенез протекает периостально и, как правило, в непосредственной топической связи с частицами имплантированных гранул НК. Важно отметить изначально анатомически правильное формирование новой костной ткани с сохранением ее архитектоники: в центре дефекта - формирование губчатой костной ткани, по периферии - компактной.
В динамике эксперимента через 9-12 недель в этой группе животных на базе первичного регенерата продолжает формироваться молодая кость, и к концу 12-ой недели после операции костная рана выполнена морфологически зрелой губчатой костной тканью в центре с очагами гемопоэза в межтрабекулярных пространствах. Обнаруживаются отдельные, не полностью резорбированные частицы коралла. Полное закрытие костного дефекта в данной группе животных с формированием незначительной костной мозоли происходит через ~20 недель после операции. На Фиг.1 представлена динамика замещения костного дефекта крысы с использованием гранул натурального коралла Acropora sp. (окраска - гематоксилин-эозином, увел.×100).
Таким образом, заявляемый материал соответствует критериям охраноспособности. Приведенные выше результаты эксперимента свидетельствуют о возможностях и преимуществах использования его в качестве материала для замещения дефектов костной ткани.