СПОСОБ И УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ СТРОЕНИЯ ХРОМОСОМ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к области цитогенетики, в частности, к определению строения хромосом.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Цитогенетика - область изучения хромосом на стадии метафазы клеточного цикла. Именно на этой стадии хромосомы находятся в наиболее конденсированном состоянии и наиболее удобны для изучения как в нормальном состоянии, так и в состоянии болезни. В настоящее время наиболее часто применяемым способом в области цитогенетики (во всем мире) является краткосрочное (<10 дней) либо долгосрочное (вплоть до 45 дней) культивирование образцов, взятых для анализа. В качестве образцов могут выступать периферическая кровь, костный мозг, амниотическая жидкость, солидная ткань, продукты оплодотворения, плевральная жидкость и т.п. После успешного культивирования при помощи различных способов получают метафазные хромосомы и исследуют их для определения того, имеет ли анализируемый индивид генетическую аномалию. Этот способ является достаточно сложным и требует применения многочисленных химических веществ и реактивов, а также значительного количества времени и квалификации.
Исследования хромосом часто требуются для различных диагностических целей, включающих следующие: 1) пренатальную диагностику; 2) хромосомный тест периферической крови (для тестирования пациентов с аномальными фенотипическими характеристиками, умственной отсталостью, пар с проблемами бесплодия, а также с проблемами многочисленных выкидышей для определения наличия генетической обусловленности отклонения; 3) диагностику лейкемии/лимфомы (крайне необходимы как для точной диагностики, так и для назначения курса лекарственных препаратов) и 4) диагностику и назначение лечения солидной опухоли (для опухолей мочевого пузыря, простаты, груди, легких и т.п.).
В течение почти пятнадцати лет для получения информации о хромосоме/кариотипе использовали метод под названием флюоресцентная гибридизация in situ (Fluorescent In Situ Hybridization, FISH). Однако этот метод имеет ряд ограничений. Применение способа FISH не дает полную информацию о кариотипе. Значительная часть исследований способом FISH проводилась на интерфазном ядре, когда хромосомы не видны обычными цитогенетическими способами, без дополнительного культивирования. Недавно стал возможен более полный анализ хромосом или кариотипа с применением метода мультиплексной FISH (M-FISH). Сложность этого метода состоит в том, что для получения хромосом для анализа все же необходим один пассаж клеток. Только после этого методом M-FISH можно выявить предположительные аномалии, а также обнаружить новые или не предполагаемые изменения.
Совсем недавно было разработано несколько способов многоцветного дифференциального окрашивания хромосом, таких как многоцветное дифференциальное окрашивание (multicolor banding, MCG), метод многоцветного «штрихового кода» хромосомы, метод многоцветного окрашивания, основанный на межвидовой гибридизации (rх-FISH), метод спектрального многоцветного дифференциального окрашивания (SCAN). Из всех этих способов только MCG применялся для анализа интерфазных хромосом.
В большинстве основанных на FISH методах используют зонды, специфичные для определенного заболевания. При создании специфичных для некоторого заболевания зондов набор таких зондов ограничен имеющимися данными о специфических изменениях, таких как транслокации, делеции, инверсии, амплификации участков хромосомы или другие известные хромосомные аномалии. Без предварительных знаний о предполагаемой генетической аномалии методы цитогенетики не способны диагностировать не известное или не предполагаемое генетическое нарушение. Применение зондов сплошного окрашивания хромосом позволяет обнаружить не выявленные ранее транслокации. Однако этот способ является очень трудоемким и требует применения набора из двадцати четырех (24) отдельных зондов для окрашивания хромосом. Более того, данный способ позволяет выявить только один тип генетической аномалии, а именно транслокацию между двумя различными хромосомами. Часто при развитии болезни генетические отклонения состоят из ряда проявлений, включающих транслокации, делеции или инверсии. Все эти дополнительные изменения, в особенности внутрихромосомные перестройки, невозможно обнаружить доступными наборами зондов для окрашивания хромосом. Вместо этого, для их обнаружения обычно требуется дополнительный набор или несколько наборов зондов, специфичных для определенного заболевания, в связи с чем данная методика становится недопустимо дорогостоящей и недоступной для обычной клинической цитогенетической лаборатории.
С вышеупомянутыми методами исследования метафазных хромосом связан ряд дополнительных недостатков, которые включают: очень сложный рисунок окрашивания сегментов хромосом, получаемый при идентификации отдельных хромосом человека; методики требуют применения очень дорогого оборудования, такого как фильтры, дихроичные зеркала, ПЗС (Charge-Coupled Device, CCD-камеры (Charge-Coupled Device, CCDб устройство (камера) с переносом заряда), сложные компьютерные программы, интерферометры и другие специализированные приборы для интерпретации рисунка исчерченности; указанные методики не предоставляют полную информацию о кариотипе, т.е. обнаруживают определенного типа аномалии, например, Робертсоновские транслокации; все методики основаны на применении флуорохромов, свечение которых гаснет или затухает, и образующийся рисунок исчерченности не является постоянным; образующемуся рисунку исчерченности компьютерная программа присваивает определенные псевдоцвета, а сам рисунок не может быть интерпретирован человеком путем прямого наблюдения; указанные методики хотя и применимы для исследовательских задач, но не подходят для практического применения в клинических цитогенетических лабораториях; а также наличие маркерных хромосом, имеющих структурные изменения, которые как правило не могут быть отслежены, что особенно существенно, поскольку маркерные хромосомы играют важную диагностическую и прогностическую роль в ряде клинических случаев.
Один тип генетической аномалии имеет особое значение при генетической диагностике, эта аномалия известна как Робертсоновская транслокация. Робертсоновские транслокации представляют собой транслокации между акроцентрическими хромосомами, которые соединяются своими центромерами, в результате чего в кариотипе становится на одну центромеру меньше. Робертсоновские транслокации имеют клиническое значение, в частности, при пренатальной диагностике. Патологическое состояние под названием однородительская дисомия (ОРД) характерно для хромосом 13, 14, и 15. ОРД у плода, обнаруженная при пренатальной диагностике, способствует тяжелым клиническим проявлениям и в значительной степени увеличивает показатели заболеваемости/смертности новорожденных.
Содержание документов и публикаций, цитируемых в данном описании, включено в данное описание посредством ссылок в полном объеме, в той степени, в которой они напрямую не противоречат данному описанию.
Краткое описание изобретения
Таким образом, задачей настоящего изобретения является обеспечение способа и устройства для определения строения хромосом. Аспекты настоящего изобретения включают способ определения строения интерфазных хромосом, включающий получение образца, содержащего клетки с хромосомами для анализа; получение видоспецифичных ДНК-зондов, при этом указанные ДНК-зонды способны маркировать по меньшей мере одну хромосому по существу равномерно по длине хромосомы; гибридизацию образца с ДНК-зондами; применение совокупности ферментов для получения характерно окрашенных сегментов хромосомы для колориметрического анализа образца; применение визуального анализа для определения строения хромосомы на основании колориметрического анализа.
Кроме того, способ предусматривает проведение гибридизации in situ. В типичном варианте реализации гибридизацию in situ можно проводить на пластинке. Пластинка (предметное стекло) может, например, содержать некоторое количество лунок для приема материала, гибридизации и анализа упомянутого строения ДНК.
В другом аспекте настоящего изобретения средства для визуального анализа включают световой микроскоп или CCD камеру (камеру с переносом заряда).
Аспекты настоящего изобретения предусматривают получение образцов для исследования из: амниотической жидкости; периферической крови;
плевральной жидкости; костного мозга; опухолевой ткани; продуктов оплодотворения или из любого другого источника, содержащего клетки, имеющие хромосомы для анализа.
Способ согласно аспектам данного изобретения включает визуальное определение хромосомных аномалий, таких как, например, транслокации или, более конкретно, Робертсоновские транслокации.
Способ согласно аспектам данного изобретения предусматривает получение полной информации о кариотипе.
Изобретение также охватывает способ колориметрической гибридизации in situ, включающий стадии: получения образца, содержащего клетки с хромосомами для определения строения; получения видоспецифических ДНК-зондов, способных маркировать хромосому в по существу равномерно по длине хромосомы; гибридизации in situ образца с указанными ДНК-зондами; применения совокупности ферментов для получения характерного окрашивания сегментов хромосомы для колориметрического анализа; и применения визуального анализа для определения строения указанной хромосомы.
Способ может дополнительно включать стадию in situ гибридизации образца на пластинке, при этом пластинка содержит некоторое количество лунок для приема материала, гибридизации и анализа упомянутого строения ДНК.
Изобретение может также включать способ визуального выявления Робертсоновских транслокаций в хромосомах, включающий стадии: получения образца, содержащего клетки с хромосомами для анализа; получения специфичных для человека ДНК-зондов, способных маркировать по меньшей мере две хромосомы в по существу равномерно по длине каждой из хромосом; гибридизации образца с указанными ДНК-зондами; применения совокупности ферментов для получения характерного окрашивания сегментов хромосом для колориметрического анализа; и применения визуального анализа для определения того, произошла ли Робертсоновская транслокация между указанными хромосомами.
Согласно изобретению, способ может также включать гибридизацию образца in situ на пластинке, содержащей некоторое количество лунок для приема материала, гибридизации и анализа упомянутого строения ДНК. Этот способ может также включать визуальный анализ, с применением светового микроскопа или CCD камеры.
Способ также предусматривает выбор источника данного образца ДНК из группы, включающей: амниотическую жидкость, периферическую кровь, плевральную жидкость, костный мозг, опухолевую ткань и продукты оплодотворения.
В дополнительном варианте реализации настоящего изобретения, способ обнаружения маркерных хромосом включает стадии: получения образца, содержащего клетки с хромосомами для определения строения; получения специфичных для человека ДНК-зондов, при этом указанные ДНК-зонды способны маркировать по меньшей мере две хромосомы по существу равномерно по длине каждой из указанных хромосом; гибридизации вышеуказанного образца с указанными ДНК-зондами; и применения совокупности ферментов для получения характерного окрашивания сегментов хромосом для колориметрического анализа хромосом.
Способ обнаружения маркерных хромосом может включать in situ гибридизацию образца на пластинке, содержащей некоторое количество лунок для приема материала, гибридизации и анализа строения ДНК. Детекцию можно осуществлять посредством визуального анализа с применением светового микроскопа или CCD-камеры.
Образец ДНК для анализа может быть получен из одного из следующих источников: амниотическая жидкость, периферическая кровь, плевральная жидкость, костный мозг, опухолевая ткань и продукты оплодотворения.
Другой аспект настоящего изобретения предусматривает способ мечения хромосомы, включающий стадии: получения образца, содержащего клетки с хромосомами для мечения, получения видоспецифичных ДНК-зондов, при этом ДНК-зонды могут быть способными пометить хромосому по существу равномерно по ее длине, гибридизации хромосомы с ДНК-зондами, в результате чего происходит мечение хромосомы.
Способ может включать in situ гибридизацию хромосомы на пластинке, при этом пластинка содержит некоторое количество лунок для приема материала, гибридизации и анализа строения ДНК. Способ дополнительно предусматривает получение ДНК из источника, выбранного из группы, включающей: амниотическую жидкость, периферическую кровь, плевральную жидкость, костный мозг, опухолевую ткань и продукты оплодотворения.
Типичный вариант реализации согласно аспектам настоящего изобретения включает набор для определения строения интерфазных хромосом, множество видоспецифичных ДНК-зондов, при этом указанные ДНК-зонды способны маркировать по меньшей мере одну хромосому по существу равномерно по длине хромосомы, множество ферментов для получения характерного окрашивания сегментов хромосомы для колориметрического анализа и некоторое количество пластинок для in situ гибридизации хромосомы с набором зондов.
Набор может дополнительно включать средства визуального анализа для колориметрического анализа одной хромосомы, такие как, например, микроскоп или камера.
Другой вариант реализации согласно аспектам настоящего изобретения включает набор зондов, включающий множество видоспецифичных ДНК-зондов, при этом ДНК-зонды могут быть сконструированы для маркирования (мечения) по меньшей мере одной хромосомы по существу равномерно по длине указанной хромосомы. Набор зондов может дополнительно включать совокупность ферментов для получения характерного окрашивания сегментов указанной хромосомы. Дополнительный вариант реализации согласно аспектам настоящего изобретения включает пластинку для in situ гибридизации интерфазных хромосом, которая включает стеклянную пластинку, дополнительно содержащую некоторое количество лунок, в которых можно проводить in situ гибридизацию.
Выше описан способ исследования строения хромосом с применением способа определения строения интерфазных хромосом (Interphase Chromosome Profiling, ICP) для получения полной информации о хромосомах и кариотипе при использовании любого типа клеток/образца без необходимости дополнительного культивирования ткани. Это достигается путем комбинирования патентуемых наборов ДНК-зондов и технологии колориметрической гибридизации in situ (Colorimetric In Situ Hybridization, CISH) на интерфазном ядре. Применение способов, раскрытых в данной заявке, позволяет обнаружить приблизительно 99% всех хромосомных аномалий с получением результатов при общей продолжительности анализа (turn around time, TAT) менее 48 часов.
Изобретение относится к способам и устройству для получения полной информации о кариотипе человека путем наблюдения отдельных хромосом человека в интерфазных клетках в гибридизационных камерах на совокупности пластинок. Анализ IСР не требует предварительных данных о наличии определенных или предполагаемых заболеваний, он выявляет известные и не известные генетические изменения и предоставляет полную информацию о кариотипе в рамках одного исследования. Кроме того, IСР не требует культивирования клеток и обеспечивает способ обнаружения почти всех типов хромосомных изменений в интерфазном ядре.
Дополнительные задачи и преимущества настоящего изобретения ясны с учетом нижеследующего подробного описания изобретения и прилагаемых графических материалов, при этом одни и те же номера ссылок относятся к одному и тому же признаку, компоненту или элементу.
Краткое описание графических материалов
Патент или заявка содержит, по меньшей мере, один чертеж и/или микрофотографию, исполненную в цвете.
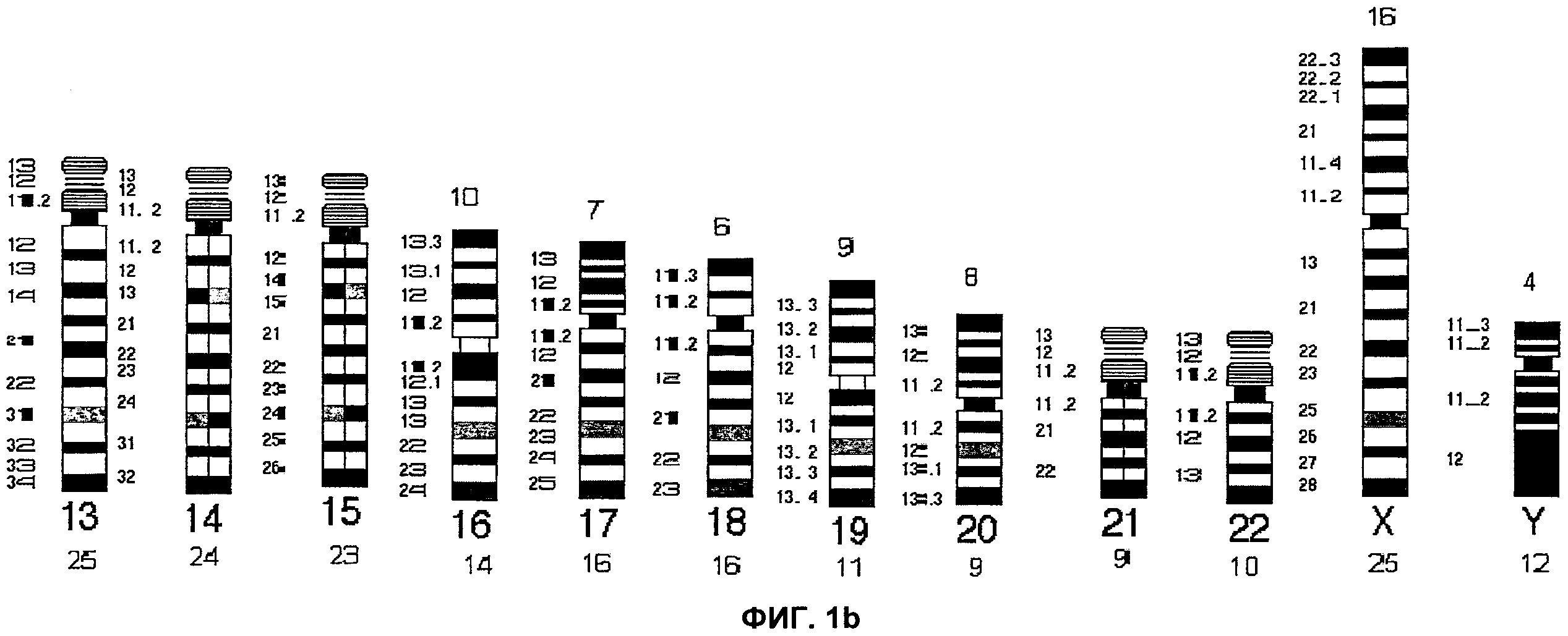
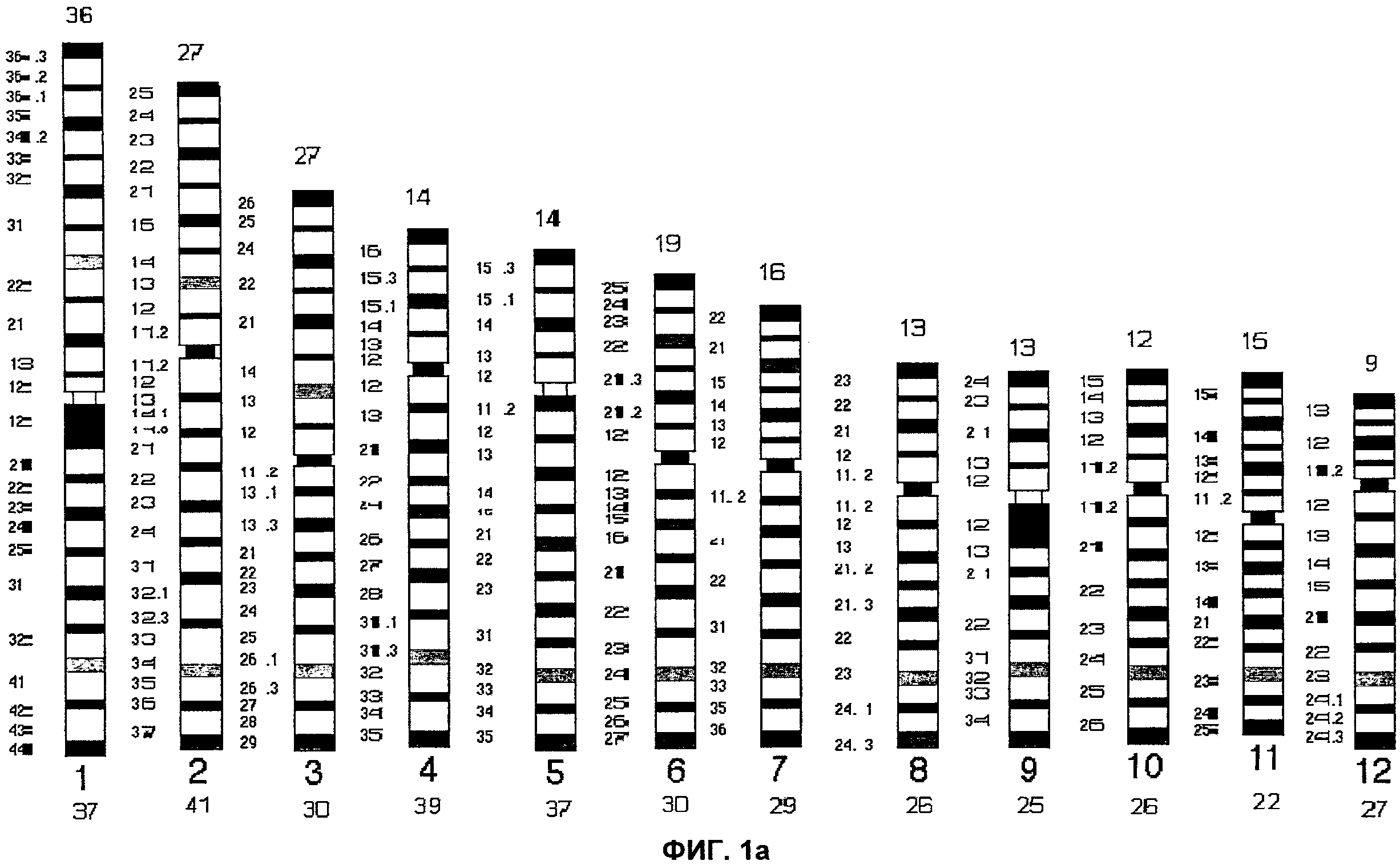
Фиг.1а и 1b представляют собой идеограммы строения интерфазных хромосом, иллюстрирующие типичную цветную исчереченность хромосомы согласно аспектам настоящего изобретения.
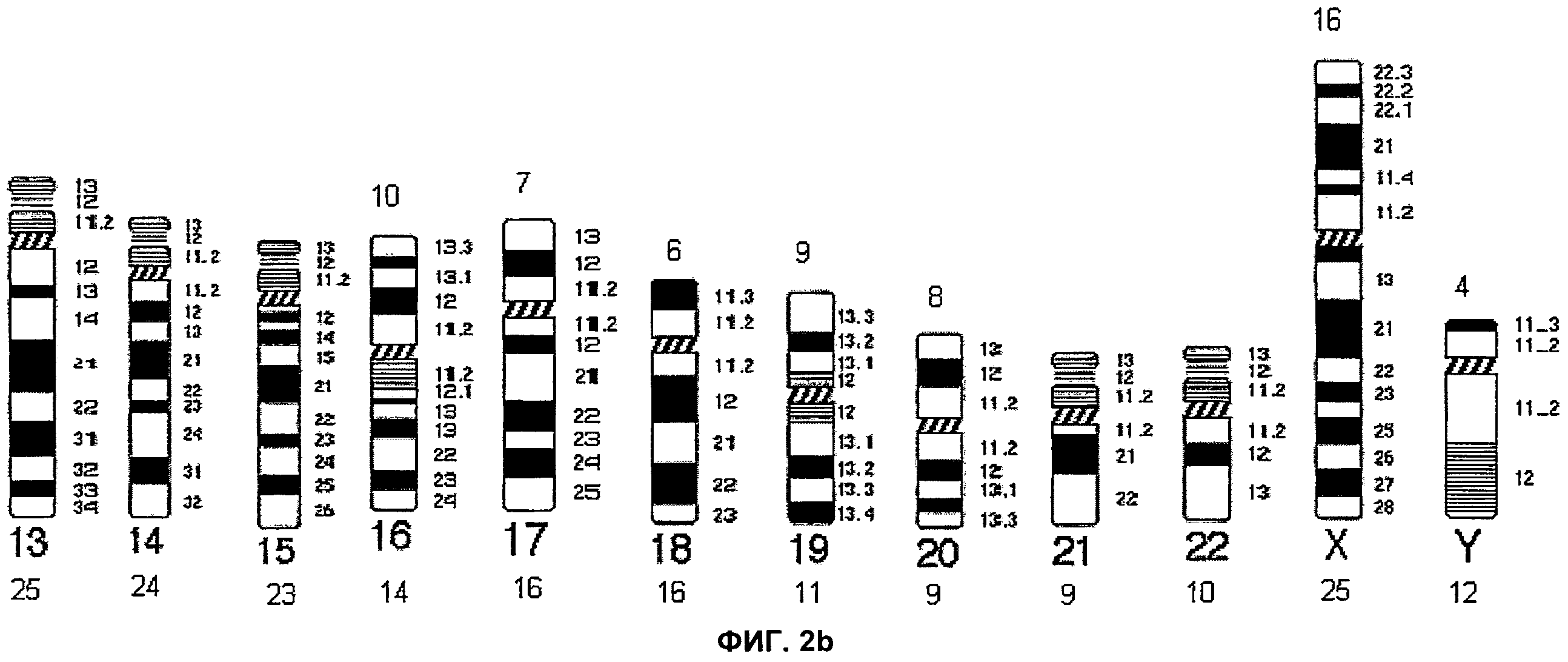
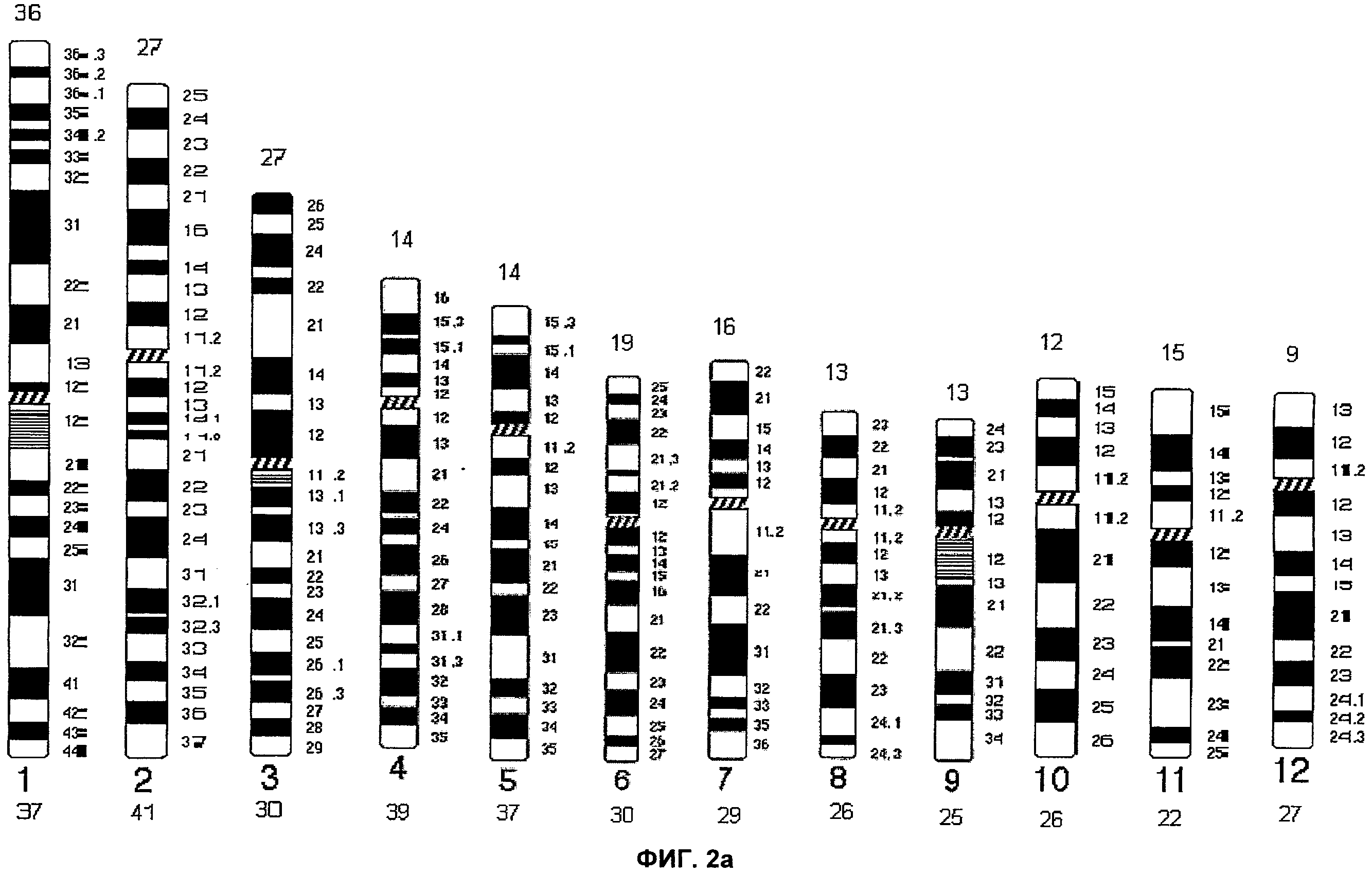
Фиг.2а и 2b представляют собой известные из предшествующего уровня техники идеограммы G-окрашивания (бандирования) с разрешением, составляющим 400 бэндов.
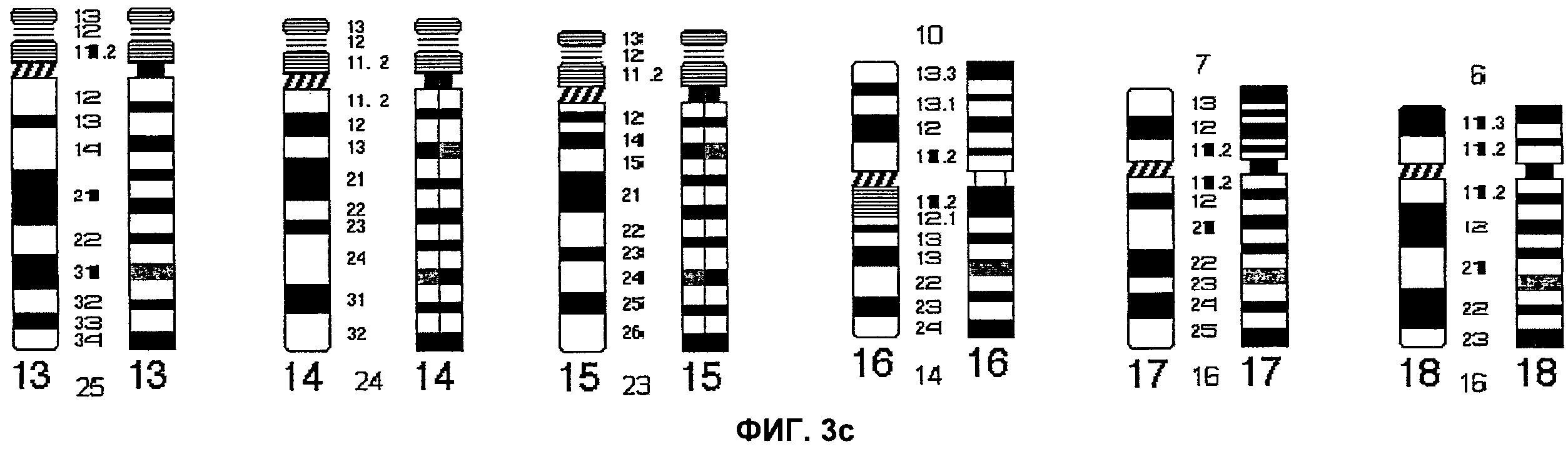
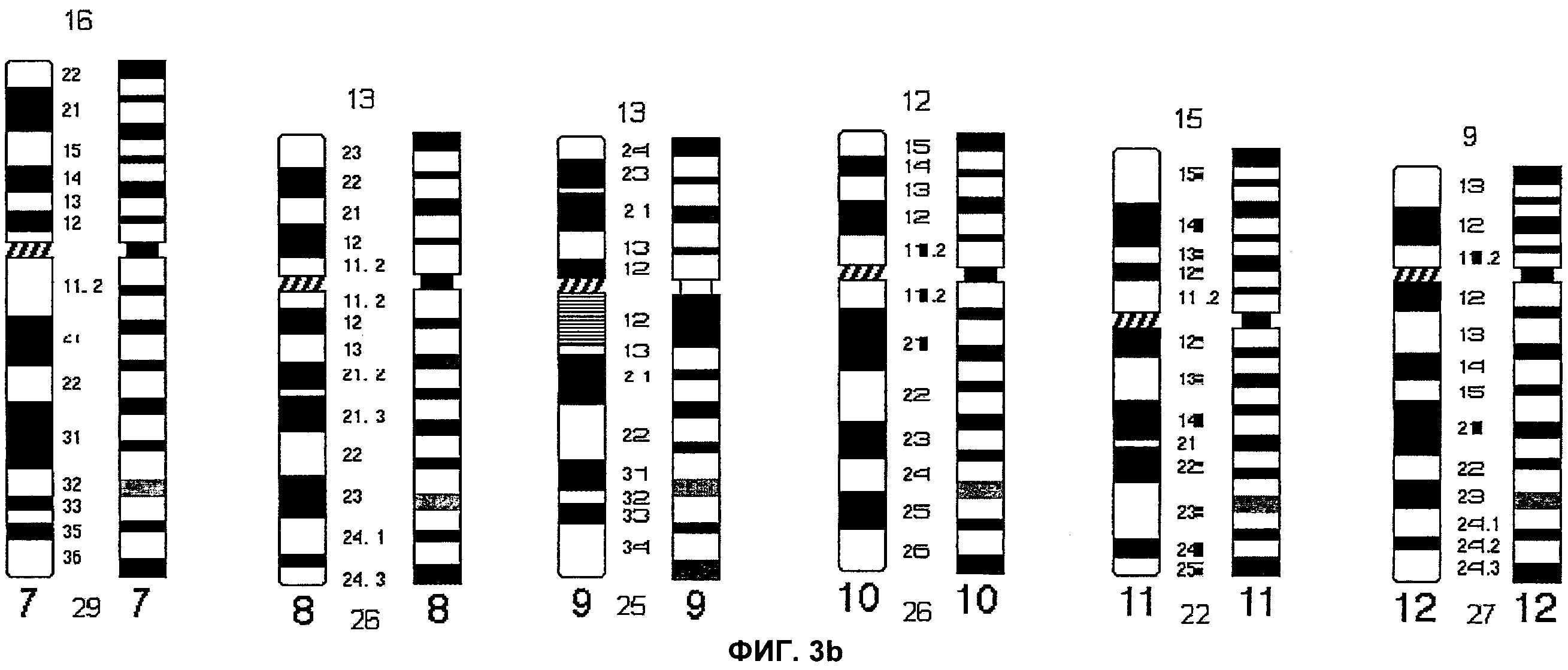
Фиг.3а-3d представляют собой сопоставление выявляемого строения интерфазных хромосом (ICP) и идеограммы G-окрашивания согласно аспектам настоящего изобретения.
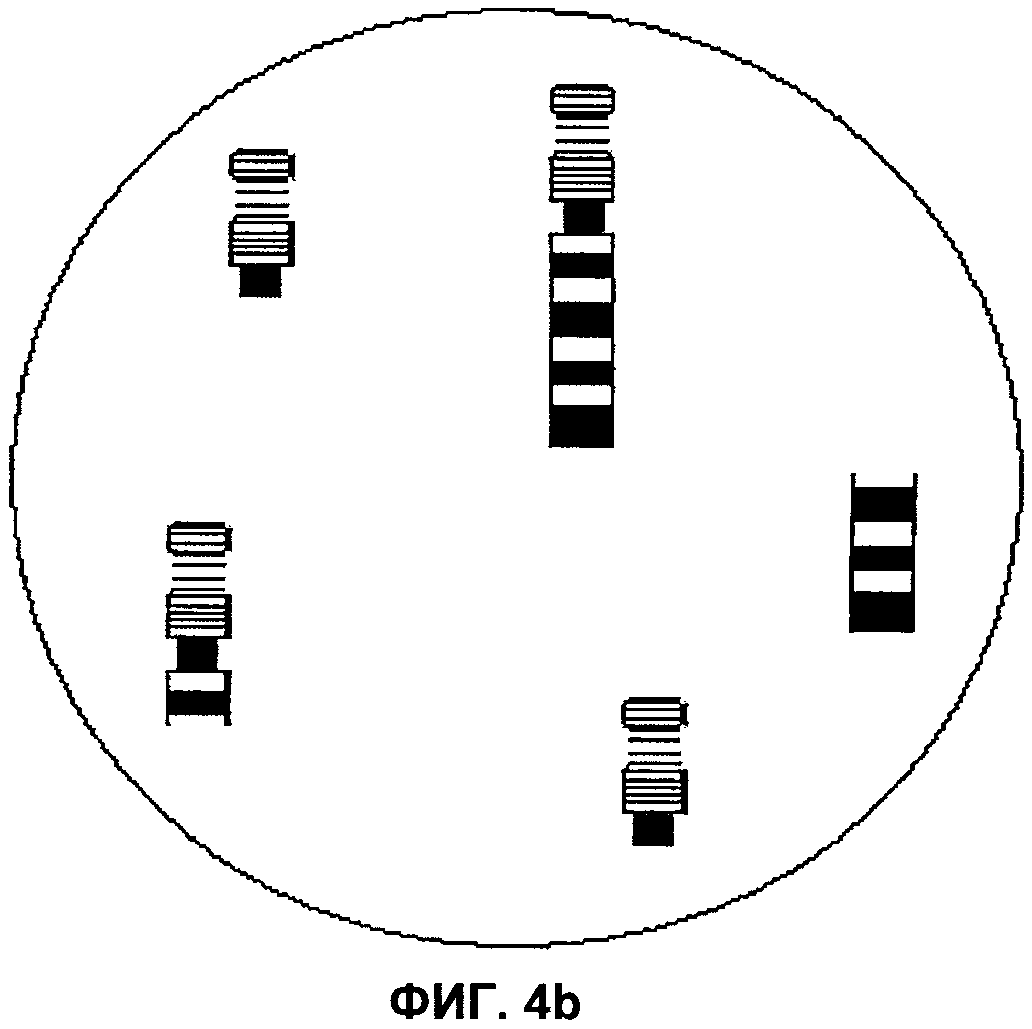
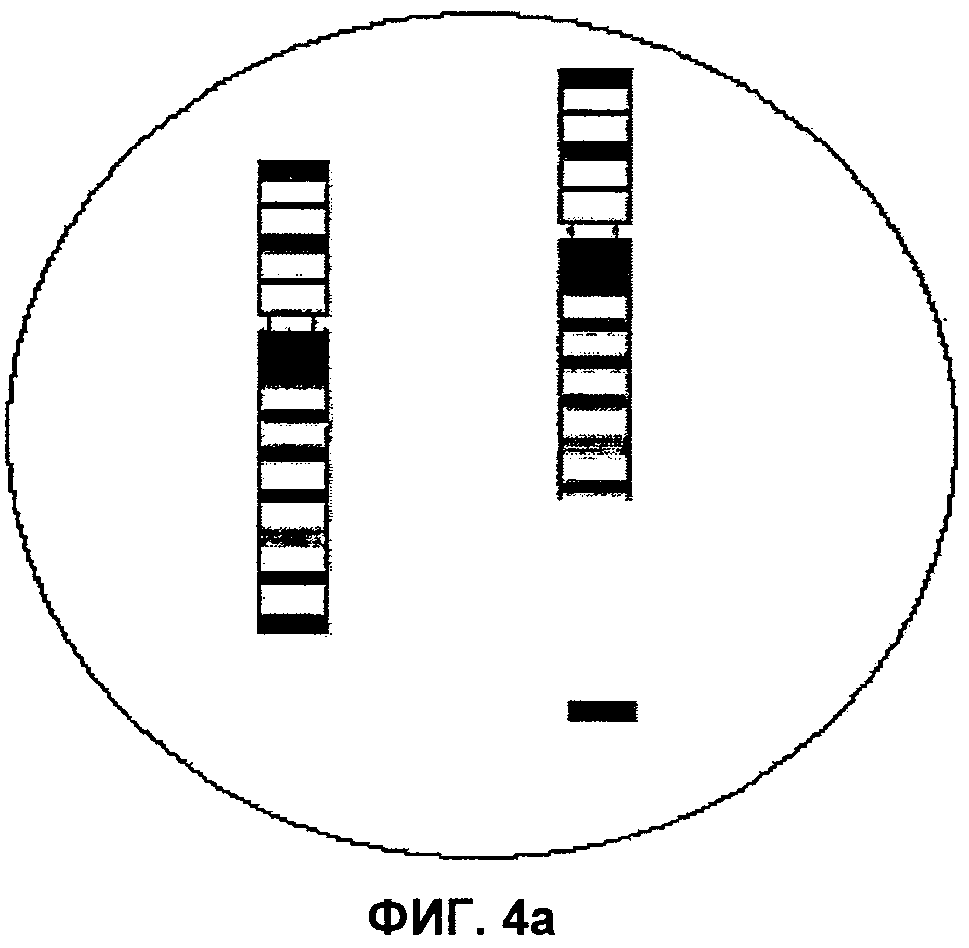
Фиг.4а и 4b представляют собой изображения полей зрения микроскопа, демонстрирующие транслокацию между хромосомами 9 и 22, соответственно, согласно аспектам настоящего изобретения.
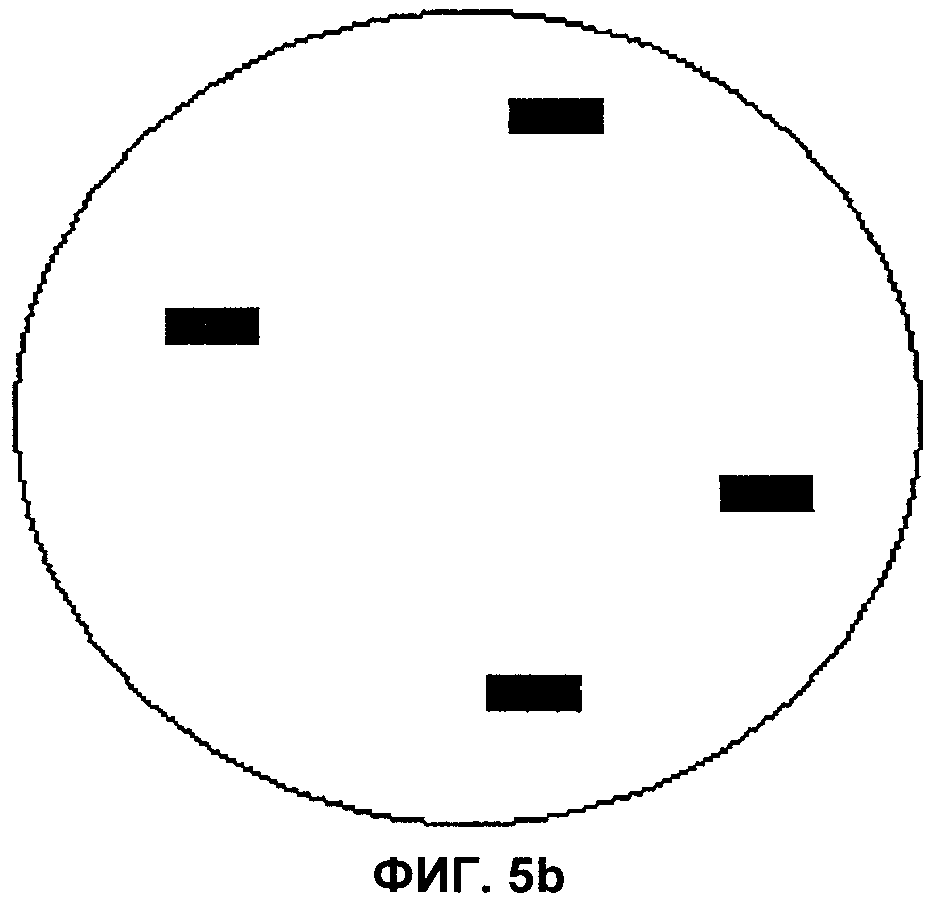
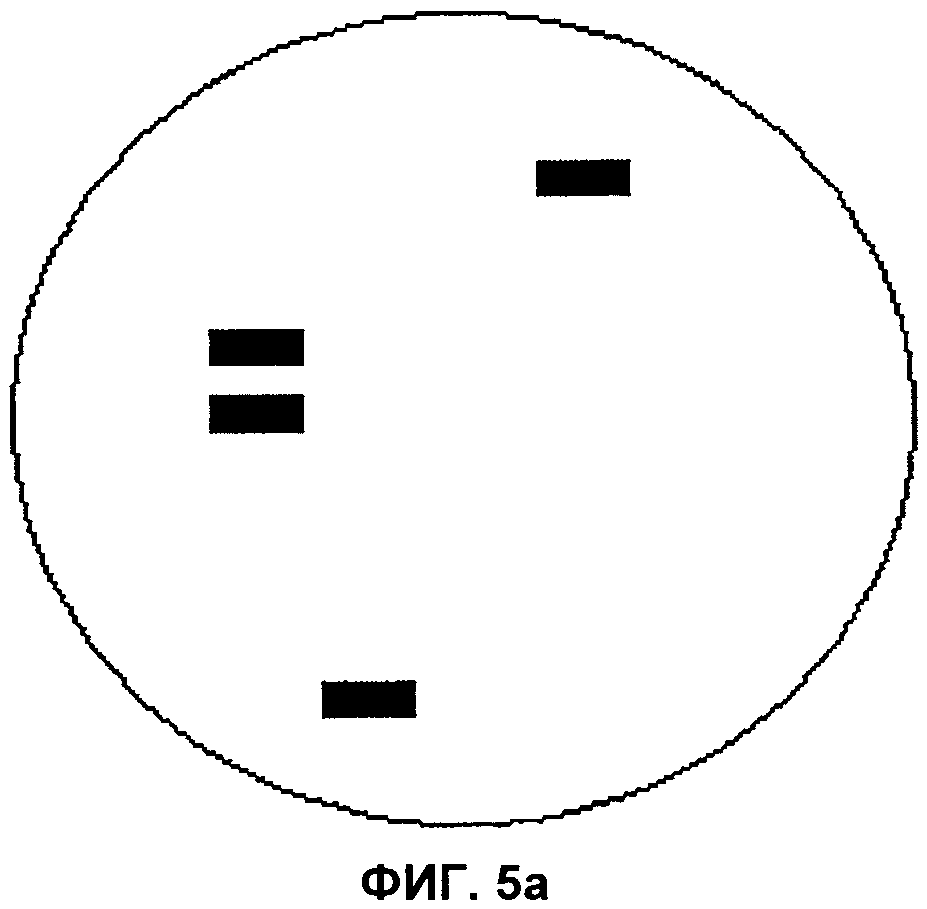
Фиг.5а и 5b представляют собой изображения полей зрения микроскопа, демонстрирующие наличие транслокации и отсутствие транслокации соответственно, в целях проверки согласно аспектам настоящего изобретения.
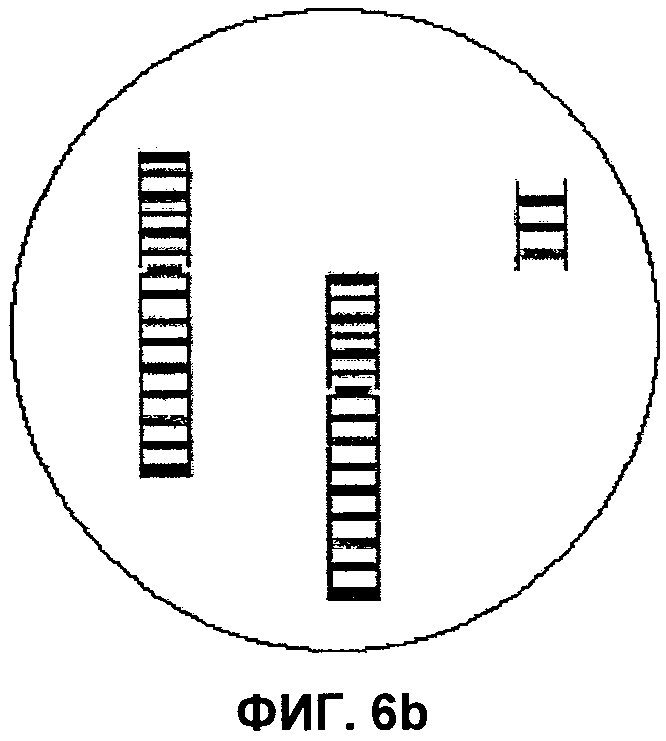
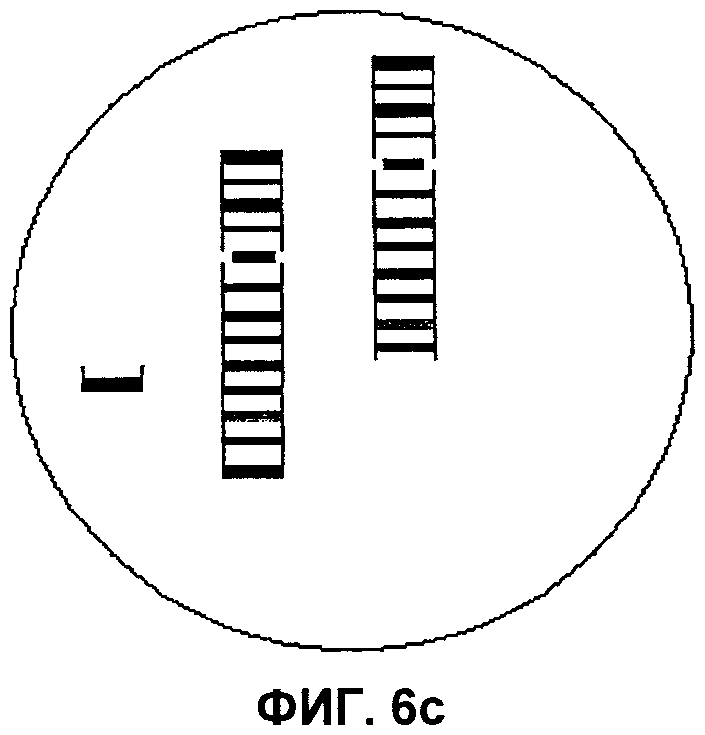
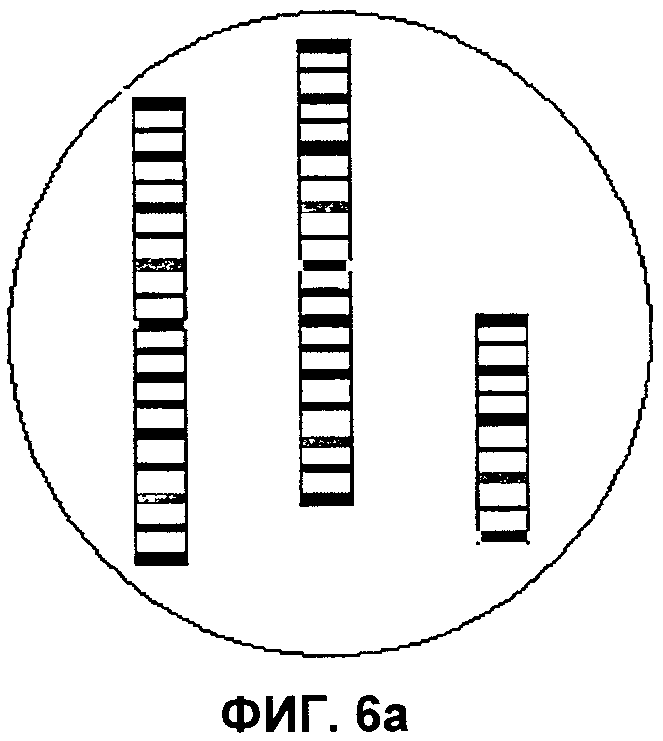
Фиг.6а, 6b и 6c представляют собой изображения выявления маркерной хромосомы в составе хромосом 3, 7 и 10 соответственно, согласно аспектам настоящего изобретения.
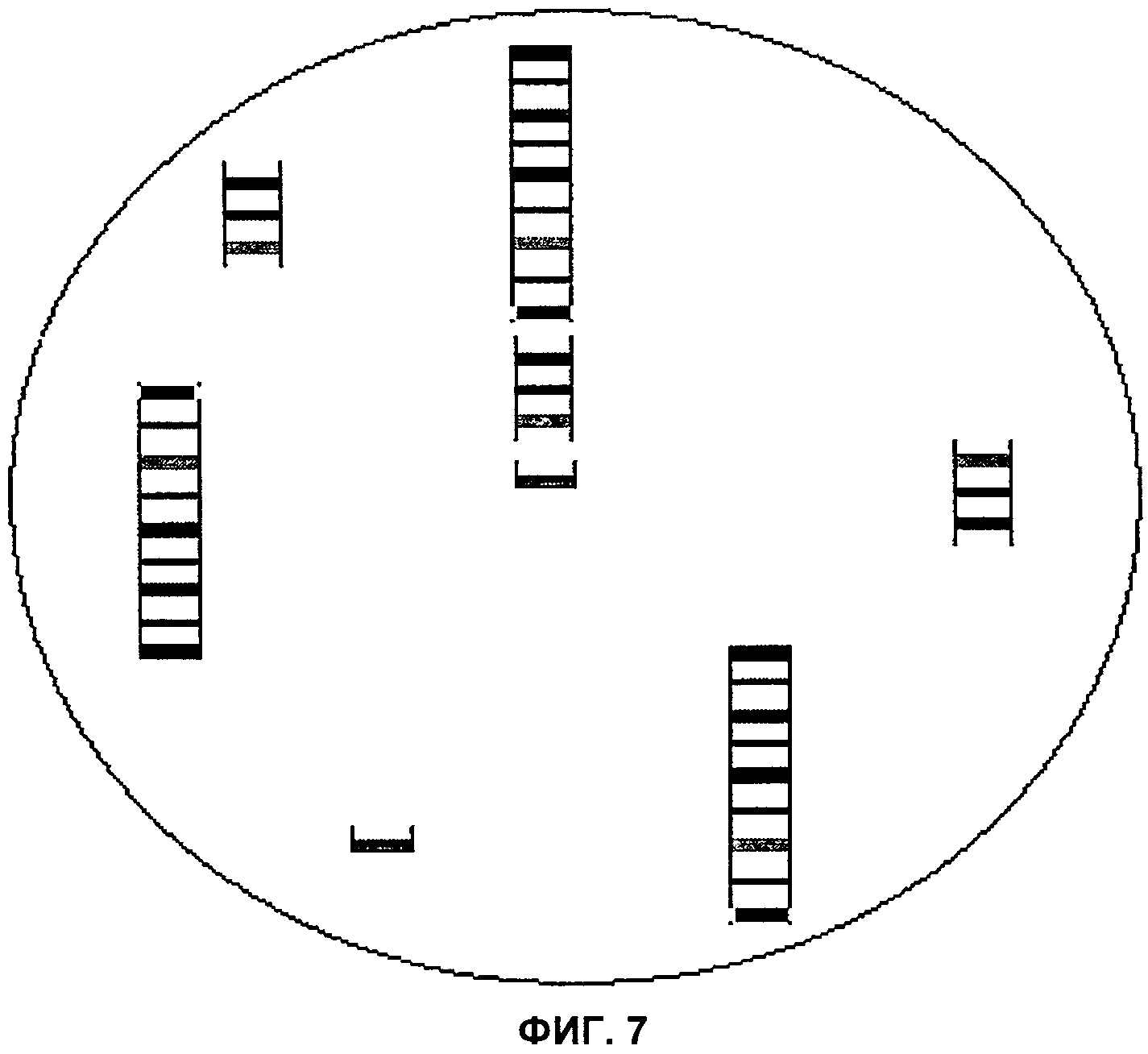
Фиг.7 представляет собой конечное изображение поля зрения микроскопа при обнаружении материала маркерной хромосомы, в хромосомах 3, 7 и 10, согласно аспектам настоящего изобретения.
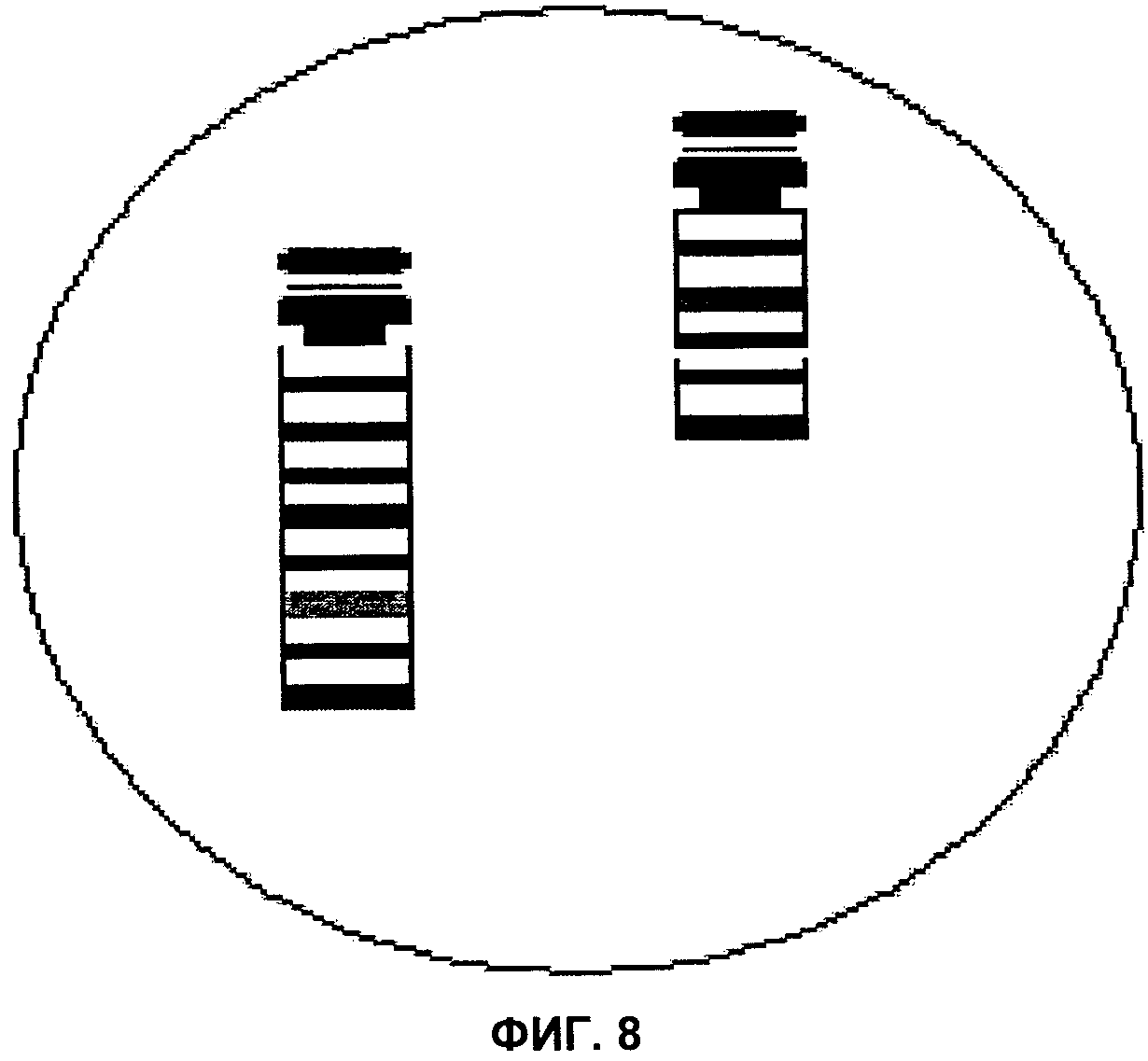
Фиг.8 представляет собой изображение поля зрения микроскопа, демонстрирующее интерстициальную делецию в хромосоме 13, согласно аспектам настоящего изобретения.
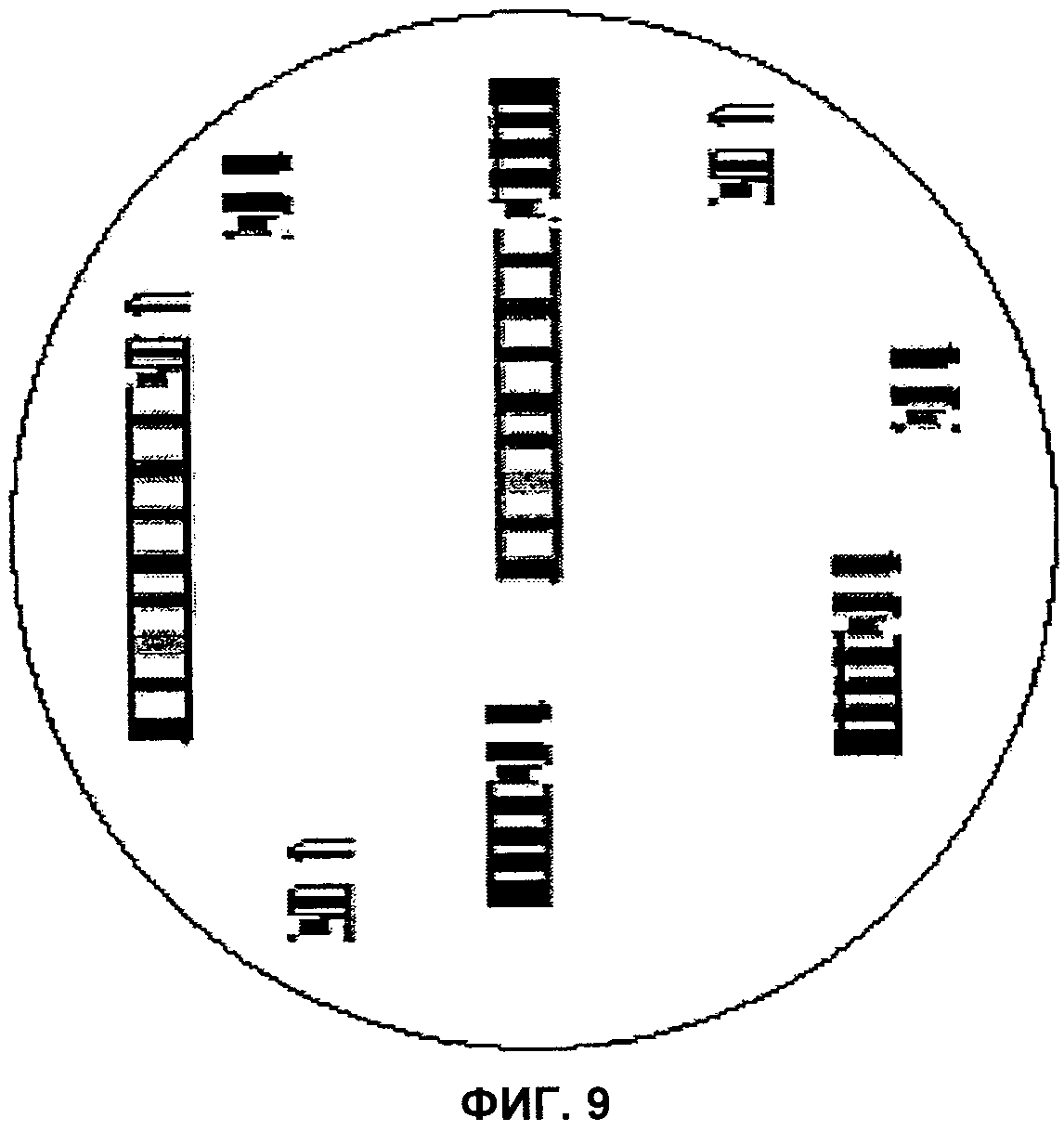
Фиг.9 представляет собой изображение поля зрения микроскопа, демонстрирующее Робертсоновскую транслокацию, затрагивающую хромосомы 14 и 21, согласно аспектам настоящего изобретения.
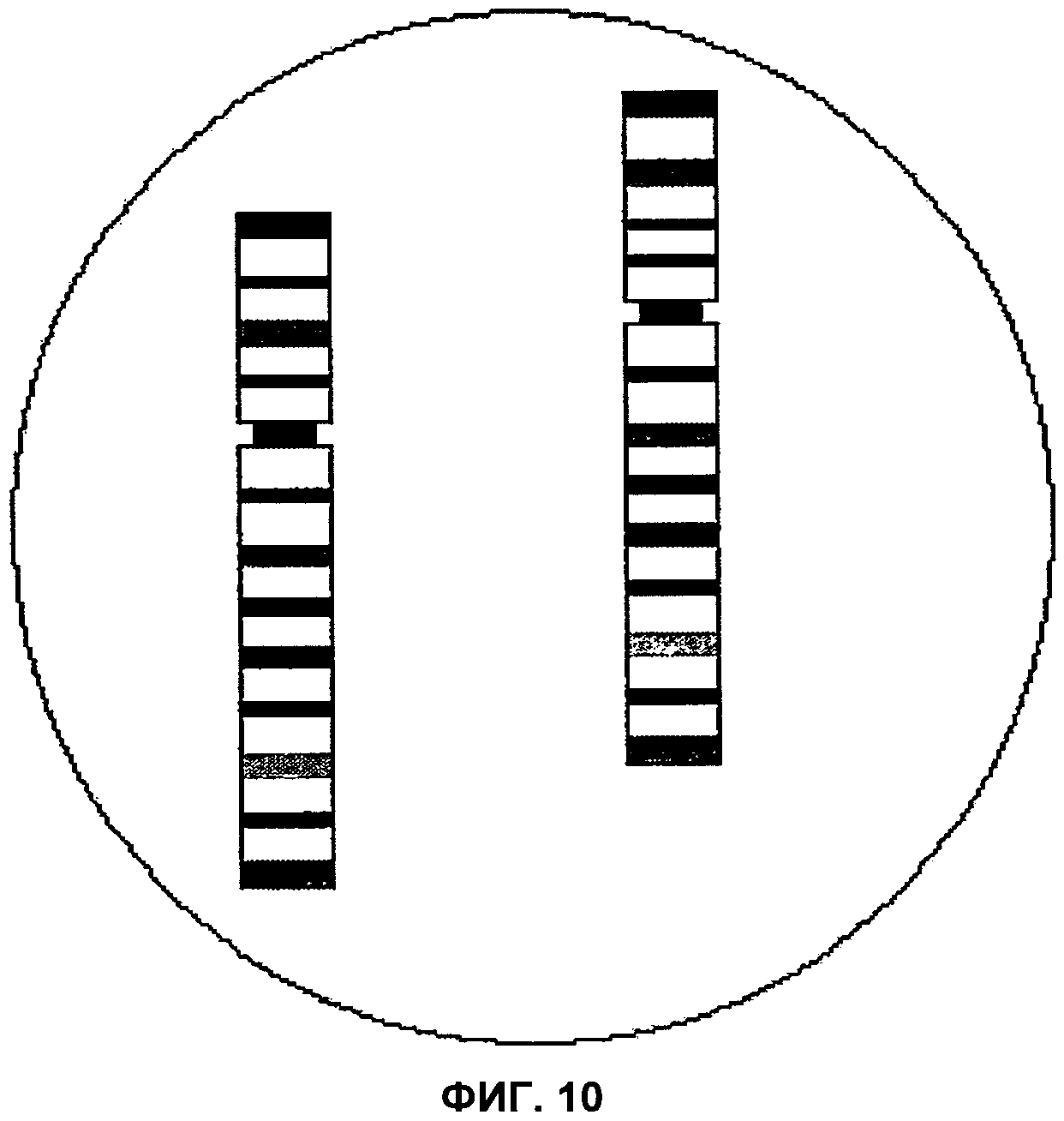
Фиг.10 представляет собой изображение поля зрения микроскопа, демонстрирующее парацентрическую инверсию короткого плеча хромосомы 8, согласно аспектам настоящего изобретения.
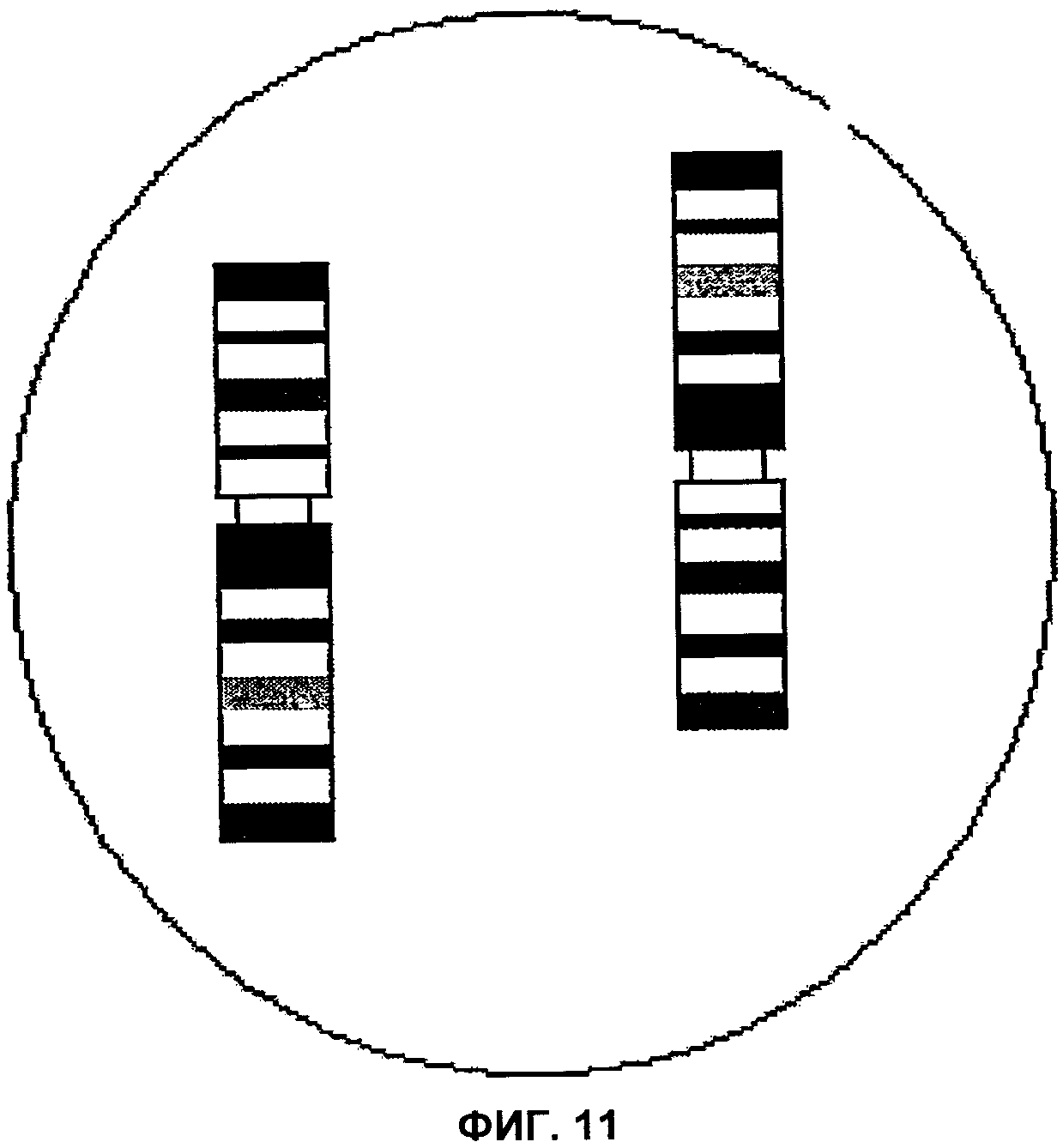
Фиг.11 представляет собой изображение поля зрения микроскопа, демонстрирующее перицентрическую инверсию короткого плеча хромосомы 16, согласно аспектам настоящего изобретения.
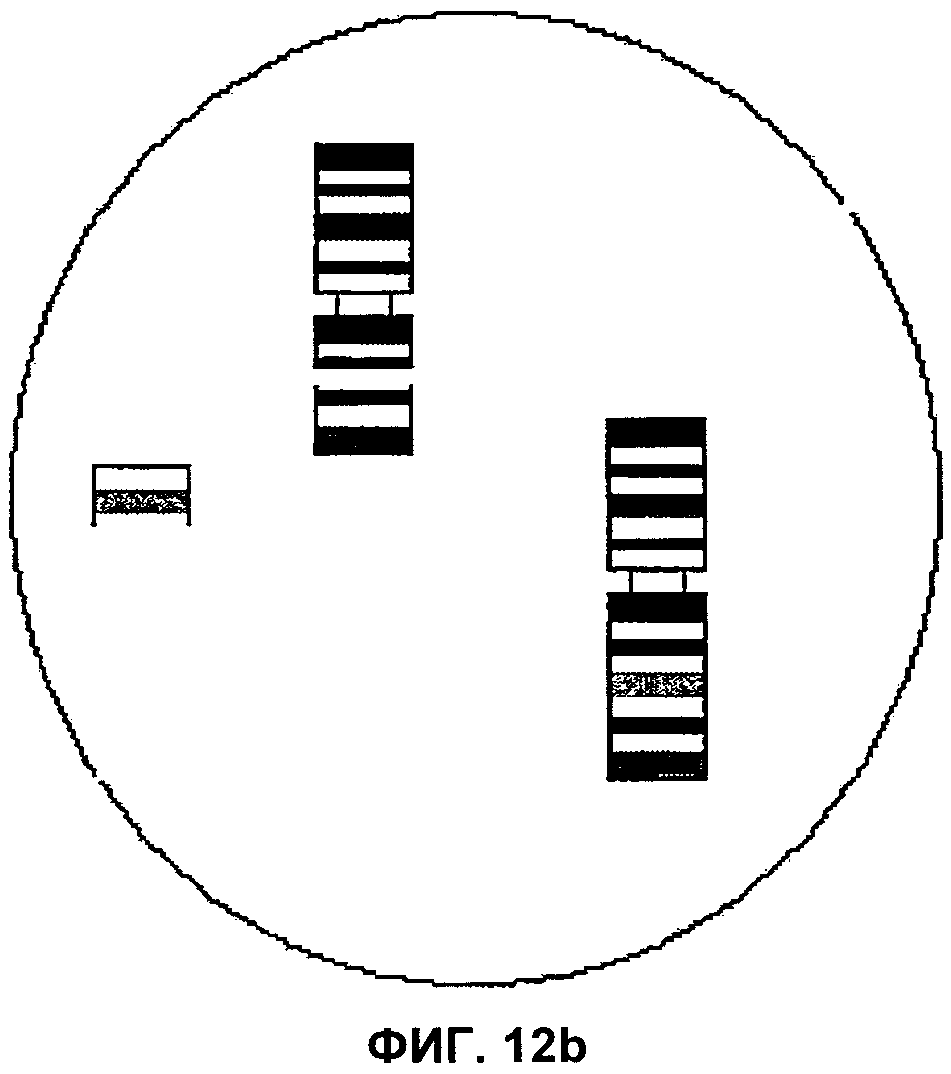
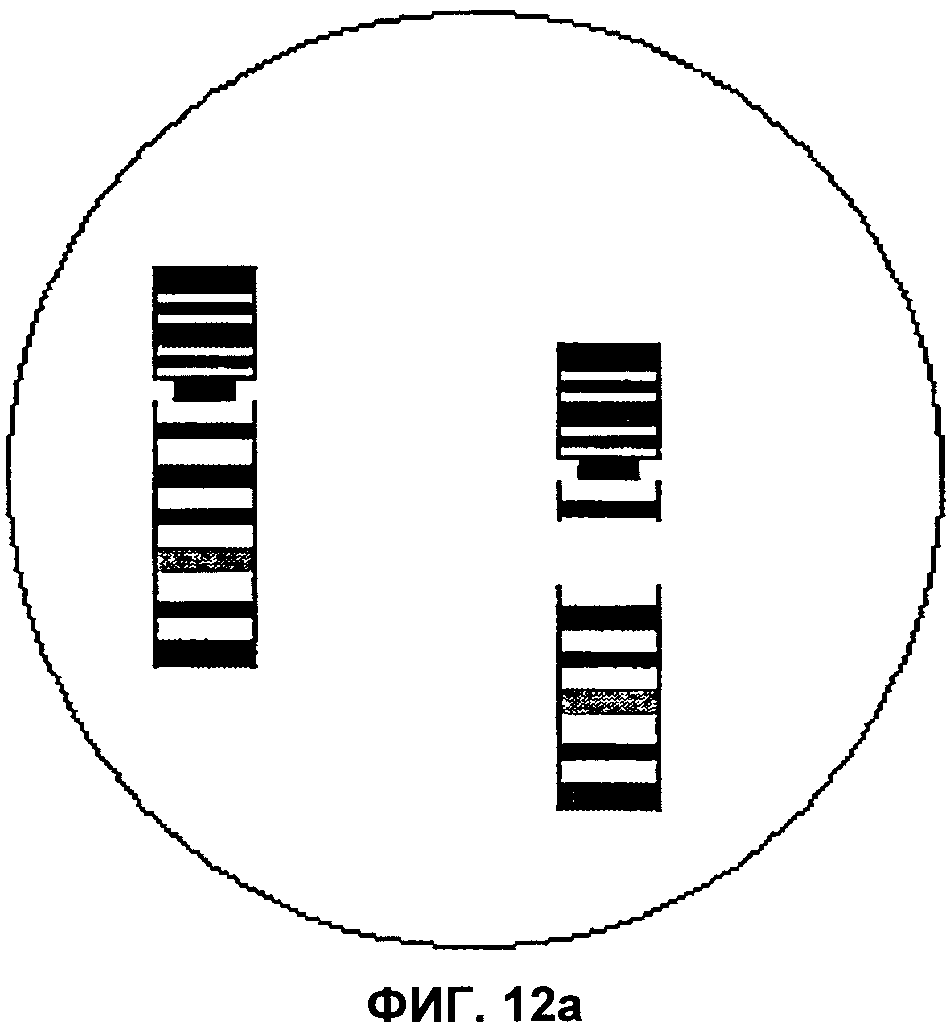
Фиг.12а и 12b представляют собой изображения полей зрения микроскопа, демонстрирующие интерстициальные транслокации, затрагивающие хромосомы 17 и 19 соответственно, согласно аспектам настоящего изобретения.
Фиг.13а и 13b представляют собой микрофотографии колориметрической in situ гибридизации из предшествующего уровня техники.
Фиг.14 иллюстрирует гибридизационную пластинку.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
На Фиг.1 каждая хромосома представлена в виде идеограммы характерного окрашивания сегментов хромосомы - ICP. Центромерные/перицентромерные области показаны черным цветом; теломеры короткого плеча обозначены синим цветом, а теломеры длинного плеча обозначены красным цветом. Для акроцентрических хромосом 14, 15 и 21, идеограммы ICP разделены на две части: левую и правую. На левой идеограмме представлено окрашивание сегментов хромосомы в случае, когда хромосома была введена первой, а на правой идеограмме представлено окрашивание хромосомы в случае, когда хромосома была введена второй. Термины первый и второй относятся к порядку соответствующей хромосомы при комбинировании акроцентрических хромосом на Пластинке 1. Для хромосом 13 и 22 характерен только один вариант характерного окрашивания сегментов ICP, поскольку эти хромосомы всегда вводят как первую и вторую, соответственно. Фиг.2 представляет собой идеограмму стандартного дифференциального G-окрашивания хромосом с разрешением, составляющим 400 бэндов.
Каждую хромосому, например, хромосому человека, можно идентифицировать на стадии интерфазы посредством гибридизации специфических последовательностей ДНК на различных хромосомах. Эти последовательности могут располагаться в цетромерных или теломерных областях хромосомы, или в специфичных областях, лежащих между центромерой и теломерой. Размещение указанных последовательностей на хромосоме предусмотрено таким образом, что они по существу равномерно распределены по хромосоме с учетом общей длины короткого и длинного плеча хромосомы. С использованием принципа по существу равномерного распределения, все плечи хромосом человека можно отнести к одной из трех групп: Группа 1 (малые), Группа 2 (средние) и Группа 3 (большие). В пределах каждой группы индивидуальные сегменты располагаются по существу на одинаковом расстоянии друг от друга. Такое расположение в сочетании с описанной в данной заявке техникой окрашивания обеспечивает создание уникального для каждой хромосомы рисунка окрашивания сегментов хромосомы. Хромосомы разделяют на несколько групп на основании их размера, и хромосомы в пределах каждой группы имеют рисунок с одинаковой цветовой последовательностью для удобства опознавания.
Каждое плечо хромосомы имеет индивидуальный «рисунок» окрашенных сегментов. Любые изменения этого рисунка могут свидетельствовать о генетических изменениях (то есть, хромосомной аномалии). Как правило, центромеры хромосомы окрашивают черным, по мере продвижения от центромеры к концу плеча окрашенные сегменты образуются при смешивании в различных соотношениях двух основных цветов, применяемых для окрашивания концевых (теломерных) сегментов хромосом. К примеру, если теломера короткого плеча окрашена синим цветом, а теломера длинного плеча окрашена красным цветом, то окрашенный сегмент между центромерой и теломерой будет представлять собой смесь красного и синего цветов в различных соотношениях, например иметь темно-красный, темно-синий, светло-синий, фиолетовый и красновато-коричневый цвет. С применением такого дифференциального окрашивания можно легко распознать хромосомные аномалии в интерфазной клетке при помощи простого светового микроскопа, без каких-либо манипуляций с цветами, что имеет место при использовании способов, применяемых в настоящее время в данной области для детекторов на основе FISH, фильтров, дихроичных зеркал, CCD камер, сложных компьютерных программ или интерферометрической спектроскопии.
В альтернативном варианте реализации хромосому можно окрашивать черным или другим различимым цветом в дополнительных равноудаленных участках короткого и длинного плеча хромосомы, расположенных между основными характерно окрашенными сегментами. Такое дополнительное окрашивание позволяет упростить визуальное обнаружение генетических аномалий, увеличивая разрешение, а также обеспечивая ориентиры, которые могут быть идентифицированы пользователем. В данной заявке отличающиеся по цвету сегменты называют основными сегментами (бэндами), а дополнительные сплошные сегменты, такие как, например, черные полосы, называют второстепенными сегментами (бэндами).
Для обеспечения дополнительных различий между коротким плечом и длинным плечом хромосомы второстепенные сегменты короткого и длинного плеч могут быть окрашены с получением различных по толщине полос (сегментов) на соответствующих плечах хромосомы. Например, второстепенные сегменты короткого плеча можно окрасить таким образом, что они будут иметь одинаковую толщину, меньшую чем у второстепенных сегментов на длинном плече хромосомы. Такое окрашивание может упростить выявление аномалий, затрагивающих отдельную хромосому.
В отличие от FISH, в настоящем изобретении обнаружение гибридизированных последовательностей основано на колориметрической in situ гибридизации (Colorimetric In Situ Hybridization, CISH). Согласно аспектам настоящего изобретения добавление специфических ферментов, конъюгированных с ДНК-зондами в определенных соотношениях, может привести к образованию различных цветов. Это делает возможным протекание последовательных или одновременных ферментативных реакций на одном и том же участке хромосомы в интерфазной клетке.
В настоящее время в основанных на FISH подходах, известных в данной области, применяют специфические ДНК-зонды для обнаружения известных генетических аномалий с применением как метафазных хромосом, так и интерфазных ядер. Для проверки диагноза, прежде всего, проводят тестирование с определенным набором зондов, и если результаты теста положительные, тестирование не продолжают. Однако очень часто первоначальный «рабочий диагноз», поставленный практикующим врачом, является неправильным, и лаборанты вынуждены перебирать один за другим множество наборов ДНК-зондов. Это не только занимает много времени, но также является дорогостоящим. В худшем случае может возникнуть недостаток исследуемого материала (то есть, метафазных или интерфазных хромосом) для проведения серии гибридизаций, необходимых для получения полной информации о кариотипе и правильной постановки диагноза.
Классический цитогенетический анализ остается общепринятым, поскольку 1) он не требует предварительной информации о заболевании; 2) он способен выявить не только известные, но и неизвестные генетические аномалии и 3) он дает полную информацию о кариотипе за один эксперимент. Однако этот способ требует культивирования, что значительно увеличивает продолжительность анализа. Кроме того, для таких типов тканей, как солидные опухоли и продукты оплодотворения, процент успешных попыток культивирования очень низок, что приводит к недостатку или полному отсутствию значимой информации. Кроме того, выявление маркерной хромосомы часто очень затруднительно и вообще невозможно при применении стандартного дифференциального G-окрашивания. Настоящее изобретение позволяет преодолеть эти проблемы, не требуя культивирования клеток и обеспечивая достоверный способ обнаружения всех типов хромосомных изменений в интерфазном ядре менее чем за 48 часов.
IСР облегчает определение почти всех хромосомных аномалий благодаря применению одного универсального набора зондов, без какой-либо предварительной информации о наличии определенных генетических аномалий в образце. При таком исследовании в капле или лунке гибридизационной камеры (пластинки) можно проанализировать одну интерфазную хромосому. Например, гибридизационные камеры включают набор из трех пластинок, каждая из которых содержит 10 лунок. Пластинку 1 можно применять для обнаружения Робертсоновских транслокаций (транслокаций между акроцентрическими хромосомами (т.е., хромосомами 13, 14, 15, 21 и 22)). Пластинку 2 можно применять для исследования хромосом 1-10. Пластинку 3 можно применять для исследования хромосом 11, 12, 16-20, X и Y. В одном из аспектов изобретения, две лунки можно преднамеренно оставлять пустыми для дополнительного тестирования. Способ ICP позволяет избегать излишних реакций гибридизации с многочисленными наборами различных зондов, позволяя таким образом получить полную информацию о кариотипе при объединении результатов, полученных лишь для 28 лунок.
В одном аспекте изобретения технику ICP применяют согласно следующим стадиям: 1) создание ДНК-зондов; 2) in situ гибридизация; 3) колориметрическая детекция гибридизации ДНК и 4) микроскопический анализ. Стадия 1 может включать применение ДНК-зондов из 24 хромосом человека, содержащих метку, такую как ДНП, биотин, флуоресцеин и т.п. В частности, зонды могут быть созданы путем микродиссекции хромосом или другим способом, известным в данной области, для получения определенного участка хромосомы, с которым необходимо осуществить гибридизацию. Например, зонд может быть создан с применением способа микродиссекции, с применением плазмид, космид, компьютерных способов анализа геномной информации, синтеза и т.п. На Стадии 2 интерфазные клетки в каждой лунке гибридизуют в течение ночи с одним набором ДНК-зондов, специфичных для хромосомы или аномалии, которую необходимо выявить. Гибридизацию можно осуществлять с применением стандартных способов in situ гибридизации, например, с предварительной обработкой ферментами для обеспечения проникновения ДНК-зондов через ядерную мембрану и денатурации ДНК для разделения двух ее нитей. На Стадии 3 каждую конкретную метку можно выявить при помощи стандартных способов детекции. Детекция может быть последовательной или одновременной. На основании заранее определенного соотношения цветов в различных сегментах по всей длине отдельных хромосом смешивание, например, двух цветов, в результате двух ферментативных реакций, приводит к образованию нового детектируемого цвета. Различные цвета сегментов хромосом могут быть заранее определены, и, как показано на Фиг.1, могут быть представлены в виде идеограммы для удобства сравнительного анализа. Согласно Стадии 4, проявление цвета отдельных сегментов на хромосоме может быть замечено и проанализировано человеком с применением простого стандартного светового микроскопа.
В пренатальной диагностике общая продолжительность анализа является критическим параметром, и с проведением анализа могут быть связаны значительные переживания родителей, ожидающих результатов. Для принятия решения и контроля протекания беременности крайний срок для получения результатов ограничен 24 неделей беременности. При нормальных обстоятельствах стандартный хромосомный тест проводят на сроке приблизительно 16-20 недель беременности, при этом результаты готовы через 10-14 дней. Таким образом, тестирование с применением аминоцентеза на поздних сроках беременности, как правило, является нежелательным. В некоторых клинических случаях необходимо проведение хромосомного анализа в течение последних нескольких недель беременности. При определенных обстоятельствах результаты должны быть получены в кратчайшие сроки. При анализе с применением аминоцентеза на ранних сроках (т.е. 12 недель) получение результатов обычно занимает значительно более 10-14 дней. Обычно это обусловлено небольшим количеством клеток, доступных для анализа. Во всех подобных случаях классическая цитогенетика, как правило, не может определить природу маркерных хромосом. В результате необходимо проведение специальных исследований, требующих дополнительного времени и денег. Стандартный анализ методом FISH можно осуществить за 48 часов, но его возможности ограничены, и он не может предоставить полную информацию о хромосомах, в том числе обнаружить Робертсоновские транслокации, которые могут потенциально увеличивать заболеваемость, обуславливая такие патологические состояния, как однородительская дисомия (ОРД).
Хромосомный анализ клеток периферической крови может быть выполнен для пациентов с аномальными фенотипическими характеристиками, такими как, например, умственная отсталость, или у пар с проблемами бесплодия или многократными выкидышами для постановки генетического диагноза. Как правило, с применением современных подходов общая продолжительность такого анализа составляет 5 дней, однако, стандартный хромосомный анализ не может идентифицировать маркерные хромосомы и несбалансированные хромосомные перестройки. Эти случаи требуют дополнительного тестирования, что увеличивает общую продолжительность анализа и увеличивает его стоимость. При определенных условиях, аномалии затрагивают концы хромосом (т.е. «скрытые перестройки»), что может остаться незамеченным при обычном тестировании. В настоящее время обнаружение такого рода аномалий требует проведения дорогостоящего анализа методом FISH для получения какого-либо диагностического заключения.
Например, среди пациентов с такими заболеваниями, как идиопатическая умственная отсталость (ID), приблизительно у 5-9% наблюдаются ультрамикроскопические субтеломерные перестройки, которые не могут быть выявлены способами классической цитогенетики. Более того, у приблизительно 7% всех пациентов с нормальным кариотипом, имеющих ID, нарушения развития, наблюдаются субтеломерные перестройки. В некоторых случаях необходим стандартный анализ дополнительных клеток, что может значительно увеличить стоимость.
При анализе лейкемии/лимфомы информация о хромосомах является не только крайне необходимой для постановки точного диагноза, но также крайне важна для назначения различных схем лекарственного лечения. Часто врач может ожидать результатов, чтобы принять критическое решение о дальнейшем лечении. В современных способах тестирования общая продолжительность анализа составляет обычно около 5 дней. Одним из основных недостатков современных способов тестирования является то, что стандартный хромосомный анализ не может идентифицировать маркерные хромосомы и производные хромосом, а также упомянутые выше скрытые перестройки, затрагивающие теломеры. В этих случаях может потребоваться дополнительное тестирование, что приводит к увеличению общей продолжительности анализа и увеличению его стоимости. В некоторых случаях с нормальными/аномальными результатами необходим анализ значительно большего числа клеток стандартными способами тестирования, что может также увеличить стоимость. К несчастью, во многих случаях невозможно получить дополнительные клетки с хромосомами для тестирования. Приблизительно в 5-10% случаев вообще не удается получить информацию о хромосомах из-за невозможности культивирования.
Значение информации о хромосомах для диагностики солидных опухолей и ведения пациента быстро возрастает. Для раков солидных тканей, например, мочевого пузыря, простаты, почки, груди, легкого и т.п., стандартный хромосомный анализ может занимать до 30 дней или более, и более чем в 70-80% случаев невозможно получить результаты. Это приводит к увеличению случаев неудавшихся исследований. Как и в случаях лейкемии и лимфомы, описанных выше, маркерные хромосомы и их производные невозможно выявить с применением стандартных способов анализа хромосом.
Информацию о хромосомах можно получить на абортивном материале для постановки генетического диагноза и для предоставления рекомендаций пациенту относительно будущей беременности. С применением современных способов тестирования, общая продолжительность генетического тестирования ткани такого рода может составлять до 30-45 дней. Что еще более важно, в 20-40% случаев результаты не могут быть получены при помощи стандартного хромосомного анализа из-за повреждения образца. Таким образом, для правильной диагностики генетической аномалии и предоставления консультации пациенту, как правило, необходимы дополнительные исследования. Впоследствии, такие дополнительные исследования увеличивают стоимость и необходимое для анализа время.
ICP восполняет недостатки, обусловленные ограничениями современных способов тестирования, удовлетворяя существующие потребности клинической цитогенетики и медицины, и является наиболее эффективным по времени и стоимости исследования.
Следующие примеры иллюстрируют способы осуществления изобретения. Данные примеры следует истолковывать как очевидные варианты реализации изобретения, но не в качестве ограничения применения изобретения.
Пример 1 - Применение гибридизационных камер
Согласно современным подходам, для получения многоцветного кариотипа на основе метафазных хромосом используют 24 различных цвета. Для получения метафазных хромосом материал из различных видов образцов, таких как, например, периферическая кровь, костный мозг, амниотическая жидкость, солидные массы и тому подобное, необходимо культивирование. В целом для получения полной информации о кариотипе необходимо проанализировать 20 клеток. Часто доступное количество клеток ограничено. До настоящего изобретения не существовало способа для эффективного использования исходного материала так, чтобы могла быть получена полная характеристика генетических изменений, присутствующих в предоставленном для исследования образце. В данной области существует несколько способов для исследования конкретных наборов хромосом, однако, эти способы довольно ограничены. Как обсуждалось выше, предполагаемая генетическая аномалия должна быть известна заранее, и подобные анализы позволяют получить только ограниченную информацию. Применяя настоящее изобретение с одним универсальным набором зондов без предварительного знания о конкретных генетических изменениях в образце, можно полностью охарактеризовать почти все хромосомные изменения. Так можно проанализировать одну хромосому за один раз в интерфазных клетках в капле или лунке гибридизационной камеры.
В одном аспекте изобретения, гибридизационная камера может состоять из набора пластинок и, как проиллюстрировано на диаграмме, каждая пластинка может содержать лунки. Например, пластинка 1 может представлять собой пластинку для определения особого типа хромосомных перестроек, называемых Робертсоновскими транслокациями. Робертсоновские транслокации представляют собой транслокации между акроцентрическими хромосомами, которые соединяются центромерами, что приводит к уменьшению центромер в кариотипе на одну. Например, когда Робертсоновская транслокация имеет место между хромосомой 14 и хромосомой 21 в сбалансированной форме, в кариотипе присутствуют одна нормальная 21, одна нормальная 14 и объединенная хромосома 14/21, так что общее количество хромосом в геноме человека изменяется с 46 до 45. В геноме человека присутствуют пять акроцентрических хромосом (хромосомы 13, 14, 15, 21 и 22), и любая из них может участвовать в этом типе перестроек, включая перестройки между обеими копиями одной и той же хромосомы, то есть приводящие к образованию, например, объединенной хромосомы 21/21. Перестройка может приводить к образованию сбалансированного или несбалансированного кариотипа. В несбалансированной форме общее количество хромосом в целом остается 46, однако, в кариотипе, вероятно, присутствуют три копии одной из акроцентрических хромосом.
Применяя современные методы FISH на клиническом образце, полученного от пациента с синдромом Дауна, обычно обнаруживают три копии специфичного для синдрома Дауна участка, то есть 21 q22. Такой результат является достаточным для проявления свободной формы синдрома Дауна, характеризующегося тремя копиями хромосомы 21 в отсутствии Робертсоновских транслокаций. Однако такой же клинический фенотип синдрома Дауна может обуславливаться Робертсоновской транслокацией, затрагивающей хромосому 21 и любую другую акроцентрическую хромосому. Последнюю невозможно обнаружить с применением современных способов, используемых в данной области. Это имеет важное клиническое значение для генетического консультирования и контроля протекания последующей беременности, поскольку показатель риска рецидива сильно отличается между свободной формой и Робертсоновской формой синдрома Дауна. Соответственно, ценная информация потеряна. Это ограничение можно преодолеть при помощи настоящего изобретения.
Робертсоновская транслокация, затрагивающая хромосомы, отличные от 21-й, может также быть клинически значимой в пренатальной диагностике. Патологическое состояние, называемое однородительская дисомия (ОРД), характерно для хромосом 13, 14, и 15. Когда сбалансированные Робертсоновские транслокации происходят между акроцентрическими хромосомами и затрагивают хромосомы 13, 14 или 15, возрастает риск того, что у носителя будет ОРД. ОРД у плода, обнаруженная при пренатальной диагностике, способствует возникновению тяжелых клинических проявлений и значительно увеличивает уровень смертности. До настоящего изобретения единственным способом обнаружения Робертсоновских транслокаций и определения потенциальной ОРД было применение способов стандартной цитогенетики. Выявление строения интерфазных хромосом (ICP) позволяет преодолеть эту проблему путем обнаружения всех Нобертсоновских транслокаций в интерфазных клетках, таким образом, обеспечивая ценную информацию для контроля протекания беременности при пренатальной диагностике.
Пластинка 2 может содержать лунки для хромосом 1-10. Пластинка 3 может содержать лунки для хромосом 11, 12, 16, 17, 18, 19, 20, X/Y с дополнительными лунками, оставленными специально пустыми для дополнительного анализа. При тщательном размещении 25-30 интерфазных клеток в каждой лунке можно изучать даже поврежденные образцы, поскольку отсутствуют излишние реакции гибридизации, и при объединении результатов для отдельных лунок можно получить полную информацию о кариотипе.
Пример 2 - Набор ДНК-зондов
Набор зондов включает уникально сконструированные комбинации ДНК-зондов для каждой из 24 хромосом. Каждая хромосома человека содержит центромеру, а также одно короткое и одно длинное плечо, соединенные в области центромеры. Все хромосомы содержат на концах плеч специфические последовательности ДНК, называемые теломерами, уникальные для каждой хромосомы. Акроцентрические хромосомы содержат только центромеры и длинные плечи. Их короткие плечи являются вариабельными и могут отсутствовать в геноме, и не имеют никакого клинического значения. Поэтому зонды для детекции коротких плеч акроцентрических хромосом не конструируют.
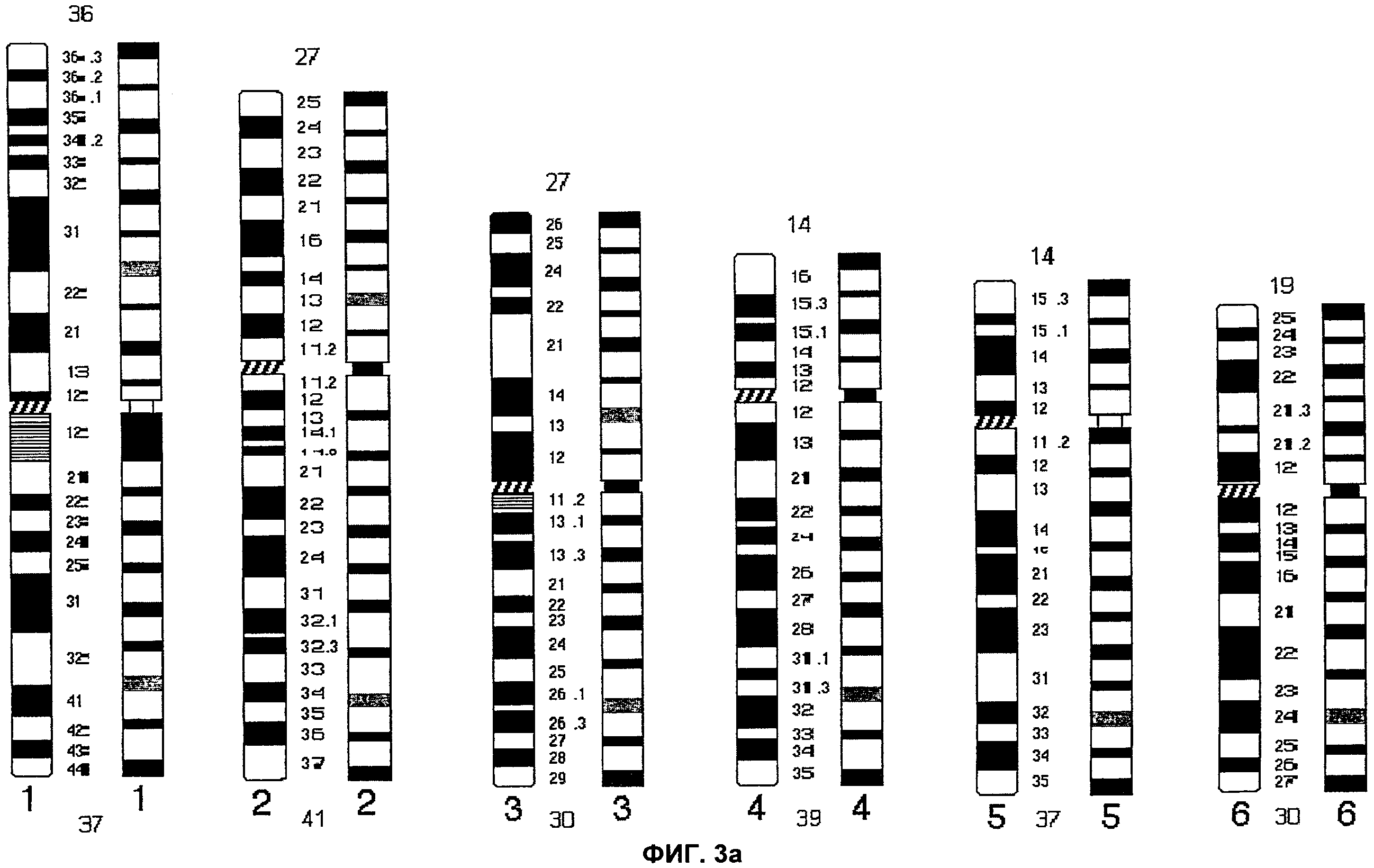
На Фиг.1 представлен рисунок окрашивания сегментов хромосомы, полученный согласно настоящему изобретению. Для сравнения представлено стандартное G-окрашивание (т.е., золотой стандарт). Идеограмма представляет собой схематическое изображение всех сегментов, видимых на хромосоме. На основании данной идеограммы G-окрашивания каждой хромосоме человека была присвоена определенная длина в единицах. Например, хромосома 1, самая большая хромосома человека, имеет 73 единицы длины, при этом короткое плечо имеет 36 единиц длины, а длинное - 37; хромосома 2 имеет 68 единиц длины, при этом короткое плечо - 27 единиц длины, а длинное плечо - 41. Длины всех хромосом в единицах представлены на идеограммах.
В соответствии с современной методологией хромосомы классифицируют, как правило, на основании характера G-окрашивания, и хромосомы разделяют на группы от А до G и половые хромосомы. Хромосомы 1-3 относят к группе А, 3-4 - к группе В, 6-12 и Х - к группе С, 13-15 - к группе D, 16-18 относят к группе F, а 19-20, а также Y хромосому относят к группе G. Сегменты (бэнды) отдельных хромосом, как правило, выявляют химическим окрашиванием, и они имеют строго определенное положение на хромосоме и являются неизменными. Вследствие этого, идентификация хромосомных изменений, затрагивающих область между двумя по природе своей близко расположенными G-бэндами, может быть и часто является затруднительной. Эта проблема может быть решена при помощи настоящего изобретения путем распределения «окрашенных сегментов» по существу на равном расстоянии относительно друг друга с учетом общего размера короткого и длинного плеч. Это может упростить идентификацию хромосомных изменений в интерфазных ядрах.
С применением принципа по существу равномерной гибридизацией на хромосомах, плечи хромосом человека можно отнести к одной из трех групп: хромосомы группы 1 (малые) имеют 4-6 единиц длины; группы 2 (средние) имеют 7-19 единиц длины; группы 3 (большие) имеют 20-41 единиц длины. В пределах каждой группы индивидуальные бэнды расположены по существу на равном расстоянии друг от друга. Например, короткое плечо может иметь 5 сегментов, и длинное плечо может также иметь 5 сегментов. С учетом окрашенного сегмента в области центромеры хромосома 1 имеет всего 11 (5+1+5) окрашенных сегментов. Таким образом, при наблюдении хромосомы 1 человека в клетках на стадии интерфазы с применением способа ICP настоящего изобретения можно увидеть в направлении от конца короткого плеча окрашенный сегмент, затем «неокрашенный» сегмент, окрашенный сегмент, окрашенный сегмент т.п. до центромеры, и такой рисунок сохраняется до конца длинного плеча с окрашенным сегментом. С учетом всех сегментов, окрашенных и неокрашенных, в норме хромосома 1 должна иметь в общей сложности 21 полосу. Разрешающая способность бэндирования такого типа равна или превосходит стандартное разрешение бэндирования при G-окрашивании, проводимом исключительно на метафазных хромосомах, которые можно получить только после культивирования. В качестве другого примера, в соответствии с вышеприведенной моделью, хромосома 18 имеет короткое плечо группы 1 и длинное плечо группы 2; хромосома Y имеет короткое плечо группы 1 и длинное плечо группы 1.
В качестве дополнительного примера, относящегося к хромосоме 1, в промежуточных участках между цветными сегментами могут быть окрашены второстепенные сегменты. Такого рода окрашивание второстепенных сегментов может добавить, например, восемь (8) дополнительных сегментов, в результате чего общее число окрашенных сегментов в хромосоме 1 становится равным девятнадцати (19).
Как показано на Фиг.1, способ классификации проиллюстрирован соответствующим расположением (рисунком) окрашенных сегментов хромосом человека. Как правило, исключительно для наглядности, сегменты в области центромеры могут быть окрашены черным, и по мере продвижения от центромеры к концу короткого плеча, окрашенные сегменты могут быть получены за счет смешивания в различных соотношениях двух основных цветов, применяемых для выделения концевых (теломерных) сегментов. В одном аспекте изобретения, теломерный сегмент короткого плеча может быть окрашен в синий цвет, а теломерный сегмент длинного плеча может быть окрашен в красный цвет. В другом аспекте изобретения для хромосом 1, 5, 9, 16 и 19 вместо центромеры можно использовать перицентромерный сегмент, т.е. сегмент, непосредственно примыкающий к центромере.
Исключительно для наглядности, на примере хромосомы 1, центромера может быть окрашена черным, следующий сегмент в коротком плече может быть окрашен смесью цветов в соотношении 1 часть синего к 9 частям красного, дающей результирующий темно-красный цвет. Следующий сегмент может быть окрашен 7 частями синего к 3 частям красного с получением светло-синего цвета. Следующий сегмент может быть окрашен 5 частями синего к 5 частям красного с получением фиолетового цвета. Следующий сегмент может быть окрашен 3 частями синего к 7 частям красного с получением красновато-коричневого цвета. Наконец, теломерный сегмент может иметь 100% синий цвет, что обозначает конец теломеры. Такую последовательность сегментов между центромерой и теломерой, 7:3, 5:5, 3:7, можно изменить на противоположную при взаимной замене основных цветов для окрашивания длинного плеча. Следовательно, длинное плечо хромосомы 1 в направлении от центромеры, окрашенной в черный цвет, будет иметь 3 красный:7 синий (красновато-коричневый); 5 красный:5 синий (фиолетовый); 7 красный:3 синий (светло-синий) цвет сегментов и, наконец, красный цвет теломерной полосы (100%). Окрашивание целой хромосомы от короткого плеча к длинному плечу представляет собой смену синего, красновато-коричневого, фиолетового, светло-синего, темно-красного, черного, красновато-коричневого, фиолетового, светло-синего и красного цветов. Как ясно из данного описания, каждое плечо имеет четкий рисунок цветных сегментов, и любые изменения этого рисунка указывают на наличие генетического изменения.
Согласно аспектам настоящего изобретения, изменения могут быть легко выявлены в клетках на стадии интерфазы с применением простого светового микроскопа без необходимости обработки цветов при помощи фильтров, дихроичных зеркал, CCD камер, сложных компьютерных программ, интерферометров и т.п., применяемых в настоящее время в данной области для основанной на FISH детекции хромосомных изменений. Поскольку цветные сегменты, полученные согласно настоящему изобретению, располагаются более или менее на равных расстояниях относительно друг друга, независимо от размера плеча, изменение последовательности цветов, потеря или наличие дополнительных цветных сегментов, уменьшение или увеличение единиц длины нецветных сегментов, смещение последовательности цветов указывают на наличие хромосомных аномалий. Этот способ можно применять для обнаружения как численных, так и структурных аномалий по существу любой хромосомы человека. Несколько примеров идентификации хромосомных аномалий, в особенности идентификации маркерных хромосом с применением ICP, описаны ниже. Согласно современной методологии, маркерные хромосомы можно было идентифицировать только на метафазных хромосомах. С применением настоящего изобретения маркерные хромосомы можно идентифицировать в интерфазных ядрах. В результате, значительно экономятся время и деньги.
Пример 3 - Методика CISH
В настоящем изобретении применяют методику колориметрической гибридизации in situ (CISH). При использовании CISH существует множество преимуществ. Наиболее значительные преимущества - это практичность доступного для цитогенетических лабораторий оборудования и избежание излишних расходов, связанных с оборудованием, которое основано на FISH. В то время как подход, основанный на FISH, является достаточным для научных исследований, CISH является уникально подходящей для рутинных клинических цитогенетических лабораторий и лабораторий, занимающихся другими патологиями. Как обсуждалось выше, хромосомные перестройки легко определяются в интерфазных клетках при обычной световой микроскопии без дополнительных манипуляций. При применении способа CISH для представления результатов не используют псевдоцвета, как в методиках многоцветной FISH. Кроме того, как правило, то, что видно в поле микроскопа, представляет собой результат тестирования, то есть истинно окрашенное изображение. Цвет, описанный выше, например, предназначен для обычного глаза человека, не являющегося дальтоником, который может различать близкие цвета. Это дает дополнительные возможности для выполнения текущих цитогенетических анализов даже специалистами невысокой квалификации, таким как лаборанты. Поэтому существует возможность экономии средств и времени, поскольку высококвалифицированные специалисты требуют большую зарплату и их довольно трудно найти.
В настоящее время в методиках CISH применяют только общие ферментативные реакции для получения специфичных цветов в месте реакции. Смешивание специфичных ферментов, конъюгированных с ДНК-зондами, в определенных пропорциях, как здесь описано, с получением различающихся цветов не было известно. В то время, как последовательные ферментативные реакции в различных областях интерфазного ядра были известны из уровня техники, до настоящего изобретения не были возможны последовательные ферментативные реакции в одной и той же области (например, в любой данной области в интерфазном ядре). Главный недостаток CISH по сравнению с FISH - это разрешение (то есть яркость) сигнала в месте реакции. За последние несколько лет в области CISH было сделано несколько усовершенствований, так что при необходимости теперь возможна амплификация сигнала в месте реакции. Кроме того, при включении нескольких лигандов, к которым впоследствии присоединяются ферменты, в течение стадий приготовления ДНК-зондов может быть получено усиление интенсивности сигнала для окрашенных сегментов.
Способ CISH имеет преимущество в том, что он является постоянным. Полученная цветная реакция постоянна и может быть сохранена для применения впоследствии. С другой стороны, сигналы FISH быстро гаснут и вовсе неприменимы для ретроспективного анализа. Поскольку новые генетические изменения обнаруживаются у пациентов (то есть во время лечения) для установления клинической корреляции, наличие предварительно прогибридизированного препарата будет особенно полезным при применении для сравнительных целей.
Пример 4 - Рабочий пример
В настоящее время цитогенетические способы опираются на точки естественного разрыва хромосом при дизайне зондов, которые фланкируют эти участки. Например, для обнаружения специфичной для лейкемии транслокации, такой как транслокация между хромосомой 9 и 22, конструируют зонды для обнаружения точек разрыва на хромосоме 9 в сегменте 9q34 (ген abl) и сегменте 22qII.2 (ген bсr). При использовании двух цветов, красного для 22 и зеленого для 9, нормальная интерфазная реакция имеет вид как два красных пятна и два зеленых пятна, тогда как транслокация приводит к появлению одного зеленого, одного красного и одного желтого, обусловленного слиянием красного и зеленого. Например, при использовании настоящего изобретения та же транслокация будет проявляться как замещение хромосомы 9 в двух сегментах и хромосомы 22 в двух сегментах. Получающийся рисунок окрашивания сегментов в лунке с хромосомой 9 на соответствующей пластинке будет: начиная от теломеры короткого плеча, голубой, красновато-коричневый, черный, фиолетовый, непрерывный участок светло-голубого и красный в отдалении от этого участка, то есть замещение красного, что указывает на разрыв между светло-голубым и красным, на участке, где располагается ген abl на хромосоме 9. Неразделенная цветовая последовательность в той же лунке представляет собой нормальную хромосому 9. Аналогично, рисунок окрашивания сегментов хромосомы 22 будет представляться красным, отделенным от фиолетового, где непрерывный участок темно-синего будет указывать на разрыв между красным и фиолетовым. Ген bcr на хромосоме 22 находится между двумя цветными сегментами: красным и фиолетовым. Снова, неразделенный рисунок окрашивания из красного, фиолетового и темно-синего показывает нормальную хромосому 22. Поскольку центромера хромосомы 22 перекрестно гибридизуется с хромосомой 14, будут присутствовать два дополнительных отдельных красных сигнала. Гибридизационные лунки для хромосомы 14 будут также иметь 2 дополнительные красные или голубые точки. Если это представляет собой единственное генетическое изменение в образце, при прочтении препаратов интерфазных хромосом все лунки, содержащие хромосому 22, будут иметь описанные выше характеристики, лунка, содержащая хромосому 9, будет иметь описанные выше цветовые характеристики, а все остальные хромосомы будут иметь два участка непрерывного окрашивания сегментов. В зависимости от пола пациента, либо XX, либо XY, рисунок окрашивания хромосом прочитывался бы в лунке, содержащей зонды для Х и Y хромосом. Как можно увидеть из этого примера, предварительное знание о статусе заболевания не является необходимым для применения способа ICP.
В применении согласно аспектам настоящего изобретения при простой транслокации, подобной приведенному выше примеру траслокации 9:22, подтверждение транслокации может быть получено средствами визуального анализа. Окрашивание каждого из индивидуальных цветных сегментов, включая промежуточные черные второстепенные сегменты, для всех хромосом человека в геноме может быть доступно в наборе в красный или синий цвет. Как указано ранее, для дополнительных и/или подтверждающих тестов, можно специально оставить пустые области или лунки в гибридизационной камере. Таким образом, при выборе одного из нецентромерного или нетеломерного сегмента по любую сторону от разрыва на хромосоме 9 и хромосоме 22 и введении их в гибридизационную камеру, любая клетка на стадии интерфазы, несущая траснлокацию, имела бы порядок окрашивания красный, красный, синий, синий. Наложение красного и синего цветов указывало бы на транслокацию. Клетки, не содержащие транслокацию в этой цветовой схеме, имели бы порядок окрашивания красный, красный, синий, синий. Поскольку цетромеры не окрашены, перекрестная гибридизация для хромосомы 22 отсутствует.
Например, эту цветовую схему можно применять для проверки практически любой простой транслокации, независимо от того, какой сегмент хромосомы вовлечен. Даже сложная транслокация, включающая более двух хромосом, может быть определена и диагностирована систематическими дополнительными гибридизациями с применением вышеописанного способа.
Пример 5 - Идентификация маркерных хромосом
По определению маркерных хромосом, данному в клинической цитогенетике, выявляющей их при помощи методики стандартного G-окрашивания, происхождение центромер и дополнительного материала на такой хромосоме невозможно идентифицировать. Тем не менее такие маркерные хромосомы играют важную роль в возникновении заболевания и/или его развитии. Применяя 24-цветные методики FISH на метафазных хромосомах, можно в целом идентифицировать природу маркерных хромосом. Однако их идентификация в интерфазном ядре затруднена и с применением современных методик не может быть выполнена.
Пример маркерной хромосомы описывают следующим образом: имеет центромеру хромосомы 3; все короткое плечо хромосомы 3; два сегмента из длинного плеча хромосомы 7; и теломеру длинного плеча из хромосомы 10. Такая хромосома представляет собой очень сложный маркер и в цитогенетике рака, особенно цитогенетике солидных опухолей, этот тип встречается регулярно.
При применении способов по настоящему изобретению в модели ICP гибридизацию завершают, применяя технологию на трех пластинках, при этом результаты будут следующими: пластинка 1 - не содержит изменений (т.е. норма); пластинка 2, 1-2, 4-6, 8-9 не содержат изменений (т.е. норма); пластинка 3 - не содержит изменений (т.е. норма). На пластинке 2 в гибридизационной лунке для хромосомы 3 был бы выявлен аномальный профиль окрашивания сегментов. В дополнение к двум нормальным смежным цветным сегментам, вероятно, будут присутствовать дополнительные сегменты центромеры и короткого плеча. Аналогично, в лунке для хромосомы 7 в дополнение к двум смежным цветным сегментам будут присутствовать два дополнительных соседних цветных сегмента. Наконец, в лунке для хромосомы 10 в зависимости от того, сбалансирован или нет состав теломеры длинного плеча хромосомы 10, можно наблюдать либо два смежных цветных сегмента и отдельный дополнительный сегмент теломеры, либо один непрерывный участок цветных сегментов и замещение сегмента теломеры из второй цветовой последовательности сегментов. На Фиг.6 изображена маркерная хромосома в трех различных интерфазных клетках.
Согласно аспектам настоящего изобретения, в модели IСР маркерные хромосомы можно «реконструировать». Взяв центральный фрагмент из хромосомы 3 и ацентрические фрагменты из 7 и 10 и гибридизуя все вместе в интерфазной клетке, можно подтвердить, сформирован ли «предполагаемый» маркер из всех этих фрагментов. Если обнаружена непрерывная цветовая последовательность сегментов, то, вероятно, результат положительный. Кроме того, соответствующие сегменты на нормальных хромосомах 3, 7 и 10 будут также, вероятно, выделенными, подтверждая тем самым природу маркерной хромосомы. На Фиг.7 изображен «реконструированный маркер» с остальными цветными сегментами, как было описано.
|
В таблице А представлены комбинации акроцентрических хромосом на пластинке 1 согласно аспектам настоящего изобретения. В зависимости от того, была ли введена хромосома первой или второй, центромера будет иметь красный или голубой цвет с остальной цветовой последовательностью согласно представлению на идеограммах. Цветовая последовательность слева от хромосомы на идеограмме представляет первую, а последовательность справа представляет собой вторую в комбинации. Для хромосом 13 и 22 представлен только один цвет, потому что их всегда вводят только или как первую, или как вторую.
Поскольку центромеры хромосом 13 и 21 могут перекрестно гибридизоваться в лунке #3, все центромеры будут фиолетовыми (красный+голубой). Это справедливо вне зависимости от того, имеет ли место транслокация между этими двумя хромосомами. При наличии транслокации, в сбалансированном состоянии будет на одну центромеру меньше (то есть 3 вместо 4) в интерфазных клетках, находящихся в этой лунке, тогда как в несбалансированном состоянии останется 4 центромеры. То же общее правило применимо также для хромосом 14 и 22. Поэтому интерфазные клетки в лунке #7 будут себя вести сходно с хромосомами 13 и 21. Как в сбалансированном, так и в несбалансированном состоянии, вероятно, будет более длинный непрерывный участок цветов из обеих хромосом без центромеры, что указывает на наличие Робертсоновской транслокации. Во всех лунках, кроме #3 и #7, вероятно, будут присутствовать 2 или более дополнительных сегмента центромер, представляющие перекрестную гибридизацию. Этот подход обеспечивает множество возможностей для совместного рассмотрения генетических аномалий.
Пример 7 - Методика клеточных измерений
Согласно аспектам настоящего изобретения, ICP подходит для исследования всех типов образцов, таких как, например, периферическая кровь, вытяжка из костного мозга, амниотическая жидкость, ворсины хориона, плевральная жидкость, биопсия лимфатического узла, масса солидной опухоли, продукты оплодотворения и др. Из этих типов образцов только «жидкие» образцы, такие как кровь, костный мозг, амниотическая жидкость и плевральная жидкость, содержат единичные клетки. Остальные образцы являются тканями, содержащими агрегаты клеток, связанных друг с другом. Для выполнения ICP, необходимы единичные интерфазные клетки. Таким образом, согласно другому аспекту настоящего изобретения, может быть разработан способ для добавления или нанесения 25-30 клеток в каждую лунку на пластинках гибридизационной камеры.
Существующие методики, с применением ферментов, например, коллагеназы и трипсина, которые могут диссоциировать твердые ткани на суспензии единичных клеток. Как обсуждалось выше, жидкие образцы в основном не требуют такого типа обработки для получения единичных клеток. При получении суспензии единичных клеток из образца любого типа, концентрацию клеток доводят до значения, чтобы каждая «капля» из пипетки содержала 25-30 клеток. Например, если мл образца содержит 1000 клеток, и каждый мл содержит 10 капель, то тогда каждая капля содержит 100 клеток. Поскольку каждая лунка получит только одну каплю для IСР, образец соответствующим образом разводят, в этом случае, в 3,5-4 раза так, чтобы каждая капля содержала требуемое количество клеток. Если исходный объем был 10 клеток на каждую каплю, то образец концентрируют в 2,5-3 раза центрифугированием и удалением излишнего объема так, чтобы каждая капля содержала требуемое количество клеток.
Эта методика обеспечивает то, что даже "аномальные" образцы, образцы, имеющие малый объем, можно анализировать полностью настоящим изобретением, тогда как другие методы в уровне техники могут не давать полную информацию о кариотипе.
Пример 8 - Применение гипотонической обработки
В большинстве современных методик FISH применяют мазки, полученные из образца без гипотонической обработки. Открытие значения гипотонической обработки, например, растворов KCl и цитрата Na, дало начало современной цитогенетике. Надлежащее «набухание» метафазных клеток обеспечивает разделение метафазных хромосом при помещении содержащей их капли на пластинку. Аналогично, правильное разделение интерфазных хромосом важно для успешного формирования рисунка чередующихся многоцветных сегментов. Проводя эксперименты с различными гипотоническими растворами в различной концентрации, как в отдельности, так и в комбинации, можно добиться соответствующего «набухания» интерфазных клеток, перед их фиксацией в гибридизационной лунке на пластинке.
Пример 9 - Методика ICP
Получение ДНК-зондов, специфичных для человека:
1) Для каждой хромосомы участок гибридизации ДНК-зонда изображен на стандартных идеограммах G-окрашивания. Как было описано ранее, хромосома 1 может иметь 19 ДНК-зондов: 1 в области перицентромеры, 4 цветных для короткого плеча + 5 черных для короткого плеча + 1 в области теломеры короткого плеча, 3 цветных для длинного плеча + 4 черных для длинного плеча + 1 в области теломеры длинного плеча.
2) Можно осуществить микродиссекцию или выделение каждого сегмента хромосомы с применением других способов, известных в данной области для препарирования стандартных G-окрашенных метафазных хромосом.
3) Каждый «препарированный» сегмент хромосомы можно амплифицировать при помощи методики ПЦР с вырожденными праймерами (DOP-PCR), описанной Telenius (1992).
4) Повторяющиеся последовательности можно удалить из пробы, применяя меченную биотином Cot-1 ДНК, которая затем удаляется магнитными шариками, конъюгированными с авидином, как описано Craig (1997).
5) Освобожденные от повторяющихся последовательностей зонды, полученные в первом цикле ПЦР с вырожденными праймерами (DOP-PCR), можно подвергнуть последующим раундам амплификации с применением методологии, описанной Liehr (2002).
6) С применением стандартной процедуры обработки ультразвуком можно получить зонды длиной приблизительно 200 н.п. - 600 н.п. Кроме того, можно получить меньшие по размеру фрагменты с применением стандартных способов, например при помощи набора Vector labs Nickit.
7) Фрагменты ДНК можно пометить меткой, такой как, например, ДНФ (DNP), биотин, флуоресцеин или т.п., с применением стандартной методики или технологии мечения, например при помощи набора Vector Labs FastTag.
8) Метку выбирают согласно выбранной заранее методологии.
9) При помощи способа FastTag, например, можно присоединять метки к многочисленным сайтам по всей нити ДНК для достижения более высокой чувствительности в сайте гибридизации.
10) Полученные из 24 хромосом человека ДНК-зонды готовы теперь для in situ гибридизации с интерфазными клетками, находящимися в пластинках гибридизационных камер.
11) Можно создать самим центромерные и теломерные ДНК-зонды или применять коммерчески доступные зонды. Можно получить зонды, предназначенные для ICP, без необходимости мечения, и, как описано выше, необходимую метку можно ввести в ДНК.
In situ гибридизация:
1) Суспензию отдельных клеток можно поместить в каждую лунку пластинок трехгибридизационных камер. Суспензию обрабатывают гипотоническим раствором и фиксируют раствором, содержащим метанол и уксусную кислоту в соотношении 3:1.
2) Интерфазные клетки в каждой лунке можно прогибридизовать с одним набором ДНК-зондов, специфичных для данной лунки, с применением стандартных способов in situ гибридизации, таких, как с предварительной ферментативной обработкой, обеспечивающей проникновение ДНК-зондов через ядерную мембрану, при этом осуществляют денатурацию ДНК для разделения цепей ДНК.
3) Гибридизацию можно проводить в течение ночи.
4) Для удаления остаточных непрогибридизовавшихся зондов с пластинок, после гибридизации можно проводить отмывки препаратов.
Колориметрическая детекция гибридизации ДНК (CISH):
1) Биотиновые метки можно обнаружить при помощи фермента глюкозоксидазы, конъюгированного с авидином D, после реакции с субстратом TNBT, специфичным для глюкозоксидазы. В результате этого может образоваться черный осадок в сайте гибридизации ДНК (то есть, в центромерных и перицентромерных сегментах, а также в промежуточных участках коротких и длинных плеч всех хромосом).
2) Флуоресцеиновую метку можно обнаружить при помощи антител к флуоресцеину, конъюгированных с ферментом пероксидазой, после реакции с субстратом, таким как, например, NovaRed, специфичным для пероксидазы. В результате этого образуется красный осадок в сайте гибридизации ДНК, т.е. в теломерах длинных плеч и в других сегментах хромосомы, на всех хромосомах.
3) Метку ДНФ (DNP) можно обнаружить при помощи анител к ДНФ, конъюгированных с ферментом щелочной фосфатазой, при реакции с субстатом, таким как, например, «vector blue», специфичным для щелочной фосфатазы. Это приводит к образованию синего осадка в сайте гибридизации ДНК, т.е., в теломерах коротких плеч и в других сегментах хромосомы, на всех хромосомах.
4) Эти три реакции выполняют последовательно, чередуя с необходимыми стадиями блокирования и отмывки. Коммерческие субстраты следует применять в соответствии с протоколом изготовителя.
5) Последовательность может быть следующей: детекция биотина, флуоресцеина и ДНФ.
6) В качестве альтернативы, можно проводить все три реакции одновременно, поскольку применяются различные ферменты и субстраты специфичны для этих соответствующих ферментов.
7) Как описано выше, центромеры акроцентрических хромосом можно окрасить в цвета, такие как, например, синий или красный, отличные от черного. То же можно проделать с определенными сегментами в хромосоме 10, 12 и Y, а также с сегментами длинных плеч акроцентрических хромосом для обеспечения соответствующей идентификации всех хромосомных перестроек.
8) Пластинки можно дополнительно окрасить для улучшения контраста специальным красителем, например, метиловым зеленым (Vector Labs), и заключали в гистологическую среду, такую как, например, «permount» (Vector Labs). Метиловый зеленый можно применять, поскольку он обеспечивает исключительный контраст с тремя основными цветами: черным, синим и красным.
9) На основании заданного соотношения цветов в различных сегментах вдоль длины отдельных хромосом смешение двух цветов (две ферментативные реакции) приводит к образованию нового детектируемого цвета. Пример цветовой схемы для всех сегментов всех хромосом человека представлен на Фиг.1.
Микроскопический анализ:
1) При проявлении цвета в отдельных сегментах хромосом, интерфазные хромосомы можно наблюдать с применением простого стандартного светового микроскопа без дополнительных вспомогательных средств. В качестве средства визуализации можно применять CCD камеры, однако, они не являются необходимыми.
2) Начиная с пластинки 1 можно зарегистрировать цветной рисунок каждой интерфазной клетки. На основании ожидаемого в норме цветного рисунка, представленного на идеограммах, можно определить нормальный или аномальный статус соответствующих акроцентрическимх хромосом. Как правило, можно проанализировать 20 клеток на стадии интерфазы в каждой лунке.
3) После повторения такого же анализа для оставшихся хромосом на пластинках 2 и 3, т.е. регистрирования нормального и аномального статуса каждой хромосомы с применением 20 интерфазных клеток, можно объединить результаты с получением полной информации о кариотипе индивида, прошедшего тестирование.
4) При предписании дополнительного анализа, например, при подозрении на наличие мозаицизма - нормальных и аномальных клеток, для анализа простых или сложных транслокаций, маркерных хромосом или т.п., для подтверждающих экспериментов можно применять пустые лунки, например, на пластинке #3. При необходимости в зависимости от целей подтверждающего эксперимента можно применять целую дополнительную пластинку.
5) Характер исчерченности любой хромосомы можно документально зафиксировать путем простого фотографирования на цифровую камеру.
6) Простую мозаичность можно легко обнаружить микроскопическим анализом. Даже сложная, явно родственная клональная мозаичность может быть выявлена. Следующий пример иллюстрирует процедуру выявления согласно аспектам настоящего изобретения.
Пример 10 - Анализ кариотипа
В качестве примера анализировали кариотип со следующими результатами: +8/t(9; 22)/t(9; 22), +8/норма.
В случае хронической гранулоцитарной лейкемии имеется 2 клональных отклонения: t(9; 22), как обсуждалось выше, характерное изменение для этой болезни. Трисомия 8 (+8) означает развитие заболевания в сложной форме. Однако трисомия 8 может существовать одна как «неродственный» клон. Таким образом, клинически очень важно установить имеет ли один и тот же клон как t(9; 22), так и +8.
Например, при первой реакции ICP было 10 клеток с t(9; 22); 5 клеток с+8, 15 клеток, нормальных по хромосоме 8, и 10 клеток, нормальных по хромосомам 9 и 22. Как уже упоминалось, выявление транслокации можно осуществить посредством «красного-синего» эксперимента, где наложение красного и синего указывает на транслокацию, а их отдельное расположение указывает на отсутствие транслокации. При объединении этого результата с результатом окрашивания центромеры хромосомы 8 (черный) результаты, вероятно, будут следующими: возможно, было 5 клеток с t(9; 22); 5 клеток с t(9; 22) и +8; 10 клеток нормальных по хромосомам 8, 9 и 22. Эти результаты четко показывают, что +8 является частью развития заболевания, а не несвязанным событием. Если бы +8 представляло собой несвязанное событие, то не наблюдалось бы клеток с объединенным результатом.
На Фиг.14 проиллюстрирована гибридизационная пластинка, согласно аспектам настоящего изобретения, и обозначена ссылкой под номером 10. Пластинка 10 может содержать тело 20, множество лунок 22 и зону идентификационной отметки 24. Тело 20 может быть выполненным из стекла или любого другого прозрачного материала, подходящего для выполнения на нем гибридизации, указанные лунки 22 могут включать зоны с тиснением для разделения лунок 22. Лунки 22 могут также быть выполненными в виде выточенных углублений, отлитых углублений или т.п. для приема и гибридизации образца. Зона идентификационной отметки 24 может быть выполнена в виде прозрачной или матовой зоны для проставления отметки или другого способа идентификации.
Следующие таблицы обеспечивают краткую сводку для пользователя для сравнения результатов, полученных при применении способов, раскрытых здесь, со способами, в которых использован золотой стандарт G-окрашивания.
Таблицы, представленные ниже, иллюстрируют профиль исчерченности интерфазных хромосом (IPC) по сравнению со стандартными способами G-окрашивания. Для облегчения введены следующие сокращения: Q = длинное плечо; Р = короткое плечо; р = проксимальный по отношению к центромере; q = дистальный по отношению к центромере; Теr = Теломера; mа = основной сегмент; и mi = второстепенный сегмент.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ввиду того, что предшествующее описание представлено авторами изобретения в наилучшей форме для применения изобретения на практике и помогает специалистам в соответствующей области в осуществлении данного изобретения, ясно, что способы, включающие модификации и варианты, очевидны для специалистов в данной области. По существу, оно не ограничено данным описанием, но включает вышеупомянутые очевидные варианты, и ограничено только объемом следующей формулы.