Результат интеллектуальной деятельности: Штамм Komagataella phaffii T07/pPZL-4x-OA-xyl-AsOr, обладающий способностью продуцировать ксиланазу из грибов вида Aspergillus oryzae
Вид РИД
Изобретение
Изобретение относится к микробиологии и биотехнологии и может быть использовано в химической, пищевой, ферментационной, фармацевтической промышленности.
Ферменты применяются в различных областях, таких как производство продуктов питания, корма для животных, моющие средства, косметика, пивоварение и текстильная промышленность, бумажная промышленность, фармацевтика, а также в качестве инструментов для научных исследований и разработок.
Ксиланазы относятся к группе разнообразных ферментов, которые гидролизуют основную гемицеллюлозу клеточной стенки растительных клеток - ксиланы [1]. Ксиланы являются одной из основных составляющих лигноцеллюлозной биомассы. Механизм действия ксиланаз заключается в случайном расщеплении β-1,4-связанных D-ксилопиранозных единиц, составляющих углеродный скелет гомополимерной структуры ксиланов. В настоящее время ксиланазы объединяют в семейства гликозил-гидролаз (GH) 5, 7, 8, 10, 11, 26, 30 и 43, при этом наиболее хорошо изученными на данный момент являются механизмы действий ксиланаз, относящихся к 10 и 11 семействам [2].
Гемицеллюлазы, такие как ксиланазы, являются наиболее важной группой ферментов, имеющей широкое применение в промышленном производстве, в том числе в биоконверсии лигниноцеллюлозы в биотопливо, SCP (single-cell protein англ. микробные белки), биоотбеливание, тканевая промышленность, осветление соков, очищение сточных вод и очистка от чернил [3]. Применение ксиланаз в вышеперечисленных областях промышленности снижает использование опасных химических веществ и тем самым снижает токсичную нагрузку на окружающую среду [4].
Однако стоит отметить, что крупномасштабное получение ксиланазы грибов при наработке в непосредственных хозяевах затруднено из-за низкой скорости генерации и проблем аэрации в вязкой среде [5].
Актуальной задачей на сегодняшний день является получение рекомбинантных продуцентов, имеющих большую эффективность продукции белка в сравнении с продуцентами, полученными из природных организмов.
Было показано, что ксиланазы грибов обладают более высокой активностью по сравнению с бактериальными, однако большинство этих ксиланаз эффективны при температуре ниже 50°С и в диапазоне рН 4-6 [6]. Так, для эндо-1,4-β-ксиланазы Aspergillus oryzae было показано, что оптимум рН составляет 5,0 в то время как оптимум температуры - 60°С [7]. Экспрессия ксиланазы Aoxyn10 происходила во внеклеточное пространство с наибольшей активностью фермента 45,0 ЕД/мл с оптимумом рН 5,5 и температурным оптимумом 60°С, однако она оставалась стабильной при спектре рН от 4,0 до 7,0 и при температурах ниже 50°С [8]. Известно, что ксиланаза XynFl из Aspergillus oryzae LCl была клонирована в экспрессирующую систему Е. coli BL21(DE3), которая показала специфическую активность 1037,3 МЕ/мг, что составило в 9,3 более высокий уровень экспресии, чем в нативиом организме. Было показано, что рекомбинантная ксиланаза XynFl с молекулярным весом 37 кДа обладает активностью в спектре рН от 3,0 до 10,0 и при температурах от 30 до 70°С, при этом оптимумы рН и температуры составляли 5,0 и 30°С, соответственно [9].
Известен рекомбинантный штамм дрожжей Penicillium canescens, продуцирующий неингибируемую эндо-1,4-β-ксиланазу Е. Известна конструкция, содержащая целевую кодирующую последовательность, включающую последовательно соединенные ген eglII, кодирующий высокоактивную эндо-1,4β-глюканазу II, и ген xyIE Penicillium canescens, кодирующий неингибируемую эндо-1,4-(3-ксиланазу Е. Изобретение также относится к рекомбинантным штаммам Penicillium verruculosum ЕХ13, ВКМ F-4765D, и Penicillium verruculosum ЕХ35, ВКМ F-4766D. Указанные штаммы предназначены для продукции гомологичной высокоактивной эндо-1,4-β-глюканазы II и неингибируемой эндо-1,4-β- ксиланазы Е Penicillium canescens [10].
Известен рекомбинантный штамм дрожжей Pichia pastoris -продуцент ксиланазы из Paenibacillus brasilensis. Изобретение относится к микробиологии и биотехнологии. Предложен рекомбинантный штамм дрожжей Pichia pastoris ВКПМ Y-4393, продуцирующий ксиланазу. Указанный штамм содержит ген xyl, кодирующий эндо-1,4-β-ксиланазу из Paenibacillus brasilensis. Штамм продуцирует фермент в количестве 1114 ед./мл культуральной жидкости [11].
Известен штамм дрожжей Pichia pastoris, продуцирующий ксиланазу из Streptomyces sp.FAl. Изобретение относится к штамму-продуценту ксиланазы и его применению и относится к области генной инженерии. Ксиланазу по изобретению получают путем клонирования гена ксиланазы (xyn A) Streptomyces sp.FAl и экспрессии в P. pastoris. PPICZ альфа или pPIC9k используется для конструирования вектора экспрессии и преобразования P. pastoris, сначала реализуется высокоэффективная экспрессия ксиланазы, полученной из Streptomyces sp.FAl, в P. pastoris, ферментация в 3-литровом ферментационном резервуаре длится 140 часов, а общее содержание белка в ферментированной надосадочной жидкости может достигать 6,5 г/мл, что представляет собой самый высокий уровень экспрессии ксиланазы, полученной из десятого семейства Streptomyces sp., в Pichia pastoris. Рекомбинантная ксиланаза используется для улучшения качества булочек на пару и дает отличный эффект [12].
Известен штамм дрожжей Pichia pastoris, продуцирующий ксиланазу из Aspergillus sulphureus. Ген xynB из Aspergillus sulphureus, кодирующий эндо-β-1,4-ксиланазу, был синтезирован de novo с помощью сплайсинга полимеразной цепной реакции удлинения перекрытия в соответствии со смещением кодонов белка Pichia pastoris. Синтетическая ДНК и ДНК дикого типа помещались под контроль промотора гена глицеральдегид-3-фосфатдегидрогеназы (GAP) в плазмиде вектора конститутивной экспрессии pGAPzαA и электротрансформировались в штамм P. pastoris X-33 соответственно. Трансформанты, скринированные с помощью зеоцина, были способны конститутивно секретировать ксиланазу в жидкой среде YPD. Максимальный выход рекомбинантной ксиланазы, продуцируемой синтетической ДНК, составлял 105 ед/мл, что было примерно в 5 раз выше, чем при использовании ДНК дикого типа при культивировании в колбах при 28°С в течение 3 дней. Фермент проявлял оптимальную активность при 50°С и рН 5,0. Остаточная активность оставалась выше 90% после предварительной обработки рекомбинантной ксиланазы в буфере Na2HPO4-лимонная кислота (рН 2,4) в течение 2 ч. Активность ксиланазы была значительно улучшена Zn2+. Эти биохимические характеристики позволяют предположить, что рекомбинантная ксиланаза имеет перспективное применение в кормовой промышленности в качестве добавки [13].
Наиболее близким заявляемому штамму - прототипом, является штамм Pichia pastoris GS/Xyn4-11, экспрессирующий внеклеточно ксиланазу 10 семейства из A. oryzae. Трансформант, обозначенный как Р. pastoris GS/Xyn4-11l, проявляет самую высокую активность рекомбинантного AoXyn10 (названного reAoXyn10), составляющую 45,0 ед/мл. Очищенный reAoXyn10 проявлял максимальную активность при рН 5,5 и 60°С. Он был стабилен в диапазоне рН 4,0-7,0 при 50°С и ниже. Его деятельность не подвергается воздействию множества ионов металлов или ЭДТА, но ингибируется Mn2+и Ва2+. Км и Vmax reAoXyn10 составляли 1,7 мг/мл и 817 мкмоль/мин/мг соответственно [14].
Недостатком этого штамма является то, что продуцируемый им фермент стабилен в узком диапазоне рН, не стабилен при температуре выше 50°С.
Задачей изобретения является получение штамма - продуцента ксиланазы из грибов вида Aspergillus oryzae (xAOr-Fl) на основе штамма-реципиента Komagataella phaffii Т07 4x-OA-xyl-AsOr, устойчивого к температурным и рН условиям.
Технический результат: расширение ассортимента штаммов-продуцентов ксиланазы, повышение устойчивости к температурным и рН условиям, упрощение условий культивирования штамма.
Поставленная задача достигается получением штамма Komagataella phaffii T07/pPZL-4x-OA-xyl-AsOr, способного продуцировать ксиланазу из из грибов вида Aspergillus oryzae (xAOr-Fl). Ксиланаза xAOr-Fl обладает способностью проявлять активность при рН от 3,0 до 9,0, а также при 2,5 и 10,0, при этом фермент является термоустойчивым, проявляя высокую активность также при 85°С.
Штамм дрожжей Komagatella phaffii Т07 4x-OA-xyl-AsOr получен в результате генно-инженерной модификации штамма дрожжей Komagatella phaffii Т07.
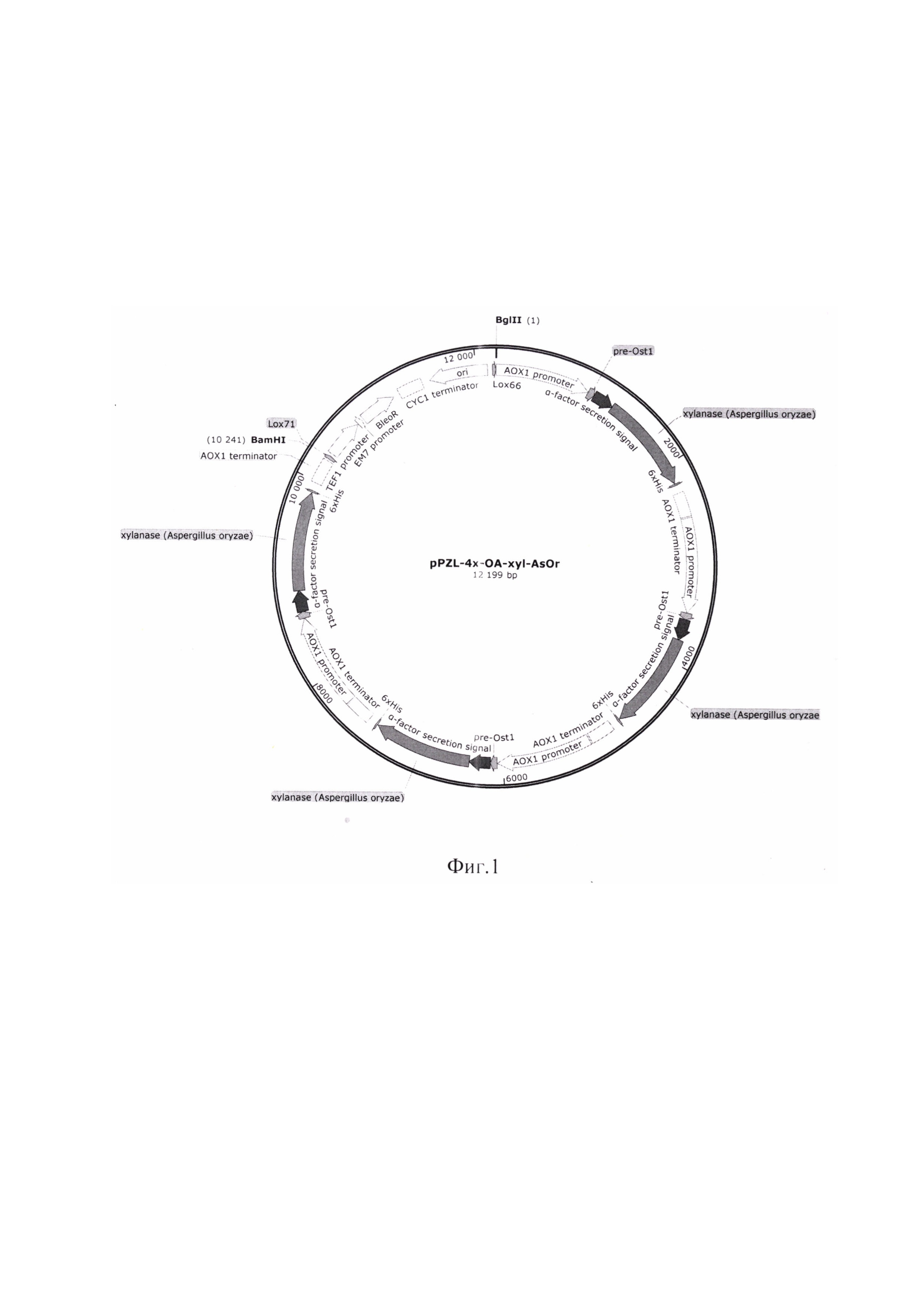
Генно-инженерными методами получают плазмиду pPZL-4x-OA-xyl-AsOr, несущую ген, имеющий размер 981 п. н., с нуклеотидной последовательностью SEQ ID NO 1, кодирующий ксиланазу xAOr-Fl с SEQ ID NO 2, слитую с гибридной сигнальной последовательностью альфа-фактора Saccharomyces cerevisiae с препептидом Ostl S. cerevisiae, под контролем промотора гена алкоголь оксидазы АОХ1 дрожжей вида Komagataella phaffii.
Исходным генетическим материалом для конструирования рекомбинантной плазмиды pPZL-4x-OA-xyl-AsOr являются:
- плазмида pPICZ(alpha)-A (Invitrogen),
- искусственно синтезированный ген ксиланазы xAOr-Fl,
- сайты рекомбинации lox66 и lox71 в составе олигонуклеотидов.
Полученная плазмида pPZL-4x-OA-xyl-AsOr характеризуется следующими признаками:
- имеет размер 12199 п. н.;
- содержит 4 копии искусственного гена xAOr-Fl под контролем промотора и терминатора гена AOXl;
- состоит из следующих элементов:
BleoR - ген, кодирующий белковую последовательность, обеспечивающую устойчивость клетки к блеомицину, флеомицину и зеоцину;
TEF1 promoter - промотор, регулирующий работу гена BleoR в клетках дрожжей;
ЕМ7 promoter - промотор, регулирующий работу гена BleoR в клетках E.coli;
CYCl terminator - терминатор транскрипции из дрожжей S. cerevisiae;
ori - начало репликации плазмидной конструкции;
lox66 и lox71 - сайты рекомбинации системы cre-lox;
xylanase AsOr - ген, кодирующий последовательность ксиланазы xAOr-Fl [15] без первой аминокислоты метионина, и находящийся под контролем промотора гена AOXl K. phaffii;
АОХ1 promoter - промотор гена AOXl K. phaffii;
АОХ1 terminator - терминатор гена AOXl K. phaffii;
α-factor secretion signal - сигнальная последовательность альфа-фактора S. cerevisiae;
pre-Ostl - препептид сигнальной последовательности Ostl S. cerevisiae.
Функциональная карта плазмиды pPZL-4x-OA-xyl-AsOr представлена на фиг.1.
Нуклеотидные последовательности синтетического гена, кодирующего ксиланазу xAOr-Fl (SEQ ID NO 1), а также аминокислотная последовательность самой ксиланазы xAOr-Fl (SEQ ID NO 2) приведены в перечне последовательностей.
Предлагаемый штамм получают трансформацией клеток дрожжей К. phaffii Т07 плазмидой pPZL-4x-OA-xyl-AsOr методом электропорации на электропораторе Gene Pulser Xcell (Bio-Rad). Отбор трансформантов осуществляют на среде Yeast extract-Peptone-Dextrose (YPD) с зеоцином (100 мг/л). Затем отобранные клоны трансформируют плазмидой pSH67 [16], несущей, в частности, ген cre-рекомбиназы и маркер устойчивости к генетицину G418. Выросшие клоны путем пересева проверяют на отсутствие устойчивости к зеоцину и к генетицину.
Продуцируемая заявляемым штаммом ксиланаза xAOr-Fl обладает способностью проявлять активность при рН от 3.0 до 9.0, а также при 2.5 и 10.0, при этом фермент является термоустойчивым, проявляя высокую активность также при 85°С. Оптимум работы фермента составляет 60°С, при 85°С и рН 9.0 фермент сохраняет 40% активности.
Ксиланаза xAOr-Fl обладает более высоким температурным оптимумом по сравнению с прототипом, а также отличается высокой активностью при более высоких температурах (до 85°С) и более высоких значениях рН - до 9.0. Такие параметры работы фермента позволяют применять ферментные препараты на основе ксиланазы xAOr-Fl в технологических процессах, требующих высоких температур (например, экстракция) или щелочных рН (например, моющие средства).
Штамм дрожжей Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr характеризуется следующими признаками.
Культурально-морфологические признаки: клетки округлой формы, 3-4 мкм в диаметре. Клетки почкуются, почкование истинное, многостороннее. На агаризованной среде YPD образуют крупные круглые белые колонии, глянцевые с ровным краем, выпуклой серединой.
Физиолого-биохимические признаки: Штамм способен к росту как в аэробных, так и в анаэробных условиях. Оптимальная температура роста 30°С. Растет в пределах рН среды от 6.0 до 10.0 с оптимумом 7.0. В качестве единственного источника углерода способен использовать метанол, этанол, глюкозу, глицерин.
Штамм не обладает инфекционным и общетоксическим действием.
Штамм является непатогенным и не включен в списки, приведенные в санитарных правилах СП 1.3.2322-08; штамм не несет опасных генетических конструкций.
Штамм идентифицирован на основании анализа последовательности полного генома.
Хранение штамма осуществляют на среде YPD с глицерином при температуре -70°С.
Для культивирования штамма применяют среды YPD, BMGY и др. следующего состава:
Среда YPD (%): пептон - 2, дрожжевой экстракт - 1, глюкоза - 2.
Среда BMGY (%, мас./об.): дрожжевой экстракт - 1, пептон - 2, YNB - 1,34, глицерин - 1. Также - биотин - 0,4 мг/мл, забуференный 1/10 объема 0,1 М калий-фосфатным буфером.
Выход фермента в биореакторе составляет 258240 МЕ/мл для культуральной жидкости. Было показано, что ксиланаза xAOr-Fl может проявлять активность при рН от 3,0 до 9,0, а также обладает способностью проявлять активность при 2,5 и 10,0, при этом ферментный препарат является термоустойчивым, проявляя высокую активность также при 85°С. Активность фермента, термо- и рН-стабильность, температурный оптимум и оптимум рН доказаны экспериментальными методами.
Активность фермента определялась согласно ГОСТ 31488-2012 «Препараты ферментные. Методы определения ферментативной активности ксиланазы» с использованием в качестве субстрата ксилана из овса с массовой долей 1% [17].
Предлагаемый штамм дрожжей Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr - продуцент ксиланазы xAOr-Fl, имеет ряд преимуществ перед известными штаммами, заключающимися в следующем.
1. Предлагаемый штамм продуцирует высоко активную ксиланазу из гриба Aspergillus oryzae - xAOr-Fl, пригодную к использованию в химической, пищевой, ферментационной, фармацевтической промышленности.
2. Штамм дрожжей Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr продуцирует ксиланазу xAOr-Fl, способную проявлять активность в широком диапазоне рН: от 3,0 до 9,0, а также при 2,5 и 10,0, что позволяет применять данный штамм и фермент в различных областях, а также в качестве инструментов для научных исследований и разработок.
3. Штамм дрожжей Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr продуцирует термостабильную ксиланазу xAOr-Fl, способную проявлять высокую активность также при 85°С, что позволяет использовать данный штамм в производстве.
4. Штамм дрожжей Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr в условиях биореактора нарабатывает в культуральной жидкости 258240 МЕ/мл фермента.
Поскольку предлагаемый штамм получен впервые и фермент, выделенный из него, характеризуется уникальным комплексом свойств, можно сделать вывод о соответствии предлагаемого штамма критериям изобретения «новизна» и «изобретательский уровень».
Изобретение иллюстрируется примерами конкретного выполнения.
Пример 1. Получение плазмиды pPZL-4x-OA-xyl-AsOr и штамма Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr
Для получения экспрессирующей конструкции использовали модифицированную плазмиду, полученную из плазмиды pPICZ(alpha)-A (Invitrogen). В исходной плазмиде область препептида сигнальной последовательности альфа-фактора S. cerevisiae заменили на препептид сигнальной последовательности Ostl S. cerevisiae, а также добавили сайты рекомбинации lox66 и lox71, фланкирующие экспрессионную кассету. Затем искусственно синтезированную последовательность гена xAOr-Fl слили методом Гибсона с вышеупомянутой сигнальной последовательностью для секреции продукта в культуральную жидкость. При этом после отрезания сигнального пептида в просвете ЭПР на N-конце белка оказываются 4 аминокислоты (Glu-Ala-Glu-Ala), отсутствующие в природном белке (и отсутствует первый остаток метионина природного белка).
Затем рестриктазно-лигазным методом экспрессионную кассету мультиплицировали до 4 тандемных копий. Полученной плазмидой pPZL-4x-OA-xyl-AsOr трансформировали дрожжи штамма Komagatella phaffii Т07.
После отбора клонов, выделяющих в культуральную жидкость активную ксиланазу, из них удалили ген устойчивости к антибиотику, необходимый для селекции на первых этапах. Ген удаляли с использованием вспомогательной плазмиды pSH67, кодирующей рекомбиназу Cre.
Пример 2. Культивирование штамма Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr и выделение ксиланазы xAor-Fl
Культивирование штамма проводилась в биореакторе ProLab (GPC, Франция). Штамм К. phaffii T07/pPZL-4x-OA-xyl-AsOr на агаризованной среде YPD рассевали до отдельных колоний и культивировали в течение 48 часов, а затем инокулировали в 5 мл среды YPD с 200 мкг/мл зеоцина и культивировали в течение ночи при 30°С. Ночную культуру инокулировали в среду в объеме 1:100 со средой YNB и культивировали в шейкере при 30°С и 250 об/мин в течение 48 ч.
Первичную культуру асептически вносили в ферментер, содержащий солевую среду с концентрациями 32,5 г/л глицерина, 9,375 г/л (NH4)2SO4, 1,875 г/л CaSO4⋅2H2O, 0,9375 г/л NaCl, 3,75 г/л MgSO4⋅7H2O, и 3,75 г/л KH2PO4. Ферментер был предварительно стерилизован 45 минут при 121°С.
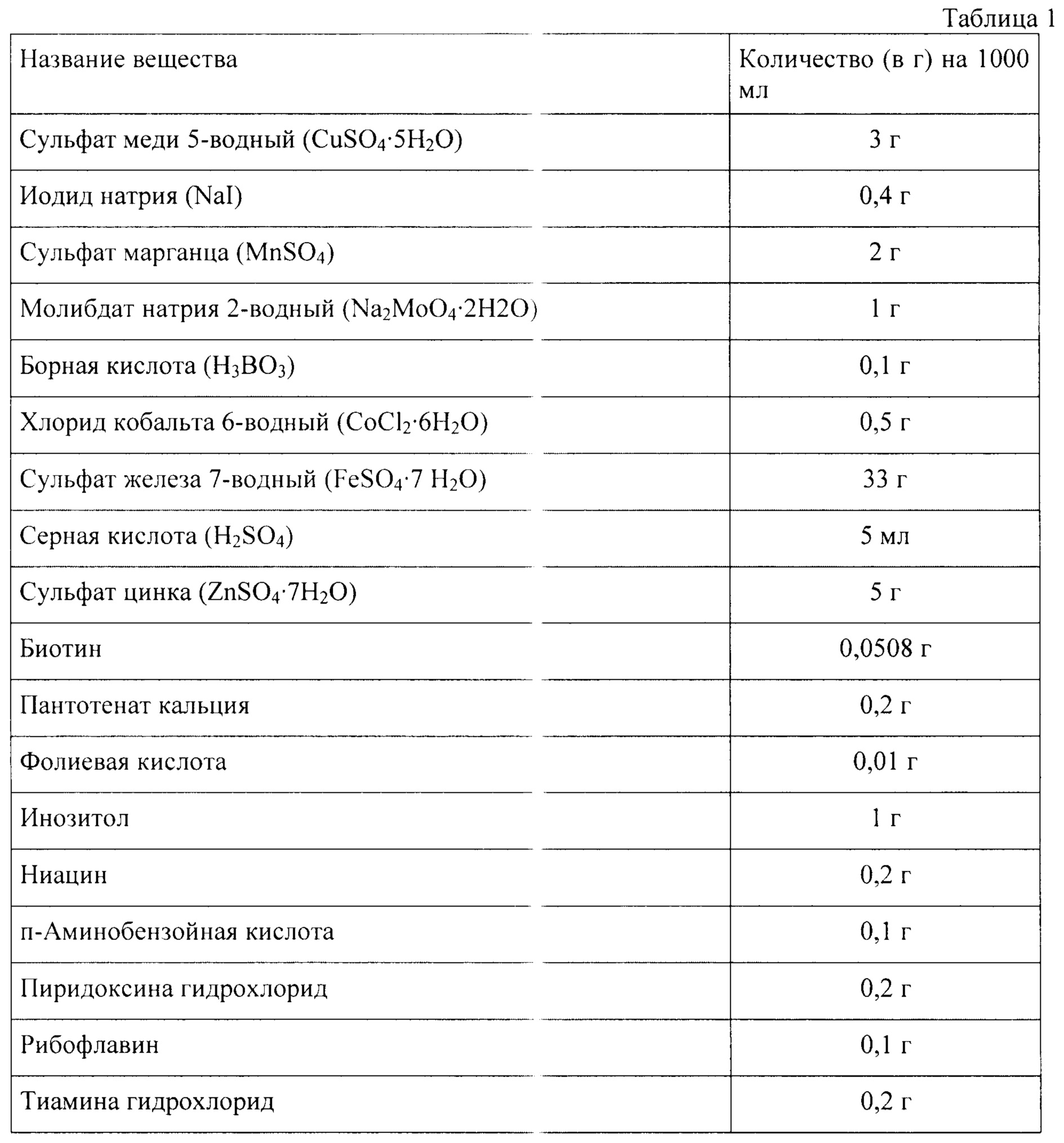
При старте культивирования температура составляла 30°С при постоянном потоке воздуха 3 л/мин и начальной скорости вращения мешалки 400 об/мин. Концентрацию растворенного кислорода поддерживали на уровне >20% при помощи постепенного увеличения скорости перемешивания до 1200 об/мин, а рН среды - 5,8-6,0, используя для корректировки 4М раствор NaOH. Перед инокуляцией в среду добавляли 2,5 мл/л микроэлементов и 2,5 мл/л витаминов (таблица 1).
Выделение ксиланазы xAor-Fl проводили следующим образом. Культуральную жидкость отделяли от клеток и иных взвесей центрифугируем при 4000 об/мин в течение 10 минут, затем супернатант очищали и концентрировали методом тангенциальной ультрафильтрации на оборудовании SartoJet (Sartorius, Германия) с использованием фильтров с порами 10 кДа. Все операции проводили при 4°С.
Концентрат замораживали до -70°С, а затем лиофильно высушивали (Labconco, США). Полупродукт затем растворяли в 10 мМ натрий-фосфатном буфере (рН 7,3), очищали с использованием сефадекс G-25 (Sigma-Aldrich, Германия). Далее, использовали метод ионообменной хроматографии на колонке (V=10 мл) с анионитом DEAE-Sepharose 6HF (Biotoolomics, Великобритания). Колонку промывали 10 мМ натрий-фосфатным буфером (рН 7,5), белок элюировали линейным градиентом NaCl до 0,5 М в стартовом буфере. Фракции, где была обнаружена максимальная ксилолитическая активность, объединяли.
Пример 3. Оценка ферментативной активности штамма Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr
Наличие наработки ксиланазы xAor-Fl проверяли путем инокуляции полученных колоний в 24-луночный планшет с глубокими лунками, при этом каждую колонию инокулировали в отдельную лунку, содержащую по 2 мл YPGM (среда YPD с добавлением метанола) с 0,3% глюкозы и 1% метанола. В качестве отрицательного контроля использовался штамм K. phaffii Т07 без встроенного гена ксиланазы. Планшет помещали в термошейкер при 30° и культивировали клетки на 360 об/мин, причем каждые 24 ч добавляли по 200 мкл 10% метанола в каждую ячейку планшета. На третьи сутки культивирования отобрали аликвоты культуры и осаждали клетки центрифугированием при 4000g в течение 5 минут.
Ферментативную активность проверяли по освобождению красителя, из синтетического субстрата 4-нитрофенил-(3-0-ксилопиранозида. Для определения активности в лунку планшета вносили по 1 объему культуральной жидкости, полученной после культивирования полученных клонов, затем добавляли 4 объема буфера (50 мМ Tris-HCl, 1 mM CaCl2, рН 9,0) и 5 объемов раствора 100 мг 4-нитрофенил-β-D-ксилопиранозида в 10 мл 100 mM PBS. Реакцию осуществляли при 60°С. Ход реакции контролировали при помощи планшетного спектрофотометра Epoch (Biotek, USA). Измерение проводили каждые 10 минут при длине волны 405 нм. В качестве отрицательного контроля использовали супернатант из образца культуры штамма К. phaffii Т07 без встроенного гена протеазы.
Активность ксиланазы xAor-Fl рассчитывали, исходя из калибровки по ксилозе, при этом молярный коэффициент поглощения-составил ε ≈ 0,00045±0,00005 мкМоль-1хсм-1. Было показано, что при рН 7,5 активность фермента составила 258240 МЕ/мл для культуральной жидкости.
Источники информации
1. Vladimir Puchart, Katarina  Peter Biely. Xylanases of glycoside hydrolase family 30 - An overview, Biotechnology Advances, Volume 47, 2021, 107704, ISSN 0734-9750, https://doi.org/10.1016/j.biotechadv.2021.107704.
Peter Biely. Xylanases of glycoside hydrolase family 30 - An overview, Biotechnology Advances, Volume 47, 2021, 107704, ISSN 0734-9750, https://doi.org/10.1016/j.biotechadv.2021.107704.
2. Moreira L.R.S., Filho, E.X.F. Insights into the mechanism of enzymatic hydrolysis of xylan. Appl Microbiol Biotechnol 100, 5205-5214 (2016). https://doi.org/10.1007/s00253-016-7555-z.
3. Bhardwaj N., Verma V.K., Chaturvedi V. et al. GH10 XynFl and XynllA: the predominant xylanase identified in the profiling of extracellular proteome of Aspergillus oryzae LCI. Ann Microbiol 68, 731-742 (2018). https://doi.org/10.1007/sl3213-018-1378-3.
4. Thomas L. et al. Production of an alkaline xylanase from recombinant Kluyveromyces lactis (KYl) by submerged fermentation and its application in bio-bleaching // Biochemical Engineering Journal. - 2015. - Vol.102. - P. 24-30.
5. Mandal A. Review on microbial xylanases and their applications // International Journal of Life Sciences. - 2015. - Vol.4. - №. 3. - P. 178-187.
6. Beg Q.K., Kapoor M., Mahajan L., Hoondal G.S. Microbial xylanases and their industrial applications: a review // Applied Microbiology and Biotechnology, - 2001. - Vol.56. - P. 326-338.
7. Kitamoto N., Yoshino S., Ohmiya K., Tsukagoshi N. Purification and characterization of the overexpressed Aspergillus oryzae xylanase, XynFl. Biosci. Biotechnol. Biochem. 63:1791-1794(1999).
8. Yin X, Gong YY, Wang JQ, Tang CD, Wu MC. Cloning and expression of a family 10 xylanase gene (AoxynlO) from Aspergillus oryzae in Pichia pastoris. J Gen Appl Microbiol. 2013;59(6):405-l5. doi: 10.2323/jgam.59.405. PMID: 24492599.
9. Bhardwaj N., Verma V.K., Chaturvedi V. et al. GH10 XynF1 and XynllA: the predominant xylanase identified in the profiling of extracellular proteome of Aspergillus oryzae LC1. Ann Microbiol 68, 731-742 (2018). https://doi.org/10.1007/sl3213-018-1378-3.
10. Патент RU 2653429 C1, опубл. 08.05.2018.
11. Патент RU 2701308, опубл. 25.09.2019.
12. Патент CN104789486 Al, опубл. 22.07.2015.
13. Li Y. et al. Improvement of Aspergillus sulphureus endo-|3-l, 4-xylanase expression in Pichia pastoris by codon optimization and analysis of the enzymic characterization //Applied biochemistry and biotechnology.- 2010. -T. 160. - №. 5. -C. 1321-1331.
14. Yin X, Gong YY, Wang JQ, Tang CD, Wu MC. Cloning and expression of a family 10 xylanase gene (AoxynlO) from Aspergillus oryzae in Pichia pastoris. J Gen Appl Microbiol. 2013;59(6):405-15. doi: 10.2323/jgam.59.405. PMID: 24492599.
15. https://www.ncbi.nlm.nih.gov/protein/094163.1?report=genbank&l og$=protalign&blast_rank=1&RID=EJ2S9 WF8016.
16. Hegemann J.H. and Heick S.B. (2011). Delete and repeat: a comprehensive toolkit for sequential gene knockout in the budding yeast Saccharomyces cerevisiae. Methods Mol Biol 765, 189-206.
17. Остроумов Л.А., Бабич О.О., Милентьева И.С. Изучение критериев качества и безопасности функциональных продуктов питания, полученных из вторичных продуктов переработки растительного сырья // Современные наукоемкие технологии. -2012. -Т. 12.-№12. -С. 24-27.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Komagataella
phaffii T07 pPZL-4x-OA-xyl-AsOr.xml" softwareName="WIPO Sequence"
softwareVersion="2.1.1" productionDate="2022-08-17">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText></ApplicationNumberText>
<FilingDate></FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>-</ApplicantFileReference>
<ApplicantName languageCode="ru">Федеральное государственное
бюджетное научное учреждение «Федеральный исследовательский центр
Институт цитологии и генетики Сибирского отделения Российской
академии наук» (ИЦиГ СО РАН)</ApplicantName>
<ApplicantNameLatin>Institute of Cytology and Genetics, Siberian
Branch of Russian Academy of Sciences</ApplicantNameLatin>
<InventionTitle languageCode="ru">Штамм Komagataella phaffii
T07/pPZL-4x-OA-xyl-AsOr, обладающий способностью продуцировать
ксиланазу из грибов вида Aspergillus oryzae</InventionTitle>
<SequenceTotalQuantity>2</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>981</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..981</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>genomic DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Aspergillus oryzae</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>atggttcatttaaaagcccttgcttccggtactcttttcgcttctcttg
cttcttccgctgttatttcaagacaagccgctgcctccattaacgacgcctttgtagctcacggaaagaa
atattttggaacctgttctgaccaggcattattgcaaaattcccaaaatgaagctattgtcagagcagac
ttcggtcagctgacacctgaaaattcaatgaaatgggacgcccttgaaccatctcaaggatctttctctt
tcgctggagccgatttcttagctgactatgccaaaaccaacaacaagctggtcagaggacacacattggt
gtggcattcacaattgccatcatgggttcagggtatcactgacaaagatacattaacagaggtcattaag
aatcatatcactactatcatgcagagatataaaggacaaatttatgcatgggatgtggtgaacgaaattt
ttgacgaggatggtaccctgagagattccgtattttcccaggttttgggtgaggattttgttcgtattgc
atttgaaacagctcgtgaagctgaccctaacgcaaaattgtacatcaatgactacaatctggactctgca
gattacgctaagactaagggaatggtctcctatgtcaagaaatggctggatgccggtgttccaatagatg
gtataggatctcaatcacactactctgctaatggatttcctgtatcaggtgcaaagggtgccttgactgc
tcttgcctctactggtgtttccgaggttgctgtaaccgaattggacattgagggtgcttcttccgaatct
tacttagaggtggttaacgcttgccttgatgtgtcttcatgtgtcggaattactgtttggggtgtatctg
ataaggattcctggaggtcatcaacctctccattgttgttcgactccaactatcaagccaaggatgcata
caacgcaatcatagatgctttg</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
<SequenceData sequenceIDNumber="2">
<INSDSeq>
<INSDSeq_length>330</INSDSeq_length>
<INSDSeq_moltype>AA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..330</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>protein</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q4">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>Aspergillus oryzae</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>EAEAVHLKALASGTLFASLASSAVISRQAAASINDAFVAHGKKYFGTCS
DQALLQNSQNEAIVRADFGQLTPENSMKWDALEPSQGSFSFAGADFLADYAKTNNKLVRGHTLVWHSQLP
SWVQGITDKDTLTEVIKNHITTIMQRYKGQIYAWDVVNEIFDEDGTLRDSVFSQVLGEDFVRIAFETARE
ADPNAKLYINDYNLDSADYAKTKGMVSYVKKWLDAGVPIDGIGSQSHYSANGFPVSGAKGALTALASTGV
SEVAVTELDIEGASSESYLEVVNACLDVSSCVGITVWGVSDKDSWRSSTSPLLFDSNYQAKDAYNAIIDA
L</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---
Штамм Komagatella phaffii T07/pPZL-4x-OA-xyl-AsOr, обладающий способностью продуцировать ксиланазу из грибов вида Aspergillus oryzae (xAOr-F1), полученный путем трансформации штамма Komagatella phaffii Т07 плазмидой pPZL-4x-OA-xyl-AsOr, несущей ген, имеющий нуклеотидную последовательность SHQ ID NO 1 и кодирующий ксиланазу xAOr-F1, имеющую аминокислотную последовательность SEQ ID NO 2, слитую с гибридной сигнальной последовательностью альфа-фактора S. cerevisiae с препептидом Ostl S. cerevisiae, под контролем промотора гена алкоголь оксидазы АОХ1 дрожжей вида Komagataella phaffii.