Результат интеллектуальной деятельности: Метод определения ДНКазной активности в режиме реального времени
Вид РИД
Изобретение
Область техники
Изобретение относится к биотехнологии, в частности к молекулярной биологии и медицинской микробиологии и может быть использовано как в научно-исследовательской, так и в практической работе для определения наличия ДНКазной активности в образцах и бактериологической диагностики ряда микроорганизмов.
Уровень техники
ДНКазы - это ферменты, которые расщепляет ДНК по фосфодиэфирным связям на олигонуклеотидные фрагменты или отдельные нуклеотиды.
Тест на определение ДНКазной активности является распространенным для идентификации патогенных микроорганизмов [Gerceker и др., 2009].
Ряд клинически значимых эукариотических и прокариотических микроорганизмов продуцируют ДНКазы как факторы вирулентности. К ним относятся грамположительные бактериальные патогены, такие как Staphylococcus aureus, и виды стрептококков, такие как Streptococcus pyogenes [Berends и др., 2010].
В настоящее время существуют разнообразные методики и среды для определения дезоксирибинуклеазной (ДНКазной) активности.
1. Методика Калиниченко Н.Ф., Овчаренко О.И., Бирюкова С.В. «Об определении ДНКазы у микроорганизмов» (ЖМЭИ, 1968, №12, с. 11-14); Изобретение SU 1693058 А1 (Кишиневский государственный медицинский университет) 23.11.1991 «Способ определения ДНКазной активности микроорганизмов»; Изобретение RU 2684721 С1 (Федеральное государственное бюджетное образовательное учреждение высшего образования "Тихоокеанский государственный медицинский университет" Министерства здравоохранения Российской Федерации (RU) 11.04.2019 «Питательная среда для определения ДНКазной активности у патогенных грамположительных бактерий»; Приказ Минздрава СССР от 22.04.1985 №535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений описана среда для определения ДНКазной активности бактерий»; Экспресс-метод на чашках с агаром предложенный [JEFFRIES, HOLTMAN, GUSE, 1957]; Шрайер модифицировал ДНКазный тест-агар, в котором для определения активности ДНКазы используется толуидиновый синий [Schreier, 1969]; Дезоксирибонуклеат-агар с акридиновым оранжевым предложен [Detection of nuclease activity in semisolid and broth cultures - PubMed,] для определения нуклеазной активности и множество других коммерчески представленных сред, содержащих в своем составе ДНК-агар. Эти тесты имеют ряд недостатков, в том числе длительное время для просмотра результатов ДНКазной активности бактерий и дороговизна использованных компонентов.
2. Еще одним аналогом заявляемого изобретения по совокупности признаков является метод, представленный [Gerceker и др., 2009] как экспресс-тест для обнаружения ДНКазной активности микроорганизмов: «ДНКазная пробирка». В этом методе бактерии добавляют в бульонную среду, содержащую ДНК, и отслеживается деградация ДНК, вызванная ДНКазой бактерией, путем прогона электрофореза в агарозном геле. Однако данный метод позволяет наблюдать ДНКазную активность в реальном времени.
3. Наиболее близким аналогом заявляемого изобретения по совокупности признаков является метод представленный [Е и др., 2019] в исследовании с использованием флуоресцентно меченых олигонуклеотидов для диагностики микроорганизмов, продуцирующих нуклеазы, однако исследователи предложили самозамыкающиеся шпильки, использование которых может коммерчески не выгодно.
Изобретение решает задачу определения наличия неспецифической ДНКазной активности в режиме реального времени.
Поставленная задача решается за счет того, что:
1. Предлагается анализировать ДНКазную активность на субстрате, полученном отжигом двух взаимокомплементарных олигонуклеотидов (один олигонуклеотид содержит на 5'-конце флуоресцентный краситель, тогда как на 3'-конце второго находится гаситель флуоресценции).
2. Предлагается использовать в качестве субстрата сверхспирализованную плазмидную ДНК в присутствии интеркалирующего красителя.
3. Предлагается использовать в качестве субстрата ДНК олигонуклеотиды, в присутствии интеркалирующего красителя
Технический результат данного изобретения заключается в определении наличия неспецифической ДНКазной активности в режиме реального времени.
Для решения технической проблемы и достижения заявленного технического результата предлагается анализировать ДНКазную активность на субстрате, полученном отжигом двух взаимокомплементарных олигонуклеотидов (один олигонуклеотид содержит на 5'-конце флуоресцентный краситель, тогда как на 3'-конце второго находится гаситель флуоресценции).
Предлагается также использовать в качестве субстрата сверхспирализованную плазмидную ДНК, в присутствии интеркалирующего красителя.
Предлагается также использовать в качестве субстрата ДНК олигонуклеотиды, в присутствии интеркалирующего красителя.
Технический результат достигается путем использования субстрата, полученного путем отжига двух взаимокомплементарных олигонуклеотидов: один олигонуклеотид содержит на 3'-конце флуоресцентный краситель, тогда как на 3'-конце второго находится находился гаситель флуоресценции. Равновесная смесь пары олигонуклеотидов в буфере, содержащим (10 мМ Трис-HCl рН 8,0, 25 мМ NaCl), подвергается нагреву в кипящей водяной бане в течении 3 мин. В пробирки, предназначенные для проведения реакции ПЦР в реальном времени, вносится субстрат флуоресцентно-меченных олигонуклеотидов, образец, а также реакционный буфер для работы ДНКазы, включающий кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси. Реакция гидролиза флуоресцентно-меченных олигонуклеотидов детектируется в режиме реального времени в соответствующем ПЦР-приборе при оптимальной температуре для работы фермента.
Технический результат также достигается путем использования субстрата плазмидной ДНК в присутствии интеркалирующего красителя. В пробирки, предназначенные для проведения реакции ПЦР в реальном времени, вноситься смесь, содержащая плазмидный субстрат, прошедший инкубацию с интеркалирующим красителем EVA Green, образец, свободный от РНК, а также реакционный буфер для работы ДНКазы, включающий кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси. Реакция гидролиза плазмидной ДНК детектируется в режиме реального времени в соответствующем ПЦР-приборе при оптимальной температуре для работы фермента.
Технический результат также достигается путем использования субстрата ДНК олигонуклеотидов в присутствии интеркалирующего красителя. Равновесная смесь пары олигонуклеотидов в буфере, содержащем 10 мМ Трис-HCl рН 8,0, 25 мМ NaCl, подвергается нагреву в кипящей водяной бане в течении 3 мин. В пробирки, предназначенные для проведения реакции ПЦР в реальном времени, вносится смесь, содержащая ДНК олигонуклеотидный субстрат, прошедший инкубацию с интеркалирующим красителем EVA Green, образец свободный от РНК, а также реакционный буфер для работы ДНКазы, включающий кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси. Реакция гидролиза ДНК олигонуклеотидного субстрата детектируется в режиме реального времени в соответствующим ПЦР-приборе при оптимальной температуре для работы фермента.
Изобретение иллюстрируется нижеследующими примерами
Пример 1.
Готовилась смесь пары олигонуклеотидов, представленных в таблице 1 () по 10 мкМ каждого олигонуклеотида в буфере, содержащем 10 мМ Трис-HCl рН 8,0, 25 мМ NaCl. Данная смесь прогревалась в кипящей водяной бане в течении 3 мин, после чего она остывала до комнатной температуры.

Пример 2.
Готовилась смесь пары олигонуклеотидов, представленных в таблице 2 по 10 мкМ каждого олигонуклеотида в буфере, содержащем 10 мМ Трис-HCl рН 8,0, 25 мМ NaCl. Данная смесь прогревалась в кипящей водяной бане в течении 3 мин, после чего она остывала до комнатной температуры.
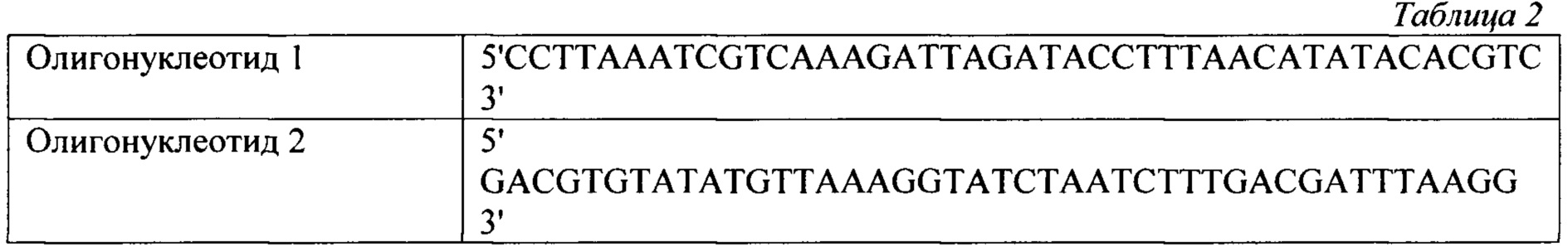
Пример 3.
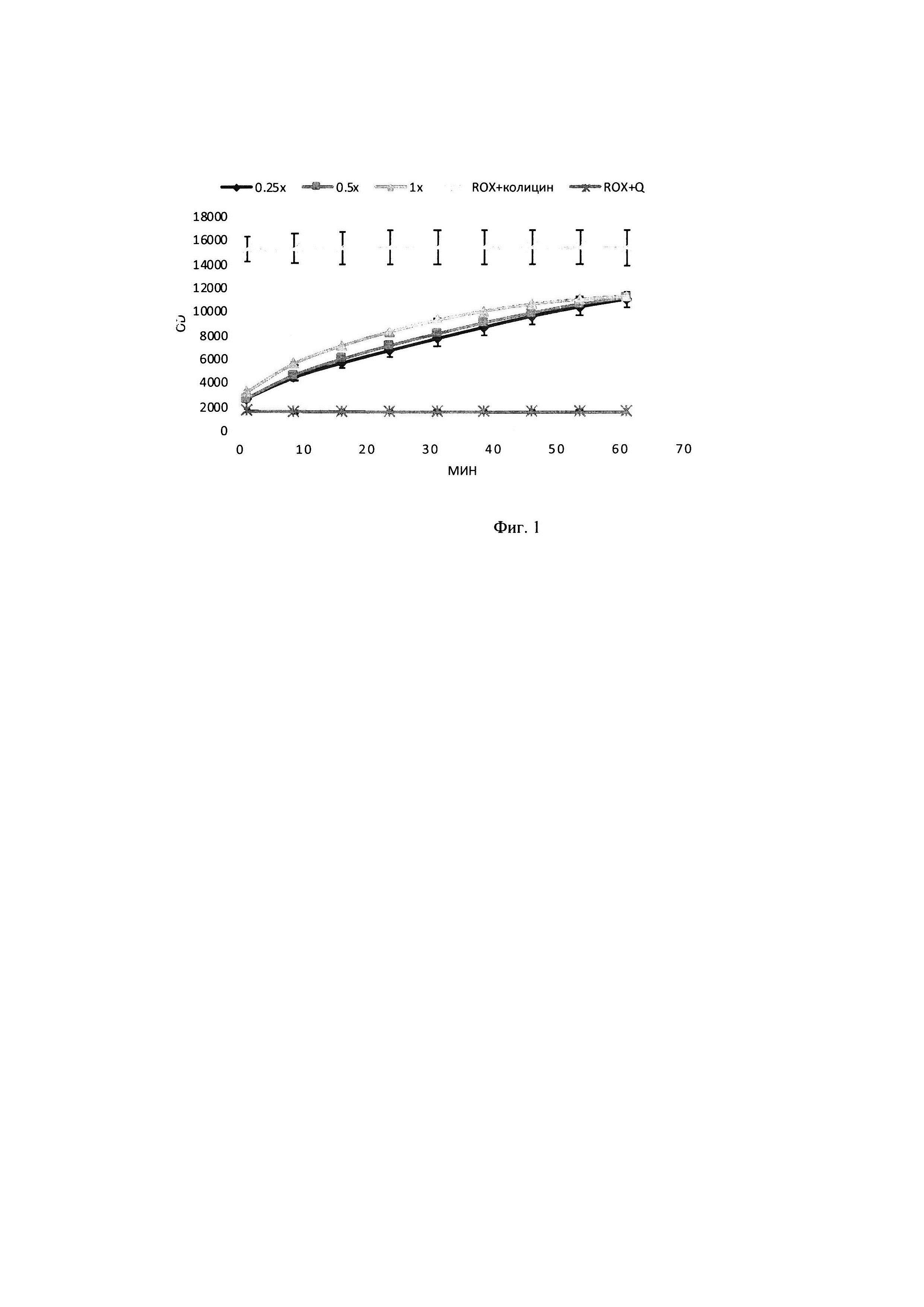
В тонкостенные пробирки на 100 мкл вносилась смесь объемом 25 мкл, содержащая 7 мкл субстрата флуоресцентно-меченных олигонуклеотидов до концентрации 2,8 мкМ, 1 мкл исследуемого образца с ферментативным препаратом ДНКазы колицин Е9 с концентрациями в реакционной смеси 0,8 мкМ, 0,4 мкМ, 0,2 мкМ, а также 2,5 мкл реакционного буфера для работы, включающий кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси концентрация буфера в реакционной смеси (трис-HCl 50 мМ, NaCl 80 мМ, MgCl2 10 мМ). Реакцию гидролиза флуоресцентно-меченных олигонуклеотидов детектировали в режиме реального времени в соответствующем ПЦР-приборе при температуре 30°. Результаты представлены на фигуре 1: график выхода флуоресценции при инкубации флуоресцентно-меченных олигонуклеотидов с 1-0,8 мкМ, 0,5-0,4 мкМ, 0,1-0,2 мкМ ДНКазы. (ROX+Q) - флуоресцентно-меченные олигонуклеотиды; (ROX+колицин) - ДНКаза с флуоресцентно-меченным олигонуклеотидом R-SD10 up (Rox).
Пример 4.
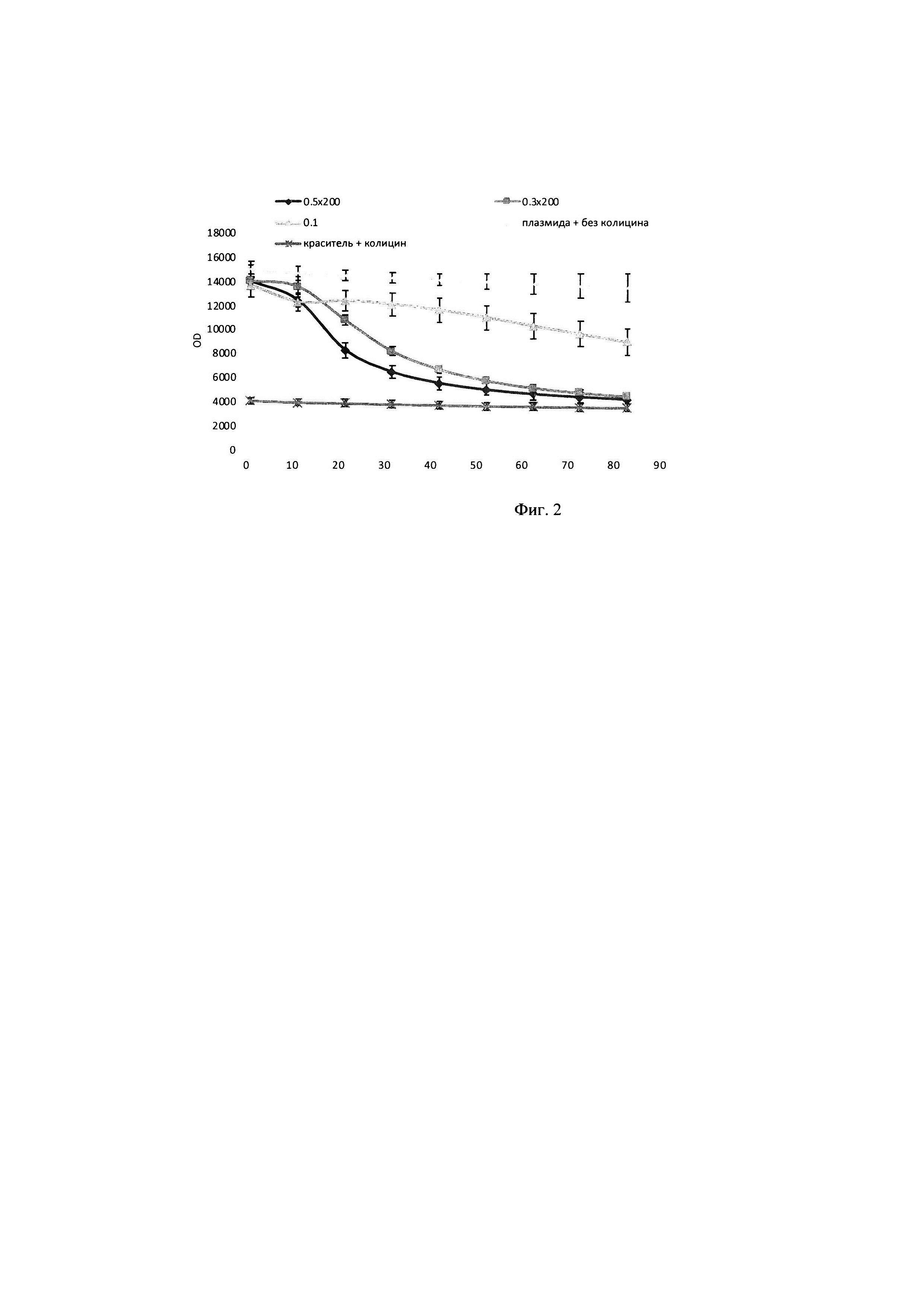
В тонкостенные пробирки на 100 мкл вносилась смесь объемом 25 мкл, содержащая 2,5 мкл плазмидного pRSF-Duet-1 субстрата до конечной концентрации в реакционной смеси 8 нМ, прошедшего инкубацию в течение 30 минут с 2,25 мкМ интеркалирующим красителем EVA Green, 1 мкл исследуемого образца с ферментативным препаратом ДНКазы колицин Е9 с концентрациями в реакционной смеси 0,8 мкМ, 0,4 мкМ, 0,24 мкМ, а также 2,5 мкл реакционного буфера для работы, включающего кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси концентрация буфера в реакционной смеси (трис-HCl 50 мМ, NaCl 80 мМ, MgCl2 10 мМ). Реакцию гидролиза плазмидного субстрата детектировали в режиме реального времени в соответствующем ПЦР-приборе при температуре 30°. Результаты представлены на фигуре 2: график падения выхода флуоресценции в зависимости от времени при внесении 0,1-0,08 мкМ ДНКазы к 200 нг субстрата, 0,3*2000,24 мкМ ДНКазы к 200 нг субстрата, 0,5*200-0,4 мкМ ДНКазы к 200 нг субстрата, (краситель + колицин) - субстрат с EVA Green; (плазмида без колицина) - EVA Green с ДНКазой без ДНК.
Пример 5.
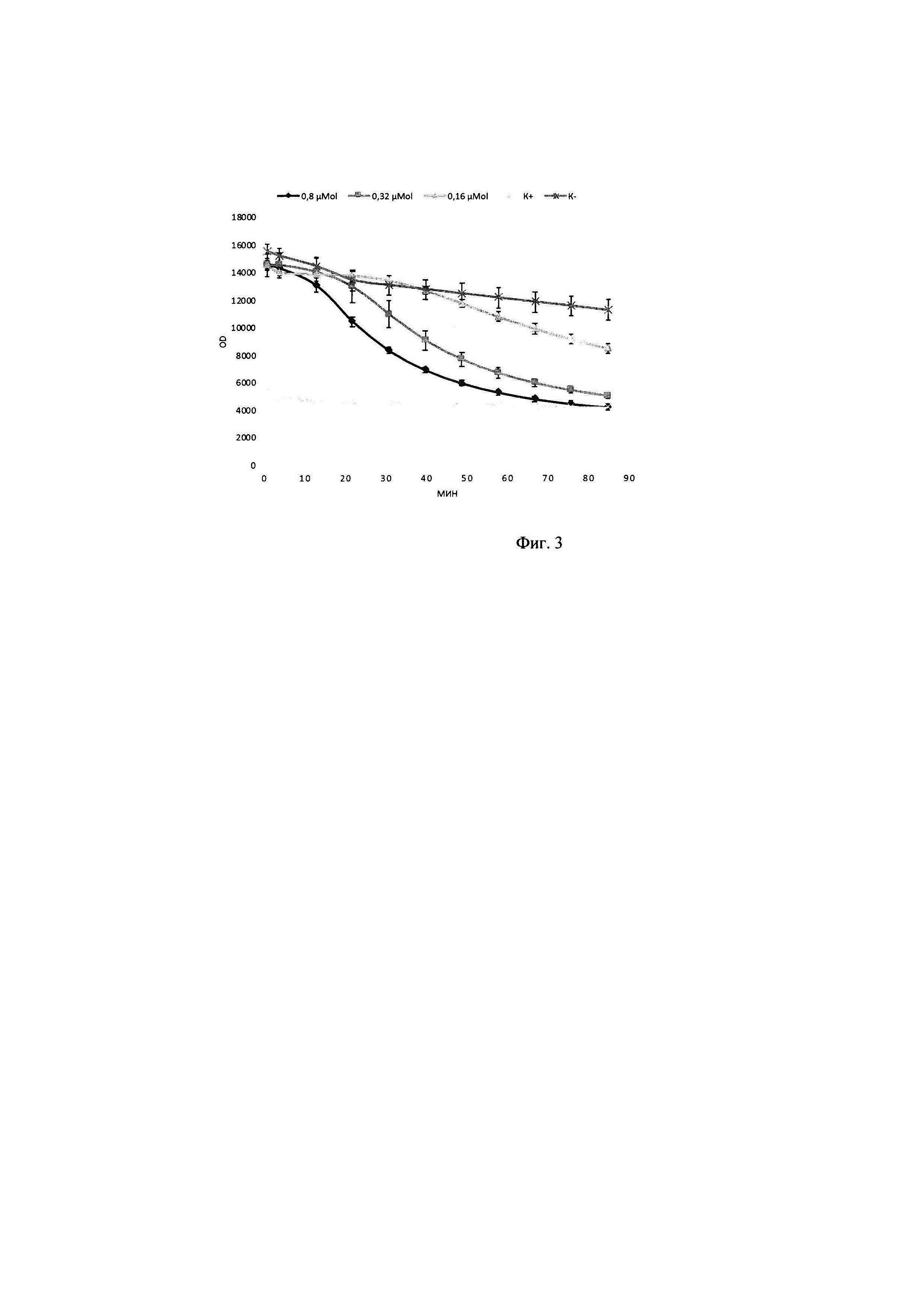
В тонкостенные пробирки на 100 мкл вносилась смесь объемом 25 мкл, содержащая 1 мкл ДНК олигонуклеотидного субстрата до конечной концентрации в реакционной смеси 0,20 мкМ субстрата, прошедшего инкубацию в течение 30 минут с 2,25 мкМ интеркалирующим красителем EVA Green, 1 мкл исследуемого образца с ферментативным препаратом ДНКазы колицин Е9 с концентрациями в реакционной смеси 0,8 мкМ, 0,32 мкМ, 1,6 мкМ, а также 2,5 мкл реакционного буфера для работы, включающего кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси концентрация буфера в реакционной смеси (трис-HCl 50 мМ, NaCl 80 мМ, MgCl2 10 мМ). Реакцию гидролиза олигонуклеотидного субстрата детектировали в режиме реального времени в соответствующим ПЦР-приборе при температуре 30°. Результаты представлены на фигуре 3: график падения выхода флуоресценции в зависимости от времени при различном количестве ДНКазы: 0,8; 0,32, 0,16 мкМ; ДНКазы на 0,25 мкМ субстрата. (K-) - субстрат с интеркалирующим красителем; (K+) - интеркалирующий красителеь с ДНКазой.
Пример 6.
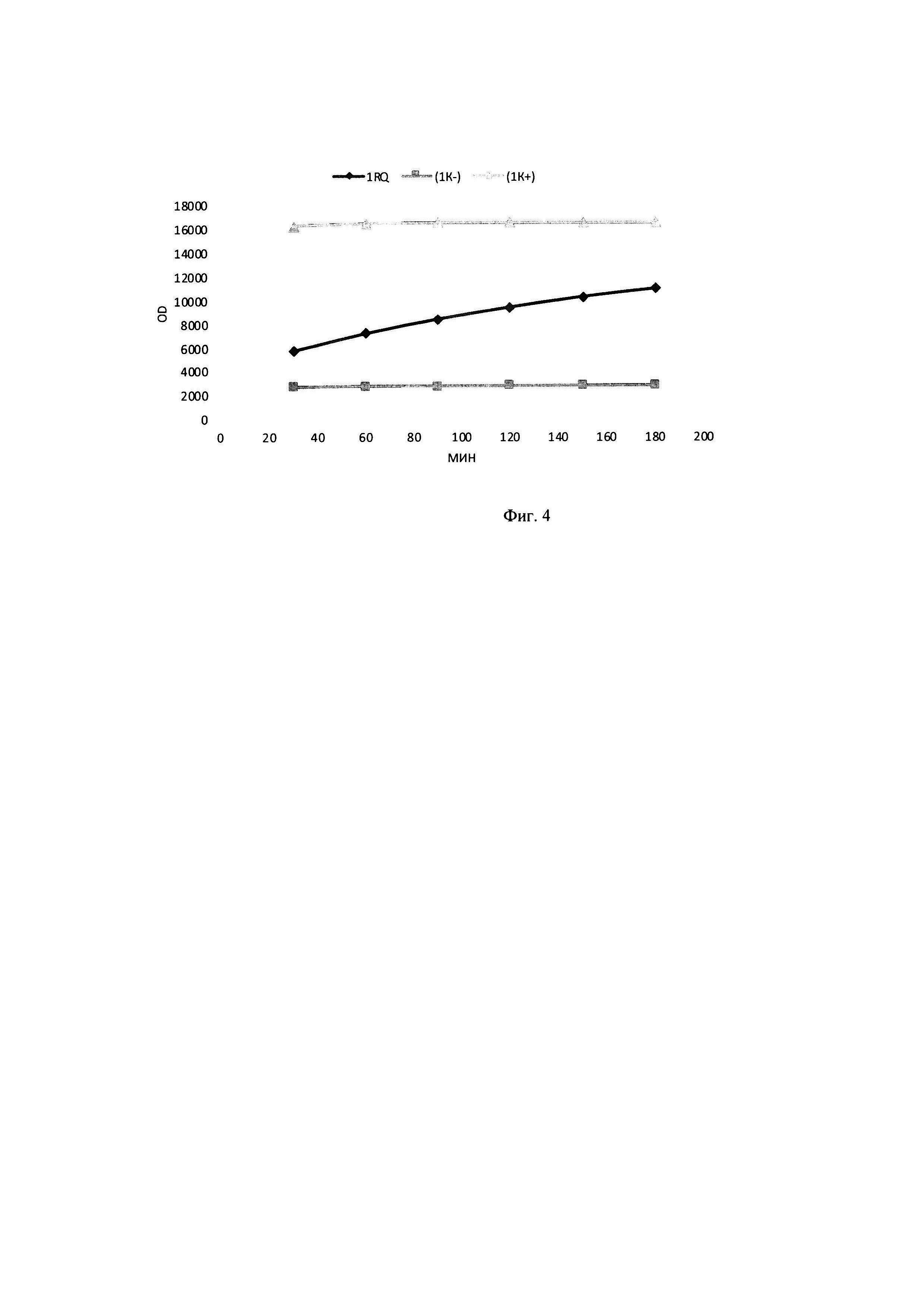
В тонкостенные пробирки на 100 мкл вносилась смесь объемом 25 мкл, содержащая 7 мкл субстрата флуоресцентно-меченных олигонуклеотидов до концентрации 2,8 мкМ, 5 мкл образца культуральной жидкости Staphylococcus aureus, а также 2,5 мкл реакционного буфера для работы, включающего кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси концентрация буфера в реакционной смеси (трис-HCl 50 мМ, NaCl 10 мМ, CaCl2 10 мМ). Реакцию гидролиза флуоресцентно-меченных олигонуклеотидов детектировали в режиме реального времени в соответствующим ПЦР-приборе при температуре 30°. Результаты на фигуре 4: График сигнала флюоресценции в образцах с флуоресцентно-меченными олигонуклеотидами: RQ - субстрат в присутствии культуральной жидкости St. aureus; (K-) - флуоресцентно-меченные олигонуклеотиды со средой LB; (K+) - культуральная жидкость St. aureus с флуоресцентно-меченным олигонуклеотидом R-SD10 up (Rox).
Пример 7.
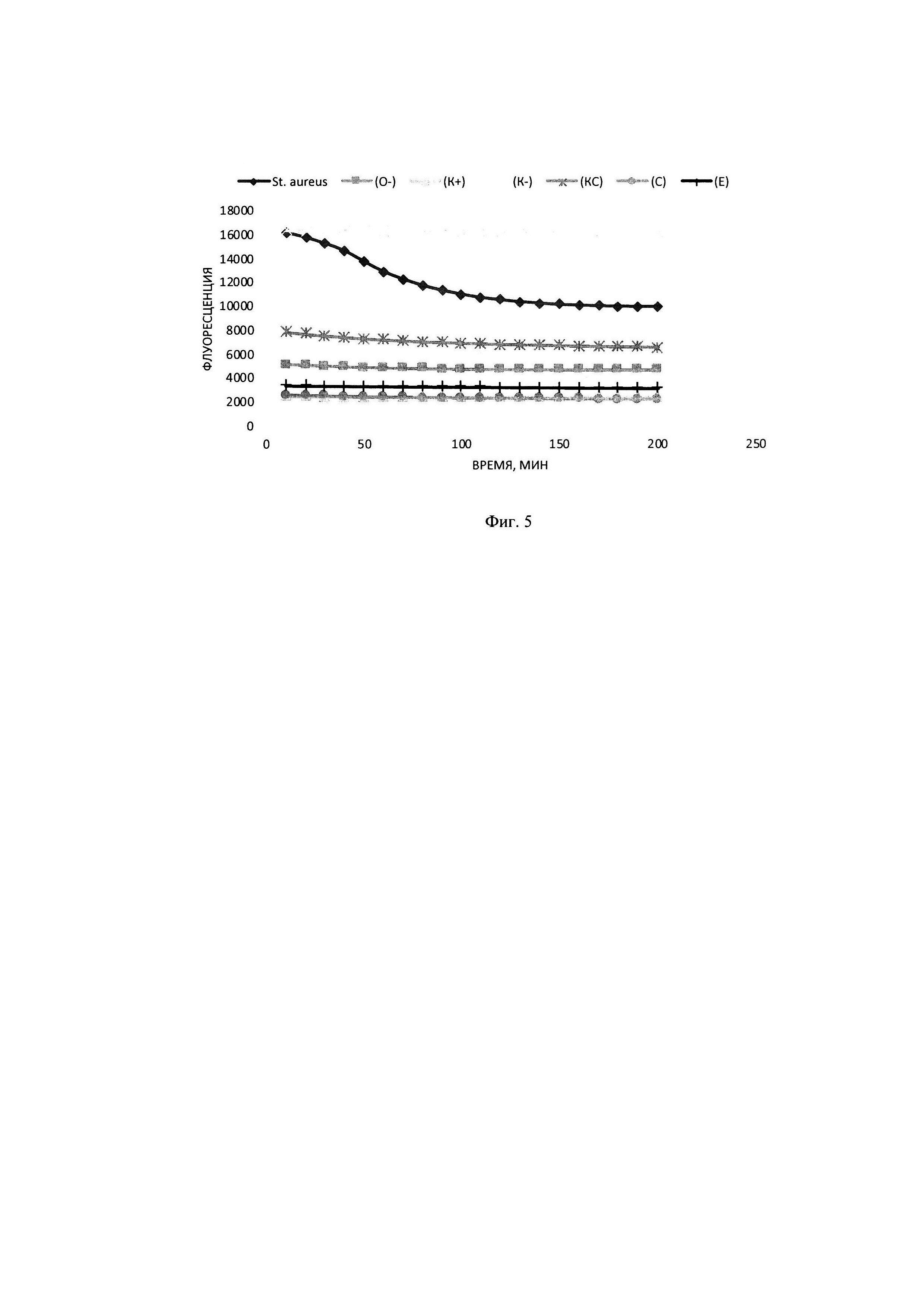
В тонкостенные пробирки на 100 мкл вносилась смесь объемом 25 мкл, содержащая 2,5 мкл плазмидного pRSF-Duet-1 субстрата до конечной концентрации в реакционной смеси 8 нМ, прошедшего инкубацию в течение 30 минут с 2,25 мкМ интеркалирующим красителем EVA Green, 5 мкл образца культуральной жидкости Staphylococcus aureus, прошедшего инкубацию с РНКазой А до полного гидролиза РНК присутствующей в питательной среде, а также 2,5 мкл реакционного буфера для работы, включающего кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси концентрация буфера в реакционной смеси (трис-HCl 50 мМ, NaCl 10 мМ, CaCl2 10 мМ). Реакцию гидролиза плазмидного субстрата детектировали в режиме реального времени в соответствующем ПЦР-приборе при температуре 30°. Результаты на фигуре 5: График сигнала флюоресценции в образцах с 100 нг плазмидной ДНК pRSFDuet-1, красителем EVA Green 2,25 скМ в присутствии культуральной жидкости: St. aureus и щелочного буфера; (О-) - соответствующий образец в отсутствии субстрата; (K+) - соответствующий образец в отсутствии субстрата и интеркалирующего красителя; (K-)- субстрат с интеркалирующим красителем и средой LB; (KC) - интеркалирующий краситель со средой LB; (С) - среда LB; (Е) - интеркалирующий краситель.
Пример 8.
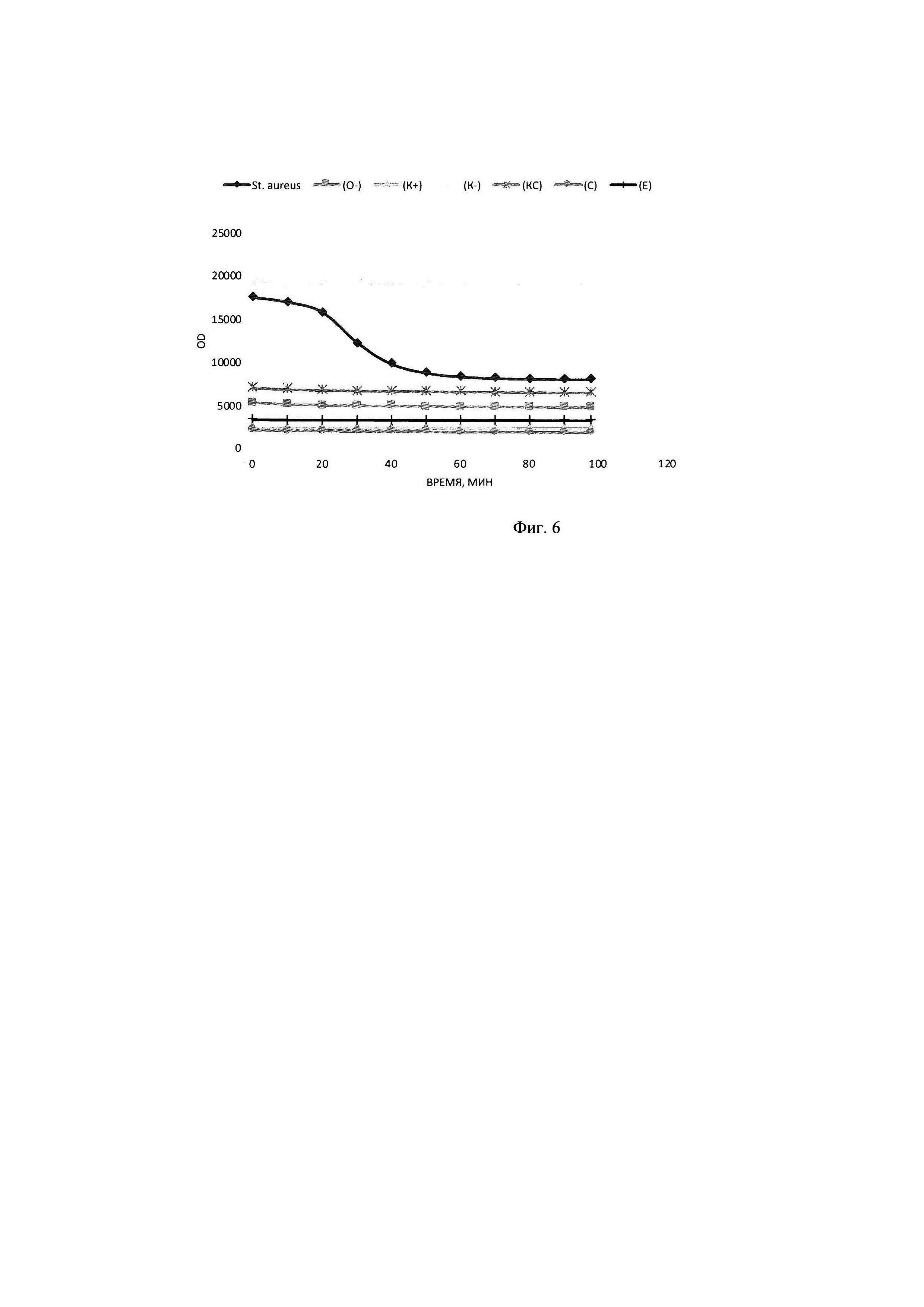
В тонкостенные пробирки на 100 мкл вносилась смесь объемом 25 мкл, содержащая 1 мкл ДНК олигонуклеотидного субстрата до конечной концентрации в реакционной смеси 0,20 мкМ субстрата, прошедшего инкубацию в течение 30 минут с 2,25 мкМ интеркалирующим красителем EVA Green, 5 мкл образца культуральной жидкости Staphylococcus aureus, прошедшего инкубацию с РНКазой А до полного гидролиза РНК присутствующей в питательной среде, а также 2,5 мкл реакционного буфера для работы, включающего кофакторы и необходимую буферную систему для поддержания рН в реакционной смеси концентрация буфера в реакционной смеси (трис-HCl 50 мМ, NaCl 10 мМ, CaCl2 10 мМ). Реакцию гидролиза олигонуклеотидного субстрата детектировали в режиме реального времени в соответствующем ПЦР-приборе при температуре 30°. Результаты представлены на фигуре 6: График сигнала флюоресценции в образцах с 2,8 μMol олигонуклеотидами, красителем EVA Green 2,25 мкМ в присутствии культуральной жидкости St. aureus и щелочного буфера; (О-) - соответствующий образец в отсутствии субстрата; (K+) -соответствующий образец в отсутствии субстрата и интеркалирующего красителя; (K-)- субстрат с интеркалирующим красителем и средой LB; (KC) - интеркалирующий краситель со средой LB; (С) - среда LB;; (Е) - интеркалирующий краситель.
Литература
1. Berends Е.Т.М. и др. Nuclease expression by Staphylococcus aureus facilitates escape from neutrophil extracellular traps // J. Innate Immun. 2010. T. 2. №6. C. 576-586.
2. E M. и др. Oligomer based real-time detection of microorganisms producing nuclease enzymes // Analyst. 2019. T. 144. №4. C. 1379-1385.
3. Gerceker D. и др. A new, simple, rapid test for detection of DNase activity of microorganisms: DNase Tube test // J. Gen. Appl. Microbiol. 2009. T. 55. №4. C. 291-294.
4. JEFFRIES CD., HOLTMAN D.F., GUSE D.G. Rapid method for determining the activity of microorganisms on nucleic acids. // J. Bacteriol. 1957. T. 73. №4. С. 590-591.
5. Schreier J.B. Modification of deoxyribonuclease test medium for rapid identification of Serratia marcescens. //Am. J. Clin. Pathol. 1969. T. 51. №6. С 711-716.
6. Detection of nuclease activity in semisolid and broth cultures - PubMed [Электронный ресурс]. URL: https://pubmed.ncbi.nlm.nih.gov/4185235/ (дата обращения: 22.04.2021).
Способ определения ДНКазной активности, включающий использование субстрата, полученного путем отжига двух взаимокомплементарных олигонуклеотидов в присутствии интеркалирующего красителя EVA Green, проведение ПЦР в смеси, содержащей ДНК олигонуклеотидный субстрат, прошедший инкубацию с интеркалирующим красителем EVA Green, образец, свободный от РНК, а также реакционный буфер для работы ДНКазы, включающий кофакторы и буферную систему для поддержания рН в реакционной смеси, наличие неспецифической ДНКазной активности определяют по реакции гидролиза ДНК олигонуклеотидного субстрата в режиме реального времени на основании падения флуоресценции в опытном образце относительно контрольного образца.