Результат интеллектуальной деятельности: НОВЫЕ ЧАСТИЦЫ НОСИТЕЛЯ ДЛЯ СУХИХ ПОРОШКОВЫХ СОСТАВОВ ДЛЯ ИНГАЛЯЦИИ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к частицам носителя для применения в сухих порошковых составах для ингаляции и способам их получения.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Медикаментозную терапию посредством ингаляции сухого порошка (DPI) многие годы используют для лечения респираторных состояний, таких как астма, хроническое обструктивное заболевание легких (COPD) и системные заболевания.
По сравнению с пероральным приемом лекарственных средств необходимы только относительно небольшие дозы для эффективной терапии, поскольку метаболизм первого прохождения обходится и/или значительно уменьшается.
Такие малые дозы снижают воздействие лекарственного средства на организм и минимизируют побочные эффекты. Системные неблагоприятные явления также уменьшаются, поскольку местная доставка в легкие направляет лекарственное средство непосредственно в область действия. Режимы с более низкими дозировками также могут обеспечивать значительную экономию, в частности, когда речь идет о дорогостоящих терапевтических средствах.
Для эффективной доставки в легкие необходимо, чтобы частицы лекарственного вещества имели размер частиц в диапазоне нескольких микрометров, как правило, 1-5 микрометров.
Сухие порошковые составы обычно составляют путем смешения лекарственного средства с грубыми частицами носителя, обеспечивая упорядоченную смесь, где микронизированные активные частицы прилипают к поверхности частиц носителя, находясь в ингаляторе.
Носитель делает микронизированный порошок менее липким и повышает его текучесть, упрощая переработку порошка в ходе процесса производства (переливание, заполнение, дозирование и т.д.). Кроме того, носитель выступает в качестве наполнителя, когда терапевтическая доза лекарственного средства находится в микрограммовом диапазоне.
В ходе ингаляции частицы лекарственного средства отделяются от поверхности частиц носителя и проникают в нижние отделы легких, в то время как более крупные частицы носителя в основном откладываются в полости ротоглотки.
Открепление частиц лекарственного средства от поверхности носителя считается наиболее важным фактором, который определяет доступность лекарственного средства для легких. Это может зависеть от механической стабильности порошковой смеси и от того, как на это влияют характеристики адгезии между лекарственным средством и носителем, и внешних сил, требуемых для разрушения нековалентных связей, образованных между слипшимися частицами. Слишком сильные связи между слипшимися частицами могут в действительности препятствовать отделению микронизированных частиц лекарственного средства от поверхности частиц носителя.
В данной области были предложены различные подходы, нацеленные на модулирование сцепления, для способствования отделению частиц лекарственного средства от частиц носителя и, таким образом, повышения респирабельной фракции. Например, для достижения указанной цели в качестве решения технической проблемы было предложено добавление частиц эксципиента и/или тонких добавок со смазывающими или антиадгезивными свойствами (далее в совокупности называемых тонкими частицами). Как правило, указанные тонкие частицы имеют размер менее 50 микрометров, предпочтительно менее 20 микрометров.
Однако, поскольку тонкие частицы имеют плохую текучесть, текучесть соответствующих порошковых составов имеет тенденцию к ухудшению по мере увеличения содержания тонких частиц.
С другой стороны, ингаляционный путь все в больше и больше используется для введения активных ингредиентов в довольно высоких разовых дозах.
Это становится трудной задачей, поскольку хорошо известно, что чем выше доза, и, таким образом, концентрация активного ингредиента, тем выше риск образования шероховатых агломератов (т.е. микронизированных частиц лекарственного средства, удерживаемых вместе мощными силами сцепления), которые являются неблагоприятными с точки зрения возможности достижения хорошей однородности распределения лекарственного средства в порошковой смеси и, таким образом, высокой точности дозы, а также для приемлемой деагрегации при ингаляции пациентом. Более того, чем более высокой является доза и, таким образом, концентрация активного ингредиента, тем более высоким является количество тонких частиц, требуемых для удовлетворительной респирабельной фракции.
Высокое количество микронизированного активного ингредиента и/или тонких частиц эксципиента может оказывать неблагоприятное влияние на текучесть соответствующего состава, что в свою очередь может влиять на способность устройства доставлять правильную дозу при активации ингалятора.
Таким образом, было бы благоприятно предложить частицы носителя, способные вмещать довольно высокие количества микронизированных лекарственных средств без ухудшения текучести соответствующих порошковых составов.
Было бы еще более благоприятно предложить частицы носителя, способные вмещать довольно высокие количества микронизированных лекарственных средств при сохранении хорошей эффективности аэрозоля без использования тонких частиц эксципиента и/или тонких добавок.
Проблема решается посредством частиц носителя по настоящему изобретению и способов их получения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к отвержденным распылением из расплава частицам (например, замороженным распылением), изготовленным из маннита, для применения в качестве носителя для сухих порошковых составов для введения путем ингаляции, причем указанные частицы имеют массовый диаметр в диапазоне от 10 до 300 микрометров, и указанные частицы характеризуются правильной формой, имеющей коэффициент формы, составляющий от 0,80 до 1,00, предпочтительно от 0,90 и 1,00, более предпочтительно от 0,95 до 1,00.
Во втором аспекте изобретение относится к описанным выше частицам носителя, получаемым посредством процесса, включающего стадии:
i) нагревания маннита до полного расплавления;
ii) распыления расплавленного маннита посредством подходящей форсунки в камеру для замораживания спрея с получением капель;
iii) охлаждения капель, с тем чтобы вызвать отверждение и образование частиц,
iv) разделения полученных частиц; и
v) проведения стадии кондиционирования частиц.
В третьем аспекте изобретение относится к описанным выше частицам носителя, полученным посредством процесса, включающего стадии:
i) нагревания маннита до полного расплавления;
ii) распыления расплавленного маннита посредством подходящей форсунки в камеру для замораживания спрея с получением капель;
iii) охлаждения капель, с тем чтобы вызвать отверждение и образование частиц,
iv) разделения полученных частиц; и
v) проведения стадии кондиционирования частиц.
В четвертом аспекте изобретение относится к способу получения заявленных замороженных распылением частиц, причем указанный процесс включает следующие стадии:
i) нагревания маннита до полного расплавления;
ii) распыления расплавленного маннита посредством подходящей форсунки в камеру для замораживания спрея с получением капель;
iii) охлаждения капель, с тем чтобы вызвать отверждение и образование частиц,
iv) разделения полученных частиц; и
v) проведения стадии кондиционирования частиц.
В пятом аспекте изобретение относится к фармацевтической композиции в форме сухого порошка для ингаляции, содержащей частицы носителя по изобретению и один или несколько активных ингредиентов.
В шестом аспекте изобретение относится к ингалятору сухого порошка, заполненному вышеупомянутой сухой порошковой фармацевтической композицией.
В седьмом аспекте изобретение относится к способу получения вышеупомянутой фармацевтической композиции, включающему стадию смешения частиц носителя по изобретению с одним или несколькими активными ингредиентами в смесителе с высоким усилием сдвига.
В следующем аспекте изобретение также относится к упаковке, содержащей сухой порошковый фармацевтический состав по изобретению и ингалятор сухого порошка.
ОПРЕДЕЛЕНИЯ
Если нет иных указаний, термины "активное лекарственное средство", "активный ингредиент", "активный" и "активное вещество", "активное соединение" и "терапевтическое средство" используются в качестве синонимов.
Термин "микроны" используется в качестве синонима "микрометрам".
Как правило термины, размер частиц количественно определяют путем измерения характеристического эквивалентного диаметра сфер, известно как объемный диаметр, посредством лазерной дифракции.
Размер частиц также можно количественно определять путем измерения массового диаметра с использованием подходящих устройств и способов, известных специалисту в данной области, таких как просеивание.
Объемный диаметр (VD) относится к массовому диаметру (MD), умноженному на плотность частиц (предполагая, что размер не зависит от плотности частиц).
Альтернативно размер частиц можно выражать в терминах объемного диаметра. В частности, распределение размера частиц может быть выражено в терминах: i) объемного срединного диаметра (VMD), который соответствует диаметру 50 процентов по массе частиц, например, d(v0,5), и ii) объемного диаметра (VD) в микрометрах 10% и 90% частиц, соответственно, например, d(v0,1) и d(v0,9).
Термин "тонкие частицы" относится к частицам, имеющим срединный объемный диаметр предпочтительно ниже 20 микрометров, более предпочтительно ниже 15 микрометров, изготовленным из физиологически приемлемого эксципиента и/или изготовленным из добавки со смазывающими или антиадгезивными свойствами, или их смеси.
Термин "хорошие свойства текучести" относится к составу, который легко перерабатывать в процессе производства и который способен обеспечивать точную и воспроизводимую доставку терапевтически эффективной дозы.
Характеристики текучести можно оценивать путем измерения индекса Карра; индекс Карра менее 25 обычно считается указывающим на хорошие характеристики текучести.
Альтернативно характеристики текучести можно оценивать путем измерения коэффициента функции течения (ffc) с использованием модуля сдвиговой ячейки порошкового реометра. В соответствии с величиной ffc порошок может быть классифицирован как твердый (ffc ≤ 1), в значительной степени сцепленный (ffc 1-2), от сцепленного (ffc 2-4) до легко текучего (ffc 4-10) и свободно текучий (ffc ≥ 10). Величина выше 10 обычно считается указывающей на свободно текучий порошок и хорошие характеристики текучести.
Выражение "хорошая однородность" относится к составу, где при смешении однородность содержимого активного ингредиента, выраженная в качестве относительного стандартного отклонения (RSD), составляет менее 5%.
Выражение "физически стабильный в устройстве до применения" относится к составу, где активные частицы по существу не отделяются и/или открепляются от поверхности частиц носителя как в ходе производства сухого порошка, так и в устройстве для доставки перед применением.
Выражение "вдыхаемая фракция" относится к показателю процента частиц активного ингредиента, которые могут достигнуть глубоких областей легких пациентов. Вдыхаемую фракцию, также называемую фракцией тонких частиц (FPF), обычно оценивают с использованием подходящего устройства in vitro, как правило, многостадийного каскадного импактора или многостадийного жидкостного импинджера (MLSI), быстрого скринингового импактора (FSI) или импактора последнего поколения (NGI) в соответствии с методиками, описанными в распространенных фармакопеях. Ее вычисляют по соотношению между вдыхаемой дозой и доставляемой (выпускаемой) дозой.
Доставляемую дозу вычисляют из совокупного оседания лекарственного средства на ступенях устройства, в то время как вдыхаемую дозу (доза тонких частиц) вычисляют из оседания на ступенях, соответствующего частицам, имеющим диаметр < 5,0 микрометров. Специалист в данной области может использовать другие параметры, такие как поток при вдохе, в соответствии с руководством, описанным в распространенных фармакопеях.
Вдыхаемая фракция выше 30% является признаком хорошей ингаляционной эффективности.
Термин "терапевтическое количество" означает количество активного ингредиента, которое, когда его доставляют в легкие через сухой порошковый состав, как описано в настоящем описании, обеспечивает желаемый биологический эффект.
"Однократная доза" означает количество активного ингредиента, вводимое за один раз посредством ингаляции при срабатывании ингалятора.
"Срабатывание" означает высвобождение активного ингредиента из устройства посредством однократной активации (например, механическая или вдох).
Определение "довольно высокая однократная терапевтически эффективная доза" означает номинальную дозу, равную или превышающую 800 микрограмм (мкг).
Термин "смеситель с высоким усилием сдвига" относится к смесителю, где используется ротор или лопасть, вместе со стационарным компонентом, известным как статор, в емкости, содержащей порошок, подлежащий смешению для обеспечения сдвига.
Термин "маннит" относится к трем полиморфным формам маннита: α, β и δ. Форма β является термодинамически стабильной формой при 20°C и выше. Форма δ является формой с наиболее низкоплавкой формой маннита. Форма δ является термодинамически нестабильной и может спонтанно преобразовываться в более термодинамически стабильную форму β. Полиморфный переход из δ в β может запускаться, например, влагой.
ФИГУРЫ
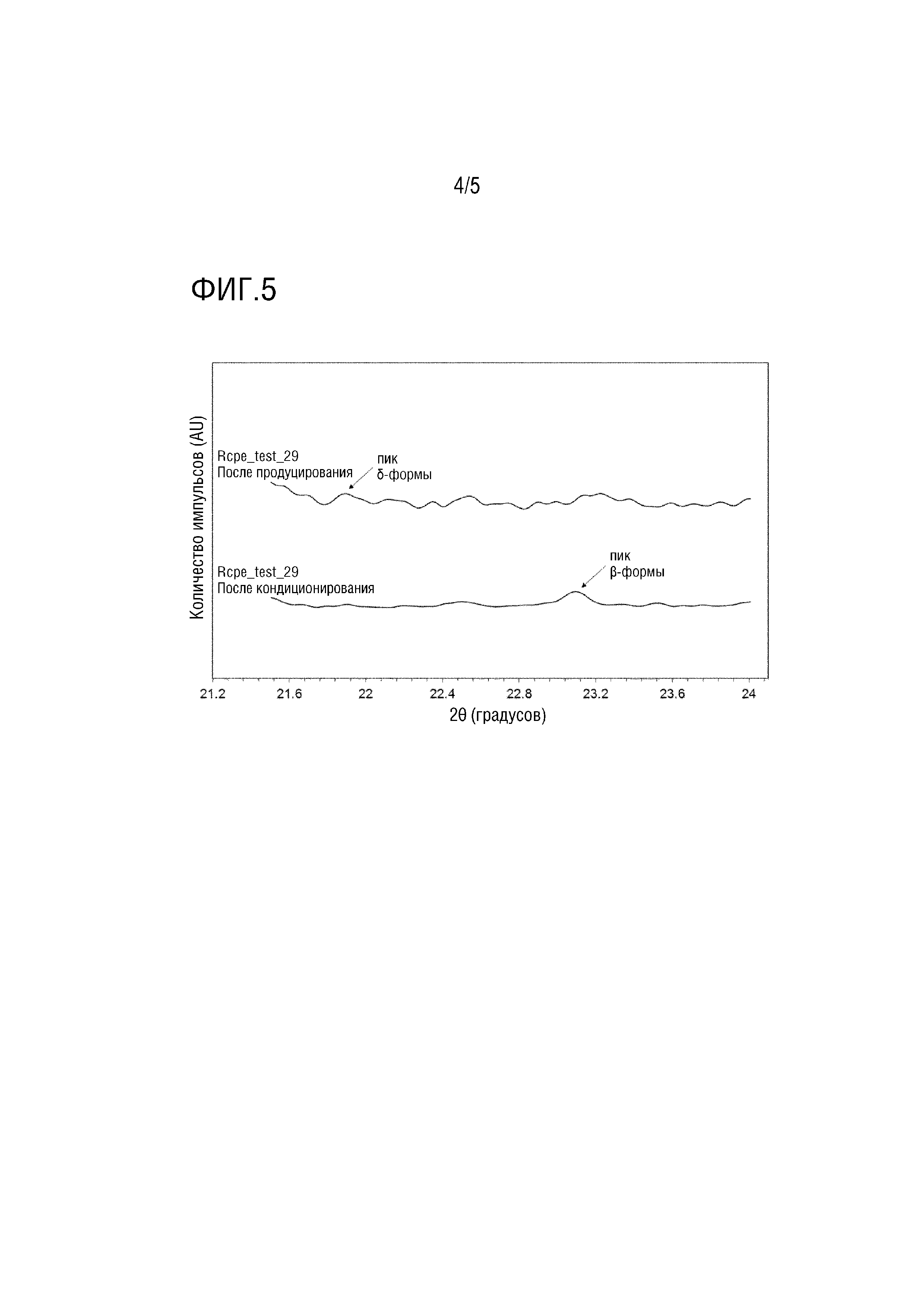
Фиг.1 - Схематическая диаграмма устройства замораживания распылением.
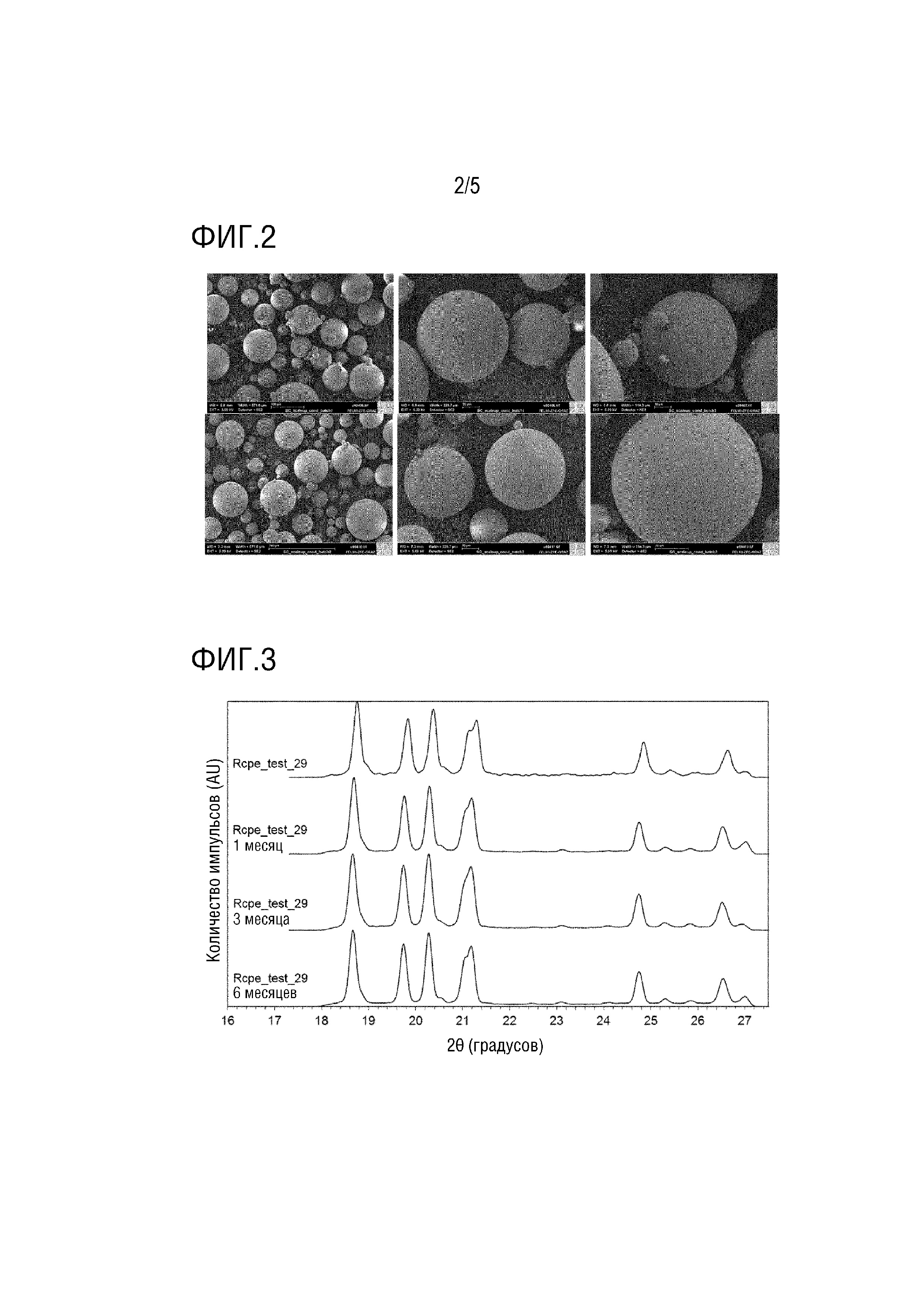
Фиг.2 - Изображения SEM частиц маннита.
Фиг.3 - Паттерн WAXS для замороженного распылением маннита в течение 6 месяцев (испытание стабильности).
Фиг.4 - Паттерн WAXS для замороженного распылением маннита после получения и после кондиционирования.
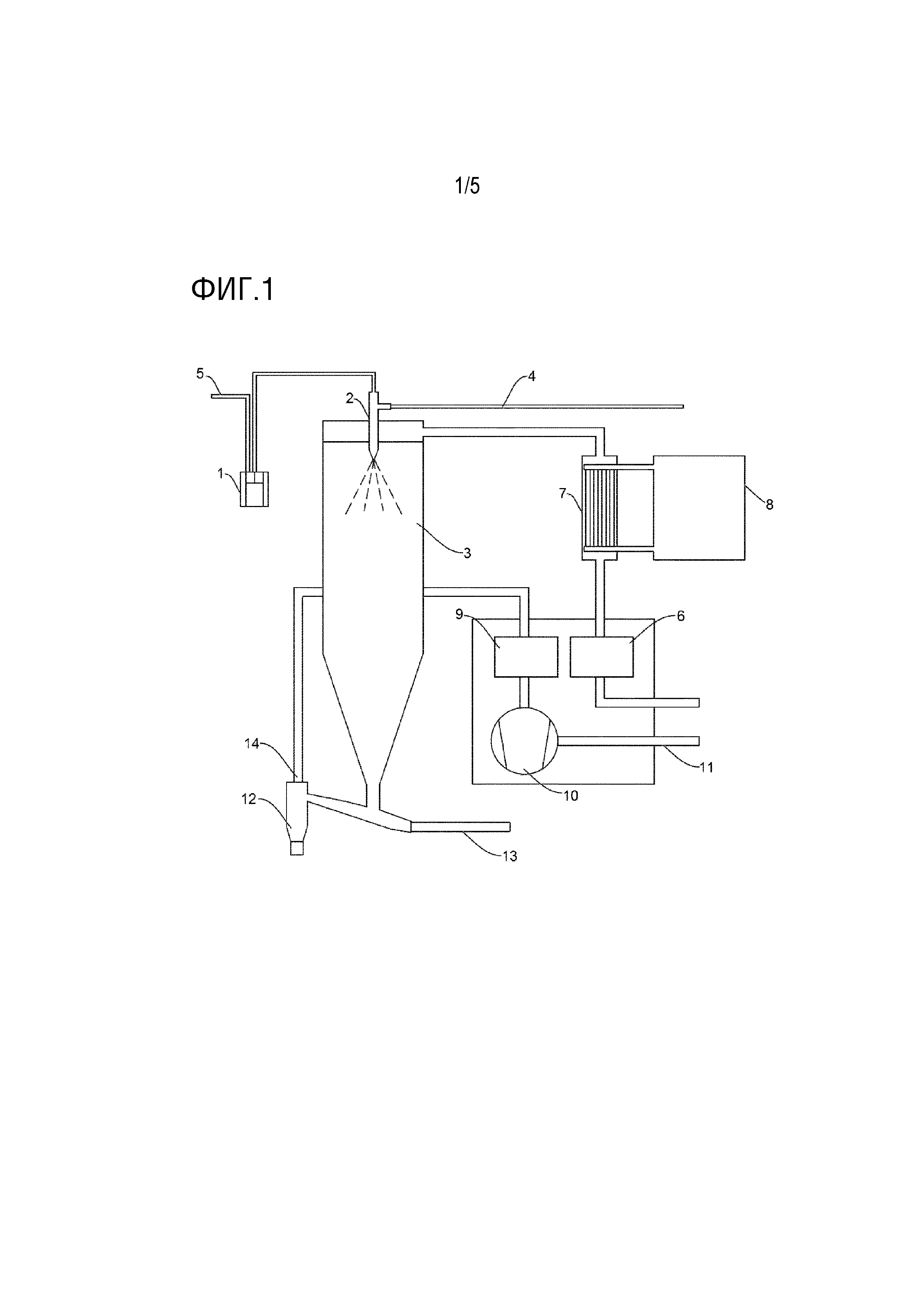
Фиг.5 - Паттерн WAXS для замороженного распылением маннита после получения и после кондиционирования (увеличение).
Фиг.6 - Изображения, полученные с использованием оптической микроскопии.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к замороженным распылением частицам, изготовленным из маннита, для применения в качестве носителя для сухих порошковых составов для ингаляции.
Замораживание распылением, также известное как охлаждение распылением, представляет собой свободный от растворителя процесс, который преобразует расплав в строго определенные сферические частицы.
Репрезентативная схематическая диаграмма устройства для замораживания распылением представлена на фиг.1:
Расплавленный образец подается из нагретого контейнера (1) с жидкостью к нагретой форсунке (2), распыляющей образец в камеру (3) для замораживания. Нагретая форсунка и нагретый контейнер соединены с линиями (4) и (5) подачи сжатого газа. Воздух подается в верхнюю часть камеры (3) для замораживания через впускной HEPA-фильтр (высокоэффективный воздушный фильтр) (6), соединенный с теплообменником (7) и холодильным элементом (8). Воздух из камеры (3) выпускается через выпускной HEPA-фильтр (9) и вентилятор (10) к выпускному отверстию (11).
Сухие частицы извлекаются со дна камеры (3) для замораживания через выпускную трубку (12), в которую подается сжатый газ из линий (13) и (14) подачи газа.
Можно использовать другое сходное устройство, работающее на тех же принципах.
Маннит используют ввиду того факта, что, в противоположность другим сахарам, таким как лактоза, не происходит деградации в ходе плавления.
Все частицы имеют размер частиц, выражаемый в виде массового или объемного диаметра, в диапазоне от 10 до 300 микрометров, предпочтительно от 20 до 280 микрометров, более предпочтительно от 30 до 250 микрометров.
В предпочтительном варианте осуществления изобретения, когда размер выражают в качестве объемного диаметра, распределение размера частиц носителя удовлетворяет следующим параметрам: d(v,0,1), составляющий от 25 до 45 микрометров, d(v,0,5), составляющий от 70 и 110 микрометров, и d(v,0,9), составляющий от 150 до 220 микрометров.
Диапазон распределения размера частиц для указанных частиц носителя, выражаемый в качестве размаха, преимущественно может составлять от 1,3 до 2,2, предпочтительно от 1,6 до 2,0. Согласно Chew et al. J Pharm Pharmaceut Sci 2002, 5, 162-168, размах соответствует [d(v,0,9) - d(v,0,1)]/d(v,0,5).
Для охарактеризации формы частиц носителя по изобретению используют фактор формы.
Таким образом, частицы носителя по изобретению характеризуются коэффициентом формы, составляющим от 0,80 до 1,00, предпочтительно от 0,90 до 1,00, более предпочтительно от 0,95 до 1,00.
Коэффициент формы можно определять по следующему уравнению, описанному в Kumar S et al Curr Appl. Phys. Influence of metal powder shape on drag coefficient in a spray jet, 2009, 9, 678-682
SF=1/RN
где:
RN указывает на округлость частиц и вычисляется с использованием следующей формулы:

где p и A представляют собой величины среднего периметра и площади, соответственно, для десяти сферических частиц при определении на изображениях, полученных посредством сканирующей электронной микроскопии (SEM).
Альтернативно средний периметр и площадь можно определять с помощью оптического микроскопа.
В Kumar S et al. описано, что коэффициент формы (SF) круга равен 1,00. Также там описано, что отклонение от единицы приводит к неправильности частицы, но частицы с величиной SF выше 0,8 могут считаться имеющими сферическую форму.
В типичном варианте осуществления полученные частицы носителя продемонстрировали коэффициент формы 0,986, измеренный посредством Malvern Morphology G3 Ver. 8.12 (Malvern Instruments Inc, Pennsylvania, США).
Также для количественной оценки характеристик микрочастиц порошка по изобретению, таких как форма частиц и морфология их поверхности, можно использовать сканирующую электронную (SEM) или оптическую микроскопию.
Частицы носителя по изобретению демонстрируют улучшенную текучесть, которую можно измерять, например, с использованием реометра для порошков FT4 (Freeman Technology, Tewkesbury, Великобритания). Таким образом, частицы носителя по изобретению характеризуются величиной ffc выше 10, как правило, от 14 до 16.
Также для определения характеристик частиц носителя по изобретению, например, истинной плотности, кажущейся и насыпной плотности, и удельной площади поверхности, можно использовать некоторые другие способы.
Истинную плотность частиц по изобретению можно определять с использованием гелиевой пикнометрии (пикнометр: AccuPyc II 1340, Micromeritics, Norcross, GA, США) по следующей методике: продувание 20 раз при 19,5 фунт/кв. дюйм (134,5 кПа) и пять аналитических пусков при 19,5 фунт/кв. дюйм (134,5 кПа) при скорости уравновешивания 0,0050 фунт./кв. дюйм/мин (34,5 Па/мин). Определяли объем частиц, позволяющий вычисление плотности частиц.
Как правило, истинная плотность составляет от 1,3 до 1,6 г/см3, предпочтительно от 1,4 до 1,5 г/см3.
Кажущуюся и насыпную плотность можно определять известными способами.
Например, образец помещали в 10-мл цилиндр до достижения 70-90% объема (точную массу и высоту цилиндра регистрировали).
Кажущуюся объемную плотность (ABD) определяли по формуле
ABD=M/V0 (выражаемая в г/мл)
где M представляет собой массу образца и V0 представляет собой первоначальный объем образца в цилиндре.
Как правило, кажущаяся объемная плотность составляет от 0,55 и 0,75 г/мл, предпочтительно от 0,6 до 0,7 г/мл.
Использовали возрастающее количество постукиваний: 10, 40, 50, 100, 300, 250 и 500 и регистрировали соответствующий насыпной объем. Анализ завершали при всего 1250 постукиваниях, если высота не изменялась на стадии от 250 до 500 постукиваний: если наблюдали изменение добавляли дополнительные 1250 постукиваний до достижения равновесия.
Насыпную объемную плотность (TBD) измеряли с использованием следующей формулы:
TBD=M/Vt (выражаемая в г/мл)
где M представляет собой массу образца и Vt представляет собой конечный объем образца в цилиндре.
Как правило, насыпная объемная плотность составляет от 0,7 до 0,9 г/мл, предпочтительно от 0,75 до 0,85 г/мл.
Из IBD и TBD можно вычислять индекс Карра с использованием следующей формулы:
Индекс Карра=100×(TBD-IBD)/TBD (выражаемый в %)
Как правило, оказывалось, что величины составляют значительно ниже 25, что указывает на то, что частицы носителя по изобретению наделены хорошими характеристиками текучести.
Удельная площадь поверхности может быть определена способом адсорбции азота Брунауэра-Эммета-Теллера (BET) в соответствии с известной методикой.
Удельная площадь поверхности частиц носителя по изобретению составляет от 0,09 до 0,26 м2/г, предпочтительно от 0,10 до 0,20 м2/г.
Неожиданно, фармацевтические составы, содержащие частицы носителя по изобретению, могут обеспечить хорошие характеристики аэрозоля без использования частиц эксципиента и/или тонкоизмельченных добавок.
Более того, если смешение происходит в смесителе с высоким усилием сдвига в течение короткого времени смешения (равного 20 минут или менее), указанные составы демонстрируют хорошую однородность активных ингредиентов, подлежащих доставке, при довольно высоких дозах, например, 800 микрограмм на срабатывание ингалятора.
Однако хорошей однородности также можно достигать, подвергая порошок более длительному времени перемешивания с использованием общепринятых смесителей.
Указанные оптимальные характеристики являются результатом процесса, используемого для получения частиц носителя.
Таким образом, изобретение относится к способу получения частиц носителя по изобретению, причем способ включает следующие стадии:
i) нагревание маннита до полного расплавления;
ii) распыление расплавленного маннита посредством подходящей форсунки (2) в камеру (3) для замораживания спрея с получением капель;
iii) охлаждение капель для индуцирования отверждения и образования частиц,
iv) разделение полученных частиц;
v) проведение стадии кондиционирования частиц.
Маннит является коммерчески доступным и может быть использован в каждой из его кристаллических полиморфных форм (форма α, β и δ) и/или их смеси, а также в аморфной и/или кристаллической форме, а также их смеси.
Устройство для замораживания распылением является коммерчески доступным, например, от ProCepT (Zelzate, Бельгия).
Преимущественно, на стадии i) маннит нагревают до температуры по меньшей мере 185°C, предпочтительно от 190 до 200°C в вакууме.
На стадии ii) в качестве подходящей форсунки можно использовать двухжидкостную форсунку.
Альтернативно можно преимущественно использовать другие типы форсунок, такие как ультразвуковой распылитель и ротационный распылитель.
Параметры, касающиеся типа форсунки, ее внутреннего диаметра, давления и скорости распыления, могут изменяться специалистом в данной области в зависимости от размера партии.
Как правило, для получения частиц носителя с заявленным размером частиц внутренний диаметр двухжидкостной форсунки составляет 1,2 мм и скорость распыления доводят до диапазона от 18,3 до 21,5 г/мин. Воздух в форсунке доводят до 5 л/мин, что соответствует давлению 0,44 бар.
Охлаждения капель на стадии iii) можно достигать с помощью температуры окружающей среды или с использованием охлаждающего воздуха в ходе распыления при температуре по меньшей мере от -10 до -20°C.
В некоторых устройствах можно проводить отверждение частиц распылением из расплава путем переливания капель в жидкий азот.
На стадии iv) частицы отделяют от потока газа, например, в циклоне и/или пакете для фильтрации.
Поскольку в ходе отверждения происходит образование метастабильной δ-формы маннита, частицы на стадии v) подвергают стадии кондиционирования для преобразования метастабильной формы в стабильную β-формы.
Преимущественно, стадию кондиционирования проводят путем воздействия на порошок при комнатной температуре в закрытой камере относительной влажности 90-97%, предпочтительно 93%, в течение 12-48 часов, предпочтительно 24 часов.
Среды с желаемой влажностью можно достигать насыщенным солевым раствором сульфата калия или нитрата калия, предпочтительно нитрата калия.
Мониторинг перехода из δ-формы в β-форму можно проводить посредством анализа DSC и или WAXS в соответствии с методиками, известными специалисту в данной области.
После конвертирования всей δ-формы в более стабильные полиморфы не наблюдают дальнейших изменений.
Широкоугольное рассеяние рентгеновских лучей (WAXS) можно использовать для определения кристалличности и полиморфных форм образцов порошка. Измерение следует проводить при комнатной температуре с использованием системы камеры с точечной фокусировкой S3 - камеры MICRO (Bruker AXS GmbH, Германия). Образцами необходимо заполнять стеклянные капилляры диаметром 2 мм и анализировать при постоянном вращении (9 об/мин) в течение 600 с при 30 импульсах/с.
Результаты WAXS после кондиционирования могут продемонстрировать исчезновение характерного для δ-формы пика Брэгга при приблизительно 22° и появление наиболее выраженного пика Брэгга для β-формы при приблизительно 23°. В этом случае можно сделать заключение, что выбранная методика кондиционирования была успешной для достижения желаемого перехода от δ к β-полиморфу.
Альтернативно для твердофазной охарактеризации можно использовать дифференциальный сканирующий калориметр (DSC 204F1 Phoenix®, Netzsch GmbH, Selb, Германия) со следующими параметрами.
- Масса образцов 10-12 мг (n=3)
- закрытые алюминиевые емкости с крышкой с отверстиями
- нагревание от 25 до 200°C при скорости нагрева 10°C/мин с использованием чистого азота в качестве газа для продувания при скорости потока 20 мл/мин.
Частицы маннита присутствуют по существу в кристаллической форме.
Преимущественно степень кристалличности, выражаемая в качестве масс.% кристаллических частиц относительно общей массы частиц, превышает 90%, предпочтительно превышает 95%.
Кристалличность и ее степень можно определять с использованием порошковой рентгенодифракции или других способов, известных специалистам в данной области, таких как дифференциальная сканирующая калориметрия (DSC), широкоугольное рассеяние рентгеновского излучения (WAXS) или микрокалориметрия.
Оказалось, что кондиционированные частицы носителя являются физически стабильными в течение по меньшей мере 6 месяцев при комнатной температуре, делая возможным предоставление стабильных фармацевтических составов.
Таким образом, изобретение также относится к фармацевтической композиции в форме сухого порошка для ингаляции, содержащей частицы носителя по изобретению в физической смеси с одним или несколькими активными ингредиентами.
Активный ингредиент может представлять собой практически любое фармацевтически активное соединение, которое можно вводить путем ингаляции в форме сухого порошка.
Чтобы активное вещество поддавалось ингалированию, т.е. могло проходить в глубокие области легкого, такие как терминальные и дыхательные бронхиолы и альвеолярные протоки и мешки, оно должно быть в форме частиц, имеющих средний диаметр частиц (измеренный в качестве массового среднего диаметра) не более чем приблизительно 10 микрометров, например, от 1 до 10 микрометров, и предпочтительно от 1 до 6 микрометров. Такие микронизированные частицы можно получать по существу известным способом, например, посредством микронизации, контролируемой преципитации из определенных растворителей, распылительной сушки, надкритических жидкостей или в соответствии со способами, описанными в WO 2004/073827, WO 2008/155570, WO 2008/114052 и WO 2010/007447.
Терапевтическое количество активного вещества может варьироваться в широком диапазоне в зависимости от природы активного вещества, типа и тяжести подвергаемого лечению состояния и состояния пациента, нуждающегося в лечении.
Как правило, частицы активного вещества добавляют к частицам носителя по изобретению путем смешения с использованием известных методик, предпочтительно в смесителе с высоким усилием сдвига.
Типичными смесителями с высоким усилием сдвига являются P 100 и P 300 (Diosna GmbH, Германия), Roto Mix (IMA, Италия) и CyclomixTM (Hosokawa Micron Group Ltd, Япония).
В частности, скорость вращения смесителя и время перемешивания могут корректироваться специалистом в данной области для достижения высокой однородности распределения активного ингредиента в составе.
Как правило, превосходной однородности распределения активных ингредиентов достигают в смесителе с высоким усилием сдвига при применении времени смешения по меньшей мере 5 минут и скорости 100-500 об/мин, предпочтительно в течение 20 минут при скорости 100-250 об/мин.
В качестве примера активные ингредиенты могут быть выбраны из бета2-агонистов короткого действия и длительного действия, таких как тербуталин, репротерол, сальбутамол, сальметерол, формотерол, кармотерол, милветерол, индакатерол, олодатерол, фенотерол, кленбутерол, бамбутерол, броксатерол, эпинефрин, изопреналин или гексопреналин или их соли и/или сольваты; антихолинэргетиков короткого действия и длительного действия, таких как тиотропиум, ипратропиум, окситропиум, оксибутинин, аклидиниум, троспиум, гликопирроний или соединения, известные под кодами GSK 573719 и GSK 1160274, в форме их солей и/или сольватов; бифункциональных соединений антагонистов мускариновых рецепторов-агонистов бета 2 (MABA) для ингаляции, таких как GSK 961081; ингибиторов эластазы нейтрофилов, таких как ONO-6818 и MK0339; ингибиторов map-киназы p38, таких как VX-702, SB-681323 и GW-856553; кортикостероидов короткого действия и длительного действия, таких как бутиксокарт, рофлепонид, флунизолид, будезонид, циклезонид, мометазон и его сложный эфир, т.е. фуроат, флукатизон и его сложный эфир, т.е. пропионат и фуроат, беклометазон и его сложный эфир, т.е. пропионат, лотепреднол или триамцинолона ацетонид и его сольватов; антагонистов лейкотриена, таких как андоласт, иралукаст, пранлукаст, имитродаст, сератродаст, зилеутон, зафирлукаст или монтелукаст; ингибиторы фосфодиэстеразы, такие как филаминаст, пикламиласт или рофлумиласт; ингибитора PAF, такого как апафант, рорапафант или исрапафант; болеутоляющих средств, таких как морфин, фентанил, пентазоцин, бупренорфин, петидин, тилидин или метадон; повышающих потенцию средств, таких как силденафил, алпростадил или фентоламин; или фармацевтически приемлемого производного или соли любого из вышеуказанных соединений или классов соединений. Когда любые из этих соединений обладают хиральными центрами, соединения можно использовать в оптически чистой форме, или они могут быть представлены в качестве диастереомерных смесей или рацемических смесей.
Сухие порошковые составы также могут содержать в качестве активных ингредиентов антибиотики, такие как ципрофлоксацин, левофлоксацин и колистин, тобрамицин, амикацин и гентамицин; белки, такие как инсулин и α1-антитрипсин; противовирусные средства, такие как занамивир и рибавирин; противогрибковые средства, такие как итраконазол, и ингибиторы фосфодиэстеразы (PDE)-5, такие как силденафил и тадалафил. Предпочтительно, сухие порошковые составы для ингаляции, содержащие частицы носителя по изобретению и один или несколько активных ингредиентов, выбранных из классов бифункциональных соединений антагонистов мускариновых рецепторов-агонистов бета 2 (MABA), ингибиторов эластазы нейтрофилов, ингибиторов map-киназы p38, кортикостероидов короткого действия и длительного действия и ингибиторов фосфодиэстеразы.
Концентрация активного ингредиента в порошковом составе зависит от массы порции состава, доставляемой при срабатывании ингалятора.
Например, учитывая ожидаемую однократную дозу 800 микрограмм, если масса порции состава, доставляемая при срабатывании ингалятора, составляет 10 мг, это будет соответствовать концентрации активного ингредиента 8% масс./масс.
Аналогично, для массы порции 20 мг концентрация активного ингредиента составляет 4% масс./об.
В предпочтительном варианте осуществления сухие порошковые составы, содержащие частицы носителя по изобретению, являются особенно пригодными для введения активных ингредиентов, подлежащих доставке, в однократных дозах на срабатывание ингалятора в диапазоне 800 микрограмм до 1 мг.
Хотя это и не является необходимым для достижения хороших характеристик аэрозоля, порошковый состав может дополнительно содержать фракцию тонких частиц, имеющих срединный объемный диаметр менее 20 микрометров, более преимущественно менее 15 микрометров, предпочтительно менее 10 микрометров.
Указанные тонкие частицы могут быть изготовлены из физиологически приемлемого эксципиента, как определено выше, и/или могут быть изготовлены из дополнительного материала, выбранного из класса антиадгезивов, таких как аминокислоты, например лейцин и изолейцин, или из класса смазывающих веществ, таких как стеарат магния; стеарилфумарат натрия, стеариловый спирт, стеариновая кислота и монопальмитат сахарозы.
В конкретном варианте осуществления тонкие частицы могут состоять из частиц физиологически приемлемого эксципиента и частиц добавки в любом соотношении, и их получают в соответствии с описанием WO 01/78695.
В другом варианте осуществления тонкие частицы могут состоять из смеси от 90 до 99,5 процентов по массе частиц моногидрата альфа-лактозы и от 0,5 до 10 процентов по массе стеарата магния, где по меньшей мере 90% указанных частиц имеют объемный диаметр менее 12 микрометров, и объемный срединный диаметр указанных частиц составляет от 4 до 6 микрометров.
Указанные тонкие частицы можно добавлять к составу и смешивать известными способами.
Сухой порошковый состав для ингаляции, содержащий частицы носителя по изобретению, можно использовать с любым ингалятором сухого порошка.
Ингаляторы сухого порошка можно в основном подразделить на: i) ингаляторы однократной дозы (единичной дозы), для введения единичных дробных доз активного соединения; ii) многодозовые ингаляторы с отмеренной дозой или резервуарные ингаляторы, предварительно загруженные количествами активного вещества, достаточными для более длительных курсов лечения.
Сухие порошковые составы могут быть предоставлены в единичной дозированной форме. Сухие порошковые композиции для местной доставки в легкие посредством ингаляции могут быть предоставлены в капсулах и кассетах, например, из желатина, или блистерах, например, из многослойной алюминиевой фольги, для применения в ингаляторе или инсуфляторе.
Сухой порошковый состав для ингаляции по изобретению является особенно пригодным для многодозовых ингаляторов сухого порошка, содержащих резервуар, из которого индивидуальные терапевтические дозировки могут быть отобраны при необходимости посредством приведения устройства в действие.
Предпочтительным многодозовым устройством является ингалятор, описанный в WO 2004/012801, в частности, со стр.1, первая строка, по стр.39, последняя строка.
Другими многодозовыми устройствами, которые можно использовать, являются, например, ELLIPTATM или DISKUSTM от GlaxoSmithKline, TURBOHALERTM от AstraZeneca, TWISTHALERTM от Schering и CLICKHALERTM от Innovata.
В качестве выпускаемых в продажу примеров устройств с однократной дозой могут быть упомянуты ROTOHALERTM от GlaxoSmithKline и HANDIHALERTM от Boehringer Ingelheim.
Следующие примеры подробно иллюстрируют изобретение.
Пример 1 - Получение частиц носителя на основе маннита по изобретению
Маннит Pearlitol 300DC приобретали от Roquette (Франция).
Использовали устройство для замораживания распылением, доступное от ProCepT (Бельгия).
Получали три различных образца (60 г, 2×500 г, содержавших 4 раза по 125 г).
Маннит нагревали при 200°C в вакууме до полного расплавления и распыляли через двухжидкостную форсунку с внутренним диаметром 1,2 мм с использованием охлаждающего воздуха в камере при температуре от -7°C до -10°C (устройство охлаждения с заданной температурой -20°C) в камеру для замораживания.
Полученные частицы (выход: приблизительно 45%) отделяли от потока газа в циклоне.
Образование δ-маннита в ходе замораживания распылением вызвало опасение в отношении стабильности конечных частиц. В действительности, δ-форма является метастабильным полиморфом маннита, который имеет 2 стабильных полиморфа (α и β). Испытание стабильности в течение одного месяца для выбранной замороженной распылением партии показало, что δ-форма обнаруживалась после конвертирования согласно WAXS в стабильную β- или α-форму с течением времени (фиг.3). Однако δ-форма может успешно конвертироваться в стабильный β-маннит с использованием стадии кондиционирования после замораживания распылением (24 ч при 93% RH, установленной с использованием насыщенного солевого раствора нитрата калия в закрытой камере) (фиг.4 и 5). Кондиционированный материал является стабильным вплоть до 6 месяцев (фиг.3).
Морфологию частиц исследовали с использованием сканирующего электронного микроскопа (SEM) (Zeiss Ultra 55, Zeiss, Oberkochen, Германия), работающего при 5 кВ. Образцы перед анализом помещали на углеродную ленту и на них напыляли золото-палладий (фиг.2).
Анализ коэффициента формы проводили следующим образом. Образец замороженного распылением порошка выделяли посредством градуированного шпателя (19 мм3 образца), аликвоту помещали в держатель образца Morphology G3 (визуализирующая система анализа с использованием оптической микроскопии, Malvern Morphology G3 Ver. 8.12) и распределяли на специализированном предметном стекле при контролируемом давлении (1 бар) с использованием специализированной распределяющей камеры. Анализ изображений проводили с использованием объектива 5x на выбранной области (округлая область с радиусом 25 мм) для гарантии измерения по меньшей мере 20000 частиц. Параметры измерения были установлены для получения индивидуальных частиц для анализа формы и любых аномалий взятия образцов, т.е. множество частиц было удалено фильтром программного обеспечения.
Коэффициент скругленности (RN) определяли с использованием уравнения RN=p2/4πA, где p представляет собой периметр и A представляет собой площадь. Коэффициент формы частиц (PSF) вычисляли с использованием программного обеспечения Morphology с использованием уравнения 1/RN (этот коэффициент называется HS Circularity согласно терминологии Malvern Morphology). Порошок имел однородную сферическую морфологию, продемонстрированную изображениями оптической микроскопии и SEM (фиг.2 и 6). Коэффициент формы частиц (PSF), определенный посредством анализа изображений ~40000 индивидуальных частиц, обеспечил среднюю величину 0,986 и подтвердил сферическую морфологию частиц.
Физическое состояние исследовали посредством WAXS при комнатной температуре с использованием системы камеры с точечным фокусированием S3 - камеры MICRO (Bruker AXS GmbH, Германия). Образцами заполняли стеклянные капилляры диаметром 2 мм и анализировали при постоянном вращении (9 об/мин) в течение 600 с при 30 импульсах/с.
Результаты WAXS указывают на то, что найденный паттерн пиков кондиционированного образца соответствует смеси полиморфов α и β (δ-маннит дает начало β-манниту), преимущественно α (Burger at al., Journal of Pharmaceutical Science, 2000, Energy/temperature diagram and compression behavior of the polymorphs of D-mannitol).
Охарактеризацию свойств тонких частиц проводили в соответствии со следующими способами.
Размер частиц определяли лазерной дифракцией с использованием линзы R1 (Sympatec HELOS). Образец порошка распределяли для двух условий измерения с использованием давления воздуха 0,5 и 3 бар, соответственно (Sympatec RODOS) и проводили взятие образцов со скоростью 5 м/с из дозирующего элемента с контролируемой температурой и влажностью (Sympatec ASPIROS). Средние величины d[v,10], d[v,50], d[v,90] измеряли посредством измерения в трех экземплярах.
Размах вычисляли с использованием следующего уравнения:
Размах= [d (v, 0,9) - d(v,0,1)]/d(v,0,5)
Удельную площадь поверхности частиц маннита исследовали с использованием Micromeritics Tristar II 3020 (Norcross, США). Все образцы подвергали вакуумной сушке в течение двух суток при 25°C с использованием дегазирующего элемента Micromeritics VacPrep 061 (Norcross, США). Измерение проводили с использованием изотерм адсорбции и десорбции азота при температуре жидкого N2 (-196°C); для вычисления удельной площади поверхности использовали теорию адсорбции Брунауэра, Эммета и Теллера (BET) (Emmett, 1936), с использованием диапазона давлений 0,05-0,30, нормализованного к насыщающему давлению адсорбата.
Использовали 1,5 г порошка, что приводило к коэффициентам корреляции BET выше 0,999, что указывает на применимость способа. Каждое измерение проводили в трех повторениях.
Истинную плотность определяли посредством гелиевой пикнометрии (AccuPyc II 1340, Micromeritics, США). Образцы порошка аккуратно взвешивали, и их объем измеряли в течение пяти последовательных пусков с использованием 20 продуваний газом при 19,5 фунт/кв. дюйм (134,5 кПа) и скорости уравновешивания 0,005 фунт./кв. дюйм/мин (34,5 Па/мин). Плотность частиц вычисляли в качестве соотношения массы и объема образцов.
Характеристики трех партий представлены в таблице 1.
Таблица 1
|
Пример 2 - Получение составов, содержащих частицы носителя по изобретению
Соединение 1-(S)-1-[(3-циклопропилметокси-4-дифторметокси)фенил]-2-[(3,5-дихлор-1-окси)-4-пиридинил]этиловый эфир 3-циклопропилметокси-4-[(метансульфонил)-амино]бензойной кислоты, далее упоминаемой как CHF 6001, получали способом, описанным в WO 2010/089107.
Частицы маннита получали, как описано в примере 1.
Составы CHF 6001 (размер партии 25 г), содержавшие 4% масс./масс. лекарственного средства, получали путем смешения в смесителе с высоким усилием сдвига (Hosokawa Lab Cyclomix, Япония) в течение 20 мин при 100 об/мин или 250 об/мин.
Однородность полученных смесей проверяли в конце процедуры смешения. Для каждого состава десять образцов (от 20 до 60 мг каждый) собирали из различных точек слоя порошка. Каждый образец растворяли в 50 мл соответствующего растворителя (CH3CN/вода, раствор 60:40 об./об.) и проводили количественное определение лекарственных средств посредством ВЭЖХ-УФ.
За однородность принимали коэффициент вариаций (вычисленный в качестве процента отношения стандартного отклонения к средней величине для десяти измерений) ниже 5%. Результат анализа выражают в качестве % относительно теоретического заявленного содержания.
Результаты представлены в таблице 2.
Таблица 2.
|
Пример 3 - Аэродинамические характеристики in vitro
Порошковый состав согласно примеру 3 охарактеризовывали с точки зрения характеристик аэрозоля после загрузки в многодозовый ингалятор сухого порошка, описанный в WO 2004/012801, и известный как NEXThaler®. Средняя масса выброса состава зависит от плотности порошка, и для этого состава она составляет приблизительно 20 мг. Номинальная дозировка в тестируемом составе (нагрузка лекарственным средством 4% масс./масс.) соответствует 800 мкг/выброс 20 мг.
Аэродинамическую оценку in vitro проводили с использованием импактора Next Generation Impactor (NGI, Copley Scientific, Великобритания), оборудованного отверстием для индукции USP, пресепаратором, семью ступенями уплотнения и конечным коллектором с микроотверстиями.
После завершения сборки NGI подсоединяли к вакуумному насосу (и измеряли скорость потока через импактор с использованием массового расходомера).
Критический поток (соотношение P3/P2) составлял ≤ 0,5 при скорости потока для взятия образцов 60 мл/мин.
После подсоединения устройства к импактору через воздухонепроницаемый резиновый патрубок, вакуумный насос активировали при скорости потока 60 л/мин в течение 4 секунд, так чтобы через устройство забиралось 4 л воздуха согласно Ph. Eur. 8.0, 2.9.18.
Лекарственное средство CHF 6001, депонированное в каждой ячейке импактора, извлекали из NGI с использованием растворителя CH3CN:H2O (60:40% об./об.), подаваемого в отверстие для индукции (в том числе патрубок -50 мл), пресепаратор (100 мл) и каждую ячейку (10 мл). Все образцы анализировали посредством ВЭЖХ-УФ.
Аэродинамическое распределение размера частиц было основано на 2 срабатываниях из NEXThaler®, многодозового устройства, описанного в WO 2004/012801, и, в частности, со стр.1, первая строка, по стр.39, последняя строка), в каждом случае взятие образцов проводили в 4 литра воздуха (эквивалентно времени ингалирования 4 с).
Аэродинамические характеристики оценивали путем вычисления:
- выпускаемой дозы (ED), получаемой в качестве суммы частей лекарственного средства, извлеченных во всех частях импактора, выраженной в мкг, и его процента относительно номинальной дозы;
- массы тонких частиц (FPM), а именно количества лекарственного средства с пороговым диаметром ниже 5 мкм, вычисленного посредством интерполяции согласно Европейской фармакопее (Ph. Eur. 8.0, 2.9.18.) и выраженного в мкг;
- фракции тонких частиц (FPF), вычисленной в качестве отношения FPM к ED, выраженного в качестве процента;
- среднего массового аэродинамического диаметра (MMAD), вычисленного в качестве срединного значения распределения массы взвешенных в воздухе частиц относительно аэродинамического диаметра.
Результаты характеристик аэрозоля представлены в таблице 3.
Таблица 3.
|
Как может быть понятно, хороших характеристик аэрозоля достигали для всех препаратов, причем FPF значительно превышала 40%.
Были достигнуты превосходные величины с точки зрения процентов испускаемых доз.
Сходные результаты, касающиеся процента испускаемой дозы, были достигнуты путем замены CHF 6001 на беклометазона дипропионат в той же номинальной дозе на выпуск (800 мкг/20 мг).