Результат интеллектуальной деятельности: ШТАММ МИКРОВОДОРОСЛИ Lobosphaera (Parietochloris) sp. - ПРОДУЦЕНТ АРАХИДОНОВОЙ КИСЛОТЫ
Вид РИД
Изобретение
Область применения
Изобретение относится к фотобиотехнологии и представляет собой новый штамм микроводоросли Lobosphaera (Parietochloris) sp. NAMSU-005/2, предназначенный для получения арахидоновой кислоты.
Уровень техники
Известно, что зеленая микроводоросль Lobosphaera (Parietochloris) incisa относится к группе экстремотолерантных фототрофных одноклеточных эукариот, способных при неблагоприятных условиях внешней среды [Zorin, B., et al. (2017). "Arachidonic acid is important for efficient use of light by the microalga Lobosphaera incisa under chilling stress." Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids 1862(9): 853-868], а также конститутивно накапливать в липидах клеток (преимущественно в составе запасных нейтральных липидов) ценной полиненасыщенной арахидоновой кислоты [Bigogno, C., et al. (2002). "Lipid and fatty acid composition of the green oleaginous alga Parietochloris incisa, the richest plant source of arachidonic acid." Phytochemistry 60(5): 497-503].
Арахидоновая кислота — ценная полиненасыщенная жирная кислота, содержащая 20 атомов углерода с 4 двойными связями в составе углеродного скелета. Данное соединение является важным компонентом пищевых и кормовых добавок. Особенно важно поступление арахидоновой кислоты в организм младенцев и детей, которым она необходима для полноценного развития нервной системы. Особенно важно присутствие арахидоновой кислоты в смесях для искусственного вскармливания [Hansen, J., et al. (1997). "Docosahexaenoic acid plus arachidonic acid enhance preterm infant growth." Prostaglandins Leukot Essent Fatty Acids 57: 196; Crawford, M., et al. (2003). "The potential role for arachidonic and docosahexaenoic acids in protection against some central nervous system injuries in preterm infants." Lipids 38(4): 303-315]. Метаболиты каскада арахидоновой кислоты также играют важную роль в передаче сигналов в клетках организма [Levin, G., et al. (2002). "Differential metabolism of dihomo-γ-linolenic acid and arachidonic acid by cyclo-oxygenase-1 and cyclo-oxygenase-2: implications for cellular synthesis of prostaglandin E1 and prostaglandin E2." Biochem. J 365: 489-496]. В практике аквакультуры арахидоновая кислота является ценной кормовой добавкой, повышающей выживаемость и иммунный статус молоди рыб [Bell, J. G. and J. R. Sargent (2003). "Arachidonic acid in aquaculture feeds: current status and future opportunities." Aquaculture 218(1–4): 491-499].
В настоящее время известны штаммы гриба Mortierella alpina — перспективные продуценты арахидоновой кислоты [Jareonkitmongkol, S., et al. (1992). "Fatty acid desaturation-defective mutants of an arachidonic-acid-producing fungus, Mortierella alpina 1S-4." Microbiology 138(5): 997-1002]. Отдельные штаммы этого гриба, такие как выделенный из ризосферы озимой пшеницы штамм ВКПМ F-1134 [RU2596922, 27.01.2015], накапливает арахидоновую кислоту в количестве до 50% суммы жирных кислот липидов клеток. Однако для культивирования грибов требуются среды, содержащие источник органического углерода, и, как следствие поддержание строго асептических условий культивирования, что дорого и непрактично при больших объемах производства. В этой связи наиболее перспективным биотехнологическим источником арахидоновой кислоты является вышеупомянутая зеленая одноклеточная водоросль Lobosphaera (Parietochloris) incisa. Известно, что в условиях стресса (дефицит связанного азота в среде культивирования) данный организм способен накапливать до 30–35% арахидоновой кислоты от суммы жирных кислот липидов клеток [Bigogno, C., et al. (2002). "Accumulation of arachidonic acid-rich triacylglycerols in the microalga Parietochloris incisa (Trebuxiophyceae, Chlorophyta)." Phytochemistry 60(2): 135-143; Cheng-Wu, Z., et al. (2002). "Characterization of growth and arachidonic acid production of Parietochloris incisa comb. nov (Trebouxiophyceae, Chlorophyta)." Journal of Applied Phycology 14(6): 453-460]. При этом снижается продуктивность культуры по биомассе клеток, высокая при культивировании на полной среде [Khozin-Goldberg, I., et al. (2002). "Nitrogen starvation induces the accumulation of arachidonic acid in the freshwater green alga Parietochloris incisa (Trebuxiophyceae)." Journal of Phycology 38(5): 991-994], но сопровождающаяся снижением доли арахидоновой кислоты в сумме жирных кислот [Cheng-Wu, Z., et al. (2002). "Characterization of growth and arachidonic acid production of Parietochloris incisa comb. nov (Trebouxiophyceae, Chlorophyta)." Journal of Applied Phycology 14(6): 453-460]. Было показано, что максимальное содержание арахидоновой кислоты в культурах Lobosphaera (Parietochloris) incisa достигается именно при снижении скорости деления клеток, т.е. на стационарной фазе роста культуры [Jian-Guo, L., et al. (2002). "Fatty acids profile in a high cell density culture of arachidonic acid-rich Parietochloris incisa (Trebouxiophyceae, chlorophyta) exposed to high PFD." Chinese Journal of Oceanology and Limnology 20(2): 149-156]. При этом стресс, вызванный высокой интенсивностью света, приводит к снижению содержания арахидоновой кислоты [Merzlyak, M., et al. (2006). Effects of light and nitrogen availability on growth and accumulation of arachidonic acid in the microalga Parietochloris incisa. Industrial application of biotechnology. I. Krylov and G. Zaikov. Happauge. NY, Nova Science Pub Inc: 9-16; Solovchenko, A., et al. (2008). "Effects of light intensity and nitrogen starvation on growth, total fatty acids and arachidonic acid in the green microalga Parietochloris incisa." Journal of Applied Phycology 20(3): 245-251].
Известен способ получения арахидоновой кислоты путем щелочного гидролиза морской красной водоросли рода Gracilaria с подкислением гидролизата, удалением насыщенных жирных кислот в виде Li-солей, концентрированием арахидоновой кислоты методом высокоэффективной жидкостной хроматографии на обращенной фазе С-18 с использованием элюирующей системы этанол-вода при соотношении 8,0: (1,0-2,5) об./об [RU2620164, 23.05.2017]. Способ обеспечивает получение арахидоновой кислоты с высоким выходом и чистотой, позволяющей использовать её в биохимических, медицинских и диетологических исследованиях. Однако сырьем для получения арахидоновой кислоты этим способом является биомасса морской макрофитной водоросли, запасы которой ограничены, а сбор сложен и дорог.
Известен штамм гриба Mortierella alpina ВКПМ F-1134 для производства комплекса жирных кислот с преобладанием арахидоновой кислоты, проявляющего рострегулирующий эффект по отношению к растениям [RU2596922, 10.09.2016]. Штамм выделен из ризосферы озимой пшеницы, выращиваемой в Иглинском районе республики Башкортостан. Штамм синтезирует комплекс жирных кислот, обладающих физиологической активностью по отношению к растениям, среди которых не менее 50% по массе арахидоновой кислоты. Недостатком использования предложенного штамма гриба для получения арахидоновой кислоты является высокая стоимость полученной биомассы.
Также известен способ получения арахидоновой кислоты из биомассы зеленой микроводоросли рода Euglena путем ее миксотрофного культивирования [US2015044738, 12.02.2015]. Недостатком этого способа является необходимость использования среды, обогащенной органическим углеродом, что усложняет и удорожает культивирование. Южнокорейскими оригинаторами недавно описан штамм К-1 Parietochloris incisa [KR20190136190, 10.12.2019], однако авторы не указывают продуктивность данного штамма по арахидоновой кислоте.
Основными недостатками перечисленных выше штаммов является отсутствие способности к одновременному накоплению значимых количеств арахидоновой кислоты и поддержания высокой скорости роста культуры на минеральной среде, обеспечивающей высокий выход целевого продукта.
Наиболее близким аналогом является штамм микроводоросли Parietochloris incisa, у которого накопление арахидоновой кислоты составляет 21% от суммы жирных кислот при культивировании на полной среде, обеспечивающей высокую скорость накопления биомассы (Cheng-Wu, Z., et al. (2002). "Characterization of growth and arachidonic acid production of Parietochloris incisa comb. nov (Trebouxiophyceae, Chlorophyta)." Journal of Applied Phycology 14(6): 453-460). Недостатком аналога является недостаточно высокий уровень накопления арахидоновой кислоты при культивировании на полной среде и низкая скорость накопления биомассы культурой (< 0,5 г/л/сут.) в условиях азотного голодания, необходимого для индукции накопления арахидоновой кислоты этим штаммом.
Раскрытие изобретения
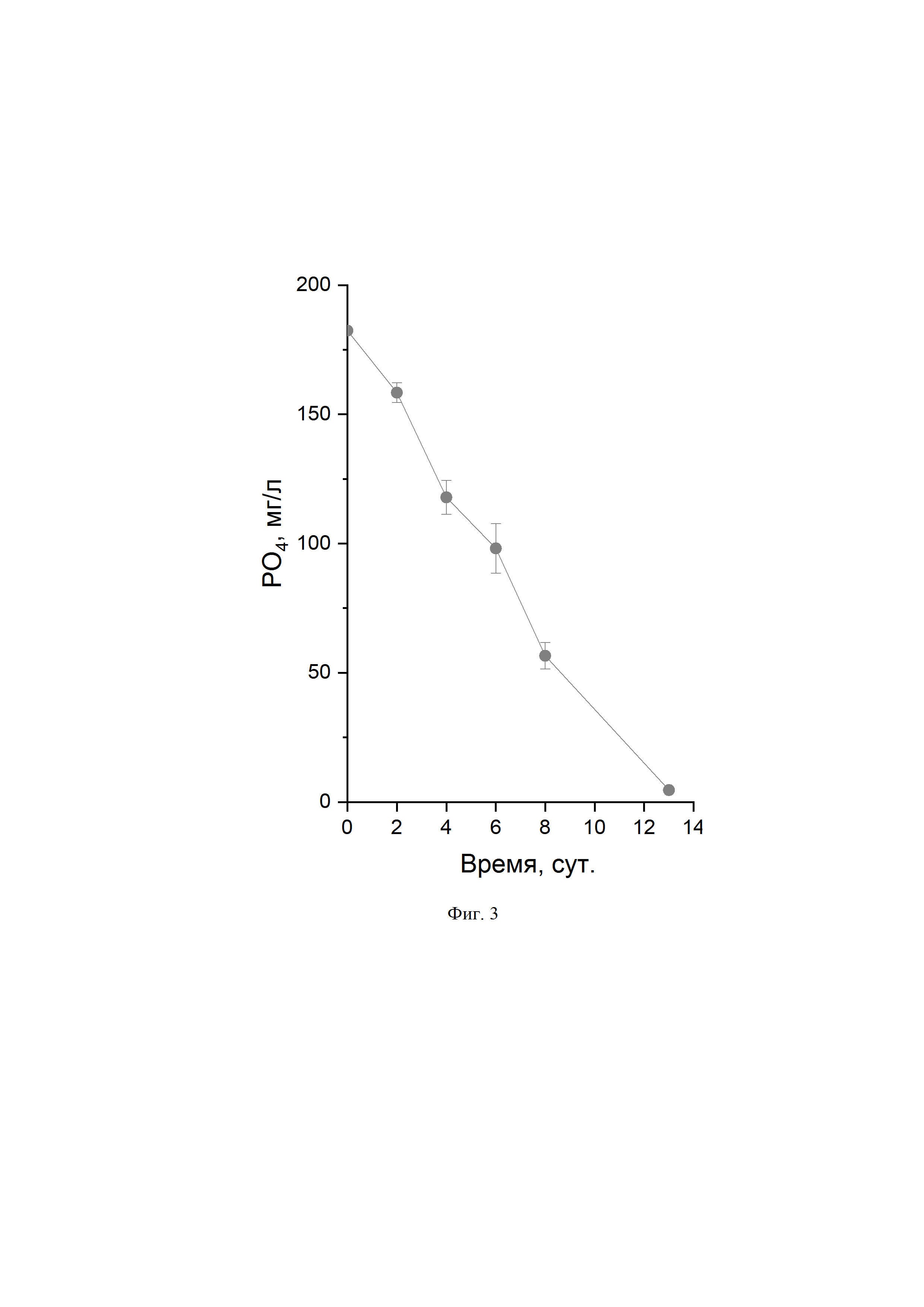
Техническим результатом заявляемого изобретения является получение штамма микроводоросли с высоким уровнем накопления арахидоновой кислоты (не менее 31 масс.% от суммы жирных кислот липидов клеток) и сохранении высокой продуктивности культуры по арахидоновой кислоте (не менее 0,15 г/л культуры/сут. или 1,42 г сухой биомассы/л культуры/сут. (при расчете по логарифмической фазе роста; фиг. 1, 2), содержащей не менее 34% суммы жирных кислот от веса сухой биомассы за 7 суток культивирования и поглощение не менее 3,5 мг фосфора в сутки (фиг. 3) при культивировании на полной минеральной среде, обеспечивающей высокую скорость накопления биомассы.
Технический результат достигается штаммом микроводоросли Lobosphaera (Parietochloris) sp. NAMSU-005/2, выделенного на Дальнем Востоке в Российской Федерации из временного водоёма (лужи) в г. Якутске (62°1′N, 129°42′15″E), депонированного в Российской коллекции микроводорослей при учреждении «Институт физиологии растений им. К.А. Тимирязева Российской академии наук» (IPPAS) с присвоенным идентификатором IPPAS С-2047.
Впервые был получен штамм микроводоросли, способный к высокому уровню накопления арахидоновой кислоты, обеспечивающий высокую продуктивность при выращивании, обладающий этой способностью при культивировании на полной среде, в то время как остальные штаммы накапливают высокие количества арахидоновой кислоты только при выращивании на безазотной среде, что препятствует достижению высокой продуктивности культуры.
Полученный штамм характеризуется высокой способностью к накоплению арахидоновой кислоты (31–34 масс.% от суммы жирных кислот при культивировании на полной среде), при этом сумма жирных кислот оценивается в 34–38 % сухого веса, культура обладает высокой продуктивностью по арахидоновой кислоте (0,15–0,19 г/л культуры/сут.), а также, по накоплению биомассы (1,42–1,46 г/л культуры/сут.) при культивировании на полной среде.
Для культивирования культуры микроводоросли Lobosphaera (Parietochloris) sp. штамм NAMSU-005/2 используют питательную среду BG-11 [Stanier, R., et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Microbiology and Molecular Biology Reviews. 1971, 35(2): 171-205]. Инокулят вносят в среду до конечной концентрации хлорофилла 7–10 мкг/мл, культивирование проводят в фотобиореакторе при постоянном освещении с интенсивностью 200 мкмоль квантов/м2/с с помощью светодиодов (4700 К), при температуре 22–25ºС и барботировании среды газо-воздушной смесью с содержанием СО2 1,5–2% со скоростью 0,8–1,2 л/мин. Значение рН среды в начале культивирования — 6,5–7,0 в конце культивирования — 7,5–8,0. После этого отделяют биомассу от среды центрифугированием.
В результате получают в сутки 1,42 – 1,44 г сухой биомассы, содержащей 0,15–0,19 г арахидоновой кислоты в сутки с 1 л культуры, при этом биомасса содержит 34–38 % жирных кислот, в которой доля арахидоновой кислоты 31–34 масс.% от суммы жирных кислот.
Краткое описание чертежей
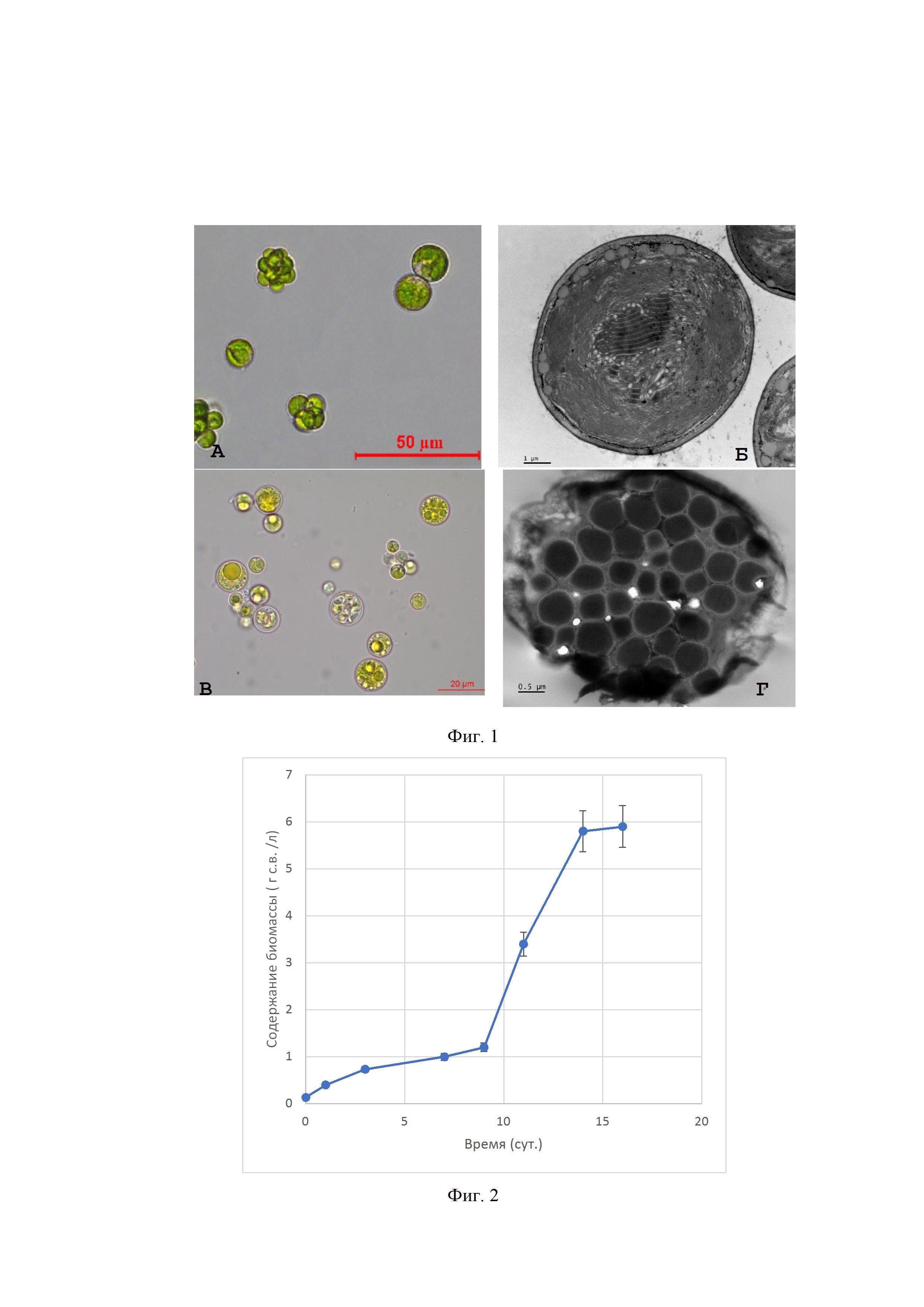
На Фиг. 1 представлены микрофотографии клеток микроводоросли Lobosphaera (Parietochloris) sp., штамм NAMSU-005/2, выращенные в оптимальных для вегетативного роста условиях (А, Б) и в стрессовых условиях (В, Г).
На Фиг. 2 показана типичная кривая роста культуры Lobosphaera (Parietochloris) sp., штамм NAMSU-005/2, зарегистрированная по накоплению сухой биомассы, выраженная в граммах веса сухой биомассы на литр объема культуры.
На Фиг. 3 показана динамика остаточного содержания неорганического фосфата в среде культивирования Lobosphaera (Parietochloris) sp., штамм NAMSU-005/2.
На Фиг. 4 показаны филогенетические взаимоотношения штамма микроводоросли NAMSU-005/2 и таксономически близких штаммов, основанные на анализе и сопоставлении частичной последовательности гена 18S pРНК.
Осуществление изобретения
Штамм Lobosphaera (Parietochloris) sp. NAMSU-005/2 выделен из временного водоёма на Дальнем Востоке России, г. Якутск (62°1′N, 129°42′15″E). Отселектирован в результате скрининга по способности к биосинтезу арахидоновой кислоты.
Способ выделения — из накопительной культуры, получен путем рассева полученного штамма на минеральной среде BG-11 (с добавлением антибиотиков) и последующими пересевами с разведением на твердой среде BG-11, содержащей 1.5% агара, из единичных колоний.
Морфологические признаки
Характер роста на среде хранения: гомогенный, на поздних стадиях возможна агрегация. Неподвижные одиночные сферические коккоидные вегетативные клетки — 6–15 мкм. Клеточная стенка характеризуется формированием эпиструктур (бородавок, тяжей), формирующие войлочный слой. Пластидом вегетативных клеток — один крупный двулопастной хлоропласт, окружённый двумя мембранами и имеющий хорошо развитую систему тилакоидов в строме. Пиреноид один, крупный, Запасные включения представлены в основном крахмальными зернами, которые откладываются, как правило, вокруг пиреноида в виде не изолирующей фрагментированной крахмальной обкладки, а также в виде межтилакоидных зерен, расположенных диффузно в строме. Ядро одно, крупное, центральное. Одно ядрышко. Размножение — вегетативное (митотическое деление с образованием двух дочерних клеток); бесполое: автоспорангиями с 16–32 полностью сформированными дочерними вегетативными клетками — автоспорами; зооспорангии с зооспорами яйцевидной или грушевидной формы с двумя изоконтными жгутиками на апикальном конце.
Особенности морфологии в условиях, обеспечивающих максимальный выход продукта.
Клетки приобретают желтую окраску. Наблюдается редукция фотосинтетического аппарата, проявляющееся увеличением межтилакоидного пространства. Формируются липидные глобулы.
Физиологические свойства штамма
Оптимальные условия культивирования:
Для культивирования используют жидкую питательную среду BG-11 [Stanier, R. et al. Purification and properties of unicellular blue-green algae (order Chroococcales). Microbiology and Molecular Biology Reviews. 1971, 35(2): 171-205], готовится из стоковых растворов; все компоненты можно автоклавировать.
Среда BG-11 следующего состава:
K2HPO4 – 0,04 г/л, NaNO3 – 0,3 г/л, MgSO4·7H20 – 0,075 г/л,
CaCl2·2H20 – 0,036 г/л, лимонная кислота – 0,006 г/л,
FeSO4·7H20 – 0,006 г/л, Na2CO3 – 0,2 г/л, ЭДТА – 0,001 г/л,
раствор FeSO4·7H20 (7,45 г/л) + ЭДТА (5,57 г/л) – 1 мл/л,
раствор микроэлементов (H3BO3 – 2,86 г/л, MnCl2·4H20 – 1,86 г/л, ZnSO4·7H20 – 0,22 г/л, CuSO4·5H20 – 0,08 г/л, Na2MoO4·7H20 – 0,39 г/л, Co(NO3)2·6H20 – 0,05 г/л) – 1 мл/л,
pH в начале культивирования – 7,5 -8,0
pH в конце культивирования 7,0–7,2
содержание СО2 в ГВС – 2–5%, скорость барботажа 0,8-1,2 л/мин
температура 26-28°С
освещение круглосуточное, освещённость 200 моль квантов /м2/сек
тип ламп: светодиодные, 4700 К
Продуктивность в оптимальных условиях культивирования:
по накоплению биомассы (сухой вес, г/л в сутки): 1,42–1,44;
выход полезного продукта: сумма жирных кислот оценивается в 34–38% веса сухих клеток, продуктивность по арахидоновой кислоте 0,15–0,19 г в сутки с 1 л культуры.
Биотехнологическая характеристика штамма.
Штамм микроводоросли Lobosphaera (Parietochloris) sp. штамм NAMSU-005/2, депонированный в Российской коллекции микроводорослей при учреждении «Институт физиологии растений им. К.А. Тимирязева Российской академии наук» (IPPAS) с присвоенным идентификатором IPPAS С-2047, продуцент арахидоновой кислоты с выходом 31–34 масс.% от суммы жирных кислот липидов клеток, которая составляет 34–38% от веса сухой биомассы, при продуктивности по биомассе 1,42–1,44 г в сутки с 1 л культуры, способный к биоизъятию фосфатов из среды со скоростью 3,5–3,7 мг/л/сут.
Условия культивирования, обеспечивающие максимальный уровень (выход) полезного свойства (продукта): достаточно яркое освещение — 200–250 моль квантов/м2/с при культивировании не менее 14 суток на среде с полным набором питательных веществ.
Генотипирование
Выделение ДНК
Для выделения ДНК отбирают 5–10 мг биомассы культуры микроводоросли. Выделение ДНК проводят методом фенол-хлороформной экстракции. Перед выделением проводят трехкратное замораживание образцов при –4°С с последующим оттаиванием. Это необходимо для разрушения прочных клеточных стенок водорослей. Образцы инкубируют в течение часа в 300 мкл TE буфера (10 mM Tris-Cl (pH 7.5), 1 mM EDTA), содержащего 10 мг/мл лизоцима при 37°С. Затем добавляют 2% додецилсульфата натрия и инкубируют в течение часа при 40°С и интенсивном перемешивании. Далее добавляют 1 М NaCl и оставляют на ночь на льду для высаливания белков. После чего проводят процедуру фенол-хлороформной экстракции. Чистоту образцов ДНК оценивают методом электрофореза в 1,5% агарозном геле. Полученные образцы ДНК хранят в ТЕ-буфере при –4°С.
Анализ жирных кислот
К осажденным центрифугированием при 3000 g в течение 15 мин клеткам добавляют смесь хлороформа и метанола (2:1 по объему), гомогенизируют в гомогенизаторе "стекло-тефлон", к гомогенату добавляют воду (1/5 объемную часть), перемешивают и центрифугируют при 3000 g в течение 15 мин до разделения фаз, экстракцию повторяют до обесцвечивания осадка. Хлороформные фазы экстрактов объединяют, при необходимости упаривают на роторном испарителе. Суммарные липиды клеток в хлороформной фазе экстрактов переметилируют путем инкубации с 2% H2SO4 в метаноле в течение 1.5 ч при 80ºС в присутствие 0,01% 2,6-ди-трет-бутил-4-метилфенола, в качестве антиоксиданта. В качестве внутреннего стандарта к образцам добавляют гептадекановую (С17) кислоту. Метиловые эфиры экстрагируют n-гексаном и сразу же используют для ГХ-МС-анализа на газовом хроматографе, оснащенном капиллярной колонкой (длина 30 м, диаметр — 0,25 мм) и масс-селективным детектором.
Определение остаточного содержания неорганического фосфата в среде.
Остаточное содержание фосфора (в виде неорганического фосфата) в среде культивирования определяют методом ионообменной высокоэффективной жидкостной хроматографии (ВЭЖХ). Для этого культуральную жидкость отделяют от клеток центрифугированием либо фильтрацией через специальные фильтры. Для анализа берут надосадочную жидкость или фильтрат, при необходимости их разбавляют дистиллированной водой.
Филогенетический анализ
Филогенетические взаимоотношения штамма NAMSU-005/2 и близких штаммов оценивают по сходству частичной последовательности гена 18S pРНК. Представленное филогенетическое дерево получено методом NJ (Фиг. 4). Филогенетический анализ проведен в программе BioNJ. Визуализация проведена в программе TreeDyn 198.3. Процент репликативных деревьев, в которые были объединены таксоны в бустрап-тесте показаны рядом ветками.
В результате проведенного филогенетического анализа установлена родовая принадлежность исследуемого изолята. Изолят идентифицирован как Lobosphaera sp. и получил идентификатор NAMSU-005/2; после депонирования в Российской коллекции микроводорослей при учреждении «Институт физиологии растений им. К.А. Тимирязева Российской академии наук» (IPPAS) ему присвоен идентификатор IPPAS С-2047.
Штамм микроводоросли Lobosphaera (Parietochloris) sp. NAMSU-005/2 демонстрирует высокую способность к накоплению высоких количеств арахидоновой кислоты при высоких темпах накопления биомассы во время культивирования на среде с полным набором питательных веществ, что не встречается у известных аналогов. Накопление арахидоновой кислоты составляет 31–34 масс. % от суммы жирных кислот липидов клеток, которая составляет 34–38% от веса сухой биомассы что на в 0,63 раза превосходит аналогичный показатель у известного прототипа. Штамм NAMSU-005/2 сохраняет высокую продуктивность по биомассе (1,42–1,44 г в сутки с 1 л культуры) и одновременную способность к биоизъятию фосфатов из среды со 3,5–3,7 мг/л/сут., что соответствует уровню известных аналогов, не способных к одновременному накоплению арахидоновой кислоты.
Штамм микроводоросли Lobosphaera (Parietochloris) sp. NAMSU-005/2 успешно прошел предварительное тестирование и этап пробного культивирования в экспериментальных и полупромышленных фотобиореакторах объемом до 50 л. Таким образом, можно считать степень готовности штамма к масштабированию культуры для промышленного применения высокой.
В результате получен штамм микроводоросли Lobosphaera (Parietochloris) sp. NAMSU-005/2, депонированный в Российской коллекции микроводорослей при учреждении «Институт физиологии растений им. К.А. Тимирязева Российской академии наук» (IPPAS) с присвоенным идентификатором IPPAS С-2047, который обладает высоким уровнем накопления арахидоновой кислоты, сохраняющий высокую продуктивность при выращивании, обладающий способностью к одновременному биоизъятию фосфатов из среды.
Штамм микроводоросли () sp.NAMSU-005/2, депонированный в Российской коллекции микроводорослей при учреждении Институт физиологии растений им. К.А. Тимирязева Российской академии наук (IPPAS) с присвоенным идентификатором IPPAS С-2047, - продуцент ценной полиненасыщенной жирной кислоты - арахидоновой кислоты, обладающий способностью к одновременному поглощению фосфатов из среды.