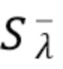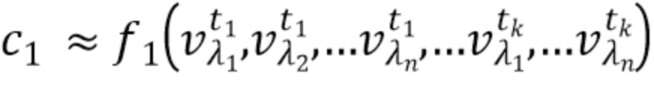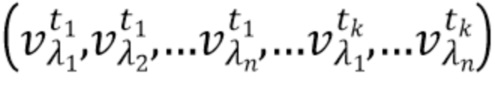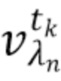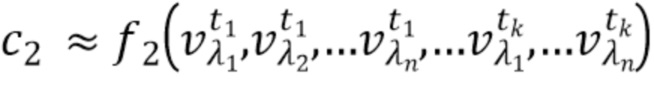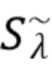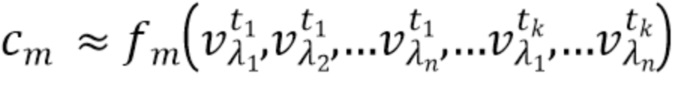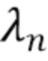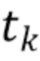Результат интеллектуальной деятельности: ПОРТАТИВНОЕ УСТРОЙСТВО И СПОСОБ ДЛЯ НЕИНВАЗИВНОГО ИЗМЕРЕНИЯ ЭЛЕМЕНТОВ КРОВИ
Вид РИД
Изобретение
Область техники
Изобретение относится к устройствам и способам неинвазивного измерения элементов крови, а именно к средствам неинвазивного, персонального и/или по требованию или запросу мониторинга состояния здоровья субъекта, в частности мониторинга и измерения параметров крови. Указанные устройства могут использоваться в портативных измерительных устройствах, ручных часах, так называемых умных часах, стационарных диагностических приборах, бытовых измерительных устройствах и гаджетах персонального контроля здоровья.
Описание предшествующего уровня техники
C ростом популярности портативных измерительных устройств для мониторинга состояния здоровья субъекта, вырос спрос на компактные средства неинвазивного, персонального и/или по требованию или запросу мониторинга состояния здоровья субъекта, в частности мониторинга измерения концентрации различных форм гемоглобина Hb: оксигенированного Hb, деоксигенированного Hb, мет-Hb, карбокси-Hb и других свойств крови.
Основным требованием к данным устройствам является высокая точность измерений, высокая чувствительность к изменениям измеряемых параметров, небольшая чувствительность к изменениям условий измерения (артефактам движения), при одновременном требовании к компактности устройств и возможности выполнения измерений в реальном времени.
Таким образом, задача настоящего изобретения, с точки зрения конструкции устройства измерения компонентов крови, состоит в том, чтобы предоставить компактное переносное устройство способное обеспечить высокое спектральное разрешение и, соответственно, высокую точность измерения, обеспечивающее надежное и устойчивое к любым движениям при процессе измерения, решение для использования в портативных потребительских гаджетах и подобных устройствах.
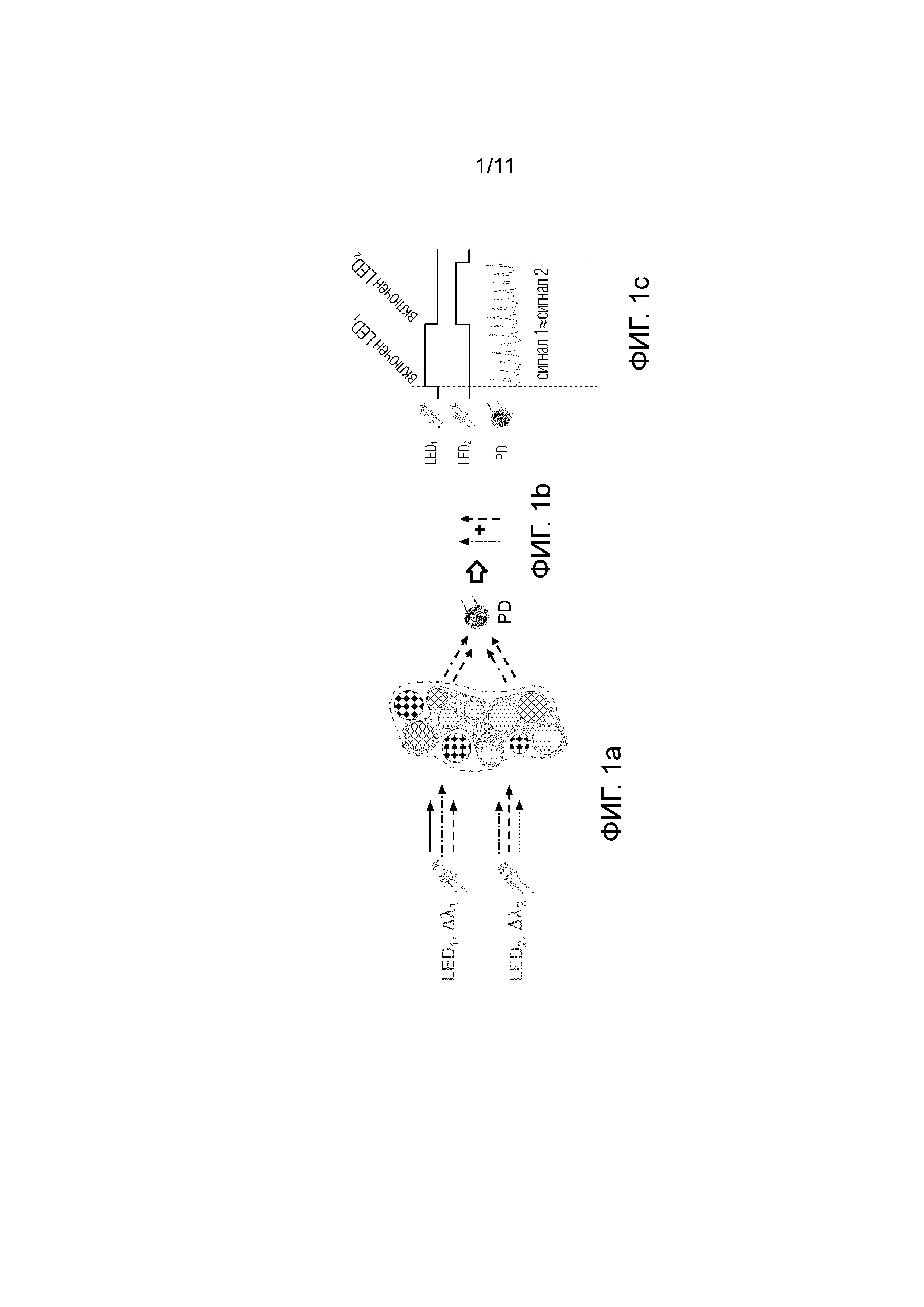
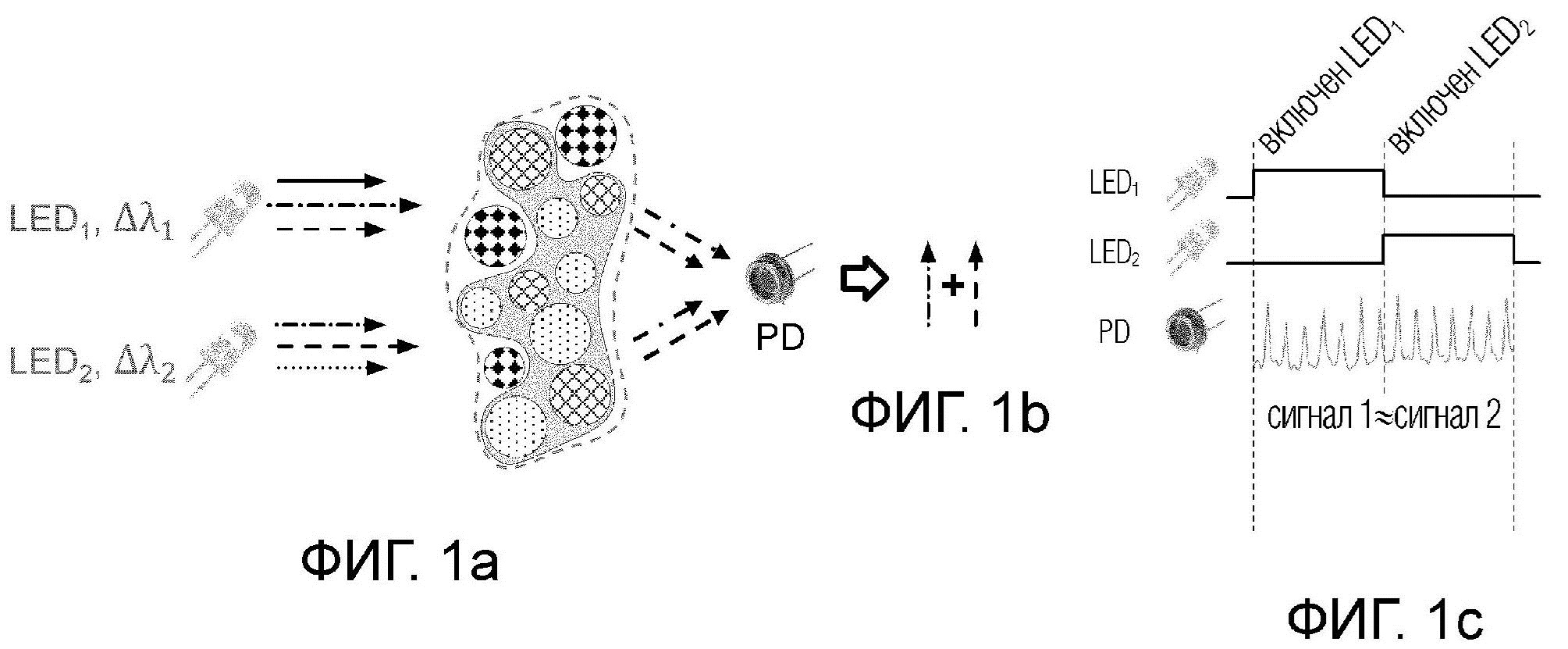
Известные в уровне техники аналогичные решения основаны на следующих принципах, которые будут описаны со ссылкой на фиг.1а, 1b и 1с.
Целевой участок субъекта облучается несколькими источниками излучения, в данном случае широкополосными светодиодами: LED1 и LED2 каждый со своим диапазоном длин волн: LED1 соответствует Δλ1,
а LED2 соответствует Δλ2.
При этом исследуемые компоненты участка субъекта, подлежащего мониторингу, условно разделяются на целевые компоненты, в которые входят эритроциты, кровь, и нецелевые компоненты, содержащие другие компоненты, ткань, хромофоры и т.д. После прохождения через целевой участок субъекта, и, соответственно, через целевые и нецелевые компоненты, см. фиг.1а, пучки излучения от разных светодиодов претерпевают изменения.
При этом оптическое излучение взаимодействует как с целевыми, так и нецелевыми компонентами ткани, в частности частично поглощается, частично рассеивается. Оптическое излучение различных длин волн по-разному взаимодействует с целевыми и нецелевыми компонентами ткани. Например, целевой компонент может преимущественно поглощать одну длину волны, а нецелевой компонент - другую длину волны. При этом из-за того, что спектры широкополосных источников излучения (светодиодов) могут частично перекрываться, результирующая интенсивность излучения от разных светодиодов может совпадать, несмотря на то что свет от этих источников излучения поглотился разными компонентами ткани.
Таким образом при прохождении через целевой участок субъекта пучки излучения от разных светодиодов на выходе попадают в фотодетектор(PD), где измеряется общая интенсивность излучения от разных светодиодов, прошедших через целевые и нецелевые компоненты исследуемого участка субъекта, см. фиг.1b. Следует отметить, что во время измерения исследуемого участка субъекта, любое движение как самого субъекта, так и устройства приводит к возникновению артефактов в виде помех и шумов. На фиг.1с наглядно продемонстрирована схема, где приведены графики поведения сигнала 1 для LED1 и сигнала 2 для LED2, при прохождении через исследуемый участок субъекта, и сигнала 1 и сигнала 2 на фотодетекторе(PD), при этом сигнал 1 ≈ сигнал 2.
В общем случае излучение от светодиодов LED1 и LED2 может частично перекрываться. Излучение обоих источников содержит общие спектральные компоненты, обозначенные на фиг.1a, 1b, как «--->» и «-.-.->». При этом излучение светодиода LED1 преимущественно поглощается одним компонентом ткани (например, целевым), а излучение светодиода LED2 преимущественно поглощается другим компонентом ткани (например, нецелевым). При этом излучение светодиода LED1 содержит спектральные компоненты, которые могут поглощаться и нецелевым компонентом, а излучение светодиода LED2 содержит спектральные компоненты, которые могут поглощаться целевым компонентом ткани. Несмотря на разное соотношение спектральных компонент в излучении прошедшем через образец ткани, фотодетектор не может их различить и выходной сигнал фотодетектора от обоих светодиодов будет примерно одинаковым (сигнал 1 ≈ сигнал 2). Таким образом, широкополосный источник излучения не может обеспечить спектральное разрешение достаточное для того, чтобы спектрально разделить сигналы от разных компонент ткани.
Такая структура известного из уровня техники решения не позволяет детектировать непосредственно сигнал от целевого компонента исследуемого участка субъекта, поскольку сигнал от других нецелевых компонентов смешивается с сигналом от целевых компонентов, в виде эритроцитов, крови, что позволяет измерить на фотодетекторе только общую интенсивность сигналов от разных компонентов исследуемого участка субъекта, и приводит к неточности измерений показателей крови.
Процессы кровоснабжения ткани ассоциируются с пульсовой волной, т.е. изменением количества крови в измеряемом объеме ткани и соответственно, сигнал от крови в данном случае характеризуется слабой переменной составляющей (AC) на фоне сильной постоянной составляющей (DC) сигнала.
В общем случае определение параметров и компонентов крови при помощи фотоплетизмографии (PPG) основано на измерении переменной составляющей (AC). Для корректного измерения переменной составляющей (AC) фотоплетизмографического сигнала требуется накопление нескольких циклов пульсовой волны, и процесс измерений или сбор данных занимает, как правило, несколько секунд. При этом живая ткань или живой организм субъекта за несколько секунд измерений может изменяться, т.е. является нестабильным, и влияние любых движений, возникающих на фотодатчике или других элементах устройства измерения, обуславливает возникновения нежелательных артефактов или шумов, что значительно снижает точность измерений компонентов крови.
С учетом указанных исследований известных из уровня техники устройств измерения компонентов крови можно сделать вывод, что указанным устройствам свойственны следующие основные недостатки:
1) Невысокая точность измерений, обусловленная низким спектральным разрешением,
2) Артефакты движения, возникающие при измерении крови,
3) Большое энергопотребление из-за длительного времени сбора данных.
Задача настоящего изобретения заключается в устранении всех вышеуказанных недостатков, свойственных известным из уровня техники устройствам измерения крови.
Далее будут описаны известные из уровня техники аналоги заявленного изобретения, предназначенные для измерения компонентов крови.
Из уровня техники известна патентная заявка US20190374140A1, опубл. 12.12.2019 г., IPC A61B 5/00, раскрывающая систему и способ определения периферического насыщения кислородом (SpO2) и концентрации гемоглобина с использованием методов и систем мультиспектральной лазерной визуализации (МSLI). Система состоит из по меньшей мере двух разных источников света с разными длинами волн, камеры, выполненной с возможностью одновременного приема данных, относящихся к первому и второму источникам света от образца, и процессора для формирования синтезированного изображения. Недостатком указанной системы (МSLI) является необходимость включения в нее дополнительных средств визуализации, в данном случае камеры для формирования двумерного изображения.
Кроме того, из уровня техники известна патентная заявка US20180214025A1, опубл. 02.08.2018 г., IPC A61B 5/00, в которой предложены система и способ, предназначенные для обнаружения кровотока или других флюидов в биологической ткани путем облучения биологической ткани двумя или более пучками когерентного света и детектирования, контактирующего с биологической тканью и обратно рассеянного от биологической ткани, света. При этом динамические параметры крови определяются на основании изменяющейся во времени и/или в пространстве картины интерференции света, полученной от биологической ткани (например, спекл-паттернов), или некоторых других свойств детектированного света. Недостатками указанных, известных из уровня техники, системы и способа являются особые требования к электронике и блокам обработки для измерения динамических параметров крови, скорости и т.д.
Аналогом заявленного изобретения также является стационарная система физиологических измерений, раскрытая в патентной заявке US10123726B2, опубл. 13.11.2018 г., IPC A61B 5/14552, указанная система выполнена на основе типичного светодиодного пульсоксиметра и включает в себя датчик, процессор, канал связи и информационные элементы. Датчик выполнен с возможностью пропускания света, имеющего множество длин волн, в участок ткани и генерирования сигнала датчика в ответ на прошедший свет после ослабления в ткани. Процессор сконфигурирован с возможностью обработки сигналов от датчика для получения по меньшей мере одного физиологического параметра. Недостатком указанной системы, в отличие от заявленного портативного устройства измерения, является невозможность ее использования в мобильных устройствах и гаджетах.
Наиболее близким аналогом заявленного изобретения, является система и способ измерения, известные из международной публикации WO2016178986A1, опубл. 10.11.2016 г., IPC A61B 5/1455, в которой раскрываются система и способ измерения SpO2 с использованием отражательной технологии PPG. Способ измерения применяется к анализу физиологических сигналов, а система измерения способствует прогнозированию измерений SpO2, основываясь на калибровке соотношения длин путей прохождения красного и инфракрасного излучений. Раскрытая система облегчает прогнозирование SpO2 для любого пользователя для заданной оптической конфигурации, гарантируя, что длина пути соответствующим образом учитывается при прогнозировании. Кроме того, использование средства автоматической регулировки усиления, реализованной в системе, обеспечивает оптимальное извлечение сигнала для определения SpO2. Указанное устройство относится к типичной системе пульсоксиметрии, работающей в отражающем режиме, чувствительной к артефактам движения, и обладает достаточно низкой точностью измерений и чувствительностью ввиду использования в устройстве широкополосных источников света.
Таким образом, известные средства измерения параметров крови не обеспечивают требования, предъявляемые к ним потребителями. При этом спрос на портативные измерительные устройства компонентов крови, и в частности устройств для неинвазивного измерения концентрации различных форм гемоглобина Hb: оксигенированного Hb, деоксигенированного Hb, мет-Hb, карбокси-Hb и концентрации кислорода в крови, очень вырос.
При этом показатели гемоглобина и показатели содержания кислорода в крови (сатурация) актуальны для выявления состояния субъектов и любое отклонение от типичных диапазонов для групп популяции свидетельствует о потенциальном риске заболеваний в зависимости от концентрации гемоглобина и/или показателей содержания кислорода в крови. На рынке устройств измерения параметров крови существует множество решений, выполняющих измерения компонентов крови, но многие из них не пригодны для непрерывного мониторинга параметров крови, требуют забор крови, требуется использование дополнительно устройства (пульсометра), что зачастую является неудобным для выполнения измерений вне медицинских учреждений. В связи с этим возникает необходимость в создании неинвазивного и неинтрузивного способа измерения и контроля концентрации гемоглобина в крови и содержания кислорода в крови, который одновременно обеспечивает не одномоментное измерение параметров крови, а позволяет отслеживать параметры крови в течение периода времени (несколько секунд) без большого количества тестов.
Авторами изобретения были проведены исследования известных на рынке подобных устройств измерения параметров крови и выявлены следующие характеристики известных устройств по сравнению с изобретением, представленным в настоящем раскрытии.
Параметры устройств рассматривались по следующим характеристиками:
использование отдельного устройства для измерения, точность измерения параметров, энергопотребление, непрерывный мониторинг, неустойчивость к движению.
При этом рассматривались следующие устройства измерения параметров крови:
- заявленное устройство согласно изобретению,
- фирма Cercacor (US10123726B2),
- устройство mHematology,“Virtual Hyperspectral Imaging of Eyelids”-mHe matology for blood hemoglobin analysis, Michelle A. Visbal-Onufrak, total 41 pages, publ. 12.04.2019г., доступно по ссылке (http://dx.doi.org/10.2139/ssrn.3369797),
- приложение HemaApp, “ Noninvasive blood screening of hemoglobin using smartphone cameras”, Doug Hawkins, and others, UbiComp '16: Proceedings of the 2016 ACM International Joint Conference on Pervasive and Ubiquitous Computing, September 2016,Pages 593-604, доступно по ссылке (http://dx.doi.org/10.1145/2971648.2971653),
- приложение Fingermale, “Smartphone app for non-invasive detection of anemia using only patient-sourced photos”, Rober G. Mannino and others, publ.04.12.2018г., доступно по ссылке (https://doi.org/10.1038/s41467-018-07262-2).
Заявленное устройство
1) Не требует использования дополнительных отдельных средств для измерения, может быть встроено в существующие носимые устройства (мобильный телефон, часы, фитнес браслеты, т.д.),
2) обладает высокой точностью измерений параметров крови,
3) низкое энергопотребление,
4) предусмотрена возможность непрерывного мониторинга, не требующего участия пользователя,
5) обеспечивает высокую устойчивость к паразитным движениям.
Устройство фирмы Cercacor
1) Требует использование дополнительных отдельных средств для измерения (например, прищепка на палец (Finger clip)),
2) обладает достаточной точностью измерений параметров крови,
3) высокое энергопотребление,
4) не предусмотрена возможность непрерывного мониторинга, каждое отдельное измерение требует непосредственного участия пользователя.
5) обеспечивает среднюю устойчивость к паразитным движениям.
Устройство mHematology
1) Не требует использования дополнительных отдельных средств для измерения,
2) обладает низкой точностью измерений параметров крови,
3) низкое энергопотребление,
4) не предусмотрена возможность непрерывного мониторинга,
5) обеспечивает очень низкую устойчивость к движению.
Приложение HemaApp
1) Требуется использование дополнительных отдельных средств для измерения и дополнительные источники излучения,
2) обладает низкой точностью измерений параметров крови,
3) низкое энергопотребление,
4) не предусмотрена возможность непрерывного мониторинга,
5) обеспечивает очень низкую устойчивость к движению.
Приложение Fingermale
1) не требуется использование дополнительных отдельных средств для измерения,
2) обладает низкой точностью измерений параметров крови,
3) низкое энергопотребление,
4) не предусмотрена возможность непрерывного мониторинга,
5) обеспечивает очень низкую устойчивость к движению.
Таким образом, из проведенного авторами сопоставительного анализа известных на рынке подобных решений, можно сделать вывод, что заявленное решение обладает высокой точностью измерений параметров крови наряду с другими преимуществами.
Сущность изобретения
Согласно первому аспекту изобретения заявлен способ неинвазивного измерения элементов (компонентов) крови, содержащий этапы, при которых:
- облучают анализируемую область тела субъекта, содержащую элементыы крови и динамические (движущиеся и/или пульсирующие), и статичные (не движущиеся) элементы ткани, по меньшей мере двумя пучками света посредством по меньшей мере двух узкополосных когерентных источников излучения, каждый, имеющий соответствующую длину волны,
- детектируют по меньшей мере один отклик обратно рассеянного когерентного излучения от компонентов крови и динамических, и статичных компонентов ткани, представляющий собой по меньшей мере один интерференционный сигнал от каждого из по меньшей мере двух узкополосных источников когерентного излучения, с помощью по меньшей мере одного фотодетектора,
- фильтруют детектированные интерференционные сигналы в соответствии с заданной полосой частот сигнала, в которой локализованы частоты интерференционных биений, характеризующие динамику компонентов крови, с помощью фильтра,
- осуществляют аналого-цифровую выборку фильтрованных сигналов с частотой соответствующей заданной полосе частот фильтрованного сигнала, с формированием дискретных фильтрованных сигналов,
- выделяют из дискретных фильтрованных сигналов набор спектрально-временных признаков 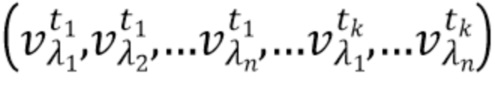 сигналов, характеризующих спектральные и динамические свойства компонентов крови,
сигналов, характеризующих спектральные и динамические свойства компонентов крови,
где λ1, λ2, λ3,.....λn - индекс, указывающий длину волны,
t1,….tk - индекс, указывающий временной признак, при этом спектрально-временной признак 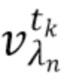 соответствует временному признаку
соответствует временному признаку 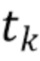 , измеренному на длине волны
, измеренному на длине волны 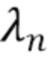 ,
,
- вычисляют концентрацию компонентов крови посредством блока обработки, на основании полученного набора спектрально-временных признаков 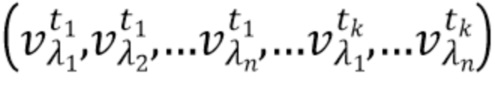 сигналов, в соответствии со следующим выражением:
сигналов, в соответствии со следующим выражением:
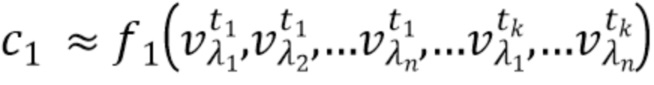
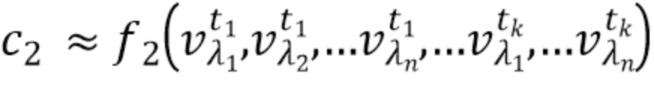
…

где с1…сm - концентрации компонентов крови, которые характеризуются соответствующим набором спектрально-временных признаков 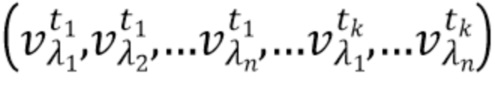 сигналов,
сигналов,
f
1, f2, fm - функциональные зависимости полученного набора спектрально-временных признаков 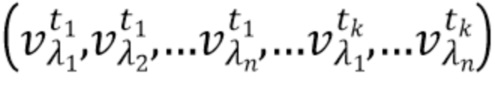 сигналов и определяемых концентраций компонентов крови.
сигналов и определяемых концентраций компонентов крови.
При этом по меньшей мере два узкополосных когерентных источника излучения представляет собой лазерный диод (LD) и обеспечивают излучение с отличными друг от друг длинами волн в видимой и ближней инфракрасной областях спектра.
Кроме того, облучение анализируемой области тела субъекта по меньшей мере двумя узкополосными когерентными источниками излучения осуществляют по сигналу от блока управления, в заданные периоды времени.
Согласно первому аспекту изобретения регистрируют на по меньшей мере одном фотодетекторе от каждого из по меньшей мере двух узкополосных источников когерентного излучения по меньшей мере один интерференционный сигнал Sλ, характеризующий отклик обратно рассеянного когерентного излучения от компонентов крови и динамических и статичных компонентов ткани, и который характеризуется следующим соотношением:
Sλ = 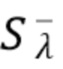 +
+ 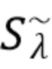 ,
,
где Sλ - общий сигнал, регистрируемый на по меньшей мере одном фотодетекторе,
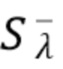 - постоянный или медленноменяющийся сигнал, характерный для интерференции излучения рассеянного статичными компонентами ткани,
- постоянный или медленноменяющийся сигнал, характерный для интерференции излучения рассеянного статичными компонентами ткани,
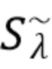 - флуктуирующий сигнал характерный для интерференции излучения рассеянного компонентами крови и динамическими компонентами ткани,
- флуктуирующий сигнал характерный для интерференции излучения рассеянного компонентами крови и динамическими компонентами ткани,
λ - представляет собой одну из длин волн λ1, λ2, λ3,..... λn каждого из по меньшей мере двух указанных источников излучения.
Кроме того, на этапе фильтрации удаляют из указанного интерференционного сигнала Sλ постоянный сигнал 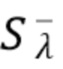 , характеризующий статичные компоненты ткани, с обеспечением выборки флуктуирующего сигнала
, характеризующий статичные компоненты ткани, с обеспечением выборки флуктуирующего сигнала 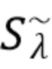 , характеризующего компоненты крови и динамические компоненты ткани.
, характеризующего компоненты крови и динамические компоненты ткани.
Согласно способу неинвазивного измерения компонентов крови, на этапе фильтрации детектированных интерференционных сигналов в соответствии с заданной полосой частот сигнала, заданная полоса частот сигнала (F) находится в диапазоне от Fmin=500 Гц до Fmax=10 кГц, и соответствует более высоким частотам интерференционных биений, по сравнению с другими детектированными интерференционными сигналами, зарегистрированными на по меньшей мере одном фотодетекторе.
Согласно указанному способу на этапе фильтрации детектированных интерференционных сигналов в соответствии с заданной полосой частот F, заданная полоса частот сигнала находится в диапазоне от, Fmin=50 Гц до Fmax=500 Гц, и соответствует более низким частотам интерференционных биений, по сравнению с другими детектированными интерференционными сигналами, зарегистрированными на по меньшей мере одном фотодетекторе.
При этом аналого-цифровая выборка фильтрованного сигнала в способе согласно изобретению осуществляется с частотой дискретизации FD удовлетворяющей критерию Найквиста для заданной полосы частот сигнала F: FD ≥ 2·Fmax.
Кроме того, аналого-цифровая выборка фильтрованного сигнала
осуществляется с частотой дискретизации FD ниже порогового значения соответствующего критерию Найквиста для заданной полосы частот сигнала, FD < 2·Fmax, так что после аналого-цифровой выборки фильтрованный высокочастотный сигнал переносится в низкочастотную область: F < FD/2.
Согласно способу неинвазивного измерения компонентов крови набор спектрально-временных признаков 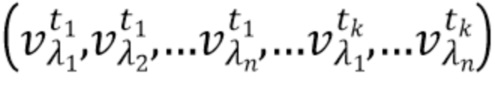 сигналов для каждой из по меньшей мере двух длин волн представляет собой по меньшей мере одно из: интенсивность рассеянного излучения, полная мощность сигнала, мощность в заданной полосе частот сигнала, моменты спектра сигнала, частоты сигнала характерные для частот интерференционных биений, характеризующих динамику компонентов крови, и комбинации указанных спектрально-временных признаков, абсолютные значения указанных спектрально-временных признаков, относительные значения указанных спектрально-временных признаков, линейные комбинации указанных спектрально-временных признаков на различных длинах волн, нелинейные комбинации указанных спектрально-временных признаков на различных длинах волн.
сигналов для каждой из по меньшей мере двух длин волн представляет собой по меньшей мере одно из: интенсивность рассеянного излучения, полная мощность сигнала, мощность в заданной полосе частот сигнала, моменты спектра сигнала, частоты сигнала характерные для частот интерференционных биений, характеризующих динамику компонентов крови, и комбинации указанных спектрально-временных признаков, абсолютные значения указанных спектрально-временных признаков, относительные значения указанных спектрально-временных признаков, линейные комбинации указанных спектрально-временных признаков на различных длинах волн, нелинейные комбинации указанных спектрально-временных признаков на различных длинах волн.
При этом в заявленном способе выполняется измерение по меньшей мере одного отклика обратно рассеянного когерентного излучения от компонентов крови и динамических и статичных компонентов ткани, представляющий собой по меньшей мере один интерференционный сигнал от каждого из по меньшей мере двух узкополосных источников когерентного излучения, с последующей фильтрацией детектированного сигнала, аналого-цифровой выборкой фильтрованного сигнала, выделением спектрально-временных признаков сигнала для субъекта с известной концентрацией искомых компонентов крови, и
определяется вид функциональных зависимостей f1, f2, fm и значения входящих в них коэффициентов, связывающих набор вычисленных спектрально-временных признаков 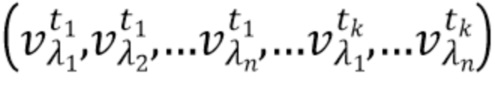 сигналов и известные концентрации компонентов крови с1…сm.
сигналов и известные концентрации компонентов крови с1…сm.
При этом известные концентрации компонентов с1…сm представляют собой предварительно полученные значения концентраций компонентов крови для различных популяций субъектов или групп популяций субъектов, для которых предварительно определяются признаки соответствующих интерференционных сигналов, используемые в процессе калибровки.
Согласно способу неинвазивного измерения компонентов крови вид функциональных зависимостей f1, f2, fm и значения входящих в них коэффициентов определяется в процессе калибровки по меньшей мере одним из методов: регрессионные методы, в том числе линейная регрессия, логистическая регрессия, методы последовательных приближений, дифференциальные методы, в том числе градиентные методы, в том числе градиентный спуск, стохастический градиентный спуск, и модификации указанных методов, на основании данных компонентов крови, предварительно измеренных для различных популяций субъектов или групп популяций субъектов.
Кроме того, согласно способу определяется искомая концентрация компонентов крови в анализируемом объекте по измеренным значениям спектрально-временных признаков 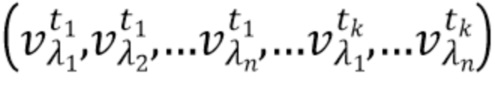 сигналов с использованием функциональных зависимостей f1, f2, fm, определенных в процессе калибровки.
сигналов с использованием функциональных зависимостей f1, f2, fm, определенных в процессе калибровки.
Согласно второму аспекту изобретения предлагается портативное устройство для неинвазивного измерения компонентов крови, выполненное с возможностью реализации способа неинвазивного измерения компонентов крови согласно первому аспекту изобретения, содержащее:
- по меньшей мере два узкополосных когерентных источника излучения, каждый, имеющий соответствующую длину волны и выполненный с возможностью облучения анализируемой области тела субъекта, содержащей компоненты крови и динамические и статичные компоненты ткани;
- по меньшей мере один фотодетектор, выполненный с возможностью детектирования по меньшей мере один отклика обратно рассеянного когерентного излучения от компонентов крови и динамических, и статичных компонентов ткани, представляющий собой по меньшей мере один интерференционный сигнал от каждого из по меньшей мере двух узкополосных источников когерентного излучения,
- фильтр, выполненный с возможностью фильтрации детектированных интерференционных сигналов в соответствии с заданной полосой частот сигнала, в которой локализованы частоты интерференционных биений, характеризующие динамику компонентов крови,
- аналого-цифровой преобразователь, выполненный с возможностью аналого-цифровой выборки фильтрованных сигналов с частотой соответствующей заданной полосе частот фильтрованного сигнала, с формированием дискретных фильтрованных сигналов,
- блок управления, выполненный с возможностью управления по меньшей мере двумя узкополосными когерентными источниками излучения, по меньшей мере одним фотодетектором, фильтром, и аналого-цифровым преобразователем, и
- блок обработки, соединенный с блоком управления, и выполненный с возможностью обработки полученных после выборки дискретных фильтрованных интерференционных сигналов, и реализующий по сигналу от блока управления следующие этапы, при которых:
- выделяют из дискретных фильтрованных сигналов набор спектрально-временных признаков 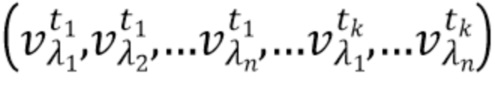 сигналов, характеризующих спектральные и динамические свойства компонентов крови,
сигналов, характеризующих спектральные и динамические свойства компонентов крови,
где λ1, λ2, λ3,.....λn - индекс, указывающий длину волны,
t1,….tk - индекс, указывающий временной признак, при этом спектрально-временной признак 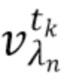 соответствует временному признаку
соответствует временному признаку 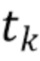 , измеренному на длине волны
, измеренному на длине волны 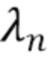 ,
,
- вычисляют концентрацию компонентов крови на основании полученного набора спектрально-временных признаков 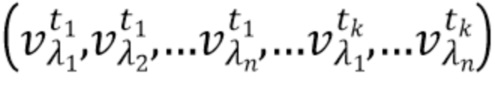 сигналов в соответствии со следующим выражением:
сигналов в соответствии со следующим выражением:
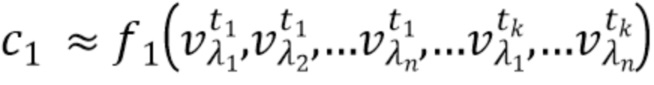
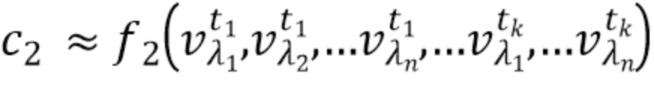
…

где с1…сm - концентрации компонентов крови, которые характеризуются соответствующим набором признаков 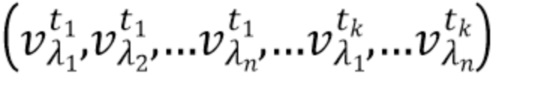 сигналов,
сигналов,
f
1, f2, fm - функциональные зависимости полученного набора спектрально-временных признаков 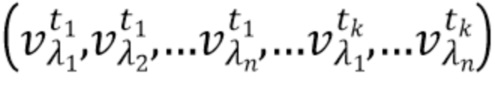 сигналов и определяемых концентраций компонентов крови.
сигналов и определяемых концентраций компонентов крови.
При этом в указанном устройстве, каждый из по меньшей мере двух узкополосных источников излучения представляет собой лазерный диод (LD), фильтр представляет собой один из: аналогового фильтра, цифрового фильтра, и каждый из по меньшей мере двух фотодетекторов представляет собой по меньшей мере один из: фотодиода, фототранзистора, фоторезистора, или прибора с зарядовой связью (ПЗС), или устройства на базе комплементарной структуры металл-оксид-полупроводник (КМОП), или светочувствительный элемент.
Указанное устройство дополнительно содержит блок памяти для хранения информации, используемой для работы устройства, при этом информация, используемая для работы устройства, представляет собой по меньшей мере одно из: напряжения, тока питания источников излучения, частоты аналого-цифровых выборок, коэффициентов усиления, значения калибровочных коэффициентов ассоциируемых с спектрально-временными признаками сигнала, используемых для расчета концентрации компонентов крови.
Портативное устройство для неинвазивного измерения компонентов крови согласно изобретению выполнено с возможностью встраивания в одно из: портативного измерительного устройства персонального контроля здоровья, в частности умные часы, стационарного диагностического прибора контроля здоровья, бытового измерительного устройства персонального контроля здоровья и гаджета персонального контроля здоровья.
Краткое описание чертежей
Вышеописанные и другие признаки и преимущества настоящего изобретения поясняются в последующем описании, иллюстрируемом чертежами, на которых представлено следующее:
Фиг.1а иллюстрирует оптическую схему устройства измерения компонентов крови, включающую прохождения пучков излучения от широкополосных светодиодов через компоненты исследуемого участка субъекта и их регистрацию на фотодетекторе согласно известному уровню техники.
Фиг.1b иллюстрирует схематично получение общей интенсивности излучения на фотодетекторе согласно схеме на фиг.1b согласно известному уровню техники.
Фиг.1с - представлены графики изменения сигнала 1 для LED1 и сигнала 2 для LED2, при прохождении через исследуемый участок субъекта, и а сигнала 1 и сигнала 2 на фотодетекторе(PD) устройства измерения компонентов крови согласно известному уровню техники на фиг.1а;
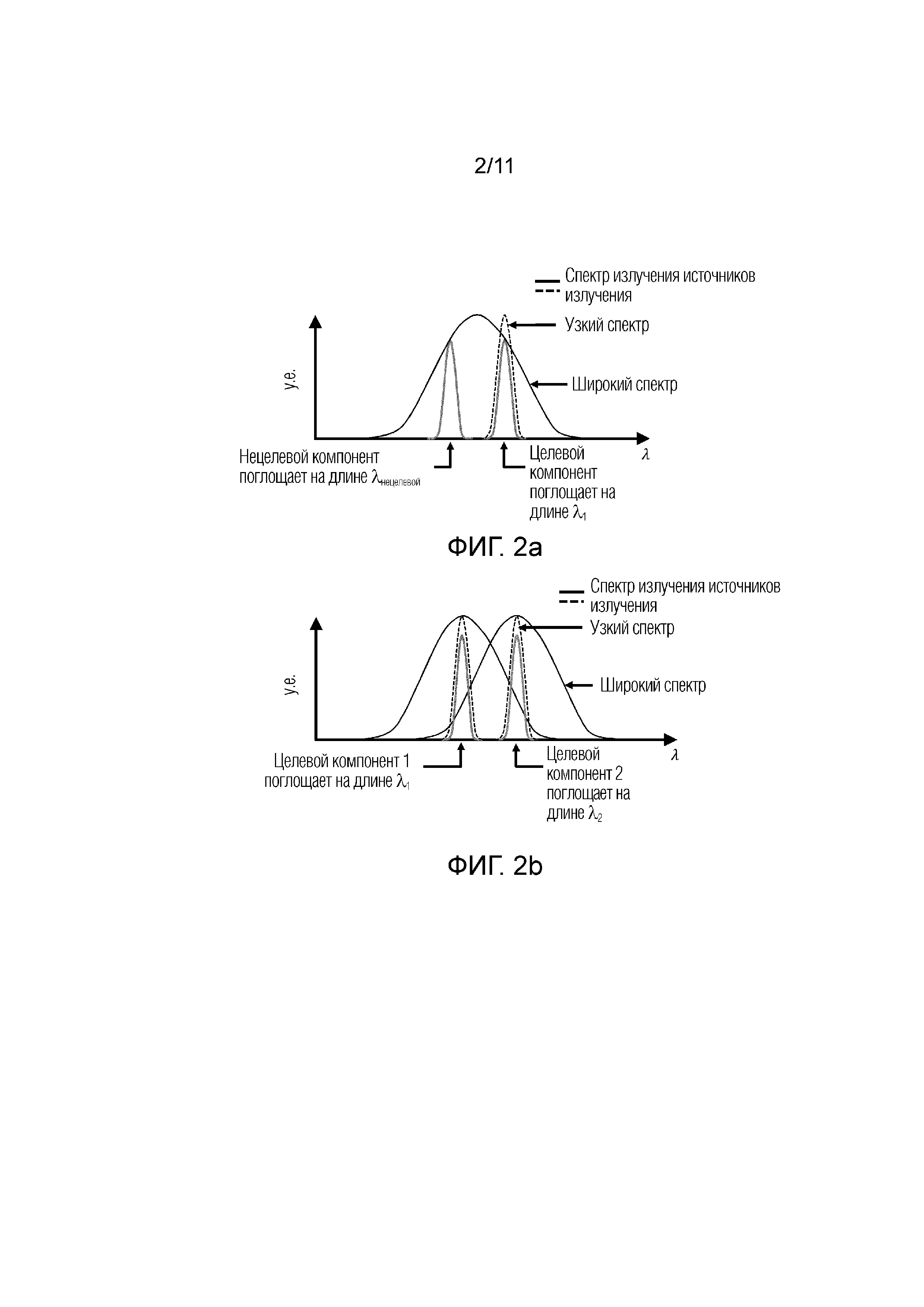
Фиг.2а - представлены графики, иллюстрирующие широкополосные и узкополосные спектры излучения, при этом два узкополосных источника излучения могут излучать на длинах волн достаточно отстоящих друг от друга и совпадающих с длинами волн поглощения нецелевого и целевого компонента, но не совпадающих друг с другом, при этом широкополосный источник излучения имеет спектр достаточно широкий, включающий в себя одновременно длины волн поглощения целевого и нецелевого компонента.
Фиг.2b - представлены графики, иллюстрирующие несколько широкополосных и узкополосных источников излучения, центральные длины волн которых совпадают с длинами волн поглощения разных целевых компонентов, при этом даже если центральные длины волн излучения широкополосных источников точно совпадают полосами поглощения искомых компонентов, другая часть спектра излучения этих источников совпадает с другим компонентом.
Фиг.2с - представлены графики, иллюстрирующие коэффициент поглощения µa(λ ) компонентов крови в зависимости от длины волны λ (нм).
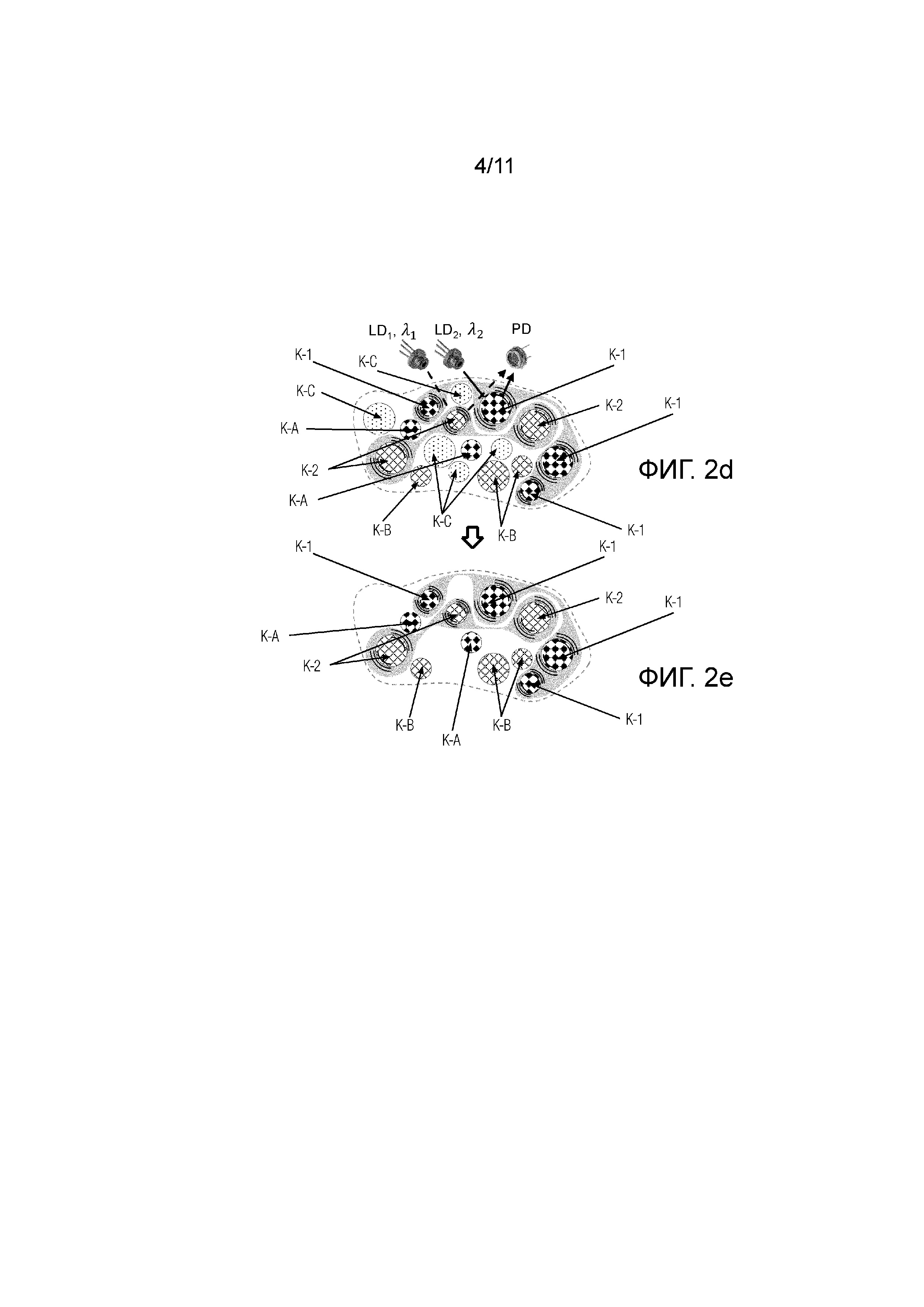
Фиг.2d - представлена схема, иллюстрирующая процесс спектральной селекции, происходящий в анализируемом объеме ткани при облучении двумя узкополосными когерентными источниками излучения LD1 с длиной волны λ1 и LD2 с длиной волны λ2.
Фиг.2е - представлена схема, иллюстрирующая результат спектральной селекции, происходящий в анализируемом объеме ткани согласно фиг.2d при выделении целевых компонентов.
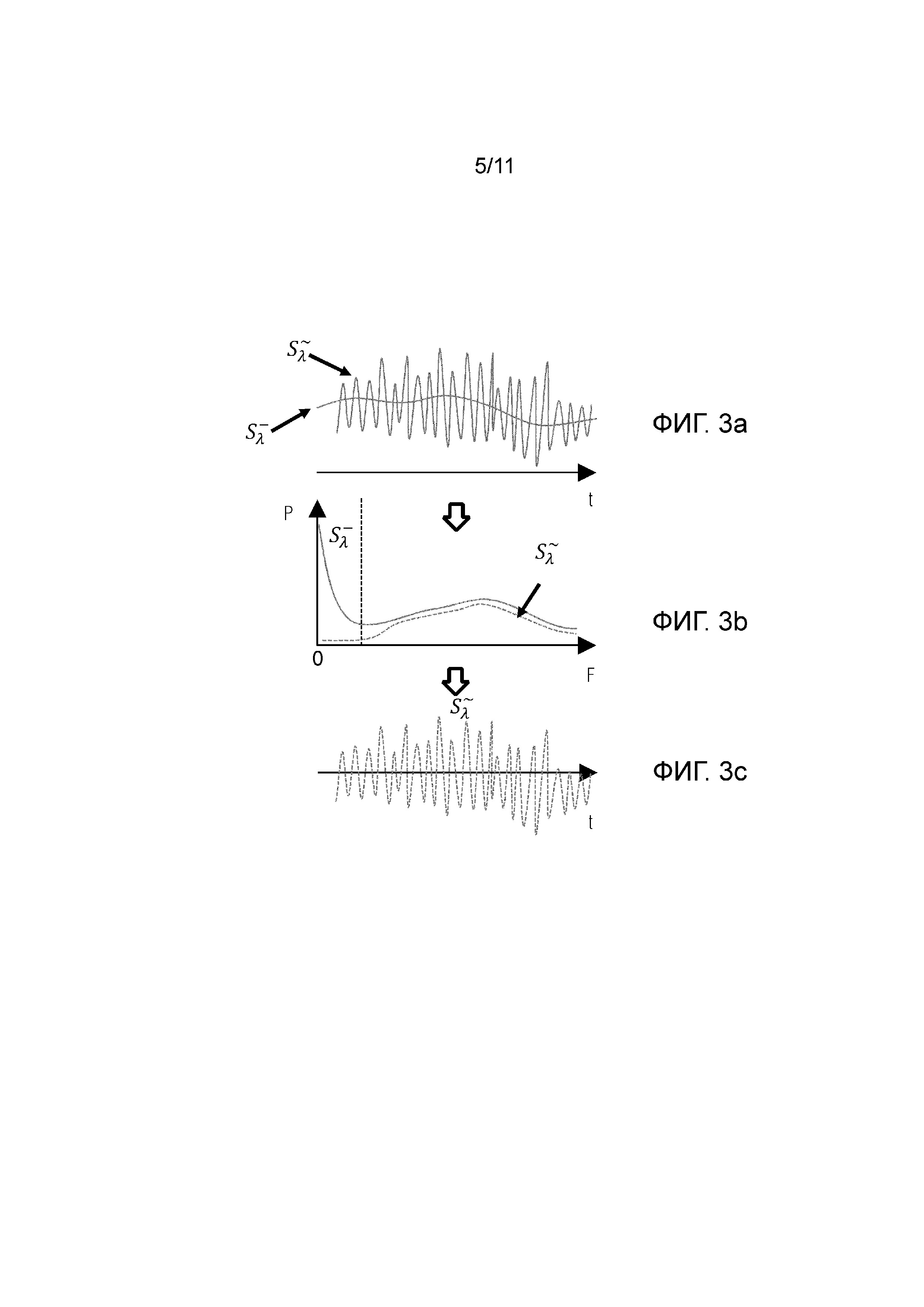
Фиг.3а - представлены амплитуды постоянной (медленноменяющейся) составляющей сигнала и флуктуирующей (быстроменяющейся) составляющей сигнала.
Фиг.3b - представлены кривые, характеризующие мощность (P) сигнала в зависимости от частоты(F) сигнала, при этом сплошная линия показывает мощность исходного сигнала, содержащего и медленноменяющуюся и быстроменяющуюся компоненты, а пунктирная линия показывает мощность только флуктуирующей компоненты.
Фиг.3c - представлена амплитуда результирующего сигнала в зависимости от времени после соответствующей обработки, которая сохраняет только флуктуирующую составляющую сигнала.
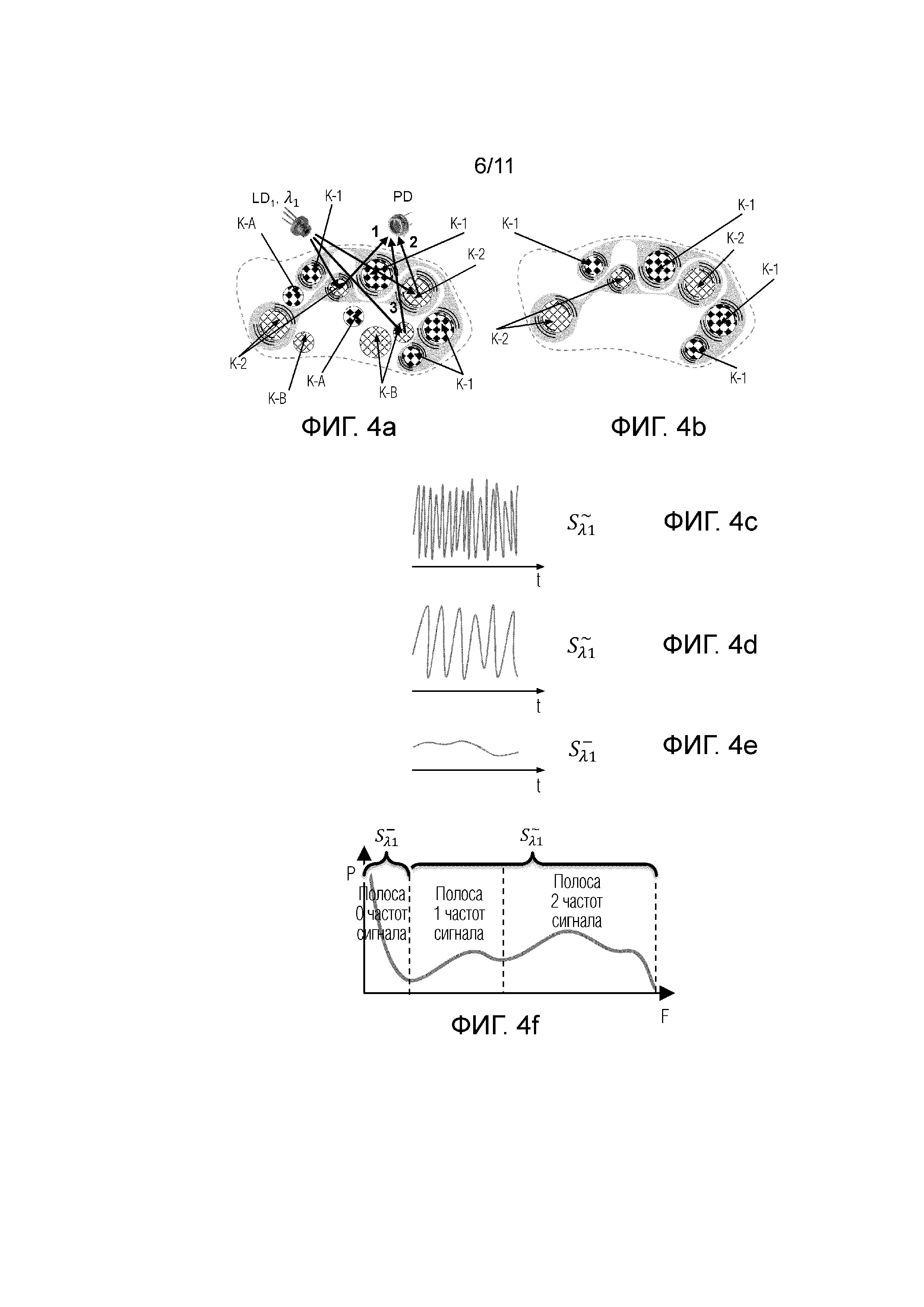
Фиг.4а - представлена схема, иллюстрирующая процесс селекции по динамическим свойствам компонент, происходящий в анализируемом объеме ткани при облучении узкополосным когерентным источником излучения LD1 с длиной волны λ1.
Фиг.4b - представлена схема, иллюстрирующая результат селекции компонент по динамическим свойствам, происходящий в анализируемом объеме ткани согласно фиг.4a при выделении целевых компонентов.
Фиг.4с - представлена амплитуда сигнала флуктуирующего в результате интерференции излучения рассеявшегося на подвижной компоненте K-1 и опорным излучением.
Фиг.4d - представлена амплитуда сигнала флуктуирующего в результате взаимной интерференции излучения рассеявшегося на целевой подвижной компоненте K-1 и целевой подвижной компоненте K-2.
Фиг.4e - представлена амплитуда нефлуктуирующего (медленноменяющегося) сигнала от неподвижной компоненты K-А.
Фиг.4f - представлена кривая, характеризующая мощность сигнала зарегистрированного на фотодетекторе(PD) в зависимости от частоты, в полосе 0 частот сигнала, соответствующей сигналу на Фиг.4e, в полосе 1 частот сигнала, соответствующей сигналу на Фиг.4d и полосе 2 частот сигнала, соответствующей сигналу на Фиг.4c.
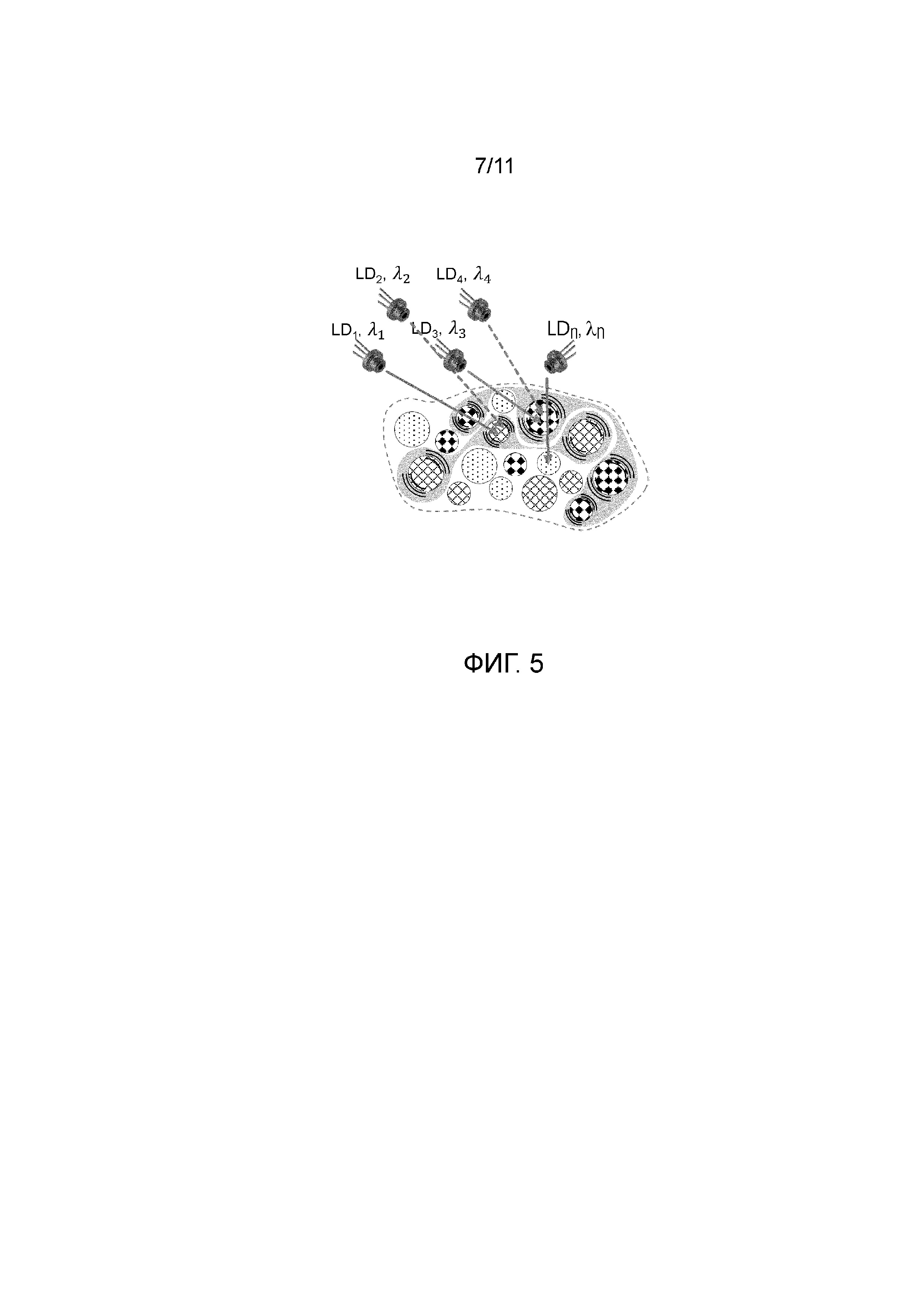
Фиг.5 - представлена схема, иллюстрирующая процесс, происходящий в анализируемом объеме ткани при облучении несколькими когерентными источниками излучения.
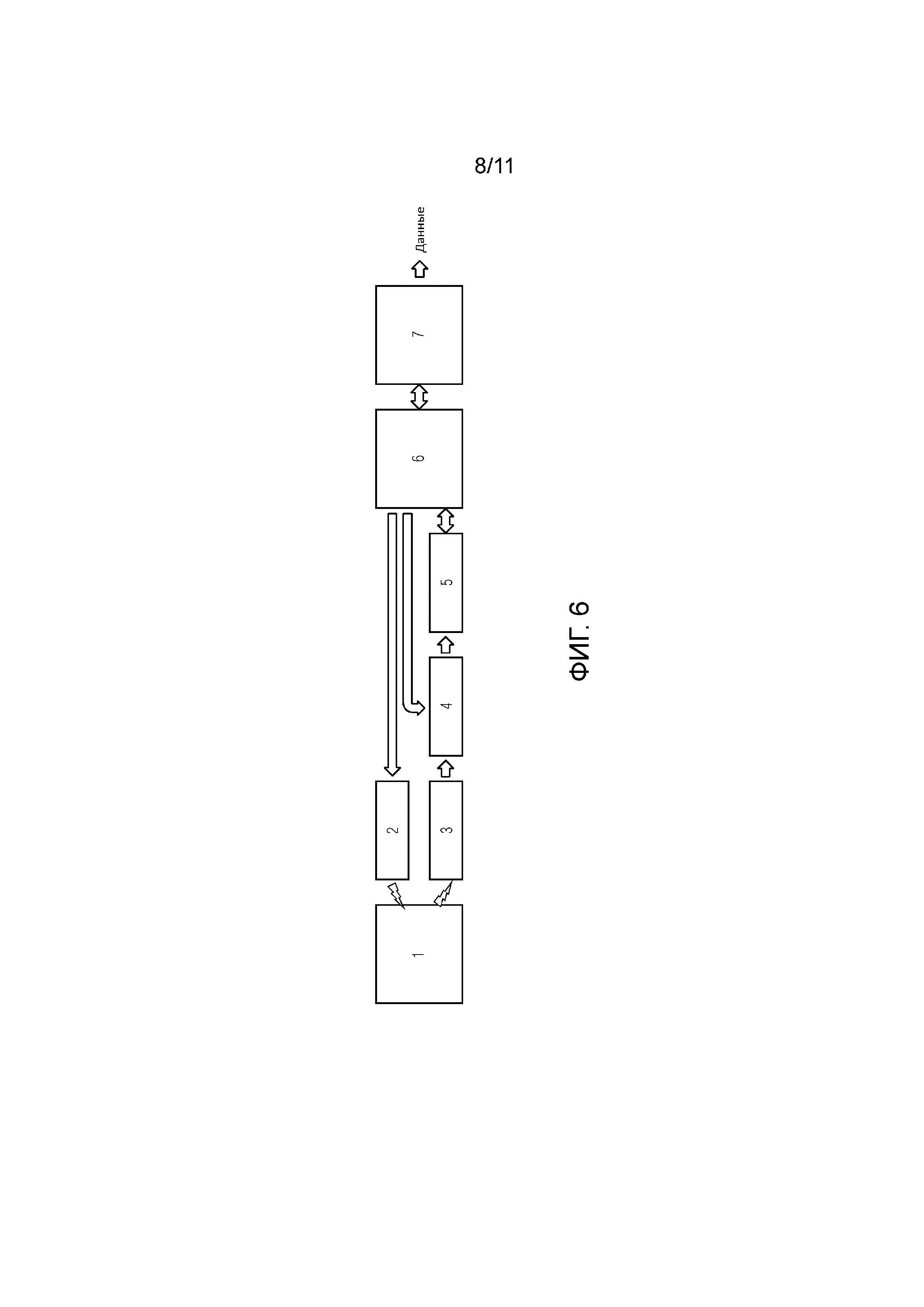
Фиг.6 - представлена блок-схема портативного устройства неинвазивного измерения компонентов крови.
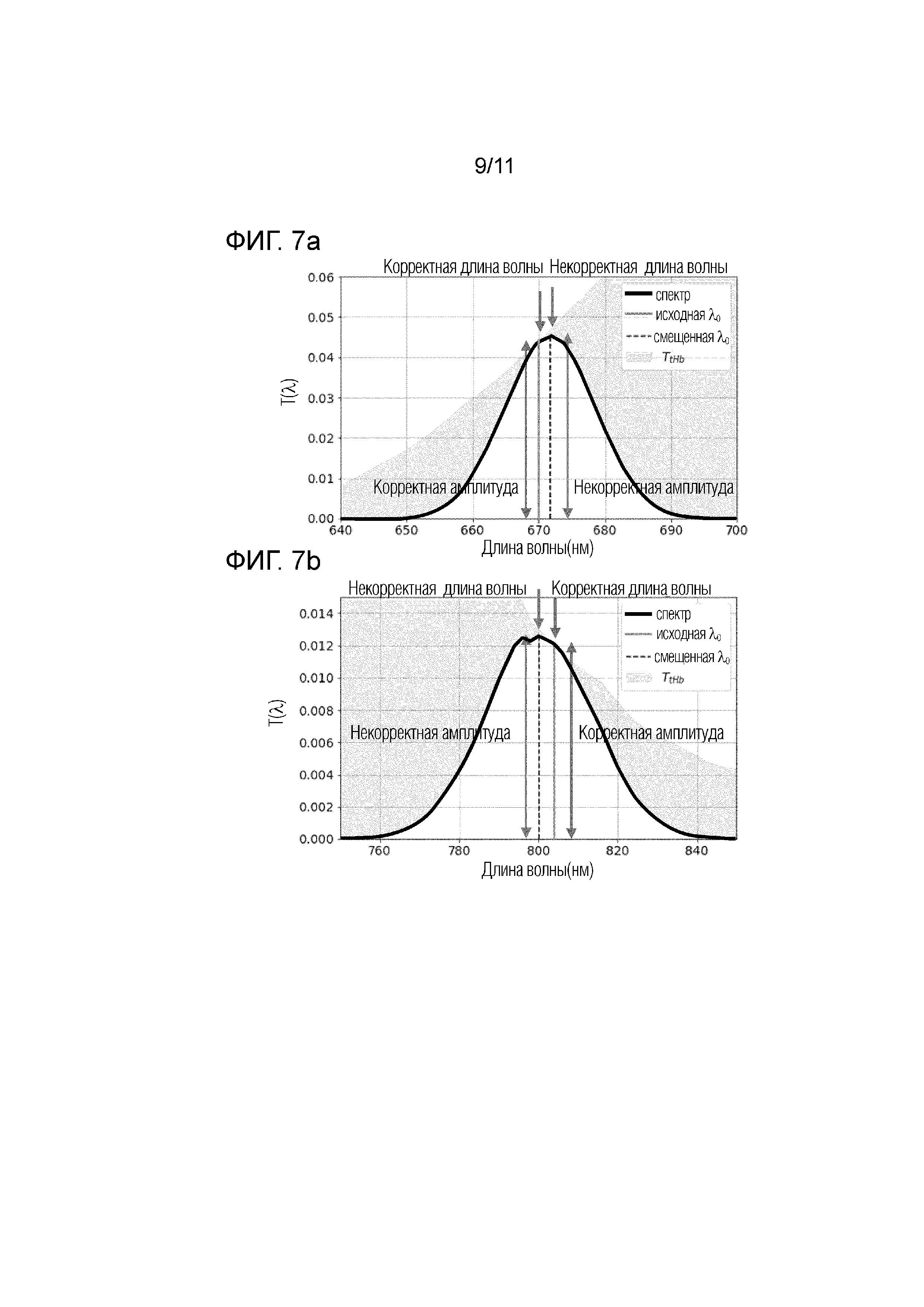
Фиг.7а - схематично представлены изменения в спектре излучения широкополосного источника излучения (жирная линия) на длине волны 670нм при прохождении через анализируемый объем, который характеризуется спектром пропускания (T(λ )).
Фиг.7b - схематично представлены изменения в спектре излучения широкополосного источника излучения (жирная линия) на длине волны 805 нм при прохождении через анализируемый объем, , который характеризуется спектром пропускания (T(λ )).
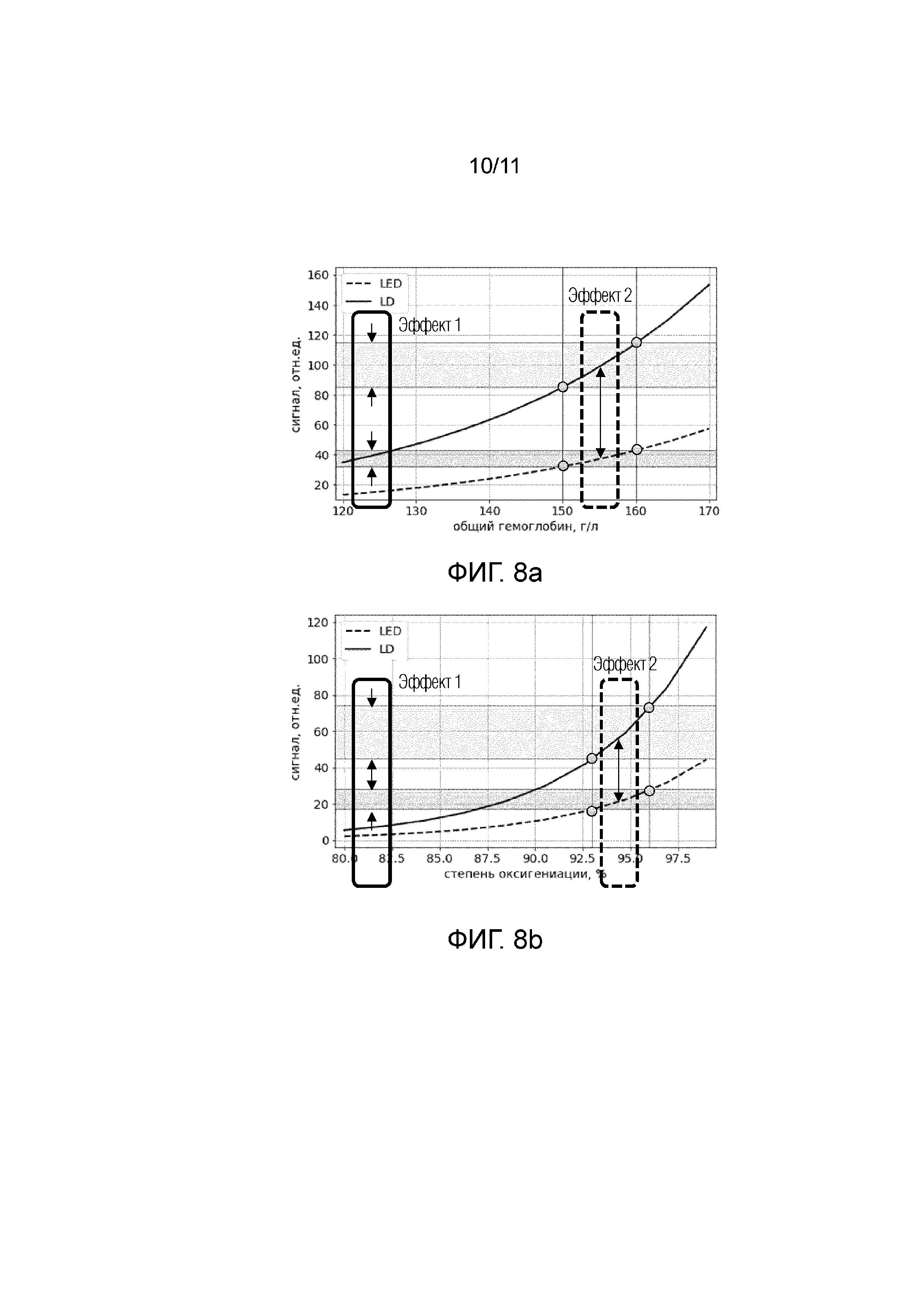
Фиг. 8a - представлены графики, демонстрирующие кривые сигнала для широкополосного источника излучения (светодиода-LED), и узкополосного источника излучения (лазерный диод-LD), в зависимости от концентрации общего гемоглобина (г/л).
Фиг.8b - представлены графики, демонстрирующие кривые сигнала для широкополосного источника излучения (светодиода-LED), и узкополосного источника излучения (лазерный диод-LD), в зависимости от уровня оксигенации(%).
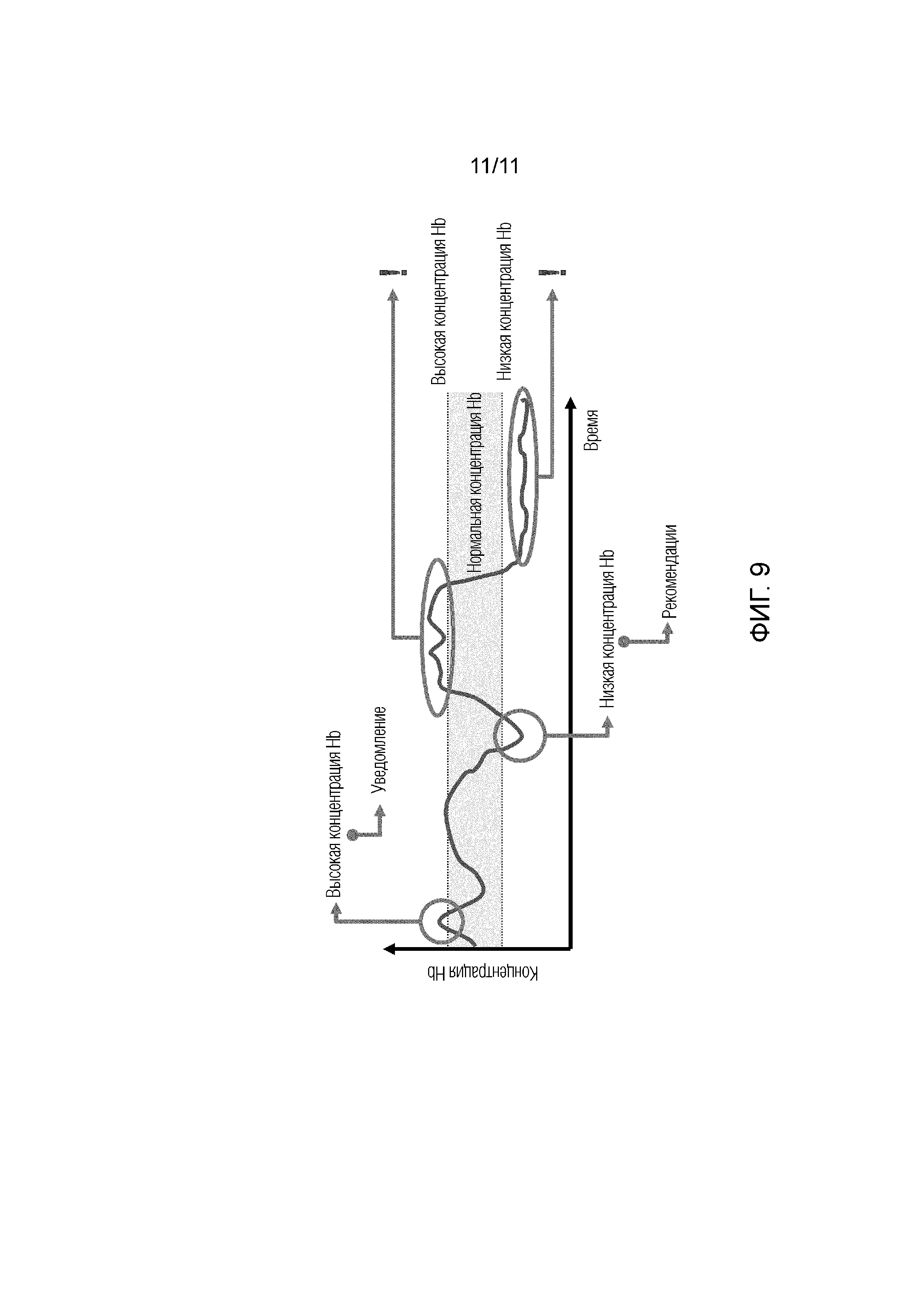
Фиг.9 - представлена схема неинвазивного отслеживания концентрации гемоглобина крови.
Подробное описание изобретения
Примеры вариантов осуществления настоящего раскрытия будут подробно описаны ниже. Примеры вариантов осуществления были проиллюстрированы на прилагаемых чертежах, на которых одинаковые или подобные ссылочные позиции относятся к одинаковым или подобным элементам или элементам, имеющим одинаковые или подобные функции. Примерные варианты осуществления, описанные со ссылкой на прилагаемые чертежи, являются иллюстративными, используются только для объяснения настоящего раскрытия и не должны рассматриваться как какие-либо ограничения к нему.
В рамках настоящего изобретения будут использоваться следующие понятия и термины, толкование которых предоставляется ниже авторами изобретения:
Анализируемый объем - зона биологической ткани субъекта (человек, животное и т.п.), подлежащая исследованию.
Образец - это объект, подлежащий исследованию или участок биологической ткани субъекта (ткань, кровь и т.д.)
Исследуемый компонент крови - целевой компонент биологической ткани, подлежащий исследованию.
Целевой компонент - компонент биологической ткани, подлежащей исследованию, который поглощает излучение с длинами волн λ1,... λn и характеризуются движением и/или пульсацией при протекании крови.
Нецелевой компонент - компонент биологической ткани, подлежащей исследованию, который поглощает излучение на длинах волн λ1,... λn или других длинах волн и характеризуется отсутствием движения.
Артефакты движения - помехи, шумы, периодические или непериодические, случайные, или имеющие какую-то закономерность компоненты сигнала имеющие параметры нехарактерные для пульсовой волны и вызванные любым механическим смещением измерительного устройства и измеряемого объекта относительно друг друга.
PPG(photoplethysmography) измерения - метод спектрофотометрического измерения степени поглощения оптического излучения различных длин волн с целью качественного и количественного анализа состава какого-либо объекта, в частности биологической ткани.
Интерференционные сигналы - сигналы, полученные в результате интерференции двух частей излучения, например опорного излучения, в качестве, которого может выступать как излучение, рассеявшееся на движущейся частице анализируемого объема, или любое другое внешнее излучение, так и излучение, рассеявшееся на неподвижной частице анализируемого объема.
Частота интерференционных биений - частота, на которой происходит флуктуация интерференционного сигнала, представляющая собой разностную частоту (период). При этом разностная частота (период) интерференционного сигнала пропорциональна разности между параметрами, например частотой, длиной волны двух интерферирующих частей излучения, т.е. опорного излучения, в качестве, которого может выступать как излучение, рассеявшееся на движущейся частице анализируемого объема, или любое другое внешнее излучение, так и излучение, рассеявшееся на неподвижной частице анализируемого объема.
Настоящее изобретение предназначено для обеспечения устройства и способа неинвазивного измерения компонентов крови, и может использоваться в портативных измерительных устройствах, ручных часах, так называемых умных часах, стационарных диагностических приборах, бытовых измерительных устройствах и гаджетах персонального контроля здоровья.
Основными задачами, которые решает настоящее изобретение, являются:
- повышение спектрального разрешения выполняемых измерений;
- исключение влияния движений измерительного устройства и измеряемого объекта относительно друг друга;
- селективная чувствительность устройства измерения к динамическим компонентам ткани (крови)
- снижение энергопотребления устройства измерения.
Решение вышеуказанных задач обеспечивает получение портативного устройства и способа неинвазивного измерения компонентов крови, обеспечивающих достижение более точного измерения компонентов крови, при одновременном снижении энергопотребления устройства.
Далее представлены предпочтительные варианты реализации устройства и способа неинвазивного измерения компонентов крови со ссылками на прилагаемые чертежи. Следует остановиться на некоторых принципиальных моментах измерений, раскрываемых в настоящем описании.
Как хорошо известно, кровь - это жидкая и подвижная соединительная ткань внутренней среды организма, которая состоит из жидкой среды в виде плазмы и взвешенных в ней форменных элементов (клеток и производных от клеток): эритроцитов, лейкоцитов и тромбоцитов и т.д. Кровь циркулирует по замкнутой системе сосудов под действием силы ритмически сокращающегося сердца и в зависимости от типа сосудов, по которым она протекает варьируется скорость протекания крови и ее пульсация. В более крупных сосудах, артериолах кровь течет более быстро и подвержена пульсации, а в более мелких сосудах, капиллярах кровь течет более медленно и пульсации незначительная или практически отсутствует.
В зависимости от способности поглощения различными компонентами крови при облучении их оптическим излучением компоненты можно условно классифицировать по спектральным свойствам, и по динамическим свойствам, например по скорости протекания крови и ее пульсации.
При этом, как уже указывалось ранее, при облучении анализируемого объема несколькими источники излучения, в качестве примера, см. фиг.1а, LED1 и LED2 каждый со своим диапазоном длин волн: LED1 имеет диапазон длин волн Δλ1, а LED2 имеет диапазон длин волн Δλ2. Пучки света взаимодействуют с компонентами крови и другими компонентами ткани анализируемого объема и детектируются на фотодетекторе PD.
При этом различные компоненты крови и ткани поглощают по-разному излучение с различными длинами волн. В данном случае, для наглядности со ссылкой на фиг. 2d, различные фракции или компоненты, составляющие целевые компоненты(например, компонент 1 (K-1)и компонент 2 (K-2)) поглощают излучение с длинами волн λ1 и λ2 и характеризуются пульсацией при протекании крови, а другие, так называемые нецелевые компоненты(K-А) и (K-B), включающие ткань, хромофоры, могут поглощать, а могут и не поглощать излучение с длинами волн λ1 и λ2, но не характеризуются пульсацией или движением при протекании крови.
Таким образом, для отделения и независимого измерения целевых компонентов крови (см. фиг. 2d, 2е и 4а, 4b)необходимо выполнение двух условий: компоненты должны селективно поглощать на определенной длине волны и двигаться и/или пульсировать.
Далее будут раскрыты ключевые положения заявленного изобретения.
Ключевое положение 1 заявленного изобретения заключается:
Этап 1
Осуществляют выбор компонентов крови по их спектральным свойствам. Таким образом в процессе измерения выбираются только те компоненты крови, которые поглощают излучение испускаемое когерентным источником излучения с предварительно заданными длинами волн, например λ1, и λ2.
При этом селективность по спектральным свойствам обеспечивается высоким спектральным разрешением, обусловленным использованием когерентного источника излучения.
Ключевое положение 2 заявленного изобретения заключается:
Этап 2
Осуществляют выбор компонентов крови по их динамическим свойствам. Таким образом в процессе измерения выбираются только те компоненты (биологической ткани), которые движутся и/или пульсируют. При этом обеспечивается чувствительность к движению, обусловленное использованием когерентного источника излучения.
При этом следует отметить, что этап 1 и этап 2 не разделены по времени, и происходят одновременно, а именно одновременно происходит спектральная селекция и детектируется интерференционный сигнал на какой-то длине волны.
Этап 3
Измерение концентрации, непосредственно, выбранных на этапах 1 и 2 параметров компонентов крови, условно компонента K-1 и компонента K-2 (см. фиг.2е).
Этап 4
Выполнение оценки результатов измерения пользователем устройства измерения. В результате информирование пользователя о нормальных или отклоняющихся от нормы показателях значений компонентов крови.
Как уже указывалось ранее, выбор целевых компонентов в настоящем изобретении осуществляется по их спектральным свойствам (Ключевое положение 1) и динамическим свойствам (Ключевое положение 2). При этом в устройстве измерения используются узкополосные когерентные источники света (лазерные диоды (LD)), что обеспечивает высокое спектральное разрешение для чувствительного и точного отделения целевых компонентов по их спектральным свойствам и обеспечивает возможность детектирования интерференционного сигнала для чувствительного и точного отделения целевых компонентов по их динамическим свойствам.
При этом работа Ключевого положения 1 подразумевает следующие возможные исходные условия, см. фиг.2d, 2e:
- целевой компонент K-1 и нецелевой компонент K-А, оба поглощают излучение с длиной волны λ2,
- целевой компонент K-2 и нецелевой компонент K-В, оба поглощают излучение с длиной волны λ1,
- нецелевой компонент С не поглощает ни λ1, ни λ2.
При этом измерение поглощения для каждого компонента крови на длинах волн λ1, λ2 позволяет исключить нецелевой компонент K-С из измерений (см. фиг.2е).
При этом сигналы, поступающие на фотодетектор PD после прохождения анализируемого объема, несут информацию о каждом из компонентов крови, например сигнал Sλ1 - это сигнал регистрируемый на PD от источника излучения LD1, при его инициировании, несет информацию о целевом компоненте K-1 и нецелевом компоненте K-А, а сигнал Sλ2 - это сигнал регистрируемый на PD от источника излучения LD2, при его инициировании, несет информацию о целевом компоненте K-2 и нецелевом компоненте K-В.
В заявленном изобретении используют, преимущественно узкополосные источники излучения для измерения целевых компонентов крови, что обеспечивает точность выполняемых измерений. В то время как традиционные решения используют широкополосные источники излучения и процесс измерения выполняется, как для целевых компонентов крови, так и для нецелевых компонентов, и в результате не обеспечивает требуемую точность при измерении.
При этом в настоящем изобретении при использовании узкополосных источников излучения различные компоненты крови, например компонент K-1 и компонент K-2 измеряются по-отдельности, что исключает возникновение перекрытия спектров излучения.
На фиг.2а и 2b наглядно продемонстрированы графики, иллюстрирующие спектры излучения узкополосных и широкополосных источников излучения, при этом сплошной линией на фиг.2а и 2b показан широкополосный спектр а штрих-пунктирной линией обозначен узкополосный спектр излучения При этом на фиг.2а и 2b объединены различные параметры: спектры излучения и коэффициенты поглощения (т.е. кривые, характеризующие спектры излучения и кривые, характеризующие коэффициенты поглощения в зависимости от длины волны), лишь для иллюстративных целей.
На фиг.2а представлены графики, иллюстрирующие широкополосные и узкополосные спектры излучения, при этом два узкополосных источника излучения могут излучать на длинах волн достаточно отстоящих друг от друга и совпадающих с длинами волн поглощения нецелевого и целевого компонента, но не совпадающих друг с другом, при этом широкополосный источник излучения имеет спектр достаточно широкий, включающий в себя одновременно длины волн поглощения целевого компонента (λ1) нецелевого компонента(λнецелевой ).
На фиг.2b представлены графики, иллюстрирующие несколько широкополосных и узкополосных источников излучения, центральные длины волн которых совпадают с длинами волн поглощения разных целевых компонентов (λ1, λ2), при этом даже если центральные длины волн излучения широкополосных источников точно совпадают полосами поглощения искомых компонентов, другая часть спектра излучения этих источников совпадает с другим компонентом.
Таким образом, при использовании широкополосного источника изучения, принципиально невозможно измерить степень поглощения (или какую-либо иную спектральную характеристику) оптического излучения на одной конкретной длине волны и, следовательно, невозможно селективно измерить концентрацию (или какой-либо иной параметр) отдельно взятого целевого компонента ткани.
Кроме того, на фиг.2с представлены графики, иллюстрирующие коэффициент поглощения µa(λ) в (1/см) компонентов крови в зависимости от длины волны λ(нм), cоответствующие уровням оксигенации крови 80%, 88%, 95% и 95%.
Как наглядно, проиллюстрировано на графиках фиг.2с, сигналы, получаемые на фотодетекторе, характеризующие коэффициенты поглощения могут быть различными для разных концентраций или уровней оксигенации крови и на разных длинах волн излучения, поэтому для получения достоверных данных измерений необходимо измерять сигнал на точно заданной длине волны.
Как уже указывалось ранее, одним из преимуществ заявленного изобретения является высокая спектральное разрешение получаемых данных измерений, позволяющих в результате обработки данных получить в реальном времени точные данные о компонентах крови субъекта. Одним из факторов, обеспечивающих указанный результат является использование узкополосных когерентных источником излучения.
В одном из предпочтительных вариантов осуществления изобретения для облучения анализируемого объема ткани используются два источника излучения, один - LD1 с длиной волны λ1, находящийся, предпочтительно, в видимом диапазоне длин волн <800 нм и второй - LD2 с длиной волны λ2, находящийся, предпочтительно, в ближнем инфракрасной диапазоне длин волн >800 нм. Например, один лазерный диод может иметь длину волны λ1=650 нм, второй - длину волны λ2=940 нм. При использовании фотодетекторов на основе кремния предпочтительные диапазоны для выбора λ1, и λ2 в диапазонах: 400 нм - 800 нм и 800 нм - 1100 нм, соответственно. Изобретение не исключает использование иных приемников оптического излучения. В этом случае выбор длин волн можно расширить на диапазон <400 нм и >1100 нм, соответственно.
При этом указанные диапазоны значений не ограничивается представленными значениями, а приведены в настоящем описании только в качестве примера.
Далее будет детально раскрыто Ключевое положение 1 настоящего изобретения.
Как уже ранее указывалось в настоящем изобретении осуществляют выбор компонентов крови по их спектральным свойствам. Таким образом в процессе измерения выбираются только те компоненты крови, которые поглощают излучение испускаемое когерентным источником излучения с предварительно заданными длинами волн, например λ1, λ2, .....λn.
Для дальнейшего анализа общий гемоглобин (tHb) можно упрощенно рассмотреть состоящим из двух компонент: оксигенированного (О2Hb) и неоксигенированного (RHb) гемоглобина. Без потери общности выводов можно принять вклад других форм гемоглобина, например, метгемоглобина (MetHb), сульфгемоглобина (SHb), в спектр поглощения цельной крови незначительным.
Поглощение излучения на различных длинах волн различными компонентами крови определяется коэффициентом экстинкции(е(λ)).
В соответствии с указанным выше допущением, коэффициент экстинкции цельной крови будет определяться коэффициентами экстинкции оксигенированного и восстановленного гемоглобина в следующей пропорции:
etHb(λ)=eO2Hb(λ)·S+eRHb(λ)·(1-s) (4),
где etHb(λ), eO2Hb(λ), eRHb(λ) - коэффициенты экстинкции общего гемоглобина, оксигенированного гемоглобина и восстановленного гемоглобина в зависимости от длины волны λ, соответственно.
S - сатурация(SPO2), т.е. доля насыщенного кислородом гемоглобина (О2Hb) относительно общего гемоглобина в крови.
Для проведения расчетов можно воспользоваться значениями коэффициентов экстинкции известными из публикации:
Steven L Jacques, Optical properties of biological tissues: a review, Physics in Medicine & Biology, Volume 58, Number 11, 2013.
Поглощение излучения (безразмерная величина) образцом ткани, зависит от концентрации анализируемого компонента в ткани (в данном случае компонентов крови), оптического пути от источника излучения до фотодетектора, и длины волны, и определяется следующим выражением(5):
A(λ)=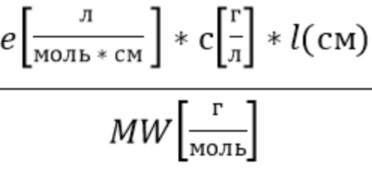
где
A(λ) - поглощение образца ткани в зависимости от концентрации c анализируемого компонента крови, в данном случае рассматривается гемоглобин, длины оптического пути l, длины волны λ,
e - коэффициент экстинкции гемоглобина, например общего гемоглобина, оксигенированного гемоглобина и восстановленного гемоглобина, в зависимости от длины волны λ.
c - концентрация гемоглобина,
MW(г/моль) - молекулярный вес молекулы гемоглобина,
l(см) - длина оптического пути излучения от источника излучения, прошедшее образец и падающее на фотодетектор.
Для визуализации спектров поглощения удобно оперировать с коэффициентом поглощения µa (ед. измерения 1/см) с помощью выражения(6):
µa(λ) ~ 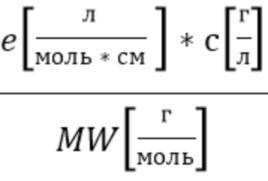
e - коэффициент экстинкции гемоглобина, например общего гемоглобина, оксигенированного гемоглобина и восстановленного гемоглобина в зависимости от длины волны λ.
c - концентрация гемоглобина,
MW(г/моль) - молекулярный вес молекулы гемоглобина.
Пропускание (Т(λ))представляет собой отношение интенсивности излучения, прошедшего через образец(исследуемый компонент) к интенсивности излучения падающего на образец и связано с поглощением выражением:
Т(λ)=10-А(λ) (7)
где А(λ) - поглощения образца (компоненты крови и/или ткани) в зависимости от длины волны λ.
Опишем подробнее влияние ширины спектра излучения источника на возможность спектрального разделения поглощающих компонент в анализируемом объеме ткани. Для этого можно промоделировать процесс поглощения излучения при заданных спектральных свойствах источника и анализируемого образца ткани. Спектр излучения источника можно условно задать в форме некоторого распределения имеющего конечную ширину, например, распределения Гаусса (8):
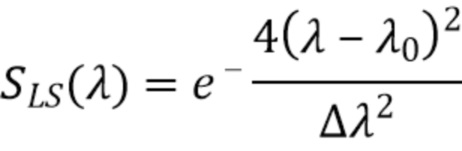
где
SLS(λ) - спектр излучения источника излучения(LS) (усл.единицы)
Δλ - полоса частот источника излучения (нм)
λо - центральная длина волны источника излучения(нм)
При этом спектр излучения S’LS(λ) источника излучения, прошедшего через образец, в данном случае компонент крови можно представить следующим выражением (9):
S’LS(λ)=SLS(λ)*ТtHb(λ)
где SLS(λ) - спектр излучения источника излучения, падающего на образец(усл.единицы),
ТtHb(λ) - коэффициент пропускания излучения образца компонента крови, в данном случае общего гемоглобина на длине волны λ.
Если не учитывать кривую спектральной чувствительности фотодетектора, общая интенсивность излучения IPD, регистрируемого на фотодетекторе(PD) определяется посредством следующего выражения (10):

где S’LS(λ) - спектр излучения источника излучения, прошедшего через образец.
Посредством выражения (10) можно рассчитать общую интенсивность излучения источника с центральной длиной волны λо прошедшего через образец. Например, такой расчет можно сделать для источника LS1 с центральной длиной волны 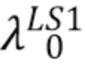 и для источника LS2 с центральной длиной волны
и для источника LS2 с центральной длиной волны 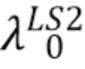 . Для спектрофотометрических измерений важны не абсолютные значения интенсивностей на конкретных длинах волн, а отношение интенсивностей излучения измеренных на разных длинах волн (11):
. Для спектрофотометрических измерений важны не абсолютные значения интенсивностей на конкретных длинах волн, а отношение интенсивностей излучения измеренных на разных длинах волн (11):
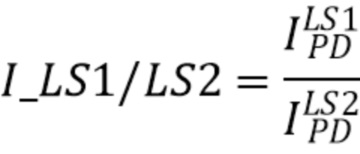
I_LS1/LS2 - отношение интенсивностей (I) излучения источника излучения 1(LS1) и источника излучения 2(LS2),
I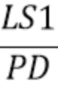 - общая интенсивность излучения от источника излучения LS1, прошедшего через образец и зарегистрированного на фотодетекторе(PD)(усл. ед.).
- общая интенсивность излучения от источника излучения LS1, прошедшего через образец и зарегистрированного на фотодетекторе(PD)(усл. ед.).
I
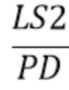 - общая интенсивность излучения от источника излучения LS2, прошедшего через образец и зарегистрированного на фотодетекторе(PD) (усл. ед.).
- общая интенсивность излучения от источника излучения LS2, прошедшего через образец и зарегистрированного на фотодетекторе(PD) (усл. ед.).
В качестве примера для расчетов авторами изобретения были рассмотрено излучение на длинах волн 670 нм и 940 нм, которые часто используются в схемах пульсоксиметрии. С точностью до калибровочного коэффициента отношение интенсивностей на выбранных длинах волн дает оценку степени оксигенации крови. Методы расчетов калибровочного коэффициента для оценки степени оксигенации раскрыты в публикации:
Toshiyo Tamura, Current progress of photoplethysmography and SPO2 for health monitoring, Biomedical Engineering Letters (2019) 9:21-36, https://doi.org/10.1007/s13534-019-00097-w .
Как уже описывалось ранее, при прохождении широкополосного излучения через анализируемый объем, в частности, биологическую ткань, излучение на разных длинах волн поглощается неодинаково (см. фиг.2с). Излучение на одних длинах волн поглощается в большей степени, излучение на других длинах волн поглощается в меньшей степени. В результате этого изначальный спектр излучения источника после прохождения через исследуемый объем искажается.
На фиг.7а и 7b схематично представлены: жирная линия - изменения в спектрах излучения широкополосного источника излучения после прохождения через анализируемый объем (по оси х представлены длины волн (нм)); область со сплошной заливкой - спектр пропускания (Т(λ)), полученные в результате математического моделирования, описанных выше на основании выполнения соотношений (8)-(11). На самих графиках 7a и 7b показаны изменения в спектре широкополосного излучения (жирная, черная линия), прошедшего через анализируемый объем, в качестве примера приведены два спектра на разных длинах волн: 670 нм и 805 нм, соответственно.
Форма спектра изменилась незначительно, однако спектральный состав излучения претерпел существенные изменения. Центральная длина волны излучения сместилась. На графиках 7a и 7b обозначено положение корректной (исходной) центральной длины волны излучения источника (сплошная линия) и центральной длина волны излучения (некорректной), прошедшего через исследуемый объект (пунктирная линия). Интенсивности корректной и некорректной длин волн также отличаются. Для спектральных измерений важно точно определить интенсивность излучения, прошедшего через исследуемый объект, на конкретно заданной длине волны. В данном примере, в результате использования широкополосного источника излучения измеряется некорректное (завышенное) значение интенсивности, которое соответствует смещенной (некорректной) длине волны излучения. Эти эффекты, которые проиллюстрированы на фиг.7a и 7b, приводят, как следствие, к некорректным результатам детально описанным со ссылками на фиг.8a и 8b.
Авторы изобретения провели сопоставительный анализ способа и устройства измерения на основании узкополосного когерентного источника излучения в соответствии с заявленным изобретением и традиционными спектральными средствами измерения, основанными на широкополосных источниках измерения.
На фиг.8а и 8b представлены графики, демонстрирующие результаты оценки или определений параметров компонентов крови, в данном случае концентрации общего гемоглобина и уровня оксигенации в зависимости от использования широкополосного и узкополосного источника излучения.
Авторы изобретения рассчитывали отношение интенсивностей излучения для широкополосного источника излучения, в данном случае рассматривался светодиод (LED) и узкополосного когерентного источника излучения, в данном случае рассматривался лазерный диод(LD), для различных концентраций общего гемоглобина(tHb) и уровня насыщения крови кислородом (степени оксигенации) (SpO2).
Из уровня техники известно, что для определения какого-либо параметра крови, например, степени оксигенации, измеряется отношение интенсивностей оптического излучения, прошедшего через анализируемый объем ткани, на разных длинах волн, т.е. измеряется отношение пропускания (или поглощения) ткани на этих длинах волн. Таким образом, данный параметр (отношение интенсивностей оптического излучения, прошедшего через ткань, на разных длинах волн) и реакция этого параметра на какие-либо изменения в составе или состоянии анализируемого объема ткани является одним из основных критериев, характеризующих эффективность измерительного устройства, такие как точность, чувствительность, динамический диапазон и прочее.
В качестве Примера реализации заявленного изобретения на основании узкополосного когерентного источника излучения авторы изобретения измеряли общую интенсивность излучения 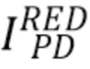 с центральной длиной волны 670 нм (красная полоса спектра излучения), прошедшего через образец и зарегистрированного на фотодетекторе(PD), и общую интенсивность излучения
с центральной длиной волны 670 нм (красная полоса спектра излучения), прошедшего через образец и зарегистрированного на фотодетекторе(PD), и общую интенсивность излучения 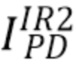 с центральной длиной волны 940 нм (инфракрасная полоса спектра излучения), прошедшего через образец и зарегистрированного на фотодетекторе(PD)и на основании измеренных общих интенсивностей рассчитали отношение указанных интенсивностей (далее - сигнал) I_RED/IR2 излучения на длинах волн 670 нм и 940, соответственно, для различных концентраций общего гемоглобина(tHb) и уровня оксигенации (SpO2). Для сравнения аналогичные расчеты были проведены также для широкополосного источника излучения LED. При этом центральные длины волны излучения широкополосного источника излучения были выбраны равными центральным длинам волн узкополосного источника излучения: 670 нм и 940 нм, соответственно.
с центральной длиной волны 940 нм (инфракрасная полоса спектра излучения), прошедшего через образец и зарегистрированного на фотодетекторе(PD)и на основании измеренных общих интенсивностей рассчитали отношение указанных интенсивностей (далее - сигнал) I_RED/IR2 излучения на длинах волн 670 нм и 940, соответственно, для различных концентраций общего гемоглобина(tHb) и уровня оксигенации (SpO2). Для сравнения аналогичные расчеты были проведены также для широкополосного источника излучения LED. При этом центральные длины волны излучения широкополосного источника излучения были выбраны равными центральным длинам волн узкополосного источника излучения: 670 нм и 940 нм, соответственно.
На фиг. 8a представлены графики, демонстрирующие кривые сигнала (относительные единицы измерения) для широкополосного источника излучения (светодиода-LED), представленного пунктирной линий на графике и узкополосного источника излучения (лазерный диод-LD), представленного сплошной линией, в зависимости от концентрации общего гемоглобина (г/л).
На фиг.8b представлены графики, демонстрирующие кривые сигнала (относительные единицы измерения) для широкополосного источника излучения (светодиода-LED), представленного пунктирной линий на графике и узкополосного источника излучения (лазерный диод-LD), представленного сплошной линией, в зависимости от уровня оксигенации(%).
Как видно на графиках 8a и 8b при изменении концентрации общего гемоглобина или степени оксигенации на одинаковую величину, сигнал, соответствующий узкополосному источнику излучения имеют более выраженный отклик (Эффект 1 на фиг.8a и 8b), т.е чувствительность к изменению измеряемого параметра при использовании узкополосного источника излучения в 2-3 раза выше чувствительности к измерениям при использовании широкополосного источника излучения.
Кроме того, как видно из фиг.8a, 8b кривая зависимости сигнала широкополосного источника от концентрации общего гемоглобина и степени насыщения крови кислородом значительно смещена относительно аналогичной кривой для узкополосного источника. При этом с использованием узкополосного источника излучения измеряется пропускание (или поглощение) анализируемого объема ткани на точно заданных целевых длинах волн, т.е. 670 нм и 940 нм, соответственно.
При этом с использованием широкополосного источника излучения измеряется общее (или среднее) пропускание (или поглощение) анализируемого объема ткани в широком диапазоне длин волн, соответствующем полосе излучения источника, содержащем в том числе целевые длины волн, т.е. 670 нм и 940 нм, соответственно. При этом пропускание и/или поглощение анализируемого объема ткани на других длинах волн, входящих диапазон длин волн, излучаемых широкополосным источником, может значительно отличаться от пропускания (поглощения) на целевых длинах волн.
Усреднение, или суммирование по всему диапазону длин волн, излучаемых широкополосным источником, приводит к ошибке в измерении пропускания и/или поглощения на целевых длинах волн и, следовательно, к ошибке в оценке концентрации компонентов крови. Из различий между двумя кривыми следует, что значения концентрации общего гемоглобина и степени насыщения крови кислородом, измеренные устройством на основе широкополосных источников, значительно отличаются от истинных значений, измеренных точно на целевых длинах волн при помощи узкополосных источников. Таким образом, как следует из фиг.8а и 8b, при одинаковых концентрациях гемоглобина и одинаковой степени оксигенации точность измерений более высокая для узкополосного источника излучения по сравнению с широкополосным источником излучения (Эффект 2 на фиг.8a и 8b).
Кроме того, выбор целевых компонентов в настоящем изобретении осуществляется по их динамическим свойствам(Ключевое положение 2).
Ключевое положение 2 заявленного изобретения
Ключевое положение 2 основано на когерентном детектировании интерферометрического сигнала от компонентов крови.
Для описания динамических свойств компонентов крови следует остановиться на пояснении процессов, происходящих при облучении указанных компонентов когерентным оптическим излучением на определенных длинах волн, условно, в качестве примера можно указать длины волн λ1 и λ2.
Целевые компоненты крови (K-1, K-2) и нецелевые компоненты крови и ткани (K-А, K-В, K-С(не показана)) при воздействии на них излучения от разных источников излучения по меньшей мере частично поглощают и/или рассеивают свет на определенной длине волны (см.фиг.4а и 4b). Например целевой компонент K-1 и нецелевой компонент K-А поглощают излучение на одной длине волны, например λ2, но целевой компонент K-1 движется, а нецелевой компонент K-А не движется и компонент K-2 и нецелевой компонент K-B поглощают излучение на длине волны λ1, но целевой компонент K-2 движется, а нецелевой компонент В не движется.
При рассеянии когерентного оптического излучения на движущейся частице (например, клетке крови) параметры излучения (частота, длина волны) изменяются, в соответствии с эффектом Доплера, на малую величину. При этом величина изменения пропорциональна скорости движения частицы. При рассеянии когерентного излучения на статичной (неподвижной) частице (например, прочие компоненты биологической ткани) параметры излучения (частота, длина волны) не изменяются. При смешении когерентного излучения, испытавшего рассеяние на движущейся частице, и некоторого опорного когерентного излучения на апертуре фотодетектора возникает сигнал биения, интерференционный сигнал, флуктуирующий с некоторой разностной частотой (периодом). В качестве опорного излучения может выступать как излучение, рассеявшееся на движущейся частице, так и излучение, рассеявшееся на неподвижной частице. При этом разностная частота (период) интерференционного сигнала пропорционален разности между параметрами двух интерферирующих частей излучения (частотой, длиной волны).
Работа Ключевого положения 2 подразумевает следующие возможные исходные условия для целевых и нецелевых компонентов крови:
- целевые компоненты K-1 и K-2 движутся и регистрируемые на фотодетекторе соответствующие сигналы  и
и 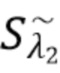 от этих компонент K-1 и K-2, является быстро флуктуирующими,
от этих компонент K-1 и K-2, является быстро флуктуирующими,
- нецелевые компоненты K-А и K-В не движутся и регистрируемые на фотодетекторе соответствующие сигналы 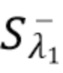 и
и 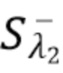 от этих компонент K-A и K-B, медленно меняются со временем или остаются постоянными.
от этих компонент K-A и K-B, медленно меняются со временем или остаются постоянными.
Таким образом, с точки зрения когерентного детектирования сигнал, попадающий на фотодетектор(фотоприемник) можно разделить на постоянную составляющую и флуктуирующую составляющую, которые составляют общий сигнал на фотодетекторе от лазерного диода 1 (LD1), который равен сумме двух составляющих:
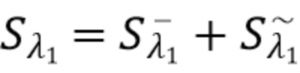 (1)
(1)
где
Sλ1 - общий сигнал, регистрируемый на фотодетекторе,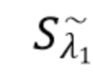 - флуктуирующий сигнал(составляющая), регистрируемый на фотдетекторе,
- флуктуирующий сигнал(составляющая), регистрируемый на фотдетекторе, 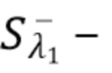 постоянный сигнал(составляющая), регистрируемый на фотодетекторе.
постоянный сигнал(составляющая), регистрируемый на фотодетекторе.
Общий сигнал на фотодетекторе от лазерного диода 2 (LD2) равен сумме двух составляющих:
Sλ2=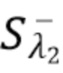 +
+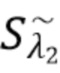 (2)
(2)
Sλ2 - общий сигнал, регистрируемый на фотодетекторе,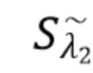 - флуктуирующий сигнал(составляющая), регистрируемый на фотодетекторе,
- флуктуирующий сигнал(составляющая), регистрируемый на фотодетекторе,  постоянный сигнал(составляющая), регистрируемый на фотодетекторе.
постоянный сигнал(составляющая), регистрируемый на фотодетекторе.
Таким образом,  - флуктуирующий сигнал, регистрируемый на фотодетекторе, получаемый при функционировании лазерного диода 1 (LD1) несет информацию только о целевом компоненте K-1, а
- флуктуирующий сигнал, регистрируемый на фотодетекторе, получаемый при функционировании лазерного диода 1 (LD1) несет информацию только о целевом компоненте K-1, а 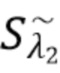 - флуктуирующий сигнал, регистрируемый на фотодетекторе, получаемый при функционировании лазерного диода 2 (LD2) несет информацию о целевом компоненте K-2.
- флуктуирующий сигнал, регистрируемый на фотодетекторе, получаемый при функционировании лазерного диода 2 (LD2) несет информацию о целевом компоненте K-2.
Таким образом, авторы изобретения при регистрации общего сигнала на фотодетекторе могут удалить из него постоянную составляющую сигнала и таким образом получить флуктуирующую составляющую сигнала и следовательно, определить целевую компоненту по ее динамическим свойствам, в данном случае, движения.
Далее со ссылкой на графики на фиг.3а-3с и фигуры 4a-4f опишем более детально процесс выделения целевых компонентов крови Излучение на длине волны λ1 , испускаемое источником излучения LD1 рассеивается на целевых и нецелевых компонентах крови, информация о которых при детектировании на фотодетекторе PD заключена в условно постоянной или медленноменяющейся и флуктуирующей составляющих сигнала. Аналогичный процесс происходит для источника LD2. При этом сигналы от LD1, LD2 можно описать выражениями (1) и (2), описанными выше, и характеризующими общие сигналы(Sλ1 или Sλ2), каждый из которых состоит из постоянной и флуктуирующей составляющих сигнала.
При этом указанный общий сигнал, условно Sλ 1) детектируется в определенный период времена и амплитуды постоянного 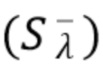 и флуктуирующего (
и флуктуирующего (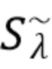 ) составляющих сигнала представлены на фиг.3а, где спектр высокочастотных областей амплитуды сигнала соответствует флуктуирующей составляющей сигнала от подвижной компоненты, спектр низкочастотной составляющей сигнала соответствует медленно меняющейся, т.е. по существу, постоянной составляющей сигнала от не движущейся компоненты.
) составляющих сигнала представлены на фиг.3а, где спектр высокочастотных областей амплитуды сигнала соответствует флуктуирующей составляющей сигнала от подвижной компоненты, спектр низкочастотной составляющей сигнала соответствует медленно меняющейся, т.е. по существу, постоянной составляющей сигнала от не движущейся компоненты.
Далее 2) выделяется спектр указанного сигнала с заданной полосой, соответствующей флуктуирующей составляющей сигнала (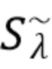 ) от подвижной компоненты и постоянной составляющей сигнала
) от подвижной компоненты и постоянной составляющей сигнала 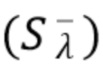 от неподвижной компоненты.
от неподвижной компоненты.
На фиг.3b представлены кривые, характеризующие изменение мощности (P) сигнала в зависимости от частоты(F) сигнала для флуктуирующей составляющей сигнала (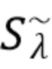 ) от подвижной компоненты и постоянной или составляющей или сигнала
) от подвижной компоненты и постоянной или составляющей или сигнала 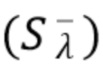 от неподвижной компоненты, при этом сплошная линия показывает мощность исходного сигнала, содержащего и медленноменяющуюся и быстроменяющуюся компоненты, а пунктирная линия показывает мощность только флуктуирующей компоненты.
от неподвижной компоненты, при этом сплошная линия показывает мощность исходного сигнала, содержащего и медленноменяющуюся и быстроменяющуюся компоненты, а пунктирная линия показывает мощность только флуктуирующей компоненты.
На следующем этапе путем фильтрации и обработки сигнала выполняется восстановление результирующего сигнала, содержащего только флуктуирующую составляющую сигнала (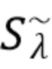 ). На фиг.3с представлена амплитуда результирующего сигнала в зависимости от времени для только флуктуирующей составляющей сигнала (
). На фиг.3с представлена амплитуда результирующего сигнала в зависимости от времени для только флуктуирующей составляющей сигнала (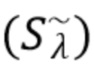 ), соответствующей движущимся компонентам.
), соответствующей движущимся компонентам.
Далее следует пояснить процессы, которые проходят при облучении исследуемого объема тела субъекта одним или более источниками излучения (LD1, LD2).
На фиг.4a условна представлена схема, иллюстрирующая процесс селекции по динамическим свойствам компонент, происходящий в целевой зоне при облучении когерентным источником излучения LD1 с длиной волны λ1, где позициями 1 и 2 обозначены лучи света (излучения), взаимодействующие с подвижными частицами крови (целевые компоненты, представляющие кровь), а позицией 3 обозначены лучи света (излучение), взаимодействующее с не подвижными частицами (нецелевой компонент, представляющий ткань или статичный компонент ткани). При этом лучи света представляют собой световые сигналы 1, 2 и 3, которые регистрируются на фотодетекторе(PD).
При облучение целевых (K-1),(K-2) и нецелевых компонентов(K-A), (K-B) когерентным излучением возникает интерференция световых волн друг с другом и с опорным излучением, в данном случае под опорным излучением рассматривается излучение, рассеявшееся на целевых и нецелевых компонентах, излучение, отразившееся от поверхности ткани (кожи), излучение, отразившееся от границ раздела любых оптических элементов, использованных в конструкции устройства (линзы, зеркала, окна, пленки, покрытия и т.д.).
При этом могут рассматриваться три варианта интерференции световых сигналов:
1) Интерференция излучения от целевой подвижной компоненты K-1 и опорным излучением и от целевой подвижной компоненты K-2 (см. фиг.4b) и опорным излучением, в результате получается высокочастотный, сильный (с большой мощностью) флуктуирующий сигнал (полоса 2 частот сигнала)-как представлено на фиг.4с.
2) Взаимное интерференция излучения (световые лучи 1, 2) от целевой подвижной компоненты K-1 и от целевой подвижной компоненты K-2 (полоса 1 частот сигнала), в результате получается низкочастотный слабый (малой мощности) сигнал, как представлено на фиг. 4d.
Сигнал (световой луч 3) от нецелевой не движущейся компоненты K-А (и/или компоненты K-В), который представляет собой медленно изменяющийся сигнал (полоса 0 частот сигнала), как представлено на фиг. 4e. При этом полосы 1 и 2 частот сигнала характеризуют  (флуктуирующий сигнал), а полоса 0 частот сигнала характеризует
(флуктуирующий сигнал), а полоса 0 частот сигнала характеризует 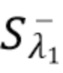 (постоянный сигнал).
(постоянный сигнал).
На фотодетекторе (PD) регистрируются световые сигналы 1, 2 и 3, что описывается соотношением 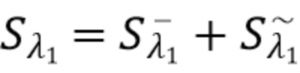 (1), описанным выше.
(1), описанным выше.
При этом авторы изобретения, измеряют на фотодетекторе (PD) (см. фиг.4f), как флуктуирующие сигналы ( ) в полосе 1 частоты сигнала, так и в полосе 2 частот сигнала, а также в обеих полосах 1 и 2 частот сигнала, что повышает точность измерения поглощения только компонентов крови, исключая другие компоненты целевой зоны субъекта.
) в полосе 1 частоты сигнала, так и в полосе 2 частот сигнала, а также в обеих полосах 1 и 2 частот сигнала, что повышает точность измерения поглощения только компонентов крови, исключая другие компоненты целевой зоны субъекта.
Кроме того, возможность исключения (фильтрации) постоянного сигнала 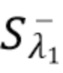 (полоса 0 частот сигнала на фиг.4f), из общего сигнала Sλ1 , характеризующего артефакты движения и/или шумы, обеспечивает высокую устойчивость к смещениям измерительного устройства и измеряемого объекта относительно друг друга.
(полоса 0 частот сигнала на фиг.4f), из общего сигнала Sλ1 , характеризующего артефакты движения и/или шумы, обеспечивает высокую устойчивость к смещениям измерительного устройства и измеряемого объекта относительно друг друга.
Следует отметить, что фильтрация детектированных интерференционных сигналов, а именно постоянного сигнала 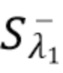 из общего сигнала Sλ1 , как указано выше, выполняется в соответствии с заданной полосой частот сигнала, в которой локализованы частоты интерференционных биений, характеризующих динамику компонентов крови, с помощью аналогового или цифрового фильтра, например одного из: фильтр верхних частот, полосно-пропускающий фильтр. При этом на этапе фильтрации детектированных интерференционных сигналов в соответствии с заданной полосой частот, заданная полоса частот F может находиться в диапазоне от Fmin=500 Гц до Fmax=10 кГц, и соответствует более высоким частотам интерференционных биений, по сравнению с другими детектированными интерференционными сигналами, зарегистрированными на по меньшей мере одном фотодетекторе и заданная полоса частот F может находиться в диапазоне от Fmin=50 Гц до Fmax=500 Гц, и соответствует более низким частотам интерференционных биений, по сравнению с другими детектированными интерференционными сигналами, зарегистрированными на по меньшей мере одном фотодетекторе.
из общего сигнала Sλ1 , как указано выше, выполняется в соответствии с заданной полосой частот сигнала, в которой локализованы частоты интерференционных биений, характеризующих динамику компонентов крови, с помощью аналогового или цифрового фильтра, например одного из: фильтр верхних частот, полосно-пропускающий фильтр. При этом на этапе фильтрации детектированных интерференционных сигналов в соответствии с заданной полосой частот, заданная полоса частот F может находиться в диапазоне от Fmin=500 Гц до Fmax=10 кГц, и соответствует более высоким частотам интерференционных биений, по сравнению с другими детектированными интерференционными сигналами, зарегистрированными на по меньшей мере одном фотодетекторе и заданная полоса частот F может находиться в диапазоне от Fmin=50 Гц до Fmax=500 Гц, и соответствует более низким частотам интерференционных биений, по сравнению с другими детектированными интерференционными сигналами, зарегистрированными на по меньшей мере одном фотодетекторе.
При этом указанные диапазоны значений не ограничивается представленными значениями, а приведен в настоящем описании только в качестве примера.
Далее, осуществляют аналого-цифровую выборку фильтрованных сигналов с частотой соответствующей заданной полосе частот фильтрованного сигнала, с формированием дискретных фильтрованных сигналов, с помощью АЦП. При этом аналого-цифровая выборка фильтрованного сигнала осуществляется с частотой дискретизации FD удовлетворяющей критерию Найквиста для заданной полосы частот F: FD ≥ 2·Fmax и с частотой дискретизации FD ниже порогового значения соответствующего критерию Найквиста для заданной полосы частот, FD < 2·Fmax, так что после аналого-цифровой выборки фильтрованный высокочастотный сигнал переносится в низкочастотную область: F < FD/2.
Далее выделяют из дискретных фильтрованных сигналов (или вычисление?) спектрально-временные признаки 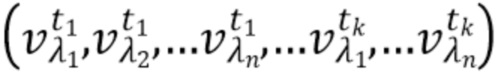 , характеризующие спектральные и динамические свойства компонентов крови,
, характеризующие спектральные и динамические свойства компонентов крови,
где λ1, λ2, λ3,.....λn - индекс, указывающий длину волны,
t1,….tk - индекс, указывающий временной признак, при этом спектрально-временной признак 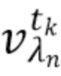 соответствует временному признаку
соответствует временному признаку 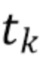 , измеренному на длине волны
, измеренному на длине волны 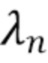 , указанного дискретных фильтрованных сигналов.
, указанного дискретных фильтрованных сигналов.
Следует отметить, что набор спектрально-временных признаков 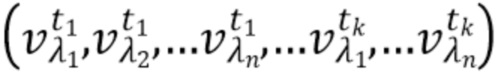 сигналов для каждой из по меньшей мере двух длин волн представляет собой по меньшей мере одно из: интенсивность рассеянного излучения, полная мощность сигнала, мощность в заданной полосе частот сигнала, моменты спектра сигнала, характерные (преобладающие) частоты сигнала, и комбинации указанных спектрально-временных признаков, абсолютные значения указанных спектрально-временных признаков, относительные значения указанных спектрально-временных признаков, линейные комбинации указанных спектрально-временных признаков на различных длинах волн, нелинейные комбинации указанных спектрально-временных признаков на различных длинах волн.
сигналов для каждой из по меньшей мере двух длин волн представляет собой по меньшей мере одно из: интенсивность рассеянного излучения, полная мощность сигнала, мощность в заданной полосе частот сигнала, моменты спектра сигнала, характерные (преобладающие) частоты сигнала, и комбинации указанных спектрально-временных признаков, абсолютные значения указанных спектрально-временных признаков, относительные значения указанных спектрально-временных признаков, линейные комбинации указанных спектрально-временных признаков на различных длинах волн, нелинейные комбинации указанных спектрально-временных признаков на различных длинах волн.
На основании полученного набора спектрально-временных признаков 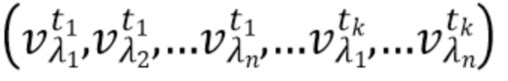 сигналов вычисляют концентрацию компонентов крови с1…сm.
сигналов вычисляют концентрацию компонентов крови с1…сm.
Указанные компоненты крови определяются следующими соотношениями (3)
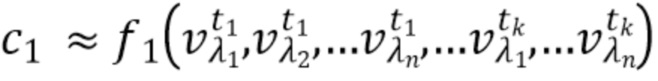
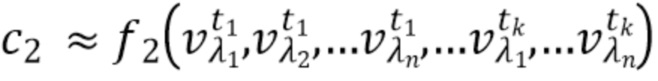
…
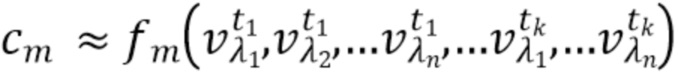
где с1…сm концентрации компонентов крови, которые характеризуются соответствующим набором спектрально-временных признаков 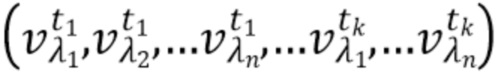 сигналов,
сигналов,
f1, f2, fm - функциональные зависимости полученного набора спектрально-временных признаков сигналов 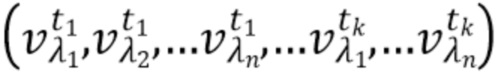 и определяемых концентраций компонентов крови.
и определяемых концентраций компонентов крови.
Процеcc, происходящий в анализируемом объеме ткани при облучении излучении, детально было описан выше со ссылками на фиг.4а-4f.
При этом в одном предпочтительном варианте реализации авторы фильтруют электрический сигнал, регистрируемый на фотодетекторе PD с помощью аналогового или цифрового высокочастотного фильтра сохраняя для дальнейшей обработки интерферометрический сигнал расположенный в полосе 2 частот сигнала (фиг.4f) от примерно 500 Гц до 10 кГц, и соответствует более высоким частотам интерференционных биений, по сравнению с другими детектированными интерференционными сигналами, зарегистрированными на фотодетекторе. При этом указанный диапазон не ограничивается представленными значениями, а приведен в настоящем описании только в качестве примера.
Как уже пояснялось ранее, в результате интерференции излучения от целевой подвижной компоненты K-1 и опорным излучением и от целевой подвижной компоненты K-2 и опорным излучением, в результате получается высокочастотный, сильный (с большой мощностью) флуктуирующий сигнал (полоса 2 частот сигнала)(см. на фиг.4c и 4d).
Как уже было описано ранее, этот высокочастотный флуктуирующий сигнал, характеризующий движущиеся и/или пульсирующие компоненты крови и подлежит детектированию и дальнейшему аналого-цифровому преобразованию и обработке.
При этом наличие в заявленном устройстве только двух узкополосных когерентных источников излучения не ограничивается, их может быть несколько, т.е. 2 или более: LD1, LD2… LDn с длинами волн λ1, λ2, .....λn, соответственно (см.фиг.5).
При этом увеличение количества источников излучения позволяет повысить точность измерений и чувствительность к измерениям SpO2 и ко всем измерениям гемоглобина крови анализируемого объема ткани. Кроме того, расширяет возможности исследований дополнительных параметров анализируемого объема ткани, помимо упомянутых оксигенированного кислорода SpO2 и уровня общего гемоглобина (Hb), и только уровень общего гемоглобина (Hb), этими параметрами могут быть карбоксигемоглобин (COHb), метгемоглобин (MetHb) и т.д., что значительно расширяет диапазон измеряемых параметров компонентов крови для пользователя в реальном режиме времени.
Как мы уже указывали ранее одним из основных моментов сбора данных сигналов, детектируемых на фотодетекторе PD является фильтрация сигнала в определенной полосе частот.
В одном варианте реализации изобретения предусматривается фильтрация сигнала с помощью аналогового или цифрового широкополосного фильтра, с выбором для дальнейшей обработки интерферометрического сигнала из полосы 1 частот сигнала(фиг.4f).
Как уже пояснялось ранее, в результате взаимной интерференции световых лучей 1, 2 от целевой подвижной компоненты K-1 и от целевой подвижной компоненты K-2, при этом полоса 1 частот сигнала составляет, примерно от 50 Гц до 500 Гц), и соответствует более низким частотам интерференционных биений, по сравнению с другими детектированными интерференционными сигналами, зарегистрированными на фотодетекторе. При этом указанный диапазон не ограничивается представленными значениями, а приведен в настоящем описании только в качестве примера. Таким образом, получается низкочастотный сигнал малой мощности, как представлено на фиг. 4d и 4f.
Этот низкочастотный сигнал, также характеризует пульсирующие компоненты крови и подлежит дальнейшей обработке. Для этого сигнал предварительно обрабатывается полосно-пропускающим фильтром чтобы выделить только те компоненты сигнала, которые соответствуют диапазону полосы 1 частот сигнала. После этого сигнал подвергается аналого-цифровому преобразованию с частотой дискретизации равной или большей частоты достаточной для выполнения критерия Найквиста для диапазона полосы 1 частот сигнала, детально описанной ранее.
Указанный вариант реализации позволяет легко использовать заявленный способ измерения совместно с известными микросхемами и контроллерами для работы с PPG сигналами без дополнительных требований к модификациям известных средств обработки и измерений.
Далее необходимо установить соответствие между измеренными значениями интенсивности прошедшего через образец излучения и спектрально-временными признаками, выделенными из сигнала, и концентрацией искомого компонента. Для этого необходимо найти функцию или операцию, которая описывает это соответствие. Для этого используются концентрации компонент крови для различных популяций субъекта, полученные, например в процессе лабораторных исследований.
Далее выполняется измерение по меньшей мере одного отклика обратно рассеянного когерентного излучения от компонентов крови и динамических и статичных компонентов ткани, представляющий собой по меньшей мере один интерференционный сигнал от каждого из по меньшей мере двух узкополосных источников когерентного излучения, с последующей фильтрацией детектированного сигнала, аналого-цифровой выборкой фильтрованного сигнала, выделением спектрально-временных признаков сигнала для субъекта с известной концентрацией искомых компонент крови. Далее определяется вид функциональных зависимостей f1, f2, fm и значения входящих в них коэффициентов, связывающих набор вычисленных спектрально-временных признаков 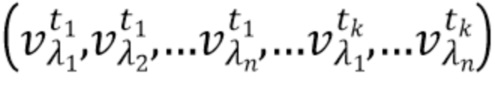 и известные концентрации компонент с1…сm.
и известные концентрации компонент с1…сm.
При этом указанные функциональные зависимости f1, f2, fm могут быть найдены в явном виде. Например, но не только, такой функцией может быть регрессионная модель, в которую в качестве переменных входят измеренные значения интенсивности прошедшего излучения, их отношения, или результаты иных математических преобразований этих значений интенсивности, а коэффициенты регрессионной модели находятся в процессе калибровки. Иначе эта функция может быть задана в неявном виде, например, в виде нейронной сети, на вход которой качестве переменных подаются измеренные значения интенсивности прошедшего излучения, их отношения, или результаты иных математических преобразований этих значений интенсивности. Коэффициенты внутренних слоев нейронной сети так же находятся в процессе калибровки или обучения. После того как в процессе калибровки определены вид и параметры функции ставящей в соответствие значения интенсивности прошедшего через образец излучения и концентрацию искомого компонента, данная функция может использоваться для определения неизвестной концентрации искомого компонента. Способы обработки сигналов, в данном случае способы определения функций, определяющих соответствие между измеренными значениями интенсивности прошедшего через образец излучения (спектром пропускания и/или поглощения) и концентрацией искомого компонента, посредством различных методов компьютерного моделирования широко известны из уровня техники, например в публикации: Ian Goodfellow, Yoshua Bengio, and Aaron Courville. 2016. Deep Learning. The MIT Press
Maria Deprez, Emma Robinson, Machine Learning for Biomedical Applications, 2022, Elsevier.
1) Измерение интенсивностей излучения: Iλ1, Iλ2,.... Iλn, прошедшего через анализируемый объем по меньшей мере на двух длинах волн, например λ1, λ2, .....λn. Для измерения интенсивности излучения используются по меньшей мере два источника излучения, излучающих на длинах волн λ1, λ2, .....λn , соответственно, и по меньшей мере один приемник оптического излучения (фотодетектор), расположенные таким образом, чтобы излучение источников излучения проходило через анализируемый объем ткани и/или крови и попадало на светочувствительную поверхность фотодетектора. Генерируемый фотодетектором электрический сигнал пропорциональный интенсивности прошедшего через анализируемый объем ткани излучения усиливается, при необходимости фильтруется, оцифровывается и подвергается дальнейшей обработке в цифровом виде.
2) Вычисление функций от по меньшей мере двух измеренных интенсивностей излучения f(Iλ1, Iλ2,.... Iλn) или на основании других параметров(например отношение интенсивности падающего излучения на анализируемый компонент крови и интенсивности излучения, прошедшего через анализируемый компонент крови, не явно, связывающих интенсивность излучения и концентрацию анализируемого компонента крови, посредством регрессионных моделей, например по меньшей мере одним из методов: регрессионный метод, в том числе метод линейной регрессии, логистической регрессии, метод последовательных приближений, дифференциальный метод, в том числе градиентный метод, в том числе градиентный спуск, стохастический градиентный спуск, и модификации указанных методов, а также моделей машинного обучения, раскрытых, например публикациях:
Ian Goodfellow, Yoshua Bengio, and Aaron Courville. 2016, Deep Learning. The MIT Press
Maria Deprez, Emma Robinson, Machine Learning for Biomedical Applications, 2022, Elsevier
3) Оценка концентрации интересующего компонента крови, в данном неограничивающем Примере оксигенированного гемоглобинна на основании полученных коэффициентов экстинции, коэффициентов поглощения и коэффициента пропускания излучения:
О2Hb≈ f(Iλ1, Iλ2,.... Iλn).
На фиг.9 представлена схема неинвазианого отслеживания концентрации гемоглобина крови или других компонентов крови в зависимости от времени. При этом рассматриваются два варианта наблюдений: 1) долговременное, где время наблюдений составляет от нескольких часов до нескольких дней или даже до нескольких месяцев и 2) кратковременное, в котором период наблюдений составляет от несколько минут до несколько часов.
При этом при проведении мониторинга концентрации гемоглобина возможны следующие ситуации. При определении высокой концентрации гемоглобина (Hb) пользователь устройства информируется о полученном результате, при определении низкой концентрации гемоглобина, пользователь информируется о полученном результате и о предварительном диагнозе, например анемия и на экран выводятся рекомендации общего характера: изменение диеты, увеличение активности, прогулки на свежем воздухе, и т.п.
При этом кратковременные отклонения концентрации гемоглобина от нормы не являются критичными и могут быть откорректированы пользователем устройства с помощью рекомендаций, выводимых на экран дисплея, напротив, долговременные отклонения концентрации гемоглобина от нормы могут означать серьезные проблемы здоровья и на экран дисплея выводят рекомендации об обязательном обращении к специалисту. Кроме того, данные полученных результатов кратковременного или долговременного мониторинга концентрации крови могут быть направлены специалисту непосредственно с устройства измерения.
Преимущества такого мониторинга заключаются в достаточно невысоких затратах на такой исследование, обеспечение долговременного периода непрерывного отслеживания за параметрами крови, что обеспечивает получение достоверных данных измерений и установление более точного диагноза человека на основании полученных данных.
Далее, со ссылкой на фиг.6 будет раскрыта блок-схема портативного устройства неинвазивного измерения компонентов крови, где под позицией 1 обозначен анализируемый объем, являющийся зоной биологической ткани субъекта (человека или животного, подлежащего исследованию), который представляет собой динамические компоненты, например кровь, эритроциты и статичные компоненты, представляющие собой ткань, хромофоры и любые недвижущиеся компоненты анализируемого объема, под позицией 2 обозначен источник излучения, представляющий собой по меньшей мере два узкополосных когерентных источника излучения, каждый, имеющий соответствующую длину волны и выполненный с возможностью облучения анализируемой области тела субъекта, содержащей компоненты крови и динамические и статичные компоненты ткани.
Каждый из по меньшей мере двух узкополосных источников излучения представляет собой лазерный диод (LD) и обеспечивают излучение с отличными друг от друг длинами волн в видимой и ближней инфракрасной областях спектра, но указанными диапазоны не ограничивают возможные спектры излучения, а представлены лишь в качестве предпочтительных примеров.
Под позицией 3 на фиг.6 обозначен по меньшей мере один фотодетектор, состоящий из фотоэлемента, представляющий собой по меньшей мере один из: фотодиода, фототранзистора, фоторезистора, или прибора с зарядовой связью (ПЗС), или устройства на базе комплементарной структуры металл-оксид-полупроводник (КМОП), или иной светочувствительный элемент, и преобразователя фототок-напряжение. Детектор 3 выполнен с возможностью детектирования и усиления по меньшей мере одного отклика обратно рассеянного когерентного излучения от динамических компонентов крови и статичных компонентов ткани, представляющий собой по меньшей мере один интерференционный сигнал от каждого, из по меньшей мере двух узкополосных источников когерентного излучения.
Под позицией 4 обозначен фильтр, представляющий собой аналоговый или цифровой фильтр, и выполненный с возможностью выделения из детектированных интерференционных сигналов сигнала в соответствии с заданной полосой частот сигнала в заданное время.
Под позицией 5 обозначен аналого-цифровой преобразователь, выполненный с возможностью аналого-цифровой выборки фильтрованных сигналов с частотой соответствующей заданной полосе частот фильтрованного сигнала, с формированием дискретных фильтрованных сигналов.
Под позицией 6 обозначен блок управления, выполненный с возможностью управления по меньшей мере двумя узкополосными когерентными источниками излучения, по меньшей мере одним фотодетектором, и фильтром, аналого-цифровым преобразователем и под позицией 7 обозначен блок обработки, выполненный с возможностью обработки полученных после выборки фильтрованных интерференционных сигналов, характеризующих выбранные компоненты крови с получением значений концентрации выбранных динамических компонентов крови согласно способу неинвазивного измерения компонентов крови.
При этом блок обработки 7 соединен с блоком управления 6, и выполнен с возможностью обработки полученных после выборки дискретных фильтрованных интерференционных сигналов, и реализующий по сигналу от блока управления следующие этапы, при которых:
- выделяют из дискретных фильтрованных сигналов набор спектрально-временных признаков 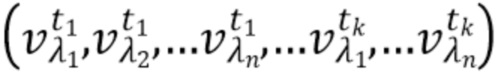 сигналов, характеризующих спектральные и динамические свойства компонентов крови,
сигналов, характеризующих спектральные и динамические свойства компонентов крови,
где λ1, λ2, λ3,.....λn - индекс, указывающий длину волны,
t1,….tk - индекс, указывающий временной признак, при этом спектрально-временной признак 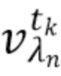 соответствует временному признаку
соответствует временному признаку 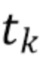 , измеренному на длине волны
, измеренному на длине волны 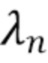 ,
,
- вычисляют концентрацию компонентов крови посредством вычислительного устройства, на основании полученного набора спектрально-временных признаков 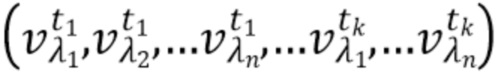 сигналов в соответствии со следующим выражением:
сигналов в соответствии со следующим выражением:
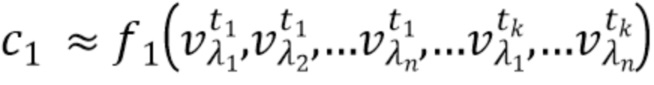
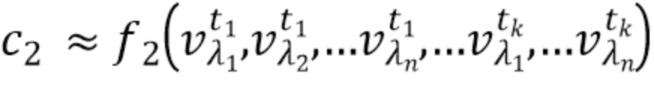
…

где с1…сm концентрации компонентов крови, которые характеризуются соответствующим набором признаков 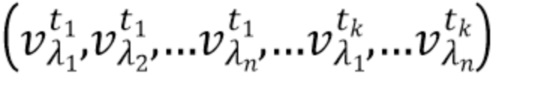 сигналов,
сигналов,
f
1, f2, fm - функциональные зависимости полученного набора спектрально-временных признаков 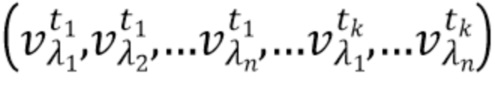 сигналов и определяемых концентраций компонентов крови.
сигналов и определяемых концентраций компонентов крови.
Устройство также дополнительно содержит блок памяти (не показан на фиг.6), предназначенный для хранения параметров необходимых для функционирования элементов устройства (напряжения и токи питания источников излучения, частоты аналого-цифровых выборок, коэффициенты усиления, значения калибровочных коэффициентов при спектрально-временных признаках, входящих в модель для расчета концентрации компонент крови и т.д.).
Кроме того, устройство для неинвазивного измерения компонентов крови выполнено с возможностью встраивания в одно из: портативного измерительного устройства персонального контроля здоровья, в частности умные часы, стационарного диагностического прибора контроля здоровья, бытового измерительного устройства персонального контроля здоровья и гаджета персонального контроля здоровья.
Промышленная применимость
Устройство и способ измерения компонентов крови могут использоваться для неинвазивного, персонального и/или по требованию или запросу мониторинга состояния здоровья субъекта, в частности мониторинга измерения концентрации различных форм гемоглобина Hb: оксигенированного Hb, деоксигенированного Hb, мет-Hb, карбокси-Hb и других свойств крови и могут использоваться в портативных измерительных устройствах, ручных часах, так называемых умных часах (smart watches), стационарных диагностических приборах, бытовых измерительных устройствах и гаджетах персонального контроля здоровья.