Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pF644, КОДИРУЮЩАЯ ГИБРИДНЫЙ ПОЛИПЕПТИД, СОДЕРЖАЩИЙ ПРОИНСУЛИН ГЛАРГИН, И ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ ГИБРИДНОГО ПОЛИПЕПТИДА, СОДЕРЖАЩЕГО ПРОИНСУЛИН ГЛАРГИН
Вид РИД
Изобретение
Область техники
Изобретение относится к области биотехнологии, а именно к получению рекомбинантного инсулинового аналога гларгин и может быть использовано для приготовления лекарственных препаратов для лечения сахарного диабета.
Краткое описание изобретения
Изобретение относится к биотехнологии, в частности к генетической инженерии. Данное изобретение может быть использовано для получения рекомбинантного проинсулина гларгин, имеющего в своем составе цепь B, С- пептид и цепь А. Предложена рекомбинантная плазмидная ДНК, содержащая гибридный tac-промотор, терминатор рибосомного оперона
Е. coli, искусственный ген, кодирующий гибридный полипептид, состоящий из короткой лидерной последовательности фрагмента человеческого белка HGS, субстрата тирозин киназы, пептидного линкера GlyHis6GlySerArg, сайта протеолиза «Арг», цепи B, сайта протеолиза «Арг Арг», С-пептида, сайта протеолиза «Арг» и цепи А.
Также предложен штамм Escherichia coli - продуцента гибридного полипептида с последовательностью проинсулина гларгин, трансформированный рекомбинантной плазмидной ДНК согласно изобретению, и гибридный полипептид, состоящий из короткой лидерной последовательности фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер с последовательностью GlyHis6GlySerArg с аминокислотной последовательностью проинсулина гларгин, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А. При этом, биосинтез гибридного полипептида индуцируется изопропилтиогалактопиранозидом, уровень его биосинтеза составляет не ниже 4% от массы влажного осадка клеточной биомассы.
Настоящее изобретение позволяет получать гибридный полипептид с высокой долей инсулина гларгин (49,5%) и повысить эффективность очистки целевого продукта за счет элиминации близкородственной примеси Арг0-А-гларгин. Изобретение направлено на получение высокопродуктивного бактериального штамма - продуцента инсулинового аналога гларгин.
Предшествующий уровень техники
В настоящее время сахарный диабет представляет собой серьезнейшую медицинскую и социально-экономическую проблему во всем мире. В связи с этим разработка и внедрение современных методов терапии сахарного диабета является одним из наиболее приоритетных направлений медицины и фармацевтической промышленности (1).
Эффективная заместительная инсулинотерапия, как основной способ терапии инсулинозависимого сахарного диабета, имеет, в связи с этим, особое значение. Природные и рекомбинантные инсулины уже не способны в полной мере удовлетворить потребности клиницистов и пациентов. Сегодняшняя медицина требует использования более современных противодиабетических препаратов, таких как аналоги человеческого инсулина короткого и пролонгированного действия (2-5).
У здоровых людей пики выделения инсулина непосредственно связаны с приемом пищи. Между приемами пищи уровень эндогенного инсулина снижается до базального уровня. У здорового человека приблизительно 50% выделяемого за сутки инсулина является базальным (6). Подобный профиль лучше всего может быть воспроизведен путем применения пролонгированного инсулина в сочетании с инсулином короткого действия. Постпрандиальные пики активности эндогенного инсулина могут быть имитированы путем введения препаратов инсулина короткого действия, тогда как для воссоздания базального уровня инсулина используют инсулины в комплексе с нейтральным протамином Хагедорна (инсулин НПХ) или аналоги человеческого инсулина пролонгированного действия (7).
Одним из аналогов человеческого инсулина длительного действия является инсулин гларгин, который согласно многим исследованиям демонстрирует профиль активности в организме гораздо более близкий к естественному, чем инсулин НПХ (5).
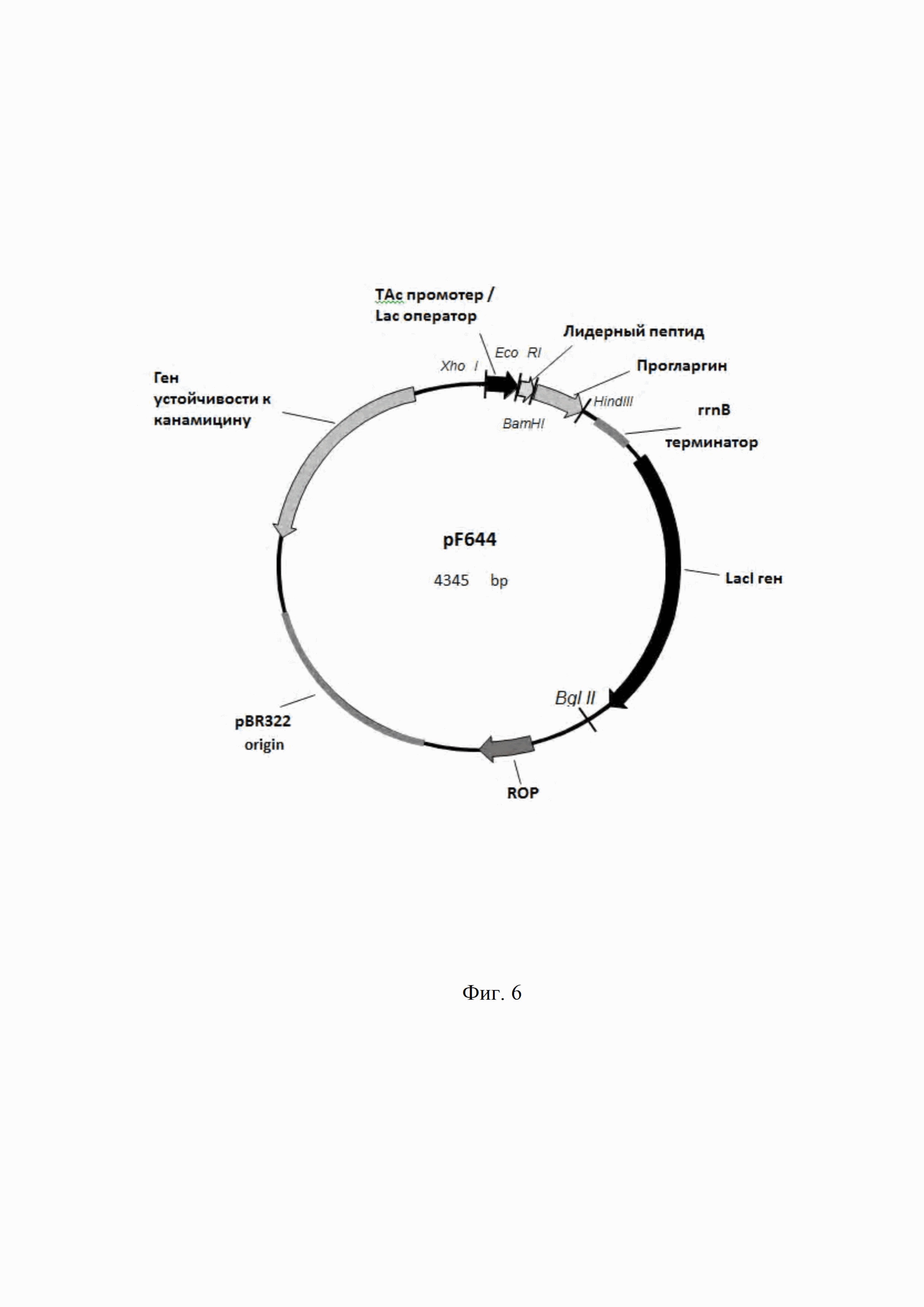
По своей химической природе молекула гларгина от молекулы человеческого инсулина отличается тем, что в ней имеется два дополнительных остатка аргинина на С-конце бета-цепи, а аспарагин в положении 21 альфа-цепи заменен на глицин (2, 5). Инсулин гларгин имеет эмпирическую формулу C267H404N72O78S6 и молекулярный вес 606,3 (8).
Эти модификации (Фиг. 1), а также добавление в препарат небольшого количества ионов цинка повышают стабильность препарата и способствуют сдвигу изоэлектрической точки инсулина гларгина с 5,4 до 6,7, по сравнению с инсулином человека, что приводит к уменьшению растворимости препарата в нейтральной среде подкожной клетчатки.
Инсулин гларгин хорошо растворим при рН 4,0. Кислый раствор препарата нейтрализуется при подкожных инъекциях, и этот аналог инсулина, который ex vivo представляет собой прозрачный раствор, образует микропреципитаты, из которых происходит медленное высвобождение гексамеров инсулина и их диссоциация с образованием ди- и мономеров. Благодаря этим свойствам препарат медленно всасывается из подкожной ткани в кровоток, не обладает выраженным пиком действия и обеспечивает практически постоянную базальную концентрацию гормона в крови в течение суток. Добавление ионов цинка в препарат также замедляет процесс освобождения димеров и мономеров, что увеличивает время действия аналога (2, 9). При этом, в мире с каждым годом растет количество пациентов с диабетом 1 типа, которым необходим инсулин гларгин на постоянной основе.
Таким образом, разработка способов получения инсулинового аналога гларгин является актуальной медицинской задачей.
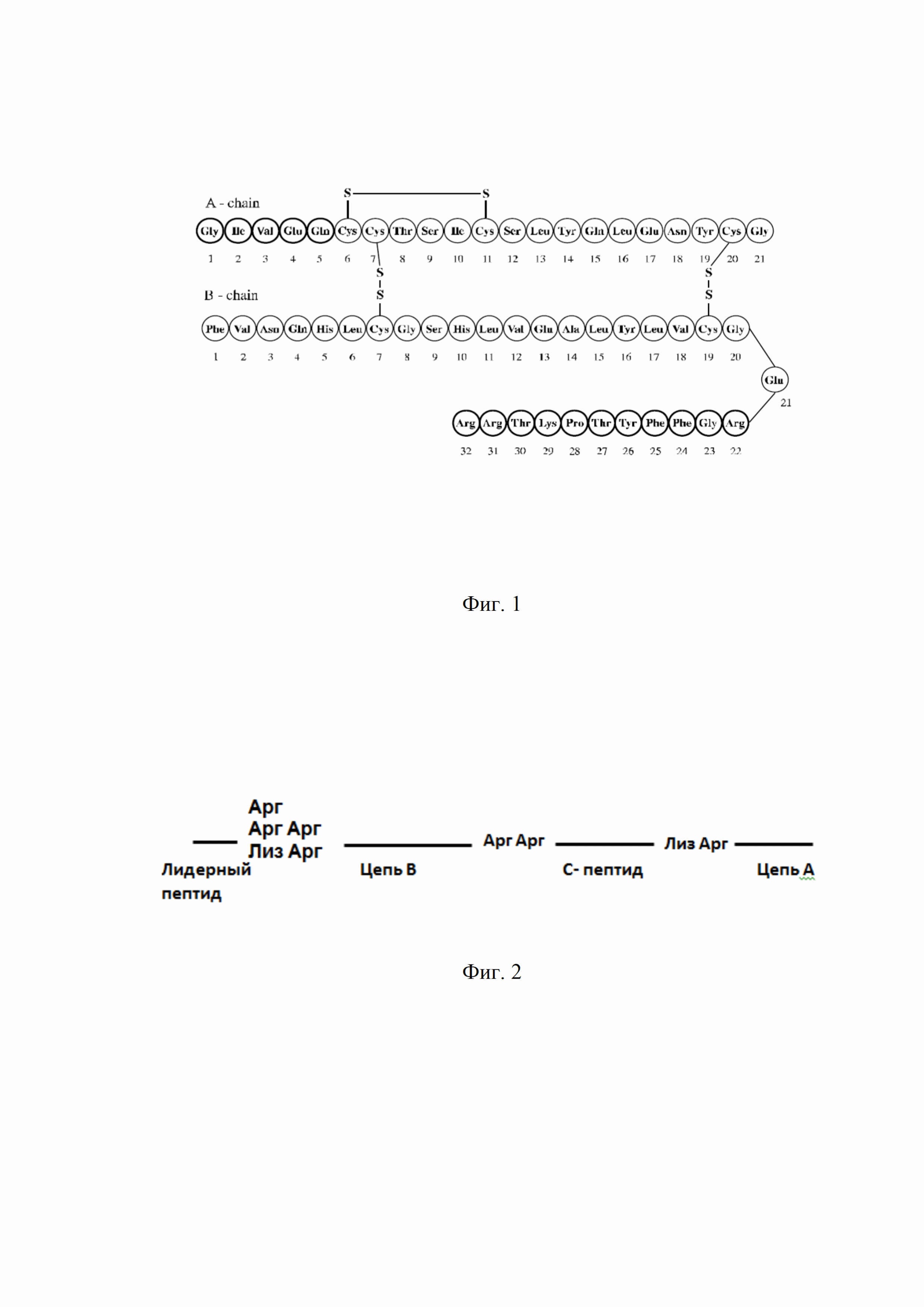
В настоящее время наиболее перспективной является технология получения инсулина и инсулиновых аналогов с использованием методологии экспрессии гена проинсулина человека в клетках Escherichia coli в составе гибридных белков в виде нерастворимых "телец включения" (10). Структура одноцепочечного предшественника (гибридного полипептида), экспрессируемого в известных штаммах продуцентах инсулина человеческого, представляет собой лидерный пептид, сайт протеолиза «Арг» или «Лиз» или «Лиз Арг», цепь B, сайт протеолиза «Арг Арг», С-пептид, сайт протеолиза «Лиз Арг», цепь А (Фиг. 2).
Необходимость включать лидерные пептиды в состав гибридного полипептида связана с низкой стабильностью проинсулина в клетках Escherichia coli, время полужизни которого составляет 2 минуты (4). В качестве лидерных последовательностей, защищающих проинсулин от протеолитической деградации, используют глутатион-трансферазу (11), иммуноглобулин, связывающий (IgG) домен белка А из S.aureus X (12), интерлейкин-2 (13) и др.
Технологическая схема получения инсулина гларгин из гибридного полипептида характеризуется следующими этапами: наращивание биомассы клеток штамма-продуцента, выделение телец включения, денатурация гибридного полипептида, ренатурация гибридного полипептида. Следующим этапом технологического процесса является ферментативный гидролиз с использованием трипсина. Под действием трипсина осуществляется гидролиз пептидной связи преимущественно после аргинина. В результате образуется инсулин гларгин.
К недостаткам использованных ранее генетических конструкций для экспрессии гибридного полипептида относятся:
Низкая доля конечного продукта - инсулина человека. Это связанно с тем, что лидерные пептиды представляют собой достаточно протяженные аминокислотные последовательности и составляют от 40 до 60% массы гибридного полипептида.
Образование близкородственной примеси Арг0-А-инсулин в результате гидролиза трипсином пептидной связи после аминокислоты лизин между С-пептидом и А-цепью (Фиг. 2).
Наиболее близкими по технической сущности к предлагаемому изобретению являются рекомбинантные плазмиды ДНК pPINS07 (14), pGG-1 (15) и pHINS11 (16), обеспечивающие синтез гибридных полипептидов, имеющих в своем составе IgG-связывающий домен стафилококкового белка А (pPINS07, pGG-1) и N-концевой фрагмент гамма-интерферона человека (pHINS11).
Патент РФ №2144957 описывает штамм E.coli JM109/pPINS07, обеспечивающий синтез гибридного полипептида с уровнем экспрессии не ниже 25-30%. Плазмида pPINS07 детерминирует синтез гибридного белка, в котором единственный IgG-связывающий домен стафилококкового белка А соединен через пептидный линкер His6GlySerArg с аминокислотной последовательностью проинсулина человека. Преимущества предложенного конструкта заключаются, во-первых, в высоком уровне экспрессии гибридного белка и, во-вторых, в его эффективной ренатурации (рефолдинге) и, как следствие, высоком выходе правильно свернутого полипептида.
Патент РФ №2325440C1 описывает штамм E.coli BL21/ pGG-1 (15). Плазмида pGG-1 получена путем направленного мутагенеза плазмиды pPINS07 и детерминирует синтез гибридного белка, в котором IgG-связывающий домен стафилококкового белка А соединен через пептидный линкер His6GlySerArg с аминокислотной последовательностью проинсулина гларгин.
Существенным недостатком рекомбинантных плазмид pPINS07 и pGG-1 является то, что они кодирует белок с низкой долей инсулина и инсулина гларгин, соответственно, составляющего около 33%.
Патент РФ №2354702 описывает рекомбинантную плазмиду pHINS11 и штамм E.coli JM109/pHINS11. Данная плазмида детерминирует синтез гибридного полипептида, в котором N-концевой фрагмент гамма-интерферона человека соединен через пептидный линкер HisProGlySerHisHisHisHisGlySerArg с аминокислотной последовательностью проинсулина человека и обеспечивает его высокую экспрессию. Использование этих конструкций в технологическом процессе позволяет получать высокоочищенный инсулин с чистотой не ниже 98% и активностью не менее 27,5 МЕ/мг. Для данного штамма-продуцента характерен высокий уровень биосинтеза гибридного полипептида и более высокая доля инсулина человека в гибридном полипептиде (38%) по сравнения с рекомбинантной плазмидой pPINS07 (33%), однако стадия ренатурации продуцируемого гибридного полпептида недостаточно эффективна (15).
Общим недостатком гибридных полипептидов в описанных патентах является сайт протеолиза «Лиз Арг» между С-пептидом и А-цепью, допускающий образование близкородственной примеси Арг0-А-инсулин.
Задачей предлагаемого изобретения является конструирование плазмиды, обеспечивающий высокий уровень индуцируемой экспрессии гибридного полипептида с высокой долей инсулина гларгин и модифицированным сайтом протеолиза между С-пептидом и А-цепью с целью предотвращения возможности образования близкородственной примеси Арг0-А-гларгин при ферментативном гидролизе гибридного полипептида.
Поставленная задача решается конструированием рекомбинантной плазмидной ДНК pF644 и штамма Escherichia coli BL21/pF644, трансформированной с помощью данной рекомбинантной плазмидной ДНК, обеспечивающего синтез гибридного полипептида с уровнем экспрессии не ниже 4% от сырого веса клеточной биомассы.
Описание фигур
На Фиг. 1 показана молекулярная структура инсулина гларгина (источник: US FDA, NDA 21-081).
На Фиг. 2 показана структура одноцепочечного предшественника (гибридного полипептида) в штаммах продуцентах инсулина.
На Фиг. 3 представлена структура последовательности ДНК, полученной методом химического синтеза.
На Фиг. 4 показано расположение праймеров на плазмиде pF173 для сайт-направленного мутагенеза сайта протеолиза между С-пептидом и А-цепью.
На Фиг. 5 представлена нуклеотидная последовательность и кодируемая ею аминокислотная последовательность гибридного полипептида EcoRI/HindIII-фрагмента плазмиды pF644. Подчеркнуты инициирующий и терминирующие кодоны, обозначены сайты узнавания рестриктаз.
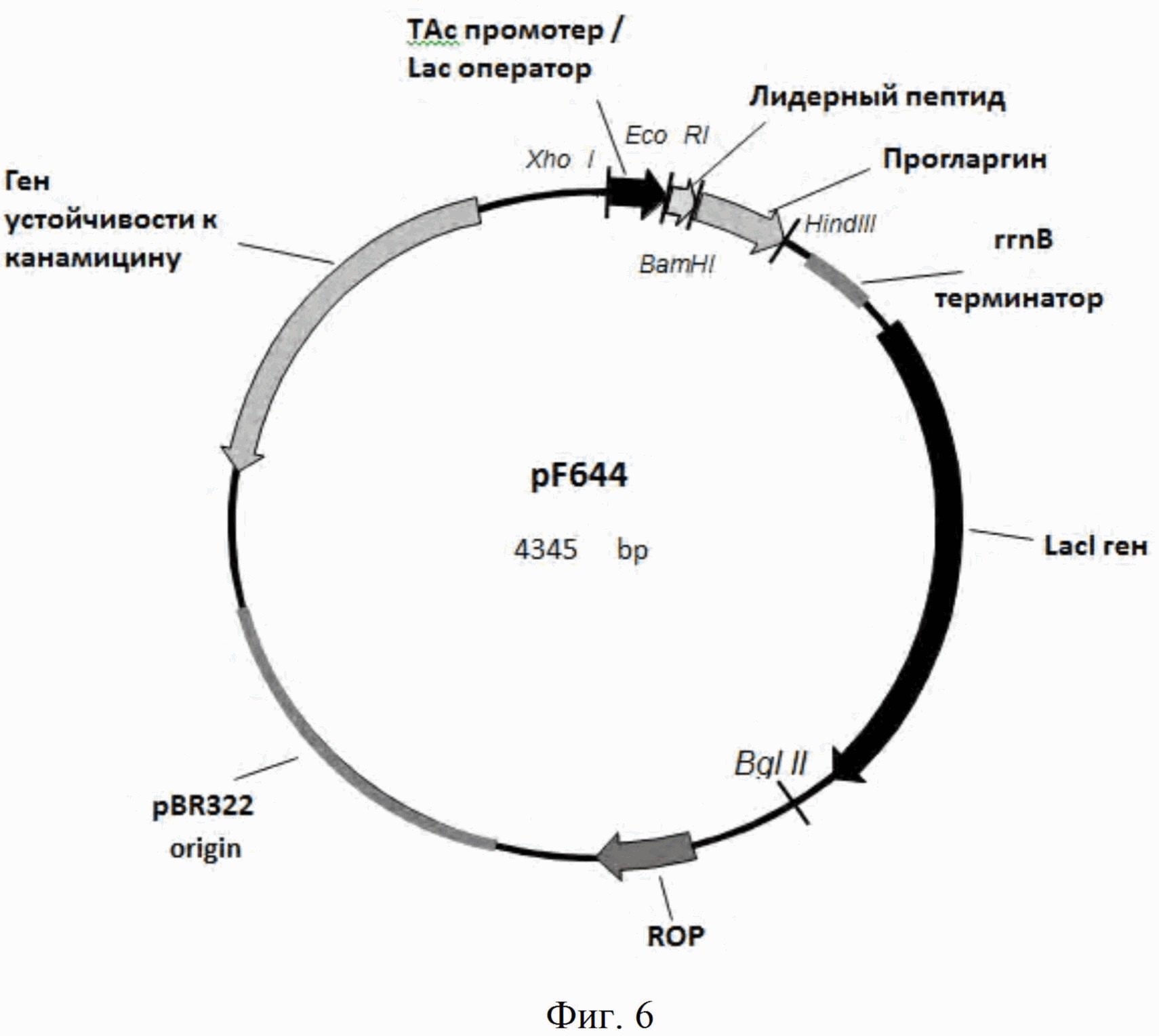
На Фиг. 6 - физическая карта плазмиды pF644. Указаны сайты эндонуклеаз рестрикции, pBR322 ori - участок инициации репликации плазмиды, Ptac - гибридный промотор транскрипции, rrnB - терминатор транскрипции рибосомного оперона Е. coli, Лидерный пептид - MetLeuTyrTyrGluGlyLeuGlnAsp, фрагмент человеческого белка HGS, субстрата тирозин киназы (TKS), и пептидный линкер GlyHis6GlySerArg, Прогларгин - проинсулин гларгин, LacI - транскрипционный репрессор, регулирующий транскрипцию Tac-промотора.
Подробное описание изобретения
Согласно изобретению, предложена рекомбинантная плазмидная ДНК pF644, кодирующая гибридный полипептид, в котором последовательность фрагмента человеческого белка HGS, субстрата тирозин киназы, соединена через пептидный линкер GlyHis6GlySerArg с аминокислотной последовательностью проинсулина гларгин, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А, с молекулярной массой 1,4 МДа (4345 п.о.), содержащая
- BglII/XhoI фрагмент плазмиды pBR322, включающий ген устойчивости к канамицину;
- участок инициации репликации (ori);
- ROP ген, регулирующий копийность плазмиды;
- XhoI/EcoRI фрагмент, представляющий собой гибридный Tac-промотор транскрипции;
- EcoRI/HindIII фрагмент, содержащий искусственный ген, в котором последовательность короткого лидерного пептида MetLeuTyrTyr GluGlyLeuGlnAsp соединена через пептидный линкер GlyHis6GlySerArg с аминокислотной последовательностью проинсулина гларгин;
- HindIII/BglII фрагмент, содержащий терминатор оперона рибосомальных РНК rrnB, транскрипционный репрессор LacI, регулирующий транскрипцию Tac-промотора;
- уникальные сайты узнавания рестрикционными эндонуклеазами со следующими координатами: XhoI - 54, EcoRI - 167, BamHI - 228, HindIII - 496, KasI - 1757, BglII - 1924, NdeI - 2528, AagI - 4215.
Также предложен штамм Escherichia coli BL21/pF644 - продуцента гибридного полипептида с последовательностью проинсулина гларгин, трансформированный рекомбинантной плазмидной ДНК согласно изобретению.
Кроме того, предложен гибридный полипептид, в котором последовательность MetLeuTyrTyrGluGlyLeuGlnAsp фрагмента человеческого белка HGS, субстрата тирозин-киназы, соединена через пептидный линкер с последовательностью GlyHis6GlySerArg с аминокислотной последовательностью проинсулина гларгин, с аргинином в качестве сайта протеолиза между С-пептидом и цепью А, полученный с помощью рекомбинантной плазмидной ДНК согласно изобретению.
Недостатком гибридных полипептидов в патентах, описанных в предшествующем уровне техники, является то, что получаемый гибридный полипептид включает сайт протеолиза «Лиз Арг» между С-пептидом и А-цепью, допускающий образование близкородственной примеси Арг0-А-гларгин.
Авторы настоящего изобретения установили, что при существенном сокращении размера гибридного полипептида за счет использования короткой лидерной последовательности, состоящей из 31 аминокислоты и изменении сайта протеолиза между С-пептидом и А-цепью на «Арг» можно достичь высоких выходов целевого продукта.
В составе лидерного пептида имеется короткая последовательность фрагмента человеческого белка HGS, субстрата тирозин киназы, образующая выраженную пространственную структуру типа «альфа-спираль». Наличие N-концевого альфа-спирального участка в гибридном полипептиде положительно влияет на уровень ренатурации гибридного полипептида.
Настоящее изобретение позволяет получать гибридный полипептид с высокой долей инсулина гларгин (49,5%) и повысить эффективность очистки целевого продукта за счет элиминации близкородственной примеси Арг0-А-гларгин. Изобретение направлено на получение высокопродуктивного бактериального штамма - продуцента инсулинового аналога гларгин.
Исходной плазмидой для создания экспрессионного вектора pF644 послужила плазмида pF019, представляющая собой рекомбинантный вектор pBR322 (16), в которой методами молекулярного клонирования был полностью удален ген устойчивости к тетрациклину (пример 1).
На следующем этапе синтезировали фрагмент ДНК размером 1,6 кб, содержащий следующие элементы и сайты рестрикции (Фиг. 3):
- Tac промотер и Lac оператор для контроля экспрессии гибридного полипептида (17), фланкированный сайтами рестрикции XhoI и EcoRI;
- Терминатор транскрипции rnnB оперона штамма K-12 ER3413 (REGION: 4143199..4143361), перед которым расположен сайт рестрикции HindIII;
- LacI ген штамма K-12 ER3413 (REGION: 365804 to 367006) с сайтом рестрикции BglII на 3’-конце. Введение LacI гена в экспрессионную конструкцию решает задачу контроля экспрессии гибридного полипептида при использовании широкого круга штаммов-хозяев, включая BL21, характеризующийся повышенной стабильностью рекомбинантных полипептидов за счет удаления клеточных протеаз lon и ompT.
Синтезированный фрагмент ДНК и плазмидную ДНК pF019 инкубировали с эндонуклеазами рестрикции XhoI и BglII в течение 3-х часов при 37°С. Соответствующие ДНК-фрагменты выделяли из агарозного геля с использованием набора Quiagen и лигировали с помощью T4 ДНК лигазы. После электропорации XL1-Blue штамма E.coli выделенные из выросших колоний плазмидные ДНК анализировали с помощью методов ПЦР и секвенирования.
Таким образом, получали экспрессионный вектор pF20 на основе плазмидной ДНК pBR322, содержащий Тас промотер, rnnB терминатор и LacI ген, кодирующий транскрипционный репрессор Тас промотера, а также сайты рестрикции EcoRI и HindIII для последующей вставки гена, кодирующего гибридный полипептид.
ДНК последовательность гибридного полипептида, содержащая в качестве лидерного пептида IgG-связывающий домен белка А из Staphylococcus aureus, пептидный линкер His6GlySerArg и проинсулина гларгина, вырезали из плазмидной ДНК pPIN07 (14) с помощью эндонуклеаз рестрикции EcoRI /HindIII и вставляли по соответствующим сайтам рестрикции в экпрессионный вектор pF20 описанным выше способом, при этом в получающемся векторе появлялся сайт рестрикции BamHI, образованный кодирующей последовательностью двух аминокислот пептидного линкера GlySer (GGATCC). В результате получали рекомбинантную плазмидную ДНК pF100.
На следующим этапе получали рекомбинантную плазмидную ДНК pF173 после замены ДНК последовательности IgG-связывающего домена белка А из Staphylococcus aureus ДНК последовательностью, кодирующей более короткий лидерный пептид MetLeuTyrTyrGluGlyLeuGlnAsp, представляющий собой фрагмент человеческого белка HGS, субстрата тирозин киназы (TKS), регулируемой фактором роста гепатоцитов (пример 2).
Аминокислотная последовательность LeuTyrTyrGluGlyLeuGlnAsp локализована в альфа-спиральном участке белка TKS (№ 3D структуры в базе данных PDB: 3F1I). Наличие альфа-спирального участка в лидерном пептиде способствует эффективной ренатурации гибридного полипептида.
Методом сайт-направленного мутагенеза в рекомбинантной плазмидной ДНК pF173 удаляли кодон «aag» в положении 373-375, соответствующий аминокислоте лизин сайта протеолиза «Лиз Арг» между С-пептидом и А-цепью проинсулина. В результате получали рекомбинантную плазмидную ДНК pF265, экспрессирующую проинсулин человека в составе гибридного полипептида (пример 3).
На следующем этапе последний кодон А-цепи «AAC», кодирующий аминокислоту аспарагин заменяли методом сайт-направленного мутагенеза рекомбинантной плазмидной ДНК pF265 на кодон «ggt», кодирующий глицин. Описанным способом была получена рекомбинантная плазмидная ДНК pF266, экспрессирующая проинсулин гларгин (пример 4).
На последнем этапе ген устойчивости к ампициллину заменяли методом Fusion-PCR геном устойчивости к канамицину, амплифицированному с матрицы pET24a (Novagen, 69749-3) с использованием праймеров Pr408 (gatgcttttctgtgactggtg) и Pr122 (ctgtcagaccaagtttactcatatatac) (пример 5).
В результате описанных молекулярно-генетических манипуляций получали рекомбинантную плазмидную ДНК pF644, кодирующую гибридный полипептид с аминокислотной последовательностью проинсулина гларгин, которая характеризуется следующими признаками:
имеет молекулярную массу 1,4 МДа (4345 п.о.);
состоит из следующих структурных элементов (Фиг.6):
BglII/XhoI фрагмент плазмиды pBR322, в котором ген устойчивости к ампициллину замещен на ген устойчивости к канамицину;
участок инициации репликации (ori);
ROP ген, регулирующий копийность плазмиды;
XhoI/EcoRI фрагмент, представляющий собой гибридный Tac-промотор транскрипции;
EcoRI/HindIII фрагмент, содержащий искусственный ген, в котором последовательность короткого лидерного пептида MetLeuTyrTyrGluGlyLeuGlnAsp соединена через пептидный линкер GlyHis6GlySerArg с аминокислотной последовательностью проинсулина гларгин;
HindIII/BglII фрагмент, содержащий терминатор оперона рибосомальных РНК rrnB, а также транскрипционный репрессор LacI, регулирующий транскрипцию Tac-промотора;
содержит уникальные сайты узнавания рестрикционными эндонуклеазами, имеющими следующие координаты: XhoI - 54, EcoRI - 167, BamHI - 228, HindIII - 496, KasI - 1757, BglII - 1924, NdeI - 2528, AagI - 4215.
Преимуществами предложенной рекомбинантной плазмидной ДНК конструкции являются высокая доля инсулина гларгин в гибридном полипептиде (49,5%), наличие в составе лидерного пептида последовательности, образующей пространственную структуру типа «альфа-спирали» для улучшения эффективности ренатурации гибридного полипептида, модификация сайта протеолиза между С-пептидом и А-цепью, исключающая образование близкородственной примеси Арг0-А-гларгин при ферментативном гидролизе гибридного полипептида.
Для получения штамма-продуцента гибридного полипептида с проинсулином гларгином электрокомпетентные клетки штамма реципиента Escherichia coli BL21 трансформировали рекомбинантной плазмидной ДНК pF644 методом электропорации согласно описанной методике (18) и высевали на LB-агар, содержащий 50 мкг/мл канамицина.
Полученный штамм-продуцент Escherichia coli BL21/pF644 характеризуется следующими признаками:
Морфологические признаки: Клетки мелкие, палочковидной формы, грамотрицательные, неспороносные, размером 1x3,5 мкм, подвижные, с хорошо различимыми тельцами включения после индукции синтеза гибридного полипептида.
Культуральные признаки: при росте на агаризованной среде LB колонии круглые, гладкие, полупрозрачные, блестящие, серые; край ровный, диаметр колоний 1-3 мм, консистенция пастообразная. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением.
Физиолого-биохимические признаки: клетки растут при температуре
4-42°С, при оптимальном рН 6,8-7,6. В качестве источника азота используют как минеральные соли аммония, так и органические соединения: аминокислоты, пептон, триптон, дрожжевой экстракт. В качестве источника углерода при росте на минимальной среде используют глицерин, углеводы, аминокислоты.
Устойчивость к антибиотикам: клетки штамма-продуцента проявляют устойчивость к канамицину (до 100 мг/мл).
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование промежуточной генетической конструкции pF019.
ПЦР-продукт размером 2,8 кб, полученный в результате амплификации плазмиды pBR322 с праймерами Pr033 (5’ - ccaacgtaacagatct (BglII) aacagctcgaactcgag (XhoI) ttgaagacgaaagggcctcg - 3’) и Pr039 (5’- ccaaccgtaacagatct (BglII) ctgtggaacacctacatctg- 3’), вырезали из геля, очищали с использованием набора Qiagen. После инкубации с эндонуклеазой рестрикции BglII в течение 3-х часов при 37°С очищенный ДНК-фрагмент лигировали с помощью T4 ДНК лигазы и использовали для трансформации XL1-Blue штамма E.coli (Agilent Technology, 200249) методом электропорации (18). Корректность плазмидной ДНК, выделенной из колоний, выросших на среде LB с ампицилином (100 мкг/мл) подтверждали секвенированием. Описанным выше способом получали рекомбинантную плазмидную ДНК pF019, представляющую собой фрагмент плазмидной ДНК pBR322 с полной делецией гена устойчивости к тетрациклину.
Пример 2. Конструирование промежуточной рекомбинантной плазмиды pF173.
Для введения в состав проинсулина короткого лидерного пептида были синтезированы праймеры pr096 (tcaacgtaacgaattct atg ctg tat tat gaa ggc ctg cag gac ggc agc agc cac cac catcatcatcatggatcccg) и pr130 (tgcctggcggcagtagcgcg). Праймер pr096 имеет в своем составе сайт узнавания эндонуклеазы рестрикции EcoRI; область, кодирующую аминокислотную последовательность лидерного пептида; последовательность, соответствующую пептидному линкеру His6GlySerArg конструкции pF100.
В состав реакционной смеси (100 мкл) для полимеразной цепной реакции (ПЦР) входили следующие компоненты:
10 мкл 10-кратного буфера для Pfu ДНК-полимеразы,
0,1 нг плазмидной ДНК pF100,
1 мкл смеси 10 мМ dNTP,
0,5 мкл каждого праймера (10 мкМ),
2 ед. Pfu ДНК-полимеразы,
2 ед. Taq ДНК полимеразы.
ПЦР проводили с помощью ДНК амплификатора T100 Thermal Cycler, Bio-Rad в следующих условиях: 96°С (5 мин), 30 циклов - 96°С (15 сек), 55°С (15 сек), 72°С (30 сек).
Продукты амплификации анализировали с помощью электрофореза в агарозном геле с использованием интеркалирующего красителя GelRed, Biotium. ПЦР-продукт, соответствующий по размеру 600 п.о., вырезали из геля и очищали с помощью набора Zymoclean™ Gel DNA Recovery Kit. Электрофорез проводили в стандартном буфере TBE (Трис-борат-ЭДТА) c использованием 1%-й агарозы. ДНК визуализировали с помощью гельдокументирующей системы Fusion-SL2-400.
Вырезанный из геля ПЦР-продукт и плазмиду pF100 инкубировали с эндонуклеазами рестрикции EcoRI и HindIII в течение 3-х часов при 37°С. Соответствующие ДНК-фрагменты (330 п.о. и 4,2 кб) выделяли из агарозного геля с использованием набора Quiagen и лигировали с помощью T4 ДНК лигазы. После электропорации XL1-Blue штамма E.coli выделенные из выросших колоний рекомбинантные плазмидные ДНК анализировали с помощью ПЦР и секвенирования.
Пример 3. Конструирование промежуточной рекомбинантной плазмидной ДНК pF265 с помощью сайт-направленный мутагенеза плазмиды pF173.
Для модификации сайта протеолиза «Лиз Арг» между С-пептидом и
А-цепью проинсулина синтезировали олигонуклеотиды Pr237 (cgtggtatcgttgaacagtg) и Pr238 (ctgcagagaaccttccagag), содержащие фосфатную группу с 5’- конца (Фиг. 3).
В состав реакционной смеси (100 мкл) для полимеразной цепной реакции (ПЦР) входили следующие компоненты:
10 мкл 10-кратного буфера для Pfu ДНК-полимеразы,
0,1 нг плазмидной ДНК pF173,
1 мкл смеси 10 мМ dNTP,
0,5 мкл каждого праймера (10 мкМ),
2 ед. Pfu ДНК-полимеразы,
2 ед. Taq ДНК полимеразы.
ПЦР проводили с помощью ДНК амплификатора T100 Thermal Cycler, Bio-Rad в следующих условиях: 96°С (5 мин), 30 циклов - 96°С (15 сек), 55°С (15 сек), 72°С (3 мин).
Продукты амплификации анализировали с помощью электрофореза в агарозном геле с использованием интеркалирующего красителя GelRed, Biotium. ПЦР-продукт, соответствующий по размеру плазмиде pF173 (4,5 кБ), вырезали из геля и очищали с помощью набора Zymoclean™ Gel DNA Recovery Kit. Электрофорез проводили в стандартном буфере TBE c использованием 1%-й агарозы. ДНК визуализировали с помощью гельдокументирующей системы Fusion-SL2-400.
Для получения рекомбинантной плазмидной ДНК pF265 концы выделенного из геля ПЦР-продукта лигировали с помощью T4 ДНК-лигазы (NEB). Лигирующую смесь (10 мкл) использовали для трансформации штамма BL21 методом электропорации (18). После трансформации отбирали колонии, выращенные на среде с ампициллином, из них выделяли плазмиды и анализировали с помощью секвенирования последовательности гибридного полипептида. В результате получали рекомбинантную плазмидную ДНК pF265, экспрессирующую проинсулин в составе гибридного полипептида.
Пример 4. Конструирование промежуточной рекомбинантной плазмидной ДНК pF266.
Рекомбинантную плазмидную ДНК pF266 получали методом сайт-направленного мутагенеза рекомбинантной плазмидной ДНК pF265. Для этого синтезировали олигонуклеотиды (праймеры) Pr074 (ccagctggaaaactactgcggttagtaagc) и Pr075 (tacagagagcagatagaggtg), содержащие фосфатную группу с 5’- конца. Праймер Pr074 содержал последовательность «ggt», кодирующую аминокислоту глицин. Полимеразная цепная реакция (ПЦР) с применением праймеров Pr074 и Pr075 приводила к замене последнего кодона в гене прогларгина «aac» (asn) на кодон «ggt» (gly).
В состав реакционной смеси (100 мкл) для ПЦР входили следующие компоненты:
10 мкл 10-кратного буфера для PFU ДНК-полимеразы,
0,1 нг плазмидной ДНК pF265,
1 мкл смеси 10 мМ dNTP,
0,5 мкл каждого праймера (10 мкМ),
2 ед. Pfu ДНК-полимеразы,
2 ед. Taq ДНК полимеразы.
ПЦР проводили с помощью ДНК амплификатора T100 Thermal Cycler, Bio-Rad в следующих условиях: 96°С (5 мин), 30 циклов - 96°С (15 сек), 55°С (15 сек), 72°С (3 мин).
Продукты амплификации анализировали с помощью электрофореза в агарозном геле с использованием интеркалирующего красителя GelRed, Biotium. ПЦР-продукт, соответствующий по размеру рекомбинантной плазмидной ДНК pF265 (4,5 кБ), вырезали из геля и очищали с помощью набора Zymoclean™ Gel DNA Recovery Kit. Электрофорез проводили в стандартном буфере TBE c использованием 1%-й агарозы. ДНК визуализировали с помощью гельдокументирующей ситемы Fusion-SL2-400.
Для получения плазмидной ДНК концы выделенного из геля ПЦР-продукта лигировали с помощью T4 ДНК-лигазы (NEB). Лигирующую смесь (10 мкл) использовали для трансформации штамма BL21 методом электропорации (18).
После трансформации отбирали колонии, выращенные на среде с ампициллином, из них выделяли рекомбинантные плазмидные ДНК и анализировали с помощью секвенирования последовательности гибридного полипептида. В результате получали рекомбинантную плазмидную ДНК pF266 с геном устойчивости к ампициллину, экспрессирующую проинсулин гларгин в составе гибридного полипептида.
Пример 5. Получение конечной генетической конструкции pF644 с геном канамициновой устойчивости, экспрессирующей гибридный полипептид проинсулина гларгин.
Рекомбинантную плазмидную ДНК pF644 получали методом Fusion-PCR. Для этого синтезировали олигонуклеотиды Pr121 (cctgataaatgcttcaataatattgaaaaaggaagagtatgagccatattcaacgggaaacg), Pr120 (ttagaaaaactcatcgagcatcaaatgaaactg), Pr408 (gatgcttttctgtgactggtg), Pr122 (ctgtcagaccaagtttactcatatatac), при этом праймеры Pr120 и Pr121 содержали фосфатную группу с 5’- конца.
На первом этапе были получены ПЦР- фрагменты 1 и 2.
С помощью матрицы pF266 и праймеров Pr408/Pr122 был амплифицирован ПЦР фрагмент, размером 3958 bp (Фиг. 5).
Ген устойчивости к канамицину (ПЦР- фрагмент 2, 816 bp) был амплифицирован с помощью матрицы pET24a (Novagen, 69749-3) и праймеров Pr408/Pr122.
В состав реакционных смесей (100 мкл) для ПЦР входили следующие компоненты:
10 мкл 10-кратного буфера для Pfu ДНК-полимеразы,
0,1 нг плазмидной ДНК,
1 мкл смеси 10 мМ dNTP,
0,5 мкл каждого праймера (10 мкМ),
2 ед. Pfu ДНК-полимеразы,
2 ед. Taq ДНК полимеразы.
ПЦР проводили с помощью ДНК амплификатора T100 Thermal Cycler, Bio-Rad в следующих условиях: 96°С (5 мин), 30 циклов - 96°С (15 сек), 55°С (15 сек), 72°С (3 мин).
Продукты амплификации анализировали с помощью электрофореза в агарозном геле с использованием интеркалирующего красителя GelRed, Biotium. ПЦР-фрагменты 1 и 2 вырезали из геля и очищали с помощью набора Zymoclean™ Gel DNA Recovery Kit.
ПЦР фрагменты 1 и 2 объединяли на этапе Fusion- PCR в следующих условиях:
В состав реакционных смесей (100 мкл) для ПЦР входили следующие компоненты:
10 мкл 10-кратного буфера для Pfu ДНК-полимеразы,
0,1 нг ПЦР фрагмента 1,
0,6 нг ПЦР фрагмента 2
1 мкл смеси 10 мМ dNTP,
0,5 мкл праймера Pr120 (10 мкМ),
0,5 мкл праймера Pr122 (10 мкМ),
2 ед. Pfu ДНК-полимеразы,
2 ед. Taq ДНК полимеразы.
ПЦР проводили с помощью ДНК амплификатора T100 Thermal Cycler, Bio-Rad в следующих условиях: 96°С (5 мин), 30 циклов - 96°С (15 сек), 55°С (15 сек), 72°С (3 мин).
Для получения плазмидной ДНК pF644 концы выделенного из геля ПЦР-продукта, размером 4345 п.о., лигировали с помощью T4 ДНК-лигазы (NEB). Лигирующую смесь (10 мкл) использовали для трансформации штамма BL21 методом электропорации (18).
После трансформации отбирали колонии, выращенные на среде с канамицином (50 мг/л), из них выделяли плазмиды и анализировали с помощью секвенирования последовательности гибридного полипептида. В результате получали рекомбинантную плазмидную ДНК pF644 с геном устойчивости к канамицину, экспрессирующую проинсулин гларгин в составе гибридного полипептида.
Пример 6. Определение продуктивности штамма-продуцента гибридного полипептида.
Индивидуальную колонию клеток штамма E. coli BL21, содержащую рекомбинантную плазмидную ДНК pF644, инокулировали 2 мл LB среды, содержащей канамицин в концентрации 50 мкг/мл, растили в термошейкере при 37°С в течение 22 часов при перемешивании (170 об./мин). После измерения оптической плотности OD600 ночной культуры засевали 40 мл жидкой среды LB, содержащей 50 мкг/мл канамицина (ODстартовая600 = 0,1) и растили 1-2 часа при 37°С на шэйкере-инкубаторе при перемешивании (180 об/мин) до достижения оптической плотности OD600 = (0,8 ± 0,2). 20 мл культуры переносили в другую колбу (контроль без индукции), к оставшимся 20 мл добавляли 10 мкл 1М ИПТГ (изопропил-бета-галактопиранозид) (конечная концентрация ИПТГ - 0,5 мМ). После 4 часов инкубирования на шэйкере-инкубаторе при перемешивании (180 об/мин) клеточные культуры центрифугировали (15 мин, 3000 об/мин), определяли массу влажного осадка клеток, замораживали. Содержание гибридного полипептида в % от массы влажного осадка измеряли методом капиллярного электрофореза. Уровень экспрессии составил не ниже 4% от сырого веса клеточной биомассы.
Источники информации:
1. King H, Aubert RE, Herman WH. Global burden of diabetes, 1995-2025: prevalence, numerical estimates, and projections. Diabetes care. 1998 Sep;21(9):1414-31. PubMed PMID: 9727886.
2. Bolli GB, Owens DR. Insulin glargine. Lancet. 2000 Aug 5;356(9228):443-5. PubMed PMID: 10981882.
3. Meece JD, Campbell RK. Insulin lispro update. The Diabetes educator. 2002 Mar-Apr;28(2):269-77. PubMed PMID: 11924304.
4. Dunn CJ, Plosker GL. Insulin lispro: a pharmacoeconomic review of its use in diabetes mellitus. PharmacoEconomics. 2002;20(14):989-1025. PubMed PMID: 12403639.
5. Home PD, Ashwell SG. An overview of insulin glargine. Diabetes/metabolism research and reviews. 2002 Sep-Oct;18 Suppl 3:S57-63. PubMed PMID: 12324987.
6. Nakashima E, Kuribayashi N, Ishida K, Taketsuna M, Takeuchi M, Imaoka T. Efficacy and safety of stepwise introduction of insulin lispro mix 50 in Japanese patients with type 2 diabetes inadequately controlled by oral therapy. Endocrine journal. 2013;60(6):763-72. PubMed PMID: 23459461.
7. Roach P, Woodworth JR. Clinical pharmacokinetics and pharmacodynamics of insulin lispro mixtures. Clinical pharmacokinetics. 2002;41(13):1043-57. PubMed PMID: 12403642.
8. Levien TL, Baker DE, White JR, Jr., Campbell RK. Insulin glargine: a new basal insulin. The Annals of pharmacotherapy. 2002 Jun;36(6):1019-27. PubMed PMID: 12022906. Epub 2002/05/23.
9. Dunn CJ, Plosker GL, Keating GM, McKeage K, Scott LJ. Insulin glargine: an updated review of its use in the management of diabetes mellitus. Drugs. 2003;63(16):1743-78. PubMed PMID: 12904090.
10. Баирамашвили ДИ. Генноинженерный инсулин человека: успехи и перспективы. Рос хим ж (Ж Рос об-ва им ДИ Менделеева). 2005; XLIX(1):34-45.
11. Berg H, Walter M, Mauch L, Seissler J, Northemann W. Recombinant human preproinsulin. Expression, purification and reaction with insulin autoantibodies in sera from patients with insulin-dependent diabetes mellitus. Journal of immunological methods. 1993 Sep 15;164(2):221-31. PubMed PMID: 8370928.
12. Jonasson P, Nilsson J, Samuelsson E, Moks T, Stahl S, Uhlen M. Single-step trypsin cleavage of a fusion protein to obtain human insulin and its C peptide. European journal of biochemistry / FEBS. 1996 Mar 1;236(2):656-61. PubMed PMID: 8612642.
13. Castellanos-Serra LR, Hardy E, Ubieta R, Vispo NS, Fernandez C, Besada V, et al. Expression and folding of an interleukin-2-proinsulin fusion protein and its conversion into insulin by a single step enzymatic removal of the C-peptide and the N-terminal fused sequence. FEBS letters. 1996 Jan 8;378(2):171-6. PubMed PMID: 8549827.
14. Коробко ВГ, Болдырева ЕФ, Шингарова ЛН. Рекомбинантная плазмидная ДНК pPINS07, кодирующая гибридный полипептид, содержащий проинсулин человека, и штамм бактерий Escherichia coli - продуцент гибридного полипептида, содержащего проинсулин человека: Патент РФ №2144957; 1999.
15. Шматченко ВВ, Шматченко НА, Байдусь АН. Рекомбинантная плазмидная ДНК pHINS11, кодирующая гибридный белок - предшественник инсулина человека, клетка Escherichia coli, трансформированная рекомбинантной плазмидной ДНК pPHINS11, штамм бактерий Escherichia coli JM109/pHINS11 - продуцент гибридного белка - предшественника инсулина человека и способ получения инсулина человека2006. Available from: http://bd.patent.su/2263000-2263999/pat/servl/servletc85e.html.
16. Bolivar F, Rodriguez RL, Greene PJ, Betlach MC, Heyneker HL, Boyer HW, et al. Construction and characterization of new cloning vehicles. II. A multipurpose cloning system. Gene. 1977;2(2):95-113. PubMed PMID: 344137. Epub 1977/01/01.
17. de Boer HA, Comstock LJ, Vasser M. The tac promoter: a functional hybrid derived from the trp and lac promoters. Proceedings of the National Academy of Sciences of the United States of America. 1983 Jan;80(1):21-5. PubMed PMID: 6337371.
18. Lessard JC. Transformation of E. coli via electroporation. Methods in enzymology. 2013;529:321-7. PubMed PMID: 24011058. Epub 2013/09/10.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Zakrytoe Aktsionernoe Obshchestvo "FARM-Kholding"
<120> Recombinant Plasmid DNAPf644 encoding Hybrid polypeptide comprising proinsulin glargine, and proinsulin glargine - comprising hybrid polypeptide producer bacterial strain Escherichia coli
<140> RU 2019116105
<141> 2019-05-23
<160> 1
<210> 1
<211> 10
<212> PRT
<213> E. coli
<400> 1
GlyHisHisHisHisHisHisGlySerArg
<210> 2
<211> 9
<212> PRT
<213> E. coli
<400> 2
HisHisHisHisHisHisGlySerArg
<210> 3
<211> 11
<212> PRT
<213> E. coli
<400> 3
HisProGlySerHisHisHisHisGlySerArg
<210> 4
<211> 9
<212> PRT
<213> E. coli
<400> 4
MetLeuTyrTyrGluGlyLeuGlnAsp
<210> 5
<211> 8
<212> PRT
<213> E. coli
<400> 5
LeuTyrTyrGluGlyLeuGlnAsp
<210> 6
<211> 21
<212> DNA
<213> E. coli
<400> 6
gatgcttttctgtgactggtg
<210> 7
<211> 28
<212> DNA
<213> E. coli
<400> 7
ctgtcagaccaagtttactcatatatac
<210> 8
<211> 53
<212> DNA
<213> E. coli
<400> 8
ccaacgtaacagatct16
aacagctcgaactcgag17
ttgaagacgaaagggcctcg20
<210> 9
<211> 37
<212> DNA
<213> E. coli
<400> 9
ccaaccgtaacagatct 17
ctgtggaacacctacatctg 20
<210> 10
<211> 79
<212> DNA
<213> E. coli
<400> 10
tcaacgtaacgaattct 17
atgctgtattatgaaggcctgcaggacggcagcagccaccac 42
catcatcatcatggatcccg 20
<210> 11
<211> 20
<212> DNA
<213> E. coli
<400> 11
cgtggtatcgttgaacagtg
<210> 12
<211> 20
<212> DNA
<213> E. coli
<400> 12
ctgcagagaaccttccagag
<210> 13
<211> 30
<212> DNA
<213> E. coli
<400> 13
ccagctggaaaactactgcggttagtaagc
<210> 14
<211> 21
<212> DNA
<213> E. coli
<400> 14
tacagagagcagatagaggtg
<210> 15
<211> 62
<212> DNA
<213> E. coli
<400> 15
cctgataaatgcttcaataatattgaaaaaggaagagtatgagccatattcaacgggaaacg
<210> 16
<211> 33
<212> DNA
<213> E. coli
<400> 16
ttagaaaaactcatcgagcatcaaatgaaactg
<210> 17
<211> 21
<212> DNA
<213> E. coli
<400> 17
gatgcttttctgtgactggtg
<210> 18
<211> 28
<212> DNA
<213> E. coli
<400> 18
ctgtcagaccaagtttactcatatatac
<210> 19
<211> 720
<212> DNA
<213> E. coli
<400> 19
tttgtttaactttaagaaggagagaattctatgctgtattatgaa 45
aaacaaattgaaattcttcctctcttaagatacgacataatactt 45
ggcctgcaggacggcagcagccaccaccatcatcatcatggatcc 45
ccggacgtcctgccgtcgtcggtggtggtagtagtagtacctagg 45
cgttttgttaaccaacacctgtgcggttctcacctggttgaagct 45
gcaaaacaattggttgtggacacgccaagagtggaccaacttcga 45
ctgtacctggtttgcggtgaacgtggtttcttctacaccccgaag 45
gacatggaccaaacgccacttgcaccaaagaagatgtggggcttc 45
acccgtcgtgaagctgaagacctgcaggttggtcaggttgaactg 45
tgggcagcacttcgacttctggacgtccaaccagtccaacttgac 45
ggtggtggtccgggtgctggtagcctgcaaccgctggctctggaa 45
ccaccaccaggcccacgaccatcggacgttggcgaccgagacctt 45
ggttctctgcagcgtggtatcgttgaacagtgctgcacctctatc 45
ccaagagacgtcgcaccatagcaacttgtcacgacgtggagatag 45
tgctctctgtaccagctggaaaactactgcggttagtaagcttag 45
acgagagacatggtcgaccttttgatgacgссаatcattcgaatc 45
<210> 20
<211> 106
<212> PRT
<213> E. coli
<400> 20
MetLeuTyrTyrGlu 5
GlyLeuGlnAspGlySerSerHisHisHisHisHisHisGlySer 15
ArgPheValAsnGlnHisLeuCysGlySerHisLeuValGluAla 15
LeuTyrLeuValCysGlyGluArgGlyPhePheTyrThrProLys 15
ThrArgArgGluAlaGluAspLeuGlnValGlyGlnValGluLeu 15
GlyGlyGlyProGlyAlaGlySerLeuGlnProLeuAlaLeuGlu 15
GlySerLeuGlnArgGlyIleValGluGlnCysCysThrSerIle 15
CysSerLeuTyrGlnLeuGluAsnTyrCysGly 11
<---