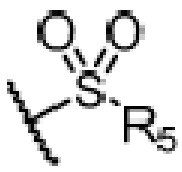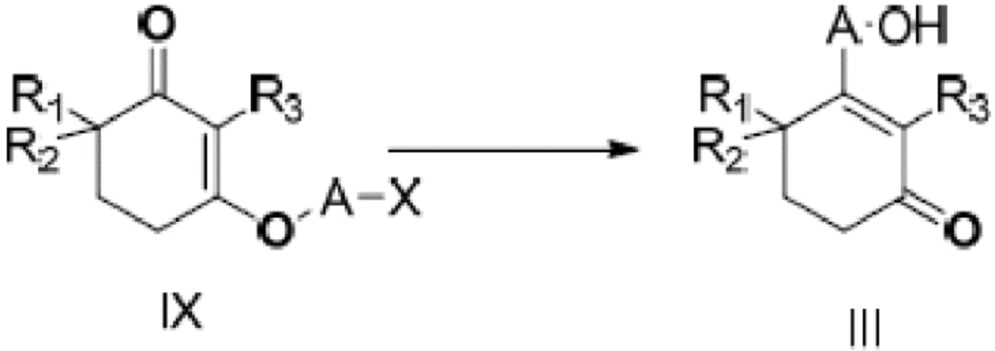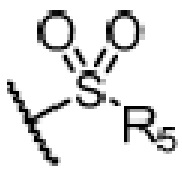Результат интеллектуальной деятельности: СПОСОБ ПРОИЗВОДСТВА ДЛИННОЦЕПОЧЕЧНОГО СПИРТА ЦИКЛОГЕКСЕНОНА ВЫСОКОЙ СТЕПЕНИ ОЧИСТКИ
Вид РИД
Изобретение
Область техники
Данное изобретение относится к областям фармакохимии и синтетической химии, и, в частности, относится к способу получения длинноцепочечного спирта циклогексанона с высокой степени очистки.
Уровень техники
Фактор роста нервов (ФРН) присутствует в первую очередь в гиппокампе и области коры головного мозга, играя роль в регулировании выживания, роста и развития, дифференциации, регенерации и функционального поддерживания нейронов. ФРН действует не только на катехоламинергические нейроны в перифкрической нервной системе, но также на холинергические нейроны в мозге. Полагают, что болезнь Альцгеймера связана с дегенерацией и потерей холинергических нейронов. Исследователи пытались лечить болезнь Альцгеймера введением ФРН в мозг, но такой тип терапевтического подхода не подходит для человека, так как ФРН является макромолекулярным белком с молекулярной массой вплоть до 12000, который не способен проникать через гематоэнцефалический барьер. Таким образом, исследователи предпринимали непрерывные попытки найти ФРН-подобное вещество, которое может проникать через гематоэнцефалический барьер или низкомолекулярное соединение, которое может стимулировать синтез ФРН в мозге, и использовать такое вещество в лечении болезни Альцгеймера. Длинноцепочечные алифатические спирты, такие как длинноцепочечные спирты циклогексенона, классифицируются как маленькие молекулы, которые имеют сходную природу с ФРН, и могут стимулировать рост нейронов в мозге, что делает их перспективными в клиническом применении.
В литературе, Molecules(2000, 5, 1439-1460),представлен способ получения длинноцепочечного спирта циклогексенона как показано на схеме 1.
Схема 1:
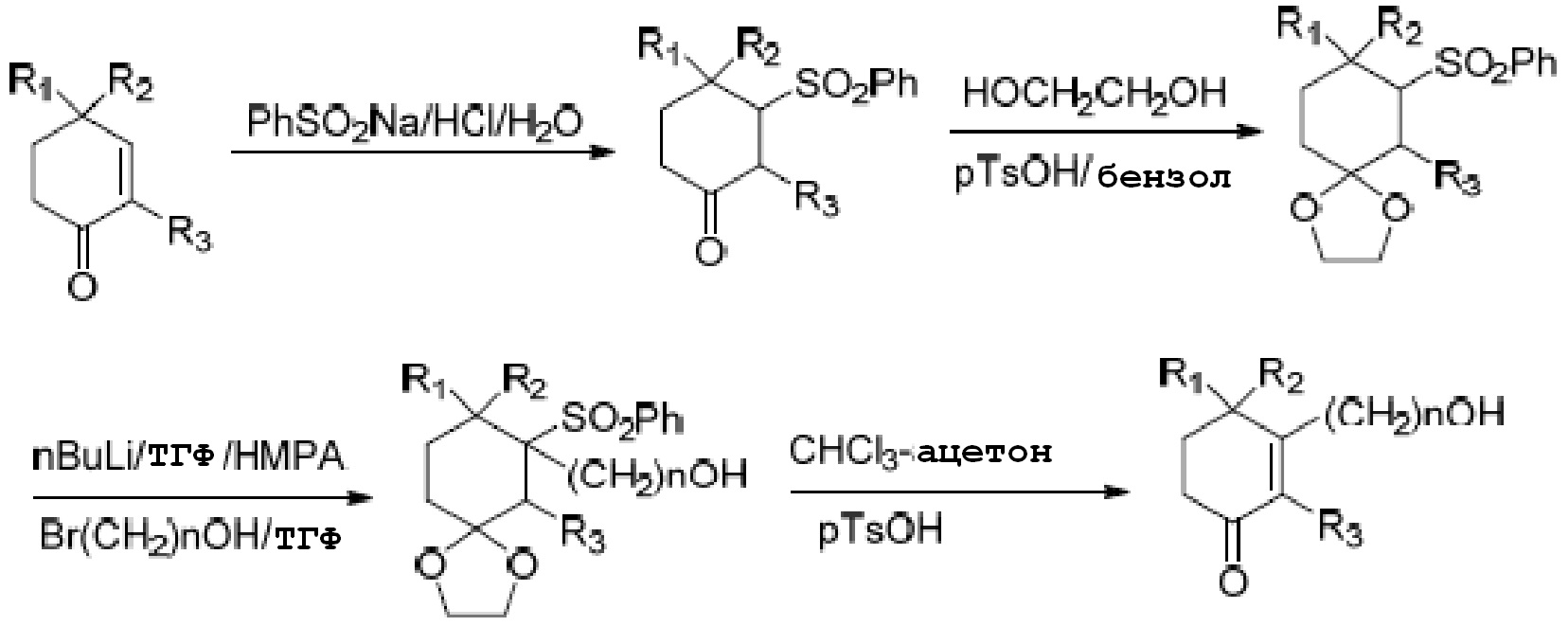
Этот способ не подходит для промышленного производства, так как ненасыщенный циклогексанон, который является исходным материалом на схеме 1, тяжело получить; общий процентный выход способа низкий; в способе применяют бутиллитий в качестве трансметаллирующего реагента; и множество растворителей I типа (к которому относятся человеческие канцерогены и органические растворители, которые предположительно считаются человеческими канцерогенами, или вещества, вредящие окружающей среде) включены в схему.
В литературе, Bioorganic & Medicinal Chemistry Letters (2000, 10, 2537-2539), описан способ получения, показанный на схеме 2.
Схема 2:
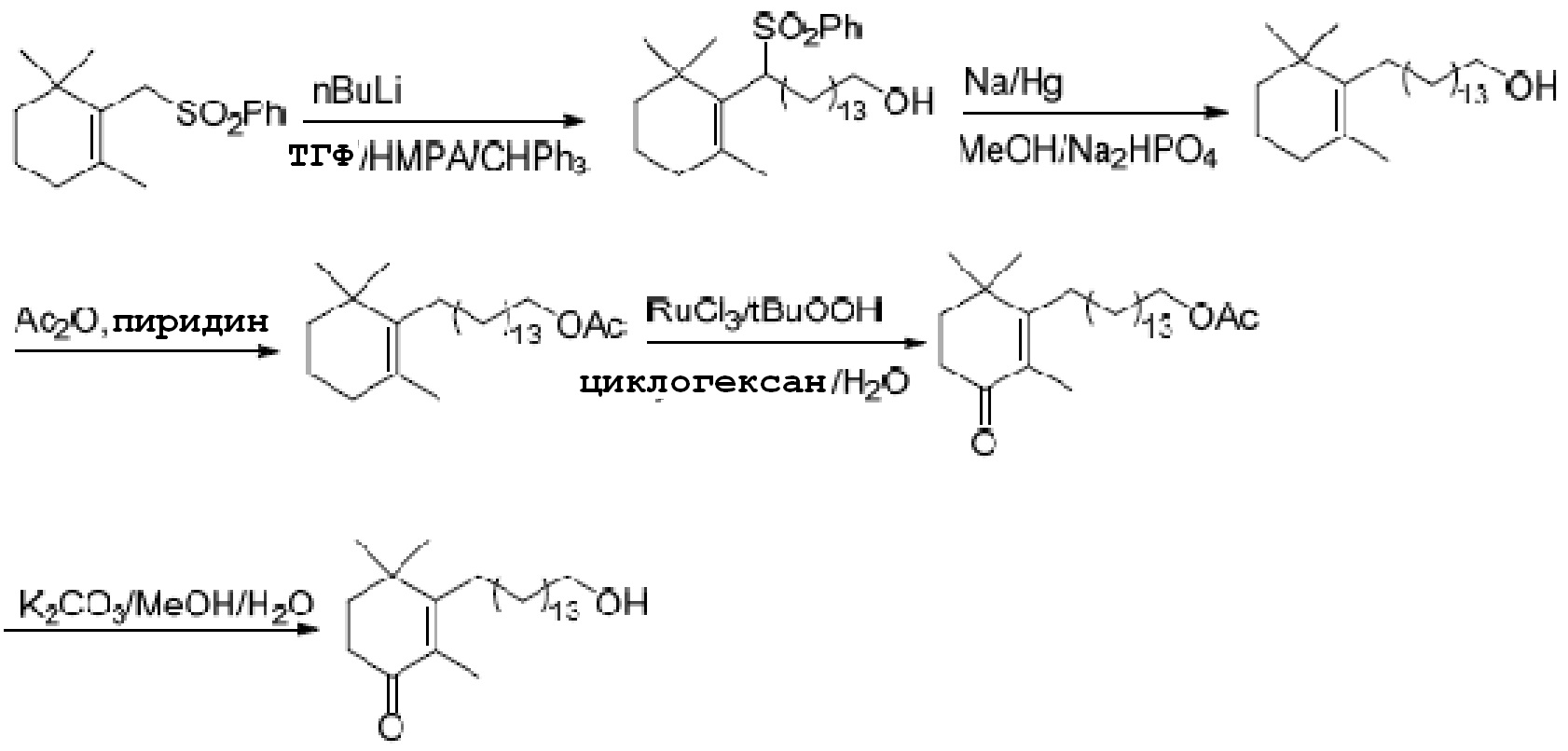
Этот способ не подходит для промышленного производства, так как сульфон, который является исходным материалом на схеме 2, трудно получать; при удалении сульфоновой группы необходимо применять высокотоксичный Na(Hg); и при введении карбонильной группы применяют рутений, очень дорогой металл, и гидропероксид трет-бутила, высокоопасное веещство.
В WO2004/087630 описан способ получения, показанный на схеме 3.
Схема 3:
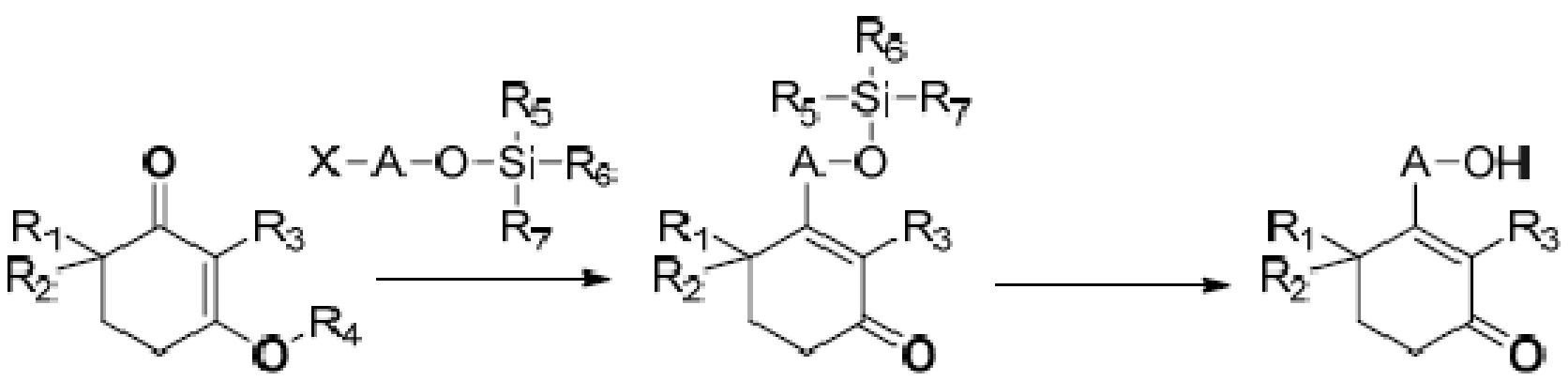
На схеме 3 применяют реагент Гриньяра для проведения реакции 1,2-присоединения с ненасыщенным кетоном. Однако производительность реакции присоединения составляет едва около 30%, и большое количество галогенированного углеводорода, защищенного силиловым эфиром, расщепляется во время получения реагента Гриньяра, значительно повышая стоимость производства. Кроме того, низкая производительность и большое количество побочных продуктов, образованных во время получения реагента Гриньяра, крайне затрудняет очистку продукта. Таким образом, эта схема также не подходит для промышленного производства.
Более того, получение исходного лекарственного средства высокой очистки является основным требованием в разработке длинноцепочечного спирта циклогексенона в качестве медицинского средства и его клинического применения. Длинноцепочечные спирты циклогексеноны имеют низкую температуру плавления и превращаются в масло при повышении комнатной температуры, что затрудняет их очистку. Длинноцепочечные спирты циклогексеноны, описанные в литературе, получают в виде продуктов высокой очистки обработкой хроматографией на колонке. Так как хроматография на колонке не подходит для промышленного производства из-за высокой стоимости и больших потерь, существует крайняя потребность в способе производства длинноцепочечного спирта циклогексенона высокой чистоты, получаемого по короткой схеме с высоким выходом, технологичном и подходящем для промышленного применения.
Сущность изобретения
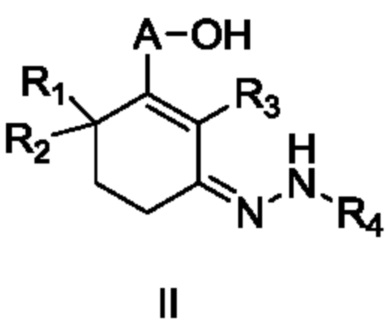
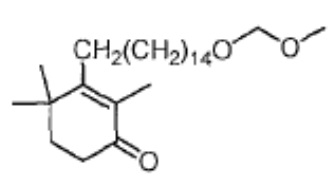
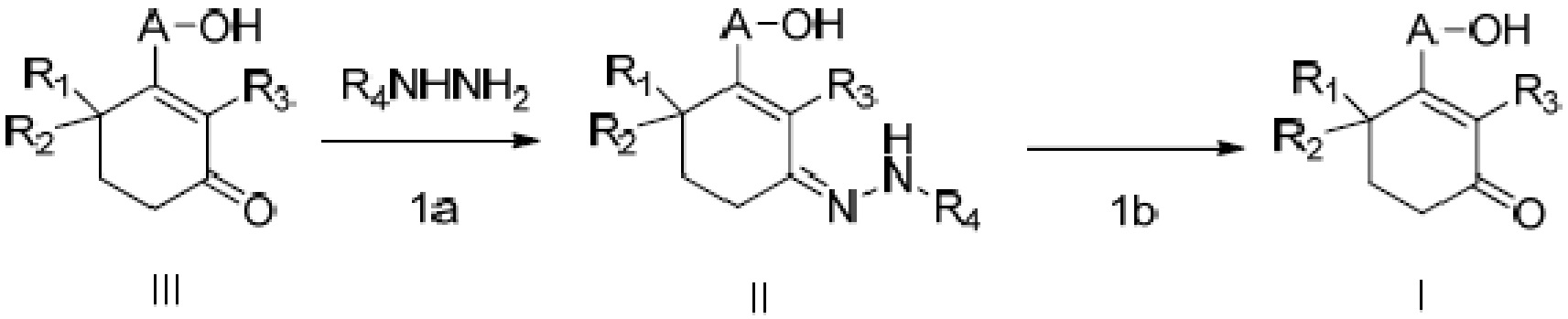
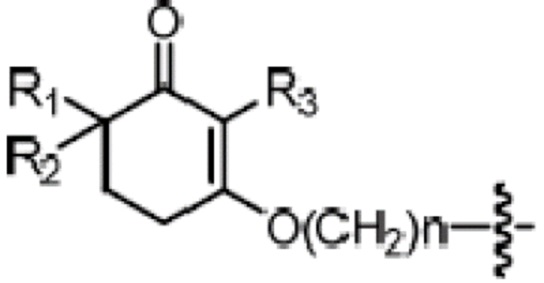
Объектом данного изобретения является способ получения длинноцепочечного спирта циклогексенона высокой чистоты, представленного формулой I, где способ проходит по следующей реакционной схеме:
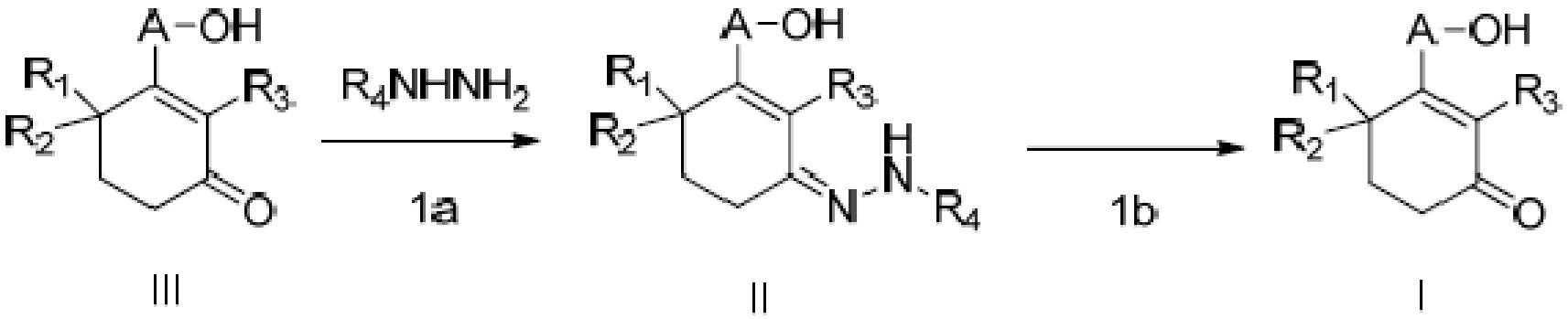
где
A является C10-18алкиленом,
R1, R2 и R3 каждый независимо является H или метилом,
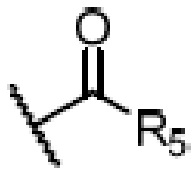
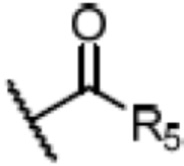
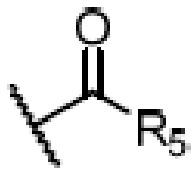
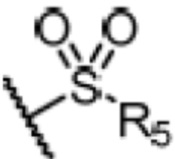
R4 является H, замещенным или незамещенным C1-7алкилом, замещенным или незамещенным C6-14арилом, 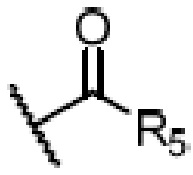 или
или 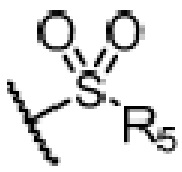 ,
,
где ʺзамещенныйʺ означает замещенный одним заместителем или двумя или более заместителями, выбранными из метила, нитро, хлора и брома; R5 является H, метокси, трет-бутокси, бензилокси, фенилом, 4-метилфенилом или амино; и R4 предпочтительно является  или
или 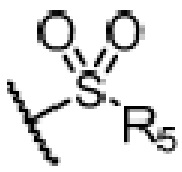 ,
,
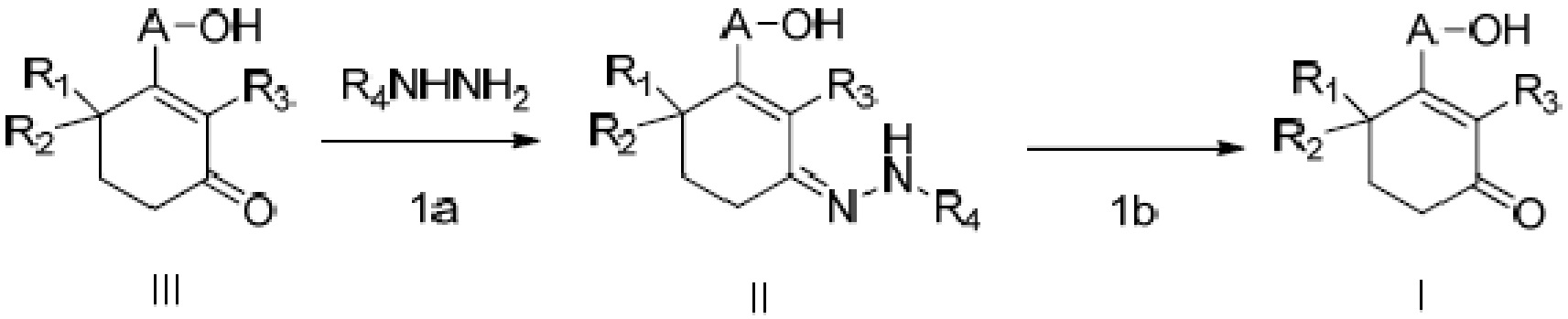
где способ включает стадии
(1a) реакцию конденсации неочищенного продукта длинноцепочечного спирта циклогексенона III и гидразина или его производного R4NHNH2 в подходящих условиях с получением соединения II, и
(1b) гидролиз соединения II в присутствии кислого вещества с получением длинноцепочечного спирта циклогексенона высокой чистоты (соединение I).
В этом способе длинноцепочечный спирт циклогексенон высокой чистоты (соединение I) имеет чистоту по ВЭЖХ более 95%; предпочтительно, длинноцепочечный спирт циклогексенон высокой чистоты имеет чистоту по ВЭЖХ более 99%; и более предпочтительно, длинноцепочечный спирт циклогексенон высокой чистоты имеет чистоту по ВЭЖХ более 99,9%.
В этом способе подходящие условия на стадии (1a) означают условия, в которых присутствует кислота, щелочь или десикант. Щелочью является одно, или два или более веществ, выбранных из алкоксида натрия, алкоксида калия, оксида магния, оксида кальция, карбоната натрия, карбоната калия, карбоната лития, карбоната цезия, карбоната кальция, ацетата натрия, ацетата калия, ацетата лития, бензоата натрия, бензоата калия, бензоата лития, триэтиламина, триметиламина, диизопропилэтиламина, 1,8-диазабицикло[5.4.0]ундец-7-ена, 1,5-диазабицикло[4.3.0]нон-5-ена и триэтилендиамина, и, предпочтительно, одно, или два или более веществ, выбранных из трет-бутоксида натрия, трет-бутоксида калия, карбоната натрия, карбоната калия, ацетата натрия, ацетата калия, триэтиламина и диизопропилэтиламина. Кислотой является одно, или два или более веществ, выбранных из уксусной кислоты, бензойной кислоты, хлористоводородной кислоты, серной кислоты, фосфорной кислоты, бензолсульфоновой кислоты, п-толуолсульфоновой кислоты, камфорсульфоновой кислоты, этилового эфира трифторида бора, трифторметансульфоната индия и трифторметансульфоната висмута, и, предпочтительно, одно, или два или более веществ, выбранных из уксусной кислоты, п-толуолсульфоновой кислоты, этилового эфира трифторида бора и трифторметансульфоната висмута. Десикантом является одно, или два или более веществ, выбранных из десикантов, таких как молекулярное сито, сульфат магния, сульфат натрия и гидрид кальция, и, предпочтительно, одно, или два или более веществ, выбранных из молекулярного сита и сульфата магния.
Молекулярное отношение гидразина или его производного R4NHNH2 к неочищенному продукту длинноцепочечного спирта циклогексенона III составляет от 0,8:1 до 3:1, и, предпочтительно, от 0,9:1 до 2:1. Реакцию конденсации проводят в растворителе, и растворителем является одно, или два или более веществ, выбранных из метанола, этанола, изопропанола, н-бутанола, трет-бутанола, трет-пентанола, ацетонитрила, тетрагидрофурана, метил трет-бутилового эфира, изопропилового эфира, диоксана, ацетона, 2-бутанона, этилацетата, изобутилацетата, толуола, ксилола, хлорбензола, бензола, N,N-диметилацетамида, N,N-диметилформамида, N,N-диэтилформамида, N-метилпирролидона, дихлорметана, 1,2-дихлорэтана, хлороформа, н-гексана, н-гептана, циклогексана и воды, и, предпочтительно, одно, или два или более веществ, выбранных из метанола, этанола, тетрагидрофурана, ацетонитрила и н-гептана.
Температура реакции конденсации составляет от 0 до 149°C, и, предпочтительно, от 20 до 129°C, и время реакции составляет от 0,5 до 24 часов, и, предпочтительно, от 1 до 10 часов.
В этом способе кислым веществом, указанным на стадии (1b), является одно, или два или более веществ, выбранных из органической кислоты, неорганической кислоты, кислоты Льюиса, кислой соли и другого кислого вещества. Неорганической кислотой является серная кислота, хлористоводородная кислота, фосфорная кислота, полифосфорная кислота или фосфорновольфрамовая кислота. Органической кислотой является муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, фумаровая кислота, малеиновая кислота, трифторуксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, камфорсульфоновая кислота или трифторметансульфоновая кислота. Кислотой Льюиса является этиловый эфир трифторида бора, трихлорид алюминия, трихлорид железа, трифторметансульфонат висмута или трифторметансульфонат индия. Кислой солью является кислая соль, такая как гидросульфат натрия, гидросульфат аммония, гидросульфат магния, п-толуолсульфонат пиридиния, гидрохлорид триэтиламина и гидрохлорид пиридина. Другими кислыми веществами являются силикагель, кислая смола или кислая смола. Предпочтительно, кислым веществом является п-толуолсульфоновая кислота, хлористоводородная кислота, серная кислота, гидросульфат натрия или гидросульфат магния. Молярное отношение добавленного количества соединения II к добавленному количеству кислого вещества составляет от 1:0,2 до 1:10, и, предпочтительно, от 1:0,2 до 1:2.
Реакцию гидролиза проводят в растворителе, и растворителем является одно, или два или более веществ, выбранных из бензола, толуола, хлорбензола, ксилола, ацетонитрила, 2-бутанона, ацетона, 1,2-диметил-2-имидазолона, диметилсульфоксида, диметилсульфона, сульфолана, гексаметилфосфорного триамида, N,N-диметилформамида, N,N-диметилацетамида, N,N-диэтилформамида, N-метилпирролидона, метанола, этанола, изопропанола, н-бутанола, этиленгликоля, полиэтиленгликоля, диоксана, метил-трет-бутилового эфира, изопропилового эфира, тетрагидрофурана, н-гексана, циклогексана, дихлорметана, 1,2-дихлорэтана, хлороформа и воды; и, предпочтительно, растворителем является одно, или два или более веществ, выбранных из толуола, ацетонитрила, метанола, этанола, воды, тетрагидрофурана, метил-трет-бутилового эфира и дихлорметана.
Температуру реакции гидролиза выбирают из от 20 до 139°C, и время реакции составляет от 0,5 до 24 часов. Предпочтительно, температура реакции составляет от 20 до 100°C, и время реакции составляет от 0,5 до 10 часов.
Неочищенным продуктом длинноцепочечного спирта циклогексенона (соединение III) относится к такому продукта, очистка которого еще не проведена. Если содержание длинноцепочечного спирта циклогексенона составляет 95% или менее, спиртовой продукт считается неочищенным продуктом. Обычно содержание неочищенного продукта длинноцепочечного спирта циклогексенона (соединение III) составляет от 45 до 80% при применении способа в соответствии с данным изобретением (метод внешнего стандарта ВЭЖХ).
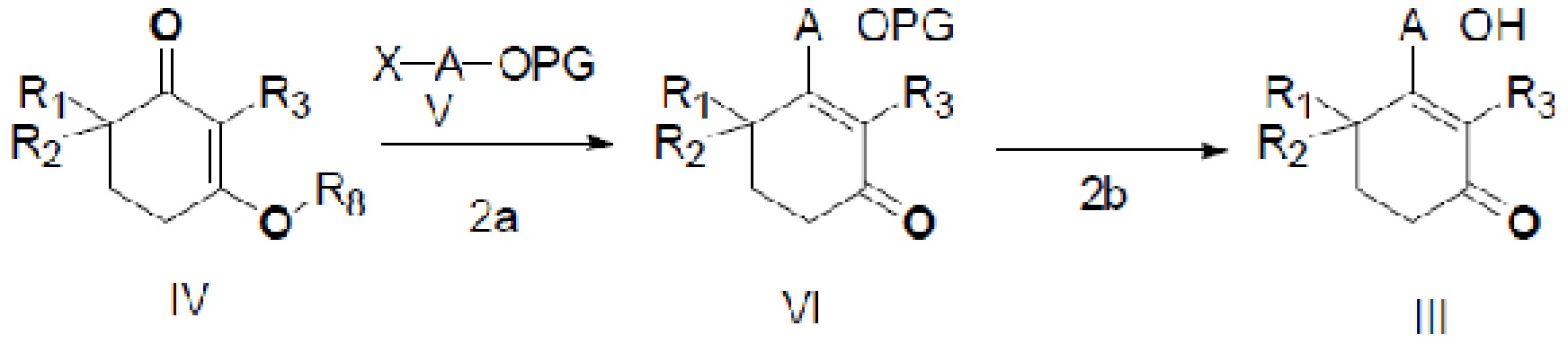
В данном изобретении также представлен способ получения неочищенного продукта длинноцепочечного спирта циклогексенона, представленного формулой III, который показан на следующей реакционной схеме.
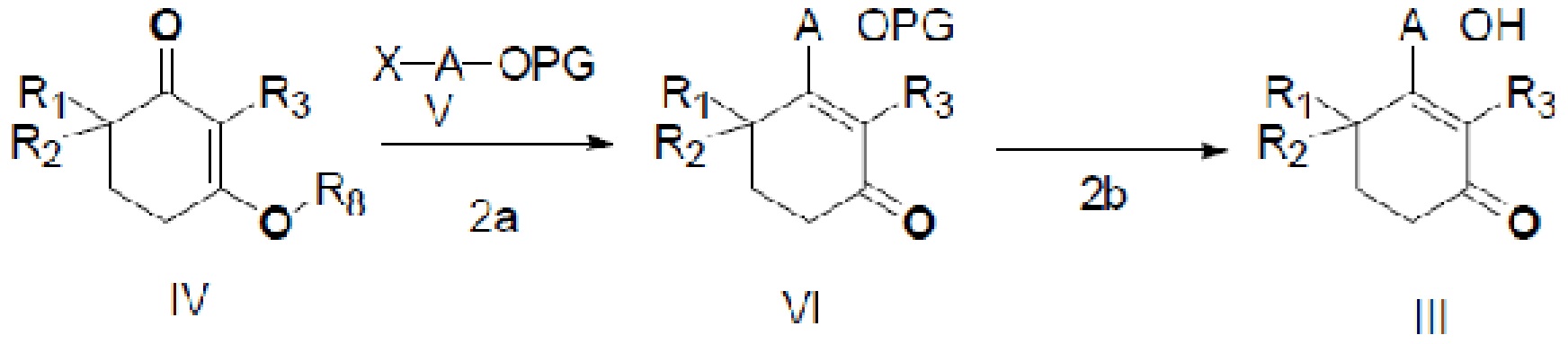
Этот способ включает следующие стадии:
(2a) медиированная металлом реакция Барбье соединения IV и соединения V с получением соединения VI, и
(2b) реакция снятия защиты с соединения VI в присутствии кислого вещества для прямого удаления защитной группы с получением неочищенного продукта длинноцепочечного спирта циклогексенона III,
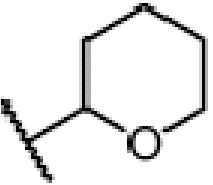
где X является галогеном, R8 является C1-7алкилом, C6-14 арилом или 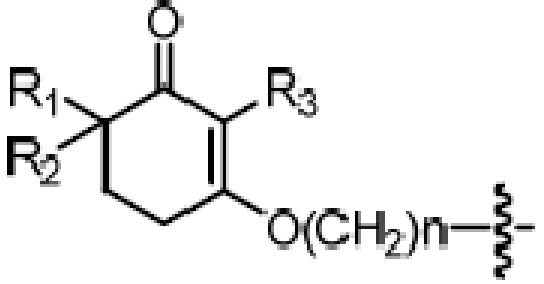 , R1, R2, R3 и A такие, как определены выше, n равно 1-12, ЗГ является
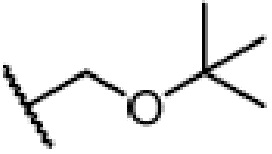
, R1, R2, R3 и A такие, как определены выше, n равно 1-12, ЗГ является 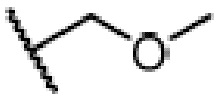 ,
,  ,
,  ,
, 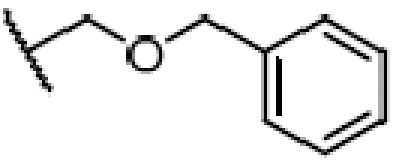 ,
, 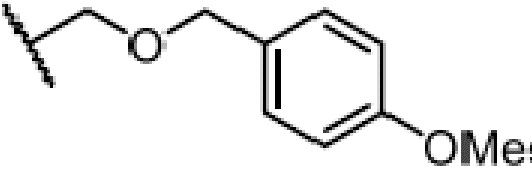 или
или 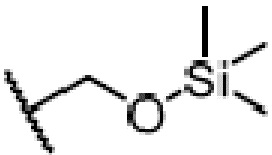 ,
,
и ЗГ предпочтительно является 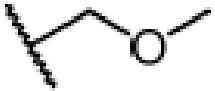 или
или 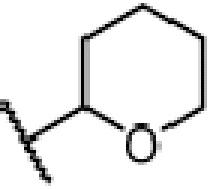 .
.
В этом способнее металлом на стадии (2a) является литий, натрий, стронций, магния или цинк, и, предпочтительно, литий, стронций или магний; и молярное отношение металла к соединению IV составляет от 1:1 до 12:1, и, предпочтительно, от 2:1 до 10:1.
Молярное отношение соединения V к соединению IV составляет от 0,6:1 до 6:1, и, предпочтительно, от 0,8:1 до 4:1.
Реакцию Барбье может проводиться в присутствии или отсутствии катализатора, и катализатором является одно, или два или более веществ, выбранных из тетраметилэтилендиамина и гексаметилфосфорного триамида, и молярное отношение катализатора к соединению IV составляет от 0,2:1 до 2:1, и, предпочтительно, от 0,4:1 до 1,2:1.
Реакцию Барбье проводят в подходящем растворителе, и растворителем является одно, или два или более веществ, выбранных из бензола, толуола, хлорбензола, ксилола, тетрагидрофурана, метилтетрагидрофурана, диоксана, метил-трет-бутилового эфира, н-гексана, н-гептана, циклогексана, ацетонитрила, гексаметилфосфорного триамида и сульфолана, и, предпочтительно, одно, или два или более веществ, выбранных из толуола, ксилола, тетрагидрофурана, метилтетрагидрофурана и н-гексана.
Температуру реакции Барбье выбирают из от -20 до 100°C, предпочтительно, от -10 до 50°C, и время реакции составляет от 1 до 36 часов, и, предпочтительно, от 2 до 24 часов.
В этом способе кислым веществом на стадии (2b) является одно, или два или более веществ, выбранных из метансульфоновой кислоты, бензолсульфоновой кислоты, п-толуолсульфоновой кислоты, камфорсульфоновой кислоты, п-толуолсульфоната пиридиния, гидрохлорида триэтиламина, хлористоводородной кислоты, серной кислоты, фосфорной кислоты, гидросульфата натрия, гидросульфата магния, кислого молекулярного сита, кислой смолы, уксусной кислоты, трифторуксусной кислоты, трифторметансульфоновой кислоты, трихлорида железа, простого эфира трифторида бора, хлоротриметилсилана и ацетилхлорида, и, предпочтительно, одно, или два или более веществ, выбранных из бензолсульфоновой кислоты, п-толуолсульфоновой кислоты, камфорсульфоновой кислоты, п-толуолсульфоната пиридиния, хлористоводородной кислоты и уксусной кислоты. Молярное отношение кислого вещества к соединению VI составляет от 0,02:1 до 1:1, и, предпочтительно, от 0,05:1 до 0,2:1.
Реакцию снятия защиты проводят в подходящем растворителе, и растворителем является одно, или два или более веществ, выбранных из метанола, этанола, изопропанола, н-бутанола, трет-бутанола, трет-пентанола, ацетонитрила, тетрагидрофурана, метил-трет-бутилового эфира, изопропилового эфира, диоксана, ацетона, 2-бутанона, этилацетата, изобутилацетата, толуола, ксилола, хлорбензола, бензола, N,N-диметилацетамида, N,N-диметилформамида, N,N-диэтилформамида, N-метилпирролидона, дихлорметана, 1,2-дихлорэтана, хлороформа, н-гексана, н-гептана, циклогексана и воды, и, предпочтительно, является одно, или два или более веществ, выбранных из метанола, этанола, тетрагидрофурана, ацетонитрила, н-гептана и воды.
Температуру реакции снятия защиты выбирают из от -20 до 100°C, и, предпочтительно, от 0 до 50°C. Время реакции составляет от 0,1 до 10 часов, и, предпочтительно, от 0,5 до 5 часов.
Стадия (2a) и стадия (2b) могут быть по отдельности проведены постепенно, или могут быть проведены методом реакции в одном реакционном сосуде.
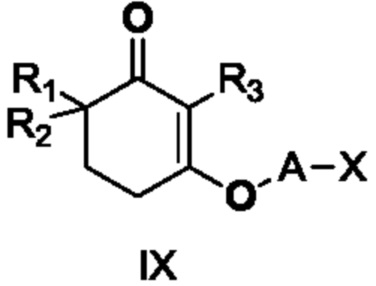
В данном изобретении далее представлен способ получения неочищенного продукта длинноцепочечного спирта циклогексенона, представленного формулой III. Более конкретно, соединение IX подвергают медиированной металлом межмолекулярной реакции Барбье с получением неочищенного продукта длинноцепочечного спирта циклогексенона III. Реакция показана на следующей реакционной схеме:
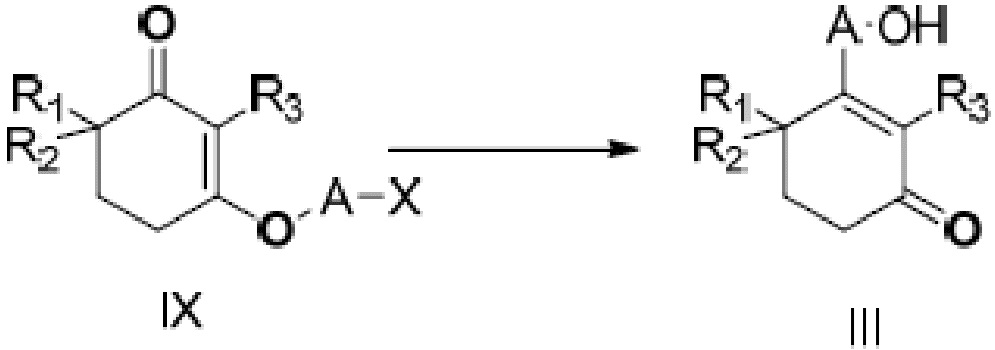
где A является C10-18алкиленом и X является галогеном.
В этом способе металлом является литий, натрий, стронций, магний или цинк, и, предпочтительно, литий, стронций или магний.
Молярное отношение металла к соединению IX составляет от 1:1 до 12:1, и, предпочтительно, от 2:1 до 10:1.
Реакцию Барбье может проводиться в присутствии или отсутствии катализатора, и катализатором является одно, или два или более веществ, выбранных из тетраметилэтилендиамина и гексаметилфосфорного триамида, и молярное отношение катализатора к соединению IX составляет от 0,2 до 2:1, и, предпочтительно, от 0,4 до 1,2:1.
Реакцию Барбье проводят в подходящем растворителе, и растворителем является одно, или два или более веществ, выбранных из бензола, толуола, хлорбензола, ксилола, тетрагидрофурана, метилтетрагидрофурана, диоксана, метил-трет-бутилового эфира, н-гексана, н-гептана, циклогексана, ацетонитрила, гексаметилфосфорного триамида и сульфолана, и, предпочтительно, одно, или два или более веществ, выбранных из толуола, ксилола, тетрагидрофурана, метилтетрагидрофурана и н-гексана.
Температуру реакции Барбье выбирают из от -20 до 100°C, предпочтительно, от -10 до 50°C, и время реакции составляет от 1 до 36 часов, и, предпочтительно, от 2 до 24 часов.
Полезный эффект
В данном изобретении представлен способ получения и очистки длинноцепочечного спирта циклогексенона высокой чистоты, получение длинноцепочечного спирта циклогексенона однореакторным способом с применением медиированной металлом реакции Барбье вместо реакции Гриньяра (которая требует отдельное получение только реагента Гриньяра), описанной в литературе. Продукт очищают реакцией конденсации с гидразином или его производным, избегая хроматографии на колонке.
Способ в соответствии с данным изобретением осуществляют по короткой схеме, он технологичен, легко контролируется, дает продукт высокой чистоты с высоким выходом и прост, высокоэффективен, экономичен и промышленно применим.
Описание вариантов
Далее описано данное изобретение более подробно со ссылкой на примеры. Однако представленные ниже варианты просто описаны в виде примеров, и эти примеры не ограничивают данное изобретение каким-либо образом. Понятно, что специалист в данной области техники может провести различные замещения или модификации в пределах объема и концепции данного изобретения. Данное изобретение должно рассматриваться как включающее замещения и модификации, сделанные в пределах объема формулы изобретения, приложенной к описанию.
Получение соединения IV
Пример получения 1: 3-изобутокси-2,6,6-триметилциклогекс-2-ен-1-он
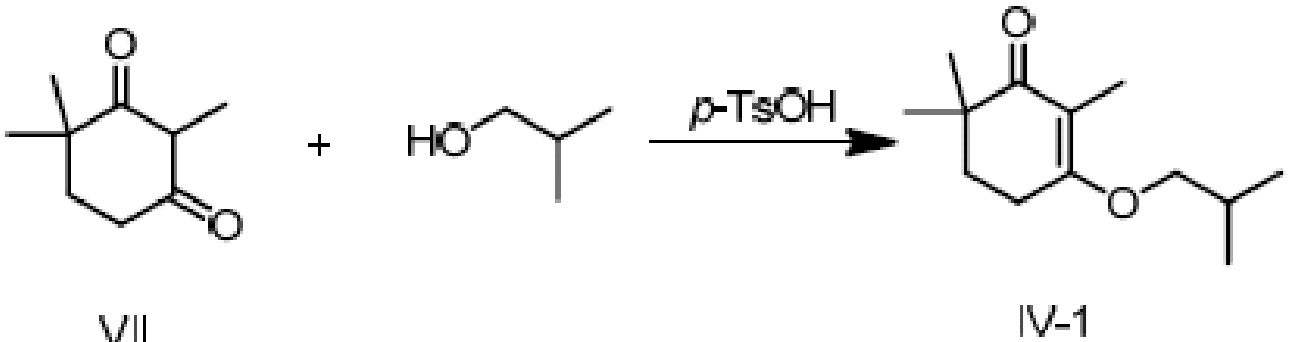
2,4,4-триметилциклогексан-1,3-дион VII (80 г, 1 экв.) и изобутанол (76,9 г, 2 экв.) добавляют к циклогексану (400 мл), и туда добавляют п-ТСК·H2O (5 г, 0,05 экв.), затем нагревают при температуре кипения с обратным холодильником в течение 16 часов для отделения воды. Реакционную смесь подвергают последующей обработке и охлаждают до температуры окружающей среды. Продукт затем последовательно промывают 5% гидроксидом натрия (80 мл), водой (80 мл) и насыщенным раствором хлорида натрия (80 мл), и сушат над безводным сульфатом натрия, затем концентрируют сушкой с получением 3-изобутокси-2,6,6-триметилциклогекс-2-ен-1-она (103,65 г, 95%).
1H ЯМР (400 МГц, CDCl3): δ 3,77 (д, 2 H, J=6,4 Гц), 2,55-2,58 (м, 2 H), 1,95-2,05 (м, 1 H), 1,82 (т, 2 H, J=6,4 Гц), 1,72 (с, 3 H), 1,11 (с, 6 H), 1,01 (д, 6 H, J=6,4 Гц).
Пример получения 2: 3-циклогексилметокси-2,6,6-триметилциклогекс-2-ен-1-он
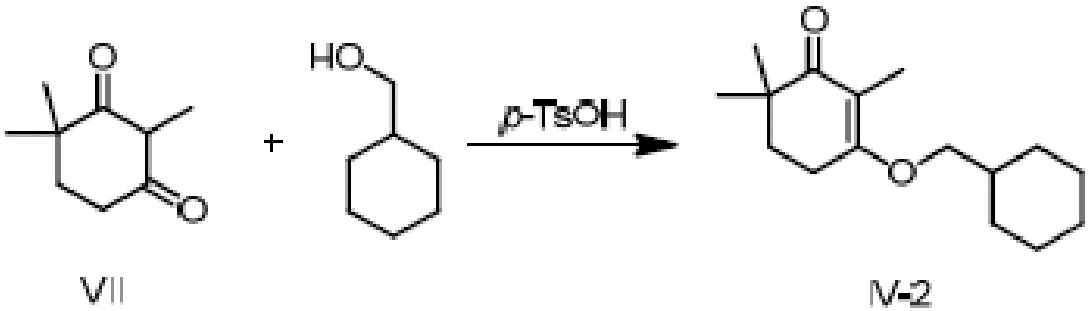
2,4,4-триметилциклогексан-1,3-дион VII (10 г, 1 экв.) и циклогексилметанол (14,8 г, 2 экв.) добавляют к циклогексану (100 мл), и туда добавляют п-ТСК·H2O (0,62 г, 0,05 экв.), затем нагревают при температуре кипения с обратным холодильником в течение 16 часов для отделения воды. Реакционную смесь подвергают последующей обработке и охлаждают до температуры окружающей среды. Продукт затем последовательно промывают 5% гидроксидом натрия (20 мл), водой (20 мл) и насыщенным раствором хлорида натрия (20 мл), и сушат над безводным сульфатом натрия, затем концентрируют сушкой и очищают хроматографией на колонке с получением 3-циклогексилметокси-2,6,6-триметилциклогекс-2-ен-1-она (14,8 г, 91%).
1H ЯМР (400 МГц, CDCl3) δ 3,80(д, J=6,9Гц, 1H), 2,55 (тд, 1 H, J=6,2, 1,1 Гц), 1,83 (м, 6 H), 1,75 (м, 3 H), 1,72 (с, 3 H), 1,36-1,23 (м, 6 H), 1,12 (с, 6 H).
Пример получения 3: 3,3'-(этил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он)

2,4,4-триметилциклогексан-1,3-дион VII (5 г, 1 экв.), этиленгликоль (1,01 г, 0,5 экв.), п-ТСК·H2O (311 мг, 0,05 экв.) и толуол (30 мл) добавляют в колбу и нагревают при температуре кипения с обратным холодильником в течение 6 часов для отделения воды. Толуол сушат вращением, и добавляют насыщенный раствор гидрокарбоната натрия и дихлорметан, затем экстрагируют. Слой дихлорметана затем один раз промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и сушат вращением. Туда добавляют смешанный растворитель петролейного эфира и этилацетата, и осаждают твердые вещества, затем перемешивают в течение 3 часов и затем фильтруют отсасыванием и сушат с получением 3,3'-(этил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-она) (4,3 г, 80%). Температура плавления от 131 до 132°C.
1H ЯМР (300 МГц, CDCl3) δ 4,25 (с, 4 H), 2,57 (т, 4 H, J=6,2 Гц), 1,81 (т, 4 H, J=6,3 Гц), 1,68 (с, 6 H), 1,07 (с, 12 H).
Пример получения 4: 3-метокси-2,6,6-триметилциклогекс-2-ен-1-он
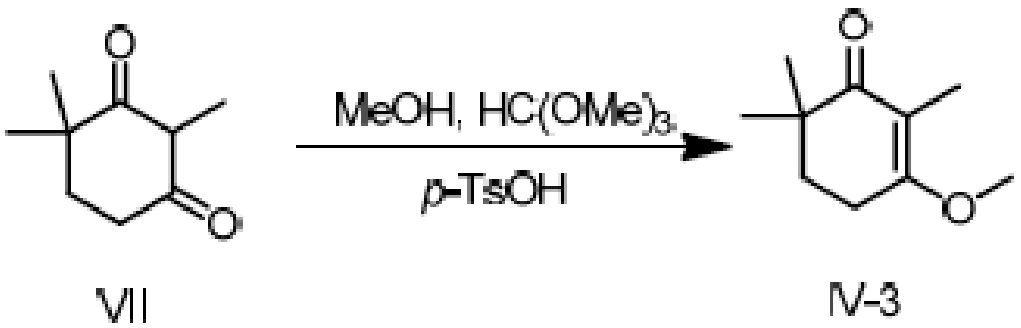
2,4,4-триметилциклогексан-1,3-дион VII (2,7 г, 1 экв.) и триметилортоформиат (2,8 г, 1,5 экв.) добавляют к метанолу (40 мл), и туда добавляют п-ТСК·H2O (167 мг, 0,05 экв.), затем перемешивают при комнатной температуре в течение ночи. Реакционную смесь подвергают последующей обработке, и для разбавления добавляют дихлорметан (30 мл). Продукт промывают последовательно 5% гидроксидом натрия (20 мл), водой (10 мл) и насыщенным раствором хлорида натрия (10 мл) и сушат над безводным сульфатом натрия, затем концентрируют сушкой и очищают хроматографией на колонке с получением 3-метокси-2,6,6-триметилциклогекс-2-ен-1-она (2,19 г, 74,4%).
1H ЯМР (400 МГц, CDCl3): δ 3,81 (с, 3 H), 2,55-2,58 (м, 2 H), 1,95-2,05 (м,1 H), 1,82 (т, 2 H, J=6,4 Гц), 1,72 (с, 3 H), 1,11 (с, 6 H).
Пример получения 5: 3,3'-(пропил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он)
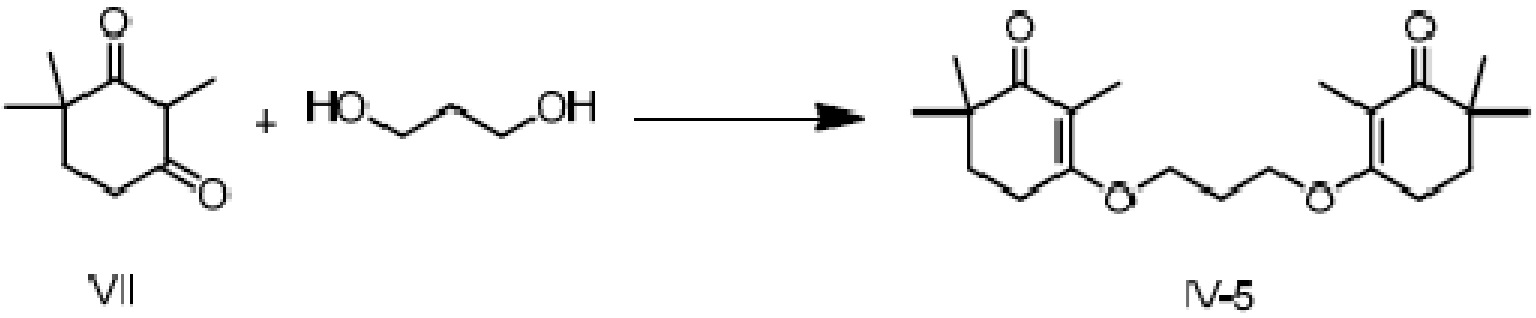
2,4,4-триметилциклогексан-1,3-дион VII (5 г, 1 экв.), 1,3-пропандиол (1,23 г, 0,5 экв.), п-ТСК·H2O (311 мг, 0,05 экв.) и толуол (30 мл) добавляют в колбу и нагревают при температуре кипения с обратным холодильником в течение 6 часов для отделения воды. Толуол сушат вращением, и добавляют насыщенный водный раствор гидрокарбоната натрия и дихлорметан, затем экстрагируют. Слой дихлорметана затем один раз промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и сушат вращением, затем проводят хроматографию на колонке с получением 3,3'-(пропил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-она) (3,96 г, 70%).
1H ЯМР (400 МГц, CDCl3) δ 4,13 (м, 4 H), 2,46 (т, 4 H, J=6,2 Гц), 1,81 (т, J=6,2 Гц, 4 H), 1,70(с, 6 H), 1,32 (т, 2 H, J=6,2 Гц), 1,08 (с, 12 H).
Пример получения 6: 3,3'-(бутил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он)
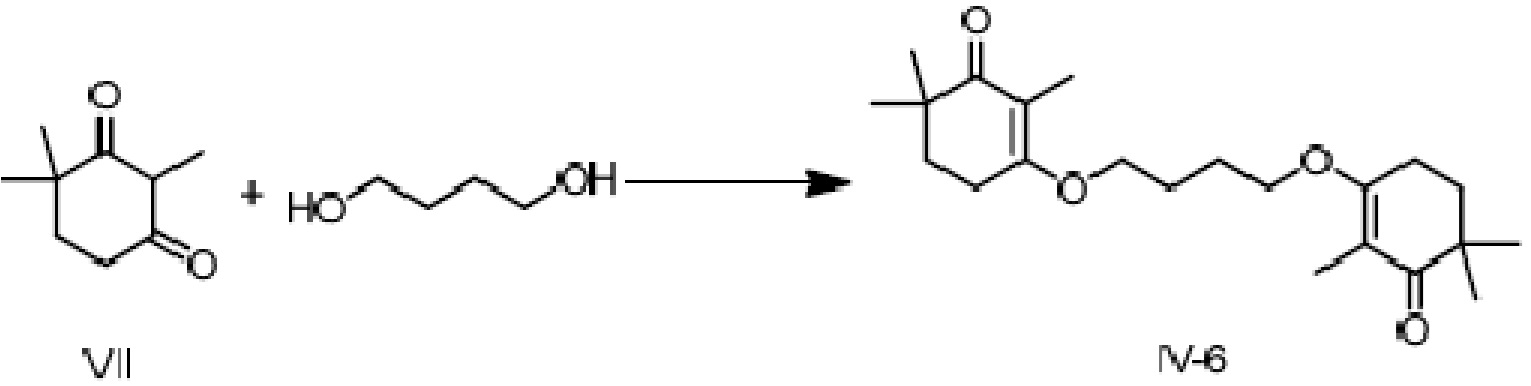
2,4,4-триметилциклогексан-1,3-дион VII (5 г, 1 экв.) растворяют в толуоле, и туда добавляют п-ТСК·H2O (280 мг, 0,05 экв.) и 1,4-бутандиол (1,46 г, 0,5 экв.), затем нагревают при кипении с обратным холодильником для отделения воды. Реакционную смесь охлаждают до комнатной температуры, и добавляют насыщенный раствор карбоната натрия, затем добавляют этилацетат для экстрагирования. Органический слой промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия, концентрируют и растирают со смешанным растворителем петролейного эфира и этилацетата, затем фильтруют с получением соединения 3,3'-(бутил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-она) (4,3 г, 74%). Температура плавления от 132 до 134°C.
1H ЯМР (300 МГц, CDCl3) δ 4,10(м, 4 H), 2,57 (т, 4 H, J=6,2 Гц), 1,83 (м, 4 H), 1,78 (т, 4 H, J=6,2 Гц) 1,70(с, 6 H), 1,08 (с, 12 H).
Пример получения 7: 3,3'-(пентил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он)
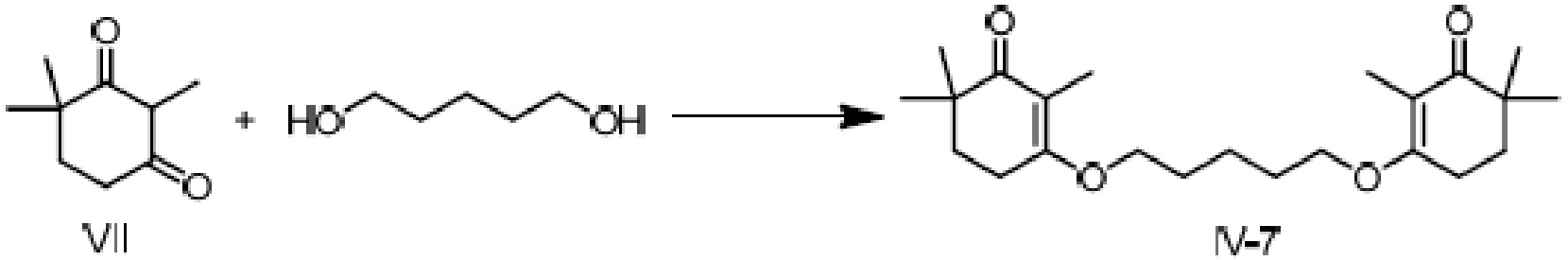
2,4,4-триметилциклогексан-1,3-дион VII (5 г, 1 экв.) растворяют в толуоле, и туда добавляют п-ТСК·H2O (280 мг, 0,05 экв.) и 1,4-пентандиол (1,69 г, 0,5 экв.), затем нагревают при кипении с обратным холодильником для отделения воды. Реакционную смесь охлаждают до комнатной температуры и добавляют насыщенный раствор карбоната натрия, затем добавляют этилацетат для экстрагирования. Органический слой промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют, затем проводят хроматографию на колонке, с получением соединения 3,3'-(пентил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-она) (3,66 г, 60%).
1H ЯМР (300 МГц, CDCl3) δ 4,10(м, 4 H), 2,57 (т, 4 H, J=6,2 Гц), 1,83 (м, 6 H), 1,78 (т, 4 H, J=6,2 Гц) 1,70(с, 6 H), 1,08 (с, 12 H).
Пример получения 8: 3,3'-(гексил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он)
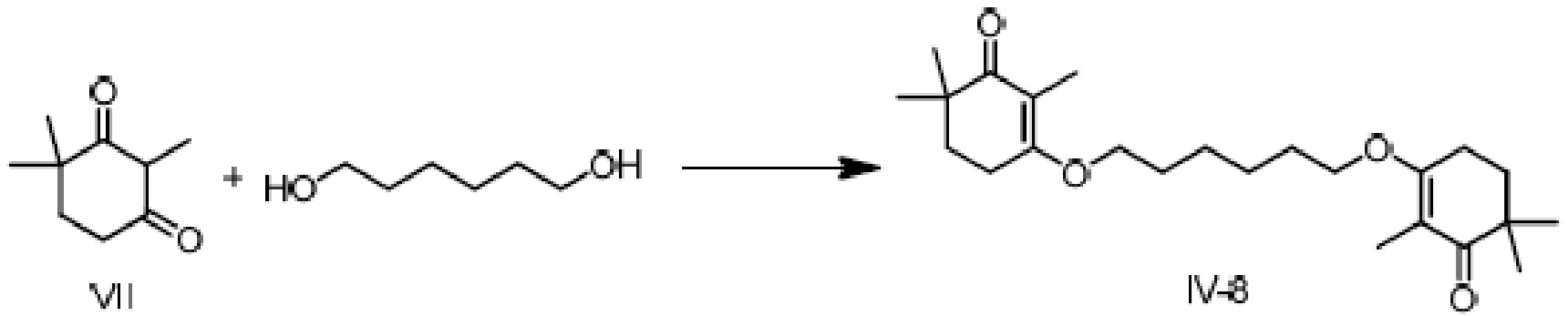
2,4,4-триметилциклогексан-1,3-дион VII (5 г, 1 экв.) и 1,6-гександиол (1,92 г, 0,5 экв.) растворяют в толуоле (50 мл), и туда добавляют камфорсульфоновую кислоту (1,5 г, 0,2 экв.), затем нагревают при кипении с обратным холодильником в течение ночи для отделения воды. Реакционную смесь охлаждают до температуры окружающей среды и отдельно промывают 5% гидроксидом натрия (20 мл), водой (10 мл) и насыщенным раствором хлорида натрия (20 мл). Продукт сушат над безводным сульфатом натрия, фильтруют и сушат концентрацией, затем растирают с метанолом с получением 3,3'-(гексил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-она) (4,7 г, 89%) в виде белого твердого вещества. Температура плавления от 92 до 94°C.
1H ЯМР (300 МГц, CDCl3) δ 4,10(м, 4 H), 2,47 (т, 4 H, J=6,2 Гц), 1,88 (м, 4 H), 1,78 (т, 4 H, J=6,2 Гц) 1,70(с, 6 H), 1,32 (м, 4 H) 1,08 (с, 12 H).
Получение соединения IX
Пример получения 9: 3-(15-хлорпентадецилокси-2,6,6-триметилциклогекс-2-ен-1-он)
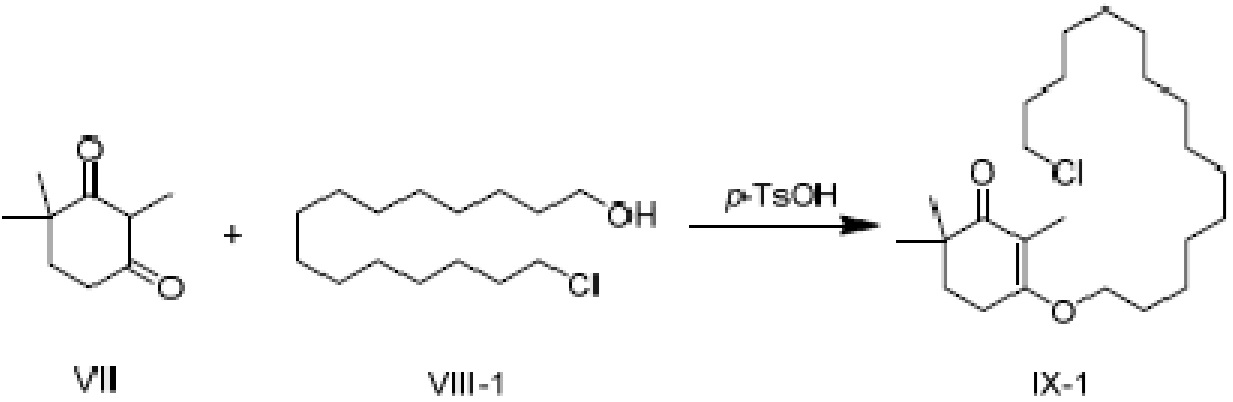
2,4,4-триметилциклогексан-1,3-дион VII (1,3 г, 1,1 экв.) и 15-хлорпентадеканол VIII-1 (2 г, 1 экв.) добавляют к циклогексану (50 мл), и туда добавляют п-ТСК·H2O (70 мг, 0,05 экв.), затем нагревают при температуре кипения с обратным холодильником в течение 16 часов для отделения воды. Реакционную смесь подвергают последующей обработке, охлаждают до температуры окружающей среды и последовательно промывают 5% гидроксидом натрия (20 мл), водой (10 мл) и насыщенным раствором хлорида натрия (10 мл). Продукт сушат над безводным сульфатом натрия и сушат концентрацией с получением 3-(15-хлорпентадецилокси)-2,6,6-триметилциклогекс-2-ен-1-она (2,46 г, 80,9%).
1H ЯМР (400 МГц, CDCl3): δ 3,97 (т, 2 H, J=6,8Гц), 3,45 (м, 2 H, J=6,8Гц), 2,54-2,55 (м, 2 H), 1,78-1,84 (м, 4 H), 1,68 (с, 3 H), 1,39-1,41 (м, 4 H), 1,22-1,35 (м, 21 H), 1,08 (с, 6 H).
Пример получения 10: 3-(15-бромпентадецилокси)-2,6,6-триметилциклогекс-2-ен-1-он

2,4,4-триметилциклогексан-1,3-дион VII (1,5 г, 1 экв.) и 15-бромпентадеканол VIII-2 (2,5 г, 1 экв.) добавляют к циклогексану (50 мл), и туда добавляют п-ТСК·H2O (80 мг, 0,05 экв.), затем нагревают при температуре кипения с обратным холодильником в течение 16 часов для отделения воды. Реакционную смесь подвергают последующей обработке, охлаждают до температуры окружающей среды и последовательно промывают 5% гидроксидом натрия (20 мл), водой (10 мл) и насыщенным раствором хлорида натрия (10 мл). Продукт сушат над безводным сульфатом натрия и сушат концентрацией с получением 3-(15-бромпентадецилокси)-2,6,6-триметилциклогекс-2-ен-1-она (3,37 г, 93,6%).
1H ЯМР (400 МГц, CDCl3): δ 3,97 (т, 2 H, J=6,8Гц), 3,40(м, 2 H, J=6,8Гц), 2,54-2,55 (м, 2 H), 1,78-1,84 (м, 4 H), 1,68 (с, 3 H), 1,39-1,41(м, 4 H), 1,22-1,35 (м, 21 H), 1,08 (с, 6 H).
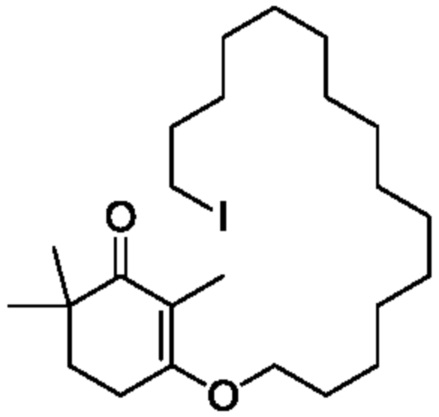
Пример получения 11: 3-(15-йодпентадецилокси)-2,6,6-триметилциклогекс-2-ен-1-он
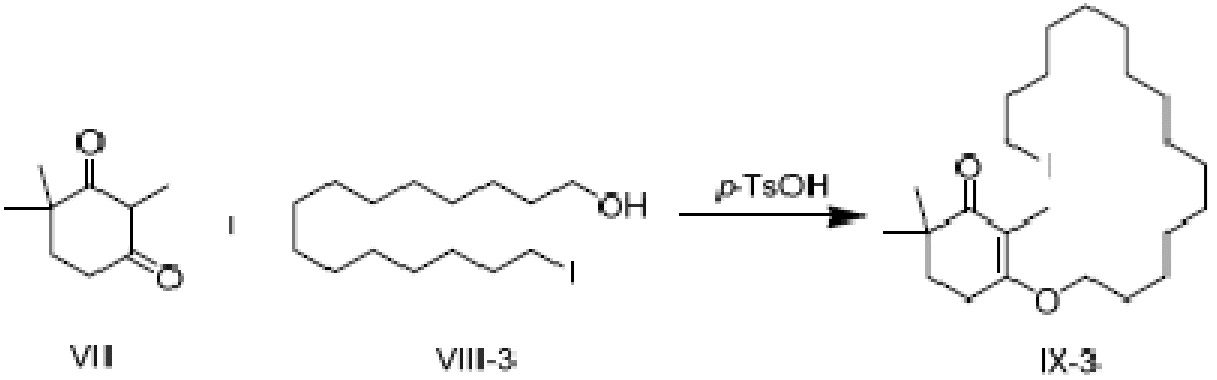
2,4,4-триметилциклогексан-1,3-дион VII (2,55 г, 1,2 экв.) и 15-йодпентадеканол VIII-3 (5 г, 1 экв.) добавляют к циклогексану (50 мл), и туда добавляют п-ТСК·H2O (130 мг, 0,05 экв.), затем нагревают при температуре кипения с обратным холодильником в течение 16 часов для отделения воды. Реакционную смесь подвергают последующей обработке, охлаждают до температуры окружающей среды, последовательно промывают 5% гидроксидом натрия (20 мл), водой (10 мл) и насыщенным раствором хлорида натрия (10 мл). Продукт сушат над безводным сульфатом натрия и сушат концентрацией, с получением 3-(15-йодпентадецилокси)-2,6,6-триметилциклогекс-2-ен-1-она (5,3 г, 76,6%).
1H ЯМР (400 МГц, CDCl3): δ 3,97 (т, 2 H,J=8,4 Гц), 3,18 (м, 2 H, J=9,6Гц), 2,54 (т, 2 H, J=8,4 Гц), 1,78-1,83 (м, 2 H), 1,68 (с, 3 H), 1,21-1,50(м, 25 H), 1,08 (с, 6 H).
Получение соединения VI
Пример 1: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
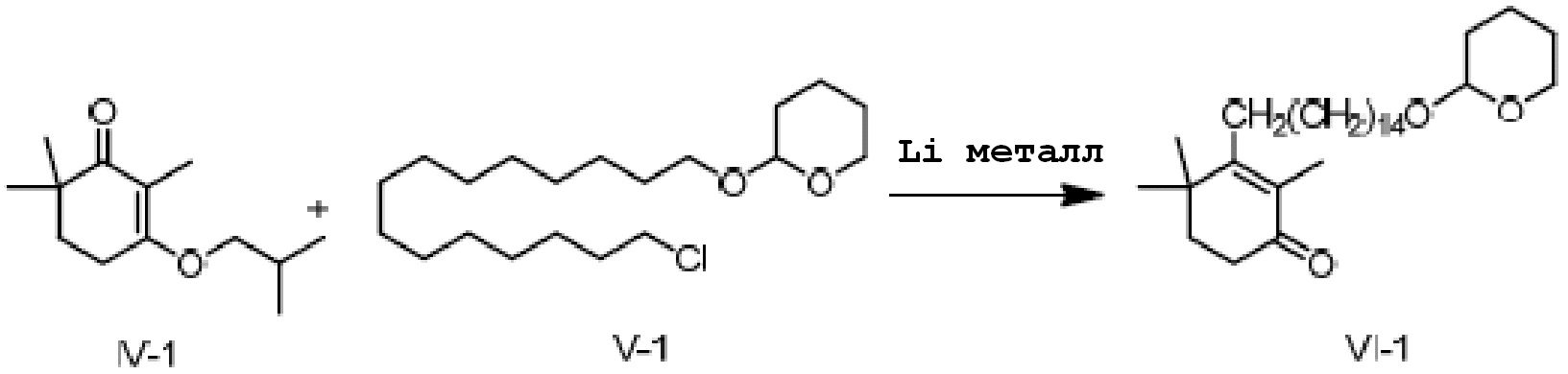
3-изобутокси-2,6,6-триметилциклогекс-2-ен-1-он IV-1 (3 г, 1 экв.) и 2-(15-хлорпентадецил)окситетрагидро-2-гидропиран V-1 (5,44 г, 1,1 экв.) добавляют в трехгорлую колбу, и три раза проводят замещение газообразным азотом. Туда добавляют тетрагидрофуран или толуол и три раза проводят замещение газообразным азотом. Туда добавляют Li (297 г, 3 экв.) и три раза проводят замещение газообразным азотом. Температуру контролируют на уровне от 25 до 30°C, и реакцию проводят в течение 16 часов. ТСХ подтверждает, что исходные материалы практически полностью прореагировали. Реакционную смесь охлаждают до от 10 до 20°C, и по каплям добавляют насыщенный хлорид аммония (30 мл), затем добавляют воду (30 мл). Смесь перемешивают в течение 5 минут и разделяют на слои. Органический слой промывают 0,5 M хлористоводородной кислотой (20 мл) и выдерживают для разделения слоев. Продукт промывают насыщенным раствором хлорида натрия и сушат над безводным сульфатом натрия, затем концентрируют сушкой с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она (неочищенный продукт: 6,6 г, 103%) в виде лаймово-зеленого масла.
1H ЯМР (400 МГц, CDCl3) δ 4,59 (дд, 1 H, J=4,5, 2,7 Гц), 3,89 (ддд, 1 H, J=11,1, 7,4, 3,4 Гц), 3,75 (дт, 1 H, J=9,5, 6,9 Гц), 3,59-3,47 (м, 1H), 3,40 (дт, 1 H, J=9,6, 6,7 Гц), 2,51-2,43 (м, 2 H), 2,23-2,14 (м, 2 H), 1,89-1,80 (м, 4 H), 1,77 (с, 3 H), 1,67-1,48 (м, 6 H), 1,49-1,28 (м, 23 H), 1,17 (с, 6 H), 1,14 (д, 1 H, J=14,2 Гц).
Пример 2: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
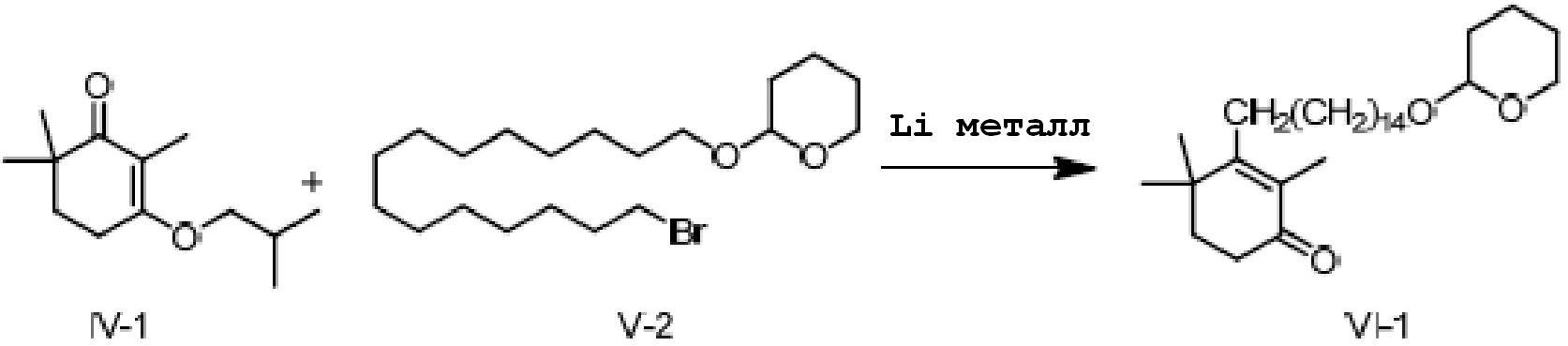
3-изобутокси-2,6,6-триметилциклогекс-2-ен-1-он (5 г, 1 экв.) и 2-(15-бромпентадецил)окситетрагидро-2-гидропиран (12,1 г, 1,3 экв.) растворяют в ТГФ и толуоле, и проводят замену на газообразный азот. Туда добавляют Li (500 мг, 3 экв.) и смесь перемешивают при от 15 до 25°C в течение ночи. На следующий день ТСХ подтверждает, что исходные материалы полностью прореагировали. Реакционную смесь охлаждают до около 20°C, и к реакционной смеси по каплям добавляют насыщенный раствор хлорида аммония (20 мл), затем добавляют воду (20 мл) и перемешивают для разделения смеси на слои. Органический слой промывают 0,5N хлористоводородной кислотой (20 мл) и промывают водой, затем сушат и концентрируют сушкой с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она (неочищенный продукт: 13,5 г, 126%) в виде масла.
Пример 3: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
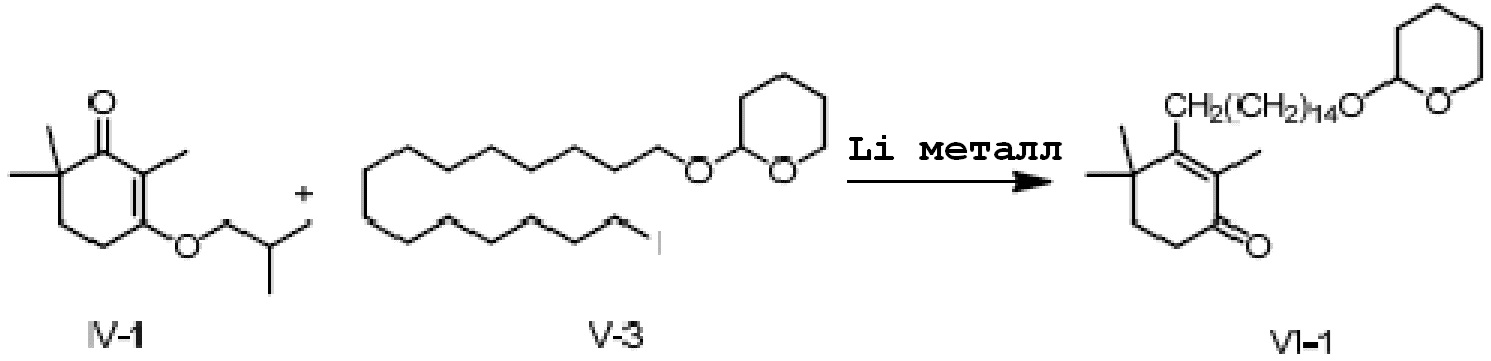
3-изобутокси-2,6,6-триметилциклогекс-2-ен-1-он IV-1 (5 г, 1 экв.) и 2-(15-йодпентадецил)окситетрагидро-2-гидропиран V-3 (13,6 г, 1,3 экв.) растворяют в ТГФ и толуоле и проводят замену на газообразный азот. Туда добавляют Li (500 мг, 3 экв.), и смесь перемешивают при от 15 до 25°C в течение ночи. На следующий день ТСХ подтверждает, что исходные материалы полностью прореагировали. Реакционную смесь охлаждают до около 20°C, и по каплям добавляют насыщенный раствор хлорида аммония (20 мл) к реакционной смеси, затем добавляют воду (20 мл) и перемешивают для разделения смеси на слои. Органический слой промывают 0,5N хлористоводородной кислотой (20 мл) и промывают водой, затем сушат и концентрируют сушкой с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она (13,5 г, 126%) в виде масла.
Пример 4: 3-(15-метоксиметилепеоксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он
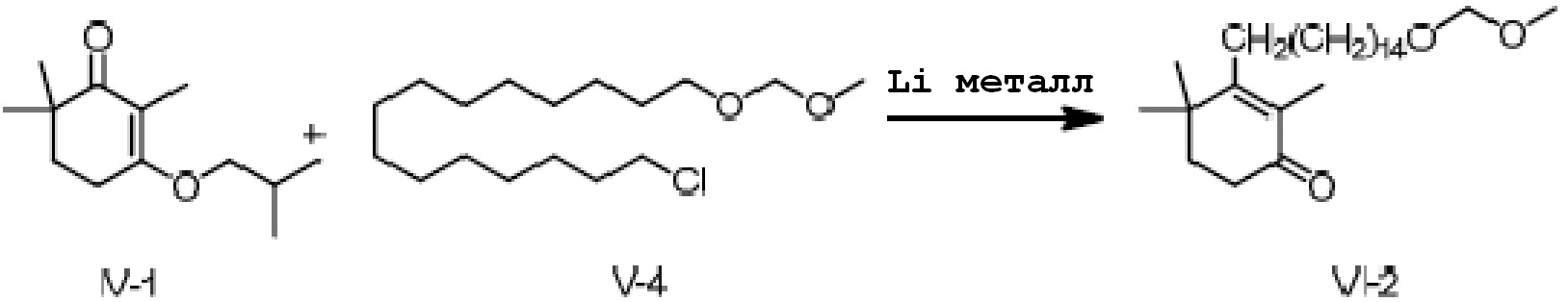
3-изобутокси-2,6,6-триметилциклогекс-2-ен-1-он IV-1 (3 г, 1 экв.) и 1-хлор-15-метоксиметиленоксипентадекан V-4 (4,82 г, 1,1 экв.) добавляют в трехгорлую колбу и три раза проводят замещение газообразным азотом. Туда добавляют тетрагидрофуран и толуол, и три раза проводят замещение газообразным азотом. Туда добавляют Li (297 г, 3 экв.) и три раза проводят замену на газообразный азот. Температуру контролируют на уровне от 25 до 30°C, и реакцию проводят в течение 16 часов. ТСХ подтверждает, что исходные материалы практически полностью прореагировали. Реакционную смесь охлаждают до 10-20°C, и по каплям добавляют насыщенный раствор хлорида аммония (30 мл), затем добавляют воду (30 мл) и перемешивают в течение 5 минут для разделения смеси на слои. Органический слой промывают 0,5M хлористоводородной кислотой (20 мл) и выдерживают для разделения слоев. Продукт промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и сушат концентрацией с получением 3-(15-метоксиметилепеоксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она (неочищенный продукт: 6,8 г, 117%) в виде лаймово-зеленого масла.
1H ЯМР (400 МГц, CDCl3) δ 4,55 (с, 2 H), 3,49 (т, 2 H, J=7,4 Гц), 3,16(с, 3 H), 2,92 (т, 2 H, J=5,9 Гц), 2,30-2,22 (м, 2 H), 1,99 (с, 2 H), 1,63-1,68 (м, 2 H), 1,52-1,42 (м, 2 H), 1,42-1,31 (м, 3 H), 1,34-1,25 (м, 22 H), 1,21 (с, 6 H).
Пример 5: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
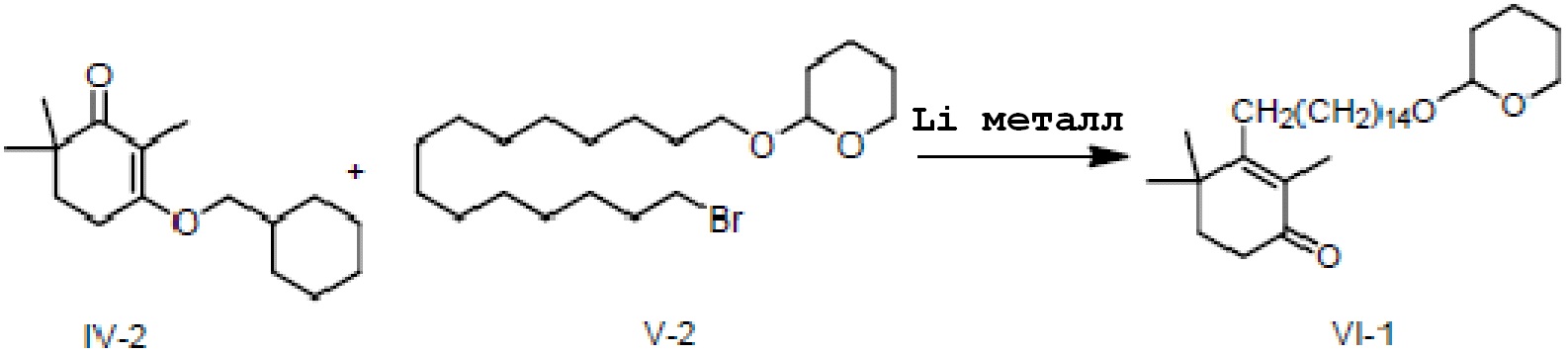
3-циклогексилметокси-2,6,6-триметилциклогекс-2-ен-1-он IV-2 (2 г, 1 экв.) и 2-(15-бромпентадецил)окситетрагидро-2-гидропиран V-2 (3,44 г, 1,1 экв.) растворяют в ТГФ (30 мл) и проводят замену на газообразный азот. Туда добавляют Li (166 мг, 3 экв.), и смесь перемешивают при 20-30°C в течение ночи. На следующий день ТСХ подтверждает, что исходные материалы полностью прореагировали. Насыщенный раствор хлорида аммония (10 мл) и воду (10 мл) добавляют по каплям к реакционной смеси, и смесь перемешивают в течение 10 минут, затем разделяют на слои. ЭА добавляют к органическому слою для разбавления, и продукт промывают водой, промывают насыщенным раствором хлорида натрия и сушат, затем концентрируют сушкой с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она (неочищенный продукт: 4,6 г, 128%) в виде масла.
Пример 6: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
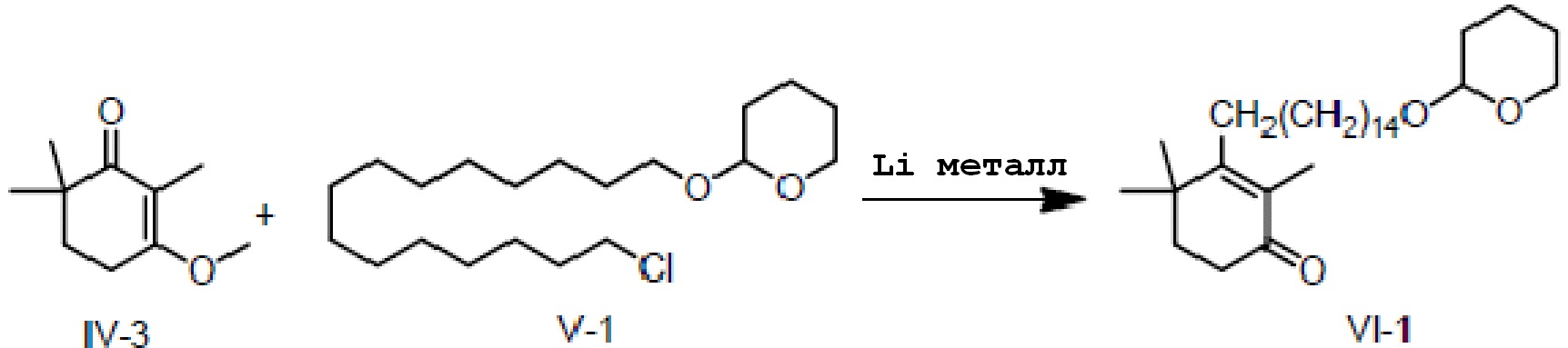
3-Изометокси-2,6,6-триметилциклогекс-2-ен-1-он IV-3 (10 г, 1 экв.) и 2-(15-хлорпентадецил)окситетрагидро-2-гидропиран V-1 (22,7 г, 1,1 экв.) добавляют в трехгорлую колбу, и три раза проводят замену на газообразный азот. Туда добавляют тетрагидрофуран или толуол и проводят замену на газообразный азот три раза. Туда добавляют Li (1,24 г, 3 экв.), и три раза проводят замещение газообразным азотом. Температуру контролируют на уровне 25-30°C, и реакцию проводят в течение 16 часов. ТСХ подтверждает, что исходные материалы практически полностью прореагировали. Реакционную смесь охлаждают до 10-20°C, и насыщенный раствор хлорида аммония (100 мл) добавляют по каплям, затем добавляют воду (100 мл) и перемешивают в течение 5 минут для разделения смеси на слои. Органический слой промывают 0,5M хлористоводородной кислотой (60 мл) и выдерживают для разделения слоев. Продукт промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и сушат концентрацией с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она (неочищенный продукт: 28,2 г, 106%) в виде лаймово-зеленого масла.
Получение соединения III
Пример 7: 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он
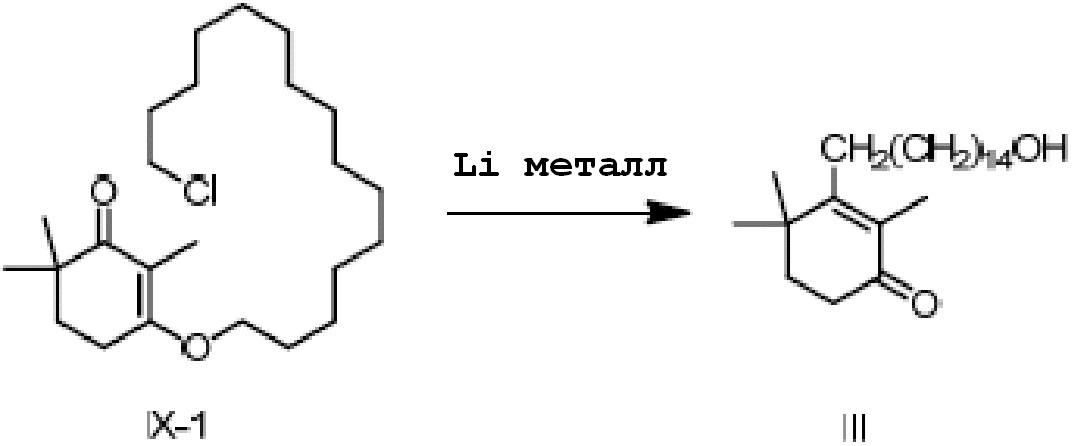
3-(15-хлорпентадецилокси-2,6,6-триметилциклогекс-2-ен-1-он) IX-1 (2 г) добавляют в безводный тетрагидрофуран (20 мл) и защищают газообразным азотом. Туда добавляют литий (104 мг, 3 экв.), и проводят замену на газообразный азот, затем перемешивают при комнатной температуре в течение более 16 часов. ТСХ подтверждает, что исходные материалы полностью прореагировали. Насыщенный раствор хлорида аммония (10 мл) и воду (10 мл) добавляют по капле к реакционной смеси, и смесь перемешивают в течение 10 минут для разделения смеси на слои. ЭА добавляют к органическому слою для разбавления, и продукт промывают водой, промывают насыщенным раствором хлорида натрия и сушат с получением 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она неочищенного продукта в виде масла (1,82 г, 100%). Содержание (метод внешнего стандарта ВЭЖХ) 61,2%.
Пример 8: 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он
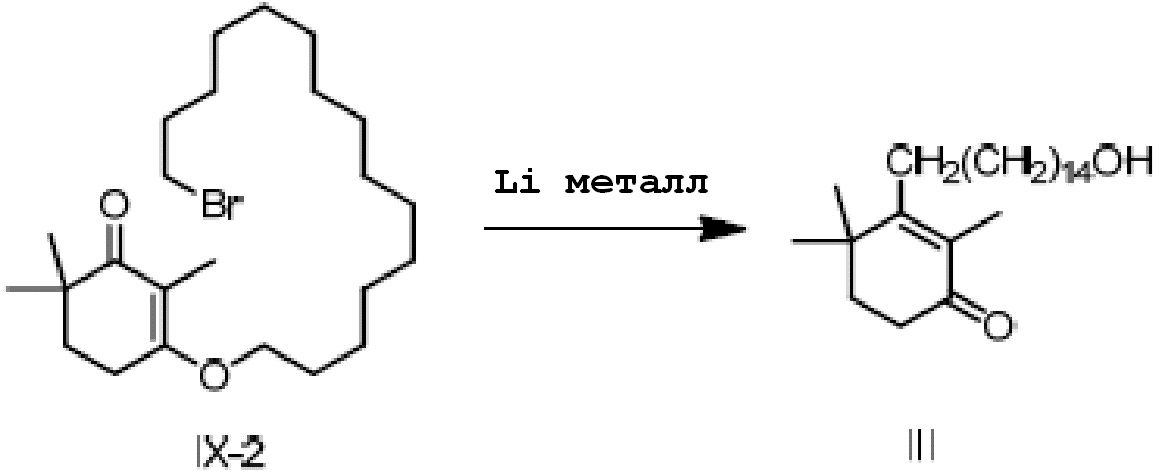
3-(15-бромпентадецилокси)-2,6,6-триметилциклогекс-2-ен-1-он IX-2 (2 г) добавляют к безводному тетрагидрофурану (20 мл) и защищают газообразным азотом. Туда добавляют литий (94 мг, 3 экв.) и проводят замену на газообразный азот, затем перемешивают при комнатной температуре в течение более 16 часов. ТСХ подтверждает, что исходные материалы полностью прореагировали. Насыщенный раствор хлорида аммония (10 мл) и воду (10 мл) добавляют по капле к реакционной смеси, и смесь перемешивают в течение 10 минут для разделения смеси на слои. ЭА добавляют к органическому слою для разбавления, и продукт промывают водой, промывают насыщенным раствором хлорида натрия и сушат с получением 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она неочищенного продукта в виде масла (1,67 г, 102%). Содержание (метод внешнего стандарта ВЭЖХ) 63,3%.
Пример 9: 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он
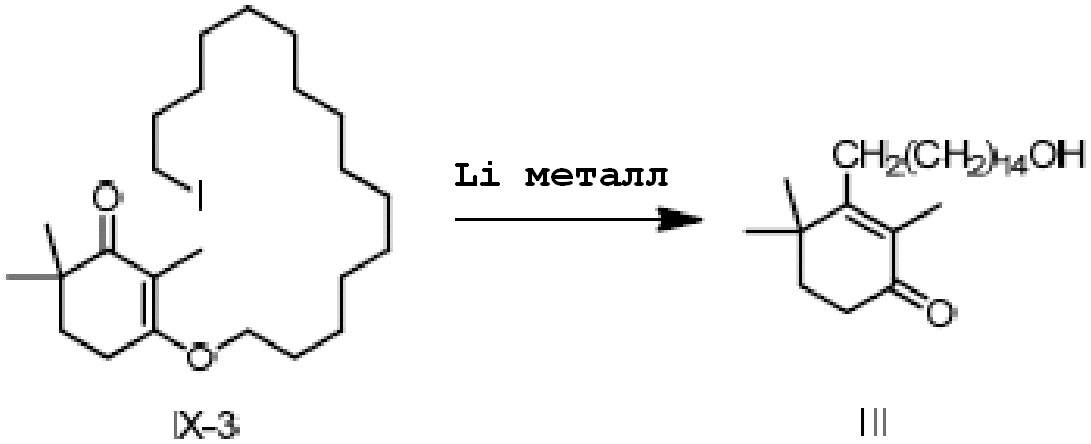
3-(15-йодпентадецилокси)-2,6,6-триметилциклогекс-2-ен-1-он IX-3 (2 г) добавляют к безводному тетрагидрофурану (20 мл) и защищают газообразным азотом. Туда добавляют литий (85 мг, 3 экв.) и проводят замену на газообразный азот, затем перемешивают при комнатной температуре в течение более 16 часов. ТСХ подтверждает, что исходные материалы полностью прореагировали. Насыщенный хлорид аммония (10 мл) и воду (10 мл) добавляют по капле к реакционной смеси, и смесь перемешивают в течение 10 минут для разделения смеси на слои. ЭА добавляют к органическому слою для разбавления, и продукт промывают водой, промывают насыщенным раствором хлорида натрия и сушат с получением 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она неочищенного продукта в виде масла (1,50 г, 101%). Содержание (метод внешнего стандарта ВЭЖХ) 60,5%.
Получение соединения VI
Пример 10: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
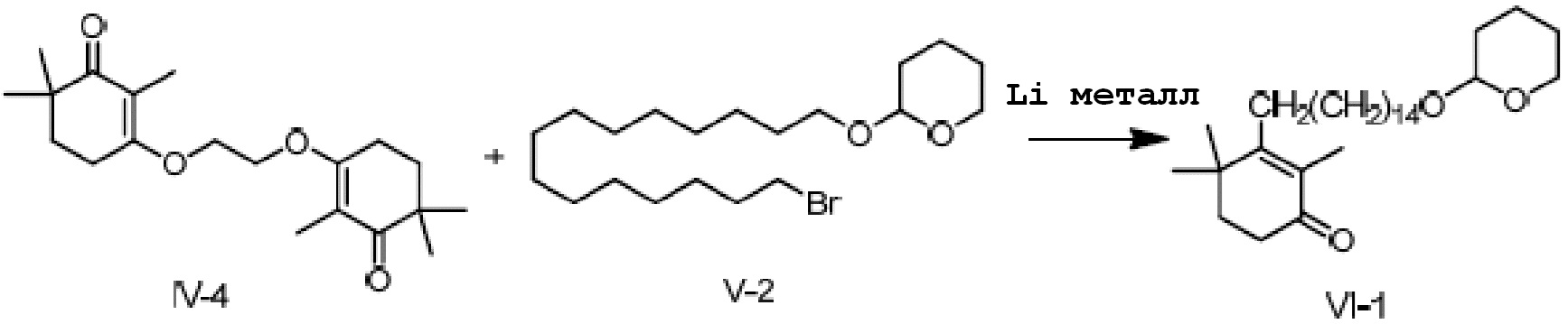
3,3'-(этил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он) IV-3 (5 г, 1 экв.) и 2-(15-бромпентадецил)окситетрагидро-2-гидропиран (12,8 г, 2,2 экв.) растворяют в ТГФ (50 мл), и проводят замену на газообразный азот. Туда добавляют Li (623 мг, 6 экв.) и перемешивают при 25-35°C в течение ночи. На следующий день ТСХ подтверждает окончание реакции. Реакционную смесь охлаждают до 0-10°C, и насыщенный хлорид аммония (20 мл) и воду (10 мл) добавляют по каплям, затем разделяют на слои. Органический слой промывают 0,5N хлористоводородной кислотой (20 мл), промывают насыщенным раствором хлорида натрия и сушат над безводным сульфатом натрия, затем фильтруют и концентрируют сушкой, с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она неочищенного продукта (13,9 г, 104%).
Пример 11: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
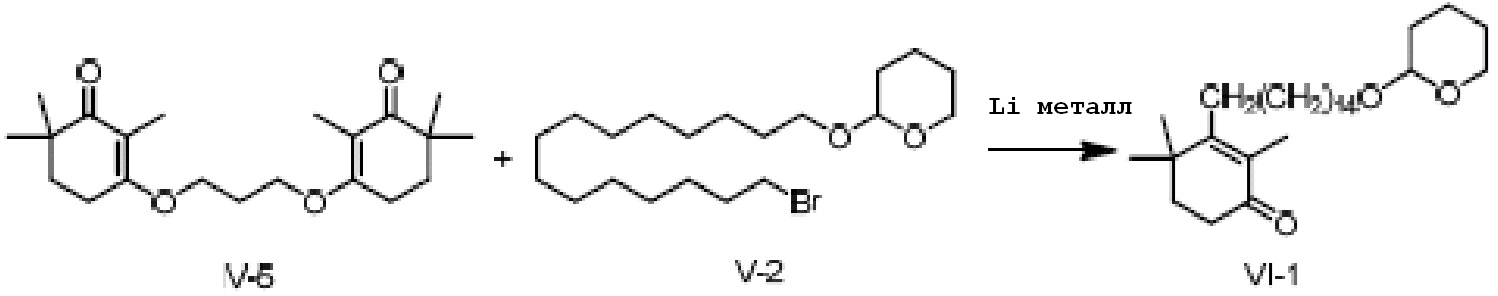
3,3'-(пропил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он) (5 г, 1 экв.) и 2-(15-бромпентадецил)окситетрагидро-2-гидропиран (12,4 г, 2,2 экв.) растворяют в ТГФ (50 мл), и проводят замену на газообразный азот. Туда добавляют Li (597 мг, 6 экв.), и смесь перемешивают при 25-35°C в течение ночи. На следующий день ТСХ подтверждает завершение реакции. Реакционную смесь охлаждают до 0-10°C, и насыщенный хлорид аммония (20 мл) и воду (10 мл) добавляют по каплям для разделения смеси на слои. Органический слой промывают 0,5N хлористоводородной кислотой (20 мл), промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и фильтруют, затем концентрируют сушкой с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она (неочищенный продукт: 7,05 г, 109%).
Пример 12: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
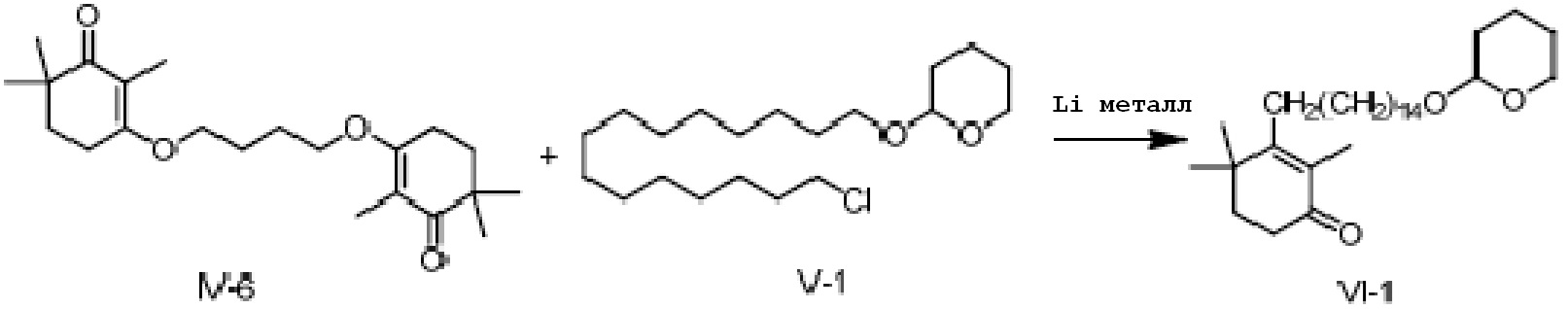
3,3'-(бутил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он) IV-6 (5 г, 1 экв.) и 2-(15-хлорпентадецил)окситетрагидро-2-гидропиран V-1 (10,5 г, 2,2 экв.) растворяют в ТГФ (50 мл), и проводят замену на газообразный азот. Туда добавляют Li (574 мг, 6 экв.), и смесь перемешивают при 25-35°C в течение ночи. На следующий день ТСХ подтверждает завершение реакции, и реакционную смесь охлаждают до 0-10°C. Насыщенный хлорид аммония (20 мл) и воду (10 мл) добавляют по каплям для разделения смеси на слои. Органический слой промывают 0,5N хлористоводородной кислотой (20 мл), промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и фильтруют, затем концентрируют сушкой с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она (неочищенный продукт: 7,1 г, 115%).
Пример 13: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
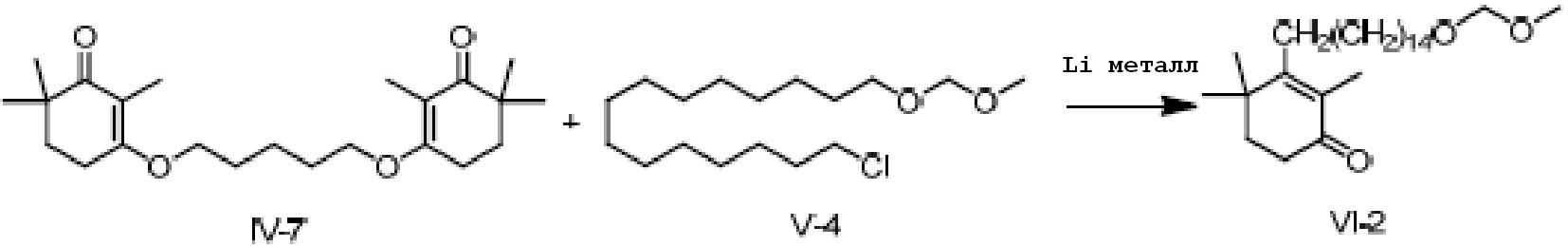
3,3'-(пентил-1,1-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он) IV-7 (5 г, 1 экв.) и 1-хлор-15-метоксиметиленоксипентадекан V-4 (8,97 г, 2,2 экв.) растворяют в ТГФ (50 мл), и проводят замену на газообразный азот. Туда добавляют Li (553 мг, 6 экв.), и смесь перемешивают при 25-35°C в течение ночи. На следующий день ТСХ подтверждает завершение реакции, и реакционную смесь охлаждают до 0-10°C. Насыщенный хлорид аммония (20 мл) и воду (10 мл) добавляют по каплям для разделения смеси на слои. Органический слой промывают 0,5N хлористоводородной кислотой (20 мл), промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и фильтруют, затем концентрируют сушкой с получением 3-(15-метоксиметилепеоксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она (неочищенный продукт: 5,5 г, 101%).
Пример 14: 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он
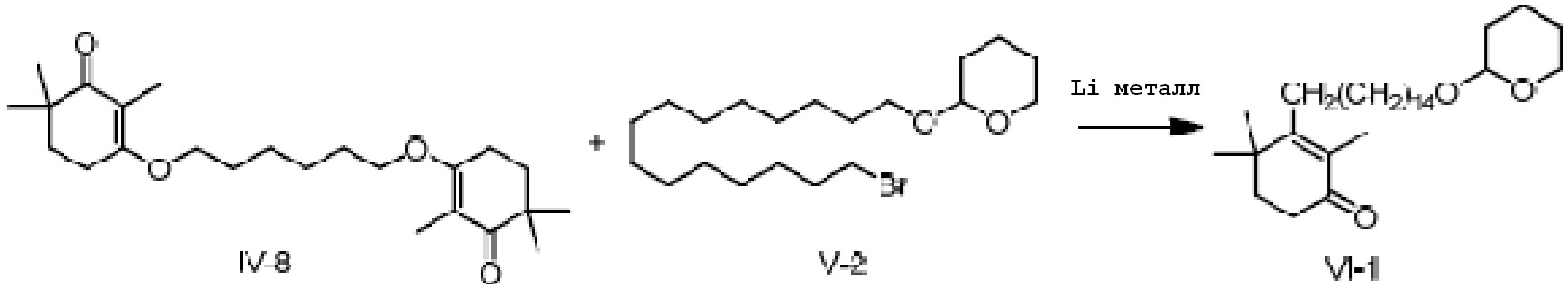
3,3'-(гексил-1,2-диокси)-ди(2,6,6-триметилциклогекс-2-ен-1-он) IV-8 (5 г, 1 экв.) и 2-(15-бромпентадецил)окситетрагидро-2-гидропиран (12,1 г, 2,2 экв.) растворяют в ТГФ (50 мл), и проводят замену на газообразный азот. Туда добавляют Li (530 мг, 6 экв.), и смесь перемешивают при 25-35°C в течение ночи. На следующий день ТСХ подтверждает завершение реакции, и реакционную смесь охлаждают до 0-10°C. Насыщенный хлорид аммония (20 мл) и воду (10 мл) добавляют по каплям для разделения смеси на слои. Органический слой промывают 0,5N хлористоводородной кислотой (20 мл), промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом натрия и фильтруют, затем концентрируют сушкой с получением 2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-она неочищенного продукта (13,6 г, 118%).
Получение соединения III
Пример 15: 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он
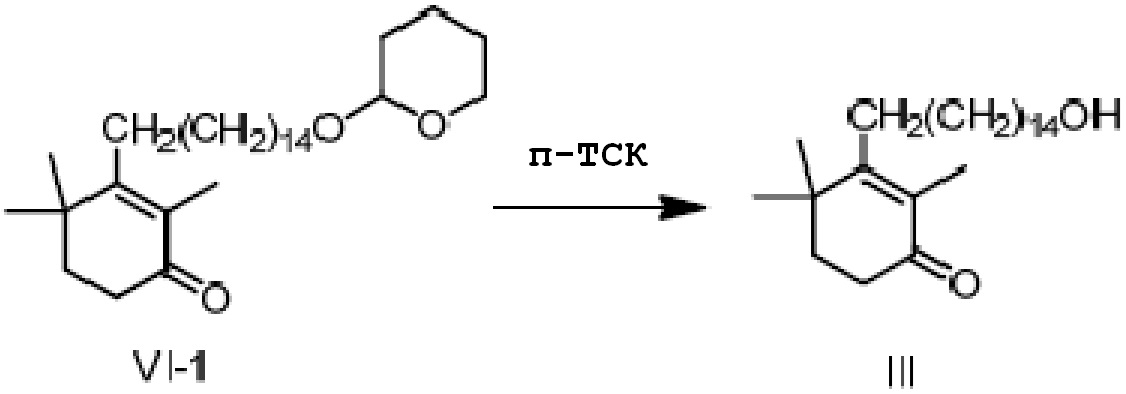
2,4,4-триметил-3-[15-(тетрагидро-2-гидропиранил)-2-оксипентадецил]циклогекс-2-ен-1-он VI-1 (51,7 г, 1 экв.) растворяют в метаноле (200 мл) и туда добавляют п-ТСК·H2O (1,8 г, 0,1 экв.), затем перемешивают в течение 3 часов. Добавляют гидрокарбонат натрия (2 г) и смесь перемешивают в течение 10 минут и сушат концентрацией. Туда добавляют дихлорметан (100 мл) и воду (50 мл) для разделения смеси на фазы. Органический слой промывают насыщенным раствором хлорида натрия (50 мл), сушат над безводным сульфатом натрия и сушат концентрацией с получением 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она (неочищенный продукт: 39,8 г). Содержание (метод внешнего стандарта ВЭЖХ) 70,2%.
Пример 16: 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он
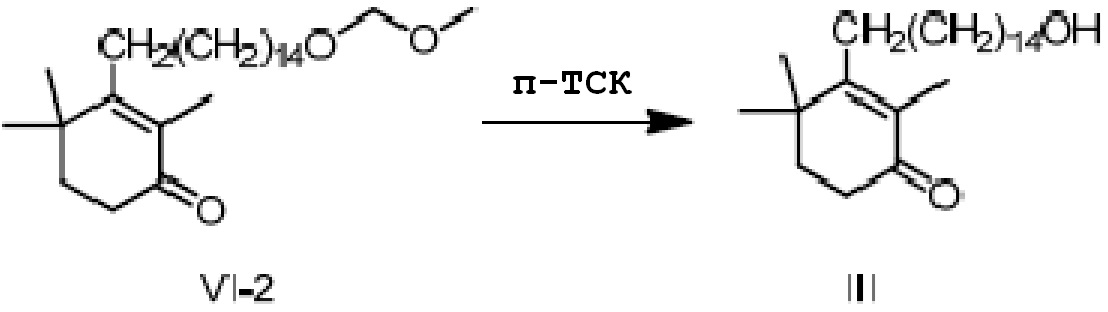
3-(15-метоксиметилепеоксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он VI-2 (50 г, 1 экв.) растворяют в метаноле (200 мл), и туда добавляют п-ТСК·H2O (2,11 г, 0,1 экв.), затем перемешивают в течение 3 часов. Добавляют гидрокарбонат натрия (2 г), и смесь перемешивают в течение 10 минут и сушат концентрацией. Дихлорметан (100 мл) и воду (50 мл) добавляют для разделения смеси на слои. Органический слой промывают насыщенным раствором хлорида натрия (50 мл), сушат над безводным сульфатом натрия и сушат концентрацией с получением 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она (неочищенный продукт: 42,8 г). Содержание (метод внешнего стандарта ВЭЖХ) 69,6%.
Пример 17: 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он (однореакторный метод)
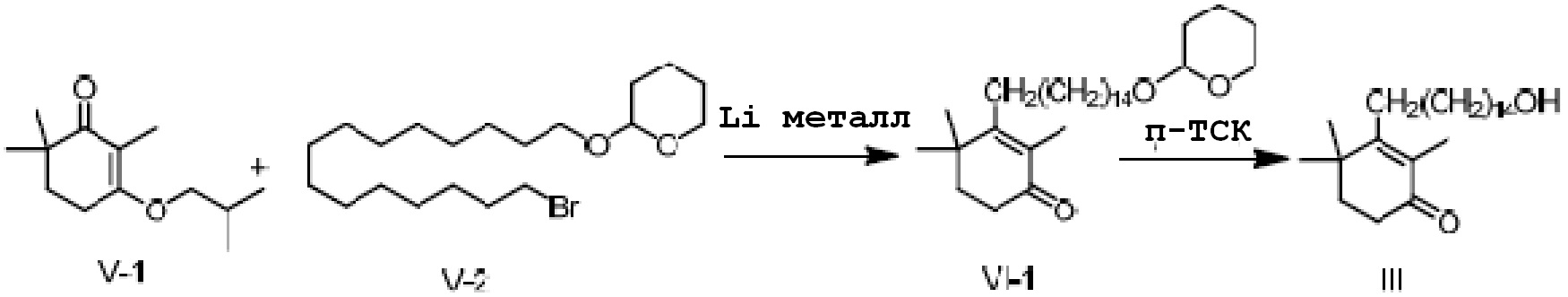
3-изобутокси-2,6,6-триметилциклогекс-2-ен-1-он (50 г, 1 экв.) и 2-(15-бромпентадецил)окситетрагидро-2-гидропиран V-2 (121 г, 1,3 экв.) растворяют в ТГФ, и проводят замену на газообразный азот. Туда добавляют Li (5 г, 3 экв.), и смесь перемешивают при 15-25°C в течение ночи. На следующий день ТСХ подтверждает, что исходные материалы полностью прореагировали. Реакционную смесь охлаждают до около 20°C, и насыщенный раствор хлорида аммония (200 мл) добавляют по каплям к реакционной смеси, затем добавляют воду (200 мл) и перемешивают для разделения смеси на слои. Органический слой промывают 0,5N хлористоводородной кислотой (200 мл) и промывают водой. Туда добавляют метанол (400 мл) и п-ТСК·H2O (4,7 г, 0,1 экв.), и смесь перемешивают в течение 3 часов. Добавляют гидрокарбонат натрия (5,22 г), и смесь перемешивают в течение 10 минут, затем концентрируют сушкой. Туда добавляют дихлорметан (200 мл) и воду (100 мл) для разделения смеси на слои. Органический слой промывают насыщенным раствором хлорида натрия (100 мл), сушат над безводным сульфатом натрия и сушат концентрацией с получением 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она неочищенного продукта (103,9 г, 120%). Содержание (метод внешнего стандарта ВЭЖХ) 68,5%.
Получение соединения II
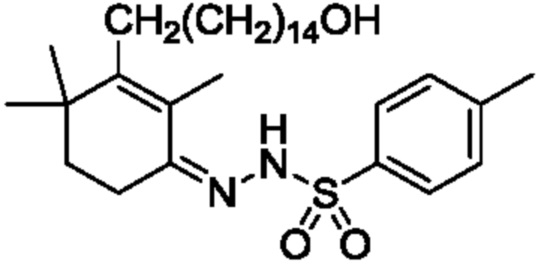
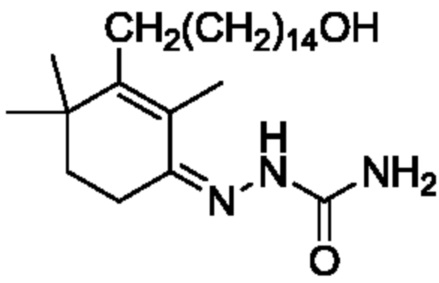
Пример 18: [3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен]аминоформилгидразон
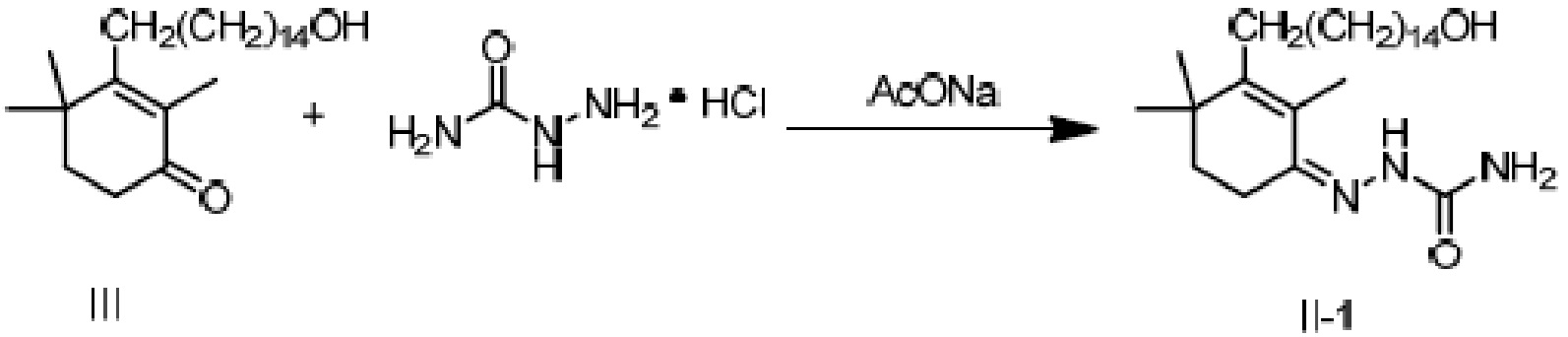
3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он неочищенный продукт III (полученный в примере 17, содержание: 68,5%) (10,4 г, 1 экв.) растворяют в этаноле (70 мл), и туда добавляют воду (35 мл). Добавляют гидрохлорид семикарбазида (3,98 г, 1,5 экв.) и добавляют безводный ацетат натрия (3,9 г, 2 экв.), затем перемешивают до полного растворения. Затем раствор нагревают при кипении с обратным холодильником в течение ночи при перемешивании для осаждения твердого вещества. ТСХ подтверждает, что исходные материалы полностью прореагировали. Растворитель удаляют концентрацией и туда добавляют воду (50 мл), затем растирают при комнатной температуре в течение 30 минут. Продукт фильтруют и промывают водой, затем растирают твердое вещество с ацетонитрилом (50 мл) в течение 30 минут. Затем продукт фильтруют и сушат нагреванием с получением 8,14 г 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-аминоформилгидразона в виде беловатого твердого вещества (рассчитано на основе соединения IV-1, трехстадийный выход: 81,2%). Температура плавления 150-152°C.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,98 (с, 1 H), 6,24 (с, 2 H), 4,32 (с, 1 H), 3,35 (д, 5H, J=13,8 Гц), 2,35 (д, 1 H, J=7,3 Гц), 2,11 (с, 2 H), 1,79 (с, 2 H), 1,51 (с, 1 H), 1,39 (с, 2 H), 1,33 (с, 8 H), 1,25 (с, 16 H), 1,02 (с, 6 H).
|
Пример 19: [3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен]-4-метилбензолсульфонилгидразон
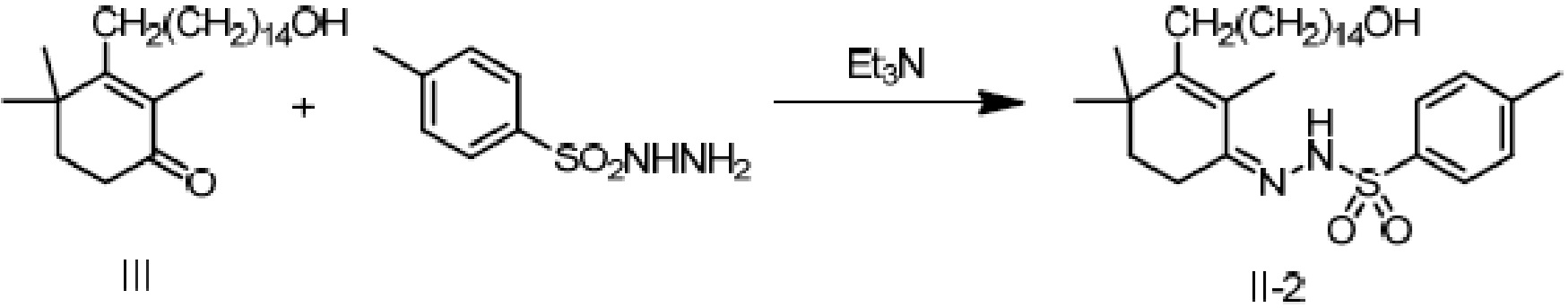
3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он неочищенный продукт III (5 г, 1 экв.) (полученный в примере 15, содержание: 70,2%) растворяют в этаноле (50 мл), и туда добавляют воду (25 мл). Добавляют п-толуолсульфонил гидразон (6,38 г, 2,5 экв.) и добавляют триэтиламин (2,78 г, 2 экв.), затем перемешивают для полного растворения. Раствор нагревают до достижения внутренней температуры 60-70°C и перемешивают в течение ночи для осаждения твердого вещества. ТСХ подтверждает, что исходные материалы полностью прореагировали. Растворитель удаляют концентрацией и туда добавляют воду (50 мл), затем растирают при комнатной температуре в течение 30 минут. Продукт фильтруют и промывают водой, затем растирают твердое вещество с ацетонитрилом (50 мл) в течение 30 минут. Продукт фильтруют и сушат нагреванием с получением 3,56 г 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-аминоформилгидразона в виде беловатого твердого вещества (рассчитано на основе соединения IV-1, выход из трех стадий: 81,2%).
1H ЯМР (400 МГц, CDCl3) δ 7,82-7,80(м, 2 H), 7,33-7,31 (м, 2 H), 4,30(т, 2 H, J=7,0 Гц), 2,42 (с, 2 H), 2,30-2,22 (м, 2 H), 2,11 (т, J=7,1 Гц, 2 H), 1,89 (с, 2 H), 1,49 (дт, J=14,1, 7,0 Гц, 4 H), 1,42-1,22 (м, 25H), 1,02 (с, 6 H).
|
Получение соединения I
Пример 20: 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он
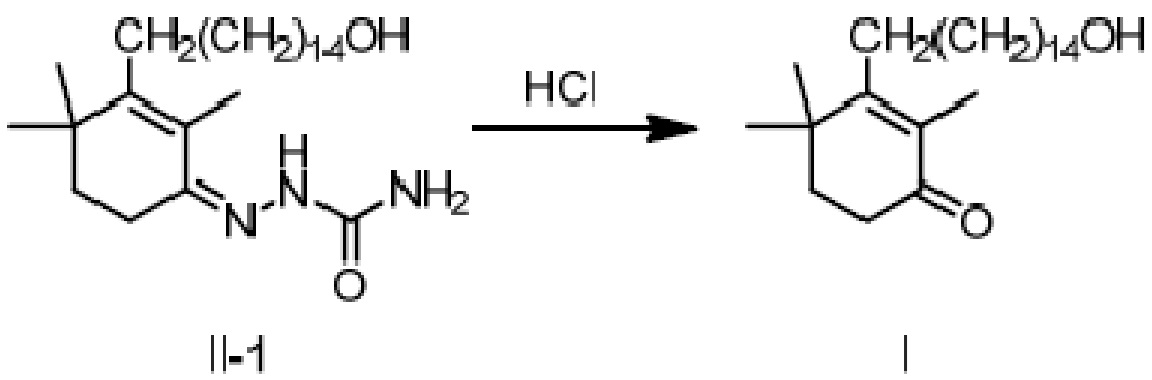
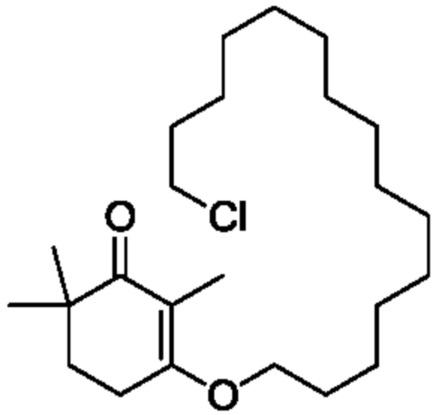
[3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен]-аминоформилгидразон II-1 (100 г) добавляют к ТГФ (200 мл) и 3N хлористоводородной кислоте (500 мл), и защищают газообразным азотом. Раствор нагревают до 55-60°C и перемешивают в течение 2 часов для разделения слоев с получением двух фаз, затем охлаждают до 45°C, разделяя на слои. Водный слой отделяют и удаляют, и органический слой диспергируют в н-гептане (200 мл), затем последовательно промывают насыщенным раствором гидрокарбоната натрия (200 мл) и насыщенным раствором хлорида натрия (100 мл). Продукт сушат над безводным сульфатом натрия, и туда добавляют активированный уголь (5 г), затем перемешивают в течение 20 минут. Смесь фильтруют и сушат концентрацией. н-Гептан (1000 мл) добавляют для растворения, и температуру понижают до 0-10°C при перемешивании, затем перемешивают в течение 2 часов. Продукт фильтруют, и твердое вещество сушат при пониженном давлении с получением 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она (79 г, 91%) в виде беловатого твердого вещества или бледно-желтого масла. Температура плавления 36-38°C.
1H ЯМР (400 МГц, CDCl3): δ 3,61 (т, 2 H, J=6,8 Гц), 2,43 (т, 2 H, J=9,6 Гц), 2,13-2,17 (м, 2 H), 1,77-1,80(м, 3 H), 1,73 (с, 3 H), 1,49-1,55 (м, 2 H), 1,21-1,42 (м, 24 H), 1,13 (с, 6 H). ВЭЖХ: 99,98%, отдельные примеси <0,05% (210 нм, 254 нм).
Пример 21: 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-он
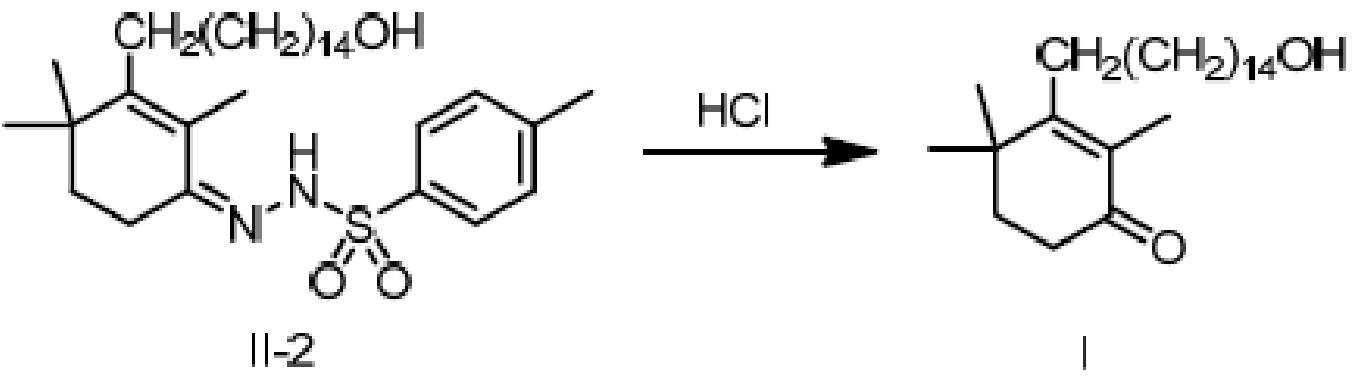
[3-(15-гидроксипентадецил)-2,4,4-триметилциклогексил-2-ен]-метилбензолсульфонилгидразон II-2 (50 г) добавляют к ТГФ (100 мл) и 3N хлористоводородной кислоте (250 мл), и защищают газообразным азотом. Раствор нагревают до 55-60°C и перемешивают в течение 2 часов для разделения на слои с получением двух фаз, затем охлаждают до 45°C, разделяя на слои. Водный слой отделяют и удаляют, и органический слой диспергируют в н-гептане (100 мл), затем последовательно промывают насыщенным гидрокарбонатом натрия (100 мл) и насыщенным раствором хлорида натрия (50 мл). Продукт сушат над безводным сульфатом натрия, и туда добавляют активированный уголь (5 г), затем перемешивают в течение 20 минут. Смесь фильтруют и сушат концентрацией. Добавляют н-гептан (1000 мл) для растворения, и температуру понижают до 0-10°C при перемешивании, затем перемешивают в течение 2 часов. Продукт фильтруют, и твердое вещество сушат при пониженном давлении с получением 3-(15-гидроксипентадецил)-2,4,4-триметилциклогекс-2-ен-1-она (27,4 г, 80%) в виде беловатого твердого вещества или бледного масла.
1H ЯМР (400 МГц, CDCl3): δ 3,61 (т, 2 H, J=6,8 Гц), 2,43 (т, 2 H, J=9,6 Гц), 2,13-2,17 (м, 2 H), 1,77-1,80(м, 3 H), 1,73 (с, 3 H), 1,49-1,55 (м, 2 H), 1,21-1,42 (м, 24 H), 1,13 (с, 6 H). ВЭЖХ: 99,95%, отдельные примеси <0,05% (210 нм, 254 нм).