Результат интеллектуальной деятельности: КАРБОКСАМИДЫ ИЗОПИМАРОВОЙ КИСЛОТЫ, ОБЛАДАЮЩИЕ АНАЛЬГЕТИЧЕСКОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к новым химическим соединениям, конкретно - к N-замещенным (1R,4aR,4bS,7S,10aR)-7-винил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7,8,10,10a-додекагидрофенантрен-1-карбоксамидам (карбоксамидам изопимаровой кислоты) формулы (Iа,б)
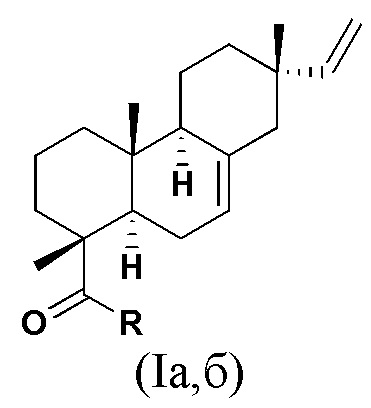
Iа: R = NHCH2CH2OH, Iб: R = (2R)-(гидроксиметил)пирролидин-1-ил,
обладающим анальгетической активностью.
Указанные свойства позволяют предполагать возможность использования соединений в медицине в качестве фармацевтического препарата.
Несмотря на наличие большой группы веществ, обладающих анальгетической активностью, изыскание новых соединений подобного действия не ослабевает. Это связано с рядом побочных эффектов, характерных для известных анальгетиков (психическая зависимость, нарушение аккомодации и т.д.). Анализ литературных данных показывает, что синтез и фармакологические испытания новых химических соединений, отличающихся от существующих особенностью и избирательностью действия, пролонгированностью эффекта и отсутствием побочных эффектов является актуальной задачей.
Изопимаровая кислота (II) - доступный пимарановый дитерпеноид, содержащийся в живице и канифоли хвойных растений родов Pinus, Larix и Picea [Пентегова, В.А.; Дубовенко, Ж.В.; Ралдугин, В.А.; Шмидт, Э.Н. Терпеноиды хвойных растений. Изд-во Наука, Новосибирск, 1987, 36c.; Толстиков, Г.А.; Толстикова, Т.Г.; Шульц, Э.Э.; Толстиков, С.Е.; Хвостов, М.В. Смоляные кислоты хвойных России: Химия, фармакология, отв. ред. Б.А. Трофимов, Научное изд-во ГЕО, Новосибирск, 2011, 395 с.; Jiang, W.; Xiong, J.; Zang, Y.; Li, J.; Osman, E.E.A.; Li, J.-Y.; Zhou, Y.-B.; Li, J.; Hu, J.-F. Phytochemical and biological studies on rare and endangered plants endemic to China. Part XIV. Structurally diverse terpenoids from thetwigs and needles of the endangered plant Picea brachytyla // Phytochemistry - 2020. - V. 169. - N 11216].
Изопимаровая кислота (II) обладает антибактериальными [Cheng, S.S. Chang, S.T. Bioactivity and characterization of exudates from Cryptomeria japonica bark // Wood Sci. Technol. - 2014. - V. 48. - P. 831-840] и противовоспалительными свойствами [Pferschy-Wenzig, E. M.; Kunert, O.; Presser, A.; Bauer, R. In Vitro Anti-inflammatory Activity of Larch (Larix decidua L.) Sawdust // J. Agric. Food Chem. - 2008. - V. 56. - P. 11688-11693], а также рассматривается в качестве перспективного агента для предупреждения и лечения нейрологических заболеваний [Yamamoto, K.; Ueta, Y.; Wang, L.; Yamamoto, R.; Inoue, N.; Inokuchi, K.; Aiba, A.; Yonekura, H.; Kato, N. Suppression of a Neocortical Potassium Channel Activity by Intracellular Amyloid- and Its Rescue with Homer1a // J. Neuroscience - 2011. - V. 31. - P. 11100-11109]. Это соединение характеризуется селективным связыванием с каннабиноидными рецепторами CB2 и опиатными рецепторами μ (mu) типа в экспериментах in silico. Дополнительно, CB2-агонистическая активность подтверждена в экспериментах in vitro [Labib, R.M; Srivedavyasasri R.; Youssef, F.S; Ross, S.A. Secondary metabolites isolated from Pinus roxburghii and interpretation of their cannabinoid and opioid binding properties by virtual screening and in vitro studies // Saudi Pharm. J. - 2018. - V. 26 . - N 3. - P. 437-444]. В работе [Russo, R.; Loverme, J.: Rana, G.L.; D'Agostino, G.; Sasso, O.; Calignano, A.; Piomelli, D. Synergistic antinociception by the cannabinoid receptor agonist anandamide and the PPAR-α receptor agonist GW 7647 // Eur. J. Pharm. - 2007. - V. 566. - P. 117-119] выявлен синергетический эффект агониста каннабиноидных рецепторов анандамида и изопимаровой кислоты (II) in vivo по степени уменьшения болевой реакции, вызванной при воспроизведении формалиновой боли. Таким образом, обозначена анальгетическая активность соединения (II).
Из азиатского вида растения целебник Acanthopanax koreanum выделено изомерное изопимаровой кислоте соединение энт-8(11),15-пимарадиеновая кислота (III), названное акантойной кислотой (Рис. 1). Этот трициклический дитерпеноид проявляет анальгетическую [Kang, H.-S.; Kim, Y.-H.; Lee, C.-S.; Lee, J.-J.; Choi, I.; Pyun, K.-H. Suppression of interleukin-1 and tumor necrosis factor-α production by acanthoic acid, (-)-pimara-9(11),15-dien-19-oic acid, and its antifibrotic effects in vivo // Cell. Immunol. - 1996. - V. 170. - N 2. - P. 212-221], противовоспалительную [Mizokami, S.S.; Hohmann, M.S.N.; Staurengo-Ferrari, L.; Carvalho, T.T.; Zarpelon, A.C.; Possebon, M.I.; de Souza, A.R.; Veneziani, R.C.S.; Arakawa, N.S.; Casagrande, R. Pimaradienoic acid inhibits carrageenan-induced inflammatory leukocyte recruitment and edema in mice: inhibition of oxidative stress, nitric oxide and cytokine production // PLoS One - 2016. - V. 11, N 2. - e0149656/1-e0149656/17] и противоопухолевую активность [Kim, K.N.; Ham, Y.M.; Moon, J.Y.; Kim, M.J.; Jung, Y.H.; Jeon, Y.J.; Lee, N.H.; Kang, N.; Yang, H.M.; Kim, D.; Hyun, C.-G. Acanthoic acid induces cell apoptosis through activation of the p38 MAPK pathway in HL-60 human promyelocytic leukaemia // Food Chemistry. - 2012. - V. 135. - N 3. - P. 2112-2117]. Синтезированы амиды этого соединения (IV, (R = морфолино, пиперидино, циклогексиламино, NH(CH2)nCO2H), которые запатентованы в качестве модуляторов интерлейкина IL-1 и модуляторов некроза опухоли TNF-α - важных воспалительных цитокинов, контролирующих различные функции в клетке [Palladino, M.A.; Theodorakis, E.A.; Macherla, V.R.R.; Chao, T.-H; Suh, Y.G. Synthesis of interleukin-1 and tumor necrosis factor-α modulators for therapeutic use. Патент WO 2007015757 A2 20070208]. Исследовано влияние производных акантойной кислоты, модифицированных по положению С-4 (IV), на системное воспаление. Показано, что дитерпеновые производные типа IV ингибировали высвобождение TNF-a без заметного влияния на апоптоз в нормальных лимфоидных клетках [Chao, T.H.; Lam, T.; Vong, B.G.;  , P.G.; Hortelano, S.; Chowdhury, C.; Bahjat, F.R.; Lloyd, G.K.; Moldawer, L.L.;
, P.G.; Hortelano, S.; Chowdhury, C.; Bahjat, F.R.; Lloyd, G.K.; Moldawer, L.L.;  , L. A new family of synthetic diterpenes that regulates cytokine synthesis by inhibiting IkappaB alpha phosphorylation. ChemBioChem - 2005. - V. 6. - P. 133-144], оказывали сильную и селективную активацию изоферментов p110g and p110d PI3K в макрофагах. Введение некоторых синтетических производных in vivo подтвердило низкую токсичность этих соединений и перспективы использования в качестве противовоспалительных а также анальгетических агентов [Traves, P.G.; Pimentel-Santillana, M.; Rico, D., Rodriguez, N.; Miethke, T.; Castrillo, A.; Theodorakis, E. A.; Martín-Sanz, B.; Palladino, M.A., Bosca, L. Anti-inflammatory Actions of Acanthoic Acid-Related Diterpenes Involve Activation of the PI3K p110g/d Subunits and Inhibition of NF-kB // Chem. Biol. - 2014. - V. 21. - P. 955-966].
, L. A new family of synthetic diterpenes that regulates cytokine synthesis by inhibiting IkappaB alpha phosphorylation. ChemBioChem - 2005. - V. 6. - P. 133-144], оказывали сильную и селективную активацию изоферментов p110g and p110d PI3K в макрофагах. Введение некоторых синтетических производных in vivo подтвердило низкую токсичность этих соединений и перспективы использования в качестве противовоспалительных а также анальгетических агентов [Traves, P.G.; Pimentel-Santillana, M.; Rico, D., Rodriguez, N.; Miethke, T.; Castrillo, A.; Theodorakis, E. A.; Martín-Sanz, B.; Palladino, M.A., Bosca, L. Anti-inflammatory Actions of Acanthoic Acid-Related Diterpenes Involve Activation of the PI3K p110g/d Subunits and Inhibition of NF-kB // Chem. Biol. - 2014. - V. 21. - P. 955-966].
Исходное соединение (III) является не доступным во флоре России.
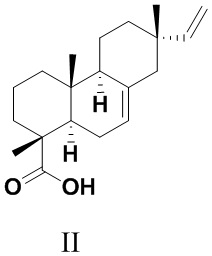
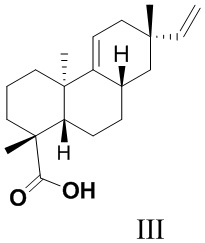
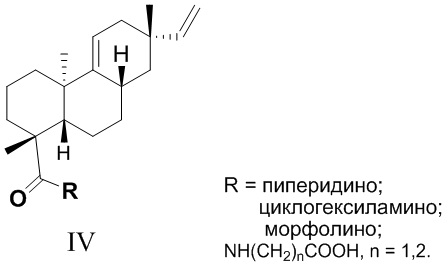
Рис. 1. Структуры трициклических дитерпеноидов
Задачей предлагаемого изобретения является разработка новых анальгетических агентов на основе доступных соединений: растительного дитерпеноида пимаранового ряда изопимаровой кислоты (II) и аминов [этаноламина, (2R)-(гидроксиметил)пирролидина).
Поставленная задача решается новыми химическими соединениями - карбоксамидами изопимаровой кислоты формулы (Iа,б), проявляющими выраженную анальгетическую активность
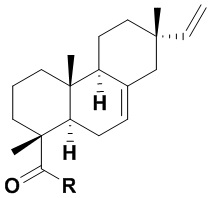
(Iа,б)
Iа: R = NHCH2CH2OH, Iб: R = (2R)-(гидроксиметил)пирролидин-1-ил.
Аналогом по структуре заявляемого соединения является изопимаровая кислота (II). Это соединение также служило исходным веществом для получения анальгетических агентов (Iа,б). Соединение (II) выделяли из живицы Pinus sibirica R. Mayr. перекристаллизацией солей смоляных кислот, образующихся при обработке живицы 2-амино-2-метил-1-пропанолом. Выход кристаллического соединения (II) в пересчете на массу живицы P. sibirica составил 6.3% [Харитонов, Ю.В.: Шакиров, М.М.; Шульц, Э.Э. Синтетические трансформации высших терпеноидов. Cообщение 33. Получение 15,16-дигидроизопимаровой кислоты и метилдигидроизопимарата и их превращения. Химия природных соединений. 2013. № 6. С. 916-923]. Таким образом, изопимаровая кислота (II) является весьма доступным соединением для получения на его основе различных фармакологически ценных производных.
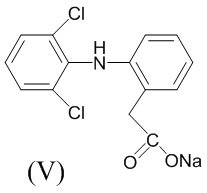
Аналогом по свойствам заявляемого соединения является нестероидный противовоспалительный препарат диклофенак-натрий (ортофен, вольтарен) (V). Основным недостатком указанного препарата является его ульцерогенный эффект [Машковский, М.Д. Лекарства ХХ века. М.: Новая волна. 1998. 319 с.].
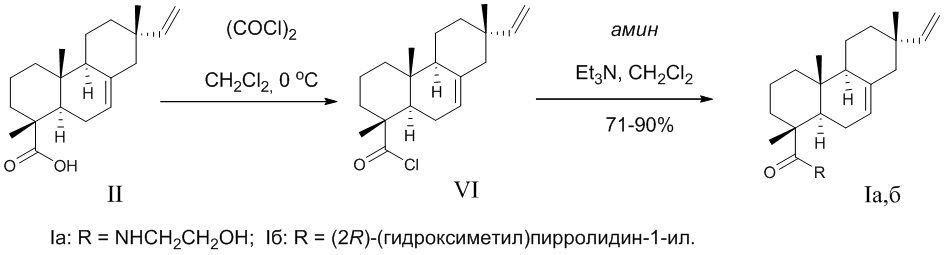
Способ получения соединений (Iа,б) из изопимаровой кислоты (II) реализуется по приведенной схеме 1. Обработка изопимаровой кислоты (II) хлористым оксалилом (1.2 экв.) в хлористом метилене по ранее предложенной методике [Тимошенко, M.A.; Аюшеев, A.B.; Харитонов, Ю.В.; Шакиров, M.M.; Шульц, Э.Э. Синтетические трансформации высших терпеноидов XXXIV. Получение производных изопимаровой кислоты по карбоксильной функции // Хим. природ. соедин. - 2014. - № 4. - С. 583-589] приводит к образованию хлорангидрида изопимаровой кислоты (VI) c количественным выходом. При взаимодействии хлорангидрида (VI) с аминами [этаноламин, (2R)-(гидроксиметил)пирролидин] образуются N-(2-гидроксиэтил)-, N-морфолинил- или N-[(2S)-(гидроксиметил)пирролидин-1-ил-] (1R,4aR,4bS,7S,10aR)-7-винил-1,4a,7-триметил-1,2,3,4,4a, 4b,5,6,7,8,10,10a-додекагидрофенантрен-1-карбоксамиды (Ia,б) (выход 71 или 87% соответственно) в виде белых кристаллических соединений.
Достоинством изобретения является способ получения новых соединений (I,б) путем химической модификации доступного растительного дитерпеноида изопимаровой кислоты (II) и их анальгетическая активность. Физико-химические константы новых, впервые полученных соединений (Iа, Iб), приведены в примерах 1, 2.
Биологическая активность соединений (Iа,б) изучалась путем определения токсичности, и анальгетической активности в тестах “уксусные корчи” и “горячая пластина”. Статистическую обработку данных проводили с помощью пакета программ “Statistika 8.0”, уровень достоверности определяли по t-критерию Стьюдента.
Острую токсичность определяли на аутбредных мышах массой 22-28 г при однократном внутрижелудочном способе введения. Параметры токсичности рассчитывали по методу Кербера. Установлено, что LD50 соединений (Iа,б) меньше 1250 мг/кг. Изучаемые вещества (Iа,б) относятся к 3-ему классу умеренно токсичных соединений. LD50 препарата сравнения Диклофенак-натрия (V) составляет 350 мг/кг [Чернух, А.М. Воспаление, Медицина, М., 1979, 448 с.], то есть синтезированные соединения в 3 раза менее токсичны, чем препарат сравнения.
Результаты изучения анальгетической активности соединений (Iа,б) на модели висцеральной боли “уксусные корчи” путем однократного введения в дозах 5, 25 и 50 мг/кг приведены в таблице 1. Эксперимент проводили на беспородных мышах массой 22-25 г. После карантина животные были рандомизированы по весу и разделены на группы по 8 мышей одного пола в каждой. “Уксусные корчи” воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты по 0.1 мл на 10 г веса животного. Оценка активности осуществлялась по количеству корчей в течение 3 мин, по прошествию 5 мин после введения раствора уксусной кислоты. Обезболивающее действие соединений сравнивали с активностью исходного соединения изопимаровой кислоты (II) и активностью препарата сравнения (V), введенного в эффективной дозе 10 мг/кг. Из данных таблицы 1 видно, что соединения (Iа,б) и (II) введенные в дозе 50 мг/кг, достоверно уменьшают количество корчей, вызванных введением уксусной кислоты. Наиболее активно соединение (Iб), которое снижает более чем в 2 раза (на 58%) выраженность болевой реакции по сравнению с контрольной группой. Изопимаровая кислота (II) снижает болевую реакцию на 31%; ее эффект в два раза менее выражен, чем у препарата Диклофенак-натрия, введенного в дозе 10 мг/кг.
Введение соединений (Ia,б) в дозе 25 мг/кг достоверно снижало болевую реакцию на 56 и 48% соответственно.
Введение соединений (Iа,б) в дозе 5 мг/кг обеспечивало достоверный обезболивающий эффект на 30-31%. Таким образом, соединения (Iа,б) обладают выраженной анальгетической активностью в тесте висцеральной боли (химического раздражения).
Таблица 1.
Влияние соединений (Iа,б) на уровень болевой чувствительности в тесте
“уксусные корчи”
|
Примечание: *P ≤ 0.05 относительно контроля.
Нами также изучена анальгетическая активность соединений (Iа,б) и (II) на модели термического раздражения. Эксперимент проводили на беспородных мышах массой 22-25 г. После карантина, животные были рандомизированы по весу и разделены на группы по 8 мышей одного пола в каждой. Животных помещали на нагретую до 54°С металлическую пластину и регистрировали латентное время болевой реакции, то есть, время, проведенное животным на пластине до облизывания задней лапы или подпрыгивания. Для соединений, достоверно увеличивающих время нахождения на горячей пластине, определяли процент анальгетического эффекта по формуле:
ПАЭ = (t-tконтроль)/tконтроль×100 (где t - время нахождения на пластине животных, получавших агент; tконтроль - время нахождение на пластине животных контрольной группы).
Результаты представлены в таблице 2. Как видно, при введении в дозе 50 мг/кг соединения (Ia,б) обладали достоверным анальгетическим эффектом и увеличивали латентное время болевой реакции на 40-57%. Соединение (Iб) на 50% увеличивало время нахождения животного на горячей пластине пластине при его введении в дозе 25 мг/кг. Эффект этого соединения превышал эффект препарата Диклофенак натрия. Указанное соединение (Iб) также обладало достоверной анальгетической активностью в дозе 5 мг/кг. Изопимаровая кислота (II) не обладала анальгетической активностью на модели термического раздражения в тесте “горячая пластина”.
Таблица 2.
Влияние соединений (Iа,б), (II) на уровень болевой чувствительности в тесте
“горячая пластина”
|
Примечание: *P ≤ 0.05 относительно контроля.
Таким образом, соединения (Ia,б) достоверно снижают развитие болевого эффекта в дозах 50, 25 и 5 мг/кг на модели химического и термического раздражения.
Изобретение иллюстрируется следующими примерами.
Пример 1. Синтез (1R,4aR,4bS,7S,10aR)-N-(2-Гидроксиэтил)-7-винил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7,8,10,10a-додекагидрофенантрен-1-карбоксамида (Ia)
К раствору 0.50 г (1.66 ммоль) изопимаровой кислоты (II) в 10 мл безводного хлористого метилена в токе аргона при охлаждении льдом и интенсивном перемешивании в течение 15 мин добавили 0.17 мл (1.99 ммоль) хлористого оксалила в 10 мл хлористого метилена. Температуру реакционной смеси подняли до комнатной и перемешивали 5 ч. Растворитель отогнали в вакууме, к остатку добавили 10 мл хлористого метилена и снова удалили растворитель. Эту процедуру повторили 4 раза, получили 0.50 г хлорангидрида изопимаровой кислоты (VI) в виде желтого маслообразного вещества. К раствору 0.12 г (1.87 ммоль) этаноламина и 0.43 мл (3.12 ммоль) триэтиламина в 15 мл безводного хлористого метилена постепенно добавили 0.50 г (1.56 ммоль) соединения (VI). Реакционную смесь перемешивали при комнатной температуре 24 ч. Растворитель удалили в вакууме, остаток хроматографировали на колонке с силикагелем (элюент - хлороформ), выделили 0.38 г (71%) соединения (Iа). Т.пл. 104-106°C (из СHCl3). Rf = 0.58 CHCl3:MeOH 50:1. 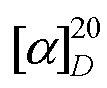 - 16.0 (c 0.1, CHCl3). Спектр 1H ЯМР (400 MГц, CDCl3, δ, м.д.): 0.82 (с, 3H, СН3-17); 0.87 (с, 3H, СН3-20); 1.12 (м, 1H, H-1); 1.25 (с, 3H, СН3-19); 1.32 (м, 2H, H-11,12); 1.44 (м, J = 2.5 Гц, 1H, H-12); 1.45-1.54 (м, 4H, H-11,2,3,2); 1.59 (с, 1H, H-9); 1.72 (м, 2H, H-6,3); 1.79 (м, 1H, H-1); 1.85 (д, J = 2.2 Гц, 1H, H-5); 1.87 (м, 2H, H-14,14); 1.89 (м, 1H, H-6); 3.38 (м, J = 10.2, 5.1, 4.0 Гц, 2H, 2Н-1'); 3.65 (д, J = 4.9 Гц, 1H, Н-2'); 3.67 (д, J = 4.9 Гц, 1H, Н-2'); 4.83 (дд, J = 10.7, 1.3 Гц, 1H, Н-16); 4.90 (дд, J = 17.5, 1.3 Гц, 1H, Н-16); 5.25 (д, J = 5.0 Гц, 1H, Н-7); 5.76 (дд, J = 17.5, 10.7 Гц, 1H, Н-15); 6.31 (т, J = 5.0 Гц, NH). Спектр 13C ЯМР (125 МГц, CDCl3) δС: 15.19 (C20H3); 17.26 (C19H3); 18.02 (С-2); 19.85 (С-11); 21.39 (C17H3); 24.74 (C-6); 35.02 (С-10); 35.96 (С-12); 36.63 (С-13); 37.17 (С-3); 38.67 (С-1); 42.72 (С-1'); 45.60 (C-5); 45.94 (C-14); 46.25 (C-4); 51.93 (C-9); 62.62 (С-2'); 109.12 (C-16); 120.73 (C-7); 135.57 (С-8); 150.16 (С-15); 180.11 (C=O). ИК-спектр (ν, см-1): 653, 754, 916, 998, 1029, 1076, 1274, 1363, 1386, 1442, 1467, 1521, 1616 (C=O), 3367 (OH). УФ-спектр (λmax, нм) (lgε): 241 (2.92), 233 (2.92). Масс-спектр, m/z (Iотн, %): 345 (100), 330 (7), 257 (13), 256 (9), 241 (15), 159 (5), 145 (5), 130 (9), 107 (7), 88 (14), 81 (18), 70 (17), 55 (9), 30 (4). Найдено: 345.2660 [M]. C22H35NO2. Вычислено: 345.2662.
- 16.0 (c 0.1, CHCl3). Спектр 1H ЯМР (400 MГц, CDCl3, δ, м.д.): 0.82 (с, 3H, СН3-17); 0.87 (с, 3H, СН3-20); 1.12 (м, 1H, H-1); 1.25 (с, 3H, СН3-19); 1.32 (м, 2H, H-11,12); 1.44 (м, J = 2.5 Гц, 1H, H-12); 1.45-1.54 (м, 4H, H-11,2,3,2); 1.59 (с, 1H, H-9); 1.72 (м, 2H, H-6,3); 1.79 (м, 1H, H-1); 1.85 (д, J = 2.2 Гц, 1H, H-5); 1.87 (м, 2H, H-14,14); 1.89 (м, 1H, H-6); 3.38 (м, J = 10.2, 5.1, 4.0 Гц, 2H, 2Н-1'); 3.65 (д, J = 4.9 Гц, 1H, Н-2'); 3.67 (д, J = 4.9 Гц, 1H, Н-2'); 4.83 (дд, J = 10.7, 1.3 Гц, 1H, Н-16); 4.90 (дд, J = 17.5, 1.3 Гц, 1H, Н-16); 5.25 (д, J = 5.0 Гц, 1H, Н-7); 5.76 (дд, J = 17.5, 10.7 Гц, 1H, Н-15); 6.31 (т, J = 5.0 Гц, NH). Спектр 13C ЯМР (125 МГц, CDCl3) δС: 15.19 (C20H3); 17.26 (C19H3); 18.02 (С-2); 19.85 (С-11); 21.39 (C17H3); 24.74 (C-6); 35.02 (С-10); 35.96 (С-12); 36.63 (С-13); 37.17 (С-3); 38.67 (С-1); 42.72 (С-1'); 45.60 (C-5); 45.94 (C-14); 46.25 (C-4); 51.93 (C-9); 62.62 (С-2'); 109.12 (C-16); 120.73 (C-7); 135.57 (С-8); 150.16 (С-15); 180.11 (C=O). ИК-спектр (ν, см-1): 653, 754, 916, 998, 1029, 1076, 1274, 1363, 1386, 1442, 1467, 1521, 1616 (C=O), 3367 (OH). УФ-спектр (λmax, нм) (lgε): 241 (2.92), 233 (2.92). Масс-спектр, m/z (Iотн, %): 345 (100), 330 (7), 257 (13), 256 (9), 241 (15), 159 (5), 145 (5), 130 (9), 107 (7), 88 (14), 81 (18), 70 (17), 55 (9), 30 (4). Найдено: 345.2660 [M]. C22H35NO2. Вычислено: 345.2662.
Пример 2. Синтез [(S)-2-(Гидроксиметил)пирролидин-1-ил]-[(1R,4aR,4bS,7S,10aR)-7-винил 1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7,8,10,10a-додекагидрофенантрен-1-ил)метанон (Iб)
К раствору 0.50 г (1.66 ммоль) изопимаровой кислоты (II) в 10 мл безводного хлористого метилена в токе аргона, при охлаждении льдом и интенсивном перемешивании в течение 15 мин добавили 0.17 мл (1.99 ммоль) хлористого оксалила в 10 мл хлористого метилена. Температуру реакционной смеси подняли до комнатной, перемешивали 5 ч. Растворитель отогнали в вакууме, к остатку добавили 10 мл хлористого метилена и снова удалили растворитель. Эту процедуру повторили 4 раза, в остатке получили 0.5 г хлорангидрида изопимаровой кислоты (VI), в виде желтого маслообразного вещества. К раствору 0.19 г (1.87 ммоль) 2(R)-(гидроксиметил)пирролидина и 0.43 мл (3.12 ммоль) триэтиламина в 15 мл безводного хлористого метилена постепенно добавили 0.50 г (1.56 ммоль) хлорангидрида (VI). Реакционную смесь перемешивали при комнатной температуре 24 ч. Растворитель удалили в вакууме, остаток хроматографировали на колонке с силикагелем (элюент - хлороформ), выделили 0.52 г (87%) соединения (Iб). Т.пл. 122-124°C (из СHCl3), Rf = 0.55, CHCl3:MeOH 50:1. 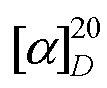 - 27.2 (c 0.4, CHCl3). Спектр 1H ЯМР (300 MГц, CDCl3, δ, м.д.): 0.83 (с, 3H, СН3-17); 0.90 (с, 3H, СН3-20); 1.10 (м, 1H, H-1); 1.32 (с, 3H, СН3-19); 1.37-1.46 (м, 3H, H-11,12,12); 1.52-1.56 (м, 5H, H-11,2,3,2); 1.61 (с, 1H, H-9); 1.73 (м, 2H, H-6,3); 1.80 (с, 1H, H-1); 1.84, 1.88, 1.92, 2.02 (все м, 8H, H-5,14,14,6,3',3',4',4'); 3.42 (ддд, J = 10.6, 8.8, 6.3 Гц, 1H, СH2OH); 3.52 (дд, J = 11.3, 7.6 Гц, 1H, Н-5'); 3.59 (дд, J = 11.3, 2.7 Гц, 1H, Н-5'); 3.97 (ддд, J = 14.7, 10.6, 6.6, 4.2 Гц, 1H, СH2OH); 4.37 (ддд, J = 14.7, 7.4, 2.7 Гц, 1H, Н-2'); 4.82 (дд, J = 10.7, 1.2 Гц, 1H, Н-16); 4.86 (д, J = 17.6 Гц, 1H, Н-16); 5.28 (д, J = 5.3 Гц, 1H, Н-7); 5.76 (дд, J = 17.6, 10.7 Гц, 1H, Н-15). Спектр 13C ЯМР (100 MГц, CDCl3) δС: 15.13 (C20H3); 18.02 (С-2); 19.54 (C19H3); 19.87 (С-11); 21.32 (C17H3); 25.19 (С-6); 25.49 (C-3'); 27.08 (C-4'); 35.12 (С-10); 35.37 (С-12); 35.89 (С-13); 36.65 (С-3); 38.33 (С-1); 45.34 (C-5); 45.92 (C-14); 47.03 (C-4); 49.09 (C-5'); 51.98 (C-9); 62.63 (C-2'); 68.14 (CН2OH); 109.12 (C-16); 120.06 (C-7); 135.34 (С-8); 150.13 (С-15); 179.89 (C=O). ИК-спектр (ν, см-1): 908, 989, 1062, 1093, 1149, 1172, 1238, 1324, 1361, 1380, 1400, 1444, 1457, 1575, 1612, 1637, 3305 (OH). УФ-спектр (λmax, нм) (lgε): 249 (2.82), 242 (3.02). Масс-спектр, m/z (Iотн, %): 385 (100), 257 (41), 241 (34), 185 (12), 145 (10), 133 (10), 119 (16), 105 (17), 91 (12), 81 (41), 70 (71), 55 (16), 41 (10). Найдено: 385.2977 [M]. C25H39NO2. Вычислено: 385.2975.
- 27.2 (c 0.4, CHCl3). Спектр 1H ЯМР (300 MГц, CDCl3, δ, м.д.): 0.83 (с, 3H, СН3-17); 0.90 (с, 3H, СН3-20); 1.10 (м, 1H, H-1); 1.32 (с, 3H, СН3-19); 1.37-1.46 (м, 3H, H-11,12,12); 1.52-1.56 (м, 5H, H-11,2,3,2); 1.61 (с, 1H, H-9); 1.73 (м, 2H, H-6,3); 1.80 (с, 1H, H-1); 1.84, 1.88, 1.92, 2.02 (все м, 8H, H-5,14,14,6,3',3',4',4'); 3.42 (ддд, J = 10.6, 8.8, 6.3 Гц, 1H, СH2OH); 3.52 (дд, J = 11.3, 7.6 Гц, 1H, Н-5'); 3.59 (дд, J = 11.3, 2.7 Гц, 1H, Н-5'); 3.97 (ддд, J = 14.7, 10.6, 6.6, 4.2 Гц, 1H, СH2OH); 4.37 (ддд, J = 14.7, 7.4, 2.7 Гц, 1H, Н-2'); 4.82 (дд, J = 10.7, 1.2 Гц, 1H, Н-16); 4.86 (д, J = 17.6 Гц, 1H, Н-16); 5.28 (д, J = 5.3 Гц, 1H, Н-7); 5.76 (дд, J = 17.6, 10.7 Гц, 1H, Н-15). Спектр 13C ЯМР (100 MГц, CDCl3) δС: 15.13 (C20H3); 18.02 (С-2); 19.54 (C19H3); 19.87 (С-11); 21.32 (C17H3); 25.19 (С-6); 25.49 (C-3'); 27.08 (C-4'); 35.12 (С-10); 35.37 (С-12); 35.89 (С-13); 36.65 (С-3); 38.33 (С-1); 45.34 (C-5); 45.92 (C-14); 47.03 (C-4); 49.09 (C-5'); 51.98 (C-9); 62.63 (C-2'); 68.14 (CН2OH); 109.12 (C-16); 120.06 (C-7); 135.34 (С-8); 150.13 (С-15); 179.89 (C=O). ИК-спектр (ν, см-1): 908, 989, 1062, 1093, 1149, 1172, 1238, 1324, 1361, 1380, 1400, 1444, 1457, 1575, 1612, 1637, 3305 (OH). УФ-спектр (λmax, нм) (lgε): 249 (2.82), 242 (3.02). Масс-спектр, m/z (Iотн, %): 385 (100), 257 (41), 241 (34), 185 (12), 145 (10), 133 (10), 119 (16), 105 (17), 91 (12), 81 (41), 70 (71), 55 (16), 41 (10). Найдено: 385.2977 [M]. C25H39NO2. Вычислено: 385.2975.
Пример 3. Исследование анальгетической активности соединений (Iа,б) в тесте «уксусные корчи»
Эксперимент проводили на аутбредных мышах-самцах массой 22-25 г. После карантина, животные были рандомизированы по весу и разделены на группы по 8 мышей одного пола в каждой. «Уксусные корчи» воспроизводили путем внутрибрюшинного введения 0.75% уксусной кислоты из расчета 0,1 мл на 10 г веса животного. Шести группам животных внутрижелудочно за час до воспроизведения модели вводили исследуемый агент (Iа) или (Iб) в исследуемой дозе (50, 25 и 5 мг/кг), одна группа - получала Диклофенак-натрий (V) в эффективной дозе 10 мг/кг. Каждой исследуемой дозе агентов (Iа) или (Iб), введенных в дозах 50, 25 или 5 мг/кг соответствовала отдельная контрольная группа животных. Животным контрольных групп вводили 0.2 мл воды на 10 г веса животного. Одной группе животных вводили изопимаровую кислоту (II) в дозе 10 мг/кг. Оценка активности осуществлялась по определению количества “корчей” в течение 3 мин (через 5 мин после введения раствора уксусной кислоты). Как видно, количество зарегистрированных “корчей” в контрольных группах животных составило 11.73, 11.7, 11.9 шт. Количество корчей животных при введении изучаемых агентов (Iа,б), изопимаровой кислоты (II) или Диклофенак-натрия (V) снижалось. Так при введении соединений (Iа,б) в дозах 50 мг/кг выраженность болевой реакции достоверно снижалась на 49-58%, при введении агентов (Iа,б) в дозе 25 мг/кг - до 48-56%, при введении агентов (Iа,б) в дозе 5 мг/кг - до 30-31%, а при введении агента (V) в дозе 10 мг/кг - до 71% (табл. 1).
Как видно, соединения (Iа,б) обладали достоверным дозозависимым анальгетическим эффектом при внутрижелудочном введении новых соединений (Ia,б) в дозах 50, 25 или 5 мг/кг.
Пример 4. Исследование анальгетической активности соединений (Iа,б) в тесте «горячая пластина» при внутрижелудочном введении в дозе 50 мг/кг
Использовали пять группы экспериментальных животных. Первым двум группам внутрижелудочно за час до воспроизведения модели вводили исследуемые агенты (Iа) или (Iб) в дозе 50 мг/кг, третья группа получала исходное вещество изопимаровую кислоту (II), четвертая группа -препарат (V) в эффективной дозе 10 мг/кг, пятая (контрольная) группа - 0.2 мл воды на 10 г веса животного. Животных помещали на нагретую до 54оС горячую пластину. Оценка активности осуществлялась по определению процента анальгетического эффекта по формуле ПАЭ = (t-tконтроль)/tконтроль×100 (где t - время нахождения на пластине животных получавших агент; tконтроль - время нахождение животных на пластине животных контрольной группы). Результаты представлены в таблице 2. Как видно, при введении в дозе 50 мг/кг соединения (Ia,б) обладали достоверным анальгетическим эффектом и увеличивали латентное время болевой реакции на 40-51%. Эффект Диклофенак-натрия составил 45%. Эффект исходного соединения (II) был не достоверным. То есть соединение не проявило анальгетической активности.
Пример 5. Исследование анальгетической активности соединений (Iа-в) в тесте «горячая пластина» при внутрижелудочном введении в дозе 25 мг/кг
Использовали пять групп экспериментальных животных. Двум группам внутрижелудочно за час до воспроизведения модели вводили исследуемые агенты (Iа) или (Iб) в дозе 25 мг/кг, третья группа получала препарат (V) в эффективной дозе 10 мг/кг, четвертая (контрольная) группа - 0.2 мл воды на 10 г веса животного. Животных помещали на нагретую до 54°С горячую пластину. Соединения (Iа) и (Iб) достоверно увеличивали время нахождения животных на пластине при введении в дозе 25 мг/кг на 36 и 50% соответственно. Активность соединения (Iб) в дозе 25 мг/кг превышала активность Диклофенак-натрия.
Пример 6. Исследование анальгетической активности соединений (Iа,б) в тесте «горячая пластина» при внутрижелудочном введении в дозе 5 мг/кг
Использовали четыре группы экспериментальных животных. Двум группам внутрижелудочно за час до воспроизведения модели вводили исследуемые агенты (Iа) или (Iб) в дозе 5 мг/кг, третья группа получала препарат (V) в эффективной дозе 10 мг/кг, четвертая (контрольная) группа - 0.2 мл воды на 10 г веса животного. Животных помещали на нагретую до 54°С горячую пластину. Соединение (Iб) достоверно увеличивало время нахождения животных на пластине при введении в дозе 5 мг/кг на 32%. Эффект соединения (Iа) был не достоверным. Эффект Диклофенак-натрия в более высокой дозе 10 мг/кг составил 43%.
Пример 7. Определение токсичности соединений (Ia,б)
Исследование проводили в острых опытах на беспородных мышах обоего пола массой 22-28 г. Соединения вводили в виде водно-твиновых растворов по 0.2 мл на 10 г массы тела в дозах 500, 750, 1000, 1250 и 1500 мг/кг. На каждую дозу брали по 6 мышей. Установлено, что в диапазоне доз 500-1250 мг/кг соединения (Iа,б) не вызвали гибели животных, клинические симптомы интоксикации отсутствовали. Половой чувствительности к соединениям не выявлено. При введении соединений (Ia) или (Iб) в дозе 1500 мг/кг признаки интоксикации проявлялись у одного или двух животных соответственно. Гибели животных не наблюдалось. Согласно общепринятой классификации соединения (Iа,б) относятся к 3-ему классу умеренно токсичных соединений. LD50 соединений (Iа,б) меньше 1250 мг/кг.
Таким образом, в результате исследования установлено, что соединения (Iа,б) обладают выраженным анальгетическим действием, причем изменения носят достоверный дозозависимый характер по сравнению с соответствующими показателями у животных в контрольной группе. Агенты (Iа,б) блокируют развитие болевого эффекта, на моделях химического и термического раздражения в дозах 50, 25 и 5 мг/кг. Обезболивающий эффект соединения (Iб), введенного в дозе 25 мг/кг в тесте термического раздражения, превышает анальгетическую активностью препарата сравнения Диклофенак-натрия, введенного в эффективной дозе анальгетического действия 10 мг/кг. Исходное соединение - изопимаровая кислота (II) достоверно уменьшает болевую реакцию только на модели висцеральной боли (в тесте “уксусные корчи”) в дозе 50 мг/кг.
Таким образом, предлагаемое изобретение обладает следующими преимуществами, а именно:
- Анальгетическая активность в тестах “уксусные корчи” и “горячая пластина”.
- Низкая токсичность по сравнению с препаратом сравнения Диклофенак натрия.
- Использование для получения заявляемого соединения широко представленной в хвойных растениях изопимаровой кислоты.
Схема. Синтез карбоксамидов изопимаровой кислоты (Iа,б)