Результат интеллектуальной деятельности: (2Z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(АЦЕТИЛОКСИ)-3(Z),11(E)-БИС(ГИДРОКСИИМИНО)-4,8,10,14-ТЕТРАМЕТИЛГОНАН-17-ИЛИДЕН]-6-МЕТИЛГЕПТ-5-ЕНОВАЯ КИСЛОТА, СПОСОБ ПОЛУЧЕНИЯ И АНТИМИКРОБНЫЕ СВОЙСТВА
Вид РИД
Изобретение
Изобретение относится к области синтеза биологически активных аналогов природных соединений, а именно к получению (2Z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(ацетилокси)-3(Z), 11(E)-бис(гидроксиимино)-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еновой кислоты формулы (1), обладающей высокой активностью по отношению к Staphylococcus aureus (MRSA):
Известен способ получения метил-3-О-ацетил-11(E)-гидроксиимино-24,25-дигидрофузидата (3) и метил-3-гидроксиимино-24,25-дигидрофузидата (5) (соотношение Е- и Z-изомеров 10:1, соответственно), заключающийся во взаимодействии метилового эфира 3-O-ацетил-11-оксо-24,25-дигидрофузидовой кислоты (2) или метилового эфира 24,25-дигидрофузидовой кислоты (4) с 3 эквивалентами гидроксиламин гидрохлорида в метаноле при 20°С в присутствии ацетата калия (схема 1) [Murphy W.S., Sarsam В., Ferguson G., Gallagher J.F. Azasteroids derived from fusidic acid. J. Chem. Soc., Perkin Trans. 1, 1998, 4121-4128].
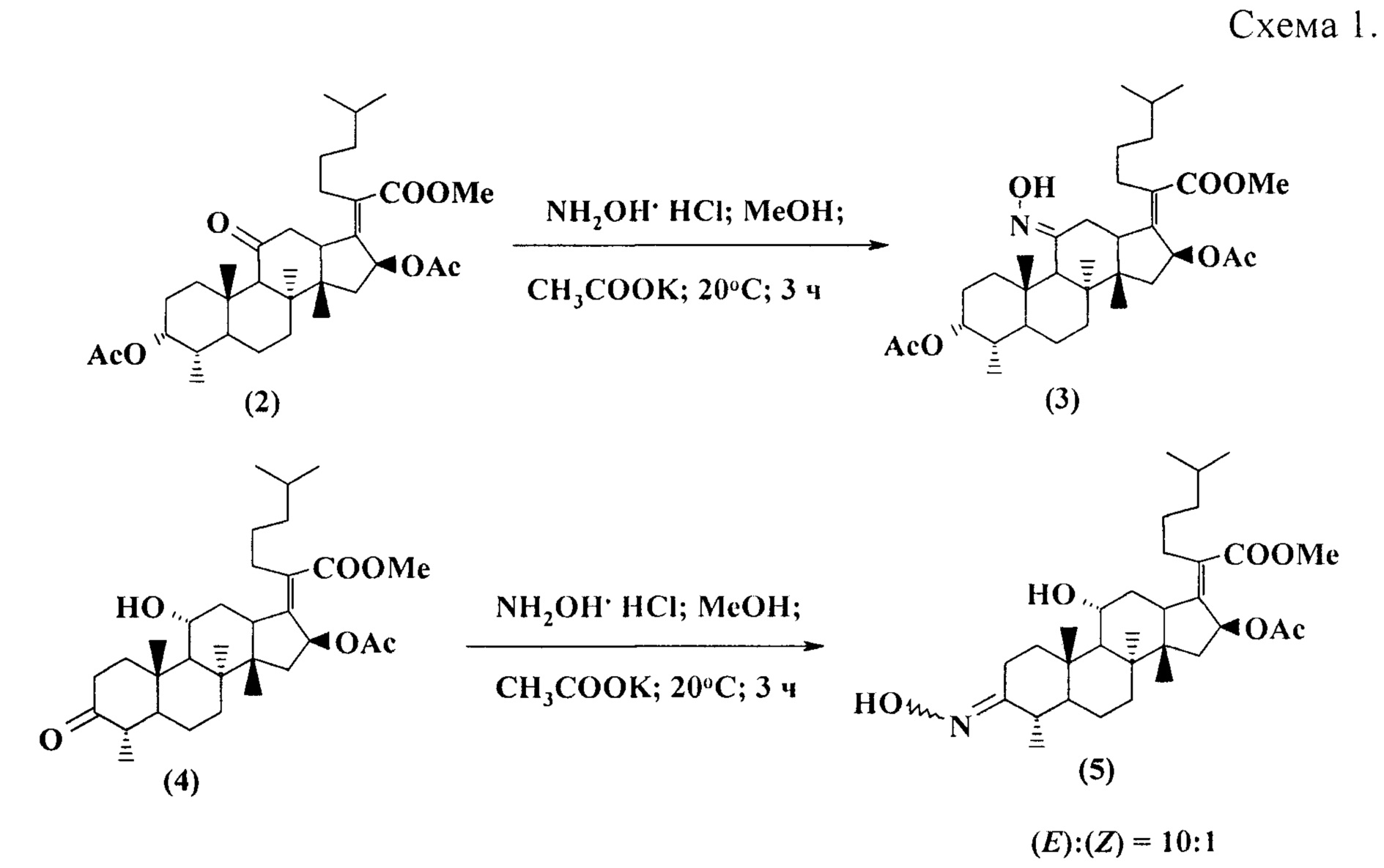
Таким образом, синтез 3(Z),11(E)-бис(гидроксиимино)-производного фузидовой кислоты в литературе не описан.
Антимикробное и противогрибковое действие данных соединений на штаммах возбудителей бактериальных и грибковых инфекций человека и животных изучено не было.
Задачей предлагаемого изобретения является разработка способа получения нового соединения - (2Z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(ацетилокси)-3(Z),11(E)-бис(гидроксиимино)-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еновой кислоты, исследование in vitro ее антимикробных и противогрибковых свойств.
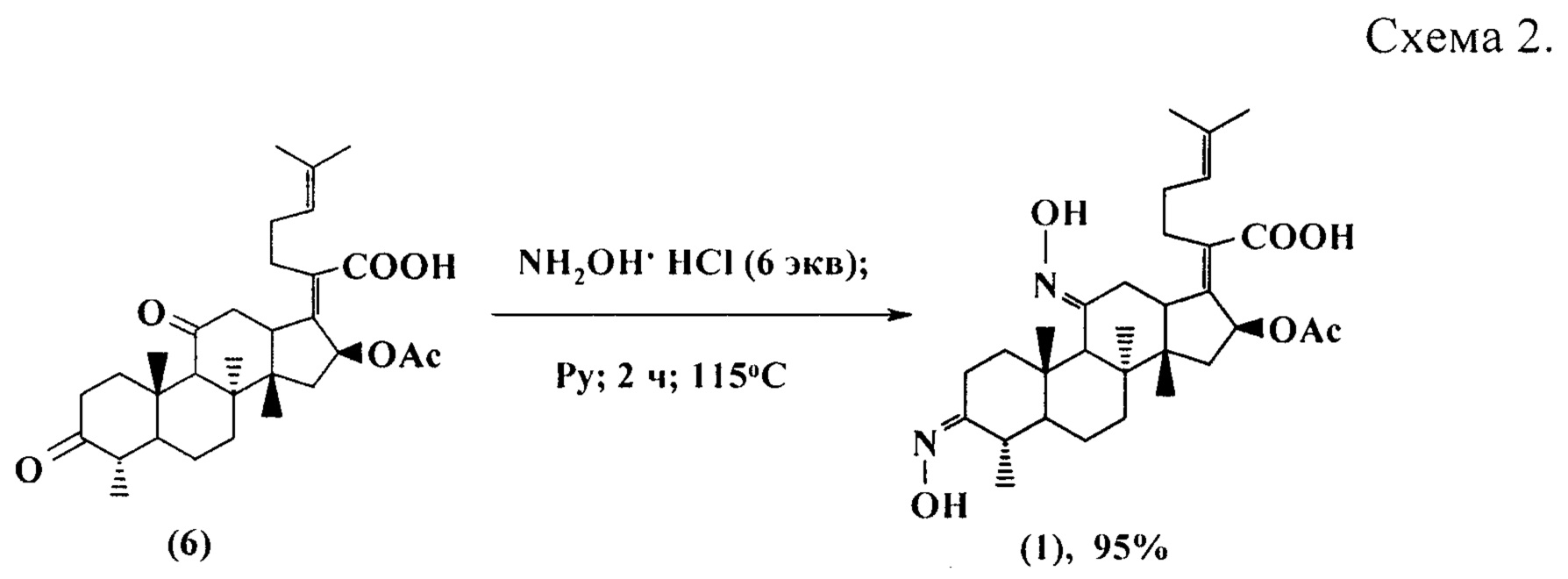
Синтез заявленного соединения (1) осуществляли следующим образом: 3,11-диоксопроизводное фузидовой кислоты (6) вовлекали во взаимодействие с 6 эквивалентами гидроксиламин гидрохлорида в среде сухого пиридина при кипячении в течение 2 часов (схема 2). После выделения и хроматографической очистки, получали диоксииминопроизводное (1) с выходом 95%, которое представляло собой кристаллическое вещество светло-желтого цвета (т.пл. 179-181°С), 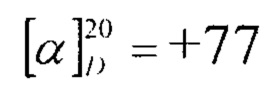 (с 1.13, CHCl3). Структура соединения (1) установлена с помощью 1D и 2D спектроскопии ЯМР 1Н и 13С и масс-спектрометрии MALDI TOF/TOF.
(с 1.13, CHCl3). Структура соединения (1) установлена с помощью 1D и 2D спектроскопии ЯМР 1Н и 13С и масс-спектрометрии MALDI TOF/TOF.
Преимущества предлагаемого способа:
В известном способе для получения оксииминопроизводных (3) и (5) в качестве исходных соединений используются монооксо-производные метилового эфира 24,25-дигидрофузидовой кислоты (2) и (4), синтезируемые из нативной фузидовой кислоты в 4 или 3 стадии, соответственно; целевое соединение (5) получено в виде смеси стереоизомеров (схема 1).
В отличие от известного, в предлагаемом способе исходным соединением является 3,11-диоксопроизводное, синтезируемое из фузидовой кислоты в 1 стадию; предлагаемый метод позволяет получать 3(Z),11(E)-бис(гидроксиимино)-производное (1) в виде индивидуального стереоизомера с количественным выходом (схема 2).
Сущность изобретения поясняется следующими примерами.
Пример 1. К раствору 1 г (1.6 ммоль) соединения (6) в 50 мл сухого пиридина добавляли 0.67 г (9.6 ммоль) гидроксиламина солянокислого. Смесь нагревали при температуре 115°С в течение 2 ч и выливали в ледяную воду, подкисленную 5% соляной кислотой. Выпавший осадок отфильтровывали, промывали водой, сушили на воздухе. Выход соединения (1) 1.01 г (95%), кристаллы светло-желтого цвета. Т.пл. 179-181°С, 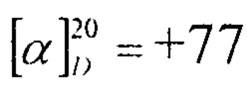 (с 1.13, CHCl3).
(с 1.13, CHCl3).
Спектральные характеристики (2Z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(ацетилокси)-3(Z),11(E)-бис(гидроксиимино)-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еновой кислоты (1)1.
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.01 с (3Н, Н19), 1.07 с (3Н, H18), 1.11 д (3Н, Н28, 3J 6.6 Гц), 1.16 с (3Н, Н30), 1.20-1.26 м (1Н, Н6), 1.20-1.31 м (1Н, Н7), 1.30-1.46 м (1Н, H15), 1.53-1.71 м (1Н, Н6), 1.63 с (3Н, Н27), 1.68 с (3Н, Н26), 1.83 т (1Н, H5, 3J 10.6 Гц), 1.97-2.10 м (1Н, Н12), 1.99-2.08 м (1H, Н7), 2.00 с (3Н, Н32), 2.05-2.20 м (2Н, H23), 2.09-2.21 м (1Н, Н2), 2.09-2.23 м (1Н, Н15), 2.09-2.24 м (1Н, Н1), 2.24-2.37 м (1Н, Н2), 2.39-2.53 м (1Н, H1), 2.40-2.49 м (1Н, Н22), 2.54 с (1Н, Н9), 2.54-2.65 м (1Н, Н22), 2.55-2.64 м (1Н, Н13), 2.70-2.75 м (1Н, Н4), 4.07 дд (1Н, Н12, 3J 4.8 Гц, 2J 15.2 Гц), 5.19 т (1Н, Н24, 3J 7.4 Гц), 5.85 д (1Н, Н16, 3J 8.4 Гц).
Спектр ЯМР, 13С (CDCl3), δ, м.д.: 14.65 (С28), 17.25 (С18), 17.96 (С27), 20.83 (С32), 21.44 (С6), 23.89 (С30), 24.43 (С19), 25.65 (С12), 25.74 (С1), 26.14 (С26), 29.05 (C23), 30.07 (С22), 33.95 (С4), 34.85 (С2), 35.03 (С7), 37.95 (С10), 39.36 (С15), 40.83 (С8), 45.86 (С5), 46.48 (C13), 50.07 (С14), 51.61 (С9), 75.69 (С16), 124.31 (С24), 133.06 (С20), 133.75 (С25), 147.53 (С17), 157.23 (С11), 168.66 (C3), 172.56 (С31), 173.76 (С21). Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 543 (100) [М+Н]+, 581 (49.1) [М+K]+.
1Контроль реакции осуществляли методом ТСХ на пластинах Sorbfil (Сорбполимер, Краснодар, Россия), проявляли 10% раствором серной кислоты. Для колоночной хроматографии использовали силикагель L (50-160 мкм) марки КСКГ. Температура плавления определена на приборе РНМК 80/2617. Спектры ЯМР 1D (1Н, 13С) и 2D (COSY, NOESY, HSQC, НМВС) сняты на спектрометре Bruker Avance 500 (125.78 МГц для 13С и 500.17 МГц для 1Н) с использованием стандартных импульсных последовательностей фирмы Bruker, внутренний стандарт Me4Si, растворитель - CD3OD. Оптические углы измерены на поляриметре Perkin-Elmer 341. Масс-спектры MALDI TOF/TOF получены на спектрометре Bruker Autoflex ТМ III Smartbeam с использованием матрицы 3-(4-гидрокси-3,5-диметоксифенил)проп-2-еновой кислоты (синапиновая кислота).
Для установления стереохимии оксимино-групп, соединение (1) вовлекали в реакцию метилирования с MeJ в присутствии NaH в среде сухого тетрагидрофурана, в результате которой было выделено производное (7) (схема 3). На основании спектров NOESY соединения (7) было установлено, что полученный диоксим имеет 3(Z),11(E)-конфигурацию.
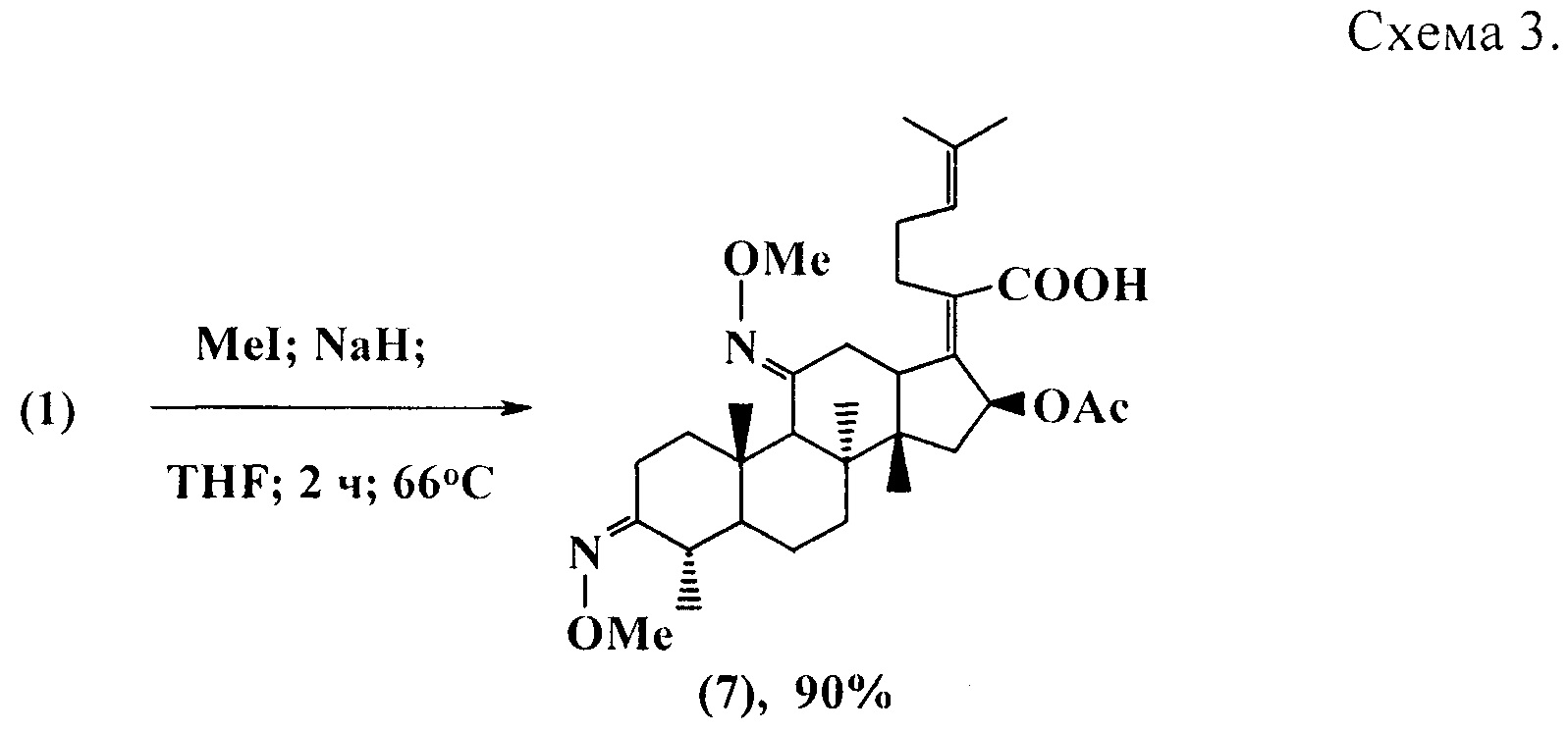
Пример 2. К раствору 2 г (3.7 ммоль) соединения (1) в 50 мл сухого тетрагидрофурана добавляли 0.27 г (11.2 ммоль) гидрида натрия. Перемешивали 30 мин при комнатной температуре и добавляли 0.2 мл (3.7 ммоль, 0.5 г) йодметана. Смесь нагревали при температуре 66°С в течении 2 ч и выливали в ледяную воду. Выпавший осадок фильтровывали, промывали водой до нейтральной рН, сушили на воздухе. Выход соединения (7) 1.89 г (90%), кристаллы белого цвета. Т.пл. 142-144°С, 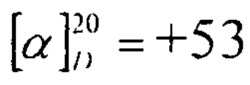 (с 0.94, CHCl3).
(с 0.94, CHCl3).
Спектр ЯМР 1Н (CDCl3), δ, м.д.: 1.07 д (3Н, Н28, 3J 6.5 Гц), 1.16 с (3Н, H30), 1.16-1.35 м (1Н, Н7), 1.17-1.26 м (1Н, H6), 1.19 с (3Н, Н19), 1.23 с (3Н, H18), 1.26-1.47 м (1Н, H15), 1.50-1.71 м (1Н, Н6), 1.64 с (3Н, Н27), 1.69 с (3Н, Н26), 1.91-2.06 м (1Н, Н7), 1.98-2.10 м (1Н, Н12), 1.99 с (3Н, Н32), 2.06-2.30 м (2Н, Н23), 2.06-2.40 м (2Н, Н2), 2.07-2.26 м (1Н, H15), 2.11-2.27 м (1Н, Н1), 2.32-2.57 м (2Н, Н22), 2.39-2.52 м (1Н, Н1), 2.54 с (1Н, Н9), 2.55-2.66 м (1Н, Н5), 2.59-2.73 м (1Н, Н4), 2.96 дд (1Н, Н13, 3J 3.5 Гц, 3J 13.0 Гц), 3.79 с (3Н, Н34), 3.86 с (3Н, Н33), 3.94 дд (1Н, Н12, 3J 4.5 Гц, 2J 11.0 Гц), 5.16 т (1Н, Н24, 3J 6.3 Гц), 5.84 д (1Н, Н16, 3J 8.4 Гц).
Спектр ЯМР 13С (CDCl3), δ, м.д.: 13.58 (С28), 15.80 (С18), 16.51 (С27), 19.35 (С32), 19.89 (С6), 21.98 (С30), 23.17 (С19), 24.89 (С12), 24.28 (С1), 24.71 (С26), 27.57 (С23), 28.65 (С22), 32.92 (С4), 33.46 (С2), 33.32 (С7), 36.43 (С10), 37.82 (C15), 40.58 (С8), 44.88 (C5), 46.37 (С13), 48.50 (С14), 50.23 (С9), 60.08 (С34), 60.55 (С33), 74.08 (С16), 122.87 (С24), 132.20 (С20), 132.31 (С25), 145.91 (С17), 156.10 (С11), 167.00 (С3), 170.95 (C31), 172.01 (С21). Масс-спектр (MALDI TOF/TOF), m/z (Iотн., %): 571 (100) [М+H]+ 609 (35.5) [М+K]+.
Противомикробный скрининг соединения (1) проводили в CO-ADD (The Community for Antimicrobial Drug Discovery), финансируемым Wellcome Trust (Великобритания) и Университетом Квинсленда (Австралия), на пяти бактериальных штаммах: Escherichia coli (Е. coli) АТСС 25922, Klebsiella pneumoniae (K. pneumoniae) АТСС 700603, Acinetobacter baumannii (A. baumannii) ATCC 19606, Pseudomonas aeruginosa (P. aeruginosa) ATCC 27853 и Staphylococcus aureus (S. aureus) ATCC 43300. Противогрибковую активность определяли на двух грибковых штаммах: Candida albicans (С. albicans) АТСС 90028 и Cryptococcus neoformans (С. neoformans) АТСС 208821.
Первичный скрининг противомикробной активности проводился путем тестов на ингибирование размножения клеток, используя образцы в одной (32 мкг/мл) концентрации. Аликвоту каждого образца в ДМСО помещали в 384-луночный планшет и обрабатывали соответствующей бактериальной культурой. Ингибирование роста бактерий определяли измерением поглощения при 600 нм (OD600) с использованием монохромного считывателя микропланшетов Tecan M1000 Pro. Процент ингибирования роста рассчитывали для каждой лунки с использованием отрицательного контроля (только для среды) и положительного контроля (бактерии без ингибиторов) на той же пластинке. В случае если один или оба раза наблюдалось ингибирование роста ≥80%, соединение считалось активным (Таблица 1).
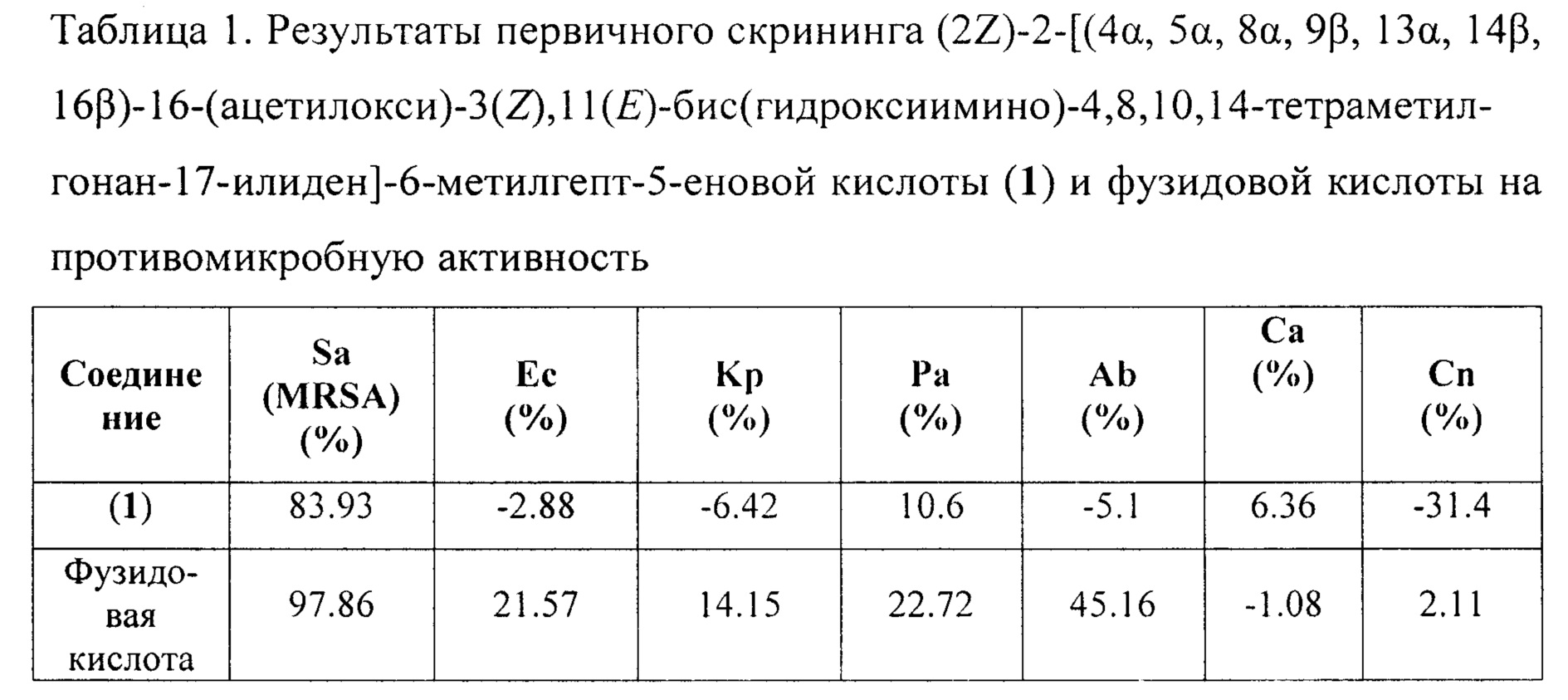
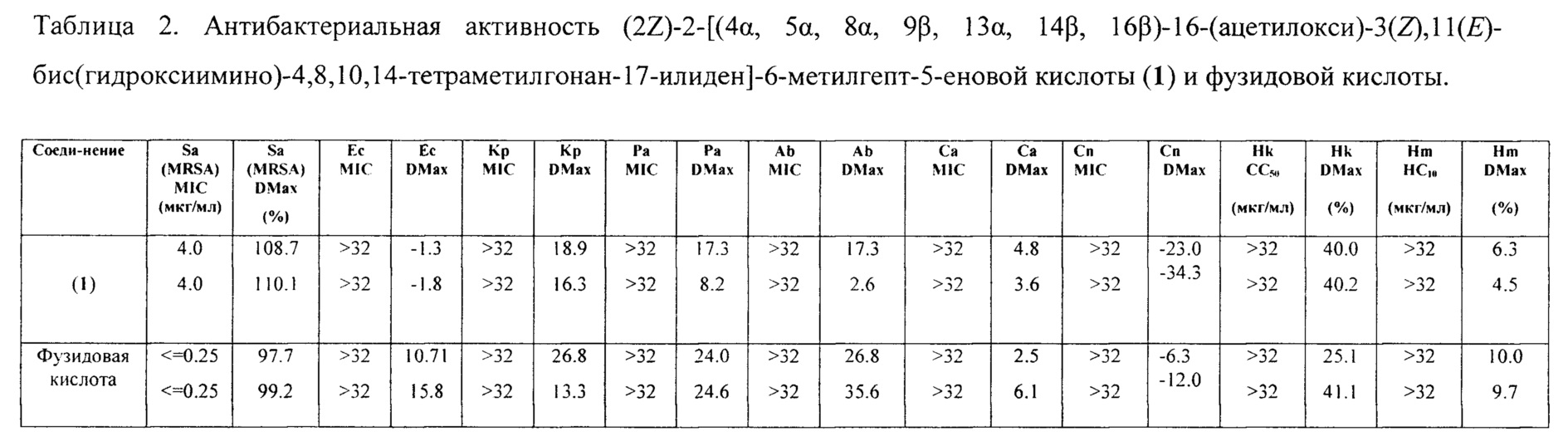
При первичном скрининге было выявлено наличие противомикробной активности у (2Z)-2-[(4α, 5α, 8α, 9β, 13α, 14β3, 16β)-16-(ацетилокси)-3(Z),11(E)-бис(гидроксиимино)-4,8,10,14-тетраметилгонан-17-илиден]-6-метилгепт-5-еновой кислоты (1) в отношении культуры бактерий Staphylococcus aureus. Для соединения (1) была определена минимальная ингибирующая концентрация в отношении вышеуказанной культуры, а также изучена цитотоксическая и гемолитическая активности.
Минимальную ингибирующую концентрацию (MIC; мкг/мл) устанавливали в соответствии с рекомендациями Института клинических и лабораторных стандартов (Clinical and Laboratory Standards Institute), определяя самую низкую концентрацию, при которой было обнаружено полное ингибирование бактерий или грибов. Тесты проводились в двойном повторе. Максимальный процент ингибирования роста обозначался как DMax. Хиты были классифицированы при MIC ≤ 16 мкг/мл или MIC ≤ 10 мкМ в любой реплике (n=2 на разных пластинах).
Цитотоксическое действие определяли на клеточной линии эмбриональных почек человека HEK293 путем определения концентрации, вызывающей гибель 50% клеток (Hk СС50). Ингибирование роста клеток HEK293 определяли, измеряя флуоресценцию после добавления 5 мкл 25 мкг/ мл резазурина (конечная концентрация 2.3 мкг/мл) и после инкубации в течение еще 3 ч при 37°С в 5% СО2. Интенсивность флуоресценции измеряли с использованием монохромного считывателя Tecan M1000 Pro с использованием автоматического вычисления коэффициента усиления. Максимальный процент цитотоксичности обозначали как DMax. Соединение считалось токсичным при СС50 ≤ 32 мкг / мл или СС50 ≤ 10 мкМ. Кроме того, образцы были отмечены как частичные цитотоксические, если DMax ≥ 50%, даже при СС50 выше максимальной тестируемой концентрации.
Гемолитическую активность (Hm НС10 и НС50 - концентрация при 10% и 50% гемолизе, соответственно) определяли путем измерения поглощения при 405 мм супернатанта - надосадочной жидкости, образованной после инкубации в течение 1 ч при 37°С планшетов, содержащих образцы соединений с добавленными к ним промытыми клетками крови человека, и последующего центрифугирования при 1000 об/мин в течение 10 мин. Абсорбцию измеряли с использованием монохромного считывателя Tecan M1000 Pro.
Максимальный процент гемолиза представлен как DMax. Низкое значение DMax при НС10 > 32 мкг/мл (максимально испытанная концентрация) указывает на образцы без гемолитической активности. Образцы, обладающие гемолитической активностью, были охарактеризованы при НС10 ≤ 32 мкг/мл. Кроме того, образцы были помечены как частично гемолитические, если DMax ≥ 50%, даже при НС10 > максимальной тестируемой концентрации.
«Колистин» и «Ванкомицин» были использованы в качестве положительных стандартов бактериального ингибирования для грамотрицательных и грамположительных бактерий, соответственно. «Флуконазол» использовали в качестве стандартного ингибитора гриба для С. albicans и С. neoformans. «Тамоксифен» использовали в качестве положительного стандарта цитотоксичности. «Мелиттин» использовали в качестве положительного гемолитического стандарта.
Образец (2Z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(ацетилокси)-3(Z),11(E)-бис(гидроксиимино)-4,8,10,14-тетраметил гонан-17-илиден]-6-метилгепт-5-еновой кислоты (1) в концентрации 4.0 мкг/мл показал противомикробную активность, ингибируя рост и размножение >100% грамположительных бактерий Staphylococcus aureus. Гемолитическая активность соединения (1) не превышает 6.3% даже при максимально тестируемой концентрации >32 мкг/мл, что ниже таковой у фузидовой кислоты в 1.5 раза. Цитотоксичность соединения (1) сравнима с фузидовой кислотой (Таблица 2).
Таким образом, соединение (1) проявляет противомикробную активность в отношении патогенных микроорганизмов Staphylococcus aureus при низкой токсичности и обладает минимальным гемолитическим действием при максимально тестируемой концентрации.
![(2Z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(АЦЕТИЛОКСИ)-3(Z),11(E)-БИС(ГИДРОКСИИМИНО)-4,8,10,14-ТЕТРАМЕТИЛГОНАН-17-ИЛИДЕН]-6-МЕТИЛГЕПТ-5-ЕНОВАЯ КИСЛОТА, СПОСОБ ПОЛУЧЕНИЯ И АНТИМИКРОБНЫЕ СВОЙСТВА](https://fips.edrid.ru/images/rid/8e/2e/52/64b1b13f3081bebe753267e394d98703.jpg)
![(2Z)-2-[(4α, 5α, 8α, 9β, 13α, 14β, 16β)-16-(АЦЕТИЛОКСИ)-3(Z),11(E)-БИС(ГИДРОКСИИМИНО)-4,8,10,14-ТЕТРАМЕТИЛГОНАН-17-ИЛИДЕН]-6-МЕТИЛГЕПТ-5-ЕНОВАЯ КИСЛОТА, СПОСОБ ПОЛУЧЕНИЯ И АНТИМИКРОБНЫЕ СВОЙСТВА](https://fips.edrid.ru/images/rid/8e/2e/52/bce3da016575e5aa91089dce17483335.jpg)

