Результат интеллектуальной деятельности: Рекомбинантный штамм вируса гриппа A/PR8-NS124-TB10.4-2A-HspX и способ специфической профилактики туберкулеза легких с использованием вакцины мукозального применения на его основе
Вид РИД
Изобретение
Разработка новой стратегии специфической профилактики туберкулеза, обеспечивающей защиту различных целевых групп населения, является одной из приоритетных задач здравоохранения в XXI веке. Согласно документу Всемирной Организации Здравоохранения, одной из предпочтительных стратегий является схема иммунизации, включающая первичной применение вакцины БЦЖ и последующее применение вакцины, усиливающей защитное действие БЦЖ [WHO РРС, 2018]. Относительно данной стратегии, антигены М. tuberculosis ТВ 10.4 и HspX являются перспективными для включения в состав разрабатываемых вакцин, поскольку данные белки экспрессируются Bacillus Calmette-Guerin [Boon С, DickT. 2012;7(4):513-8; Singh S., Saraav I., Sharma S. Vaccine. 2014; 32(6):712-6] и, таким образом, смогут обеспечить требуемый бустирующий эффект вакцинации
В настоящее время двенадцать кандидатных вакцин против туберкулеза находятся на различных фазах клинических испытаний: четыре на I фазе, шесть на II фазе и две на III фазе [WHO Global Tuberculosis report, 2018]. Они включают как профилактические вакцины, предназначенные для предотвращения развития туберкулезной инфекции и болезни, так и терапевтические вакцины, предназначенные для улучшения результатов лечения туберкулеза. Кандидатные вакцины представлены следующими типами: живые аттенуированные, инактивированные (или клеточные экстракты), рекомбинантные белковые (в том числе адьювантные) и векторные вакцины (в том числе на основе гриппозного вектора).
Настоящее изобретение относится к области биотехнологии, вирусологии и медицины и описывает способ получения оригинального векторного вакцинного штамма на основе аттенуированного вируса гриппа, и способ профилактики туберкулеза легких с помощью мукозальной вакцины на его основе.
Область и уровень техники
Близким техническим решением к настоящему изобретению являются аттенуированные рекомбинантные вирусы гриппа A/PR8-2A-ESAT-6 (H1N1), A/Singapore/-2A-ESAT-6 (H2N2), A/Aichi-2A-ESAT-6 (H3N2), экспрессирующие ранний секреторный антиген ESAT-6 в составе рамки считывания укороченного до 124 аминокислот белка NS1 [Патент RU №2318872, опубл. 10.03.2008]. Описанные рекомбинантные штаммы способны индуцировать специфичный противотуберкулезный иммунный ответ, и при мукозальном введении обеспечивают профилактический эффект на уровне вакцины М. bovis БЦЖ. Однако вакцинные кандидаты содержат ранний секреторный белок культурального фильтрата микобактерий - антиген ESAT-6, входящий в состав современных туберкулезных диагностических тест-систем («Диаскинтест», «Quantiferon-ТВ Gold» и др.), и поэтому не совместимы с современными диагностическими тест-системами на основе IGRA (Interferon-gamma release assay). Кроме того, белок ESAT-6 не входит в состав вакцины БЦЖ и поэтому не может быть использован для усиления защитного действия БЦЖ в схеме прайм-буст иммунизации. Другим близким техническим решением является аттенуированный рекомбинантный вакцинный штамм ТВ-FLU ESAT6 2А AG85A, экспрессирующий два секреторных белка ESAT-6 и Ag85A в рамке укороченного до 124 аминокислот белка NS1 [Патент РК №81636, опубл. 15.01.2014]. Также известен аналогичный рекомбинантный вектор NS116-Esat6Ag85A/A, кодирующий те же антигены, но в составе еще более укороченного белка NS1 (до 116 а.о.) и несущий дополнительные мутации в белке NEP [Патент WO 2014041082 A1]. Данные вакцинные кандидаты обладают теми же недостатками и ограничениями, как и штаммы, описанные выше [Патент RU №2318872].
Из уровня техники известен холодоадаптированный аттенуированный вакцинный штамм A/PR8/HK-NS80-E85A, экспрессирующий фрагменты антигенов ESAT-6 (1-73 а.о.) и Ag85A (234-295 а.о.) [Патент RU №2678175, опубл. 23.01.2019]. Данный штамм способен репродуцироваться в развивающихся куриных эмбрионах, являющихся основным субстратом производства живой гриппозной вакцины в Российской Федерации, однако по-прежнему остается ограничение, связанное с белком ESAT-6, использование которого не совместимо с существующими диагностическими тест-системами.
Из уровня техники известен аттенуированный вирус гриппа А, содержащий химерный NS фрагмент, включающий укороченную рамку считывания белка NS1 и гетерологичную последовательность гена белка NEP, происходящую от подтипа вируса гриппа А, отличающегося от подтипа указанного аттенуированного вируса гриппа А, где указанная укороченная рамка считывания кодирует белок NS1 размером 80-130 аминокислотных остатков [Патент RU №2628690, опубл. 21.08.2017, заявка ЕР 3382010А4, заявка PCT/RU2016/050066]. В описании изобретения указано, что данный вирус может быть использован в качестве вектора для создания рекомбинантного штамма, в котором укороченная рамка считывания гена белка NS1 продолжена вставкой последовательности по меньшей мере одного трансгена, кодирующего белок микобактерий туберкулеза ESAT- 6, Ag85A, Ag85 В, Mpt64, HspX, Mtb8.4 или 10.4 или их фрагменты. Также указано, что введение штамма в эффективном количестве может быть использовано для профилактики туберкулезной инфекции. Описанный штамм способен репродуцироваться в системе куриных эмбрионов. Недостатком указанного изобретения является отсутствие описания схемы профилактики, учитывающей «прайм» иммунизацию БЦЖ, которая в настоящее время является обязательной на территории Российской Федерации.
Из литературы известны рекомбинантные вирусы гриппа, кодирующие отдельные эпитопы антигенов Ag85A (240-254 а.о., CD4+ эпитоп) или ТВ10.4 (3-11 а.о., CD8+ эпитоп) [ Eur J Immunol. 2015 Mar; 45(3):780-93]. Однако данные штаммы не могут рассматриваться в качестве вакцинных кандидатов, так как они обладают хорошими репликативными свойствами, то есть не являются аттенуированными по сравнению с вирусами гриппа «дикого» типа. Кроме того, недостатком одного из штаммов является узкая направленность иммунного ответа (единственный CD8+ эпитоп) и недостаточная активация CD4+ Т-клеток иммунной системы для достижения протекции в отношении туберкулеза..
Eur J Immunol. 2015 Mar; 45(3):780-93]. Однако данные штаммы не могут рассматриваться в качестве вакцинных кандидатов, так как они обладают хорошими репликативными свойствами, то есть не являются аттенуированными по сравнению с вирусами гриппа «дикого» типа. Кроме того, недостатком одного из штаммов является узкая направленность иммунного ответа (единственный CD8+ эпитоп) и недостаточная активация CD4+ Т-клеток иммунной системы для достижения протекции в отношении туберкулеза..
Из уровня техники известен другой тип аттенуированных гриппозных векторов, которые могут быть использованы, в том числе, для экспрессии антигенных эпитопов М. tuberculosis, в том числе, эпитопа FAYGSFVRTVSLPVGA (HspX, 93-108 а.о.) [Патент WO 2015142671 А2]. Аттенуация векторов данного типа обеспечивается нокаутом гена М2, поэтому репродукция (и соответственно производство) данных векторов ограничено клеточными линиями, экспрессирующими вирусный белок М2, что является ограничением векторов данного типа.
Сущность изобретения
Изобретательской задачей является создание нового рекомбинантного штамма на основе гриппозного вектора, предназначенного для получения векторной вакцины против туберкулеза, обладающего более высоким защитным потенциалом и лишенного недостатков прототипов. Поставленная задача решена с помощью генно-инженерного конструирования рекомбинантного вакцинного штамма, экспрессирующего полноразмерные туберкулезные антигены ТВ10.4 и HspX. Особенностью генетической конструкции вакцинного штамма является укорочение транслируемой области белка NS1 до 124 аминокислотных остатков и замещение его карбоксильной части последовательностью, кодирующей туберкулезные антигены ТВ10.4 и HspX. Данные иммунодоминантные антигены экспрессируются в различные фазы жизненного цикла М. tuberculosis. Кроме того, данные белкине входят в состав современных диагностических тест-систем («Диаскинтест», «Quantiferon-ТВ Gold» и др.).
Аттенуация рекомбинантного вакцинного штамма, сконструированного на основе вируса гриппа A/PR/8/34 (H1N1), обеспечивается модификацией геномного NS фрагмента, приводящей к укорочению NS1 белка до 124 аминокислотных остатков. Укорочение NS1 белка нарушает способность вируса ингибировать систему врожденного иммунитета, в частности, выработку интерферонов первого типа. Это приводит к подавлению способности вируса к продуктивной репродукции in vivo и предотвращению трансмиссии вакцинного штамма. В то же время, интраназальная иммунизация вакцинным штаммом обеспечивает экспрессию антигенов М. tuberculosis в эпителиальных и антиген-презентирующих клетках респираторного тракта. При этом в зоне вирусной аппликации происходит усиленная выработка интерферонов и других цитокинов, обладающих иммуноадъювантными свойствами, что вызывает выраженный иммунный ответ к антигенам М. tuberculosis и формирование протективного иммунного ответа с поляризацией в сторону Th1 звена.
Несмотря на модификацию NS геномного фрагмента, вакцина на основе сконструированного рекомбинантного вируса может нарабатываться в куриных эмбрионах с использованием стандартных технологических схем, применяемых для производства гриппозных вакцин.
Настоящее изобретение относится к аттенуированному вирусу гриппа А, экспрессирующему микобактериальные антигены ТВ10.4 и HspX, где экспрессия антигенов происходит в рамке считывания белка NS1. При этом последовательность антигена ТВ10.4 отделена от последовательности укороченного до 124 аминокислотных остатков белка NS1 глициновым линкером, а следующая далее последовательность HspX отделена от ТВ10.4 сайтом автопротеолиза 2А пикорновируса, который обеспечивает отрезание перед последним пролином (17АК остатков, NFDLLKLAGDVESNLGP) [Percy N, Barclay WS,  et al., J Virol. 1994; 68(7):4486-92], и последовательностью сигнального пептида мышиного иммуноглобулина IgK, который обеспечивает секрецию белка. Следствием этого белок ТВ10.4 в вакцинном штамме A/PR8/NS124-TB10.4-2А-HspX экспрессируется в сшивке с укороченным до 124 аминокислотных остатков NS1 белком вируса гриппа, а белок HspX отщепляется при помощи сайта протеолитического расщепления, и секретируется наружу клетки.
et al., J Virol. 1994; 68(7):4486-92], и последовательностью сигнального пептида мышиного иммуноглобулина IgK, который обеспечивает секрецию белка. Следствием этого белок ТВ10.4 в вакцинном штамме A/PR8/NS124-TB10.4-2А-HspX экспрессируется в сшивке с укороченным до 124 аминокислотных остатков NS1 белком вируса гриппа, а белок HspX отщепляется при помощи сайта протеолитического расщепления, и секретируется наружу клетки.
Первым техническим результатом, достигаемым при осуществлении настоящего изобретения, является получение высокопродуктивного генетически стабильного вакцинного штамма на основе вируса гриппа А, экспрессирующего белки ТВ10.4 и HspX, который в режиме однократного интраназального введения индуцирует выраженный поствакцинальный противотуберкулезный Т-клеточный иммунный ответ.Рекомбинантный штамм A/PR8/NS124-TB10.4-2A-HspX депонирован в Государственной коллекции вирусов Национального исследовательского центра эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи Министерства здравоохранения Российской Федерации под №2864.
Вторым техническим результатом является способ прайм-буст профилактической иммунизации, предполагающий первичную иммунизацию БЦЖ и бустирующую интраназальную иммунизацию вакциной на основе штамма A/PR8/NS124-TB10.4-2А-HspX, которая обеспечивает протективный эффект, существенно превышающий защитное действие вакцины М. bovis БЦЖ, и может быть использована для специфической профилактики туберкулеза легких.
Сущность изобретения поясняется с помощью графических изображений:
Фиг. 1, на которой представлена структура гена NS рекомбинантного вакцинного штамма A/PR8-NS124-TB10.4-2A-HspX. (А) Схема открытых рамок считывания в гене NS. (Б) Последовательность белка, кодируемого открытой рамкой считывания NS1. Жирным шрифтом выделен укороченный белок NS 1(1-124 а.о.), курсивом отмечены глициновые линкеры, подчеркнуты последовательности белков ТВ10.4 и HspX, красная стрелка отмечает место разрезания в сайте 2А, перед белком HspX вставлен сигнальный пептид мышиного IgK.
Фиг. 2, на которой приведена электрофореграмма продуктов амплификации продуктов ОТ-ПЦР с кДНК копий химерного гена NS пассажных вариантов V4 и Е1 рекомбинантного вакцинного штамма A/PR8-NS124-TB10.4-2A-HspX относительно маркера молекулярного веса (ММ).. Стрелкой отмечен целевой ОТ-ПЦР-фрагмент.
Фиг 3., на которой показана экспрессия химерного белка NS1-TB10.4-HspX в клетках MDCK, инфицированных пассажными вариантами вакцинного штамма A/PR8-NS124-TB10.4-2A-HspX. Дорожка 1 - неинфицированные клетки; дорожка 2 - клетки, инфицированные вектором A/PR8-NS124 без вставки; дорожка 3 - клетки, инфицированные вирусом A/PR8-NS124-TB10.4, кодирующим только антиген ТВ10.4; дорожки 4-10 - клетки, инфицированные различными пассажными вариантами штамма A/PR8-NS124-ТВ10.4-2A-HspX.
Фиг. 4, на которой приведен результат масс-спектрометрического анализа экспрессии антигенов М. tuberculosis ТВ10.4 и HspX в клетках, инфицированных вакцинным штаммом A/PR8-NS124-ТВ10.4-2A-HspX. (А) Фрагменты геля, отправленные на анализ. Дорожка 1 - инфицированные клетки; дорожка 2 - контрольные клетки. (Б) Фрагмент MALDI масс-спектра, по которому идентифицировали фрагменты химерного белка NS1-TB10.4-HspX. Отмечены ионы, найденные в последовательности белка: указаны их соотношения m/z и номера соответствующих им аминокислот. Величина Score составила 108 при пороговом значении 61 (р<0.05).
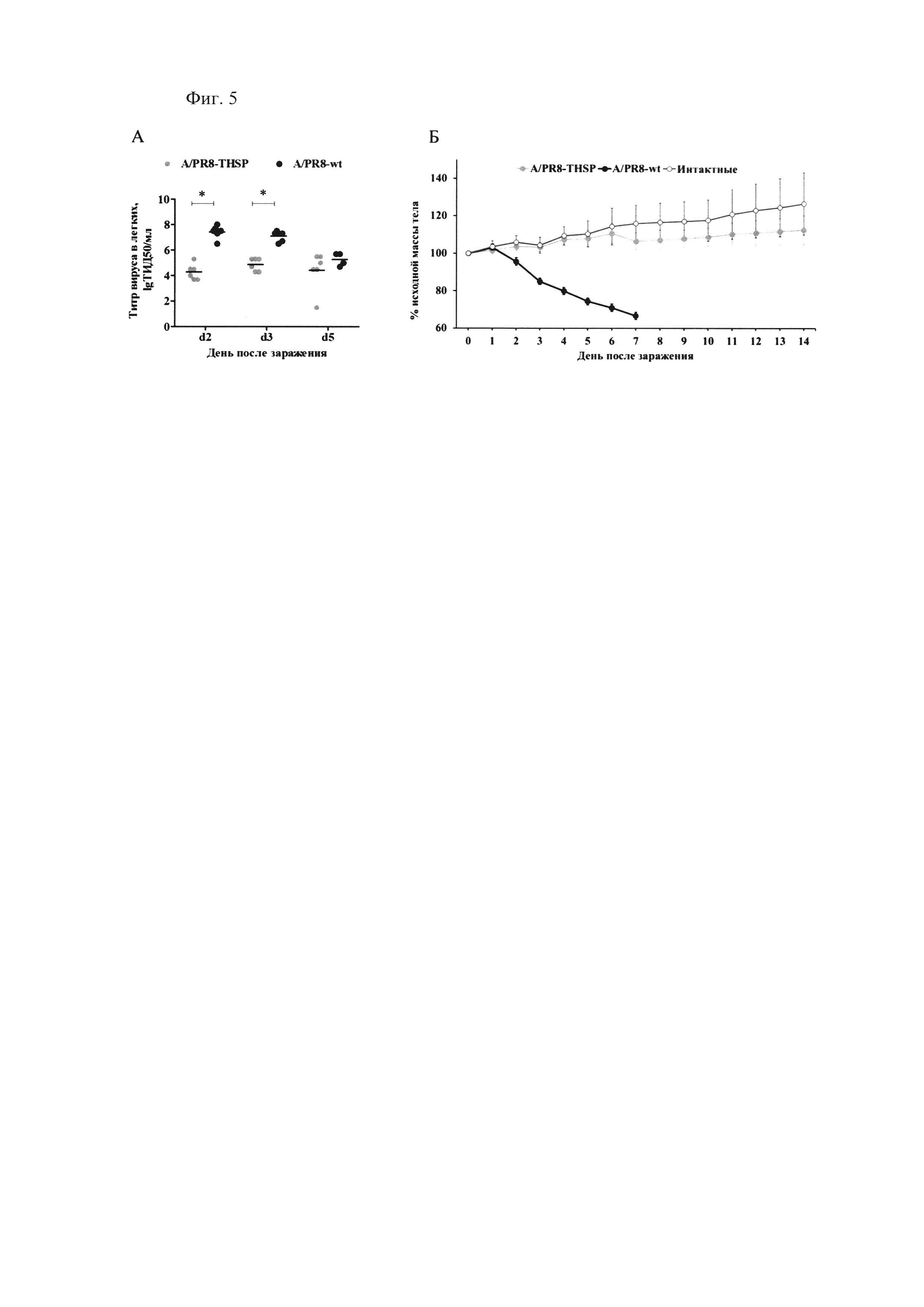
Фиг. 5., которая демонстрирует аттенуацию вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX по сравнению с патогенным для мышей вирусом гриппа «дикого типа» A/PR/8/34(H1N1). Репликация вирусов в легких инфицированных мышей (А) и динамика массы тела мышей (Б) после заражения вакцинным штаммом A/PR8-NS124-ТВ10.4-2А-HspX [обозначен A/PR8-THSP], вирусом гриппа «дикого типа» A/PR/8/34(H1N1) [обозначен A/PR8-wt] и интактными животными [Контроль] (*р<0.001, многофакторный дисперсионный анализ с апостериорным критерием Бонферони).
Фиг. 6, которая демонстрирует стимуляцию выработки антиген специфичных эффекторных Т-клеток памяти в селезенке мышей через 8 дней после интраназальной иммунизации вакцинным штаммом A/PR8-NS124-ТВ10.4-2A-HspX [A/PR8-THSP] в сравнении с интактными животными [Контроль]. Показано относительное содержание (%) эффекторных Т-клеток памяти, продуцирующих IFNγ, TNFα, IL-12, после 24-часовой стимуляции БЦЖ (A) CD4+CD44+CD62L- лимфоциты. (Б) CD8+CD44+CD62L-лимфоциты. (** р<0.01, *** р<0.001, n=5, критерий Стьюдента).
Фиг. 7, которая демонстрирует распространенность очагов специфического воспаления в легких мышей при заражении мышей M.tuberculosis H37Rv. Показаны микрофотографии гистологических срезов легких зараженных мышей; окраска гематоксилином и эозином х 300. (А) - контроль заражения, видны крупные сливающиеся очаги специфической инфильтрации без четкой пространственной ориентации клеток, снижение воздушности легочной ткани. (Б) - вакцинация БЦЖ, определяется крупная гранулема с единичными эпителиоидными клетками в центре, крупный периваскулярный лимфогистиоцитарный инфильтрат и снижение воздушности легочной ткани; (В) - «прайм-буст» вакцинация БЦЖ и вакцинным штаммом A/PR8-NS124-ТВ10.4-2A-HspX, определяется небольшой очаг специфической инфильтрации в легких.
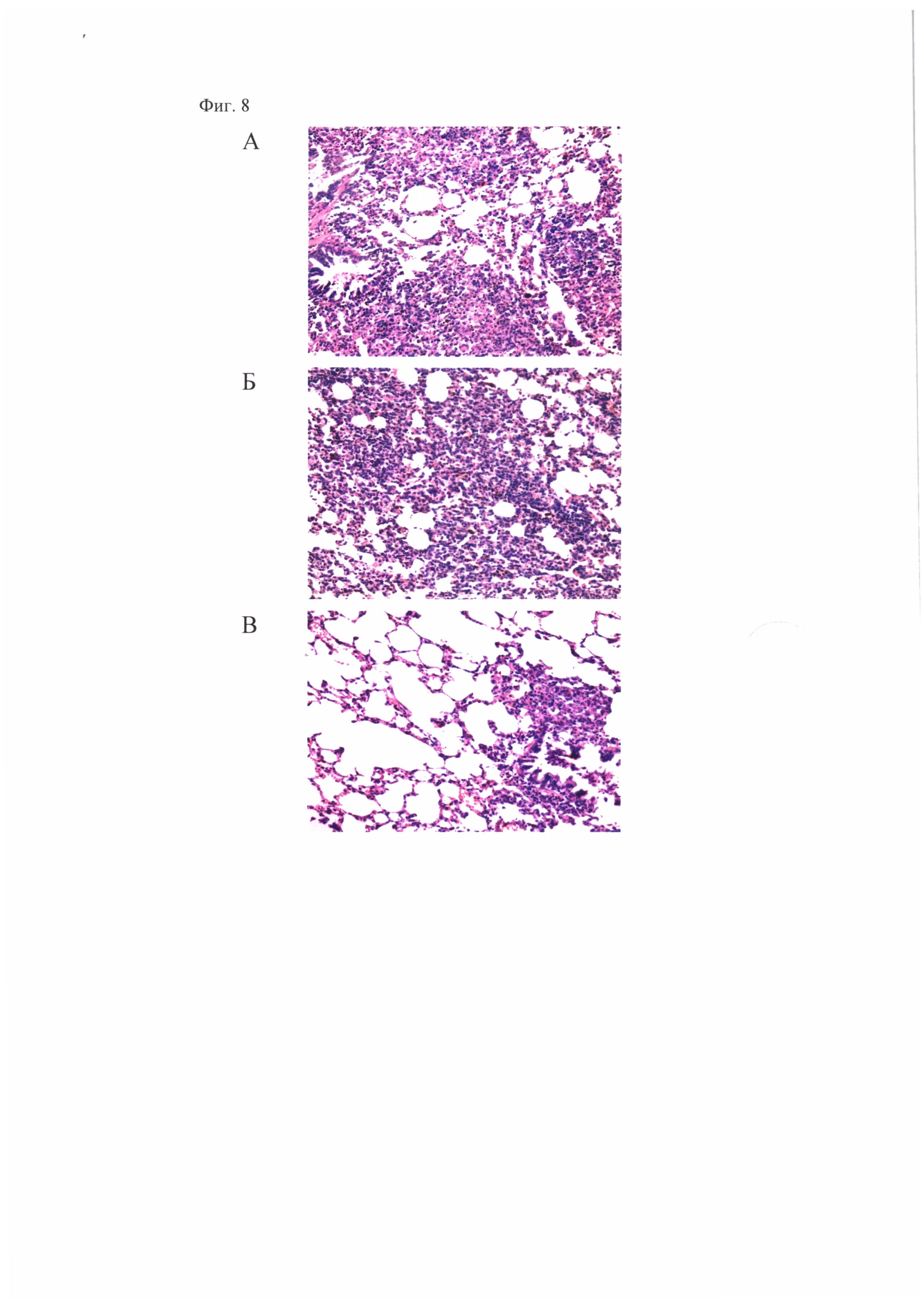
Фиг. 8, которая демонстрирует распространенность очагов специфического воспаления в легких морских свинок при заражении мышей М. tuberculosis H37Rv. Показаны микрофотографии гистологических срезов легких зараженных морских свинок, окраска гематоксилином и эозином х 300. (А) - контроль заражения, видны крупные сливающиеся очаги специфической инфильтрации без четкой пространственной ориентации клеток с некрозом в центре. (Б) - вакцинация БЦЖ, определяется участок специфической инфильтрации. (В) - «прайм-буст» вакцинация БЦЖ и вакцинным штаммом A/PR8-NS124-ТВ10.4-2A-HspX, определяется небольшой перибронхиальный очаг специфической инфильтрации в легких.
Изобретение иллюстрируется следующими примерами:
Пример 1. Способ получения генетически стабильного рекомбинантного вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX
На первом этапе проводили конструирование плазмид для сборки рекомбинантного вируса гриппа. Синтез генетических фрагментов, кодирующих белки вируса гриппа A/PR/8/34 (H1N1), в том числе химерный ген NS со вставкой туберкулезных антигенов выполняли de novo (Евроген, Россия).
В качестве основы для создания химерного гена была использована нуклеотидная последовательность генного сегмента NS вируса гриппа A/PR/8/34 (H1N1), включающая кодирующую, а также 5'-UTR и 3'-UTR некодирующие области (номер последовательности в базе GenBank AF389122). В последовательность были внесены три нуклеотидные мутации (329C→G, 763A→G, 765G→A), обеспечивающие аминокислотные замены в белке NS1 (101D→Е) и NEP (89I→V), повышающие урожайность вируса в системе РКЭ [Horimoto Т, Murakami S, Muramoto Y et al. Virology. (2007) 366: 23]. Открытая рамка считывания NS1 была укорочена до 124 аминокислот, после которых вставлена гетерологичная последовательность, кодирующая антиген ТВ10.4 М.tuberculosis (номер последовательности в базе данных TubercuList: RV0288), отделенная глициновыми линкерами. Далее был вставлен сайт автопротеолиза 2А, сигнал секреции мышиного IgK, после чего вставлена последовательность антигена HspX М.tuberculosis (номер последовательности в базе данных TubercuList: RV2031). Рамка считывания была терминирована кассетой из трех стоп-кодонов. Последующие 30 нуклеотидов генного сегмента NS были удалены и заменены уникальным сайтом рестрикции NotI, оставшиеся 100 нуклеотидов перед началом рамки NS2(NEP) были сохранены для процесса сплайсинга. Карта гена и аминокислотная последовательность химерного белка NS1 представлена на Фиг. 1.
Синтезированные последовательности клонировали в аналог двунаправленного вектора на основе плазмиды pHW2000 [Hoffmann Е, Neumann G, Kawaoka Y, Hobom G, Webster RG. PNAS (2000) 97: 6108].
Полученные плазмиды накапливали в клетках E.coli DH5alpha и очищали с использованием набора реагентов Endofree Maxi Kit (Qiagen) для выделения плазмид, свободных от эндотоксина. Нуклеотидные последовательности плазмид верифицировали секвенированием по Сенджеру с использованиемследующих праймеров:
INS-F: 5'TggCTAACTAgAgAACCCACTgCTTACTg
INS-R: 5'CTAgAAggCACAgTCgAggCTgATC (Syntol, Россия)
На втором этапе набором из полученных плазмид (по 1 мкг каждой) трансфецировали клетки Vero (АТСС CCL-81), адаптированные к росту в бессывороточной среде OptiPro SFM (Gibco). Для одной трансфекции использовали 3*106 клеток, ресуспендированных в 100 мкл смеси буферов из набора Nucleofector Kit V (Lonza). Электропорацию проводили с использованием Amaxa Nucleofector II (Lonza) по программе U-020.
В течение суток после трансфекции клетки Vero образовали плотный монослой. Через 2 суток в сформировавшемся монослое наблюдали начало развития цитопатического действия (ЦПД) вируса. Через 3 суток разрушение монослоя составило 100%. Культуральная жидкость содержала штамм A/PR8/NS124-ТВ 10.4-2A-HspX (пассаж V0).
Для повышения генетической стабильности вируса A/PR8/NS124-ТВ10.4-2A-HspX был проведен ряд последовательных клонирований вируса в клетках Vero методом предельных разведений. Контроль генетической стабильности проводили методом ОТ-ПЦР, определяя размер гетерологичной вставки в генном сегменте NS.
Клетки Vero в 48-луночных планшетах заражали падающими 10-кратными разведениями вирусного материала в поддерживающей среде OptiPro с добавлением 2% GlutaMax (Gibco) и 1 мкг/мл TPCK-трипсина (Sigma). Через 1 час после инкубации с инокулятом (200 мкл/лунку), его удаляли, а в лунки вносили 1,0 мл поддерживающей среды. Планшеты инкубировали в течение 72 ч при +37°С, после чего регистрировали ЦПД. Вирусный материал из лунок, соответствующих наибольшим разведениям, в которых развилось ЦПД, анализировали методом ОТ-ПЦР анализа.
Вирусную РНК выделяли из 140 мкл вируссодержащей жидкости с использованием набора QIAmpViral RNA kit (Qiagen). ОТ-ПЦР проводили «одношаговым» методом с использованием набора реагентов AgPath-ID One-Step RT-PCR Reagents (Ambion, США). Предварительно проводили отжиг праймера для обратной транскрипции: смешивали 2 мкл РНК и 2 мкл праймера Uni12 (100 пмоль/мкл, Beagle, Россия) [Zhou В, Donnelly ME, Scholes DT et al. J Virol. (2009) 83: 10309], затем инкубировали при 70°C в течение 4 мин, после чего охлаждали во льду.
Состав реакционной смеси для ОТ-ПЦР включал следующие компоненты:
|
Общий объем реакции 25 мкл
Последовательности использованных праймеров представлены ниже:
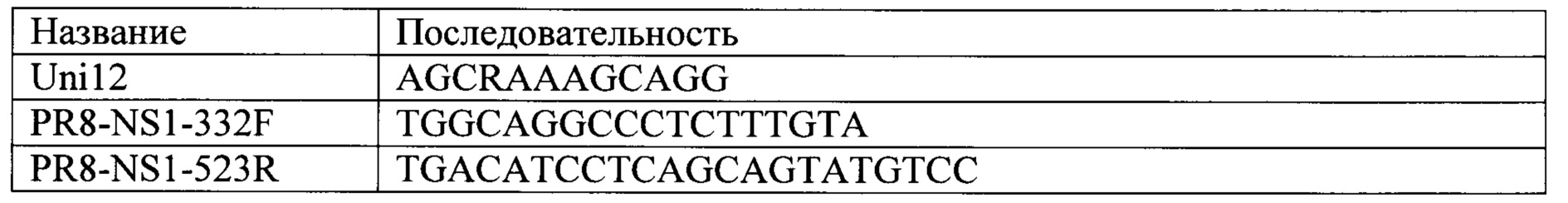
Термальный профиль реакции включал следующие стадии:
1: 42°С - пауза
2: 42°С - 60 мин
3: 95°С - 15 мин
4: 95°С - 15 с
5: 58°С - 30 с
6: 72°С - 1 мин
7: Переход к 4, повтор 39 раз
8: 72°С - 5 мин
9:8°С - хранение
Для анализа результатов ОТ-ПЦР проводили горизонтальный электрофорез (ЭФ) образцов в 2% агарозном геле (Thermo Scientific, США) в 1X ТВЕ буфере (Thermo Scientific, ЕС), содержащем 5 мкг/мл бромистого этидия (Ethidium Bromide, Amresco, США). В качестве маркера молекулярного веса использовали М28 (Сибэнзим, Россия). ЭФ проводили в камере SE-2 (Helicon, Россия) при 150 В в течение 1,5 часов. Для детекции результатов ЭФ использовали систему гель-документирования ChemiDoc (Bio-Rad, США).
Вирусный материал, для которого размер амплифицируемого фрагмента гена NS соответствовала размеру фрагмента, амплифицированного с исходной плазмиды, использовали для последующего клонирования (Фиг. 2). После клонирования V4 гетерогенность популяции штамма была минимизирована и последующие пассажи проводили в системе развивающихся куриных эмбрионов (РКЭ).
РКЭ заражали рядом падающих разведений вирусного материала на фосфатно-солевом буфере DPBS с добавлением 100 ед/мл пенициллина/100 мкг/мл стрептомицина и 5 мкг/мл амфотерицина Б (Биолот, Россия). РКЭ заражали в аллантоисную полость по 0,2 мл материала и инкубировали при температуре 34°С в течение 48 ч. Затем РКЭ охлаждали и вскрывали. Наличие вируса в аллантоисной жидкости определяли по положительной реакции гемагглютинации (РГА) в объеме 50 мкл с эквивалентным количеством 0,5% суспензии куриных эритроцитов. Контроль размера гетерологичной вставки в гене NS проводили как описано выше. Инфекционную активность вируса подсчитывали по методу Рида-Менча (Reed, Muench, 1938).
В результате были определены условия культивирования генетически стабильного варианта вируса A/PR8-NS124-ТВ 10.4-2A-HspX, заключающиеся в использовании малой заражающей дозы (1-10 ЭИД50 на эмбрион), при которых штамм был стабилен на протяжении 5 последовательных пассажей.
Пример 2. Характеристика репродуктивных свойств вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX в различных субстратах накопления
Для характеристики репродуктивных свойств штамма A/PR8-NS124-ТВ10.4-2А-HspX определяли его инфекционную активность в культуре клеток Vero, MDCK и в РКЭ. Заражение проводили методом, аналогичным описанному выше для клонирования, инфекционную активность выражали в lg 50%-ной инфекционной дозы, которую подсчитывали по методу Рида-Менча (Reed, Muench, 1938). В качестве поддерживающей среды для клеток MDCK (IRR FR-58) использовали среду DMEM с добавлением 100 ед/мл пенициллина/100 мкг/мл стрептомицина/2,5 мкг/мл амфотерицина Б (Биолот, Россия). Для изучения температурочувствительного (ts) фенотипа вирус титровали в РКЭ при двух температурах инкубации 34°С и 39°С. Критерием температурочувствительности считали разницу в инфекционной активности при температурах 34°С и 39°С не менее 3 lg ЭИД50/мл.
Результаты изучения репродуктивных свойств вакцинного штамма A/PR8/NS124-ТВ10.4-2A-HspX представлены в Таблице 1. Вакцинный штамм A/PR8/NS124-ТВ10.4-2А-HspX характеризуется высокой инфекционной активностью во всех изученных субстратах, а также температурочувствительностью, поскольку разница в репродукции при оптимальной и повышенной температурах (RCT34/39) составила 3,53 lg ЭИД50мл.

Пример 3. Определение аттенуации вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX на лабораторных мышах
Определение аттенуации проводили на мышах С57/black. Животным интраназально вводили 6 lgЭИД50 вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX в объеме 30 мкл под легким эфирным наркозом. В качестве положительного контроля (патогенный, не аттенуированный вирус) использовали вирус гриппа A/PR/8/34 «дикого типа», который вводили в дозе 5 lgЭИД50/мышь. Отрицательным контролем была группа интактных животных. Массу тела животных контролировали ежедневно. В дни 2, 3 и 5 после заражения по 6 животных в группе (кроме интактных) подвергали эвтаназии и извлекали легкие для определения вирусной нагрузки. Легкие гомогенизировали в фосфатно-солевом буфере для получения 10% суспензии, которую титровали в клетках MDCK, как описано в Примере 2.
Мыши, зараженные вирусом гриппа «дикого типа», в течение эксперимента демонстрировали значительное снижение массы тела (более 25%) и высокий уровень смертности (80%). В то же время у мышей, зараженных вакцинным штаммом A/PR8/NS124-ТВ10.4-HspX, данные показатели были на уровне контрольных животных (Фиг. 5Б). Кроме того, вирусная нагрузка в легких на 2, 3 и 5 дни после инфекции у мышей, зараженных вакцинным штаммом, была значительно ниже, отличаясь на 2,2-3,1 lgТИД50 от уровня репродукции вируса «дикого» типа (день 3 и день 2, соответственно (фиг. 5А). Таким образом, было показано, что вакцинный штамм A/PR8/NS124-ТВ10.4-HspX обладает аттенуированным фенотипом по сравнению с вирусом гриппа «дикого» типа.
Пример 4. Определение экспрессии белков ТВ10.4 и HspX при заражении рекомбинантным штаммом A/PR8-NS124-TB10.4-2A-HspX клеток MDCK
Для оценки экспрессии химерного белка NS1, содержащего вставку антигенов ТВ10.4 и HspX, клетки MDCK в 6-луночных планшетах инфицировали вакцинным штаммом и контрольными вирусами в дозе 10 ТИД50/клетку, или не инфицировали (отрицательный контроль), и инкубировали при +37°С, 5% CO2. Через 6 часов клетки промывали DPBS (Биолот), снимали 0,25% Trypsin-EDTA (Gibco) и центрифугировали. Клетки в осадке лизировали нагреванием при 100°С в течение 7 минут в 80 мкл 1х буфера Лэммли (Bio Rad). Белки из 5 мкл образца разделяли с помощью денатурирующего электрофореза в полиакриламидном геле (Any kD Precast Gel, Bio-Rad) и проявляли окрашиванием геля с помощью Coomassie blue (Serva) или переносили из геля на нитроцеллюлозную мембрану (Bio Rad) и проявляли моноклональными антителами 1Н7, направленными против NS1 [Krivitskaya, V.Z., Sorokin, E.V., Tsareva, T.R. et al. Appl Biochem Microbiol (2018) 54: 756].
Результаты изучения экспрессии белков иллюстрирует Фиг. 3. Для всех исследованных пассажных вариантов вируса A/PR8/NS124-ТВ 10.4-2A-HspX была зафиксирована экспрессия химерного белка NS1 с двойной гетерологичной вставкой, масса которого совпадала с теоретически рассчитанной (полоса в районе 45кДа на Фиг. 3). Также зафиксирована экспрессия укороченного химерного антигена NS1 с одинарной гетерологичной вставкой ТВ10.4, образованного после автопротеолиза по 2А сайту (полоса в районе 25 кДа на Фиг. 3). В качестве контролей использовали вирус без вставки A/PR8/NS124 (расчетная молекулярная масса белка NS1 - 14,2 кДа), а также вирус со вставкой одного антигена A/PR8/NS124-ТВ10.4 (расчетная масса химерного белка NS124-ТВ10.4 - 24,7 кДа), для которых также показана экспрессия соответствующих белковых продуктов. Таким образом продемонстрирована экспрессия полноразмерного химерного белка NS124-ТВ10.4-2A-HspX при заражении клеток векторным вакцинным штаммом A/PR8/NS124-ТВ10.4-2A-HspX, которая была стабильна на протяжении нескольких пассажей в РКЭ.
Для точной идентификации белков ТВ10.4 и HspX с помощью масс-спектрометрического анализа полосу химерного белка NS124-ТВ 10.4-2A-HspX вырезали из геля и отмывали от красителя (дважды по 30 мМ NH4HCO3, 40% ацетонитрила и затем 100% ацетонитрила). К высушенному кусочку геля добавляли 2 мкл трипсина (20 мкг/мл Sequence grade modified trypsin porcine (Promega) в 50 мМ NH4HCO3) и инкубировали в течение 24 часов при 37°С. Реакцию останавливали раствором 10% ацетонитрила, 0,5% трифторуксусной кислоты. Полученные после трипсинолиза образцы смешивали с матрицей НССА (а-циано-4-гидроксикоричная кислота, Bruker, Германия) и наносили на мишень GroundSteel (Bruker, Германия). Спектр триптических пептидов получали на масс-спектрометре «ultrafieXtreme» (Bruker, Германия) в режиме регистрации положительных ионов. Для каждого спектра суммировали не менее 5000 импульсов лазера. Идентификацию белков осуществляли с использованием поисковой машины MASCOT (matrixscience.com). Аминокислотная последовательность рекомбинантного белка была добавлена в локальную базу данных. Идентификацию белков проводили с использованием MASCOT (matrixscience.com) и одновременном доступе к базе данных SwissProt (www.uniprot.org) и локальной базе данных. В качестве вариабельных модификаций при поиске учитывали окисление метионинов. Величину ошибки m/z принимали не более 50 ррт. Основные белки (например, актин) исключали при предварительной обработке спектров.
В зоне электрофоретической подвижности, приблизительно соответствующей 45 кДа, были достоверно идентифицированы фрагменты полноразмерного белка NS1-TB10.4-HspX. В зоне 26 кДа были идентифицированы фрагменты белка NS1-TB10.4 (Фиг. 4, Табл. 2). Таким образом, мы подтвердили внутриклеточную экспрессию полноразмерных туберкулезных антигенов ТВ10.4 и HspX при инфицировании клеток вакцинным штаммом A/PR8/NS124-TB10.4-HspX.

Пример 5. Определение иммуногенности вакцинного штамма A/PR8-NS124-ТВ10.4-2-A-HspX на лабораторных мышах
Идентификацию антиген-специфических субпопуляций CD4+ и CD8+ Т-лимфоцитов проводили, определяя уровень экспрессии на их поверхности молекул CD44 (маркер Т-клеток памяти у мышей) и CD62L (рецептор хомминга, способствущий миграции Т-клеток во вторичные лимфоидные органы).
Мышей C57/black иммунизировали интраназально в дозе 6,0 lgЭИД50 вакцинного штамма A/PR8/NS124-ТВ10.4-HspX, группой контроля были интактные животные. Анализ адаптивного Т-клеточного иммунного ответа проводили в селезенках, собранных через 8 дней после иммунизации. Выделенные спленоциты стимулировали БЦЖ (5 мкг/мл) в течение 24 часов при 37°С, 5% CO2. За 6 часов до окончания стимуляции добавляли реагент GolgiPlug (BD Biosciences, США). В качестве отрицательного и положительного контроля использовали культуральную среду без и с добавлением PMA/Ionomycin (Sigma) соответственно. Фенотипирование Т-клеток проводили с использованием набора антител, конъюгированных с флуорохромами со следующей специфичностью: CD4-PerCP-Cy5.5, CD8-PE/Cy7, CD62L-APC/Cy7 и CD44-BV421 (BioLegend, США). Внутриклеточную продукцию цитокинов оценивали с использованием антител против IFNγ-FITC, IL2-PE и TNFα-BV510 (BioLegend, США). Окрашивание для выявления внутриклеточных маркеров проводили с использованием набора Cytofix/Cytoperm (BD Biosciences, США). Мертвые клетки идентифицировали с использованием маркера жизнеспособности Zombie Red (BioLegend, США). Для блокирования неспецифического связывания антител клетки предварительно окрашивали реагентом True Stain (BioLegend, США), содержащим антитела к CD16/CD36. Данные собирали на проточном цитометре Cytoflex (Beckman Coulter, США). Результаты анализировали с использованием программы Kaluza Analysis 2.2 (Beckman Coulter, США).
Показано, что в отличие от контрольных мышей, интраназальная иммунизация вакцинным штаммом A/PR8/NS124-ТВ10.4-HspX приводила к достоверному повышению относительного количества как CD4+, так и CD8+ цитокин-продуцирующих эффекторных Т-клеток памяти с фенотипом CD44hlghCD62Llow (Tem) в пуле спленоцитов иммунизированных животных в ответ на специфическую стимуляцию (Фиг. 6А, Б). Феномен генерации и длительного существования клеток памяти в организме лежит в основе всех известных на сегодняшний день методов эффективной вакцинации.
Пример 6. Определение защитной эффективности схемы «прайм-буст» иммунизации с помощью БЦЖ и мукозальной вакцины на основе рекомбинантного вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX на модели мышей
Для оценки защитной эффективности схемы прайм-буст иммунизации с помощью БЦЖ и мукозальной вакцины на основе рекомбинантного вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX использовали мышей С57/Black/6 (самцы) массой 18-20 г, полученных из питомника «Столбовая» ФГБУН НЦБМТ ФМБА России (Московская область). Схема иммунизации животных включала праймирование стандартной вакциной БЦЖ (105 КОЕ/животное подкожно, однократно) и бустирование мукозальной вакциной, содержащей 106,0 ЭИД50 рекомбинантного штамма A/PR8-NS124-ТВ10.4-2A-HspX (30 мкл, интраназально, под легкой эфирной анестезией) через 5,5 месяцев после вакцинации БЦЖ. Животным группы контроля вводили эквивалентный объем 0,9% NaCl. Инфицирование животных проводили через 6 недель после второй вакцинации инокуляцией в латеральную хвостовую вену 106 КОЕ культуры М. tuberculosis H37Rv, полученной из Государственного НИИ стандартизации и контроля медицинских биологических препаратов им. Тарасевича.
Оценку протективного эффекта выполняли через 5 недель после инфицирования по следующим показателям: индекс поражения легких, массовые коэффициенты легких и селезенки, высеваемость микобактерий из легких, гистологическая оценка распространенности туберкулезного процесса в легких.
Индекс поражения легких устанавливали визуальной оценкой совокупности экссудативных и продуктивных изменений и выражали в баллах (максимально 5 баллов).
Экссудативные изменения:
- легкие воздушны - 0
- единичные безвоздушные очаги - 0,25
- легкие безвоздушны на 1/2 - 0,5
- легкие безвоздушны на 2/3 - 0,75
- легкие безвоздушны на всем протяжении - 1,0
Продуктивные очаги:
- единичные субмилиарные очаги - 0,5
- многочисленные (не более 20) - 1,0
- многочисленные субмилиарные (более 20) - 1,5
- единичные милиарные - 1,75
- многочисленные сливающиеся субмилиарные и единичные милиарные - 2,0
- многочисленные милиарные (не более 10) - 2,25
- многочисленные милиарные, сливающиеся - 2,75
- появление мелких казеозных некротических фокусов - 3,0
- обширный казеоз - 4,0
- сплошное поражение легких - 5,0
Высев микобактерий из гомогенатов ткани легких и селезенки проводили на плотную яичную среду Левенштейна-Йенсена методом серийных разведений. Титр микобактерий выражали в десятичных логарифмах (lg) от числа колониеобразующих единиц (КОЕ) на массу легких. Нижняя граница чувствительности метода составляла 2×10 КОЕ. Положительным эффектом по задержке роста микобактерий считали снижение высеваемости по сравнению с группой контроля на ≥0,5 lg КОЕ.
Гистологическое исследование легких проводили на парафиновых срезах, окрашенных гематоксилином и эозином, с помощью эргономичного микроскопа «Olympus ВХ45», снабженного программным обеспечением «Olympus DP-Soft».
Сравнение показателей тяжести течения туберкулезной инфекции у мышей показало наиболее выраженный защитный эффект схемы «прайм-буст» вакцинации, который достоверно превышал защитный эффект БЦЖ. По сравнению с мышами, вакцинированными БЦЖ, в группе «прайм-буст» иммунизированных животных зарегистрировано статистически значимое снижение коэффициентов массы органов и уменьшение индекса поражения легких, который отражает распространенность очагов специфического воспаления (Табл. 3).
Кроме того, вакцинация по схеме «прайм-буст» обеспечила более выраженный клиренс микобактерий, являющийся интегральным показателем протекции при туберкулезной инфекции. В группе мышей, иммунизированных по прайм-буст схеме, уровень обсемененности легких был значимо ниже по сравнению с мышами, иммунизированными только БЦЖ (Табл. 4).

Гистологическое исследование легочной ткани вакцинированных и контрольных мышей показало наличие признаков специфического поражения (сливной инфильтрации, крупных гранулем, снижения воздушности легочной ткани более, чем на 30% площади срезов) в группе контроля заражения и группе, однократно вакцинированной БЦЖ (в меньшей степени) (Табл. 5, Фиг. 7). При этом в группе мышей, вакцинированных по схеме «прайм-буст», перечисленные признаки поражения не были зафиксированы, что свидетельствует о снижении распространенности очагов специфического воспаления.
Таким образом, «прайм-буст» схема иммунизации, предполагающая первичную иммунизацию БЦЖ и бустирующую интраназальную иммунизацию вакциной на основе штамма A/PR8/NS124-ТВ10.4-2A-HspX, на модели мышей обеспечила защитный эффект, существенно превышающий защитное действие вакцины БЦЖ по всем исследованным показателям.

Пример 7. Определение защитной эффективности схемы прайм-буст иммунизации с помощью БЦЖ и мукозальной вакцины на основе рекомбинантного векторного вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX на модели морских свинок
Для оценки защитной эффективности схемы прайм-буст иммунизации с помощью БЦЖ и мукозальной вакцины на основе рекомбинантного векторного вакцинного штамма A/PR8-NS124-ТВ10.4-2A-HspX использовали морских свинок Агути (самцы) массой 200-250 г, полученных из питомника лабораторных животных ФГУП «Рапполово». Схема иммунизации животных включала праймирование стандартной вакциной БЦЖ (105 КОЕ/животное подкожно, однократно) и бустирование мукозальной вакциной, содержащей 106,0 ЭИД50 рекомбинантного штамма A/PR8-NS124-ТВ10.4-2A-HspX (30 мкл, интраназально, под легкой эфирной анестезией) через 5,5 месяцев после вакцинации БЦЖ. Животным группы контроля вводили эквивалентный объем 0,9% NaCl. Инфицирование животных проводили через 6 недель после второй вакцинации подкожным введением в левую паховую область 109 КОЕ культуры М. tuberculosis H37Rv, полученной из Государственного НИИ стандартизации и контроля медицинских биологических препаратов им. Тарасевича.
Оценку протективного эффекта выполняли через 8,5 недель после инфицирования по следующим показателям: суммарный индекс поражения, массовые коэффициенты легких и селезенки; высеваемость микобактерий из легких, гистологическая оценка распространенности туберкулезного процесса в легких. Суммарный индекс поражения устанавливали по совокупности экссудативных и продуктивных изменений в легких, печени, селезенки и лимфатических узлов и выражали в баллах (максимальное значение поражения каждого органа - 4 балла, суммарного индекса 20 баллов). Высеваемость микобактерий и гистологический анализ проводили аналогично методам, описанным в Примере 6.
Визуальная оценка распространенности специфического инфекционного процесса в органах инфицированных морских свинок, предварительно вакцинированных по «прайм-буст» схеме, зафиксировала самый низкий уровень туберкулезного поражения паренхиматозных органов и паховых лимфатических узлов, достоверно отличающийся от группы морских свинок, вакцинированных только БЦЖ и группы контроля (Табл. 6). Отмеченные различия в суммарном индексе поражения были обусловлены меньшей степенью поражения легких, где у иммунизированных по схеме «прайм-буст» морских свинок практически не регистрировались милиарные очаги, и меньшей степенью поражения регионарных паховых лимфоузлов, в которых не наблюдалось некротического поражения. Также в группе морских свинок, иммунизированных по схеме «прайм-буст» зафиксирован самый низкий массовый коэффициент селезенки, который был значимо ниже, чем у вакцинированных только БЦЖ.
Отчетливый протективный эффект был отмечен по уровню обсемененности микобактериями, который был минимальным при «прайм-буст» схеме иммунизации и достоверно отличался как от группы контроля, так и от группы вакцинированных только БЦЖ (Табл. 7).

Анализ гистологических срезов показал, что у морских свинок, праймированных БЦЖ и «буст»-иммунизированных A/PR8-NS124-ТВ10.4-2A-HspX, по сравнению с животными, вакцинированными только БЦЖ, через 8,5 недель после инфицирования M.tuberculosis H37Rv отчетливо выражена задержка специфического поражения легких по снижению распространенности очагов специфического воспаления, отсутствию признаков альтеративного компонента воспалительной реакции (Табл. 8, Фиг. 8).
Таким образом, предложенный способ «прайм-буст» профилактической иммунизации, предполагающий первичную иммунизацию БЦЖ и бустирующую интраназальную иммунизацию вакциной на основе штамма A/PR8/NS124-ТВ10.4-2А- HspX, обеспечивает протективный эффект, существенно превышающий защитное действие вакцины БЦЖ по исследованным показателям, и может быть использован для специфической профилактики туберкулеза легких.
--->
Перечень последовательностей
<110> Smorodintsev Research Institute of Influenza of the Ministry of Health of the Russian Federation
<120> Recombinant influenza virus vector A/PR8-NS124-TB10.4-2A-HspX and a method for the specific prophylaxis of pulmonary tuberculosis using the vector-based mucosal vaccine
<140> 2019123215/20(045355)
<141> 2019-07-18
<160> 1
<210> 1
<211> 405
<212> PRT
<213> Artificial Sequence
<220>
<223> Recombinant chimearic protein consisted of truncated NS1 from
Influenza A virus, antigens TB10.4 and Hspx
from M. tuberculosis and linker sequences
<400> 1
Met Asp Pro Asn Thr Val Ser Ser Phe Gln Val Asp Cys Phe Leu Trp His Val Arg Lys
1 5 10 15 20
Arg Val Ala Asp Gln Glu Leu Gly Asp Ala Pro Phe Leu Asp Arg Leu Arg Arg Asp Gln
25 30 35 40
Lys Ser Leu Arg Gly Arg Gly Ser Thr Leu Gly Leu Asp Ile Glu Thr Ala Thr Arg Ala
45 50 55 60
Gly Lys Gln Ile Val Glu Arg Ile Leu Lys Glu Glu Ser Asp Glu Ala Leu Lys Met Thr
65 70 75 80
Met Ala Ser Val Pro Ala Ser Arg Tyr Leu Thr Asp Met Thr Leu Glu Glu Met Ser Arg
85 90 95 100
Glu Trp Ser Met Leu Ile Pro Lys Gln Lys Val Ala Gly Pro Leu Cys Ile Arg Met Asp
105 110 115 120
Gln Ala Ile Met Gly Gly Met Ser Gln Ile Met Tyr Asn Tyr Pro Ala Met Leu Gly His
125 130 135 140
Ala Gly Asp Met Ala Gly Tyr Ala Gly Thr Leu Gln Ser Leu Gly Ala Glu Ile Ala Val
145 150 155 160
Glu Gln Ala Ala Leu Gln Ser Ala Trp Gln Gly Asp Thr Gly Ile Thr Tyr Gln Ala Trp
165 170 175 180
Gln Ala Gln Trp Asn Gln Ala Met Glu Asp Leu Val Arg Ala Tyr His Ala Met Ser Ser
185 190 195 200
Thr His Glu Ala Asn Thr Met Ala Met Met Ala Arg Asp Thr Ala Glu Ala Ala Lys Trp
205 210 215 220
Gly Gly Gly Gly Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly
225 230 235 240
Pro Met Lys Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro Arg Ser His
245 250 255 260
Gly Met Ala Thr Thr Leu Pro Val Gln Arg His Pro Arg Ser Leu Phe Pro Glu Phe Ser
265 270 275 280
Glu Leu Phe Ala Ala Phe Pro Ser Phe Ala Gly Leu Arg Pro Thr Phe Asp Thr Arg Leu
285 290 295 300
Met Arg Leu Glu Asp Glu Met Lys Glu Gly Arg Tyr Glu Val Arg Ala Glu Leu Pro Gly
305 310 315 320
Val Asp Pro Asp Lys Asp Val Asp Ile Met Val Arg Asp Gly Gln Leu Thr Ile Lys Ala
325 330 335 340
Glu Arg Thr Glu Gln Lys Asp Phe Asp Gly Arg Ser Glu Phe Ala Tyr Gly Ser Phe Val
345 350 355 360
Arg Thr Val Ser Leu Pro Val Gly Ala Asp Glu Asp Asp Ile Lys Ala Thr Tyr Asp Lys
365 370 375 380
Gly Ile Leu Thr Val Ser Val Ala Val Ser Glu Gly Lys Pro Thr Glu Lys His Ile Gln
385 390 395 400
Ile Arg Ser Thr Asn
405
<---