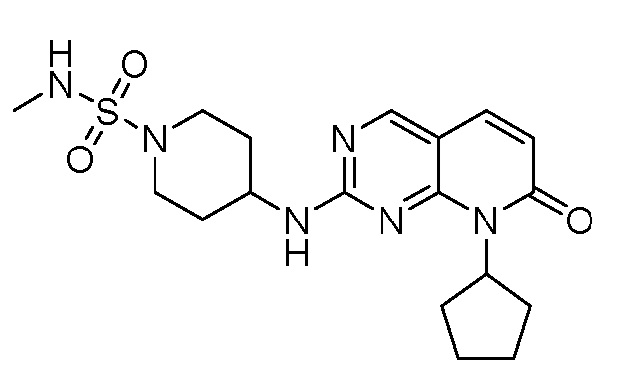
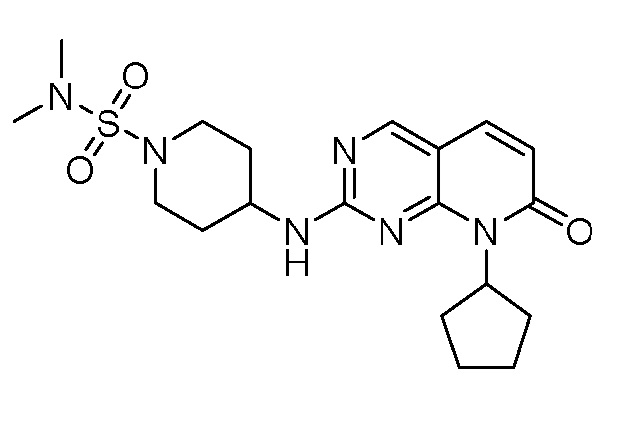
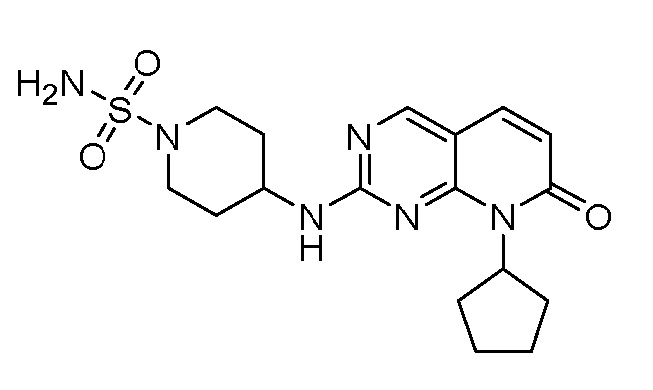
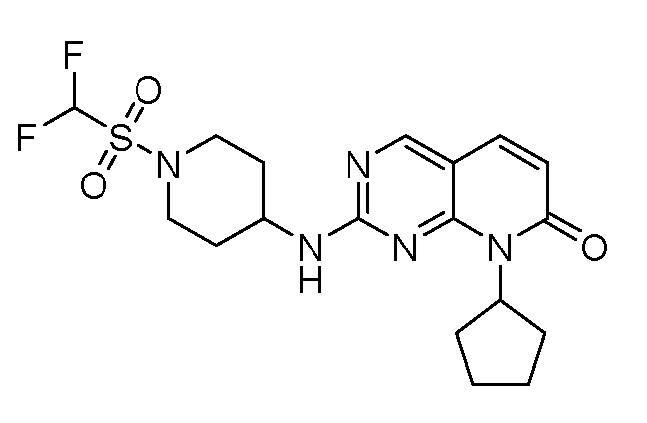
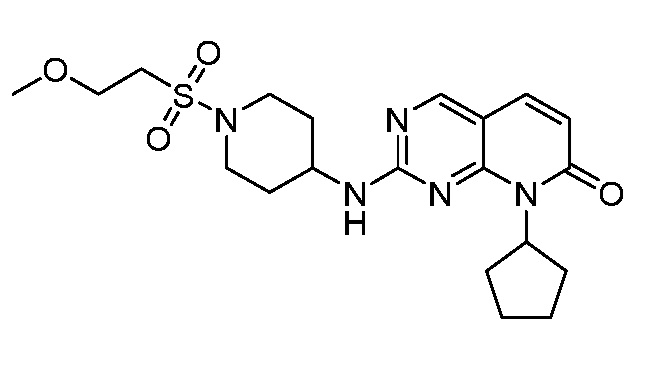
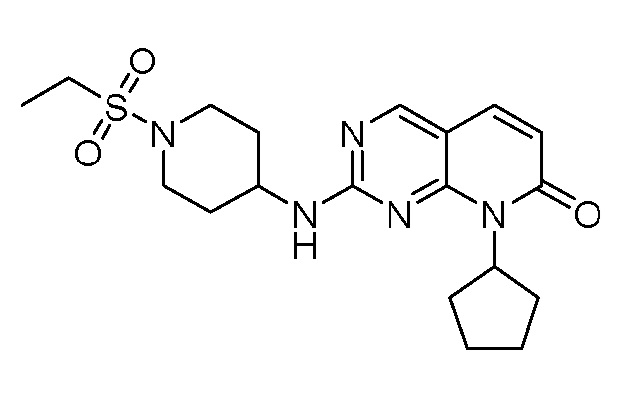
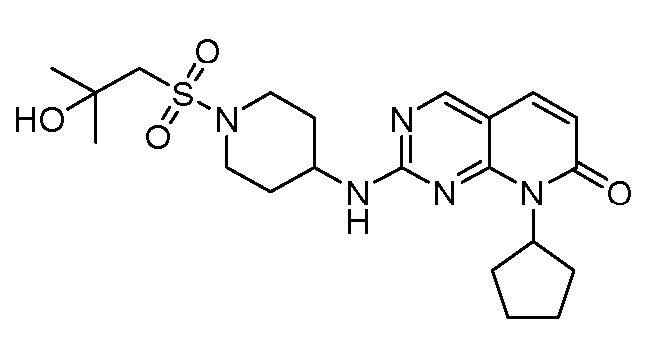
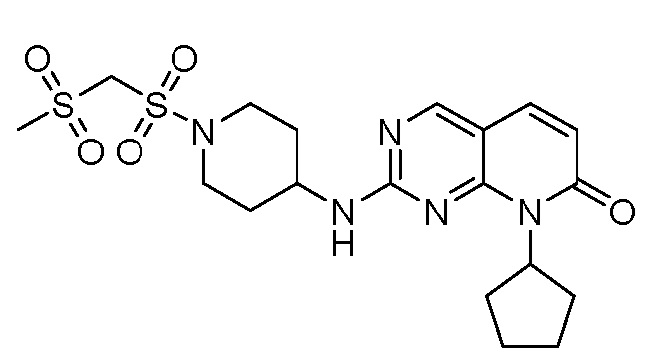
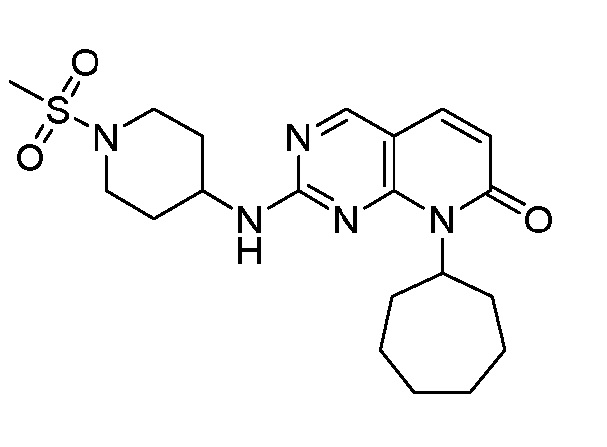
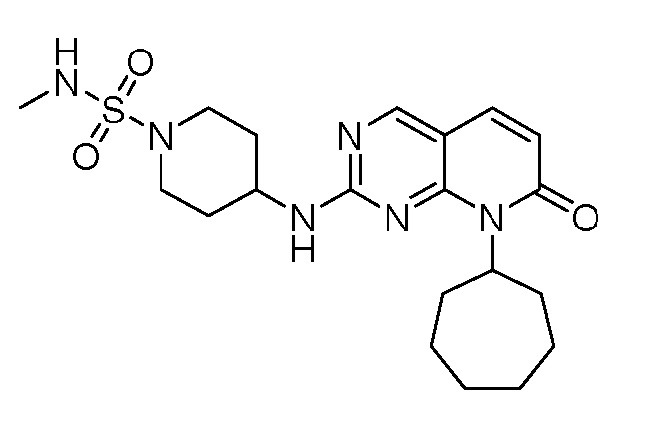
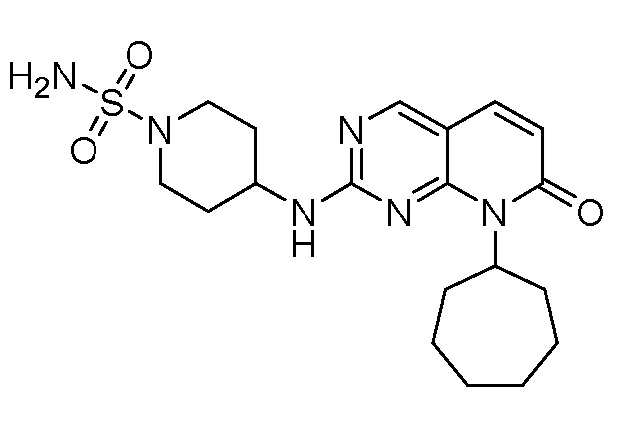
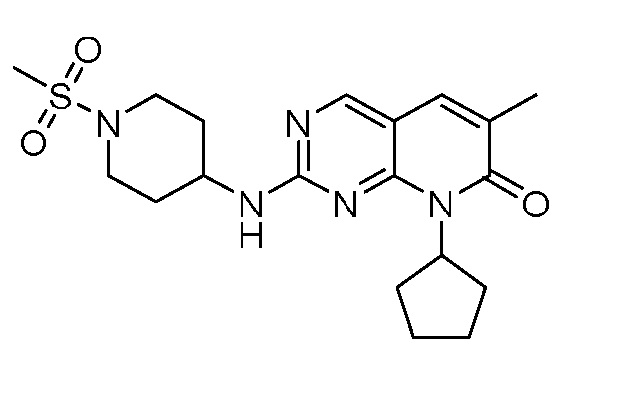
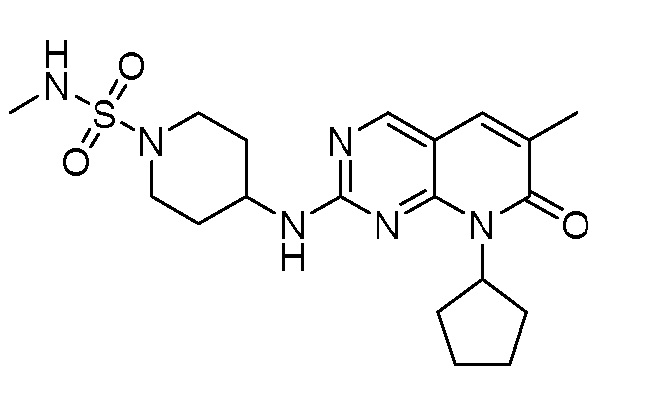
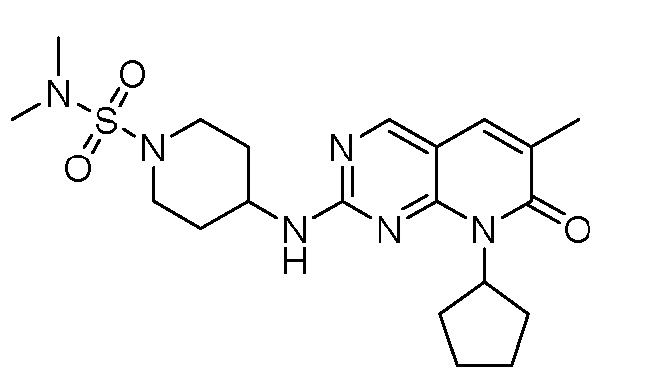
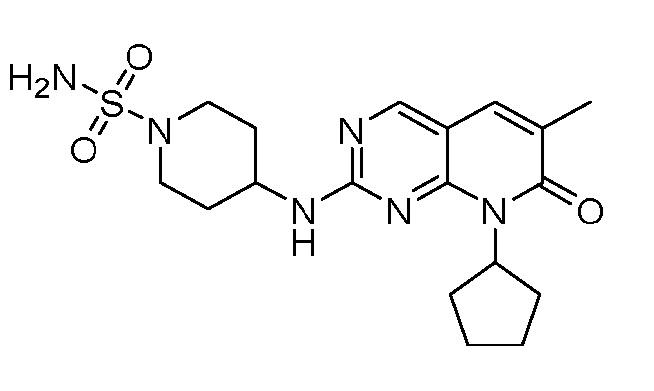
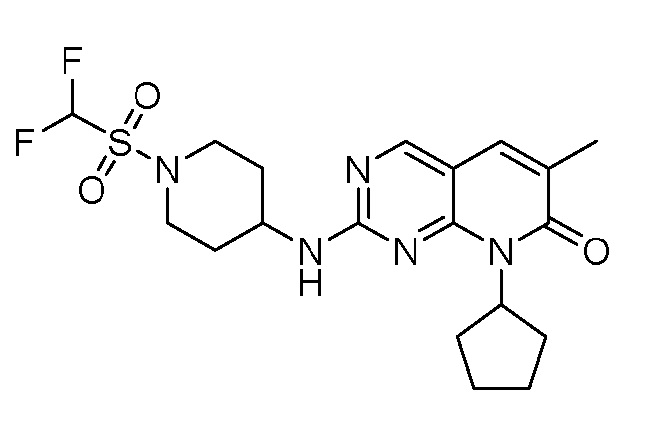
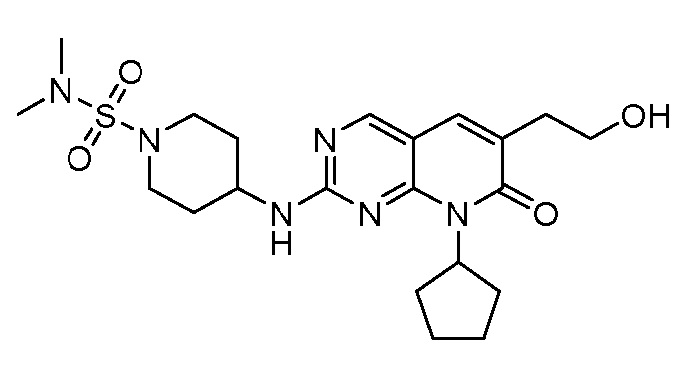
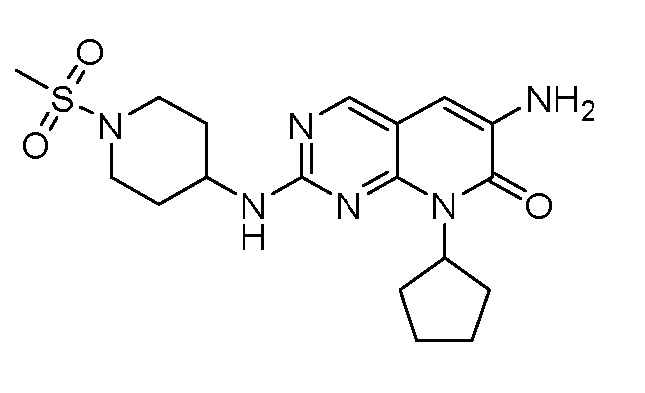
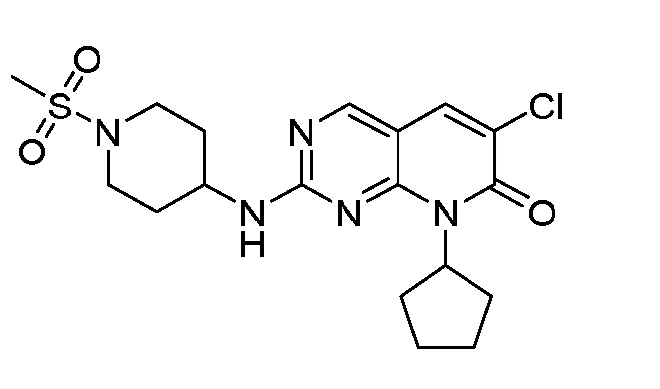
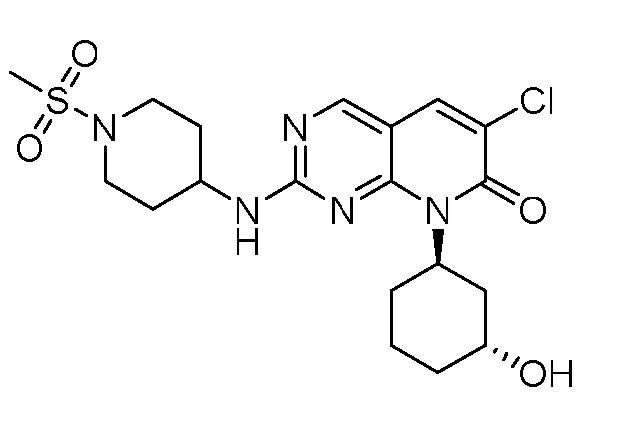
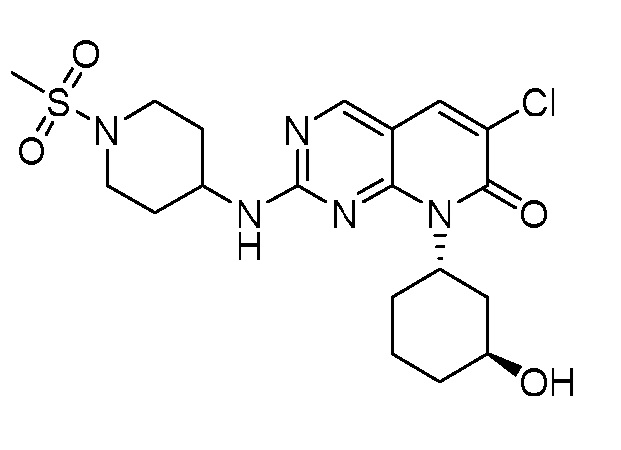
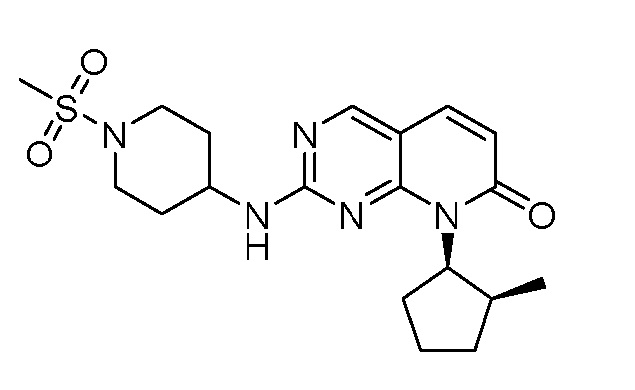
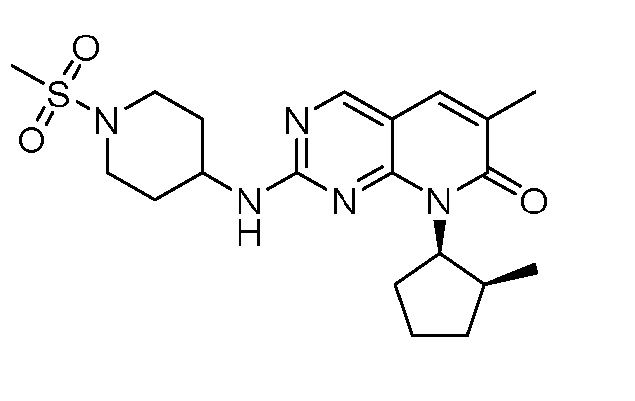
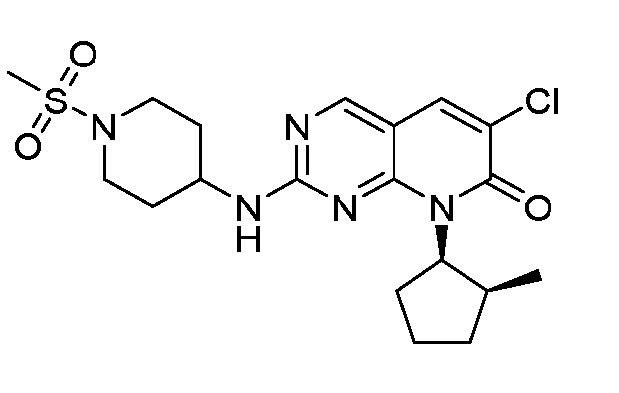
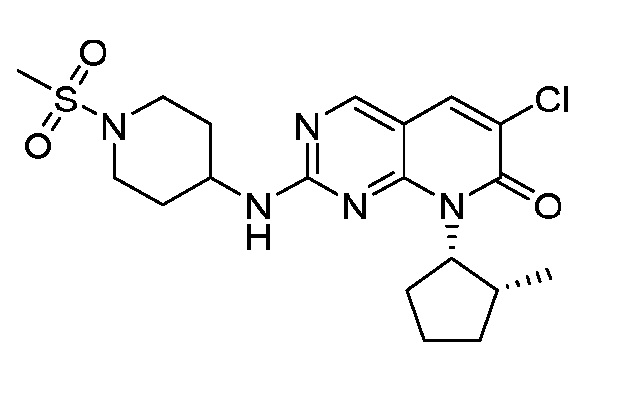
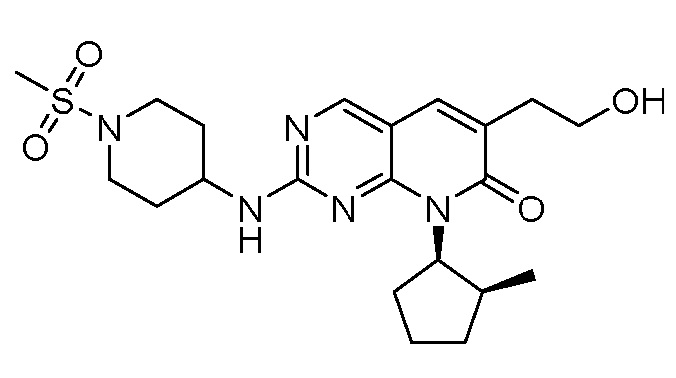
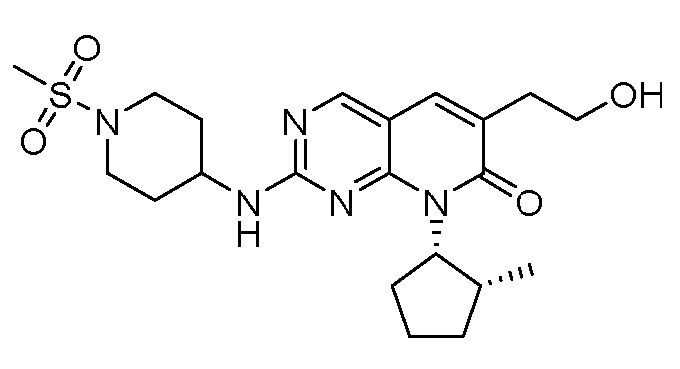
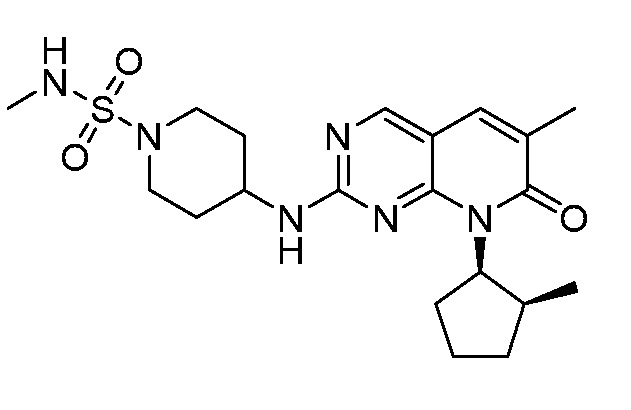
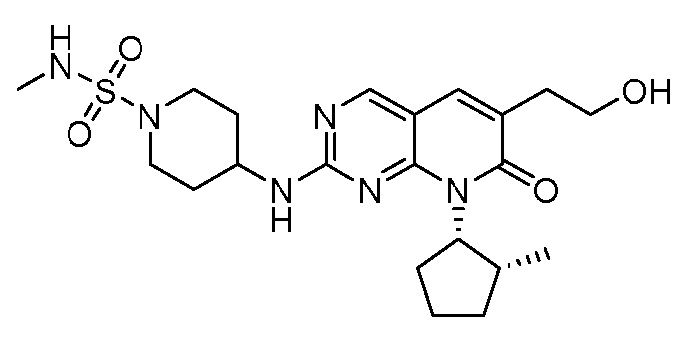
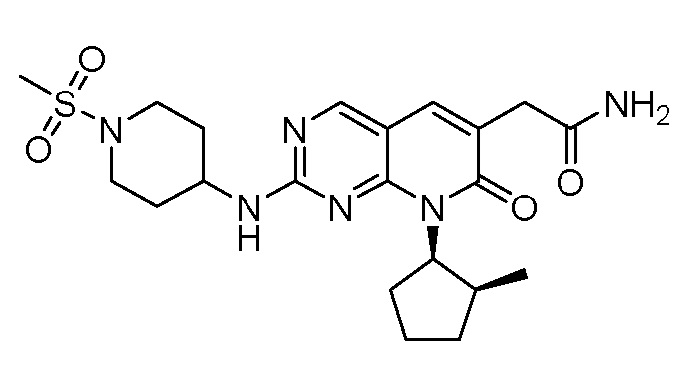
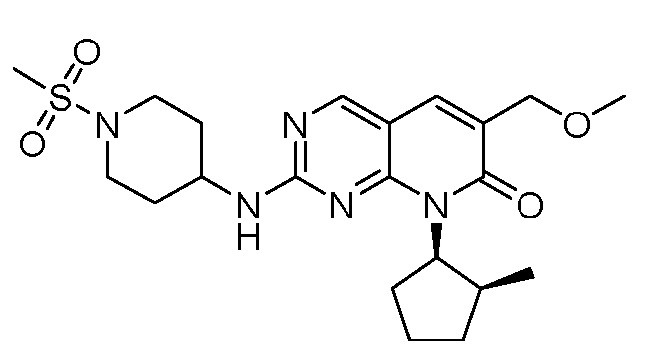
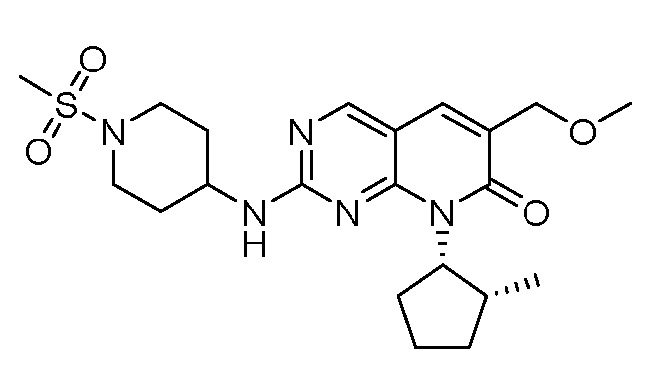
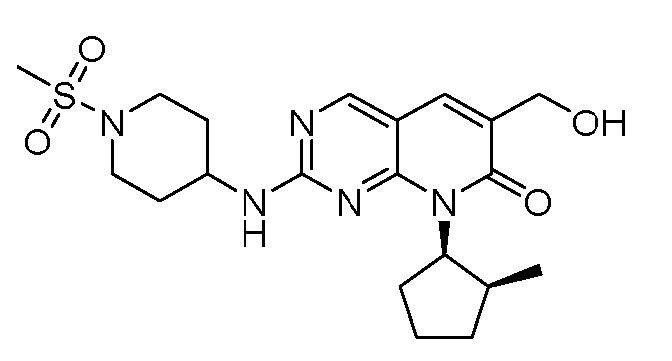
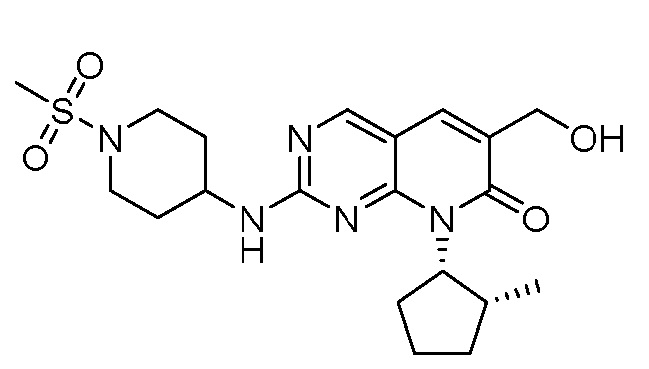
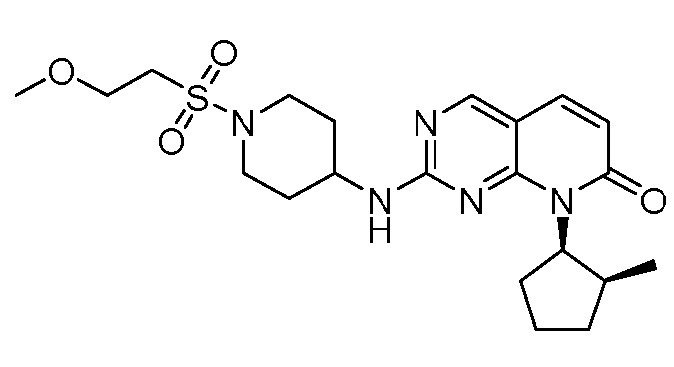
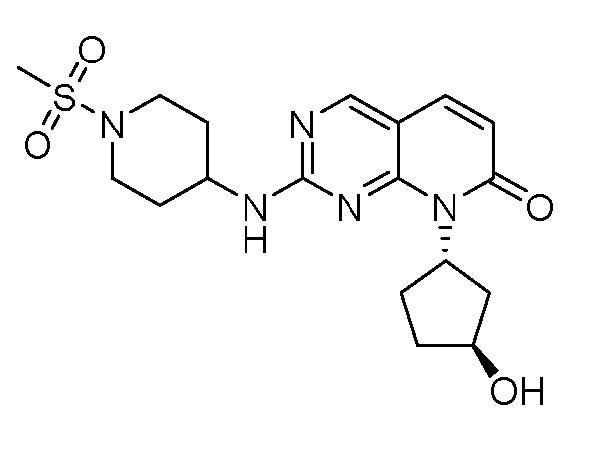
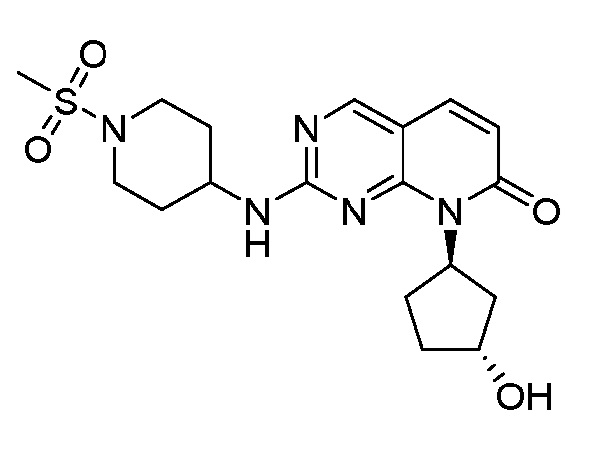
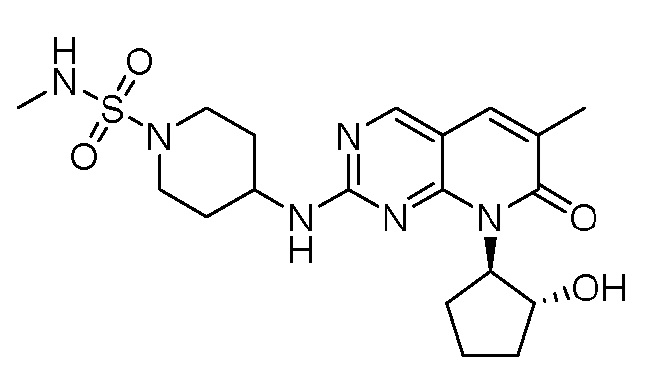
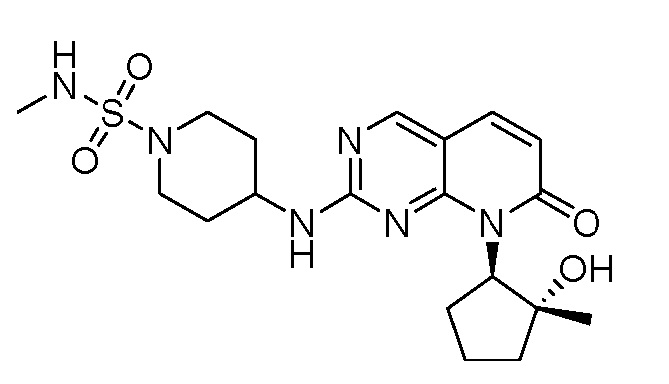
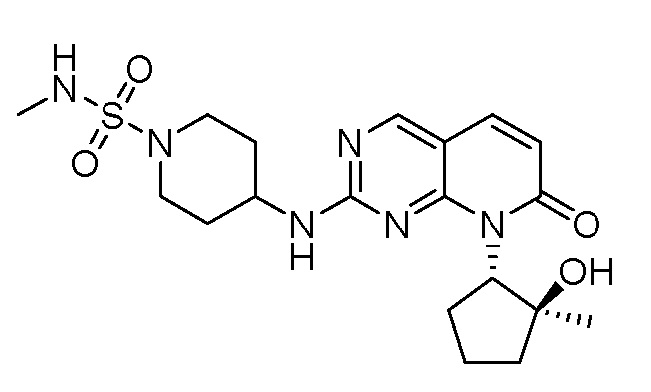
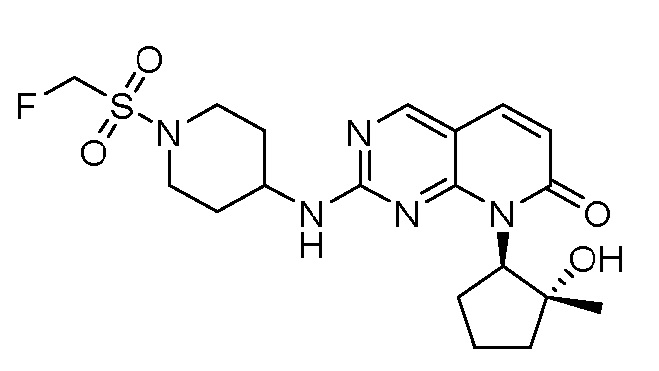
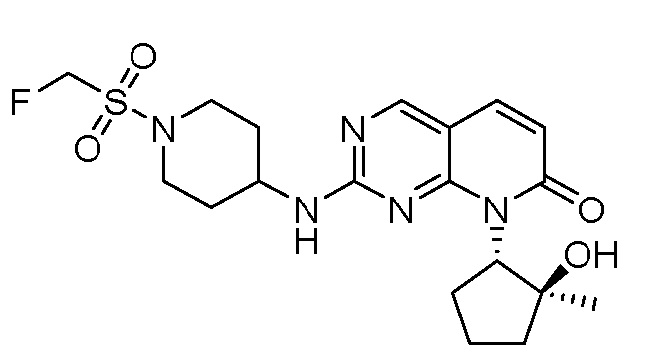
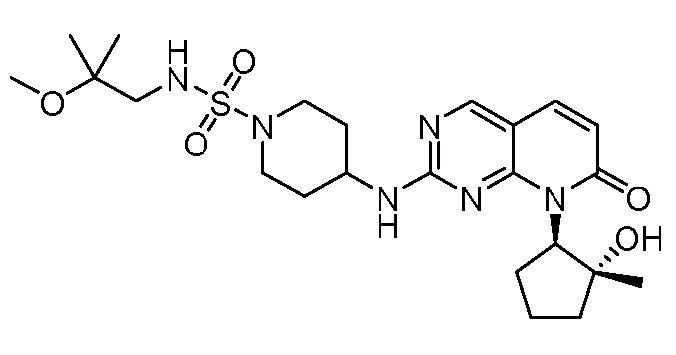
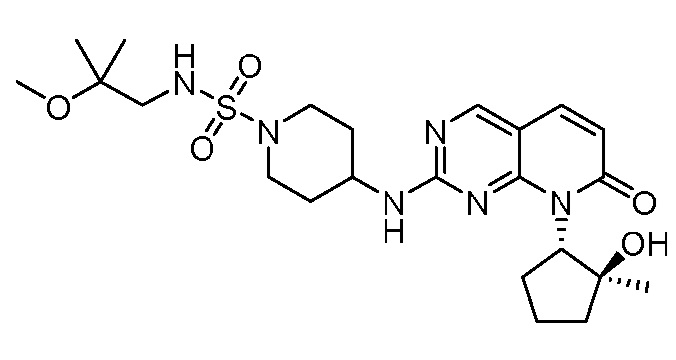
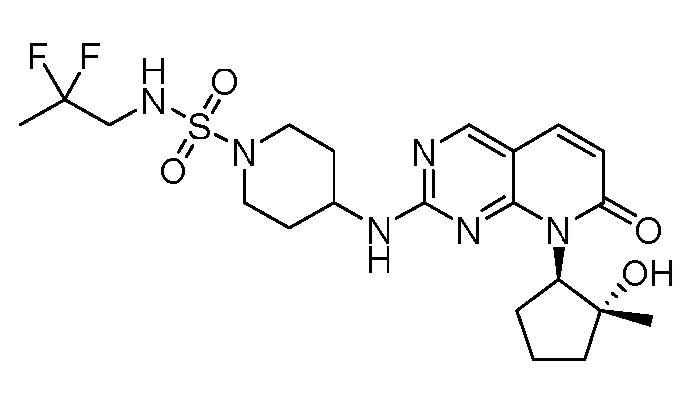
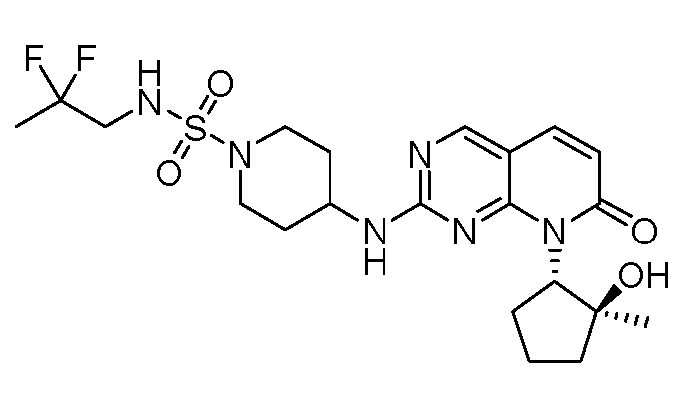
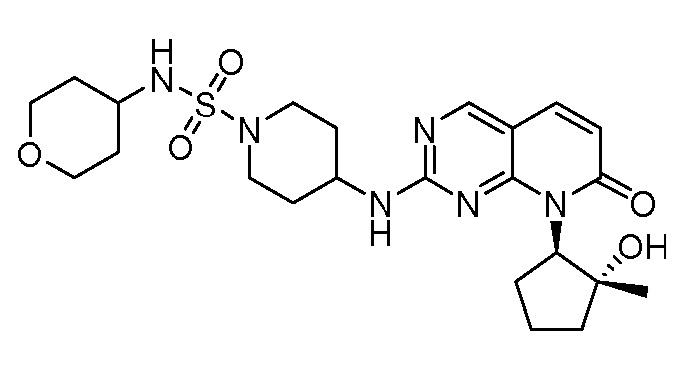
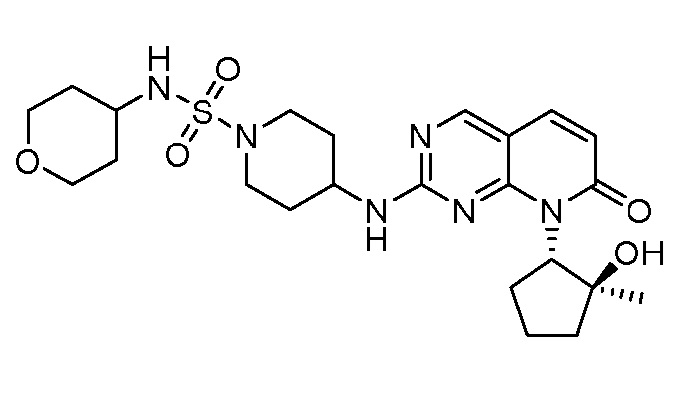
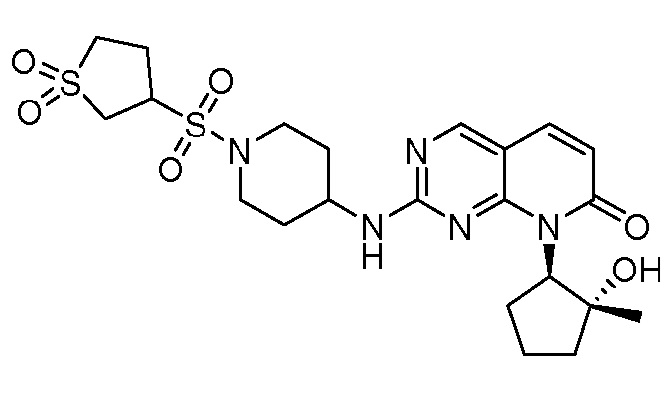
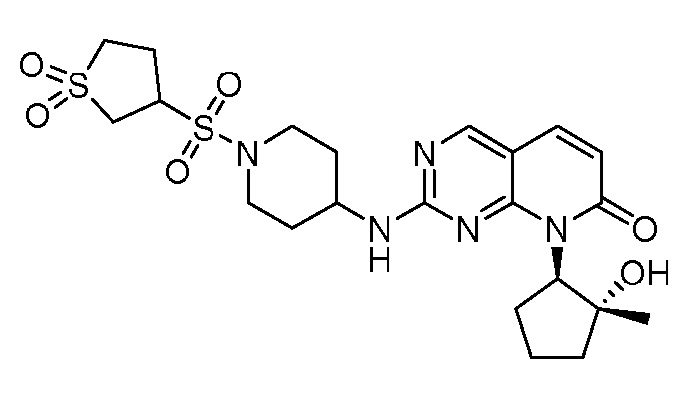
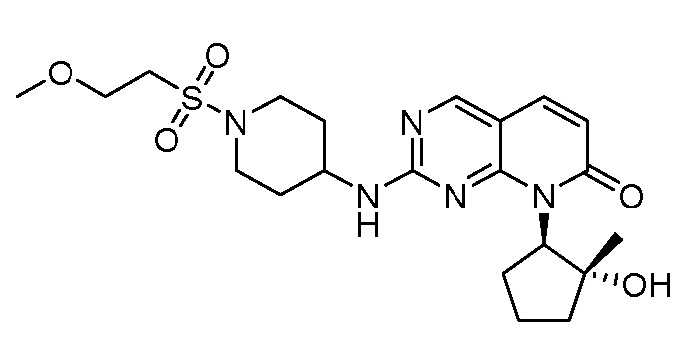
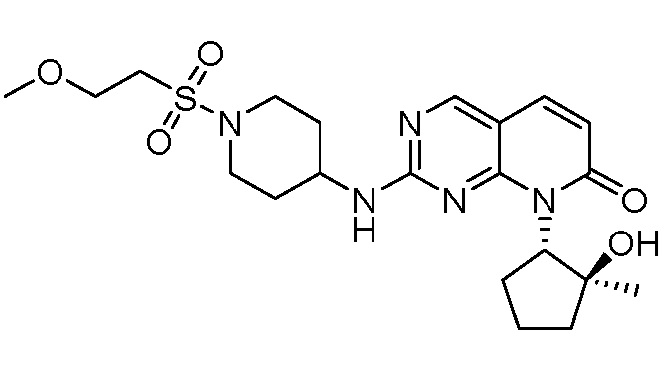
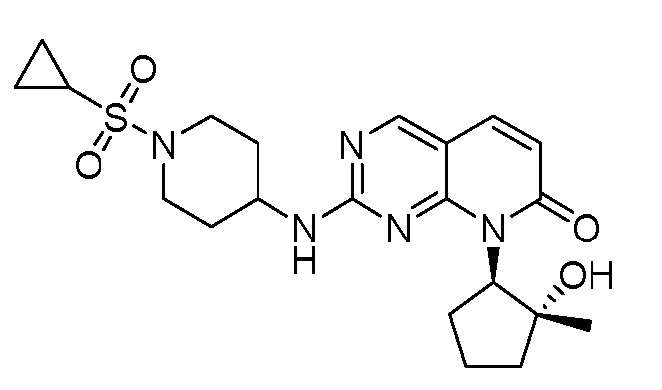
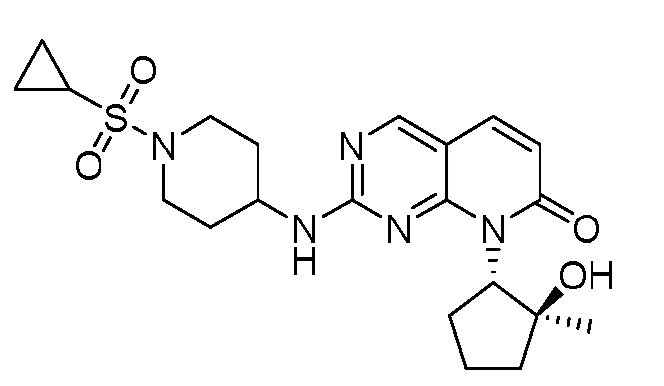
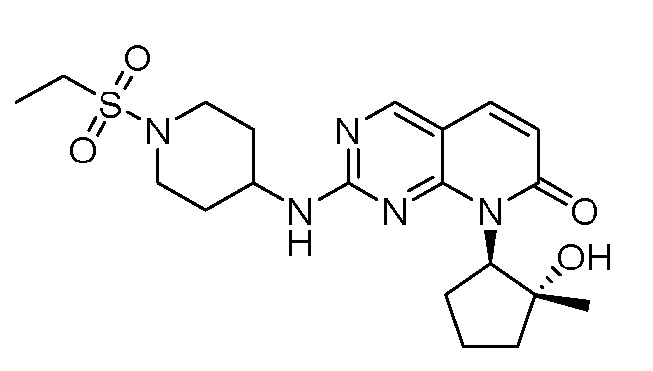
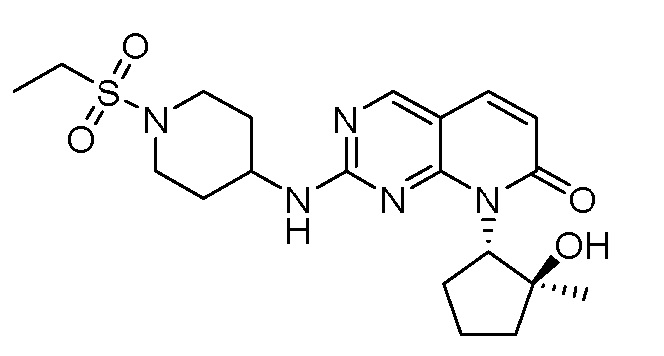
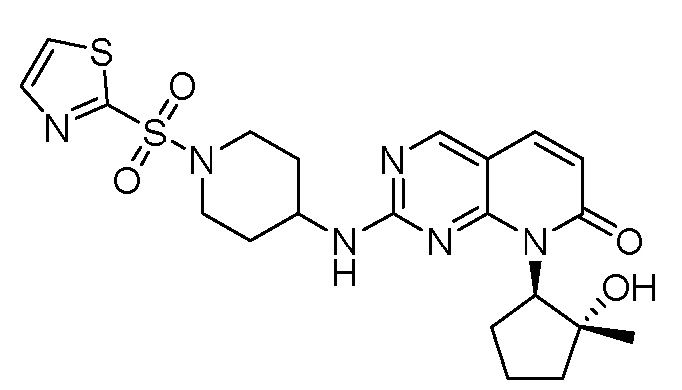
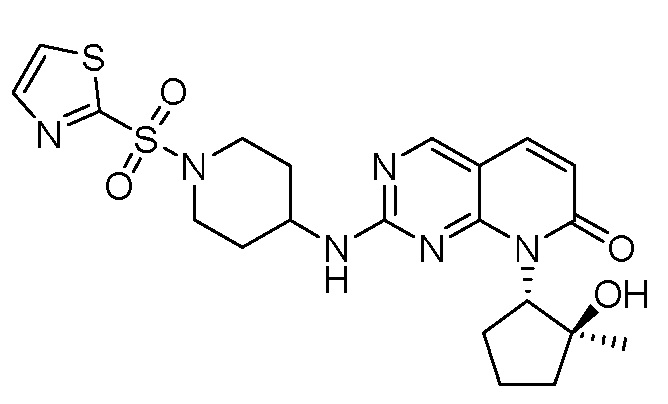
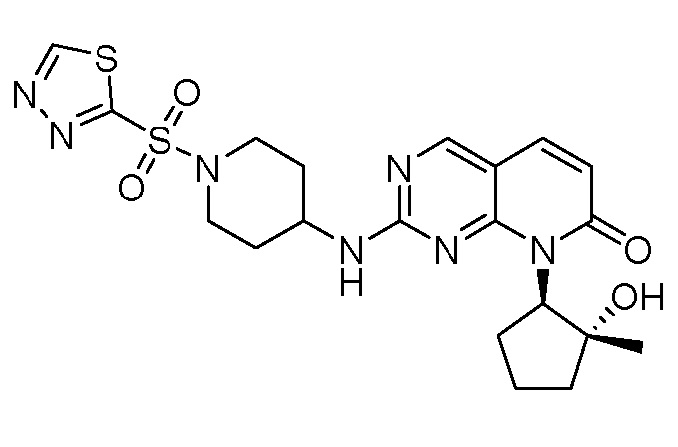
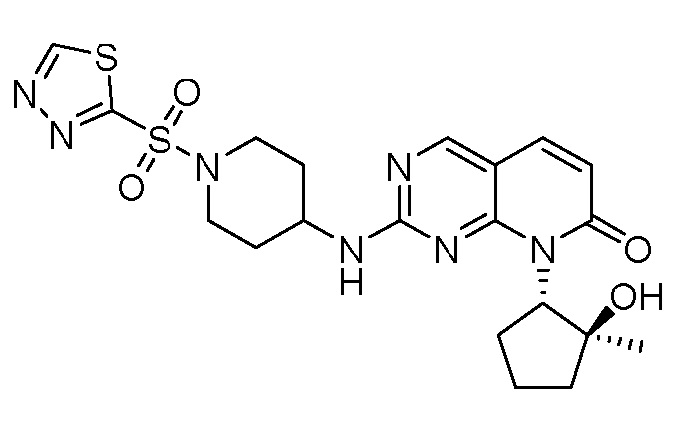
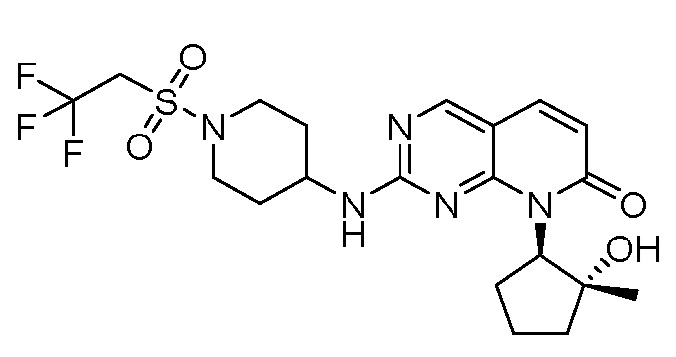
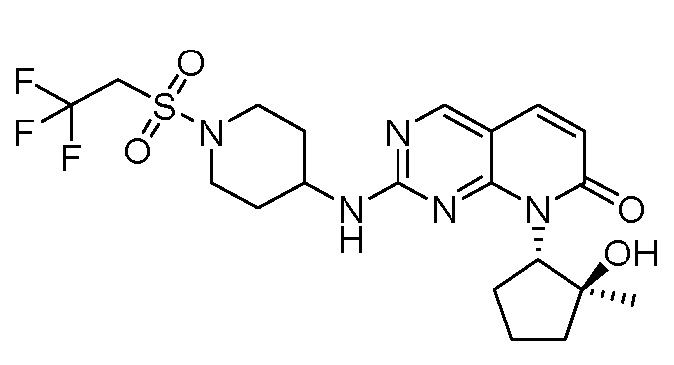
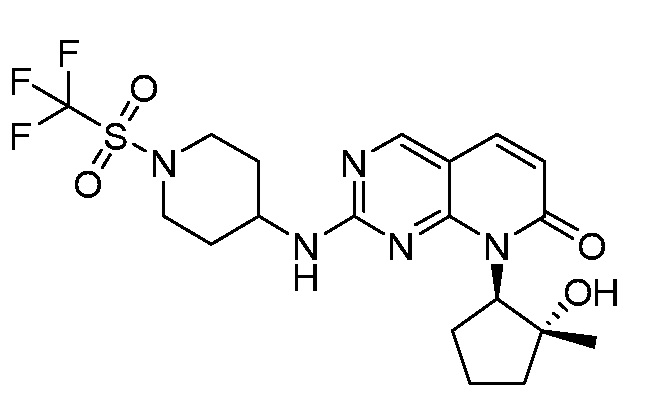
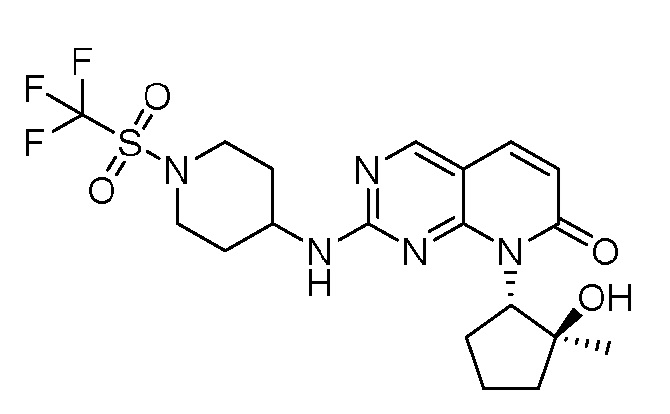
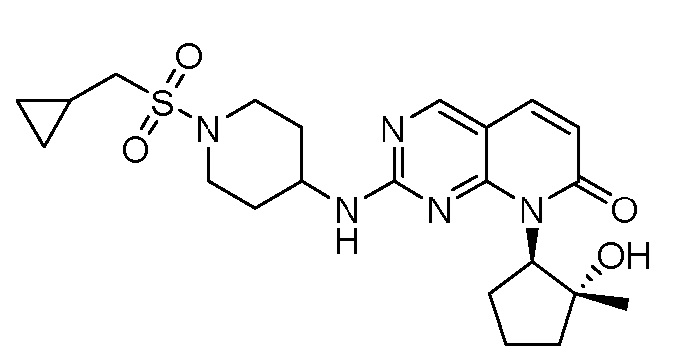
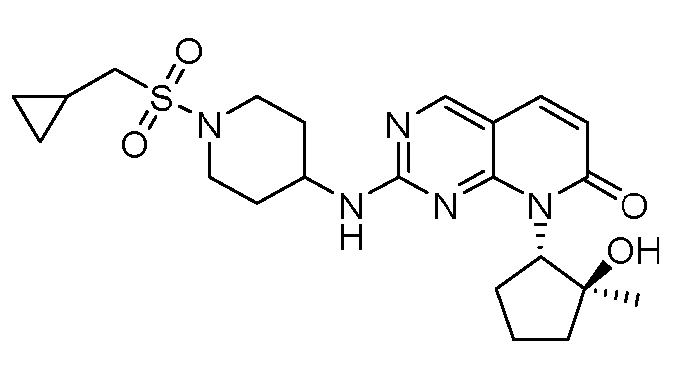
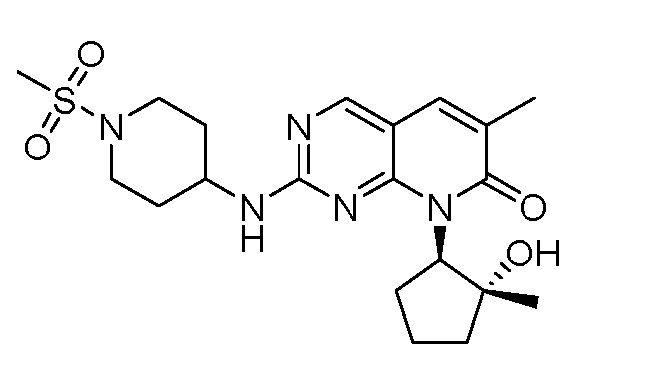
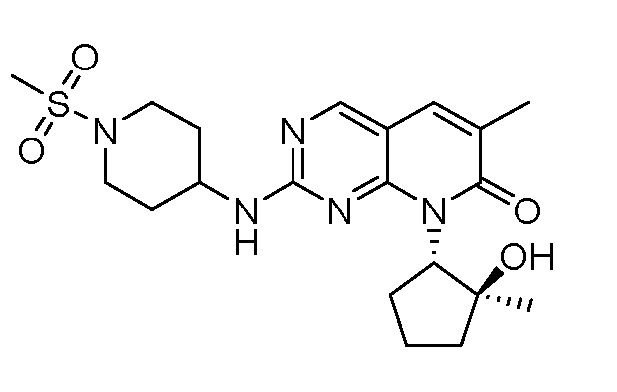
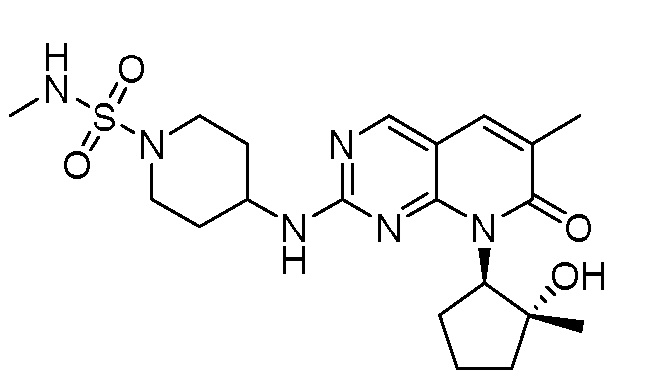
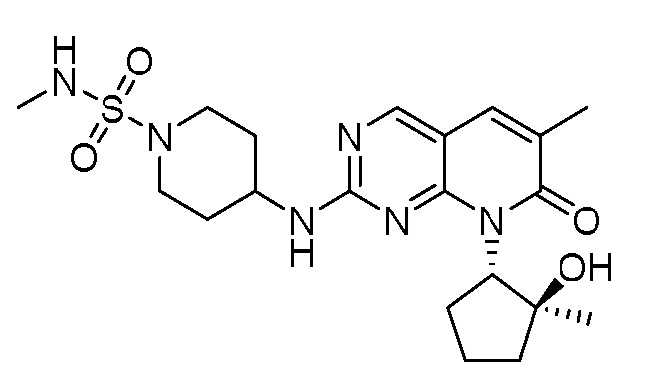
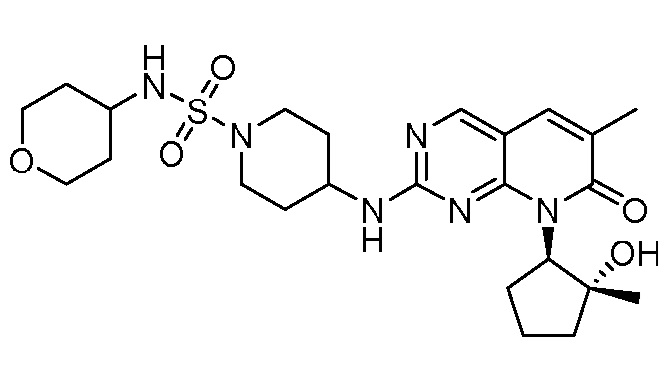
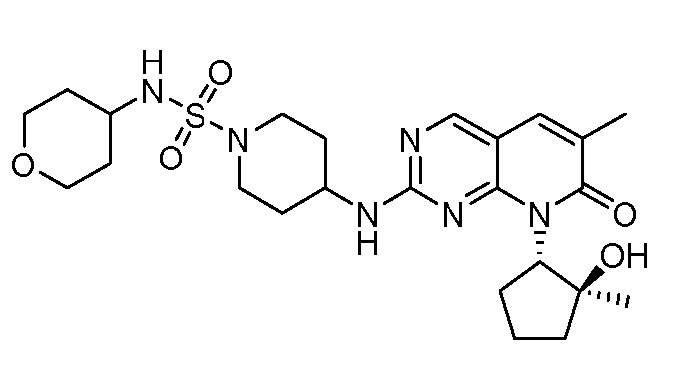
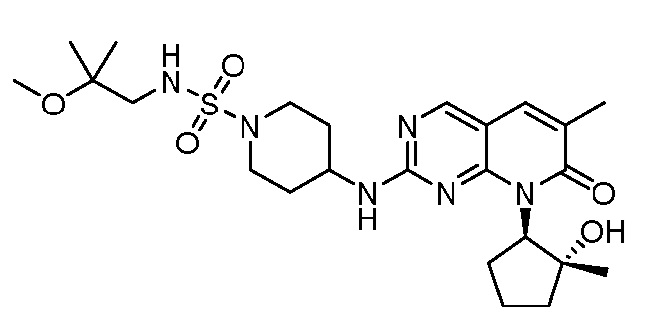
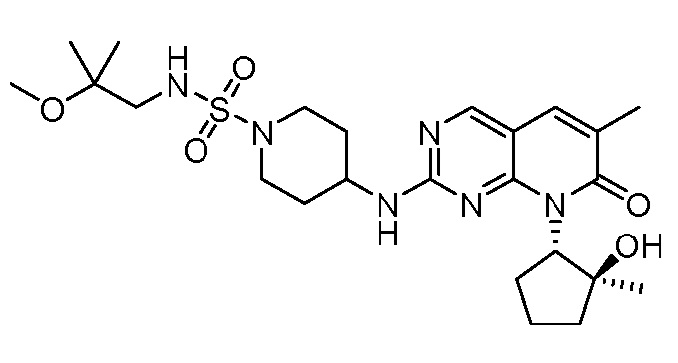
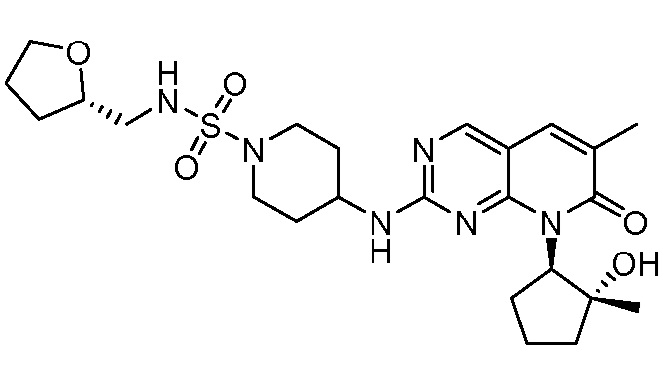
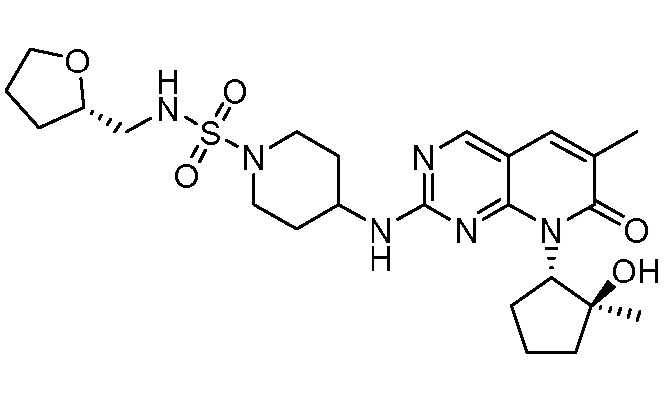
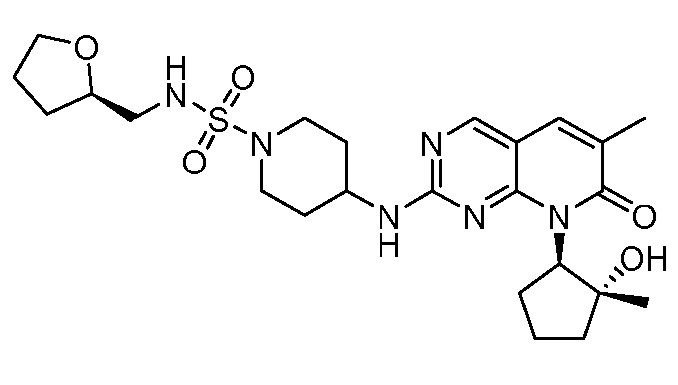
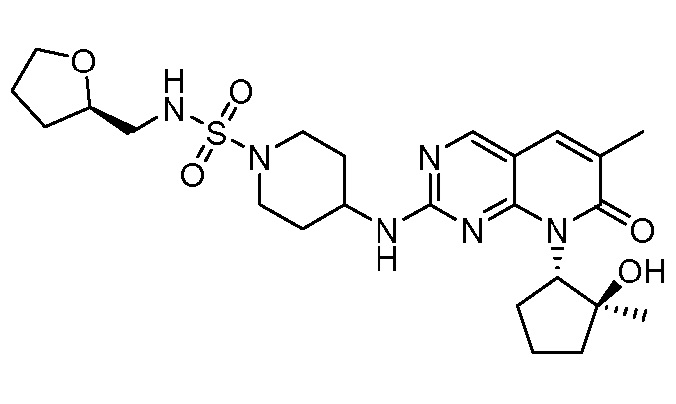
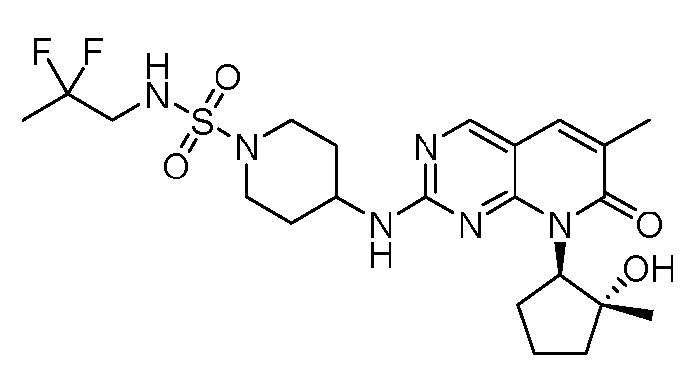
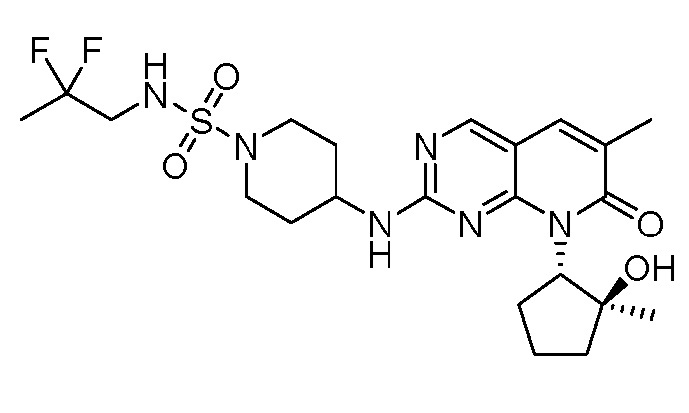
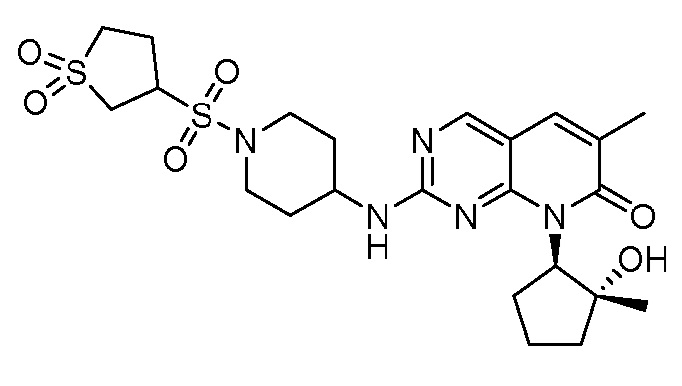
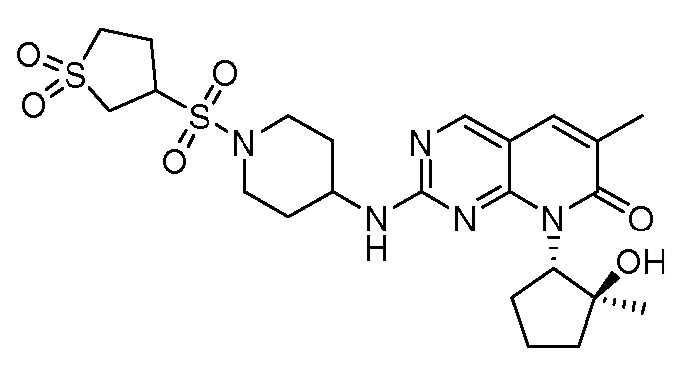
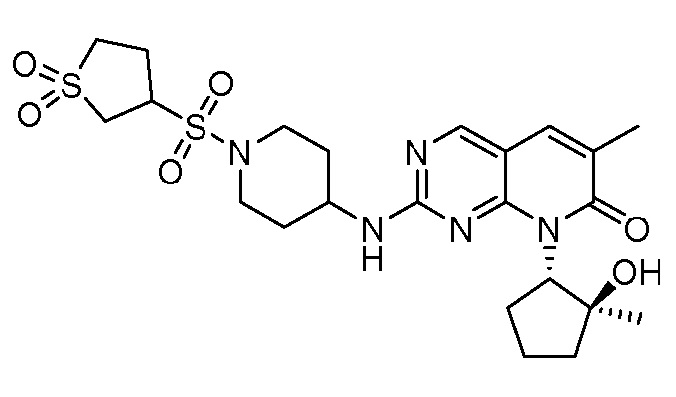
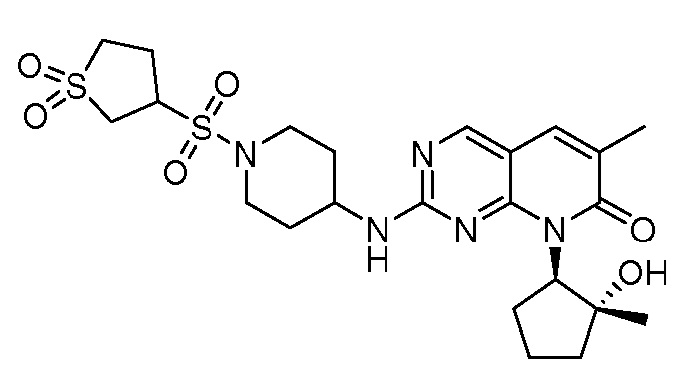
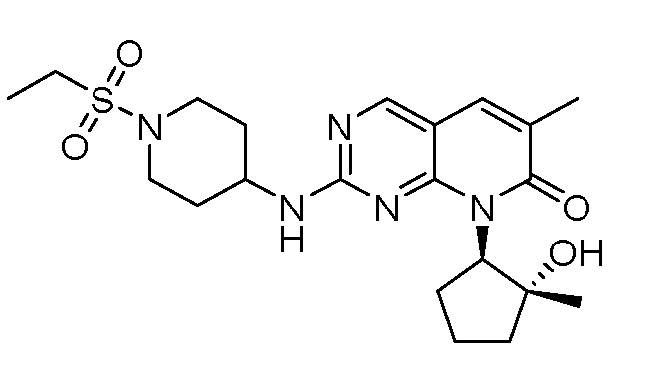
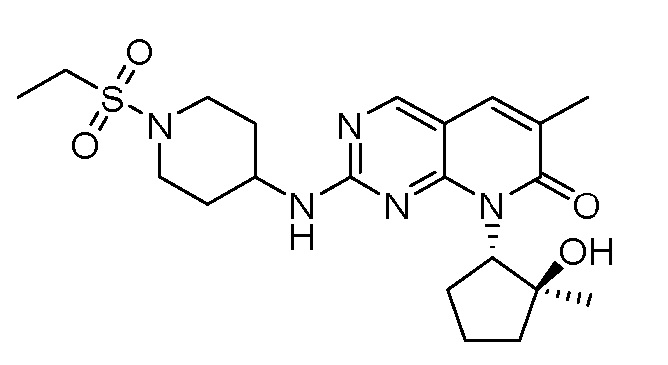
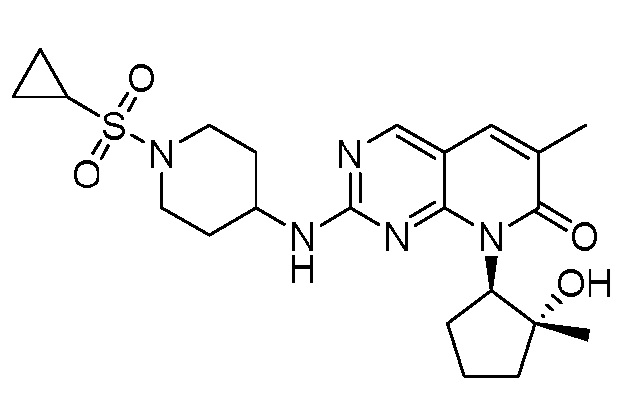
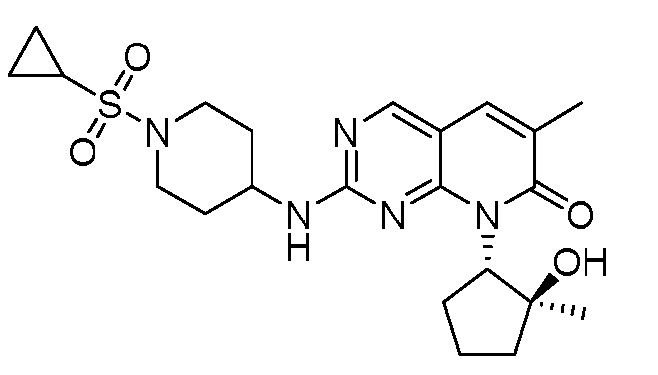
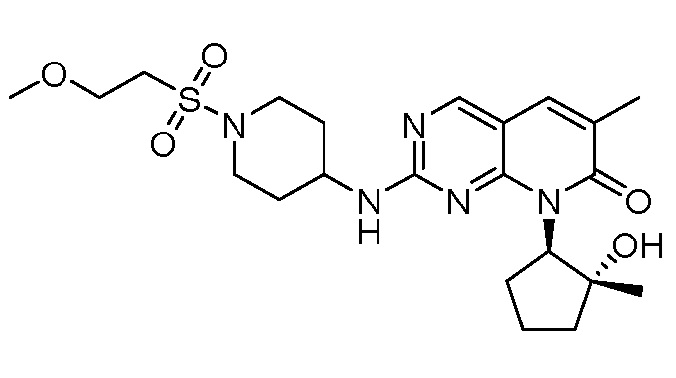
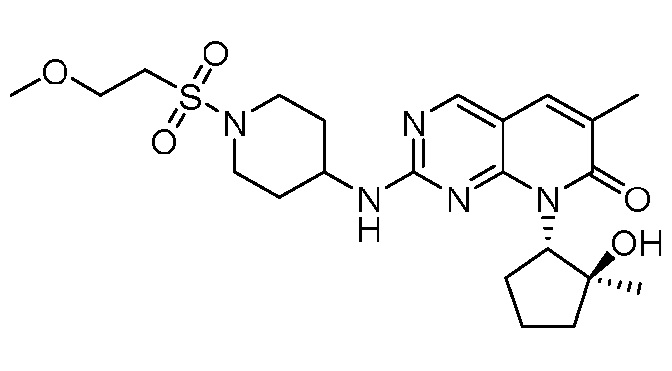
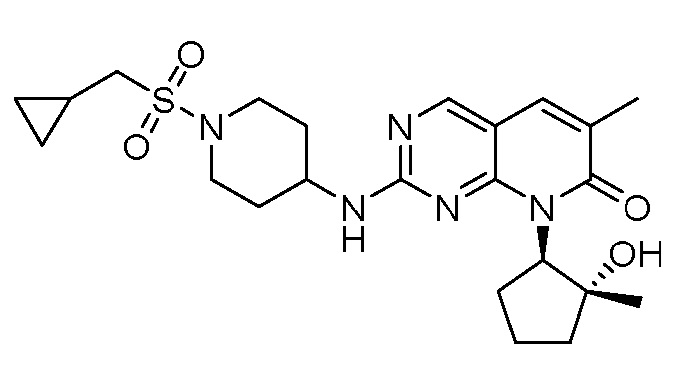
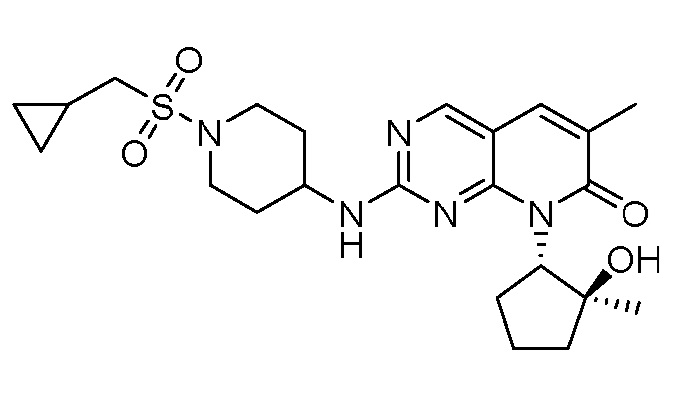
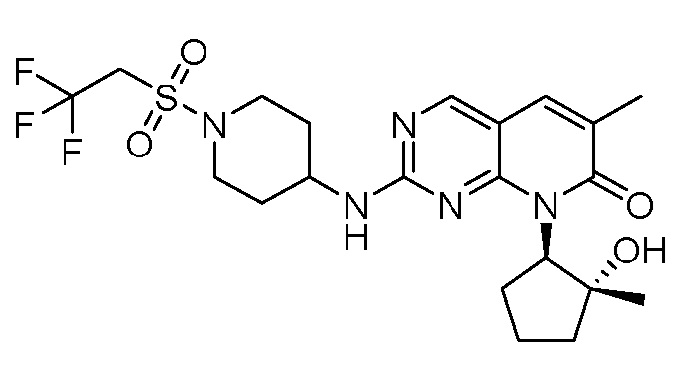
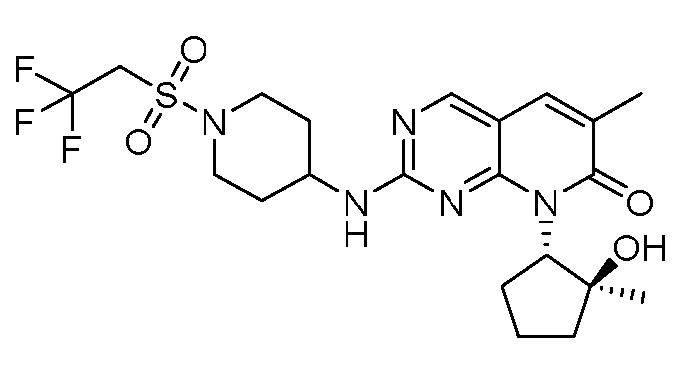
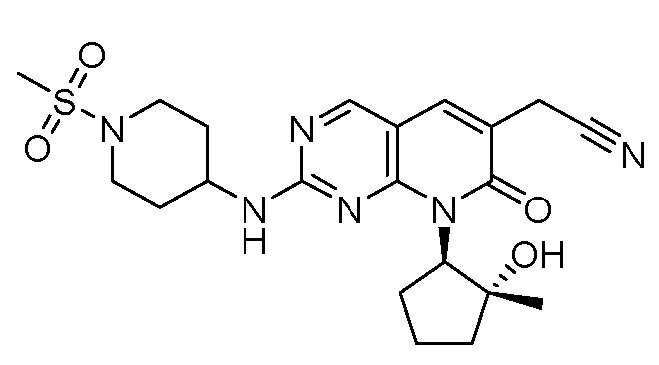
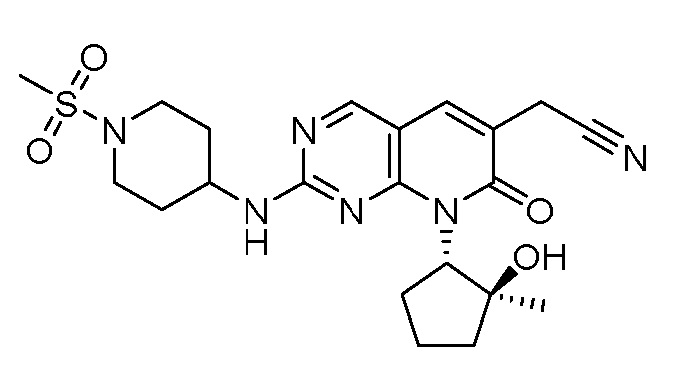
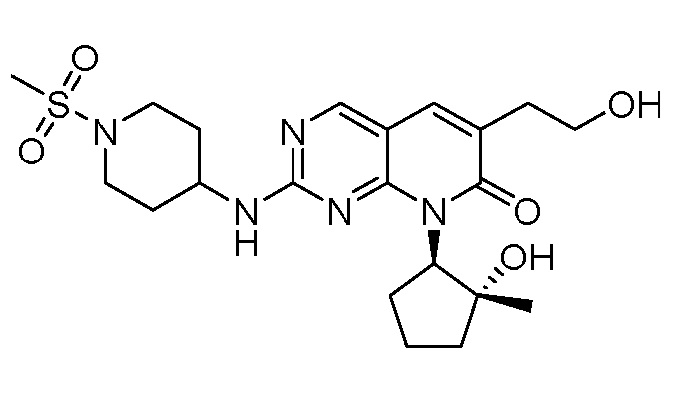
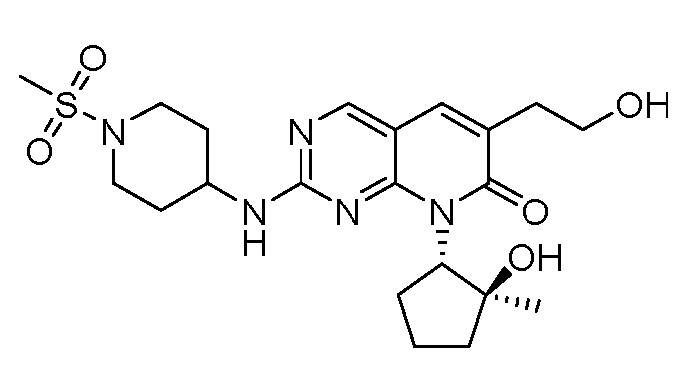
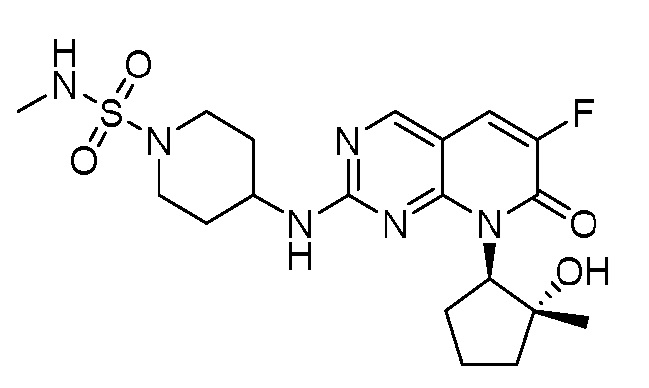
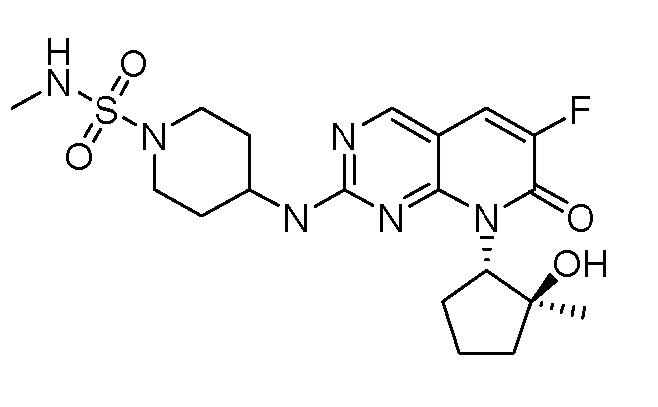
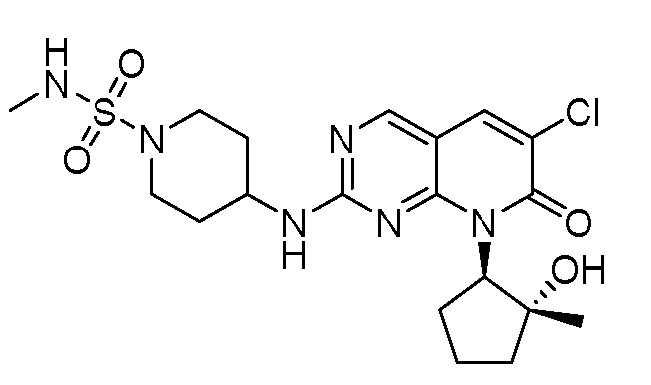
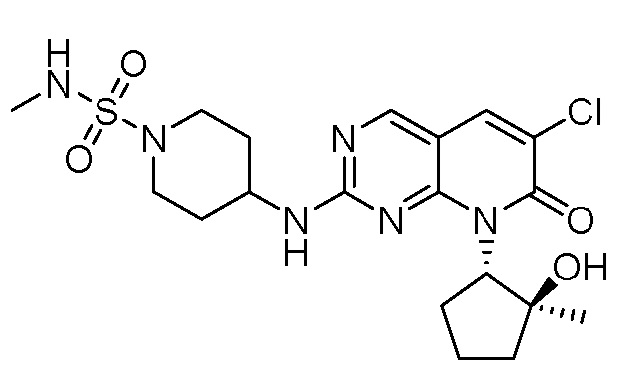
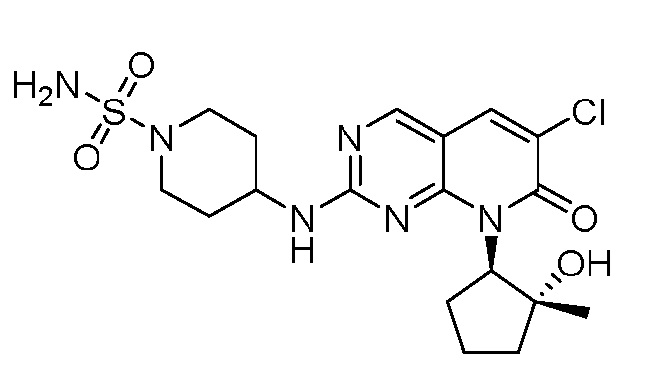
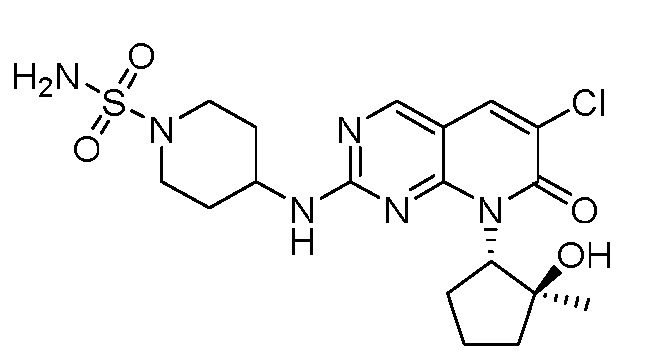
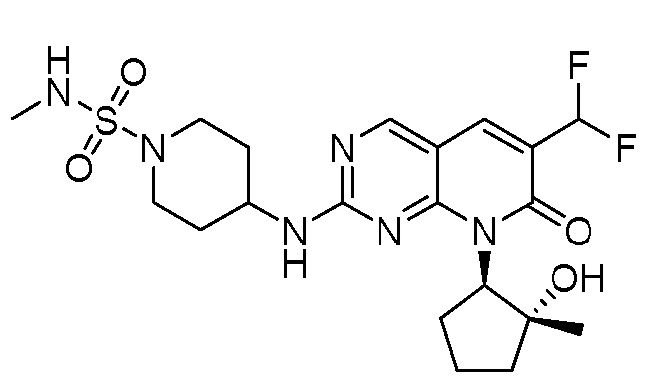
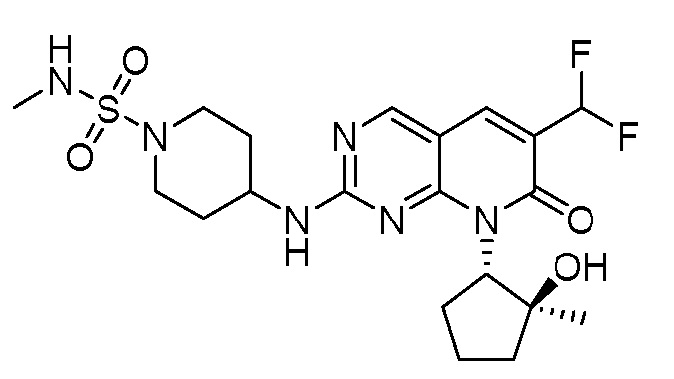
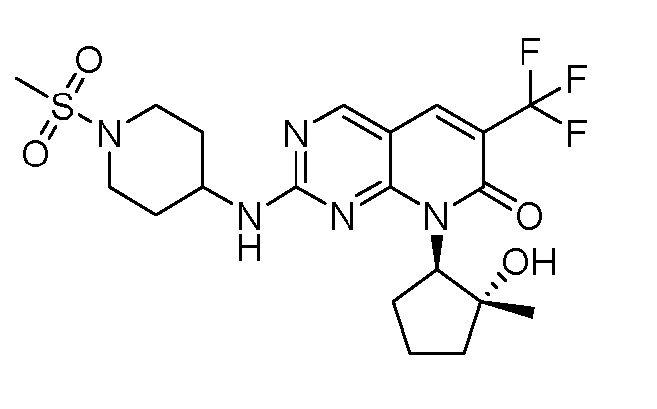
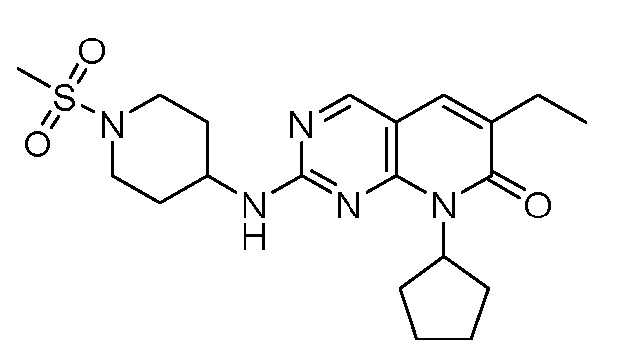
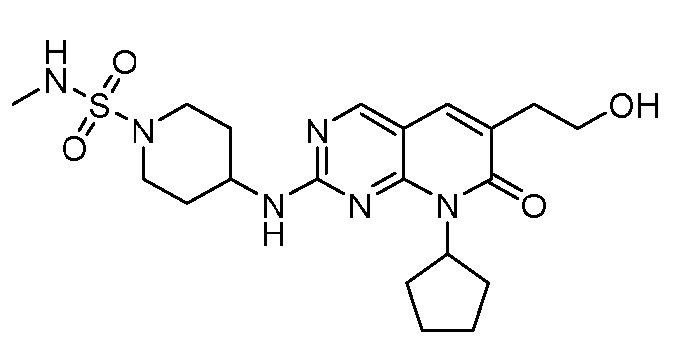
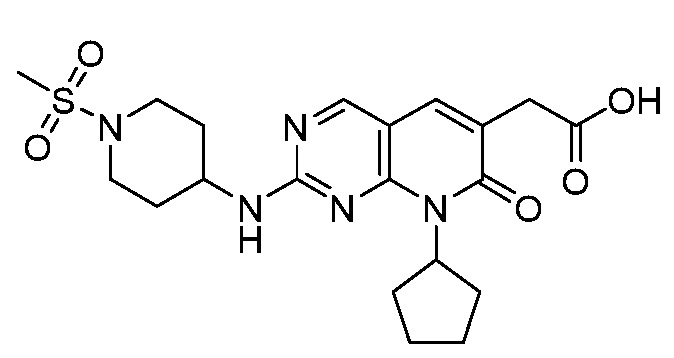
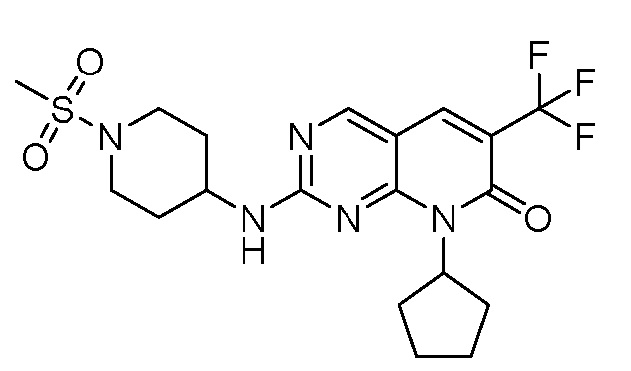
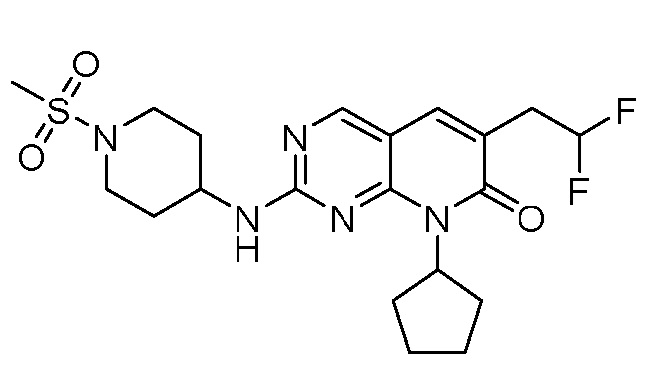
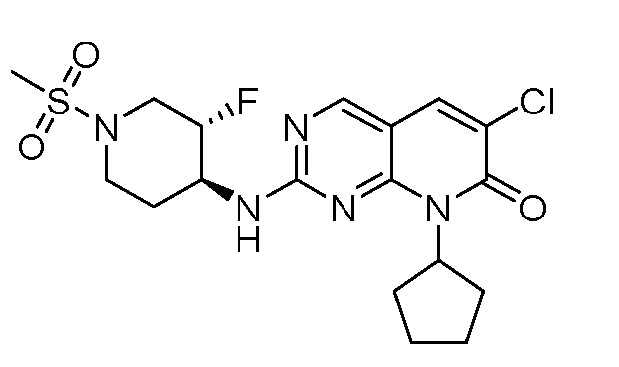
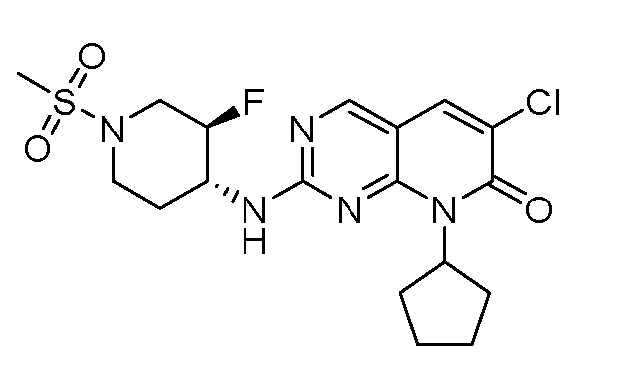
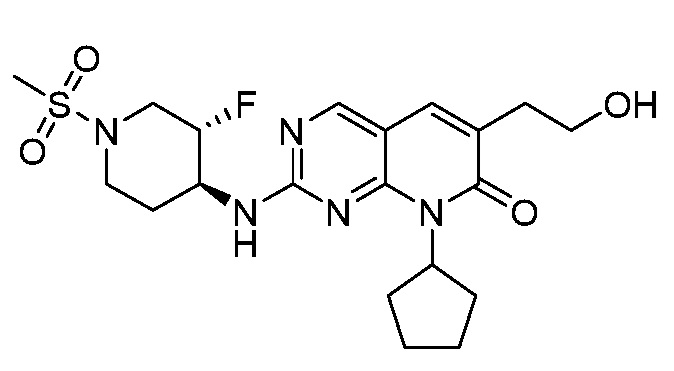
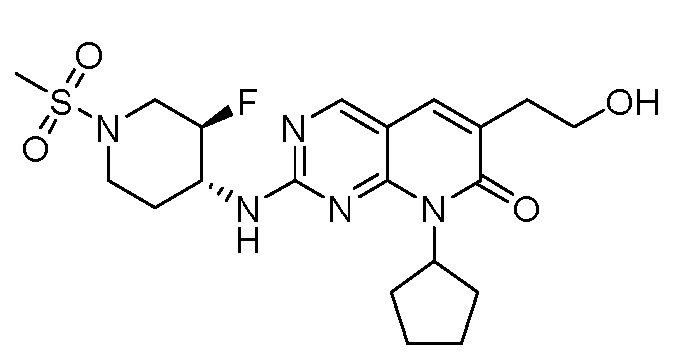
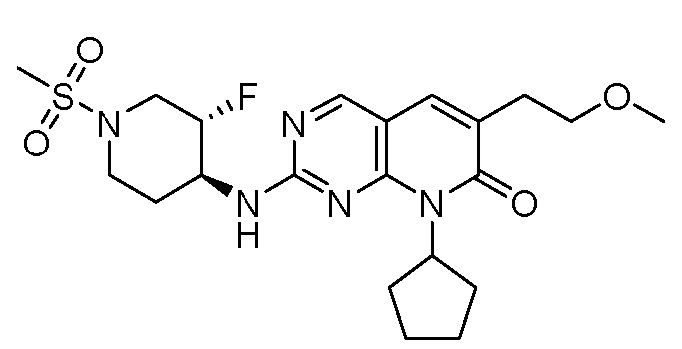
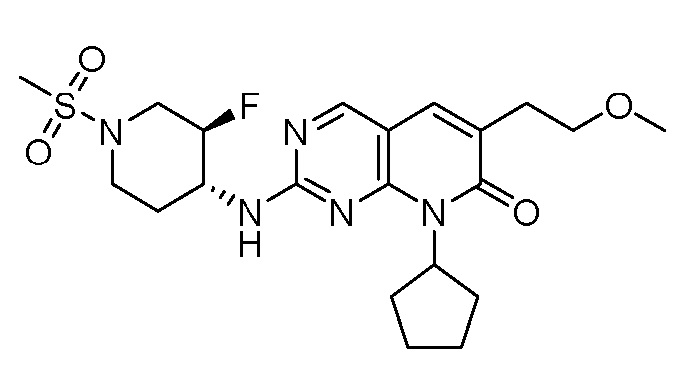
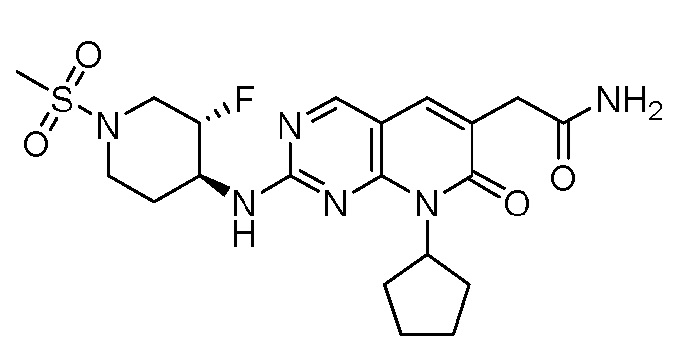
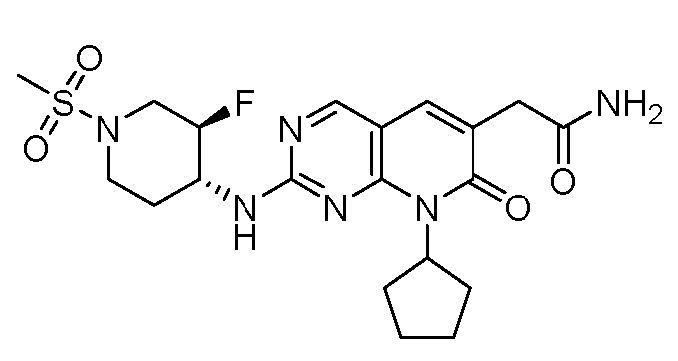
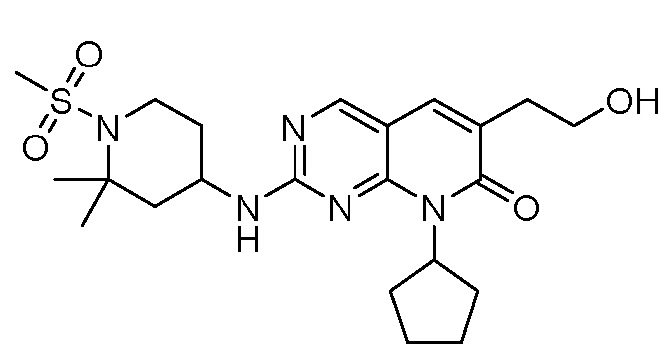
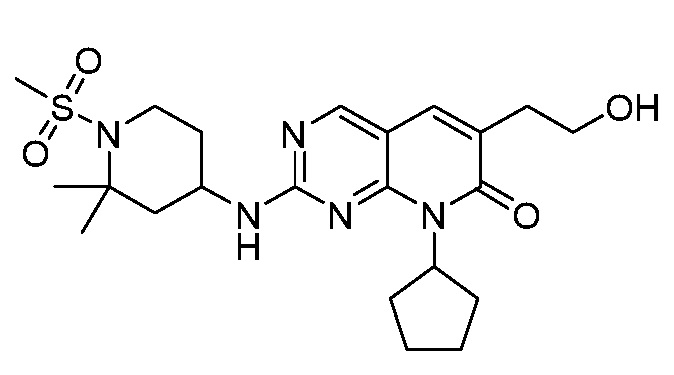
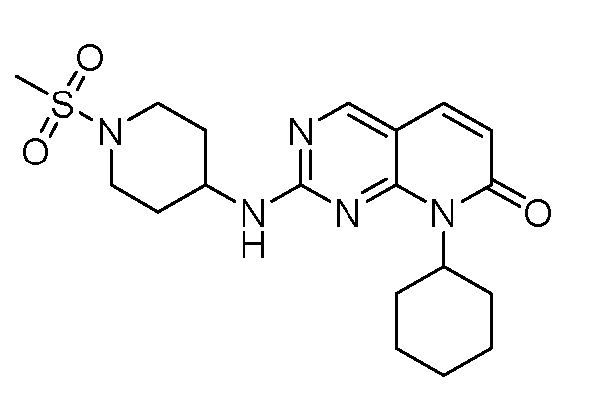
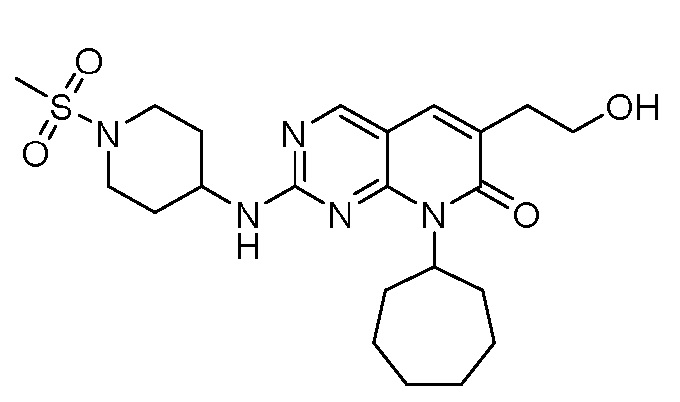
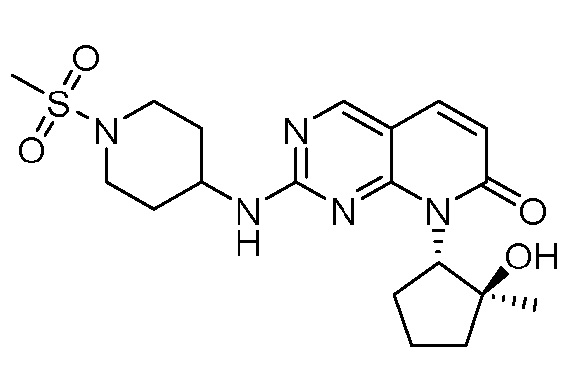
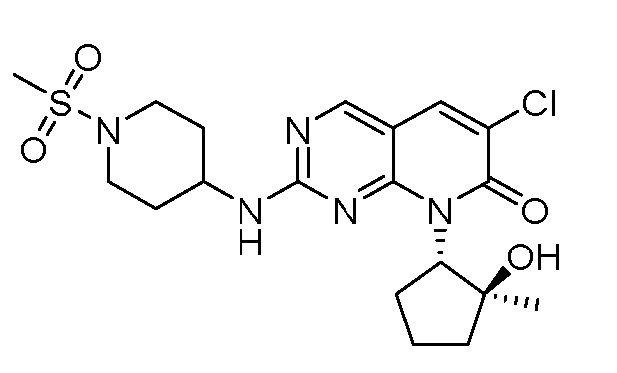
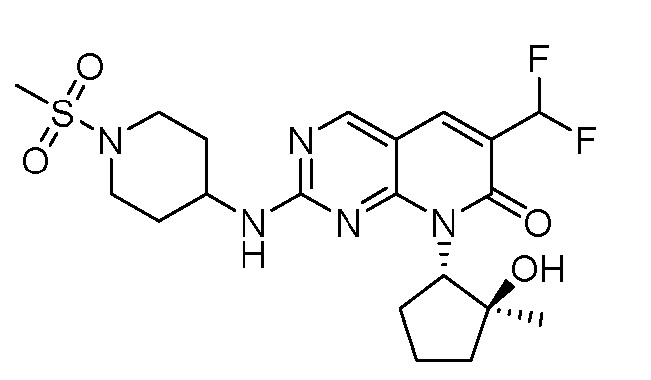
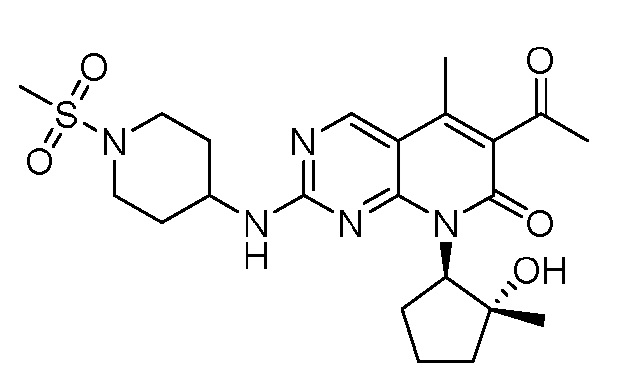
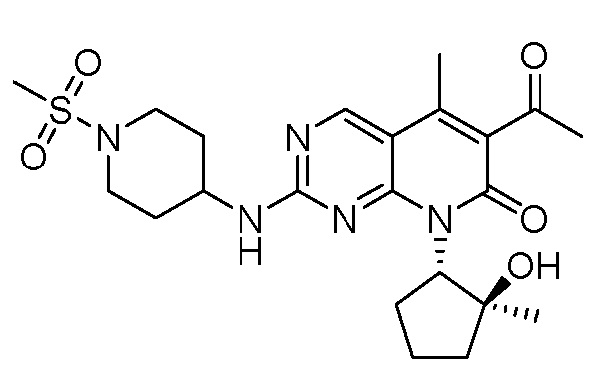
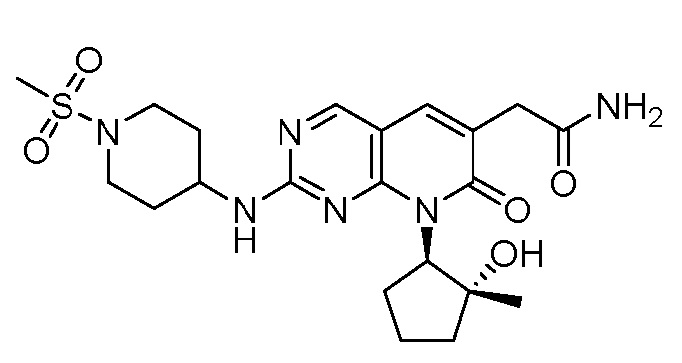
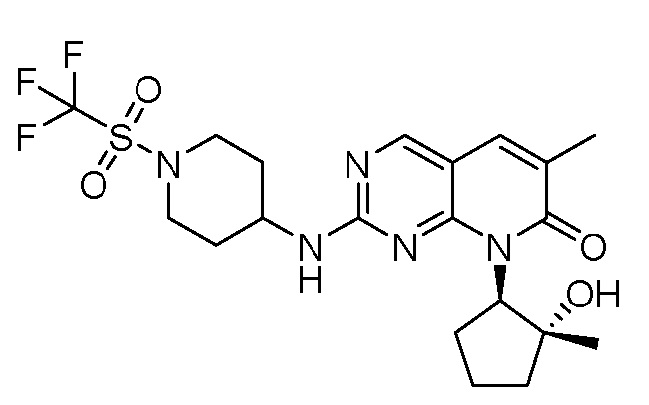
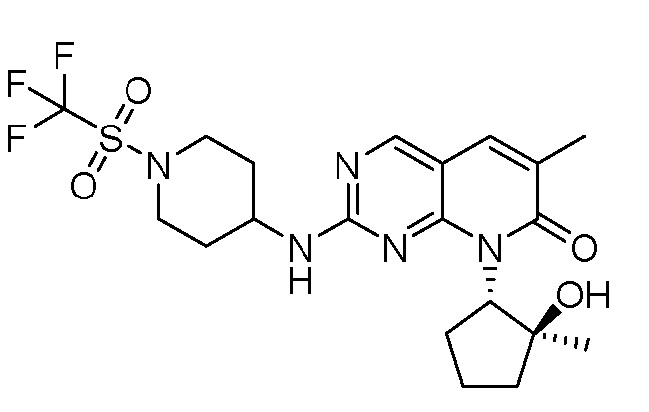
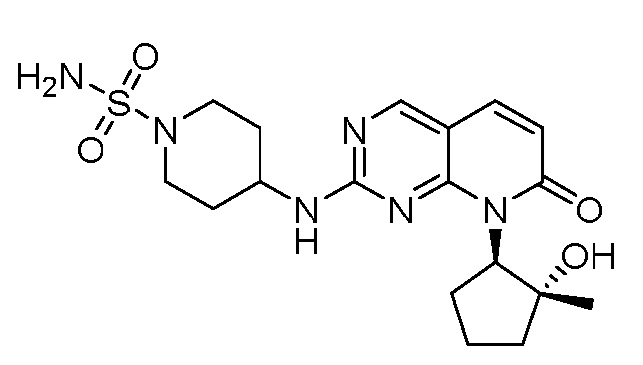
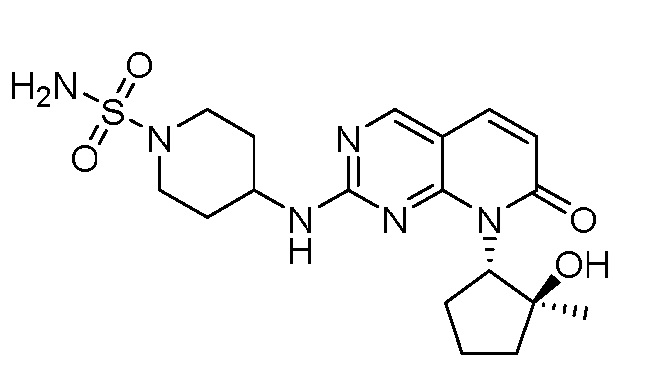
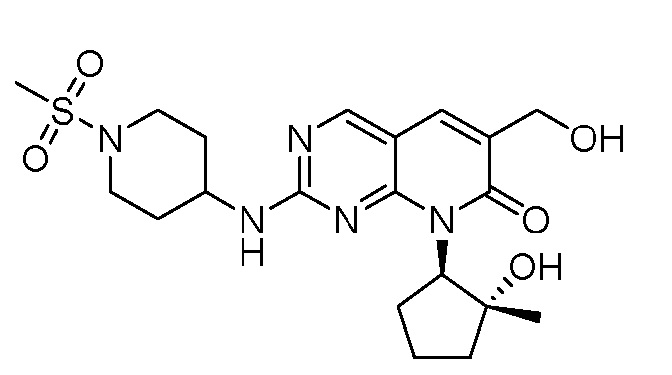
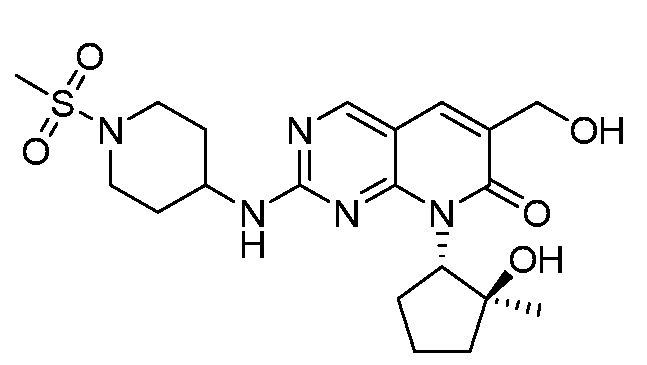
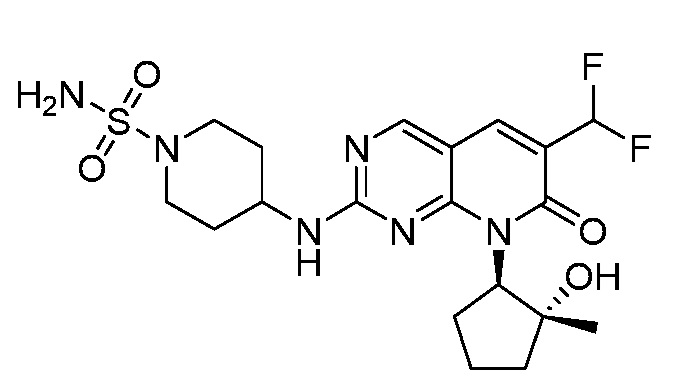
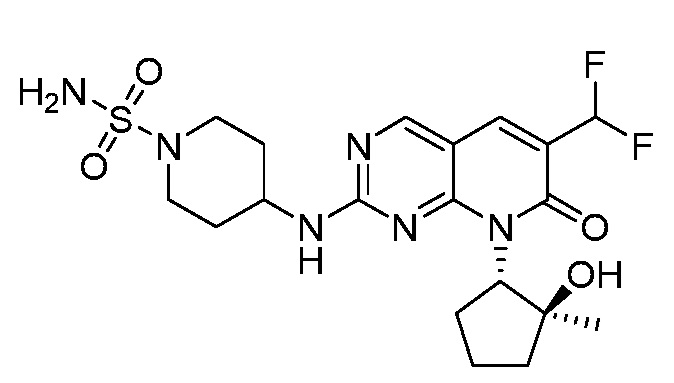
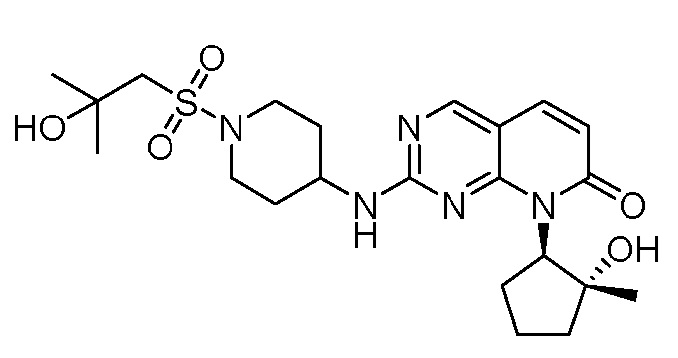
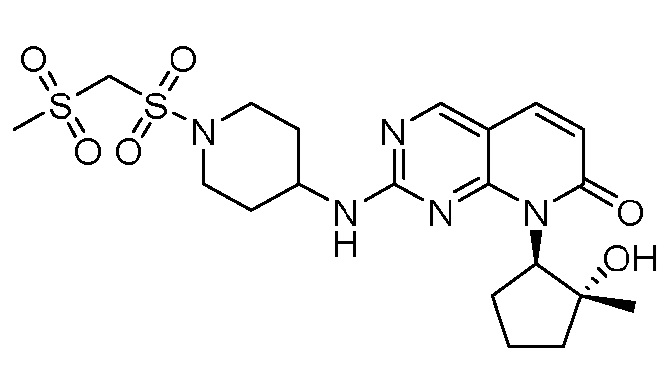
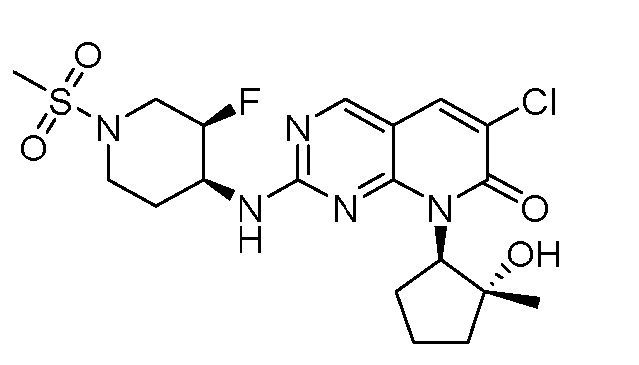
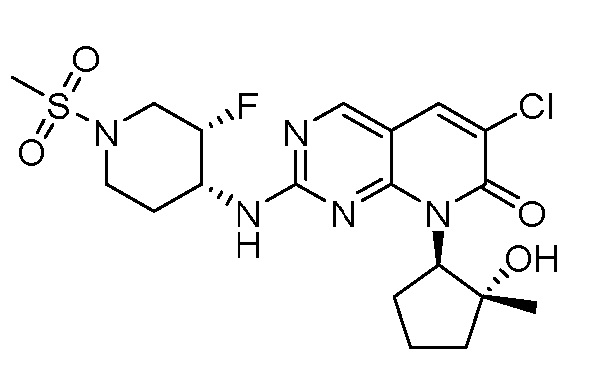
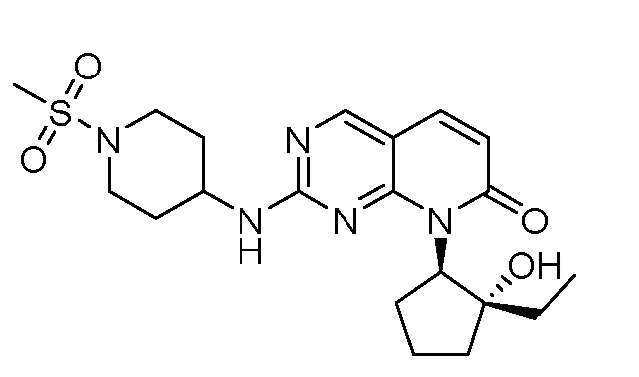
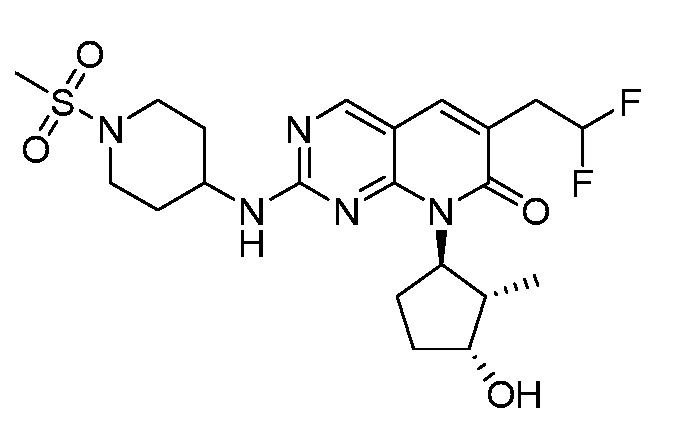
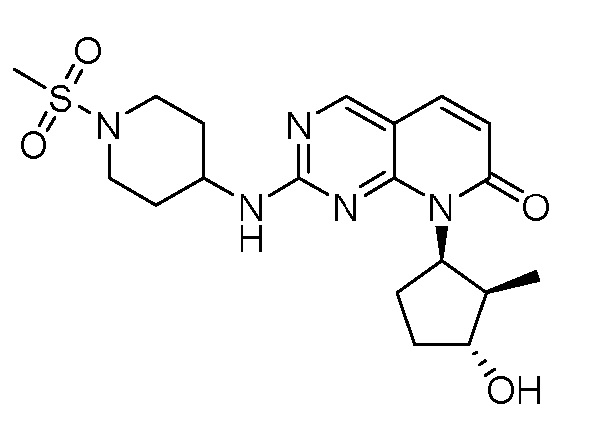
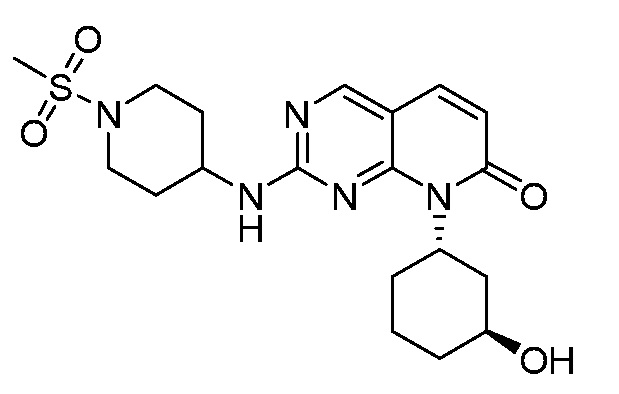
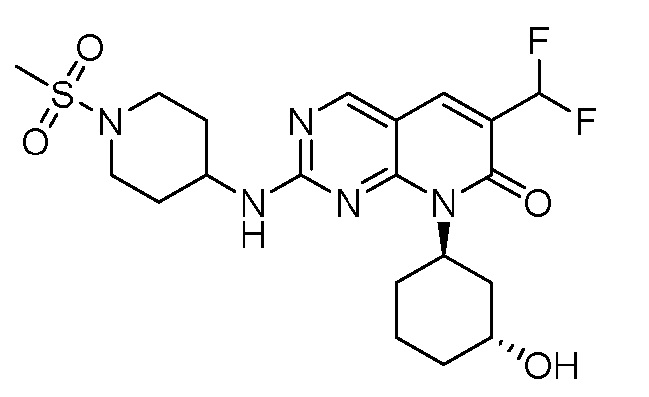
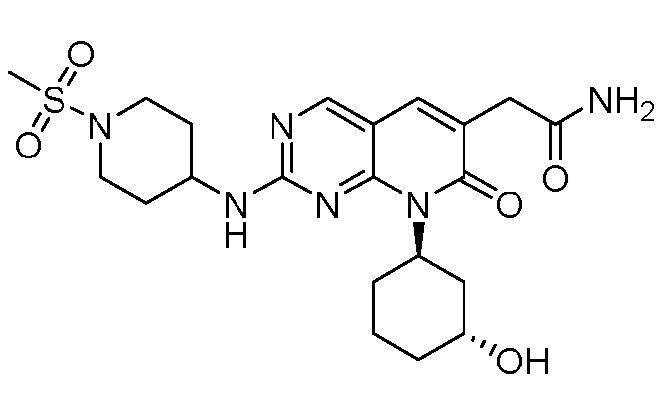
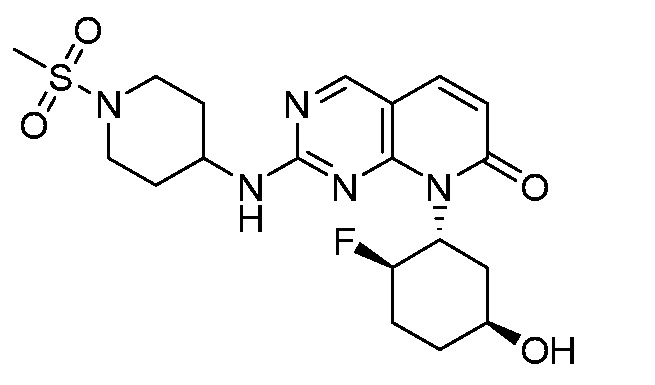
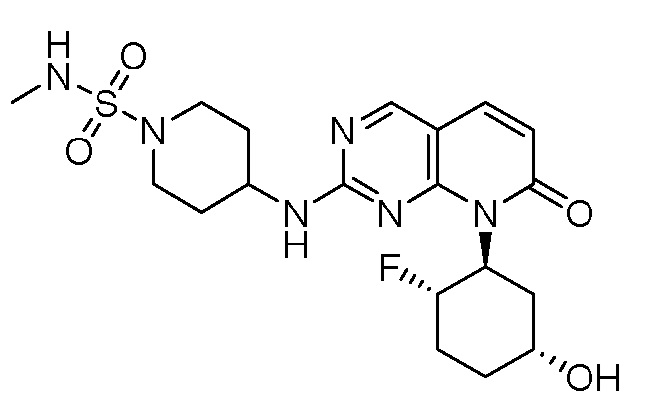
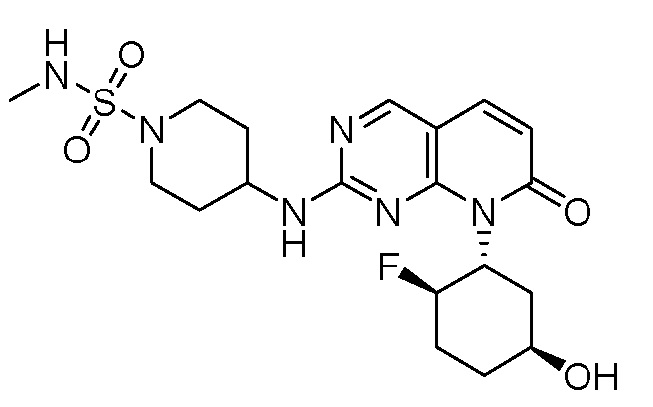
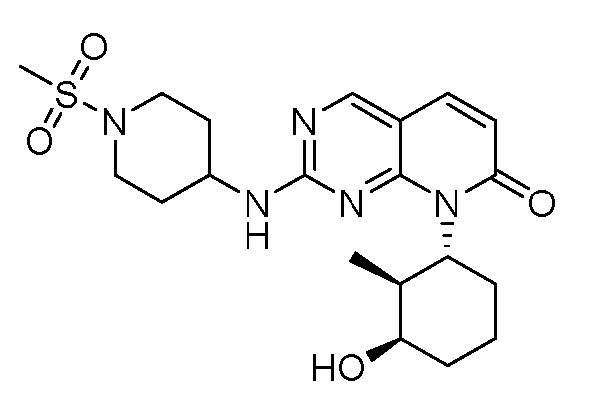
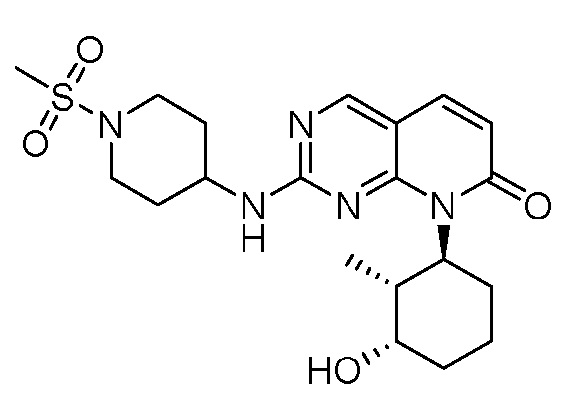
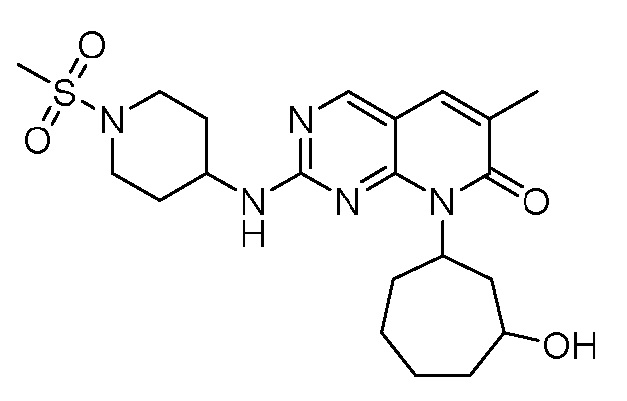
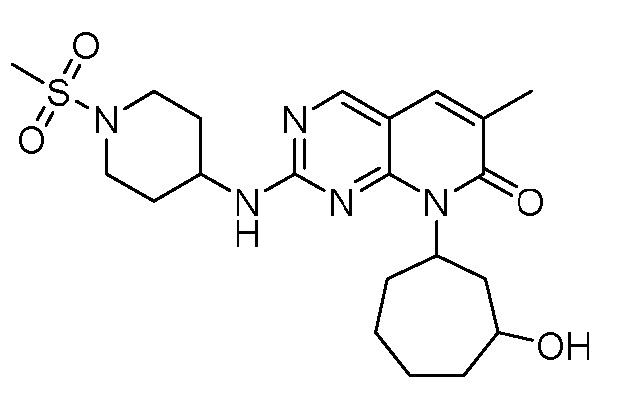
Результат интеллектуальной деятельности: ПИРИДОПИРИМИДИНОВЫЕ ИНГИБИТОРЫ CDK2/4/6
Вид РИД
Изобретение
Ссылка на список последовательностей
Настоящая заявка подается в электронном виде через EFS-Web и включает в себя список последовательностей, представленный в электронном виде в формате.txt. Файл.txt содержит список последовательностей, озаглавленный "PC72302SEQLISTING_ST25.txt", созданный 17 июля 2017 года и имеющий размер 2 КБ. Перечень последовательностей, содержащийся в этом файле.txt, является частью описания и полностью включен в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
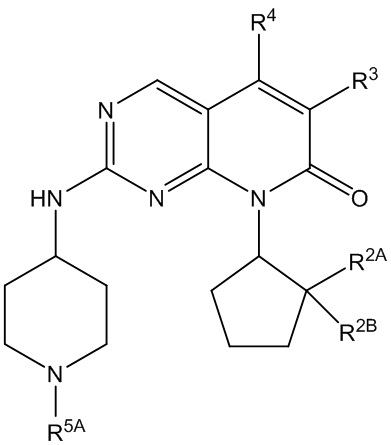
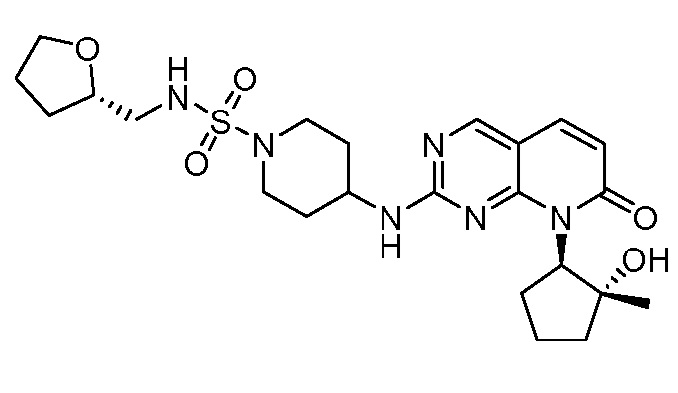
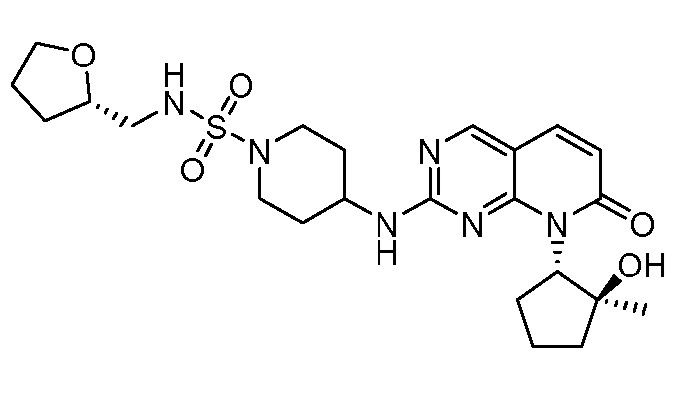
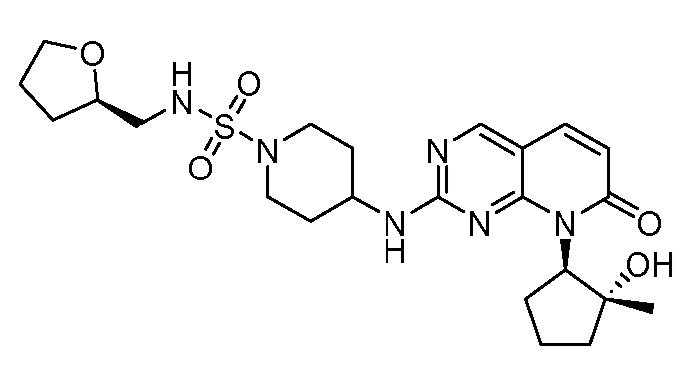
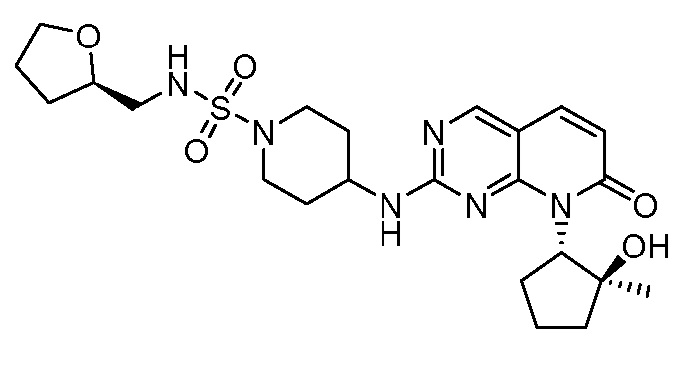
Настоящее изобретение относится к соединениям формул (I)-(VII) и их фармацевтически приемлемым солям, к фармацевтическим композициям, содержащим такие соединения и соли, и к их применению. Соединения, соли и композиции по настоящему изобретению являются полезными для лечения или ослабления аномальных клеточных пролиферативных нарушений, таких как рак.
Уровень техники
Циклинзависимые киназы (CDK) являются важными клеточными ферментами, которые выполняют основные функции в регуляции деления эукариотических клеток и пролиферации. Каталитические единицы циклинзависимой киназы активируются посредством регуляторных субъединиц, известных как циклины. По меньшей мере, идентифицированы шестнадцать циклинов млекопитающих (Johnson DG, Walker CL. Cyclins and Cell Cycle Checkpoints. Annu. Rev. Pharmacol. Toxicol. (1999) 39:295-312). Циклин B/CDK1, циклин А/CDK2, циклин Е/CDK2, циклин D/CDK4, циклин D/CDK6 и, вероятно, другие гетеродимеры, являются важными регуляторами развития клеточного цикла. Дополнительные функции гетеродимеров циклин/CDK включают регуляцию транскрипции, репарацию ДНК, дифференцировку и апоптоз (Morgan DO. Cyclin-dependent kinases: engines, clocks, and microprocessors. Annu. Rev. Cell. Dev. Biol. (1997) 13:261-291).
Было показано, что ингибиторы циклинзависимой киназы могут оказаться пригодными при лечении рака. Показано, что увеличенная активность или временно аномальная стимуляция циклинзависимых киназ приводит к развитию опухолей у человека, и развитие человеческих опухолей обычно ассоциируется с изменениями или в самих CDK-белках или в их регуляторах (Cordon-Cardo C. Mutations of cell cycle regulators: biological and clinical implications for human neoplasia. Am. J. Pathol. (1995) 147:545-560; Karp JE, Broder S. Molecular foundations of cancer: new targets for intervention. Nat. Med. (1995) 1:309-320; Hall M, Peters G. Genetic alterations of cyclins, cyclin-dependent kinases, and Cdk inhibitors in human cancer. Adv. Cancer Res. (1996) 68:67-108). Сообщалось также об амплификациях регуляторных субъединиц CDK и циклинов, и мутации, делеции генов или транскрипционном сайленсинге эндогенных ингибиторов CDK (Smalley et al. Identification of a novel subgroup of melanomas with KIT/cyclin-dependent kinase-4 overexpression. Cancer Res (2008) 68: 5743-52).
Клинические испытания ингибиторов CDK4/6 палбоциклиб, рибоциклиб и абемациклиб продолжаются в отношении рака молочной железы и других видов рака, в виде отдельных средств или в комбинации с другими терапевтическими средствами. Палбоциклиб и рибоциклиб были одобрены для лечения гормон-рецептор(HR)- положительного, рецептор эпидермального фактора роста 2 (HER2)-негативного распространенного или метастатического рака молочной железы в сочетании с ингибиторами ароматазы у женщин в постменопаузе и для палбоциклиба в сочетании с фульвестрантом после прогрессирования заболевания после эндокринной терапии, (O'Leary et al. Treating cancer with selective CDK4/6 inhbitors. Nature Reviews (2016) 13:417-430). Хотя ингибиторы CDK4/6 показали значительную клиническую эффективность при ER-положительном метастатическом раке молочной железы, как и в случае с другими киназами, их эффекты могут со временем ограничиваться развитием первичной или приобретенной резистентности.
Сверхэкспрессия CDK2 связана с аномальной регуляцией клеточного цикла. Комплекс циклин E/CDK2 играет важную роль в регуляции перехода G1/S, биосинтеза гистонов и дублирования центросом. Прогрессивное фосфорилирование Rb с помощью циклин D/Cdk4/6 и циклин E/Cdk2 высвобождает фактор транскрипции G1, E2F, и способствует входу в S-фазу. Активация циклин A/CDK2 во время ранней S-фазы способствует фосфорилированию эндогенных субстратов, которые обеспечивают репликацию ДНК и инактивацию E2F для завершения S-фазы. (Asghar et al. The history and future of targeting cyclin-dependent kinases in cancer therapy, Nat. Rev. Drug. Discov. 2015; 14(2): 130-146).
Циклин E, регуляторный циклин для CDK2, часто сверхэкспрессируется при раке. Амплификация или сверхэкспрессия циклина Е долгое время ассоциировалась с плохими исходами при раке молочной железы. (Keyomarsi et al., Cyclin E and survival in patients with breast cancer. N Engl J Med. (2002) 347:1566-75). Сверхэкспрессия циклина E2 (CCNE2) связана с эндокринной резистентностью в клетках рака молочной железы, и сообщалось, что ингибирование CDK2 восстанавливает чувствительность к тамоксифену или ингибиторам CDK4 в тамоксифен-резистентных и CCNE2 сверхэкспрессирующих клетках. (Caldon et al., Cyclin E2 overexpression is associated with endocrine resistance but not insensitivity to CDK2 inhibition in human breast cancer cells. Mol Cancer Ther. (2012) 11:1488-99; Herrera-Abreu et al., Early Adaptation and Acquired Resistance to CDK4/6 Inhibition in Estrogen Receptor-Positive Breast Cancer, Cancer Res. (2016) 76: 2301-2313). Также сообщается, что амплификация циклина E способствует устойчивости к трастузумабу при раке молочной железы HER2+. (Scaltriti et al. Cyclin E amplification/overexpression is a mechanism of trastuzumab resistance in HER2+ breast cancer patients, Proc Natl Acad Sci. (2011) 108: 3761-6). Сообщалось также, что сверхэкспрессия циклина Е играет роль в базальноподобном и трижды негативном раке молочной железы (TNBC), а также в отечно-инфильтративном раке молочной железы. (Elsawaf & Sinn, Triple Negative Breast Cancer: Clinical and Histological Correlations, Breast Care (2011) 6:273-278; Alexander et al., Cyclin E overexpression as a biomarker for combination treatment strategies in inflammatory breast cancer, Oncotarget (2017) 8: 14897-14911.)
Амплификация или сверхэкспрессия циклина Е1 (CCNE1) также связана с плохими исходами при раке яичников, желудка, эндометрия и других типах рака. (Nakayama et al., Gene amplification CCNE1 is related to poor survival and potential therapeutic target in ovarian cancer, Cancer (2010) 116: 2621-34; Etemadmoghadam et al., Resistance to CDK2 Inhibitors Is Associated with Selection of Polyploid Cells in CCNE1-Amplified Ovarian Cancer, Clin Cancer Res (2013) 19: 5960-71; Au-Yeung et al., Selective Targeting of Cyclin E1-Amplified High-Grade Serous Ovarian Cancer by Cyclin-Dependent Kinase 2 and AKT Inhibition, Clin. Cancer Res. (2017) 23:1862-1874; Ayhan et al., CCNE1 copy-number gain and overexpression identify ovarian clear cell carcinoma with a poor prognosis, Modern Pathology (2017) 30: 297-303; Ooi et al., Gene amplification of CCNE1, CCND1, and CDK6 in gastric cancers detected by multiplex ligation-dependent probe amplification and fluorescence in situ hybridization, Hum Pathol. (2017) 61: 58-67; Noske et al., Detection of CCNE1/URI (19q12) amplification by in situ hybridisation is common in high grade and type II endometrial cancer, Oncotarget (2017) 8: 14794-14805).
Низкомолекулярный ингибитор, динациклиб (MK-7965) ингибирует CDK1, CDK2, CDK5 и CDK9 и в настоящее время находится в клинической разработке для рака молочной железы и гематологического рака. Селициклиб (росковитин или CYC202), который ингибирует CDK2, CDK7 и CDK9, исследуется для лечения запущенных солидных опухолей в сочетании с химиотерапией. Несмотря на значительные усилия, на сегодняшний день нет одобренных средств, нацеленных на CDK2. Cicenas et al. Highlights of the Latest Advances in Research on CDK Inhibitors. Cancers, (2014) 6:2224-2242. Остается необходимость в обнаружении ингибиторов CDK, имеющих новые профили активности, в частности, те, которые нацелены на CDK2.
Краткое изложение
Настоящее изобретение, частично, относится к соединениям формул (I)-(VII) и их фармацевтически приемлемым солям. Такие соединения могут ингибировать активность CDK, включая CDK2, CDK4 и/или CDK6, тем самым влияя на биологические функции. Также предоставлены фармацевтические композиции и лекарственные средства, включающие соединения или соли по изобретению, отдельно или в комбинации с дополнительными противораковыми терапевтическими средствами или паллиативными средствами.
Настоящее изобретение также относится, частично, к способам получения соединений, фармацевтически приемлемых солей и композиций по изобретению, и способам применения вышеизложенного.
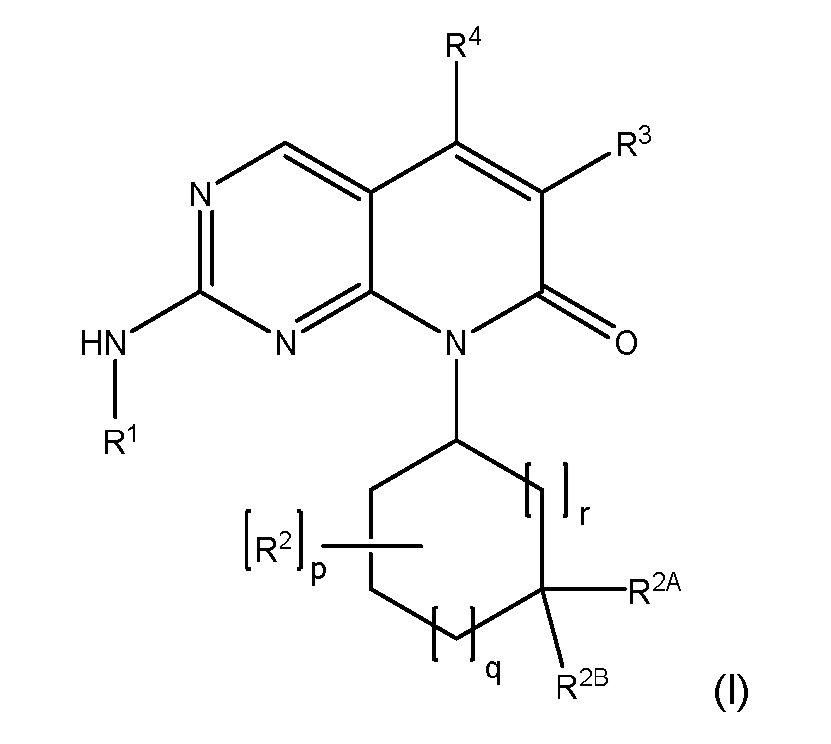
В одном аспекте изобретение относится к соединению формулы (I):
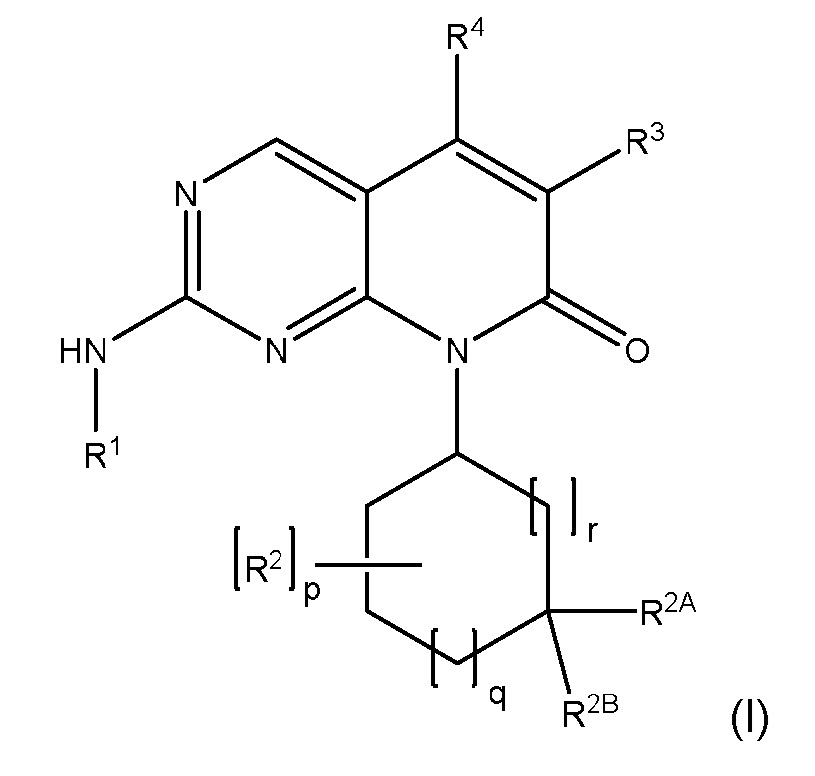
или его фармацевтически приемлемой соли,
где:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A, или C3-C8 циклоалкил, замещенный R5B, где указанные 3-10-членный гетероциклил и C3-C8 циклоалкил необязательно дополнительно замещены одним или несколькими R6;
каждый R2 независимо представляет собой F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси;
R2A и R2B независимо представляют собой H, F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси;
где каждый указанный C1-C4 алкил и C1-C4 фторалкил в R2, R2A и R2B независимо необязательно замещен OH, C1-C4 алкокси или C1-C4 фторалкокси;
R3 представляет собой H, F, Cl, NH2, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH;
R4 представляет собой H, C1-C2 алкил или C1-C2 фторалкил;
R5A представляет собой SO2R7, SO2NR8R9, NHSO2R7 или NHSO2NR8R9;
R5B представляет собой NHSO2R7 или NHSO2NR8R9;
каждый R6 независимо представляет собой F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси;
R7 представляет собой C1-C4 алкил, C1-C4 фторалкил, -L-(C3-C8 циклоалкил), -L-(5-6-членный гетероциклил) или -L-(5-6-членный гетероарил);
R8 и R9 независимо представляют собой H, C1-C4 алкил, C1-C4 фторалкил, -L-(C3-C8 циклоалкил), -L-(5-6-членный гетероциклил) или -L-(5-6-членный гетероарил); или
R8 и R9 могут быть взяты вместе с атомом азота, к которому они присоединены, с образованием 5-6-членного гетероциклила;
где каждый указанный C1-C4 алкил и C1-C4 фторалкил в R7, R8 и R9 необязательно замещен OH, C1-C4 алкокси, C1-C4 фторалкокси или SO2Me, и каждый указанный C3-C8 циклоалкил, 5-6-членный гетероциклил и 5-6-членный гетероарил в R7, R8 и R9 необязательно замещен C1-C4 алкилом, OH, C1-C4 алкокси или C1-C4 фторалкокси;
L представляет собой связь или C1-C4 алкилен, где указанный C1-C4 алкилен необязательно замещен OH, C1-C4 алкокси или C1-C4 фторалкокси;
p имеет значение 0, 1, 2, 3 или 4;
q имеет значение 0, 1, 2 или 3; и
r имеет значение 0, 1 или 2.
В другом аспекте изобретение относится к фармацевтической композиции, включающей соединение любой из формул, описанных в настоящем документе, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент. В некоторых вариантах осуществления, фармацевтическая композиция включает два или несколько фармацевтически приемлемых носителей и/или эксципиентов.
Изобретение также предоставляет терапевтические способы и применения, включающие введение соединения по изобретению или его фармацевтически приемлемой соли.
В другом аспекте изобретение относится к способу лечения аномального клеточного роста, в частности, рака, у субъекта, нуждающегося в этом, включающему введение субъекту терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. Соединения по изобретению могут быть введены в виде отдельных средств или могут быть введены в комбинации с другими противораковыми терапевтическими средствами, в частности, стандартными средствами лечения, подходящими для конкретного вида рака.
В дополнительном аспекте изобретение относится к способу лечения аномального клеточного роста, в частности, рака, у субъекта, нуждающегося в этом, включающему введение субъекту количества соединения по изобретению или его фармацевтически приемлемой соли, в комбинации с количеством дополнительного противоракового терапевтического средства, количества которых являются в совокупности эффективными при лечении указанного аномального клеточного роста.
В другом аспекте изобретение относится к соединению по изобретению или его фармацевтически приемлемой соли для применения в качестве лекарственного средства, в частности, лекарственного средства для лечения рака.
В другом аспекте изобретение относится к соединению по изобретению, его фармацевтически приемлемой соли, для применения при лечении аномального клеточного роста, в частности, рака, у субъекта.
В дополнительном аспекте изобретение относится к применению соединения по изобретению или его фармацевтически приемлемой соли для лечения аномального клеточного роста, в частности, рака, у субъекта.
В другом аспекте изобретение относится к фармацевтической композиции для применения при лечении аномального клеточного роста у субъекта, нуждающегося в этом, причем эта композиция включает соединение по изобретению или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент.
В еще одном аспекте изобретение относится к применению соединения любой из формул, описанных в настоящем описании, или его фармацевтически приемлемой соли, для получения лекарственного средства для лечения аномального клеточного роста у субъекта.
В обычных вариантах осуществления вышеуказанных соединений, способов и применений аномальный клеточный рост представляет собой рак.
В некоторых вариантах осуществления, предоставленные способы и применения приводят к одному или нескольким из следующих эффектов: (1) ингибирование пролиферации раковых клеток; (2) ингибирование инвазивности раковых клеток; (3) индукция апоптоза раковых клеток; (4) ингибирование метастазирования раковых клеток; или (5) ингибирование ангиогенеза.
В другом аспекте изобретение относится к способу лечения расстройства, опосредованного CDK2, у субъекта, включающему введение субъекту соединения по изобретению или его фармацевтически приемлемой соли в количестве, эффективном для лечения указанного расстройства, в частности, рака. В некоторых вариантах осуществления, расстройство представляет собой рак, который характеризуется амплификацией или сверхэкспрессией CCNE1 и/или CCNE2.
В другом аспекте изобретение относится к способу лечения расстройства, опосредованного CDK2, CDK4 и/или CDK6, у субъекта, включающему введение субъекту соединения по изобретению или его фармацевтически приемлемой соли в количестве, эффективном для лечения указанного расстройства, в частности, рака. В некоторых вариантах осуществления, расстройство представляет собой рак, который характеризуется амплификацией или сверхэкспрессией CCNE1 и/или CCNE2.
В некоторых вариантах осуществления, способы и применения, описанные в настоящем документе, дополнительно включают введение субъекту количества дополнительного противоракового терапевтического средства или паллиативного средства, количества которых являются в совокупности эффективными при лечении указанного аномального клеточного роста. Каждый из вариантов осуществления соединений по настоящему изобретению, описанных ниже, может быть объединен с одним или несколькими другими вариантами осуществления соединений по настоящему изобретению, описанными в настоящем документе, не противоречащими варианту(ам) осуществления, с которыми он комбинируется.
Кроме того, каждый из приведенных ниже вариантов осуществления, описывающих изобретение, включает в свой объем фармацевтически приемлемые соли соединений по изобретению. Соответственно, фраза «или его фармацевтически приемлемая соль» подразумевается в описании всех соединений, описанных в настоящем документе.
Краткое описание фигур
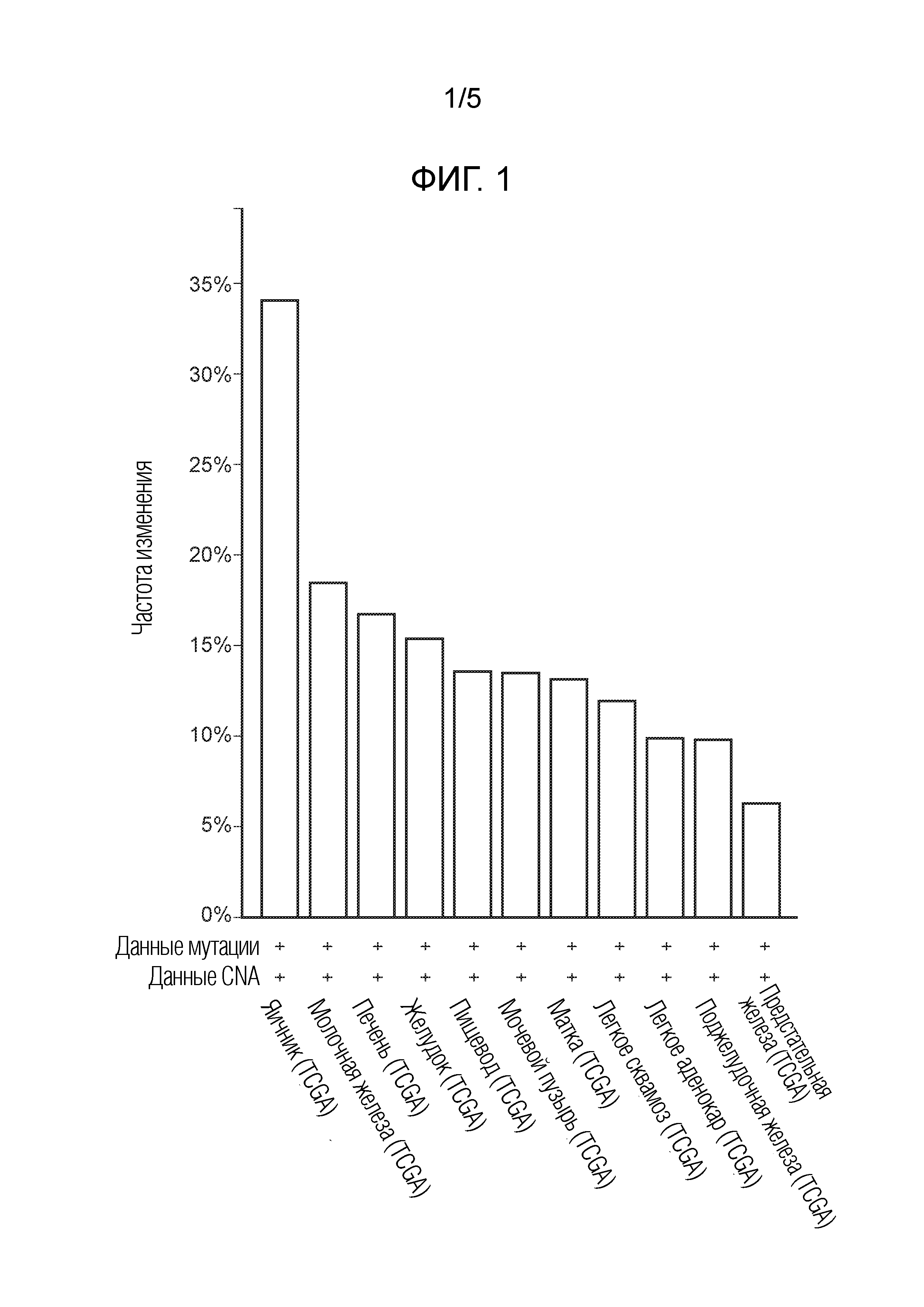
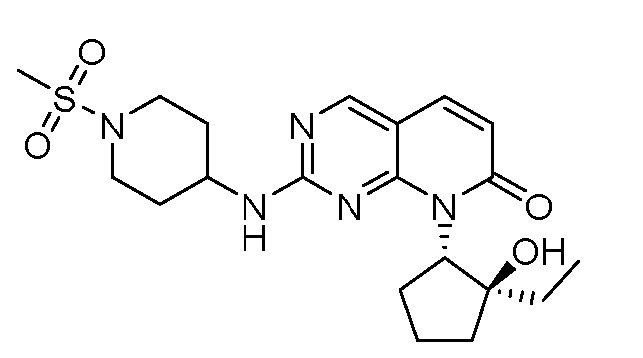
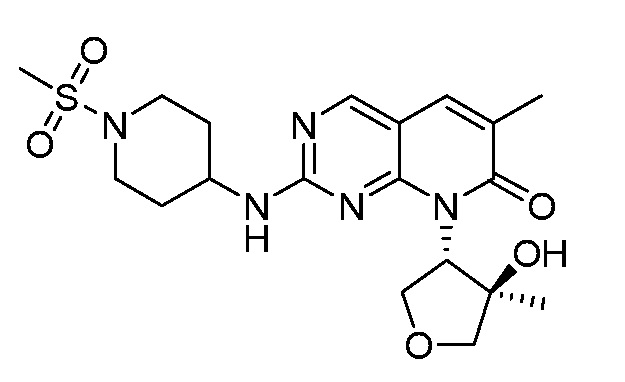
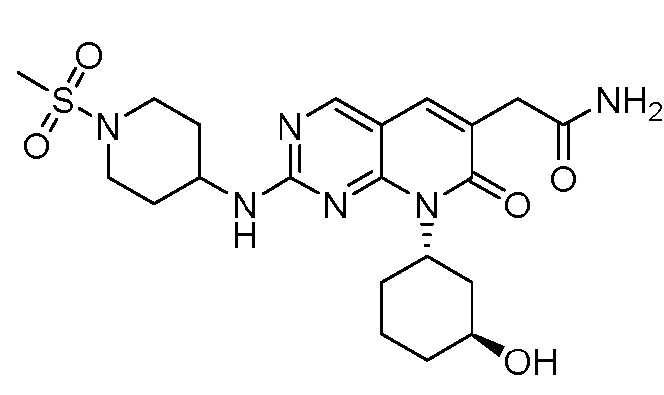
На фиг. 1 показана частота амплификации циклина E1/2 (CCNE1/2) по типу опухоли (http://oasis.pfizer.com/).
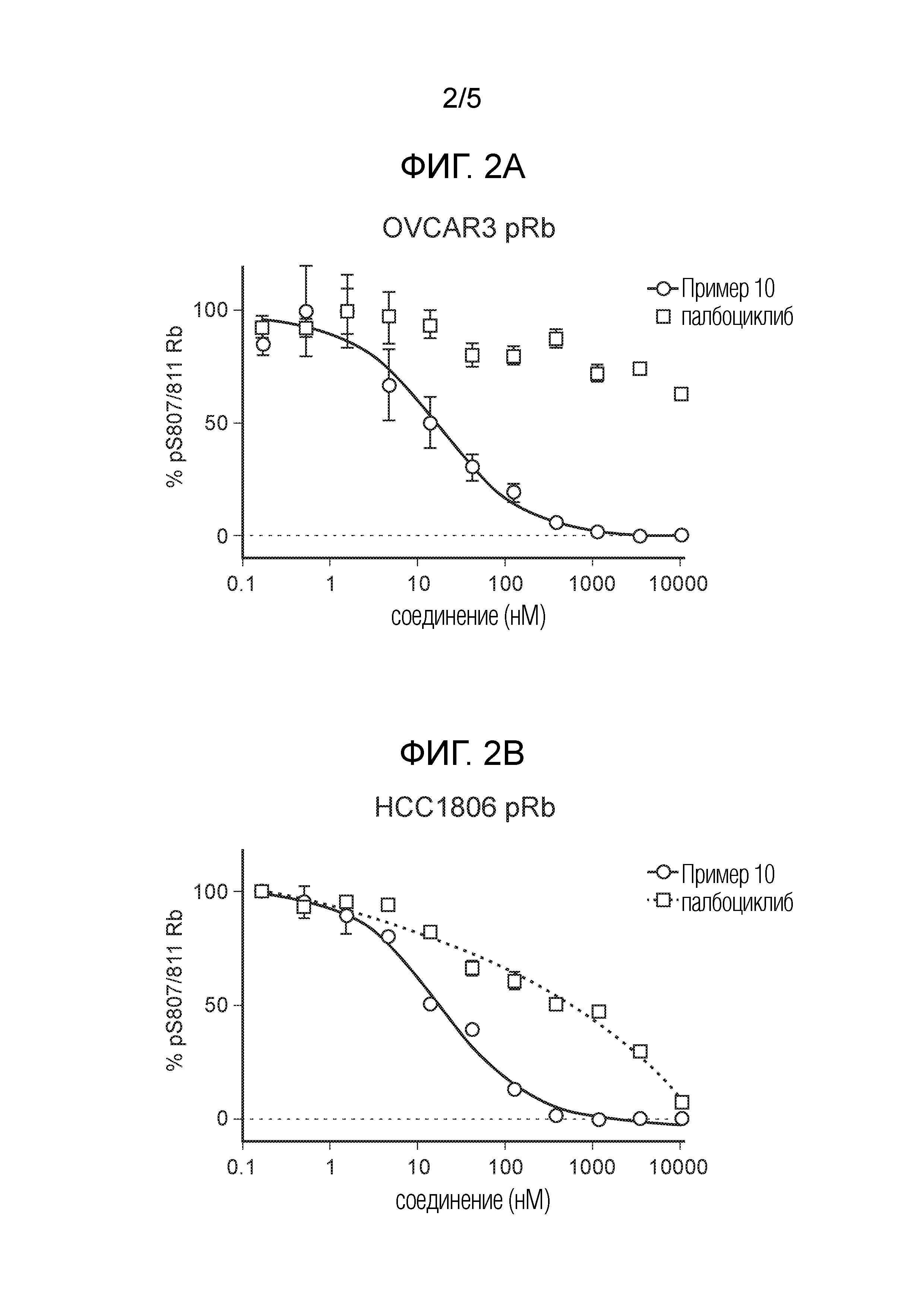
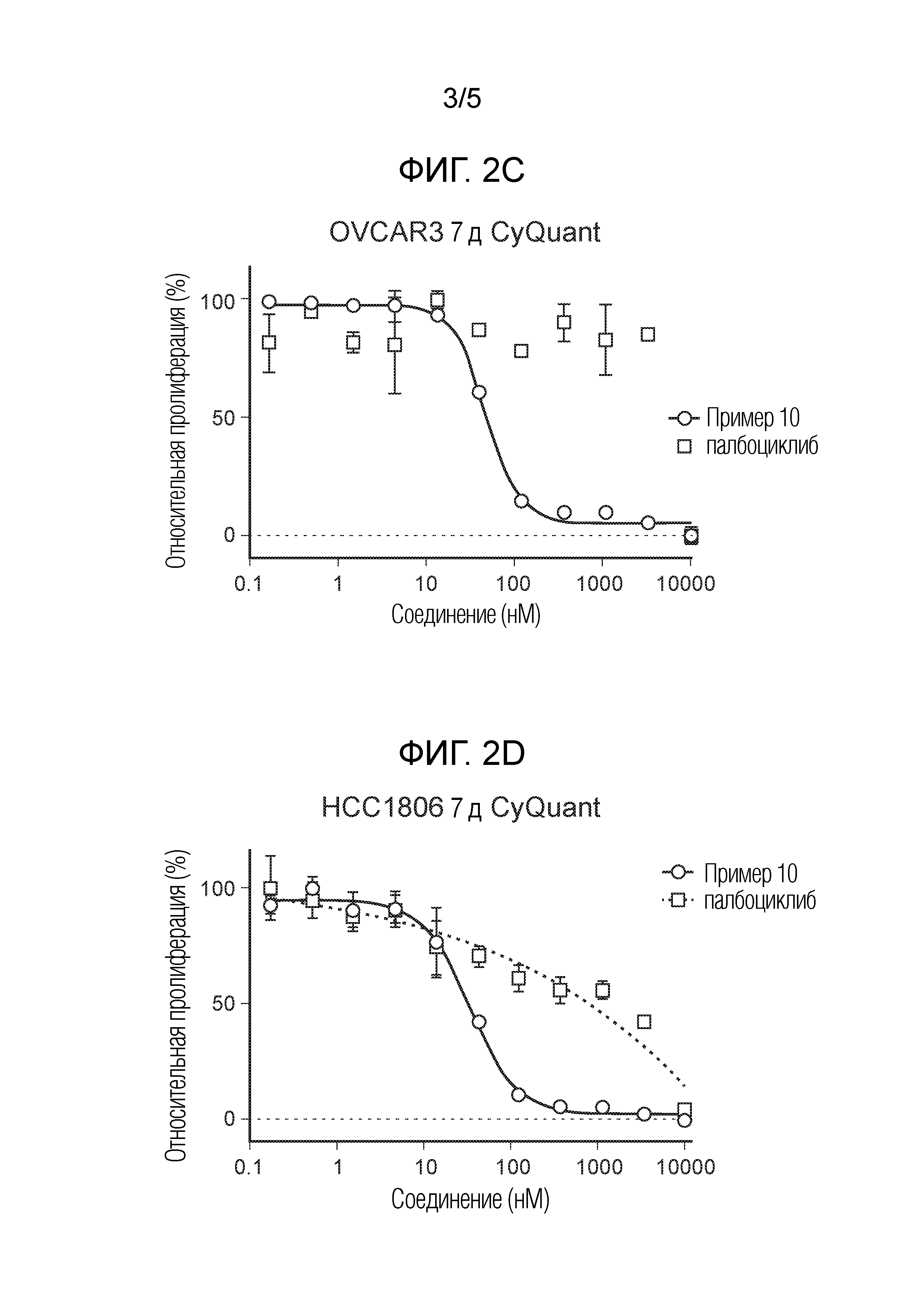
На фиг. 2 показаны данные IC50 in vitro для соединения примера 10 и палбоциклиба в (A) ELISA-анализе Rb Ovcar3 (CCNE амплифицированная карцинома яичника); (B) ELISA-анализе Rb HCC1806 (CCNE амплифицированный рак молочной железы); (C) анализе пролиферации клеток Ovcar3; и (D) анализе пролиферации клеток HCC1806.
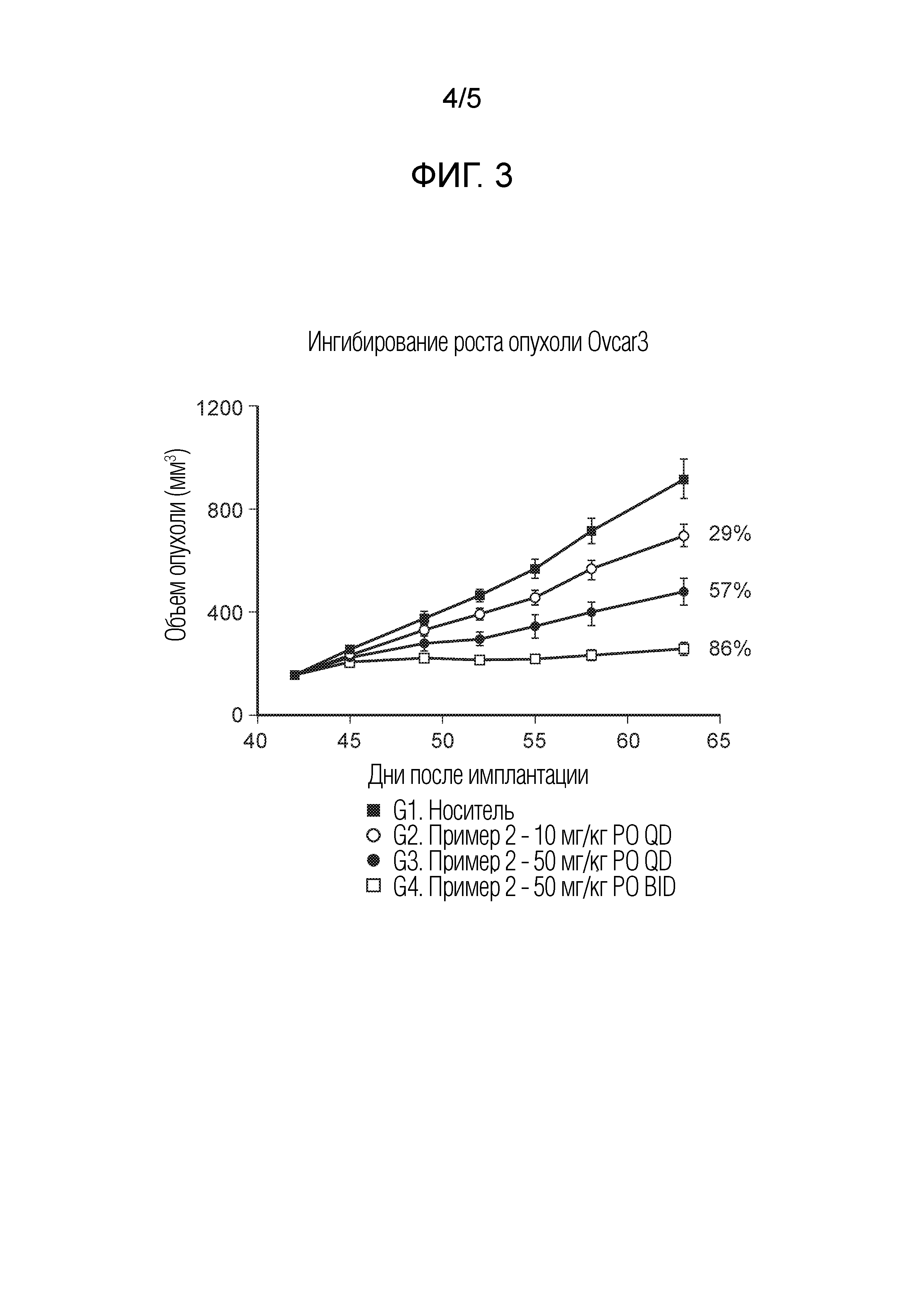
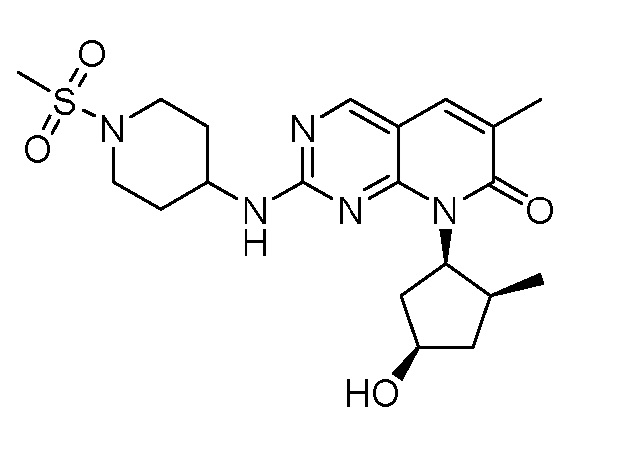
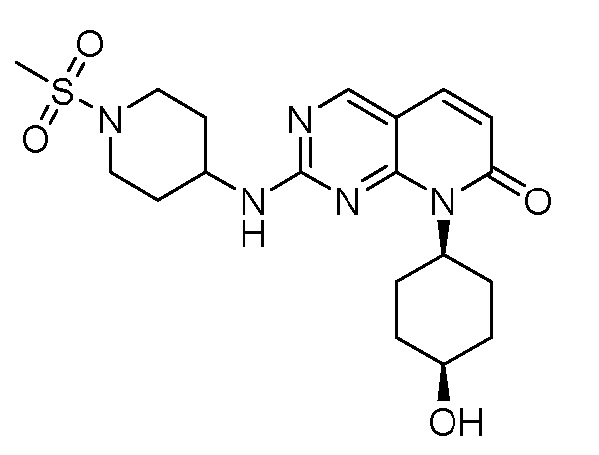
На фиг.3 показано ингибирование роста опухоли для соединения примера 2 в модели ксенотрансплантата опухоли мыши Ovcar3 при 10 мг/кг PO (перорально) QD (один раз в день), 50 мг/кг PO QD и 50 мг/кг PO BID (два раза в день).
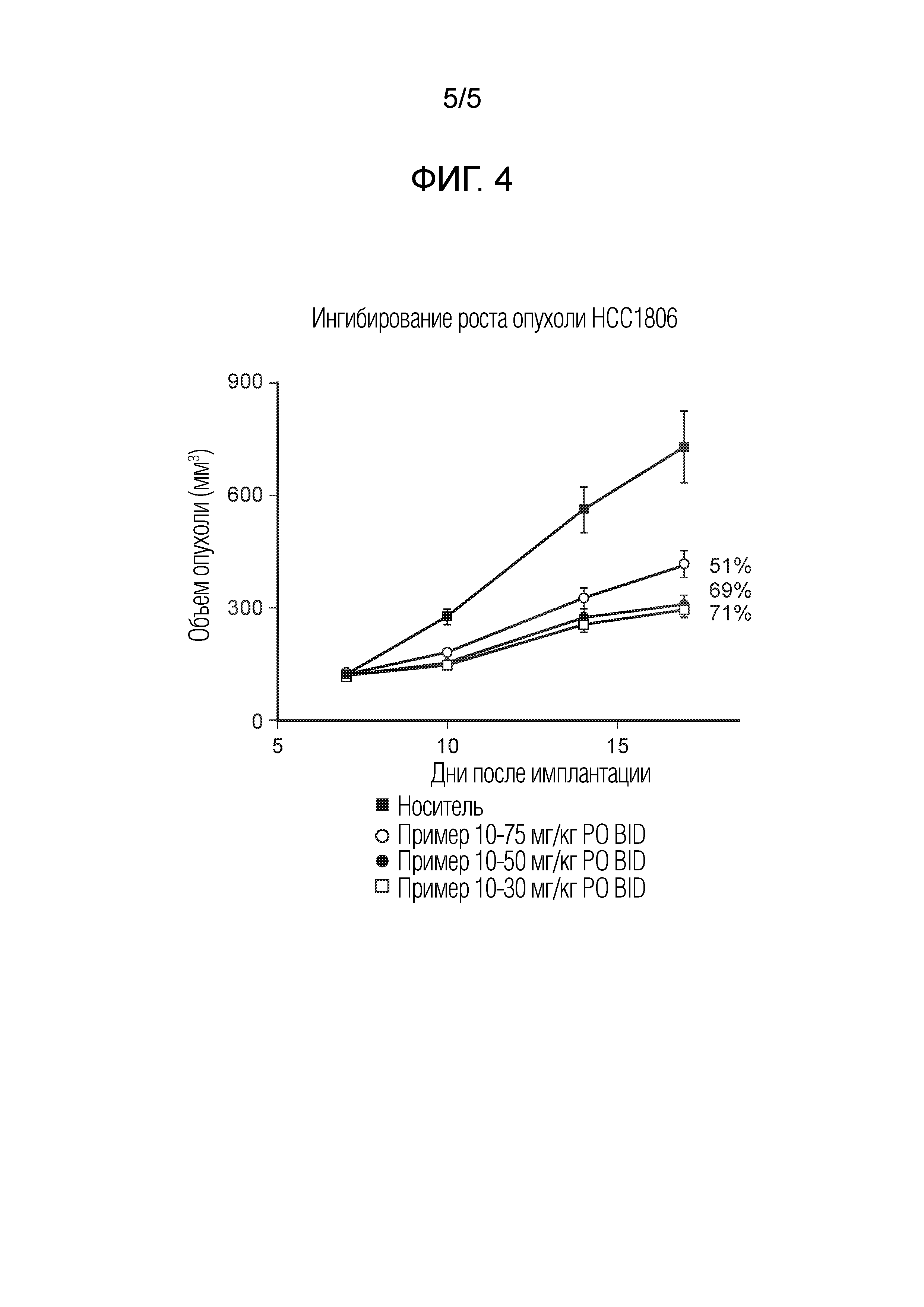
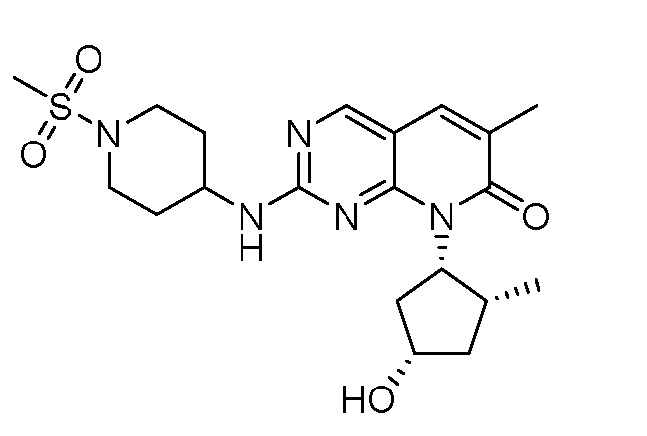
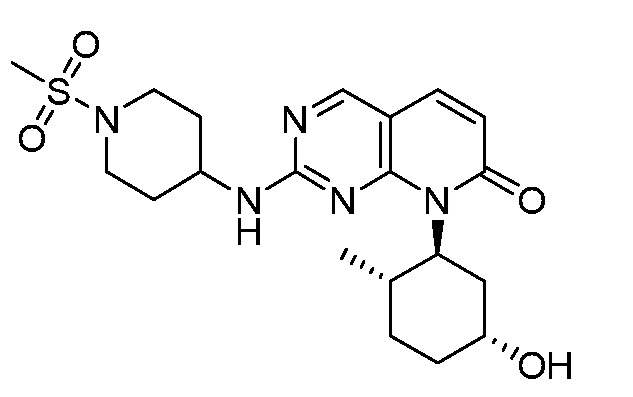
На фиг.4 показано ингибирование роста опухоли для соединения примера 10 в модели ксенотрансплантата опухоли мыши HCC1806 при 30 мг/кг PO BID, 50 мг/кг PO BID и 75 мг/кг PO BID.
Подробное описание
Настоящее изобретение может быть более легко понято посредством ссылки на следующее подробное описание предпочтительных вариантов осуществления изобретения и примеров, включенных в настоящее описание. Следует понимать, что используемая в настоящем описании терминология предназначена только для описания конкретных вариантов осуществления и не предназначена для ограничения. Кроме того, следует понимать, что если специально не определено в настоящем документе, терминология, используемая в настоящем документе, должна иметь свое обычное значение, известное в соответствующей области техники.
Как используется в настоящем документе, формы единственного числа включают формы множественного числа, если не указано иное. Например, заместитель включает один или несколько заместителей.
Изобретение, описанное в настоящем документе, соответствующим образом может быть осуществлено на практике в отсутствие какого-либо элемента(ов), конкретно не раскрытого в настоящем документе. Таким образом, например, в каждом случае в настоящем документе любой из терминов «включающий», «состоящий по существу из» и «состоящий из» может быть заменен любым из двух других терминов.
«Алкил» относится к насыщенному одновалентному алифатическому углеводородному радикалу, включая группы с прямой или разветвленной цепью, имеющие указанное число атомов углерода. Алкильные заместители обычно содержат 1-20 атомов углерода («C1-C20 алкил»), предпочтительно 1-12 атомов углерода («C1-C12 алкил»), более предпочтительно 1-8 атомов углерода («C1-C8 алкил»), или 1-6 атомов углерода («C1-C6 алкил») или 1-4 атомов углерода («C1-C4 алкил»). Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, н-гептил, н-октил и тому подобное. Алкильные группы могут быть замещенными или незамещенными. В частности, если не указано иное, алкильные группы могут быть замещены одной или несколькими галогеновыми группами, вплоть до общего числа атомов водорода, присутствующих в алкильной части. Таким образом, C1-C4 алкил включает галогенированные алкильные группы и, в частности, фторированные алкильные группы, имеющие от 1 до 4 атомов углерода, например, трифторметил или дифторэтил (т.е. CF3 и -CH2CHF2).
Алкильные группы, описанные в настоящем описании, как необязательно замещенные, могут быть замещены одной или несколькими группами заместителей, которые выбираются независимо, если не указано иное. Общее количество групп заместителей может равняться общему количеству атомов водорода в алкильном фрагменте, если такое замещение имеет химический смысл. Необязательно замещенные алкильные группы обычно содержат от 1 до 6 необязательных заместителей, иногда от 1 до 5 необязательных заместителей, предпочтительно от 1 до 4 необязательных заместителей или более предпочтительно от 1 до 3 необязательных заместителей.
Необязательные группы заместителей, подходящие для алкила, включают, но не ограничиваются ими, C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил и 5-12-членный гетероарил, галоген,=O (оксо),=S (тионо), =N-CN, =N-ORx, =NRx, -CN, -C(O)Rx, -CO2Rx, -C(O)NRxRy, -SRx, -SORx, -SO2Rx, -SO2NRxRy, -NO2, -NRxRy, -NRxC(O)Ry, -NRxC(O)NRxRy, -NRxC(O)ORx, -NRxSO2Ry, -NRxSO2NRxRy, -ORx, -OC(O)Rx и -OC(O)NRxRy; где каждый Rx и Ry независимо представляет собой Н, C1-C8 алкил, C1-C8 ацил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил или 5-12-членный гетероарил, или Rx и Ry могут быть взяты вместе с атомом N, к которому они присоединены, с образованием 3-12-членного гетероциклила или 5-12-членного гетероарила, каждый из которых необязательно содержит 1, 2 или 3 дополнительных гетероатомов, выбранных из O, N и S(O)q, где q имеет значение 0-2; каждый Rx и Ry необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, =O, =S, =N-CN, =N-OR', =NR', -CN, -C(O)R', -CO2R', -C(O)NR'2, -SOR', -SO2R', -SO2NR'2, -NO2, -NR'2, -NR'C(O)R', -NR'C(O)NR'2, -NR'C(O)OR', -NR'SO2R', -NR'SO2NR'2, -OR', -OC(O)R' и -OC(O)NR'2, где каждый R' независимо представляет собой H, C1-C8 алкил, C1-C8 ацил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил, или C5-C12 гетероарил; и где каждый указанный C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил и 5-12-членный гетероарил необязательно замещен, как далее определено в настоящем документе.
Типичные группы заместителей в алкиле включают галоген, -OH, C1-C4 алкокси, -O-C6-C12 арил, -CN, =O, -COORx, -OC(O)Rx, -C(O)NRxRy, -NRxC(O)Ry, -NRxRy, C3-C8 циклоалкил, C6-C12 арил, 5-12-членный гетероарил и 3-12-членный гетероциклил; где каждый Rx и Ry представляет собой независимо H или C1-C4 алкил, или Rx и Ry могут быть взяты вместе с N, к которому они присоединены, с образованием 3-12-членного гетероциклила или 5-12-членного гетероарильного кольца, каждый из которых необязательно содержит 1, 2 или 3 дополнительных гетероатома, выбранных из O, N и S(O)q, где q имеет значение 0-2; где каждый указанный C3-C8 циклоалкил, C6-C12 арил, 5-12-членный гетероарил и 3-12-членный гетероциклил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, =O, C1-C4 алкила, C1-C4 алкокси, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C1-C4 алкокси-C1-C6 алкила, -CN, -NH2, -NH(C1-C4 алкил) и -N(C1-C4 алкил)2.
В некоторых вариантах осуществления, алкил необязательно замещен одним или несколькими заместителями и предпочтительно 1-3 заместителями, которые независимо выбраны из группы, состоящей из галогена, -ОН, C1-C4 алкокси, -O-C6-C12 арила, -CN, =O, -COORx, -OC(O)Rx, -C(O)NRxRy, -NRxC(O)Ry, -NRxRy, C3-C8 циклоалкила, C6-C12 арила, 5-12-членного гетероарила и 3-12-членного гетероциклила; где каждый Rx и Ry представляет собой независимо H или C1-C4 алкил, или Rx и Ry могут быть взяты вместе с N, к которому они присоединены, с образованием 3-12-членного гетероциклила или 5-12-членного гетероарильного кольца, каждый из которых необязательно содержит 1, 2 или 3 дополнительных гетероатома, выбранных из O, N и S(O)x, где x имеет значение 0-2; и каждый указанный C3-C8 циклоалкил, C6-C12 арил, 5-12-членный гетероарил и 3-12-членный гетероциклил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, =O, C1-C4 алкила, C1-C4 алкокси, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C1-C4 алкокси-C1-C6 алкила, -CN, -NH2, -NH(C1-C4 алкил) и -N(C1-C4 алкил)2.
В других вариантах осуществления, алкил необязательно замещен одним или несколькими заместителями и предпочтительно 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, C1-C4 алкокси, -CN, -NRxRy, C3-C8 циклоалкила, 3-12-членного гетероциклила, C6-C12 арила и 5-12-членного гетероарила; где каждый Rx и Ry представляет собой независимо H или C1-C4 алкил, или Rx и Ry могут быть взяты вместе с N, к которому они присоединены, с образованием 3-12-членного гетероциклила или 5-12-членного гетероарильного кольца, каждый из которых необязательно содержит 1, 2 или 3 дополнительных гетероатома, выбранных из O, N и S(O)x, где x имеет значение 0-2; и где каждый указанный циклоалкил, гетероциклил, арил или гетероарил необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, =O, C1-C4 алкила, C1-C4 алкокси, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C1-C4 алкокси-C1-C6 алкила, -CN, -NH2, -NH(C1-C4 алкил) и -N(C1-C4 алкил)2.
В некоторых случаях замещенные алкильные группы могут быть названы конкретно со ссылкой на группу-заместитель. Например, «галогеналкил» относится к алкильной группе, имеющей конкретное число атомов углерода, которая замещена одним или несколькими галогеновыми заместителями, и обычно содержит 1-6 атомов углерода или предпочтительно 1-4 атома углерода или 1-2 атома углерода и 1, 2 или 3 атомов галогена (т.е. «C1-C6 галогеналкил», C1-C4 галогеналкил» или C1-C2 галогеналкил»). Более конкретно, фторированные алкильные группы могут конкретно упоминаться как фторалкильные группы, например, C1-C6, C1-C4 или C1-C2 фторалкильные группы, которые обычно замещены 1, 2 или 3 атомами фтора. Таким образом, C1-C4 фторалкил включает трифторметил (-CF3), дифторметил (-CF2H), фторметил (-CFH2), дифторэтил (-CH2CF2H), и тому подобное.
Аналогично, «гидроксиалкил» относится к алкильной группе, имеющей указанное число атомов углерода, которая замещена одним или несколькими гидроксизаместителями, и обычно содержит 1-6 атомов углерода, предпочтительно 1-4 атома углерода и 1, 2 или 3 гидрокси (т.е., ''C1-C6 гидроксиалкил''). Таким образом, C1-C6 гидроксиалкил включает гидроксиметил (-CH2OH) и 2-гидроксиэтил (-CH2CH2OH).
«Алкоксиалкил» относится к алкильной группе, имеющей указанное число атомов углерода, которая замещена одним или несколькими алкоксизаместителями. Алкоксиалкильные группы обычно содержат 1-6 атомов углерода в алкильной части и замещены 1, 2 или 3 C1-C4 алкоксизаместителями. Такие группы иногда определены в настоящем описании как C1-C4 алкокси-C1-C6 алкил.
«Аминоалкил» относится к алкильной группе, имеющей конкретное количество атомов углерода, которая замещена одной или несколькими замещенной или незамещенной аминогруппами, такими как группы, которые в дальнейшем определены в настоящем описании. Аминоалкильные группы обычно содержат 1-6 атомов углерода в алкильной части и замещены 1, 2 или 3 заместителями амино. Таким образом, C1-C6 аминоалкил включает, например, аминометил (-CH2NH2), N,N-диметиламиноэтил (-CH2CH2N(CH3)2), 3-(N-циклопропиламино)пропил (-CH2CH2CH2NH-cPr) и N-пирролидинилэтил (-CH2CH2-N-пирролидинил).
«Алкенил» относится к алкильной группе, как она определена в настоящем описании, состоящей из по меньшей мере двух атомов углерода и по меньшей мере одной двойной связи углерод-углерод. Обычно алкенильные группы имеют от 2 до 20 атомов углерода («C2-C20 алкенил»), предпочтительно от 2 до 12 атомов углерода («C2-C12 алкенил»), более предпочтительно от 2 до 8 атомов углерода («C2-C8 алкенил») или от 2 до 6 атомов углерода («C2-C6 алкенил»), или от 2 до 4 атомов углерода («C2-C4 алкенил»). Репрезентативные примеры включают, но не ограничиваются ими, этенил, 1-пропенил, 2-пропенил, 1-, 2- или 3-бутенил и тому подобное. Алкенильные группы могут быть незамещенными или замещены такими же группами, которые раскрыты в настоящем описании в качестве подходящих для алкила.
«Алкинил» относится к алкильной группе, как она определена в настоящем описании, состоящей по меньшей мере из двух атомов углерода и по меньшей мере одной тройной связи углерод-углерод. Алкинильные группы имеют от 2 до 20 атомов углерода («C2-C20 алкинил»), предпочтительно от 2 до 12 атомов углерода («C2-C12 алкинил»), более предпочтительно от 2 до 8 атомов углерода («C2-C8 алкинил») или от 2 до 6 атомов углерода («C2-C6 алкинил»), или от 2 до 4 атомов углерода («C2-C4 алкинил»). Репрезентативные примеры включают, но не ограничиваются ими, этинил, 1-пропинил, 2-пропинил, 1-, 2- или 3-бутинил и тому подобное. Алкинильные группы могут быть незамещенными или замещены такими же группами, которые раскрыты в настоящем описании в качестве подходящих для алкила.
"Алкилен", как используется в настоящем описании, относится к двухвалентной гидрокарбильной группе, имеющей конкретное количество атомов углерода, которая может связывать вместе две другие группы. Иногда он относится к группе -(CH2)t-, где t равен 1-8 и предпочтительно t равен 1-4. Где указано, алкилен также может быть замещен другими группами и может иметь одну или более степеней ненасыщенности (т.е. алкениленовую или алкиниленовую группировку) или колец. Не обязательно, чтобы открытые валентности алкилена находились у противоположных концов цепи. Таким образом, разветвленные алкиленовые группы, такие как -CH(Me)-, -CH2CH(Me)- и -C(Me)2- также включены в объем, охватываемый термином "алкилены", также как и циклические группы, такие как циклопропан-1,1-диил, и ненасыщенные группы, такие как этилен (-СН=СН-) или пропилен (-CH2-CH=CH-). Когда алкиленовая группа описана как необязательно замещенная, то заместители включают заместители, которые обычно присутствуют в алкильных группах, как описано в настоящем документе.
«Гетероалкилен» относится к алкиленовой группе, как описано выше, где один или несколько несмежных атомов углерода алкиленовой цепи заменены -N(R)-, -O- или -S(O)x-, где R представляет собой H или подходящую группу заместителей (например, R6) и x имеет значение 0-2. Например, группа -O-(CH2)1-4- представляет собой 'C2-C5'-гетероалкиленовую группу, где один из атомов углерода соответствующего алкилена заменен О.
"Алкокси" относится к одновалентной группе -O-алкил, где алкильная часть имеет конкретное количество атомов углерода. Алкоксигруппы обычно содержат от 1 до 8 атомов углерода ("C1-C8 алкокси"), или от 1 до 6 атомов углерода ("C1-C6 алкокси"), или от 1 до 4 атомов углерода ("C1-C4 алкокси"). Например, C1-C4 алкокси включает метокси, этокси, изопропокси, трет-бутилокси (то есть -OCH3, -OCH2CH3, -OCH(CH3)2, -OC(CH3)3), и тому подобное. Алкоксигруппы могут быть незамещенными или замещены в алкильной части такими же группами, которые раскрыты в настоящем описании в качестве подходящих для алкила. В частности, алкоксигруппы могут быть необязательно замещены одним или несколькими атомами галогена и, в частности, одним или несколькими атомами фтора, вплоть до общего количества атомов водорода, присутствующих в алкильной части. Такие группы упоминаются как «галогеналкокси» (или, где фторированные, более конкретно как «фторалкокси») группы, имеющие указанное число атомов углерода и замещенные одним или несколькими галогеновыми заместителями, Обычно такие группы содержат от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, и иногда и от 1 до 2 атомов углерода, и 1, 2 или 3 атомов галогена (то есть «C1-C6 галогеналкокси», «C1-C4 галогеналкокси») или «C1-C2 галогеналкокси»). Более конкретно, фторированные алкильные группы могут конкретно называться фторалкоксигруппами, например, C1-C6, C1-C4 или C1-C2 фторалкоксигруппы, которые обычно замещены 1, 2 или 3 атомами фтора. Таким образом, C1-C4 фторалкокси включает трифторметилокси (-OCF3), дифторметилокси (-OCF2H), фторметилокси (-OCFH2), дифторэтилокси (-OCH2CF2H), и тому подобное.
Аналогично, "тиоалкокси" относится к одновалентной -S-алкильной группе, где алкильная часть имеет конкретное количество атомов углерода и необязательно замещена в алкильной части такими же группами, которые раскрыты в настоящем описании в качестве подходящих для алкила. Например, C1-C4 тиоалкокси включает -SCH3 и -SCH2CH3.
"Циклоалкил" относится к неароматической, насыщенной или частично ненасыщенной карбоциклической кольцевой системе, содержащей конкретное количество атомов углерода, которая может быть моноциклической, спироциклической, мостиковой или конденсированной бициклической или полициклической кольцевой системой, которая связана с основой молекулы посредством атома углерода циклоалкильного кольца. Обычно циклоалкильные группы по изобретению содержат от 3 до 12 атомов углерода ("C3-C12 циклоалкил"), предпочтительно от 3 до 8 атомов углерода ("C3-C8 циклоалкил"). Репрезентативные примеры включают, например, циклопропан, циклобутан, циклопентан, циклопентен, циклогексан, циклогексен, циклогексадиен, циклогептан, циклогептатриен, адамантан и тому подобное. Циклоалкильные группы могут быть незамещенными или замещены такими же группами, которые раскрыты в настоящем описании в качестве подходящих для алкила.
Иллюстративные примеры циклоалкильных колец включают, но не ограничиваются ими, следующие кольца:
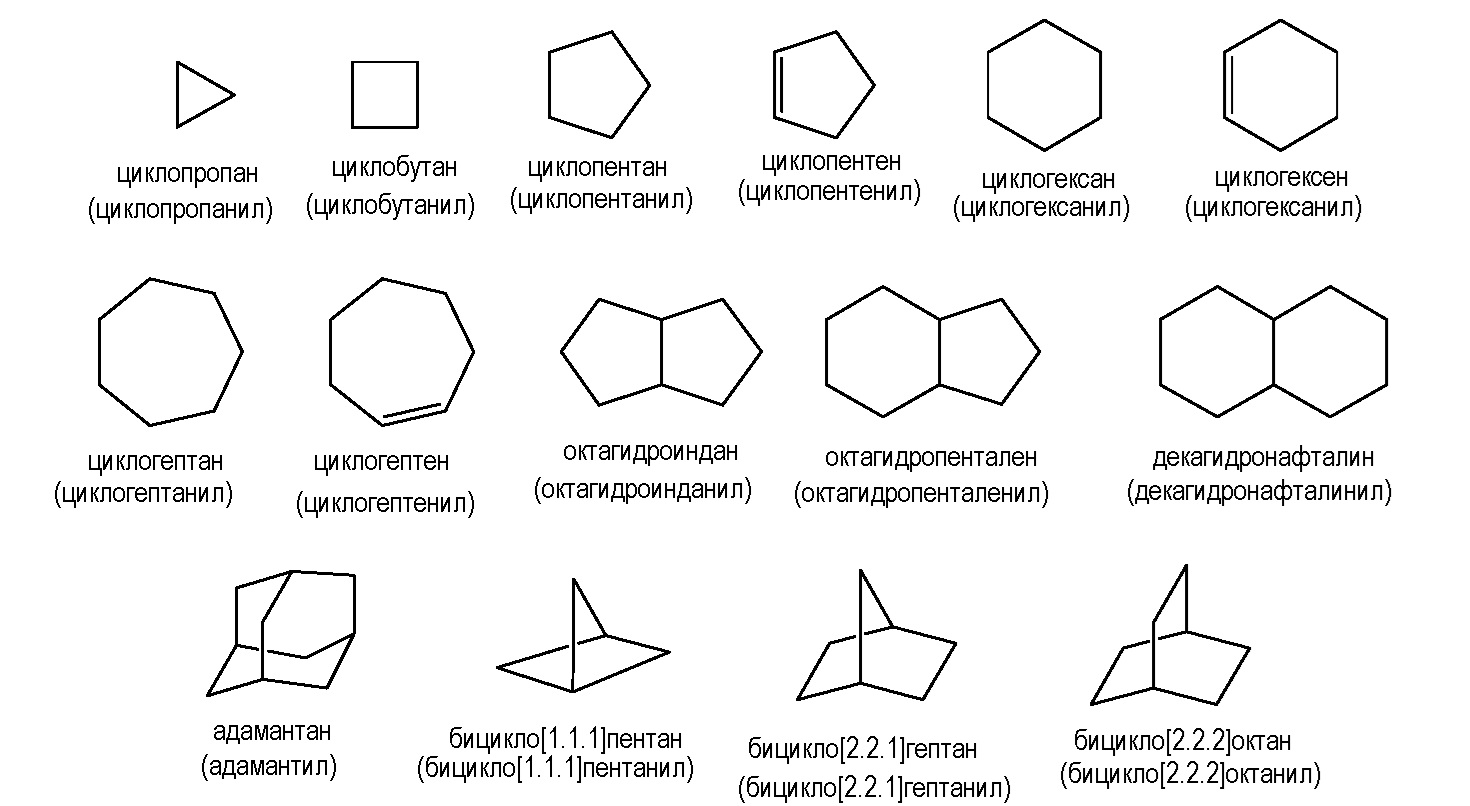
"Циклоалкилалкил" может быть использован для описания циклоалкильного кольца, обычно C3-C8 циклоалкила, которое соединено с основой молекулы посредством алкиленового линкера, обычно C1-C4 алкилена. Циклоалкилалкильные группы иногда описываются через общее количество атомов углерода в карбоциклическом кольце и линкере и обычно содержат 4-12 атомов углерода ("C4-C12 циклоалкилалкил"). Таким образом, циклопропилметильная группа представляет собой С4-циклоалкилалкильную группу, и циклогексилэтил представляет собой С8-циклоалкилалкил. Циклоалкилалкильные группы могут быть незамещенными или замещены в циклоалкильной и/или алкиленовой частях такими же группами, которые раскрыты в настоящем описании в качестве подходящих для алкильных групп. Иногда циклоалкилалкильные группы описываются в настоящем документе как -L- C3-C8-циклоалкил, где циклоалкильная группа имеет указанное количество атомов углерода и -L- относится к алкиленовому линкеру. Будет понятно, что когда -L- представляет собой связь, группа представляет собой циклоалкил.
Термины "гетероциклил", "гетероциклический" или "гетероалициклический" используются в настоящем описании взаимозаменяемо для обозначения неароматической, насыщенной или частично ненасыщенной кольцевой системы, содержащей конкретное количество кольцевых атомов, включая по меньшей мере один гетероатом, выбранный из N, О и S, в качестве кольцевого члена, где кольцевые атомы S необязательно замещены одной или двумя оксогруппами (то есть S(O)x, где x равно 0, 1 или 2) и где гетероциклическое кольцо связано с основой молекулы посредством кольцевого атома, которым может быть С или N. Гетероциклические кольца включают кольца, которые являются спироциклическими, мостиковыми или конденсированными с одним или несколькими другими гетероциклическими или карбоциклическими кольцами, где такие спироциклические, мостиковые или конденсированные кольца сами могут быть насыщенными, частично ненасыщенными или ароматическими в той степени, в которой ненасыщенность или ароматичность имеет химический смысл, при условии, что точка присоединения к основной молекуле представляет собой атом гетероциклической части кольцевой системы. Предпочтительно гетероциклические кольца содержат от 1 до 4 гетероатомов, выбранных из N, O и S(O)q, в качестве кольцевых членов, и более предпочтительно от 1 до 2 кольцевых гетероатомов, при условии, что такие гетероциклические кольца не содержат двух смежных атомов кислорода. Гетероциклильные группы являются незамещенными или замещены подходящими группами заместителей, например, такими же группами, которые раскрыты в настоящем описании в качестве подходящих для алкила, арила или гетероарила. Такие заместители могут присутствовать в гетероциклическом кольце, присоединенном к основной молекуле, или в спироциклическом, мостиковом или конденсированном кольце, присоединенном к нему. Кроме того, кольцевые атомы N необязательно замещены группами, подходящими для амина, например, алкильным, ацильным, карбамоильным, сульфонильным заместителями и тому подобное.
Гетероциклы обычно включают 3-12-членные гетероциклильные группы, предпочтительно 3-10-членные гетероциклильные группы и более предпочтительно 5-6-членные гетероциклильные группы, в соответствии с определением, приведенным в настоящем описании.
Иллюстративные примеры насыщенных гетероциклов включают, но не ограничиваются ими:
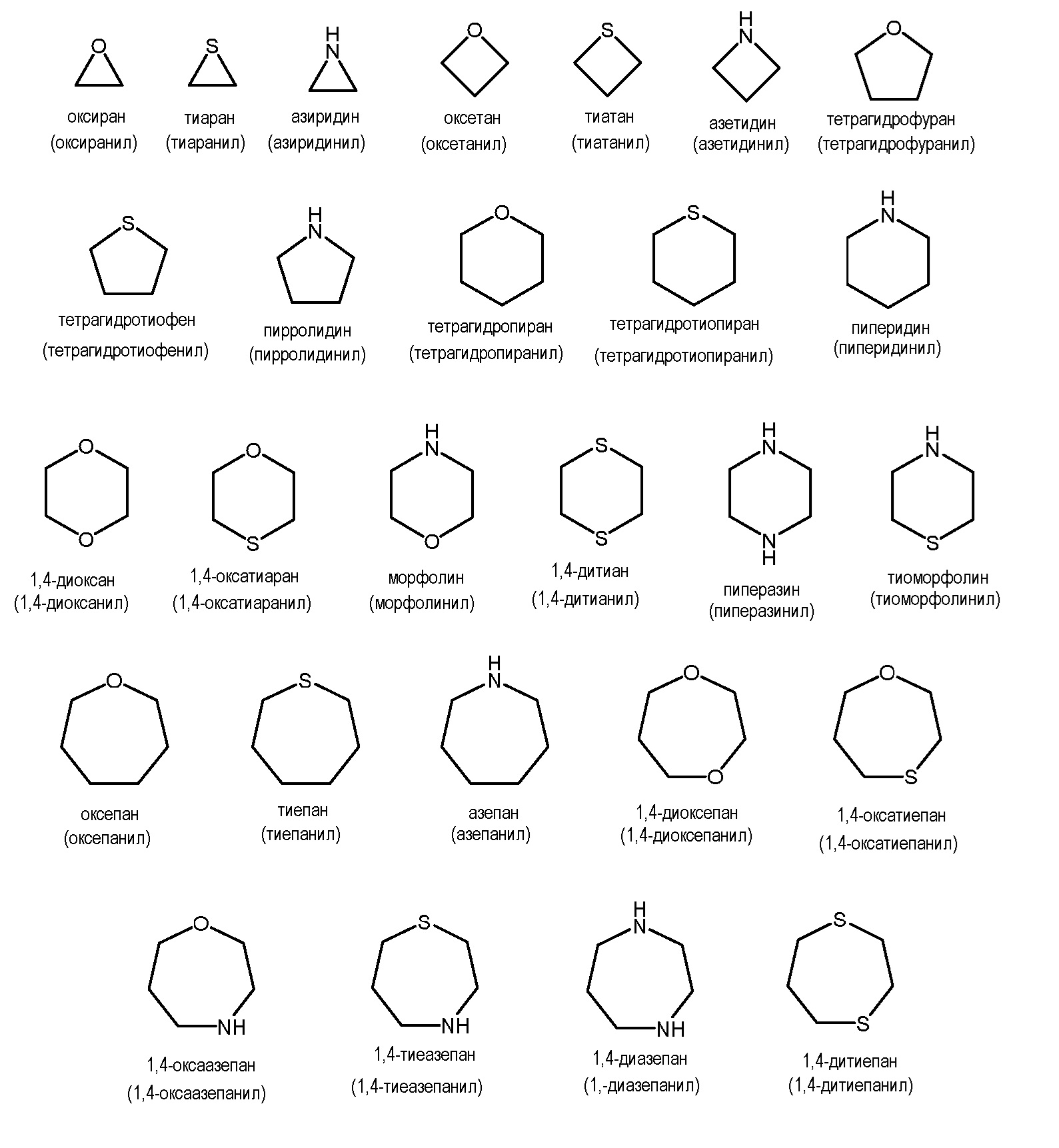
Иллюстративные примеры частично ненасыщенных гетероциклов включают, но не ограничиваются ими:
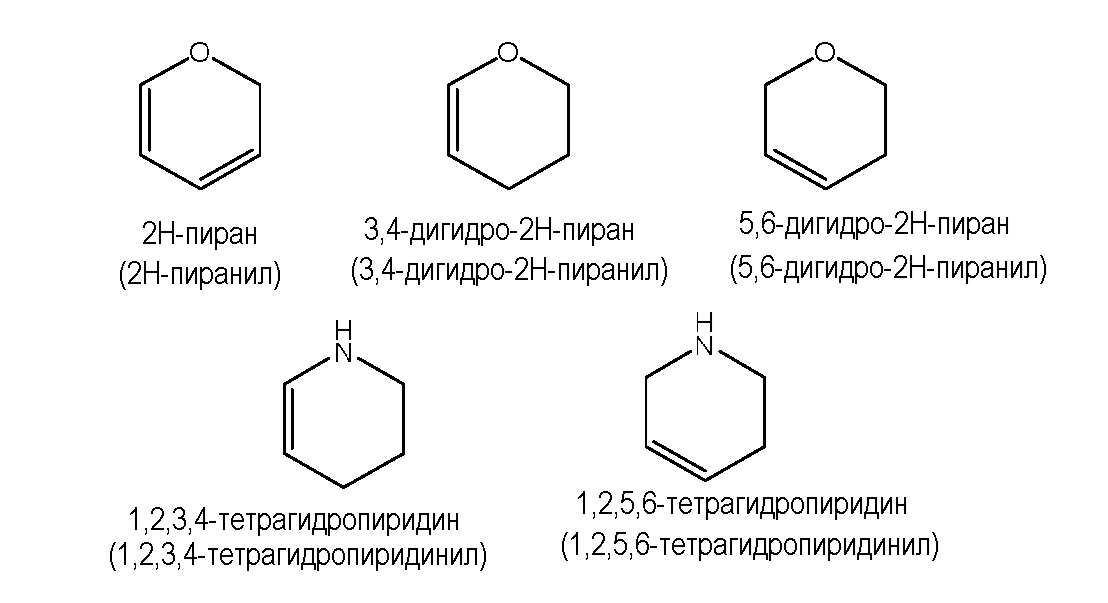
Иллюстративные примеры мостиковых, конденсированных и спиро гетероциклов включают, но не ограничиваются ими:
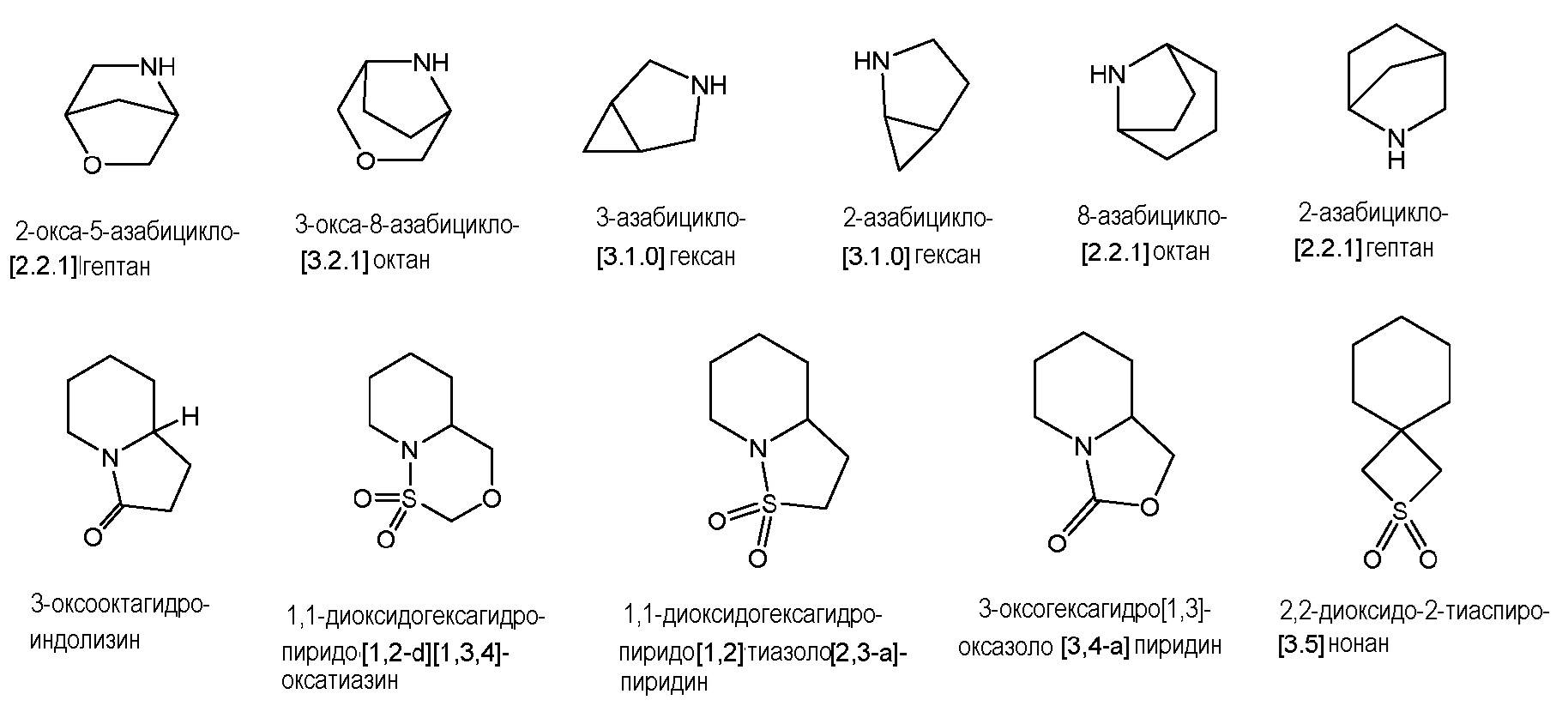
В обычных вариантах осуществления, гетероциклические группы содержат 3-12 кольцевых членов, включая, как атомы углерода, так и неуглеродные гетероатомы, и предпочтительно 4-7 кольцевых членов. В некоторых предпочтительных вариантах осуществления, группы-заместители, содержащие 3-12-членные гетероциклы выбраны из азетидинильного, пирролидинильного, пиперидинильного, пиперазинильного, азепанильного, диазепанильного, тетрагидрофуранильного, тетрагидропиранильного, тетрагидротиофенильного, тетрагидротиопиранильного, морфолинильного и тиоморфолинильного колец, каждое из которых необязательно замещено, как описано для конкретной группы-заместителя, если такое замещение имеет химический смысл.
Следует понимать, что не более двух атомов N, О или S обычно соединены последовательно, за исключением случая, когда оксогруппа присоединена к N или S с образованием нитро- или сульфонильной группы, или в случае некоторых гетероароматических колец, таких как триазин, триазол, тетразол, оксадиазол, тиадиазол и тому подобное.
Термин "гетероциклилалкил" может быть использован для описания гетероциклической группы конкретного размера, которая соединена с основной молекулой посредством алкиленового линкера конкретной длины. Обычно такие группы содержат необязательно замещенный 3-12-членный гетероцикл, присоединенный к основной молекулы посредством C1-C4 алкиленового линкера. В тех случаях, когда указано, такие группы могут быть необязательно замещены в алкиленовой части такими же группами, которые раскрыты в настоящем описании в качестве подходящих для алкильных групп, а в гетероциклической части группами, описанными в качестве подходящих для гетероциклических колец. Иногда гетероциклилалкильные группы описываются в настоящем документе как -L-гетероциклилалкил, где гетероциклилалкильная группа имеет указанное количество кольцевых атомов и -L- относится к алкиленовому линкеру. Будет понятно, что когда -L представляет собой связь, группа представляет собой гетероциклил.
"Арил" или "ароматический" относится к необязательно замещенной моноциклической или конденсированной бициклической или полициклической кольцевой системе, имеющей хорошо известные характеристики ароматичности, где по меньшей мере одно кольцо содержит полностью конъюгированную пи-электронную систему. Обычно арильные группы содержат от 6 до 20 атомов углерода ("C6-C20 арил") в качестве кольцевых членов, предпочтительно от 6 до 14 атомов углерода ("C6-C14 арил") или более предпочтительно от 6 до 12 атомов углерода ("C6-C12 арил"). Конденсированные арильные группы могут включать арильное кольцо (например, фенильное кольцо), конденсированное с другим арильным или гетероарильным кольцом, или конденсированное с насыщенным или частично ненасыщенным карбоциклическим или гетероциклическим кольцом, при условии, что точка присоединения к основной молекуле в таких конденсированных кольцевых системах представляет собой атом ароматической части кольцевой системы. Примеры, без ограничения, арильных групп включают фенил, бифенил, нафтил, антраценил, фенантренил, инданил, инденил и тетрагидронафтил. Арильная группа может быть незамещенной или замещена, как в дальнейшем раскрыто в настоящем описании.
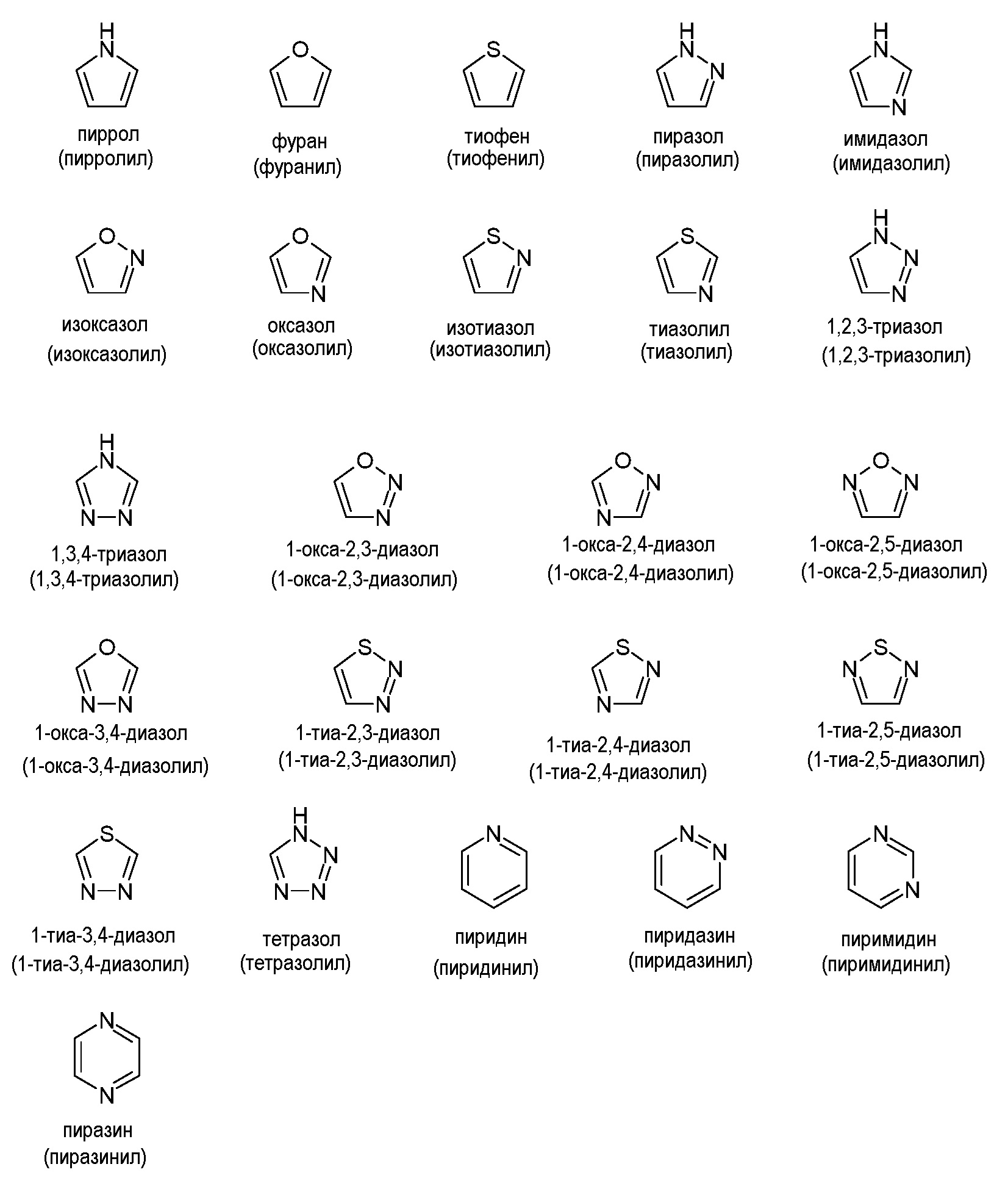
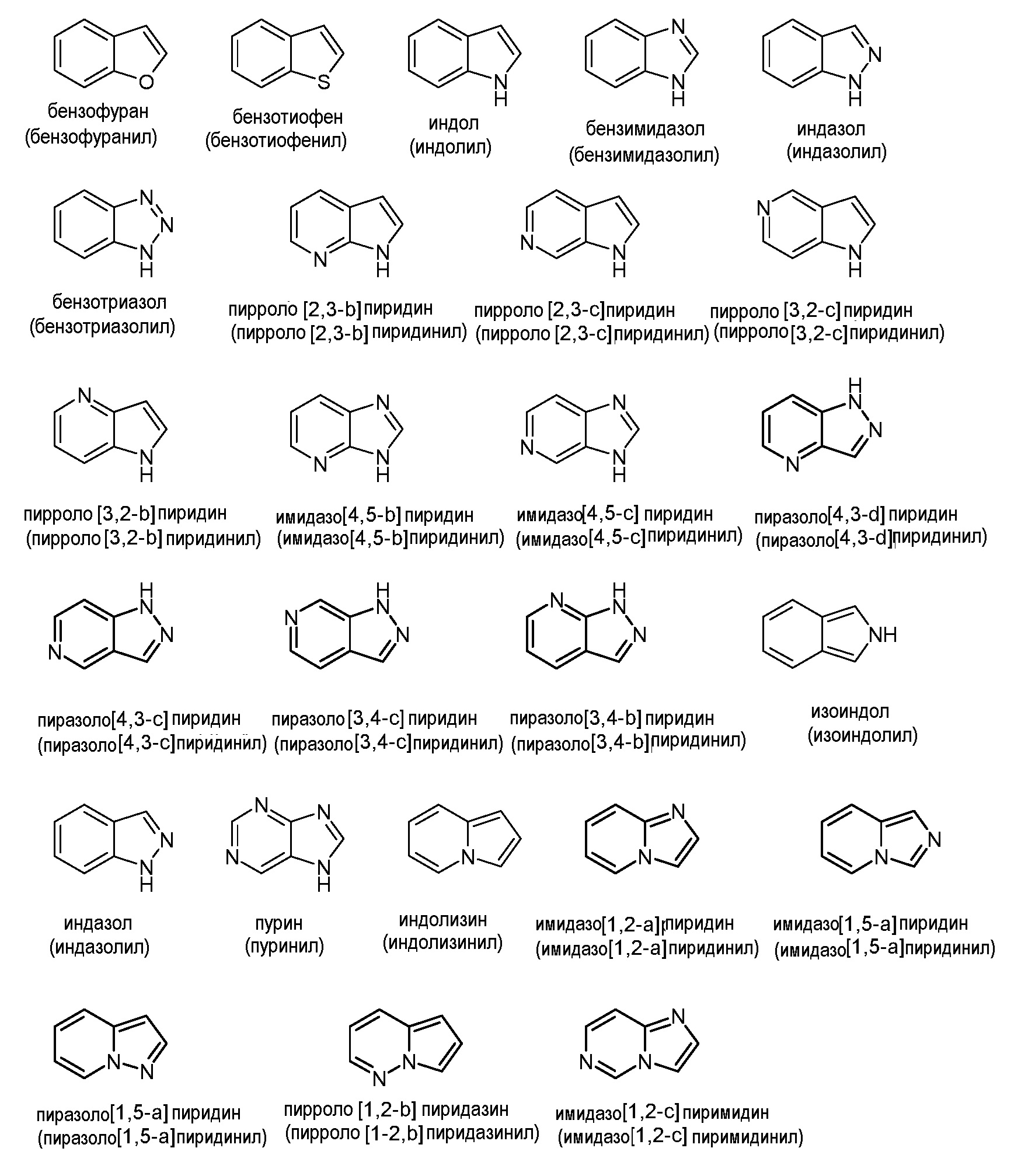
Аналогично, "гетероарил" или "гетероароматический" относятся к моноциклическим или конденсированным бициклическим или полициклическим кольцевым системам, обладающим хорошо известными характеристиками ароматичности, которые содержат конкретное количество кольцевых атомов и включают по меньшей мере один гетероатом, выбранный из N, О и S, в качестве кольцевого члена в ароматическом кольце. Включение гетероатома допускает ароматичность в 5-членных кольцах, а также в 6-членных кольцах. Обычно гетероарильные группы содержат от 5 до 20 кольцевых атомов ("5-20-членный гетероарил"), предпочтительно от 5 до 14 кольцевых атомов ("5-14-членный гетероарил") и более предпочтительно от 5 до 12 кольцевых атомов ("5-12-членный гетероарил"). Гетероарильные кольца присоединены к основной молекуле посредством кольцевого атома гетероароматического кольца, так что ароматичность сохраняется. Таким образом, 6-членные гетероарильные кольца могут быть присоединены к основной молекуле посредством кольцевого атома С, тогда как 5-членные гетероарильные кольца могут быть присоединены к основной молекуле посредством кольцевого атома С или N. Гетероарильные группы также могут быть конденсированы с другим арильным или гетероарильным кольцом или конденсированы с насыщенным или частично ненасыщенным карбоциклическим или гетероциклическим кольцом, при условии, что точка присоединения к основной молекуле в таких конденсированных кольцевых системах представляет собой атом гетероароматической части кольцевой системы. Примеры незамещенных гетероарильных групп часто включают, но не ограничиваются ими, пиррол, фуран, тиофен, пиразол, имидазол, изоксазол, оксазол, изотиазол, тиазол, триазол, оксадиазол, тиадиазол, тетразол, пиридин, пиридазин, пиримидин, пиразин, бензофуран, бензотиофен, индол, бензимидазол, индазол, хинолин, изохинолин, пурин, триазин, нафтиридин и карбазол. В часто встречающихся предпочтительных вариантах осуществления 5- или 6-членные гетероарильные группы выбраны из группы, состоящей из пирролильного, фуранильного, тиофенильного, пиразолильного, имидазолильного, изоксазолильного, оксазолильного, изотиазолильного, тиазолильного, триазолильного, пиридинильного и пиримидинильного, пиразинильного или пиридазинильного колец. Гетероарильная группа может быть незамещенной или замещена, как в дальнейшем раскрыто в настоящем описании.
Арильные, гетероарильные и гетероциклильные фрагменты, описанные в настоящем описании как необязательно замещенные, могут быть замещены одной или несколькими группами-заместителями, которые выбраны независимо, если не указано иное. Общее количество групп-заместителей может быть равно общему количеству атомов водорода в арильном, гетероарильном или гетероциклильном фрагменте в той степени, в которой такое замещение имеет химический смысл, и ароматичность сохраняется в случае арильных и гетероарильных колец. Необязательно замещенные арильные, гетероарильные или гетероциклильные группы обычно содержат от 1 до 5 необязательных заместителей, иногда от 1 до 4 необязательных заместителей, предпочтительно от 1 до 3 необязательных заместителей, или более предпочтительно от 1 до 2 необязательных заместителей.
Необязательные группы-заместители, подходящие для арильного, гетероарильного и гетероциклильного колец, включают, но не ограничиваются ими: C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил и 5-12-членный гетероарил; и галоген, =O, -CN, -C(O)Rx, -CO2Rx, -C(O)NRxRy, - SRx, -SORx, -SO2Rx, -SO2NRxRy, -NO2, -NRxRy, -NRxC(O)Ry, -NRxC(O)NRxRy, -NRxC(O)ORx, -NRxSO2Ry, -NRxSO2NRxRy, -ORx, -OC(O)Rx и -OC(O)NRxRy; где каждый Rx и Ry представляет собой независимо H, C1-C8 алкил, C1-C8 ацил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил, или 5-12-членный гетероарил, или Rx и Ry могут быть взяты вместе с атомом N, к которому они присоединены, с образованием 3-12-членного гетероциклила или 5-12-членного гетероарила, каждый из которых необязательно содержит 1, 2 или 3 дополнительных гетероатомов, выбранных из O, N и S(O)q, где q имеет значение 0-2; каждый Rx и Ry необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, =O, =S, =N-CN, =N-OR', =NR', -CN, -C(O)R', -CO2R', -C(O)NR'2, -SR', -SOR', -SO2R', -SO2NR'2, -NO2, -NR'2, -NR'C(O)R', -NR'C(O)NR'2, -NR'C(O)OR', -NR'SO2R', -NR'SO2NR'2, -OR', -OC(O)R' и -OC(O)NR'2, где каждый R' независимо представляет собой H, C1-C8 алкил, C1-C8 ацил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил или 5-12-членный гетероарил; и каждый указанный C1-C8 алкил, C2-C8 алкенил, C2-C8 алкинил, C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил и 5-12-членный гетероарил необязательно замещен, как далее определено в настоящем документе.
В типичных вариантах осуществления необязательное замещение в арильных, гетероарильных и гетероциклильных кольцах включает один или несколько заместителей и предпочтительно от 1 до 3 заместителей, независимо выбранных из группы, состоящей из галогена, C1-C8 алкила, -OH, C1-C8 алкокси, -CN, =O, -C(O)Rx, -COORx, -OC(O)Rx, -C(O)NRxRy, -NRxC(O)Ry, -SRx, -SORx, -SO2Rx, -SO2NRxRy, -NO2, -NRxRy, -NRxC(O)Ry, -NRxC(O)NRxRy, -NRxC(O)ORy -NRxSO2Ry, -NRxSO2NRxRy, -OC(O)Rx, -OC(O)NRxRy, C3-C8 циклоалкила, 3-12-членного гетероциклила, C6-C12 арила, 5-12-членного гетероарила, -O-(C3-C8 циклоалкил),-O-(3-12-членный гетероциклил), -O-(C6-C12 арил) и -O-(5-12-членный гетероарил); где каждый Rx и Ry представляет собой независимо H или C1-C4 алкил, или Rx и Ry могут быть взяты вместе с N, к которому они присоединены, с образованием 3-12-членного гетероциклила или 5-12-членного гетероарильного кольца, каждый из которых необязательно содержит 1, 2 или 3 дополнительных гетероатома, выбранных из O, N и S(O)q, где q имеет значение 0-2; и где каждый указанный C1-C8 алкил, C1-C8 алкокси, C3-C8 циклоалкил, 3-12-членный гетероциклил, C6-C12 арил, 5-12-членный гетероарил, -O-(C3-C8 циклоалкил),-O-(3-12-членный гетероциклил), -O-(C6-C12 арил) и -O-(5-12-членный гетероарил), который описан как необязательный заместитель или является частью Rx или Ry, необязательно замещен 1-3 заместителями, независимо выбранными из группы, состоящей из галогена, -OH, =O, C1-C4 алкила, C1-C4 алкокси, C1-C6 галогеналкила, C1-C6 гидроксиалкила, C1-C4 алкокси-C1-C6 алкила, -CN, -NH2, -NH(C1-C4 алкил), -N(C1-C4 алкил)2 и N- пирролидинила.
Примеры моноциклических гетероарильных групп включают, но не ограничиваются ими:
Иллюстративные примеры конденсированных кольцевых гетероарильных групп включают, но не ограничиваются ими:
"Арилалкильная" группа относится к арильной группе, как она раскрыта в настоящем описании, которая соединена с основной молекулой посредством алкиленового или аналогичного линкера. Арилалкильные группы описаны через общее количество атомов углерода в кольце и линкере. Таким образом, бензильная группа представляет собой C7-арилалкильную группу и фенилэтил представляет собой C8-арилалкил. Обычно арилалкильные группы содержат 7-16 атомов углерода ("C7-C16 арилалкил"), где арильная часть содержит 6-12 атомов углерода и алкиленовая часть содержит 1-4 атомов углерода. Такие группы также могут быть представлены как -C1-C4 алкилен-C6-C12 арил.
"Гетероарилалкил" относится к гетероарильной группе, как описано выше, которая присоединена к основной молекуле посредством алкиленового линкера и отличается от "арилалкила" тем, что по меньшей мере один кольцевой атом ароматического фрагмента представляет собой гетероатом, выбранный из N, О и S. Гетероарилалкильные группы иногда определены в настоящем описании в соответствии с общим количеством неводородных атомов (т.е. атомов С, N, S и О) в объединенных кольце и линкере за исключением групп-заместителей. Таким образом, например, пиридинилметил может иметь название "С7"-гетероарилалкил. Обычно незамещенные гетероарилалкильные группы содержат 6-20 неводородных атомов (включая атомы С, N, S и О), где гетероарильная часть обычно содержит 5-12 атомов, а алкиленовая часть обычно содержит 1-4 атомов углерода. Такие группы также могут быть представлены как -C1-C4 алкилен-5-12-членный гетероарил. Иногда гетероарилалкильные группы описываются в настоящем документе как -L- гетероарилалкил, где гетероарилалкильная группа имеет указанное количество кольцевых атомов и -L- относится к алкиленовому линкеру. Понятно, что когда -L представляет собой связь, группа представляет собой гетероарил.
Аналогично, "арилалкокси" и "гетероарилалкокси" относятся к арильным и гетероарильным группам, присоединенным к основной молекуле посредством гетероалкиленового линкера (т.е. -О-алкилен-), где группы описаны в соответствии с общим количеством неводородных атомов (т.е. атомов С, N, S и О) в объединенных кольце и линкере. Таким образом, -O-CH2-фенильные и -O-CH2-пиридинильные группы могут иметь названия С8-арилалкокси и С8-гетероарилалкокси группы, соответственно.
В тех случаях, когда арилалкильная, арилалкоксильная, гетероарилалкильная или гетероарилалкоксильная группы описаны как необязательно замещенные, заместители могут присутствовать либо в двухвалентной линкерной части либо в арильной или гетероарильной части группы. Заместители, необязательно присутствующие в алкиленовой или гетероалкиленовой части, являются такими же, как заместители, в целом описанные выше для алкильной группы или алкоксигруппы, а заместители, необязательно присутствующие в арильной или гетероарильной части, являются такими же, как заместители, в целом описанные выше для арильной или гетероарильной групп.
"Гидрокси" относится к группе -ОН.
"Ацилокси" относится к одновалентной группе -ОС(О)алкил, где алкильная часть имеет конкретное количество атомов углерода (обычно C1-C8, предпочтительно C1-C6 или C1-C4), которая необязательно замещена группами, подходящими для алкила. Таким образом, C1-C4 ацилокси включает заместитель -OC(O)C1-C4 алкил, например, -OC(O)CH3.
«Ацил» относится к одновалентной группе -C(O)алкил, где алкильная часть имеет конкретное количество атомов углерода (обычно C1-C8, предпочтительно C1-C6 или C1-C4) и может быть необязательно замещена группами, подходящими для алкила, например, F, ОН или алкокси. Таким образом, необязательно замещенный -C(O)C1-C4 алкил включает незамещенные ацильные группы, такие как -C(O)CH3 (т.е. ацетил) и -C(O)CH2CH3 (т.е. пропионил), а также замещенные ацильные группы такие как -C(O)CF3 (трифторацетил), -C(O)CH2OH (гидроксиацетил), -C(O)CH2OCH3 (метоксиацетил), -C(O)CF2H (дифторацетил) и тому подобное.
"Ациламино" относится к одновалентной группе -NHC(O)алкил или -NRC(О)алкил, где алкильная часть имеет конкретное количество атомов углерода (обычно C1-C8, предпочтительно C1-C6 или C1-C4) и необязательно замещена группами, подходящими для алкила. Таким образом, C1-C4 ациламино включает заместитель -NHC(O)C1-C4 алкил, например, -NHC(O)CH3.
«Арилокси» или «гетероарилокси» относятся к необязательно замещенному -О-арилу или -О-гетероарилу в каждом случае, когда арил и гетероарил имеют значения, определенные в настоящем описании далее.
«Ариламино» или «гетероариламино» относятся к необязательно замещенному -NH-арилу, -NR-арилу, -NH-гетероарилу или -NR-гетероарилу, в каждом случае, когда арил и гетероарил такие, как определено в настоящем описании, и R представляет собой заместитель, подходящий для амина, например, алкильная, ацильная, карбамоильная или сульфонильная группа или тому подобное.
"Циано" относится к группе -C≡N.
"Незамещенный амино" относится к группе -NH2. Если амино описан как замещенный или необязательно замещенный, то термин включает группы вида -NRxRy, где каждый из Rx и Ry независимо представляет собой Н, алкил, алкенил, алкинил, циклоалкил, гетероциклил, ацил, тиоацил, арил, гетероарил, циклоалкилалкил, арилалкил или гетероарилалкил, имеющий в каждом случае конкретное количество атомов и необязательно замещенный, как раскрыто в настоящем описании. Например, "алкиламино" относится к группе -NRxRy, где один из Rx и Ry представляет собой алкильную группу, а другой представляет собой Н, и "диалкиламино" относится к -NRxRy, где оба из Rx и Ry представляют собой алкильные группы, где алкильные группы имеют конкретное количество атомов углерода (например, -NH-C1-C4 алкил или -N(C1-C4 алкил)2). Обычно алкильные заместители в аминах содержат от 1 до 8 атомов углерода, предпочтительно от 1 до 6 атомов углерода или более предпочтительно от 1 до 4 атомов углерода. Этот термин также включает формы, где Rx и Ry взяты вместе с атомом N, к которому они присоединены, с образованием 3-12-членного гетероциклильного или 5-12-членного гетероарильного кольца, каждое из которых само может быть необязательно замещено, как раскрыто в настоящем описании для гетероциклильного или гетероарильного колец, и которые могут содержать от 1 до 3 дополнительных гетероатомов, выбранных из N, O и S(O)x, х имеет значение 0-2, в качестве кольцевых членов, при условии, что такие кольца не содержат двух смежных атомов кислорода.
"Галоген" или "галогено" относится к фтору, хлору, брому и йоду (F, C1, Br, I). Предпочтительно галоген относится к фтору или хлору (F или Cl).
«Необязательный» или «необязательно» означает, что событие или условие, описанные потом, не обязательно могут происходить, и описание включает случаи, когда событие или условие происходит, и случаи, когда оно не происходит.
Термины "необязательно замещенный" и "замещенный или незамещенный" используются взаимозаменяемо для указания на то, что конкретная описываемая группа может не иметь неводородных заместителей (т.е. незамещенная), или эта группа может иметь один или более неводородных заместителей (т.е. замещенная). Если не указано иное, общее количество заместителей, которые могут присутствовать, равно количеству атомов Н, присутствующих в незамещенной форме описываемой группы. Если необязательный заместитель присоединен посредством двойной связи, такой как заместитель оксо (=O), то группа занимает две доступные валентности, так что суммарное количество других заместителей, которые могут быть включены, уменьшается на два. В случае, когда необязательные заместители независимо выбраны из списка альтернатив, выбранные группы могут быть одинаковыми или разными. На протяжении всего описания будет понятно, что количество и природа необязательных групп заместителей будут ограничены в той степени, в которой такие замены имеют химический смысл.
В одном аспекте изобретение относится к соединению формулы (I):
или его фармацевтически приемлемой соли,
где:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A, или C3-C8 циклоалкил, замещенный R5B, где указанные 3-10-членный гетероциклил и C3-C8 циклоалкил необязательно дополнительно замещены одним или несколькими R6;
каждый R2 независимо представляет собой F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси;
R2A и R2B независимо представляют собой H, F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси;
где каждый указанный C1-C4 алкил и C1-C4 фторалкил в R2, R2A и R2B независимо необязательно замещен OH, C1-C4 алкокси или C1-C4 фторалкокси;
R3 представляет собой H, F, Cl, NH2, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH;
R4 представляет собой H, C1-C2 алкил или C1-C2 фторалкил;
R5A представляет собой SO2R7, SO2NR8R9, NHSO2R7 или NHSO2NR8R9;
R5B представляет собой NHSO2R7 или NHSO2NR8R9;
каждый R6 независимо представляет собой F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси;
R7 представляет собой C1-C4 алкил, C1-C4 фторалкил, -L-(C3-C8 циклоалкил), -L-(5-6-членный гетероциклил) или -L-(5-6-членный гетероарил);
R8 и R9 независимо представляют собой H, C1-C4 алкил, C1-C4 фторалкил, -L-(C3-C8 циклоалкил), -L-(5-6-членный гетероциклил) или -L-(5-6-членный гетероарил); или
R8 и R9 могут быть взяты вместе с атомом азота, к которому они присоединены, с образованием 5-6-членного гетероциклила;
где каждый указанный C1-C4 алкил и C1-C4 фторалкил в R7, R8 и R9 необязательно замещен OH, C1-C4 алкокси, C1-C4 фторалкокси или SO2Me, и каждый указанный C3-C8 циклоалкил, 5-6-членный гетероциклил и 5-6-членный гетероарил в R7, R8 и R9 необязательно замещен C1-C4 алкилом, OH, C1-C4 алкокси или C1-C4 фторалкокси;
L представляет собой связь или C1-C4 алкилен, где указанный C1-C4 алкилен необязательно замещен C1-C4 алкилом, OH, C1-C4 алкокси или C1-C4 фторалкокси;
p имеет значение 0, 1, 2, 3 или 4;
q имеет значение 0, 1 или 2; и
r имеет значение 0, 1 или 2.
В некоторых вариантах осуществления, соединение формулы (I) имеет абсолютную стереохимию, как показано в формуле (I-A), (I-B) или (I-C):
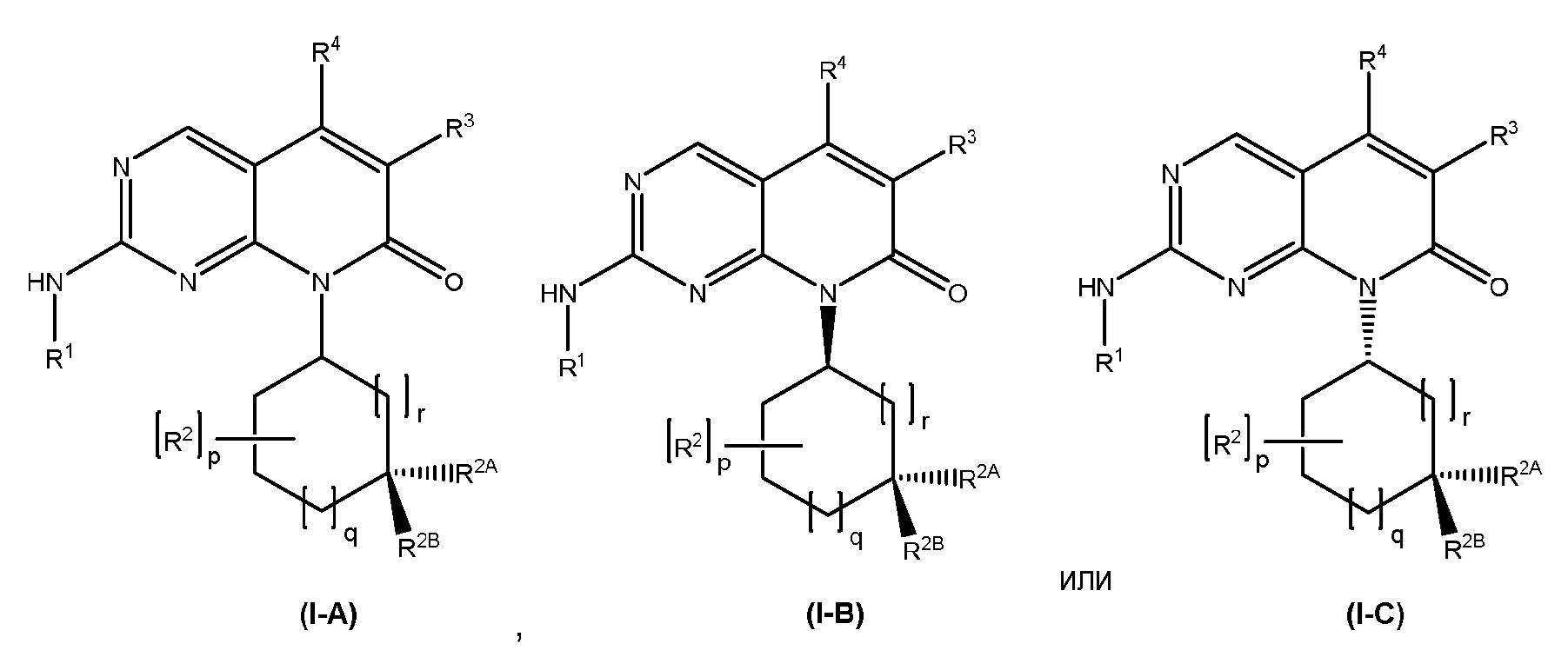
или его фармацевтически приемлемая соль, где R1, R2, R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8, R9, p, q и r имеют значения такие, как определены для формулы (I).
Каждый из аспектов и вариантов осуществления, описанных в настоящем документе, в отношении формулы (I), также применим к соединениям формулы (I-A), (I-B) или (I-C).
В соединениях формулы (I), R1 представляет собой 3-10-членный гетероциклил, замещенный R5A, или C3-C8 циклоалкил, замещенный R5B, где указанные 3-10-членный гетероциклил и C3-C8 циклоалкил необязательно дополнительно замещены одним или несколькими R6.
В некоторых вариантах осуществления формулы (I), R1 представляет собой 3-10-членный гетероциклил, замещенный R5A, и, необязательно, дополнительно замещенный одним или несколькими R6. В некоторых таких вариантах осуществления, R1 представляет собой 5-6-членный гетероциклил, замещенный R5A, и, необязательно, дополнительно замещенный одним или несколькими R6. В некоторых таких вариантах осуществления, R1 представляет собой 5-6-членный гетероциклил, замещенный R5A. В конкретных вариантах осуществления, R1 представляет собой 5-6-членный азотсодержащий гетероциклил, замещенный R5A. В некоторых таких вариантах осуществления, представляет собой пиперидинильное или пирролидинильное кольцо. В конкретных вариантах осуществления, R1 представляет собой пиперидин-4-ил, пиперидин-3-ил или пирролидин-3-ил. В обычных вариантах осуществления, R1 представляет собой 5-6-членный азотсодержащий гетероциклил, который N-замещен R5A. В обычных вариантах осуществления, R1 представляет собой пиперидин-4-ил, для которого N1 пиперидинильного кольца замещен R5A. В других вариантах осуществления, R1 представляет собой пиперидин-3-ил, для которого N1 пиперидинильного кольца замещен R5A. В дополнительных вариантах осуществления, R1 представляет собой пирролидин-3-ил, для которого N1 пирролидинильного кольца замещен R5A.
В каждом из вышеупомянутых вариантов осуществления, R1 необязательно дополнительно замещен одним или несколькими R6. В некоторых вариантах осуществления, R1 необязательно дополнительно замещен одним, двумя или тремя R6. В дополнительных вариантах осуществления, R1 необязательно дополнительно замещен одним или двумя R6. В некоторых вариантах осуществления, R1 представляет собой 3-10-членный азотсодержащий гетероциклил, замещенный R5A, и дополнительно замещенный одним, двумя или тремя R6, где каждый R6 независимо представляет собой F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси, как дополнительно описано в настоящем документе. В некоторых вариантах осуществления, R1 представляет собой 3-10-членный азотсодержащий гетероциклил, замещенный R5A, и дополнительно замещенный одним или двумя R6, где каждый R6 независимо представляет собой F или CH3.
В конкретных вариантах осуществления, R1 представляет собой 5-6-членный азотсодержащий гетероциклил, который N-замещен R5A, который выбран из группы, состоящей из:
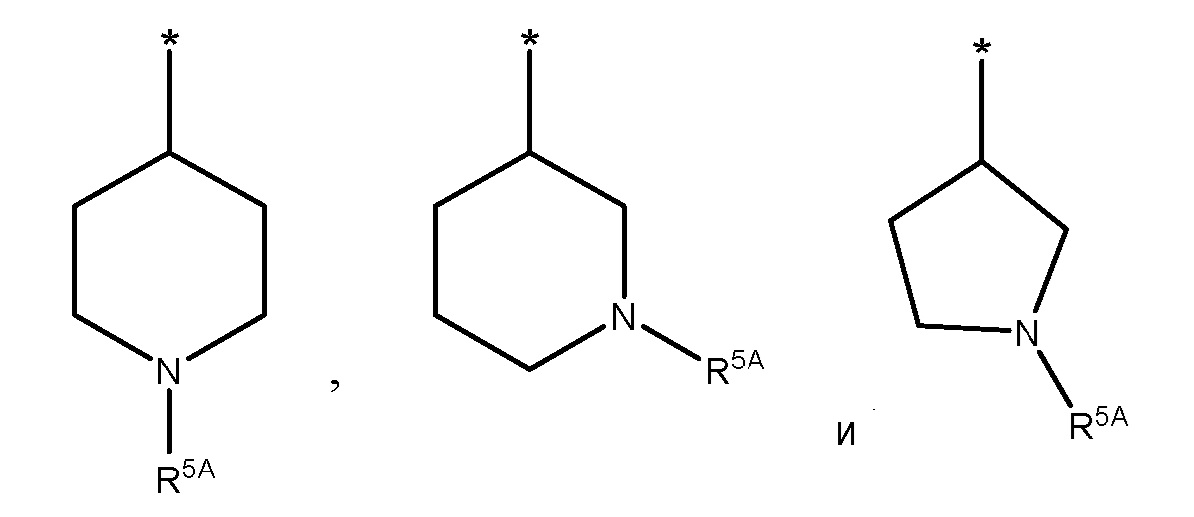
где * представляет собой точку присоединения к 2-амино-заместителю.
В конкретных вариантах осуществления, R1 представляет собой
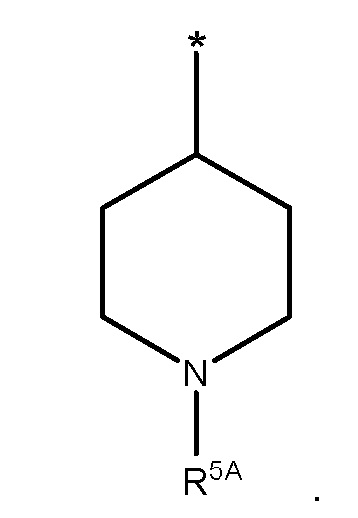
В некоторых таких вариантах осуществления, R5A представляет собой SO2R7 или SO2NR8R9.
В соединениях формулы (I), R5A представляет собой SO2R7, SO2NR8R9, NHSO2R7 или NHSO2NR8R9, где R7, R8 и R9 имеют значения, определенные для формулы (I), и дополнительно описанные в настоящем документе. В некоторых вариантах осуществления формулы (I), R1 представляет собой 3-10-членный гетероциклил и R5A представляет собой SO2R7 или SO2NR8R9. В других вариантах осуществления, R1 представляет собой 3-10-членный гетероциклил и R5A представляет собой NHSO2R7 или NHSO2NR8R9.
В некоторых вариантах осуществления формулы (I), R1 представляет собой 3-10-членный гетероциклил и R5A представляет собой SO2R7 или SO2NR8R9. В некоторых таких вариантах осуществления, R1 представляет собой пиперидинил или пирролидинил и R5A представляет собой SO2R7 или SO2NR8R9. В конкретных вариантах осуществления, R1 представляет собой пиперидин-4-ил, пиперидин-3-ил или пирролидин-3-ил и R5A представляет собой SO2R7 или SO2NR8R9. В обычных вариантах осуществления, R1 представляет собой пиперидин-4-ил, для которого N1 пиперидинильного кольца замещен R5A, где R5A представляет собой SO2R7 или SO2NR8R9. В других вариантах осуществления, R1 представляет собой пиперидин-3-ил, для которого N1 пиперидинильного кольца замещен R5A, где R5A представляет собой SO2R7 или SO2NR8R9. В других вариантах осуществления, R1 представляет собой пирролидин-3-ил, для которого N пирролидинильного кольца замещен R5A, где R5A представляет собой SO2R7 или SO2NR8R9. В каждом из вышеупомянутых вариантов осуществления, R1 необязательно дополнительно замещен одним или несколькими R6.
В некоторых вариантах осуществления формулы (I), R1 представляет собой 5-6-членный гетероциклил и R5A представляет собой SO2R7. В других вариантах осуществления формулы (I), R1 представляет собой 5-6-членный N-содержащий гетероциклил и R5A представляет собой SO2R7. В обычных вариантах осуществления, R1 представляет собой 5-6-членный N-содержащий гетероциклил, замещенный у N R5A, где R5A представляет собой SO2R7. В некоторых таких вариантах осуществления, R7 представляет собой CH3. В конкретных вариантах осуществления, R1 представляет собой пиперидин-4-ил, замещенный у N1 R5A, где R5A представляет собой SO2R7 и R7 представляет собой CH3.
В еще других вариантах осуществления формулы (I), R1 представляет собой 5-6-членный гетероциклил и R5A представляет собой SO2NR8R9. В некоторых таких вариантах осуществления, R8 и R9 независимо представляют собой H или CH3. В конкретных вариантах осуществления, R1 представляет собой пиперидин-4-ил, замещенный у N1 R5A, где R5A представляет собой SO2NR8R9 и R8 и R9 независимо представляют собой H или CH3.
В других вариантах осуществления формулы (I), R1 представляет собой C3-C8 циклоалкил, где указанный C3-C8 циклоалкил замещен R5B, и, необязательно, дополнительно замещенный одним или несколькими R6. В некоторых таких вариантах осуществления, R1 представляет собой циклопропил, циклобутил, циклопентил или циклогексил. В каждом из вышеизложенного, R1 замещен R5B и необязательно дополнительно замещен одним или несколькими R6. В других вариантах осуществления формулы (I), R5B представляет собой NHSO2R7 или NHSO2NR8R9.
В соединениях формулы (I), R7 представляет собой C1-C4 алкил, C1-C4 фторалкил, -L-(C3-C8 циклоалкил), -L-(5-6-членный гетероциклил) или -L-(5-6-членный гетероарил), где R7 необязательно замещен, как описано для формулы (I) выше.
В соединениях формулы (I), L представляет собой связь или C1-C4 алкилен, где указанный C1-C4 алкилен необязательно замещен OH, C1-C4 алкокси или C1-C4 фторалкокси. В некоторых вариантах осуществления, R7 представляет собой C1-C4 алкил, необязательно замещенный OH, C1-C4 алкокси, C1-C4 фторалкокси или SO2Me. В конкретных вариантах осуществления, R7 представляет собой C1-C4 алкил. В некоторых таких вариантах осуществления, R7 представляет собой CH3. В других таких вариантах осуществления, R7 представляет собой CH2CH3. В дополнительных вариантах осуществления, R7 представляет собой C1-C4 алкил, необязательно замещенный OH, OCH3 или SO2Me. В некоторых вариантах осуществления, R7 представляет собой C1-C4 фторалкил. В некоторых таких вариантах осуществления, R7 представляет собой CH2F, CHF2, CH2CF2H, CF3 или CH2CF3.
В дополнительных вариантах осуществления, R7 представляет собой -L-(C3-C8 циклоалкил), где указанный C3-C8 циклоалкил необязательно замещен C1-C4 алкилом, OH, C1-C4 алкокси или C1-C4 фторалкокси. В некоторых таких вариантах осуществления, L представляет собой связь и R7 представляет собой циклопропил, циклобутил, циклопентил. В других таких вариантах осуществления, L представляет собой метилен (т.е. -CH2-) и R7 представляет собой циклопропилметил, циклобутилметил или циклопентилметил.
В еще других вариантах осуществления, R7 представляет собой -L-(5-6-членный гетероциклил) или -L-(5-6-членный гетероарил), где указанные 5-6-членный гетероциклил и 5-6-членный гетероарил необязательно замещены C1-C4 алкилом, OH, C1-C4 алкокси или C1-C4 фторалкокси. В некоторых таких вариантах осуществления, L представляет собой связь, метиленовый или этиленовый фрагмент (то есть, связь, -CH2- или -CH2CH2-), и R7 представляет собой необязательно замещенный 5-6-членный гетероарил, выбранный из группы, состоящей из пиразолила, имидазолила, тиазолила или тиадиазолила. В некоторых таких вариантах осуществления L представляет собой связь. В других таких вариантах осуществления, L представляет собой связь, метилен или этилен и R7 представляет собой необязательно замещенный 5-6-членный гетероциклил. В конкретном варианте осуществления, L представляет собой связь и R7 представляет собой диоксидотетрагидротиофенил.
В некоторых вариантах осуществления R5A представляет собой SO2R7, где R7 выбран из каждого из вышеупомянутых вариантов осуществления, описанных для R7. В некоторых вариантах осуществления, R5A представляет собой SO2R7 и R7 представляет собой C1-C4 алкил, необязательно замещенный OH, C1-C4 алкокси, C1-C4 фторалкокси или SO2Me. В конкретных вариантах осуществления, R5A представляет собой SO2R7 и R7 представляет собой C1-C4 алкил. В конкретных вариантах осуществления каждого из вышеупомянутых вариантов осуществления R7, R1 представляет собой пиперидинил или пирролидинил, в частности, пиперидин-4-ил, пиперидин-3-ил или пирролидин-3-ил, и R5A представляет собой SO2R7.
В соединениях формулы (I), R8 и R9 независимо представляют собой H, C1-C4 алкил, C1-C4 фторалкил, -L-(C3-C8 циклоалкил), -L- (5-6-членный гетероциклил) или -L-(5-6-членный гетероарил); или R8 и R9 могут быть взяты вместе с атомом азота, к которому они присоединены, с образованием 5-6-членного гетероциклила, где R8 и R9 необязательно замещены, как описано для формулы (I) выше или дополнительно описано в настоящем документе.
В некоторых вариантах осуществления формулы (I), R8 и R9 независимо представляют собой H или C1-C4 алкил. В некоторых таких вариантах осуществления, R8 и R9 независимо представляют собой H или CH3. В некоторых вариантах осуществления, оба R8 и R9 представляют собой H. В других вариантах осуществления, R8 представляет собой H и R9 представляет собой CH3. В еще других вариантах осуществления, оба R8 и R9 представляют собой CH3. В дополнительных вариантах осуществления, один из R8 и R9 представляет собой H, а другой представляет собой C1-C4 алкил или C1-C4 фторалкил, каждый необязательно замещен, как описано в настоящем документе. В некоторых таких вариантах осуществления, R8 представляет собой H и R9 представляет собой C1-C4 алкил или C1-C4 фторалкил, необязательно замещенный OH или C1-C4 алкокси, В еще других вариантах осуществления, один из R8 и R9 представляет собой H, а другой представляет собой -L-(C3-C8 циклоалкил), -L-(5-6-членный гетероциклил) или -L-(5-6-членный гетероарил), каждый необязательно замещен, как описано в настоящем документе. В некоторых таких вариантах осуществления, R8 представляет собой H и R9 представляет собой -L-(5-6-членный гетероциклил), где L представляет собой связь, метилен или этилен. В конкретных вариантах осуществления, R8 представляет собой H и R9 представляет собой тетрагидрофуранил или тетрагидропиранил, где L представляет собой связь, или тетрагидрофуранилметил или тетрагидропиранилметил, где L представляет собой метилен. В некоторых таких вариантах осуществления, L представляет собой связь.
В некоторых вариантах осуществления R5A представляет собой SO2NR8R9, где R8 и R9 выбраны из каждого из вышеупомянутых вариантов осуществления, описанных для R8 и R9. В конкретных вариантах осуществления каждого из вышеупомянутых вариантов осуществления R8 и R9, R1 представляет собой пиперидинил или пирролидинил, в частности, пиперидин-4-ил, пиперидин-3-ил или пирролидин-3-ил, и R5A представляет собой SO2NR8R9.
В некоторых вариантах осуществления формулы (I), R8 и R9 взяты вместе с атомом азота, к которому они присоединены, с образованием 5-6-членного гетероциклила, где указанный 5-6-членный гетероциклил необязательно замещен C1-C4 алкилом, OH, C1-C4 алкокси или C1-C4 фторалкокси. В некоторых таких вариантах осуществления, R8 и R9 взяты вместе с атомом азота, к которому они присоединены, с образованием необязательно замещенного пиперидинильного кольца. В дополнение к N, к которому присоединены R8 и R9, указанный 5-6-членный гетероциклил может необязательно включать дополнительный гетероатом, выбранный из N, O и S, в качестве кольцевого члена, где атомы кольца S необязательно замещены одной или двумя оксогруппами (т.е., S(O)x, где x имеет значение 0, 1 или 2). В некоторых таких вариантах осуществления, R8 и R9 взяты вместе с атомом азота, к которому они присоединены, с образованием необязательно замещенного пирролидинильного кольца. В дополнительных вариантах осуществления, R8 и R9 взяты вместе с атомом азота, к которому они присоединены, с образованием необязательно замещенного морфолинильного или пиперазинильного кольца.
В соединениях формулы (I), каждый R6 независимо представляет собой F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси. В обычных вариантах осуществления, R6 отсутствует. В некоторых таких вариантах осуществления, каждый R6 независимо представляет собой F или C1-C4 алкил. В некоторых вариантах осуществления, R1 представляет собой 5-6-членный азотсодержащий гетероциклил, замещенный R5A, и дополнительно замещенный одним, двумя или тремя R6, где каждый R6 независимо представляет собой F или C1-C4 алкил. В некоторых таких вариантах осуществления, R1 представляет собой 5-6-членный азотсодержащий гетероциклил, замещенный R5A, и дополнительно замещенный одним R6, где R6 представляет собой F. В других вариантах осуществления, R1 представляет собой 5-6-членный азотсодержащий гетероциклил, замещенный R5A, и дополнительно замещенный одним или двумя R6, где каждый R6 представляет собой CH3.
В соединениях формулы (I), p имеет значение 0, 1, 2, 3 или 4, где p представляет собой целое число, которое представляет количество необязательных групп заместителей, R2.
В соединениях формулы (I), каждый R2 независимо представляет собой F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси, где каждый указанный C1-C4 алкил и C1-C4 фторалкил необязательно замещен OH, C1-C4 алкокси или C1-C4 фторалкокси. В обычных вариантах осуществления, p имеет значение 0 и R2 отсутствует. В других вариантах осуществления, p имеет значение 1 или 2. В некоторых вариантах осуществления, p имеет значение 1 или 2, и каждый R2 независимо представляет собой F, OH или C1-C4 алкил. В некоторых вариантах осуществления, p имеет значение 1 или 2, и каждый R2 независимо представляет собой F, OH или CH3. В некоторых таких вариантах осуществления p имеет значение 1 и R2 представляет собой F или CH3.
В соединениях формулы (I), R2A и R2B независимо представляют собой H, F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси, где каждый указанный C1-C4 алкил и C1-C4 фторалкил необязательно замещен OH, C1-C4 алкокси или C1-C4 фторалкокси.
В некоторых вариантах осуществления, R2A и R2B независимо представляют собой H, OH или C1-C4 алкил. В конкретных вариантах осуществления, R2A и R2B независимо представляют собой H, OH или CH3.
В предпочтительных вариантах осуществления формулы (I), по меньшей мере один из R2A и R2B не является H. В конкретных вариантах осуществления, R2A и R2B независимо представляют собой H, F, ОН, C1-C4 алкил, C1-C4 фторалкил, C1-C4 алкокси или C1-C4 фторалкокси, при условии, что по меньшей мере один из R2A и R2B не является H. В конкретных вариантах осуществления, R2A и R2B независимо представляют собой H, OH или CH3, при условии, что по меньшей мере один из R2A и R2B не является H.
В некоторых вариантах осуществления формулы (I), один из R2A и R2B представляет собой OH и другой представляет собой CH3. В других вариантах осуществления, один из R2A и R2B представляет собой OH и другой представляет собой H. В других вариантах осуществления, один из R2A и R2B представляет собой H и другой представляет собой CH3.
В конкретных вариантах осуществления фомулы (I), (I-A), (I-B) или (I-C), R2A представляет собой OH и R2B представляет собой CH3. В других таких вариантах осуществления, R2A представляет собой OH и R2B представляет собой H. В дополнительных вариантах осуществления, R2A представляет собой H и R2B представляет собой CH3.
В дополнительных вариантах осуществления формулы (I), (I-A), (I-B) или (I-C), R2B представляет собой OH и R2A представляет собой CH3. В других таких вариантах осуществления, R2B представляет собой OH и R2A представляет собой H. В дополнительных вариантах осуществления, R2B представляет собой H и R2A представляет собой CH3.
В соединениях формулы (I), R3 представляет собой H, F, Cl, NH2, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH. В некоторых вариантах осуществления формулы (I), R3 представляет собой H, F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил или C1-C4 фторалкил необязательно замещены OH. В других вариантах осуществления, R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H. В других вариантах осуществления формулы (I), R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH. В некоторых таких вариантах осуществления, R3 представляет собой F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H. В некоторых вариантах осуществления формулы (I), R3 представляет собой H.
В других вариантах осуществления формулы (I), R3 представляет собой F или Cl. В некоторых таких вариантах осуществления, R3 представляет собой F. В других таких вариантах осуществления, R3 представляет собой Cl.
В других вариантах осуществления формулы (I), R3 представляет собой NH2. В некоторых вариантах осуществления формулы (I), R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH. В некоторых таких вариантах осуществления, R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH.
В некоторых вариантах осуществления формулы (I), R3 представляет собой C1-C4 алкил, необязательно замещенный OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH. В некоторых таких вариантах осуществления, R3 представляет собой C1-C2 алкил, необязательно замещенный OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH. В некоторых вариантах осуществления формулы (I), R3 представляет собой C1-C2 алкил, необязательно замещенный OH. В некоторых вариантах осуществления, R3 представляет собой CH3 или CH2CH3. В некоторых вариантах осуществления, R3 представляет собой CH2OH, CH2CH2OH, CH2OCH3 или CH2CH2OCH3. В других вариантах осуществления, R3 представляет собой CH2CN, CH2CONH2 или CH2COOH.
В других вариантах осуществления формулы (I), R3 представляет собой C1-C4 фторалкил, необязательно замещенный OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH. В некоторых таких вариантах осуществления, R3 представляет собой C1-C2 фторалкил, необязательно замещенный OH, CN, C1-C4 алкокси, C1-C4 фторалкокси, CONH2 и COOH. В некоторых вариантах осуществления формулы (I), R3 представляет собой C1-C2 алкил, необязательно замещенный OH.
В некоторых вариантах осуществления, R3 представляет собой C1-C4 фторалкил. В других вариантах осуществления, R3 представляет собой C1-C2 фторалкил. В конкретных вариантах осуществления, R3 представляет собой CF3, CHF2, CH2F, CH2CF3, CH2CHF2 или CH2CH2F. В определенных вариантах осуществления, R3 представляет собой CHF2 или CH2CHF2. В некоторых таких вариантах осуществления, R3 представляет собой CHF2. В других таких вариантах осуществления, R3 представляет собой CH2CHF2.
В соединениях формулы (I), R4 представляет собой H, C1-C2 алкил или C1-C2 фторалкил. В обычных вариантах осуществления, R4 представляет собой H. В некоторых вариантах осуществления, R4 представляет собой C1-C2 алкил, такой как CH3.
В конкретных вариантах осуществления, R4 представляет собой H и R3 представляет собой C1-C4 фторалкил. В некоторых таких вариантах осуществления, R4 представляет собой H и R3 представляет собой C1-C2 фторалкил. В конкретных вариантах осуществления, R4 представляет собой H и R3 представляет собой CF3, CHF2, CH2F, CH2CF3, CH2CHF2 или CH2CH2F. В определенных предпочтительных вариантах осуществления, R4 представляет собой H и R3 представляет собой CHF2 или CH2CHF2.
В некоторых вариантах осуществления каждого из вышеупомянутых вариантов осуществления, описанных для R3, R4 представляет собой H. В других вариантах осуществления каждого из вышеупомянутых вариантов осуществления, описанных для R3, R4 представляет собой C1-C2 алкил или C1-C2 фторалкил. В конкретных вариантах осуществления каждого из вышеупомянутых вариантов осуществления, описанных для R3, R4 представляет собой CH3, CH2CH3, CF3, CHF2, CH2F, CH2CF3, CH2CHF2 или CH2CH2F.
В соединениях формулы (I), q имеет значение 0, 1 или 2; и r имеет значение 0, 1 или 2. В некоторых вариантах осуществления, q имеет значение 1 и r имеет значение 0. В других вариантах осуществления, q имеет значение 0 и r имеет значение 1. В других вариантах осуществления, q имеет значение 1 и r имеет значение 1. В еще других вариантах осуществления, q имеет значение 2 и r имеет значение 0. В дополнительных вариантах осуществления, q имеет значение 2 и r имеет значение 1. В некоторых вариантах осуществления, сумма q и r имеет значение 0, 1, 2 или 3. В некоторых таких вариантах осуществления, кольцо, включающее q и r, представляет собой циклобутильное, циклопентильное, циклогексильное или циклогептильное кольцо, замещенное R2A и R2B и необязательно замещенное R2. В предпочтительных вариантах осуществления кольцо, включающее q и r, представляет собой циклопентильное или циклогексильное кольцо. В некоторых вариантах осуществления, сумма q и r меньше или равна 3. В других вариантах осуществления сумма q и r меньше или равна 2. В еще других вариантах осуществления сумма q и r равна 1 или 2.
В определенных предпочтительных вариантах осуществления изобретение относится к соединению формулы (I), (I-A), (I-B) и (I-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A;
p имеет значение 0 и R2 отсутствует;
q имеет значение 1 и r имеет значение 0; или
q имеет значение 1 и r имеет значение 1;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил;
R3 представляет собой H, F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (I), (I-A), (I-B) и (I-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A; или
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A, где указанный 3-10-членный гетероциклил необязательно дополнительно замещен одним или двумя R6;
p имеет значение 0 и R2 отсутствует; или
p имеет значение 1 или 2, и каждый R2 независимо представляет собой F, OH или CH3;
q имеет значение 1 и r имеет значение 0; или
q имеет значение 0 и r имеет значение 1; или
q имеет значение 1 и r имеет значение 1;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует; или
каждый R6 независимо представляет собой F или CH3;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединению формулы (I), (I-A), (I-B) и (I-C), или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A; или
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A, где указанный 5-6-членный гетероциклил необязательно дополнительно замещен одним или двумя R6;
p имеет значение 0 и R2 отсутствует;
q имеет значение 1 и r имеет значение 0; или
q имеет значение 1 и r имеет значение 1;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует; или
каждый R6 независимо представляет собой F или CH3;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (I), (I-A), (I-B) и (I-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
q имеет значение 1 и r имеет значение 0;
R2A и R2B независимо представляют собой H, OH или CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В еще других предпочтительных вариантах осуществления изобретение относится к соединению формулы (I), (I-A), (I-B) и (I-C), или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
q имеет значение 1 и r имеет значение 0; или
q имеет значение 1 и r имеет значение 1; R2A и R2B независимо представляют собой H, OH или CH3, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединению формулы (I), (I-A), (I-B) и (I-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
q имеет значение 1 и r имеет значение 0;
один из R2A и R2B представляет собой OH и другой представляет собой CH3; или
один из R2A и R2B представляет собой OH и другой представляет собой H; или
один из R2A и R2B представляет собой H и другой представляет собой CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (I), (I-A), (I-B) и (I-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
q имеет значение 1 и r имеет значение 0;
R2A представляет собой OH и R2B представляет собой H; или
R2A представляет собой OH и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой CH3;
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7;
R6 отсутствует; и
R7 представляет собой CH3.
В конкретных вариантах осуществления, изобретение относится к соединениям формулы (I-B) или их фармацевтически приемлемой соли, имеющим две или несколько из следующих характеристик:
R1 представляет собой пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
q имеет значение 1 и r имеет значение 0;
R2A представляет собой H или OH и R2B представляет собой H или CH3; или
R2A представляет собой OH и R2B представляет собой H; или
R2A представляет собой OH и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой H;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7, где R7 представляет собой CH3; или
R5A представляет собой SO2NR8R9, где R8 представляет собой H или CH3 и R9 представляет собой CH3; и
R6 отсутствует.
В другом аспекте изобретение относится к соединению формулы (II), (II-A), (II-B) или (II-C):
или его фармацевтически приемлемой соли, где R1, R2, R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8, R9 и p имеют значения такие, как определены для формулы (I).
Варианты осуществления, описанные в настоящем документе для формулы (I) в отношении R1, R2, R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8, R9 и p также применимы к соединениям формул (II), (II-A), (II-B) и (II-C) в той степени, в которой они не являются противоречивыми.
В определенных предпочтительных вариантах осуществления изобретение относится к соединению формулы (II), (II-A), (II-B) и (II-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A;
p имеет значение 0 и R2 отсутствует;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил;
R3 представляет собой H, F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (II), (II-A), (II-B) и (II-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A; или
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A, где указанный 3-10-членный гетероциклил необязательно дополнительно замещен одним или двумя R6;
p имеет значение 0 и R2 отсутствует; или
p имеет значение 1 или 2, и каждый R2 независимо представляет собой F, OH или CH3;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует; или
каждый R6 независимо представляет собой F или CH3;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (II), (II-A), (II-B) и (II-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A; или
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A, где указанный 5-6-членный гетероциклил необязательно дополнительно замещен одним или несколькими R6;
p имеет значение 0 и R2 отсутствует; R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует; или
каждый R6 независимо представляет собой F или CH3;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В еще других предпочтительных вариантах осуществления изобретение относится к соединению формулы (II), (II-A), (II-B) и (II-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
R2A и R2B независимо представляют собой H, OH или CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (II), (II-A), (II-B) и (II-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
R2A и R2B независимо представляют собой H, OH или CH3, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединению формулы (II), (II-A), (II-B) и (II-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
один из R2A и R2B представляет собой OH и другой представляет собой CH3; или
один из R2A и R2B представляет собой OH и другой представляет собой H; или
один из R2A и R2B представляет собой H и другой представляет собой CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединениям формулы (II-B) или их фармацевтически приемлемой соли, имеющим две или несколько из следующих характеристик:
R1 представляет собой пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
R2A представляет собой OH и R2B представляет собой H; или
R2A представляет собой OH и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой CH3; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7;
R6 отсутствует; и
R7 представляет собой CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединениям формулы (II-B) или их фармацевтически приемлемой соли, имеющим две или несколько из следующих характеристик:
R1 представляет собой пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
R2A представляет собой H или OH и R2B представляет собой H или CH3; или
R2A представляет собой OH и R2B представляет собой H; или
R2A представляет собой OH и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой H;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7, где R7 представляет собой CH3; или
R5A представляет собой SO2NR8R9, где R8 представляет собой H или CH3 и R9 представляет собой CH3; и
R6 отсутствует.
В другом аспекте изобретение относится к соединению формулы (III), (III-A), (III-B) или (III-C):
или его фармацевтически приемлемой соли, где R1, R2, R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8, R9 и p имеют значения такие, как определены для формулы (I).
Варианты осуществления, описанные в настоящем документе для формулы (I) в отношении R1, R2, R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8, R9 и p также применимы к соединениям формул (III), (III-A), (III-B) и (III-C) в той степени, в которой они не являются противоречивыми.
В определенных предпочтительных вариантах осуществления изобретение относится к соединению формулы (III), (III-A), (III-B) и (III-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A;
p имеет значение 0 и R2 отсутствует;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил;
R3 представляет собой H, F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других вариантах осуществления, изобретение относится к соединению формулы (III), (III-A), (III-B) и (III-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A; или
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A, где указанный 3-10-членный гетероциклил необязательно дополнительно замещен одним или двумя R6;
p имеет значение 0 и R2 отсутствует; или
p имеет значение 1 или 2, и каждый R2 независимо представляет собой F, OH или CH3;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует; или
каждый R6 независимо представляет собой F или CH3;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (III), (III-A), (III-B) и (III-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A; или
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A, где указанный 5-6-членный гетероциклил необязательно дополнительно замещен одним или несколькими R6;
p имеет значение 0 и R2 отсутствует;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует; или
каждый R6 независимо представляет собой F или CH3;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (III), (II-A), (III-B) и (III-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
R2A и R2B независимо представляют собой H, OH или CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (III), (III-A), (III-B) и (III-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
R2A и R2B независимо представляют собой H, OH или CH3, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединению формулы (III), (III-A), (III-B) и (III-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
p имеет значение 0 и R2 отсутствует;
один из R2A и R2B представляет собой OH и другой представляет собой CH3; или
один из R2A и R2B представляет собой OH и другой представляет собой H; или
один из R2A и R2B представляет собой H и другой представляет собой CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В другом аспекте изобретение относится к соединению формулы (IV), (IV-A), (IV-B) или (IV-C):
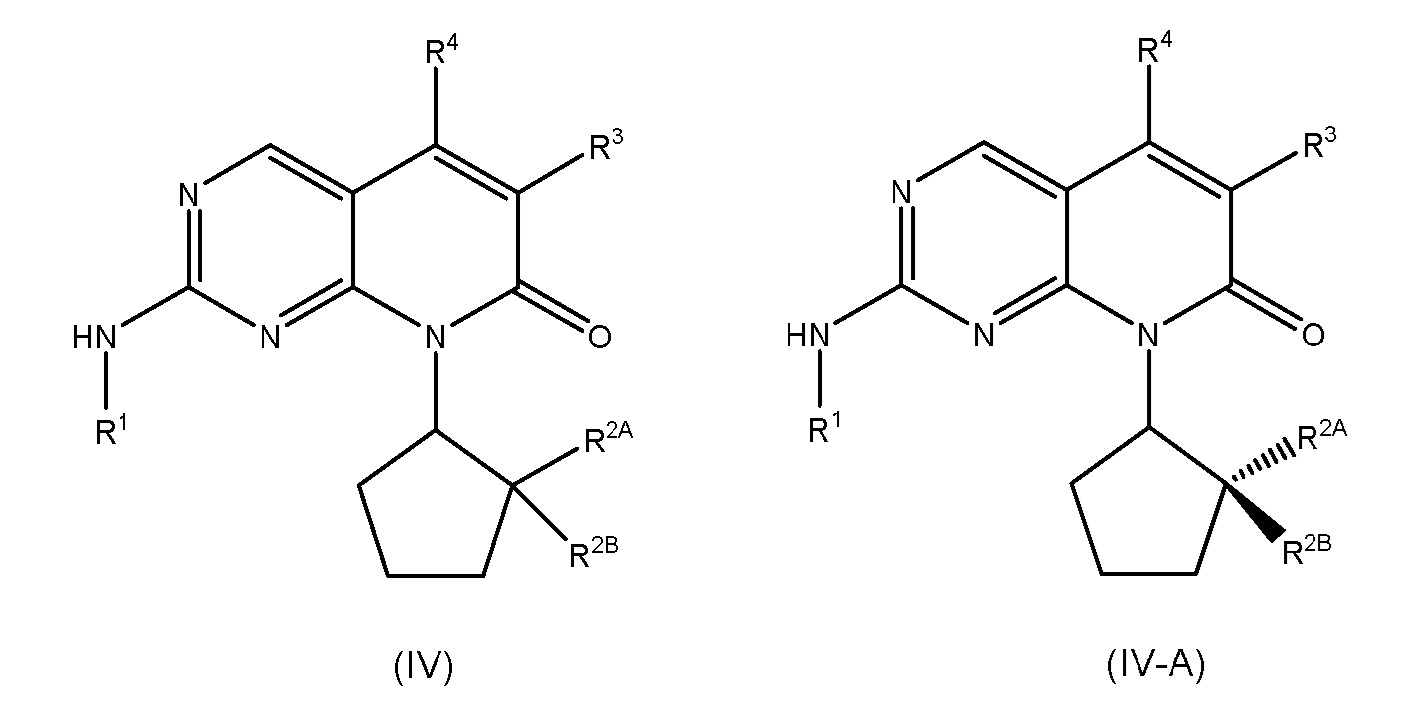
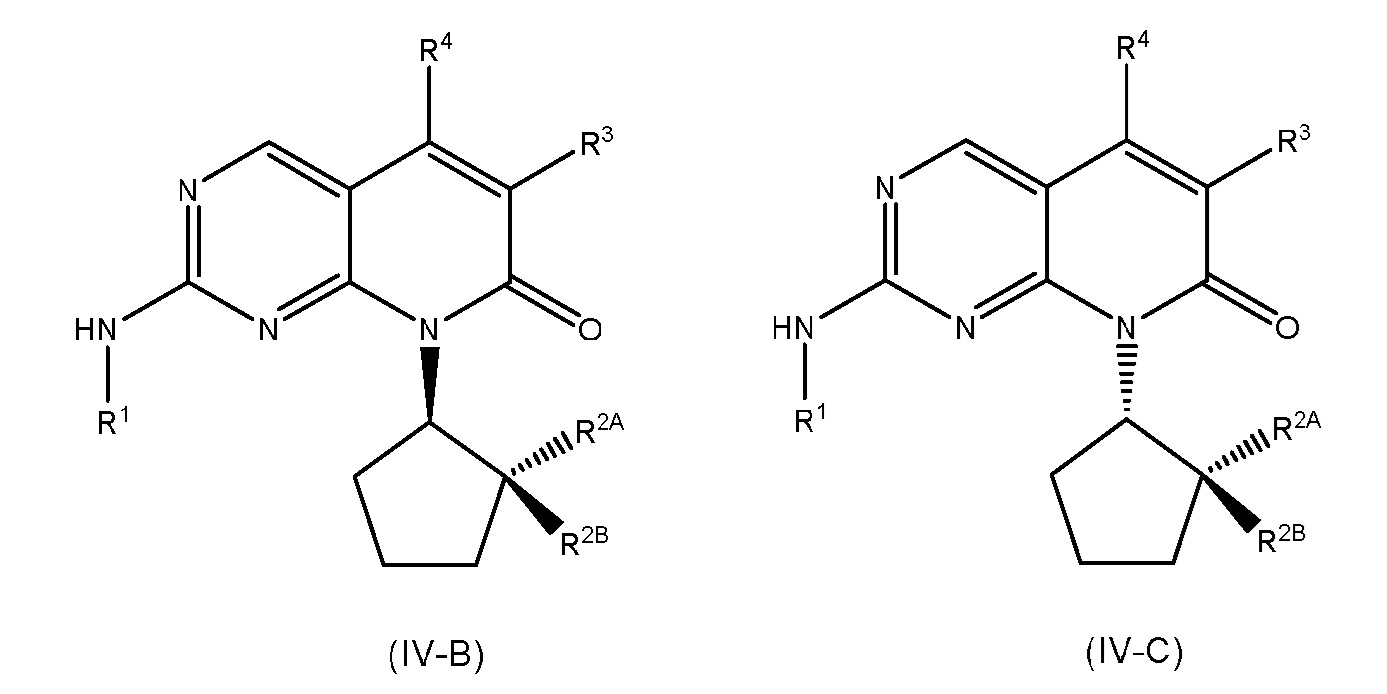
или его фармацевтически приемлемой соли, где R1, R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8 и R9 имеют значения такие, как определены для формулы (I).
Варианты осуществления, описанные в настоящем документе для формулы (I) в отношении R1, R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8 и R9 также применимы к соединениям формул (IV), (IV-A), (IV-B) и (IV-C) в той степени, в которой они не являются противоречивыми.
В конкретных вариантах осуществления, соединения формул (IV), (IV-A), (IV-B) и (IV-C) имеют структуру:
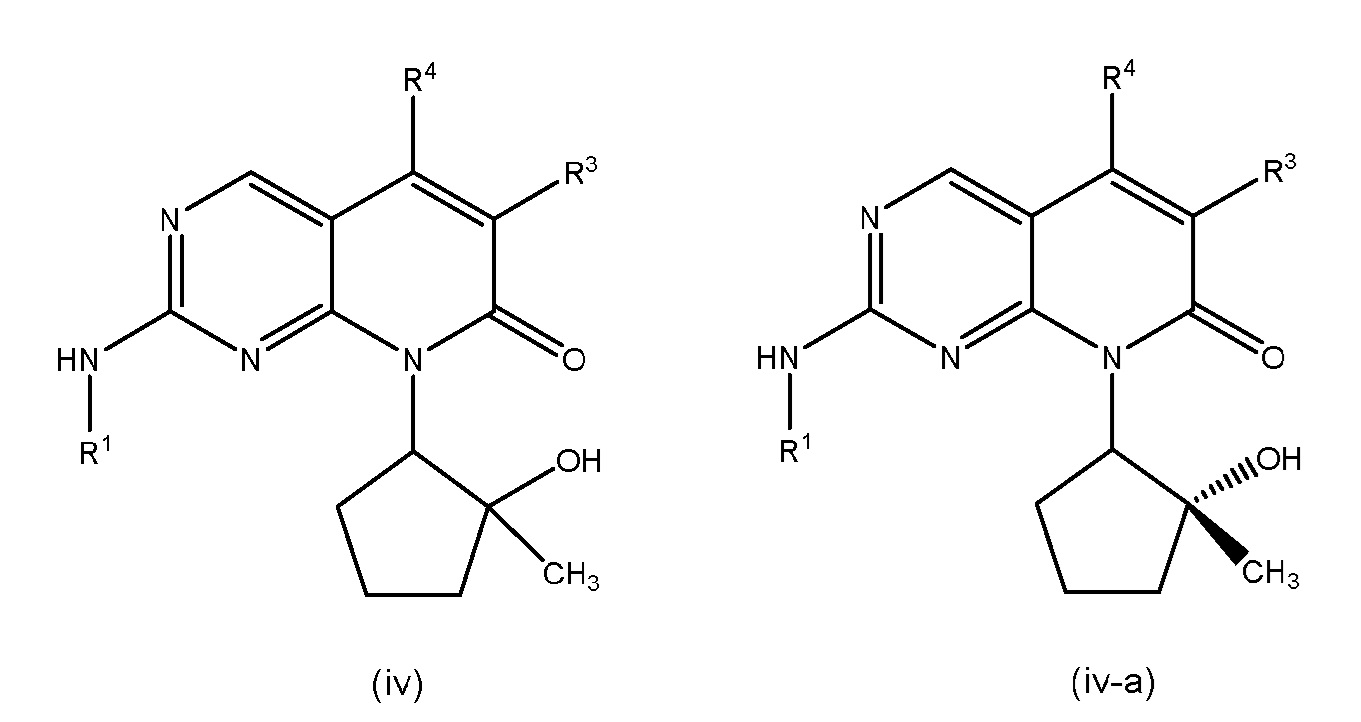
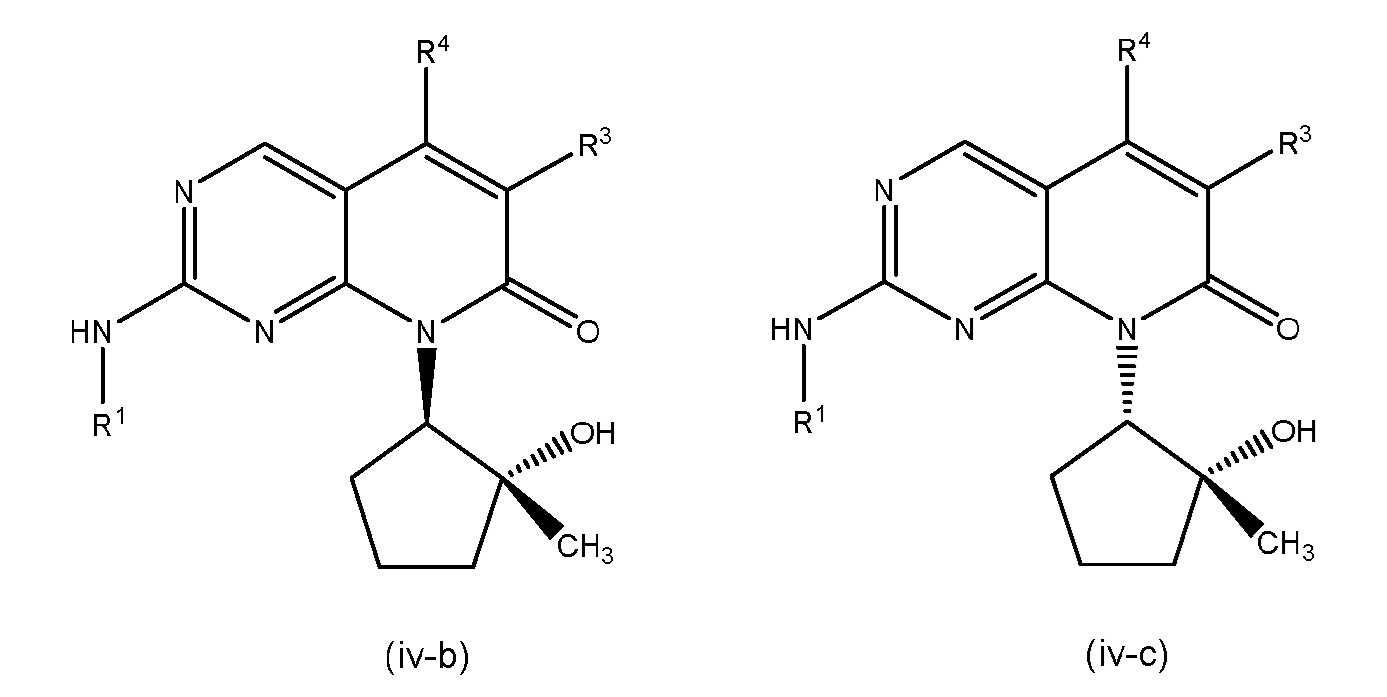
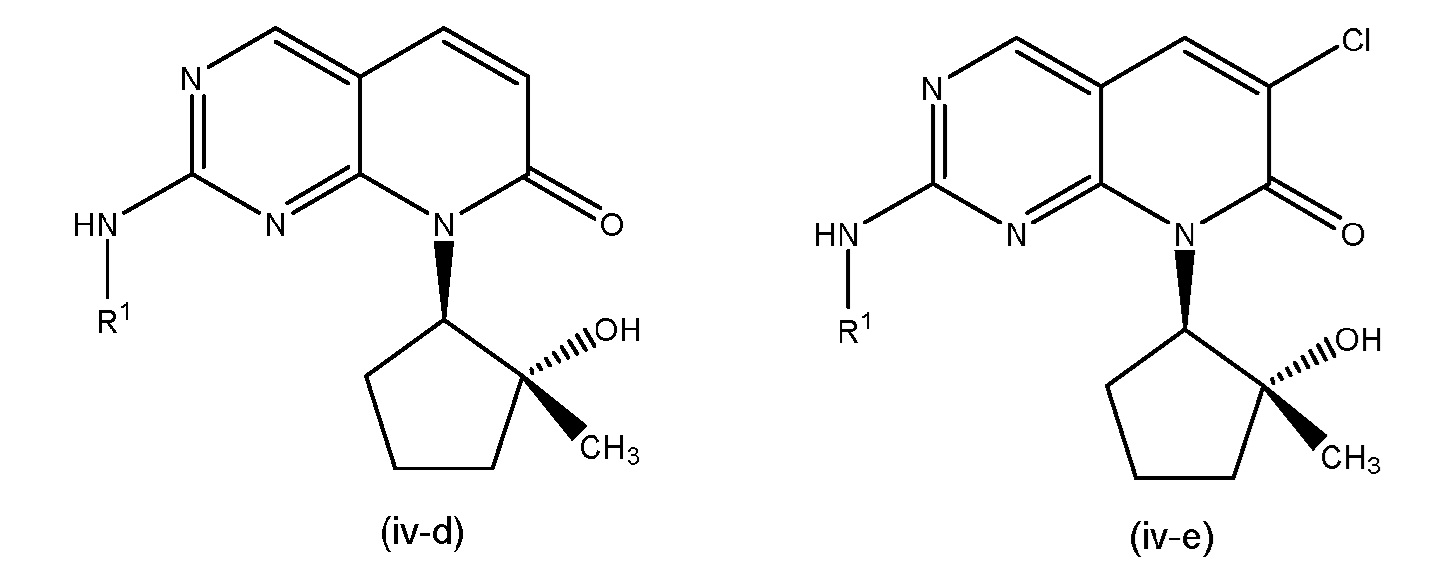
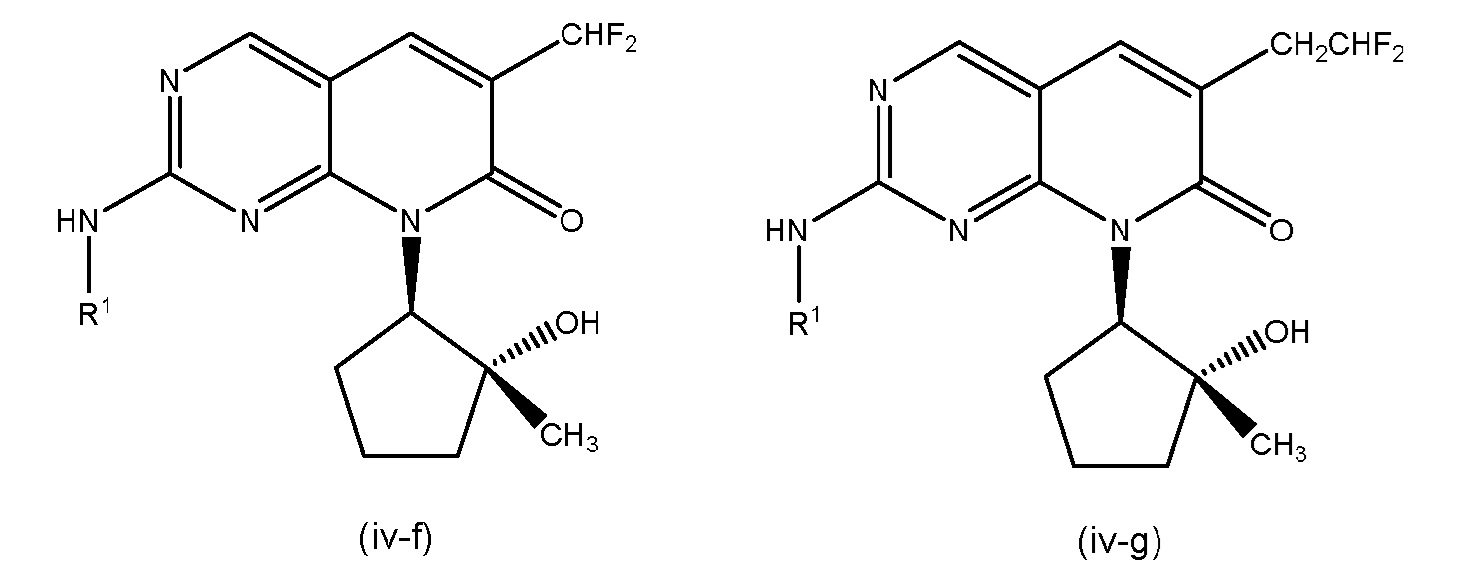
или его фармацевтически приемлемая соль, где R1, R3, R4, R5A, R5B, R6, R7, R8 и R9 имеют значения такие, как определены для формулы (I).
В определенных предпочтительных вариантах осуществления изобретение относится к соединению формулы (IV), (IV-A), (IV-B) и (IV-C), или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил;
R3 представляет собой H, F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления, изобретение относится к соединению формулы (IV), (IV-A), (IV-B) и (IV-C), или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления, изобретение относится к соединению формулы (IV), (IV-A), (IV-B) и (IV-C), или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (IV), (IV-A), (IV-B) и (IV-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
R2A и R2B независимо представляют собой H, OH или CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В других предпочтительных вариантах осуществления, изобретение относится к соединению формулы (IV), (IV-A), (IV-B) и (IV-C), или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
R2A и R2B независимо представляют собой H, OH или CH3, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединению формулы (IV), (IV-A), (IV-B) и (IV-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
один из R2A и R2B представляет собой OH и другой представляет собой CH3; или
один из R2A и R2B представляет собой OH и другой представляет собой H; или
один из R2A и R2B представляет собой H и другой представляет собой CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединениям формулы (IV-B), или их фармацевтически приемлемой соли, имеющим две или несколько из следующих характеристик:
R1 представляет собой пиперидин-4-ил, замещенный на N1 R5A;
R2A представляет собой OH и R2B представляет собой H; или
R2A представляет собой OH и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой CH3; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7;
R6 отсутствует; и
R7 представляет собой CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединениям формулы (IV-B) или их фармацевтически приемлемой соли, имеющим две или несколько из следующих характеристик:
R1 представляет собой пиперидин-4-ил, замещенный на N1 R5A;
R2A представляет собой H или OH и R2B представляет собой H или CH3; или
R2A представляет собой OH и R2B представляет собой H; или
R2A представляет собой OH и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой H;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7, где R7 представляет собой CH3; или
R5A представляет собой SO2NR8R9, где R8 представляет собой H или CH3 и R9 представляет собой CH3; и
R6 отсутствует.
В других предпочтительных вариантах осуществления изобретение относится к соединениям формулы (iv), (iv-a), (iv-b) или (iv-c) или их фармацевтически приемлемой соли, имеющим две или несколько из следующих характеристик:
R1 представляет собой пиперидин-4-ил, замещенный на N1 R5A;
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7, где R7 представляет собой CH3; или
R5A представляет собой SO2NR8R9, где R8 представляет собой H или CH3 и R9 представляет собой CH3; и
R6 отсутствует.
В других предпочтительных вариантах осуществления изобретение относится к соединениям формулы (iv-f) или (iv-g), или их фармацевтически приемлемой соли, где:
R1 представляет собой пиперидин-4-ил, замещенный на N1 R5A;
R5A представляет собой SO2R7, где R7 представляет собой CH3; или
R5A представляет собой SO2NR8R9, где R8 представляет собой H или CH3 и R9 представляет собой CH3; и
R6 отсутствует.
В другом аспекте изобретение относится к соединению формулы (V), (V-A), (V-B) или (V-C):
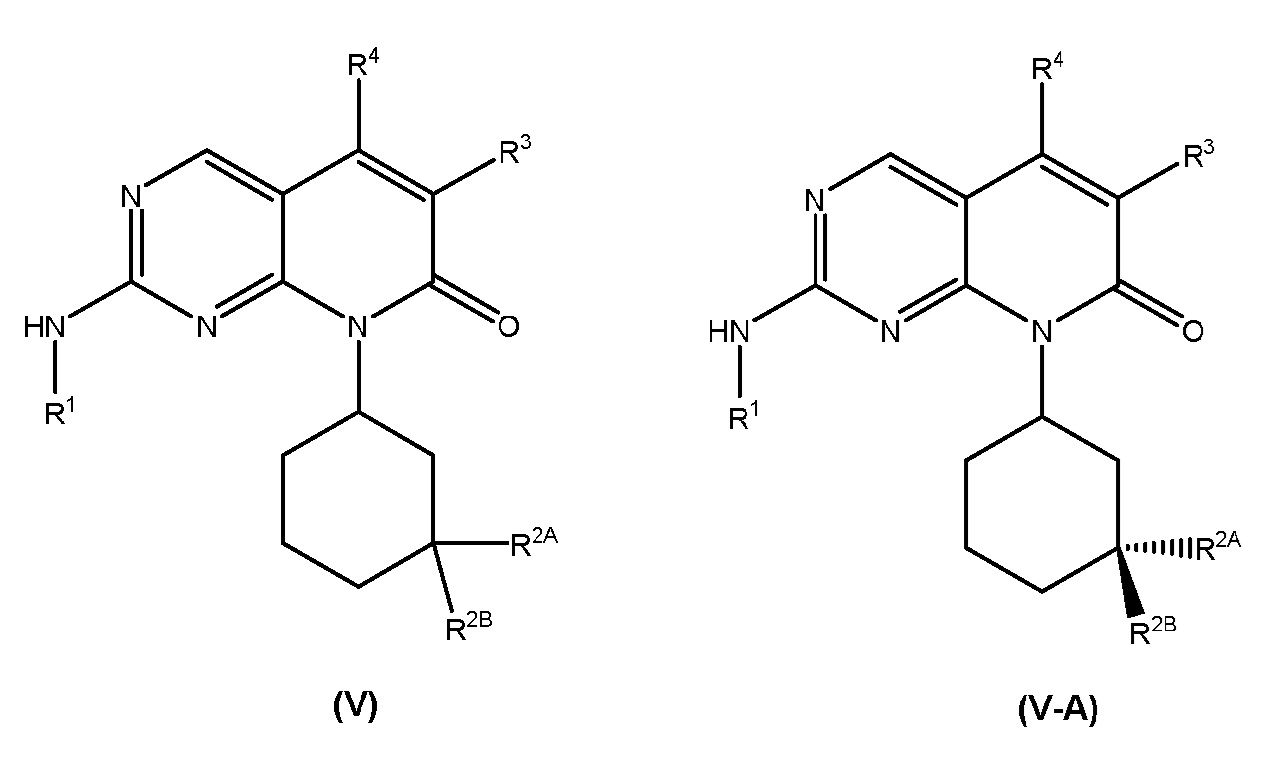
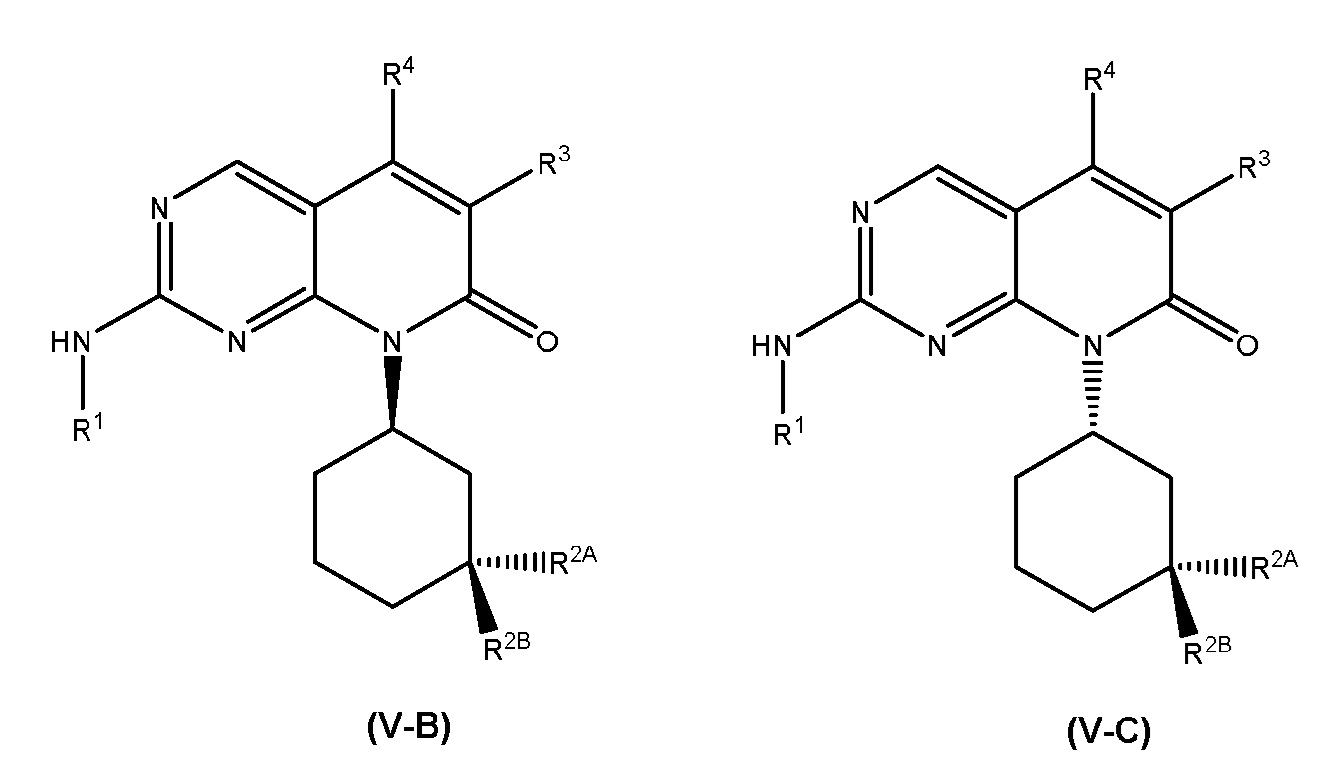
или его фармацевтически приемлемой соли, где R1. R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8 и R9 имеют значения такие, как определены для формулы (I).
Варианты осуществления, описанные в настоящем документе для формулы (I) в отношении R1, R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8 и R9 также применимы к соединениям формул (V), (V-A), (V-B) и (V-C) в той степени, в которой они не являются противоречивыми.
В конкретных вариантах осуществления, соединения формулы (V), (V-A), (V-B) и (V-C) имеют структуру:
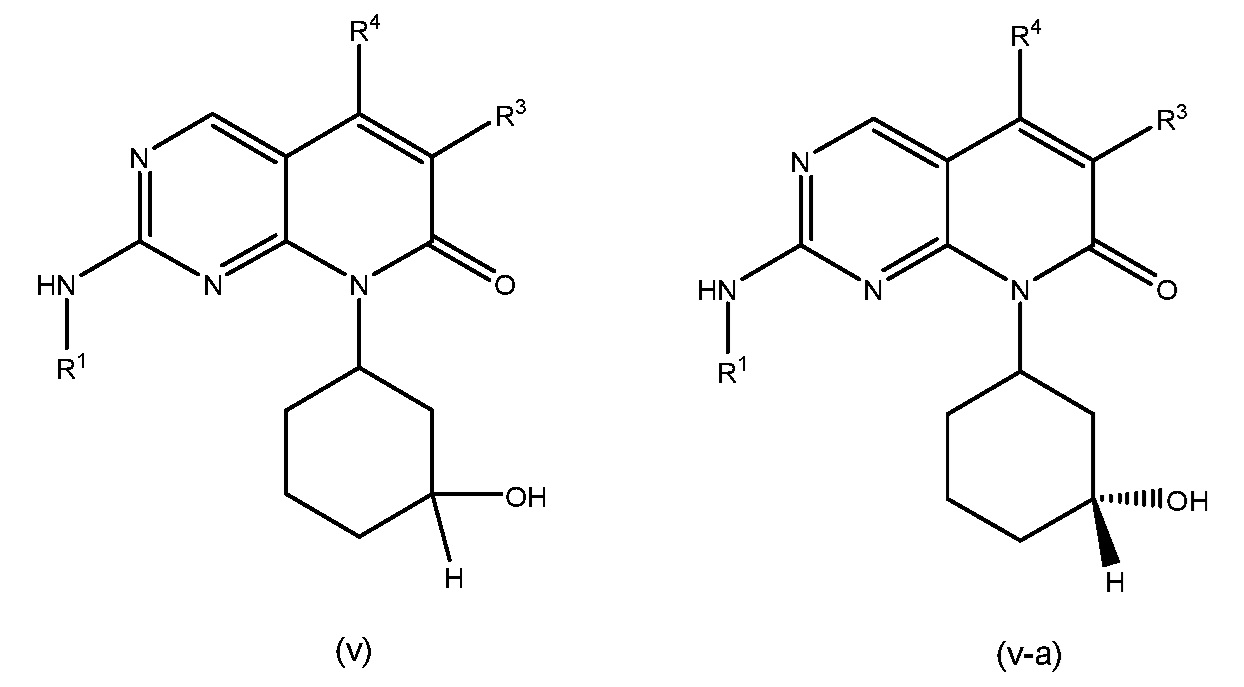
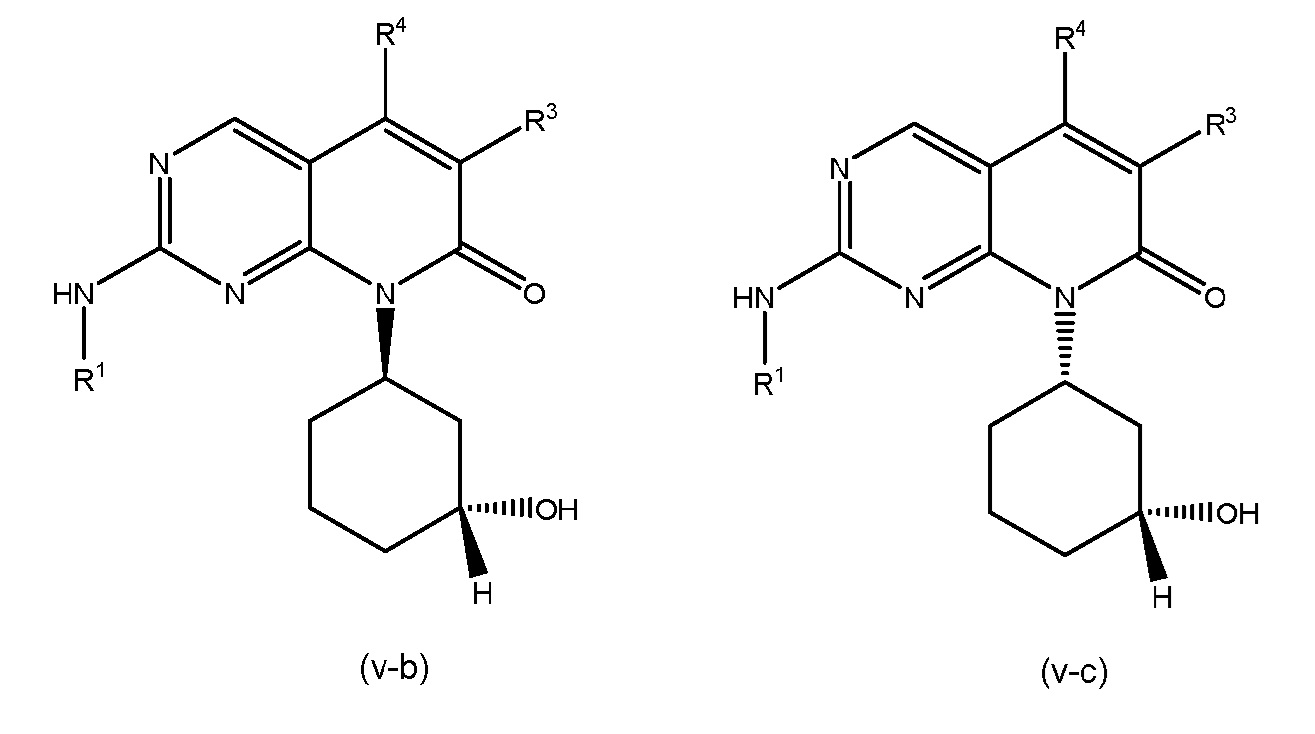
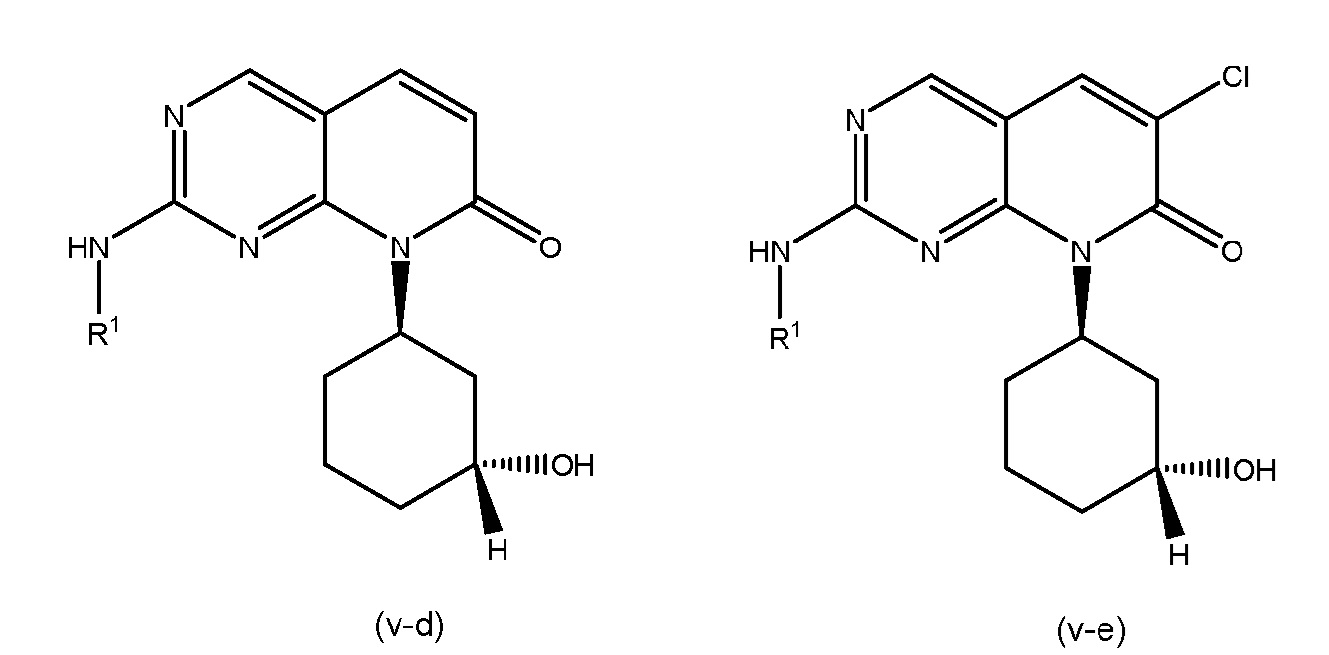
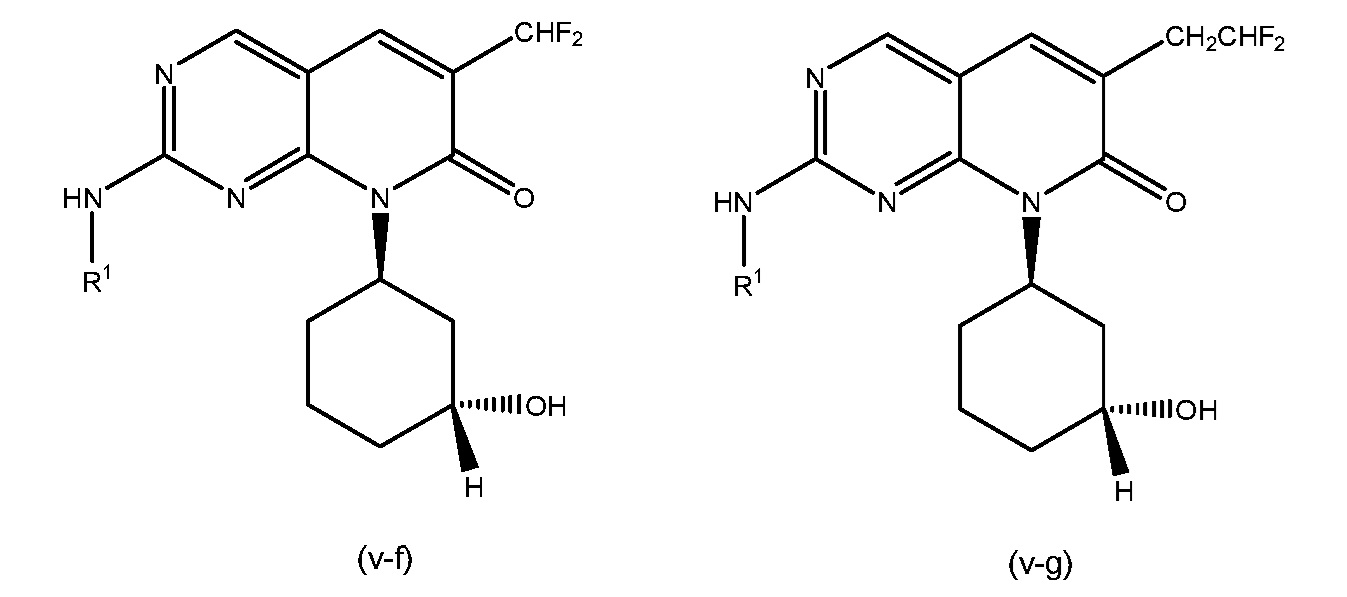
или их фармацевтически приемлемые соли, где R1, R3, R4, R5A, R5B,R6, R7, R8 и R9 имеют значения такие, как определены для формулы (I).
В определенных предпочтительных вариантах осуществления изобретение относится к соединению формулы (V), (V-A), (V-B) и (V-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил;
R3 представляет собой H, F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления, изобретение относится к соединению формулы (V), (V-A), (V-B) и (V-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A; или
R1 представляет собой 3-10-членный гетероциклил, замещенный R5A, где указанный 3-10-членный гетероциклил необязательно дополнительно замещен одним или двумя R6;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует; или
каждый R6 независимо представляет собой F или CH3;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления, изобретение относится к соединению формулы (V), (V-A), (V-B) и (V-C), или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A; или
R1 представляет собой 5-6-членный гетероциклил, замещенный R5A, где указанный 5-6-членный гетероциклил необязательно дополнительно замещен одним или двумя R6;
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует; или
каждый R6 независимо представляет собой F или CH3;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (V), (V-A), (V-B) и (V-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
R2A и R2B независимо представляют собой H, OH или CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В других предпочтительных вариантах осуществления, изобретение относится к соединению формулы (V), (V-A), (V-B) и (V-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
R2A и R2B независимо представляют собой H, OH или CH3, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединению формулы (V), (V-A), (V-B) и (V-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R1 представляет собой пиперидинил, предпочтительно пиперидин-4-ил, замещенный на N1 R5A;
один из R2A и R2B представляет собой OH и другой представляет собой CH3; или
один из R2A и R2B представляет собой OH и другой представляет собой H; или
один из R2A и R2B представляет собой H и другой представляет собой CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R6 отсутствует;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В другом аспекте изобретение относится к соединению формулы (VI), (VI-A), (VI-B) или (VI-C):
или его фармацевтически приемлемой соли, где R2A, R2B, R3, R4, R5A, R7, R8 и R9 имеют значения такие, как определены для формулы (I).
Варианты осуществления, описанные в настоящем документе для формулы (I) в отношении R2A, R2B, R3, R4, R5A, R5B, R6, R7, R8 и R9 также применимы к соединениям формул (VI), (VI-A), (VI-B) и (VI-C) в той степени, в которой они не являются противоречивыми.
В определенных предпочтительных вариантах осуществления изобретение относится к соединению формулы (VI), (VI-A), (VI-B) и (VI-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил;
R3 представляет собой H, F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (VI), (VI-A), (VI-B) и (VI-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R7 представляет собой C1-C4 алкил; или
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или C1-C4 алкил; или
R8 и R9 независимо представляют собой H или CH3.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (VI), (VI-A), (VI-B) и (VI-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R2A и R2B независимо представляют собой H, OH или CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединению формулы (VI), (VI-A), (VI-B) и (VI-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
один из R2A и R2B представляет собой OH и другой представляет собой CH3; или
один из R2A и R2B представляет собой OH и другой представляет собой H; или
один из R2A и R2B представляет собой H и другой представляет собой CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединениям формулы (VI-B) или их фармацевтически приемлемой соли, имеющим две или несколько из следующих характеристик:
R2A представляет собой H или OH и R2B представляет собой H или CH3; или
R2A представляет собой OH и R2B представляет собой H; или
R2A представляет собой OH и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой H;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H; и
R5A представляет собой SO2R7, где R7 представляет собой CH3; или
R5A представляет собой SO2NR8R9, где R8 представляет собой H или CH3 и R9 представляет собой CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединениям формулы (VI-B) или их фармацевтически приемлемым солям, имеющим две или несколько из следующих характеристик:
один из R2A и R2B представляет собой OH и другой представляет собой CH3; или
один из R2A и R2B представляет собой OH и другой представляет собой H; или
один из R2A и R2B представляет собой H и другой представляет собой CH3; или
R2A представляет собой OH и R2B представляет собой H; или
R2A представляет собой OH и R2B представляет собой CH3; или
R2A представляет собой H и R2B представляет собой CH3;
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H; и
R5A представляет собой SO2R7; и
R7 представляет собой CH3.
В другом аспекте изобретение относится к соединению формулы (VII), (VII-A), (VII-B) или (VII-C):
или его фармацевтически приемлемой соли, где R2A, R2B, R3, R4, R5A, R7, R8 и R9 имеют значения такие, как определены для формулы (I).
Варианты осуществления, описанные в настоящем документе для формулы (I) в отношении R2A, R2B, R3, R4, R5A, R7, R8 и R9 также применимы к соединениям формул (VII), (VII-A), (VII-B) и (VII-C) в той степени, в которой они не являются противоречивыми.
В определенных предпочтительных вариантах осуществления изобретение относится к соединению формулы (VII), (VII-A), (VII-B) и (VII-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил;
R3 представляет собой H, F, Cl, C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R7 представляет собой C1-C4 алкил; и
R8 и R9 независимо представляют собой H или C1-C4 алкил.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (VII), (VII-A), (VII-B) и (VII-C), или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R2A и R2B независимо представляют собой H, OH или C1-C4 алкил, при условии, что по меньшей мере один из R2A и R2B не является H;
R3 представляет собой C1-C4 алкил или C1-C4 фторалкил, где указанные C1-C4 алкил и C1-C4 фторалкил необязательно замещены OH; или
R3 представляет собой C1-C4 фторалкил; или
R3 представляет собой C1-C2 фторалкил; или
R3 представляет собой CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R7 представляет собой C1-C4 алкил; или
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или C1-C4 алкил; или
R8 и R9 независимо представляют собой H или CH3.
В других предпочтительных вариантах осуществления изобретение относится к соединению формулы (VII), (VII-A), (VII-B) и (VII-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
R2A и R2B независимо представляют собой H, OH или CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В дополнительных предпочтительных вариантах осуществления изобретение относится к соединению формулы (VII), (VII-A), (VII-B) и (VII-C) или его фармацевтически приемлемой соли, имеющему две или несколько из следующих характеристик:
один из R2A и R2B представляет собой OH и другой представляет собой CH3; или
один из R2A и R2B представляет собой OH и другой представляет собой H; или
один из R2A и R2B представляет собой H и другой представляет собой CH3;
R3 представляет собой H, F, Cl, CH3, CH2CH2OH, CF2H или CH2CF2H;
R4 представляет собой H;
R5A представляет собой SO2R7 или SO2NR8R9;
R7 представляет собой CH3; и
R8 и R9 независимо представляют собой H или CH3.
В другом аспекте изобретение относится к соединению, выбранному из группы, состоящей из:
8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
8-[(1R,3R)-3-гидроксициклогексил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
4-({6-(2-гидроксиэтил)-8-[(1R,2S)-2-метилциклопентил]-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил}амино)-N-метилпиперидин-1-сульфонамида;
(+)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
(-)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
(+)-6-(2,2-дифторэтил)-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
(-)-6-(2,2-дифторэтил)-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
6-хлор-8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она; и
6-(дифторметил)-8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
или его фармацевтически приемлемой соли.
В другом аспекте изобретение относится к соединению, выбранному из группы, состоящей из:
(-)-6-(дифторметил)-8-[(1R*,3R*)-3-гидроксициклопентил]-2-{[1-(метилсульфонил)-пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
(+)-6-(дифторметил)-8-[(1R*,3R*)-3-гидроксициклопентил]-2-{[1-(метилсульфонил)-пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
(8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}-7-оксо-7,8-дигидро-пиридо[2,3-d]пиримидин-6-ил)ацетонитрила;
8-циклопентил-6-(2-гидроксиэтил)-2-{[1-(пропан-2-илсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
6-амино-2-{[1-(бут-3-ин-1-илсульфонил)пиперидин-4-ил]амино}-8-циклопентилпиридо[2,3-d]пиримидин-7(8H)-она;
8-циклопентил-6-этенил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}-6-(проп-2-ен-1-ил)пиридо[2,3-d]пиримидин-7(8H)-она; и
6-(2,2-дифторэтил)-8-[(1R,3R)-3-гидроксициклогексил]-2-{[1-(метилсульфонил)-пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она;
или его фармацевтически приемлемой соли.
В другом аспекте изобретение относится к соединению, выбранному из группы, состоящей из соединений, приведенных в качестве примеров в таблице 1, включающей примеры 11-132 и 141-226, включительно, или его фармацевтически приемлемой соли. В другом аспекте изобретение относится к соединению, выбранному из группы, состоящей из соединений, приведенных в качестве примеров в примерах 1-226 в настоящем документе, или его фармацевтически приемлемой соли.
Соединения изобретения были оптимизированы по селективности в отношении CDK2 по сравнению с CDK1. Предпочтительно, соединения показали, по меньшей мере, 20-кратную селективность в отношении CDK2 по сравнению с CDK1, и более предпочтительно, соединения показали, по меньшей мере, 30-кратную селективность в отношении CDK2 по сравнению с CDK1. Соединения по изобретению также были оптимизированы для улучшения физико-химических свойств, таких как повышенная растворимость в воде и уменьшенный клиренс в моделях микросом печени человека (HLM).
"Фармацевтическая композиция" относится к смеси одного или более чем одного соединения, раскрытого в настоящем описании, или его фармацевтически приемлемых соли, сольвата, гидрата или пролекарства в качестве активного ингредиента и по меньшей мере одного фармацевтически приемлемого носителя или эксципиента. В некоторых вариантах осуществления, фармацевтическая композиция включает два или несколько фармацевтически приемлемых носителей и/или эксципиентов. В других вариантах осуществления, фармацевтическая композиция дополнительно включает по меньшей мере одно дополнительное противораковое терапевтическое средство.
В другом аспекте изобретение относится к фармацевтической композиции, включающей соединение одной из формул, описанных в настоящем документе, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или эксципиент. В некоторых вариантах осуществления, фармацевтическая композиция включает два или несколько фармацевтически приемлемых носителей и/или эксципиентов.
В некоторых вариантах осуществления, фармацевтическая композиция дополнительно включает по меньшей мере одно дополнительное противораковое терапевтическое средство или паллиативное средство. В некоторых таких вариантах осуществления, по меньшей мере, одно дополнительное средство представляет собой противораковое терапевтическое средство, как описано ниже. В некоторых таких вариантах осуществления, комбинация обеспечивает аддитивный, более чем аддитивный или синергетический противораковый эффект.
В одном аспекте изобретение относится к способу лечения аномального клеточного роста у субъекта, нуждающегося в этом, включающему введение субъекту терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли.
В другом аспекте изобретение относится к способу лечения аномального клеточного роста у субъекта, нуждающегося в этом, включающему введение субъекту количества соединения по изобретению или его фармацевтически приемлемой соли в комбинации с количеством дополнительного терапевтического средства (например, противоракового терапевтического средства), количества которых являются в совокупности эффективными при лечении указанного аномального клеточного роста.
В обычных вариантах осуществления способов, представленных в настоящем описании, аномальный клеточный рост представляет собой рак. Соединения по изобретению могут быть введены в виде отдельных средств или могут быть введены в комбинации с другими противораковыми терапевтическими средствами, в частности, стандартными средствами лечения, подходящими для конкретного вида рака.
В некоторых вариантах осуществления, предоставленные способы приводят к одному или нескольким из следующих эффектов: (1) ингибирование пролиферации раковых клеток; (2) ингибирование инвазивности раковых клеток; (3) индукция апоптоза раковых клеток; (4) ингибирование метастазирования раковых клеток; или (5) ингибирование ангиогенеза.
В другом аспекте изобретение относится к способу лечения расстройства, опосредованного CDK2, CDK4 и/или CDK6, у субъекта, такого как некоторые виды рака, включающему введение субъекту соединения по изобретению или фармацевтически приемлемой соли в количестве, эффективном для лечения указанного расстройства.
Если не указано иное, все ссылки, сделанные в настоящем описании на соединения по изобретению, включают ссылки на их соли, сольваты, гидраты и комплексы и на сольваты, гидраты и комплексы их солей, включая полиморфы, стереоизомеры и их меченные изотопом варианты.
Соединения по изобретению могут существовать в форме фармацевтически приемлемых солей, таких как, например, соли присоединения кислоты и соли присоединения основания для соединений одной из формул, предложенных в настоящем изобретении. Используемый в настоящем описании термин "фармацевтически приемлемая соль" относится к таким солям, которые сохраняют биологическую эффективность и свойства родительского соединения. Используемая в настоящем описании фраза "фармацевтически приемлемая(ые) соль(и)", если не указано иное, включает соли кислотных или основных групп, которые могут присутствовать в соединениях формул, раскрытых в настоящем описании.
Например, соединения по изобретению, которые являются основными по своей природе, способны к образованию большого множества солей с различными неорганическими и органическими кислотами. Несмотря на то что такие соли должны быть фармацевтически приемлемыми для введения млекопитающим, часто на практике желательно сначала выделить соединение по настоящему изобретению из реакционной смеси в виде фармацевтически неприемлемой соли, а затем легко превратить последнюю обратно в соединение в виде свободного основания путем обработки щелочным реагентом, а впоследствии превратить это свободное основание в фармацевтически приемлемую соль присоединения кислоты. Кислотно-аддитивные соли основных соединений по этому изобретению могут быть получены путем обработки основного соединения по существу эквивалентным количеством выбранной неорганической или органической кислоты в водной среде-растворителе или в подходящем органическом растворителе, таком как метанол или этанол. После выпаривания растворителя получают желаемую твердую соль. Желаемую соль кислоты также можно осадить из раствора свободного основания в органическом растворителе путем добавления к раствору подходящей неорганической или органической кислоты.
Кислотами, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей таких основных соединений, которые образуют нетоксичные кислотно-аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, такие как соли, представляющие собой гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкуронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3-нафтоат)].
Примеры солей включают, но не ограничиваются ими, соли, представляющие собой ацетат, акрилат, бензолсульфонат, бензоат (такой как хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат и метоксибензоат), бикарбонат, бисульфат, бисульфит, битартрат, борат, бромид, бутин-1,4-диоат, эдетат кальция, камсилат, карбонат, хлорид, капроат, каприлат, клавуланат, цитрат, деканоат, дигидрохлорид, дигидрогенфосфат, эдетат, эдизилат, эстолат, эзилат, этилсукцинат, формиат, фумарат, глюцептат, глюконат, глутамат, гликоллат, гликоллиларсанилат, гептаноат, гексин-1,6-диоат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, γ-гидроксибутират, йодид, изобутират, изотионат, лактат, лактобионат, лаурат, малат, малеат, малонат, манделят, мезилат, метафосфат, метан-сульфонат, метилсульфат, моногидрофосфат, мукат, напзилат, нафталин-1-сульфонат, нафталин-2-сульфонат, нитрат, олеат, оксалат, памоат (эмбонат), пальмитат, пантотенат, фенилацетаты, фенилбутират, фенилпропионат, фталат, фосфат/дифосфат, полигалактуронат, пропансульфонат, пропионат, пропиолат, пирофосфат, пиросульфат, салицилат, стеарат, субацетат, суберат, сукцинат, сульфат, сульфонат, сульфит, таннат, тартрат, теоклат, тозилат, триэтйодид и валерат.
Иллюстративные примеры подходящих солей включают органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных и третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития.
Соединения по изобретению, которые содержат основную группу, такую как аминогруппа, могут образовывать фармацевтически приемлемые соли с различными аминокислотами, помимо упомянутых выше кислот.
Соединения по изобретению, которые являются кислотными по своей природе, способны к образованию солей присоединения основания с различными фармакологически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочно-земельных металлов, в частности, соли натрия и калия. Все эти соли получают по традиционным методикам. Химическими основаниями, которые используют в качестве реагентов для получения фармацевтически приемлемых солей присоединения основания по настоящему изобретению, являются основания, которые образуют нетоксичные соли основания с кислотными соединениями. Эти соли могут быть получены любым подходящим способом, например, путем обработки свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочноземельного металла, или т.п. Эти соли также могут быть получены путем обработки соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые катионы, а затем упаривания полученного раствора досуха, предпочтительно при пониженном давлении. Альтернативно, они также могут быть получены путем смешивания вместе растворов кислотных соединений в низших спиртах и желаемого алкоксида щелочного металла, а затем упаривания полученного раствора досуха таким же способом, как описано раньше. В любом случае для обеспечения полноты реакции и максимальных выходов целевого конечного продукта предпочтительно используют стехиометрические количества реагентов.
Химическими основаниями, которые могут быть использованы в качестве реагентов для получения фармацевтически приемлемых солей присоединения основания к соединениям по изобретению, являющимся кислотными по своей природе, являются такие, которые образуют нетоксичные соли присоединения основания с такими соединениями. Такие нетоксичные основные соли включают, но не ограничиваются ими, соли, полученные из таких фармакологически приемлемых катионов, таких как катионы щелочных металлов (например, калия и натрия) и катионы щелочно-земельных металлов (например, кальция и магния), соли аммония или водорастворимые соли присоединения амина, такого как N-метилглюкамин-(меглумин), и низшего алканоламмония и другие основные соли фармацевтически приемлемых органических аминов.
Также могут быть образованы гемисоли кислот и оснований, например, гемисульфат и гемикальциевые соли.
Для обзора подходящих солей, см. Handbook of Pharmaceutical Salts: Properties, Selection, and Use by Stahl and Wermuth (Wiley-VCH, 2002). Способы получения фармацевтически приемлемых солей соединений по изобретению известны специалисту в данной области техники.
Соли по настоящему изобретению могут быть получены способами, известными специалистам в данной области техники. Фармацевтически приемлемая соль соединений по изобретению может быть легко получена путем смешивания вместе растворов соединения и желаемой кислоты или желаемого основания, в зависимости от конкретного случая. Соль может выпадать в осадок из раствора и ее можно собрать фильтрованием или можно извлечь путем выпаривания растворителя. Степень ионизации в соли может варьироваться от полностью ионизированной до почти неионизированной.
Специалистам в данной области техники будет понятно, что соединения по изобретению в форме свободного основания, имеющие основную функциональную группу, могут быть превращены в соли присоединения кислоты путем обработки стехиометрическим избытком подходящей кислоты. Кислотно-аддитивные соли соединений по изобретению могут быть преобразованы в соответствующее свободное основание путем обработки стехиометрическим избытком подходящего основания, такого как карбонат калия или гидроксид натрия, обычно в присутствии водного растворителя и при температуре между примерно 0° и 100°С. Форму свободного основания можно выделить традиционными способами, такими как экстракция органическим растворителем. Кроме того, кислотно-аддитивные соли соединений по настоящему изобретению можно подвергать взаимному обмену, используя преимущества, заключающиеся в разности растворимостей солей, летучестей или кислотностей кислот, или путем обработки подходящим образом нагруженной ионообменной смолой. Например, взаимный обмен можно осуществить путем взаимодействия соли соединений по изобретению со слегка стехиометрическим избытком кислоты при более низком рК, чем у кислотного компонента исходной соли. Это превращение обычно проводят при температуре от примерно 0°С до точки кипения растворителя, используемого в качестве среды для осуществления процедуры. Аналогичного типа замены возможны для солей присоединения основания, обычно путем посредничества формы свободного основания.
Соединения по изобретению могут существовать как в несольватированной, так и в сольватированной формах. Если растворитель или вода связан(а) крепко, то комплекс будет иметь вполне определенную стехиометрию независимо от влажности. Однако, если растворитель или вода связан(а) слабо, как в канальных сольватах и гигроскопичных соединениях, то содержание воды/растворителя будет зависеть от влажности и условий сушки. В таких случаях нестехиометрия будет нормой. Термин "сольват" используют в настоящем описании для описания молекулярного комплекса, включающего соединение по изобретению и одну или более чем одну молекулу фармацевтически приемлемого растворителя, например, этанола. Термин "гидрат" используют в тех случаях, когда растворителем является вода. Фармацевтически приемлемые сольваты по этому изобретению включают гидраты и сольваты, в которых растворитель кристаллизации может быть изотопно-замещенным, например, D2O, d6-ацетон, d6-DMSO.
Также включены в объем изобретения такие комплексы, как клатраты, комплексы включения лекарственное средство-хозяин, где в отличие от вышеупомянутых сольватов, лекарственное средство и хозяин присутствуют в стехиометрических или нестехиометрических количествах. Также включены комплексы лекарственного средства, включающие два или более чем два органических и/или неорганических компонента, которые могут быть в стехиометрических или нестехиометрических количествах. Полученные комплексы могут быть ионизированными, частично ионизированными или неионизированными. Обзор таких комплексов см. J Pharm Sci, 64 (8), 1269-1288 by Haleblian (August 1975), описание которого полностью включено в настоящее описание в качестве ссылки.
Изобретение также относится к пролекарствам соединений формул, предложенных в настоящем изобретении. Таким образом, некоторые производные соединений по изобретению, которые сами могут иметь небольшую фармакологическую активность или не иметь ее, могут при введении пациенту, превращаться в соединения по изобретению, например, путем гидролитического расщепления. Такие производные называют "пролекарствами". Дополнительную информацию, касающуюся применения пролекарств, можно обнаружить в 'Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (T Higuchi and W Stella) и 'Bioreversible Carriers in Drug Design', Pergamon Press, 1987 (ed. E B Roche, American Pharmaceutical Association), раскрытия которых включены в настоящий документ в качестве ссылки во всей своей полноте.
Пролекарства по изобретению могут, например, быть получены путем замены подходящих функциональных групп, присутствующих в соединениях по изобретению, некоторыми группировками, которые известны специалистам в области техники в качестве "прогруппировок", как описано, например, в "Design of Prodrugs", H Bundgaard (Elsevier, 1985), описание которого включено в настоящее описание путем ссылки во всей своей полноте.
Некоторые неограничивающие примеры пролекарств по изобретению включают:
(1) где соединение содержит функциональную группу карбоновой кислоты (-COOH), ее сложный эфир, например, с заменой водорода (C1-C8)алкилом;
(2) где соединение содержит спиртовую функциональную группу (-ОН), его простой эфир, например, с заменой водорода (C1-C6)алканоилоксиметилом или группой фосфатного эфира; и
(3) если соединение содержит первичную или вторичную функциональную аминогруппу (-NH2 или -NHR, где R ≠ H), то его амид, например, с заменой одного или обоих атомов водорода подходящей метаболически неустойчивой группой, такой как амидная, карбаматная, мочевинная, фосфонатная, сульфонатная и т.д.
Дополнительные примеры замещающих групп в соответствии с приведенными выше примерами и примеры других типов пролекарств можно найти в вышеупомянутых ссылках.
Наконец, некоторые соединения по изобретению могут сами выступать в качестве пролекарств других соединений по изобретению.
В объем изобретения также включены метаболиты соединений формул, описанных в настоящем документе, то есть соединения, образованные in vivo после введения лекарственного средства.
Соединения формул, предложенных в настоящем изобретении, могут иметь асимметрические атомы углерода. Углерод-углеродные связи соединений по изобретению могут быть изображены в настоящем описании с использованием сплошной линии  , сплошной клиновидной линии
, сплошной клиновидной линии  или штриховой клиновидной линии
или штриховой клиновидной линии  . Использование сплошной линии для изображения связей с асимметрическими атомами углерода предназначено для обозначения того, что включены все возможные стереоизомеры (например, конкретные энантиомеры, рацемические смеси и т.д.) при таком атоме углерода. Использование или сплошной, или штриховой клиновидной линии для изображения связей с асимметрическими атомами углерода предназначено для обозначения того, что только лишь указанный стереоизомер предполагается для включения. Возможно, что соединения по изобретению могут содержать более одного асимметрического атома углерода. В этих соединениях использование сплошной линии для изображения связей с асимметрическими атомами углерода предназначено для обозначения того, что все возможные стереоизомеры предполагаются для включения и присоединенный стереоцентр. Например, если не указано иное, то подразумевается, что соединения по изобретению могут существовать в виде энантиомеров и диастереомеров или в виде их рацематов и смесей. Использование сплошной линии для изображения связей с одним или более с асимметрическими атомами углерода в соединении по изобретению и использование сплошной или штриховой клиновидной линии для изображения связей с другими асимметрическими атомами углерода в том же самом соединении предназначено для обозначения того, что присутствует смесь диастереомеров.
. Использование сплошной линии для изображения связей с асимметрическими атомами углерода предназначено для обозначения того, что включены все возможные стереоизомеры (например, конкретные энантиомеры, рацемические смеси и т.д.) при таком атоме углерода. Использование или сплошной, или штриховой клиновидной линии для изображения связей с асимметрическими атомами углерода предназначено для обозначения того, что только лишь указанный стереоизомер предполагается для включения. Возможно, что соединения по изобретению могут содержать более одного асимметрического атома углерода. В этих соединениях использование сплошной линии для изображения связей с асимметрическими атомами углерода предназначено для обозначения того, что все возможные стереоизомеры предполагаются для включения и присоединенный стереоцентр. Например, если не указано иное, то подразумевается, что соединения по изобретению могут существовать в виде энантиомеров и диастереомеров или в виде их рацематов и смесей. Использование сплошной линии для изображения связей с одним или более с асимметрическими атомами углерода в соединении по изобретению и использование сплошной или штриховой клиновидной линии для изображения связей с другими асимметрическими атомами углерода в том же самом соединении предназначено для обозначения того, что присутствует смесь диастереомеров.
Соединения по изобретению, которые содержат хиральные центры, могут существовать в виде стереоизомеров, таких как рацематы, энантиомеры или диастереомеры.
Стереоизомеры соединений формул в настоящем описании могут включать цис- и транс-изомеры, оптические изомеры, такие как (R)- и (S)-энантиомеры, диастереомеры, геометрические изомеры, поворотные изомеры, атропизомеры, конформационные изомеры и таутомеры соединений по изобретению, в том числе соединения, проявляющие более одного вида изомерии; и их смеси (такие как рацематы и пары диастереомеров).
Также включены соли присоединения кислоты или присоединения основания, где противоион является оптически активным, например, d-лактат или l-лизин, или рацемическим, например, dl-тартрат или dl-аргинин.
Если какой-либо рацемат кристаллизуется, то возможны кристаллы двух разных типов. Первым типом является вышеуказанное рацемическое соединение (истинный рацемат), где получена одна гомогенная форма кристалла, содержащая оба энантиомера в эквимолярных количествах. Вторым типом является рацемическая смесь или конгломерат, где получены две формы кристалла в эквимолярных количествах, каждая из которых содержит одиночный энантиомер.
Соединения по изобретению могут демонстрировать таутомерные эффекты и обладать структурной изомерией. Например, соединения могут существовать в нескольких таутомерных формах, включая енольную и иминную форму, и кето и енаминную форму, и геометрических изомерах и их смесях. Все такие таутомерные формы включены в объем, охватываемый соединениями по изобретению. Таутомеры существуют в виде смесей группы таутомеров в растворе. В твердой форме обычно преобладает один таутомер. Даже если один таутомер может быть описан, настоящее изобретение включает все таутомеры соединений приведенных формул.
Кроме того, некоторые соединения по изобретению могут образовывать атропизомеры (например, замещенные биарилы). Атропизомеры представляют собой конформационные стереоизомеры, которые встречаются, когда не допускается вращение вокруг одинарной связи в молекуле, или оно сильно замедлено в результате стерических взаимодействий с другими частями молекулы и заместители на обоих концах этой одинарной связи являются несимметричными. Взаимное превращение атропизомеров является достаточно слабым, чтобы предоставить возможность для разделения и выделения в заданных условиях. Энергетический барьер термической рацемизации может быть определен по стерическому затруднению в отношении свободного вращения одной или более связей, образующих хиральную ось.
Если соединение по изобретению содержит алкенильную или алкениленовую группу, то возможны геометрические цис/транс (или Z/E) изомеры. Цис/транс-изомеры могут быть разделены посредством традиционных методик, хорошо известных специалистам в данной области техники, например, хроматографией и фракционной кристаллизацией.
Традиционные методики получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или расщепление рацемата (или рацемата соли или производного) с использованием, например, хиральной жидкостной хроматографии высокого давления (ВЭЖХ) или сверхкритической флюидной хроматографии (SFC).
Альтернативно, рацемат (или предшественник рацемата) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например, спиртом, или в случае, когда соединение содержит кислотную или основную группу, с кислотой или основанием, такими как винная кислота или 1-фенилэтиламин. Полученная диастереомерная смесь может быть разделена хроматографией и/или фракционной кристаллизацией, и один или оба диастереоизомера могут быть превращены в соответствующий(е) чистый(е) энантиомер(ы) методами, хорошо известными специалисту в области техники.
Хиральные соединения по изобретению (и их хиральные предшественники) могут быть получены в энантиомерно-обогащенной форме с использованием хроматографии, обычно ВЭЖХ, на асимметричной смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащего от 0 до 50% изопропанола, обычно от 2 до 20%, и от 0 до 5% алкиламина, обычно 0,1% диэтиламина. Концентрирование элюата приводит к обогащенной смеси.
Стереоизомерные конгломераты могут быть разделены посредством традиционных методик, известным специалистам в области техники; см., например, "Stereochemistry of Organic Compounds" by E L Eliel (Wiley, New York, 1994), описание которого включено в настоящее описание путем ссылки во всей своей полноте.
Энантиомерная чистота соединений, описанных в настоящем документе, может быть описана в терминах энантиомерного избытка (ее), который указывает степень, в которой образец содержит один энантиомер в больших количествах, чем другой. Рацемическая смесь имеет ее 0%, в то время как один полностью чистый энантиомер имеет ее 100%. Аналогично, диастереомерная чистота может быть описана в терминах диастереомерного избытка (de).
Настоящее изобретение также включает меченные изотопом соединения, которые идентичны соединениям, изложенным в одной из предложенных формул, за исключением того, что один или несколько атомов заменены атомом, имеющим атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно встречающихся в природе.
Меченные изотопом соединения по изобретению обычно могут быть получены традиционными методиками, известными специалистам в данной области техники, или способами, аналогичными способам, раскрытым в настоящем описании, с использованием подходящего меченного изотопом реагента вместо реагента, не меченного изотопом, используемого в других случаях.
Примеры изотопов, которые могут быть включены в соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как, но не ограничиваются ими, 2H, 3H, 13C, 14C, 15N, 18O, 17O, 31P, 32P, 35S, 18F и 36Cl. Некоторые меченные изотопом соединения по изобретению, например, такие, в которые включены такие радиоактивные изотопы, такие как 3Н и 14С, являются полезными в анализах распределения лекарственного средства и/или субстрата в ткани. Тритированные, то есть 3Н и углерод-14, то есть 14С, изотопы являются особенно предпочтительными вследствие легкости их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами, такими как дейтерии, т.е. 2H, может предоставить некоторые терапевтические преимущества, получаемые вследствие более высокой метаболической стабильности, например, повышенный период полураспада in vivo или пониженные требования к дозировкам, и, следовательно, могут быть предпочтительными в некоторых случаях. Меченные изотопом соединения по изобретению в основном могут быть получены посредством осуществления процедур, раскрытых на схемах и/или в примерах и получениях ниже, путем замены реагента, не меченного изотопом, на меченный изотопом реагент.
Соединения по изобретению, предназначенные для фармацевтического применения, можно вводить в виде кристаллических или аморфных продуктов или их смесей. Они могут быть получены, например, в виде твердаых прессованных масс, порошков или пленок такими способами, как осаждение, кристаллизация, лиофильная сушка, сушка распылением или сушка выпариванием. Микроволновая или радиочастотная сушка могут быть использованы для этой цели.
Терапевтические способы и применения
Изобретение также предоставляет терапевтические способы и применения, включающие введение соединений по изобретению или их фармацевтически приемлемых солей, отдельно или в комбинации с другими терапевтическими средствами или паллиативными средствами.
В одном аспекте изобретение относится к способу лечения аномального клеточного роста у субъекта, включающему введение субъекту терапевтически эффективного количества соединения по изобретению или его фармацевтически приемлемой соли. В обычных вариантах осуществления, аномальный клеточный рост представляет собой рак.
В другом аспекте изобретение относится к способу лечения рака у субъекта, включающему введение субъекту количества соединения по изобретению или его фармацевтически приемлемой соли в комбинации с количеством дополнительного противоракового терапевтического средства, где эти количества совместно являются эффективными при лечении указанного рака.
Соединения по изобретению включают соединения любой из формул, описанных в настоящем описании, или их фармацевтически приемлемые соли.
В еще одном аспекте изобретение относится к способу ингибирования пролиферации раковых клеток у субъекта, включающему введение субъекту соединения по изобретению или его фармацевтически приемлемой соли в количестве, эффективном для ингибирования пролиферации клеток.
В другом аспекте изобретение относится к способу ингибирования инвазивности раковых клеток у субъекта, включающему введение субъекту соединения по изобретению или его фармацевтически приемлемой соли в количестве, эффективном для ингибирования инвазивности клеток.
В другом аспекте изобретение относится к способу индукции апоптоза в раковых клетках у субъекта, включающему введение субъекту соединения по изобретению или его фармацевтически приемлемой соли в количестве, эффективном для индукции апоптоза.
В обычных вариантах осуществления способов, представленных в настоящем описании, аномальный клеточный рост представляет собой рак, характеризующийся амплификацией или сверхэкспрессией CCNE1 и/или CCNE2. В некоторых вариантах осуществления способов, представленных в настоящем документе, субъект идентифицирован как имеющий рак, характеризующийся амплификацией или сверхэкспрессией CCNE1 и/или CCNE2.
В обычных вариантах осуществления способов, представленных в настоящем описании, аномальный клеточный рост представляет собой рак, где рак выбран из группы, состоящей из рака молочной железы, рака яичника, рака мочевого пузыря, рака матки, рака простаты, рака легкого (включая NSCLC, SCLC, плоскоклеточный рак или аденокарциному), рака пищевода, рака головы и шеи, колоректального рака, рака почки (включая RCC), рака печени (включая HCC), рака поджелудочной железы, рака желудка (то есть желудочно-кишечного тракта) и рака щитовидной железы. В других вариантах осуществления способов, представленных в настоящем документе, рак выбран из группы, состоящей из рака молочной железы, рака яичника, рака мочевого пузыря, рака матки, рака простаты, рака легкого, рака пищевода, рака печени, рака поджелудочной железы и рака желудка. В некоторых таких вариантах осуществления, рак характеризуется амплификацией или сверхэкспрессией CCNE1 и/или CCNE2.
В некоторых вариантах осуществления, рак выбран из группы, состоящей из рака молочной железы и рака яичника. В некоторых таких вариантах осуществления, рак представляет собой рак молочной железы или рак яичника, характеризующийся амплификацией или сверхэкспрессией CCNE1 и/или CCNE2. В некоторых таких вариантах осуществления, рак представляет собой (a) рак молочной железы или рак яичника; (b) характеризуется амплификацией или сверхэкспрессией циклина Е1 (CCNE1) или циклина Е2 (CCNE2); или (с) оба (а) и (b).
В некоторых вариантах осуществления, рак представляет собой рак яичника. В некоторых таких вариантах осуществления, рак яичника характеризуется амплификацией или сверхэкспрессией CCNE1 и/или CCNE2.
В других вариантах осуществления, рак представляет собой рак молочной железы, включая, например, ER-положительный/HR-положительный рак молочной железы, HER2-негативный рак молочной железы; ER-положительный/HR-положительный рак молочной железы, HER2-положительный рак молочной железы; трижды негативный рак молочной железы (TNBC); или отечно-инфильтративный рак молочной железы. В некоторых вариантах осуществления, рак молочной железы является эндокринно-резистентным раком молочной железы, трастузумаб-резистентным раком молочной железы или раком молочной железы, демонстрирующим первичную или приобретенную устойчивость к ингибированию CDK4/CDK6. В некоторых вариантах осуществления, рак молочной железы является распространенным или метастатическим раком молочной железы. В некоторых вариантах осуществления каждого из вышеизложенного рак молочной железы характеризуется амплификацией или сверхэкспрессией CCNE1 и/или CCNE2.
В некоторых вариантах осуществления, соединение по изобретению вводят в качестве терапии первой линии. В других вариантах осуществления, соединение по изобретению вводят в качестве терапии второй (или более поздней) линии. В некоторых вариантах осуществления, соединение по изобретению вводят в качестве терапии второй (или более поздней) линии после лечения гормональным терапевтическим средством и/или ингибитором CDK4/CDK6. В некоторых вариантах осуществления, соединение по изобретению вводят в качестве терапии второй (или более поздней) линии после лечения гормональным терапевтическим средством. В некоторых вариантах осуществления, соединение по изобретению вводят в качестве терапии второй (или более поздней) линии после лечения ингибитором CDK4/CDK6. В некоторых вариантах осуществления, соединение по изобретению вводят в качестве терапии второй (или более поздней) линии после лечения одним или несколькими химиотерапевтическими режимами лечения, например, включая средства на основе таксана или платины. В некоторых вариантах осуществления, соединение по изобретению вводят в качестве терапии второй (или более поздней) линии после лечения средствами, нацеленными на HER2, например, трастузумабом. Термин "терапевтически эффективное количество", используемый в настоящем описании, относится к такому количеству вводимого соединения, которое будет ослаблять в некоторой степени один или несколько симптомов расстройства, которое лечат. При ссылке на лечение рака, терапевтически эффективное количество относится к такому количеству, которое обладает эффектом (1) уменьшения размера опухоли, (2) ингибирования (т.е. замедления в некоторой степени, предпочтительно останавливания) метастазирования опухоли, (3) ингибирования в некоторой степени (т.е. замедления в некоторой степени, предпочтительно останавливания) роста опухоли или инвазивности опухоли, и/или (4) ослабления в некоторой степени (или, предпочтительно, устранения) одного или нескольких признаков или симптомов, ассоциированных с раком.
Используемый в настоящем описании термин «субъект» относится к субъекту человека или животного. В определенных предпочтительных вариантах субъектом является человек.
Термин "процесса лечения", используемый в настоящем описании, если не указано иное, означает изменение, облегчение, ингибирование прогрессирования или предупреждение расстройства или состояния, в отношении которого такой термин применяется, или одного или нескольких симптомов такого расстройства или состояния. Термин "лечение", используемый в настоящем описании, если не указано иное, относится к акту процесса лечения как "процесса лечения", как он определен непосредственно выше. Термин "процесс лечения" также включает адъювантное и неоадъювантное лечение субъекта.
Термины "аномальный клеточный рост" и "гиперпролиферативное расстройство" используются в этом изобретении взаимозаменямо.
"Аномальный клеточный рост", используемый в настоящем описании, если не указано иное, относится к клеточному росту, который не зависит от нормальных регуляторных механизмов (например, потере контактного ингибирования). Аномальный клеточный рост может быть доброкачественным (нераковым) или злокачественным (раковым).
Аномальный клеточный рост включает аномальный рост: (1) опухолевых клеток (опухолей), которые демонстрируют повышенную экспрессию CDK2; (2) опухолей, которые пролиферируют вследствие аберрантной активации CDK2; (3) опухолей, характеризующихся амплификацией или сверхэкспрессией CCNE1 и/или CCNE2; и 4) опухолей, которые устойчивы к эндокринной терапии, антагонистам HER2 или ингибированию CDK4/6.
Термин «дополнительное противораковое терапевтическое средство» в контексте настоящего описания означает любое одно или несколько терапевтических средств, отличных от соединения по изобретению, которое используется или может быть использовано при лечении рака, таких как средства, полученные из следующих классов: ингибиторы митоза, алкилирующие средства, антиметаболиты, противоопухолевые антибиотики, ингибиторы топоизомеразы I и II, растительные алкалоиды, гормональные средства и антагонисты, ингибиторы факторов роста, радиация, ингибиторы протеинтирозинкиназ и/или серин/треонинкиназ, ингибиторы клеточного цикла, модификаторы биологического ответа, ингибиторы ферментов, антисмысловые олигонуклеотиды или производные олигонуклеотидов, цитотоксические и иммуноонкологические средства.
Используемый в настоящем описании термин "рак" относится к любому злокачественному и/или инвазивному росту или опухоли, вызванной аномальным клеточным ростом. Рак включает солидные опухоли, названные по типу клеток, которые их формируют, рак крови, костного мозга или лимфатической системы. Примеры солидных опухолей включают, но не ограничиваются ими, саркомы и карциномы. Примеры видов рака крови включают, но не ограничиваются ими, лейкемии, лимфомы и миелому. Рак также включает первичный рак, который возникает в конкретном участке организма, метастатический рак, который распространяется из места, в котором он начался, в другие части организма, рецидив первоначального первичного рака после ремиссии и второй первичный рак, который представляет собой новый первичный рак у пациента, обладающего историей предыдущего рака с типом, отличным от последнего рака.
В некоторых вариантах осуществления способов, представленных в настоящем документе, рак выбран из группы, состоящей из рака молочной железы, рака яичника, рака мочевого пузыря, рака матки, рака простаты, рака легкого, рака пищевода, рака печени, рака поджелудочной железы и рака желудка. В некоторых таких вариантах осуществления, рак характеризуется амплификацией или сверхэкспрессией CCNE1 и/или CCNE2.
Лекарственные формы и режимы
Введение соединений по изобретению можно осуществить любым способом, который делает возможной доставку соединений к месту действия. Эти способы включают пероральные пути, интрадуоденальные пути, парентеральную инъекцию (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или инфузию), местное и ректальное введение.
Режимы дозирования можно скорректировать для обеспечения оптимального желаемого ответа. Например, можно вводить разовый болюс, можно вводить несколько доз, разделенных по времени, или дозу можно пропорциональным образом уменьшить или увеличить, как предписывает терапевтическая ситуация. Особенно полезно изготавливать парентеральные композиции в стандартной лекарственной форме для легкости введения и единообразия дозы. Стандартная лекарственная форма, как используется в настоящем описании, относится к физически дискретным единицам, пригодным в качестве единичных доз для млекопитающих, которых следует лечить; причем каждая единица содержит предварительно определенное количество активного соединения, рассчитанное для получения желаемого терапевтического эффекта вместе с желаемым фармацевтическим носителем. Подробное определение стандартных лекарственных форм по изобретению продиктовано и непосредственно зависит от (а) уникальных характеристик химиотерапевтического средства и конкретного терапевтического или профилактического эффекта, который следует достичь, и (b) ограничений, присущих в области приготовления лекарственных средств, таких как активное соединение для лечения чувствительности у индивидуумов.
Таким образом, специалисту будет понятно, что дозу и режим дозирования можно корректировать на основе предложенного описания в соответствии со способами, хорошо известными в области терапии. То есть, можно легко установить максимально приемлемую дозу, также как и можно определить эффективное количество, обеспечивающее обнаруживаемую терапевтическую пользу для пациента, а также временные требования по введению каждого агента с обеспечением обнаруживаемой терапевтической пользы у пациента. Соответственно, несмотря на то, что в настоящем описании для некоторых доз и режимов введения приведены примеры, эти примеры никоим образом не ограничивают дозу и режим введения, которые могут быть предложены пациенту при осуществлении настоящего изобретения на практике.
Следует отметить, что значения доз могут варьироваться в зависимости от типа и тяжести состояния, которое следует облегчить, и могут включать однократные или многократные дозы. Кроме того, следует понимать, что для любого конкретного субъекта конкретные режимы дозирования следует скорректировать в отношении времени в соответствии с индивидуальной потребностью и профессиональным суждением личности, осуществляющей введение и наблюдающей за введением композиции, и что изложенные в настоящем описании диапазоны доз являются только лишь типичными и не предназначены ограничивать объем или практическое использование заявленной композиции. Например, дозы можно скорректировать, исходя из фармакокинетических или фармакодинамических параметров, которые могут включать клинические эффекты, такие как токсические эффекты, и/или лабораторные значения. Таким образом, настоящее изобретение охватывает расширение диапазона доз для пациента, определяемое квалифицированным специалистом. Определение подходящих доз и режимов введения химиотерапевтических агентов хорошо известно в соответствующей области, и должно быть понятно специалисту в данной области после получения информации, раскрытой в настоящем описании.
Количество вводимого соединения по изобретению будет зависеть от субъекта, которого лечат, тяжести расстройства или состояния, скорости введения, распределения соединения и усмотрения лечащего врача. Однако эффективная доза обычно находится в диапазоне от примерно 0,001 до примерно 100 мг на 1 кг массы тела в сутки, предпочтительно от примерно 1 до примерно 35 мг/кг/сутки, в однократной или разделенных дозах. Для человека с массой 70 кг, это количество могло бы составить от примерно 0,05 до примерно 7 г/сутки, предпочтительно от примерно 0,1 до примерно 2,5 г/сутки. В некоторых случаях уровни доз ниже нижнего предела вышеупомянутого диапазона могут быть более чем достаточными, в то время как в других случаях могут использоваться более большие дозы, не вызывая какого-либо опасного побочного эффекта, при условии, что такие большие дозы сначала делятся на несколько небольших доз для введения в течение суток.
Составы и пути введения
Используемый в настоящем описании "фармацевтически приемлемый носитель" относится к носителю или разбавителю, который не вызывает значительного раздражения организма и не отменяет биологическую активность и свойства вводимого соединения.
Фармацевтически приемлемый носитель может включать любой обычный фармацевтический носитель или эксципиент. Выбор носителя и/или эксципиента будет в большой степени зависеть от таких факторов, как конкретный путь введения, влияние носителя или эксципиента на растворимость и стабильность и природы лекарственной формы.
Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители (например, гидраты и сольваты). Фармацевтические композиции могут, если желательно, содержать дополнительные ингредиенты, такие как корригенты, связующие вещества, эксципиенты и т.п. Таким образом, для перорального введения таблетки, содержащие различные эксципиенты, такие как лимонная кислота, можно применять вместе с различными разрыхлителями, такими как крахмал, альгиновая кислота и некоторые комплексные силикаты, и со связующими веществами, такими как сахароза, желатин и гуммиарабик. Примеры, без ограничения, эксципиентов включают карбонат кальция, фосфат кальция, различные сахара и виды крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Кроме того, для целей таблетирования часто полезны смазывающие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. Твердые композиции подобного типа также можно применять в мягких и твердых наполненных желатиновых капсулах. Таким образом, неограничивающие примеры материалов включают лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии или эликсиры, активное соединение в них может быть объединено с различными подсластителями или ароматизаторами, красящими веществами или красками и, если желательно, эмульгаторами или суспендирующими средствами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их комбинации.
Фармацевтическая композиция может, например, находиться в форме, подходящей для перорального введения в виде таблетки, капсулы, пилюли, порошка, препаратов замедленного высвобождения, раствора, суспензии, для парентеральной инъекции в виде стерильного раствора, суспензии или эмульсии, для местного введения в виде мази или крема или для ректального введения в виде суппозитория.
Типичные формы для парентерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, например, в водном пропиленгликолевом или декстрозном растворах. Если требуется, такие лекарственные формы могут быть подходящим образом буферизованы.
Фармацевтическая композиция может находиться в стандартных лекарственных формах, подходящих для однократного введения точных доз.
Фармацевтические композиции, подходящие для доставки соединений по изобретению, и способы их получения будут очевидны специалистам в данной области. Такие композиции и способы их получения можно обнаружить, например, в "'Remington's Pharmaceutical Sciences', 19th Edition (Mack Publishing Company, 1995), описание которого включено в настоящее описание путем ссылки во всей своей полноте.
Соединения по изобретению можно вводить перорально. Пероральное введение может включать глотание, так что соединение попадает в желудочно-кишечный тракт, или может быть использовано трансбуккальное или подъязычное введение, посредством которых соединение попадает в кровоток непосредственно изо рта.
Составы, подходящие для перорального введения, включают твердые составы, такие как таблетки, капсулы, содержащие частицы, жидкости или порошки, лепешки (включая заполненные жидкостью), жвачки, мульти- и наночастицы, гели, твердый раствор, липосому, пленки (включая мукоадгезивные), вагинальные суппозитории яйцевидной формы, спреи и жидкие композиции.
Жидкие композиции включают суспензии, растворы, сиропы и эликсиры. Такие композиции могут быть использованы в качестве наполнителей в мягких или твердых капсулах и обычно содержат носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или несколько эмульгаторов и/или суспендирующих веществ. Жидкие композиции также могут быть приготовлены путем восстановления влагосодержания твердого вещества, например, из саше.
Соединения по изобретению также можно применять в быстрорастворимых, быстроразрушающихся лекарственных формах, таких как описанные в Expert Opinion in Therapeutic Patents, 11 (6), 981-986 by Liang and Chen (2001), описание которого включено в настоящее описание путем ссылки во всей своей полноте.
Для таблетированных лекарственных форм, в зависимости от дозы, лекарственное средство может составлять от 1% масс. до 80% масс. лекарственной формы, более типично от 5% масс. до 60% масс. лекарственной формы. В дополнение к лекарству таблетки обычно содержат разрыхлитель. Примеры разрыхлителей включают натрийкрахмалгликолат, карбоксиметилцеллюлозу натрия, карбоксиметилцеллюлозу кальция, кроскармеллозу натрия, кросповидон, поливинилпирролидон, метилцеллюлозу, микрокристаллическую целлюлозу, низший алкилзамещенный гидроксипропил-целлюлозу, крахмал, пептизированный крахмал и альгинат натрия. Обычно разрыхлитель будет составлять от 1% масс. до 25% масс., предпочтительно от 5% масс. до 20% масс. лекарственной формы.
Связующие вещества обычно используют для придания составу таблетки связующих качеств. Подходящие связующие вещества включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, прежелатинизированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Таблетки также могут содержать разбавители, такие как лактоза (моногидрат, высушенный распылением моногидрат, безводный и т.п.), маннит, ксилит, декстрозу, сахарозу, сорбит, микрокристаллическую целлюлозу, крахмал и дигидрат двухосновного фосфата кальция.
Таблетки также необязательно могут содержать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и скользящие вещества, такие как диоксид кремния и тальк. Когда они присутствуют, поверхностно-активные вещества обычно находятся в количествах от 0,2% масс. до 5% масс. таблетки, а скользящие вещества обычно от 0,2% масс. до 1% масс. таблетки.
Таблетки также обычно содержат лубриканты, такие как стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Лубриканты обычно присутствуют в количествах от 0,25% масс. до 10% масс., предпочтительно от 0,5% масс. до 3% масс. таблетки.
Другие общепринятые ингредиенты включают антиоксиданты, красители, корригенты, консерванты и вещества, маскирующие вкус.
Типичные таблетки содержат вплоть до примерно 80% масс. лекарственного средства, от примерно 10% масс. до примерно 90% масс. связующего вещества, от примерно 0% масс. до примерно 85% масс. разбавителя, от примерно 2% масс. до примерно 10% масс. разрыхлителя и от примерно 0,25% масс. до примерно 10% масс. лубриканта.
Таблеточные смеси могут быть подвергнуты непосредственному прессованию или прессованию с помощью вращающегося цилиндра с формированием таблеток. Альтернативно, таблеточные смеси или части смесей могут быть подвергнуты влажному, сухому гранулированию или гранулированию из расплава, застыванию расплава или экструзии перед таблетированием. Конечный препарат может содержать один или более слоев и может быть покрытым или непокрытым, или инкапсулированным.
Изготовление таблеток подробно рассмотрено в "Pharmaceutical Dosage Forms: Tablets, Vol. 1", by H. Lieberman and L. Lachman, Marcel Dekker, N.Y., N.Y., 1980 (ISBN 0-8247-6918-X), описание которого включено в настоящее описание путем ссылки во всей своей полноте.
Твердые составы для перорального введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Препараты модифицированного высвобождения включают отсроченное, замедленное, прерывистое, контролируемое, направленное и программируемое высвобождение.
Подходящие составы с модифицированным высвобождением описаны в патенте США No 6106864. Подробности других подходящих технологий высвобождения, таких как высокоэнергетические дисперсии и осмотические и покрытые частицы, можно обнаружить в Verma et al, Pharmaceutical Technology On-line, 25(2), 1-14 (2001). Использование жевательной резинки для достижения контролируемого высвобождения описано в WO 00/35298. Описания этих ссылок включены в настоящее описание путем ссылок во всей их полноте.
Парентеральное введение
Соединения по изобретению также можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы парентерального введения включают внутривенное, внутриартериальное, внутрибрюшинное, интратекальное, внутрижелудочковое, интрауретральное, интрастернальное, интракраниальное, внутримышечное и подкожное. Подходящие устройства для парентерального введения включают игольчатые (в том числе микроигольчатые) инжекторы, безыгольные устройства для инъекций и оборудование для инфузии.
Парентеральные композиции обычно представляют собой водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные вещества (предпочтительно до pH от 3 до 9), но в некоторых случаях они могут быть более подходящим образом изготовлены в виде стерильного неводного раствора или в виде сухой формы, которую следует использовать совместно с подходящим наполнителем, таким как стерильная апирогенная вода.
Приготовление парентеральных композиций в стерильных условиях, например, путем лиофилизации, может быть легко осуществлено с использованием стандартных фармацевтических методик, хорошо известных специалистам в данной области.
Растворимость соединений по изобретению, используемых при получении парентеральных растворов можно увеличить с помощью подходящих методик приготовления, таких как включение веществ, улучшающих растворимость.
Препараты для парентерального введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Лекарственные формы модифицированного высвобождения включают отсроченное, замедленное, прерывистое, контролируемое, направленное и программируемое высвобождение. Таким образом, соединения по изобретению могут быть изготовлены в виде твердого вещества, полутвердого вещества или тиксотропной жидкости для введения в качестве имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких лекарственных форм включают покрытые лекарством стенты и микросферы из PGLA.
Соединения по изобретению также можно вводить местно на кожу или слизистую оболочку, т.е. дермально или трансдермально. Типичные лекарственные формы для этой цели включают гели, гидрогели, лосьоны, растворы, кремы, мази, присыпки, перевязочные материалы, пены, пленки, кожные пластыри, пластины, имплантаты, губки, волокна, повязки и микроэмульсии. Также могут быть использованы липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, медицинский вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усилители проникновения; см., например, J Pharm Sci, 88 (10), 955-958 by Finnin and Morgan (October 1999). Другие средства для местного введения включают доставку электропорацией, ионтофорезом, фонофорезом, сонофорезом и микроигольчатой или безыгольчатой (например, Powderject™, Bioject™, и т.д.) инъекцией. Описания этих ссылок включены в настоящее описание путем ссылок во всей их полноте.
Лекарственные формы для местного введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Лекарственные формы модифицированного высвобождения включают отсроченное, замедленное, прерывистое, контролируемое, направленное и программируемое высвобождение.
Соединения по изобретению также можно вводить интраназально или ингаляцией, обычно в форме сухого порошка (либо отдельно, в виде смеси, например, сухой смеси с лактозой, или в виде частицы из смешанных компонентов, например, в смеси с фосфолипидами, такими как фосфатидилхолин) из ингалятора сухого порошка или в виде аэрозольного спрея из находящегося под давлением контейнера, насоса, разбрызгивателя, пульверизатора (предпочтительно пульверизатора, использующего электрогидродинамику для получения мелкодисперсного тумана) или небулайзера с использованием подходящего пропеллента, такого как 1,1,1,2-тетрафторэтан или 1,1,1,2,3,3,3-гептафторпропан, или без его использования. Для интраназального применения порошок может содержать биоадгезивные вещества, например хитозан или циклодекстрин.
Находящийся под давлением контейнер, насос, разбрызгиватель, пульверизатор или небулайзер содержит раствор или суспензию соединения(й) по изобретению, содержащую, например, этанол, водный этанол или подходящее альтернативное вещество для диспергирования, солюбилизации или удлинения высвобождения активного вещества, пропеллент(ы) в качестве растворителя и необязательное поверхностно-активное вещество, такое как сорбитантриолеат, олеиновая кислота или олигомолочная кислота.
Лекарственный продукт перед применением в препарате сухого порошка или суспензионном препарате подвергают микронизации до размера, подходящего для доставки ингаляцией (обычно менее чем 5 микрон). Этого можно достичь любым подходящим способом измельчения, таким как размол на спиральной струйной мельнице, размол на струйной мельнице с кипящим слоем, сверхкритической флюидной обработкой с образованием наночастиц, гомогенизацией при высоком давлении или сушкой распылением.
Капсулы (сделанные, например, из желатина или НРМС), блистеры и картриджи для применения в ингаляторе или инсуффляторе могут быть изготовлены таким образом, чтобы содержать порошковую смесь соединения по изобретению, подходящей порошковой основы, такой как лактоза или крахмал, и модификатора характеристик, такого как l-лейцин, маннит или стеарат магния. Лактоза может быть безводной или в форме моногидрата, предпочтительно в форме последнего. Другие подходящие эксципиенты включают декстран, глюкозу, мальтозу, сорбит, ксилит, фруктозу, сахарозу и трегалозу.
Подходящие композиции в форме раствора для применения в пульверизаторе, использующем электрогидродинамику для получения мелкодисперсного тумана, могут содержать от 1 мкг до 20 мг соединения по изобретению на одно включение, а объем активации может варьироваться от 1 до 100 мкл. Типичная композиция включает соединение по изобретению, пропиленгликоль, стерильную воду, этанол и хлорид натрия. Альтернативные растворители, которые могут быть использованы вместо пропиленгликоля, включают глицерин и полиэтиленгликоль.
Подходящие корригенты, такие как ментол и левоментол, или подсластители, такие как сахарин или натрия сахарин, могут быть добавлены к таким композициям по изобретению, предназначенным для ингаляционного/интраназального введения.
Лекарственные формы для ингаляционного/интраназального введения могут быть изготовлены для немедленного и/или модифицированного высвобождения с использованием, например, поли(DL-молочная-согликолевая кислота) (PGLA). Лекарственные формы модифицированного высвобождения включают отсроченное, замедленное, прерывистое, контролируемое, направленное и программируемое высвобождение.
В случае ингаляторов сухого порошка и аэрозолей стандартную дозу определяют с помощью клапана, который доставляет отмеренное количество. Устройства в соответствии с изобретением типично оборудованы для введения отмеренной дозы или "вдоха", содержащего желаемое количество соединения по изобретению. Общую суточную дозу можно вводить в однократной дозе или чаще всего в виде разделенных доз на протяжении суток.
Соединения по изобретению можно вводить ректально или вагинально, например, в форме суппозитория, пессария или клизмы. Масло какао является традиционной основой для суппозиториев, но при необходимости можно использовать различные альтернативы.
Лекарственные формы для ректального/вагинального введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Лекарственные формы модифицированного высвобождения включают отсроченное, замедленное, прерывистое, контролируемое, направленное и программируемое высвобождение.
Соединения по изобретению также можно вводить непосредственно в глаз или в ухо, типично в форме капель состоящей из микрочастиц суспензии или раствора в изотоническом стерильном солевом растворе с установленным pH. Другие лекарственные формы, подходящие для глазного и ушного введения, включают мази, биоразлагаемые (например, гемостатические губки коллаген) и бионеразлагаемые (например, силиконовые) имплантаты, пластины, линзы и системы, состоящие из частиц или везикул, таких как ниосомы или липосомы. Полимер, такой как поперечно-сшитая полиакриловая кислота, поливиниловый спирт, гиалуроновая кислота, целлюлозный полимер, например, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза или метилцеллюлоза, или гетерополисахаридный полимер, например, гелановую камедь, можно включать вместе с консервантом, таким как хлорид бензалкония. Такие лекарственные формы можно также доставлять ионофорезом.
Лекарственные формы для глазного/ушного введения могут быть изготовлены для немедленного и/или модифицированного высвобождения. Лекарственные формы модифицированного высвобождения включают отсроченное, замедленное, прерывистое, контролируемое, направленное и программируемое высвобождение.
Другие технологии
Соединения по изобретению можно объединять с растворимыми макромолекулярными веществами, такими как циклодекстрин и его подходящие производные или полимеры, содержащие полиэтиленгликоль, в целях улучшения их растворимости, скорости растворения, маскирования вкуса, биодоступности и/или стабильности для применения при любом из вышеупомянутых путей введения.
Например, обнаружено, что комплексы лекарственное средство-циклодекстрин, в целом полезны для большинства лекарственных форм и путей введения. Могут быть использованы как комплексы включения, так и комплексы невключения. В качестве альтернативы непосредственному комплексообразованию с лекарством циклодекстрин можно использовать в качестве вспомогательной добавки, т.е. в качестве носителя, разбавителя или солюбилизатора. Чаще всего для этих целей используют альфа-, бета-и гаммациклодекстрины, примеры которых можно обнаружить в РСТ публикациях No WO 91/11172, WO 94/02518 и WO 98/55148, описания которых включены в настоящее описание путем ссылок во всей их полноте.
Дозировка
Количество вводимого активного соединения будет зависеть от субъекта, которого лечат, тяжести расстройства или состояния, скорости введения, распределения соединения и усмотрения лечащего врача. Однако эффективная доза обычно находится в диапазоне от примерно 0,001 до примерно 100 мг на 1 кг массы тела в сутки, предпочтительно от примерно 0,01 до примерно 35 мг/кг/сутки, в однократной или разделенных дозах. Для человека с массой 70 кг это количество могло бы составить от примерно 0,07 до примерно 7000 мг/сутки, предпочтительно от примерно 0,7 до примерно 2500 мг/сутки. В некоторых случаях уровни доз ниже нижнего предела вышеупомянутого диапазона могут быть более чем адекватными, тогда как в других случаях могут быть использованы даже большие дозы без вызывания какого-либо опасного побочного эффекта, где такие большие дозы обычно разделены на несколько меньших доз для введения в течение суток.
Составный набор
Поскольку может быть желательным введение комбинации активных соединений, например, для лечения конкретного заболевания или состояния, в объем настоящего изобретения входят две или несколько фармацевтических композиций, по меньшей мере одна из которых содержит соединение по изобретению, можно удобно объединять в форме набора, подходящего для совместного введения композиций. Таким образом, набор по изобретению включает две или несколько отдельных фармацевтических композиций, по меньшей мере одна из которых включает соединение по изобретению, и средства для отдельного хранения указанных композиций, такие как контейнер, секционная бутыль или секционный пакет из фольги. Примером такого набора является знакомая блистерная упаковка, используемая для упаковки таблеток, капсул и тому подобного.
Набор по изобретению является особенно подходящим для введения различных лекарственных форм, например, пероральной и парентеральной, для введения отдельных композиций при различных интервалах дозирования или для титрования отдельных композиций друг против друга. Чтобы способствовать соблюдению пациентом режима и схемы лечения, набор обычно содержит инструкции по введению и может быть снабжен так называемой памяткой.
Комбинированная терапия
Используемый в настоящем описании термин "комбинированная терапия" относится к введению соединения по изобретению вместе по меньшей мере с одним дополнительным фармацевтическим или медицинским средством (например, противораковым средством) или последовательно, или одновременно.
Как отмечено выше, соединения по изобретению могут быть использованы в комбинации с одним или несколькими дополнительными противораковыми средствами, которые описаны ниже. Эффективность соединений по настоящему изобретению в определенных опухолях может быть повышена путем комбинации с другими одобренными или экспериментальными методами лечения рака, например, облучением, хирургическим вмешательством, химиотерапевтическими средствами, направленными терапиями, средствами, которые ингибируют другие сигнальные пути, которые разрегулированы в опухолях, и другими усиливающими иммунитет средствами, такими как антагонисты PD-1 и тому подобное.
Когда используется комбинированная терапия, один или несколько дополнительных противораковых средств можно вводить последовательно или одновременно с соединением по изобретению. В одном варианте осуществления дополнительное противораковое средство вводят млекопитающему (например, человеку) до введения соединения по изобретению. В другом варианте осуществления дополнительное противораковое средство вводят млекопитающему после введения соединения по изобретению. В другом варианте осуществления дополнительное противораковое средство вводят млекопитающему (например, человеку) одновременно с введением соединения по изобретению.
Изобретение также относится к фармацевтической композиции для лечения аномального клеточного роста у млекопитающего, включая человека, включающей количество соединения по изобретению, определенного выше (включая гидраты, сольваты и полиморфы указанного соединения или его фармацевтически приемлемые соли), в комбинации с одним или несколькими (предпочтительно одним-тремя) противораковыми средствами.
В конкретных вариантах осуществления, соединение по изобретению можно вводить в комбинации с одним или несколькими: средствами целенаправленного воздействия, такими как ингибиторы PI3 киназы, mTOR, PARP, IDO, TDO, ALK, ROS, MEK, VEGF, FLT3, AXL, ROR2, EGFR, FGFR, Src/Abl, RTK/Ras, Myc, Raf, PDGF, AKT, c-Kit, erbB, CDK4/CDK6, CDK5, CDK7, CDK9, SMO, CXCR4, HER2, GLS1, EZH2 или Hsp90, или иммуномодулирующими средствами, такими как антагонисты PD-1 или PD-L1, агонисты OX40 или агонисты 4-1BB.
В других вариантах осуществления, соединение по изобретению можно вводить в комбинации со стандартным средством для лечения, таким как тамоксифен, доцетаксел, паклитаксел, цисплатин, капецитабин, гемцитабин, винорелбин, эксеместан, летрозол, фулвестрант, анастрозол или трастузумаб.
Способы синтеза
Соединения по изобретению получают в соответствии с иллюстративными процедурами, приведенными в настоящем описании, и их модификациями, известными специалистам в данной области.
Следующие аббревиатуры использованы в примерах: "Ac" означает ацетил, "AcO" или "OAc" означает ацетокси, "ACN" означает ацетонитрил, "водн. " означает водный, "атм. " означает атмосфера(ы), "BOC", "Boc" или "boc" означает N-трет-бутоксикарбонил, "Bn" означает бензил, "Bu" означает бутил, "nBu" означает нормальный бутил, "tBu" означает трет-бутил, "DBU" означает 1,8-диазабицикло[5.4.0]ундец-7-ен, "Cbz" означает бензилоксикарбонил, "DCM" (CH2Cl2) означает метиленхлорид, "de" означает диастереомерный избыток, "DEA" означает диэтиламин, "DIPEA" означает диизопропилэтиламин, "DMA" означает N,N-диметилацетамид, "DME" означает 1,2-диметоксиэтан, "DMF" означает N,N-диметилформамид, "DMSO" означает диметилсульфоксид, "EDTA" означает этилендиаминтетрауксусную кислоту, "ee" означает энантиомерный избыток, "Et" означает этил, "EtOAc" означает этилацетат, "EtOH" означает этанол, "HOAc" или "AcOH" означает уксусную кислоту, "i-Pr" или "iPr" означает изопропил, "IPA" означает изопропиловый спирт, "LAH" означает литий-алюминий гидрид, "LHMDS" означает литий гексаметилдисилазид (литий бис(триметилсилил)амид), "mCPBA" означает мета-хлорпероксибензойную кислоту, "Me" означает метил, "MeOH" означает метанол, "MS" означает масс-спектрометрию, "MTBE" означает метил трет-бутиловый эфир, "NCS" означает N-хлорсукцинимид, "Ph" означает фенил, "TBHP" означает трет-бутилгидропероксид, "TFA" означает трифторуксусную кислоту, "THF" означает тетрагидрофуран, "SFC" означает сверхкритическую флюидную хроматографию, "TLC" означает тонкослойную хроматографию, "Rf" означает удерживаемую фракцию, "~" означает примерно, "rt" означает время удерживания, "ч" означает часы, "мин" означает минуты, "экв. " означает эквиваленты, "насыщ. " означает насыщенный.
Получение синтетических промежуточных соединений
Промежуточное соединение 1: (±)-4-{[(1R*,2R*)-2-гидрокси-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегид.
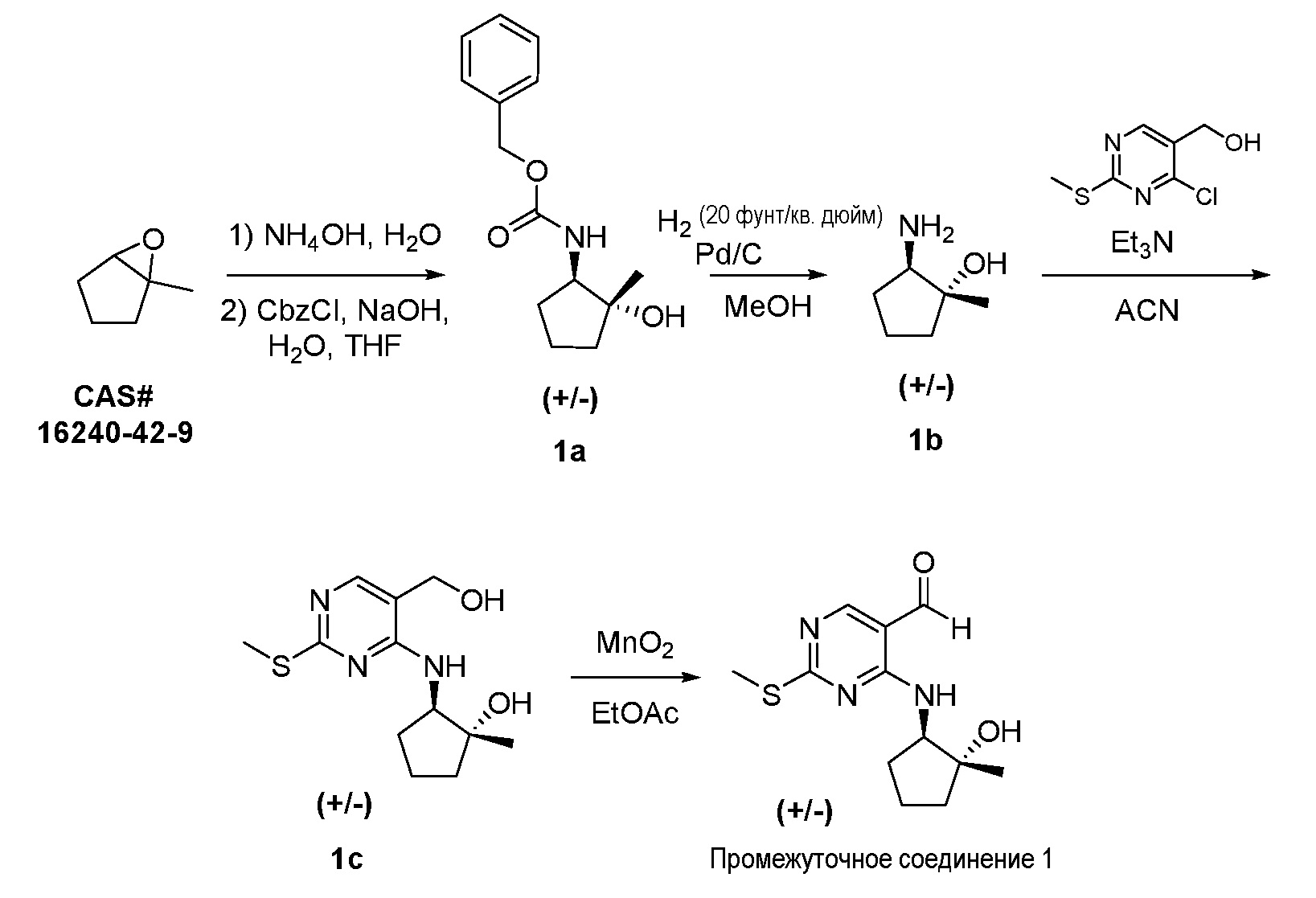
Раствор 1-метил-6-оксабицикло[3.1.0]гексана (CAS# 16240-42-9, 330 г, 3,36 моль) в гидроксиде аммония (28% масс. в воде, 1,5 л) перемешивали при 85°C в течение 24 ч. Раствор концентрировали до коричневой камеди, камедь растворяли в воде (2,0 л) и THF (200 мл), и раствор охлаждали до 0°C. Гидроксид натрия (287 г, 7,16 моль) и бензилхлорформиат (587 г, 3,44 моль) добавляли по каплям. Полученную смесь перемешивали при комнатной температуре в течение 18 ч, затем экстрагировали DCM (1000 мл×3). Объединенные органические слои промывали насыщ. водн. NaCl (500 мл), сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (элюирование 10-33% EtOAc в петролейном эфире), с получением твердого вещества желтого цвета (550 г, 77% чистота по ЯМР). Это твердое вещество промывали петролейным эфиром/EtOAc (3000 мл/100 мл) и петролейным эфиром/MTBE (2000 мл/500 мл) с получением (±)-бензил [(1R*,2R*)-2-гидрокси-2-метилциклопентил]карбамата (1a, 239 г, 28%, 90% чистота по ЯМР) в виде бледно-желтого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=7,37 (т, J=3,9 Гц, 5H), 5,16-4,95 (м, 3H), 4,44 (с, 1H), 3,81-3,68 (м, 1H), 2,15-1,99 (м, 1H), 1,59 (шир.с, 4H), 1,45-1,31 (м, 1H), 1,19-1,11 (м, 3H).
Раствор (±)-бензил [(1R*,2R*)-2-гидрокси-2-метилциклопентил]карбамата (1a, (109 г, 437 ммоль) в MeOH (1000 мл) обрабатывали влажным Pd/C (11 г). Черную суспензию перемешивали при 20°C под водородом (20 фунтов на квадратный дюйм) в течение 18 ч. После удаления твердых веществ фильтрованием, фильтрат концентрировали с получением (±)-(1R*,2R*)-2-амино-1-метилциклопентанола (1b, 48,0 г, 95%) в виде бледно-желтой камеди. 1H ЯМР (400 MГц, DMSO-d6) δ=2,86 (т, J=6,9 Гц, 1H), 1,99-1,86 (м, 1H), 1,60-1,49 (м, 4H), 1,28-1,17 (м, 1H), 1,08 (с, 3H).
Раствор [4-хлор-2-(метилсульфанил)пиримидин-5-ил]метанола (CAS# 1044145-59-6, 6,6 г, 35 ммоль), (±)-(1R*,2R*)-2-амино-1-метилциклопентанола (1b, 4,4 г, 46 ммоль) и триэтиламина (14,5 мл, 104 ммоль) в ACN (86 мл) перемешивали на масляной бане при 50°C в течение 16 ч. Реакционный раствор упаривали досуха. Добавляли к остатку воду (25 мл), насыщ. водн. NaCl (25 мл) и насыщ. водн. NaHCO3 (25 мл) и смесь экстрагировали EtOAc (200 мл×3). Объединенные органические вещества сушили над сульфатом натрия, и концентрировали досуха. Остаток (9,3 г светло-желтой камеди) суспендировали в EtOAc (50 мл) с помощью ультразвука с получением густой белой суспензии. Эту суспензию нагревали при 60°C при перемешивании. К нагретой суспензии медленно добавляли гептан (~150 мл), затем смесь оставляли охлаждаться до комнатной температуры в течение ночи. Полученное твердое вещество собирали фильтрованием, промывали гептаном (30 мл) и сушили с получением (±)-(1R*,2R*)-2-{[5-(гидроксиметил)-2-(метилсульфанил)пиримидин-4-ил]амино}-1-метилциклопентанола (1c, 6,91 г, 74%) в виде белого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=7,82 (с, 1H), 6,32 (д, J=7,9 Гц, 1H), 5,27 (т, J=5,4 Гц, 1H), 4,66 (с, 1H), 4,36 (д, J=5,3 Гц, 2H), 4,30 (кв, J=7,7 Гц, 1H), 2,42 (с, 3H), 2,22-2,10 (м, 1H), 1,75-1,56 (м, 4H), 1,52-1,39 (м, 1H), 1,09 (с, 3H). MS: 270 [M+H]+.
Диоксид марганца (33,4 г, 384 ммоль) добавляли к суспензии (±)-(1R*,2R*)-2-{[5-(гидроксиметил)-2-(метилсульфанил)пиримидин-4-ил]амино}-1-метилциклопентанола (1c, 6,9 г, 25,6 ммоль) в EtOAc (384 мл), и смесь перемешивали на масляной бане при 50°C в течение 7 ч, и затем при комнатной температуре в течение ночи. Твердые вещества удаляли фильтрованием. Колбу и осадок на фильтре промывали EtOAc (~300 мл). Объединенные фильтраты снова фильтровали для удаления небольшого количества остаточного черного твердого вещества, затем концентрировали с получением (±)-4-{[(1R*,2R*)-2-гидрокси-2-метилциклопентил]амино}-2-(метилсульфанил)-пиримидин-5-карбальдегида (промежуточное соединение 1, 5,84 г, 85%) в виде не совсем белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=9,72 (с, 1H), 8,66 (шир.с, 1H), 8,35 (с, 1H), 4,39 (ддд, J=6,5, 8,2, 9,5 Гц, 1H), 4,15 (шир.с, 1H), 2,57 (с, 3H), 2,33-2,23 (м, 1H), 2,03-1,92 (м, 1H), 1,91-1,70 (м, 3H), 1,68-1,56 (м, 1H), 1,17 (с, 3H). MS: 268 [M+H]+.
Промежуточное соединение 2: 4-{[(1R,2R)-2-гидрокси-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегид.
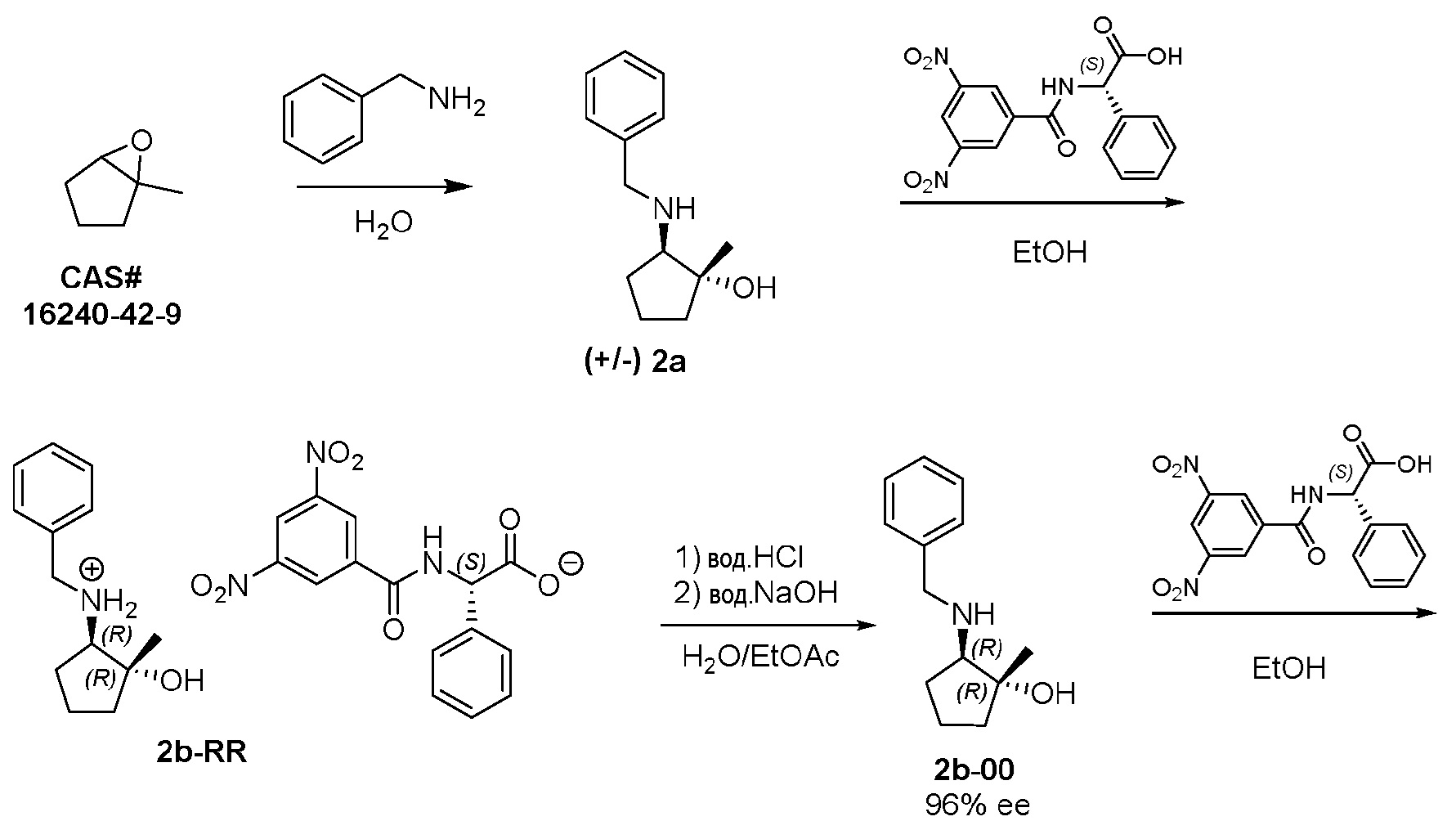
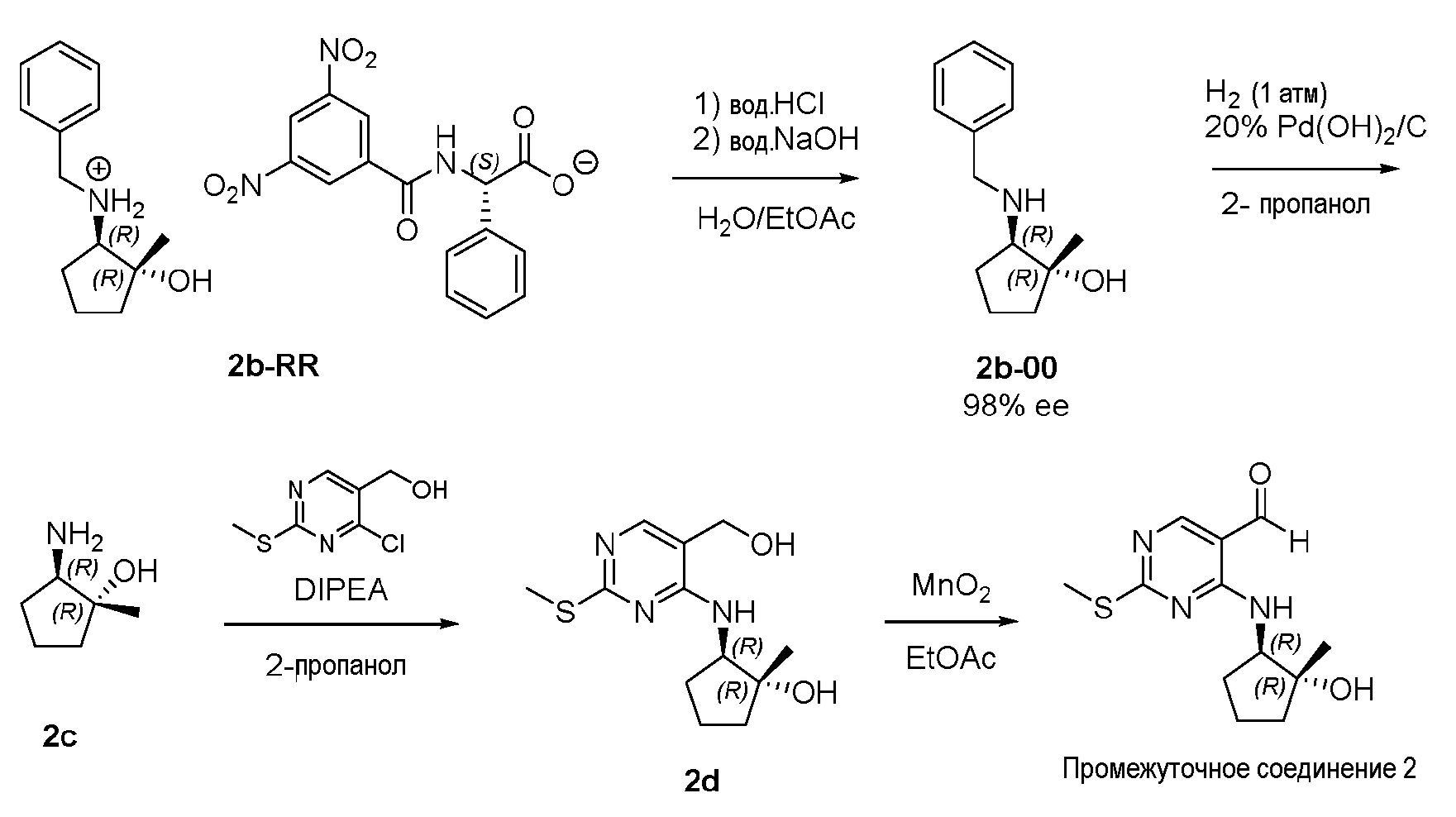
В герметичную колбу объемом 150 мл загружали воду (50,9 мл) и бензиламин (10,9 г, 11,1 мл, 102 ммоль), затем продували азотом в течение 5 минут, прежде чем добавляли 1-метил-6-оксабицикло[3.1.0]гексан (CAS# 16240-42-9, 10 г, 102 ммоль). Колбу герметизировали и нагревали при 100°C в течение 18 ч, после чего наблюдалась двухфазная смесь. После охлаждения до комнатной температуры сосуд дополнительно охлаждали на ледяной бане. Концентрированную водную HCl (~12 M, 13 мл) добавляли для доведения згначения рН до 1. Органические примеси экстрагировали EtOAc (150 мл) и отделяли. Кислый водный слой охлаждали на ледяной бане и значение рН доводдили до 10 с использованием 5 н. водн. NaOH. Полученную двухфазную смесь экстрагировали EtOAc (250 мл×3). Объединенные органические экстракты сушили над сульфатом натрия и концентрировали до коричневого масла. Оставшийся бензиламин выпаривали в более высоком вакууме (~5 мм рт.ст.) при 80°C в течение нескольких часов, пока 1H ЯМР образца не показал только ~20 мол.% оставшегося бензиламина. Остаточное масло растирали с гептаном (100 мл), что приводило к образованию белых кристаллов. Кристаллы собирали фильтрованием и сушили с получением (±)-(1R*,2R*)-2-(бензиламино)-1-метилциклопентанола (2a, 13 г, 62%) в виде белого кристаллического твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=7,36-7,31 (м, 4H), 7,28-7,23 (м, 1H), 3,91-3,85 (м, 1H), 3,79-3,74 (м, 1H), 2,86 (дд, J=7,8, 8,5 Гц, 1H), 2,12-2,03 (м, 1H), 1,75-1,53 (м, 5H), 1,37-1,27 (м, 1H), 1,22 (с, 3H).
Магнитно-перемешиваемый раствор (±)-(1R*,2R*)-2-(бензиламино)-1-метилциклопентанола (2a, 100 г, 487 ммоль) и EtOH (700 мл) в 1 л колбе нагревали на масляной бане при 80°С в течение 30 мин. В отдельную трехгорлую колбу 5 л, снабженную верхней мешалкой, внутренним термометром и конденсатором с водяным охлаждением, загружали (2S)-[(3,5-динитробензоил)амино](фенил)этановую кислоту (CAS#74927-72-3, 84,1 г, 244 ммоль, 0,5 эквив.) и EtOH (1,4 л). Эту колбу также нагревали на масляной бане при 80°С при перемешивании до растворения твердого вещества, ~15 мин, и перемешивание продолжали в течение еще 30 мин. Горячий раствор амина 2а из первой колбы выливали через воронку равномерным потоком в течение 1 минуты в горячий механически перемешиваемый раствор хиральной кислоты во второй колбе. Перенос количественно определяли с помощью EtOH (10 мл). Реакционная смесь оставалась прозрачной в течение примерно 1 мин, затем начиналось осаждение. Через 5 минут образовалась густая белая суспензия, но она не мешала механическому перемешиванию. Перемешивание продолжали при 80°С в течение 4 ч, затем нагревание прекращали и смесь перемешивали при постепенном охлаждении до комнатной температуры в течение ночи. Полученное твердое вещество собирали фильтрованием, промывали EtOH (350 мл), и сушили в вакуумной печи (10 мм рт.ст., 40°C) в течение 1,5 дней, с получением (1R,2R)-N-бензил-2-гидрокси-2-метилциклопентанаминий (2S)-[(3,5-динитробензоил)амино](фенил)ацетата (2b-RR, 110,22 г, 82%) в виде белого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=9,64 (д, J=7,0 Гц, 1H), 9,09 (д, J=2,1 Гц, 2H), 8,96 (т, J=2,1 Гц, 1H), 7,55-7,48 (м, 2H), 7,43-7,23 (м, 8H), 5,47 (д, J=7,1 Гц, 1H), 4,02-3,75 (м, 2H), 2,86 (т, J=8,0 Гц, 1H), 2,03-1,87 (м, 1H), 1,66-1,48 (м, 4H), 1,48-1,32 (м, 1H), 1,17 (с, 3H). MS: 206 [M+H]+ для катиона амина. Низкомолекулярная рентгеновская кристаллическая структура этой соли подтвердила абсолютную (1R,2R) стереохимию на циклопентановом кольце.
Хиральную соль (1R,2R)-N-бензил-2-гидрокси-2-метилциклопентанаминий (2S)-[(3,5-динитробензоил)амино](фенил)ацетат (2b-RR, 110,22 г, 200,2 ммоль) суспендировали в воде (500 мл) и EtOAc (700 мл) в 2 л делительной воронке. Добавляли водную HCl (4 M, 200 мл, 800 ммоль) и смесь перемешивали в течение ~30 секунд. Получали прозрачную двухфазную смесь. Слои разделяли, и органический слой дополнительно промывали водной HCl (0,2 M, 125 мл×2). Кислые водные слои объединяли, разделяли на две части и каждую часть охлаждали на бане с ледяной водой. Водный NaOH (4 н, 150 мл, 600 ммоль) добавляли к каждой части для доведения рН до 10. При этом pH образуется белая суспензия. Две части объединяли, разбавляли насыщ. водн. NaCl (150 мл) и экстрагировали EtOAc (250 мл×4). Объединенные органические экстракты сушили над сульфатом натрия и упаривали с получением (1R,2R)-2-(бензиламино)-1-метилциклопентанола (2b-00, 41,4 г, 100%, 96% ee). 1H ЯМР (400 MГц, DMSO-d6) δ=7,36-7,25 (м, 4H), 7,24-7,16 (м, 1H), 4,23 (с, 1H), 3,78-3,65 (м, 2H), 2,70 (т, J=7,5 Гц, 1H), 1,86 (дт, J=3,9, 7,8 Гц, 1H), 1,73 (шир.с, 1H), 1,62-1,44 (м, 4H), 1,35-1,23 (м, 1H), 1,12 (с, 3H). Хиральная чистота: 96% ee. Хиральный SFC/MS анализ проводили на Chiralpak AS-3, 4,6×100 мм, 3 мкм колонку нагревали до 25°C и элюировали подвижной фазой CO2 и 5% диэтиламин в этаноле (20 мM об/об) в течение 1 мин, протекающей при 3,5 мл/мин и поддерживали при давлении на выходе 160 бар. Градиент к 50%-му модификатору в 3 минуты добавляли, чтобы элюировать любые остающиеся противоионы. Детектирование проводили с помощью APCI(+)MS при 100-800 Да с мониторингом избранного иона (SIM) при 206 Да. Пик продукта имел время удерживания 1,81 мин. Оптическое вращение образца, полученного этим способом, дало [α]D22 -42,6 (c 1,0, MeOH).
Поскольку желательна более высокая хиральная чистота, классическое разрешение было повторено для энантио-обогащенного амина: Раствор (1R,2R)-2-(бензиламино)-1-метилциклопентанола (2b-00, (41,0 г, 200 ммоль, 96%ee) в EtOH (200 мл) нагревали при 80°C при перемешивании в течение 30 минут. В отдельную трехгорлую колбу 2 л, снабженную верхней мешалкой, внутренним термометром и конденсатором с водяным охлаждением, загружали (2S)-[(3,5-динитробензоил)амино](фенил)этановую кислоту (CAS#74927-72-3, 67 г, 194 ммоль, 0,97 эквив.; так как амин составлял ~96% ee) и EtOH (1,3 л). Эту колбу перемешивали и нагревали при 80°С (внутренняя) до растворения твердого вещества (~15 минут), затем еще 30 минут. Горячий раствор амина добавляли к горячему раствору кислоты через воронку в постоянном потоке (менее 1 минуты) и количественно определяли перенос с помощью EtOH (10 мл). Осаждение начиналось примерно через 1 мин, и к 5 мин образовалась густая белая суспензия, хотя перемешивание не было затруднено. Перемешивание продолжали при 80°С в течение 4 ч, затем нагревание прекращали и реакционную смесь перемешивали и давали постепенно остыть до комнатной температуры в течение ночи. Полученное твердое вещество собирали фильтрованием, промывали EtOH (350 мл) и сушили (10 мм рт.ст., 40°C) в течение 1,5 дней с получением (1R,2R)-N-бензил-2-гидрокси-2-метилциклопентанаминий (2S)-[(3,5-динитробензоил)амино](фенил)ацетата (2b-RR, 106 г, 99%). 1H ЯМР (400 MГц, DMSO-d6) δ=9,66 (д, J=7,0 Гц, 1H), 9,09 (д, J=2,1 Гц, 2H), 8,96 (т, J=2,1 Гц, 1H), 7,55-7,46 (м, 2H), 7,44-7,22 (м, 8H), 5,48 (д, J=7,1 Гц, 1H), 4,63 (шир.с, 1H), 3,96-3,79 (м, 2H), 3,66-2,97 (м, 2H), 2,84 (т, J=7,9 Гц, 1H), 2,00-1,85 (м, 1H), 1,64-1,48 (м, 4H), 1,45-1,32 (м, 1H), 1,16 (с, 3H). MS: 206 [M+H]+ для катиона амина.
Перемешиваемую суспензию (1R,2R)-N-бензил-2-гидрокси-2-метилцикло-пентанаминий (2S)-[(3,5-динитробензоил)амино](фенил)ацетата (2b-RR, 106 г, 193 ммоль) в воде (500 мл) и EtOAc (700 мл) обрабатывали с HCl (4 M, 193 мл, 770 ммоль) и перемешивали в течение ~30 секунд. Получали прозрачную двухфазную смесь. Слои разделяли, и водный слой экстрагировали еще EtOAc (125 мл×2). Органические слои откладывали. Кислый водный слой охлаждали на ледяной бане, и подщелачивают до рН 10 водным NaOH (4 н, 289 мл, 6 эквив., 1160 ммоль). Полученную белую суспензию разбавляли насыщ. водн. NaCl (300 мл) и экстрагировали EtOAc (700 мл×4). Объединенные органические экстракты сушили над сульфатом натрия, и упаривали с получением (1R,2R)-2-(бензиламино)-1-метилциклопентанола (2b-00, 38,5 г, 97%, 98%ee). 1H ЯМР (400 MГц, CDCl3) δ=7,38-7,30 (м, 4H), 7,27-7,23 (м, 1H), 3,94-3,75 (м, 2H), 2,88 (дд, J=7,8, 8,4 Гц, 1H), 2,16-2,03 (м, 1H), 1,79-1,57 (м, 4H), 1,53-1,39 (м, 2H), 1,38-1,28 (м, 1H), 1,25 (с, 3H). MS: 206 [M+H]+. Хиральная чистота: 98% ee. Хиральный SFC/MS анализ проводили на Chiralpak AS-3, 4,6×100 мм, 3 мкм нагревали до 25°C и элюировали подвижной фазой CO2 и 5% диэтиламин в этаноле (20 мM об/об) в 1 мин, протекающей при 3,5 мл/мин и поддерживали при давлении на выходе 160 бар. Градиент к 50% модификатору в 3 минуты добавляли, чтобы элюировать любые остающиеся противоионы. Детектирование проводили с помощью APCI(+)MS при 100-800 Да с мониторингом избранного иона (SIM) при 206 Да. Пик продукта имел время удерживания 1,82 мин. Оптическое вращение этой партии не определялось.
В заполненную азотом 3-литровую трехгорлую колбу добавляли 20%-Pd(OH)2/C (Aldrich 212911-10G, Lot #SHBC7570V, 3,85 г) и 2-пропанол (260 мл). Добавляли раствор (1R,2R)-2-(бензиламино)-1-метилциклопентанола (2b-00, 38,5 г, 188 ммоль, 98%ee) в 2-пропаноле (1300 мл). Перенос количественно определяли с помощью 2-пропанола (30 мл). Раствор продували газообразным водородом в течение ~2 мин, и затем перемешивали при комнатной температуре в атмосфере водорода (три баллона) в течение 16 ч. Баллоны пополнили водородом и перемешивание продолжали при комнатной температуре в течение 6 ч, после чего 1Н ЯМР аликвоты показывал, что реакция завершилась. Реакционную смесь продували азотом и катализатор удаляли фильтрованием через слой Celite®. Колбу и осадок на фильтре промывали 2-пропанолом (500 мл). Небольшую аликвоту объединенного фильтрата упаривали для анализа. Остаток фильтрата концентрировали при пониженном давлении (~10 мм рт.ст., 20°С) до примерно 350 мл, и неочищенный (1R,2R)-2-амино-1-метилциклопентанол (2с) использовали непосредственно на следующей стадии без дальнейшей очистки. 1H ЯМР (400 MГц, CDCl3) δ=3,03 (т, J=7,4 Гц, 1H), 2,19-2,01 (м, 1H), 1,83-1,58 (м, 4H), 1,42 (с, 3H), 1,35-1,25 (м, 1H), 1,22 (с, 3H). MS: 116 [M+H]+. Хиральный SFC анализ: 96% ee. Хиральный SFC/MS анализ проводили на ChiroSil RCA (+), 4,6×150 мм 5 мк нагревали до 40°C и элюировали подвижной фазой 20% ACN, 60% муравьиная кислота в MeOH(1% об/об), 20% формиат аммония в MeOH (20 мM мас/об), протекающей при 1,5 мл/мин. Детектирование проводили с помощью ESI (+) MS при 100-650 Да с мониторингом избранного иона (SIM) при 116 Да. Пик продукта имел время удерживания 2,09 мин. Оптическое вращение предшествующей партии, полученной этим способом, составляло [α]D22 -37,7 (c 0,3, MeOH).
К неочищенному раствору (1R,2R)-2-амино-1-метилциклопентанола (2c, 188 ммоль теоретического) в 2-пропаноле (~350 мл) добавляли твердый [4-хлор-2-(метилсульфанил)пиримидин-5-ил]метанол (CAS# 1044145-59-6, 34,8 г, 182 ммоль) и DIPEA (95,3 мл, 547 ммоль). Смесь дегазировали азотом и перемешивали в атмосфере азота при комнатной температуре в течение 15 мин, затем при 80°C в течение 40 ч. Летучие вещества удаляли, и остаточное масло (95 г) разделяли между EtOAc (800 мл) и насыщ. водн. NaCl (250 мл). Водный слой дополнительно экстрагировали EtOAc (500 мл×3). Объединенные органические экстракты сушили над сульфатом натрия и упаривали с получением масла (75 г). Это масло растворяли в EtOAc (200 мл) и прозрачный раствор нагревали при 60°C. Некоторое количество белого твердого вещества наблюдалось через 5 мин после начала нагрева. В это время при 60°C, к суспензии медленно добавляли гептан (400 мл), и перемешивание продолжали при 60°C в течение 15 мин. Суспензию охлаждали до комнатной температуры, и затем охлаждали на ледяной бане в течение 15 мин. Полученный осадок собирали фильтрованием и сушили с получением (1R,2R)-2-{[5-(гидроксиметил)-2-(метилсульфанил)пиримидин-4-ил]амино}-1-метилциклопентанола (2d, 47,8 г, 97%, 98% ee). 1H ЯМР (400 MГц, CDCl3) δ=7,76 (с, 1H), 6,01 (д, J=4,6 Гц, 1H), 5,31 (шир.с, 1H), 4,55 (с, 2H), 4,26 (ддд, J=5,7, 8,2, 10,5 Гц, 1H), 2,50 (с, 3H), 2,21 (ддд, J=3,5, 8,2, 12,1 Гц, 1H), 1,97 (дт, J=3,5, 7,7 Гц, 1H), 1,89-1,76 (м, 2H), 1,75-1,63 (м, 1H), 1,60-1,50 (м, 2H), 1,11 (с, 3H). MS: 270 [M+H]+. Оптическое вращение: [α]D22 +37,7 (c 1,0, MeOH). Хиральная чистота: 98% ee. Хиральный SFC/MS анализ проводили на Chiralpak IC-3, 4,6×150 мм, 3 мкм нагревали до 25°C и элюировали подвижной фазой CO2 и 30% аммиака в метаноле (20 мM об/об), протекающей при 4,0 мл/мин и поддерживали при давлении на выходе 160 бар. Пик продукта имел время удерживания 1,85 мин.
В 2-литровую 3-колбу, снабженную механической мешалкой и обратным холодильником, добавляли твердый диоксид марганца (10 мкм ячейка, чистый для анализа, 278 г, 2660 ммоль), EtOAc (1,2 л, 0,14 M) и твердый (1R,2R)-2-{[5-(гидроксиметил)-2-(метилсульфанил)пиримидин-4-ил]амино}-1-метилциклопентанол (2d, 47,7 г, 177 ммоль). Смесь перемешивали в атмосфере азота и нагревали на масляной бане при 50°C в течение 4 ч. Добавляли еще диоксид марганца (80 г); перемешивание и нагревание продолжали в течение еще 16 ч, до завершения реакциии согласно данным LCMS. Твердое вещество удаляли фильтрованием и колбу и осадок на фильтре промывали EtOAc (1 л). Объединенные фильтраты повторно фильтровали для полного удаления следов нерастворимых веществ, а затем упаривали с получением 4-{[(1R,2R)-2-гидрокси-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 2, 43,8 г, 93%, >98%ee) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=9,73 (с, 1H), 8,66 (шир.с, 1H), 8,35 (с, 1H), 4,39 (ддд, J=6,5, 8,2, 9,6 Гц, 1H), 4,16 (с, 1H), 2,57 (с, 3H), 2,33-2,22 (м, 1H), 2,03-1,92 (м, 1H), 1,89-1,68 (м, 3H), 1,68-1,56 (м, 1H), 1,17 (с, 3H). MS: 268 [M+H]+. Оптическое вращение [α]D22 +12,7 (c 1,0, CHCl3). Хиральная чистота: >98% ee. Хиральный SFC/MS анализ проводили на Chiralpak IC-3, 4,6×150 мм, 3 мкм колонку нагревали до 25°C и элюировали подвижной фазой CO2 и 30% аммиак в метаноле (20 мM об/об), протекающей при 4,0 мл/мин и поддерживали при давлении на выходе 160 бар. Пик продукта имел время удерживания 2,83 мин.
Промежуточное соединение 3: 4-{[(1R,3R)-3-гидроксициклогексил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегид.
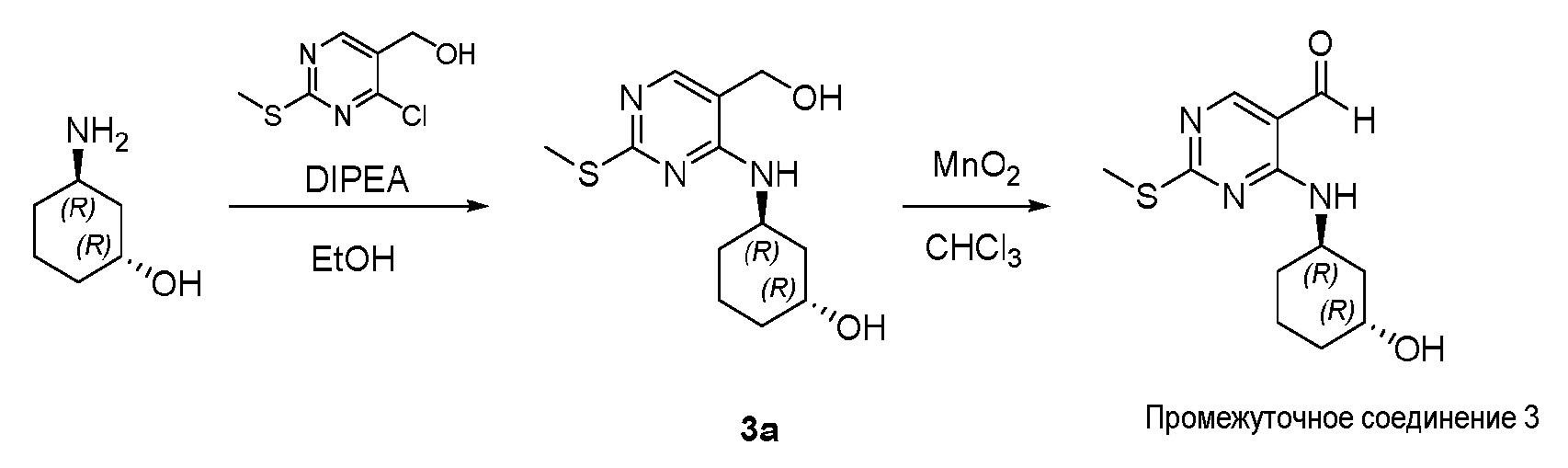
Раствор [4-хлор-2-(метилсульфанил)пиримидин-5-ил]метанола (CAS# 1044145-59-6, 3,5 г, 18,4 ммоль), (1R,3R)-3-аминоциклогексанола (3,34 г, 22,0 ммоль) [Brocklehurst, C.E.; Laumen, K.; La Vecchia, L.; Shaw, D.; Vögtle, M. Org. Process Res. Dev. 2011, 15, 294. [α]D22 -4,9 (c 1,2, MeOH)], и DIPEA (11,9 г, 16,3 мл) в EtOH (40 мл) перемешивали при 85°C в течение 20 ч. После охлаждения до комнатной температуры, смесь разделяли между водой и DCM. Органические вещества концентрировали досуха и очищали с помощью хроматографии на силикагеле (элюируя 0-30% MeOH в DCM) с получением (1R,3R)-3-{[5-(гидроксиметил)-2-(метилсульфанил)пиримидин-4-ил]амино}циклогексанола (3a, 4,80 г, 97%) в виде желтой пены. 1H ЯМР (400 MГц, CDCl3) δ=7,62-7,47 (м, 1H), 6,05 (д, J=7,5 Гц, 1H), 4,58-4,31 (м, 3H), 4,02 шир.д, J=3,0 Гц, 1H), 2,54-2,34 (м, 3H), 1,88-1,71 (м, 4H), 1,70-1,52 (м, 3H), 1,43 (шир.с, 1H). MS: 270 [M+H]+. Оптическое вращение: [α]D22 +0,14 (c 2,8, MeOH). Хиральная чистота: >95%ee. Хиральный SFC/MS анализ проводили на Chiralpak AD-3, 4,6×150 мм, 3 мм, 3 мкм нагревали до 40°C и элюировали подвижной фазой CO2 и градиент 5-40% EtOH (0,05%DEA) в течение 5,5 мин, протекающей при 2,5 мл/мин. Поток при 40% EtOH (0,05% DEA) продолжали в течение 3 минут, чтобы элюировать любые оставшиеся противоионы. Пик продукта имел время удерживания 3,79 мин.
Суспензию (1R,3R)-3-{[5-(гидроксиметил)-2-(метилсульфанил)пиримидин-4-ил]амино}циклогексанола (3a, 4,80 г, 17,8 ммоль) и диоксида марганца (15,5 г, 178 ммоль) в хлороформе (70 мл) перемешивали при комнатной температуре в течение 18 ч. Смесь фильтровали, колбу и осадок на фильтре промывали EtOAc (100 мл) и THF (100 мл), и объединенные фильтраты концентрировали досуха. Остаток очищали с помощью хроматографии на силикагеле (элюируя 0-40% EtOAc в петролейном эфире) с получением 4-{[(1R,3R)-3-гидроксициклогексил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 3, 3,70 г, 80%) в виде желтой камеди. 1H ЯМР (400 MГц, CDCl3) δ=9,69 (с, 1H), 8,61 (шир.с, 1H), 8,30 (с, 1H), 4,75-4,49 (м, 1H), 4,27-4,01 (м, 1H), 2,56 (с, 3H), 2,00-1,87 (м, 2H), 1,87-1,56 (м, 6H). MS: 268 [M+H]+. Оптическое вращение: [α]D22 +2,8 (c 1,4, MeOH). Хиральная чистота: 96%. Хиральный SFC/MS анализ проводили на Chiralpak AD-3, 4,6×150 мм, 3 мкм нагревали до 40°C и элюировали подвижной фазой CO2 и градиентом 5-40% EtOH (0,05%DEA) в течение 5,5 мин, протекающей при 2,5 мл/мин. Поток при 40% EtOH (0,05% DEA) продолжали в течение 3 минут, чтобы элюировать любые оставшиеся противоионы. Пик продукта имел время удерживания 4,42 мин.
Промежуточное соединение 4: 4-{[(1R,2R)-2-гидроксициклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегид.
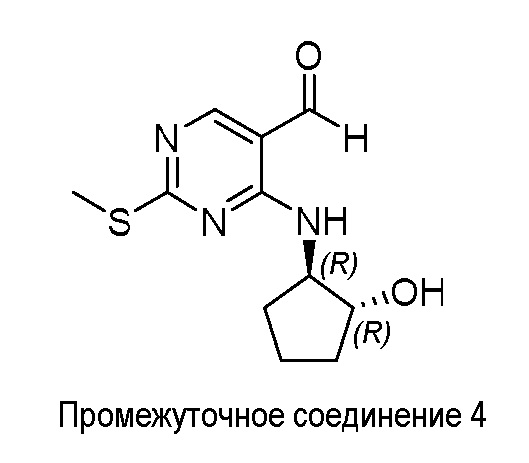
По тому же способу, что и для промежуточного соединения 3, (1R,2R)-2-аминоциклопентанол гидрохлорид (CAS# 68327-11-7) использовали для получения 4-{[(1R,2R)-2-гидроксициклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 4). 1H ЯМР (400 MГц, CDCl3) δ=9,70 (с, 1H); 8,72-8,62 (м, 1H), 8,34 (с, 1H), 4,24-4,14 (м, 1H), 4,12-4,02 (м, 1H), 3,97 (с, 1H), 2,57 (с, 3H), 2,34-2,21 (м, 1H), 2,13-2,01 (м, 1H), 1,93-1,60 (м, 4H). MS: 254 [M+H]+.
Промежуточное соединение 5: 4-(циклогептиламино)-2-(метилсульфанил)пиримидин-5-карбальдегид.
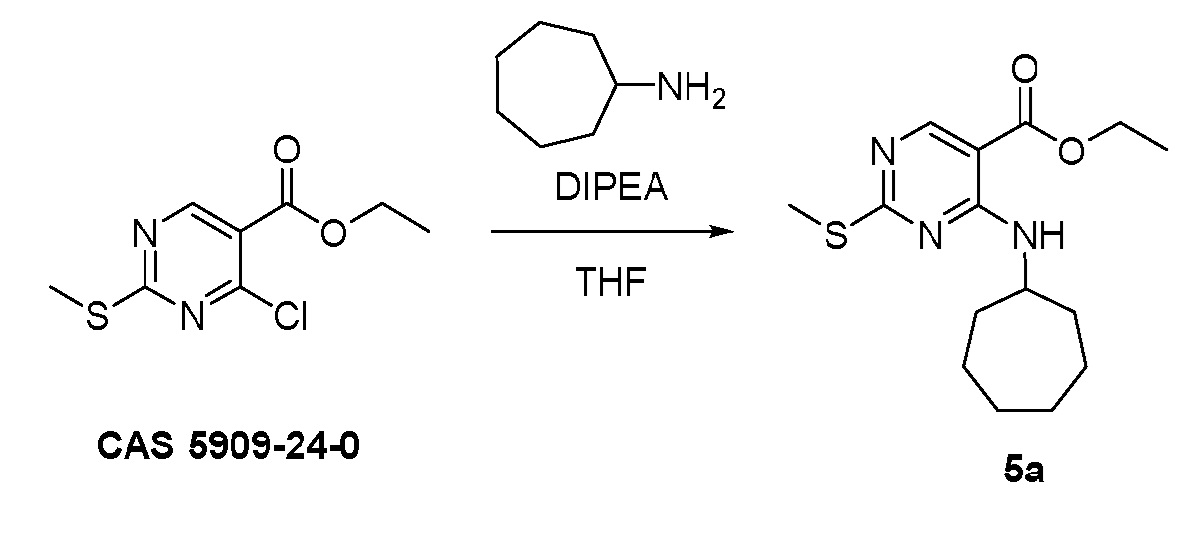
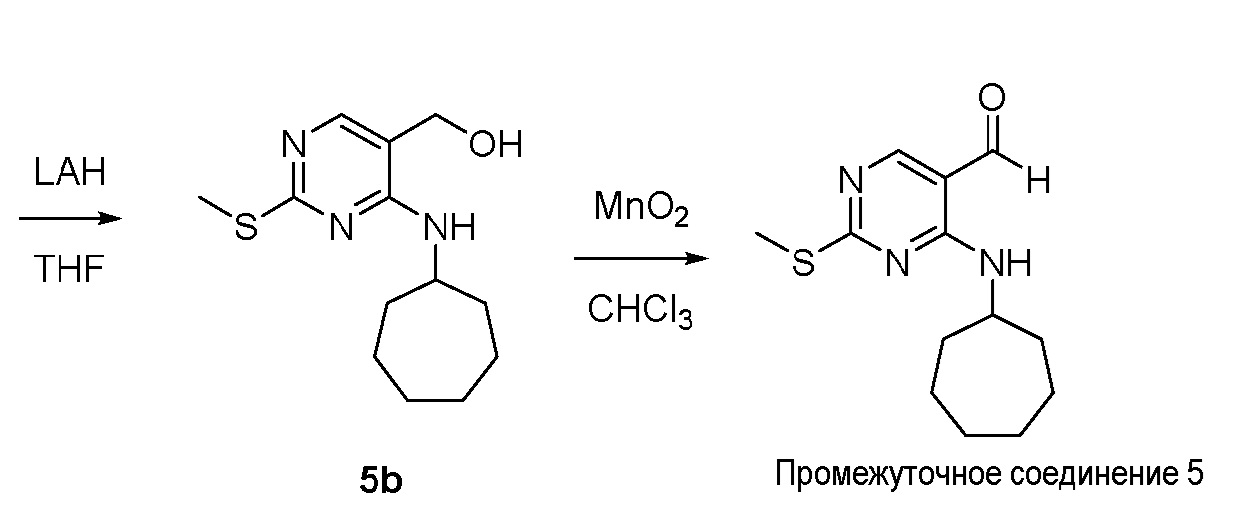
Суспензию этил 4-хлор-2-(метилсульфанил)пиримидин-5-карбоксилата (CAS# 5909-24-0, 16 г, 68,7 ммоль), циклогептиламина (9,34 г, 82,5 ммоль) и DIPEA (17,8 г, 138 ммоль) в THF (150 мл) перемешивали при комнатной температуре в течение 18 ч. Растворители выпаривали, остаток растворяли в воде (150 мл), и раствор экстрагировали EtOAc (150 мл×2). Объединенные органические вещества промывали насыщ. водн. NaCl (150 мл×2), сушили над сульфатом натрия, и концентрировали с получением этил 4-(циклогептиламино)-2-(метилсульфанил)пиримидин-5-карбоксилата (5a, 21 г, 99%) в виде желтого масла. MS: 310 [M+H]+.
Охлажденный (5°С) раствор этил 4-(циклогептиламино)-2-(метилсульфанил)пиримидин-5-карбоксилата (5a, 21 г, 67,9 ммоль) в THF (200 мл) обрабатывали LAH (2,5 M раствор в THF, 81,4 мл, 204 ммоль) порциями в течение 1,5 ч. Полученную суспензию перемешивали при 5-10°C в течение дополнительного часа, затем при комнатной температуре в течение 18 ч. Смесь слегка охлаждали (15°C), затем по каплям добавляли воду (10 мл) и 2 н NaOH (10 мл), чтобы погасить любой остаточный LAH. После перемешивания в течение 1 часа при комнатной температуре, суспензию фильтровали и колбу и осадок на фильтре промывали (300 мл×4). Объединенные фильтраты концентрировали для удаления большей части растворителя. Остаток разделяли между водой (100 мл) и EtOAc (250 мл×2). Объединенные органические слои промывали насыщ. водн. NaCl (100 мл), сушили над сульфатом натрия, и концентрировали досуха. Неочищенный продукт перекристаллизовывали из петролейного эфира/EtOAc (200 мл/50 мл) с получением [4-(циклогептиламино)-2-(метилсульфанил)пиримидин-5-ил]метанола (5b, 13,6 г, 75%) в виде белого твердого вещества. MS: 268 [M+H]+.
Диоксид марганца (43,3 г, 860 ммоль) добавляли к раствору [4-(циклогептиламино)-2-(метилсульфанил)пиримидин-5-ил]метанола (5b, 13,6 г, 50 ммоль) в хлороформе (200 мл), и полученную суспензию перемешивали при комнатной температуре в течение 15 ч. Твердые вещества удаляли фильтрованием. Колбу и осадок на фильтре промывали DCM (150 мл×4). Объединенные фильтраты снова фильтровали для удаления следов твердых веществ, и концентрировали с получением 4-(циклогептиламино)-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 5, 12,9 г, 98%) в виде желтого масла. 1H ЯМР (400 MГц, CDCl3) δ=9,68 (с, 1H), 8,63 (шир.с, 1H), 8,28 (с, 1H), 4,36-4,32 (м, 1H), 2,55 (с, 3H), 2,03-1,99 (м, 2H), 1,67-1,58 (м, 10H). MS: 266 [M+H]+.
Промежуточное соединение 6: 4-{[(1R,2S)-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегид.
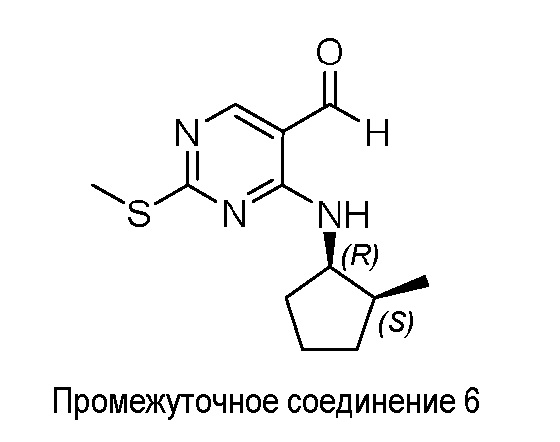
По тому же способу, что и для промежуточного соединения 5, (1R,2S)-2-метилциклопентанамин [Wiehl, W.; Frahm, A. W. Chem. Ber. 1986, 119, 2668] использовали для получения 4-{[(1R,2S)-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 6). 1H ЯМР (400 MГц, CDCl3) δ=9,70 (с, 1H), 8,67 (шир.с, 1H), 8,29 (с, 1H), 4,65-4,58 (м, 1H), 2,55 (с, 3H), 2,32-2,23 (м, 1H), 2,11-2,02 (м, 1H), 1,95-1,77 (м, 2H), 1,70-1,62 (м, 2H), 1,46-1,37 (м, 1H), 0,93 (д, J=6,8, 3H). MS: 252 [M+H]+.
Промежуточное соединение 7: 4-{[(1S,2R)-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегид.
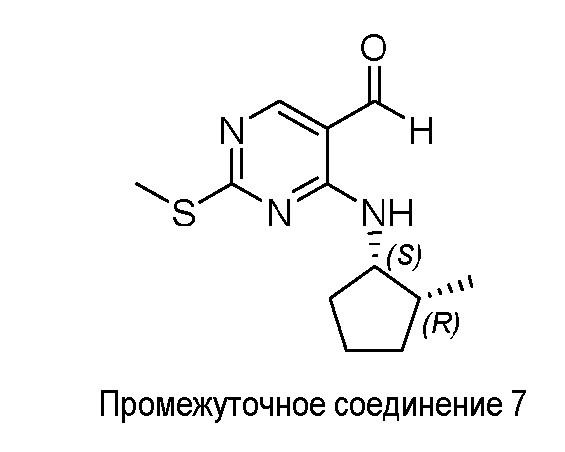
По тому же способу, что и для промежуточного соединения 5, (1S,2R)-2-метилциклопентанамин [Wiehl, W.; Frahm, A. W. Chem. Ber. 1986, 119, 2668] использовали для получения 4-{[(1S,2R)-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 7). 1H ЯМР (400 MГц, CDCl3) δ=9,68 (с, 1H), 8,73-8,59 (м., 1H), 8,27 (с, 1H), 4,67-4,52 (м, 1H), 2,53 (с, 3H), 2,29-2,20 (м, 1H), 2,12-1,99 (м, 1H), 1,92-1,75 (м, 2H), 1,63 (с, 2H), 1,45-1,34 (м, 1H), 0,91 (д, J=7,0, 3H). MS: 252 [M+H]+.
Промежуточное соединение 8: (±)-4-{[(1R*,3R*)-3-гидроксициклопентил]амино}-2-(метилсульфанил)-пиримидин-5-карбальдегид.
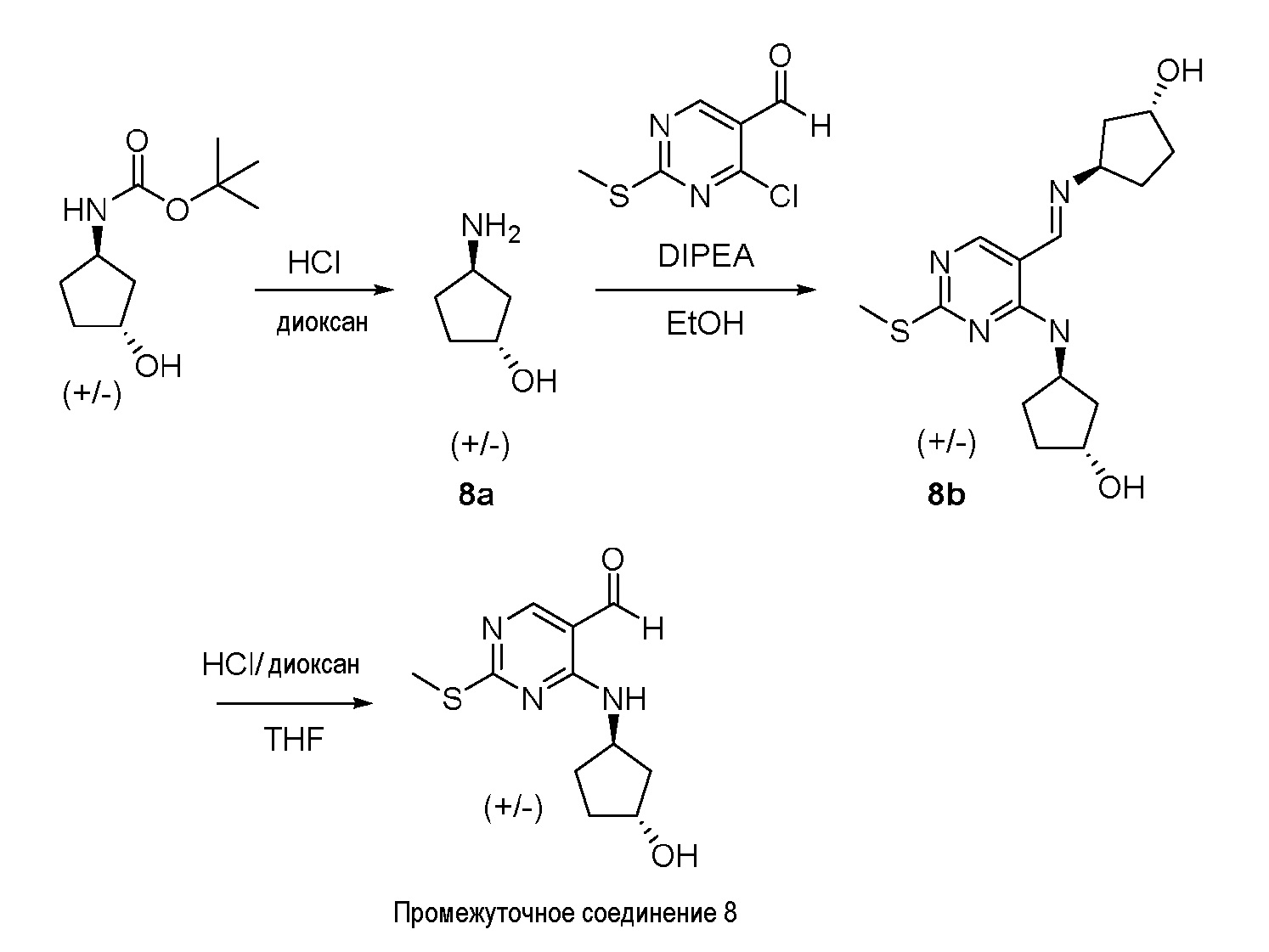
К охлажденному (0°C) раствору (±)-транс-(3-гидрокси-циклопентил)-карбаминовой кислоты трет-бутилового эфира (2,03 г, 10,1 ммоль) [Kulagowski, J.J. et al. J. Med. Chem. 2012 55, 5901] в 1,4-диоксане (20 мл) добавляли HCl (4,0 мл раствора в 1,4-диоксане, 20 мл, 80 ммоль), и смесь перемешивали при 0°C в течение 1 ч и при комнатной температуре в течение 3 ч. Растворители выпаривали, остаток растворяли DCM (50 мл), и добавляли раствор NaOH (502,2 мг, 12,6 ммоль) в воде (1,5 мл). После перемешивания при комнатной температуре в течение 1 ч реакционную смесь сушили над смесью безводного карбоната натрия и безводного сульфата натрия, фильтровали и концентрировали с получением (±)-транс-(3-гидрокси-циклопентил амина (8a, 0,68 г, 67%) в виде янтарной жидкости, которую использовали без дополнительной очистки в следующей реакции. 1H ЯМР (400 MГц, DMSO-d6) δ=4,29 (шир.с, 1H), 4,19-4,10 (м, 1H), 3,35 (квин, J=6,4 Гц, 1H), 1,93-1,80 (м, 2H), 1,64 (ддд, J=3,4, 6,9, 13,0 Гц, 1H), 1,54 (шир.с, 2H), 1,41-1,32 (м, 2H), 1,19-1,07 (м, 1H).
Раствор 4-хлор-2-(метилсульфанил)пиримидин-5-карбальдегида (613,7 мг, 3,25 ммоль) [Zheng, K.; Min Park, C.; Iqbal, S. Hernandez, P.; Park, H.; LoGrasso, P.V.; Feng, Y. ACS Med. Chem. Lett. 2015, 6, 413], (±)-транс-(3-гидрокси-циклопентил амина (8a, 0,68 г, 6,7 ммоль) и DIPEA (3,0 мл, 17 ммоль) в EtOH (32,5 мл) нагревали на масляной бане при 70°С в течение 18 ч. Растворители выпаривали и остаток разделяли между насыщ. водн. NaHCO3 (50 мл) и EtOAc (50 мл×3). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали. Коричневый липкий остаток растворяли в ACN (20 мл), вызывая образование осадка. Суспензию концентрировали досуха, оставляя неочищенный иминный диаддукт (8b, 0,90 г, 82%) в виде темно-желтого твердого вещества с незначительными примесями. 1H ЯМР (400 MГц, DMSO-d6) δ=9,96 (д, J=6,8 Гц, 1H), 8,29 (с, 1H), 8,14 (с, 1H), 4,60 (д, J=3,9 Гц, 1H), 4,58 (д, J=3,9 Гц, 1H), 4,51 (sxt, J=6,8 Гц, 1H), 4,34-4,27 (м, 1H), 4,26-4,19 (м, 1H), 3,88 (квин, J=6,0 Гц, 1H), 2,47 (с, 3H), 2,25-2,14 (м, 1H), 2,10-1,78 (м, 5H), 1,77-1,68 (м, 1H), 1,63-1,45 (м, 4H), 1,38 (тдд, J=6,2, 8,7, 12,7 Гц, 1H).
Неочищенный иминный диаддукт (8b, 0,90 г) растворяли в THF (20 мл) и обрабатывали HCl (4,0 M раствор в 1,4-диоксане, 4,1 мл, 16,4 ммоль). Светлый осадок образовывался сразу при контакте с кислотой, мешая перемешиванию. Добавляли еще THF (10 мл) и смесь встряхивали вручную и обрабатывали ультразвуком до тех пор, пока перемешивание не возобновлялось, затем продолжали перемешивание при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли EtOAc (50 мл). При перемешивании, добавляли по каплям насыщ. водн. NaHCO3 (30 мл), вызывая выделение слабого газа. Слои полученного прозрачного двухфазного раствора разделяли и водный слой дополнительно экстрагировали EtOAc (50 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали, с получением (±)-4-{[(1R*,3R*)-3-гидроксициклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 8, 659,9 мг, 74% из 4-хлор-2-(метилсульфанил)пиримидин-5-карбальдегида) в виде коричневого масла. 1H ЯМР (400 MГц, DMSO-d6) δ=9,74 (с, 1H), 8,52 (с, 1H), 8,54 (шир.с, 1H), 4,72-4,61 (м, 1H), 4,59 (д, J=3,8 Гц, 1H), 4,28-4,19 (м, 1H), 2,52 (с, 3H), 2,26-2,14 (м, 1H), 2,04-1,88 (м, 2H), 1,66 (ддд, J=5,9, 7,8, 13,4 Гц, 1H), 1,58-1,41 (м, 2H). MS: 254 [M+H]+.
Промежуточное соединение 9: 4-амино-N-метилпиперидин-1-сульфонамид
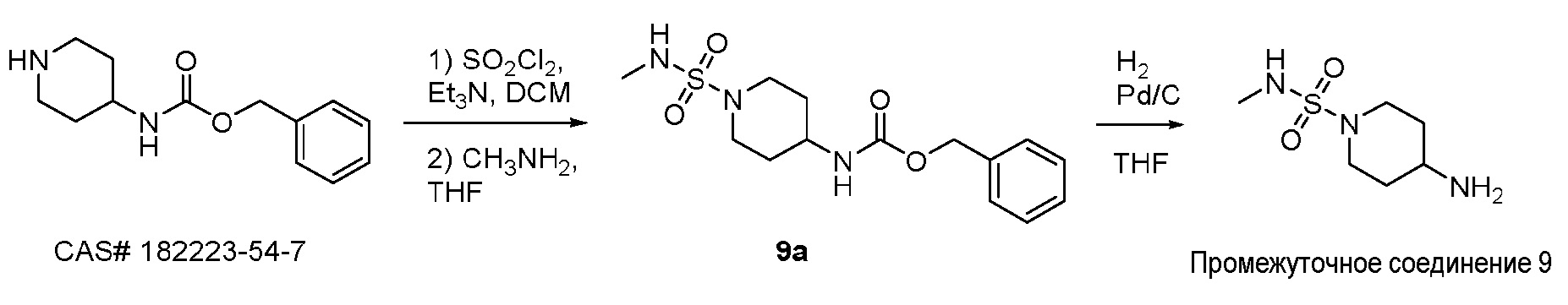
Раствор бензил 4-пиперидинилкарбамата (CAS# 182223-54-7, 7,0 г, 27 ммоль) и триэтиламина (3,27 г, 32,3 ммоль) в DCM (80 мл) добавляли в охлажденный (0°C) раствор сульфурил хлорида (3,99 г, 29,6 ммоль) в DCM (70 мл), достаточно медленно для поддержания внутренней температуры ниже 10°C. Охлаждающую баню убирали и смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь снова охлаждали до 0°C, затем раствор метиламина (2,0 M в THF, 26,9 мл, 53,8 ммоль) и еще триэтиламин (15 мл, 108 ммоль) в DCM (50 мл) добавляли по каплям, поддерживая внутреннюю температуру ниже 10°C. Полученную суспензию перемешивали при комнатной температуре в течение 15 ч. Поскольку LCMS показала наличие остаточного хлорсульфонильного промежуточного соединения, раствор охлаждали до 0°C и добавляли больше метиламина (2,0 M в THF, 40 мл, 80 ммоль). Перемешивание продолжали при комнатной температуре в течение 3 ч, после чего с помощью LCMS не было обнаружено хлорсульфонильного промежуточного соединения. Реакционную смесь разделяли между водой (100 мл) и DCM (150 мл×2). Объединенные органические экстракты сушили, концентрировали и очищали с помощью хроматографии на силикагеле (элюируя 50-80% EtOAc в петролейном эфире) с получением бензил [1-(метилсульфамоил)пиперидин-4-ил]карбамата (9a, 4,0 г, 90% чистота, 45% выход) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=7,42-7,31 (м, 5H), 5,17-5,06 (м, 2H), 4,73 (д, J=6,5 Гц, 1H), 4,12 (кв, J=4,9 Гц, 1H), 3,67 (д, J=12,3 Гц, 3H), 2,97-2,88 (м, 2H), 2,72 (д, J=5,3 Гц, 3H), 2,03 (д, J=11,3 Гц, 2H), 1,57-1,46 (м, 2H). MS: 350 [M+Na]+.
Суспензию бензил [1-(метилсульфамоил)пиперидин-4-ил]карбамата (9a, 4,0 г, 12 ммоль) и Pd/C(50% H2O, 2 г) в THF (100 мл) дезоксигенировали и продували водородом (3 цикла), затем перемешивали под водородным баллоном при комнатной температуре в течение 4 ч. Суспензию фильтровали, и фильтрат концентрировали с получением неочищенного продукта (2,3 г, 85% чистота, 100% выход) в виде белого твердого вещества.
Несколько партий, полученных этим способом, объединяли, получая 45 г неочищенного продукта, который затем перекристаллизовывали из горячего DCM с получением чистого 4-амино-N-метилпиперидин-1-сульфонамида (промежуточное соединение 9, 40 г, 89%). 1H ЯМР (400 MГц, DMSO-d6) δ=3,45-3,37 (м, 2H), 2,75-2,59 (м, 3H), 2,50 (с, 3H), 1,78-1,67 (м, 2H), 1,30-1,15 (м, 2H). MS: 194 [M+H]+.
Промежуточное соединение 10: 4-амино-N-(2-метокси-2-метилпропил)пиперидин-1-сульфонамид.
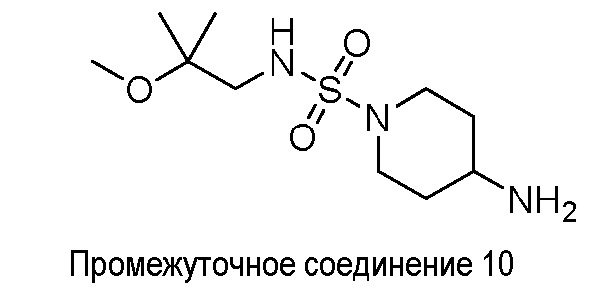
По способу промежуточного соединения 9 2-метокси-2-метилпропан-1-амин использовали для синтеза 4-амино-N-(2-метокси-2-метилпропил)пиперидин-1-сульфонамида (промежуточное соединение 10). 1H ЯМР (400 MГц, CDCl3) δ=4,54-4,42 (м, 1H), 3,67 (д, J=12,3 Гц, 2H), 3,19 (с, 3H), 3,01 (д, J=5,8 Гц, 2H), 2,88-2,76 (м, 3H), 1,89 (д, J=10,5 Гц, 2H), 1,39 (д, J=9,3 Гц, 2H), 1,21 (с, 6H)
Промежуточное соединение 11: 4-амино-N-(тетрагидро-2H-пиран-4-ил)пиперидин-1-сульфонамид.
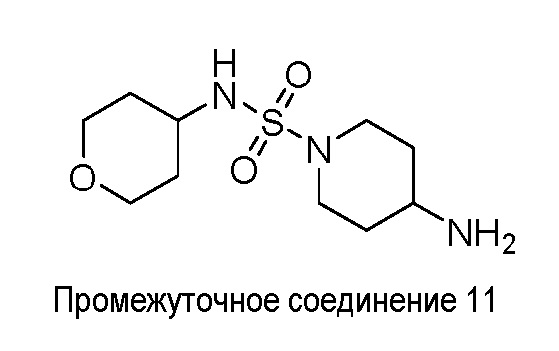
По способу промежуточного соединения 9, 4-аминотетрагидропиран использовали для синтеза соединения 4-амино-N-(тетрагидро-2H-пиран-4-ил)пиперидин-1-сульфонамида (промежуточное соединение 11). 1H ЯМР (400 MГц, CDCl3) δ=4,24-4,13 (м, 1H), 3,95 (тд, J=3,6, 11,7 Гц, 2H), 3,77-3,74 (м, 1H), 3,67 (д, J=12,5 Гц, 2H), 3,43 (дт, J=2,3, 11,7 Гц, 3H), 2,89-2,77 (м, 3H), 2,02-1,86 (м, 5H), 1,59-1,48 (м, 2H), 1,46-1,38 (м, 3H)
Другие 4-амино-N-алкилпиперидин-1-сульфонамиды синтезировали по способу промежуточного соединения 9 и использовали неочищенными, без очистки или характеризации, при получении примеров соединений из таблицы 1.
Промежуточное соединение 12: 1-[(2,2,2-трифторэтил)сульфонил]пиперидин-4-амин трифторацетат.
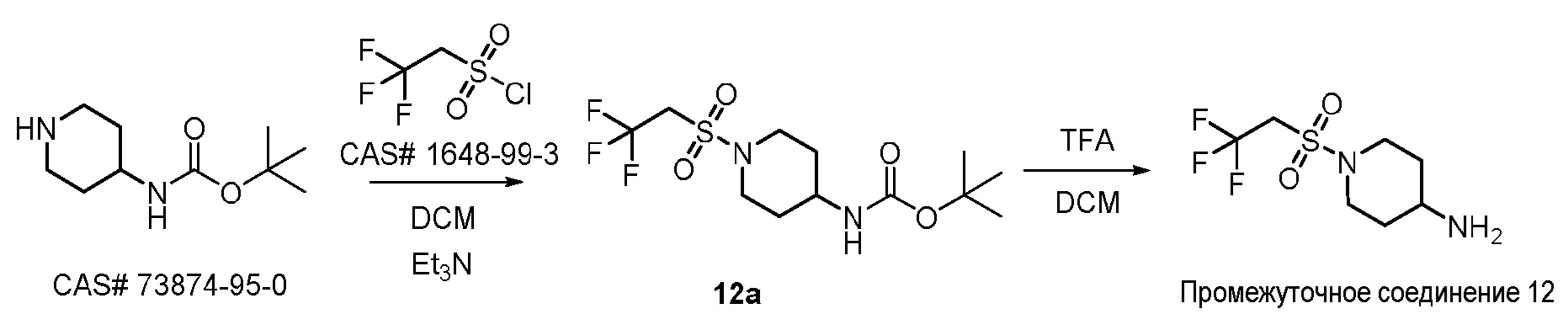
К охлажденному на ледяной бане раствору 4-(N-Boc-амино)пиперидина (300 мг, 1,5 ммоль) и триэтиламина (303 мг, 3 ммоль1) в DCM (10 мл) добавляли 2,2,2-трифторэтансульфонил хлорид (301 мг, 1,65 ммоль), и смесь перемешивали при комнатной температуре в течение 2 ч. Полученный осадок собирали фильтрованием и сушили в вакууме с получением трет-бутил {1-[(2,2,2-трифторэтил)сульфонил]пиперидин-4-ил}карбамата (12a, 300 мг, 58%) в виде белого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=4,47 (кв, J=10,2 Гц, 2H), 3,63-3,51 (м, 2H), 3,44-3,36 (м, 1H), 3,01-2,83 (м, 2H), 1,80 (д, J=10,5 Гц, 2H), 1,47-1,27 (м, 2H), 1,39 (с, 9H).
Трифторуксусную кислоту (1 мл) добавляли к раствору трет-бутил {1-[(2,2,2-трифторэтил)сульфонил]пиперидин-4-ил}карбамата (12a, 300 мг, 0,87 ммоль) в DCM (10 мл), и смесь перемешивали при комнатной температуре в течение 14 ч. Летучие вещества выпаривали и остаток сушили в вакууме с получением 1-[(2,2,2-трифторэтил)сульфонил]пиперидин-4-амин TFA соли (промежуточное соединение 12, 300 мг, 74%) в виде белой камеди. 1H ЯМР (400 MГц, DMSO-d6) δ=8,05 (шир.с, 3H), 4,65-4,35 (м, 2H), 3,70 (д, J=12,8 Гц, 2H), 3,20 (д, J=4,8 Гц, 1H), 2,95 (т, J=11,7 Гц, 2H), 1,98 (д, J=10,5 Гц, 2H), 1,66-1,38 (м, 2H).
Промежуточное соединение 13: 1-(бут-3-ин-1-илсульфонил)пиперидин-4-амин метансульфонат.
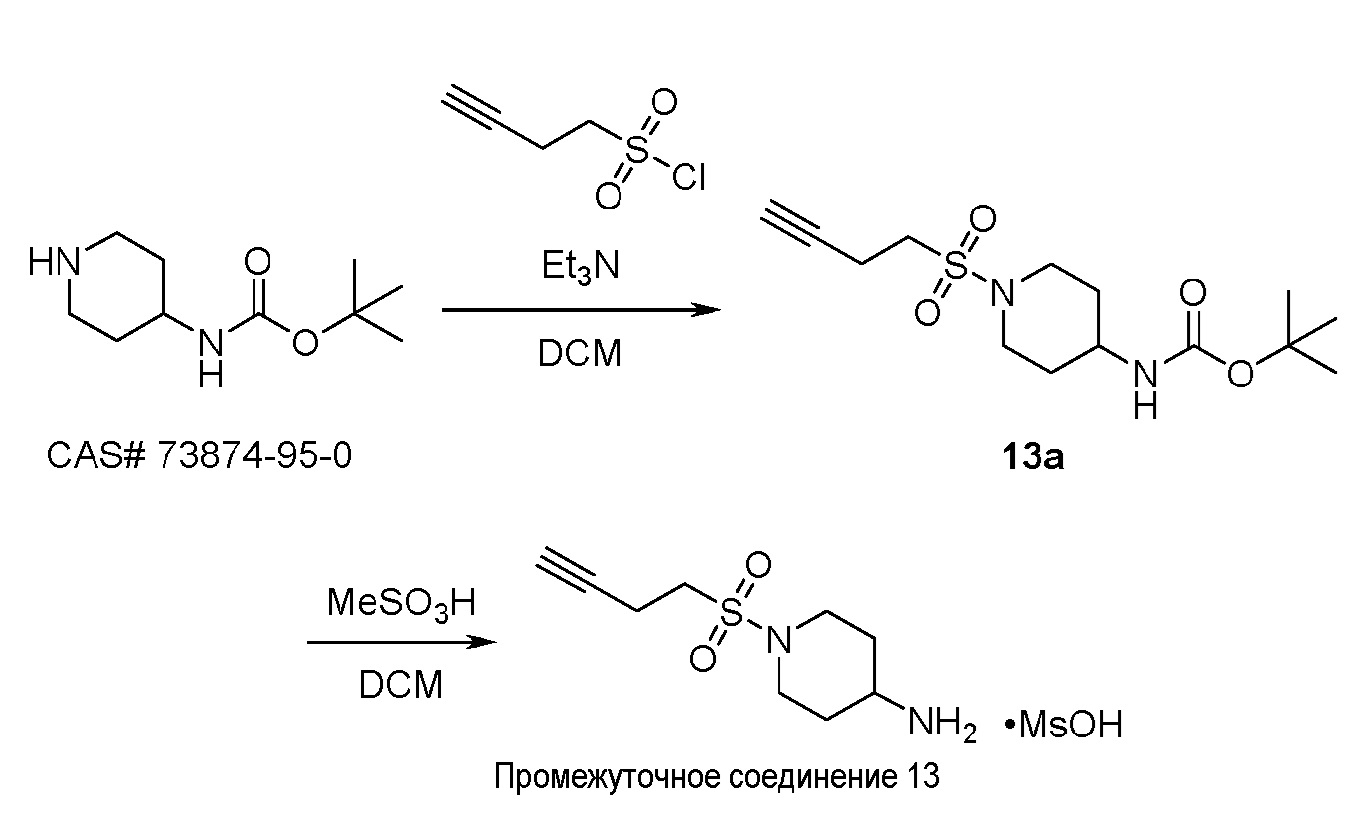
Раствор бут-3-ин-1-сульфонил хлорида (653 мг, 4,3 ммоль) в DCM (36 мл) в атмосфере азота охлаждали на бане ацетон/сухой лед. Твердый 4-(N-Boc-амино)пиперидин (714 мг, 3,6 ммоль) частично растворяли в DCM (8 мл) и добавляли через шприц. Добавляли по каплям триэтиламин (646 мкл, 4,6 ммоль) в течение 1 минуты. Смесь перемешивали на охлаждающей бане в атмосфере азота в течение 30 минут. В то время как все оставалось охлажденным, реакцию разбавляли насыщенным водным NaHCO3 (10 мл) и деионизированной водой (10 мл). Смесь экстрагировали DCM (50 мл). Органический слой сушили над сульфатом натрия и упаривали с получением трет-бутил (1-(бут-3-ин-1-илсульфонил)пиперидин-4-ил)карбамата (13a, 1,08 г, 96%) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=4,45 (шир.с, 1H), 3,76 (д, J=12,7 Гц, 2H), 3,66-3,48 (м, 1H), 3,17-3,08 (м, 2H), 3,03-2,88 (м, 2H), 2,70 (дт, J=2,7, 7,6 Гц, 2H), 2,17-2,07 (м, 1H), 2,03 (дд, J=2,9, 13,1 Гц, 2H), 1,54-1,35 (м, 11H).
К раствору трет-бутил (1-(бут-3-ин-1-илсульфонил)пиперидин-4-ил)карбамата (13a, 253 мг, 0,8 ммоль) в DCM (8 мл) добавляли метансульфоновую кислоту (318 мкл, 4,8 ммоль), и полученный раствор перемешивали при комнатной температуре в течение 30 минут. Летучие вещества выпаривали и остаток суспендирован в этиловом эфире (15 мл). Эфир декантировали и твердое вещество сушили в высоком вакууме при комнатной температуре с получением 1-(бут-3-ин-1-илсульфонил)пиперидин-4-амин метансульфоната (промежуточное соединение 13, 248 мг, 99%) в виде белого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=7,90 (шир.с, 3H), 3,65 (д, J=12,7 Гц, 2H), 3,27 (т, J=7,5 Гц, 2H), 2,93 (т, J=11,4 Гц, 2H), 2,57 (дт, J=2,6, 7,5 Гц, 2H), 2,36 (с, 5H), 1,96 (д, J=10,5 Гц, 2H), 1,51 (dq, J=3,9, 12,0 Гц, 2H). MS: 217 [M+H]+.
Промежуточное соединение 14: (+/-)-цис-3-фтор-1-(метилсульфонил)пиперидин-4-амин.
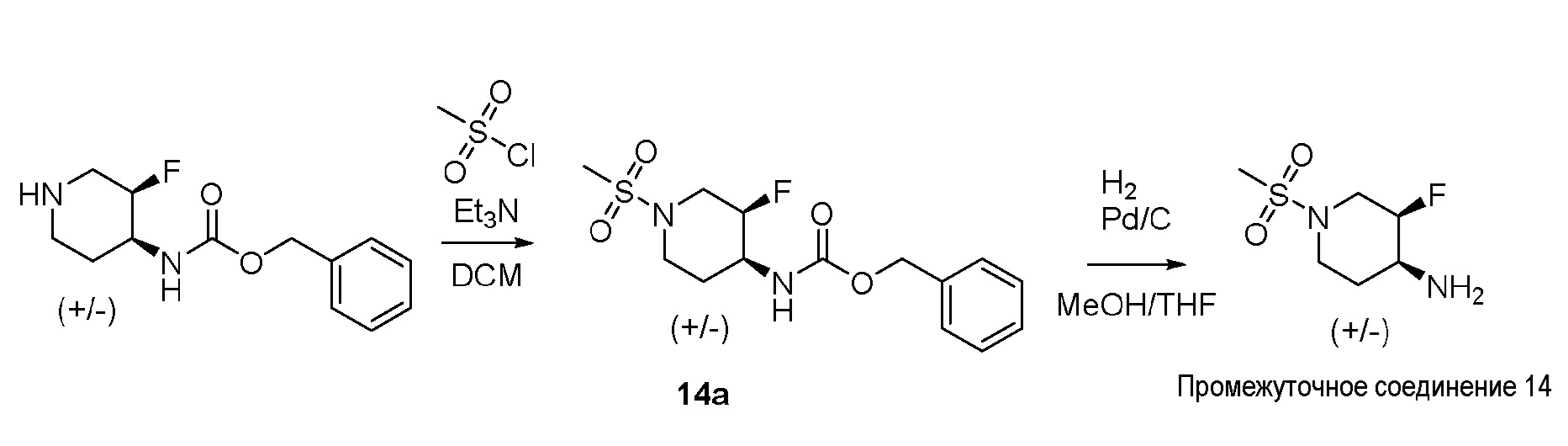
Рацемический цис-(3-фтор-пиперидин-4-ил)-карбаминовая кислота бензиловый эфир [Array Biopharma Inc. Patent: Triazolopyridine Compounds as PIM Kinase Inhibitors, WO2010/22081 A1, 2010] сульфонилировали по способу промежуточного соединения 12 и удаляли защиту по способу промежуточного соединения 9 с получением (+/-)-цис-3-фтор-1-(метилсульфонил)пиперидин-4-амина (промежуточное соединение 14) в виде светло-желтого твердого вещества. 1H ЯМР (400 MГц, CD3OD) δ=ppm 4,66 (д, J=48,4 Гц, 1H), 4,01-3,94 (м, 1H), 3,78-3,74 (м, 1H), 3,00 (дд, J=36,9, 14,0 Гц, 1H), 2,98-2,91 (м, 1H), 2,88 (с, 3H), 2,82 (т, J=8 Гц, 1H), 1,79-1,73 (м, 2H). MS: 197 [M+H]+.
Другие алкил- и арил-замещенные сульфонилпиперидин-4-амины синтезировали по способам промежуточного соединения 9, промежуточного соединения 12 или промежуточного соединения 13 и использовали неочищенными, без очистки или характеризации, при получении примеров соединений, представленных в таблице 1.
Промежуточное соединение 15: (±)-(1R*,2R*)-2-амино-1-этилциклопентан-1-ол.
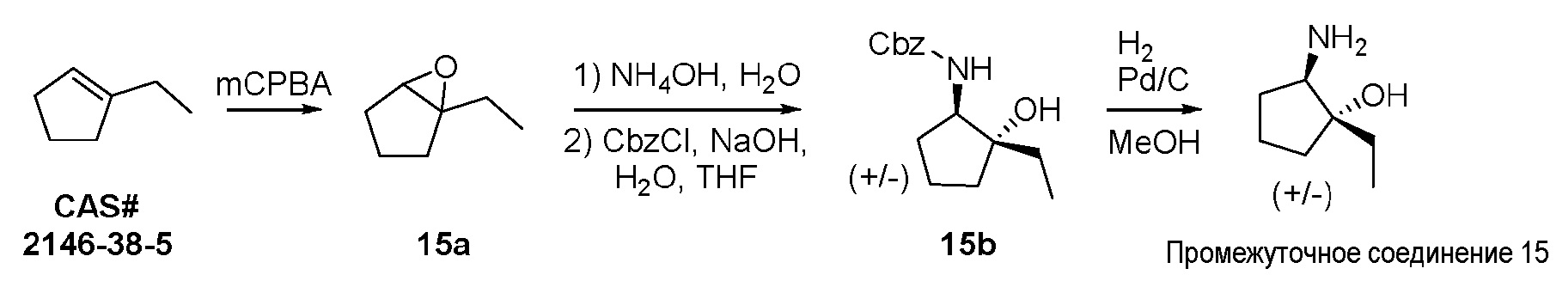
Эпоксидирование 1-этилциклопентена (CAS#2146-38-5) с последующим раскрытием кольца и снятием защиты с Cbz по способу промежуточного соединения 1 дает (±)-(1R*,2R*)-2-амино-1-этилциклопентан-1-ол (промежуточное соединение 15) в виде желтой камеди. 1H ЯМР (400 MГц, DMSO-d6) δ=2,86 (дд, J=3,5, 6,3 Гц, 1H), 2,03-1,92 (м, 1H), 1,63-1,51 (м, 4H), 1,41-1,35 (м, 2H), 1,20 (ддд, J=3,9, 7,2, 13,1 Гц, 1H), 0,87 (т, J=7,5 Гц, 3H).
Промежуточное соединение 15 было дополнительно обработано по способу промежуточного соединения 2 и способу А для получения Примеров 194 и 195, как показано в Таблице 1.
Промежуточное соединение 16: (±)-(1R*,2S*,4R*)-4-((трет-бутилдифенилсилил)окси)-2-метилциклопентан-1-амин.
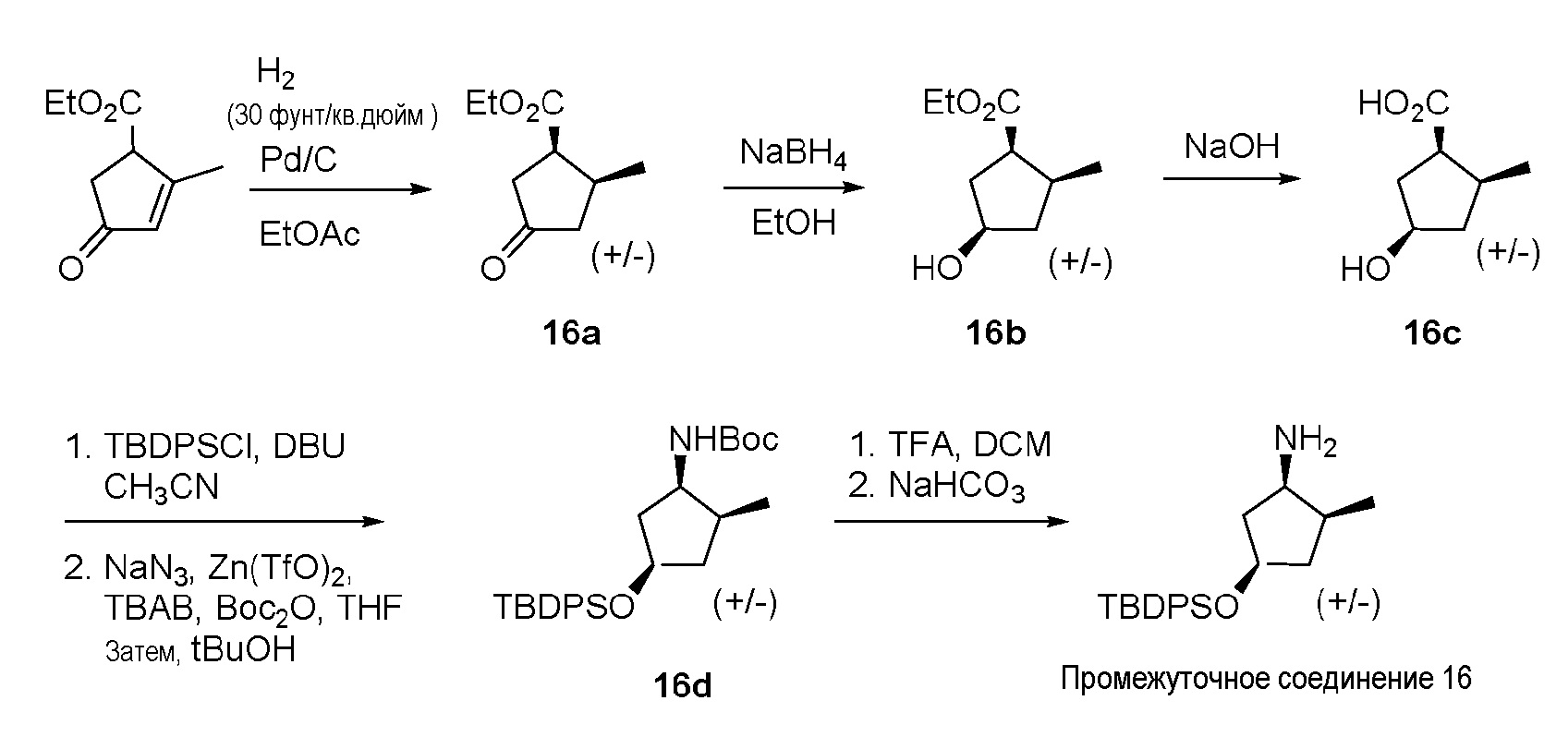
К раствору этил 2-метил-4-оксоциклопент-2-ен-1-карбоксилата [Dolby, L. J. et al. J. Org. Chem. 1968, 33(12), 4508] (24,0 г, 119 ммоль) в EtOAc (500 мл) добавляли 10% масс. Pd/C (6,0 г). Через смесь барботировали газообразный водород в течение примерно 5 минут, затем смесь перемешивали в атмосфере водорода при 30 фунт/кв.дюйм в течение 48 ч. Источник водорода удаляли и смесь продували азотом в течение 5 минут. Pd/C отфильтровывали, используя слой Celite®, который промывали этилацетатом. Фильтрат концентрировали с получением 24 г желтого масла. Неочищенное масло очищали хроматографией на силикагеле (элюирование петролейным эфиром/EtOAc 10/1-3/1) с получением (±)-этил (1R*,2S*)-2-метил-4-оксоциклопентан-1-карбоксилата (16a, 19,3 г, 80%) в виде масла. 1H ЯМР (400 MГц, CDCl3) δ=4,16-4,09 (м, 2H), 3,15-3,08 (м, 1H), 2,63 (тд, J=7,4, 14,6 Гц, 1H), 2,58-2,49 (м, 1H), 2,36-2,24 (м, 2H), 2,13-2,04 (м, 1H), 1,22 (т, J=7,2 Гц, 3H), 1,00 (д, J=7,0 Гц, 3H).
Раствор (±)-этил (1R*,2S*)-2-метил-4-оксоциклопентан-1-карбоксилата (16a, 10 г, 59 ммоль) в этаноле (300 мл) охлаждали до 0°С в атмосфере азота. Боргидрид натрия (1,11 г, 29,4 ммоль) добавляли небольшими порциями. Реакционную смесь оставляли перемешиваться при 0°С в течение 1 часа. Реакцию гасили медленным добавлением насыщ. водн. раствора хлорида аммония (50 мл), затем воды (50 мл) для растворения любых твердых веществ. Этанол удаляли при пониженном давлении и водный остаток экстрагировали MTBE (2×300 мл). Объединенные органические вещества промывали насыщ. водн. NaCl (500 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением (±)-этил (1R*,2S*,4R*)-4-гидрокси-2-метилциклопентан-1-карбоксилата (16b, 9,9 г, 97%) в виде желтого масла. 1H ЯМР (400 MГц, CDCl3) δ=4,24-4,16 (м, 1H), 4,14-4,03 (м, 2H), 3,57 (шир.с, 1H), 2,74 (дт, J=3,8, 7,4 Гц, 1H), 2,29-2,11 (м, 2H), 2,04-1,95 (м, 1H), 1,89 (тд, J=3,6, 14,2 Гц, 1H), 1,35-1,26 (м, 1H), 1,23-1,18 (м, 3H), 0,95 (д, J=6,8 Гц, 3H).
Смесь (±)-этил (1R*,2S*,4R*)-4-гидрокси-2-метилциклопентан-1-карбоксилата (16b, 9,9 г, 57 ммоль) в водной NaOH (115 мл 1 M, 115 ммоль) перемешивали при комнатной температуре в течение 18 ч. Добавляли MTBE (100 мл) и слои разделяли. Водный слой охлаждали до 0°С и подкисляли до рН 1 медленным добавлением водной HCl (5н). Водную суспензию экстрагировали EtOAc (4×200 мл). Объединенные органические слои промывали насыщ. водн. NaCl (100 мл), сушили над безводным сульфатом магния, фильтровали и концентрировали с получением (±)-(1R*,2S*,4R*)-4-гидрокси-2-метилциклопентан-1-карбоновой кислоты (16c, 7,9 г, 95%) в виде желтого масла. 1H ЯМР (400 MГц, DMSO-d6) δ=12,01 (шир.с, 1H), 4,67 (шир.с, 1H), 4,02 (т, J=6,9 Гц, 1H), 2,67 (кв, J=7,9 Гц, 1H), 2,19 (тд, J=7,1, 14,1 Гц, 1H), 2,03-1,93 (м, 2H), 1,81-1,67 (м, 1H), 1,28-1,15 (м, 1H), 0,93 (д, J=6,3 Гц, 3H).
Раствор (±)-(1R*,2S*,4R*)-4-гидрокси-2-метилциклопентан-1-карбоновой кислоты (16c, 7,9 г, 55 ммоль), трет-бутил(хлор)дифенилсилана (TBDPSCl, 15,8 г, 57,5 ммоль), и DBU (10 г, 66 ммоль) в ацетонитриле (200 мл) перемешивали при комнатной температуре в течение 15 ч. Реакционную смесь концентрировали и разделяли между DCM и насыщ. водн. хлоридом аммония. Органический слой промывали насыщ. водн. NaCl над сульфатом натрия, концентрировали, и очищали с помощью хроматографии на силикагеле (элюируя 100% DCM - DCM/MeOH 20/1) с получением (±)-(1R*,2S*,4R*)-4-((трет-бутилдифенилсилил)окси)-2-метилциклопентан-1-карбоновой кислоты (18 г, 85%) в виде нечистого желтого масла, которое использовали на следующей стадии без дальнейшей очистки.
К раствору (±)-(1R*,2S*,4R*)-4-((трет-бутилдифенилсилил)окси)-2-метилциклопентан-1-карбоновой кислоты (700 мг, 1,83 ммоль), азида натрия (297 мг, 4,57 ммоль), тетрабутиламмоний бромида (TBAB, 118 мг, 0,366 ммоль), и трифлат цинка (200 мг, 0,549 ммоль) в THF (20 мл) добавляли ди-трет-бутил дикарбонат (599 мг, 2,74 ммоль). Смесь перемешивали в герметизированной пробирке в атмосфере аргона при 60°C в течение 24 ч, затем через шприц добавляли трет-бутанол (67,8 мг, 0,915 ммоль). Перемешивание продолжали при 60°C в течение еще 24 ч. Смесь охлаждали до комнатной температуры и гасили 10% водным NaNO2 (10 мл). Добавляли этилацетат и двухфазную смесь перемешивали в течение 30 мин при комнатной температуре. Два слоя разделяли и органический слой последовательно промывали насыщ. водн. NH4Cl (15 мл), и насыщенным солевым раствором (15 мл). Органический раствор сушили над сульфатом натрия, фильтровали и концентрировали с получением неочищенного 16d в виде желтого масла. Всего семь отдельных партий получали отдельно в масштабе 700 мг, как описано выше, затем партии объединяли и очищали с помощью хроматографии на силикагеле (петролейный эфир/EtOAc 10/1) с получением (±)-трет-бутил ((1R*,2S*,4R*)-4-((трет-бутилдифенилсилил)окси)-2-метилциклопентил)карбамата (16d, 3,3 г, 56% из семи партий по 700 мг каждая). MS: 476,1 [M+H]+, 1H ЯМР (400 MГц, DMSO-d6) δ=7,62-7,57 (м, 4H), 7,48-7,40 (м, 6H), 6,59 (д, J=8,8 Гц, 1H), 4,13 (т, J=6,1 Гц, 1H), 3,77-3,61 (м, 1H), 1,99-1,82 (м, 3H), 1,66 (тд, J=6,6, 12,9 Гц, 1H), 1,37 (с, 10H), 1,00 (с, 9H), 0,88 (д, J=6,5 Гц, 3H). 2D ЯМР анализ подтвердил относительное стереохимическое распределение всех цис.
Трифторуксусную кислоту (10 мл) добавляли к раствору (±)-трет-бутил ((1R*,2S*,4R*)-4-((трет-бутилдифенилсилил)окси)-2-метилциклопентил)карбамата (16d, 1,9 г, 4,2 ммоль) в DCM (30 мл), и раствор перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор концентрировали, остаток разбавляли DCM (100 мл), и насыщ. водн. NaHCO3 (50 мл) добавляли для нейтрализации остаточной кислоты. Слои разделяли и водный слой экстрагировали DCM (100 мл). Объединенные органические слои сушили, фильтровали и концентрировали с получением неочищенного (±)-(1R*,2S*,4R*)-4-((трет-бутилдифенилсилил)окси)-2-метилциклопентан-1-амина (промежуточное соединение 16, 1,5 г) в виде масла. 1H ЯМР (400 MГц, CDCl3) δ=7,72 (дд, J=1,8, 7,8 Гц, 1H), 7,66 (ддд, J=1,5, 3,5, 7,8 Гц, 3H), 7,48-7,32 (м, 6H), 4,30-4,19 (м, 1H), 3,08 (д, J=4,3 Гц, 1H), 2,03-1,90 (м, 2H), 1,79 (шир.с, 1H), 1,68 (тд, J=3,2, 13,9 Гц, 1H), 1,51-1,39 (м, 1H), 1,13-0,95 (м, 12H).
Промежуточное соединение 16 было дополнительно обработано с использованием способа промежуточного соединения 5 посредством SNAr присоединения к этил 4-хлор-2-(метилсульфанил)пиримидин-5-карбоксилату, восстановления сложного эфира с помощью LAH и окисления полученного спирта с помощью MnO2. Трет-бутилдифенилсилильная защитная группа случайно расщеплялась во время восстановления LAH. Следующий синтез по способу А дал примеры 199 и 200, как показано в таблице 1.
Промежуточное соединение 17 (±)-(1R*,3S*,4S*)-3-амино-4-фторциклогексан-1-ол гидрохлорид.
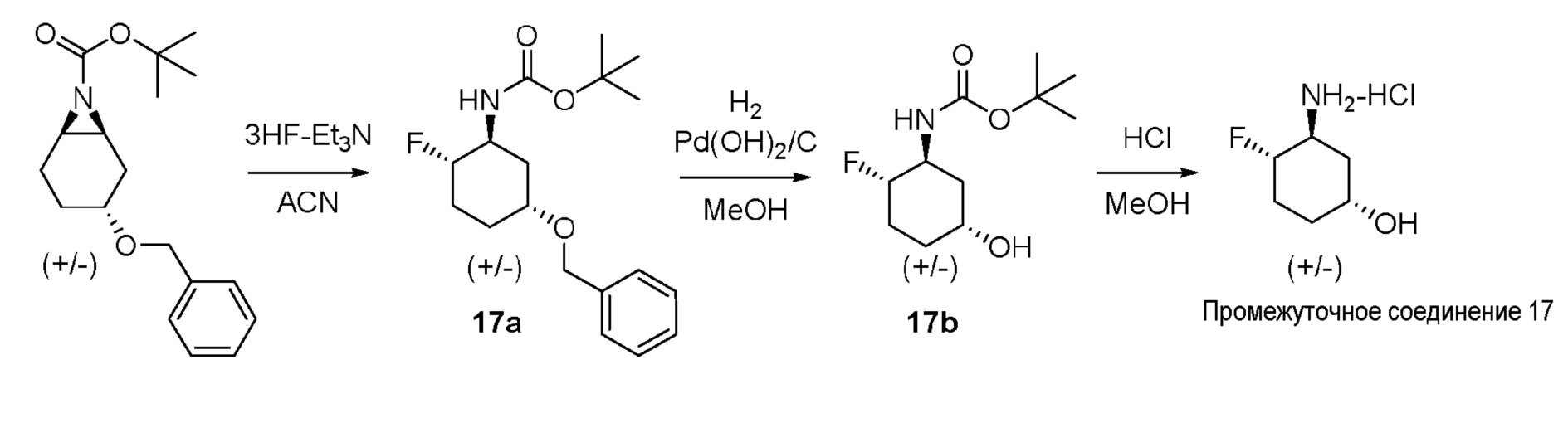
В герметичном полипропиленовом сосуде раствор (±)-(трет-бутил (1S*,3R*,6R*)-3-(бензилокси)-7-азабицикло[4.1.0]гептан-7-карбоксилата [Crotti, P. et al. J. Org. Chem. 1995, 60, 2514] (4,0 г, 13 ммоль) и триэтиламин тригидрофторид (12,8 г, 79,2 ммоль) в ацетонитриле (10 мл) перемешивали при 90°C в течение 18 ч. После охлаждения до комнатной температуры, смесь разделяли между водой и этилацетатом. Органический слой промывали насыщ. водн. NaCl, сушили над сульфатом натрия, концентрировали, и очищали с помощью хроматографии на силикагеле (элюируя петролейный эфир/EtOAc 10/1-1/1) с получением 2,4 г желаемого продукта, но с чистотой 85% по данным ВЭЖХ. Этот материал дополнительно очищали препаративной ВЭЖХ с получением (±)-трет-бутил ((1S*,2S*,5R*)-5-(бензилокси)-2-фторциклогексил)карбамата (17a, 1,88 г, 44%) в виде белого твердого вещества. 1H ЯМР (400 MГц, CD3OD) δ=7,47-7,18 (м, 5H), 4,62-4,48 (м, 2H), 4,40-4,18 (м, 1H), 3,92 (шир. дд, J=3,9, 10,7 Гц, 1H), 3,78-3,68 (м, 1H), 2,16 (шир. дд, J=1,8, 11,0 Гц, 1H), 2,04-1,84 (м, 3H), 1,57-1,39 (м, 11H).
Раствор (±)-трет-бутил ((1S*,2S*,5R*)-5-(бензилокси)-2-фторциклогексил)карбамата (17a, 1,88 г, 5,81 ммоль) и Pd(OH)2/C (1,0 г) в метаноле (100 мл) перемешивали в атмосфере водорода 45 фунтов на квадратный дюйм при комнатной температуре в течение 18 ч. Катализатор отфильтровывали и фильтрат концентрировали, с получением (±)-трет-бутил ((1S*,2S*,5R*)-2-фтор-5-гидроксициклогексил)карбамата (17b, 1,36 г, 100%) в виде белого твердого вещества, которое использовали без дальнейшей очистки. 1H ЯМР (400 MГц, CD3OD) δ=4,42-4,15 (м, 1H), 4,04-3,86 (м, 2H), 3,33 (тд, J=1,6, 3,3 Гц, 1H), 2,00-1,82 (м, 3H), 1,81-1,71 (м, 1H), 1,62-1,50 (м, 2H), 1,46 (с, 9H).
К раствору (±)-трет-бутил ((1S*,2S*,5R*)-2-фтор-5-гидроксициклогексил)карбамата (17b,1,36 г, 5,83 ммоль) в MeOH (20 мл) добавляли 4 M HCl в MeOH (20 мл, 80 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа, затем концентрировали и лиофилизировали с получением (±)-(1R*,3S*,4S*)-3-амино-4-фторциклогексан-1-ол гидрохлорида (промежуточное соединение 17, 0,985 г, 100%) в виде белого гигроскопичного твердого вещества. MS: 134,1 [M+H]+, 1H ЯМР (400 MГц, D2O) δ=4,75-4,52 (м, 1H), 4,23-4,09 (м, 1H), 3,69-3,53 (м, 1H), 2,22-2,03 (м, 2H), 1,95-1,80 (м, 2H), 1,75-1,61 (м, 2H), 19F ЯМР (376MГц, D2O) δ= -179,8 (с, 1F).
Промежуточное соединение 17 использовали без дополнительной очистки, как описано для промежуточного соединения 3 и способа А, для получения примеров 217-220, показанных в таблице 1.
Промежуточное соединение 18: (1S,2S,5R)-5-((трет-бутилдифенилсилил)окси)-2-метилциклогексан-1-амин.
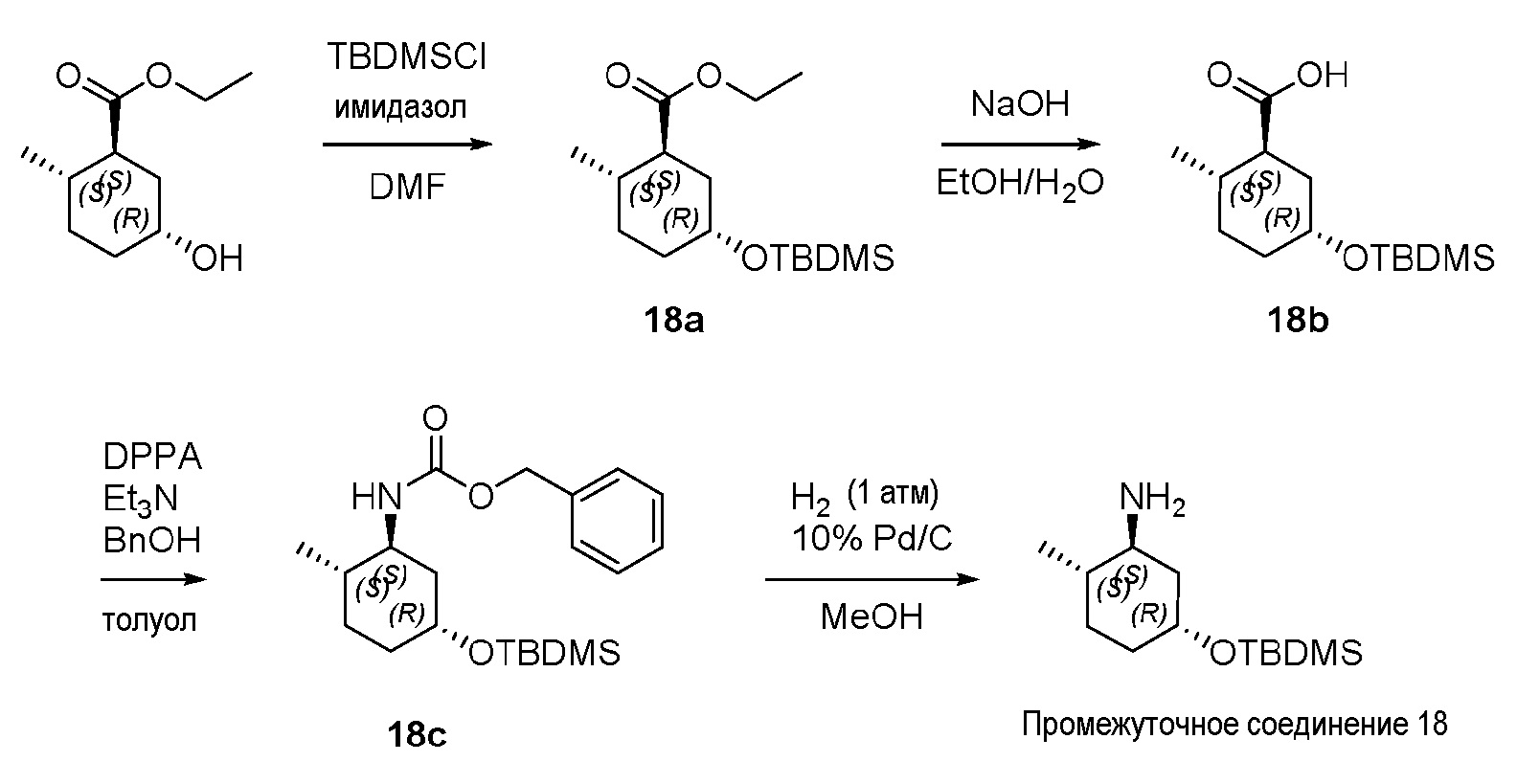
Раствор этил (1S,2S,5R)-5-гидрокси-2-метилциклогексан-1-карбоксилата [Raw, A.S. and Jang, E.B. Tetrahedron 2000, 56, 3285-3290] (6,25 г, 33,6 ммоль), имидазола (6,85 г, 101 ммоль), и трет-бутил(хлор)дифенилсилана (18,4 г, 67,1 ммоль) в DMF (80 мл) перемешивали при 20°C в течение 40 ч. Реакция гасили деионизированной водой (200 мл) и экстрагировали этилацетатом (3×80 мл). Объединенные органические вещества промывали насыщ. водн. NaCl, сушили над сульфатом натрия, концентрировали и очищали с помощью хроматографии на силикагеле (элюирование этилацетатом в петр. эфире) с получением этил (1S,2S,5R)-5-((трет-бутилдиметилсилил)окси)-2-метилциклогексан-1-карбоксилата (18a, 10,5 г, 74%) в виде светло-желтого масла. 1H ЯМР (400 MГц, CDCl3) δ=7,72-7,62 (м, 4H), 7,47-7,35 (м, 6H), 4,21-4,02 (м, 3H), 2,67-2,50 (м, 1H), 1,87-1,77 (м, 1H), 1,69-1,58 (м, 3H), 1,52-1,32 (м, 3H), 1,26 (т, J=7,2 Гц, 3H), 1,10-1,07 (м, 9H), 0,95 (д, J=6,0 Гц, 3H).
Смесь гидроксида натрия (4,71 г, 118 ммоль) и (1S,2S,5R)-5-((трет-бутилдиметилсилил)окси)-2-метилциклогексан-1-карбоксилата (18a, 5,0 г, 11,8 ммоль) в этаноле (80 мл) и деионизированную воду (80 мл) перемешивали при 80°C в течение 15 ч. Летучие вещества выпаривали и водный остаток нейтрализовали до рН 6 с помощью 1 н HCl. Продукт экстрагировали этилацетатом (3×100 мл). Объединенные органические вещества промывали насыщ. водн. NaCl, сушили над сульфатом натрия, концентрировали и очищали с помощью хроматографии на силикагеле (элюирование этилацетатом в петр. эфире) с получением (1S,2S,5R)-5-((трет-бутилдиметилсилил)окси)-2-метилциклогексан-1-карбоновой кислоты (18b, 2,55 г, 55%) в виде светло-серого твердого вещества. Хиральный SFC не показал эпимеризации. [Главный пик rt 2,72 мин, Хиральный SFC способ: Колонка: ChiralCel OJ-H 150×4,6 мм внут.диам., 5 мкм. Подвижная фаза: A: CO2 B: этанол (0,05% DEA). Градиент: от 5% до 40% B в 5,5 мин и удерживание 40% в течение 3 минут, затем 5% B в течение 1,5 мин. Скорость потока: 2,5 мл/мин Температура колонки при 40°C].
Раствор (1S,2S,5R)-5-((трет-бутилдиметилсилил)окси)-2-метилциклогексан-1-карбоновой кислоты (18b, 4,0 г, 10,1 ммоль), триэтиламина (3,1 г, 30,3 ммоль), и дифенилфосфорилазида (DPPA, 4,2 г, 15,1 ммоль) в толуоле (100 мл) перемешивали при 110°C в течение 3 ч. Добавляли бензиловый спирт (5,5 г, 50,4 ммоль) и перемешивание продолжали при 110°C в течение еще 32 ч. После охлаждения до комнатной температуры, реакционную смесь концентрировали и остаток очищали с помощью хроматографии на силикагеле (элюирование этилацетатом в петр. эфире) с получением бензил ((1S,2S,5R)-5-((трет-бутилдифенилсилил)окси)-2-метилциклогексил)карбамата (18c, 2,8 г, 55%) в виде масла. 1H ЯМР (400 MГц, CDCl3) δ=7,79-7,62 (м, 4H), 7,48-7,31 (м, 11H), 5,26-5,07 (м, 2H), 4,49-4,37 (м, 1H), 4,18-4,05 (м, 1H), 3,92-3,71 (м, 1H), 2,11-1,92 (м, 1H), 1,78-1,60 (м, 3H), 1,35-1,19 (м, 3H), 1,14-1,01 (м, 12H). MS; 524 [M+Na]+.
Бензил ((1S,2S,5R)-5-((трет-бутилдифенилсилил)окси)-2-метилциклогексил)карбамат (18c, 3,50 г, 6,98 ммоль) в метаноле (75 мл) и обрабатывали 10% палладий на угле (350 мг) и перемешивали при 30°С под водородным баллоном в течение 16 ч. Катализатор удаляли фильтрованием и фильтрат упаривали с получением (1S,2S,5R)-5-((трет-бутилдифенилсилил)окси)-2-метилциклогексан-1-амина (промежуточное соединение 18, 2,5 г, 98%) в виде масла. 1H-ЯМР (400 MГц, CDCl3) δ=7,77-7,61 (м, 4H), 7,47-7,35 (м, 6H), 4,26-4,09 (м, 1H), 2,95-2,77 (м, 1H), 1,91-1,83 (м, 1H), 1,67-1,58 (м, 3H), 1,53-1,43 (м, 1H), 1,35-1,23 (м, 1H), 1,20-1,12 (м, 2H), 1,09 (с, 12H). MS: 368 [M+H]+.
Промежуточное соединение 18 использовали в синтезе с помощью способов Промежуточного соединения 3 и Способа А с удалением защиты силила с помощью TBAF в качестве дополнительной стадии перед окислением тиоэфира OXONE®, для получения Примера 216, как показано в Таблице 1.
Промежуточное соединение 19: (±)-(3S*,4R*)-4-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-3-метилтетрагидрофуран-3-ол.
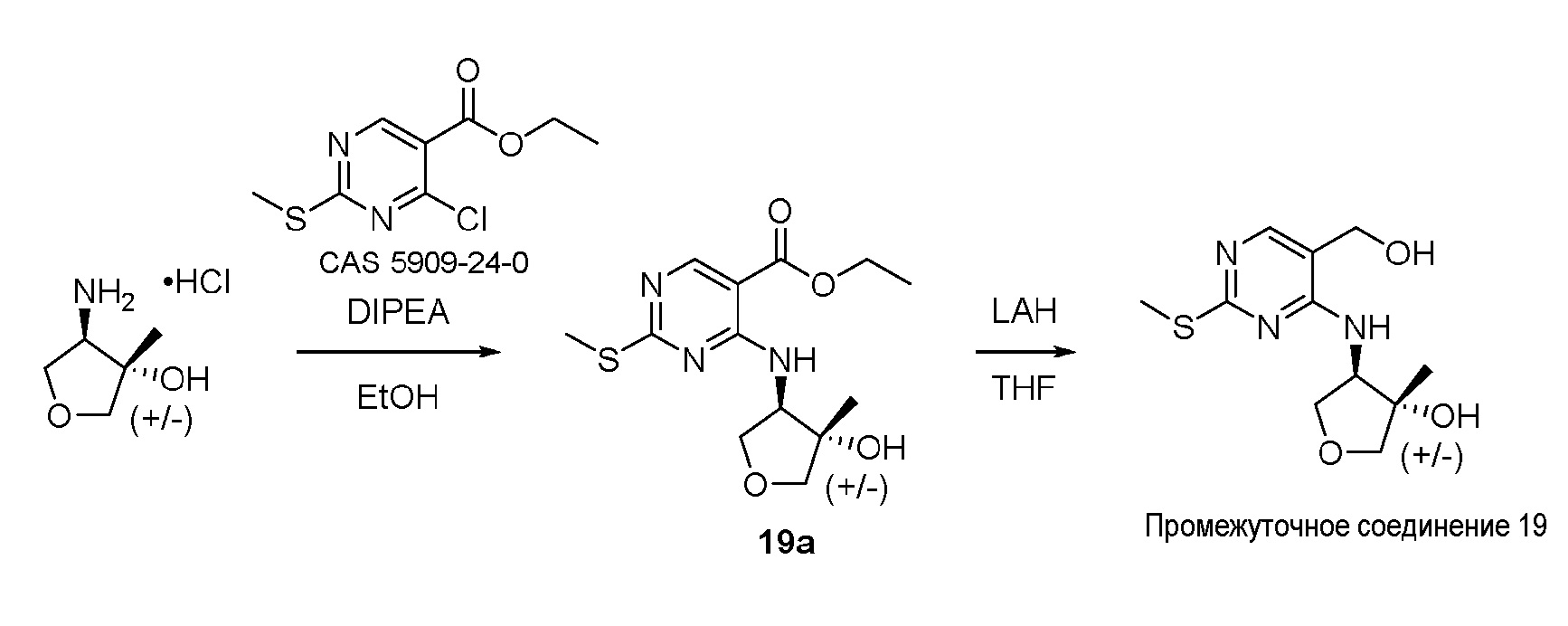
По способу промежуточного соединения 5, SNAr присоединение этил 4-хлор-2-(метилсульфанил)пиримидин-5-карбоксилата (CAS# 5909-24-0) (6,0 г, 26 ммоль) и (±)-(3S*,4R*)-4-амино-3-метил тетрагидрофуран-3-ол гидрохлорида [Eli Lilly and Co. Patent: Selective Androgen Receptor Modulators. WO 2013/055577 A1, 2013] (6,1 г, 28 ммоль) с диизопропилэтиламином (20 г, 155 ммоль) в этаноле (120 мл) дает (±)-этил 4-(((3R*,4S*)-4-гидрокси-4-мететртилагидрофуран-3-ил)амино)-2-(метилтио)пиримидин-5-карбоксилат (19a, 6,2 г, 77%), который затем восстанавливают LAH (1,91 г, 50,5 ммоль) в THF (150 мл). После водной обработки основной изомер выделяли с помощью препаративной ВЭЖХ, с получением (±)-(3S*,4R*)-4-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-3-метилтетрагидрофуран-3-ола (промежуточное соединение 19, 1,51 г, 33%) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=7,80 (с, 1H), 6,08 (д, J=6,0 Гц, 1H), 4,65-4,56 (м, 3H), 4,36 (дд, J=9,16, 7,65 Гц, 1H), 3,90 (д, J=9,0 Гц,1H), 3,76 (д, J=9,3 Гц, 1H), 3,65 (дд, J=9,16, 6,90 Гц, 1H), 2,54-2,49 (м, 3H), 1,26 (с, 3H).
Промежуточное соединение 19 окисляли до соответствующего альдегида с использованием MnO2 по способу промежуточного соединения 5 и дополнительно обрабатывали по способу A для синтеза примеров 197 и 198 и примера 198, как показано в таблице 1.
Промежуточное соединение 20: (±)-(1R*,2S*,3R*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ол.
Промежуточное соединение 21: (±)-(1R*,2R*,3S*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ол.
Промежуточное соединение 22: (±)-(1R*,2R*,3R*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ол.
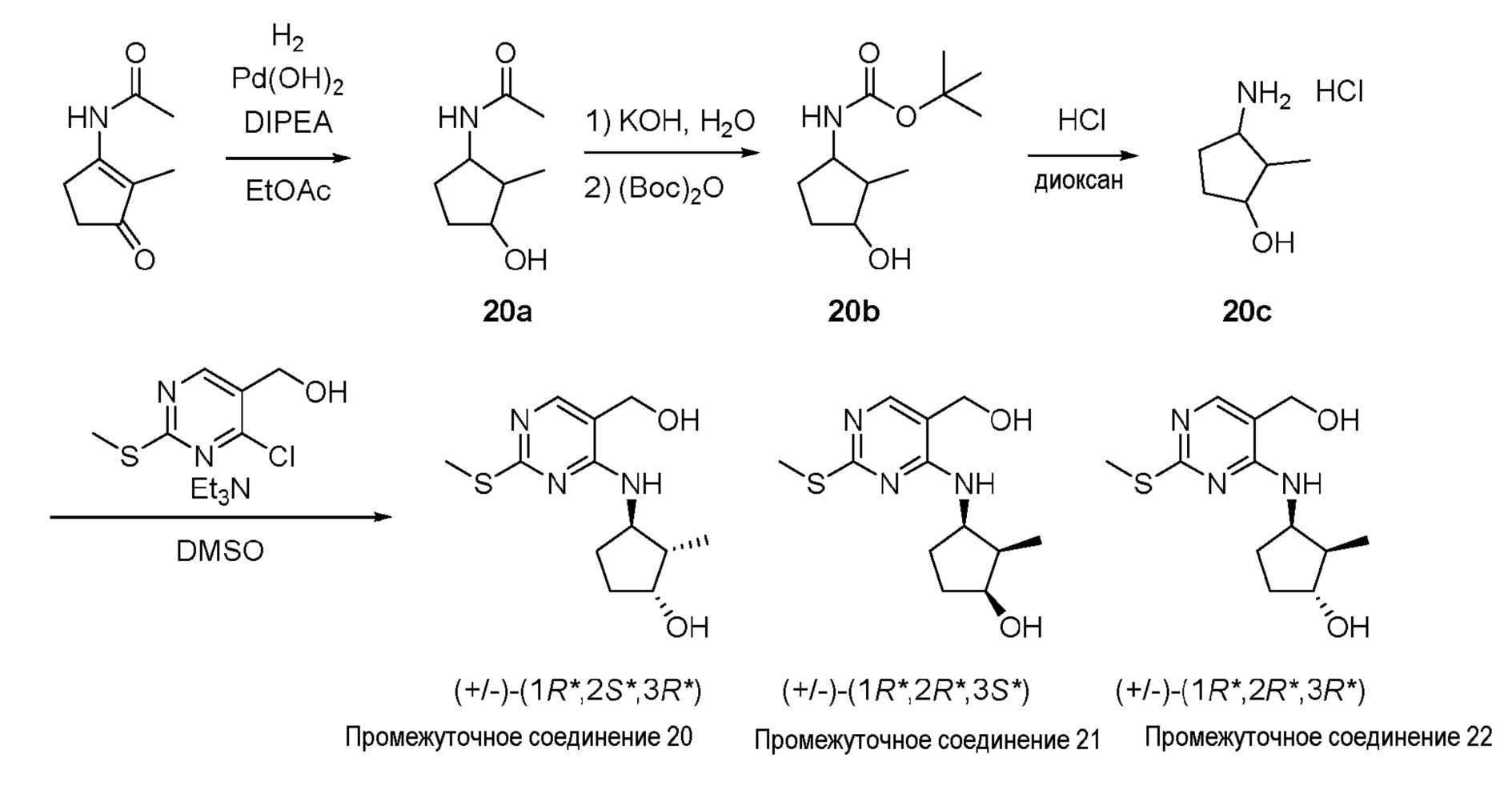
Суспензию N-(2-метил-3-оксоциклопент-1-ен-1-ил)ацетамида [Huang, K.; Guan, Z.-H.; Zhang, X., Tet. Lett., 2014, 55, 1686-1688] (17,6 г, 115 ммоль), 20% Pd(OH)2 (влаж.) (4,4 г, 28,8 ммоль), и DIPEA (37,2 г, 288 ммоль) в этилацетате (80 мл) гидрогенизировали в реакторе из нержавеющей стали при 20 бар и 80°C в течение 18 ч. Катализатор удаляли фильтрованием через слой Celite®, и осадок на фильтре промывали этилацетатом (100 мл) и водой (100 мл). Двухфазные слои фильтрата разделяли, и водный слой экстрагировали этилацетатом (3×30 мл). Объединенные органические вещества сушили над сульфатом натрия и концентрировали с получением смеси диастереомеров N-(3-гидрокси-2-метилциклопентил)ацетамида (20a, 2,32 г), в виде желтого масла. В водном слое осталась другая смесь 20а диастереомеров, которые не были выделены, а перенесены в раствор. Обе фракции были перенесены на следующую стадию без дальнейшей очистки.
Твердый гидроксид калия (8,21 г, 146 ммоль) добавляли порциями к раствору N-(3-гидрокси-2-метилциклопентил)ацетамида (20a, 2,30 г, из органических экстрактов выше) в воде (100 мл). Смесь нагревали до 90°C в течение 72 ч. После охлаждения раствора до комнатной температуры, добавляли ди-трет-бутил-дикарбонат (6,39 г, 29,3 ммоль) и тетрагидрофуран (150,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 48 ч. После водной обработки продукты очищали с помощью хроматографии на силикагеле (элюируя 0-80% этилацетат/гептан) с получением трет-бутил (3-гидрокси-2-метилциклопентил)карбамата (20b, 3,15 г) в виде смеси диастереомеров. Водный слой с первой стадии, содержащий другую смесь диастереомеров 20a, гидролизовали и Boc-защищали той же процедурой с получением второй партии 20b (10,1 г, смесь диастереомеров).
Раствор трет-бутил (3-гидрокси-2-метилциклопентил)карбамата (20b, 9,3 г, 43,2 ммоль) в 1,4-диоксане (50 мл) обрабатывали хлористоводородной кислотой (216 мл 4M раствор в 1,4-диоксане, 864 ммоль), и перемешивали при комнатной температуре в течение 2 ч. Летучие вещества выпаривали, оставляя неочищенный 3-амино-2-метилциклопентан-1-ол гидрохлорид (20c, 7,0 г) в виде смеси диастереомеров, который использовали в следующей реакции без дальнейшей очистки. Другие партии 20b обрабатывали аналогичным образом для получения партии 20c с различными смесями диастереомеров.
Раствор неочищенного 3-амино-2-метилциклопентан-1-ол гидрохлорида (20c, 7,0 г, 60,78 ммоль, смесь диастереомеров), диизопропилэтиламина (39,3 г, 304 ммоль), [4-хлор-2-(метилсульфанил)пиримидин-5-ил]метанола (CAS# 1044145-59-6) (11,6 г, 60,8 ммоль) в DMSO (20 мл) нагревали до 50°C в течение 48 ч. Добавляли триэтиламин (18,5 г, 182 ммоль), и нагревание продолжали еще 20 часов. Реакционную смесь выливали на лед/воду и экстрагировали этилацетатом (3×100 мл). Объединенные органические вещества промывали насыщенным водным NaCl (3×100 мл), промывали деионизированной водой (100 мл), сушили над сульфатом натрия и концентрировали с получением 3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ола в виде смеси диастереомеров. Другие партии 20с обрабатывали аналогично для получения различных смесей диастереомеров.
Различные смеси 3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ол диастереомеров разделяли на четыре отдельные рацемические пары в течение нескольких стадий с помощью кристаллизации, флэш хроматографии и нехиральной препаративной ВЭЖХ. Стереохимию полученных энантиомерных пар определяли с помощью 2-D ЯМР.
(±)-(1R*,2S*,3R*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ол (промежуточное соединение 20): 1H ЯМР (400 MГц, DMSO-d6) δ=7,81 (с, 1H), 6,46 (д, J=7,8 Гц, 1H), 5,10 (т, J=5,5 Гц, 1H), 4,43 (д, J=4,2 Гц, 1H), 4,33 (д, J=5,5 Гц, 2H), 4,24 (квин, J=8,5 Гц, 1H), 3,99 (д, J=3,0 Гц, 1H), 2,42 (с, 3H), 2,12-2,23 (м, 1H), 1,87-2,00 (м, 1H), 1,75-1,87 (м, 1H), 1,46-1,59 (м, 1H), 1,27-1,41 (м, 1H), 0,94 (д, J=6,8 Гц, 3H). MS: 270 [M+H]+.
(±)-(1R*,2R*,3S*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ол (промежуточное соединение 21): 1H ЯМР (400 MГц, DMSO-d6) δ=7,81 (с, 1H), 6,57 (д, J=7,8 Гц, 1H), 5,11 (т, J=5,5 Гц, 1H), 4,73 (д, J=4,6 Гц, 1H), 4,32 (д, J=5,5 Гц, 2H), 3,86-4,13 (м, 1H), 3,48-3,69 (м, 1H), 2,40 (с, 3H), 1,93-2,08 (м, 1H), 1,79-1,93 (м, 1H), 1,65-1,79 (м, 1H), 1,44-1,62 (м, 2H), 0,98 (д, J=6,8 Гц, 3H). MS: 270 [M+H]+.
(±)-(1R*,2R*,3R*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ол (промежуточное соединение 22): 1H ЯМР (400 MГц, DMSO-d6) δ=7,81 (с, 1H), 6,34 (д, J=7,9 Гц, 1H), 5,21 (т, J=5,4 Гц, 1H), 4,57-4,70 (м, 2H), 4,25-4,41 (м, 2H), 3,74 (квин, J=5,1 Гц, 1H), 2,34-2,46 (м, 3H), 2,00-2,12 (м, 2H), 1,89-2,00 (м, 1H), 1,49-1,63 (м, 1H), 1,31-1,47 (м, 1H), 0,74 (д, J=7,2 Гц, 3H). MS: 270 [M+H]+.
Четвертая из четырех возможных пар энантиомеров также была выделена, но не использовалась в дальнейшем синтезе. (±)-(1R*,2S*,3S*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклопентан-1-ол: 1H ЯМР (400 MГц, DMSO-d6) δ=7,78 (с, 1H), 6,64 (д, J=8,7 Гц, 1H), 5,13 (т, J=5,2 Гц, 1H), 4,75 (д, J=3,4 Гц, 1H), 4,44-4,62 (м, 1H), 4,30 (с, 2H), 3,89-4,05 (м, 1H), 2,41 (с, 3H), 1,91-2,04 (м, 2H), 1,73-1,81 (м, 1H), 1,54-1,73 (м, 2H), 0,89 (д, J=7,1 Гц, 3H). MS: 270 [M+H]+.
Промежуточное соединение 20, промежуточное соединение 21 и промежуточное соединение 22 по отдельности окисляли до соответствующих альдегидов с помощью MnO2, используя способ промежуточного соединения 1, и дополнительно обрабатывали по способу A и другими общими способами синтеза, описанными в настоящем документе, для синтеза примеров 201-210, показанных в таблице 1.
Промежуточное соединение 23: (±)-(1S*,2R*,3S*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклогексан-1-ол
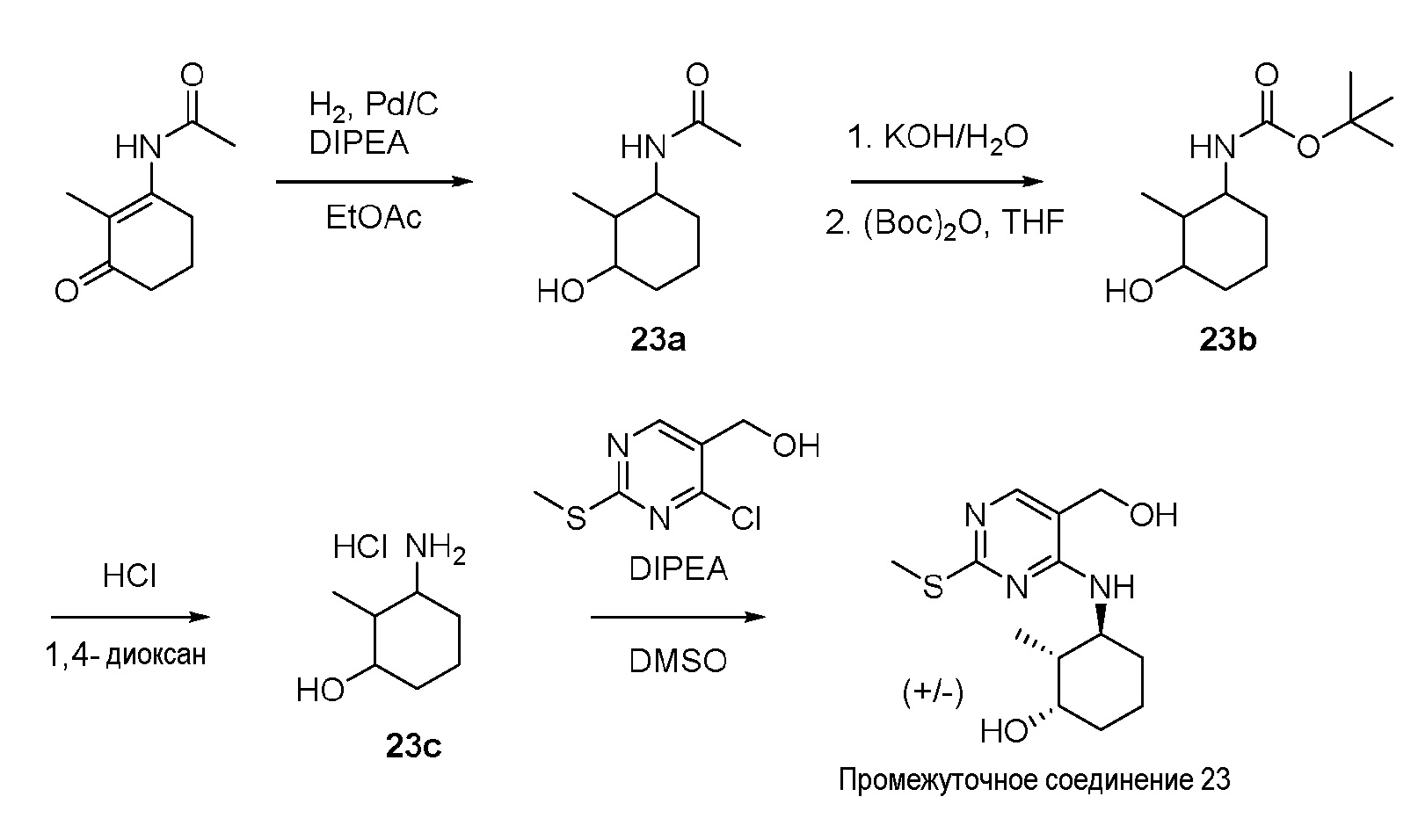
Раствор N-(2-метил-3-оксоциклогекс-1-ен-1-ил)ацетамида [CAS# 36887-93-1] (20 г, 120 ммоль), DIPEA (38,8 г, 300 ммоль) и 20% Pd/C (2 г, 12 ммоль) в этилацетате (80 мл) гидрогенизировали в сосуде из нержавеющей стали под давлением 20 бар при 80°С в течение 20 ч. Реакционную смесь фильтровали, пока она еще горячая, и осадок на фильтре промывали горячим этилацетатом. Объединенный фильтрат концентрировали и твердый остаток кристаллизовали в DCM/гептане с получением смеси диастереомеров N-(3-гидрокси-2-метилциклогексил)ацетамида (23a, 10,0 г, 51%) в виде белого твердого вещества.
Твердый гидроксид калия (22,9 г, 409 ммоль) добавляли порциями к раствору N-(3-гидрокси-2-метилциклогексил)ацетамида (23a, 7,0 г, 40 ммоль) в воде (200,0 мл). Реакционную смесь нагревали до 100°C в течение 24 ч и затем до 90°C в течение еще 72 часов. Раствор охлаждали до комнатной температуры и добавляли ди-трет-бутил дикарбонат (9,8 г, 45,0 ммоль) и тетрагидрофуран (150 мл). Перемешивание продолжали при комнатной температуре в течение 48 ч. Раствор экстрагировали этилацетатом (3×100 мл) и органические вещества объединяли, сушили над сульфатом натрия и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (элюирование 0-100% этилацетатом в гептане) с получением трет-бутил (3-гидрокси-2-метилциклогексил)карбамата (23b, 2,50 г, 30%) в виде диастереомерной смеси. 1H ЯМР (400 MГц, CDCl3) δ=4,20-4,60 (м, 1H), 3,84-4,04 (м, 1H), 3,44-3,66 (м, 1H), 1,89-2,02 (м, 1H), 1,67-1,88 (м, 2H), 1,49-1,58 (м, 1H), 1,45 (с, 9H), 1,14-1,42 (м, 2H), 0,95-1,12 (м, 3H).
Раствор трет-бутил (3-гидрокси-2-метилциклогексил)карбамата (23b, 2,50 г, 10,9 ммоль) в 1,4-диоксане (100 мл) обрабатывали хлористоводородной кислотой (40,9 мл 4М раствора в 1,4-диоксане, 164 ммоль), и перемешивали при комнатной температуре в течение 20 ч. Летучие вещества удаляли и остаток сушили в вакуумной печи в течение 72 ч с получением смеси диастереомеров 3-амино-2-метилциклогексан-1-ол гидрохлорида (23c, 1,68 г, 93%) в виде желтого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=7,57-8,28 (м, 3H), 3,58-3,78 (м, 1H), 2,55-3,19 (м, 1H), 1,71-2,01 (м, 1H), 1,60-1,71 (м, 1H), 1,51-1,60 (м, 2H), 1,06-1,51 (м, 3H), 0,70-1,06 (м, 3H).
Раствор [4-хлор-2-(метилсульфанил)пиримидин-5-ил]метанола (CAS# 1044145-59-6) (2 г, 10,5 ммоль), 3-амино-2-метилциклогексан-1-ол гидрохлорида (23c 1,5 г, 11,7 ммоль, смесь диастереомеров) и DIPEA (4,5 г, 35,1 ммоль) в DMSO (20,0 мл) нагревали до 50°C в течение 20 ч, затем выливали на воду со льдом и экстрагировали этилацетатом (3×100 мл). Органические вещества промывали насыщ. водн. NaCl (3×50 мл), сушили над сульфатом натрия, концентрировали и очищали с помощью хроматографии на силикагеле, элюируя 0-100% этилацетатом в гептане. Этот способ был достаточным для разделения желаемого диастереомера, (±)-(1S*,2R*,3S*)-3-((5-(гидроксиметил)-2-(метилтио)пиримидин-4-ил)амино)-2-метилциклогексан-1-ола (промежуточное соединение 23, 169 мг, 5,7%, пики наименее полярного продукта) в виде белого твердого вещества. Относительную стереохимию определяли с помощью 2-D ЯМР. 1H ЯМР (400 MГц, DMSO-d6) δ=7,79 (с, 1H), 6,30 (д, J=8,6 Гц, 1H), 5,12 (т, J=5,5 Гц, 1H), 4,36 (д, J=3,9 Гц, 1H), 4,32 (д, J=5,5 Гц, 2H), 4,05-4,17 (м, 1H), 3,77 (шир.с, 1H), 2,41 (с, 3H), 1,78-1,94 (м, 1H), 1,68-1,75 (м, 1H), 1,54-1,65 (м, 1H), 1,33-1,50 (м, 2H), 1,11-1,29 (м, 2H), 0,89 (д, J=6,8 Гц, 3H). MS: 284 [M+H]+.
Промежуточное соединение 23 окисляли до соответствующего альдегида с помощью MnO2, затем дополнительно обрабатывали по способу А для получения примеров 221 и 222, показанных в таблице 1.
Примеры
Общие способы и иллюстративные примеры
Способ A (Альдольная циклизация)
Пример 1: 8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
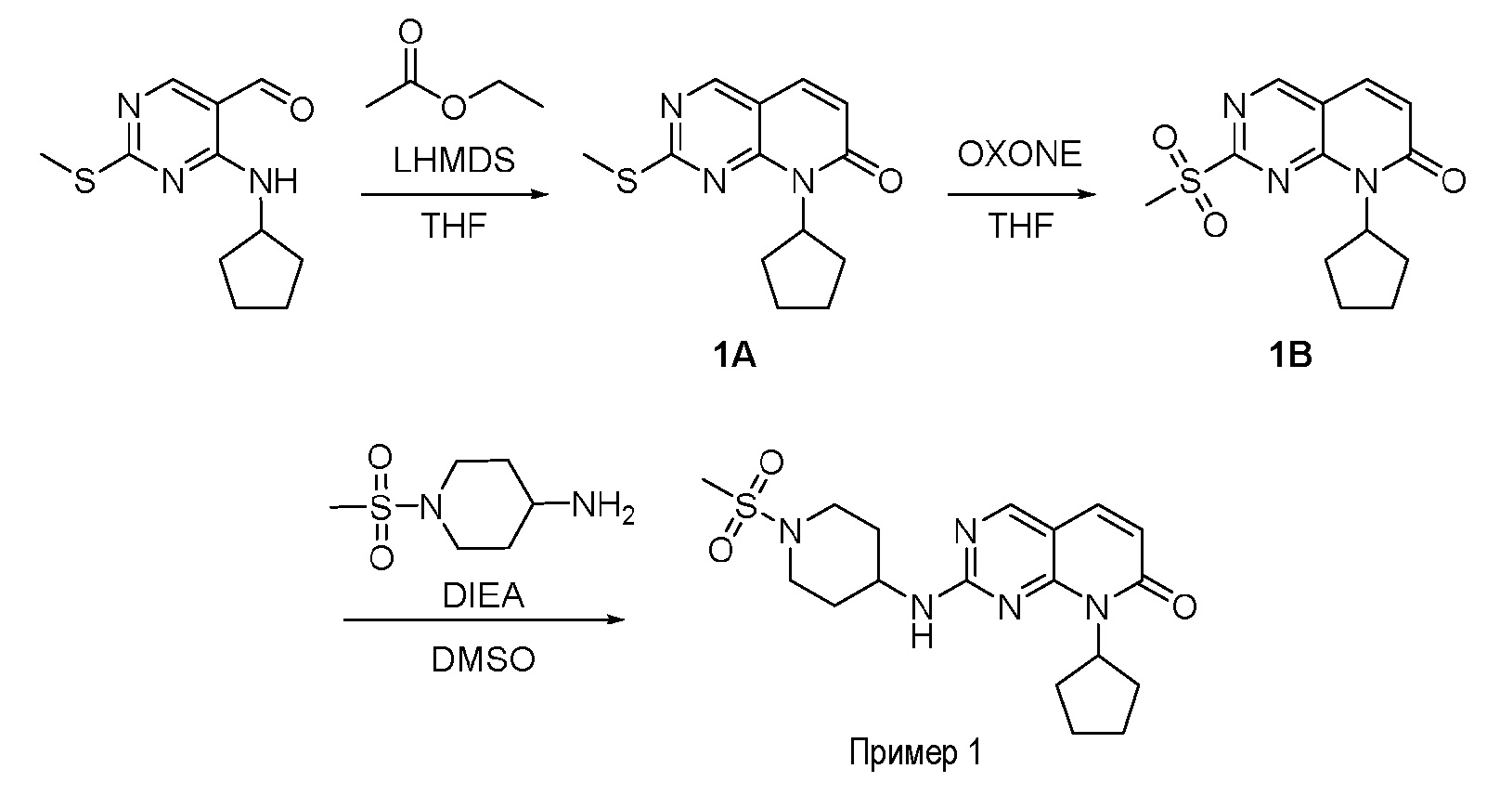
К раствору 4-(циклопентиламино)-2-(метилсульфанил)пиримидин-5-карбальдегида [VanderWel, et al. J. Med. Chem. 2005, 48, 2371] (2,0 г, 8,4 ммоль) в безводном THF (50 мл) добавляли EtOAc (2,23 г, 25,3 ммоль) при -70°C. Смесь перемешивали при этой температуре в течение 15 мин, затем добавляли по каплям LHMDS (1,0 M в THF, 29,5 ммоль, 29,5 мл). Реакционную смесь перемешивали при -70°C в течение 30 мин и затем при 20°C в течение 16 ч. Раствор охлаждали на ледяной бане, гасили водой и затем экстрагировали EtOAc (50 мл×3). Объединенные органические слои промывали водн. NH4Cl (30 мл), и насыщ. водн. NaCl (30 мл), сушили над сульфатом натрия, и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (элюируя петролейный эфир/EtOAc 10/1-3/1) с получением 8-циклопентил-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (1A, 2,01 г, 91%) в виде белого твердого вещества. MS: 262 [M+H]+.
OXONE®, (23,5 г, 38,3 ммоль) добавляли к охлажденному (0°C) раствору 8-циклопентил-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (1A, 5,0 г, 19,13 ммоль) в THF (100 мл) и воде (20 мл), и смесь перемешивали при комнатной температуре в течение 2 ч. Смесь разбавляли EtOAc (300 мл), промывали водой (100 мл), сушили над сульфатом натрия, и концентрировали с получением неочищенного 8-циклопентил-2-(метилсульфонил)пиридо[2,3-d]пиримидин-7(8H)-она (1B, 5,40 г, 96%) в виде серого твердого вещества. MS: 315 [M+Na]+.
Раствор неочищенного 8-циклопентил-2-(метилсульфонил)пиридо[2,3-d]пиримидин-7(8H)-она (1B, 5,40 г, 17,0 ммоль), 4-амино-1-метансульфонилпиперидина (CAS# 402927-97-3, 5,34 г, 24,9 ммоль) и DIPEA (14,7 мл, 82,8 ммоль) в DMSO (70 мл) перемешивали при 65°C в течение 18 ч. Реакционную смесь разбавляли DCM (150 мл), промывали водн. NH4Cl (80 мл×2), сушили над сульфатом натрия и концентрировали досуха. Неочищенный продукт перекристаллизовывали 1/2 EtOAc:петролейным эфиром (50 мл) с получением 8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (пример 1, 4,65 г, 72%) в виде серого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=8,68-8,54 (м, 1H), 7,88 (д, J=6,3 Гц, 1H), 7,68 (д, J=9,3 Гц, 1H), 6,28-6,16 (м, 1H), 5,92-5,74 (м, 1H), 4,02-3,82 (м, 1H), 3,58 (д, J=10,8 Гц, 2H), 2,96-2,82 (м, 5H), 2,33 (д, J=1,8 Гц, 1H), 2,19 (шир.с, 1H), 2,03-1,91 (м, 4H), 1,78-1,55 (м, 6H). MS: 392 [M+H]+.
Пример 2: 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
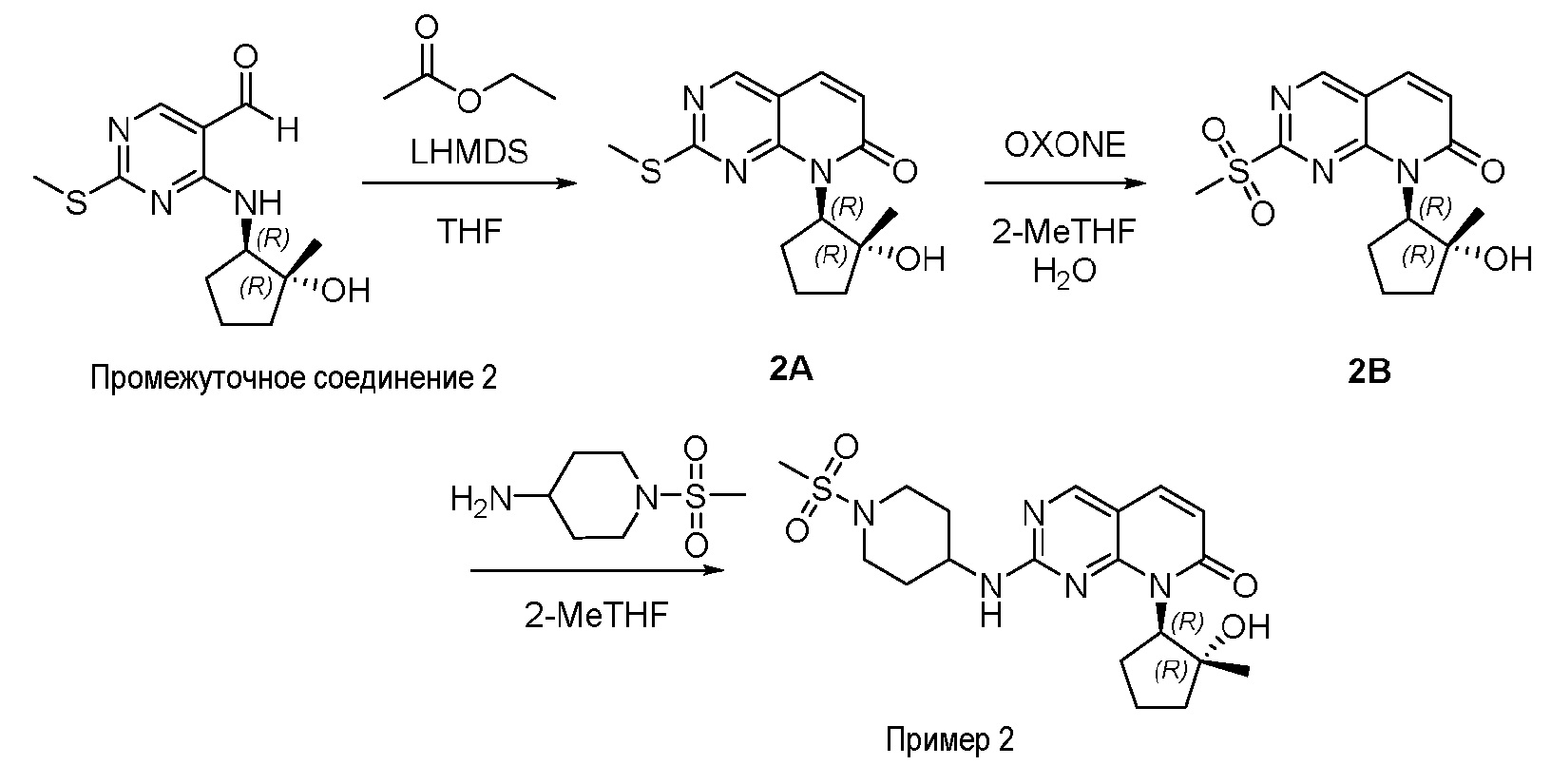
В 2 л трехгорлую колбу, снабженную механической мешалкой и внутренним термометром, добавляли твердый 4-{[(1R,2R)-2-гидрокси-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегид (промежуточное соединение 2, 34,2 г, 128 ммоль), THF (400 мл), и EtOAc (33,4 мл, 333 ммоль). Раствор продували азотом и охлаждали на бане MeOH-лед до -5°C, внутренняя. Через канюлю добавляли LHMDS (1,0 M раствор в THF, 4×100 мл свежеоткрытых бутылок, 400 ммоль), достаточно медленно, чтобы поддерживать внутреннюю температуру при -5°C. Светло-желтый осадок начал образовываться после добавления ~300 мл раствора LHMDS. Перемешивание продолжали, так как смеси давали постепенно нагреться до комнатной температуры в течение ночи. Полученный красный раствор охлаждали на ледяной бане до ~3°C, внутренняя, затем через канюлю добавляли EtOH (224 мл, 3840 ммоль), достаточно медленно, чтобы поддерживать внутреннюю температуру при ~3°C, внутренняя. Смесь перемешивали на ледяной бане в течение 1 часа, затем охлаждающую баню убирали, раствору давали нагреться до 20°С, внутренняя, и перемешивание продолжали в течение 1 ч. Растворители выпаривали, остаток разбавляли водой (180 мл) и насыщ. водн. NaCl (180 мл), и водный слой экстрагировали EtOAc (700 мл, затем 600 мл×2). Объединенные органические экстракты сушили над сульфатом натрия и концентрировали до светло-желто-коричневой пены (43,8 г). Эту пену растворяли в EtOAc (70 мл) и обрабатывали ультразвуком, чтобы вызвать осадки. Полученное твердое вещество собирали фильтрованием, промывали EtOAc (10 мл), и сушили с получением 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (2A, 21,4 г, 58%, >99%ee) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,61 (с, 1H), 7,56 (д, J=9,4 Гц, 1H), 6,60 (д, J=9,4 Гц, 1H), 5,84 (т, J=8,6 Гц, 1H), 2,92-2,76 (м, 1H), 2,64 (с, 3H), 2,34-2,19 (м, 2H), 2,13-2,01 (м, 2H), 2,00-1,81 (м, 2H), 1,16 (с, 3H). MS: 292 [M+H]+. Оптическое вращение: [α]D22= -12,9 (c 1,0, MeOH). Хиральная чистота: >99%ee. Хиральный SFC/MS анализ проводили на Chiralpak AD-3, 4,6×100 мм, 3 мкм нагревали до 25°C и элюировали подвижной фазой CO2 и 40% метанол, протекающей при 4,0 мл/мин и проводили при давлении на выходе 120 бар. Пик продукта имел время удерживания 0,85 мин.
Маточный раствор из вышеуказанных осадков упаривали досуха. Остаток (24,5 г) растворяли в EtOAc (30 мл) и раствор обрабатывали ультразвуком, чтобы вызвать осаждение. После фильтрации и сушки вторую порцию 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (2A, 4,70 г, 13%, >99% ee) получали в виде белого твердого вещества. Общий выход для обеих порций составил 26,1 г (71% при >99%ee) после кристаллизации.
Раствор 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-(метилсульфанил)-пиридо[2,3-d]пиримидин-7(8H)-она (2A, >99% ee, 2,33 г, 8 ммоль), 2-MeTHF (40 мл), воды (8 мл) и OXONE® (12,3 г, 20 ммоль) перемешивали при комнатной температуре в течение 4 ч. Раствор охлаждали на водяной бане, разбавляли водой (10 мл) и насыщ. водн. NaCl (10 мл) и экстрагировали EtOAc (80 мл×3). Объединенные органические экстракты сушили над сульфатом натрия, выпаривали до темного масла (3,76 г), и очищали с помощью хроматографии на силикагеле (элюируя градиентом 20-100% EtOAc в гептане) с получением 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-(метилсульфонил)пиридо[2,3-d]пиримидин-7(8H)-она (2B, 2,2 г, 84%) в виде пенистого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,96 (с, 1H), 7,74 (д, J=9,5 Гц, 1H), 6,90 (д, J=9,4 Гц, 1H), 5,77 (т, J=8,5 Гц, 1H), 3,40 (с, 3H), 2,92-2,73 (м, 1H), 2,36-2,25 (м, 1H), 2,19-2,08 (м, 2H), 2,03-1,85 (м, 2H), 1,14 (с, 3H). MS: 306 [M-18]+.
Раствор 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-(метилсульфонил)-пиридо[2,3-d]пиримидин-7(8H)-она (2B, 800 мг, 2,47 ммоль), и 4-амино-1-метансульфонилпиперидина (CAS# 402927-97-3, 970 мг, 5,44 ммоль) в 2-MeTHF (12,4 мл) нагревали на масляной бане при 60°С в течение 24 ч. После охлаждения до комнатной температуры, смесь разделяли между EtOAc (80 мл), водой (10 мл) и насыщ. водн. NaHCO3 (10 мл). Водный слой дополнительно экстрагировали EtOAc (60 мл×2). Объединенные органические экстракты сушили над сульфатом натрия и упаривали досуха. Остаток (1,23 г) растворяли в EtOAc (11 мл), добавляли затравочные кристаллы и раствор оставляли стоять при комнатной температуре в течение ночи. Полученное твердое вещество собирали фильтрованием, промывали EtOAc (3 мл) и сушили с получением 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (Пример 2, 680 мг, 63%, >99%ee) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,43 (с, 1H), 7,45 (д, J=9,3 Гц, 1H), 6,36 (д, J=9,4 Гц, 1H), 5,73 (т, J=8,4 Гц, 1H), 5,34 (шир.с, 1H), 4,01 (шир.с, 1H), 3,88-3,74 (м, 2H), 3,01-2,89 (м, 2H), 2,83 (с, 4H), 2,36 (шир.с, 1H), 2,29-2,14 (м, 3H), 2,03 (дт, J=2,9, 6,3 Гц, 2H), 1,98-1,89 (м, 1H), 1,88-1,81 (м, 1H), 1,78-1,60 (м, 2H), 1,18 (с, 3H). MS: 422 [M+H]+. Оптическое вращение: [α]D22 -17,0 (c 1,0, CHCl3). Хиральная чистота: >99% ee. Хиральный SFC/MS анализ проводили на Lux Cellulose-1, 4,6×100 мм, 3 мкм нагревали до 25°C и элюировали подвижной фазой CO2 и 5-60% градиента метанола в течение 3,0 мин, протекающей при 4,0 мл/мин и проводили при давлении на выходе 120 бар. Пик продукта имел время удерживания 2,37 мин.
Фильтрат от вышеуказанной кристаллизации концентрировали досуха, остаток растворяли в EtOAc (50 мл), и раствор промывали водн. HCl (0,1 M, 12,4 мл). Органический слой промывали насыщ. водн. NaHCO3 (20 мл), сушили над сульфатом натрия, и концентрировали, с получением второй партии 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (Пример 2, 361 мг, 31%, 94% общий выход), со спектрами ЯМР и LCMS, соответствующими первой партии.
Пример 3: 8-[(1R,3R)-3-гидроксициклогексил]-2-{[1-(метилсульфонил)пиперидин-4-ил]-амино}пиридо[2,3-d]пиримидин-7(8H)-он
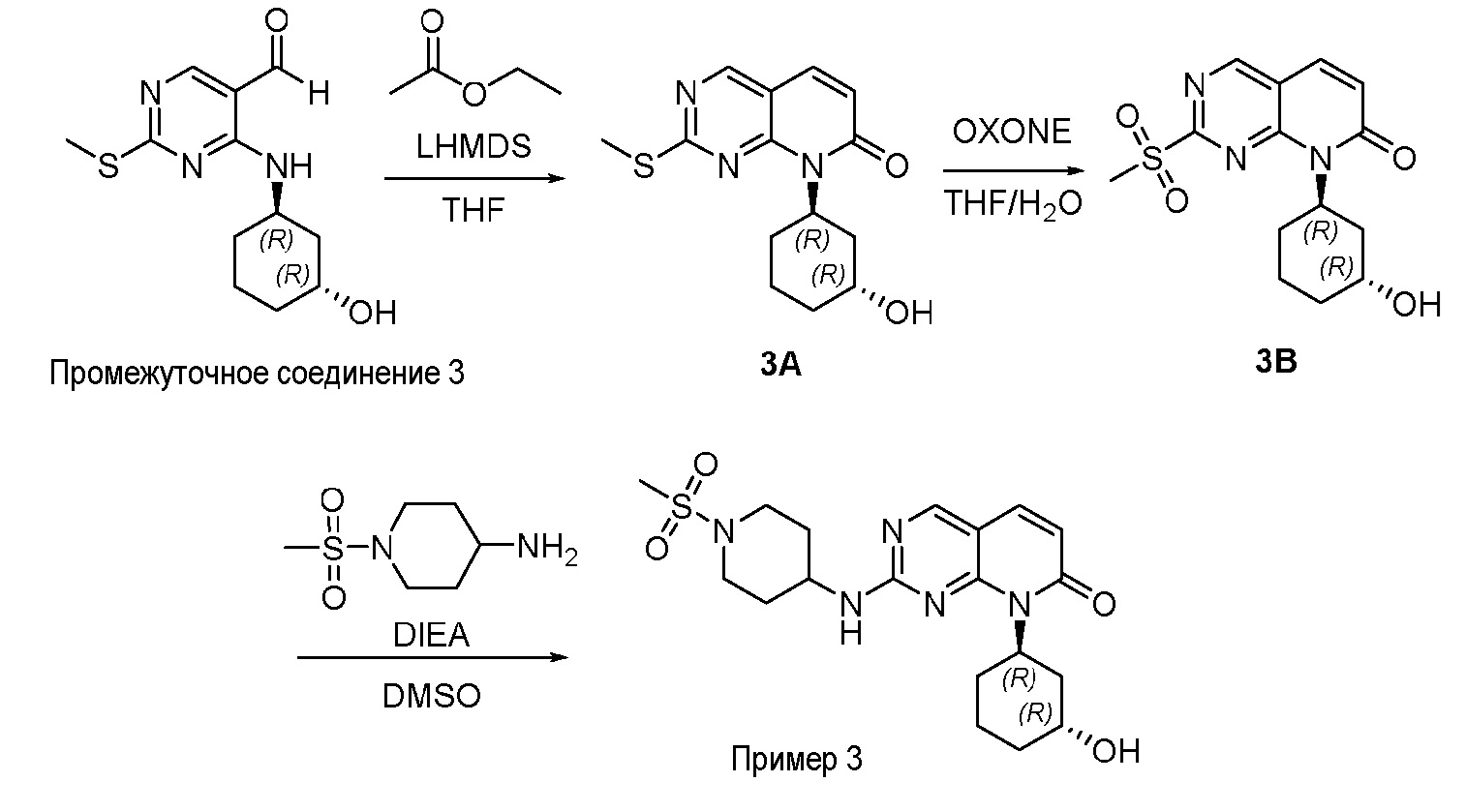
Раствор LHMDS (1,0 M в THF, 60,7 мл, 60,7 ммоль) добавляли по каплям к охлажденному (-70°C) раствору EtOAc (3,56 г, 40,4 ммоль) в THF (40 мл). Смесь перемешивали при 0°C в течение 30 мин, затем добавляли по каплям раствор 4-{[(1R,3R)-3-гидроксициклогексил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 3, 2,70 г, 10,1 ммоль) в THF (10 мл). Когда добавление было завершено, перемешивание продолжали при комнатной температуре в течение 18 ч. Раствор гасили водой (40 мл) и экстрагировали EtOAc (40 мл×3). Объединенные органические экстракты сушили над сульфатом натрия, концентрировали и остаток очищали с помощью хроматографии на силикагеле (элюируя 0-4% MeOH в DCM) с получением 8-[(1R,3R)-3-гидроксициклогексил]-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (3A, 1,46 г, 50%) в виде светло-желтого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,57 (с, 1H), 7,53 (д, J=9,3 Гц, 1H), 6,58 шир.д, J=9,3 Гц, 1H), 6,02 (шир.с, 1H), 4,37 (т, J=2,6 Гц, 1H), 2,97 (шир.с, 1H), 2,66-2,61 (м, 3H), 1,96-1,69 (м, 6H), 1,61 (шир.т, J=13,4 Гц, 2H). MS: 292 [M+H]+. Оптическое вращение: [α]D22 +15,2 (c 1,8, MeOH).
Твердый OXONE® (13,8 г, 22,4 ммоль) порциями добавляли к охлажденному (0°C) раствору 8-[(1R,3R)-3-гидроксициклогексил]-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (3A, 2,18 г, 7,48 ммоль) в THF (30 мл) и воде (20 мл). Смесь перемешивали в течение 2 ч, так как ей позволяли постепенно нагреваться до ~15°C. Раствор разбавляли EtOAc (50 мл) и промывали водой (50 мл). Органический слой сушили над сульфатом натрия и концентрировали с получением ~3:1 смеси сульфон 8-[(1R,3R)-3-гидроксициклогексил]-2-(метилсульфонил)пиридо[2,3-d]пиримидин-7(8H)-она и сульфоксид 8-[(1R,3R)-3-гидроксициклогексил]-2-(метилсульфинил)пиридо[2,3-d]пиримидин-7(8H)-она (3B, 1,80 г, 79%) в виде светло-желтого твердого вещества. MS: 330 [M+Na]+ для сульфоксида; 346 [M+Na]+ для сульфона.
Раствор смеси сульфона/сульфоксида, полученной выше (1,80 г, 5,6 ммоль), 4-амино-1-метансульфонилпиперидина (CAS# 402927-97-3, 2,08 г, 11,7 ммоль) и DIPEA (3,60 г, 34,9 мл) в DMSO (30 мл) перемешивали на масляной бане при 60°C в течение 2 ч, затем при комнатной температуре в течение ночи. Смесь разделяли между DCM (30 мл) и водой (30 мл×2). Органический слой промывали насыщ. водн. NaCl (30 мл), сушили над сульфатом натрия, и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (элюируя 0-3% MeOH в DCM) с получением 8-[(1R,3R)-3-гидроксициклогексил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (пример 3, 2,12 г, 90%) в виде желтого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,38 (с, 1H), 7,41 (д, J=9,3 Гц, 1H), 6,32 шир.д, J=8,3 Гц, 1H), 5,94 шир.д, J=9,0 Гц, 1H), 5,68 (шир.с, 1H), 4,34 (шир.с, 1H), 3,97 (шир.с, 1H), 3,86-3,76 (м, 2H), 3,02-2,86 (м, 3H), 2,86-2,78 (м, 3H), 2,67 шир.д, J=8,5 Гц, 1H), 2,21 шир.д, J=11,5 Гц, 2H), 1,87-1,52 (м, 8H). MS: 444 [M+Na]+. Оптическое вращение: [α]D22 +7,9 (c 0,11, CHCl3). Хиральная чистота: 99% ee. Хиральный SFC/MS анализ проводили на Lux Cellulose-2 4,6×150 мм, 3 мкм нагревали до 40°C и элюировали подвижной фазой CO2 и 40% EtOH (0,05% DEA), протекающей при 2,5 мл/мин. Пик продукта имел время удерживания 5,69 мин.
Пример 4: 4-({6-(2-гидроксиэтил)-8-[(1R,2S)-2-метилциклопентил]-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил}амино)-N-метилпиперидин-1-сульфонамид.
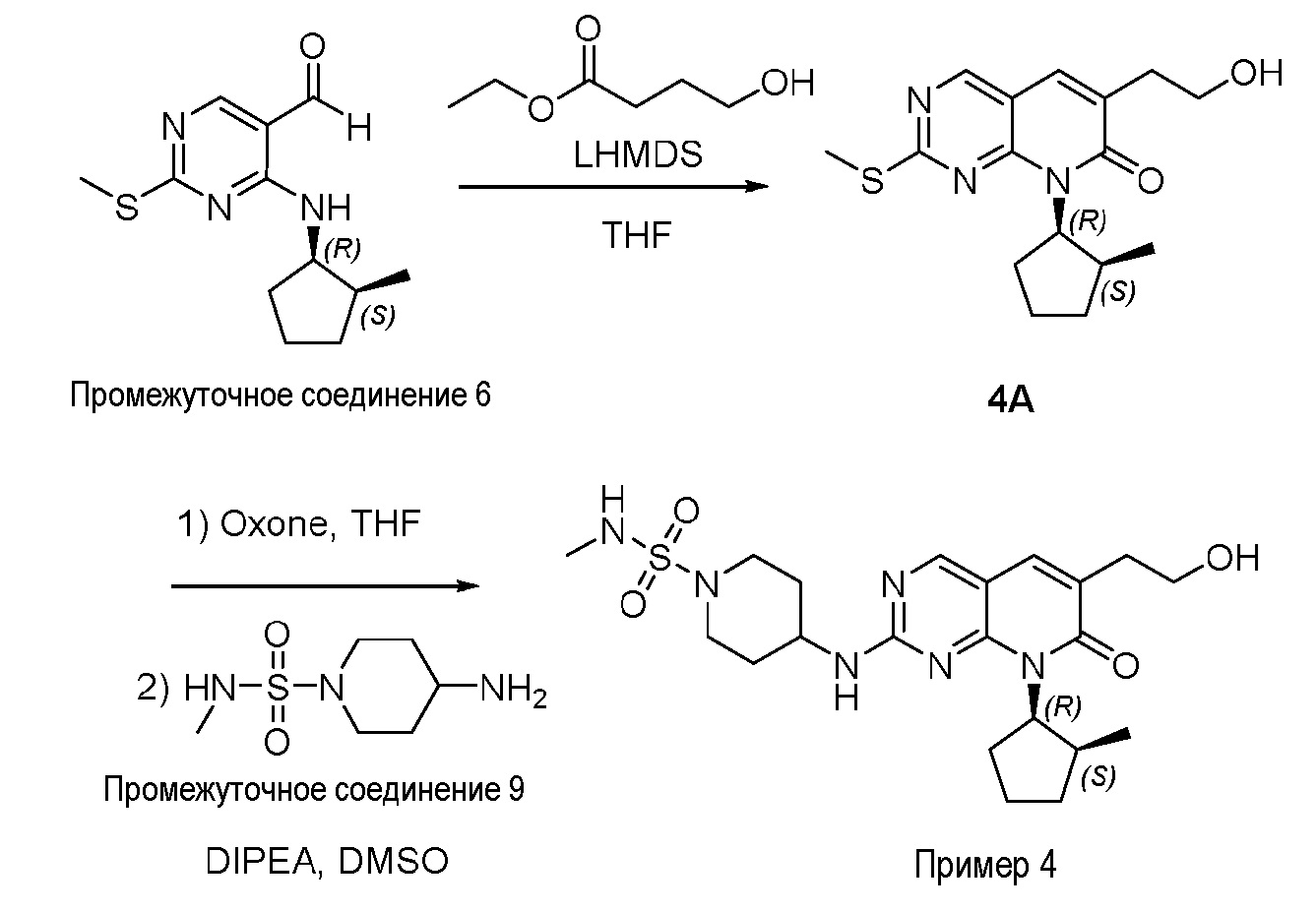
Раствор LHMDS (1,0 M в THF, 3,58 мл, 3,58 ммоль) добавляли по каплям к охлажденному (-78°C) раствору этил γ-гидроксибутирата (237 мг, 1,79 ммоль) в безводном THF (3 мл). Реакционную смесь перемешивали в течение 20 мин, затем раствор 4-{[(1R,2S)-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 6, 150 мг, 0,597 ммоль) в THF (2 мл) добавляли по каплям. Смесь постепенно нагревали до комнатной температуры при перемешивании в течение 18 ч. Реакцию гасили уксусной кислотой (573 мг, 9,55 ммоль) и разделяли между водой и EtOAc. Водный слой дополнительно экстрагировали EtOAc (20 мл×3). Объединенные органические слои промывали насыщ. водн. NaCl, сушили над сульфатом натрия, фильтровали, концентрировали и очищали с помощью хроматографии на силикагеле (элюируя 0-2% MeOH в DCM) с получением 6-(2-гидроксиэтил)-8-[(1R,2S)-2-метилциклопентил]-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (4A, 181 мг, 95%) в виде желтого масла. MS: 320 [M+H]+.
Твердый OXONE® (523 мг, 0,85 ммоль) добавляли к охлажденному (0°C) раствору 6-(2-гидроксиэтил)-8-[(1R,2S)-2-метилциклопентил]-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (4A, 181 мг, 0,567 ммоль) в THF (6 мл) и воде (3 мл). Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли воду (10 мл), и смесь экстрагировали EtOAc (20 мл×3). Объединенные органические вещества промывали насыщ. водн. NaCl, сушили над сульфатом натрия, фильтровали и концентрировали до желтого твердого вещества (178,2 мг). LCMS показала, что это смесь сульфоновых и сульфоксидных продуктов ~4:3. Эту смесь растворяли в DMSO (5 мл), добавляли 4-амино-N-метилпиперидин-1-сульфонамид (промежуточное соединение 9, 147 мг, 0,76 ммоль) и DIPEA (196 мг, 1,52 ммоль), и полученный раствор перемешивали при 85°C в течение 16 ч. После охлаждения до комнатной температуры смесь разделяли между водой (15 мл) и EtOAc (20 мл×3). Объединенные органические вещества промывали насыщ. водн. NaCl (20 мл×3), сушили над сульфатом натрия, фильтровали, концентрировали и очищали с помощью хроматографии на силикагеле (элюируя 0-3% MeOH в DCM). Полученный таким образом материал (182 мг, чистота 81% по данным LCMS) дополнительно очищали с помощью препаративной ВЭЖХ [колонка DuraShell 150×25 мм × 5 мкм; вода (0,05% NH4OH)-ACN] с получением 4-({6-(2-гидроксиэтил)-8-[(1R,2S)-2-метилциклопентил]-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил}амино)-N-метилпиперидин-1-сульфонамида (пример 4, 90 мг, 38%) в виде не совсем белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,37 (с, 1H), 7,36 (с, 1H), 5,97 (кв, J=8,9 Гц, 1H), 4,59-4,45 (м, 1H), 4,08-3,93 (м, 1H), 3,83 (шир.с, 2H), 3,77-3,64 (м, 2H) 3,15-2,92 (м, 1H) 2,80 (т, J=5,8 Гц, 2H), 2,74 (д, J=5,5 Гц, 3H), 2,72-2,60 (м, 1H), 2,41-2,27 (м, 1H), 2,19-2,10 (м, 2H), 2,09-1,99 (м, 1H), 1,86 (д, J=11,8 Гц, 1H), 1,73-1,47 (м, 3H), 0,75 (д, J=7,0 Гц, 3H). MS: 465 [M+H]+. Оптическое вращение: [α]D22 -10,3 (c 0,5 MeOH). Хиральная чистота: >99% ee. Хиральный SFC/MS анализ проводили на Chiracel OD-3 4,6×100 мм, 3 мкм нагревали до 40°C и элюировали подвижной фазой CO2 и градиентом o 5-40% EtOH (0,05%DEA) в течение 5,5 мин, протекающей при 2,8 мл/мин. Поток при 40% EtOH (0,05% DEA) продолжали в течение 2,5 минут, чтобы элюировать любые оставшиеся противоионы. Пик продукта имел время удерживания 4,049 мин.
Способ B (циклизация Виттига)
Пример 5: (+)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
Пример 6: (-)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
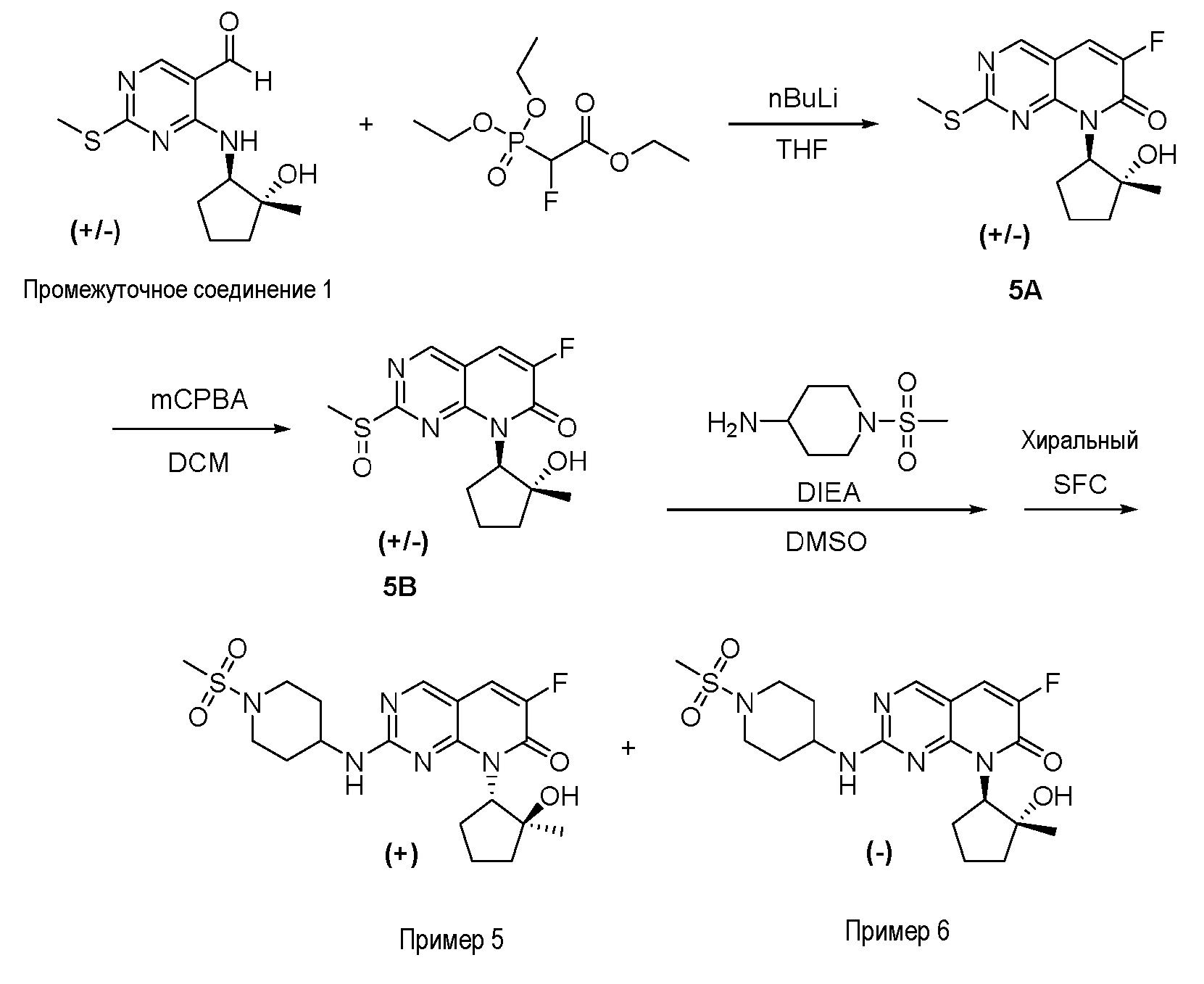
К охлажденному (-70°C) раствору этил (диэтоксифосфорил)(фтор)ацетата (407 мкл, 2 ммоль) в THF (15 мл) в атмосфере азота добавляли по каплям n-BuLi (1,6 M в гексанах, 1,9 мл, 3 ммоль), затем смесь перемешивали при -70°C в течение 40 мин. К этому раствору добавляли раствор (±)-4-{[(1R*,2R*)-2-гидрокси-2-метилциклопентил]амино}-2-(метилсульфанил)пиримидин-5-карбальдегида (промежуточное соединение 1, 267 мг, 1 ммоль) в THF (5 мл). Смесь перемешивали и оставляли постепенно нагреваться до комнатной температуры в течение ночи. Затем раствор охлаждали на ледяной бане, добавляли EtOH (2 мл), затем насыщ. водн. NaHCO3 (10 мл) и EtOAc (80 мл). Слои разделяли, органический слой сушили над сульфатом натрия, концентрировали досуха, и остаток очищали с помощью хроматографии на силикагеле (элюируя 40% гептан/60% EtOAc) с получением (±)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (5A, 218 мг, 71%). 1H ЯМР (400 MГц, CDCl3) δ=8,64 (с, 1H), 7,30 (д, J=7,5 Гц, 1H), 5,94 (т, J=8,4 Гц, 1H), 2,87-2,72 (м, 1H), 2,65 (с, 3H), 2,36-2,25 (м, 1H), 2,18-2,07 (м, 2H), 2,02-1,92 (м, 1H), 1,91-1,83 (м, 1H), 1,37 (тд, J=6,9, 13,9 Гц, 1H), 1,17 (с, 3H). 19F ЯМР (377 MГц, CDCl3) δ= -125,5 (с, 1F). MS: 310 [M+H]+.
К раствору (±)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-(метилсульфанил)пиридо[2,3-d]пиримидин-7(8H)-она (5A, 374 мг, 1,2 ммоль) в DCM (30 мл) добавляли mCPBA (70%, 313 мг, 1,27 ммоль) в одной порции. Полученную смесь перемешивали при комнатной температуре в течение 30 мин. Летучие вещества удаляли при пониженном давлении с получением неочищенного (±)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-(метилсульфинил)-пиридо-[2,3-d]пиримидин-7(8H)-она (5B), который использовали непосредственно без дальнейшей очистки на следующей стадии. MS: 308 [M+H]+.
К вышеуказанному неочищенному (±)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-(метилсульфинил)пиридо[2,3-d]пиримидин-7(8H)-ону (5B, ~1,2 ммоль) добавляли DMSO (5 мл), 4-амино-1-метансульфонилпиперидин (CAS# 402927-97-3, 237 мг, 1,33 ммоль) и DIPEA (0,42 мл, 2,42 ммоль). Смесь перемешивали при 60°C (температура масляной бани) в атмосфере азота в течение 2 ч. Добавляли уксусную кислоту (69 мкл), и всю реакционную смесь очищали хиральной препаративной SFC на колонке Chiralpak AD-H 30 мм×250 мм при 40°C и элюировали подвижной фазой 42% MeOH w/0,05% диэтиламин (об:об) в CO2, поддерживаемом при 100 бар, протекающей при 90 мл/мин, с использованием УФ-детектирования при 340 нм. После лиофилизации фракций продукта, пример 5 (пик 1, 178 мг, 34%, >99% ee) и пример 6 (пик 2, 193 мг, 36%, ~98% ee) получали в виде не совсем белых твердых веществ. Абсолютная стереохимия каждого изомера не была определена, но были получены измерения оптического вращения.
Пример 5: (+)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он. 1H ЯМР (700 MГц, DMSO-d6) δ=8,59 (шир.с, 1H), 7,85 (шир.с, 1H), 7,69 (д, J=7,0 Гц, 1H), 5,89 (шир.с, 1H), 4,41 (шир.с, 1H), 4,09-3,78 (м, 1H), 3,68-3,44 (м, 2H), 3,01-2,69 (м, 6H), 2,17 (шир.с, 2H), 1,96 (шир.с, 2H), 1,90-1,77 (м, 2H), 1,73-1,41 (м, 3H), 0,98 (шир.с, 3H). 19F ЯМР (377MГц, DMSO-d6) δ= -134,1 до -138,0 (м, 1F). MS 440 [M+H]+. Оптическое вращение: [α]D22= +18,5 (c 0,1, CHCl3). Хиральная чистота: >99% ee. Хиральный SFC/MS анализ проводили на колонке Chiralpak AD-3 4,6 мм×100 мм при комнатной температуре, элюировали подвижной фазой 70% CO2/30% MeOH, проводили при 120 бар, и протекающей со скоростью 4,0 мл/мин. Этот пик имел время удерживания 1,33 мин.
Пример 6: (-)-6-фтор-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он. 1H ЯМР (700 MГц, DMSO-d6) δ=8,59 (шир.с, 1H), 7,84 (шир.с, 1H), 7,72-7,58 (м, 1H), 5,89 (шир.с, 1H), 4,42 (шир.с, 1H), 4,06-3,84 (м, 1H), 3,63-3,48 (м, 2H), 2,96-2,73 (м, 6H), 2,40-2,12 (м, 2H), 1,96 (шир.с, 2H), 1,87 (шир.с, 2H), 1,73-1,41 (м, 3H), 0,97 (шир.с, 3H). 19F ЯМР (377MГц, DMSO-d6) δ=-136,0 (д, J=144,2 Гц, 1F). MS: 440 [M+H]+. Оптическое вращение: α]D22= -15,9 (c 0,2, CHCl3). Хиральная чистота: ~98% ee. Хиральный SFC/MS анализ проводили на колонке Chiralpak AD-3 4,6 мм×100 мм при комнатной температуре, элюировали подвижной фазой 70% CO2/30% MeOH, проводили при 120 бар и протекающей со скоростью 4,0 мл/мин. Этот пик имел время удерживания 2,47 мин.
Способ C (сочетание/циклизация Хека)
Пример 7: (+)-6-(2,2-дифторэтил)-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он.
Пример 8: (-)-6-(2,2-дифторэтил)-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он.
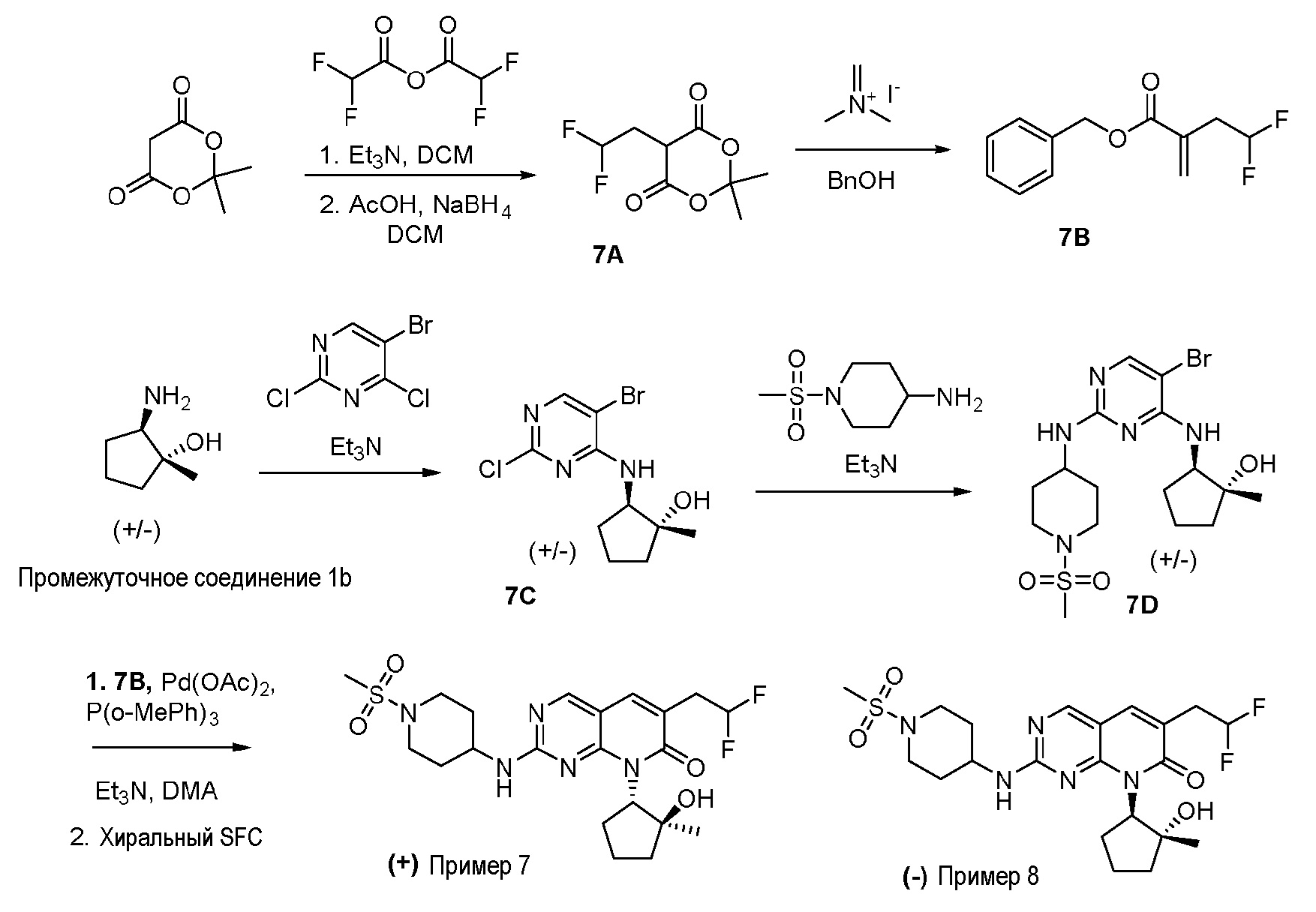
К раствору 2,2-диметил-1,3-диоксан-4,6-диона (кислота Мельдрума, 3,76 г, 26,1 ммоль) в DCM (100 мл) при 0°C добавляли дифторуксусный ангидрид (3,25 мл, 26 ммоль), затем триэтиламин (9,09 мл, 65,2 ммоль). Охлаждающую баню убирали и перемешивание продолжали при комнатной температуре в течение 3 ч. Реакционную смесь выливали в делительную воронку, промывали 6 н HCl и насыщ. водн. NaCl, сушили над MgSO4 и фильтровали. Фильтрат охлаждали до 0°C и подкисляли уксусной кислотой (16,4 мл, 287 ммоль). К этой смеси затем добавляли боргидрид натрия (2,17 г, 57,4 ммоль) тремя порциями в течение 0,5 ч. Реакционную смесь оставляли стоять при 4°С в течение ночи, затем гасили насыщением. водн. NaCl и энергично перемешивали в течение 0,5 ч. Добавляли дополнительное количество воды для растворения твердых веществ и слои разделяли. Органический слой промывали насыщ. водн. NaCl и концентрировали с получением 5-(2,2-дифторэтил)-2,2-диметил-1,3-диоксан-4,6-диона (7A, 2,78 г, 51%) в виде светло-желтого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=6,50-6,17 (м, 1H), 3,70 (т, J=6,2 Гц, 1H), 2,64 (ддт, J=5,1, 6,1, 15,6 Гц, 2H), 1,86 (с, 3H), 1,81 (с, 3H).
Суспензию 5-(2,2-дифторэтил)-2,2-диметил-1,3-диоксан-4,6-диона (7A, 2,78 г, 12,51 ммоль) в бензиловом спирте (10 мл, 97 ммоль) обрабатывали N,N-диметилметилениминий йодидом (Соль Эшенмозера, 5,86 г, 31,7 ммоль) и нагревали при 65°С в течение 6 ч. Смесь выливали в MTBE и промывали водой (2 x) и насыщ. водн. NaCl. Органический слой концентрировали и очищали с помощью хроматографии на силикагеле (элюируя 0-20% EtOAc в гептане) с получением бензил 4,4-дифтор-2-метилиденбутаноата (7B, 2,52 г, 89%) в виде чистого масла. 1H ЯМР (400 MГц, CDCl3) δ=7,40-7,35 (м, 5H), 6,44 (с, 1H), 5,84 (с, 1H), 6,01 (тт, J=4,8, 56,9 Гц, 1H), 5,23 (с, 2H), 2,95-2,83 (м, 2H).
К раствору 2,4-дихлор-5-бром пиримидина (0,735 г, 3,23 ммоль) в ACN (20 мл) добавляли (±)-(1R*,2R*)-2-амино-1-метилциклопентанол (промежуточное соединение 1b, 0,400 г, 3,47 ммоль) и триэтиламин (0,50 мл, 3,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, и затем концентрировали в вакууме. Полученное твердое вещество очищали с помощью хроматографии на силикагеле (элюируя 20-70% EtOAc в гептане) с получением (±)-(1R*,2R*)-2-[(5-бром-2-хлорпиримидин-4-ил)амино]-1-метилциклопентанола (7C, 0,774 г, 78%) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,18 (с, 1H), 5,48 (шир.с, 1H), 4,28 (с, 1H), 4,23 (ддд, J=5,7, 8,1, 10,1 Гц, 1H), 2,36-2,26 (м, 1H), 2,05-1,98 (м, 1H), 1,93-1,69 (м, 3H), 1,63-1,52 (м, 1H), 1,16 (с, 3H). MS: 306, 308 [M+H]+ (Br+Cl изотопное расщепление).
К раствору (±)-(1R*,2R*)-2-[(5-бром-2-хлорпиримидин-4-ил)амино]-1-метилциклопентанола (7C, 300 мг, 0,978 ммоль) в DMSO (0,80 мл) добавляли 4-амино-1-метансульфонилпиперидин (CAS# 402927-97-3, 250 мг, 1,40 ммоль) и DIPEA (0,20 мл, 1,15 ммоль). Смесь нагревали при 100°C в течение 6 ч и до 110°С в течение еще 6 ч. Реакционную смесь разбавляли DCM и промывали водой. Водный слой экстрагировали DCM, и объединенные органические слои концентрировали и очищали с помощью хроматографии на силикагеле (элюируя 50-90% EtOAc в гептане) с получением (±)-(1R*,2R*)-2-[(5-бром-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиримидин-4-ил)амино]-1-метилциклопентанола (7D, 0,264 г, 60%) в виде белого твердого вещества. MS; 448, 450 [M+H]+ (Br изотопное расщепление).
Раствор бензил 4,4-дифтор-2-метилиденбутаноата (7B, 2,20 г, 9,72 ммоль), (±)-(1R*,2R*)-2-[(5-бром-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиримидин-4-ил)амино]-1-метилциклопентанола (7D, 235 мг, 0,524 ммоль), и триэтиламина (0,290 мл, 2,10 ммоль) в DMA (5,00 мл) дегазировали путем барботирования азотом в течение 15 мин. Добавляли ацетат палладия (II) (23,5 мг, 0,105 ммоль) и три(о-толил)фосфин (63,8 мг, 0,210 ммоль) и реакционную смесь нагревали при 100°С в течение 3 ч. После охлаждения раствора до комнатной температуры добавляли MeOH (1,00 мл), DBU (1,0 мл, 6,4 ммоль) и тиометоксид натрия (65 мг, 0,93 ммоль) и реакционную смесь нагревали при 60°C в течение 2 ч. Полученную смесь концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (элюируя 0-10% MeOH в DCM). Полученное темное масло дополнительно очищали препаративной SFC на колонке Nacalai Cosmosil 3-гидроксифенильная связь (20×150 мм внутр.диам., размер частиц 5 мкм) при скорости потока 60 мл/мин и градиенте 15-25% метанол в CO2 при 3%/мин, при давлении, установленном на 100 бар. Рацемическую смесь разделяли с помощью препаративной SFC на колонке Chiralpak AD-H (250×21 мм внутр.диам., размер частиц 5 мкм) с 26% метанола в CO2 при скорости потока 60 мл/мин и при давлении, установленном на 100 бар, с получением примера 7 (пик 1, 18,54 мг, 7,2%, >99% ee) и примера 8 (пик 2, 19,56 мг, 7,7%, >99% ee) в виде белых порошков. Абсолютная стереохимия каждого изомера не была определена, но были получены измерения оптического вращения.
Пример 7: (+)-6-(2,2-дифторэтил)-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он. 1H ЯМР (400 MГц, DMSO-d6, 80°C) δ=8,58 (с, 1H), 7,70 (с, 1H), 7,48 (шир.с, 1H), 6,19 (тд, J=5,1, 57,2 Гц, 1H), 5,89 (т, J=8,6 Гц, 1H), 4,04 (с, 1H), 3,99 (шир.с, 1H), 3,68-3,55 (м, 2H), 3,10-2,99 (м, 2H), 2,87 (с, 3H), 2,97-2,84 (м, 2H), 2,29-2,17 (м, 1H), 2,14-1,83 (м, 5H), 1,76-1,53 (м, 3H), 1,00 (с, 3H). 19F ЯМР (377 MГц, DMSO-d6) δ= -114,9 до -114,2 (м, 2F). MS; 486 [M+H]+. Оптическое вращение: [α]D22 +31,9° (c 0,1, MeOH). Хиральная чистота: >99% ee. Хиральный SFC/MS анализ проводили на колонке Chiralpak AD-3 (100×4,6 мм Внут.Диам., 3 мкм), элюируя 30% метанола в CO2 и давление установлено на 120 бар, протекающей при 4,0 мл/мин. Этот пик имел время удерживания 0,91 мин
Пример 8: (-)-6-(2,2-дифторэтил)-8-[(1R*,2R*)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он. 1H ЯМР (400 MГц, DMSO-d6, 80°C) δ=8,58 (с, 1H), 7,70 (с, 1H), 7,47 (шир.с, 1H), 6,19 (тд, J=4,8, 57,1 Гц, 1H), 5,89 (т, J=8,3 Гц, 1H), 4,04 (с, 1H), 4,02-3,93 (м, 1H), 3,68-3,55 (м, 2H), 3,10-2,99 (м, 2H), 2,87 (с, 3H), 2,98-2,81 (м, 2H), 2,29-2,17 (м, 1H), 2,14-1,82 (м, 5H), 1,76-1,50 (м, 3H), 1,00 (с, 3H). 19F ЯМР (377 MГц, DMSO-d6) δ= -114,6 до -114,4 (м, 2F). MS; 486 [M+H]+. Оптическое вращение: [α]D22 -19,3 (c 0,1, MeOH). Хиральная чистота: >99% ee;. Хиральный SFC/MS анализ проводили на колонке Chiralpak AD-3 (100×4,6 мм Внут.Диам., 3 мкм), элюируя 30% метанолом в CO2 и давление устанавливали на 120 бар, протекающей при 4,0 мл/мин. Этот пик имел время удерживания 1,615 мин.
Способ D (Хлорирование по С-6 после циклизации)
Пример 9: 6-хлор-8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)-пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он.
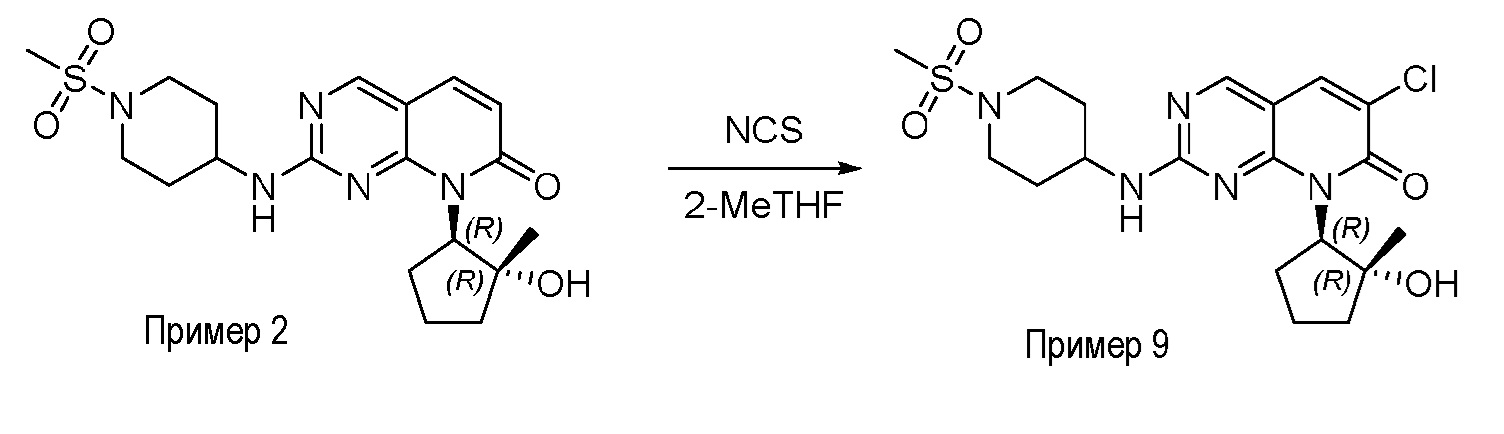
Раствор 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)-пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (пример 2, 4,22 г, 10 ммоль) и NCS (1,53 г, 11 ммоль) в 2-MeTHF (100 мл) перемешивали на масляной бане при 50°C в течение 44 ч. После охлаждения до комнатной температуры, добавляли EtOH (1,75 мл, 30 ммоль) и смесь перемешивали при комнатной температуре в течение 1 ч. Раствор разбавляли EtOAc (120 мл) и промывали смесью воды (15 мл) и насыщ. водн. NaHCO3 (15 мл). Водный слой дополнительно экстрагировали EtOAc (80 мл). Объединенные органические слои промывали насыщ. водн. NaCl (15 мл), сушили над сульфатом натрия, фильтровали и концентрировали досуха. Этанол (45 мл) добавляли к остатку, и полученную суспензию перемешивали на масляной бане при 55°C в течение 1 ч, затем давали постепенно остыть при перемешивании до комнатной температуры в течение ночи. Полученное белое твердое вещество собирали фильтрованием, промывали EtOH (3 мл), и сушили в вакууме (~10 мм рт.ст., 50°C) с получением 6-хлор-8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (пример 9, 3,86 г, 84%) в виде белого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6, 20°C) δ=8,71-8,54 (м, 1H), 8,09 (с, 1H), 8,05-7,65 (м, 1H), 5,91 (т, J=8,2 Гц, 1H), 4,46-4,28 (м, 1H), 4,03-3,81 (м, 1H), 3,65-3,48 (м, 2H), 2,98-2,77 (м, 5H), 2,46-2,27 (м, 1H), 2,18 (д, J=10,3 Гц, 2H), 1,99-1,77 (м, 4H), 1,75-1,37 (м, 3H), 0,96 (шир.с, 3H). 1H ЯМР (400 MГц, DMSO-d6, 80°C) δ=8,60 (с, 1H), 8,02 (с, 1H), 7,61 (шир.с, 1H), 5,91 (дд, J=7,4, 9,2 Гц, 1H), 4,09 (с, 1H), 4,04-3,94 (м, 1H), 3,70-3,49 (м, 2H), 2,97-2,88 (м, 2H), 2,87 (с, 3H), 2,48-2,42 (м, 1H), 2,20 (дт, J=8,1, 11,4 Гц, 1H), 2,09 (д, J=12,3 Гц, 1H), 2,05-1,96 (м, 2H), 1,96-1,84 (м, 2H), 1,79-1,66 (м, 2H), 1,65-1,51 (м, 1H), 1,01 (с, 3H). MS: 456/458 (изотопный патерн Cl) [M+H]+. Оптическое вращение: [α]D22 -31,4 (c 0,4, MeOH). Хиральный анализ: >99% ee. Хиральный SFC/MS анализ проводили на Phenomenex Lux Cellulose-1 4,6×100 мм 3 мкм колонка при комнатной температуре и элюировали подвижной фазой 30% MeOH в CO2 и проводили при давлении на выходе 120 бар, протекающей при 4 мл/мин. Пик продукта имел время удерживания 1,52 мин.
Способ E (ди- и трифторметилирование по C-6 после циклизации)
Пример 10:,6-(дифторметил)-8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
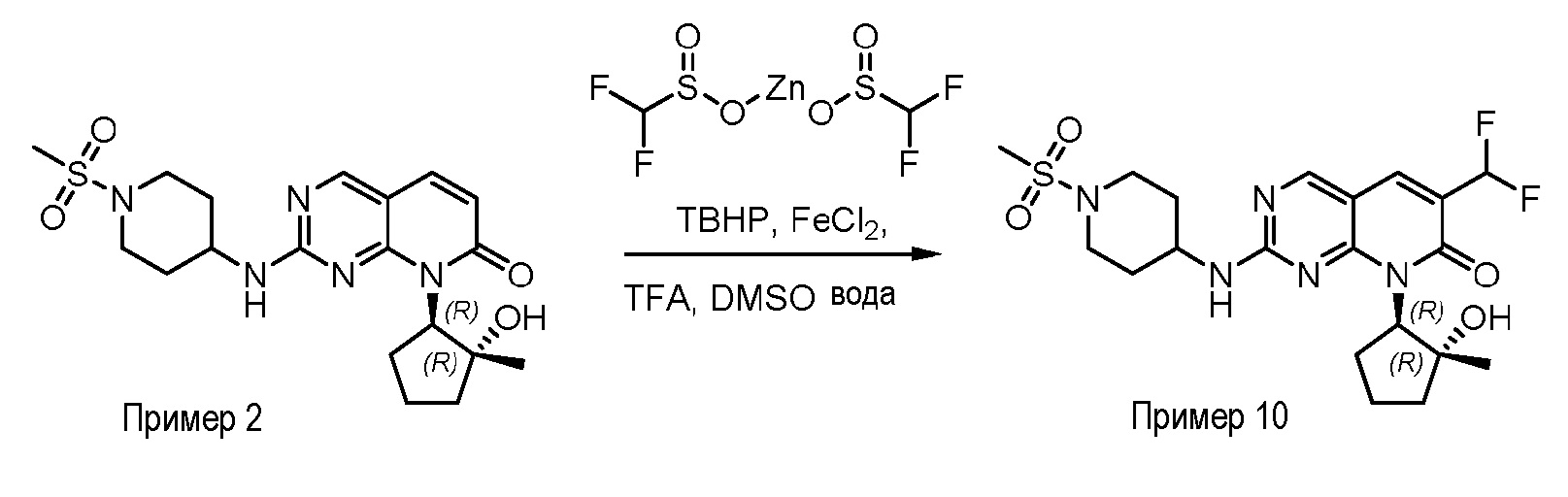
Раствор цинк дифторметансульфината (3,34 г, 11,4 ммоль) и хлорид железа (II) (377 мг, 1,90 ммоль) в воде (10 мл) добавляли порциями к раствору 8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (Пример 2, 1,60 г, 3,80 ммоль) и TFA (0,290 мл, 3,80 ммоль) в DMSO (60 мл) при комнатной температуре. Полученную смесь обработали TBHP (70% масс. раствор в воде, 0,400 мл, 342 мг, 3,80 ммоль), вызывая небольшое повышение внутренней температуры до 32°C. Перемешивание продолжали при комнатной температуре в течение 19 ч, после чего LCMS показала ~30% превращения. Добавляли вторую часть раствора TBHP (0,400 мл, 342 мг, 3,80 ммоль и перемешивание продолжали в течение 3 ч. Добавляли третью часть раствора TBHP (0,400 мл, 342 мг, 3,80 ммоль) и перемешивание продолжали при комнатной температуре в течение 45 мин, после чего LCMS показала ~50% превращения. Добавляли еще цинк дифторметансульфинат (1,1 г, 3,7 ммоль) и TBHP раствор (0,400 мл, 342 мг, 3,80 ммоль) и смесь перемешивали при комнатной температуре в течение 20 ч. После чего, LCMS показала ~90% превращения. Реакционный раствор выливали в смесь 10% водного раствора натрий EDTA/лед, и экстрагировали EtOAc (50 мл). Водный слой насыщали NaCl и дополнительно экстрагировали EtOAc (50 мл×3). Объединенные органические вещества промывали разбавленным водн. натрий EDTA (50 мл) и насыщ. водн. NaCl (50 мл). Темно-синий органический слой обрабатывали активированным углем и сульфатом натрия, фильтровали и упаривали досуха. Остаток (1,49 г пены) очищали с помощью препаративной SFC (колонка диол/монол с MeOH/CO2) с получением 6-(дифторметил)-8-[(1R,2R)-2-гидрокси-2-метилциклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (пример 10, 568 мг, 32%) в виде белого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=8,72 (с, 1H), 8,03 (с, 1H), 7,76 (шир.с, 1H), 7,00-6,50 (м, 1H), 5,87 (т, J=8,3 Гц, 1H), 4,08 (с, 1H), 4,06-3,89 (м, 1H), 3,62 (т, J=11,7 Гц, 2H), 2,98-2,89 (м, 2H), 2,87 (с, 3H), 2,57-2,51 (м, 1H), 2,27-2,14 (м, 1H), 2,10 (д, J=9,4 Гц, 1H), 2,04-1,93 (м, 2H), 1,93-1,80 (м, 2H), 1,76-1,69 (м, 2H), 1,69-1,55 (м, 1H), 1,03 (с, 3H), 19F ЯМР (377 MГц, DMSO-d6) δ= -125,7 до -113,3 (м, 2F). 13C ЯМР (101 MГц, DMSO-d6) сдвиг 159,5, 159,2, 154,9, 133,4, 110,3, 102,6, 102,0, 78,9, 61,5, 45,8, 43,0, 42,8, 40,2, 32,9, 28,5, 25,1, 22,2, 21,8. MS: 472 [M+H]+. Оптическое вращение: [α]D22 -35,8 (c 0,7, MeOH); [α]D22 -25,3 (c 0,6, CHCl3). Хиральный SFC анализ: >99% ee. Время удерживания 2,78 мин на колонка Phenomenex Lux Cellulose-1 4,6×100 мм 3 мк (температура окружающей среды); подвижная фаза: 15% MeOH в CO2, 120 бар, 4 мл/мин.
Пример 133: (-)-6-(дифторметил)-8-[(1R*,3R*)-3-гидроксициклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
Пример 134: (+)-6-(дифторметил)-8-[(1R*,3R*)-3-гидроксициклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
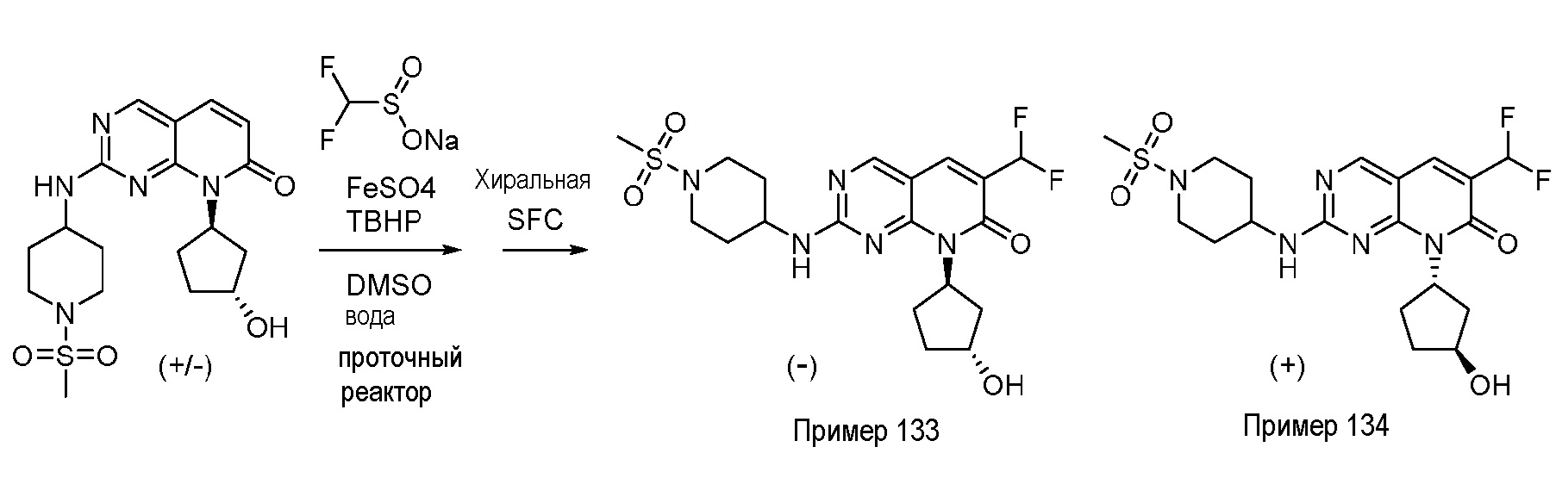
В проточном реакторе, настроенном по схеме ниже, получали следующие растворы и пропускали через соответствующие смесительные клапаны со скоростью 1 мл/мин: трет-бутилгидропероксид (TBHP, 0,632 г, 4,91 ммоль, 0,675 мл) в 29 мл DMSO; дифторметансульфинат натрия (882 мг, 6,39 ммоль) и сульфат железа (11,2 мг, 0,0737 ммоль) в 3 мл воды+27 мл DMSO; и (±)-8-[3-гидроксициклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он (синтезируется из промежуточного соединения 8 по способу 1, 500 мг, 1,23 ммоль) в 30 мл DMSO.
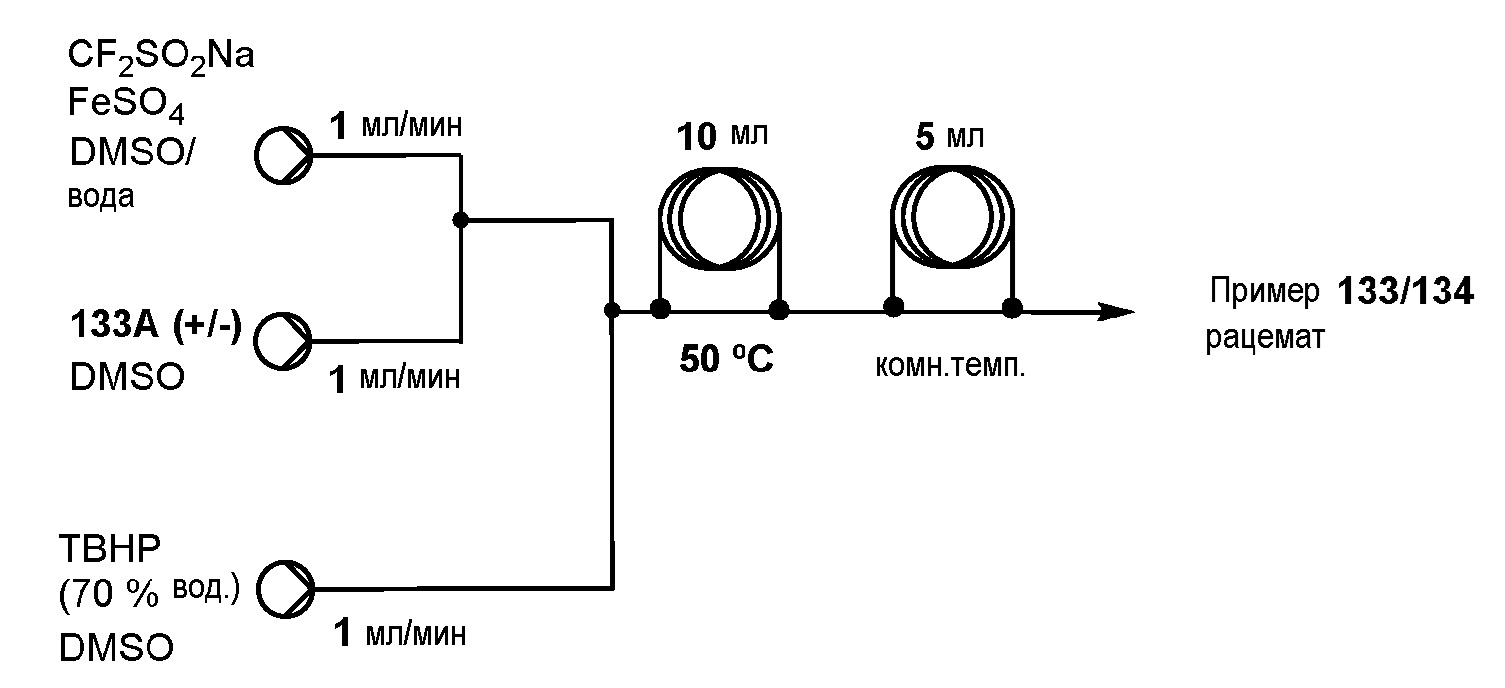
Раствор DMSO, содержащий смесь продуктов, собирали в один флакон. После того как раствор субстрата был израсходован, смесь продукта вылили в раствор этилендиаминтетрауксусной кислоты (1,080 г, 3,68 ммоль) и бикарбоната натрия (2,4 г, 28,57 ммоль) в 150 мл воды и льда, и полученный раствор экстрагировали этилацетатом (3×100 мл). Органические вещества объединяли, промывали насыщенным солевым раствором (3×100 мл), сушили над сульфатом натрия и упаривали. Неочищенный концентрат загружали в колонку с силикагелем и элюировали смесью этилацетат/гептан 0-80%. Фракции, содержащие продукт, объединяли и упаривали с получением желтого твердого вещества. Энантиомеры разделяли с помощью SFC с использованием колонки ChiralPak AD-H 21×250 мм при 40°C, элюировали 20% IPA в CO2 и проводили при 120 бар при скорости потока 85 мл/мин.
Пример 133: (-)-6-(дифторметил)-8-[(1R*,3R*)-3-гидроксициклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он (82 мг, 15%) белое твердое вещество. 1H ЯМР (400 MГц, DMSO-d6) δ=8,76 (д, J=18,8 Гц, 1H), 8,06 (с, 1H), 8,21-7,98 (м, 1H), 6,87 (т, J=55,5 Гц, 1H), 6,23-6,02 (м, 1H), 4,64-4,50 (м, 1H), 4,43 (шир. с., 1H), 4,12-3,83 (м, 1H), 3,65-3,52 (м, J=6,6 Гц, 2H), 2,94-2,81 (м, 5H), 2,42-2,10 (м, 2H), 2,09-1,87 (м, 3H), 1,75-1,52 (м, 4H). 19F ЯМР (376 MГц, DMSO-d6) δ= -120,0 до -115,8 (м, 2F). MS: 485 [M+H]+, Оптическое вращение [α]D22 -15,6 (c 0,1, MeOH); >99% ee. Время удерживания 1,828 мин в колонке ChiralPak AD-3 4,6×100 мм 3 мкм, подвижная фаза 20% IPA; 120 бар при 4 мл/мин.
Пример 134: (+)-6-(дифторметил)-8-[(1R*,3R*)-3-гидроксициклопентил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он (76 мг, 14%) белое твердое вещество. 1H ЯМР (400 MГц, DMSO-d6) δ=8,76 (д, J=18,7 Гц, 1H), 8,06 (с, 1H), 8,22-7,97 (м, 1H), 6,87 (т, J=55,3 Гц, 1H), 6,21-6,01 (м, 1H), 4,64-4,51 (м, 1H), 4,43 (шир. С., 1H), 4,13-3,83 (м, 1H), 3,63-3,52 (м, J=5,9 Гц, 2H), 2,92-2,81 (м, 5H), 2,41-2,13 (м, 2H), 2,11-1,89 (м, 3H),1,75-1,53 (м, 4H). 19F ЯМР (376 MГц, DMSO-d6) δ= -121,8 до -115,6 (м, 2F). MS: 485 [M+H]+, Оптическое вращение [α]D22 +14,8 (c 0,1, MeOH); >99% ee. Время удерживания 3,08 мин в колонке ChiralPak AD-3 4,6×100 мм 3 мкм, подвижная фаза 20% IPA; 120 бар при 4 мл/мин
Способ F (Постциклизационное амидирование и дегидратация до нитрила)
Пример 135: (8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)ацетонитрил
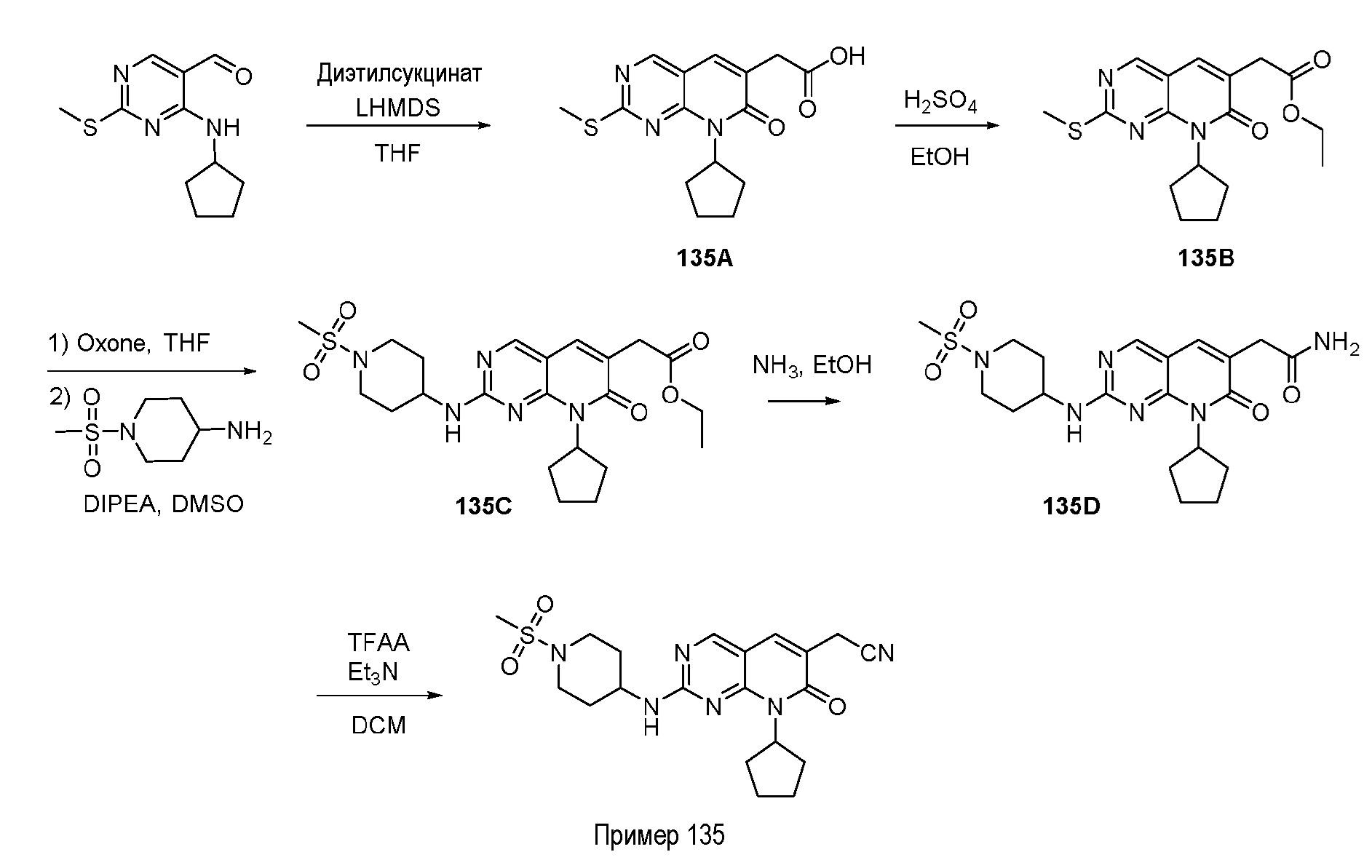
Диэтилсукцинат (6,61 г, 37,9 ммоль) добавляли по каплям к охлажденному (-70°C) раствору LiHMDS (1,0 M в THF, 75,8 мл, 75,8 ммоль) в THF (100 мл). После перемешивания в течение 10 минут, добавляли раствор 4-(циклопентиламино)-2-(метилсульфанил)пиримидин-5-карбальдегида [VanderWel, et al. J. Med. Chem. 2005, 48, 2371] (6,00 г, 25,3 ммоль) в THF (40 мл) и смесь перемешивали при -70°C в течение 30 минут. Раствор оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Смесь разделяли между водой (100 мл) и EtOAc (200 мл), и водный слой дополнительно экстрагировали EtOAc (2×50 мл). Продукт не был обнаружен в объединенных органических слоях по данным TLC. Водный слой подкисляли до pH 2 с помощью конц.HCl. Полученный осадок собирали фильтрованием с отсасыванием, промывали водой и петролейным эфиром, сушили в вакууме, и затем очищали с помощью хроматографии на силикагеле (элюируя 2-5% MeOH в DCM) с получением 2-(8-циклопентил-2-(метилтио)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)уксусной кислоты (135A, 5,00 г, 62%) в виде желтого твердого вещества.
Суспензию 2-(8-циклопентил-2-(метилтио)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)уксусной кислоты (135A, 5,00 г, 15,7 ммоль) в EtOH (80 мл) обрабатывали конц. серной кислотой (5 мл) и нагревали до 80°C в течение 18 ч, с получением прозрачного желтого раствора. После охлаждения до комнатной температуры, раствор концентрировали досуха, остаток растворяли в DCM (100 мл), и подщелачивали до pH ~8 насыщ. водн. Na2CO3. Слои разделяли и водный слой дополнительно экстрагировали DCM (2×50 мл). Объединенные органические вещества сушили над сульфатом натрия, фильтровали, концентрировали и очищали с помощью хроматографии на силикагеле (элюируя 0-20% EtOAc в DCM) с получением этил 2-(8-циклопентил-2-(метилтио)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)ацетата (135B, 4,90 г, 90%) в виде желтого твердого вещества.
По способу примера 1, 135B использовали для получения этил 2-(8-циклопентил-2-((1-(метилсульфонил)пиперидин-4-ил)амино)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)ацетата (135C, ~87% чистота) в виде неочищенной желтой камеди. Образец этой неочищенной камеди (150 мг, 0,31 ммоль) растворяли в метаноле (6 мл), и безводный газообразный аммиак барботировали в течение 10 минут. Смесь перемешивали при 80°C в течение ночи. После охлаждения до комнатной температуры, растворитель выпаривали, и остаток очищали с помощью препаративной ВЭЖХ [колонка: DuraShell 150*25 мм*5 мкм; подвижная фаза: от 25% ACN в воде (0,05% гидроксид аммония об/об) до 45% ACN в H2O(0,05% гидроксид аммония об/об)] с получением 2-(8-циклопентил-2-((1-(метилсульфонил)-пиперидин-4-ил)амино)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)ацетамида (135D, 40 мг, 28%) в виде белого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=8,59 (с., 1H), 7,85-7,49 (м, 2H), 7,35 (с., 1H), 6,86 (с., 1H), 5,93-5,75 (м, 1H), 4,07-3,80 (м, 1H), 3,57 (д, J=11,0 Гц, 2H), 3,25 (с, 2H), 2,93-2,82 (м, 5H), 2,17 (м, 2H), 1,98 (м, 4H), 1,79-1,55 (м, 6H). MS: 448,9 [M+H]+.
Вторую партию (135C, 260 мг, 0,54 ммоль), в этаноле (120°C в течение 12 ч) давал неочищенный 135D (200 мг с чистотой ~60%) в виде коричневого твердого вещества, которое использовали без очистки в последующей реакции дегидратации.
Охлажденный (0°С) раствор неочищенного 2-(8-циклопентил-2-((1-(метилсульфонил)-пиперидин-4-ил)амино)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)ацетамида (135D, 100 мг, 0,13 ммоль) и триэтиламина (67,7 мг, 0,67 ммоль) в DCM (5 мл) обрабатывали ангидридом трифторуксусной кислоты (56,2 мг, 0,27 ммоль). Охлаждающую баню убирали и смесь перемешивали при комнатной температуре в течение 2 ч. Полученную желтую суспензию промывали деионизированной водой (20 мл), затем насыщ. водн. NaCl. Органический слой сушили над сульфатом магния, фильтровали и концентрировали. Этот неочищенный продукт объединяли с продуктом из другой партии (начиная с 80 мг, 0,11 ммоль, 135D) для очистки с помощью препаративной ВЭЖХ [колонка: DuraShell 150*25 мм*5 мкм; подвижная фаза: от 36% ACN в воде (0,05% гидроксид аммония об/об) до 56% ACN в H2O(0,05% гидроксид аммония об/об)] с получением (8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)ацетонитрила (Пример 135, 27,1 мг, 26% выход для комбинированных партий) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,49 (с, 1H), 7,70 (с, 1H), 5,87 (квин, J=8,9 Гц, 1H), 5,42 (шир.с, 1H), 4,05 (шир.с, 1H), 3,92-3,73 (м, 2H), 3,66 (д, J=1,0 Гц, 2H), 2,95 (шир.с, 2H), 2,85 (с, 3H), 2,32 (шир.с, 2H), 2,21 шир.д, J=9,8 Гц, 2H), 2,04 (шир.с, 2H), 1,86 шир.д, J=9,5 Гц, 2H), 1,70 (шир.с, 4H). MS: 431 [M+H]+.
Способ G (постциклизационная функционализация пиперидина)
Пример 136: 8-циклопентил-6-(2-гидроксиэтил)-2-{[1-(пропан-2-илсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
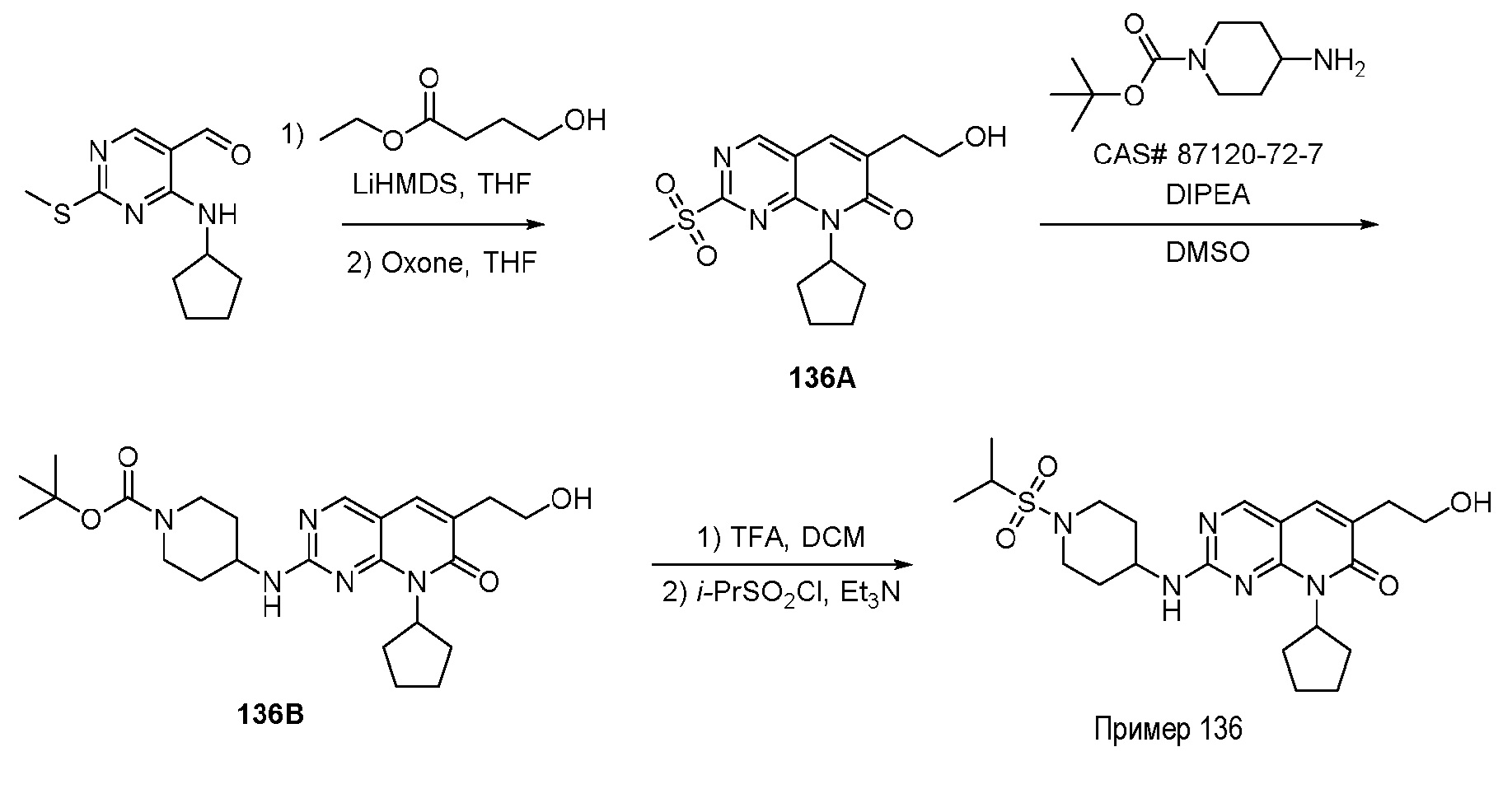
8-Циклопентил-6-(2-гидроксиэтил)-2-(метилсульфонил)пиридо[2,3-d]пиримидин-7(8H)-он (136A), синтезировали из 4-(циклопентиламино)-2-(метилсульфанил)пиримидин-5-карбальдегида [VanderWel, et al. J. Med. Chem. 2005, 48, 2371] и этил γ-гидроксибутирата с помощью способа примера 4. Раствор 136A (95 мг, 0,284 ммоль), трет-бутил 4-аминопиперидин-1-карбоксилата [CAS# 87120-72-7] (78,9 мг, 0,394) и DIPEA (0,187 мл, 1,13 ммоль) в DMSO (2,5 мл) нагревали при 65°C в течение 15 ч. Смесь охлаждали до комнатной температуры и разбавляли водой (8 мл), EtOAc (5 мл) и 4 M NaOH (1 мл) и разделяли. Органический слой концентрировали с получением неочищенного трет-бутил 4-((8-циклопентил-6-(2-гидроксиэтил)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)амино)пиперидин-1-карбоксилата (136B, 130 мг, 100%), которое использовали без дальнейшей очистки. MS: 458 [M+H]+.
Трифторуксусную кислоту (2,0 мл, 26 ммоль) добавляли к раствору неочищенного трет-бутил 4-((8-циклопентил-6-(2-гидроксиэтил)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-2-ил)амино)пиперидин-1-карбоксилата (136B, 130 мг, 0,284 ммоль) в дихлорметане (6 мл). Смесь перемешивали при комнатной температуре в течение 30 минут, затем концентрировали досуха. Остаток растворяли в дихлорметане (6 мл). Добавляли триэтиламин (0,238 мл, 1,70 ммоль) и изопропилсульфонил хлорид (0,035 мл, 0,313 ммоль), и смесь перемешивали при комнатной температуре. Через 20 минут, добавляли снова изопропилсульфонил хлорид (0,015 мл, 0,134 ммоль), и еще через 20 мин добавляли дополнительное количество изопропилсульфонил хлорида (0,030 мл, 0,269 ммоль). Смесь перемешивали в течение еще 15 минут, затем гасили 4 н NaOH (0,6 мл) и энергично перемешивали. Экстракция дихлорметаном и очистка с помощью препаративной SFC дает 8-циклопентил-6-(2-гидроксиэтил)-2-{[1-(пропан-2-илсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он (пример 136, 28,3 мг, 22%) в виде твердого вещества. 1H ЯМР (400 MГц, DMSO-d6, 80°C) δ=8,51 (с, 1H), 7,51 (с, 1H), 7,30 (д, J=4,4 Гц, 1H), 5,85 (квин, J=8,9 Гц, 1H), 3,99 (шир.с, 1H), 3,70 (д, J=13,0 Гц, 2H), 3,63 (т, J=6,5 Гц, 2H), 3,31 (тд, J=6,8, 13,6 Гц, 1H), 2,62 (т, J=6,5 Гц, 2H), 2,32 (шир.с, 2H), 2,06-1,91 (м, 4H), 1,83-1,71 (м, 2H), 1,70-1,56 (м, 4H), 1,27 (д, J=6,7 Гц, 6H). 1H затенен H2O. MS: 464 [M+H]+.
Способ H (перегруппировка Курциуса по C-6)
Пример 137: 6-амино-2-{[1-(бут-3-ин-1-илсульфонил)пиперидин-4-ил]амино}-8-циклопентилпиридо[2,3-d]пиримидин-7(8H)-он
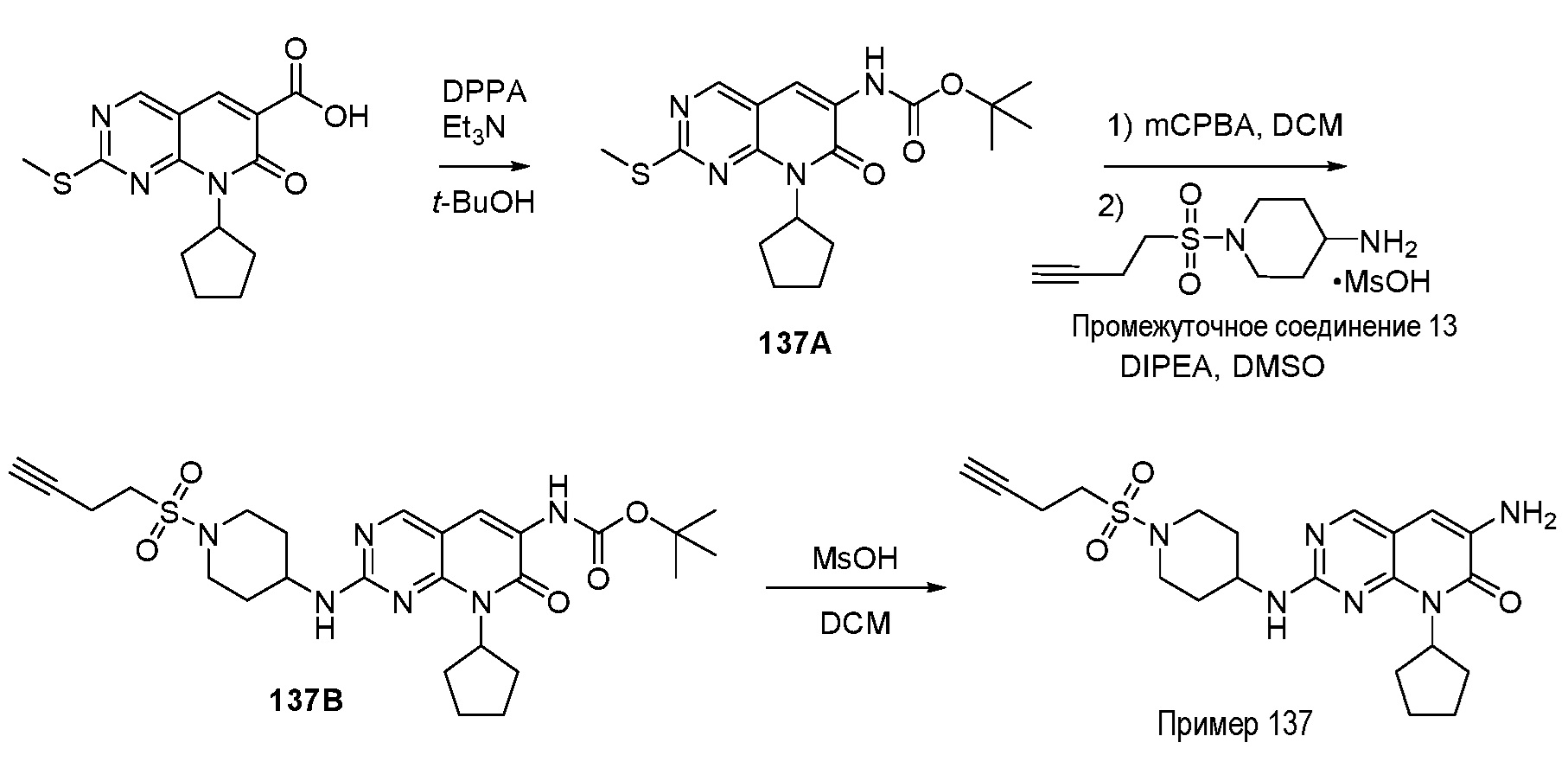
Дифенилфосфорилазид (5,41 г, 19,6 ммоль) добавляли при комнатной температуре к раствору 8-циклопентил-2-(метилтио)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-карбоновой кислоты [Toogood, et al. J. Med. Chem., 2005, 48, 2388-2406] (5,0 г, 16,37 ммоль) и триэтиламин (1,99 г, 19,6 ммоль) в трет-бутаноле (60 мл). Полученную суспензию перемешивали при 79°C в течение 18 ч. Твердые вещества удаляли фильтрованием. Осадок на фильтре промывали этилацетатом (50 мл) и комбинированные фильтраты концентрировали и очищали с помощью хроматографии на силикагеле (элюируя петр. эфир/этилацетат) с получением трет-бутил (8-циклопентил-2-(метилтио)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)-карбамата (137A, 4,1 г, 67%) в виде светло-желтого твердого вещества. 1H ЯМР (400 MГц, CDCl3): δ=8,60 (с, 1H), 8,15 (с, 1H), 7,80 (с, 1H), 6,04-6,00 (м, 1H), 2,59 (с, 3H), 2,30-2,27 (м, 2H), 2,07-2,05 (м, 2H), 1,91-1,89 (м, 2H), 1,71-1,69 (м, 2H), 1,50 (с, 9H). MS: 377 [M+H]+.
К раствору трет-бутил (8-циклопентил-2-(метилтио)-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)карбамата (137A, 495 мг, 1,3 ммоль) в DCM (13 мл) добавляли mCPBA (~70%, 389 мг, 1,58 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь разбавляли DCM (30 мл), и промывали насыщенным Na2SO3 (10 мл) и затем насыщенным водным NaHCO3 (10 мл). Органический слой сушили над сульфатом натрия и упаривали с получением белого твердого вещества, которое представляло собой смесь сульфоксидных и сульфоновых промежуточных соединений в соотношении 9:1. MS: 393 ([M+H]+ сульфоксид) и 409 ([M+H]+ сульфон). Часть этой смеси (235 мг, 0,6 ммоль) растворяли в DMSO (3 мл). Добавляли диизопропилэтиламин (0,52 мл, 3 ммоль) и 1-(бут-3-ин-1-илсульфонил)пиперидин-4-амин метансульфонат (промежуточное соединение 13, 225 мг, 0,72 ммоль). Смесь нагревали при 55°C в течение 16 ч, затем при 65°C в течение 3 ч. После охлаждения до комнатной температуры, реакционную смесь разделяли между насыщенным водным NaHCO3 (10 мл) и DCM (30 мл). Органический слой сушили над сульфатом натрия, концентрировали и очищали с помощью хроматографии на силикагеле (элюируя этилацетатом/гептаном) с получением трет-бутил (2-((1-(бут-3-ин-1-илсульфонил)пиперидин-4-ил)амино)-8-циклопентил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)карбамата (137B, 166 мг, 51%) в виде белого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=8,65 (шир.с, 1H), 8,03 (с, 1H), 7,89 (с, 1H), 7,75-7,36 (м, 1H), 5,92 (шир.с, 1H), 4,02-3,80 (м, 1H), 3,62 (д, J=12,5 Гц, 2H), 3,28-3,23 (м, 2H), 3,08-2,92 (м, 3H), 2,59 (дт, J=2,7, 7,5 Гц, 2H), 2,37-2,09 (м, 2H), 2,02-1,91 (м, 4H), 1,79 (д, J=4,6 Гц, 2H), 1,71-1,53 (м, 4H), 1,47 (с, 9H). MS: 545 [M+H]+.
Раствор трет-бутил (2-((1-(бут-3-ин-1-илсульфонил)пиперидин-4-ил)амино)-8-циклопентил-7-оксо-7,8-дигидропиридо[2,3-d]пиримидин-6-ил)карбамата (137B, 166 мг, 0,29 ммоль) и метансульфоновой кислоты (195 мкл, 2,9 ммоль) в DCM (10 мл) перемешивали при комнатной температуре в течение 1 часа. Раствор концентрировали досуха, и остаток обрабатывали льдом (10 г) и насыщенным водным NaHCO3 (10 мл), вызывая некоторое выделение газа. Полученную суспензию перемешивали при комнатной температуре в течение 1 часа, затем твердые вещества собирали фильтрованием. Осадок промывали водой и сушили в вакуумной печи (45°C, 10 мм рт.ст.) с получением 6-амино-2-{[1-(бут-3-ин-1-илсульфонил)пиперидин-4-ил]амино}-8-циклопентилпиридо[2,3-d]пиримидин-7(8H)-она (Пример 137, 119 мг, 91%) в виде светло-желтого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=8,41 (с, 1H), 7,16 (шир.с, 1H), 6,62 (с, 1H), 5,93 (т, J=8,7 Гц, 1H), 5,70-4,31 (м, 2H), 3,89 (шир.с, 1H), 3,61 (д, J=12,5 Гц, 2H), 3,28-3,24 (м, 2H), 3,07-2,94 (м, 3H), 2,59 (дт, J=2,4, 7,4 Гц, 2H), 2,30-2,21 (м, 2H), 2,08-1,89 (м, 4H), 1,85-1,70 (м, 2H), 1,68-1,44 (м, 4H). MS: 445 [M+H]+.
Способ I (Pd-катализируемое кросс-сочетание по C-6)
Пример 138: 8-циклопентил-6-этенил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
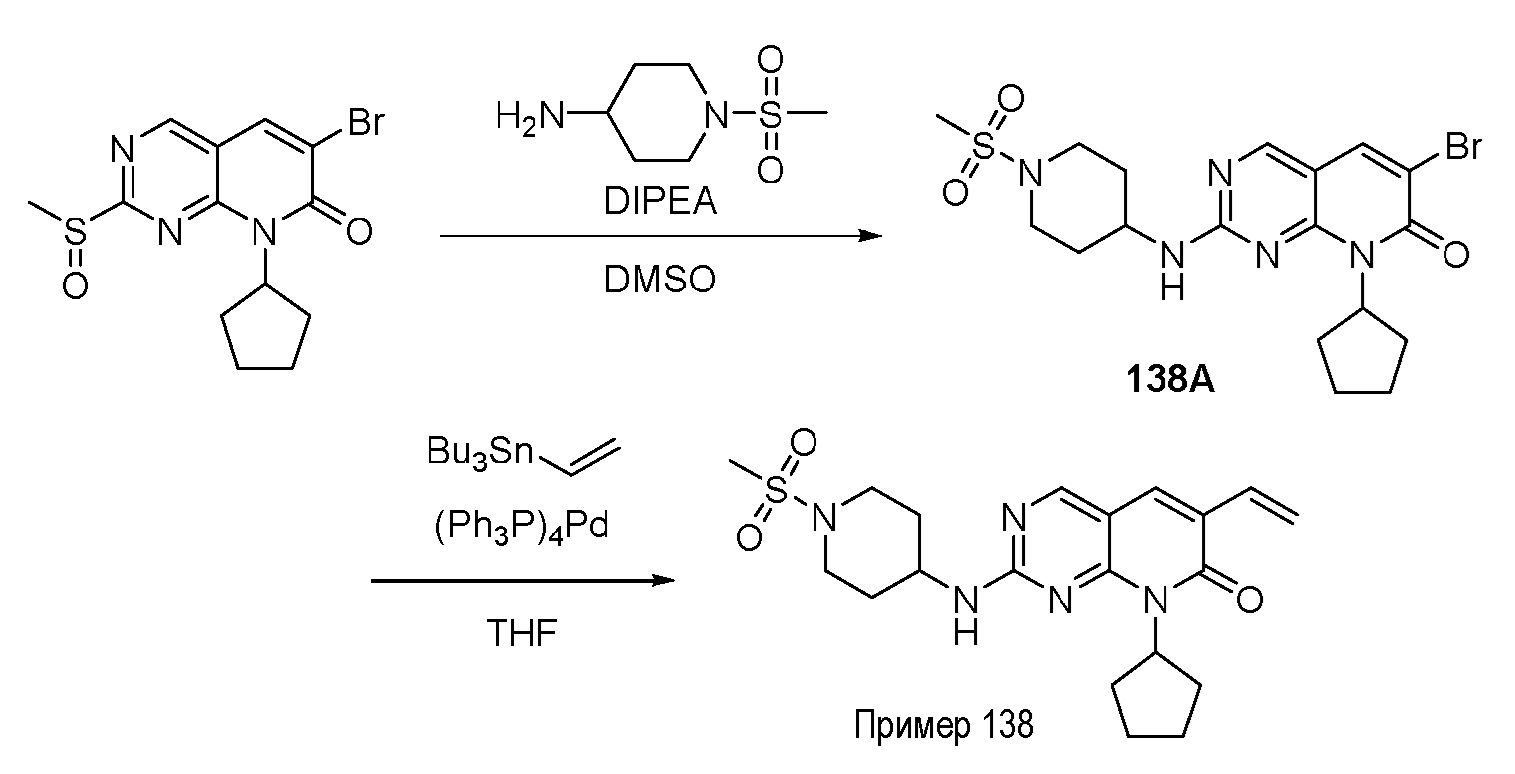
6-Бром-8-циклопентил-2-((1-(метилсульфонил)пиперидин-4-ил)амино)пиридо[2,3-d]пиримидин-7(8H)-он (138A) синтезировали из 6-бром-8-циклопентил-2-(метилсульфинил)пиридо[2,3-d]пиримидин-7(8H)-она [Toogood, et al. J. Med. Chem., 2005, 48, 2388-2406] по способу примера 1. 1H ЯМР (400 MГц, DMSO-d6) δ=8,55-8,68 (м, 1H), 8,25 (с, 1H), 7,79-8,09 (м, 1H), 5,74-6,10 (м, 1H), 3,80-4,16 (м, 1H), 3,57 (д, J=11,2 Гц, 2H), 2,76-3,00 (м, 5H), 2,20-2,35 (м, 1H), 2,15 (шир.с, 1H), 1,97 (шир.с, 4H), 1,77 (шир.с, 2H), 1,61 (д, J=11,4 Гц, 4H). MS: 470/472 (Br изотопное расщепление, [M+H]+.
Раствор 6-бром-8-циклопентил-2-((1-(метилсульфонил)пиперидин-4-ил)амино)пиридо[2,3-d]пиримидин-7(8H)-она (138A, 5,00 г, 12,0 ммоль) и три-н-бутил(этенил)станнан (3,80 г, 12,0 ммоль) в THF (100 мл, 0,1 M) дегазировали азотом, затем добавляли палладий тетракис(трифенилфосфин) (692 мг, 0,599 ммоль). Смесь нагревали при 65°C в течение 48 ч. Летучие вещества удаляли при пониженном давлении и остаток очищали на силикагеле (элюируя 0-20% этилацетат/дихлорметан). Затем продукт перекристаллизовывали из DCM/диэтилового эфира (1/10, 50 мл) с получением 8-циклопентил-6-этенил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (Пример 138, 2,5 г, 50%), все еще содержит 10% трифенилфосфин оксида.
Для биологического тестирования образец этой партии (102 мг, 0,244 ммоль) дополнительно очищали с помощью препаративной SFC с получением аналитически чистого 8-циклопентил-6-этенил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (Пример 138, 76,48 мг, 75% извлечение) в виде белого твердого вещества. 1H ЯМР (400 MГц, CDCl3) δ=8,44 (с, 1H), 7,55 (с, 1H), 6,89 (дд, J=11,25, 17,73 Гц, 1H), 5,79-5,99 (м, 2H), 5,12-5,44 (м, 2H), 3,95-4,17 (м, 1H), 3,81 (д, J=12,2 Гц, 2H), 2,90-3,06 (м, 2H), 2,84 (с, 3H), 2,27-2,47 (м, 2H), 2,21 (дд, J=3,06, 13,08 Гц, 2H), 2,00-2,13 (м, 2H), 1,80-1,91 (м, 2H), 1,64-1,79 (м, 4H). MS: 418 [M+H]+.
Пример 139: 8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}-6-(проп-2-ен-1-ил)пиридо[2,3-d]пиримидин-7(8H)-он
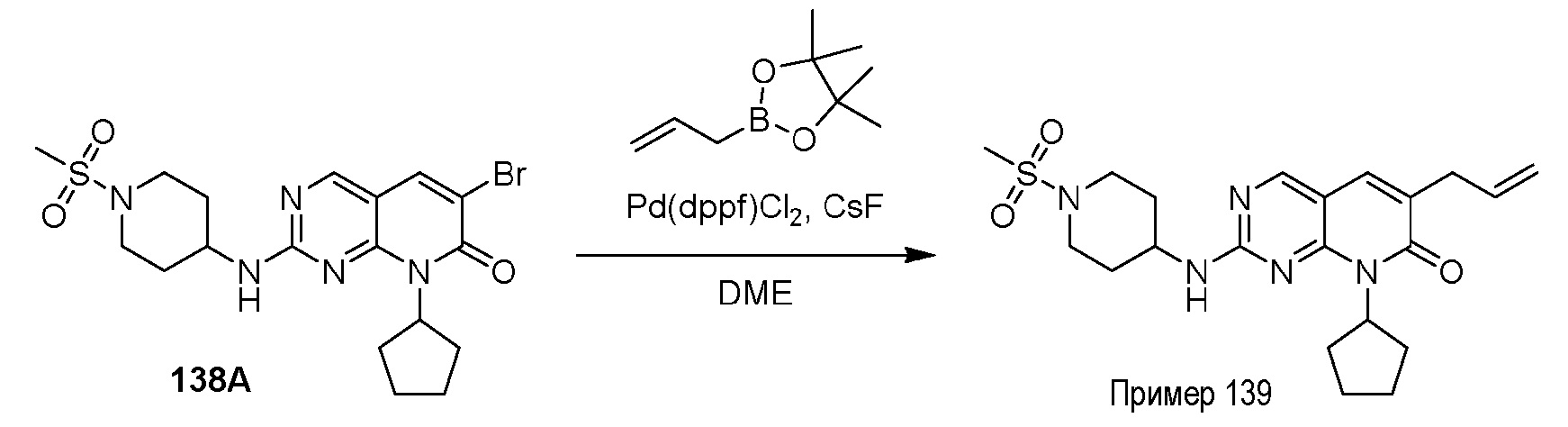
Во флакон с мешалкой добавляли 6-бром-8-циклопентил-2-((1-(метилсульфонил)пиперидин-4-ил)амино)пиридо[2,3-d]пиримидин-7(8H)-он (138A, 470 мг, 1 ммоль), DME (10 мл, 0,1 M), 4,4,5,5-тетраметил-2-(проп-2-ен-1-ил)-1,3,2-диоксаборолан (281 мкл, 1,5 ммоль), CsF (304 мг, 2 ммоль) и PdCl2(dppf) (37 мг, 0,05 ммоль). Смесь дегазировали азотом в течение 1 минуты, затем флакон закрывали и помещали в нагревательный блок при 80°C в течение 16 ч. Реакционную смесь разбавляли этилацетатом (100 мл) и насыщенным водным NaHCO3 (20 мл). Органический слой отделяли и продукт экстрагировали этилацетатом (20 мл). Объединенные органические слои сушили над сульфатом натрия, концентрировали и очищали на силикагеле (элюировали гептаном/этилацетатом) с получением 8-циклопентил-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}-6-(проп-2-ен-1-ил)пиридо[2,3-d]пиримидин-7(8H)-она (Пример 139, 154 мг, 40%) в виде светлого твердого вещества. 1H ЯМР (400 MГц, DMSO-d6) δ=8,58 (шир.с, 1H), 7,48 (с, 1H), 5,95 (тдд, J=6,69, 10,16, 17,04 Гц, 1H), 5,05-5,19 (м, 2H), 3,57 (д, J=12,2 Гц, 3H), 3,18 (д, J=6,6 Гц, 2H), 2,79-2,96 (м, 7H), 1,99 (с, 6H), 1,53-1,69 (м, 4H). MS: 432 [M+H]+.
Способ J (присоединение радикала по C-6)
Пример 140: 6-(2,2-дифторэтил)-8-[(1R,3R)-3-гидроксициклогексил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-он
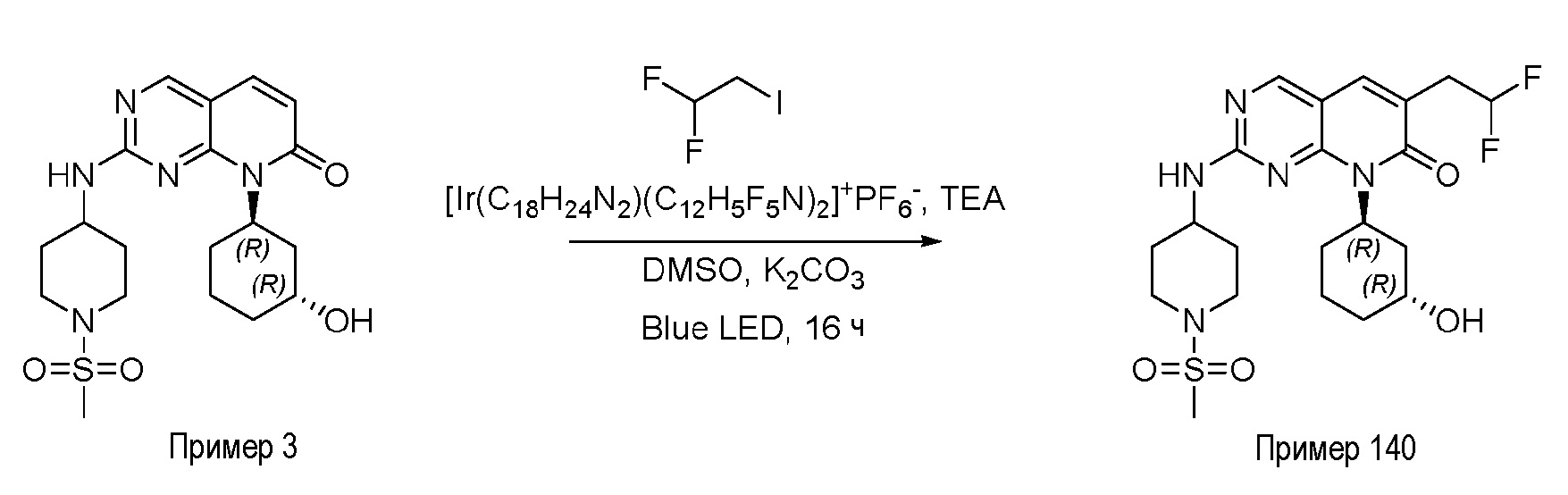
К раствору 8-[(1R,3R)-3-гидроксициклогексил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (Пример 3, 0,161 г, 0,382 ммоль) в DMSO (1,5 мл) добавляли (4,4'-ди-трет-бутил-2,2'-бипиридин)бис[3,5-дифтор-2-[5-трифторметил-2-пиридинил-kN)фенил-kC]иридий(III) гексафторфосфат (0,012 г, 0,0107 ммоль), 1,1-дифтор-2-иодэтан (0,27 мл, 3,1 ммоль), карбонат калия (0,150 г, 0,960 ммоль) и триэтиламин (30 мкл, 0,22 ммоль). Через смесь барботировали азот в течение десяти минут, а затем пробирку закрывали. Реакционную смесь облучали синим светом (Kessil, H150-Blue, 34W) в течение 16 ч. Реакционную смесь фильтровали и концентрировали, и остаток очищали с помощью препаративной ВЭЖХ (колонки Waters SFC 200 Glacier/2-Cosmosil 3HOP 150×21,1 мм внутр.диам., 5 мкм. сорастворитель метанол. 14% B в течение 2,5 мин, до 22% за 7,5 мин, до 50% за 1 мин, удержание 1 мин при 100 бар, 35°C, 80 г/мин.) с получением 6-(2,2-дифторэтил)-8-[(1R,3R)-3-гидроксициклогексил]-2-{[1-(метилсульфонил)пиперидин-4-ил]амино}пиридо[2,3-d]пиримидин-7(8H)-она (Пример 140, 29,35 мг, 16% выход). 1H ЯМР (400 MГц, DMSO-d6) δ=8,58 (с, 1H), 7,85 (д, J=7,0 Гц, 1H), 7,70 (с, 1H), 6,22 (тт, J=4,8, 57,2 Гц, 1H), 4,46 (шир.с, 1H), 4,12 (шир.с, 1H), 3,99 (шир.с, 1H), 3,66-3,55 (м, 2H), 3,02 (дт, J=4,0, 17,1 Гц, 2H), 2,89 (с, 3H), 2,87-2,77 (м, 2H), 2,18-1,38 (м, 11H). MS: 486 [M+H]+. [α]D22 +18,0 (c 0,1, MeOH).
Дополнительные соединения по изобретению получали путем модификации способов, приведенных в настоящем описании в качестве примеров. Если не указано иное, все соединения, имеющие хиральные центры, получали и/или выделяли в виде одиночного энантиомера, имеющего известную относительную конфигурацию. Соединения, отмеченные как «Абсолютная стереохимия неизвестна», обычно получали из рацемических промежуточных соединений и разделяли на отдельные энантиомеры с помощью соответствующего хирального препаративного метода SFC перед характеристикой и тестированием. Если абсолютная стереохимия неизвестна для пары энантиомеров, стереохимия, представленная в таблице 1, назначается на основе знака оптического вращения ([α]D20) и относительной биологической активности по аналогии с соединениями, имеющими известные абсолютные конфигурации. Соединения, отмеченные как «абсолютная стереохимия известна», обычно получали из хиральных промежуточных соединений, имеющих известную стереохимию.
Отобранные соединения и их соответствующие характеристические данные представлены ниже в таблице 1.
Таблица 1
|
Биологические анализы и данные
Анализ изменения подвижности CDK2/циклин E1
Целью анализа CDK2/циклин E1 является оценка ингибирования (% ингибирования, значения Kiapp и Ki) низкомолекулярных ингибиторов с использованием анализа изменения микрофлюидной подвижности на основе флуоресценции. CDK2/циклин E1 катализирует продуцирование ADP из ATP, которое сопровождает перенос фосфорила на пептидный субстрат FL-Пептид-18 (5-FAM-QSPKKG-CONH2) (SEQ ID NO:1). (CPC Scientific, Sunnyvale, CA). Анализ изменения подвижности электрофоретически разделяет флуоресцентно меченные пептиды (субстрат и фосфорилированный продукт) после киназной реакции. Измеряют и субстрат, и продукт, и отношение этих значений используют для генерирования % конверсии субстрата в продукт с помощью ридера LabChip EZ. Комплекс ферментов дикого типа полноразмерной CDK2/дикого типа полноразмерного циклина E1 получали на месте (бакуловирусная экспрессия, LJIC-2080/LJIC-2103) и фосфорилировали комплексом ферментов CDK7/циклин H1/Mat1 с CDK2:CDK7 в соотношении 50:1 (концентрация мг/мл) в присутствии 10 мМ MgCl2 и 5 мМ ATP при комнатной температуре в течение одного часа. Типичные реакционные растворы (50 мкл конечного реакционного объема) содержали 2% DMSO (± ингибитор), 4 мM MgCl2, 1 мM DTT, 150 мкM ATP (ATP Km=67,4 мкM), 0,005% Tween-20, 3 мкM FL-Пептид-18 и 0,36 нM (каталитически компетентный активный участок) комплекс ферментов фосфорилированный дикого типа полноразмерный CDK2/циклин E1 в 25 мM HEPES буфере при pH 7,15. Анализ начинали с добавления ATP, после пятнадцатиминутной предварительной инкубации фермента и ингибитора при комнатной температуре в реакционной смеси. Реакцию останавливали через 45 минут при комнатной температуре путем добавления 50 мкл 80 мM EDTA, pH 7,5. Значение Ki определяли путем подгонки данных к уравнению сильной связи Моррисона для конкурентного ингибирования с концентрацией фермента в качестве переменной.
Анализ изменения подвижности CDK6/циклин D1
Целью анализа CDK6/циклин D1 является оценка ингибирования (% ингибирования, значения Kiapp и Ki) в присутствии низкомолекулярных ингибиторов с использованием анализа изменения микрофлюидной подвижности на основе флуоресценции. CDK6/циклин D1 катализирует продуцирование ADP из ATP, которое сопровождает перенос фосфорила на пептидный субстрат 5-FAM-Dyrktide (5-FAM-RRRFRPASPLRGPPK) (SEQ ID NO:2). Анализ изменения подвижности электрофоретически разделяет флуоресцентно меченные пептиды (субстрат и фосфорилированный продукт) после киназной реакции. Измеряли и субстрат, и продукт, и отношение этих значений использовали для генерирования % конверсии субстрата в продукт с помощью ридера LabChip EZ. Типичные реакционные растворы содержали 2% DMSO (±ингибитор), 10 мM MgCl2, 1 мM DTT, 2 мM ATP, 0,005% Tween 20 (TW-20), 3 мкМ 5-FAM-Dyrktide, 3 нM (активные участки) CDK6/Циклин D1 в 40 мM буфере HEPES при pH 7,5.
Определения ингибитора Ki для нефосфорилированного CDK6/циклин D1 (LJIC-2003A2/1865) инициировали добавлением ATP (50 мкл конечного реакционного объема), после двенадцатиминутной предварительной инкубации фермента и ингибитора при 22°С в реакционной смеси. Реакцию останавливали через 35 минут добавлением 50 мкл 25 мM EDTA. Определения Ki были сделаны по графику дробной скорости как функции концентрации ингибитора, соответствующей уравнению Моррисона с концентрацией фермента в качестве переменной.
Для анализа изменения подвижности CDK2, CDK4 и CDK6, см. также also Morrison, J. F. (1969) Kinetics of the reversible inhibition of enzyme-catalysed reactions by tight-binding inhibitors, Biochimica et biophysica acta 185, 269-286; and Murphy, D. J. (2004) Determination of accurate KI values for tight-binding enzyme inhibitors: an in silico study of experimental error and assay design, Analytical biochemistry 327, 61-67.
Анализ изменения подвижности CDK4/циклин D3
Целью анализа CDK4/циклин D3 является оценка ингибирования (% ингибирования, значения Kiapp и Ki) в присутствии низкомолекулярных ингибиторов с использованием анализа изменения микрофлюидной подвижности на основе флуоресценции. CDK4/циклин D3 катализирует продуцирование ADP из ATP, которое сопровождает перенос фосфорила на пептидный субстрат 5-FAM-Dyrktide (5-FAM-RRRFRPASPLRGPPK) (SEQ ID NO:2). Анализ изменения подвижности электрофоретически разделяет флуоресцентно меченные пептиды (субстрат и фосфорилированный продукт) после киназной реакции. Измеряют и субстрат, и продукт, и отношение этих значений используют для генерирования % конверсии субстрата в продукт с помощью ридера LabChip EZ. Типичные реакционные растворы содержали 2% DMSO (±ингибитор), 10 мM MgCl2, 1 мM DTT, 2 мM ATP, 0,005% TW-20, 3 мкM 5-FAM-Dyrktide, 2 нM (активные участки) CDK4/Циклин D3 в 40 мM буфере HEPES при pH 7,5.
Определения ингибитора Ki для нефосфорилированного CDK4/циклин D3 (LJIC-2007/2010) инициировали добавлением ATP (50 мкл конечного реакционного объема), после двенадцатиминутной предварительной инкубации фермента и ингибитора при 22°С в реакционной смеси. Реакцию останавливали через 35 минут добавлением 50 мкл 25 мM EDTA. Определения Ki были сделаны по графику дробной скорости как функции концентрации ингибитора, соответствующей уравнению Моррисона с концентрацией фермента в качестве переменной.
Биологическая активность
Данные биологической активности для отдельных соединений в анализах изменения подвижности CDK2, CDK6 и CDK4 представлены в таблице 2 как Ki (нМ).
Таблица 2.
|
Клеточные анализы
Анализ клеточной пролиферации
Клетки OVCAR3 или HCC1806 высевали 3000 клеток/лунку в 96-луночные планшеты в среде для роста, содержащей 10% FBS и культивировали в течение ночи при 37°C 5% CO2. На следующий день соединения серийно разводили от 10 мМ максимальной дозы для 11-точечной 3-кратной кривой разведения в DMSO. Соединения были промежуточно разбавлены 1:200 в среде для роста перед разведением 1:5 на клетках для конечной концентрации 10 мкМ до 0,1 нМ в 0,1% DMSO на клетках. Клетки инкубировали при 37°C 5% CO2 в течение 7 дней. Затем проводили прямой анализ клеточной пролиферации CYQUANT (Molecular Probes, Eugene, OR), следуя рекомендациям производителя, для определения относительных количеств жизнеспособных клеток на многоканальном ридере Perkin Elmer Envision 2104 при возбуждении 508 нМ и длине волны излучения 527 нМ. Значения IC50 рассчитывали путем подбора кривой концентрация-ответ с использованием четырехпараметрического аналитического метода с использованием программного обеспечения GraphPad Prism.
На фигуре 2(C) показаны результаты IC50 для примера 10 и палбоциклиба в анализе пролиферации клеток OVCAR3. На фигуре 2(D) показаны результаты IC50 для примера 10 и палбоциклиба в анализе пролиферации клеток HCC1806.
Фосфо-серин 807/811 Rb ELISA
Клетки OVCAR3 или HCC1806 высевали при 25000 клеток/лунку в 100 мкл среды для роста и оставляли для прикрепления при 37°C с 5% CO2 в течение ночи. На следующий день соединения серийно разводили от 10 мМ максимальной дозы для 11-точечной 3-кратной кривой разведения в DMSO. Соединения были промежуточно разбавлены 1:200 в среде для роста перед разведением 1:5 на клетках для конечной концентрации 10 мкМ до 0,1 нМ в 0,1% DMSO на клетках. Клетки OVCAR3 обрабатывали в течение 1 часа, в то время как клетки HCC1806 обрабатывали в течение ночи, при 37°C с 5% CO2. Клетки лизировали в 100 мкл/лунку буфера для лизиса CST на льду и переносили в предварительно покрытые и блокированные анти-фосфо-Ser807/811 Rb планшеты для ELISA для инкубации в течение ночи при 4°C. Планшеты промывали для удаления остаточных несвязанных клеточных белков и добавляли антитело для определения общего Rb в течение 90 минут при 37°С. После промывки для удаления несвязанного общего Rb антитела, меченому HRP антителу давали связываться в течение 30 минут при 37°С. После промывки для удаления несвязанного HRP антитела, добавляли реагент Glo Substrate и инкубировали в защищенном от света месте в течение 5-10 минут. Планшеты считывали в режиме люминесценции и рассчитывали значения IC50.
На фигуре 2(А) показаны результаты IC50 для примера 10 и палбоциклиба в анализе ELISA Rb ObCAR3. На фигуре 2(B) показаны результаты IC50 для примера 10 и палбоциклиба в анализе ELISA Rb HCC1806.
Модели опухолей
Модель опухоли Ovcar3
Линию опухолевых клеток Ovcar3, приобретенную у ATCC (ATCC HTB-161™) культивировали в RPMI1640 (1x) среде (Gibco™ cat# 11875-093) 10% FBS (Gibco™ cat # 26140-079). Для создания модели ксенотрансплантата Ovcar3, мышам NSG в правую боковую область живота подкожно имплантировали 5×106 клеток на мышь (#5557-NOD.cg-Prkdc<scid> Jackson Lab). Клетки суспендировали в среде 50% матригеля (экстракт базальной мембраны Cultrex (BME), матрица базальной мембраны Trevigen) и 50% RPMI1640 (1x) (Gibco™ cat# 11875-093) в бессывороточной среде до имплантации.
Животных рандомизировали через 39 дней после имплантации клеток, каждая группа состояла из 4 мышей. Лечение начинали, когда опухоли достигли размера 100 мм3-190 мм3. Испытуемые соединения получали в 40% каптизола и вводили РО (перорально) в дозе 10 и 50 мг/кг QD (один раз в день) или в дозе 50 мг/кг BID (два раза в день) в виде суспензии в течение 14 дней. Животных регистрировали в назначенное время. Мышам, которые не получали лекарственные средства, давали носитель QD или BID в течение 14 дней. Объемы опухолей измеряли один раз до рандомизации с помощью электрического калипера, при этом объемы опухоли рассчитывали с использованием формулы длина×ширина×ширина/2. Объемы опухолей измеряли два раза в неделю с помощью электрического калипера, причем объемы опухолей рассчитывали по формуле длина×ширина×ширина/2. Массу животных регистрировали два раза в неделю.
На фигуре 3 показано дозозависимое ингибирование роста опухоли (мм3) для примера 2 в модели ксенотрансплантата опухоли мыши OVCAR3, дозированной при 10 мг/кг PO QD, 50 мг/кг PO QD и 50 мг/кг PO PO BID.
Модель опухоли HCC1806
Источник: HCC1806 (# CRL 2335, ATCC, Manassas, VA)
Линию опухолевых клеток HCC1806 культивировали в RPMI1640 среде, дополненной 10% фетальной бычьей сывороткой (FBS). Для создания модели ксенотрансплантата HCC1806, самкам мышей NU/NU в правую боковую область живота подкожно имплантировали 5×106 клеток на мышь. Клетки суспендировали в 50% экстракт базальной мембраны Cultrex и 50% среда RPMI 1640 в бессывороточной среде до имплантации.
Животных рандомизировали через 7 дней после имплантации клеток, каждая группа состояла из 13 мышей. Лечение начинали, когда опухоли достигли размера от 100 мм3 до 170 мм3 на 7 день. Испытуемые соединения получали в 0,1%Tween, 0,5% метилцеллюлозе в воде и давали лекарственное средство PO при 30, 50, и 75 мг/кг виде суспензии BID в течение 14 дней. Мышам, которые не получали лекарственное средство, давали носитель BID в течение 14 дней. Объемы опухолей измеряли два раза в неделю с помощью электрического калипера, при этом объемы опухоли рассчитывали с использованием формулы длина×ширина×ширина/2. Массу животных регистрировали два раза в неделю.
На фигуре 4 показано дозозависимое ингибирование роста опухоли (мм3) для примера 2 в модели ксенотрансплантата опухоли мыши HCC1806, при дозах 30 мг/кг PO BID, 50 мг/кг PO BID и 75 мг/кг PO BID.
Все публикации и патентные заявки, процитированные в данном описании, включены в него посредством ссылки во всей их полноте. Специалистам в данной области техники будет очевидно, что в них могут быть сделаны определенные изменения и модификации без отклонения от сущности или объема прилагаемой формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PFIZER INC.
Behenna, Doughlas C
Chen, Ping
Freeman-Cook, Kevin D
Hoffman, Robert L
Jalaie, Mehran
Nagata, Asako
Nair, Sajiv K
Ninkovic, Sacha
Ornelas, Martha A
Palmer, Cynthia L
Rui, Eugene Y
<120> ПИРИДОПИРИМИДИНОНОВЫЕ ИНГИБИТОРЫ CDK2/4/6
<130> PC72302A
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> 5'FAM меченный глютамин
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Глицин карбоксамид
<400> 1
Gln Ser Pro Lys Lys Gly
1 5
<210> 2
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая Конструкция
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> 5'FAM меченный аргинин
<400> 2
Arg Arg Arg Phe Arg Pro Ala Ser Pro Leu Arg Gly Pro Pro Lys
1 5 10 15
<---