КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ЦВИТТЕРИОННЫЕ АЛКИЛАЛКАНОИЛАМИДЫ И/ИЛИ АЛКИЛАЛКАНОАТЫ
Вид РИД
Изобретение
СТОРОНЫ СОГЛАШЕНИЯ О ПРОВЕДЕНИИ СОВМЕСТНЫХ ИССЛЕДОВАНИЙ
Изобретения, описанные или заявленные в данном документе, были выполнены на основании Соглашения о проведении совместных исследований между Eastman Chemical Company и Johnson & Johnson Consumer Inc.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям, содержащим цвиттерионные алкилалканоиламидные и/или алкилалканоатные поверхностно-активные вещества (ПАВ), как определено в настоящем документе.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Очищающие композиции применяются для нанесения на волосы и/или кожу человека, чтобы обеспечить очищение соответствующей части тела, нуждающейся в очищении. В отношении очищения кожи очищающие составы выполнены с возможностью удаления грязи, пота, секрета сальных желез и жиров с кожи, где очищение достигается за счет применения традиционных поверхностно-активных веществ, которые способствуют отслаиванию грязи и солюбилизации и удалению жировых загрязнений с кожи. В дополнение к удалению нежелательных веществ с кожи очищение помогает стимулировать нормальное отслоение рогового слоя эпидермиса и таким образом омолаживает кожу. Для придания таких очищающих свойств в различных очищающих композициях широко применяются традиционные детергенты, например катионные, анионные и неионные ПАВ.
Кроме того, в различных очищающих композициях широко применяются некоторые цвиттерионные ПАВ, такие как бетаины, султаины и амфоацетаты. Они наиболее известны как вещества, создающие желательную вязкость, пену и обеспечивающие мягкость действия очищающих составов, причем наиболее часто применяемым является кокамидопропилбетаин. Другие примеры включают лаурамидопропилбетаин, кокамидопропилгидроксисултаин, лаурамидопропилгидроксисултаин, лауроамфоацетат натрия, кокоамфоацетат натрия, динатрийкокоамфодипропионат и динатрийлауроамфодипропионат и т. п. Однако все эти цвиттерионные ПАВ содержат алкиламидоаминую функциональную группу и недавно были признаны потенциальными аллергенами. В частности, кокамидопропилбетаин в настоящее время входит в скрининговые тесты на кожную аллергию. Дополнительно аллергены и раздражители кожи, такие как алкиламидоамины и аминоалкиламины, присутствуют в качестве примесей во всех упомянутых выше цвиттерионных ПАВ, где первые представляют собой промежуточные соединения, образующиеся при синтезе указанных выше цвиттерионных ПАВ, а вторые представляют собой непрореагировавший сырьевой материал, используемый для синтеза.
Заявители признали желательность разработки очищающих средств, которые по существу не содержат цвиттерионных ПАВ, полученных из алкиламидоаминов, и не содержат алкиламидоаминных и аминоалкиламинных примесей и при этом по-прежнему удовлетворяют требованиям к желательной вязкости, пене и мягкости действия.
Цвиттерионные ПАВ наиболее приемлемы, чтобы способствовать созданию желательной вязкости, пены и мягкости действия в очищающих составах. Соответственно, заявители признали необходимость разработки очищающих композиций, содержащих цвиттерионные ПАВ, которые не содержат амидоаминной функциональной группы и по существу не содержат алкиламидоаминных и аминоалкиламинных примесей, и которые проявляют желательную вязкость, пену и мягкость действия для применения потребителями.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
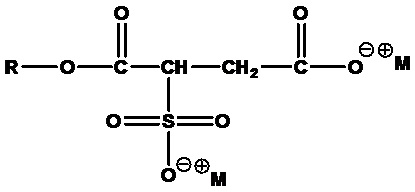
В настоящем изобретении предлагаются композиции, содержащие первое цвиттерионное алкилалканоиламидное и/или алкилалканоатное ПАВ в соответствии с формулой 1, далее в данном документе именуемое «ПАВ ZAA», и ингредиент, выбираемый из группы, состоящей из второго ПАВ, отличного от первого ПАВ ZAA, эмульгаторов, кондиционирующих агентов, умягчителей, смачивающих средств, увлажнителей, загустителей, смазывающих веществ, хелатирующих агентов, наполнителей, связывающих агентов, антиоксидантов, консервантов, активных ингредиентов, ароматизаторов, красителей, буферных агентов, скрабов, регуляторов pH, неорганических солей, растворителей, регуляторов вязкости и замутняющих агентов, где композиция по существу не содержит алкиламидоамина и аминоалкиламина.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Заявители обнаружили, что в композициях настоящего изобретения преодолены недостатки известного уровня техники, и разработали композиции, которые проявляют желательную вязкость и/или пенообразующее действие по сравнению с предшествующим уровнем техники, при этом сохраняя превосходную мягкость действия на кожу и глаза. Композиции по существу не содержат алкиламидоаминных и аминоалкиламинных примесей и по существу не содержат цвиттерионных ПАВ, полученных из амидоаминной функциональной группы. Например, как показано в разделе «Примеры», композиции, содержащие одно или более ПАВ ZAA, склонны проявлять лучшую загущающую способность, сходное или лучшее пенообразующее действие и по меньшей мере сравнимую мягкость действия (измеренную с использованием тестов EpiDermTM и EpiOcularTM) по сравнению с цвиттерионными ПАВ, несущими алкиламидоаминную функциональную группу и/или содержащими примеси алкиламидоамина и/или аминоалкиламина, такими как кокамидопропилбетаин, кокоамфоацетат натрия и кокамидопропилгидроксисултаин.
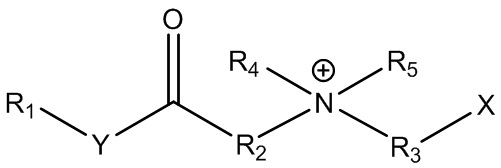
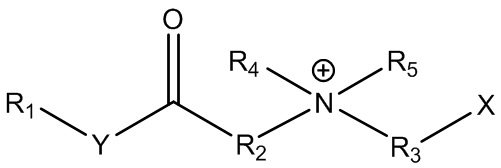
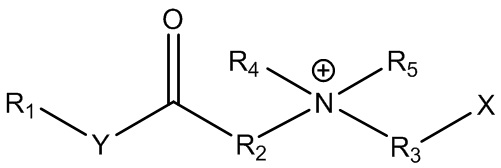
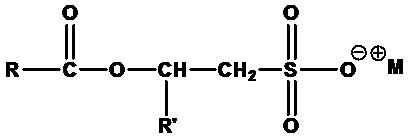
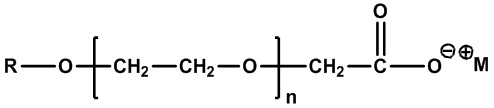
В контексте настоящего документа термин «цвиттерионные алкилаланоиламиды и/или алкилалканоаты» или «ПАВ ZAA» относится к цвиттерионным ПАВ в соответствии с формулой 1:
 ,
,
(Формула 1)
где R1 представляет собой линейную, разветвленную, насыщенную или ненасыщенную C6-C22 алкильную гидрофобную группу;
R2 представляет собой линейную, разветвленную или циклическую алкильную, гидроксиалкильную или ароматическую группу;
R3 представляет собой линейную или разветвленную алкильную, гидроксиалкильную или ароматическую группу;
R4 представляет собой линейную или разветвленную алкильную, гидроксиалкильную или ароматическую группу;
R5 представляет собой линейную или разветвленную алкильную, гидроксиалкильную или ароматическую группу; и
любой из R2, R4 или R5 может быть соединен в циклическую структуру;
Y представляет собой O или NH; и
X представляет собой -CO2-, -SO3-, -SO4-, -PO3H- или -PO4H-.
Группы X могут содержать или не содержать противоионы M+ или быть протонированными или депротонированными.
В некоторых вариантах осуществления R2 представляет собой C1-C8 линейную, разветвленную или циклическую алкильную, гидроксиалкильную или ароматическую группу; R3 представляет собой C1-C8 линейную или разветвленную алкильную, гидроксиалкильную или ароматическую группу;
R4 представляет собой C1-C8 линейную или разветвленную алкильную, гидроксиалкильную или ароматическую группу; и R5 представляет собой C1-C8 линейную или разветвленную алкильную, гидроксиалкильную или ароматическую группу.
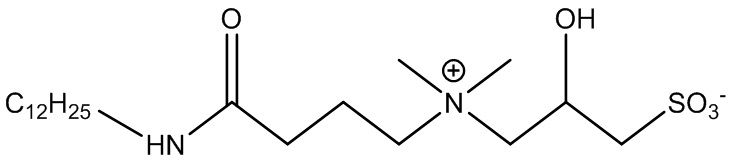
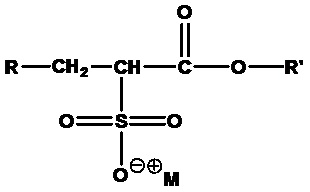
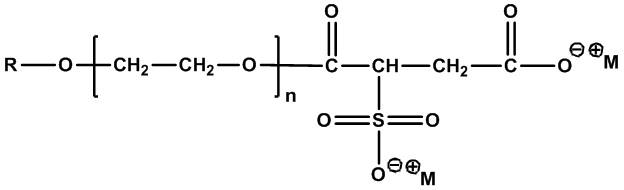
Одним конкретным примером ПАВ ZAA в соответствии с формулой 1 является 3-((4-(лауриламино)-4-оксобутил)диметиламмоний)-2-гидроксипропан-1-сульфонат, представленный в формуле 2:
 .
.
(Формула 2)
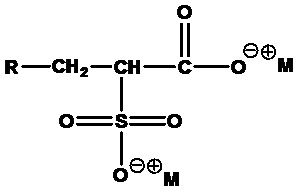
Примером ПАВ ZAA в соответствии с формулой 1, несущего алканоатную группу, является 3-((2-лаурилокси)-(2-оксоэтил)диметиламмонио)-2-гидроксипропан-1-сульфонат, представленный в формуле 2-2.
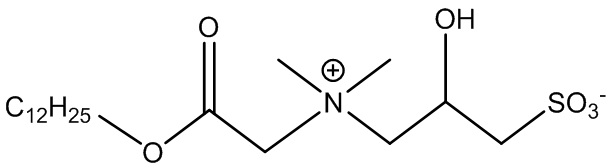
(Формула 2-2)
Примером ПАВ ZAA в соответствии с формулой 1, несущего алканоатную группу и разветвленную группу, является 3-((2-(лаурилокси)-2-оксо-1-метилэтил)диметиламмонио)-2-гидроксипропан-1-сульфонат, представленный в формуле 2-3.
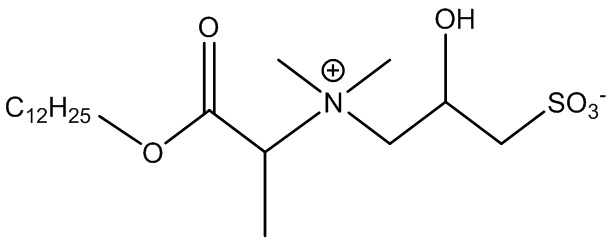
(Формула 2-3)
Примером ПАВ ZAA в соответствии с формулой 1, несущего циклическую группу, является 3-(3-(лауриламино-оксометил)-1-метилпиперидиний)-2-гидроксипропан-1-сульфонат, представленный в формуле 3:
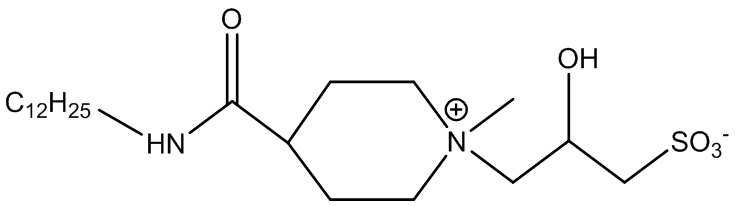 ,
,
(Формула 3)
где R2 и R4 соединены в циклическую структуру, образуя пиперидиниевую группу.
Как правило, композиции настоящего изобретения будут содержать от около 0,1% до около 30% масс./масс. ПАВ ZAA, или от около 0,5% до около 15% масс./масс. ПАВ ZAA, или от около 1% до около 10% масс./масс. ПАВ ZAA, или от около 1,5% до около 7% масс./масс. ПАВ ZAA, или от около 1,5% до около 5% масс./масс. ПАВ ZAA, или от около 1,5% до около 3,75% масс./масс. ПАВ ZAA, или от около 2,25% до около 3,75% масс./масс. ПАВ ZAA.
При использовании в настоящем документе термин «сульфонатное ПАВ ZAA» относится к ПАВ ZAA, где X представляет собой -SO3- или любую другую протонированную или солевую форму сульфонатной группы.
При использовании в настоящем документе термин «сульфатное ПАВ ZAA» относится к ПАВ ZAA, где X представляет собой -SO4- или любую другую протонированную или солевую форму сульфатной группы.
При использовании в настоящем документе термин «карбоксилатное ПАВ ZAA» относится к ПАВ ZAA, где X представляет собой -CO2- или любую другую протонированную или солевую форму карбоксигруппы.
При использовании в настоящем документе термин «фосфатное ПАВ ZAA» относится к ПАВ ZAA, где X представляет собой -PO4H- или любую другую протонированную, ионизированную или солевую форму фосфатной группы.
При использовании в настоящем документе термин «фосфонатное ПАВ ZAA» относится к ПАВ ZAA, где X представляет собой -PO3H- или любую другую протонированную, ионизированную или солевую форму фосфонатной группы.
Предпочтительно ПАВ ZAA не содержат алкиламидоаминов и аминоалкиламинов. Они представляют собой продукты реакции алкиламинов или алкиловых спиртов с производными аминокислот. Следовательно, они не содержат алкиламидоаминов (являющихся продуктом реакции алкановых кислот с аминоалкиламинами) или амидоалкиламинов. Цвиттерионные ПАВ предшествующего уровня техники состоят из алкиламидоаминов и амидоалкиламинов и, следовательно, содержат такие соединения.
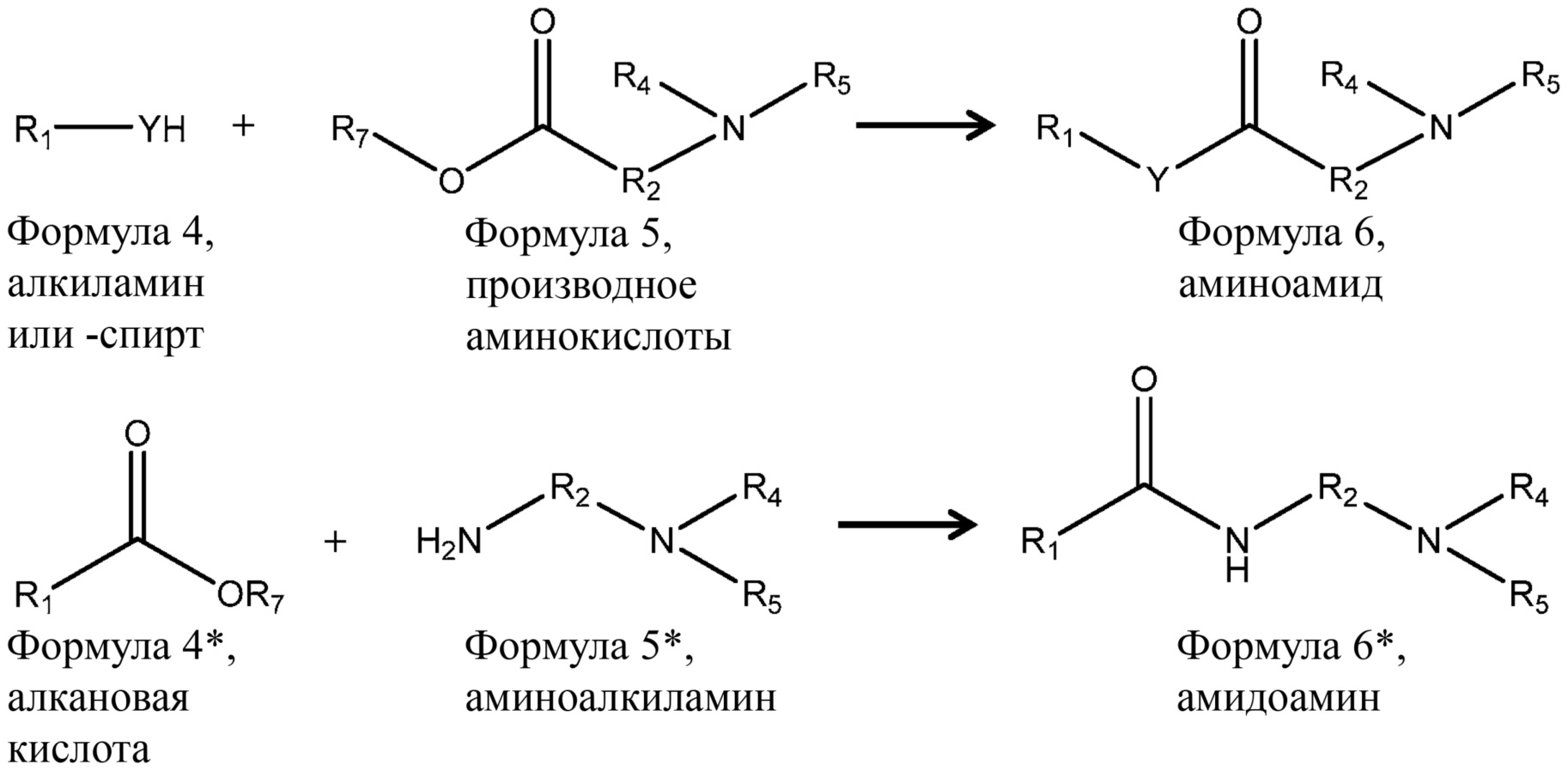
Схематический процесс получения ПАВ ZAA включает в себя:
(a) приведение в контакт спирта или амина, либо смеси спиртов или аминов формулы 4 с диалкиламинокарбоновой кислотой, либо сложным эфиром диалкиламинокарбоновой кислоты (производным аминокислоты), либо смесью диалкиламинокарбоновых кислот или сложных эфиров диалкиламинокарбоновых кислот формулы 5 в присутствии фермента в условиях, способствующих эффективному образованию промежуточного соединения формулы 6 (алканоиламида или алканоата), где Y, R1, R2, R4 и R5 являются такими, как определено выше в формуле 1, а R7 представляет собой атом водорода или C1-C6 алкил; и
(b) приведение в контакт промежуточного соединения формулы 6 с алкилирующим агентом в условиях, способствующих эффективному образованию ПАВ ZAA формулы 1. Приемлемыми алкилирующими агентами являются, например, 2-хлоруксусная кислота, или 2-гидрокси-3-хлорпропансульфонат, или 1,3-пропансультон.
С другой стороны, схематический процесс получения цвиттерионных ПАВ предшествующего уровня техники, например кокамидопропилбетаина, включает в себя:
(a*) приведение в контакт алкановой кислоты или смеси алкановых кислот формулы 4* с аминоалкиламином или смесью аминоалкиламинов формулы 5* в условиях, способствующих эффективному образованию промежуточного соединения формулы 6* (амидоамина); и
(b*) приведение в контакт промежуточного соединения формулы 6* с алкилирующим агентом в условиях, способствующих эффективному образованию цвиттерионного ПАВ, например кокамидопропилбетаина.
Все приводимые в настоящем описании процентные содержания представляют собой % масс., если особо не указано иное.
В контексте данного документа термин «по существу не содержащий алкиламидоамина и аминоалкиламина» означает композицию, которая содержит алкиламидоамин и/или аминоалкиламин в таких максимальных концентрациях, которые позволяют смягчить или избежать неблагоприятных аллергических или раздражающих кожу воздействий, вызываемых алкиламидоамином и/или аминоалкиламином, например около 0,1% масс./масс. или менее, или около 0,1% масс./масс. или менее, или около 0,05% масс./масс. или менее алкиламидоамина и/или аминоалкиламина. Еще более предпочтительно композиции не содержат алкиламидоамина и аминоалкиламина.
Некоторые варианты осуществления настоящего изобретения могут содержать второе ПАВ, отличное от ПАВ ZAA. Например, композиции могут дополнительно содержать анионные, катионные, неионные и/или цвиттерионные ПАВ в дополнение к ПАВ ZAA. В других вариантах осуществления композиции могут по существу не содержать ПАВ, отличных от ПАВ ZAA. В контексте настоящего документа термин «по существу не содержит ПАВ, отличного от ПАВ ZAA» означает композицию, которая содержит менее 0,5%, или менее 0,1%, или более предпочтительно менее 0,05% масс./масс. общего количества ПАВ, отличных от ПАВ ZAA. Еще более предпочтительно композиции не содержат ПАВ, отличных от ПАВ ZAA. При использовании дополнительных ПАВ, не являющихся ZAA, соотношение ПАВ ZAA и ПАВ, не являющихся ZAA (масс./масс.), может составлять от около 0,003 до около 300, или от около 0,1 до около 100, или от около 0,1 до около 10, или от около 0,1 до около 5, или от около 0,3 до около 3.
Где применимо, химические вещества указаны в соответствии с названиями, принятыми в Международной номенклатуре косметических компонентов (INCI). Дополнительную информацию, включая определения, поставщиков и торговые названия, можно найти в соответствующей монографии INCI в публикации International Cosmetic Ingredient Dictionary and Handbook, 14th Edition, опубликованной Советом по средствам для личной гигиены (Personal Care Products Council), г. Вашингтон, округ Колумбия, США.
Доступ также возможен через информационную базу Personal Care Products Council On-Line INFOBASE (http://online.personalcarecouncil.org/jsp/Home.jsp)
В контексте настоящего документа термин «анионное ПАВ» относится к молекуле поверхностно-активного вещества, несущей по меньшей мере отрицательный заряд и не имеющей положительного заряда, кроме противоиона (-ов) M+. К приемлемым анионным ПАВ относятся выбираемые из следующих классов ПАВ.
• Ацилизетионаты:
 ,
,
где RCO=C8-C20 ацил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, R'=H или CH3, M+=одновалентный катион, например кокоилизетионат натрия (RCO=кокоацил, R'=H, M+=Na+) и лауроилметилизетионат натрия (RCO=лауроил, R'=CH3, M+=Na+).
• Алкилсульфосукцинаты:
 ,
,
где R=C8-C20 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион, например динатрийлаурилсульфосукцинат (R=лаурил, M+=Na+).
• Сложные эфиры α-сульфожирной кислоты:
 ,
,
где R=C6-C16 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, R'=C1-C2 алкил, а M+=одновалентный катион, например метил-2-сульфолаурат натрия (R=C10H21, R'=метил, CH3, и M+=Na+).
• Соли α-сульфожирных кислот:
 ,
,
где R=C6-C16 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, M+=одновалентный катион, например динатрий-2-сульфолаурат (R=C10H21, M+=Na+).
• Алкилсульфоацетаты:
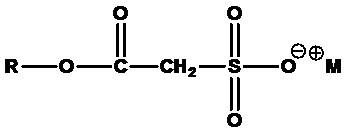 ,
,
где R=C6-C18 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, M+=одновалентный катион, например лаурилсульфоацетат натрия (R=лаурил, C12H25, M+=Na+).
• Алкилсульфаты:
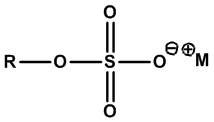 ,
,
где R=C8-C20 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси. Конкретные примеры включают ТЭА-лаурилсульфат (R=лаурил, C12H25, M+=+HN(CH2CH2OH)3), лаурилсульфат натрия (R=лаурил, C12H25, M+=Na+) и кокосульфат натрия (R=кокоалкил, M+=Na+).
• Алкилглицериловые эфирсульфонаты или алкоксилгидроксипропилсульфонаты:
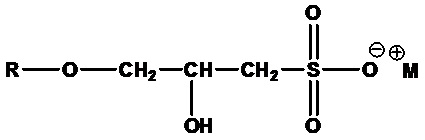 ,
,
где R=C8-C24 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, M+=одновалентный катион, например кокоглицериловый эфирсульфонат натрия (R=алкил кокосового масла, M+=Na+).
• Альфа-олефинсульфонаты (AOS), полученные путем сульфонирования длинноцепочечных альфа-олефинов. Альфа-олефинсульфонаты состоят из смеси алкенсульфонатов:
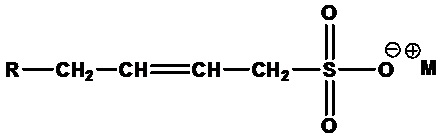 ,
,
где R=C4-C18 алкил или их смеси, М+=одновалентный катион, и гидроксиалкилсульфонатов:
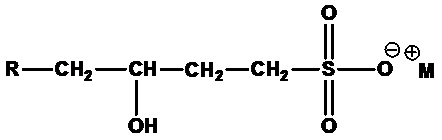 ,
,
где R=C4-C18 алкил или их смеси, М+=одновалентный катион. Примеры включают C12-C14 олефинсульфонат натрия (R=C8-C10 алкил, M+=Na+) и C14-C16 олефинсульфонат натрия (R=C10-C12 алкил, M+=Na+).
• Алкилсульфонаты или парафинсульфонаты:
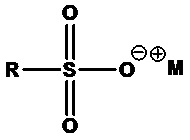 ,
,
где R=C8-C24 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, M+=одновалентный катион. Примеры включают C13-C17 алкансульфонат натрия (R=C13-C17 алкил, M+=Na+) и C14-C17 алкилсексульфонат натрия (R=C14-C17 алкил, M+=Na+).
• Алкиларилсульфонаты или линейные алкилбензолсульфонаты:
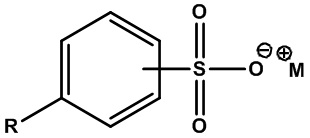 ,
,
где R=C6-C18 алкил (линейный, насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион. Примеры включают децеилбензолсульфонат натрия (R=C10 алкил, M+=Na+) и додецилбензолсульфонат аммония (R=C12 алкил, M+=NH4+).
• Алкилэфирсульфаты:
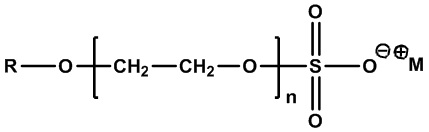 ,
,
где R=C8-C24 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, n=1-12, а M+=одновалентный катион. Примеры включают лауретсульфат натрия (R=C12 алкил, M+=Na+, n=1-3), лауретсульфат аммония (R=C12 алкил, M+=NH4+, n=1-3) и тридецетсульфат натрия (R=C13 алкил, M+=Na+, n=1-4).
• Алкилмоноглицеридсульфаты:
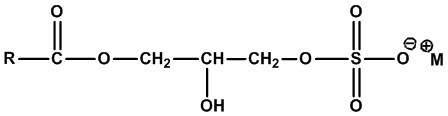 ,
,
где RСО=C8-C24 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион. Примеры включают кокомоноглицеридсульфат натрия (RCO=кокоацил, M+=Na+) и кокомоноглицеридсульфат аммония (RCO=кокоацил, M+=NH4+).
• Алкилэфиркарбоксилаты:
 ,
,
где R=C8-C24 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, n=1-20, а M+=одновалентный катион. Примеры включают лаурет-13 карбоксилат натрия (R=C12 алкил M+=Na+, n=13) и лаурет-3 карбоксилат натрия (R=C12 алкил, M+=Na+, n=3).
• Алкилэфирсульфосукцинаты:
 ,
,
где R=C8-C20 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, n=1-12, и M+=одновалентный катион, например динатрийлауретсульфосукцинат (R=лаурил, n=1-4, и M+=Na+)
• Диалкилсульфосукцинаты:
 ,
,
где R=C6-C20 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион, например диэтилгексилсульфосукцинат натрия (R=2-этилгексил, M+=Na+).
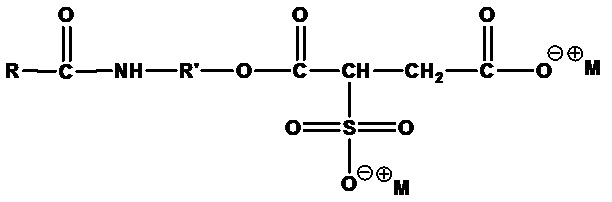
• Алкиламидоалкилсульфосукцинаты:
 ,
,
где R=C8-C20 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, R'=C2-C4 алкил (линейный или разветвленный), а М+=одновалентный катион, например двунатриевый кокамид-MIPA-сульфосукцинат (RCO=кокоацил, R'=изопропил, М+=Na+).
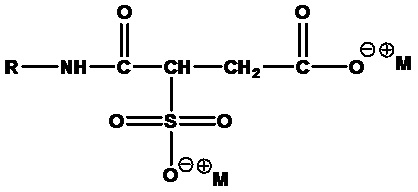
• Алкилсульфосукцинаматы:
 ,
,
где R=C8-C20 алкил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион, например динатрийстеарилсульфосукцинамат (R=стеарил, C18H37, M+=Na+).
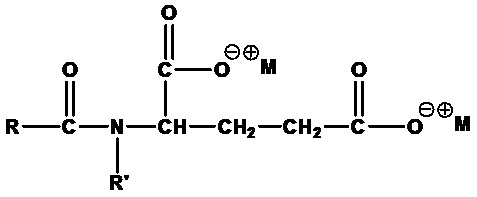
• Ацилглутаматы:
 ,
,
где RCO=C6-C20 ацил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, R'=H или CH3, M+=одновалентный катион, например динатрийкокоилглутамат (RCO=кокоацил, R'=H, M+=Na+) и динатрийлауроилглутамат (RCO=лауроил, R'=H, M+=Na+).
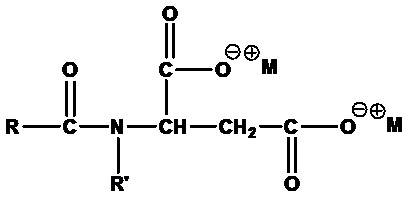
• Ациласпартаты:
 ,
,
где RCO=C6-C20 ацил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, R'=H или CH3, M+=одновалентный катион, например динатрий-N-лауроиласпартат (RCO=лауроил, R'=H, M+=Na+).
• Ацилтаураты:
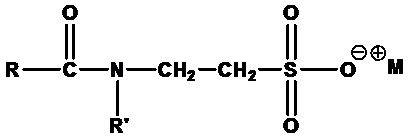 ,
,
где RCO=C6-C20 ацил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, R'=H или CH3, M+=одновалентный катион, например метилкокоилтаурат натрия (RCO=кокоацил, R'=CH3, M+=Na+) и кокоилтаурат натрия (RCO=лауроил, R'=H, M+=Na+).
• Ациллактилаты:
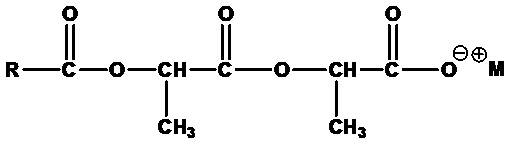 ,
,
где RCO=C8-C20 ацил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, M+=одновалентный катион, например лауроиллактилат натрия (RCO=лауроил, M+=Na+).
• Ацилглицинаты и ацилсаркозинаты:
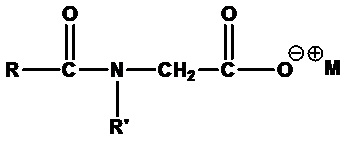 ,
,
где RCO=C8-C20 ацил (линейный или разветвленный, насыщенный или ненасыщенный) или их смеси, R'=H (глицинат) или CH3 (саркозинат), M+=одновалентный катион, например кокоилглицинат натрия (RCO=кокоацил, R'=H, M+=Na+), кокоилсаркозинат аммония (RCO=кокоацил, R'=CH3, M+=NH4+) и лауроилсаркозинат натрия (RCO=лауроил, R'=CH3, M+=Na+).
• Анионные производные алкилполигликозидов, включая: лаурилгликозидкарбоксилат натрия, динатрийкокогликозидцитрат, кокогликозидтартрат натрия, двунатриевый кокогликозидсульфосукцинат; гидроксипропилсульфонат кокоглюкозидов натрия, гидроксипропилсульфонат децилглюкозидов натрия, гидроксипропилсульфонат лаурилглюкозидов натрия; сшитый полимер гидроксипропилсульфоната и кокоглюкозида натрия, сшитый полимер гидроксипропилсульфоната и децилглюкозида натрия, сшитый полимер гидроксипропилсульфоната и лаурилглюкозида натрия; анионные полимерные производные APG, такие как описанные в публикации O'Lenick, патентах США № 7,507,399; 7,375,064; и 7,335,627); и комбинации двух или более из них и т. п.
В некоторых вариантах осуществления композиции настоящего изобретения по существу не содержат анионных ПАВ и предпочтительно не содержат анионных ПАВ.
В контексте настоящего документа термин «сульфатированное анионное ПАВ» относится к анионным ПАВ, содержащим группу -SO4-M+, где отсутствует M+, или H+, или NH4+, или Na+, или K+, или другой одновалентный или многовалентный анион. Примеры сульфатированных анионных ПАВ включают без ограничений лаурилсульфат натрия и лауретсульфат натрия. В некоторых вариантах осуществления композиции настоящего изобретения по существу не содержат сульфатированного анионного ПАВ и предпочтительно не содержат сульфатированного анионного ПАВ.
В контексте настоящего документа термин «неионное ПАВ» относится к молекуле поверхностно-активного вещества, не имеющей электростатического заряда. Любое из множества неионных ПАВ приемлемо для применения в настоящем изобретении. Примеры приемлемых неионных ПАВ включают без ограничений этоксилаты спиртов, кислот или амидов жирного ряда, этоксилаты моноглицеридов, сложные эфиры этоксилатов сорбитана, алкилполигликозиды, их смеси и т. п. Некоторые предпочтительные неионные ПАВ включают полиэтиленокси-производные сложных эфиров полиолов, где полиэтиленокси-производное сложного эфира полиола (1) получено из (а) жирной кислоты, содержащей от около 8 до около 22 и предпочтительно от около 10 до около 14 атомов углерода, и (b) полиола, выбираемого из сорбита, сорбитана, глюкозы, α-метилглюкозида, полиглюкозы, имеющей в среднем от около 1 до около 3 глюкозных остатков на одну молекулу, глицерина, пентаэритрита и их смесей, (2) содержит в среднем от около 10 до около 120, а предпочтительно от около 20 до около 80 звеньев этиленокси-; и (3) имеет в среднем от около 1 до около 3 остатков жирной кислоты на один моль полиэтиленокси-производного сложного эфира полиола. К примерам таких предпочтительных полиэтиленокси-производных сложных эфиров полиола без ограничений относятся ПЭГ-80-сорбитанлаурат и полисорбат 20. ПЭГ-80-сорбитанлаурат представляет собой моноэфир сорбитана и лауриновой кислоты, этоксилированного с использованием в среднем около 80 моль этиленоксида. Полисорбат 20 представляет собой сложный моноэфир лаурата и смеси сорбита и ангидридов сорбита, конденсированный с этиленоксидом в количестве приблизительно 20 моль.
Другой класс приемлемых неионных ПАВ включает длинноцепочечные алкилглюкозиды или полиглюкозиды, которые являются продуктами конденсации (a) длинноцепочечного спирта, содержащего от около 6 до около 22 и предпочтительно от около 8 до около 14 атомов углерода, с (b) глюкозой или глюкозосодержащим полимером. Предпочтительные алкилглюкозиды содержат от около 1 до около 6 остатков глюкозы на одну молекулу алкилглюкозида. Предпочтительным глюкозидом является децилглюкозид, представляющий собой продукт конденсации децилового спирта с олигомером глюкозы.
К другим классам приемлемых неионных ПАВ относится «полиглицериловое неионное ПАВ». К примерам полиглицериловых неионных ПАВ относятся без ограничений сложные полиглицериловые эфиры (PGE), например полиглицерин-10-лаурат.
В контексте настоящего документа термин «полиглицериловое неионное ПАВ» означает амфифильную молекулу, содержащую один или более неионных гидрофильных фрагментов, состоящих из полиглицериловой функциональной группы и одной или более гидрофобных функциональных групп. Примеры полиглицериловых неионных ПАВ включают без ограничений сложные полиглицериловые эфиры (PGE), такие как полиглицерил-10-лаурат, где PG=полиглицериловая функциональная группа, содержащая десять (10) повторяющихся звеньев глицерила, а R=C11H23:
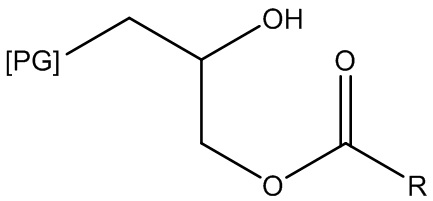 ,
,
а также полиглицерил-10-каприлат/капрат, полиглицерил-10-кокоат, полиглицерил-10-миристат, полиглицерил-10-пальмитат, полиглицерил-10-олеат, полиглицерил-12-лаурат и т. п. PGE настоящего изобретения могут включать полиглицериловые функциональные группы, несущие множественные замещения сложноэфирной группой (т. е. PGE могут представлять собой моноэфиры, диэфиры, триэфиры и т. п.). Другие полиглицериловые неионные ПАВ включают простые полиглицериловые эфиры, такие как полиглицерил-10-лауриловый эфир, где PG=полиглицериловая функциональная группа, содержащая 10 повторяющихся звеньев глицерила, а C12H25:
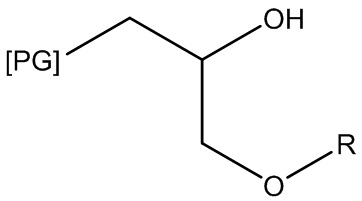
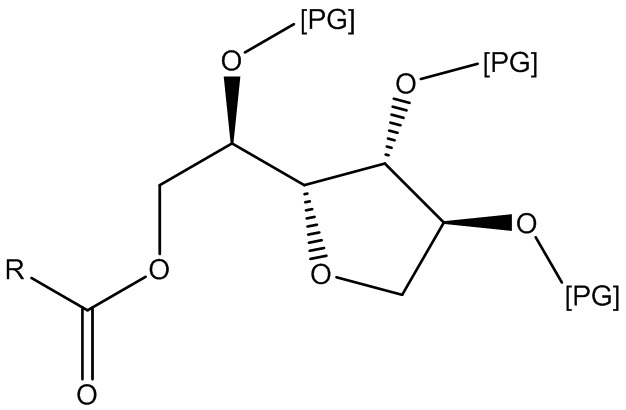
и т. п. Другие полиглицериловые неионные ПАВ включают сложные эфиры жирных кислот и полиглицерилсорбитана, такие как полиглицерил-20-сорбитанлаурат, где PG=полиглицерил, сумма всех повторяющихся звеньев (RU) PG=20, а R=C11H23. (см. патентную публикацию Bevinakatti et al. WO 2009016375, принадлежащую компании Croda International PLC):
 .
.
В композициях настоящего изобретения можно использовать любые приемлемые полиглицериловые неионные ПАВ. В некоторых предпочтительных вариантах осуществления полиглицериловые неионные ПАВ выбирают из группы, состоящей из сложных полиглицериловых эфиров, простых полиглицериловых эфиров, сложных эфиров жирных кислот и полиглицерилсорбитана, комбинаций двух или более из них и т. п. В некоторых более предпочтительных вариантах осуществления полиглицериловые неионные ПАВ выбирают из группы, состоящей из сложных полиглицериловых эфиров, простых полиглицериловых эфиров и комбинаций двух или более из них. В некоторых других предпочтительных вариантах осуществления композиции настоящего изобретения содержат одно или более полиглицериловых неионных ПАВ, выбираемых из группы, состоящей из: полиглицерил-4-каприлата/капрата, полиглицерил-5-каприлата/капрата, полиглицерил-6-каприлата/капрата, полиглицерил-7-каприлата/капрата, полиглицерил-8-каприлата/капрата, полиглицерил-9-каприлата/капрата, полиглицерил-10-каприлата/капрата, полиглицерил-4-капрата, полиглицерил-5-капрата, полиглицерил-6-капрата, полиглицерил-7-капрата, полиглицерил-8-капрата, полиглицерил-9-капрата, полиглицерил-10-капрата, полиглицерил-4-лаурата, полиглицерил-5-лаурата, полиглицерил-6-лаурата, полиглицерил-7-лаурата, полиглицерил-8-лаурата, полиглицерил-9-лаурата, полиглицерил-10-лаурата, полиглицерил-6-кокоата, полиглицерил-7-кокоата, полиглицерил-8-кокоата, полиглицерил-9-кокоата, полиглицерил-10-кокоата, полиглицерил-11-кокоата, полиглицерил-12-кокоата, полиглицерил-6-миристата, полиглицерил-7-миристата, полиглицерил-8-миристата, полиглицерил-9-миристата, полиглицерил-10-миристата, полиглицерил-11-миристата, полиглицерил-12-миристата, полиглицерил-10-олеата, полиглицерил-11-олеата, полиглицерил-12-олеата, полиглицерил-10-стеарата, полиглицерил-11-стеарата, полиглицерил-12-стеарата и комбинации двух или более вышеуказанных соединений.
В предпочтительных вариантах осуществления используемые в настоящем изобретении полиглицериловые неионные ПАВ имеют общую комбинированную степень полимеризации (СП) глицерила (т. е. общее количество повторяющихся глицериловых звеньев в данной молекуле) от около 4 до около 40 повторяющихся звеньев. В некоторых более предпочтительных вариантах осуществления полиглицериловые неионные ПАВ имеют СП от около 6 до около 30, более предпочтительно от около 6 до около 20, более предпочтительно от около 6 до около 15 и более предпочтительно от около 6 до около 12 повторяющихся глицериловых звеньев.
В композициях настоящего изобретения можно использовать любое приемлемое количество полиглицерилового неионного ПАВ. В некоторых вариантах осуществления композиции содержат от более нуля до около 25% масс. полиглицерилового неионного ПАВ. В некоторых предпочтительных вариантах осуществления композиции содержат от около 0,05% масс. до около 20% масс., более предпочтительно от около 0,1% масс. до около 15% масс., и еще более предпочтительно от около 0,2% масс. до около 10% масс., и еще более предпочтительно от около 0,25% масс. до около 5% масс. полиглицерилового неионного ПАВ от общего количества.
Другой класс приемлемых неионных ПАВ включает алканоламиды, такие как кокамид моноэтаноламина (МЭА) и кокамид диэтаноламина (ДЭА).
В контексте настоящего документа термин «цвиттерионное ПАВ, отличное от ПАВ ZAA» относится к амфифильной молекуле, содержащей гидрофобную группу и одну или более гидрофильных групп, содержащих две функциональные группы с противоположными формальными зарядами или способные нести противоположные формальные заряды (в зависимости от кислотно-щелочных свойств и рН раствора). Иногда такие ПАВ также называют «амфотерными ПАВ». Примеры цвиттерионных ПАВ, отличных от ПАВ ZAA, включают следующие.
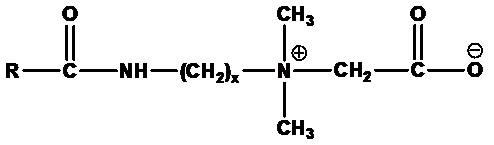
Алкиламидоалкилбетаины формулы:
 ,
,
где RСО=C6-C24 ацил (насыщенный или ненасыщенный) или их смеси, а x=1-4. Примеры включают кокамидоэтилбетаин (RCO=кокоацил, x=2), кокамидопропилбетаин (RCO=кокоацил, x=3), лаурамидопропилбетаин (RCO=лауроил, а x=3), миристамидопропилбетаин (RCO=миристоил, а x=3), соевый амидопропилбетаин (R=ацил соевого масла, x=3) и олеамидопропилбетаин (RCO=олеоил, а x=3).
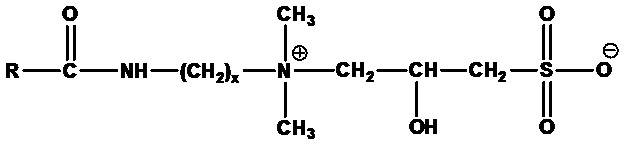
Алкиламидоалкилгидроксисултаины формулы:
 ,
,
где RCO=C6-C24 ацил (насыщенный или ненасыщенный) или их смеси. Примеры включают кокамидопропилгидроксисултаин (RCO=кокоацил, x=3), лаурамидопропилгидроксисултаин (RCO=лауроил, а x=3), миристамидопропилгидроксисултаин (RCO=миристоил, а x=3) и олеамидопропилгидроксисултаин (RCO=олеоил, а x=3).
Алкиламидоалкилсултаины формулы:
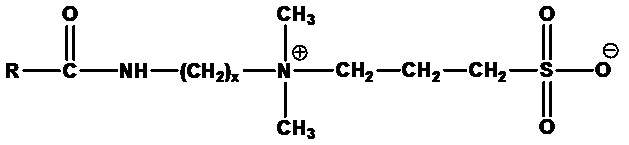 ,
,
где RCO=C6-C24 ацил (насыщенный или ненасыщенный) или их смеси. Примеры включают кокамидопропилсултаин (RCO=кокоацил, x=3), лаурамидопропилсултаин (RCO=лауроил, а x=3), миристамидопропилсултаин (RCO=миристоил, а x=3), соевый амидопропилбетаин (RCO=ацил соевого масла, x=3) и олеамидопропилбетаин (RCO=олеоил, а x=3).
Амфоацетаты формулы:
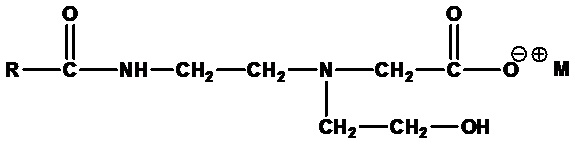 ,
,
где RСО=C6-C24 ацил (насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион. Примеры включают лауроамфоацетат натрия (RCO=лауроил, а M+=Na+) и кокоамфоацетат натрия (RCO=кокоацил, а M+=Na+).
Амфодиацетаты формулы:
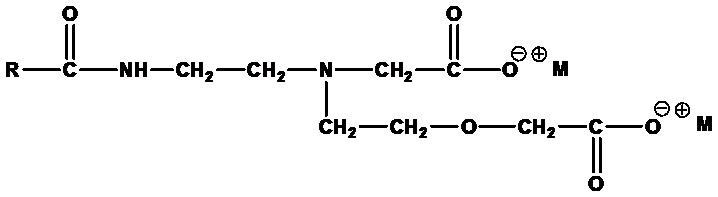 ,
,
где RСО=C6-C24 ацил (насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион. Примеры включают динатрийлауроамфодиацетат (RCO=лауроил, а M =Na+) и динатрийкокоамфодиацетат (RCO=кокоацил, а M=Na+).
Амфопропионаты формулы:
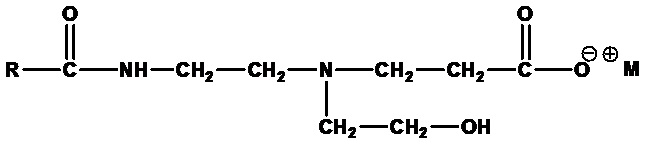 ,
,
где RСО=C6-C24 ацил (насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион. Примеры включают лауроамфопропионат натрия (RCO=лауроил, а M+=Na+) и кокоамфопропионат натрия (RCO=кокоацил, а M+=Na+).
Амфодипропионаты формулы:
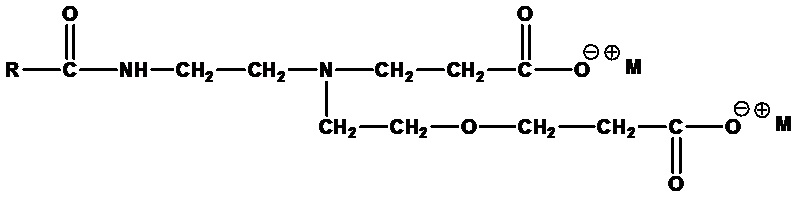 ,
,
где RСО=C6-C24 ацил (насыщенный или ненасыщенный) или их смеси, а M+=одновалентный катион. Примеры включают динатрийлауроамфодипропионат (RCO=лауроил, а M+=Na+) и динатрийкокоамфодипропионат (RCO=кокоацил, а M+=Na+).
Амфогидроксипропилсульфонаты формулы:
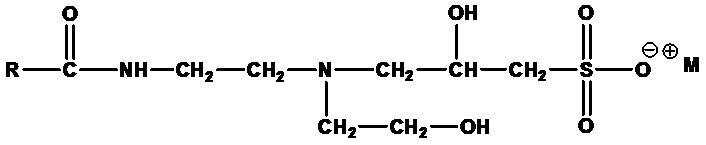 ,
,
где RCO=C6-C24 ацил (насыщенный или ненасыщенный) или их смеси, а M+ представляет собой одновалентный катион, например лауроамфогидроксипропилсульфонат натрия (RCO=лауроил, а M+= Na+) и кокоамфогидроксипропилсульфонат натрия (RCO=кокоацил, а M+=Na+).
Другие примеры включают амфогидроксиалкилфосфаты и оксиды алкиламидоалкиламина.
В некоторых вариантах осуществления настоящего изобретения композиция может дополнительно содержать неорганическую соль. Неорганические соли, приемлемые для применения в данном изобретении, включают без ограничений хлорид натрия, хлорид калия, бромид натрия, бромид калия, хлорид аммония, бромид аммония и другие соли, содержащие как одновалентные, так и многовалентные ионы. Как правило, композиции настоящего изобретения содержат от около 0,05% до около 6% масс./масс. неорганической соли, или от около 0,1% до около 4% масс./масс. неорганической соли, или от около 0,1% до около 2% масс./масс. неорганической соли, или от около 0,1% до около 1,5% масс./масс. неорганической соли.
Значение рН композиции настоящего изобретения доводят предпочтительно до интервала от около 3 до около 9, более предпочтительно от около 3,5 до около 7 и наиболее предпочтительно от около 4 до около 6. Значение рН композиции можно даже понижать до 3 при условии отсутствия отрицательного воздействия на стабильность и качество состава (например, на пенообразование, мягкость действия и вязкость). Значение pH композиции можно доводить до соответствующего значения кислотности путем использования любой косметически приемлемой органической или неорганической кислоты, такой как лимонная кислота, уксусная кислота, гликолевая кислота, молочная кислота, яблочная кислота, винная кислота, соляная кислота, комбинации двух или более из них и т. п.
В некоторых вариантах осуществления настоящего изобретения композиция может дополнительно содержать катионное ПАВ. Классы катионных ПАВ, приемлемых для применения в данном изобретении, включают без ограничений четвертичные алкильные соединения (моно-, ди- или три-), четвертичные бензильные соединения, четвертичные сложноэфирные соединения, четвертичные этоксилированные соединения, алкиламины и их смеси, где алкильная группа имеет от около 6 атомов углерода до около 30 атомов углерода, предпочтительно от около 8 до около 22 атомов углерода. В некоторых вариантах осуществления настоящего изобретения композиция содержит катионные полимеры с кондиционирующим действием. Примеры приемлемых катионных полимеров с кондиционирующим действием включают: катионную целлюлозу и ее производные; катионную гуаровую камедь и ее производные; и хлорид диаллилдиметиламмония. Производное катионной целлюлозы может представлять собой полимерную соль четвертичного аммония, полученную в результате взаимодействия гидроксиэтилцеллюлозы с замещенным эпоксидом триметиламмония, известным как поликватерний-10. Производное катионной гуаровой камеди может представлять собой хлорид гуаргидроксипропилтримония. Другими используемыми катионными полимерами с кондиционирующим действием являются те, которые получены из мономера хлорида диаллилдиметиламмония. Гомополимером данного мономера является поликватерниум-6. Сополимер хлорида диаллилдиметиламмония и акриламида известен как поликватерниум-7. Другие приемлемые полимеры с кондиционирующим действием включают те, которые описаны в патенте США № 5,876,705, включенном в настоящий документ путем ссылки.
Композиция данного изобретения может дополнительно содержать любые другие ингредиенты или добавки, обычно используемые в средствах личной гигиены, например в дерматологических или косметических составах, включая активные ингредиенты. Примерами дополнительных ингредиентов или добавок являются поверхностно-активные вещества, эмульгаторы, кондиционирующие агенты, умягчители, смачивающие средства, увлажнители, загустители, смазывающие вещества, хелатирующие агенты, наполнители, связывающие агенты, антиоксиданты, консерванты, активные ингредиенты, ароматизаторы, красители, буферные агенты, эксфолианты, регуляторы pH, растворители, регуляторы вязкости и замутняющие агенты и т. п. при условии, что они физически и химически совместимы с другими компонентами композиции. Активные ингредиенты могут включать без ограничений противовоспалительные агенты, антибактериальные агенты, противогрибковые агенты, противозудные агенты, увлажняющие агенты, растительные экстракты, витамины и т. п. Они также включают солнцезащитные активные вещества, которые могут иметь неорганическую или органическую природу. Особый интерес представляют любые активные ингредиенты, приемлемые для местного нанесения композиций для личной гигиены.
Примеры загустителей и модификаторов реологических свойств включают без ограничений полисахариды природного происхождения, в том числе ксантановую камедь, дегидроксантановую камедь, камедь Cyamopsis tetragonoloba (гуаровую камедь), кассиевую камедь, камедь Chondrus crispus (каррагинановую камедь), альгиновокислотные и альгинатные камеди (например, альгин, альгинат кальция и т. п.), геллановую камедь, пектин, микрокристаллическую целлюлозу, неэтоксилированные производные целлюлозы (например, натрийкарбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу и т. п.) и гидроксипропилгуар, и синтетические полимеры, такие как акриловые набухающие в щелочи эмульсионные (ASE) полимеры, такие как акрилатный сополимер, предлагаемый под торговым названием Carbopol® AQUA SF-1 производства компании Lubrizol Corp., г. Брексвилл, штат Огайо, США, гидрофобно-модифицированные акрилатные сшитые полимеры, такие как сшитый сополимер акрилатов и C10-30 алкилакрилатов, предлагаемый под торговым названием Carbopol® 1382 производства компании Lubrizol Corp., г. Брексвилл, штат Огайо, США, а также мицеллярные загустители, такие как кокамид MIPA, лауриллактиллактат или сорбитансесквикаприлат, и комбинации двух или более из них и т. п.;
Примеры консервантов и усилителей консервантов включают без ограничений органические кислоты (такие как, например, бензойная кислота, молочная кислота, салициловая кислота), бензиловый спирт, каприлилгликоль, дециленгликоль, этилгексилглицерин, глюконолактон, метилизотиазолинон и комбинации двух или более из них и т. п.
Приведенные ниже примеры подразумеваются как иллюстративные для настоящего изобретения и не имеют ограничительного характера.
ПРИМЕРЫ
Используемые в примерах методы испытаний описаны ниже.
Испытание вязкости при нулевом сдвиге
Определения кажущейся вязкости очищающих композиций при нулевом сдвиге проводили на реометре с регулируемым напряжением сдвига (AR-2000, TA Instruments Ltd., г. Нью-Касл, штат Делавер, США). Развертки стационарного сдвигового напряжения выполняли при 25,0 ± 0,1°C с использованием системы геометрической формы конус-плита. Сбор и анализ данных осуществляли с использованием программного обеспечения Rheology Advantage v4.1.10 (TA Instruments Ltd., г. Нью-Касл, штат Делавер, США). Значения кажущейся вязкости при нулевом сдвиге для ньютоновских жидкостей выражены как средние величины вязкости, полученные в диапазоне напряжений сдвига (0,02-1,0 Па). Для псевдопластичных (снижающих вязкость при сдвиге) жидкостей значения кажущейся вязкости при нулевом сдвиге рассчитывали путем подстановки данных измерения напряжений сдвига в модель вязкости Эллиса. Если не указано иное, значения вязкости приведены в сантипуазах (сПз).
Испытание состава на пенообразование
Представленное ниже испытание состава на пенообразование было выполнено на различных очищающих композициях с целью определения объема пены, образующейся при перемешивании, в соответствии с настоящим изобретением. Сначала получают раствор испытуемой композиции в имитации водопроводной воды. Для воспроизведения жесткости водопроводной воды растворяют 0,455 г дигидрохлорида кальция (Sigma-Aldrich) в 1000 г деионизированной воды и перемешивают в течение 15 минут перед использованием. В зависимости от надлежащего уровня, необходимого для обеспечения соответствующего уровня пенообразования для измерения прибором, взвешивают 1,0 (один) или 5,0 (пять) грамм испытуемой композиции, и этот раствор добавляют к 1000 г и перемешивают до однородного состояния в течение 15 минут перед использованием. Чтобы определить объем образуемой составом пены, испытуемую композицию (1000 мл) добавляли в емкость для образца прибора для определения пенообразования SITATM R-2000 (имеется в продаже от компании Future Digital Scientific, Co.; дер. Бетпейдж, штат Нью-Йорк, США). Параметры испытания были установлены для проведения трех повторов (число серий=3) испытания образцов в объеме 250 мл (объем наполнения=250 мл) с тринадцатью циклами перемешивания (число циклов перемешивания=13) по 15 секунд на цикл (время перемешивания=15 с) со скоростью вращения ротора 1200 об/мин (число оборотов=1200) при установке температуры 30°C ± 2°C. В конце каждого цикла перемешивания получали данные по объему пены, а также определяли среднее значение и стандартное отклонение для трех повторов. Максимальный объем пены указывали для каждого примера как значение, полученное после тринадцатого цикла перемешивания.
Модель кожи EpiDerm™ с конечными точками по цитотоксичности и цитокинам
Растворы согласно рецептуре набора с образцами кожи EpiDerm™ (MatTek Corporation) хранили, как указано производителем. Ткани EpiDerm™ хранили при 2-8°C до применения. За день до дозирования будет отобран необходимый объем не содержащей гидрокортизона аналитической среды EpiDerm™ (приготовленной без гидрокортизона) (HCF-AM) и нагрет до приблизительно 37 °C. Аликвоты по 0,9 (девять десятых) мл HCF-AM будут распределены в лунки 6-луночных планшетов. Перед вскрытием запечатанной упаковки каждый образец ткани EpiDerm™ будет проверен на наличие пузырьков воздуха между агарозным гелем и тканевой вставкой. Ткани с пузырьками воздуха, покрывающими более 50% площади тканевой вставки, не будут использоваться. 24-луночные контейнеры для перевозки будут извлечены из пластикового пакета, и поверхность будет продезинфицирована 70% этанолом. Необходимое количество образцов ткани EpiDerm™ будет перенесено из 24-луночных контейнеров для перевозки в 6-луночные планшеты для испытуемых изделий, и параллельно с воздействием на испытуемое изделие будут обрабатываться отрицательные контроли. Ткани EpiDerm™ будут инкубировать при 37 ± 1 °C в увлажненной атмосфере с содержанием в воздухе 5 ± 1% CO2 (стандартные условия культивирования) в течение ночи (по меньшей мере 16 часов), чтобы акклиматизировать ткань и стабилизировать экспрессию цитокинов. При вскрытии пакета любые неиспользованные ткани, оставшиеся на агаре для перевозки на момент переноса ткани, будут подвергать кратковременной газификации в атмосфере 5% CO2/95% воздуха, и пакет будут запечатывать и хранить при 2-8°C для последующего использования.
Анализ MTT. По меньшей мере через 16 ч после начала обработки тканей среда под тканью будет удалена, и в каждую лунку будет добавлено 0,9 мл свежей подогретой среды HCF-AM. Каждое испытуемое изделие и отрицательный контрольный образец (для воздействия испытуемого изделия) будут подвергать испытанию путем обработки трех тканевых конструктов EpiDerm™ в течение времени воздействия, указанного в приложении 1 к протоколу. На каждый образец ткани EpiDerm™ будет нанесено 100 мкл (сто микролитров) жидкого испытуемого изделия (и отрицательного контрольного образца) или 30 ± 1 мг (твердые испытуемые изделия). По окончании периода воздействия испытуемого изделия каждая ткань будет промыта пять раз не содержащим Ca++ и Mg++ фосфатно-солевым буферным раствором Дульбекко (Ca++Mg++Free-DPBS) приблизительно по 0,5 мл на каждую промывку. DPBS будет осторожно внесен пипеткой в лунку, а затем отобран аспиратором. Необходимо соблюдать осторожность, чтобы избегать прикосновения к поверхности ткани. После промывки каждая ткань будет помещена в предназначенную для нее лунку нового 6-луночного планшета, содержащего 0,9 мл свежей среды HCF-AM. После промывки образцы ткани будут возвращены в инкубатор и проинкубированы в стандартных условиях культивирования в течение периода инкубации после воздействия. Положительный/отрицательный контроль: Положительный контроль 100 мкл 1% Triton®-X-100 будет подвергнут испытанию на двух повторах образца ткани в течение 4 и 8 часов культивирования с использованием стандартной аналитической среды, содержащей гидрокортизон. Ткани будут проинкубированы в стандартных условиях культивирования в течение соответствующих периодов времени воздействия. Для параллельного введения отрицательного контроля будет использовано сто мкл стерильной воды. Обработку образцов тканей в двух повторах отрицательным контролем будут выполнять в течение 8-часового времени воздействия с использованием стандартной аналитической среды, содержащей гидрокортизон. Отрицательный контроль, испытываемый параллельно с воздействием испытуемого изделия, будут подвергать испытанию на трех повторах образцов ткани в аналитической среде, не содержащей гидрокортизона. Не более чем за два часа до использования исходный 10-кратный раствор MTT, приготовленный в ФСБ (профильтрованный во время приготовления серии), будет разморожен и разведен в теплой среде для добавления MTT (MTT Addition Medium) с получением раствора 1,0 мг/мл. В каждую лунку предварительно маркированного 24-луночного планшета будет добавлено по триста мкл раствора MTT. После необходимого времени воздействия 6-луночный планшет будет подвергнут осторожному встряхиванию для равномерного перемешивания любых высвобождаемых в среду цитокинов. Ткани, обработанные положительным и соответствующим отрицательным контролем, будут промыты, чтобы удалить контрольные изделия. Каждый образец ткани EpiDerm™ будет извлечен из инкубационной среды, промыт не содержащим Ca++ и Mg++ фосфатно-солевым буферным раствором Дульбекко (Ca++Mg++Free-DPBS) для удаления испытуемого изделия, и избыток Ca++Mg++Free-DPBS будет слит. После промывания ткани EpiDerm™ будут перенесены в соответствующие лунки. Перед перенесением в раствор MTT ткани, обработанные испытуемым изделием и соответствующим отрицательным контрольным образцом, будут высушены путем промокания (без ополаскивания). 24-луночные планшеты будут проинкубированы в стандартных условиях культивирования в течение 3 ± 0,1 часов. Среда из-под каждой ткани EpiDerm™, обработанной каждым испытуемым изделием, отрицательным и положительным контрольными образцами соответственно, будет многократно перемешана движением пипетки вверх и вниз для равномерного распределения цитокинов, извлечена и помещена равными частыми в два-три предварительно маркированных криофлакона. Флаконы будут подвергнуты быстрому замораживанию в бане из сухого льда/этанола и будут храниться при температуре - ≤ 60 °C для последующего анализа на цитокины. По окончании 3-часового периода инкубации с MTT ткани EpiDerm™ будут подвергнуты промоканию на впитывающей бумаге и перенесены в лунки предварительно маркированного 24-луночного планшета, содержащие по 2,0 мл изопропанола на каждую лунку. Планшеты будут покрыты пленкой парафильм и будут храниться в замороженном состоянии до сбора последних образцов. При необходимости планшеты могут храниться в течение ночи (или до 24 ч после сбора ткани) в холодильнике до экстракции MTT. Далее планшеты будут подвергнуты встряхиванию в течение приблизительно 2 часов при комнатной температуре. По окончании периода экстракции жидкость внутри тканевых вставок будет слита в лунку, из которой была извлечена тканевая вставка. Экстрагирующий раствор будет перемешан, и в соответствующие лунки 96-луночного планшета будет перенесено по 200 мкл. В две лунки, предназначенные для холостых проб, будет добавлено по двести мкл изопропанола. Оптическая плотность при 550 нм (OD550) в каждой лунке будет измерена с помощью считывающего устройства для планшетов Vmax компании Molecular Devices. Будет вычислено среднее арифметическое значение OD550 лунок с холостой пробой. Скорректированное среднее арифметическое значение OD550 отрицательного (-ых) контроля (-ей) будет определено путем вычитания из их средних арифметических значений OD550 среднего арифметического значения OD550 лунок с холостой пробой. Скорректированные значения OD550 отдельных периодов времени воздействия испытуемых изделий и периодов времени воздействия положительных контролей будут определены путем вычитания из каждого значения среднего арифметического значения OD550 для лунок с холостой пробой. Все расчеты будут выполнены с использованием электронных таблиц Excel.
Скорр. значение OD550 времени воздействия испытуемого изделия=OD550 времени воздействия испытуемого изделия - среднее арифметическое OD550 холостой пробы
При использовании убитых контролей (KC) будут выполнены следующие дополнительные вычисления для коррекции количества МТТ, уменьшенного непосредственно из-за остатков испытуемых изделий. Значение OD550 для обработанного отрицательным контрольным образцом убитого контроля будут вычитать из значений OD550 для каждого из обработанных испытуемым изделием убитых контролей (при каждом соответствующем времени воздействия) с получением чистых значений OD550 для убитых контролей, обработанных испытуемым изделием.
Чистая OD550 для каждого обработанного испытуемым изделием KC=Исходная OD550 для обработанного испытуемым изделием KC - исходная OD550 для обработанного отрицательным контролем KC
Чистые значения OD550 представляют собой количественное уменьшение MTT за счет прямого уменьшения из-за остатков испытуемого изделия при конкретных периодах времени воздействия. По существу, если чистое значение OD550 превышает 0,150, то чистое количественное уменьшение MTT будут вычитать из скорректированных значений OD550 обработанных жизнеспособных тканей при каждом периоде времени воздействия с получением итогового скорректированного значения OD550. Эти итоговые скорректированные значения OD550 далее будут использованы для определения % жизнеспособности контрольных образцов при каждом периоде времени воздействия.
Итоговая скорректированная OD550=cкорректированная OD550 (жизнеспособного) испытуемого изделия - чистая OD550 испытуемого изделия (KC)
Наконец, будут выполнены следующие расчеты % от контроля:

Будут построены кривые зависимости ответа от времени воздействия для положительного контроля, где на оси ординат отложен % от контроля, а на оси абсцисс - время воздействия положительного контроля. Значение ET50 будет интерполировано из графика.
Иммунологический анализ на IL-1α. Микротитрационные планшеты, покрытые моноклональными антителами к IL-1 α, будут храниться до использования при 2-8°C. Все остальные реагенты будут храниться, как описано в инструкциях, прилагаемых к набору. Для приготовления стандартных растворов и разведения супернатантов будет использован разбавитель RD5-5. Стандартный раствор 250 пг/мл IL-1 α будет приготовлен путем разведения содержимого исходного флакона в 5 мл RD5-5 и будет оставлен стоять по меньшей мере на 15 минут до использования. Из исходного раствора 250 пг/мл будет приготовлена серия стандартных растворов IL-1 α в диапазоне от 250 пг/мл до 3,9 пг/мл. Серия стандартных растворов будет приготовлена путем добавления 500 мкл исходного раствора 250 пг/мл к 500 мкл разбавителя RD5-5 (с получением концентрации 125 пг/мл) с последующим выполнением серии из пяти дополнительных разведений (с коэффициентом разведения 2). Разбавитель RD5-5 используют в качестве стандартного раствора с нулевой концентрацией. Серия стандартных растворов будет приготовлена в двух повторах. Разведения для образцов могут быть выполнены, чтобы значения находились в пределах линейного диапазона анализа. По существу разведения следует выполнять в буфере RD5-5 или в аналитической среде по мере целесообразности. Данные будут выражены в виде концентрации в первоначальном образце. Все реагенты и образцы для испытания должны иметь комнатную температуру. Перед добавлением образцов или стандартных растворов в каждую лунку будет добавлено 50 мкл аналитического разбавителя RD1-83 (хорошо перемешанного перед использованием). В покрытые соответствующими антителами лунки будет добавлено двести мкл стандартного раствора или образца (представляющего собой среду, собранную с тканей, обработанных испытуемым изделием). Лунки будут закрыты клейкой лентой, и планшет проинкубирован при комнатной температуре в течение 2 часов. После инкубации планшета в течение 2 часов при комнатной температуре растворы будут извлечены из лунок, и планшет промыт три раза приблизительно 250 мкл промывочного раствора. Важно полностью удалить жидкость из каждой лунки в конце каждой промывки. Далее во все лунки будут добавлено по двести мкл ферментного конъюгата (IL-1 α конъюгата), лунки будут закрыты новой клейкой лентой, и планшет будет проинкубирован в темноте в течение 1 часа при комнатной температуре. После этой инкубации растворы будут извлечены из лунок, и планшет трижды промыт приблизительно 250 мкл промывочного раствора. Также важно полностью удалить жидкость из каждой лунки в конце каждой промывки. В каждую лунку будет добавлено двести мкл хромогенного субстрата (Substrate Solution). Планшет будет проинкубирован в течение 20 минут при комнатной температуре в защищенном от света месте без встряхивания. Для остановки реакции во все лунки будет добавлено по пятьдесят мкл останавливающего раствора. Считывание показаний с планшета будет проведено при 450 нм с вычитанием значения оптической плотности при 540 или 570 нм в пределах 30 минут после остановки реакции (OD450-570). Будет определено значение OD450-570 для каждого образца и стандартного раствора IL-1 α. Скорректированное значение OD450-570 для исследуемых образцов и каждого стандартного раствора IL-1 α будет определено путем вычитания среднего арифметического значения OD450-570 лунок с холостым раствором. Будет вычислено среднее из скорректированных значений OD450-570 для каждого стандартного раствора IL-1 α, и эти значения будут использованы для построения калибровочной кривой. Будет построена калибровочная кривая зависимости концентрации стандартных растворов (по оси y) от соответствующего скорректированного среднего значения оптической плотности (по оси х). Количество IL-1 α, высвобождаемого группами испытуемых образцов (контролями и испытуемыми изделиями), будет математически (квадратичным методом) интерполировано из калибровочной кривой.
Испытание на модели EpiOcular™
Растворы согласно рецептуре набора конструктов человеческих клеток EpiOcular™ Human Cell Construct Kit (MatTek Corporation) хранили, как указано производителем. Конструкты человеческих клеток EpiOcular™ хранили при 2-8 °C до использования. В день дозирования аналитическую среду EpiOcular™ подогревали до приблизительно 37°C. Девять десятых мл аналитической среды разделяли на аликвоты в соответствующих лунках 6-луночных планшетов. Шестилуночные планшеты маркировали с указанием испытуемого изделия и времени воздействия. Перед вскрытием запечатанной упаковки конструкты проверяли на наличие пузырьков воздуха между агарозным гелем и культуральной клеточной вставкой. Культуры с пузырьками воздуха, покрывающими более 50% площади культуральной клеточной вставки, не использовали. 24-луночные контейнеры для перевозки извлекали из пластикового пакета и дезинфицировали их поверхности 70%-ным этанолом. Конструкты человеческих клеток EpiOcular™ переносили в 6-луночные планшеты в асептических условиях. Впоследствии конструкты инкубировали при температуре 37 ± 1 °C в увлажненной атмосфере 5 ± 1% CO2 в воздухе (стандартные условия культивирования) в течение по меньшей мере одного часа. Затем среду отсасывали, и в каждую аналитическую лунку добавляли 0,9 мл свежей аналитической среды под конструкты человеческих клеток EpiOcular™. Планшеты возвращали в инкубатор до начала обработки.
Испытуемые изделия вводили в тест-систему в виде разведений 3% масс./об. в стерильной деионизированной воде (положительный и отрицательный контроль, 1,0% Triton®-X-100 и шампунь Johnson's Baby соответственно вводили в тест-систему в виде разведений 10% масс./об. в стерильной деионизированной воде). Каждое разведение испытуемого изделия получали путем отвешивания испытуемого изделия в предварительно маркированную коническую пробирку. Добавляли стерильную деионизированную воду до достижения разведения 3% масс./об. или 10% масс./об. и перемешивали пробирку на вортексе перед нанесением. В остальной части данного отчета на каждое разведение испытуемого изделия ссылаются как на испытуемое изделие.
Культуры EpiOcular™ обрабатывали испытуемыми изделиями в двух повторах при определенных периодах времени воздействия (от 0,33 до 16 часов, четыре момента времени для каждого). На каждый конструкт человеческих клеток EpiOcular™ наносили сто микролитров каждого испытуемого изделия. Время воздействия для отрицательных контрольных культур (контроль времени воздействия), представляющих собой 100 мкл стерильной деионизированной воды (Quality Biological), составляло 0,25, 4, 8 и 24 часа. Время воздействия для положительных контрольных культур, представляющих собой 100 мкл 0,3% Triton®-X-100 (Fisher), составляло 15 и 45 минут. Впоследствии культуры после воздействия инкубировали в течение соответствующего периода времени в стандартных условиях культивирования. После соответствующего периода времени воздействия культуры EpiOcular™ интенсивно промывали не содержащим кальция и магния фосфатно-буферным раствором Дульбекко (Ca++Mg++Free-DPBS), и промывочную среду сливали. После промывки ткань переносили в 5 мл аналитической среды и замачивали в течение от 10 до 20 минут при комнатной температуре, чтобы удалить какое-либо испытуемое изделие, абсорбированное в ткани. Раствор MTT 1,0 мг/мл в теплой среде для добавления MTT готовили не более чем за 2 часа до применения. В предназначенные лунки предварительно маркированного 24-луночного планшета добавляли три десятых мл раствора MTT. После промывки Ca++Mg++Free-DPBS конструкты EpiOcular™ переносили в соответствующие лунки. Планшеты инкубировали в течение приблизительно трех часов в стандартных условиях культивирования. По окончании периода инкубации с раствором MTT культуры EpiOcular™ промокали на впитывающей бумаге, освобождали от избытка жидкости и переносили в лунки предварительно маркированного 24-луночного планшета, содержащие в каждой предназначенной лунке 2,0 мл изопропанола. Планшеты закрывали парафильмом и хранили в холодильнике (2-8°C) до сбора после последнего периода воздействия. Впоследствии планшеты встряхивали в течение по меньшей мере двух часов при комнатной температуре. По окончании периода экстракции жидкость внутри вставок клеточных культур сливали в лунку, из которой была извлечена вставка клеточной культуры. Экстрагирующий раствор перемешивали и 200 мкл переносили в соответствующие лунки 96-луночного планшета. В две лунки, предназначенные для холостых проб, добавляли двести микролитров изопропанола. Оптическую плотность при 550 нм (OD550) в каждой лунке измеряли с помощью считывающего устройства для планшетов Vmax производства компании Molecular Devices.
Регистрировали необработанные значения оптической плотности. Рассчитывали среднее арифметическое значение OD550 лунок с холостой пробой. Скорректированные средние арифметические значения OD550 отрицательных контрольных образцов определяли путем вычитания среднего арифметического значения OD550 лунок с холостой пробой из их средних арифметических значений OD550. Скорректированные средние арифметические значения OD550 отдельных периодов воздействия испытуемых изделий и периодов воздействия положительного контроля определяли путем вычитания среднего арифметического значения OD550 лунок с холостой пробой из их средних арифметических значений OD550. Все расчеты выполняли с использованием электронных таблиц Excel. Расчеты процентных значений по контролю выполняли следующим образом:

Строили графики кривых зависимости ответа от времени воздействия, нанося по оси ординат % контроля и по оси абсцисс - время воздействия испытуемого изделия или положительного контроля. Значение ET50 интерполировали из каждого графика. Чтобы определить ET50, выбирали две последовательные точки, где в результате одного периода воздействия относительная выживаемость составляла более 50%, а в результате другого периода воздействия относительная выживаемость составляла менее 50%. Две выбранные точки использовали для определения наклона кривой и отрезка, отсекаемого на оси y, для уравнения y=m(x)+b. Наконец, чтобы определить ET50, уравнение решали для y=50. Когда все моменты времени воздействия показывали выживаемость более 50%, значение ET50 представляли как превышающее наиболее длительный период воздействия испытуемого изделия.
ПАВ ZAA (E1-E7), применяемые в композициях, обладающих признаками изобретения, и цвиттерионные ПАВ, отличные от ПАВ ZAA (C1-C4), применяемые в сравнительных композициях
Кокамидопропилбетаин, сравнительные примеры 1 и 4, был получен от компании Evonic Inc. под названиями бетаин Tego™ L7V и бетаин Tego™ F-50 соответственно. Лауроамфоацетат натрия, сравнительный пример 2, был получен от компании Solvay Inc. под названием Miranol™ HMD. Кокамидопропилгидроксисултаин, сравнительный пример 3, был получен от компании Solvay Inc. под названием Mirataine™ CBS.
В таблице 1 приведен перечень ПАВ ZAA в соответствии с формулой 1, применяемых для композиций примеров, обладающих признаками изобретения, и цвиттерионных ПАВ, применяемых в сравнительных композициях.
Таблица 1
|
* Активность в воде. Водная фаза также может содержать некоторые количества хлорида натрия и примесей, таких как жирная кислота, жирный спирт или жирный амин.
** Твердое вещество, может содержать некоторые количества хлорида натрия и примесей, таких как жирный спирт или жирный амин.
ПАВ ZAA E1-E7, представленные в таблице 1, были получены, как описано ниже.
Схематический способ включает:
(a) приведение в контакт спирта или амина, или смеси спиртов и аминов формулы 4 с диалкиламинокарбоновой кислотой или сложным эфиром диалкиламинокарбоновой кислоты (производным аминокислоты) формулы 5:

Формула 4
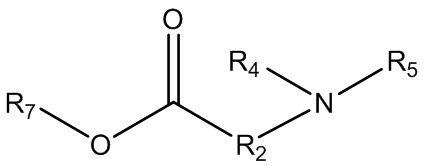
Формула 5
в присутствии фермента в условиях, способствующих эффективному образованию промежуточного соединения формулы 6:
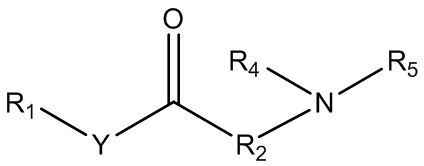 ,
,
Формула 6
где Y, R1, R2, R4 и R5 являются такими, как определено выше в формуле 1, а R7 представляет собой атом водорода или C1-C6 алкил; и
(b) приведение в контакт промежуточного соединения формулы 6 с алкилирующим агентом в условиях, способствующих эффективному образованию ПАВ ZAA формулы 1. Приемлемыми алкилирующими агентами являются, например, 2-хлоруксусная кислота, или 2-гидрокси-3-хлорпропансульфонат, или 1,3-пропансультон.
В качестве конкретного примера описано получение 3-((4-(лауриламино)-4-оксобутил)диметиламмоний)-2-гидроксипропан-1-сульфоната.
Стадия a). Промежуточное соединение: лаурил-4-диметиламинобутирамид.
Этил-4-диметиламинобутират (10 г; 62,8 ммоль), лауриламин (11,64 г; 62,8 ммоль; 1,0 экв) и Novozym™ 435 (1,0 г) объединяли и нагревали в течение ночи при 65°C при продувании азотом. Смесь фильтровали, и фермент промывали гептаном. Фильтрат концентрировали с получением лаурил-4-диметиламинобутирамида (17,69 г; выход 94%).
Стадия b). Конечный продукт: 3-((4-(лауриламино)-4-оксобутил)диметиламмоний)-2-гидроксипропан-1-сульфонат, водный раствор.
Лаурил-4-диметиламинобутирамид (12,5 г; 41,9 ммоль), натрия 3-хлор-2-гидроксипропансульфонат (95%, 9,15 г; 44,2 ммоль; 1,06 экв.) и карбонат натрия (444 мг; 4,2 ммоль; 0,1 экв) объединяли с 38,8 г воды и нагревали до 90°C в течение 10 часов с получением 99,7% преобразования в продукт по данным анализа методом ВЭЖХ. Смесь охлаждали до температуры окружающей среды с получением 59,5 г раствора высокой текучести.
Материал разбавляли небольшим количеством воды и фильтровали через мелкопористую фильтровальную бумагу с получением раствора, который по данным анализа содержал 24,9% масс. 3-((4-лауриламино-4-оксобутил)диметиламмоний)-2-гидроксипропансульфоната.
Описанные ниже композиции, примеры (E8-E68), обладающие признаками изобретения, и сравнительные примеры (C5-C43) были получены с использованием дополнительно к ПАВ ZAA различных типов ингредиентов состава (т. е. сырьевых материалов от различных поставщиков). Эти материалы вместе с названиями Международной номенклатуры косметических изделий (INCI), торговыми названиями и поставщиками перечислены ниже.
Анионные ПАВ
Лаурет-2-сульфат натрия был получен от компании Solvay Inc. под названием Rhodapex™ ES-2K.
Тридецетсульфат натрия был получен от компании Solvay Inc. под названием Rhodapex™ EST-65.
Аммония лаурилсульфат был получен от компании BASF под названием Standapol™A.
Альфа-олефинсульфонат натрия был получен от компании Stepan под названием Bioterge™ AS 40-CP.
Метил-2-сульфолаурат натрия (SM2S) был получен от компании Stepan под названием Alphastep™ PC-48.
Эфир гидролизованного картофельного крахмала и додеценилсукцината натрия был получен от компании Akzo Nobel Personal Care под названием Structure™ PS-111.
Неионные ПАВ
Полисорбат 20 был получен от компании Croda Inc Inc. под названием Tween™ 20.
ПЭГ-80-сорбитанлаурат был получен от компании Croda Inc. под названием Tween™ 28.
ПЭГ-150 дистеарат был получен от компании Ethox Chemical под названием Ethox™ PEG-6000 DS Special.
Смесь кокоглюкозида, глицерилолеата, воды; лимонной кислоты, цитрата гидрогенизированных глицеридов пальмового масла, токоферола была получена от компании BASF под названием Lamesoft™ PO 65.
Кокогликозид и децилглюкозид были получены от компании BASF под названием Plantacare™ 818 UP и Plantaren™ 2000 N соответственно.
Полиглицерин-10-лаурат и полиглицерин-10-олеат были получены от компании Lonza под названиями Polyaldo™ 10-1-L и Polyaldo™ 10-1-O соответственно.
Перламутровая добавка
Дистеарат гликоля; лауретсульфат натрия; миристиловый спирт; вода была получена от компании Solvay Inc. под названием Mirasheen™ Star K.
Катионные (четвертичные) кондиционирующие полимеры
Поликватерний-10 был получен от компании Dow Chemical под названием Ucare™ JR-400.
Хлорид гуаргидроксипропилтримония был получен от компании Solvay Inc. под названием Jaguar™ C17.
Модификаторы реологических свойств полимеров
Сшитый полимер акрилатов/C10-30 алкилакрилата был получен от компании Lubrizol под названием Carbopol™ ETD2020 или Carbopol™ 1382.
Увлажнители
Глицерин был получен от компании Emery Oleochemicals под названием Emery™ 917.
Хелатирующие агенты
Тетранатриевая соль этилендиаминтетрауксусной кислоты (EDTA) была получена от компании Dow Chemical под названием Versene™ 100XL.
Органические кислоты/консерванты
Бензоат натрия, NF, FCC был получен от компании Emerald Performance Materials.
Лимонная кислота была получена от компании Formosa Laboratories Inc (для DSM) (Тайвань).
Анисовая кислота была получена от компании Dr. Straetmans Chemische Produkte GmbH под названием Dermsoft™ MM688.
Тетранатрия глутамат диацетат получили от компании Akzo Nobel LLC под названием Dissolvine™ GL-47S.
Консерванты
Феноксиэтанол и этилгексилглицерин были получены в виде смеси от компании Schülke Inc. под названием Euxyl™ PE 9010.
Феноксиэтанол был получен от компании Clariant под названием Phenoxetol™.
Кватерний-15 был получен от компании The Dow Chemical Company под названием Dowicil™ 200.
Полезные агенты
Мука из зерен овса (Avena Sativa) была получена от компании Beacon CMP Corporation под названием Colloidal Oat Flour.
Экстракт зерен овса (Avena Sativa) был получен от компании Ceapro Inc. под названием CP Oat Avenanthramide.
Масло зерен овса (Avena Sativa) было получено от компании Symrise AG под названием Avena Lipid.
Соевое масло; подсолнечное масло было получено от компании Textron Tecnica S.L. под названием EVOIL™ RM0604.
Примеры E5-E18, обладающие признаками изобретения, и сравнительные примеры C5-C14
Получение и измерение некоторых композиций изобретения с лауретсульфатом натрия (SLES) в качестве анионного ПАВ и сравнительных композиций
Композиции E5-E18 и сравнительные композиции C5-C14 готовили согласно следующей методике. Если не указано иное, все материалы добавляли в таких количествах, чтобы композиции содержали полученные в результате количества в весовом процентном содержании активного вещества, указанные для каждой композиции в таблицах 2, 3 и 4. Например, 3,75% масс./масс. активного вещества кокамидопропилбетаина (как указано в таблице 2, C5) соответствует 12,5% масс./масс. бетаина Tego™ L7V, обладающего активностью 30% масс./масс.; 3,75% масс./масс./30% масс./масс.=12,5% масс./масс.
Приготовление исходных растворов. Композиции E5-E18 и сравнительные композиции C5-C14 готовили с использованием исходных растворов, которые были получены, как описано ниже: a) исходный раствор с цвиттерионным ПАВ: в сосуд соответствующего размера, оборудованный мешалкой с нагревательной плитой и верхним приводом, добавляли необходимое количество деионизированной воды (Millipore, Model Direct Q), цвиттерионного ПАВ и хлорида натрия и перемешивали при 200-350 об/мин, пока смесь не становилась однородной, для C1, E1 и E4 при комнатной температуре, а для E2 - при 50°C соответственно. Впоследствии добавляли бензоат натрия и лимонную кислоту (раствор 20% масс./масс. в деионизированной воде) при комнатной температуре для доведения pH до желаемого значения 4,4-4,6. Добавляли воду в достаточном количестве до 100% масс. и раствор продолжали перемешивать до однородного состояния, после чего его переносили в соответствующий сосуд для хранения; b) исходный раствор с анионным ПАВ: в сосуд соответствующего размера, оборудованный мешалкой с нагревательной плитой и верхним приводом, добавляли необходимое количество деионизированной воды (Millipore, Model Direct Q), анионного ПАВ и лимонной кислоты и перемешивали при 200-350 об/мин при комнатной температуре, пока смесь не становилась однородной. Добавляли такое количество лимонной кислоты (в виде раствора 20% масс./масс. в деионизированной воде), чтобы довести pH до желаемого значения 4,4-4,6. Добавляли воду в достаточном количестве до 100% масс./масс., и раствор продолжали перемешивать до однородного состояния, после чего его переносили в соответствующий сосуд для хранения.
Композиции E5-E18 и сравнительные композиции C5-C14 готовили, как описано ниже: в сосуд соответствующего размера, оборудованный мешалкой с нагревательной плитой и верхним приводом, добавляли необходимое количество a) исходного раствора с цвиттерионным ПАВ и b) исходного раствора с анионным ПАВ. Воду добавляли в достаточном количестве до 100% масс./масс. Раствор нагревали до 50°C при перемешивании и перемешивали при 200-350 об/мин в течение 20 минут. Раствор оставляли для охлаждения до комнатной температуры без перемешивания.
В таблицах 2-5 приведен перечень композиций (E8-E32), обладающих признаками изобретения, и сравнительных композиций (C5-C17), приготовленных из ПАВ ZAA (E1-E7), обладающих признаками изобретения, и сравнительных цвиттерионных ПАВ (C1, C2 и C4).
Вязкость при нулевом сдвиге измеряли в соответствии с испытанием вязкости при нулевом сдвиге, как описано в настоящем документе. Результаты представлены в таблице 6. В результате заявители обнаружили, что ПАВ ZAA в соответствии с формулой 1 обладают тенденцией к образованию более высокой вязкости по сравнению с ПАВ на основе алкиламидоаминбетаина в композициях, содержащих лауретсульфат натрия (SLES) в качестве анионного ПАВ.
Таблица 2a
|
Таблица 2b
|
Таблица 3a
|
Таблица 3b
|
Таблица 4
|
Таблица 5
|
Таблица 6
|
* Отношение: отношение массы цвиттерионного/амфотерного ПАВ к массе анионного ПАВ (активного вещества к активному веществу)
Примеры E33-E38, обладающие признаками изобретения, и сравнительные примеры C18-C19
Получение и измерение некоторых композиций изобретения с лаурилсульфатом аммония (ALS) в качестве анионного ПАВ и сравнительных композиций
Композиции E33-E38, обладающие признаками изобретения, и сравнительные композиции C18-19 готовили в соответствии с методикой, описанной для композиций E7-E32 и сравнительных композиций C5-C17, за исключением того, что в качестве анионного ПАВ использовали ALS (Standapol™ A) вместо SLES (Rhodapex™ ES-2K). В таблице 7 приведен перечень таких композиций.
Вязкость при нулевом сдвиге измеряли в соответствии с испытанием вязкости при нулевом сдвиге, как описано в настоящем документе. Результаты представлены в таблице 8. В результате заявители обнаружили, что ПАВ ZAA имеют тенденцию к образованию эквивалентной или более высокой вязкости по сравнению с ПАВ на основе алкиламидоамина бетаина в композициях, содержащих аммония лаурилсульфат в качестве анионного ПАВ, особенно при концентрациях солей от 0% масс./масс. до около 1% масс./масс. добавленного хлорида натрия.
Таблица 7
|
Таблица 8
|
Примеры E39-E44, обладающие признаками изобретения, и сравнительные примеры C20-C25
Получение и измерение некоторых композиций изобретения с альфа-олефинсульфатом натрия (AOS) в качестве анионного ПАВ и сравнительных композиций
Композиции E39-E44 и сравнительные композиции C20-C25 готовили в соответствии с методикой, описанной для композиций E8-E32 и сравнительных композиций C5-C17, за исключением того, что в качестве анионного ПАВ использовали AOS (Bioterge™ AS 40-CP) вместо SLES (Rhodapex™ ES-2K). В таблицах 9 и 10 приведен перечень таких композиций.
Вязкость при нулевом сдвиге измеряли в соответствии с испытанием вязкости при нулевом сдвиге, как описано в настоящем документе. Результаты представлены в таблице 11. В результате заявителями неожиданно было обнаружено, что ПАВ ZAA могут образовывать вязкость в композициях, содержащих AOS в качестве анионного ПАВ, что невозможно для ПАВ на основе алкиламидобетаина.
Таблица 9
|
Таблица 10
|
Таблица 11
|
Примеры E45-E52, обладающие признаками изобретения, и сравнительные примеры C26-C33
Получение и измерение некоторых композиций изобретения с PS-111 и без PS-111 в качестве анионного ПАВ и сравнительных композиций
Композиции E45-E52 и сравнительные композиции C26-C33 готовили согласно следующей методике. Если не указано иное, все материалы добавляли в таких количествах, чтобы композиции содержали полученные в результате количества в весовом процентном содержании активного вещества, указанные для каждой композиции в таблицах 12 и 14. Например, 3,75% масс./масс. активного вещества кокамидопропилбетаина (как указано в таблице 12, C26) соответствует 12,5% масс./масс. бетаина Tego™ L7V, обладающего активностью 30% масс./масс.; 3,75% масс./масс./30% масс./масс.=12,5% масс./масс.
Композиции E45-E52 и сравнительные композиции C26-C33 готовили следующим образом. В сосуд соответствующего размера, оборудованный мешалкой с нагревательной плитой и верхним приводом, добавляли необходимое количество деионизированной воды, цвиттерионного ПАВ, анионного ПАВ и бензоата натрия и перемешивали при комнатной температуре при 200-350 об/мин, пока смесь не становилась однородной. Впоследствии добавляли лимонную кислоту (раствор 20% масс./масс. в деионизированной воде) при комнатной температуре для доведения pH до желаемого значения 4,4-4,6. Впоследствии добавляли Structure PS-111 и хлорид натрия и перемешивали, пока смесь не становилась однородной. Добавляли воду в достаточном количестве до 100% масс., и партию оставляли для перемешивания до однородного состояния, после чего выгружали ее в соответствующий сосуд для хранения. В таблицах 12 и 14 приведен перечень таких композиций.
Вязкость при нулевом сдвиге и максимальный объем пены измеряли в соответствии с испытанием вязкости при нулевом сдвиге и испытанием состава на пенообразование соответственно, как описано в настоящем документе. Полученные результаты представлены в таблицах 13 и 15. В результате заявителями неожиданно было обнаружено, что ПАВ ZAA могут не только образовать вязкость в композициях, содержащих AOS и/или SM2S в качестве анионного ПАВ, но такие композиции также проявляют лучшую способность к пенообразованию по сравнению с композициями с цвиттерионными ПАВ на основе алкиламидоамина бетаина.
Таблица 12
|
Таблица 13
|
Таблица 14
|
Таблица 15
|
Пример E53, обладающий признаками изобретения, и сравнительный пример C34
Получение и измерение некоторых композиций изобретения с кондиционирующими полимерами и сравнительных композиций
Композицию E53 и сравнительную композицию C34 готовили согласно следующей методике. Если не указано иное, все материалы добавляли в таких количествах, чтобы композиции содержали полученные в результате количества в весовом процентном содержании активного вещества, указанные для каждой композиции в таблице 16. Например, 5% масс./масс. активного вещества кокамидопропилбетаина (как указано в таблице 16, C34) соответствует 13,2% масс./масс. бетаина Tego™ F50, обладающего активностью 38% масс./масс.; 5% масс./масс./38% масс./масс.=13,2% масс./масс.
Композицию E53 и сравнительную композицию C34 готовили следующим образом. В сосуд соответствующего размера, оборудованный мешалкой с нагревательной плитой и верхним приводом, добавляли 90% необходимого количества деионизированной воды, перемешивали при 200-350 об/мин. Добавляли овсяную муку и смешивали до получения однородной смеси. Добавляли Ucare™ JR-400 и перемешивали в течение 10 мин. Партию нагревали до 50 °C. По очереди добавляли цвиттерионное/амфотерное ПАВ и Rhodapex™ ES-2K и перемешивали до однородного состояния. К основной партии добавляли глицерин и тетранатриевую соль EDTA. Далее добавляли Dowicil™ 200 и перемешивали до однородного состояния. По очереди добавляли Mirasheen™ Star K и экстракт зерен овса (Avena sativa), Avena Lipid и Evoil™ и перемешивали до однородного состояния. Добавляли ароматизатор и доводили pH до 6,3-7,3 (целевое значение 6,4-6,7). Добавляли воду в достаточном количестве до 100% масс., и партию оставляли для перемешивания до однородного состояния, после чего выгружали ее в соответствующий сосуд для хранения. В таблице 16 приведен перечень таких композиций.
Вязкость при нулевом сдвиге и максимальный объем пены измеряли в соответствии с испытанием вязкости при нулевом сдвиге и испытанием состава на пенообразование соответственно, как описано в настоящем документе. Результаты представлены в таблице 17. В результате заявителями было неожиданно обнаружено, что ПАВ ZAA имеют тенденцию к образованию эквивалентной или более высокой вязкости по сравнению с цвиттерионными ПАВ на основе алкиламидоамина бетаина в композициях, содержащих катионные кондиционирующие полимеры, и такие композиции также проявляют лучшую способность к пенообразованию по сравнению с композициями с цвиттерионными ПАВ на основе алкиламидоамина бетаина.
Таблица 16
|
Таблица 17
|
* Испытание проводили при 0,1% масс. в имитированной жесткой воде.
Примеры E54-E57, обладающие признаками изобретения, и сравнительные примеры C35-C36
Получение и измерение некоторых композиций изобретения с PS-111 и неионными ПАВ и сравнительных композиций
Композиции E54-E57 и сравнительные композиции C35-C36 готовили согласно следующей методике. Если не указано иное, все материалы добавляли в таких количествах, чтобы композиции содержали полученные в результате количества в весовом процентном содержании активного вещества, указанные для каждой композиции в таблице 18. Например, 3,75% масс./масс. активного вещества кокамидопропилбетаина (как указано в таблице 18, C35) соответствует 12,5% масс./масс. бетаина Tego™ L7V, обладающего активностью 30% масс./масс.; 3,75% масс./масс./30% масс./масс.=12,5% масс./масс. Композиции E54-E57 и сравнительные композиции C35-C36 готовили, как описано ниже: в сосуд соответствующего размера, оборудованный мешалкой с подогревом и верхним приводом, добавляли 90% необходимого количества деионизированной воды, цвиттерионное ПАВ, анионное ПАВ (Rhodapex™ ES-2K и Structure™ PS-111) и ПАВ Polyaldo™ и партию перемешивали при 200-350 об/мин, пока смесь не становилась однородной. Добавляли лимонную кислоту (раствор 20% масс./масс. в деионизированной воде), чтобы довести pH до желаемого значения 4,4-4,6. Добавляли бензоат натрия и хлорид натрия. Добавляли воду в достаточном количестве до 100% масс., и партию оставляли для перемешивания до однородного состояния, после чего выгружали ее в соответствующий сосуд для хранения. В таблице 18 приведен перечень таких композиций.
Вязкость при нулевом сдвиге и максимальный объем пены измеряли в соответствии с испытанием вязкости при нулевом сдвиге и испытанием состава на пенообразование соответственно, как описано в настоящем документе. Результаты представлены в таблице 19. В результате заявители обнаружили, что ПАВ ZAA обладают тенденцией к образованию более высокой вязкости по сравнению с цвиттерионными ПАВ на основе алкиламидоамина бетаина в композициях, содержащих анионные ПАВ и несколько других ингредиентов состава, таких как ПАВ на основе сложных полиглицериловых эфиров. Такие композиции также проявляют эквивалентную или лучшую способность к пенообразованию по сравнению с эквивалентными композициями, содержащими цвиттерионные ПАВ на основе алкиламидоамина бетаина.
Таблица 18
|
Таблица 19
|
Примеры E58-E61 и сравнительный пример C37
Получение и измерение некоторых композиций изобретения, не содержащих анионное ПАВ, и сравнительных композиций
Композиции E58-E61 и сравнительную композицию C37 готовили согласно следующей методике. Все материалы были добавлены в количествах, как указано для каждой композиции в таблице 20. Например, 2,4% масс./масс. активного вещества 3-((4-(лауриламино)-4-оксобутил)диметиламмоний)-2-гидроксипропан-1-сульфоната (как указано в таблице 20, E58) соответствует 8,1% масс./масс. E1, обладающего активностью 29,5% масс./масс.; 2,4% масс./масс./29,5% масс./масс.=8,1% масс./масс.
Композиции E58-E61 и сравнительную композицию C37 готовили следующим образом. В сосуд соответствующего размера, оборудованный мешалкой с нагревательной плитой и верхним приводом, добавляли 50% необходимого количества деионизированной воды, перемешивали при 200-350 об/мин. Добавляли 0,05% масс./масс. лимонной кислоты для доведения pH до 3-3,5. В вортекс медленно просеивали Carbopol™ ETD2020. Смесь нагревали до 60 °C и перемешивали до полного диспергирования полимера. К смеси добавили цвиттерионное ПАВ (например, E1 или бетаин Tego™ F50), а затем бензоат натрия и перемешивали до однородного состояния. Добавляли Dermosoft™ 688, и смесь гомогенизировали в течение 10 мин. pH доводили до 5,1-5,5 путем добавления 50% масс./масс. NaOH в воде. Начинали охлаждать до 30 °C, и для более быстрого охлаждения добавляли 20% деионизированной воды. Добавляли феноксиэтанол, Plantacare™ 818UP, Lamesoft™ PO65 и ароматизатор, выполняя гомогенизацию после каждой стадии. pH раствора доводили до 5,5-5,8. Добавляли воду в достаточном количестве до 100% масс., и партию оставляли для перемешивания до однородного состояния, после чего выгружали ее в соответствующий сосуд для хранения. Перечень полученных композиций приведен в таблице 20.
Вязкость при нулевом сдвиге и максимальный объем пены измеряли в соответствии с испытанием вязкости при нулевом сдвиге и испытанием состава на пенообразование соответственно, как описано в настоящем документе. Результаты представлены в таблице 21. В результате заявители обнаружили, что ПАВ ZAA обладают тенденцией к образованию более высокой вязкости по сравнению с цвиттерионными ПАВ на основе алкиламидоамина бетаина в композициях, не содержащих анионных ПАВ, но содержащих несколько других ингредиентов состава. Такие композиции также проявляют эквивалентную или лучшую способность к пенообразованию по сравнению с эквивалентными композициями, содержащими цвиттерионные ПАВ на основе алкиламидоамина бетаина. Заявители отмечают, что сравнительный пример нормализован по таким же концентрациям ПАВ (% масс./масс. активного вещества), что и соответствующие примеры, обладающие признаками изобретения (C37 соответствует E58-E61).
Таблица 20
|
Таблица 21
|
* Испытание проводили при 0,1% масс. в имитированной жесткой воде.
Примеры E62-E67, обладающие признаками изобретения, и сравнительные примеры C38-C41
Получение и измерение некоторых композиций изобретения, эквивалентных имеющимся в продаже составам
Композиции E62-E65 и сравнительную композицию C38 готовили согласно следующей методике. Все материалы были добавлены в количествах, как указано для каждой композиции в таблице 22. Например, 2,7% масс./масс. активного вещества 3-((4-(лауриламино)-4-оксобутил)диметиламмоний)-2-гидроксипропан-1-сульфоната (как указано в таблице 22, E62) соответствует 9,2% масс./масс. E1, обладающего активностью 29,5% масс./масс.; 2,7% масс./масс./ 29,5% масс./масс.=9,2% масс./масс.
Композиции E62-E65 и сравнительную композицию C38 готовили следующим образом: в сосуд соответствующего размера, оборудованный мешалкой с нагревательной плитой и верхним приводом, добавляли 90% необходимого количества деионизированной воды, перемешивали при 200-350 об/мин. В вортекс медленно просеивали Carbopol™ 1382. Смесь перемешивали до полного диспергирования полимера. К смеси добавляли бензоат натрия и перемешивали до однородного состояния. После добавления глицерина партию нагревали до 65-70 °C. Значение pH доводили до 6,0-6,5 путем добавления 50% масс./масс. NaOH в воде. Plantaren™ 2000 N; цвиттерионное ПАВ (например, E1 или бетаин Tego™ F50); Lamesoft™ PO 65; Polyaldo™ 10-1-L добавляли одно за другим при перемешивании, перемешивали до однородного состояния. Нагреватель удаляли, и смесь оставляли для охлаждения. При 55-60 °C добавляли Euxyl™ PE9010. pH доводили до 5,3-5,8. Добавляли воду в достаточном количестве до 100% масс., и партию оставляли для перемешивания до однородного состояния, после чего выгружали ее в соответствующий сосуд для хранения. Перечень полученных композиций приведен в таблице 22.
Вязкость при нулевом сдвиге и максимальный объем пены измеряли в соответствии с испытанием вязкости при нулевом сдвиге и испытанием состава на пенообразование соответственно, как описано в настоящем документе. Результаты представлены в таблице 23. В результате заявители обнаружили, что ПАВ ZAA обладают тенденцией к образованию более высокой вязкости по сравнению с ПАВ на основе алкиламидоамина бетаина в композициях, не содержащих анионных ПАВ. Такие композиции также проявляют эквивалентную или лучшую способность к пенообразованию по сравнению с эквивалентными композициями, содержащими цвиттерионные ПАВ на основе алкиламидоамина бетаина. Заявители отмечают, что сравнительные примеры нормализованы по таким же концентрациям ПАВ (% масс./масс. активного вещества), что и соответствующие примеры, обладающие признаками изобретения (C38 соответствует E62-E65).
Таблица 22
|
Таблица 23
|
* Испытание проводили при 0,1% масс. в имитированной жесткой воде.
Композицию E66 и сравнительные композиции C39-C40 готовили согласно следующей методике. Все материалы были добавлены в количествах, как указано для каждой композиции в таблице 24. Например, 3,3% масс./масс. активного вещества кокамидопропилбетаина (как указано в таблице 24, C39) соответствует 8,7% масс./масс. C4, обладающего активностью 38% масс./масс.; 3,3% масс./масс./38% масс./масс.=8,7% масс./масс.
Композицию E66 и сравнительные композиции C39-C40 готовили следующим образом. В сосуд соответствующего размера, оборудованный мешалкой с подогревом и верхним приводом, добавляли 90% необходимого количества деионизированной воды, перемешивали при 200-350 об/мин и начали нагревать до 40 °C. Добавили глицерин, при нагревании добавили Ucare™ JR400 и перемешивали в течение 15 мин до полного диспергирования. Начали нагревание до 80-85°C. При нагревании к основной партии добавили Tween 28 (3,45%). При 80-85 °C медленно добавляли Ethox™ PEG-6000 и перемешивали до однородного состояния. Начинали охлаждение до 50-55 °C, и при охлаждении добавляли бензоат натрия и Rhodapex™ EST 65. Температуру удерживали на уровне 50-55 °C и добавляли бетаин Tego™ F50. При температуре 40 °C и ниже добавили Euxyl™ PE 9010 и тетранатриевую соль EDTA. Готовили предварительную смесь оставшегося Tween™ 28 и ароматизатора и добавляли к основной партии. pH доводили до 5,1-5,4. Добавляли воду в достаточном количестве до 100% масс., и партию оставляли для перемешивания до однородного состояния, после чего выгружали ее в соответствующий сосуд для хранения. Перечень полученных композиций приведен в таблице 24.
Вязкость при нулевом сдвиге и максимальный объем пены измеряли в соответствии с испытанием вязкости при нулевом сдвиге и испытанием состава на пенообразование соответственно, как описано в настоящем документе. Результаты представлены в таблице 25. В результате заявители обнаружили, что ПАВ ZAA обладают тенденцией к образованию более высокой вязкости по сравнению с цвиттерионными ПАВ на основе алкиламидоаминов гидроксисултаина и бетаина в композициях, содержащих анионные ПАВ и несколько других ингредиентов состава, таких как модификаторы реологических свойств на основе ПЭГ, глицерин, ароматизаторы и консерванты. Такие композиции также проявляют эквивалентную или лучшую способность к пенообразованию по сравнению с эквивалентными композициями, содержащими цвиттерионные ПАВ на основе алкиламидоаминов гидроксисултаина и бетаина. Заявители отмечают, что сравнительные примеры нормализованы по таким же концентрациям ПАВ (% масс./масс. активного вещества), что и соответствующий пример, обладающий признаками изобретения (C39-C40 соответствуют E66).
Таблица 24
|
Таблица 25
|
* Испытание проводили при 0,1% масс. в имитированной жесткой воде.
Композицию E67 и сравнительную композицию C41 готовили согласно следующей методике. Все материалы были добавлены в количествах, как указано для каждой композиции в таблице 26. Например, 2,4% масс./масс. активного вещества кокамидопропилбетаина (как указано в таблице 26, C41) соответствует 6,3% масс./масс. C4, обладающего активностью 38% масс./масс.; 2,4% масс./масс./38% масс./масс.=6,3% масс./масс.
Композицию E67 и сравнительную композицию C41 готовили следующим образом. В сосуд соответствующего размера, оборудованный мешалкой с нагревательной плитой и верхним приводом, добавляли 90% необходимого количества деионизированной воды, перемешивали при 200-350 об/мин и нагревали до 70-75°C. Далее добавляли бензоат натрия и перемешивали до однородного состояния. При нагревании добавляли Rhodapex™ ES-2k и перемешивали до однородного состояния. Затем к основной партии добавляли цвиттерионное/амфотерное ПАВ и перемешивали до однородного состояния. К основной партии добавляли Tween™ 28 и перемешивали до однородного состояния (при 70-75 °C в течение по меньшей мере 10 мин). Начинали охлаждение до 40 °C. Готовили предварительную смесь Tween™ 20 и ароматизатора и добавляли к основной партии при температуре 40 °C или ниже. Затем добавляли Dissolvine™ GL-47-S и перемешивали до однородного состояния. pH доводили до 4,3-5. Добавляли растворы красителя и хлорида натрия. Добавляли воду в достаточном количестве до 100% масс., и партию оставляли для перемешивания до однородного состояния, после чего выгружали ее в соответствующий сосуд для хранения. Перечень полученных композиций приведен в таблице 26.
Вязкость при нулевом сдвиге и максимальный объем пены измеряли в соответствии с испытанием вязкости при нулевом сдвиге и испытанием состава на пенообразование соответственно, как описано в настоящем документе. Результаты представлены в таблице 27. В результате заявители обнаружили, что ПАВ ZAA обладают тенденцией к образованию более высокой вязкости по сравнению с цвиттерионными ПАВ на основе алкиламидоамина бетаина в композициях, содержащих анионные ПАВ и несколько других ингредиентов состава, таких как модификаторы реологических свойств на основе ПЭГ, ароматизаторы и консерванты. Такие композиции также проявляют эквивалентную или лучшую способность к пенообразованию по сравнению с эквивалентными композициями, содержащими цвиттерионные ПАВ на основе алкиламидоамина бетаина. Заявители отмечают, что сравнительные примеры нормализованы по таким же концентрациям ПАВ (% масс./масс. активного вещества), что и соответствующий пример, обладающий признаками изобретения (C41 соответствует E67).
Таблица 26
|
Таблица 27
|
* Испытание проводили при 0,1% масс. в имитированной жесткой воде.
Пример E68, обладающий признаками изобретения, и сравнительные примеры C42-C43
Получение и измерение мягкости действия конкретной композиции изобретения и сравнительных композиций
Композиция E68 и сравнительные примеры C42-C43 были приготовлены в соответствии со способом, описанным для C5. В таблице 28 приведен перечень этих композиций.
Вязкость при нулевом сдвиге, концентрацию в EpiDermTM IL-1α и EpiOcularTM ET50 измеряли в соответствии с испытанием вязкости при нулевом сдвиге, испытанием с использованием EpiDermTM и испытанием с использованием EpiOcularTM соответственно, как описано в настоящем документе. Результаты представлены в таблице 29. В результате заявители обнаружили, что ПАВ ZAA проявляют сходную, если не лучшую, мягкость действия по сравнению с другими цвиттерионными ПАВ, такими как, например, ПАВ на основе алкиламидоаминов гидроксисултаина и бетаина, в композициях, содержащих анионные ПАВ.
Таблица 28
|
Таблица 29
|
JBS представляет собой шампунь Johnson's Baby - имеющуюся в продаже эталонную композицию.