Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ ФТОРСОДЕРЖАЩИХ ХЛОРИНОВ, ПРОЯВЛЯЮЩИЕ ПРОТИВООПУХОЛЕВУЮ АКТИВНОСТЬ
Вид РИД
Изобретение
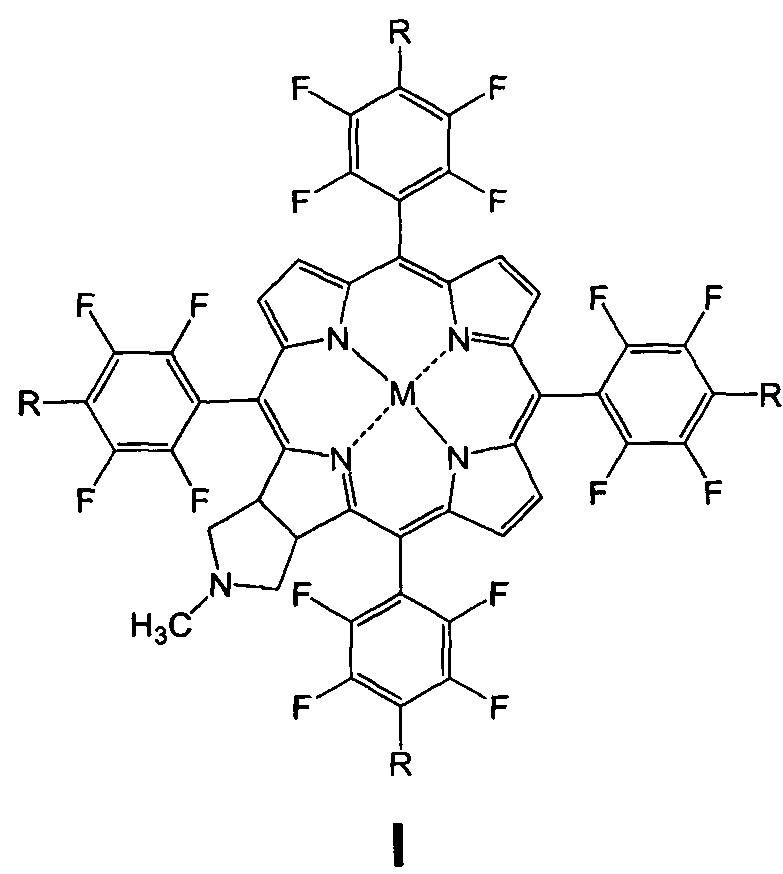
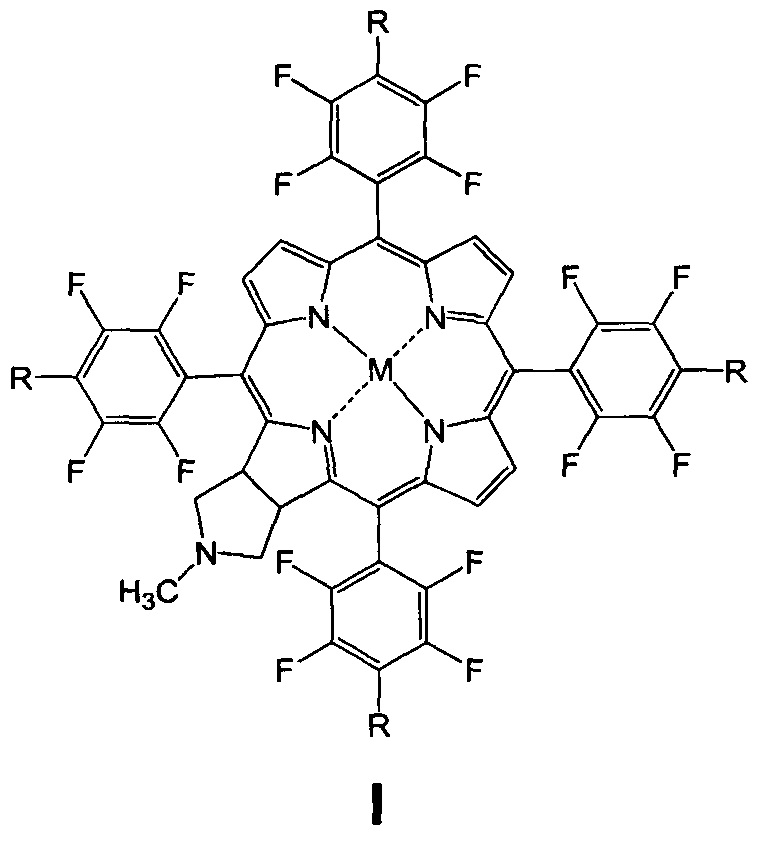
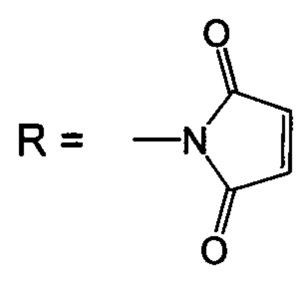
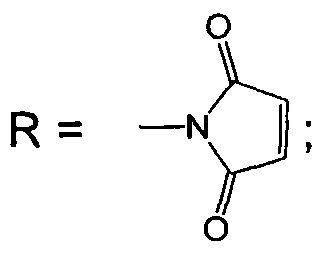
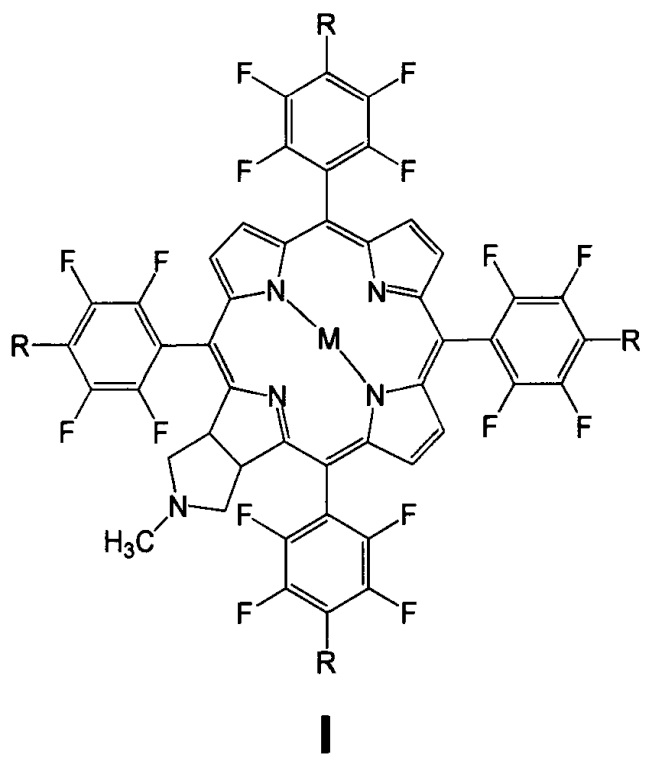
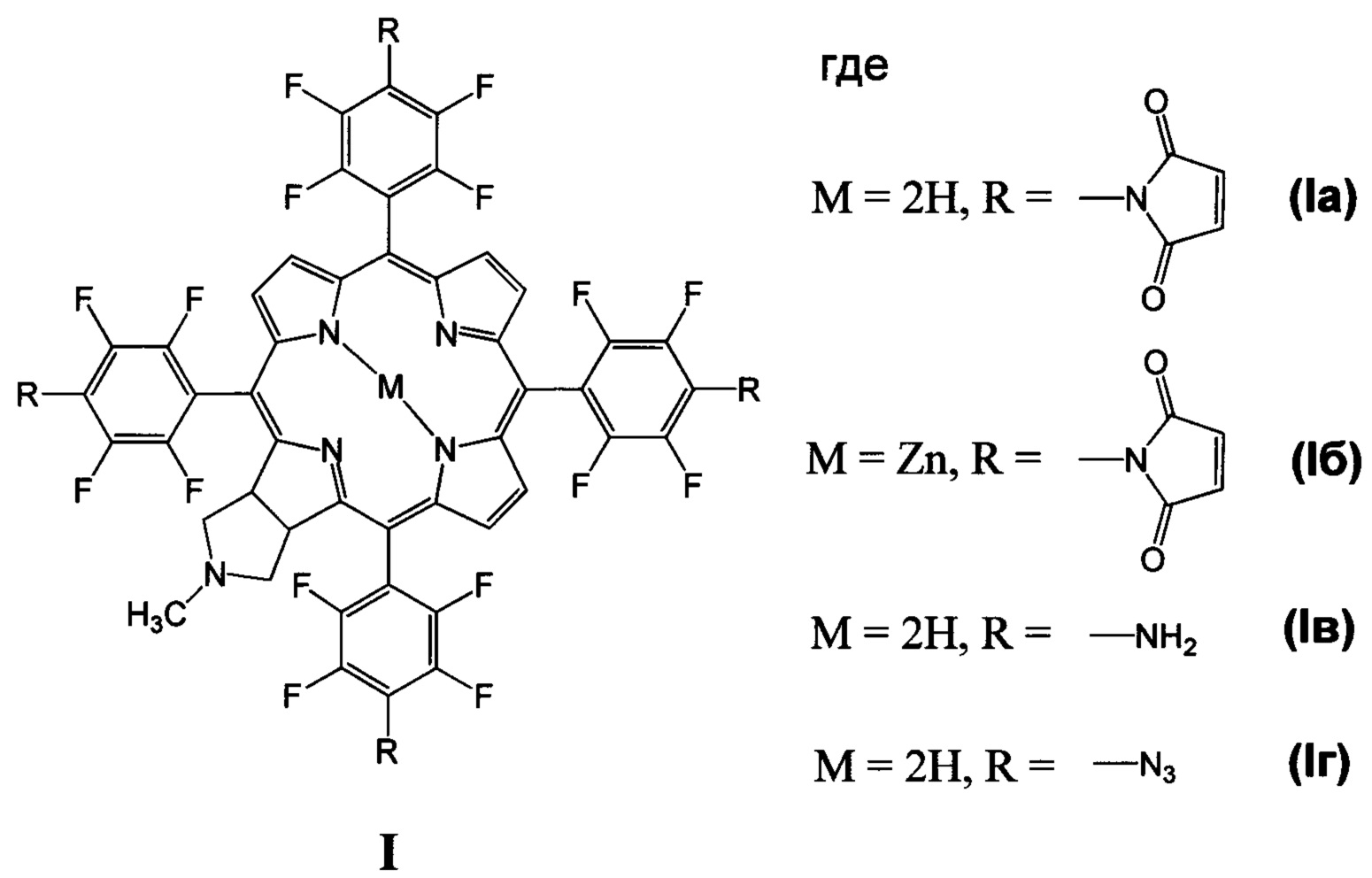
Изобретение относится к биоорганической химии, а именно к производным фторированного хлорина и его металлокомплекса общей формулы I, в частности к их малеимидным производным, проявляющим противоопухолевую активность: 5,10,15,20-тетракис(4-N-малеимидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорину (Iа) и цинковому комплексу 5,10,15,20-тетракис(4-N-малеимидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Iб), а также к их предшественникам (Iв и Iг)
Заявляемые соединения Ia и Iб наиболее эффективно могут быть использованы в качестве противоопухолевых агентов в фотодинамической терапии (ФДТ) онкологических заболеваний. Соединения Iв и Iг используются для получения соединений Ia и Iб.
Заявляемые соединения и их свойства в литературе не описаны.
Метод ФДТ основан на применении природных или синтетических фотосенсибилизаторов (ФС), которые обладают способностью к избирательному накоплению в опухолевой ткани. Известно, что в качестве фотосенсибилизаторов используют химические соединения порфиринового или хлоринового ряда. При облучении зоны опухоли светом определенной длины волны ФС поглощает кванты света и затем передает энергию молекулярному кислороду в ткани, вследствие чего происходит его активация и образуется так называемый синглетный кислород. Данная возбужденная форма молекулы кислорода токсична для биоткани и разрушает опухоль. ФДТ также приводит к нарушению питания и гибели опухоли за счет повреждения ее микрососудов.
Традиционными фотодинамическими агентами первого поколения являются гематопорфирин и его производные (Фотофторин - США, Фотогем - Россия). Недостатками этих агентов являются неоптимальный спектр поглощения, малая глубина проникновения света, недостаточная избирательность и сложный состав (фотофторин содержит около 60 компонентов) [Nseyo U.O., Shumaker В., Klein Е.А. J. Urol., 1998, 160 (1), 39-44].
Перспективными фотосенсибилизаторами для ФДТ второго поколения являются хлорины - соединения с максимумом поглощения в красном диапазоне (620-770), так называемом «терапевтическом окне», где собственное поглощение биологической ткани минимально, что обеспечивает возможность более глубокого проникновения излучения в ткань и, как следствие, высокую эффективность терапии [R. Bonnett. J. Heterocyclic Chem., 2002, 39, 455-470].
Успешное применение метода ФДТ для лечения злокачественных новообразований стимулирует поиск новых фотосенсибилизаторов с улучшенными свойствами.
Установлено, что введение малеимидной группы в молекулы хлоринов приводит к увеличению их фотодинамической активности [X. Guo, L. Wang, S. Wang, Y. Li, F. Zhang, B. Song, W. Zhao. Bioorg. Med. Chem. Lett., 2015, 25, 4078-4081].
Введение фтора в молекулы субстанций лекарственных средств повышает их устойчивость к метаболизму, биодоступность, показатели связывания с белками и обеспечивает оптимальные липофильные характеристики конечных продуктов [S. Purser, Р.R. Moore, S. Swallow, V. Gouvemeur. Chem. Soc. Rev., 2008, 37, 320-330].
Известны соединения формулы II, включающие несколько малеимидных групп, структура которых близка к структуре заявляемых соединений [Patent Application CN 105968119 А, опубл. 28.09.2016]. Однако соединения II являются порфиринами, а не хлоринами, и не содержат атомов фтора.
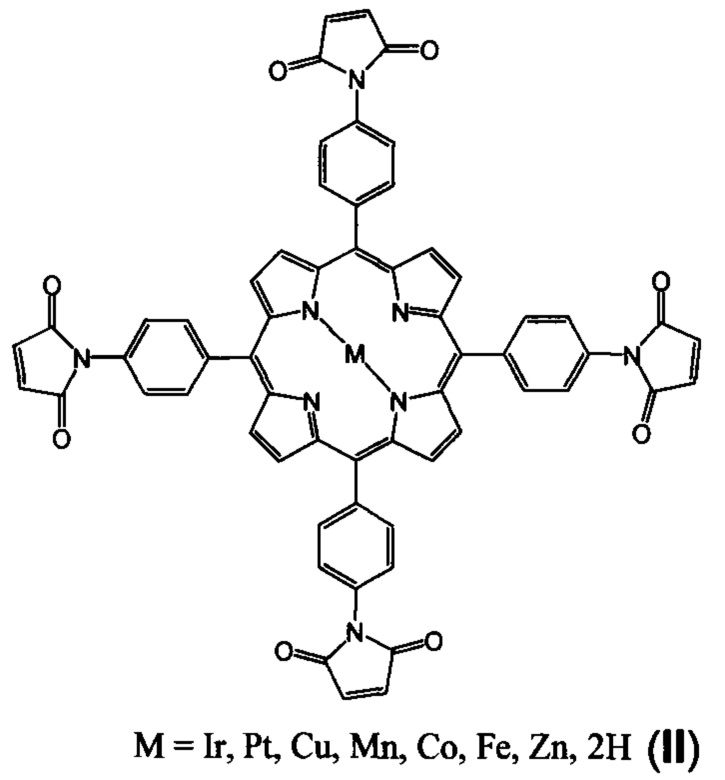
В литературе не имеется данных о биологической активности соединений II.
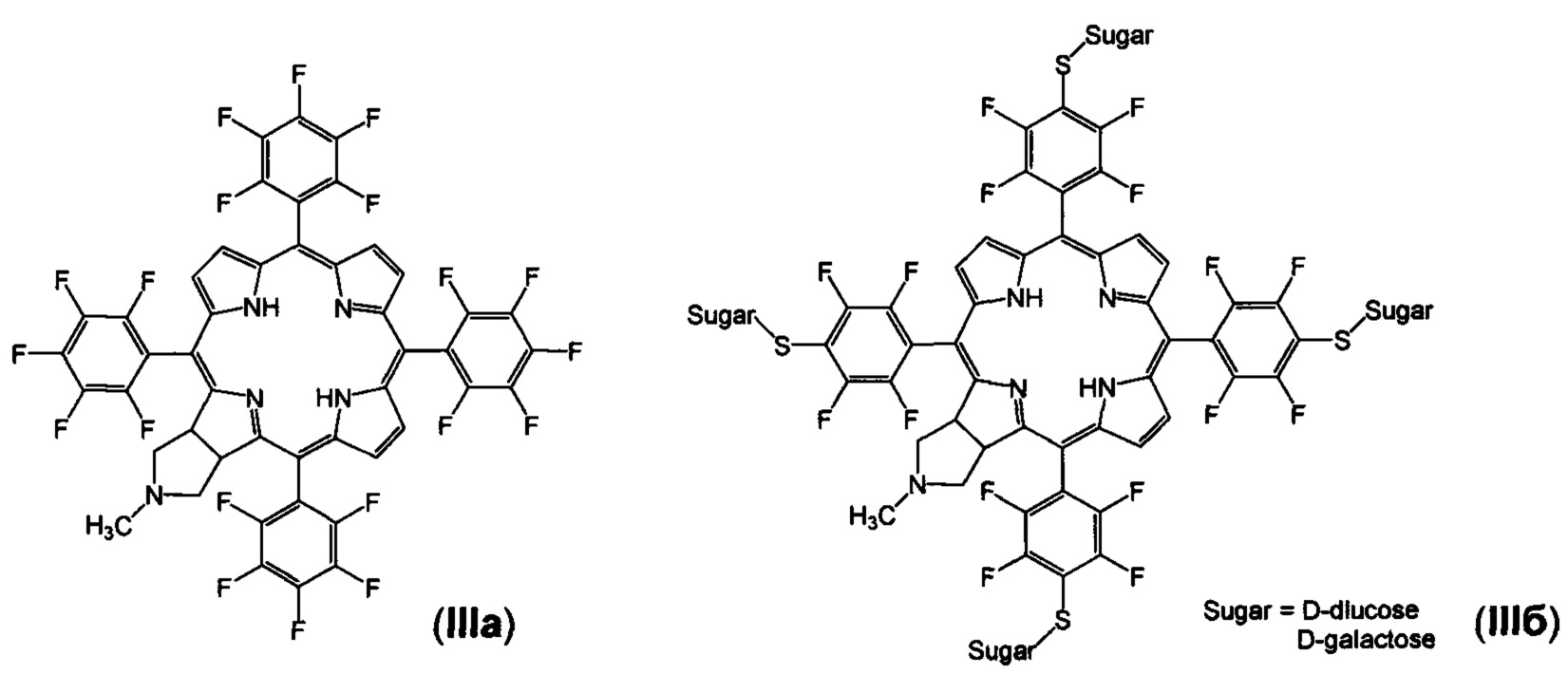
Известны производные синтетического хлорина формулы III, содержащие атомы фтора (IIIa) [G. Jimenez-Oses, J.I.  A.M.G. Silva, A.R.N. Santos, A.C. Tome, M.G.P.M.S. Neves, J.A.S. Cavaleiro. Tetrahedron, 2008, 64, 7937-7943] и гликозидные фрагменты (IIIб) [S. Hirohara, M. Obata, H. Alitomo, K. Sharyo, Т. Ando, M. Tanihara, S. Yano. J. Photochem. Photobiol. B: Biol., 2009, 97, 22-33]. Соединение IIIа не показало значительной цитотоксичности в терапевтических концентрациях, в отличие от соединений формулы IIIб [S. Hirohara, М. Obata, Н. Alitomo, K. Sharyo, Т. Ando, М. Tanihara, S. Yano. J. Photochem. Photobiol. В: Biol., 2009, 97, 22-33]. Таким образом, введение гликозидных фрагментов в молекулу фторированного хлорина IIIа увеличивает его фототоксичность, и соединения типа IIIб могут оказаться перспективными противоопухолевыми агентами. Эти данные указывают, что введение фармакофорных фрагментов в молекулу фторсодержащего хлорина увеличивают его противоопухолевую активность.
A.M.G. Silva, A.R.N. Santos, A.C. Tome, M.G.P.M.S. Neves, J.A.S. Cavaleiro. Tetrahedron, 2008, 64, 7937-7943] и гликозидные фрагменты (IIIб) [S. Hirohara, M. Obata, H. Alitomo, K. Sharyo, Т. Ando, M. Tanihara, S. Yano. J. Photochem. Photobiol. B: Biol., 2009, 97, 22-33]. Соединение IIIа не показало значительной цитотоксичности в терапевтических концентрациях, в отличие от соединений формулы IIIб [S. Hirohara, М. Obata, Н. Alitomo, K. Sharyo, Т. Ando, М. Tanihara, S. Yano. J. Photochem. Photobiol. В: Biol., 2009, 97, 22-33]. Таким образом, введение гликозидных фрагментов в молекулу фторированного хлорина IIIа увеличивает его фототоксичность, и соединения типа IIIб могут оказаться перспективными противоопухолевыми агентами. Эти данные указывают, что введение фармакофорных фрагментов в молекулу фторсодержащего хлорина увеличивают его противоопухолевую активность.
В литературе нет данных о синтетических хлоринах, которые содержат и атомы фтора, и малеимидные группы. Такая совокупность фармакофорных элементов могла бы обеспечить фотоксическое действие в отношении опухолевых клеток.
Задачей настоящего изобретения является создание ранее неизвестных малеимидных производных фторсодержащих хлоринов, которые проявляли бы противоопухолевую активность при использовании в фотодинамической терапии.
Технический результат: получение новых соединений - малеимидных производных фторсодержащего хлорина, проявляющих противоопухолевую активность, расширение арсенала агентов для ФДТ.
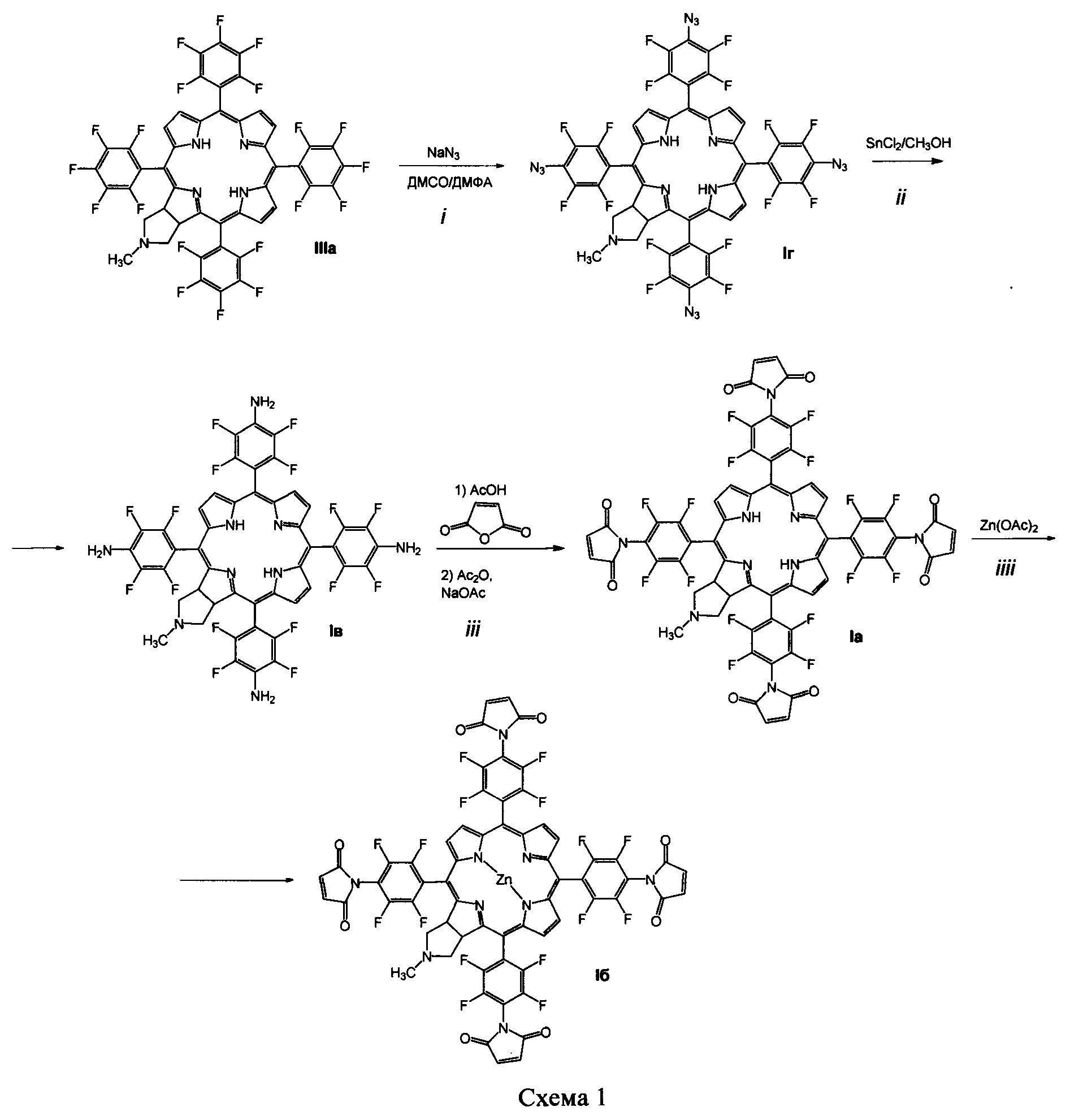
Поставленная задача решается производными 5,10,15,20-тетракис(4-амино-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина и его цинкового комплекса (Ia и Iб), проявляющими противоопухолевую активность, а также 5,10,15,20-тетракис(4-амино-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорином (Iв), используемым в качестве предшественника соединений Ia и Iб и 5,10,15,20-тетракис(4-азидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорином (Iг), используемым в качестве предшественника соединения Iв (Схема 1).
В качестве исходного соединения для получения соединения Iг используют доступный 5,10,15,20-тетракис(пентафторфторфенил)-17,18-N-метилпирролидинохлорин (IIIа), который получают по известной методике [G. Jimenez-Oses, J.I.  A.M.G. Silva, A.R.N. Santos, A.C. Tome, M.G.P.M.S. Neves, J.A.S. Cavaleiro. Tetrahedron, 2008, 64, 7937-7943].
A.M.G. Silva, A.R.N. Santos, A.C. Tome, M.G.P.M.S. Neves, J.A.S. Cavaleiro. Tetrahedron, 2008, 64, 7937-7943].
Способ получения соединений формулы I включает:
(i) обработку 5,10,15,20-тетракис(пентафторфторфенил)-17,18-N-метилпирролидинохлорина (IIIа) азидом натрия в смеси диметилформамид-диметилсульфоксид, приводящую к образованию 5,10,15,20-тетракис(4-азидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Iг);
(ii) восстановление азидных групп соединения Iг хлоридом олова в метаноле, которое дает 5,10,15,20-тетракис(4-амино-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорин (Iв);
(iii) взаимодействие соединения Iв с малеиновым ангидридом в растворе ледяной уксусной кислоты, дальнейшую обработку уксусным ангидридом в присутствии ацетата натрия и последующую стандартную очистку полученного 5,10,15,20-тетракис(4-N-малеимидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Ia);
(iiii) кипячение соединения Ia с ацетатом цинка в смеси хлороформ-метанол для введения атома цинка и получения цинкового комплекса 5,10,15,20-тетракис(4-N-малеимидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Iб).
Изобретение иллюстрируется конкретными примерами его осуществления, приведенными ниже.
Пример 1. Получение 5,10,15,20-тетракис(4-N-малеимидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Ia)
(i) Получение 5,10,15,20-тетракис(4-азидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Iг)
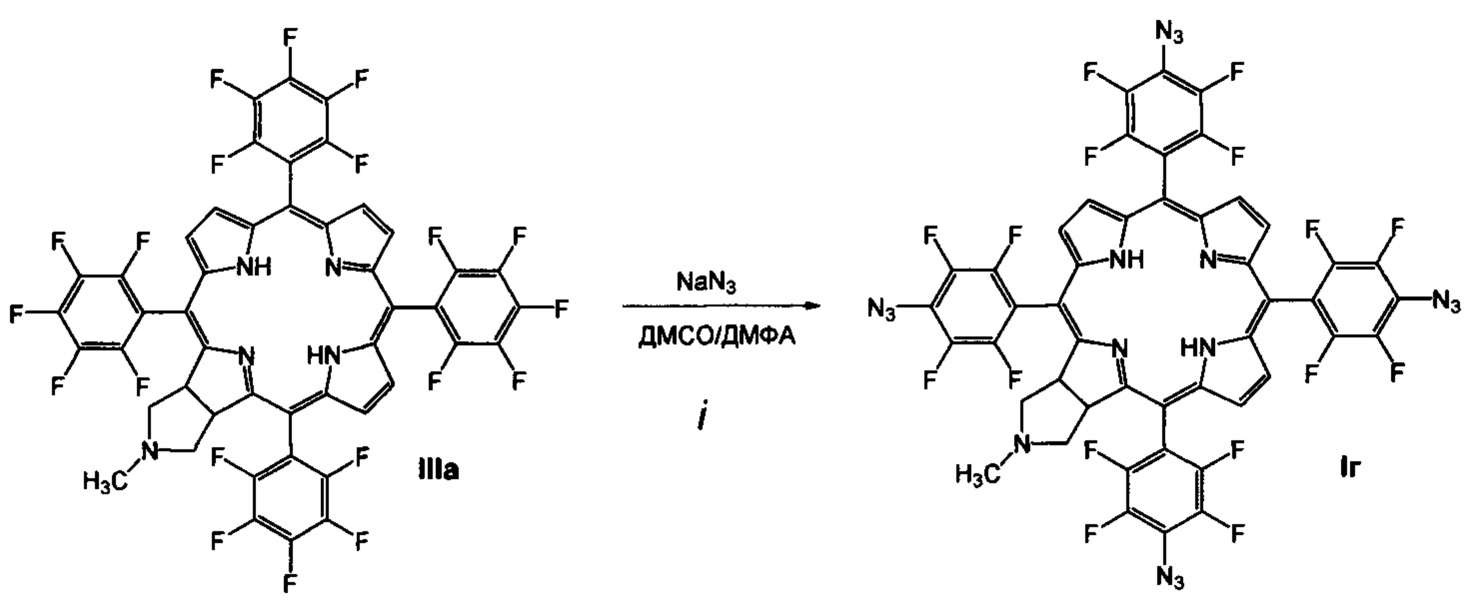
В 10 мл абсолютного диметилсульфоксида суспендируют 629 мг (9.68 ммоль) азида натрия в аргоне в течение 15 минут. К суспензии добавляют 500 мг (0.484 ммоль) 5,10,15,20-тетракис(пентафторфторфенил)-17,18-N-метил-пирролидинохлорина в 100 мл абсолютного диметилформамида. Реакционную массу греют в токе аргона при 65-70°С в течение 6 часов. Выливают в 150 мл воды, экстрагируют 4×100 мл хлороформа. Хлороформ промывают 2×150 мл воды, упаривают, продукт помещают на колонку с силикагелем, хроматографируют на силикагеле 40×60, элюент - хлороформ - ацетон (10:1). Выход соединения Iг 465 мг (85.5%). MS (MALDI): m/z [М+] для C47H17F16N17 вычислено: 1123.160; найдено: 1123.005. ИК-спектр (KBr), ν, см-1: 2924 (СН хлорина), 2125 (N3). Электронный спектр (CH2Cl2), λmax, нм, (ε⋅10-3): 412 (340.0), 506 (43.6), 601 (6.4), 654 (86.9). 1Н ЯМР - спектр (CDCl3), δ, м.д.: 8.77 (с, 2Н, β-пиррол), 8.55 (д, J=4.45 Гц, 2Н, β-пиррол), 8.45 (с, 2Н, β-пиррол), 5.30 (с, 2Н, СН), 3.20 (с, 2Н, СН2), 2.56 (с, 2Н, СН2), 2.25 (с, 3Н, СН3) -1.78 (с, 2Н, NH). 19F ЯМР - спектр (CDCl3), δ, м.д.: -151.76 (дк, J=22.00, 11.00 Гц, 4F), -150.88 (к, J=11.00 Гц, 2F), -150.51 (к, J=11 Гц, 2F), -137.94 (дд, J=22.00, 8.25 Гц, 2F), -137.44 (т, J=19.25 Гц, 4F), -135.95 (д, J=13.74 Гц, 2F).
(ii) Получение 5,10,15,20-тетракис(4-амино-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Iв)
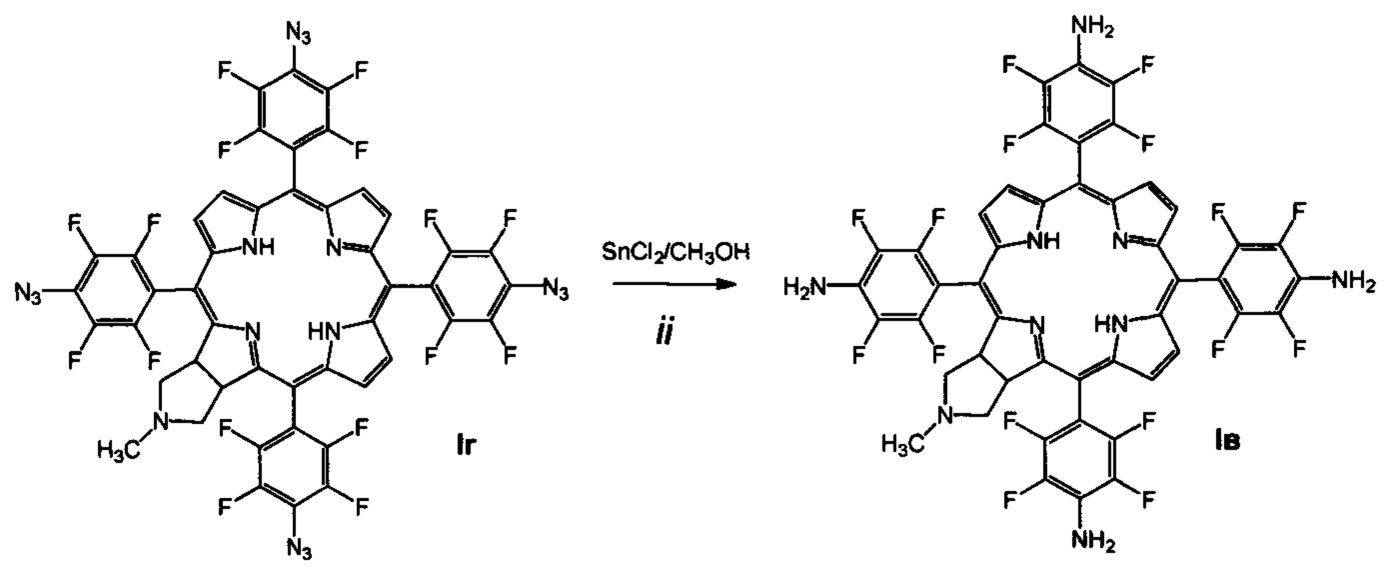
В 20 мл абсолютного метанола суспензируют 540 мг (2.85 ммоль) хлорида олова (II) в течение 20 мин. К реакционной массе добавляют 400 мг (0.356 ммоль) соединения 1 г в 50 мл абсолютного метанола. Пермешивают в токе аргона 1 час при комнатной температуре. Растворитель удаляют в вакууме, продукт помещают на колонку с силикагелем, хроматографируют на силикагеле 40×60, элюент - хлороформ - ацетон (5:2), затем хлороформ - ацетон (1:1). Выход соединения Iв 342 мг (94.1%). MS (MALDI): m/z [М+] для C47H25F16N9 вычислено: 1019.198; найдено: 1019.037. ИК-спектр (KBr), ν, см-1: 2924 (СН хлорина), 3435 (NH2 хлорина). Электронный спектр ((СН3)2СО), λmax, нм, (ε⋅10-3): 411 (334.2), 505 (47.2), 599 (7.8), 653 (82.3). 1Н ЯМР - спектр ((CD3)2CO), δ, м.д.: 9.17 (м, 2Н, β-пиррол), 8.82 (м, 4Н, β-пиррол), 5.97 (уш.с, 8Н, NH2), 4.61 (уш.с, 2Н, СН), 3.22 (уш.с, 2Н, СН2), 2.62 (с, 2Н, СН2), 2.16 (с, 3Н, СН3), -1.76 (уш.с, 2Н, NH). 19F ЯМР - спектр ((CD3)2CO), δ, м.д.: -147.55 (м, 2F), -146.52 (м, 4F), -145.93 (м, 2F), -141.30 (м, 2F), -140.73 (м, 4F), -139.17 (м, 2F).
(iii) Получение 5,10,15,20-тетракис(4-N-малеимидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Ia)
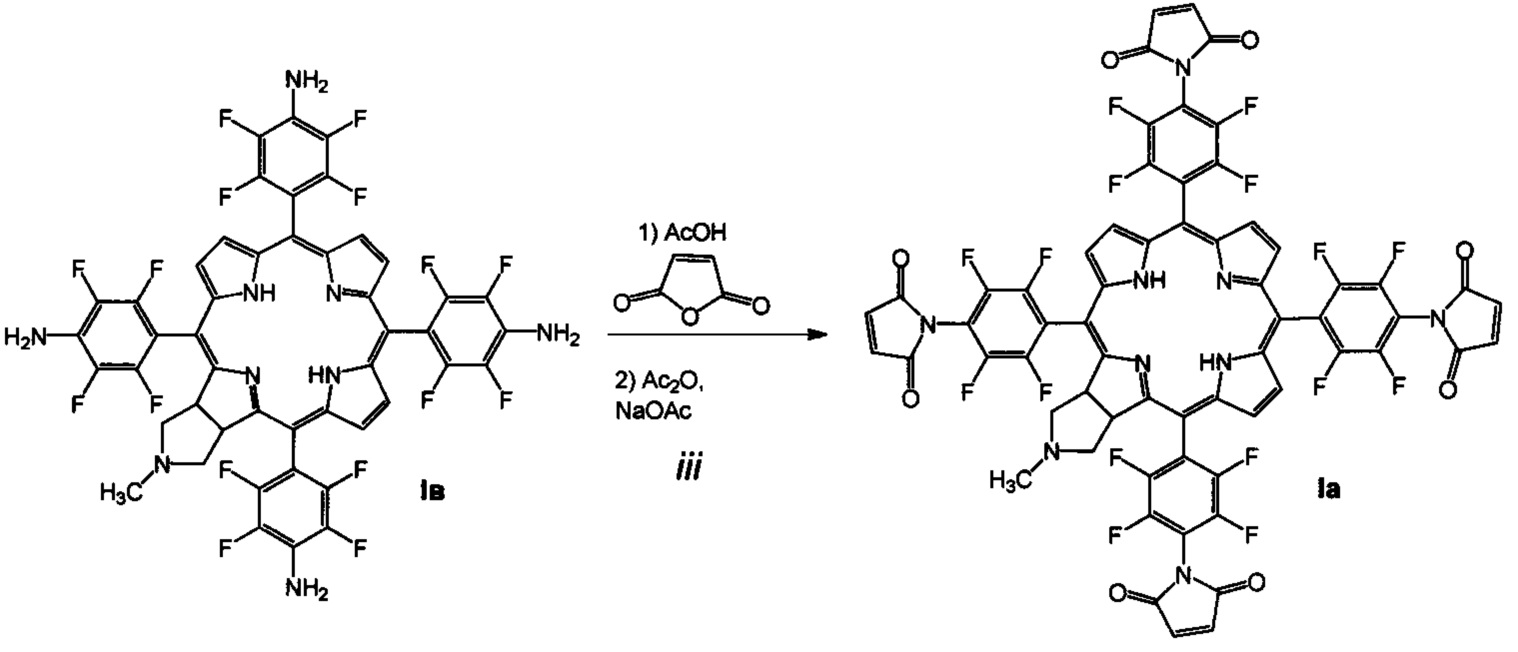
В 20 мл ледяной уксусной кислоты растворяют 300 мг (0.294 ммоль) соединения Iв и добавляют 576 мг (5.88 ммоль) малеинового ангидрида. Реакционную массу перемешивают 96 часа в токе аргона в темноте при комнатной температуре. Растворитель отгоняют в вакууме, к остатку добавляют 5 мл уксусного ангидрида и 482 мг (5.88 ммоль) ацетата натрия. Реакционную массу перемешивают 24 часа в токе аргона в темноте при 50-60°С. Растворитель упаривают в вакууме, продукт помещают на колонку с силикагелем, хроматографируют на силикагеле 40×60, элюент - хлороформ - ацетон (10:1), затем хлороформ - ацетон (5:1), затем хлороформ - ацетон (5:2)._Выход соединения Ia 87 мг (22.1%). MS (MALDI): m/z [М+] для C63H25F16N9O8 вычислено: 1339.157; найдено: 1339.014._ИК-спектр (KBr), ν, см-1: 2924 (СН хлорина), 1765 (С=O), 1615 (С=С малеимида). Электронный спектр ((СН3)2СО), λmax, нм, (ε⋅10-3): 406 (253.4), 504 (31.0), 598 (14.5), 651 (65.0)._1H ЯМР - спектр ((CD3)2CO), δ, м.д.: 9.24 (м, 2Н, β-пиррол), 8.85 (м, 4Н, β-пиррол), 6.84 (дд, J=12.08, 3.81 Гц, 4Н, СН=СН), 6.55 (д, J=12.08 Гц, 4Н, СН=СН),, 5.48 (уш.с, 2Н, СН), 3.21 (уш.с, 2Н, СН2), 2.73 (уш.с, 2Н, СН2), 2.37 (с, 3Н, СН3) -1.66 (уш.с, 2Н, NH). 19F ЯМР - спектр ((CD3)2CO), δ, м.д.: -146.22 (м, 2F), -145.24 (м, 4F), -144.82 (м, 2F), -141.56 (м, 4F), -139.69 (м, 2F), -139.34 (м, 2F).
Пример 2. Получение цинкового комплекса 5,10,15,20-тетракис(4-N-малеимидо-2,3,5,6-тетрафторфенил)-17,18-N-метилпирролидинохлорина (Iб)
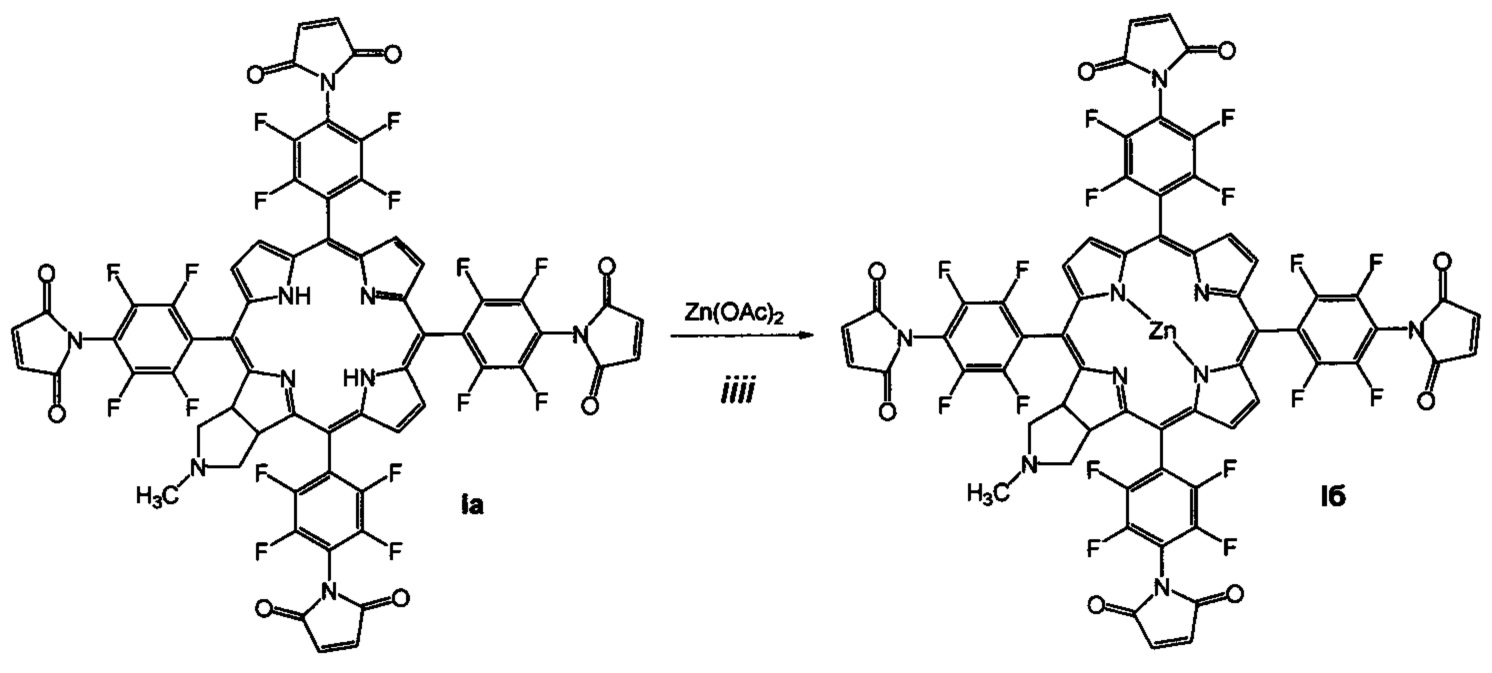
В смеси 10 мл хлороформа и 10 мл метанола растворяют 35 мг (0.026 ммоль) соединения Ia и 57 мг (0.26 ммоль) дигидрата ацетата цинка и кипятят 4 часа в токе аргона в темноте. Растворитель отгоняют в вакууме, продукт пропускают через слой силикагеля 40×60, элюент хлороформ-ацетон 1:1. Выход соединения Iб 34 мг (92.3%). MS (MALDI): m/z [М+] для C63H23F16N9O8Zn вычислено: 1401.071; найдено: 1401.003. ИК-спектр (KBr), ν, см-1: 2926 (СН хлорина), 1770 (С=O), 1614 (С=С малеимида). Электронный спектр (СН3)2СО, λmax, нм, (ε⋅10-3): 409 (267.4), 505 (32.7), 649 (67.2). 1Н ЯМР - спектр ((CD3)2CO), δ, м.д.: 9.25 (м, 6Н, β-пиррол), 6.94 (д, J=12.40 Гц, 4Н, СН=СН), 6.61 (д, J=12.40 Гц, 4Н, СН=СН), 5.42 (уш.с, 2Н, СН), 3.20 (уш.с, 2Н, СН2), 2.69 (уш.с, 2Н, СН2), 2.38 (с, 3Н, Me). 19F ЯМР - спектр ((CD3)2CO), δ, м.д.: -147.53 (д, J=13.75 Гц, 2F), -146.49 (д, J=13.75 Гц, 4F), -145.87 (к, J=11.00 Гц, 2F), -141.28 (д, J=13.75 Гц, 2F), -140.67 (д, J=13.75 Гц, 4F), -139.16 (дд, 22.00, 8.25 Гц, 2F).
Все полученные производные Ia-г представляют собой микрокристаллы темно-зеленого цвета, хорошо растворимые в ацетоне, этилацетате, диметилсульфоксиде.
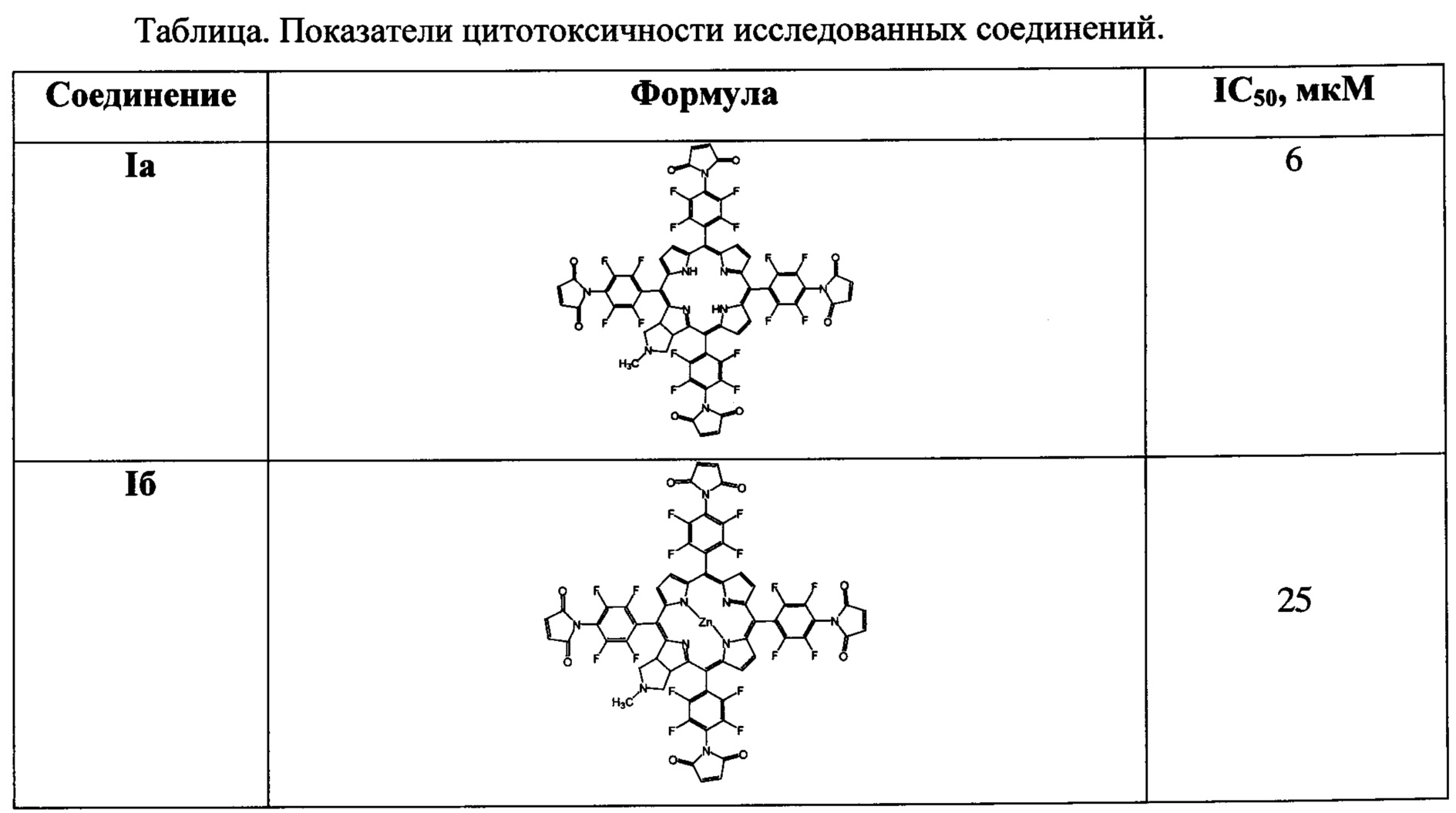
Ниже представлены результаты серии испытаний биологической активности заявляемых соединений Ia и Iб.
Результаты испытаний показали, что соединения Ia и Iб проявляют значительную активность на культивируемых злокачественных клетках (темновая и световая токсичность в терапевтических концентрациях (до 100 мкМ)), что позволяет считать их перспективными drug candidates для дальнейших исследований в качестве противоопухолевых агентов для ФДТ.
Результаты исследования темновой и световой токсичности соединений на культуре опухолевых клеток
Препараты для исследований
Для исследований использовали соединения Ia и Iб. Соединения растворяли в ДМСО до концентрации стокового раствора 10 мМ.
Изучение темновой токсичности (цитотоксичности)
Для экспериментов использована линия НСТ116 (рак толстой кишки). Клетки НСТ116 культивировали в среде DMEM с добавлением следующих компонентов до конечных концентраций: 5% эмбриональной телячьей сыворотки, 2 mM L-глутамина, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина (ПанЭко, Россия), инкубация проводилась при 37°С, 5% CO2 в увлажненной атмосфере. В экспериментах использованы клетки в логарифмической фазе роста.
МТТ-тест для исследования цитотоксичности
Цитотоксическое действие соединений исследовали в МТТ-тесте (по восстановлению желтой соли 3-4,5-диметилтиазол-2-ил-2,5-дифенилтераразола в темно-синий кристаллический формазан митохондриями живых клеток). По результатам исследования цитотоксичности построены кривые выживаемости и определены значения IC50.
Клетки рассевали в лунки 96-луночного планшета (NUNC, США) (5000 клеток в 190 мкл культуральной среды), инкубировали 24 часа при 37°С, 5% СО2, в увлажненной атмосфере. Вносили по 5-10 мкл раствора исследуемых веществ в культуральной среде, приготовленных серийными разведениями из исходного раствора, до 10 конечных концентраций.
Контролем в эксперименте служили клетки без препарата (интактные).
Клетки инкубировали 72 ч при 37°С, 5% СО2, в увлажненной атмосфере. За 1 ч до окончания инкубации в лунки вносили по 20 мкл водного раствора МТТ (5 мг/мл, ПанЭко, Россия). После окончания инкубации культуральную среду отбирали, клетки ресуспендировали в 100 мкл ДМСО и измеряли оптическую плотность раствора на планшетном спектрофотометре Multiscan FC (Thermo Scientific, США) при длине волны 570 нм. Процент клеток, выживших при действии каждой дозы соединения, подсчитывали как частное от деления средней оптической плотности в лунках после инкубации с данной дозой к средней оптической плотности контрольных лунок (значения последних приняты за 100%). Результаты представлены в таблице.
Изучение световой токсичности
Клетки НСТ116 рассеивали на 35-мм чашках Петри (50000 клеток в 2 мл культуральной среды).
Растворы исследуемых соединений концентрацией 10 мМ вносили в культуральную среду с клетками до конечной концентрации 5 мкМ и 10 мкМ. Культуры инкубировали при 37°С, 5% СО2 в течение 24 часов. Затем среду удаляли и добавляли 2 мл фосфатно-солевого буфера. Освещали белым светом в течение 20 мин. Для исключения теплового эффекта между чашкой и лампой помещали чашку с водой. Первая чашка - интактная. После облучения наблюдали за клетками в микроскоп. Изменений обнаружено не было. Остальные чашки с концентрациями соединений 5 и 10 мкМ соответственно облучали белым светом в течение 20 минут. Для исключения теплового эффекта между чашкой и лампой помещали чашку с водой. После освещения клетки округлились. Из чашек осторожно удаляли фосфатно-солевой буфер, добавляли свежую культуральную среду и инкубировали сутки, после наблюдали за клетками в микроскоп. Видели полную гибель клеток. Выявлен фототоксический эффект при освещении клеток НСТ116 в присутствии 5 мкМ и 10 мкМ Ia, и 10 мкМ Iб, менее выраженный эффект - при воздействии светом на чашки с 5 мкМ Iб.
Таким образом, проявленная активность заявляемых соединений Ia и Iб (темновая и световая токсичность в терапевтических концентрациях (до 100 мкМ) для культивируемых злокачественных клеток, позволяет считать их перспективными для дальнейших исследований как противоопухолевых агентов для ФДТ.