Результат интеллектуальной деятельности: СПОСОБЫ ЛЕЧЕНИЯ РАННЕГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ТРАСТУЗУМАБОМ-MCC-DM1 И ПЕРТУЗУМАБОМ
Вид РИД
Изобретение
[0001] РОДСТВЕННЫЕ ЗАЯВКИ
[0002] Настоящая заявка заявляет приоритет по 35 Своду законов США 119 предварительной заявке на патент США 61/984132, поданной 25 апреля 2014 года, полное содержание которой включено в настоящий документ посредством ссылки.
[0003] ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0004] Рассматриваемая заявка содержит перечень последовательностей, который представлен в формате ASCII и включен настоящий документ посредством ссылки во всей своей полноте. Текстовый файл ASCII был создан 23 апреля 2015 года, имеет название GNE-0412WO_SL.txt и размер 30505 байт.
[0005] ОБЛАСТЬ ТЕХНИКИ
[0006] Изобретение относится к способам применения трастузумаба-MCC-DM1 и пертузумаба для лечения раннего рака молочной железы (РРМЖ).
[0007] УРОВЕНЬ ТЕХНИКИ
[0008] Рак молочной железы и HER2-направленное лечение
[0009] Рак молочной железы является весьма значимой причиной заболеваемости и смертности во всем мире. Ежегодно во всем мире диагностируют более 1,3 миллиона случаев рака молочной железы с более чем 450000 случаев смертей, связанных с этим заболеванием (Jemal A, Bray F, Center M, et al. Global cancer statistics. CA Cancer J Clin, 2011; 61(2):69-90).
[0010] Рецепторная тирозинкиназа HER2 (ErbB2)является представителем семейства рецептора эпидермального фактора роста (РЭФР) (EGFR ) трансмембранных рецепторов. Избыточная экспрессия HER2 характерна для около 20% раковых опухолей молочной железы у человека (именуемых в дальнейшем HER2-положительным раком молочной железы) и ассоциируется с агрессивным ростом и неблагоприятными клиническими исходами, связанными с этими опухолями (Slamon et al (1987) Science 235:177-182). Избыточная экспрессия белка HER2 может быть определена с использованием анализа фиксированных опухолевых блоков на основе иммуногистохимии (Press MF, et al (1993) Cancer Res 53:4960-70).
[0011] Трастузумаб (CAS 180288-69-1, ГЕРЦЕПТИН®, huMAb4D5-8, rhuMAb HER2, Genentech) представляет собой полученное из рекомбинантной ДНК, IgG1 каппа, моноклональное антитело, которое является гуманизированным вариантом мышиного антитела анти-HER2 (4D5), которое селективно связывается с высокой аффинностью в анализе на основе клеток (Kd=5 нМ) с внеклеточным доменом HER2 (US 5677171; US 5821337; US 6054297; US 6165464; US 6339142; US 6407213; US 6639055; US 6719971; US 6800738; US 7074404; Coussens et al (1985) Science 230:1132-9; Slamon et al (1989) Science 244:707-12; Slamon et al (2001) New Engl. J. Med. 344:783-792). Показано, что трастузумаб как в анализах in vitro, так и у животных ингибирует пролиферацию человеческих опухолевых клеток, которые избыточно экспрессируют HER2 (Hudziak et al (1989) Mol Cell Biol 9:1165-72; Lewis et al (1993) Cancer Immunol Immunother; 37:255-63; Baselga et al (1998) Cancer Res. 58:2825-2831). Трастузумаб является медиатором антитело-зависимой клеточной цитотоксичности (ADCC, АТКЦ) (Lewis et al (1993) Cancer Immunol Immunother 37(4):255-263; Hotaling et al (1996) [abstract]. Proc. Annual Meeting Am Assoc Cancer Res; 37:471; Pegram MD, et al (1997) [abstract]. Proc Am Assoc Cancer Res; 38:602; Sliwkowski et al (1999) Seminars in Oncology 26(4), Suppl 12:60-70; Yarden Y. and Sliwkowski, M. (2001) Nature Reviews: Molecular Cell Biology, Macmillan Magazines, Ltd., Vol. 2:127-137).
[0012] ГЕРЦЕПТИН® был одобрен в 1998 году для лечения пациентов с HER2-сверхэкспрессирующим метастатическим раком молочной железы (Baselga et al, (1996) J. Clin. Oncol. 14: 737-744), которые получили интенсивную предшествующую противораковую терапию, и с тех пор применялся у более чем 300000 пациентов (Slamon DJ, et al. N Engl J Med 2001;344:783-92; Vogel CL, et al. J Clin Oncol 2002;20:719-26; Marty M, et al. J Clin Oncol 2005;23:4265-74; Romond EH, et al. T N Engl J Med 2005;353:1673-84; Piccart-Gebhart MJ, et al. N Engl J Med 2005;353:1659-72; Slamon D, et al. [abstract]. Breast Cancer Res Treat 2006, 100 (Suppl 1): 52). В 2006 году FDA (Управление по контролю качества пищевых продуктов и лекарственных средств США) одобрило ГЕРЦЕПТИН® (Трастузумаб, Genentech Inc.) в схеме лечения, содержащей доксорубицин, циклофосфамид и паклитаксел для адъювантной терапии пациентов с HER2-положительной узловой формой рака молочной железы.
[0013] Альтернативным подходом к антитело-направленной терапии является использование антител для доставки цитотоксических препаратов, в частности, к антиген-экспрессирующим раковым клеткам. Конъюгаты антитела с лекарственным препаратом, или ADC (КАЛП), представляют собой моноклональные антитела, к которым конюгируются высокоактивные цитостатические агенты. ADC (КАЛП) представляют собой новый подход, применяемый для придания опухоли селективности для системно вводимых противоопухолевых терапевтических средств. Благодаря использованию поверхностных антигенов, которые являются опухолеспецифическими и/или сверхэкспрессированными, ADC (КАЛП) предназначены для фокусирования доставки высокоактивных цитотоксических агентов к опухолевым клеткам. Потенциал этого подхода состоит в том, чтобы создать более благоприятное терапевтическое окно для таких агентов, в сравнении с тем, чего можно было бы достичь путем их введения в качестве свободных лекарственных препаратов.
[0014] Майтанзиноиды, производные анти-митотического препарата маитанзина, связываются с микротрубочками аналогично препаратам алкалоида барвинка (Issell BF et al (1978) Cancer Treat. Rev. 5:199-207; Cabanillas F et al. (1979) Cancer Treat Rep, 63:507-9. DM1 представляет собой тиолсодержащий мейтансиноид, полученный из природного эфира ансамитоцина P3 (Remillard S, Rebhun LI, Howie GA, et al. (1975) Science 189(4207):1002-1005.3; Cassady JM, Chan KK, Floss HG. (2004) Chem Pharm Bull 52(1):1-26.4). Родственный растительный сложный эфир - мейтанзин, вводимый в дозе 2,0 мг/м2 каждые 3 недели либо в виде разовой дозы, либо в течение 3 последовательных суток, был изучен в качестве химиотерапевтического агента у около 800 пациентов (Issell BF, Crooke ST. (1978) Maytansine. Cancer Treat Rev 5:199-207). В дозах, которые могут быть безопасно введены, активность маитанзина в клинических условиях была невысокой, несмотря на доказанную доклиническую активность. Дозолимитирующая токсичность (ДЛТ) была характерной для желудочно-кишечного тракта, включая тошноту, рвоту и диарею (часто переходящую в запор). Эта токсичность были дозозависимой, но не зависела от схемы применения препарата. Сообщалось о случаях периферической нейропатии (преимущественно сенсорной), которая была наиболее выраженной у пациентов, имеющих нейропатию в анамнезе. Сообщалось о субклинических транзиторных повышениях уровней печеночных трансаминаз, щелочной фосфатазы и общего билирубина. Системная токсичность, включая слабость, сонливость, дисфорию и бессонницу, была широко распространенным явлением. Менее распространенные виды токсичности включали флебит в месте инфузии и легкую миелосупрессию. Дальнейшая разработка этого препарата была приоставлена в 1980-х годах из-за узкого терапевтического окна.
[0015] Трастузумаб-MCC-DM1 (T-DM1, трастузумаб эмтансин, адо-трастузумаб эмтансин, КАДСИЛА®) - новый конъюгат антитела с лекарственным препаратом (ADC, КАЛП) для лечения HER2-положительного рака молочной железы, состоящий из цитотоксического агента DM1 (тиолсодержащий майтансиноидный антимикротрубочковый агент), конъюгированный с трастузумабом на лизиновых боковых цепях с помощью линкера MCC, со среднем содержанием лекарственного препарата (отношение лекарственного препарата к антителу) около 3,5. После связывания с HER2, экспрессированным на опухолевых клетках, Т-DM1 подвергается интернализации, опосредованной рецептором, что приводит к внутриклеточному высвобождению цитотоксических катаболитов, содержащих DM1, и последующей гибели клеток.
[0016] В фазе I исследования T-DM1 (TDM3569g) максимальная переносимая доза (МПД) T-DM1, вводимого с помощью в/в инфузии каждые 3 недели (1 раз в 3 недели), составила 3,6 мг/кг. ДЛТ (дозолимитирующая токсичность) характеризовалась транзиторной тромбоцитопенией у пациентов, получавших лечение в дозе 4,8 мг/кг. Лечение дозой 3,6 мг/кг 1 раз в 3 недели хорошо переносилось и ассоциировалось со значительной клинической активностью. (Krop (2010) J. Clin. Oncol. 28(16):2698-2704). В том же исследовании также показано, что еженедельная доза 2,4 мг/кг также хорошо переносилась и характеризовалась противоопухолевой активностью. (Beeram (2012) Cancer 118(23):5733-5740.)
[0017] В фазе II исследования (TDM4374g) продемонстрировано, что Т-DM1, вводимый в дозе 3,6 мг/кг 1 раз в 3 недели, характеризовался противоопухолевой активностью при монотерапии в популяции пациентов с HER2-положительным метастатическим раком молочной железы, ранее получавших интенсивное лечение. (Krop (2012) 30(26):3234-3241.) В фазе III исследования (TDM4370g) продемонстрировано, что T-DM1, вводимый в дозе 3,6 мг/кг 1 раз в 3 недели, значительно увеличивал выживаемость без прогрессирования и общую выживаемость, с меньшей токсичностью по сравнению с лечением лапатинибом в комбинации с капецитабином у пациентов с HER2-положительным распространенным раком молочной железы, ранее получавших лечение трастузумабом и таксаном. (Verma (2012) New England Journal of Medicine 367:1783-1791.)
[0018] Управление по контролю пищевых продуктов и лекарственных средств США одобрило адо-трастузумаб эмтансин, выпускаемый под торговым наименованием КАДСИЛА®, 22 февраля 2013 года для лечения пациентов с HER2-положительным метастатическим раком молочной железы, которые ранее получали лечение трастузумабом и таксаном.
[0019] Пертузумаб (также известный как рекомбинантное гуманизированное моноклональное антитело 2C4, rhuMAb 2C4, ПЕРЬЕТА®, Genentech, Inc., Саус-Сан-Франциско) является первым агентом нового класса, известного как ингибиторы димеризации HER (HDI), и функционирует для ингибирования способности HER2 формировать активные гетеродимеры или гомодимеры с другими HER-рецепторами (например, EGFR/HER1, HER2, HER3 и HER4). См., например, Harari and Yarden Oncogene 19:6102-14 (2000); Yarden and Sliwkowski. Nat Rev Mol Cell Biol 2:127-37 (2001); Sliwkowski Nat Struct Biol 10:158-9 (2003); Cho et al. Nature 421:756-60 (2003); и Malik et al. Pro Am Soc Cancer Res 44:176-7 (2003)
[0020] Было продемонстрировано, что блокада пертузумабом образования гетеродимеров HER2-HER 3 в опухолевых клетках ингибирует критически важные клеточные системы передачи сигналов, что приводит к снижению опухолевой пролиферации и выживаемости (Agus et al. Cancer Cell 2:127-37 (2002)).
[0021] Пертузумаб прошел испытания в качестве агента для монотерапии в клинических условиях в исследовании фазы Ia у пациентов с распространенным раком и исследовании фазы II у пациентов с раком яичников и раком молочной железы, а также раком легкого и раком предстательной железы. В фазе I исследовании пациентам с неизлечимыми, местно-распространенными, рецидивирующими или метастатическими солидными опухолями, которые прогрессировали во время или после стандартной терапии, назначали пертузумаб внутривенно каждые 3 недели. Пертузумаб в целом хорошо переносился. Регрессия опухоли достигнута у 3 из 20 пациентов, поддающихся оценке ответа. У двоих пациентов отмечались частичные ответы. Стабильное заболевание длительностью более 2,5 месяцев наблюдалось у 6 из 21 пациентов (Agus et al. Pro Am Soc Clin Oncol 22:192 (2003)). При дозах 2.0-15 мг/кг фармакокинетика пертузумаба была линейной, средний клиренс регистрировался в диапазоне от 2,69 до 3,74 мл/сут/кг, а средний терминальный период полувыведения колебался от 15,3 до 27,6 суток. Антитела к пертузумабу не обнаруживались (Allison et al. Pro Am Soc Clin Oncol 22:197 (2003)).
[0022] Патент США 2006/0034842 описывает способы лечения ErbB-экспрессирующего рака комбинацией антител анти-ErbB2. Патент США 2008/0102069 описывает применение трастузумаба и пертузумаба при лечении HER2-положительного метастатического рака, такого как рак молочной железы. Baselga et al., J Clin Oncol, 2007 ASCO Annual Meeting Proceedings Part I, Col. 25, No. 18S (June 20 Supplement), 2007:1004 сообщает о лечении пациентов с ранее пролеченным HER2-положительным раком молочной железы, который прогрессировал во время лечения трастузумабом, комбинацией трастузумаба и пертузумаба. Portera et al., J Clin Oncol, 2007 ASCO Annual Meeting Proceedings Part I. Vol. 25, No. 18S (June 20 Supplement), 2007: 1028 оценивал эффективность и безопасность комбинированной терапии трастузумабом и пертузумабом при HER2-положительном раке молочной железы у пациентов, у которых отмечалось прогрессирующее заболевание при терапии на основе трастузумаба. Авторы пришли к выводу, что необходима дополнительная оценка эффективности комбинированной терапии с целью определения общего риска и пользу от этой схемы лечения.
[0023] Пертузумаб был оценен в фазе II исследования в комбинации с трастузумабом у пациентов с HER2-положительным метастатическим раком молочной железы, которые ранее получали трастузумаб по поводу метастатического заболевания. В одном исследовании, проведенном Национальным институтом рака (НИР), участвовали 11 пациентов, ранее получавших лечение по поводу HER2-положительного метастатического рака молочной железы. У двоих из 11 пациентов отмечался частичный ответ (ЧО) (Baselga et al., J Clin Oncol 2007 ASCO Annual Meeting Proceedings; 25:18 S (June 20 Supplement): 1004. Результаты неоадъювантного исследования II фазы по оценке эффективности новой комбинированной схемы "пертузумаб и трастузумаб в комбинации с химиотерапией (доцетаксел)" у женщин с HER2-положительным раком молочной железы на ранних стадиях были представлены на Симпозиуме по проблемам рака молочной железы в Сан Антонио (CTRC-AACR San Antonio Breast Cancer Symposium (SABCS), Dec. 8-12, 2010) и продемонстрировали, что два антитела HER2 в комбинации с доцетакселом, назначаемые в качестве неоадъювантной терапии до оперативного вмешательства, значительно увеличивали скорость полного исчезновения опухоли (частота полного патологического ответа (пПО) - 45,8 процента) в молочной железе более чем наполовину по сравнению с комбинацией трастузумаба и доцетаксела (пПО - 29,0 процентов), р=0,014.
[0024] Пертузумаб, выпускаемый под торговым наименованием ПЕРЬЕТА®, был одобрен в 2012 году для лечения пациентов с распространенным HER2-положительным раком молочной железы или HER2-положительным раком молочной железы на поздней стадии (метастатическим). HER2-положительные раковые опухоли молочной железы повышают уровень белка HER2, что способствует росту и выживаемости клеток рака.
[0025] 30 сентября 2013 года Управление по контролю пищевых продуктов и лекарственных средств США предоставило ускоренное одобрение препарата ПЕРЬЕТА® (Пертузумаб) как часть полной схемы лечения для пациентов с ранними стадиями рака молочной железы (РРМЖ) до оперативного вмешательства (неоадъювантная терапия). ПЕРЬЕТА® является первым препаратом для неоадъювантной терапии рака молочной железы, одобренным FDA.
[0026] Патентные публикации, связанные с антителами HER2, включают: патент США № 5677171; 5720937; 5720954; 5725856; 5770195; 5772997; 6165464; 6387371; 6399063; 6015567; 6333169; 4968603; 5821337; 6054297; 6407213; 6639055;6719971; 6800738; 8075890; 5648237; 7018809; 6267958; 6685940; 6821515; 7060268; 7682609; 7371376; 6127526; 6333398; 6797814; 6339142; 6417335; 6489447; 7074404; 7531645; 7846441; 7892549; 8075892; 6573043; 6905830; 7129051; 7344840; 7468252; 7674589; 7919254; 6949245; 7485302; 7498030; 7501122; 7537931; 7618631; 7862817; 7041292; 6627196; 7371379; 6632979; 7097840; 7575748; 6984494; 7279287; 7811773; 7993834; 8076066; 8044017; 7435797; 7850966; 7485704; 7807799; 8142784; 7560111; 7879325; 8241630; 7449184; 8163287; 7700299; 7981418; 8247397; и US 2010/0016556; US 2005/0244929; US 2001/0014326; US 2003/0202972; US 2006/0099201; US 2010/0158899; US 2011/0236383; US 2011/0033460; US 2008/0286280; US 2005/0063972; US 2006/0182739; US 2009/0220492; US 2003/0147884; US 2004/0037823; US 2005/0002928; US 2007/0292419; US 2008/0187533; US 2011/0250194; US 2012/0034213; US 2003/0152987; US 2005/0100944; US 2006/0183150; US 2008/0050748; US 2009/0155803; US 2010/0120053; US 2005/0244417; US 2007/0026001; US 2008/0160026; US 2008/0241146; US 2005/0208043; US 2005/0238640; US 2006/0034842; US 2006/0073143; US 2006/0193854; US 2006/0198843; US 2011/0129464; US 2007/0184055; US 2007/0269429; US 2008/0050373; US 2006/0083739; US 2009/0087432; US 2006/0210561; US 2002/0035736; US 2002/0001587; US 2008/0226659; US 2002/0090662; US 2006/0046270; US 2008/0108096; US 2007/0166753; US 2008/0112958; US 2009/0239236; US 2012/0034609; US 2012/0093838; US 2004/0082047; US 2012/0065381; US 2009/0187007; US 2011/0159014; US 2004/0106161; US 2011/0117096; US 2004/0258685; US 2009/0148402; US 2009/0099344; US 2006/0034840; US 2011/0064737; US 2005/0276812; US 2008/0171040; US 2009/0202536; US 2006/0013819; US 2012/0107391; US 2006/0018899; US 2009/0285837; US 2011/0117097; US 2006/0088523; US 2010/0015157; US 2006/0121044; US 2008/0317753; US 2006/0165702; US 2009/0081223; US 2006/0188509; US 2009/0155259; US 2011/0165157; US 2006/0204505; US 2006/0212956; US 2006/0275305; US 2012/0003217; US 2007/0009976; US 2007/0020261; US 2007/0037228; US 2010/0112603; US 2006/0067930; US 2007/0224203; US 2011/0064736; US 2008/0038271; US 2008/0050385; US 2010/0285010; US 2011/0223159; US 2008/0102069; US 2010/0008975; US 2011/0245103; US 2011/0246399; US 2011/0027190; US 2010/0298156; US 2011/0151454; US 2011/0223619; US 2012/0107302; US 2009/0098135; US 2009/0148435; US 2009/0202546; US 2009/0226455; US 2009/0317387; US 2011/0044977; US 2012/0121586.
[0027] HER2-положительный рака молочной железы на ранней стадии (РРМЖ)
[0028] Для ранней стадии рака молочной железы (РРМЖ), прогностические факторы рецидива включают: стадию заболевания, включая доказательства способности распространяться (то есть, лимфоваскулярная инвазия или вовлечение лимфатических узлов) и молекулярный подтип. Опухоли с более агрессивной природой характеризуются повышенным риском рецидива, в частности опухоли, которым свойственны некоторые или все из следующих параметров: доказательства повышенной пролиферативной активности, высокая степень полиморфизма ядер, более низкие уровни экспрессии рецепторов гормона и избыточная экспрессия HER2 (Ross J, Slodkowska E, Symmans W, et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. The Oncologist, 2009; 14(4):320-68; Mazouni C, Peintinger F, Wan-Kau S, et al. Residual ductal carcinoma in situ in patients with complete eradication of invasive breast cancer after neoadjuvant chemotherapy does not adversely affect patient outcome.. J Clin Oncol, 2007; 125(19):2650-5). Сверхэкспрессия HER2 повышает риск рецидива у пациентов на всех стадиях РРМЖ. Даже опухоли≤1 см в диаметре ассоциировались с риском рецидива, достигающим 25% (Gonzalez-Angulo A, Litton J, Broglio K, et al. High risk of recurrence for patients with breast cancer who have human epidermal growth factor receptor 2 positive, node--negative tumors 1cm or smaller. J Clin Oncol, 2009; 27(34):5700-6). Учитывая высокий риск рецидива, большинству пациентов с ранними стадиями HER2-положительного рака молочной железы назначают системную терапию. Наиболее часто используют стандартные схемы для курабельного HER2-положительного рака молочной железы, которые содержат от двух до трех цитотоксических химиотерапевтических препаратов, вводимых в комбинации с трастузумабом. Учитывая существующие подходы к системной терапии, значительное число пациентов все равно будет иметь рецидив со смертельным исходом HER2-положительного рака молочной железы с долгосрочным риском рецидива 20% или выше.
[0029] Известно о четырех больших рандомизиарованных исследованиях, в которых оценивали роль трастузумаба в качестве адъювантной терапии HER2-положительного рака молочной железы на ранней стадии. В исследовании ГЕРЦЕПТИН® Адъювант (HERA) пациенты, завершившие курс химиотерапии, были рандомизированы для наблюдения, или для приема трастузумаба в течение 1 года или 2 лет (Piccart-Gebhart MJ, Procter M, Leyland-Jones B, et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med, 2005; 353(16):1659-1672). Результаты этого исследования, включая данные только из группы наблюдения и группы, получавшей терапию трастузумабом в течение 1года (Smith I. Trastuzumab following adjuvant chemotherapy in HER2-positive early breast cancer (HERA trial): disease-free and overall survival after 2 year median follow-up. Proc ASCO, 2006; Late Breaking Scientific Session), продемонстрировали, что при медиане наблюдения 23 месяца, терапия трастузумабом в течение 1 года ассоциировалась со статистически значимым показателем абсолютной выживаемости без признаков заболевания-(ВБПЗ), составляющим 6,3% (отношение рисков [ОР] = 0,64). Важно отметить, что у пациентов из группы, получавшей трастузумаб, отмечалось относительное снижение риска смерти на 34% (ОР = 0,66; р = 0,0115). Это положительный эффект был характерен для пациентов как с поражением лимфатических узлов, так и без поражения-лимфатических узлов. По достижению медианы последующего наблюдения - 8 лет, показатели общей выживаемости (ОВ) по-прежнему отмечались достоверно выше в группе пациентов, поучавших терапию трастузумабом в течение 1года, по сравнению с группой только наблюдения (ОР = 00,76, p-0,0005) (Gelber R, Goldhirsch A and Piccart M. HERA Trial: 2 years versus 1 year of Trastuzumab after adjuvant chemotherapy in women with HER2-positive early breast cancer at 8 years of median follow up. 2012 ESMO Congress; Abstract LBA6).
[0030] Проведен совместный анализ двух исследований адъювантной терапии: National Surgical Adjuvant Breast and Bowel Project (NSABP) B-31 и North Central Cancer Treatment Group (NCCTG) 9831 (Romond E, Perez E, Bryant J, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med, 2005; 353(16):1673-1684). В исследовании NSABP B-31 изучали комбинацию доксорубицина с циклофосфамидом (АС) с последующим переходом на паклитаксел, который вводили каждые 3 недели (1 раз в 3 недели) с 52 недельной терапией трастузумабом или без нее. В исследовании NCCTG 9831 сравнивали три схемы лечения: АС с последующим еженедельным введением паклитаксела, АС с последующим еженедельным введением паклитаксела с переходом на трастузумаб в течение 52 недель, и AC с последующим еженедельным введением комбинации паклитаксел + трастузумаб с последующим одним агентом трастузумабом в общей сложности 52 недель в целях HER2-направленной терапии. Совместный анализ объединял данные контрольной группы и группы пациентов, получающих одновременно паклитаксел + трастузумаб в обоих исследованиях. Авторы сообщали о 12%- показателе абсолютной эффективности, проявляющейся в 3-летней ВБПЗ в течение 3 лет. Совокупная частота застойной сердечной недостаточности (ЗСН) класса III или IV или смерти от сердечных причин составила 4,1% в исследовании B-31 и 2,9% в исследовании NCCTG 9831 в группах пациентов, одновременно получающих паклитаксел и трастузумаб. Кроме того, пациенты, получавшие одновременно паклитаксел и трастузумаб, имели тенденцию к улучшению показателей ВБПЗ по сравнению с пациентами, получавшими последовательно паклитаксел с последующим переходом на трастузумаб (ОР: 0,77; ДИ 0,53-1,11; p = 0,02).
[0031] Четвертое большое исследование, в котором оценивали адъювантное применение трастузумаба в комбинации с химиотерапией для лечения HER2-положительного РРМЖ, называлось "Международная научно-исследовательская группа по проблеме рака молочной железы (BCIRG) 006" (Slamon D, Eiermann W, Robert N, et al. Adjuvant Trastuzumab in HER2-positive breast cancer. N Engl J Med, 2011; 365(14): 1273-1283). Исследование BCIRG006 был разработано с целью определения следующих позиций: существенно ли улучшает введение трастузумаба при ранних стадиях HER2-положительного рака молочной железы клинические исходы и можно ли избежать повышенной кардиотоксичности, наблюдаемой при приеме трастузумаба с антрациклинами, с помощью использования новой схемы с применением доцетаксела без антрациклинов. Пациенты были рандомизированы в одну из трех групп лечения: доксорубицин и циклофосфамид с последующим переходом на доцетаксел (AC-T); доксорубицин и циклофосфамид с последующим переходом на доцетаксел и трастузумаб (AC-TH); или TCH. Трастузумаб вводили еженедельно во время химиотерапии, а затем 1 раз в 3 недели после этого в общей сложности 52 недели. Показатель 5-летней ВБПЗ для пациентов группы AC-T составил 75% по сравнению с 84% для пациентов группы AC-TH (ОР для сравнения с AC-T - 0,65; р <0,001) и 81% в группе TCH (ОР для сравнения с AC-T - 0,75; р = 0,04). Аналогичным образом, показатель ОВ в группах пациентов, получавших трастузумаб, отмечался выше по сравнению с группой AC-T. Показатель 5-летней ОВ для групы AC-T составил 87% по сравнению с 92% для группы AC-TH (ОР - 0,63; р <0,001) и 91% для группы TCH (ОР - 0,77; р = 0,04). Несмотря на то, что исследование не проводилось с целью обнаружения эквивалентности между двумя схемами лечения на основе трастузумаба, достоверных различий в показателях ВБПЗ или ОВ между группами TCH и AC-TH не выявлено. Важно отметить, что в группе TCH по сравнению с группой пациентов, получающих антрациклин/трастузумаб, отмечалось меньше случаев ЗСН класса 3 или 4 (4 против 21, соответственно, р < 0,001). Кроме того, субклиническое снижение средней фракции выброса левого желудочка (ФВЛЖ) >10% наблюдалось в 18,6% пациентов в группе АС-TH по сравнению с 9,4% пациентов группы TCH (р < 0,001). Несмотря на то, что во многих пациентов, которые получали трастузумаб в исследовании BCIRG, функция сердца восстановилась, из 18,6% пациентов, получавших AC-TH, с относительным уменьшением ФВЛЖ >10%, устойчивое снижение функции сердца отмечалось у многих, с длительностью >4 года у 33% из этих пациентов. Среднее изменение ФВЛЖ по сравнению с исходным уровнем на месяце 42 составляло -3.5 для AC-TH, в отличие от 0,2 для группы пациентов с лечением TCH (неопубликованные данные). Схема TCH характеризуется аналогичной эффективностью с меньшим количеством острых токсических эффектов и более низким риском кардиотоксичности и лейкемии при адъювантной терапии, по сравнению со схемами лечения на основе антрациклина.
[0032] Неоадъювантная терапия при HER2-положительном раке молочной железы
[0033] В многочисленных исследованиях оценивали трастузумаб в комбинации с различными химиотерапевтическими агентами в целях предоперационной терапии (Burstein H, Harris L, Gelman R, et al. Preoperative therapy with Trastuzumab and paclitaxel followed by sequential adjuvant doxorubicin/cyclophosphamide for HER2 overexpressing stage II or III breast cancer: a pilot study. J Clin Oncol, 2003; 21(1):46-53; Buzdar A, Ibrahim N, Francis D. Significantly higher pathologic complete remission rate after neoadjuvant therapy with Trastuzumab, paclitaxel, and epirubicin chemotherapy: results of a randomized trial in human epidermal growth factor receptor 2-positive operable breast cancer. J Clin Oncol. 2005; 23(16):3676-3685; Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant chemotherapy with Trastuzumab followed by adjuvant Trastuzumab versus neoadjuvant chemotherapy alone, in patients with HER2-positive locally advanced breast cancer (the NOAH trial): a randomised controlled superiority trial with a parallel HER2-negative cohort. Lancet, 2010; 375(9712):377-384; Untch M, Rezai M, Loibl S, et al. Neoadjuvant treatment with Trastuzumab in HER2-positive breast cancer: results from the GeparQuattro study. J Clin Oncol, 2010; 28(12): 2024-2031; Untch M, Fasching PA, Konecny GE, et al. Pathologic complete response after neoadjuvant chemotherapy plus Trastuzumab predicts favorable survival in human epidermal growth factor receptor-2-overexpressing breast cancer: results from the TECHNO trial of the AGO and GBG study groups. J Clin Oncol. 2011; 29(25):3351-7; Dent S, Oyan B, Honig A et al. HER2-targeted therapy in breast cancer: A systematic review of neoadjuvant trials. Cancer Treat Rev. 2013 Oct;39(6):622-31). Одним из первых таких исследований было экспериментальное исследование для оценки безопасности и эффективности паклитаксела в комбинации с трастузумабом. Эта схема характеризовалась частотой пПО 18% и частотой клинического ответа 85% (Burstein et al. 2003, выше). В последующем исследовании показано, что пациенты, которые получали неоадъювантную полихимиотерапию на основе комбинации антрациклина с трастузумабом достигали частоты пПО 65%, по сравнению только с 26% пациентов, получавших лишь химиотерапию (р = 0,016) (Buzdar et al. 2005 выше).
[0034] Одним из крупнейших неоадъювантных исследований в HER2-положительной популяции было рандомизированное исследование фазы III сравнения эффективности и безопасности последовательной неоадъювантной схемы, содержащей доксорубицин, паклитаксел и циклофосфамид, метотрексат и 5-фторурацил (CMF) с трастузумабом или без него у 333 пациентов с HER2-положительным местно-распространенным раком молочной железы (исследование NOAH). Параллельно наблюдаемая контрольная группа HER2-отрицательных пациентов получала такую же химиотерапевтическую схему (Gianni et al. 2010, выше). Добавление трастузумаба к неоадъювантной химиотерапии и продолжение терапии трастузумабом в адъювантной схеме лечения в общей сложности один год привело к клинически значимому и статистически достоверному улучшению показателей бессобытийной выживаемости (БСВ) и ОВ в ранее не получавших лечения пациентов с местно-распространенным HER2-положительным раком молочной железы. Эти данные подтверждают результаты вторичных параметров эффективности.
[0035] В исследовании NOAH, добавление трастузумаба к полной схеме химиотерапии ассоциировалось с увеличением мж(молоч.жел.)-пПО на 17,6% (с 26,7% до 44,3%). Увеличение мж-пПО соотносится с улучшенными показателями БСВ. Неоадъювантная терапия трастузумабом с последующим адъювантным трастузумабом была одобрена в ЕС на основании результатов этого исследования.
[0036] Другие схемы предоперационного лечения на основе трастузумаба изучались для демонстрации активности рака молочной железы при HER2-положительной опухоли, как в комбинации с химиотерапией, так и с другими HER2-направленными препаратами. При введении TCH в составе неоадъювантной терапии показатели пПО в молочной железе и лимфатической системе регистрировались в диапазоне 38,5-43,7% (Guiu S, Liegard M, Favier L et al. Long-term follow-up of HER2-overexpressing Stage II or III breast cancer treated by anthracycline-free neoadjuvant chemotherapy. Ann Oncol. 2011; 22(2):321-8; Bayraktar S, Gonzalez-Angulo A, Lei X et al. Efficacy of neoadjuvant therapy with Trastuzumab concurrent with anthracycline- and nonanthracycline-based regimens for HER2-positive breast cancer. Cancer. 2012; 118(9):2385-2393).
[0037] Адъювантная терапия HER2-положительного рака молочной железы
[0038] Адъювантная терапия, в самом широком смысле, представляет собой лечение, проводимое в дополнение к основной терапии с целью уничтожения раковых клеток, которые могут распространяться, даже если это распространение не может быть обнаружено с помощью рентгенологических или лабораторных исследований.
[0039] Публикации или семинары по вопросах адъювантной терапии включают: Paik et al., J. Natl. Cancer Inst., 92(24):1991-1998 (2000); Paik et al., J. Natl. Cancer Inst., 94:852-854 (2002); Paik et al. Успешная программа обеспечения качества тестирования HER2 в исследовании NSABP для Герцептина. Симпозиум по проблемам рака молочной железы в Сан Антонио, 2002; Roche PC et al., J. Natl. Cancer Inst., 94(11):855-7 (2002); Albain et al., Материалы ежегодного тридцать восьмого совещания Американского общества клинической онкологии, 18-21 мая 2002 года, Орландо, штат Флорида, Abstract 143; ATAC (Аримидекс, тамоксифен отдельно или в комбинации) Группа Trialists ', Lancet, 359: 2131-39 (2002); Geyer et al., 26-й ежегодный симпозиум по проблемам рака молочной железы в Сан Антонио (SABCS), декабрь 2003 года, Abstract 12; Perez et al., Proc. ASCO, 2005, Abstract 556.
[0040] Публикация патента США 2004/0014694 (опубликован 22 января 2004 года) описывает способ адъювантной терапии для лечения ранних стадий рака молочной железы, включающий введение доцетаксела, доксорубицина и циклофосфамида. Публикация патента США 2006/0275305 описывает способы адъювантной терапии с использованием трастузумаба и конъюгатов трастузумаба с лекарственным препаратом.
[0041] В настоящее время при применении HER2-направленной терапии при РРМЖ остается значительное число пациентов с риском рецидива и смерти от заболевания. Существует большая потребность в дополнительных вариантах лечения, которые улучшают исходы, предпочтительно, включая существенную оптимизацию возможности эрадикации инвазивного рака в молочной железе и лимфатических узлах.
[0042] КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0043] В целом, изобретение относится к способам лечения пациентов с раком молочной железы конъюгатом антитела с лекарственным препаратом "трастузумаб-MCC-DM1 (T-DM1)" и пертузумабом.
В одном аспекте настоящее изобретение относится к способу лечения рака молочной железы, включающему
(i) назначение пациенту с HER2-положительным, операбельным местно-распространенным или отечно-инфильтративным раком молочной железы неоадъювантной терапии комбинацией T-DM1 и пертузумаба, при отсутствии химиотерапии,
(ii) удаление указанного рака молочной железы путем радикального оперативного вмешательства; а также
(iii) назначение указанному пациенту адъювантной терапии с комбинацией T-DM1 и пертузумаба, при отсутствии химиотерапии.
В одном варианте реализации изобретения пациент подвергается адъювантному лечению комбинацией T-DM1 и пертузумаба, при отсутствии химиотерапии, которая включает таксан.
В другом варианте реализации изобретения пациент подвергается адъювантному лечению комбинацией T-DM1 и пертузумаба, при отсутствии сопутствующей химиотерапии, до и/или после радикального оперативного вмешательства.
В еще одном варианте реализации изобретения адъювантное лечение включает химиотерапию до и/или после лечения T-DM1 и пертузумабом.
В еще одном варианте реализации изобретения химиотерапия до и/или после лечения T-DM1 и пертузумабом не содержит таксана.
В еще одном дополнительном варианте реализации изобретения вводимая химиотерапия включает химиотерапию на основе антрациклина.
В другом варианте реализации изобретения применяемая химиотерапия дополнительно включает трастузумаб.
Во всех вариантах реализации изобретения терапия на основе антрациклина, если она присутствует, может, например, включать один или более препаратов FAC (5-фторурацил, доксорубицин, циклофосфамид), FEC (5-фторурацил, эпирубицин и циклофосфамид) или AC (доксорубицин, циклофосфамид).9. В одном варианте реализации изобретения рак молочной железы > 2 см в диаметре.
В другом варианте реализации изобретения радикальное оперативное вмешательство проводят по меньшей мере через 14 суток после завершения неоадъювантной терапии.
В еще одном варианте реализации изобретения радикальное оперативное вмешательство проводят не позднее, чем через 9 недель после завершения неоадъювантной терапии.
В еще одном варианте реализации изобретения протоколы неоадъювантного и адъювантного лечения включают инфузию T-DM1 в дозе 3,6 мг/кг каждые 3 недели и инфузию пертузумаба в нагрузочной дозе 840 мг и в дозе 420 мг каждые 3 недели после этого.
Во всех вариантах реализации изобретения T-DM1 и пертузумаб могут быть введены одновременно, могут быть введены совместно или могут быть введены последовательно в любом порядке. В одном конкретном варианте реализации изобретения введение осуществляют по схеме, представленной в Таблице 5.
В дополнительном варианте реализации изобретения лечение повышает один или более показателей: частота полного ответа (ПО), БСВ (бессобытийная выживаемость), ВБПЗ (выживаемость без признаков заболевания), ВБПИЗ (выживаемость без признаков инвазивного заболевания) и ОВ (общая выживаемость).
В еще одном дополнительном варианте реализации изобретения лечение увеличивает период времени до прогрессирования заболевания.
В одном варианте реализации изобретения неоадъювантное лечение по существу состоит из введения T-DM1 и пертузумаба.
В другом варианте реализации изобретения неоадъювантное лечение состоит из введения T-DM1 и пертузумаба.
В дополнительном варианте реализации изобретения адъювантное лечение по существу состоит из введения T-DM1 и пертузумаба.
В еще одном дополнительном варианте реализации изобретения адъювантное лечение состоит из введения T-DM1 и пертузумаба.
[0044] КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0045] На ФИГ. 1 представлена схема структуры белка HER2, и аминокислотные последовательности для доменов I-IV (SEQ ID №. 1-4, соответственно) его внеклеточного домена.
[0046] На ФИГ. 2А и 2В изображено выравнивание аминокислотных последовательностей вариабельных легких (VL) (ФИГ. 2А) и вариабельных тяжелых (VH) (ФИГ. 2B) доменов мышиного моноклонального антитела 2С4 (SEQ ID № 5 и 6, соответственно); VL and VH домены варианта 574/Пертузумаб (SEQ ID №. 7 и 8, соответственно), и человеческие VL and VH консенсусные каркасы (hum id, легкая каппа подгруппа I; humIII, тяжелая подгруппа III) (SEQ ID № 9 и 10, соответственно). Звездочки указывают на различия между вариабельными доменами пертузумаба и мышиного моноклонального антитела 2С4 или между вариабельными доменами пертузумаба и человеческого каркаса. Определяющие комплементарность области (CDR, ОКО) поданы в скобках.
[0047] На ФИГ. 3A и 3B приведены аминокислотные последовательности легкой цепи (ФИГ. 3A; SEQ ID №. 11) и тяжелой цепи пертузумаба (ФИГ. 3B; SEQ ID №: 12). CDR выделены жирным шрифтом. Рассчитанная молекулярная масса легкой цепи и тяжелой цепи составляет 23526,22 Да и 49216,56 Дa (цистеин в восстановленной форме). Углеводный фрагмент присоединен к Asn 299 тяжелой цепи.
[0048] На ФИГ. 4A и 4B приведены аминокислотные последовательности легкой цепи (ФИГ. 4A; SEQ ID № 13) и тяжелой цепи трастузумаба (ФИГ. 4В; SEQ ID № 14), соответственно. Границы вариабельных легких и вариабельных тяжелых доменов обозначены стрелками.
[0049] На ФИГ. 5А и 5В изображен вариант последовательности легкой цепи пертузумаба (ФИГ. 5А; SEQ ID № 15) и вариант последовательности тяжелой цепи пертузумаба (ФИГ. 5В; SEQ ID № 16), соответственно.
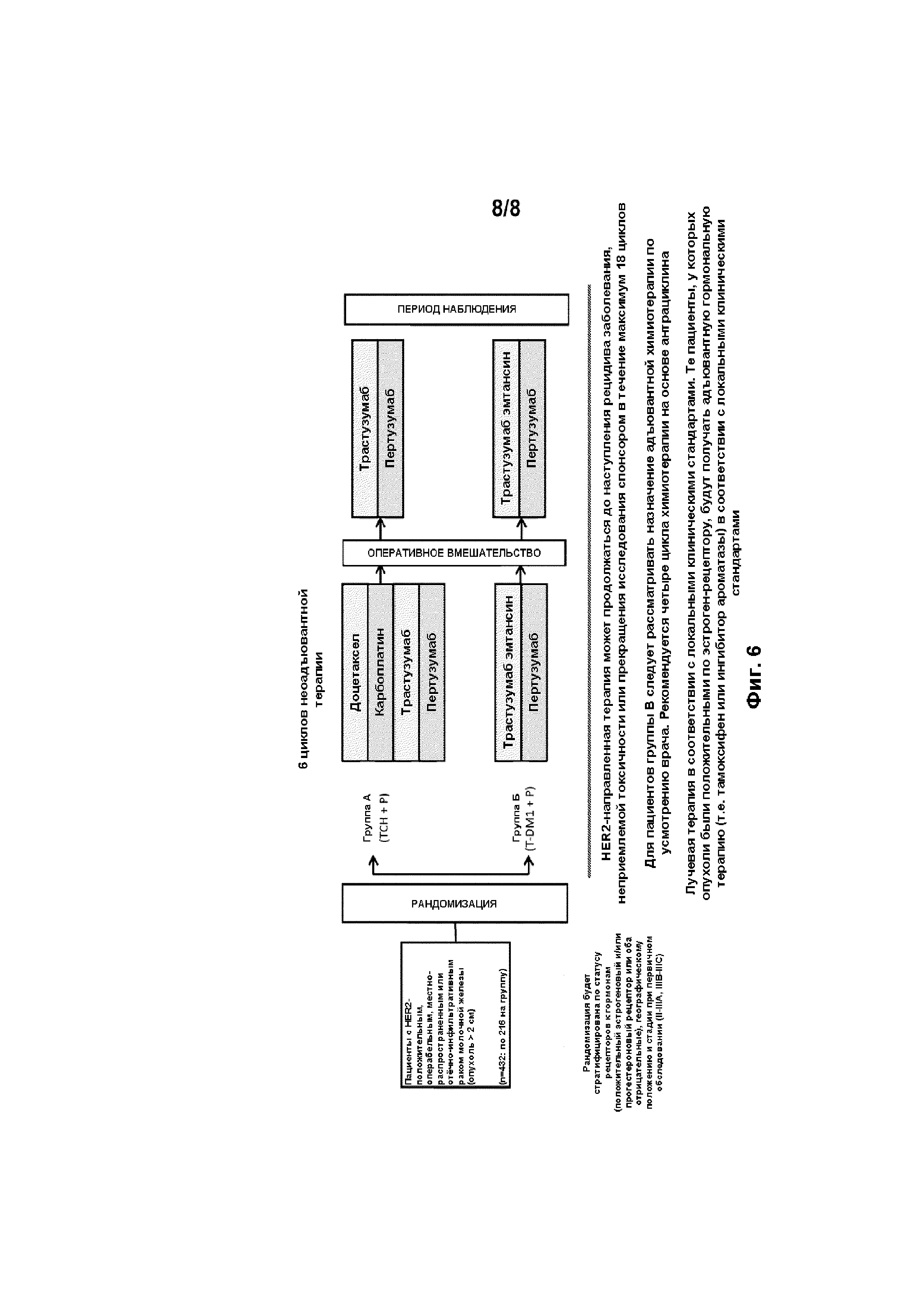
[0050] На ФИГ. 6 изображена схема клинического исследования KRISTINE, описанного в Примере 1.
[0051] ПОДРОБНОЕ ОПИСАНИЕ ТИПИЧНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0052] Далее будет приведено подробное описание определенных вариантов реализации изобретения, примеры которых проиллюстрированы в прилагаемых схемах и формулах. Поскольку изобретение будет описано во взаимосвязи с перечисленными вариантами реализации, следует понимать, что эти варианты реализации не предназначены для ограничения настоящего изобретения. Напротив, изобретение предусматривает охват всех альтернатив, модификаций и эквивалентов, которые могут быть включены в объем настоящего изобретения, как определено формулой изобретения. Специалистам в этой области техники будут очевидны многочисленные способы и материалы, аналогичные или эквивалентные описанным в настоящем документе, которые могут быть использованы в практике настоящего изобретения. Настоящее изобретение никоим образом не ограничивается способами и материалами, описанными в данном документе.
[0053] Вся литература, цитируемая по всему тексту описания, специально включена в настоящий документе в качестве ссылки во всей своей полноте. В случае, если один или более источников литературы, патентов и аналогичных материалов отличаются или противоречат настоящему применению, включая, но не ограничиваясь этим, определенные термины, использование терминов, описанные методы или т.п., настоящее применение является преимущественым.
[0054] ОПРЕДЕЛЕНИЯ
[0055] Слова "содержит", "содержащий", "включает", "включающий" и "включает в себя" при использовании в данном описании и формуле изобретения, предназначены для определения наличия заявленных признаков, целых элементов, компонентов или этапов, но они не исключают наличие или добавление одного или более других признаков, целых элементов, компонентов, этапов или их групп.
[0056] Термины "лечить" и "лечение" относятся как к терапевтическому лечению, так и к профилактическим или превентивным мерам, при этом целью является предотвращение или замедление прогрессирования (ослабление) нежелательного физиологического изменения или нарушения, такого как рост, развитие или распространение гиперпролиферативного состояния, такого как рак. В контексте настоящего изобретения благоприятные или желаемые клинические результаты включают, но не ограничиваются ими, ослабление симптомов, снижение степени заболевания, стабилизированное (т.е. не ухудшение) состояние заболевания, задержку или замедление прогрессирования заболевания, улучшение или временное облегчение болезненного состояния и ремиссию (вне зависимости от того, частичную или полную), вне зависимости от того, определяемую или неопределяемую. Термин "лечение" может также означать продление выживаемости по сравнению с ожидаемой выживаемостью без получения лечения. Пациенты, нуждающиеся в лечении, включают лиц, которые уже имеют патологическое состояние или нарушение, а также лиц, склонных к развитию патологического состояния или нарушения, или тех лиц, для которых патологическое состояние или нарушение следует предотвратить.
[0057] Термины "рак" и "раковый" относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется неконтролируемым ростом клеток. "Опухоль" включает одну или более раковых клеток. Примеры рака включают, но не ограничиваются ими, карциному, лимфому, бластому, саркому, лейкоз или лимфоидные злокачественные новообразования. Более конкретные примеры таких видов рака включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легкого, включая мелкоклеточный рак легкого, немелкоклеточный рак легкого ("НМРЛ"), аденокарциному легкого и плоскоклеточную карциному легкого, рак брюшины, гепатоцеллюлярный рак, желудочный рак или рак желудка, включая рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнной железы, рака почек или почечный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, анальную карциному, карциному полового члена, а также рак головы и шеи.
[0058] Термин "рак молочной железы на ранней стадии (РРМЖ)" или "ранний рак молочной железы» используется в данном контексте для обозначения рака молочной железы, который не распространился за пределы молочной железы или подмышечных лимфатических узлов. Термин включает протоковую карциному in situ и стадию I, стадию IIA, стадию IIB и стадию IIIA рака молочной железы.
[0059] Ссылка на опухоль или рак как "Стадия 0", "Стадия I", "Стадия II ", "Стадия III" или "Стадия IV", а также различные подстадии в рамках этой классификации, указывает на классификацию опухоли или рака с использованием известных в данной области техники способов общей группировки по стадиям или стадирования с помощью римских цифр. Хотя фактическая стадия рака зависит от типа рака, как правило, 0 стадия рака представляет собой поражение in situ, I стадия рака представляет собой небольшую локализованную опухоль, II и III стадия рака представляет собой местно распространенную опухоль с вовлечением местных лимфатических узлов, и IV стадия рака представляет собой метастатический рак. Конкретные стадии для каждого типа опухоли известны квалифицированному клиницисту.
[0060] Термин "метастатический рак молочной железы" означает состояние рака молочной железы, когда раковые клетки переносятся из первоначального места в одно или более мест в других частях тела по кровеносным или лимфатическим сосудам, с образованием одной или более вторичных опухолей в одном или более органов, помимо молочной железы.
[0061] "Распространенный" рак представляет собой рак, который распространился за пределы места или органа происхождения либо путем местной инвазии, либо путем метастазирования. Соответственно, термин "распространенный" рак включает как местно-распространенное, так и метастатическое заболевание.
[0062] "Рефракторный" рак представляет собой рак, который прогрессирует даже при введении пациенту с раком противоопухолевого агента, в том числе химиотерапии. Примером рефракторного рака является рак, рефракторный к препаратам платины.
[0063] "Рецидивирующий" рак представляет собой рак, который повторно вырос либо на первоначальном месте, либо в удаленном месте, после получения ответа на первоначальное лечение, такое как оперативное вмешательство.
[0064] "Местно-рецидивирующий" рак представляет собой рак, который рецидивирует после лечения в том же месте, что и ранее пролеченный рак.
[0065] "Операбельный" или "резектабельный" рак представляет собой рак, который ограничивается первичным органом и пригоден для хирургического вмешательства (резекции).
[0066] "Нерезектабельный" или "неоперабельный" рак не может быть удален (резецирован) хирургическим путем.
[0067] "HER2-положительный" рак содержит раковые клетки, которые имеют более высокие, по сравнению с нормальными, уровни HER2. Примеры HER2-положительного рака включают HER2-положительный рак молочной железы и HER2-положительный рак желудка. В некоторых случаях HER2-положительный рак характеризуется иммуногистохимическим (ИГХ) баллом 2+ или 3+ и/или коэффициентом амплификации ≥2.0 определенном по гибридизации in situ (ISH) к.
[0068] В данном контексте "пациент" или "субъект" является пациентом-человеком. Пациент может быть "пациентом с раком", т.е. таким, который страдает или имеет риск развития одного или более симптомов рака, в частности, рака желудка или рака молочной железы.
[0069] Термин "популяция пациентов" относится к группе раковых пациентов. Такие популяции могут быть использованы для демонстрации статистически значимой эффективности и/или безопасности лекарственного препарата, такого как пертузумаб.
[0070] Пациент "с рецидивом" - это тот, кто имеет признаки или симптомы рака после ремиссии. В некоторых случаях у пациента может быть рецидив после адъювантной или неоадъювантной терапии.
[0071] Рак или биологический образец, который "характеризуется экспрессией, амплификацией или активацией HER", является таким, который в диагностическом тесте экспрессирует (в том числе сверхэкспрессирует) рецептор HER, имеет амплифицированный ген HER, и/или иным образом демонстрирует активацию или фосфорилирование рецептора HER.
[0072] В данном контексте термин "неоадъювантная терапия" или "предоперационная терапия" относится к терапии, назначаемой до оперативного вмешательства. Целью неоадъювантной терапии является обеспечение немедленного системного лечения с потенциальной эрадикацией микрометастазов, которые в противном случае начали бы пролиферировать, если бы осуществлялась стандартная последовательность выполнения оперативного вмешательства с последующим назначением системной терапии. Неоадъювантная терапия может также способствовать уменьшению размера опухоли, тем самым позволяя производить полную резекцию первоначально неоперабельных опухолей или сохранить часть органа и его функции. Кроме того, неоадъювантная терапия позволяет оценить in vivo эффективность лекарственного препарата, которая может определять выбор последующих способов лечения.
[0073] В данном контексте термин "адъювантная терапия" относится к терапии, назначаемой после радикального оперативного вмешательства, для того чтобы уменьшить риск рецидива заболевания, при этом никаких признаков остаточной болезни не обнаруживается. Целью адъювантной терапии является предотвращение рецидива рака, и, следовательно, снижение вероятности смерти, связанной с раком. Адъювантная терапия в настоящем изобретении, в частности, исключает неоадъювантную терапию.
[0074] В данном контексте термин "радикальное оперативное вмешательство" используется так, как в медицинском сообществе. Радикальное оперативное вмешательство включает, например, хирургические или другие процедуры, в результате которых осуществляется удаление или резекция опухоли, в том числе те, в результате которых осуществляется удаление или резекция всей видимой невооруженным глазом опухоли. Радикальное оперативное вмешательство включает, например, полную или клинически радикальную резекцию, или полную объемную резекцию опухоли. Радикальное оперативное вмешательство включает процедуры, которые происходят в один или более этапов, и включает, например, многоэтапные хирургические процедуры, причем одна или более хирургических или других процедур выполняются до резекции опухоли. Радикальное оперативное вмешательство включает процедуры по удалению или резекции опухоли, включая вовлеченные органы, части органов и тканей, а также окружающие органы, такие как лимфатические узлы, части органов, или ткани. Удаление может быть неполным, вследствие чего опухолевые клетки могли оставаться, даже в том случае, если были незамеченными.
[0075] Термин "выживаемость" относится к пациенту, оставшемуся в живых, и включает выживаемость без признаков заболевания (ВБПЗ), выживаемость без прогрессирования (ВБП) и общую выживаемости (OВ). Показатели выживаемости могут быть оценены по методу Каплана-Мейера, а какие-либо их различия вычисляются с помощью стратифицированного логрангового критерия.
[0076] "Выживаемость без прогрессирования заболевания" (ВБП) представляет собой время с первого дня лечения до задокументированного прогрессирования заболевания (включая изолированную прогрессию в ЦНС) или смерти от любой причины в период исследования, в зависимости от того, что произойдет раньше.
[0077] Термин "выживаемость без признаков заболевания (ВБПЗ)" относится к пациенту, оставшемуся в живых, без рецидива рака в течение определенного периода времени, например, около 1 года, около 2 лет, около 3 лет, около 4 лет, около 5 лет, около 10 лет и т.д. от начала лечения или от первой постановки диагноза. В одном из аспектов настоящего изобретения ВБПЗ анализируют согласно назначенному лечению, т.е. пациентов оценивают на основании назначенной им терапии. Явления, анализируемые в рамках ВБПЗ, могут включать местные, регионарные и отдаленные рецидивы рака, возникновение вторичного рака и смерти от любой причины у пациентов без предварительного явления (например, рецидив рака молочной железы или второй первичный рак).
[0078] Термин "общая выживаемость" относится к пациенту, оставшемуся в живых в течение определенного периода времени, например, около 1 года, около 2 лет, около 3 лет, около 4 лет, около 5 лет, около 10 лет и т.д. от начала лечения или от первой постановки диагноза. В исследованиях, лежащих в основе изобретения, явлением, которое учитывалось при анализе выживаемости, была смерть от любой причины.
[0079] Под термином "увеличение выживаемости" подразумевают увеличение ВБПЗ и/или OВ в пролеченных пациентов по сравнению с пациентами, не получавшими лечения, или по сравнению с контрольным протоколом лечения. Выживание контролируется в течение по меньшей мере около шести месяцев, или по меньшей мере около 1 года, или по меньшей мере около 2 лет, или по меньшей мере около 3 лет, или по меньшей мере около 4 лет, или по меньшей мере около 5 лет, или по меньшей мере около 10 лет и т.д. от начала лечения или от первой постановки диагноза.
[0080] "Отношение риска" при анализе выживаемости представляет собой сумму разности между двумя кривыми выживаемости, представляющих снижение риска смерти при лечении по сравнению с контролем, в течение периода наблюдения. Отношение риска представляет собой статистическое определение для частот явлений. В контексте настоящего изобретения отношение риска определяется как существующая вероятность явления в экспериментальной группе, деленная на вероятность явления в контрольной группе в любой конкретный момент времени.
[0081] Под термином "монотерапия" подразумевается терапевтическая схема, которая включает только один терапевтический агент для лечения рака или опухоли в течение периода лечения.
[0082] Под термином "поддерживающая терапия" подразумевается терапевтическая схема, которая назначается с целью снижения вероятности рецидива или прогрессирования заболевания. Поддерживающая терапия может назначаться в течение длительного времени, включая длительные периоды времени вплоть до периода продолжительности жизни субъекта. Поддерживающая терапия может быть назначена после первичной терапии или в сочетании с первичной или дополнительной терапией. Дозы, используемые для поддерживающей терапии, могут изменяться и включать сниженные дозы по сравнению с дозами, используемыми для других видов терапии.
[0083] Как определено в настоящем описании, термины "трастузумаб", "ГЕРЦЕПТИН®" и "huMAb4D5-8" используются взаимозаменяемо. Такое антитело предпочтительно содержит аминокислотные последовательности легкой и тяжелой цепи, показанные на ФИГ. 4A; SEQ ID № 13) и на ФИГ. 4В; SEQ ID № 14), соответственно.
[0084] "Эпитоп 4D5" или "эпитоп 4D5" или "4D5" представляет собой область во внеклеточном домене HER2, с которой связывается антитело 4D5 (АТСС CRL 10463) и трастузумаб. Этот эпитоп примыкает к трансмембранному домену HER2 и находится в пределах домена IV HER2. Для скрининга антител, которые связываются с эпитопом 4D5, может быть выполнен перекресто-блокирующий анализ, как описано в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). В альтернативном варианте может быть осуществлено картирование эпитопов для оценки того, связывается ли антитело с эпитопом 4D5 HER2 (например, каким-либо одним или более остатков HER2 в области от остатка около 529 до остатка около 625, включительно).
[0085] "Эпитоп 2С4" или "эпитоп 2С4" представляет собой область во внеклеточном домене HER2, с которой связывается антитело 2С4. С целью скрининга антител, которые связываются с эпитопом 2C4, может быть выполнен перекресто-блокирующий анализ, как описано в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). В альтернативном варианте может быть осуществлено картирование эпитопов для оценки того, связывается ли антитело с эпитопом 2C4 HER2. Эпитоп 2C4 содержит остатки из домена II во внеклеточном домене HER2. Антитело 2C4 и пертузумаб связываются с внеклеточным доменом HER2 на стыке доменов I, II и III (Franklin et al. Cancer Cell 5:317-328 (2004)).
[0086] В контексте данного изобретения термины "пертузумаб", "ПЕРЬЕТА®" и "rhuMAb 2C4" используются взаимозаменяемо.. Такое антитело предпочтительно содержит аминокислотные последовательности легкой и тяжелой цепи в SEQ ID № 7 и 8, соответственно. Поскольку пертузумаб является интактным антителом, он предпочтительно содержит антитело IgG1, в одном варианте реализации изобретения включающее аминокислотную последовательность легкой цепи SEQ ID №: 11 или 15, и аминокислотную последовательность тяжелой цепи в SEQ ID № 12 или 16. В некоторых случаях антитело продуцируется рекомбинантными клетками яичника китайского хомячка (ЯКХ).
[0087] Как определено в настоящем описании, термины "T-DM1", "трастузумаб-MCC-DM1", "адо-трастузумаб эмтансин", "трастузумаб эмтансин" и "КАДСИЛА®" используются взаимозаменяемо и относятся к трастузумабу, связанному через линкерный фрагмент MCC с молекулой DM1 лекарственного препарата майтанзиноид, включая все смеси по-разному нагруженных и присоединенных конъюгатов антитела с лекарственнм препаратом, при этом 1, 2, 3, 4, 5, 6, 7 и 8 молекул лекарственного препарата ковалентно связаны с антителом трастузумаб (US 7097840, US 2005/0276812, US 2005/0166993).
[0088] В данном контексте термин "противоопухолевый агент" относится к лекарственному препарату, применяемому для лечения рака. Не ограничивающие примеры противоопухолевых агентов по настоящему изобретению включают химиотерапевтические агенты, ингибиторы димеризации HER, антитела к HER, антитела, направленные против опухолеассоциированных антигенов, антигормональные соединения, цитокины, EGFR-направленные препараты, антиангиогенные агенты, ингибиторы тирозинкиназы, агенты и антитела, ингибирующие рост, цитостатики, антитела, которые индуцируют апоптоз, ингибиторы COX, ингибиторы фарнезилтрансферазы, антитела, которые связывают онкофетальный белок CA 125, вакцины HER2, ингибиторы Raf или ras, липосомальный доксорубицин, топотекан, таксан, двойные ингибиторы тирозинкиназы, TLK286, EMD-7200, пертузумаб, трастузумаб, эрлотиниб и бевацизумаб.
[0089] Термин "химиотерапия" означает использование химиотерапевтического агента, пригодного для лечения рака.
[0090] Термин "химиотерапевтический агент" представляет собой химическое соединение, пригодное для лечения рака, независимо от механизма действия. Классы химиотерапевтических агентов включают, но не ограничиваются ими: алкилирующие агенты, антиметаболиты, растительные алкалоиды веретенного яда, цитотоксические/противоопухолевые антибиотики, ингибиторы топоизомеразы, антитела, фотосенсибилизаторы и ингибиторы киназы. Примеры химиотерапевтических агентов включают: эрлотиниб (ТАРЦЕВА®, Genentech/OSI Pharm.), доцетаксел (ТАКСОТЕР®, Sanofi-Aventis), 5-ФУ (фторурацил, 5-фторурацил, CAS № 51-21-8), гемцитабин (ГЕМЗАР®, Lilly), PD-0325901 (CAS № 391210-10-9, Pfizer), цисплатин (цис-диамин, дихлорплатин (II), CAS № 15663-27-1), карбоплатин (CAS № 41575-94-4), паклитаксел (ТАКСОЛ®, Bristol-Myers Squibb Oncology, Принстон, штат Нью-Джерси), темозоломид (4-метил-5-оксо-2,3,4,6,8-пентазабицикло [4.3.0] нона-2,7,9- триен- 9-карбоксамид, CAS № 85622-93-1, ТЕМОДАР®, ТЕМОДАЛ®, Schering Plough), тамоксифен ((Z) -2- [4- (1,2-дифенилбут-1-енил) фенокси] -N,N-диметиламин-этанамин, НОЛВАДЕКС®, ИСТУБАЛ®, ВАЛОДЕКС®) и доксорубицин (АДРИАМИЦИН®), Akti-1/2, HPPD и рапамицин.
[0091] Другие примеры химиотерапевтических агентов включают: оксалиплатин (Элоксатин®, Sanofi), бортезомиб (ВЕЛКЕЙД®, Millennium Pharm.), сутент (СУНИТИНИБ®, SU11248, Pfizer), летрозол (ФЕМАРА®, Novartis), иматиниб мезилат (ГЛИВЕК®, Novartis), XL-518 ( ингибитор МЕК, Exelixis, WO 2007/044515), Arry-886 (ингибитор Мек, AZD6244, Array BioPharma, Astra Zeneca), SF-1126 (ингибитор PI3K, Semafore Pharmaceuticals), БЭЗ-235 (ингибитор PI3K, Novartis), XL-147 (ингибитор PI3K, Exelixis), РТК787/ZK 222584 (Novartis), фулвестрант (ФАЗЛОДЕКС®, AstraZeneca), лейковорин (фолиевая кислота), рапамицин (сиролимус, РАПАМУН®, Wyeth), лапатиниб (ТИКЕРБ®, GSK572016, Glaxo Smith Kline), лонафарниб (САРАСАР™, SCH 66336, Schering Plough), сорафениб (НЕКСАВАР®, BAY43-9006, Bayer Labs), гефитиниб (ИРЕССА®, AstraZeneca), иринотекан (КАМПТОСАР®, СРТ-11, Pfizer), типифарниб (ЗАРНЕСТРА™, Johnson & Johnson), АБРАКСАН ™ (не содержащий хемофора), лекарственные формы альбумин-синтетических наночастиц паклитаксела (American Pharmaceutical Partners, Schaumberg, Il), вандетаниб (rINN, ZD6474, ЗАКТИМА®, AstraZeneca), хлоранмбуцил, AG1478, AG1571 (SU 5271; Sugen), темсиролимус (ТОРИЗЕЛ®, Wyeth), пазопаниб (GlaxoSmithKline), канфосфамид (ТЕЛКИТА®, Telik), тиотепу и циклофосфамид (ЦИТОКСАН®, НЕОСАР®); алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметиломеламин; ацетогенины (особенно буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его адозелезиновые, карзелезиновые и бизелезиновые синтетические аналоги); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; мустаргены, такие как хлорамбуцил, хлорнафазин, хлорофосфамид, эстрамустин, ифосфамид, мехлорэтамин, мехлорэтамина оксид гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; препараты нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, калихеамицин гамма 1I, калихеамицин омега I1 (Angew Chem. Intl. Ed. Engl. (1994) 33: 183-186); динемицин, динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; а также неокарциностатиновый хромофор и родственные хромопротеиновые энедииновые антибиотические хромофоры), аклациномизины, актиномицин, аутрамицин, азазерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идаруцибин, марселломицин, митомицины, такие как митомицин C, микофенольную кислоту, ногаламицин, оливомицины, пепломицин, порфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; алдофосфамида гликозид; аминолевулиновая кислотаы; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиниума ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; мейтансиноиды, такие как маитанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраерин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновая кислота; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Юджин, Орегон); разоксан; ризоксин; сизофиран; спирогерманиум; тенуазоновую кислоту; триазиквон; 2,2', 2"-трихлоротриетиламин; трихотецины (токсин Т-2, верракурин А, роридин А и ангуидин), уретан; виндезина; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид (Ara-C); циклофосфамид ; тиотепу; 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; этопозид (VP-16), ифосфамид; митоксантрон; винкристин; винорелбин (НАВЕЛБИН®); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин (КСЕЛОДА®, Roche); ибандроната; СРТ-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (ДФМО); ретиноиды, такие как ретиноевая кислота; и их фармацевтически приемлемые соли, кислоты и производные любого из указанных выше веществ.
[0092] Термин "эффективное количество" относится к количеству лекарственного препарата, эффективного для лечения рака у пациента. Эффективное количество лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. замедлять до некоторой степени и предпочтительно останавливать) метастазирование опухоли; ингибировать до некоторой степени рост опухоли; и/или ослаблять до некоторой степени один или более симптомов, ассоциированных с раком. В той мере, насколько препарат может предотвратить рост и/или разрушать существующие раковые клетки, он может быть цитостатическим и/или цитотоксическим. Эффективное количество может продлить выживаемость без прогрессирования (например, которая измеряется с помощью Критериев оценки ответа для солидных опухолей (RECIST) или изменений CA-125) и проводить к объективному ответу (включая частичный ответ (ЧО) или полный ответ (ПО)), продлению времени общей выживаемости и/или ослаблению одного или более симптомов рака (например, по оценке FOSI). Термин "эффективное количество" включает, в частности, количество, пригодное для достижения любого из первичных или вторичных критериев оценки клинического исследования, описанного в Примере 1.
[0093] "Таксан" представляет собой химиотерапевтическое вещество, которое ингибирует митоз и препятствует активности микротрубочек. Примеры таксанов включают паклитаксел (ТАКСОЛ®; Bristol-Myers Squibb Oncology, Принстон, штат Нью-Джерси); несодержащая хемофора лекарственная форма альбумин-синтетических наночастиц паклитаксела или наб-паклитаксел (АБРАКСАНТМ; American Pharmaceutical Partners, Шаумберг, штат Иллинойс); и доцетаксел (ТАКСОТЕР®; Rhône-Poulenc Rorer, Антони, Франция).
[0094] "Антациклин" представляет собой вид антибиотика, который происходит из гриба Streptococcus peucetius, и примеры которого включают: даунорубицин, доксорубицин, эпирубицин и т.д.
[0095] "Химиотерапия на основе антрациклинов" относится к химиотерапии, которая состоит или включает один или более антрациклинов. Примеры включают 5-ФУ, эпирубицин и циклофосфамид (FEC); 5-ФУ, доксорубицин и циклофосфамид (FAC); доксорубицин и циклофосфамид (АС); эпирубицин и циклофосфамид (EC); и т.п.
[0096] В контексте настоящего изобретения "химиотерапия на основе карбоплатина " относится к химиотерапии, которая состоит или включает один или более карбоплатинов. Примером может служить TCH (доцетаксел/ТАКСОЛ®, карбоплатин и трастузумаб/ГЕРЦЕПТИН®).
[0097] "Ингибитор ароматазы" ингибирует фермент ароматазу, который регулирует выработку эстрогена в надпочечниках. Примеры ингибиторов ароматазы включают: 4(5)-имидазолы, аминоглютетимид, МЕГЕЙС® мегестролацетат, АРОМАЗИН® экземестан, форместан, фадрозол, РИВИЗОР® ворозол, ФЕМАРА® летрозол и АРИМИДЕКС® анастрозол. В одном варианте реализации изобретения ингибитор ароматазы, описанный в настоящем документе, представляет собой летрозол или анастрозол.
[0098] "Антиметаболитная химиотерапия" представляет собой использование агента, который структурно подобен метаболиту, но не может быть использован организмом эффективным образом. Многие антиметаболические химиотерапевтические агенты препятствуют продукции нуклеиновых кислот, РНК и ДНК. Примеры антиметаболическими химиотерапевтических агентов включают гемцитабин (ГЕМЗАР®), 5-фторурацил (5-ФУ), капецитабин (КСЕЛОДА™), 6-меркаптопурин, метотрексат, 6-тиогуанин, пеметрексед, ралтитрекседа, рабинозилцистеин ARA-C цитарабин (ЦИТОЗАР-U®), дакарбазин (DTIC-ДОМ®), азоцитозин, деоксицитозин, пиридмиден, флударабин (ФЛУДАРА®), кладрабин, 2-дезокси-D-глюкоза и т.д.
[0099] Термин "резистентный к химиотерапии" рак означает, что рак у пациента прогрессировал во время приема химиотерапии (т.е. пациент является "резистентностым к химиотерапии"), или рак у пациента прогрессировал в течение 12 месяцев (например, в течение 6 месяцев) после завершения химиотерапевтической схемы.
[00100] В данном контексте термин "платин" используется для обозначения препаратов для химиотерапии на основе платины, включая, но не ограничиваясь ими, цисплатин, карбоплатин и оксалиплатин.
[00101] В данном контексте термин "фторпиримидин" используется для обозначения препаратов для антиметаболитной химиотерапии, включая, но не ограничиваясь ими, капецитабин, флоксуридин и фторурацил (5-ФУ).
[00102] В данном контексте термин "фиксированная" или "постоянная " доза терапевтического агента относится к дозе, которая вводится пациенту-человеку без учета веса (ВЕС) или площади поверхности тела (ППТ) пациента. Следовательно, фиксированная или постоянная доза не приводится в значениях дозы мг/кг или мг/м2, а вместо этого выражается как абсолютное количество терапевтического агента.
[00103] В данном контексте термин "нагрузочная" доза, как правило, включает начальную дозу терапевтического агента, вводимою пациенту, с последующей одной или более поддерживающей ее дозой (дозами). Как правило, вводится разовая нагрузочная доза, но в настоящем документе описаны и многократные нагрузочные дозы. Как правило, количество вводимой нагрузочной дозы (доз) превышает количество вводимой поддерживающей дозы (доз) и/или нагрузочная доза (ы) вводится чаще, чем поддерживающая доза (ы) с целью достижения желаемой стационарной концентрации терапевтического агента раньше, чем это может быть достигнуто введением поддерживающей дозы (доз).
[00104] В данном контексте термин " поддерживающая" доза относится к одной или более доз терапевтического агента, вводимых пациенту в течение всего периода лечения. Как правило, поддерживающие дозы вводят через определенные интервалы лечения, такие как примерно каждую неделю, примерно каждые 2 недели, примерно каждые 3 недели или примерно каждые 4 недели, предпочтительно каждые 3 недели.
[00105] "Инфузия" или "вливание" относится к внутривенному введению в организм в терапевтических целях раствора, содержащего препарат. Как правило, это достигается с помощью внутривенного (в/в) пакета.
[00106] "Внутривенный пакет" или "в/в пакет" представляет собой пакет, который может содержать раствор, который может быть введен пациенту внутривенно. В одном варианте реализации изобретения раствор представляет собой солевой раствор (например, около 0,9% или около 0,45% NaCl). В некоторых случаях в/в мешок изготовлен из полиолефина или поливинилхлорида.
[00107] Под термином "совместное введение" подразумевают внутривенное введение двух (или более) препаратов в процессе одного и того же введения, в отличие от последовательных инфузий двух или более препаратов. Как правило, это будет предусматривать комбинацию двух (или более) препаратов в одном и том же в/в мешке перед совместным введением.
[00108] Препарат, который вводят "одновременно" с одним или более другими препаратами, вводится в течение одного и того же цикла лечения, в одни и те же сутки лечения, что и один или более других препаратов, и в некоторых случаях - в одно и то же время, что и один или более других препаратов. Например, при противораковой терапии, применяемой каждые 3 недели, одновременно вводимые препараты являются теми, которые вводятся в 1 сутки 3-недельного цикла.
[00109] Термин "кардиотоксичность" относится к любому токсическому побочному эффекту, который влияет на сердце, и является результатом введения препарата или комбинации препаратов. Кардиотоксичность может быть оценена на основе любого одного или более из следующих параметров: частота симптоматической систолической дисфункции левого желудочка (СДЛЖ) или застойной сердечной недостаточности (ЗСН) или снижения фракции выброса левого желудочка (ФВЛЖ).
[00110] Фраза "без повышения кардиотоксичности" для комбинации препаратов, включая пертузумаб, относится к частоте кардиотоксичности, которая равна или меньше, чем наблюдаемая у пациентов, получавших препараты, за исключением пертузумаба в комбинации препаратов (например, равной или меньшей, чем возникающая после введения трастузумаба и химиотерапевтического средства, например, доцетаксела).
[00111] "Флакон" представляет собой контейнер, пригодный для наполнения жидким или лиофилизированным препаратом. В одном варианте реализации изобретения флакон представляет собой одноразовый флакон, например, одноразовый флакон 20 см3 с пробкой.
[00112] Термин "листок-вкладыш" используется для обозначения инструкций, обычно помещаемых в коммерческие упаковки терапевтических средств, которые содержат информацию о показаниях, применении, дозах, введении, противопоказаниях и/или предупреждениях, касающихся использования таких терапевтических средств.
[00113] "Нежелательное явление" представляет собой любой неблагоприятный и непреднамеренный признак, симптом или заболевание, ассоциированное по времени с использованием исследуемого (лекарственного) средства или другого вмешательства, предусмотренного протоколом,независимо от назначения; и включает: НЯ (нежелательные явления), ранее не наблюдаемые у пациента, которые появляются и в период отчетности по НЯ, предусмотренный протоколом, включая признаки или симптомы, ассоциированные с раком молочной железы, которые не наблюдались до периода отчетности по НЯ; осложнения, которые возникают в результате вмешательств, предусмотренных протоколом (например, инвазивные процедуры, такие как биопсия); если применимо, НЯ, которые происходят перед назначением исследуемого лечения, ассоциированного с периодом "вымывания" лечения, отсутствия процесса лечения или другого вмешательства, предусмотренного протоколом; существовавшие ранее медицинские состояния (за исключением исследуемых состояний), которые по мнению исследователя, ухудшились по степени тяжести или частоте или изменились по своему характеру в период отчетности по НЯ, предусмотренный протоколом.
[00114] Нежелательное явление классифицируется как "серьезное нежелательное явление" (СНЯ), если отвечает следующим критериям: приводит к смерти (т.е. НЯ непосредственно является причиной или приводит к смерти); угрожает жизни (то есть, НЯ, по мнению исследователя, представляет для пациента непосредственную опасность смерти, но не включает НЯ, которые при возникновении в более тяжелой форме, могли бы привести к смерти); является показанием к стационарной госпитализации или продлевает ее; приводит к стойкой или значительной инвалидности/нетрудоспособности (т.е. НЯ вызывает существенное нарушение возможностей пациента осуществлять нормальные жизненные функции); приводит к врожденной аномалии/пороку развития у новорожденного/ребенка, рожденного от матери, получавшей исследуемое средство; или расценивается исследователем как значимое медицинское явление на основании медицинского представления (например, может поставить под угрозу пациента или может потребовать медицинского/хирургического вмешательства с целью предотвращения одного из исходов, перечисленных выше). Все НЯ, которые не отвечают ни одному из критериев серьезного НЯ, расцениваются как несерьезные НЯ. Термины "тяжелый" и "серьезный" не являются синонимами. Тяжесть (или интенсивность) относится к степени определенного НЯ, например, инфаркт миокарда легкой (1 степень), умеренной (2 степень) или тяжелой (3 степень) степени тяжести (см. раздел 5.2.2). Термин "серьезный" является регуляторным определением (см. предыдущее определение) и основывается на полученном исходе для пациента или явления или критериях действий, обычно ассоциированных с явлениями, которые представляют угрозу для жизни или функциональной активности пациента. Серьезность (не тяжесть) служит в качестве основания для обязательств нормативной отчетности Спонсора перед соответствующими регуляторными органами. Тяжесть и серьезность следует оценивать независимо при регистрации НЯ и СНЯ в электронной индивидуальной регистрационной карте (eCRF, эИРК)
[00115] ПОДРОБНОЕ ОПИСАНИЕ
[00116] Трастузумаб-MCC-DM1 (T-DM1)
[00117] Настоящее изобретение включает терапевтическое лечение трастузумабом-MCC-DM1 (T-DM1), конъюгатом антитела с лекарственным препаратом (CAS рег. № 139504-50-0), который имеет структуру:
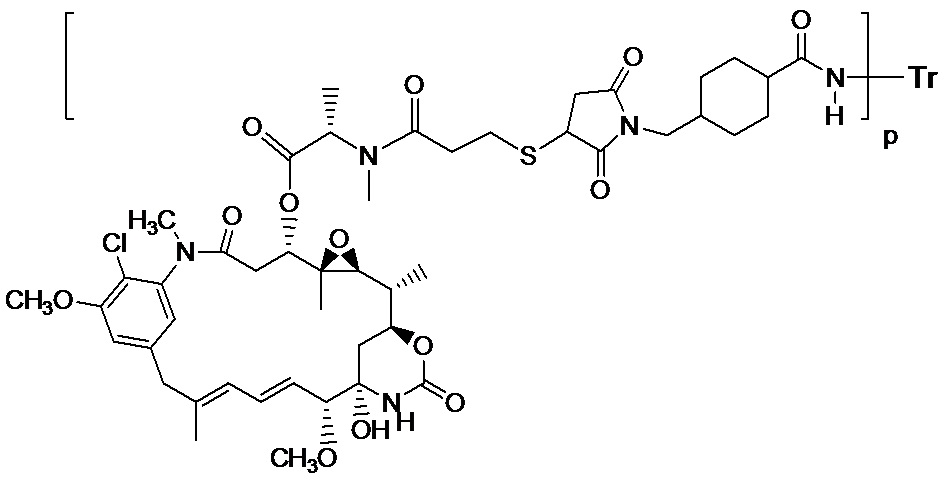
[00118] где Tr представляет собой трастузумаб, связанный через линкерный фрагмент MCC с молекулой препарата майтанзиноида DM1 (US 5208020, US 6441163). Отношение препарата к антителу или содержание лекарственного вещества представлено как р в приведенной выше структуре трастузумаба-MCC-DM1, и в диапазонах в целочисленных значениях от 1 до около 8. Трастузумаб-MCC-DM1 включает все смеси по-разному нагруженных и присоединенных конъюгатов антитела с лекарственным препаратом, в которых 1, 2, 3, 4, 5, 6, 7 и 8 молекул лекарственного препарата ковалентно присоединены к антителу трастузумаба (US 7097840, US 2005/0276812, US 2005/0166993).
[00119] Трастузумаб может продуцироваться суспензионной культурой клеток млекопитающих (клетками яичника китайского хомячка (ЯКХ)). Протоонкоген HER2 (или с-erbB2) кодирует трансмембранный рецепторный белок 185 кДа, который структурно соотносится с рецептором эпидермального фактора роста. Трастузумаб представляет собой антитело, которое имеет антигенсвязывающие остатки мышиного антитела 4D5, или полученное из этого антитела (АТСС CRL 10463, депонированное в Американской коллекции типовых культур, 12301 Parklawn Drive, Роквилл, штат Мэриленд, 20852 в рамках Будапештского договора от 24 мая 1990 года). Типичные гуманизированные антитела 4D5 включают huMAb4D5-1, huMAb4D5-2, huMAb4D5-3, huMAb4D5-4, huMAb4D5-5, huMAb4D5-6, huMAb4D5-7 и huMAb4D5-8 (ГЕРЦЕПТИН®), как и в патенте США 5821337.
[00120] Трастузумаб-MCC-DM1 может быть получен, например, согласно Примеру 1 публикация заявки на патент США № 20110165155.
[00121] Композиции пертузумаба
[00122] Композиция пертузумаба содержит смесь из основных видов антител пертузумаба, как определено выше, и их одного или более вариантов. В предпочтительном варианте реализации настоящего изобретения антитело основного вида пертузумаба представляет собой антитело, содержащее вариабельную легкую и вариабельную тяжелую аминокислотные последовательности в SEQ ID № 7 и 8, но в наиболее предпочтительном варианте содержит аминокислотную последовательность легкой цепи SEQ ID № 11, и аминокислотную последовательность тяжелой цепи SEQ ID № 12 (включая дезамидированные и/или окисленные варианты этих последовательностей). В одном варианте реализации настоящего изобретения композиция содержит смесь антитела основного вида пертузумаба и вариант аминокислотной последовательности, включающий аминоконцевое лидерное удлинение. В предпочтительном варианте реализации настоящего изобретения аминоконцевое лидерное удлинение находится на легкой цепи варианта антитела (например, на одной или двух легких цепях варианта антитела). Основной вид антитела HER2 или варианта антитела может представлять собой полноразмерное антитело или фрагмент антитела (например, Fab из F(аb')2-фрагментов), но в предпочтительном варианте оба представляют собой полноразмерные антитела. Вариант антитела согласно изобретению может включать аминоконцевое лидерное удлинение на его любой одной или более тяжелых или легких цепях. В предпочтительном варианте реализации настоящего изобретения аминоконцевое лидерное удлинение находится на одной или двух легких цепях антитела. Аминоконцевое лидерное удлинение предпочтительно содержит или состоит из VHS--. Наличие аминоконцевого лидерного удлинения в композиции может быть обнаружено с помощью различных аналитических методик, включая, но не ограничиваясь ими, анализ N-концевой последовательности, анализ определения гетерогенности заряда (например, катионообменная хроматография или капиллярный зонный электрофорез), масс-спектрометрию и т.д. Количество варианта антитела в композиции обычно колеблется от количества, составляющего предел обнаружения любого анализа (предпочтительно анализа N-концевой последовательности), используемого для обнаружения варианта, до количества, меньшего, чем количество основного вида антитела. Как правило, около 20% или менее (например, от около 1% до около 15%, например от 5% до около 15%) из молекул антител в композиции содержит аминоконцевое лидерное удлинение. Такие процентные количества предпочтительно определяют с помощью количественного анализа N-концевой последовательности или анализа катионного обмена (предпочтительно с использованием слабой катионообменной колонки с высокой разрешающей способностью, например, катионообменной колонки PROPAC WCX-10™). Помимо варианта аминоконцевого лидерного удлинения, рассматриваются дополнительные изменения аминокислотной последовательности антитела основного вида и/или варианта, включая, но не ограничиваясь этим, антитело, содержащее С-концевой остаток лизина на одной или обеих его тяжелых цепях, дезамидированный вариант антитела и т.д.
[00123] Кроме того, антитело основного вида или вариант может дополнительно содержать гликозилированные изменения, не ограничивающие примеры которых включают антитело, содержащее олигосахаридную структуру G1 или G2, присоединенную к его Fc-области, антитело, содержащее углеводный фрагмент, присоединенный к его легкой цепи (например, один или два углеводных фрагмента, таких как глюкоза или галактоза, присоединенных к одной или двум легким цепям антитела, например, присоединенных к одному или более остаткам лизина), антитело, содержащее одну или две негликозилированные тяжелые цепи, или антитело, содержащее сиалидированный олигосахарид, присоединенный к одной или двум его тяжелым цепям и т.д.
[00124] Композиция может быть извлечена из генно-инженерной клеточной линии, например клеточной линии яичника китайского хомячка (ЯКХ), экспрессирующей антитело к HER2, или может быть получена с помощью пептидного синтеза.
[00125] Для получения более подробной информации относительно примерных композиций пертузумаба см. патент США № 7560111 и 7879325, а также US 2009/0202546A1.
[00126] Лекарственные формы трастузумаба-MCC-DM1 (T-DM1) и пертузумаба
[00127] Трастузумаб-MCC-DM1 и пертузумаб могут изготавливаться в соответствии со стандартной фармацевтической практикой для применения в терапевтической комбинации. Фармацевтические композиции включают трастузумаб-MCC-DM1 и пертузумаб, соответственно, совместно с одним или более фармацевтически приемлемым носителем, веществом, способствующим скольжению, разбавителем или вспомогательным веществом.
[00128] Пригодные носители, разбавители и вспомогательные вещества хорошо известны специалистам в данной области техники и включают материалы, такие как углеводы, воски, растворимые в воде и/или набухающие в воде полимеры, гидрофильные или гидрофобные материалы, желатин, масла, растворители, воду и тому подобное. Использование определенного носителя, разбавителя или вспомогательного вещества будет зависеть от средств и цели, в связи с которыми будет применяться соединение по настоящему изобретению. Растворители, как правило, выбираются на основе растворителей, рассматриваемых специалистами в данной области техники как безопасные (GRAS) для введения млекопитающему. В общем, безопасные растворители представляют собой нетоксичные водные растворители, такие как вода и другие нетоксичные растворители, которые являются растворимыми или смешивающимися в воде. Пригодные водные растворители включают воду, этанол, пропиленгликоль, полиэтиленгликоли (например, ПЭГ 400, ПЭГ 300) и т.д. и их смеси. Лекарственные формы могут также включать один или более буферов, стабилизирующих агентов, поверхностно-активных веществ, смачивающих агентов, смазывающих агентов, эмульгаторов, суспендирующих агентов, консервантов, антиоксидантов, кроющих агентов, веществ, способствующих скольжению, технологических добавок, красителей, подсластителей, ароматизирующих добавок, вкусовых агентов и других известных добавок с целью обеспечения лучшего представления препарата (т.е., соединения по настоящему изобретению или его фармацевтической композиции) или содействия в изготовлении фармацевтического продукта (т.е., лекарственного средства).
[00129] Лекарственные формы могут быть приготовлены с использованием традиционных процедур растворения и смешивания. Например, нерасфасованное лекарственное вещество (то есть, соединение по настоящему изобретению или стабилизированная форма соединения (например, комплекс с производным циклодекстрина или другим известным комплексообразующим агентом) растворяют в пригодном растворителе в присутствии одного или более вспомогательных веществ, описанные выше. Соединение по настоящему изобретению, как правило, производится в виде фармацевтических лекарственных форм с целью обеспечения легко контролируемой дозировки препарата и соблюдения пациентом предписанной схемы.
[00130] Фармацевтическая композиция (или лекарственная форма) для применения может быть упакована по-разному, в зависимости от способа, используемого для введения лекарственного препарата. Как правило, изделие для распространения включает контейнер, в котором сохраняется фармацевтический препарат в соответствующей форме. Пригодные контейнеры хорошо известны специалистам в данной области техники и включают такие материалы, как бутылки (пластик и стекло), саше, ампулы, пластиковые пакеты, металлические цилиндры и тому подобное. Контейнер может также включать сборку с контролем первого вскрытия для предотвращения случайного доступа к содержимому пакета. Кроме того, на контейнере содержится этикетка, которая описывает содержимое контейнера. Этикетка может также включать соответствующие предупреждения.
[00131] Фармацевтические композиции могут быть приготовлены для по различных путей и видов введения с фармацевтически приемлемыми разбавителями, носителями, вспомогательными веществами или стабилизаторами (Remington's Pharmaceutical Sciences (1995) 18th edition, Mack Publ. Co., Истон, штат Пенсильвания), в форме лиофилизированной лекарственной формы, размолотого порошка или водного раствора. Лекарственная форма может быть получена путем смешивания при температуре окружающей среды при соответствующем рН и желаемой степени чистоты, с физиологически приемлемыми носителями, т.е. носителями, которые являются нетоксичными для реципиентов в используемых дозах и концентрациях. pH лекарственной формы зависит в основном от конкретного применения и концентрации соединения, но может находиться в диапазоне от около 3 до около 8.
[00132] Фармацевтическая лекарственная форма предпочтительно является стерильной. В частности, лекарственные формы, которые будут использоваться для введения in vivo, должны быть стерильными. Такая стерилизация легко осуществляется путем фильтрации через стерильные фильтрационные мембраны.
[00133] Фармацевтическая лекарственная форма обычно может храниться в виде твердой композиции, лиофилизированной лекарственной формы или в виде водного раствора.
[00134] Фармацевтические лекарственные формы по настоящему изобретению будут дозироваться и вводиться соответствующим образом, т.е. количества, концентрации, схемы, курс, растворители и пути введения будут соответствовать принципам надлежащей медицинской практики. Факторы, подлежащие рассмотрению в этом контексте, включают конкретное нарушение, подлежащее лечению, клиническое состояние отдельного пациента, причину нарушения, место доставки агента, способ введения, схему введения и другие факторы, известные практикующим врачам.
[00135] Приемлемые разбавители, носители, вспомогательные вещества и стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутил, этанол или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); полипептиды с низкой молекулярной массой (менее, чем около 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; сольобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как ТВИН™, в том числе ТВИН 80, ПЛЮРОНИК™ или полиэтиленгликоль (ПЭГ), в том числе ПЭГ400. Активные фармацевтические ингредиенты могут быть также заключены в микрокапсулы, полученные, например, способами коацервации или путем межфазной полимеризации, например, в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы, соответственно, в коллоидные системы доставки лекарственных препаратов (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики описаны в Remington's Pharmaceutical Sciences 18th edition, (1995) Mack Publ. Co., Easton, PA. Другие примеры лекарственных форм можно найти в Liberman, H. A. и Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, Vol 3, 2nd Ed., New York, NY.
[00136] Фармацевтические лекарственные формы включают такие формы, которые пригодные для введения с помощью путей, подробно описанных в настоящем документе. Составы могут быть представлены в единичной лекарственной форме и могут быть приготовлены любым из способов, хорошо известных в области фармации. Методики и лекарственные формы обычно можно найти в Remington's Pharmaceutical Sciences 18th Ed. (1995) Mack Publishing Co., Easton, PA. Такие способы включают в себя этап приведения в контакт активного ингредиента с носителем, который содержит один или более вспомогательных ингредиентов. Как правило, лекарственные формы получают путем однородного и тщательного смешивания активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями или и тем и другим, а затем, при необходимости, формируют продукт.
[00137] Фармацевтические композиции могут быть в форме стерильного инъекционного препарата, такого как стерильная водная или масляная суспензия, вводимая путем инъекции. Эта суспензия может быть приготовлена согласно известному уровню техники с использованием пригодных диспергирующих или смачивающих агентов и суспендирующих агентов, которые упоминались выше. Стерильный препарат для инъекции может представлять собой раствор или суспензию в нетоксичном приемлемом для парентерального применения разбавителе или растворителе, таком как раствор в 1,3-бутандиоле, или может быть приготовлен из лиофилизированного порошка. В числе приемлемых носителей и растворителей, которые могут быть использованы: вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно могут использоваться в качестве растворителя или суспендирующей среды. С этой целью может быть использовано любое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, так же могут быть использованы при приготовлении препаратов для инъекций.
[00138] Количество активного ингредиента, которое можно комбинировать с веществами-носителями для получения разовой лекарственной формы, может изменяться в зависимости от получающего лечение индивида и конкретного способа введения. Например, лекарственная форма с медленным высвобождением, предназначенная для перорального введения человеку, может содержать от около 1 до 1000 мг активного вещества, смешанного с соответствующим и удобным количеством материала-носителя, которое может изменяться от около 5 до около 95% от общей композиции (масс.:масс.). Фармацевтическая композиция может быть приготовлена для обеспечения легко измеримых количеств для введения. Например, водный раствор, предназначенный для внутривенной инфузии, может содержать от около 3 до 500 мкг активного ингредиента на миллилитр раствора для того, чтобы осуществить инфузию подходящего объема со скоростью около 30 мл/ч.
[00139] Лекарственные формы, пригодные для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатические агенты и растворенные вещества, которые делают препарат изотоническим с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители.
[00140] Лекарственные формы могут быть упакованы в контейнеры, рассчитанные на одну или множество доз, например в запаянные ампулы и флаконы, и могут храниться в высушенном сублимацией (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Экстемпоральные растворы и суспензии для инъекций готовят из стерильных порошков, гранул и таблеток ранее описанного вида. Предпочтительными являются такие единичные лекарственные формы, которые содержат суточную дозу или единичную суточную субдозу активного ингредиента, как описано выше, или соответствующую ее часть.
[00141] Как правило, первоначальное фармацевтически эффективное количество трастузумаба-MCC-DM1, вводимое в дозе, будет находиться в диапазоне от около 0,3 до 15 мг/кг/сут массы тела пациента.
[00142] Коммерческая лекарственная форма T-DM1 (КАДСИЛА®, адо-трастузумаб эмтансин) представляет собой стерильный лиофилизированный порошок, от белого до почти белого цвета, не содержащий консерванта, в одноразовых флаконах. Каждый флакон содержит 100 мг или 160 мг адо-трастузумаба эмтансина. После разведения каждый одноразовый флакон содержит адо-трастузумаба эмтансин (20 мг/мл), полисорбат 20 [0,02% (масса/объем)], сукцинат натрия (10 мМ) и сахарозу [6% (масса/объем)] с рН 5,0 и плотностью 1,026 г/мл. Полученный раствор, содержащий 20 мг/мл адо-трастузумаба эмтансина вводят путем внутривенной инфузии после разведения.
[00143] Коммерческая лекарственная форма пертузумаба (ПЕРЬЕТА®) содержит пертузумаба 420 мг/14 мл (30 мг/мл) в форме раствора без консервантов для внутривенной инфузии.
[00144] Введение трастузумаба-DM1 (T-DM1) и пертузумаба
[00145] Фармацевтические композиции трастузумаба-MCC-DM1 (T-DM1) и пертузумаба могут быть введены любым путем, соответствующем патологическому состоянию, подлежащему лечению. Подходящие способы включают пероральный, парентеральный (включая подкожный, внутримышечный, внутривенный, внутриартериальный, ингаляционный, внутрикожный, интратекальный, эпидуральный пути и инфузионные методики), трансдермальный, ректальный, назальный, местный (включая трансбуккальный и подъязычный), вагинальный, внутрибрюшинный, внутрилегочной и интраназальный. Местное введение может также включать использование трансдермального введения, с помощью таких средств, как трансдермальные пластыри или устройства для ионофореза. С целью местного иммуносупрессивного лечения соединения могут вводиться путем внутриочагового введения, включая перфузирование или приведение в контакт трансплантата с ингибитором перед трансплантацией иным образом. Следует принять во внимание, что предпочтительный путь может изменяться в зависимости, например, от состояния реципиента. В случаях, если соединение вводят перорально, оно может быть приготовлено в виде пилюли, капсулы, таблетки и т.д. с фармацевтически приемлемым носителем, агентом, улучшающим скольжение, или вспомогательным веществом. В случаях, если соединение вводят парентерально, оно может быть приготовлено с фармацевтически приемлемым парентеральным носителем или разбавителем, а также в единичной инъекционной лекарственной форме, как подробно описано ниже.
[00146] Готовые изделия
[00147] В настоящем изобретении предлагаются готовые изделия или "наборы", содержащие трастузумаб-MCC-DM1 и/или пертузумаб, которые пригодны для использования в способах лечения. В одном варианте реализации изобретения набор содержит контейнер, содержащий трастузумаб-MCC-DM1. В другом варианте реализации изобретения набор содержит пертузумаб. В третьем варианте реализации изобретения набор содержит трастузумаб-MCC-DM1 и пертузумаб. Набор может дополнительно содержать этикетку или листок-вкладыш на контейнере или связанный с контейнером. Термин "листок-вкладыш" используется для обозначения инструкций, обычно помещаемых в коммерческие упаковки терапевтических средств, которые содержат информацию о показаниях, применении, дозах, введении, противопоказаниях и/или предупреждениях, касающихся использования таких терапевтических средств. Пригодные контейнеры включают, например, бутылки, флаконы, шприцы, блистерную упаковку и т.д. Контейнер может быть выполнен из различных материалов, таких как стекло или пластик. Контейнер может содержать трастузумаб-MCC-DM1 и/или пертузумаб или их лекарственную форму, которая эффективна для применения в способе лечения, описанном в настоящем документе, и может иметь стерильное входное отверстие (например, контейнер может представлять собой пакет для внутривенного раствора или флакон, имеющий пробку для прокалывания иглой для подкожной инъекции). Этикетка или листок-вкладыш указывает на то, что композиция используется в способе лечения, как описано и заявлено в настоящем документе. Готовое изделие может также содержать дополнительный контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (БВДИ), забуференный фосфатом солевой раствор, раствор Рингера и раствор декстрозы. Он может дополнительно включать другие вещества, желательные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
[00148] Набор может дополнительно включать инструкции по введению трастузумаба-MCC-DM1 и/или пертузумаба. Например, если набор содержит первую композицию, содержащую трастузумаб-MCC-DM1 и вторую фармацевтическую лекарственную форму, набор может дополнительно включать указания для одновременного, последовательного или раздельного введения первой и второй фармацевтических композиций пациенту в случае необходимости.
[00149] В другом варианте реализации изобретения наборы являются пригодными для доставки твердых пероральных форм трастузумаба-MCC-DM1 и/или пертузумаба, таких как таблетки или капсулы. Такой набор предпочтительно включает некоторое количество единичных доз. Такие наборы могут включать карту с дозировками, ориентированными в порядке их предполагаемого применения. Примером такого набора является "блистерная упаковка". Блистерные упаковки хорошо известны в упаковочной промышленности и широко используются для упаковки фармацевтических единичных лекарственных форм. При необходимости, может быть предоставлена памятка, например, в виде чисел, букв или других маркировок или с календарной вставкой, обозначающей дни в схеме лечения, в которые могут вводиться дозы.
[00150] Согласно одному из вариантов реализации изобретения набор может включать (а) первый контейнер с трастузумабом-MCC-DM1, содержащимся в нем; и в некоторых случаях (b) второй контейнер с пертузумабом, содержащимся в нем. В альтернативном или дополнительном варианте набор может дополнительно содержать третий контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (БВДИ), забуференный фосфатом солевой раствор, раствор Рингера и раствор декстрозы. Он может дополнительно включать другие вещества, желательные с коммерческой и потребительской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
[00151] Если набор содержит композицию трастузумаба-MCC-DM1 и пертузумаба, он может содержать контейнер для размещения в нем отдельных композиций, такой как разделенный флакон или разделенный пакет из фольги, однако, отдельные композиции также могут быть включены в один неразделенный контейнер. Как правило, набор включает инструкции по введению отдельных компонентов. Форма набора особенно выгодна, когда отдельные компоненты предпочтительно вводят в различных лекарственных формах (например, пероральной и парентеральной), с различными интервалами дозирования или когда желательно проведение титрования отдельных компонентов комбинации лечащим врачем.
[00152] Один из вариантов реализации готового изделия по настоящему изобретению включает внутривенный (в/в) пакет, содержащий стабильную смесь пертузумаба и T-DM1, пригодную для введения пациенту с раком. В некоторых случаях смесь находится в солевом растворе; например, содержащим около 0,9% NaCl или 0,45% NaCl. Типичный в/в пакет представляет собой полиолефиновый или поливинилхлоридный инфузионный пакет, например, в/в пакет 250 мл. Согласно одному из вариантов реализации изобретения смесь содержит около 420 мг или около 840 мг пертузумаба и от около 100 мг до около 160 мг T-DM1.
[00153] В некоторых случаях смесь в в/в пакете сохраняет стабильность до 24 часов при 5°С или 30°С. Стабильность смеси может быть оценена с помощью одного или более анализов, выбранных из группы, состоящей из: анализа цвета, внешнего вида и прозрачности (ЦВЧ), анализа концентрации и мутности, анализа частиц, эксклюзионной хроматографии (ЭХ), ионообменной хроматографии (ИОХ), капиллярного зонного электрофореза (КЗЭ), изображения капиллярного изоэлектрического фокусирования (иКИФ) и анализа активности.
[00154] ПРИМЕРЫ
[00155] Для того, чтобы проиллюстрировать изобретение, приведены следующие примеры. Тем не менее, следует понимать, что эти примеры не ограничивают изобретение и предназначены только для предложения способа практического осуществления изобретения.
Таблица 1
СПИСОК СОКРАЩЕНИЙ
|
[00156] Пример 1.
[00157] Фаза III клинического исследования
[00158] Это исследование (BO28408/TRIO021) представляет собой рандомизированное, глобальное, многоцентровое, открытое, двухгрупповое исследование фазы III с участием нелеченных пациентов с операбельными, местно-распространенными или отечно-инфильтративными, централизованно оцененными HER2-положительными, первичными раковыми опухолями РРМЖ размером>2 см.
[00159] Пациенты
[00160] Популяция пациентов включает пациентов с нелеченным, операбельным, местно-распространенным или отечно-инфильтративным, централизованно подтвержденным HER2-положительным РРМЖ. Таким образом, целевая популяция для данного исследования включает пациентов с недавно диагностированным первичным инвазивным раком молочной железы, который является HER2-положительным (что определяется в центральной патологоанатомической лаборатории) и который будет пролечен с применением адъювантной системной химиотерапии после радикального оперативного вмешательства. Статус HER2 проверяется централизованно до рандомизации. Размер первичной опухоли должен быть >2 см, подтвержденный по по меньшей мере одним радиографическим или клиническим измерением. Перечень всех критерии пригодности приведен ниже.
[00161] Исследователь или соисследователь должен гарантировать, что в исследовании предполагается участие только пациентов, которые отвечают критериям включения и исключения. При принятии решения о том, является ли пациент подходящим кандидатом для исследования, исследователю или соисследователю следует также учитывать все другие значимые факторы (медицинские и немедицинские), а также риски и преимущества исследуемой терапии.
[00162] Критерии включения:
[00163] Пациенты должны отвечать следующим критериям для включения в исследование:
Подписанное письменное информированное согласие одобрено Экспертным советом организации (IRB, ЭСО) исследовательского центра/ комитетом по этике (EC, ЭК)
Гистологически подтвержденная инвазивная карцинома молочной железы с первичным размером опухоли >2 см, подтвержденным по по меньшей мере одним радиографическим или клиническим измерением.
HER2-положительный рак молочной железы. HER2-положительный статус определяется на основе анализа биопсийного материала молочной железы, полученного до лечения, и оценивается для данного конкретного исследования в 3 балла иммуногистохимически (ИГХ) + и/или оценивается положительным по результатам ISH (гибридизации in situ), что перспективно определяется в центральной лаборатории до набора пациентов в исследование. ISH-положительность определяется как отношение≥2 количества копий гена HER2 к количеству сигналов для копий хромосомы 17. Центральная лаборатория будет выполнять как анализ ИГХ, так и анализ ISH; тем не менее, для возможности участия в исследовании требуется только один положительный результат. Залитые парафином блоки опухолевой ткани или частичные блоки должны быть получены для централизованного подтверждения пригодности для участия в исследовании относительно положительности HER2. Только в тех исследовательских центрах, где действуют узаконенные нормативные положения центра, которые делают передачу блоков невозможной, и только после получения одобрения спонсора могут осуществляться передачи различных материалов, как это описано в руководстве по отбору образцов для конкретного исследования.
Пациенты с мультифокальными опухолями (более чем одной опухолью, ограниченной тем же квадрантом, что и первичная опухоль) являются пригодными кандидатами для участия в исследовании при условии, что все отобранные пораженные участки подтверждены как HER2-положительные в центральной лаборатории.
Стадии при первичном обследовании: cT2-cT4, cN0-cN3, cM0
Известный статус рецепторов гормонов первичной опухоли
Согласие пациента на мастэктомию или органосохраняющую операцию при раке молочной железы после неоадъювантной терапии
Готовность и способность выполнять запланированные визиты, планы лечения, лабораторные анализы и другие процедуры исследования, включая осуществление оценки PRO (ИОП)
Возраст≥18 лет
Функциональный статус по критериям ECOG (ВООГ) 0 или 1
Адекватное функционирование органов во время скрининга (в течение 7 суток до первой дозы), определяемое по следующим критериям:
Абсолютное количество нейтрофилов (ANC, АКН) ≥1500 клеток /мкл
Количество тромбоцитов≥100000 клеток /мкл
Гемоглобин≥9 г/дл; с целью достижения этого уровня пациентам можно переливать эритроцитарную массу
Креатинин сыворотки≤1,5× верхней границы нормы (ВГН)
Международное нормализованное отношение (МНО) и (активированное) частичное тромбопластиновое время (АЧТВ) ≤1,5×ВГН
Аспартатаминотрансфераза (AСТ) и аланинаминотрансфераза (АЛТ) ≤ВГН
Общий билирубин сыворотки≤ВГН, за исключением пациентов с синдромом Жильбера, в которых прямой билирубин должен быть в пределах нормального диапазона
Сывороточная щелочная фосфатаза≤ВГН
Исходный уровень ФВЛЖ≥55%, измеренный с помощью эхокардиографии (эхоКГ) или многовходной радионуклидной ангиографии (MUGA)
Для женщин, которые не находятся в постменопаузе (≥12 месяцев аменореи, не индуцированной терапией) или хирургически стерильные (отсутствие яичников и/или матки): согласие придерживаться воздержания или использовать одиночные или комбинированные негормональные противозачаточные средства, результатом применения которых является частота неэффективности <1% в год в течение всего периода лечения и в течение по меньшей мере 7 месяцев после последней дозы исследуемого препарата
Воздержание является единственно приемлемым, если оно находится в соответствии с предпочтительным и обычным образом жизни пациента. Периодическое воздержание (например, с помощью календарного, овуляционного, симптотермального или постовуляционного способа) и прерванный половой акт не являются приемлемыми методами контрацепции.
Примеры негормональных методов контрацепции с частотой неэффективности <1% в год включают лигирование маточных труб, мужскую стерилизацию и некоторые внутриматочные устройства. В альтернативном варианте, с целью достижения частоты неэффективности <1% в год могут комбинироваться два метода (например, два барьерных метода, таких как презерватив и шейный колпачок). Барьерные методы всегда должны дополняться использованием спермицида.
Отрицательный сывороточный тест на беременность для женщин в пременопаузе, и для женщин, у которых менопауза началась за менее чем <12 месяцев до первой лечебной дозы
Задокументированные серологические анализы на вирус гепатита В (ВГВ), включая поверхностный антиген ВГВ (HBsAg) и/или суммарные антитела к сердцевинному антигену ВГВ (анти-НВс), и вирус гепатита С (ВГС), включая анализ на антитела к ВГС. Самое последнее серологическое исследование должно быть произведено в течение 3 месяцев до начала неоадъювантной терапии. Если такое исследование не было сделано, то оно должно быть выполнено во время скрининга. Пациенты, которые имеют положительный серологический результат на ВГВ и ВГС при отсутствии активной формы заболевания, должны соответствовать критериям включения по показателям АЛТ, АСТ, общего билирубина, МНО, АЧТВ и щелочной фосфатазы, оцененных по меньшей мере два раза подряд с интервалом по меньшей мере 1 неделю, в пределах 28-дневного периода скрининга. Вторая из этих оценок должна быть выполнена в течение 3 суток до первого введения исследуемого препарата.
[00164] Критерии исключения
[00165] Пациенты, которые соответствуют любому из следующих критериев, исключаются из числа кандидатов для участия в исследовании:
Стадия IV (метастатическая) рака молочной железы
Пациенты, которые получили предшествующую противораковую терапию по поводу рака молочной железы, за исключением пациентов с анамнезом LCIS (ЛКIS) молочной железы, получивших хирургическое лечение, или пациентов с пролеченной DCIS (ПКIS) исключительно путем мастэктомии. В случае наличия в анамнезе LCIS (ЛКIS)/DCIS (ПКIS), от оперативного вмешательства до установления диагноза существующего рака молочной железы должно пройти >5 лет
Пациенты с мультицентрическим раком молочной железы (множественные опухоли с вовлечением более 1 квадранта)
Пациенты с двусторонним раком молочной железы
Пациенты, которым проводилась иницизионная и/или эксцизионная биопсия первичной опухоли и/или подмышечных лимфатических узлов
Рассечение подмышечного лимфатического узла до начала неоадъювантной терапии. Пациентам с "клинически отрицательной" подмышечной областью (при объективном осмотре и рентгенографии) можно производить процедуру биопсии сигнального лимфатического узла до NAST (НСТ), если это соответствует принципам локальной медицинской практики.
Положительный результат биопсии сигнального лимфатического узла до неоадъювантной терапии
Наличие в анамнезе одновременно или ранее пролеченных злокачественных опухолей других органов (не молочной железы), за исключением надлежащим образом пролеченных 1) немеланомного рака кожи и/или 2) карциномы in situ, включая карциному шейки матки, толстой кишки и кожи. Пациент с инвазивным раком другого органа (не молочной железы) в анамнезе может принимать участия в исследовании при условии, что он/она не имеет признаков заболевания в течение более 5 лет.
Лечение с применением любого исследуемого препарата в течение 28 суток до рандомизации
Наличие периферической невропатии (NCI CTCAE) v4.03 в стадии≥2
Кардиопульмональная дисфункции, подтвержденная с помощью любого из следующих параметров:
Симптоматическая ЗСН в анамнезе NCI CTCAE (версия 4.0) в стадии≥3 или класс≥II по критериям NYHA
Стенокардия, требующая приема антиангинальных препаратов, серьезные нарушения сердечного ритма, неконтролируемые адекватным лечением, тяжелые нарушения проводимости или клинически значимая патология клапанов сердца
Неконтролируемые аритмии с высоким риском (т.е. предсердная тахикардия с частотой сердечных сокращений > 100 уд/мин в состоянии покоя, выраженная желудочковая аритмия [желудочковая тахикардия], или атриовентрикулярная [AV] блокада высокой степени [AV-блокада второй степени типа 2 [Mobitz 2] или AV-блокада третьей степени])
Клинически значимые симптомы (стадия≥2), связанные с дисфункцией левого желудочка, сердечной аритмией или ишемической болезнью сердца
Инфаркт миокарда в течение 12 месяцев до рандомизации
Неконтролируемая артериальная гипертензия (систолическое артериальное давление >180 мм ртутного столба и/или диастолическое кровяное давление >100 ртутного столба)
Подтверждение трансмурального инфаркта на ЭКГ
Потребность в кислородной терапии
Наличие тяжелого, неконтролируемого системного заболевания, что может помешать проведению запланированного лечения (например, клинически значимая патология сердечно-сосудистой системы, легких или обмен веществ: нарушение заживления ран)
Обширное оперативное вмешательство, не связанное с раком молочной железы, или существенная травма в течение 28 суток до рандомизации или запланированное необходимое обширное оперативное вмешательство во время лечения в рамках исследования
Наличие активного заболевания печени, например, вызванного ВГВ, ВГС, аутоиммунные заболевания печени или склерозирующий холангит
Сопутствующие, тяжелые, неконтролируемые инфекции или наличие ВИЧ-инфекции
Период беременности и/или кормления грудью
Наличие гиперчувствительности к исследуемым препаратам, вспомогательным веществам и/или мышиным белкам,
[00166] Дизайн исследования
[00167] Пациенты, которые дали письменное согласие и пригодны для участия в исследовании, были рандомизированы на шесть циклов одной из следующих схем неоадъювантной терапии в соотношении 1:1:
[00168] Группа А: Доцетаксел (75 мг/м2 каждые 3 недели [1 раз в 3 недели]) и карбоплатин (площадь под кривой концентрация- время [AUC] 6) и трастузумаб (нагрузочная доза - 8 мг/кг, поддерживающая доза - 6 мг/кг 1 раз в 3 недели) и пертузумаб (нагрузочная доза - 840 мг, затем доза 420 мг 1 раз в 3 недели) (доцетаксел-карбоплатин-трастузумаб [TCH] + пертузумаб)
[00169] Группа B: Трастузумаб эмтансин (3,6 мг/кг 1 раз в 3 недели) и пертузумаб (нагрузочная доза - 840 мг, затем доза 420 мг 1 раз в 3 недели) (трастузумаб эмтансин + пертузумаб)
[00170] Схема дизайна исследования приведена на Фигуре 6, где T = доцетаксел, C = карбоплатин, H = трастузумаб.
[00171] В исследовании примут участие в общей сложности 432 пациентов, по 216 пациентов на группу лечения, в около 110 исследовательских центрах по всему миру.
[00172] Пациенты получают шесть циклов неоадъювантной терапии согласно их рандомизационной группе. Оперативное вмешательство не должно проводиться раньше по меньшей мере 14-го дня после последней дозы неоадъювантной терапии. Количество тромбоцитов, которое необходимо проверять перед оперативным вмешательством, должно составлять≥75000 клеток /мкл. Оперативное вмешательство должно быть выполнена не позднее, чем через 9 недель после последней дозы неоадъювантной терапии. Все пациенты, которые рандомизированы в группу В (трастузумаб эмтансин + пертузумаб), независимо от результата пПО в неоадъювантной терапии, будут дополнительно иметь возможность получать стандартную цитотоксическую терапию по адъювантной схеме; решение относительно назначения стандартной цитотоксической терапии и выбора схемы лечения принимает лечащий врач. Рекомендуется четыре цикла терапии на основе антрациклина (FAC, FEC или AC). Адъювантное лечение начинается в течение 9 недель после последнего хирургического вмешательства. HER2-направленная терапия предназначена для назначения на 1 год согласно рандомизации с целью соответствия опубликованным данным по адъювантному лечению и всемирным стандартам. С учетом применения терапии в неоадъювантной и адъювантной схемах лечения и возможных отсрочек в терапии, длительность HER2-направленной терапии (трастузумаб + пертузумаб [группа A] и трастузумаб эмтансин + пертузумаб [групп B]) определяется общим количеством назначенных циклов. Один год HER2-направленной терапии без каких-либо отсрочек охватывал бы 18 циклов; поэтому планы исследования предусматривают введение 18 циклов HER2-направленной терапии (включая неоадъювантную и адъювантную терапию).
[00173] Неоадъювантная фаза
[00174] Неоадъювантная терапия назначается в объеме шести циклов, вводимых 1 раз в 3 недели. В случае прогрессирования заболевания, развития неприемлемой токсичности, отзыва согласия или прекращения исследования спонсором, в зависимости от того, что произойдет раньше, неоадъювантная терапия будет прекращена до завершения этих шести циклов. Пациенты, у которых неоадъювантное лечение исследуемыми препаратами прекращено до завершения этих шести циклов, и которые не получили непротокольную неоадъювантную терапию, будут иметь возможность получать адъювантную терапию исследуемыми препаратами согласно рандомизации.
[00175] Любой пациент, получающий непротокольную терапию до оперативного вмешательства, прекратит лечение исследуемыми препаратами и будет получать терапию в соответствии с локальной медицинской практикой.
[00176] Пациенты из группы В, которые прекращают терапию трастузумабом эмтансином, должны также прекратить терапию пертузумабом, и рассматриваются как прекратившие лечение исследуемыми препаратами. Такие пациенты будет получать терапию в соответствии с локальной медицинской практикой.
[00177] Пациенты, которые прекращают терапию пертузумабом из-за токсичности, могут продолжать лечение исследуемыми препаратами (Группа А: [только TCH]; Группа B [только трастузумаб эмтансин]).
[00178] Все пациенты, которые прекращают запланированное лечение исследуемыми препаратами, будут продолжать принимать участие в исследовании для последующего анализа-вторичных и поисковых критериев оценки эффективности при условии, что их согласие на участие в исследовании не будет отозвано.
[00179] Оперативное вмешательство
[00180] Оперативное вмешательство проводится не позднее, чем через 6 недель после последней инфузии неоадъювантной терапии.
[00181] До начала неоадъювантной терапии пациенты должны осматриваться хирургом, имеющим опыт операций по поводу рака молочной железы. В исследование будут оцениваться показатели сохранения молочной железы. До начала неоадъювантной терапии хирург должен оценить состояние пациента для возможности проведения оперативного вмешательства, которое может быть проведено на основании осмотра на исходном визите (т.е. в отсутствие неоадъювантной терапии необходимо определить, требуется ли проведение мастэктомии или широкого локального иссечения, такого как сегментарная/частичная мастэктомия). Эта исходная оценка должны быть документально оформлена в электронной индивидуальной регистрационной карте (eCRF, эИРК). Место опухоли должно быть отмечено рентгеноконтрастной меткой под действием радиографического направителя (например, ультразвука) до начала неоадъювантной терапии.
[00182] После завершения неоадъювантной терапии, до оперативного вмешательства, необходимо оценить состояние пациентов для возможности проведения оперативного вмешательства и определения того, кандидатами на проведение какого объема оперативного вмешательства будут эти пациенты на основании их ответа на терапию (мастэктомия или широкое локальное иссечение, такое как сегментарная/частичная мастэктомия), причем эти возможные варианты необходимо задокументировать в eCRF (эИРК). Выбранное оперативное вмешательство также должно быть введено в eCRF (эИРК). Следует признать, что пациенты и их хирурги могут выбрать в дальнейшем не ту операцию, проведение которой было ранее запланировано, из-за целого ряда факторов (предпочтения пациента, снижение риска и т.д.). Как предполагаемое оперативное вмешательство, основанное на ответе на терапию, так и выбранное оперативное вмешательство необходимо записать в eCRF (эИРК). Оперативное вмешательство не должно проводиться раньше по меньшей мере 14-го дня после последней дозы неоадъювантной терапии. Количество тромбоцитов, которое необходимо проверять перед оперативным вмешательством, должно составлять≥75000 клеток /мкл.
[00183] Первичный критерий эффективности (пПО-ypT0/is, ypN0) будет установлен с помощью местного мероприятия по контролю после завершения неоадъювантной терапии и оперативного вмешательства.
[00184] Пациентам, у которых после неоадъювантной терапии опухоль остается неоперабельной, назначается местно-регионарное и/или системное лечение в соответствии с локальной стандартной практикой. Эти пациенты прекратят лечение исследуемыми препаратами и будут продолжать принимать участие в исследовании для последующего анализа вторичных и поисковых критериев оценки эффективности при условии, что их согласие на участие в исследовании не будет отозвано.
[00185] Варианты хирургической тактики относительно подмышечных лимфатических узлов включают биопсию сигнального лимфатического узла (SLNB, БСЛУ) (до или после неоадъювантной терапии) и рассечение подмышечного лимфатического узла (ALND, РПЛУ) лимфатического протока I и II уровня в момент операции на молочной железе. Выбор тактики в подмышечной области будет основываться на клиническом состоянии подмышечной области, Т стадии и принципах местной медицинской практики.
[00186] Адъювантная фаза
[00187] Все пациенты, которым проведено оперативное вмешательство, продолжают получать ту же HER2-направленную терапию в адъювантной фазе, которую получали и в неоадъювантной фазе исследования (Группа А [трастузумаб + пертузумаб]; Группа B [трастузумаб эмтансин + пертузумаб]). Лечение назначается таким образом, что пациент получает 18 общих циклов HER2-направленной терапии, включая терапию, получаемую как в неоадъювантной, так и в адъювантной схемах. Пациенты, прекращающие лечение трастузумабом эмтансином из-за токсичности, которая может быть вызвана компонентом трастузумаба (например, повышенная чувствительность, кардиотоксичность, пневмонит), могут не продолжать получать лечение трастузумабом после прекращения приема трастузумаба эмтансина.
[00188] Адъювантная терапия начинается в течение 9 недель после последнего хирургического вмешательства. Адъювантная терапия прекращается в случае инвазивного рецидива заболевания, второго первичного инвазивного озлокачествления, неприемлемой токсичности, отзыва согласия, или прекращения исследования спонсором, в зависимости от того, что произойдет раньше. Пациенты, у которых адъювантное лечение исследуемыми препаратами прекращено до завершения плановой терапии, будут наблюдаться в соответствии с протоколом для анализа вторичных критериев оценки при условии, что их согласие на участие в исследовании не будет отозвано.
[00189] После оперативного вмешательства, по клиническим показаниям следует назначать лучевую терапию. Пациентам с ER-положительными и/или PgR-положительными опухолями необходимо назначать адъювантную гормонотерапию (например, тамоксифен или ингибитор ароматазы) в соответствии с локальными клиническими стандартами.
[00190] Дополнительная адъювантная терапия для группы B
[00191] Все пациенты, которые рандомизированы в группу В (трастузумаб эмтансин + пертузумаб), независимо от результата пПО в неоадъювантной терапии, дополнительно имеют возможность получать стандартную цитотоксическую терапию по адъювантной схеме; при этом решение относительно назначения стандартной цитотоксической терапии и выбора схемы лечения принимает лечащий врач. Рекомендуется назначение не менее четырех циклов адъювантной терапии на основе антрациклина (например, AC, FAC, FEC). Для пациентов группы В, которым назначена химиотерапия, адъювантное введение трастузумаба также следует начинать с химиотерапией в течение 9 недель после последнего хирургического вмешательства, когда это клинически приемлемо. Трастузумаб эмтансин и пертузумаб не следует комбинировать с адъювантной химиотерапией, но введение этих препаратов необходимо возобновить, как только завершается адъювантная химиотерапия. Введение трастузумаба эмтансина и пертузумаба должно быть возобновлено в течение 28 суток после завершения необязательной химиотерапии.
[00192] Для пациентов, получавших стандартную схему адъювантной химиотерапии, лучевую терапию необходимо отложить до завершения адъювантной химиотерапии и начать в течение 28 суток после завершения адъювантной химиотерапии.
[00193] Продолжительность исследования
[00194] Первичный критерий эффективности, пПО, анализируется сразу после того, как всем пациентам проведено оперативное вмешательство, примерно по истечению 8 месяцев после рандомизации последнего пациента.
[00195] Вторичные критерии эффективности по показателям БСВ, ВБПИЗ, степени сохранения молочной железы и ОВ анализируются при средней продолжительности времени наблюдения, составляющей около 36 месяцев с момента рандомизации (т.е., когда 50-й процентильный пациент наблюдается в течение около 36 месяцев). Когда эта средняя продолжительность времени наблюдения будет достигнута, со всеми пациентами связываются для оценки вторичных критериев эффективности БСВ, ВБПИЗ и ОВ. Описательный промежуточный анализ вторичных критериев эффективности БСВ, ВБПИЗ и ОВ может быть проведен при/после проведения первичного анализа эффективности и по мере необходимости или по запросу HA после первичного анализа. Общая продолжительность исследования составляет около 45 месяцев.
[00196] Оценка результатов эффективности
[00197] Оценка результатов первичной эффективности
[00198] Оценка первичной эффективности для этого исследования заключаются в следующем:
[00199] ВБПЗ, определяемая как время от рандомизации до даты первого наступления одного из следующих явлений:
1. Ипсилатеральный рецидив инвазивной опухоли молочной железы (т.е. инвазивный рак молочной железы с вовлечением той же паренхимы молочной железы, что и при исходном первичном поражении)
2. Ипсилатеральный местно-региональный рецидив инвазивного рака молочной железы (т.е. инвазивный рак молочной железы в подмышечной области, региональных лимфатических узлах, грудной стенке, и/или кожи ипсилатеральной молочной железы)
3. Контралатеральный или ипсилатеральный второй первичный инвазивный рак молочной железы
4. Отдаленный рецидив (т.е. наличие признаков рака молочной железы в любом анатомическом месте [кроме трех участков, упомянутых выше], который либо гистологически подтвержден, либо клинически/рентгенологически диагностирован как рецидив инвазивного рака молочной железы
[00200] Смерть, вызванная любой причиной, включая рак молочной железы, рак другого органа (не молочной железы), или неизвестной причиной.
[00201] Как было описано выше, переменным показателем первичной эффективности является ВБПИЗ, определяемый как период времени от рандомизации до даты первого возникновения явления ВБПИЗ. Информация о пациентах, у которых не отмечалось какого-либо явления во время анализа данных, будет подвергаться проверке по состоянию на дату, когда об этих пациентах в последний раз было известно, что они живы и не имеют каких-либо явлений, или до клинической даты завершения внесения данных для соответствующего анализа.
[00202] Логранговый критерий, стратифицированный по факторам стратификации, определенных протоколом (за исключением области), используется для сравнения ВБПИЗ между двумя группами лечения. Область исключается из-за вероятной потери мощности в результате возможности того, что некоторые из страт могут иметь очень мало пациентов. Результаты нестратифицированного логрангового критерия также предоставляются для анализа чувствительности. Если во время анализа будет расценено, что самая маленькая страта на группу, необходимая для проведения надежных стратифицированных анализов, содержит < 5 явлений, нестратифицированный анализ будет использоваться в качестве основного анализа. Модель пропорциональных рисков Кокса, стратифицированных по описанным выше факторам стратификации, за исключением области, будет использоваться для оценки ОР между двумя группами лечения и его 95% ДИ. Для оценки 3-годичного показателя ВБПИЗ и соответствующих 95% ДИ для каждой группы лечения будет использоваться метод Каплана-Мейера.
[00203] Оценка результатов вторичной эффективности
[00204] Оценка вторичной эффективности для этого исследования заключаются в следующем:
ВБПИЗ со вторым первичным раком другого органа (не молочной железы), за исключением немеланомных раков кожи и карциномы in situ (CIS, КIS) в любом месте
ВБПЗ, определяемая как период времени от рандомизации до даты первого проявления любого из явлений ВБПИЗ, описанных выше, второго случая первичного рака другого органа (не молочной железы) (за исключением немеланомных раков кожи и CIS (КIS) в любом месте, кроме молочной железы), и контралатеральной или ипсилатеральной протоковой карциномы in situ DCIS (ПКIS).
DRFI, определяемая как период времени от рандомизации до первого проявления отдаленного рецидива рака молочной железы
ОВ, определяемая как период времени от рандомизации до смерти по любой причине
[00205] Оценка результатов безопасности
[00206] О клинических и лабораторных нежелательных явлениях будет сообщаться в соответствии с Общими критериями терминологии для нежелательных явлений Национального института рака (NCI CTCAE) v4.03. ФВЛЖ будет оцениваться с помощью либо эхокардиографии (эхоКГ), либо многовходной радионуклидной ангиографии (MUGA).
[00207] Оценка безопасности для этого исследования заключается в следующем:
Частота, тип и степень тяжести всех нежелательных явлений на основании NCI CTCAE v4.03
Частота, тип и тяжесть серьезных нежелательных явлений
Частота, тип и тяжесть нежелательных явлений≥стадии 3
Частота и тип нежелательных явлений, приводящих к прекращению, изменению или отсрочке приема дозы.
Причина смерти
Патологические изменения в лабораторных показателях
Снижение ФВЛЖ по сравнению с исходным уровнем в динамике
Оценка результатов безопасности для сердца
1. Первичные критерии оценки функции сердца: явления со стороны сердца представляют собой смерть от причины, связанной с сердцем, или тяжелую ЗСН (NYHA класс III или IV) со снижением ФВЛЖ на≥10 процентных пунктов по сравнению с исходным уровнем, до ФВЛЖ < 50%
2. Вторичные критерии оценки функции сердца: другие явления со стороны сердца (например, любая легкая симптоматическая ЗСН [NYHA класс II], ассоцированная с≥10% снижением ФВЛЖ до < 50%; бессимптомное снижение ФВЛЖ, требующее отсрочки или отмены дозы)
Оценка результатов безопасности для печени
3. Смерть, вызванная причиной, связанной с печенью
4. Тяжелое DILI (МПП) (случаи закона Хая)
5. NRH (УРГ)
Оценка результатов безопасности для легких
6. Смерть, вызванная причиной, связанной с легкими
7. Пневмонит и ИБЛ
[00208] Вторичными критериями оценки являются ВБПИЗ со вторым первичным раком другого органа (не молочной железы), ВБПЗ, DRFI (определено в разделе "Оценка эффективности") и ОВ.
[00209] Вторичные критерии анализируются так же, как и первичный критерий с целью оценки частоты явлений за 3 года (и показателя 5-летней выживаемости для ОВ) для каждой группы лечения и ОР между двумя группами лечения с 95% ДИ. Информация о пациентах, у которых не отмечалось какого-либо явления во время анализа данных, подлежит проверке по состоянию на дату, когда об этих пациентах в последний раз было известно, что они живы и не имеют каких-либо явлений, или до клинической даты завершения внесения данных для соответствующего анализа.
[00210] В конце исследования для оценки 5-летнего показателя ВБПИЗ и соответствующих 95% ДИ для каждой группы лечения используется метод Каплана-Мейера с анализом как общей популяции, определенной протоколом, так и подпопуляции с поражением лимфатических узлов.
[00211] Оценка результатов исхода, отмечаемого пациентом (PRO, ИОП)
[00212] Оценка PRO (ИОП) для этого исследования заключаются в следующем:
[00213] HRQoL (СЗКЖ), включая тягостные побочные эффекты терапии (например, периферическая невропатия, суставная/мышечная боль, кожные патологии), и функционирование пациента, что оценивается с использованием EORTC QLQ-C30 и модифицированного модуля при раке молочной железы QLQ-BR23
[00214] Время от первого HER2-направленного лечения±таксан, до ухудшения общего состояния здоровья/QoL (подшкала из QLQ-C30). Явление, ухудшающее общее состояние здоровья/КЖ для конкретного пациента, определяется как увеличение среднего балла на 10 пунктов или больше в любой из моментов времени после начала HER2-направленной терапии±таксан. Увеличение среднего балла, определяемое от "умеренного" до "очень высокого" указывает значимое изменение с точки зрения пациента (Osoba et al. Interpreting the significance of changes in health-related quality-of-life scores. J Clin Oncol 1998; 16(1):139-44).
[00215] Оценка поисковых биомаркеров
[00216] Оценка поисковых биомаркеров для данного исследования представляет собой анализ взаимосвязи между молекулярными маркерами и результатами эффективности и/или безопасности. Результаты эффективности, рассматриваемые для этого анализа, будут включать ВБПИЗ и ОВ, в зависимости от конкретного случая.
[00217] Корреляция между состоянием биомаркеров и эффективностью и/или безопасностью будет включать в себя, но не ограничиваться ими, следующие параметры:
Уровень экспрессии мРНК HER2, оцениваемый с помощью количественной полимеразной цепной реакции в режиме реального времени (кОТ-ПЦР) с результатами эффективности
Статус мутаций PIK3CA, оцениваемый с помощью анализа аллель-специфической полимеразной цепной реакции PIK3CA с результатом эффективности
Уровень амплификации гена HER2, оцениваемый с помощью гибридизации in-situ (ISH) с результатом эффективности
Уровень экспрессии белка HER2, оценениваемый с помощью анализа иммуногистохимии (ИГХ) с результатом эффективности
Изменения уровней экспрессии биомаркера или биомаркерных панелей в динамике с результатом эффективности
[00218] Дозы, введение и приверженность к терапии
[00219] Лечение на основе химиотерапии S°C должно включать от трех до четырех циклов режима на основе антрациклина. Пациентам группы А также вводят таксан: от трех до четырех циклов или 12 недель. Введение HER2-направленной терапии будет длиться до 1 года (до 18 циклов). Адъювантная лечение исследуемыми препаратами будет прекращено в случае инвазивного рецидива заболевания, неприемлемой токсичности, отзыва согласия или прекращения исследования спонсором. Пациентам с диагнозом рака молочной железы in situ или второго первичного рака, не требующего системной терапии и без признаков инвазивного рецидива рака молочной железы, следует продолжать прием исследуемой адъювантной терапии, если по мнению исследователя, это будет в наилучших интересах пациента, при любой возможности.
[00220] Антрациклиновый этап лечения
[00221] В данном исследовании по усмотрению исследователя могут быть выбраны схемы лечения либо FEC (Таблица 2), либо AC/EC (Таблица 3), как описано в следующих подразделах. Пожалуйста, обратитесь к локальным инструкциям по медицинскому применению препарата/институциональным руководящим принципам для получения информации по введению, премедикации и отсрочке/снижению дозы из-за токсичности.
Таблица 2 FEC
|
Таблица 3 AC/EC
|
Схема AC/EC с уплотнением дозы (каждые 2 недели [1 раз в 2 недели]) может вводиться с поддерживающей терапией -ГКСФ (например, пегфилграстим 6 мг подкожно на 2-е сутки цикла "1 раз в 2 недели").
[00222] Противорвотные схемы лечения могут быть использованы в качестве премедикации по усмотрению врача.
[00223] Этап одновременного введения таксана и/или этап HER2-направленной монотерапии
[00224] Этап одновременного введения таксана относится только к лечению группы А (контрольная группа). Терапия трастузумабом в комбинации с пертузумабом должна начинаться одновременно с таксановым компонентом химиотерапии после антрациклиновой терапии в контрольной группе. После антрациклинового лечения и до начала HER2-направленной терапии необходимо выдержать минимальный интервал в 3 недели от последней дозы антрациклинов. До начала введения HER2-направленного компонента терапии, у пациентов показатель ФВЛЖ должен составлять≥50% и не должны регистрироваться какие-либо клинические симптомы, предполагающие наличие сердечной недостаточности, или бессимптомное снижение ФВЛЖ с абсолютной точкой > 15% от исходного уровня. HER2-направленное лечение будет продолжаться в общей сложности до 1 года и будет прекращено в случае инвазивного рецидива заболевания, неприемлемой токсичности, отзыва согласия или прекращения исследования спонсором.
[00225] ±3-дневное окно допускается при введении 1 раз в 3 недели, и + 3-дневное окно допускается при введении 1 раз в неделю. Такое временное окно не применяется, если показана отсрочка введения дозы в связи с токсичностью.
[00226] Лечение с применением комбинации "трастузумаб плюс пертузумаб плюс таксан"
[00227] Во время этапа одновременного введения таксана, либо доцетаксел 1 раз в 3 недели (в дозе 100 мг/м2 в течение трех циклов, в дозе 75 мг/м2 в течение четырех циклов, либо первоначальная доза 75 мг/м2 в первом цикле, и повышение до 100 мг/м2, если не наблюдается ДЛТ в общей сложности за три цикла при минимуме), либо паклитаксел в дозе 80 мг/м2 1 раз в неделю в течение 12 недель, будут вводиться одновременно с трастузумабом в комбинации с пертузумабом. Пожалуйста, обратитесь к локальным инструкциям по медицинскому применению препарата/институциональным руководящим принципам для получения информации по введению доцетаксела или паклитаксела, премедикации и отсрочке/снижению дозы из-за токсичности.
[00228] После этапа одновременного введения, будет продолжаться введение только трастузумаба с пертузумабом в общей сложности до 1 года (52 недели, до 18 циклов).
[00229] Трастузумаб будет назначаться в нагрузочной дозе 8 мг/кг, а пертузумаб - в дозе 840 мг. В последующих циклах трастузумаб будет вводиться в качестве поддерживающей дозы, составляющей 6 мг/кг, а пертузумаб - 420 мг 1 раз в 3 недели. Дозу трастузумаба не следует пересчитывать, если вес тела пациента изменился не более чем на±10% от исходного уровня. Если пациент пропускает дозу трастузумаба в течение любого цикла (т.е., два последовательных введения разделяет интервал 6 недель и более), необходимо ввести повторную нагрузочную дозу 8 мг/кг трастузумаба. Если пациент пропускает дозу пертузумаба в течение любого цикла, а интервал между дозами составляет 6 недель или более, необходимо ввести повторную нагрузочную дозу пертузумаба (840 мг). Пациентам, у которых отмечаются симптомы, связанные с инфузией трастузумаба или пертузумаба, может быть проведена премедикация парацетамолом и антигистаминными препаратами перед последующими инфузиями.
[00230] Последовательность введения для этой группы лечения должна соответствовать изложенной в Таблице 4 (последовательность сверху вниз).
Таблица 4. Схема лечения для группы 1
|
[00231] Лечение комбинацией "трастузумаб плюс пертузумаб"
[00232] Таксан не будет вводиться пациентам из группы лечения 2. Введение трастузумаба эмтансина с пертузумабом будет продолжаться в общей сложности до 1 года (52 недели, до 18 циклов).
[00233] Трастузумаб эмтансин будет вводиться в дозе 3,6 мг/кг путем внутривенной инфузии в комбинации с пертузумабом в начальной нагрузочной дозе 840 мг внутривенно с последующей поддерживающей дозой 420 мг внутривенно 1 раз в 3 недели. Дозу трастузумаба эмтансина не следует пересчитывать, если вес тела пациента изменился не более чем на±10% от исходного уровня. Если пациент пропускает дозу пертузумаба в течение любого цикла, а интервал между дозами составляет 6 недель или более, необходимо ввести повторную нагрузочную дозу пертузумаба (840 мг).
[00234] Пациентам, у которых отмечаются симптомы, связанные с инфузией пертузумаба, может быть проведена премедикация парацетамолом и антигистаминными препаратами перед последующими инфузиями.
[00235] Последовательность введения для этой группы лечения должна соответствовать приведенной ниже в Таблице (Таблица 5) (последовательность сверху вниз).
Таблица 5. Схема лечения для группы 2
|
[00236] Приведенное выше описание рассматривается только как иллюстрация принципов настоящего изобретения. Кроме того, поскольку специалистам в данной области техники многочисленные будут очевидны модификации и изменения, то не желательно ограничивать настоящее изобретение точной конструкцией и способом, описанными выше. Соответственно, все пригодные модификации и эквиваленты могут рассматриваться как подпадающие под объем настоящего изобретения, что определено нижеследующей формулой изобретения.