ПИТАТЕЛЬНЫЕ КОМПОЗИЦИИ С 2FL И LNNT ДЛЯ ПРИМЕНЕНИЯ ПРИ ИНДУКЦИИ КИШЕЧНОЙ МИКРОБИОТЫ, КОТОРАЯ ПОХОЖА НА КИШЕЧНУЮ МИКРОБИОТУ МЛАДЕНЦЕВ НА ГРУДНОМ ВСКАРМЛИВАНИИ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к питательным композициям для младенцев или детей младшего возраста и их влиянию на здоровье. В частности, изобретение относится к детской смеси, содержащей специфические олигосахариды для индукции кишечной микробиоты, которая похожа на микробиоту младенцев, вскармливаемых исключительно человеческим грудным молоком (HBM).
Уровень техники
Материнское молоко рекомендовано всем младенцам. Однако в некоторых случаях грудное вскармливание является недостаточным или неэффективным по медицинским причинам, или мать отказывается от грудного вскармливания. Для этих случаев были разработаны питательные композиции, такие как детские смеси.
Питательные композиции для младенцев и детей младшего возраста часто поступают в продажу в виде порошков для растворения в воде или в некоторых случаях — в виде готового к употреблению напитка или концентрированных жидких композиций. Эти композиции предназначены для удовлетворения большинства или всех потребностей в питании младенцев или детей младшего возраста.
Однако известно, что человеческое грудное молоко представляет собой неоспоримый «золотой стандарт» в сфере питания младенцев. Следовательно, производители детских смесей много раз пытались обеспечить питательное влияние на здоровье, близкое к или аналогичное полезному воздействию человеческого грудного молока. Однако многие исследования показали, что детская смесь не обеспечивает в отношении организма воздействие, идентичное тому, которое обеспечивается человеческим грудным молоком. Например, у младенцев, находящихся на вскармливании детской смесью, и младенцев, находящихся на вскармливании человеческим грудным молоком (HBM), может наблюдаться различная кишечная микробиота.
Раннее детство, особенно первые недели, 3 месяца, 6 месяцев или 12 месяцев жизни, являются критически важными периодами для установления баланса кишечной микробиоты.
Известно, что модуляция кишечной микробиоты в младенчестве в перспективе может оказать большое влияние на будущее состояние здоровья организма. Например, кишечная флора может оказывать влияние на развитие сильной иммунной системы в дальнейшей жизни, нормальный рост и даже на развитие ожирения в дальнейшей жизни.
Аналогично здоровая кишечная флора является показателем здоровья младенца, а измененная кишечная микробиота может быть показателем (и/или причиной) аномальных состояний здоровья, таких как диарея, недостаточное всасывание питательных веществ, колики, нарушение сна и/или нарушение роста и развития.
Известно, что способ родоразрешения может также повлиять на исходную кишечную микробиоту младенцев: было показано, что младенцы, рожденные посредством кесарева сечения, имеют другую кишечную микробиоту по сравнению с младенцами, рожденными посредством вагинальных родов.
Однако кишечная микробиота и ее развитие в течение развития младенца представляют собой тонкий баланс между наличием и уровнем распространения (количеством) многих популяций кишечных бактерий. Некоторые кишечные бактерии относят к категории «в целом полезных», а другие — «в целом вредных» (или патогенных) из-за их воздействия на общее состояние здоровья младенца.
Определенные виды «в целом полезных» бактерий, такие как бифидобактерии, могут быть представлены у младенцев, находящихся на вскармливании традиционной детской смесью, в недостаточной степени по сравнению с таковыми у младенцев на грудном вскармливании. Аналогично некоторые популяции бактерий считаются патогенными, и необходимо поддерживать низкий уровень их распространения в кишечной микробиоте.
Действительно, младенец, вскармливаемый детскими смесями, может не пользоваться преимуществами, которые обеспечивает естественная, хорошо сбалансированная кишечная флора (кишечная микробиота) младенцев, вскармливаемых исключительно или преимущественно человеческим грудным молоком. Такая естественная микробиота, наблюдаемая у младенцев на грудном вскармливании, действительно является хорошо контролируемой на протяжении времени (развитие со временем) и сложной. Многие таксоны микроорганизмов сосуществуют в очень сложной микросреде кишечника, и все они находятся в последовательно формируемых пропорциях. При описании микробиоты младенцев и детей младшего возраста следует учитывать количественные и качественные параметры. Кроме того, дополнительная сложность заключается в том, что кишечная микробиота изменяется со временем.
Подходящая и здоровая кишечная микробиота является ключевым фактором для развития иммунной системы в слизистой оболочке младенца. Многие исследования позволили определить способы стимулирования роста и распространения конкретных полезных бактерий в кишечнике младенцев, но при этом мало что известно о способах индукции микробиоты, которая похожа на микробиоту младенцев на грудном вскармливании.
В частности, проводятся исследования применения пробиотиков. Пробиотики считаются препаратами на основе жизнеспособных микроорганизмов, которые укрепляют здоровье индивида путем сохранения естественной микрофлоры в кишечнике. Предполагается, что пробиотики прикрепляются к слизистой оболочке кишечника, колонизируют кишечник и таким же путем предотвращают прикрепление к нему вредных микроорганизмов. Важнейшее условие их действия заключается в том, что они должны достичь слизистой оболочки кишечника в надлежащей и жизнеспособной форме и не должны разрушаться в верхнем отделе желудочно-кишечного тракта, в частности под влиянием преобладающего в желудке низкого рН. Еще одна сложность заключается в том, что кишечная микробиота очень разнообразна и сложна, и бактерии вступают в различные взаимодействия между собой.
Известно, что, помимо прочих ингредиентов, на активацию конкретной микробиоты особенно могут повлиять неперевариваемые углеводы (пребиотики). Например, было показано, что определенные галактоолигосахариды (ГОС) и/или определенные фруктоолигосахариды (ФОС) могут стимулировать рост и распространение бифидобактерий в кишечнике, особенно у младенцев.
В частности, человеческое грудное молоко содержит избыток разнообразных по структуре олигосахаридов грудного молока (в общем известны как олигосахариды грудного молока, ОГМ), которые могут способствовать иммунной функции посредством нескольких возможных механизмов. Сюда относится пребиотический эффект, приводящий к развитию и поддержанию здоровой кишечной микробиоты, ключевого фактора для развития иммунной системы слизистой оболочки (Bode et al, Human milk oligosaccharides: Every baby needs a sugar mama. Glycobiology 2012;22(9):1147–1162). ОГМ также могут играть в кишечнике роль растворимых рецепторов-ловушек, защищающих новорожденного от кишечных патогенов (Newburg et al, Human milk glycans protect infants against enteric pathogens. Annual Review of Nutrition 2005;25:37–58), и также могут напрямую взаимодействовать с эпителиальными клетками кишечника, вызывая изменения, которые могут препятствовать взаимодействиям хозяина-микроорганизма (Bode et al, 2012).
В публикации WO9843495 от Abbott указана питательная рецептура, содержащая эффективное количество лакто-N-неотетраозы для стимуляции роста и/или метаболической активности бактерий Bifidobacterium infantis.
Публикация WO2009060073 от Nestec SA относится к применению олигосахарида, такого как лакто-N-тетраоза или лакто-N-неотетраоза, для стимуляции развития в первые несколько недель жизни младенца полезной кишечной микробиоты, сравнимой с обнаруживаемой у младенцев на грудном вскармливании, особенно кишечной микробиоты, в которой доминируют существенные популяции Bifidobacterium и Lactobacillus с исключением других популяций, таких как Bacteroides, Clostridia и Streptococci.
В публикации WO2012158517 описано применение очищенных ОГМ, таких как 2’-FL, 3-FL или LDFT, для стимуляции роста бактерий в желудочно-кишечном тракте субъекта-млекопитающего, в том числе бифидобактерий.
Однако существующие вмешательства с использованием пробиотиков и/или пребиотиков модулируют определенные таксоны микробиоты, например, они могут приводить к увеличению количества бифидобактерий или уменьшению количества клостридий. Однако в настоящее время не существует решения, которое позволяет сделать композицию общей микробиоты (т.е. общую/всю/тотальную/цельную микробиоту) младенцев, вскармливаемых смесями, похожей на микробиоту младенцев на грудном вскармливании.
Никакие существующие решения, по-видимому, также не принимают в расчет функцию кишечной микробиоты.
Следовательно, для младенцев, вскармливаемых детскими смесями, существует потребность в стимуляции и/или индукции всей микробиоты, чтобы сделать ее похожей на микробиоту младенцев на грудном вскармливании, как по композиции, так и по функции.
Существует потребность в питательных композициях для младенцев и детей младшего возраста, стимулирующих и/или индуцирующих с течением времени общую микробиоту, которая развивается аналогично микробиоте младенцев на грудном вскармливании.
Существует потребность в предоставлении младенцам или детям младшего возраста наилучшего питания, способствующего развитию общей микробиоты, которая похожа на микробиоту младенцев на грудном вскармливании, причем указанное развитие является кратковременным (т.е. действующим на протяжении вмешательства во вскармливание) и/или долговременным (т.е. действующим после вмешательства во вскармливание).
Существует потребность в питательных композициях для младенцев или детей младшего возраста, индуцирующих оптимальное в краткосрочной или долгосрочной перспективе состояние здоровья при помощи питания, индуцирующего и/или стимулирующего развитие общей микробиоты, которая похожа на микробиоту младенцев на грудном вскармливании; такое состояние здоровья включает в себя оптимальный рост с течением времени и оптимальное развитие иммунной системы, а также предотвращение метаболических расстройств.
Существует потребность в компенсации аномальной общей микробиоты, наблюдаемой у младенцев или детей младшего возраста, которые не находятся на грудном вскармливании, например, тех, которые получали традиционную питательную композицию. Существует потребность в восстановлении баланса такой общей микробиоты.
Существует потребность в усилении оптимального баланса в общей кишечной микробиоте младенцев, особенно путем угнетения или подавления роста патогенных бактерий, в течение первых недель жизни, когда устанавливается такой баланс.
Существует потребность в питательных композициях для младенцев или детей младшего возраста, обеспечивающих общую микробиоту и характерные метаболические особенности, которые похожи на таковые у младенцев на грудном вскармливании.
Существует потребность в питательных композициях для младенцев или детей младшего возраста, обеспечивающих здоровый рост, здоровую иммунную систему, нормальную работу кишечника и/или профилактику дисбиоза микробиоты у указанных младенцев или детей младшего возраста, например, сразу же или в дальнейшей жизни.
Существует потребность в обеспечении у этих младенцев и детей младшего возраста таких полезных для здоровья эффектов с помощью способа, который не вызывает побочных эффектов и/или который можно легко осуществлять и который приемлем для родителей или медицинских работников.
Сущность изобретения
Авторы настоящего изобретения обнаружили, что композиция, содержащая по меньшей мере один фукозилированный олигосахарид (2FL) и по меньшей мере один N-ацетилированный олигосахарид (LNnT), может с преимуществом применяться для обеспечения у младенцев общей микробиоты кишечника, которая похожа на микробиоту младенцев, вскармливаемых исключительно человеческим грудным молоком, по сравнению с общей микробиотой кишечника у младенцев, вскармливаемых традиционной детской смесью без содержания указанных олигосахаридов. В совокупности, микробиота кала и характерные метаболические признаки показывают, что добавление 2 индивидуальных и очень специфичных по структуре олигосахаридов грудного молока (ОГМ) сдвигает общую кишечную микробиоту, оцениваемую в кале, как по композиции, так и по функциям, в сторону микробиоты, наблюдаемой у младенцев на грудном вскармливании. Без ограничений, накладываемых какой-либо конкретной теорией, считается, что эти олигосахариды действуют синергетически, обеспечивая такое влияние на общую микробиоту кишечника.
Соответственно, настоящее изобретение относится к питательной композиции, содержащей по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид для применения в стимуляции и/или индукции у младенцев или детей младшего возраста общей микробиоты кишечника, которая похожа на общую микробиоту кишечника у младенцев или детей младшего возраста, вскармливаемых исключительно человеческим грудным молоком, по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания указанных олигосахаридов.
Преимущество питательной композиции настоящего изобретения заключается в том, что она оказывает влияние на композицию и/или функцию всей микробиоты кишечника, например, на относительное таксономическое богатство (или количество), разнообразие, активность и/или функциональность указанной микробиоты.
В частности, ее можно использовать для обеспечения здорового роста, для обеспечения здоровой иммунной системы, для обеспечения нормальной работы кишечника и/или для профилактики дисбиоза микробиоты у младенцев или детей младшего возраста.
В особенно преимущественном варианте осуществления питательная композиция содержит 2’-фукозиллактозу (2-FL) и лакто-N-неотетраозу (LNnT), и в частности 2’-фукозиллактозу (2-FL) в количестве 0,8–1,5 г/л питательной композиции и LNnT в количестве 0,5–0,8 г/л питательной композиции.
На фиг. 1 представлен общий профиль общей средней микробиоты на уровне родов в сравнении между референтной группой на грудном вскармливании (BF), контрольной группой (контроль) и исследуемой группой, оцениваемый по профилированию гена 16S рРНК.
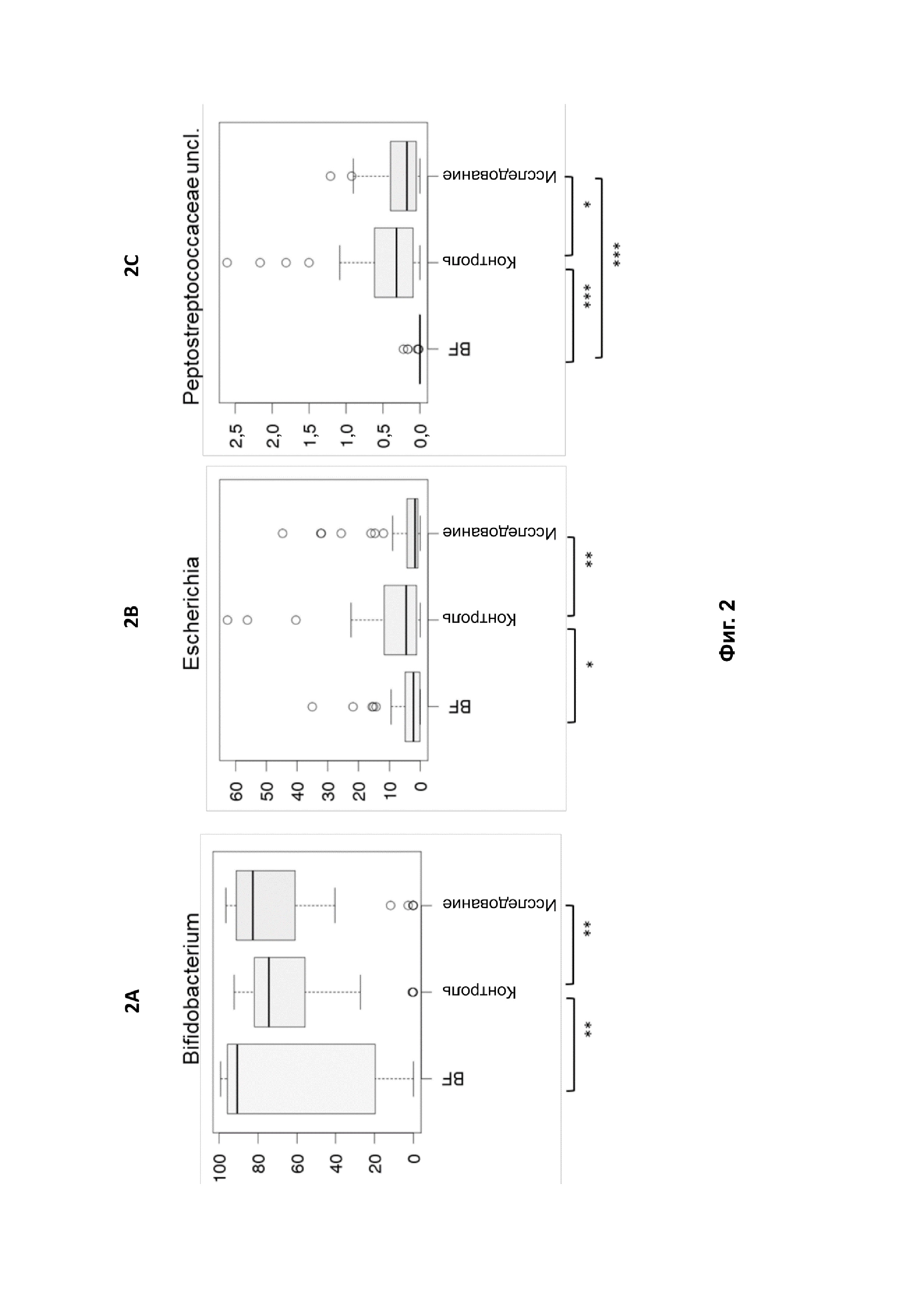
На фиг. 2 представлена относительная композиция трех основных таксонов в трех группах — BF, контрольная и исследуемая группы, — которая демонстрирует достоверные отличия между исследуемой и контрольной группами, по данным профилирования гена 16S рРНК: Bifidobacterium (фиг. 2A), Escherichia (фиг. 2B) и Peptostreptococacceae uncl (фиг. 2C). Показана медиана с межквартильными диапазонами. Достоверное отличие обозначено символом *, p < 0,05; **, p < 0,01; ***, p < 0,001. BF ― референтная группа на грудном вскармливании.
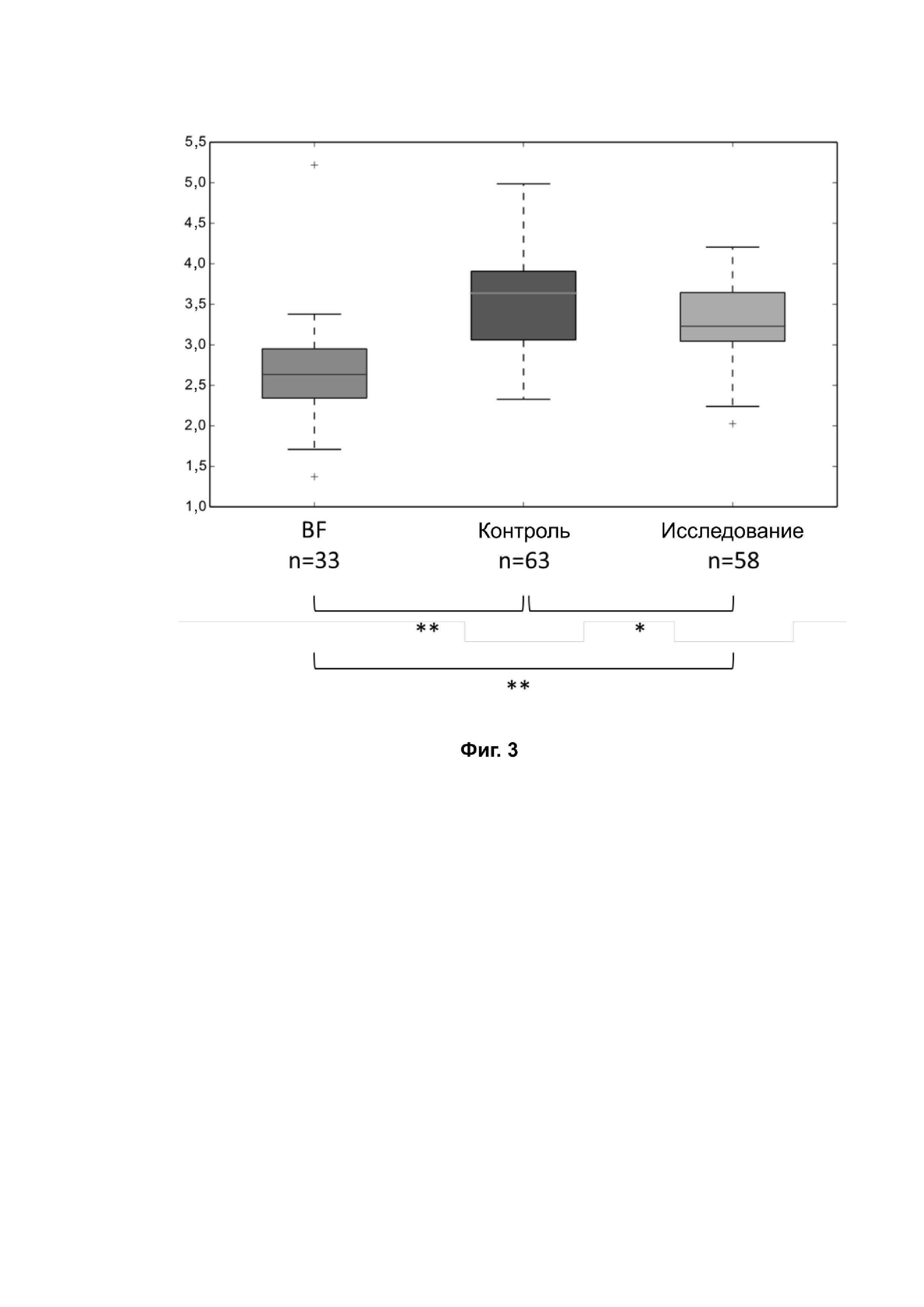
На фиг. 3 представлено значение альфа-разнообразия общей микробиоты в трех группах — BF, контрольной и исследуемой, — вычисленное с параметром PD_whole_tree (филогенетическое разнообразие по всему филогенетическому древу) на основе профилирования гена рРНК 16S. Достоверное отличие обозначено символом *, p < 0,05; **, p < 0,01.
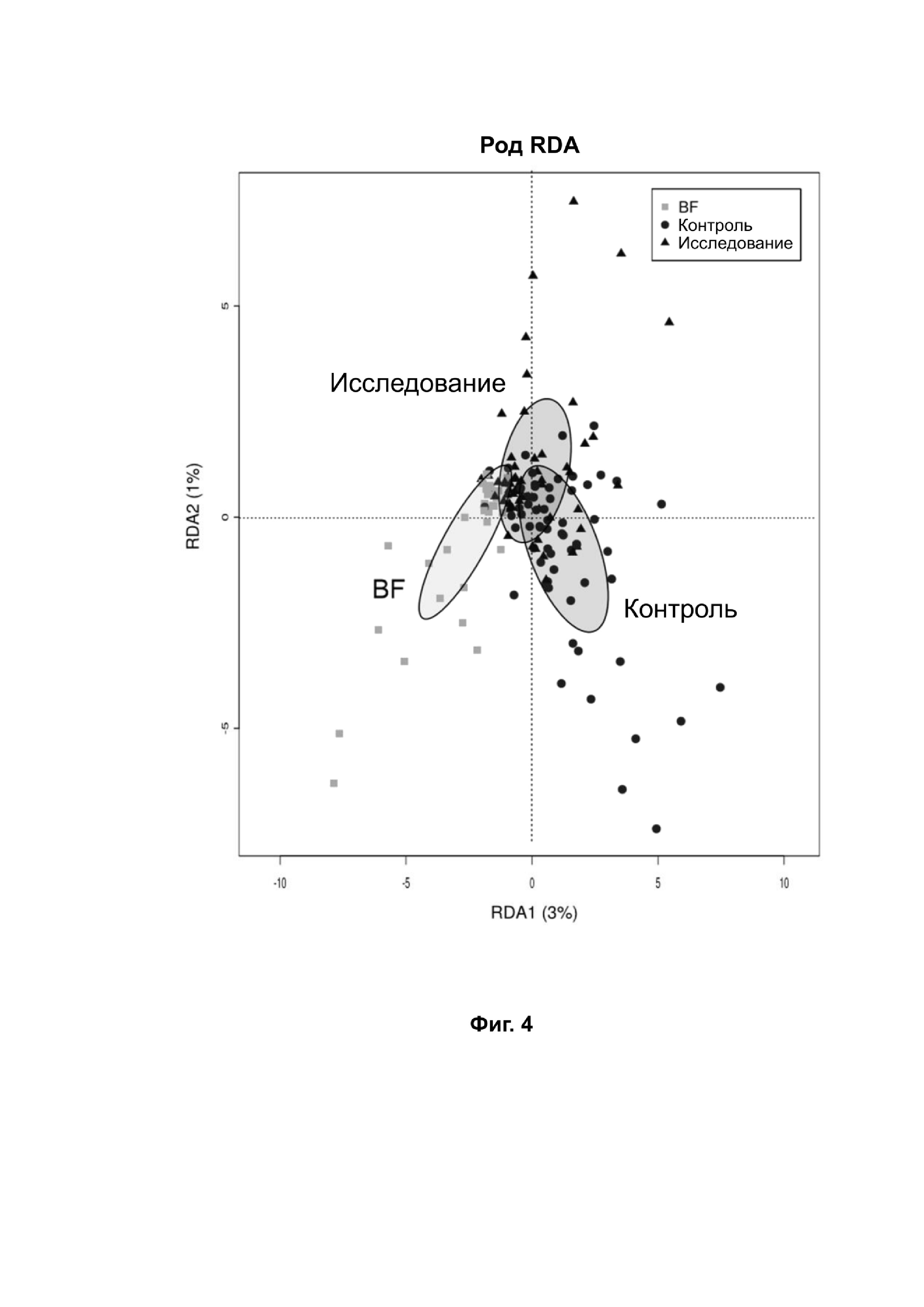
На фиг. 4 представлен анализ избыточности, основанный на данных уровня родов, измеренных при профилировании гена рРНК 16S, и показывающий достоверное разделение трех групп p < 0,001.
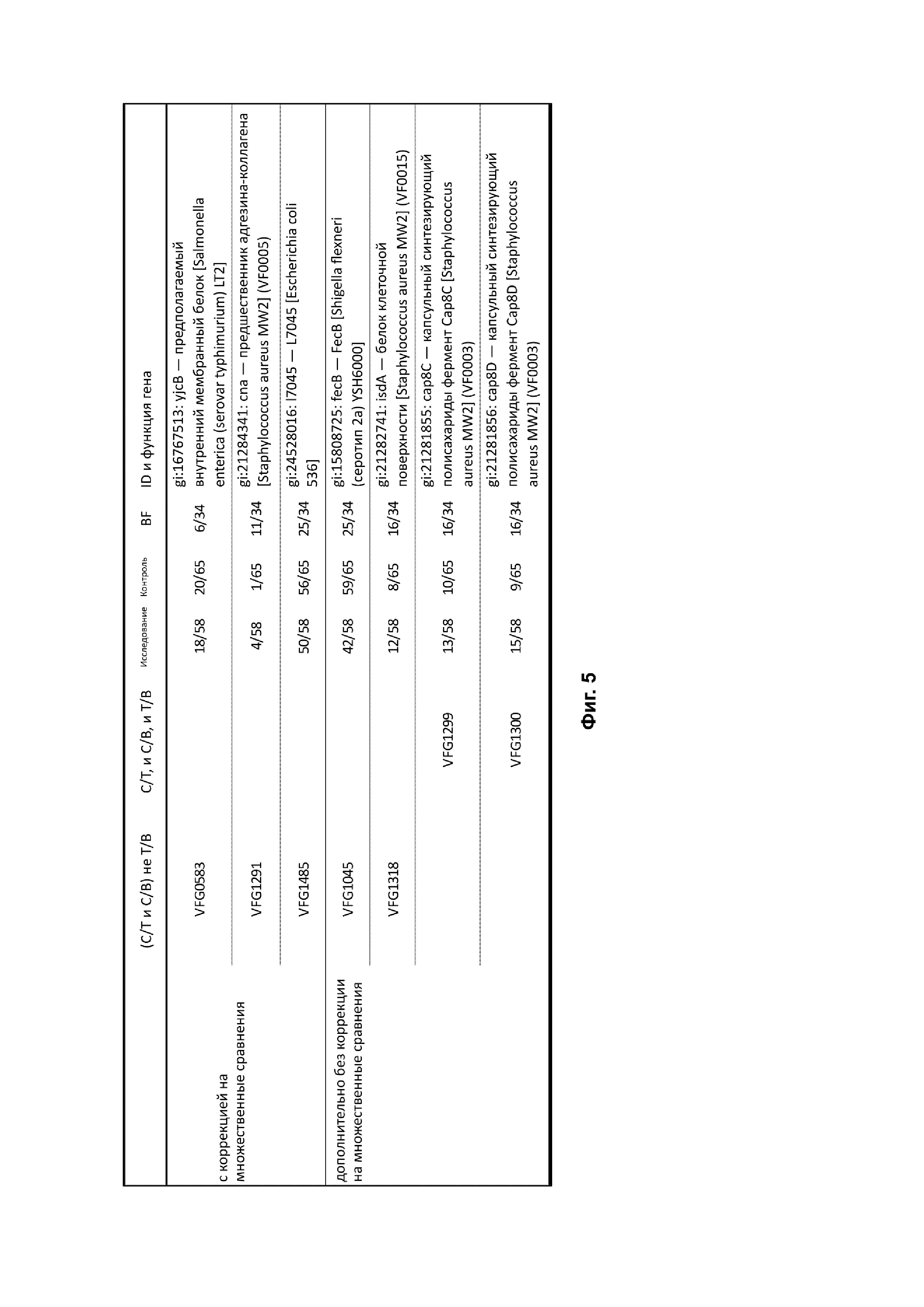
На фиг. 5 представлена таблица, демонстрирующая перечень выявленных генов, кодирующих известные болезнетворные факторы, измеренных по метагеномам. C/T, C/B и T/B означают достоверные отличия между контрольной и исследуемой группами, контрольной группой и группой на грудном вскармливании, а также исследуемой группой и группой на грудном вскармливании соответственно. Достоверность различий между группами оценивали по аппроксимации моделью отрицательной биномиальной регрессии, учитывая при необходимости лишние нулевые данные. Для каждой группы также показано количество младенцев с определенными генами.
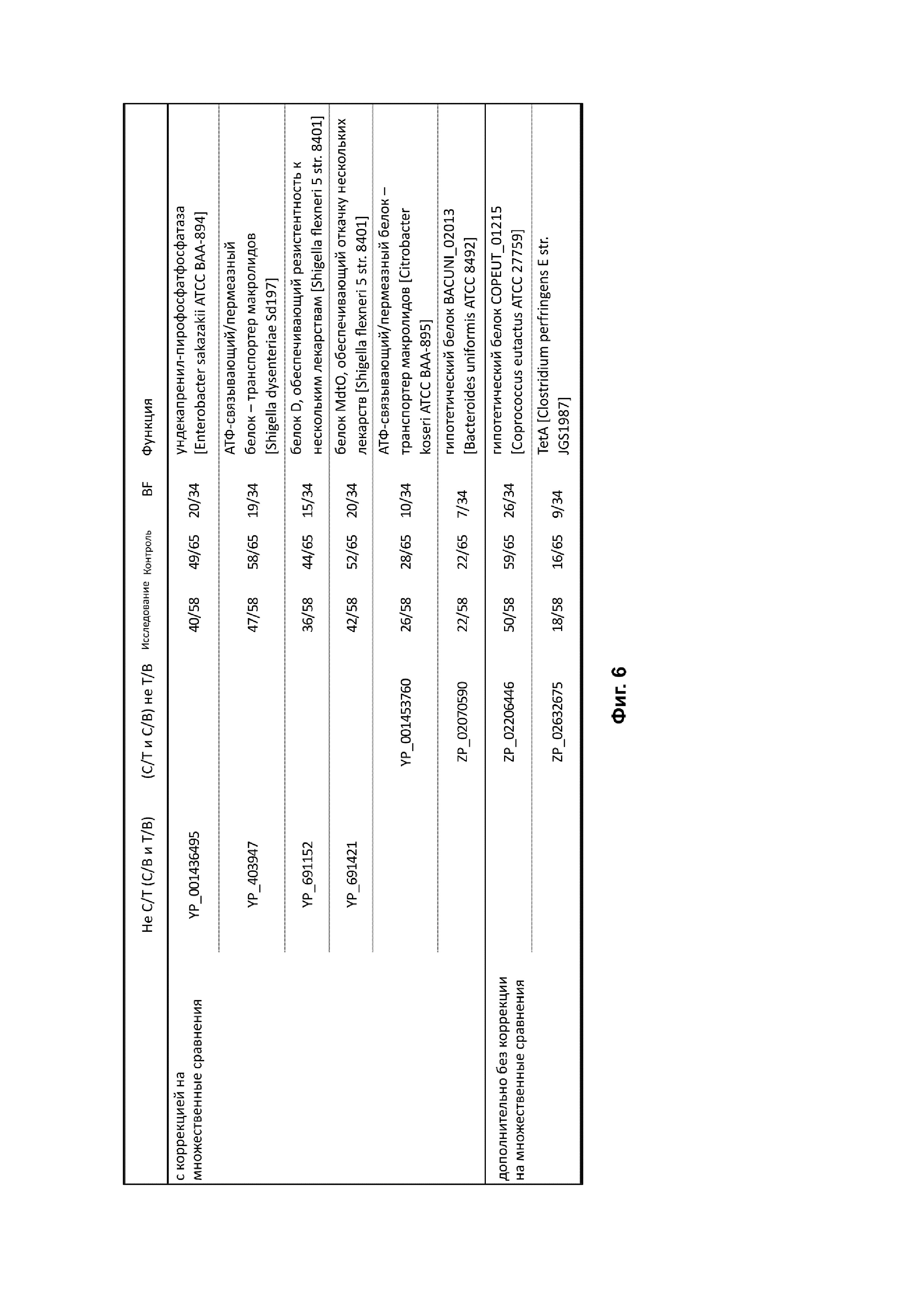
На фиг. 6 представлена таблица, демонстрирующая перечень выявленных генов, кодирующих известные гены резистентности к антибиотикам, измеренных по метагеномам. C/T, C/B и T/B означают достоверные отличия между контрольной и исследуемой группами, контрольной группой и группой на грудном вскармливании, а также исследуемой группой и группой на грудном вскармливании соответственно. Достоверность различий между группами оценивали по аппроксимации моделью отрицательной биномиальной регрессии, учитывая при необходимости лишние нулевые данные. Для каждой группы также показано количество младенцев с определенными генами.
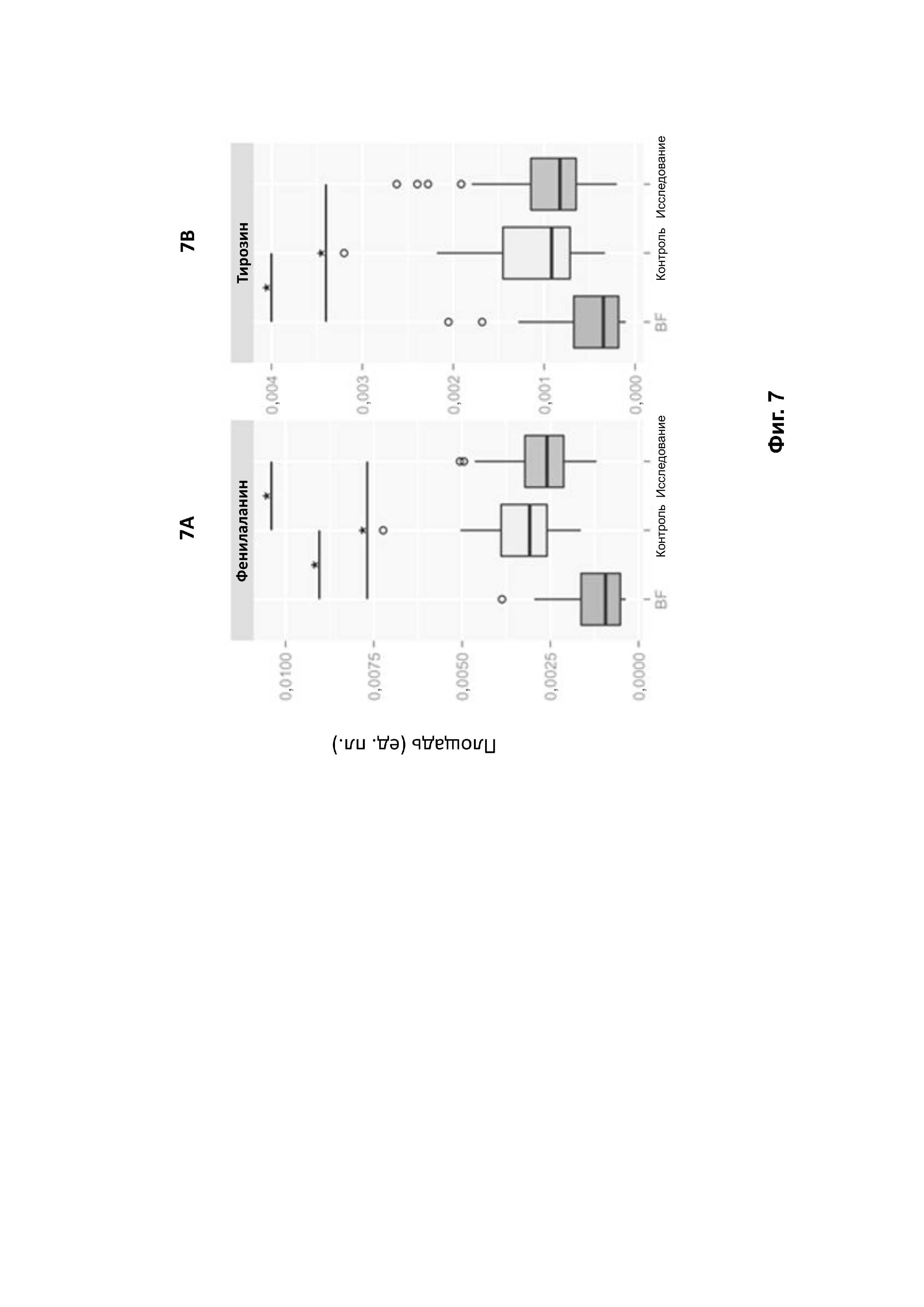
На фиг. 7 представлена относительная концентрация важных метаболитов, полученных по результатам анализа кала 1H методом ЯМР-спектроскопии, относящимся к метаболизму аминокислот и других органических кислот: фенилаланина (фиг. 7A), тирозина (фиг. 7B), лактата (фиг. 7C) и изолейцина (фиг. 7D). Знак * означает достоверное отличие по критерию Краскела — Уоллиса (p < 0,05). BF — референтная группа на грудном вскармливании.
Раскрытие изобретения
В настоящем документе следующие термины имеют приведенные ниже определения.
Термин «младенец» означает ребенка в возрасте до 12 месяцев.
Выражение «ребенок младшего возраста» означает ребенка в возрасте от одного до трех лет (также означает ребенка, начинающего ходить).
«Младенец или ребенок младшего возраста, рожденный посредством кесарева сечения» означает младенца или ребенка младшего возраста, рожденного посредством кесарева сечения. Это означает, что младенец или ребенок младшего возраста не был рожден посредством вагинальных родов.
«Младенец или ребенок младшего возраста, рожденный посредством вагинальных родов» означает младенца или ребенка младшего возраста, который был рожден посредством вагинальных родов, а не посредством кесарева сечения.
«Недоношенный» или «преждевременно родившийся» означает младенца или ребенка младшего возраста, который родился раньше срока. По существу, этот термин относится к младенцу или ребенку младшего возраста, рожденному до конца 37-й недели беременности.
Под выражением «маленький для своего гестационного возраста» или SGA подразумевают младенца или ребенка младшего возраста, размеры которого меньше нормы для его гестационного возраста при рождении, что чаще всего определяют как массу тела ниже 10-го процентиля для данного гестационного возраста. В некоторых вариантах осуществления изобретения состояние SGA может быть связано с задержкой внутриутробного развития (ЗВУР), которая относится к состоянию, при котором плод не может достичь своего потенциального размера.
Под выражением «низкий вес при рождении» следует понимать любую массу тела менее 2500 г при рождении.
Выражение «питательная композиция» означает композицию, которой вскармливают субъекта. Данная питательная композиция обычно предназначена для перорального или внутривенного применения, и она обычно включает в себя источник липидов или жира и источник белка.
В конкретном варианте осуществления питательная композиция настоящего изобретения представляет собой гипоаллергенную питательную композицию. Выражение «гипоаллергенная питательная композиция» означает питательную композицию, которая с малой вероятностью может вызывать аллергические реакции.
В конкретном варианте осуществления питательная композиция настоящего изобретения представляет собой «искусственную питательную композицию». Выражение «искусственная питательная композиция» означает смесь, полученную с помощью химических и/или биологических средств, которые могут быть химически идентичны смеси природного происхождения, присутствующей в молоке млекопитающих (т.е. искусственная композиция не является грудным молоком).
Выражение «детская смесь» в настоящем документе относится к продукту питания, специально предназначенному для применения в пищу младенцами в течение первых месяцев жизни, который сам по себе удовлетворяет потребности в питании этой категории лиц (статья 2(c) Директивы Европейской комиссии 91/321/EEC 2006/141/EC от 22 декабря 2006 г. о детских смесях и смесях для прикармливаемых детей). Оно также относится к питательной композиции, предназначенной для младенцев, как определено в Codex Alimentarius (Codex STAN 72-1981) и стандарте «Специальные продукты для младенцев» (включая статью «Продукты питания для специальных медицинских целей»). Выражение «детская смесь» охватывает как «начальную детскую смесь», так и «смесь последующего уровня» или «смесь для прикармливаемых детей». В некоторых вариантах осуществления детская смесь представляет собой детскую смесь для недоношенных младенцев.
Смесь последующего уровня или смесь для прикармливаемых детей начинают давать с 6-го месяца. Она составляет главный жидкий элемент в постепенно увеличивающемся разнообразии рациона для лиц данной категории.
Выражение «детское питание» означает продукт питания, специально предназначенный для применения в пищу младенцами или детьми младшего возраста в течение первых лет жизни.
Выражение «детская композиция на зерновой основе» означает продукт питания, специально предназначенный для применения в пищу младенцами или детьми младшего возраста в течение первых лет жизни.
Термин «обогатитель» относится к жидким или твердым питательным композициям, которые подходят для смешивания с грудным молоком или детской смесью.
Термин «ОГМ» относится к олигосахариду (-ам) грудного молока. Эти углеводы обладают высокой устойчивостью к ферментативному гидролизу, что указывает на то, что они могут проявлять существенные функции, непосредственно не относящиеся к их калорийной ценности. В первую очередь было показано, что они играют жизненно важную роль в раннем развитии младенцев и детей младшего возраста, например, в развитии иммунной системы. В грудном молоке обнаружено много различных видов ОГМ. Каждый отдельный олигосахарид основан на комбинации глюкозы, галактозы, сиаловой кислоты (N-ацетилнейраминовой кислоты), фукозы и/или N-ацетилглюкозамина с образованием многочисленных и разнообразных связей между ними, что обусловливает присутствие огромного числа различных олигосахаридов в грудном молоке — на данный момент было выявлено более 130 таких структур. Почти все они имеют лактозную группу на своем восстанавливающем конце, в то время как сиаловая кислота и/или фукоза (при наличии) занимают концевые положения на невосстанавливающих концах. ОГМ могут быть кислотными (например, олигосахарид, содержащий заряженную сиаловую кислоту) или нейтральными (например, фукозилированный олигосахарид).
«Фукозилированный олигосахарид» представляет собой олигосахарид, имеющий остаток фукозы. Он имеет нейтральный характер. Некоторыми примерами являются 2-FL (2’-фукозиллактоза), 3-FL (3-фукозиллактоза), дифукозиллактоза, лакто-N-фукопентаоза (например, лакто-N-фукопентаоза I, лакто-N-фукопентаоза II, лакто-N-фукопентаоза III, лакто-N-фукопентаоза V), лакто-N-фукогексаоза, лакто-N-дифукогексаоза I, фукозиллакто-N-гексаоза, фукозиллакто-N-неогексаоза, дифукозиллакто-N-гексаоза I, дифукозиллакто-N-неогексаоза II и любая их комбинация. Без ограничений, накладываемых какой-либо конкретной теорией, считается, что фукозил-эпитоп фукозилированных олигосахаридов может выступать в качестве «ловушки» на поверхности слизистой оболочки.
Выражения «фукозилированные олигосахариды, содержащие 2’-фукозил-эпитоп» и «2-фукозилированные олигосахариды» включают фукозилированные олигосахариды с определенной гомологией формы, поскольку они содержат 2’-фукозил-эпитоп, следовательно, можно ожидать определенную гомологию функции.
Выражение «N-ацетилированный (-ые) олигосахарид (-ы)» подразумевает как «N-ацетиллактозамин», так и «олигосахарид (-ы), содержащий (-ие) N-ацетиллактозамин». Они являются нейтральными олигосахаридами, имеющими остаток N-ацетиллактозамина. Подходящими примерами являются LNT (лакто-N-тетраоза), пара-лакто-N-неогексаоза (пара-LNnH), LNnT (лакто-N-неотетраоза) и любые их комбинации. Другими примерами являются лакто-N-гексаоза, лакто-N-неогексаоза, пара-лакто-N-гексаоза, пара-лакто-N-неогексаоза, лакто-N-октаоза, лакто-N-неооктаоза, изо-лакто-N-октаоза, пара-лакто-N-октаоза и лакто-N-декаоза.
Выражения «по меньшей мере один фукозилированный олигосахарид» и «по меньшей мере один N-ацетилированный олигосахарид» означают «по меньшей мере один тип фукозилированного олигосахарида» и «по меньшей мере один тип N-ацетилированного олигосахарида».
«Предшественник ОГМ» представляет собой ключевое соединение, которое включается в выработку ОГМ, такое как сиаловая кислота и/или фукоза.
«Сиалилированный олигосахарид» представляет собой олигосахарид, содержащий заряженную сиаловую кислоту, т.е. олигосахарид, имеющий остаток сиаловой кислоты. Он имеет кислотный характер. Некоторые примеры представляют собой 3-SL (3’-сиалиллактозу) и 6-SL (6’-сиалиллактозу).
Питательная композиция настоящего изобретения может быть представлена в твердой форме (например, в порошке) или в жидкой форме. Количество различных ингредиентов (например, олигосахаридов) может выражаться в г/100 г композиции в расчете на массу сухого вещества, если она представлена в твердой форме, например в порошке, или как концентрация в г/л композиции, если она относится к жидкой форме (последний случай также включает жидкую композицию, которую можно получать из порошка после растворения в жидкости, например в молоке, воде и т.п., например растворенную детскую смесь, или смесь для прикармливаемых детей/смесь последующего уровня, или зерновой продукт для детского питания, или любую другую рецептуру, предназначенную для питания младенцев). Они также могут быть выражены в г/100 ккал.
Выражение «период отлучения от груди» означает период, в течение которого в рационе младенца или ребенка младшего возраста материнское молоко замещают другой пищей.
Выражения «в возрасте X дней/недель/месяцев/лет», «X дней/недель/месяцев/лет жизни» и «X дней/недель/месяцев/лет от рождения» могут использоваться взаимозаменяемо.
Под «материнским молоком» следует понимать грудное молоко или молозиво матери. HBM означает человеческое грудное молоко.
Выражения «младенцы/дети младшего возраста, вскармливаемые исключительно человеческим грудным молоком», «младенцы или дети младшего возраста на исключительно грудном вскармливании», «младенцы или дети младшего возраста, вскармливаемые исключительно грудным молоком» и «младенцы/дети младшего возраста на грудном вскармливании» могут использоваться взаимозаменяемо. Они означают младенцев или детей младшего возраста, получающих подавляющее большинство (т.е. по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 99%) или все (100%) питательные вещества и/или энергию из человеческого грудного молока.
Выражение «младенцы или дети младшего возраста, вскармливаемые исключительно питательными композициями» относится к младенцам или детям младшего возраста, получающим подавляющее большинство (т.е. по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 99%) или все (100%) питательные вещества и/или энергию из искусственных питательных композиций, таких как детская смесь, молочная смесь для прикармливаемых детей или молочная смесь для детей от 1 до 3 лет.
Выражение «младенцы или дети младшего возраста, вскармливаемые преимущественно питательными композициями» относится к младенцам или детям младшего возраста, получающим питательные вещества и/или энергию преимущественно из искусственных питательных композиций, таких как детская смесь, молочная смесь для прикармливаемых детей или молочная смесь для детей от 1 до 3 лет. «Преимущественно» означает по меньшей мере 50% (или по меньшей мере 60%, или по меньшей мере 75%) таких питательных веществ и/или энергии, например, от 50% до 90%, или от 60% до 80%.
Выражение «стимулирующий и/или индуцирующий» у младенцев или детей младшего возраста относительно определенной общей микробиоты кишечника означает развитие, увеличение, установление, появление и/или смещение конкретной общей микробиоты у указанных младенцев или детей младшего возраста.
Выражение «традиционная питательная композиция» означает стандартные искусственные питательные композиции, такие как детская смесь, молочная смесь для прикармливаемых детей или молочная смесь для детей от 1 до 3 лет, которые уже доступны на рынке. Выражение «традиционная питательная композиция без содержания указанных олигосахаридов» относится к стандартной питательной композиции, которая не содержит «по меньшей мере одного фукозилированного олигосахарида и по меньшей мере одного N-ацетилированного олигосахарида».
Термины «микробный», «микрофлора» и «микробиота» могут использоваться взаимозаменяемо.
Выражения «микробиота кишечника» и «кишечная микробиота» могут использоваться взаимозаменяемо.
Термины «глобальная», «общая», «целая», «полная» и «тотальная» могут использоваться взаимозаменяемо, особенно в выражении «общая микробиота». Выражение «общая микробиота кишечника» означает общую (или полную, целую, тотальную) микробиоту кишечника. Она включает в себя:
- композицию общей микробиоты, т.е. относительное таксономическое богатство (количество) и/или разнообразие полной микробиоты кишечника, иными словами, «количественные» и/или «качественные» аспекты микробиоты; и/или
- функцию общей микробиоты, т.е. активность и/или функциональность общей микробиоты кишечника, особенно метаболическую активность/функциональность. Ее можно оценить путем измерения относительной численности предсказанных генов по метагеному или методом количественного профилирования основных метаболитов, включая аминокислоты, основные органические кислоты (лактат, сукцинат, цитрат и т.п.) и/или углеводы.
Подходящая и здоровая кишечная микробиота является ключевым фактором для развития иммунной системы в слизистой оболочке младенца.
Выражение «дисбиоз микробиоты кишечника» означает микробный дисбаланс в кишечнике.
Выражение «профилактика и/или лечение дисбиоза микробиоты кишечника» включает в себя один или несколько вариантов из:
- профилактики дисбиоза микробиоты в кишечнике
- лечения дисбиоза микробиоты в кишечнике
- профилактики и лечения дисбиоза микробиоты в кишечнике.
Выражения «угнетение» и «уменьшение» могут использоваться взаимозаменяемо.
Под выражениями «проводить профилактику» или «профилактика» понимается избегание возникновения и/или уменьшение вероятности (т.е. снижение частоты) появления физического состояния, ситуации или их последствий.
Под выражениями «лечить» или «лечение» понимается уменьшение продолжительности и/или тяжести физического состояния, ситуации или их последствий.
Профилактика и/или лечение физического состояния, ситуации или их последствий может происходить в ходе лечения (т.е. в ходе введения композиции настоящего изобретения, либо непосредственно после начала введения, либо через некоторое время после начала, например, через несколько дней или недель после начала введения). Но это также может включать в себя профилактику и/или лечение указанных нарушений в дальнейшей жизни. Термин «в дальнейшей жизни» включает в себя эффект после прекращения вмешательства или лечения. Эффект «в дальнейшей жизни» может длиться от 1 недели до нескольких месяцев, например, от 2 до 4 недель, от 2 до 6 недель, от 2 до 8 недель, от 1 до 6 месяцев или от 2 до 12 месяцев.
Термин «пребиотик» означает неперевариваемые углеводы, которые благоприятно влияют на организм-хозяина, избирательно стимулируя рост и/или активность полезных для здоровья бактерий, например, бифидобактерий в толстом кишечнике человека (Gibson GR, Roberfroid MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr. 1995; 125:1401–12).
Термин «пробиотик» означает препараты из клеток микроорганизмов или компоненты клеток микроорганизмов, которые оказывают благоприятное воздействие на здоровье или самочувствие организма-хозяина. (Salminen S, Ouwehand A. Benno Y. et al. «Probiotics: how should they be defined» Trends Food Sci. Technol. 1999:10 107–10). Клетки микроорганизмов, по существу, представляют собой бактерии или дрожжи.
Под термином «КОЕ» следует понимать колониеобразующую единицу.
Если не указано иное, все приводимые процентные соотношения представляют собой мас.%.
Дополнительно в контексте изобретения термины «содержащий» или «содержит» не исключают других возможных элементов. Композиция настоящего изобретения, включая многие варианты осуществления, описанные в настоящем документе, может содержать существенные элементы и ограничения изобретения, описанные в настоящем документе, а также любые дополнительные или необязательные ингредиенты, компоненты или ограничения, описанные в настоящем документе, или иные в зависимости от потребностей, состоять или, по существу, состоять из них.
Любую ссылку на документы предшествующего уровня техники в данном описании не следует рассматривать как признание того, что такой предшествующий уровень техники является широкоизвестным или составляет часть общеизвестных знаний в области.
Ниже представлено более подробное описание изобретения. Следует отметить, что различные аспекты, признаки, примеры и варианты осуществления, описанные в настоящей заявке, могут быть совместимыми и/или комбинироваться друг с другом.
Следовательно, первым объектом настоящего изобретения является питательная композиция, содержащая по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид, для применения в стимуляции и/или индукции у младенцев или детей младшего возраста общей микробиоты кишечника, которая похожа на общую микробиоту кишечника у младенцев или детей младшего возраста, вскармливаемых исключительно человеческим грудным молоком, по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания указанных олигосахаридов.
Питательная композиция настоящего изобретения содержит по меньшей мере один фукозилированный олигосахарид. В ней может присутствовать один или несколько типов фукозилированного (-ых) олигосахарида (-ов). Фукозилированный (-е) олигосахарид (-ы) можно фактически выбирать из перечня, включающего в себя 2’-фукозиллактозу, 3’-фукозиллактозу, дифукозиллактозу, лакто-N-фукопентаозу (например, лакто-N-фукопентаозу I, лакто-N-фукопентаозу II, лакто-N-фукопентаозу III, лакто-N-фукопентаозу V), лакто-N-фукогексаозу, лакто-N-дифукогексаозу I, фукозиллакто-N-гексаозу, фукозиллакто-N-неогексаозу (например, фукозиллакто-N-неогексаозу I, фукозиллакто-N-неогексаозу II), дифукозиллакто-N-гексаозу I, дифуко-лакто-N-неогексаозу, дифукозиллакто-N-неогексаозу I, дифукозиллакто-N-неогексаозу II, фукозил-пара-лакто-N-гексаозу, три-фуко-пара-лакто-N-гексаозу I и любую их комбинацию.
В некоторых конкретных вариантах осуществления фукозилированный олигосахарид содержит 2’-фукозил-эпитоп. Например, его можно выбирать из перечня, включающего в себя 2’-фукозиллактозу, дифукозиллактозу, лакто-N-фукопентаозу, лакто-N-фукогексаозу, лакто-N-дифукогексаозу, фукозиллакто-N-гексаозу, фукозиллакто-N-неогексаозу, дифукозиллакто-N-гексаозу, дифуко-лакто-N-неогексаозу, дифукозиллакто-N-неогексаозу, фукозил-пара-лакто-N-гексаозу и любую их комбинацию.
В предпочтительном варианте осуществления питательная композиция в соответствии с изобретением содержит 2’-фукозиллактозу (или 2FL, или 2’FL, или 2-FL, или 2’-FL). В конкретном варианте осуществления не используется никакой другой тип фукозилированного олигосахарида, кроме 2’-фукозиллактозы, т.е. питательная композиция изобретения содержит только 2’-фукозиллактозу в качестве фукозилированного олигосахарида.
Фукозилированный (-ые) олигосахарид (-ы) может (могут) быть выделен (-ы) из природного источника, такого как молоко животных, методами хроматографии или фильтрации. В альтернативном варианте осуществления его можно получить с помощью биотехнологических средств с использованием специфических фукозилтрансфераз и/или фукозидаз, либо посредством применения метода ферментации на основе ферментов (рекомбинантных или природных ферментов), либо с помощью метода микробиологической ферментации. В последнем случае микроорганизмы могут экспрессировать свои природные ферменты и субстраты, или возможно создание микроорганизмов, вырабатывающих соответствующие субстраты и ферменты. Можно применять культуры из микроорганизмов одного вида и/или смешанные культуры. Образование фукозилированного олигосахарида может быть инициировано акцепторными субстратами, начиная с любой степени полимеризации (DP) от DP = 1 и далее. В альтернативном варианте осуществления фукозилированные олигосахариды можно получать с помощью химического синтеза из лактозы и свободной фукозы. Кроме того, в продаже доступны, например, фукозилированные олигосахариды производства компании Kyowa, Hakko, Kogyo, Япония.
Питательная композиция настоящего изобретения также содержит по меньшей мере один N-ацетилированный олигосахарид. В ней может присутствовать один или несколько типов N-ацетилированного (-ых) олигосахарида (-ов). N-ацетилированный (-ые) олигосахарид (-ы) может (могут) представлять собой, например, лакто-N-тетраозу (LNT), лакто-N-неотетраозу (LNnT) или любую их комбинацию. В некоторых конкретных вариантах осуществления N-ацетилированный олигосахарид представляет собой лакто-N-неотетраозу (LNnT), пара-лакто-N-неогексаозу (пара-LNnH) или любую их комбинацию. В некоторых конкретных вариантах осуществления N-ацетилированный олигосахарид представляет собой LNnT. В некоторых конкретных вариантах осуществления N-ацетилированный олигосахарид представляет собой LNT. В некоторых других конкретных вариантах осуществления N-ацетилированный олигосахарид представляет собой смесь LNT и LNnT. В некоторых конкретных вариантах осуществления композиция содержит как LNT, так и LNnT в соотношении LNT : LNnT от 5 : 1 до 1 : 2, или от 2 : 1 до 1 : 1, или от 2 : 1,2 до 2 : 1,6.
В предпочтительном варианте осуществления питательная композиция в соответствии с изобретением содержит лакто-N-неотетраозу (LNnT). В конкретном варианте осуществления не используется никакой другой тип N-ацетилированного олигосахарида, кроме лакто-N-неотетраозы (LNnT), т.е. питательная композиция изобретения содержит только лакто-N-неотетраозу (LNnT) в качестве N-ацетилированного олигосахарида.
N-ацетилированный (-ые) олигосахарид (-ы) можно синтезировать химическим путем с помощью ферментативного переноса сахаридных единиц с донорных фрагментов на акцепторные фрагменты с использованием гликозилтрансфераз, как описано, например, в патенте США № 5,288,637 и публикации WO 96/10086. В альтернативном варианте осуществления LNT и LNnT можно получить путем химического преобразования кетогексоз (например, фруктозы), либо свободных, либо связанных с олигосахаридом (например, лактулозой), в N-ацетилгексозамин или N-ацетилгексозамин-содержащий олигосахарид, как описано в работе Wrodnigg, T.M.; Stutz, A.E. (1999) Angew. Chem. Int. Ed. 38:827–828. Полученный таким образом N-ацетилгалактозамин можно затем переносить в качестве акцепторного фрагмента на лактозу.
В наиболее преимущественном варианте осуществления настоящего изобретения питательная композиция содержит 2’-фукозиллактозу (2FL) и лакто-N-неотетраозу (LNnT).
В другом конкретном варианте осуществления питательная композиция настоящего изобретения содержит смесь олигосахаридов, состоящую из 2’-фукозиллактозы (2-FL) и лакто-N-неотетраозы (LNnT). Иными словами, питательная композиция изобретения содержит только 2’-фукозиллактозу (2-FL) в качестве фукозилированного олигосахарида и только лакто-N-неотетраозу (LNnT) в качестве N-ацетилированного олигосахарида.
Фукозилированный (-ые) олигосахарид (-ы) может (могут) присутствовать в питательной композиции в соответствии с настоящим изобретением в общем количестве 0,8–1,5 г/л композиции. В некоторых вариантах осуществления фукозилированный (-ые) олигосахарид (-ы) может (могут) присутствовать в общем количестве 0,85–1,3 г/л композиции, например, 0,9–1,25 г/л, или 0,9–1,1 г/л, или 1–1,25 г/л, или 1–1,2 г/л композиции.
Фукозилированный (-ые) олигосахарид (-ы) может (могут) присутствовать в питательной композиции в общем количестве 0,55–1,05 г/100 г композиции в расчете на массу сухого вещества. Фукозилированный (-ые) олигосахарид (-ы) может (могут) присутствовать в общем количестве 0,66–1 г/100 г композиции, например, 0,70–0,97 г/100 г, или 0,70–0,85 г/100 г, или 0,78–0,97 г/100 г или 0,78–0,93 г/100 г композиции.
N-ацетилированный (-ые) олигосахарид (-ы) может (могут) присутствовать в питательной композиции в соответствии с настоящим изобретением в общем количестве 0,5–0,8 г/л композиции.
В некоторых вариантах осуществления N-ацетилированный (-ые) олигосахарид (-ы) может (могут) присутствовать в общем количестве 0,5–0,75 г/л, или 0,5–0,7 г/л, или 0,5–0,6 г/л композиции.
N-ацетилированный (-ые) олигосахарид (-ы) может (могут) присутствовать в питательной композиции в общем количестве 0,39–0,62 г/100 г композиции в расчете на массу сухого вещества, например, 0,39–0,58 г/100 г композиции, или 0,39–0,54 г/100 г или 0,39–0,47 г/100 г.
Все эти разные диапазоны можно комбинировать.
Следовательно, в одном варианте осуществления настоящего изобретения питательная композиция содержит по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид, причем:
- фукозилированный (-ые) олигосахарид (-ы) присутствует (-ют) в общем количестве 0,8–1,5 г/л композиции и/или в общем количестве 0,62–1,16 г/100 г композиции в расчете на массу сухого вещества; и/или
- N-ацетилированный (-ые) олигосахарид (-ы) присутствует (-ют) в общем количестве 0,5–0,8 г/л композиции и/или в общем количестве 0,39–0,62 г/100 г композиции в расчете на массу сухого вещества.
В другом конкретном варианте осуществления питательная композиция настоящего изобретения содержит по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид, причем:
- фукозилированный (-ые) олигосахарид (-ы) присутствует (-ют) в общем количестве 0,9–1,25 г/л композиции и/или в общем количестве 0,70–0,97 г/100 г композиции в расчете на массу сухого вещества; и/или
- N-ацетилированный (-ые) олигосахарид (-ы) присутствует (-ют) в общем количестве 0,5–0,7 г/л композиции и/или в общем количестве 0,39–0,54 г/100 г композиции в расчете на массу сухого вещества.
В другом конкретном варианте осуществления питательная композиция настоящего изобретения содержит по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид, причем:
- фукозилированный (-ые) олигосахарид (-ы) присутствует (-ют) в общем количестве 1–1,2 г/л композиции и/или в общем количестве 0,78–0,93 г/100 г композиции в расчете на массу сухого вещества; и/или
- N-ацетилированный (-ые) олигосахарид (-ы) присутствует (-ют) в общем количестве 0,5–0,6 г/л композиции и/или в общем количестве 0,39–0,47 г/100 г композиции в расчете на массу сухого вещества.
Фукозилированный олигосахарид (-ы) и N-ацетилированный олигосахарид (-ы), включенные в питательную композицию в соответствии с изобретением, как правило, присутствуют в соотношении фукозилированный (-ый) олигосахарид (-ы): N-ацетилированный (-ые) олигосахарид (-ы) от 2 : 0,54 до 2 : 2,26, например от 2 : 0,76 до 2 : 1,8 или от 2 : 0,8 до 2 : 1,4. В особенно преимущественном варианте осуществления такое соотношение составляет 2 : 1 или примерно 2 : 1.
Питательная композиция в соответствии с настоящим изобретением может также содержать по меньшей мере другой (-ие) олигосахарид (-ы) (т.е. отличные от фукозилированного (-ых) олигосахарида (-ов) и N-ацетилированного (-ых) олигосахарида (-ов), которые в обязательном порядке присутствуют в композиции) и/или по меньшей мере клетчатку и/или по меньшей мере их предшественник (-и). Другой олигосахарид и/или клетчатка и/или их предшественник могут быть выбраны из перечня, включающего галактоолигосахариды (ГОС), фруктоолигосахариды (ФОС), инулин, ксилоолигосахариды (КОС), полидекстрозу, сиалилированные олигосахариды, сиаловую кислоту, фукозу и любую их комбинацию. Они могут присутствовать в количестве от 0 до 10 мас.% композиции.
Подходящие доступные в продаже продукты, которые можно применять дополнительно к олигосахаридам, содержащимся в смеси олигосахаридов, для получения питательных композиций в соответствии с изобретением, включают в себя комбинации ФОС с инулином, например, продукт, продаваемый компанией BENEO под товарным знаком Orafti, или полидекстрозу, продаваемую компанией Tate & Lyle под товарным знаком STA-LITE®.
В одном конкретном варианте осуществления питательная композиция в соответствии с изобретением может содержать по меньшей мере около 0,4 г или по меньшей мере 0,7 г олигофруктозы на 100 ккал композиции, например, от около 0,4 до около 0,9 г, от около 0,4 до около 0,7 г, от около 0,4 до около 0,5 г, от около 0,7 до около 0,8 г, или от около 0,7 до около 0,9 г олигофруктозы на 100 ккал.
В некоторых вариантах осуществления олигофруктоза имеет степень полимеризации от 2 до 10. В некоторых вариантах осуществления по меньшей мере 80%, 90%, 95%, 99% или 100% олигофруктозы имеют степень полимеризации от 2 до 8 (в диапазоне от 2 до 8).
В конкретном варианте осуществления питательная композиция в соответствии с изобретением может содержать ГОС. «Галактоолигосахарид» представляет собой олигосахарид, который содержит две или более незаряженных молекул галактозы и не содержит остатка N-ацетила. Подходящие галактоолигосахариды, которые также можно добавлять в питательную композицию в соответствии с настоящим изобретением, включают в себя Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,4Glc, Galβ1,3Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,3Glc, Galβ1,4Galβ1,4Glc и Galβ1,4Galβ1,4Galβ1,4Glc, а также любую их смесь. Синтезированные галактоолигосахариды, такие как Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,6Glc, Galβ1,3Galβ1,4Glc, Galβ1,6Galβ1,6Galβ1,4Glc, Galβ1,6Galβ1,3Galβ1,4Glc, Galβ1,3Galβ1,6Galβ1,4Glc, Galβ1,4Galβ1,4Glc и Galβ1,4Galβ1,4Galβ1,4Glc и их смеси, доступны в продаже под товарными знаками Vivinal ® и Elix’or®. Другими поставщиками олигосахаридов являются компании Dextra Laboratories, Sigma-Aldrich Chemie GmbH и Kyowa Hakko Kogyo Co., Ltd. В альтернативном варианте осуществления для получения нейтральных олигосахаридов можно применять специфические гликозилтрансферазы, такие как галактозилтрансферазы.
В конкретном варианте осуществления питательная композиция может также содержать по меньшей мере один олигосахарид коровьего молока. Можно применять традиционные технологии фракционирования и обогащения фракций коровьего молока в олигосахаридах из коровьего молока (такие традиционные технологии включают в себя колонную экстракцию, фильтрацию с помощью смол, нанофильтрацию, специальную ферментную обработку бета-галактозидазой, осаждение белков, кристаллизацию и отделение лактозы и т.п.). Некоторые фракции коровьего молока, обогащенные олигосахаридами, доступны в продаже или описаны, например, в публикации EP2526784 A1.
В конкретном варианте осуществления питательная композиция может также дополнительно содержать смесь олигосахаридов (BMOS), которая содержит от 0,1 до 4,0 мас.% N-ацетилированного (-ых) олигосахарида (-ов), от 92,0 до 98,5 мас.% галактоолигосахарида (-ов) и от 0,3 до 4,0 мас.% сиалилированного (-ых) олигосахарида (-ов).
В конкретном варианте осуществления питательная композиция в соответствии с изобретением может содержать сиалилированный (-ые) олигосахарид (-ы). В ней может присутствовать один или несколько сиалилированных олигосахаридов.
Сиалилированный (-е) олигосахарид (-ы) можно выбирать из группы, включающей в себя 3’-сиалиллактозу (3-SL), 6’-сиалиллактозу (6-SL) и любую их комбинацию. В некоторых вариантах осуществления изобретения композиция содержит 3-SL и 6-SL. В некоторых конкретных вариантах осуществления соотношение 3’-сиалиллактозы (3-SL) и 6’-сиалиллактозы (6-SL) может находиться в диапазоне от 5 : 1 до 1 : 10, либо от 3 : 1 до 1 : 1, либо от 1 : 1 до 1 : 10. В некоторых конкретных вариантах осуществления сиалилированный олигосахарид композиции представляет собой 6'-сиалиллактозу (6-SL).
Сиалилированный (-ые) олигосахарид (-ы) может (могут) быть выделен (-ы) из природного источника, такого как молоко животных, методами хроматографии или фильтрации. В альтернативном варианте осуществления их можно получать с помощью биотехнологических средств с использованием специфических сиалилтрансфераз или сиалидаз, нейраминидаз, посредством метода ферментации на основе ферментов (рекомбинантных или природных ферментов), путем химического синтеза или метода микробиологической ферментации. В последнем случае микроорганизмы могут экспрессировать свои природные ферменты и субстраты, или можно создавать микроорганизмы, вырабатывающие соответствующие субстраты и ферменты. Можно применять культуры микроорганизмов одного вида или смешанные культуры. Образование сиалилолигосахаридов можно инициировать акцепторными субстратами, начиная с любой степени полимеризации (DP) от DP = 1 и далее. Альтернативно сиалиллактозы можно получать путем химического синтеза из лактозы и свободной N’-ацетилнейраминовой кислоты (сиаловой кислоты). Сиалиллактозы также доступны в продаже, например, от компании Kyowa Hakko Kogyo, Япония.
В конкретных примерах композиция может содержать от 0,05 до 5 г/л сиалилированного (-ых) олигосахарида (-ов), или от 0,1 до 4 г/л, или от 0,3 до 2 г/л, или от 0,4 до 1,5 г/л, или от 0,4 до 1 г/л, например, 0,5 или 0,9 г/л сиалилированного (-ых) олигосахарида (-ов). В некоторых конкретных вариантах осуществления композиция может содержать от 0,8 до 1,7 г/л сиалилированного (-ых) олигосахарида (-ов).
Композиция в соответствии с изобретением может содержать 0,03–3,88 г сиалилированного (-ых) олигосахарида (-ов) на 100 г композиции в расчете на массу сухого вещества, например, 0,08–3,10 г, или 0,23–1,55 г, или 0,31–1,16 г, или 0,31–0,77 г, или 0,39–0,7 г, 0,62–1,32 г сиалилированного (-ых) олигосахарида (-ов) на 100 г композиции в расчете на массу сухого вещества.
В некоторых конкретных вариантах осуществления настоящего изобретения питательная композиция содержит сиалилированный (-ые) олигосахарид (-ы) в количестве менее 0,1 г/100 г композиции в расчете на массу сухого вещества.
В некоторых конкретных вариантах осуществления настоящего изобретения питательная композиция не содержит каких-либо сиалилированных олигосахаридов.
Композиция в соответствии с настоящим изобретением может также необязательно содержать по меньшей мере один предшественник олигосахарида. В ней может присутствовать один или несколько предшественников олигосахарида. Например, предшественником олигосахарида грудного молока является сиаловая кислота, фукоза или их смесь. В некоторых конкретных вариантах осуществления композиция содержит сиаловую кислоту.
В конкретных примерах композиция содержит от 0 до 3 г/л предшественника (-ов) олигосахарида, или от 0 до 2 г/л, или от 0 до 1 г/л, или от 0 до 0,7 г/л, или от 0 до 0,5 г/л, или от 0 до 0,3 г/л, или от 0 до 0,2 г/л предшественника (-ов) олигосахарида.
Композиция в соответствии с изобретением может содержать от 0 до 2,1 г предшественника (-ов) олигосахарида на 100 г композиции в расчете на массу сухого вещества, например, от 0 до 1,5 г, или от 0 до 0,8 г, или от 0 до 0,15 г предшественника (-ов) олигосахарида на 100 г композиции в расчете на массу сухого вещества.
Питательная композиция настоящего изобретения может дополнительно содержать по меньшей мере один пробиотик (или пробиотический штамм), такой как пробиотический бактериальный штамм.
Чаще всего применяются пробиотические микроорганизмы, которые главным образом представляют собой бактерии и дрожжи следующих родов: Lactobacillus spp., Streptococcus spp., Enterococcus spp., Bifidobacterium spp. и Saccharomyces spp.
В некоторых конкретных вариантах осуществления пробиотик представляет собой пробиотический бактериальный штамм. В частности, в некоторых конкретных вариантах осуществления это Bifidobacteria и/или Lactobacilli.
Подходящие пробиотические бактериальные штаммы включают в себя Lactobacillus rhamnosus, ATCC 53103, от компании Valio Oy, Финляндия, под торговой маркой LGG; Lactobacillus rhamnosus, CGMCC 1.3724, Lactobacillus paracasei, CNCM I-2116, Lactobacillus johnsonii, CNCM I-1225, Streptococcus salivarius, DSM 13084, продаваемые компанией BLIS Technologies Limited, Новая Зеландия, под названием KI2; Bifidobacterium lactis, CNCM 1-3446, продаваемый, в числе прочих, компанией Christian Hansen, Дания, под торговой маркой Bb 12; Bifidobacterium longum, ATCC BAA-999, продаваемый компанией Morinaga Milk Industry Co. Ltd., Япония, под торговой маркой BB536; Bifidobacterium breve, продаваемый компанией Danisco под торговой маркой Bb-03; Bifidobacterium breve, продаваемый компанией Morinaga под торговой маркой M-16V; Bifidobacterium infantis, продаваемый компанией Procter & GambIe Co. под торговой маркой Bifantis; и Bifidobacterium breve, продаваемый компанией Institut Rosell (г. Лаллеманд) под торговой маркой R0070.
В одном конкретном варианте осуществления пробиотик представляет собой Bifidobacterium lactis, например, Bifidobacterium lactis CNCM 1-3446.
Питательная композиция в соответствии с изобретением может содержать от 10e3 до 10e12 КОЕ пробиотического штамма, более предпочтительно от 10e7 до 10e12 КОЕ, например, от 10e8 до 10e10 КОЕ пробиотического штамма на грамм композиции в расчете на массу сухого вещества.
В одном варианте осуществления пробиотики являются жизнеспособными. В другом варианте осуществления пробиотики являются неразмножающимися или инактивированными. В некоторых других вариантах осуществления можно использовать как жизнеспособные пробиотики, так и инактивированные пробиотики.
Питательная композиция изобретения может дополнительно содержать по меньшей мере один фаг (бактериофаг) или смесь фагов, предпочтительно направленных против патогенных микроорганизмов Streptococci, Haemophilus, Moraxella и Staphylococci.
Питательная композиция в соответствии с изобретением может, например, представлять собой детскую смесь, начальную детскую смесь, смесь для прикармливаемых детей или смесь последующего уровня, смесь для недоношенных детей, детское питание, детскую композицию на зерновой основе, обогатитель, такой как обогатитель грудного молока, или добавку. В некоторых конкретных вариантах осуществления композиция изобретения представляет собой детскую смесь, обогатитель или добавку, которые могут предназначаться для первых 4 или 6 месяцев жизни. В предпочтительном варианте осуществления питательная композиция изобретения представляет собой детскую смесь.
В некоторых других вариантах осуществления питательная композиция настоящего изобретения представляет собой обогатитель. Обогатитель может представлять собой обогатитель грудного молока (например, обогатитель человеческого грудного молока) или обогатитель смеси, такой как обогатитель детской смеси или обогатитель смеси для прикармливаемых детей/смеси последующего уровня.
Если питательная композиция представляет собой добавку, она может быть обеспечена в форме стандартных доз.
Питательная композиция настоящего изобретения может быть представлена в твердой (например, порошок), жидкой или желеобразной форме.
Питательная композиция в соответствии с изобретением, по существу, содержит источник белка. Белок может содержаться в количестве от 1,6 до 3 г на 100 ккал. В некоторых вариантах осуществления, в частности, когда композиция предназначена для преждевременно родившихся младенцев, такое количество может составлять от 2,4 до 4 г/100 ккал или более 3,6 г/100 ккал. В некоторых других вариантах осуществления количество белка может составлять менее 2,0 г на 100 ккал, например, от 1,8 до 2,1 г/100 ккал, или 1,8–2 г/100 ккал, или 1,9–2,1 г белка на 100 ккал, или количество может составлять менее 1,8 г на 100 ккал, например, 1,4–1,8 г/100 ккал или 1,5–1,7 г/100 ккал.
Тип белка не считается критическим для настоящего изобретения, при условии, что соблюдены минимальные требования к содержанию незаменимых аминокислот и обеспечивается удовлетворительной рост. Таким образом, можно применять источники белка на основе молочной сыворотки, казеина и их смесей, а также источники белка на основе сои. Что касается сывороточных белков, источник белка может быть основан на кислой сыворотке или сладкой молочной сыворотке или их смесях и может включать альфа-лактальбумин и бета-лактоглобумин в любых желаемых пропорциях. «Альфа-лактальбумин» относится к высококачественному легкоперевариваемому сывороточному белку, который составляет 20–25% от общего количества белка человеческого грудного молока (HBM) и является основным белком, присутствующим в HBM. Структура альфа-лактальбумина состоит из 123 аминокислот и 4 дисульфидных мостиков, а молекулярная масса белка составляет 14,2 килодальтона. Благодаря высокому содержанию незаменимых аминокислот, особенно триптофана, альфа-лактальбумин идеально подходит для детских смесей с пониженным содержанием белка. В одном варианте осуществления питательная композиция настоящего изобретения содержит альфа-лактальбумин в количестве от около 0,2 до около 0,4 г/100 ккал питательной композиции, или в количестве по меньшей мере 1,7 г/л, или по меньшей мере 2,0 г/л или по меньшей мере 2,3 г/л, или по меньшей мере 2,6 г/л питательной композиции.
В некоторых преимущественных вариантах осуществления в источнике белка преобладает молочная сыворотка (т.е. более 50% белков происходят из сывороточных белков, например, 60% или 70%).
Белки могут быть нативными или гидролизованными, либо они могут представлять собой смесь нативных и гидролизованных белков. Под термином «нативный» подразумевается, что основная часть белков нативна, т.е. их молекулярная структура не изменена, например, не изменено по меньшей мере 80% белков, например, не изменено по меньшей мере 85% белков, предпочтительно не изменено по меньшей мере 90% белков, еще более предпочтительно не изменено по меньшей мере 95% белков, например, не изменено по меньшей мере 98% белков. В конкретном варианте осуществления 100% белков не изменено.
Термин «гидролизованный» в контексте настоящего изобретения означает белок, который был гидролизован или расщеплен на составляющие его аминокислоты.
Белки могут быть полностью (т.е. глубоко) или частично гидролизованными. Может быть желательно вводить частично гидролизованные белки (степень гидролиза от 2 до 20%), например, младенцам или детям младшего возраста, предположительно подверженным риску развития аллергии на коровье молоко. При необходимости использования гидролизованных белков процесс гидролиза может проводиться по желанию и способом, известным в данной области. Например, гидролизаты сывороточного белка можно получить ферментативным гидролизом фракции молочной сыворотки в одну или более стадий. Если фракция молочной сыворотки, применяемая в качестве исходного материала, по существу, не содержит лактозы, то установлено, что в процессе гидролиза блокировка лизина белка проявляется в гораздо меньшей степени. Это позволяет снизить степень блокировки лизина с около 15 мас.% общего лизина до менее около 10 мас.% лизина; например около 7 мас.% лизина, что значительно улучшает питательное качество источника белка.
В одном варианте осуществления изобретения гидролизовано по меньшей мере 70% белков, предпочтительно гидролизовано по меньшей мере 80% белков, например, гидролизовано по меньшей мере 85% белков, даже более предпочтительно гидролизовано по меньшей мере 90% белков, например, гидролизовано по меньшей мере 95% белков, в частности гидролизовано по меньшей мере 98% белков. В конкретном варианте осуществления 100% белков гидролизовано.
В одном конкретном варианте осуществления белки питательной композиции гидролизованы, полностью гидролизованы или частично гидролизованы. Степень гидролиза (DH) белка может составлять от 8 до 40, или от 20 до 60, или от 20 до 80 или более 10, 20, 40, 60, 80 или 90.
В конкретном варианте осуществления питательная композиция в соответствии с изобретением представляет собой гипоаллергенную композицию. В другом конкретном варианте осуществления композиция в соответствии с изобретением представляет собой гипоаллергенную питательную композицию.
Питательная композиция в соответствии с настоящим изобретением, по существу, содержит источник углеводов. Это особенно предпочтительно в том случае, когда питательная композиция изобретения представляет собой детскую смесь. В этом случае можно применять любой источник углеводов, традиционно предусмотренный в детских смесях, такой как лактоза, сукроза, сахароза, мальтодекстрин, крахмал и их смеси, хотя одним из предпочтительных источников углеводов является лактоза.
Питательная композиция в соответствии с настоящим изобретением, по существу, содержит источник липидов. Это особенно важно, если питательная композиция изобретения представляет собой детскую смесь. В этом случае источником липидов может представлять собой любой липид или жир, который подходит для применения в детских смесях. Некоторые подходящие источники жира включают в себя пальмовое масло, подсолнечное масло с высоким содержанием олеиновой кислоты и сафлоровое масло с высоким содержанием олеиновой кислоты. Можно также добавлять незаменимые жирные кислоты — линолевую кислоту и α-линоленовую кислоту, а также небольшие количества масел, содержащих большие количества арахидоновой кислоты и докозагексаеновой кислоты в готовом виде, например, рыбьи жиры или микробные масла. Соотношение n-6 и n-3 жирных кислот в источнике жира может составлять от около 5 : 1 до около 15 : 1; например, от около 8 : 1 до около 10 : 1.
В одном варианте осуществления питательная композиция настоящего изобретения содержит триглицериды с высоким содержанием sn-2-пальмитата, предпочтительно триглицериды, имеющие более 33% пальмитиновых кислот в положении sn-2.
В одном варианте осуществления питательная композиция настоящего изобретения содержит около 5 или 6 г на 100 ккал жира, и, например, по меньшей мере около 7,5 мас.% этого жира, например, около 7,5–12,0%, состоят из пальмитиновой кислоты в положении sn-2.
В одном варианте осуществления изобретения композиция содержит по меньшей мере 7,5%, предпочтительно 8%, более предпочтительно по меньшей мере 9,6% жира, представляющего собой sn-2 пальмитат, например около 7,8–11,8%, около 8,0–11,5 мас.%, около 8,5–11,0% или около 9,0–10,0 мас.% жира представляют собой пальмитиновую кислоту в положении sn-2 триглицерида.
В некоторых вариантах осуществления пальмитиновая кислота составляет от около 15 до около 25%, например от около 15 до около 20 мас.%, от общего содержания жирных кислот в смеси, и по меньшей мере от около 30%, например от около 35, до около 43% от общего содержания пальмитиновой кислоты находятся в положении sn-2.
В продаже доступна композиция BetapolTM B-55 от компании Lipid Nutrition, которая представляет собой смесь триглицеридов, полученную из растительного масла, в которой по меньшей мере 54% пальмитиновой кислоты находятся в положении sn-2 молекулы глицерина. В одном варианте осуществления содержание жира питательной композиции изобретения — около 40–50 мас.% BetapolTM B-55, например от около 43% до около 45 мас.%. Для специалистов в данной области очевидно, что процентное содержание используемого жира с высоким содержанием sn-2-пальмитата и общее количество sn-2-пальмитата в смеси может варьироваться и что можно использовать другое масло с содержанием sn-2-пальмитата без отступления от сущности и объема изобретения.
Питательная композиция изобретения может также содержать все витамины и минеральные вещества, которые считаются обязательными в повседневном пищевом рационе, в значимых с точки зрения питания количествах. Для некоторых витаминов и минеральных веществ установлены минимальные требования. Примеры минеральных веществ, витаминов и других питательных веществ, которые необязательно присутствуют в композиции изобретения, включают в себя витамин А, витамин В1, витамин В2, витамин В6, витамин В12, витамин Е, витамин К, витамин С, витамин D, фолиевую кислоту, инозит, ниацин, биотин, пантотеновую кислоту, холин, кальций, фосфор, йод, железо, магний, медь, цинк, марганец, хлор, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минеральные вещества обычно добавляют в форме соли. Присутствие и количества конкретных минеральных веществ и других витаминов будут варьироваться в зависимости от целевой популяции.
При необходимости питательная композиция изобретения может содержать эмульгаторы и стабилизаторы, такие как соя, лецитин, сложноэфирные моно- и диглицериды лимонной кислоты и т.п.
Питательная композиция изобретения может также содержать другие вещества, которые могут оказывать благоприятное воздействие, такие как лактоферрин, нуклеотиды, нуклеозиды и т.п.
Питательная композиция изобретения также может содержать каротиноид (-ы). В некоторых конкретных вариантах осуществления изобретения питательная композиция изобретения не содержит каротиноидов.
Питательную композицию в соответствии с изобретением можно получать любым подходящим способом. Далее композиция будет описана на конкретном примере.
Например, смесь, такую как детская смесь, можно получать путем смешивания источника белка, источника углеводов и источника жира в соответствующих пропорциях. На данной стадии можно добавлять эмульгаторы в случае их применения. На данной стадии можно добавлять витамины и минеральные вещества, но обычно их добавляют позднее для предотвращения термического разложения. Перед перемешиванием в источнике жира можно растворять любые липофильные витамины, эмульгаторы и т.п. Затем можно примешивать воду, предпочтительно воду, очищенную обратным осмосом, с образованием жидкой смеси. Температура воды для удобства находится в диапазоне от около 50°C до около 80°C, чтобы облегчать диспергирование ингредиентов. Для образования жидкой смеси можно применять доступные в продаже разжижители.
На данной стадии можно добавлять фукозилированный (-ые) олигосахарид (-ы) и N-ацетилированный (-ые) олигосахарид (-ы), особенно если конечный продукт должен иметь жидкую форму. Если конечный продукт должен представлять собой порошок, эти элементы при необходимости также можно добавлять на данной стадии.
Затем жидкую смесь гомогенизируют, например, в две стадии.
Затем жидкую смесь можно термически обрабатывать для снижения бактериальной нагрузки путем быстрого нагрева жидкой смеси, например, до температуры в диапазоне от около 80°C до около 150°C, в течение периода времени от около 5 секунд до около 5 минут. Это можно осуществлять путем нагнетания пара, с помощью автоклава или теплообменника, например, пластинчатого теплообменника.
Затем жидкую смесь можно охлаждать до температуры от около 60°C до около 85°C, например, путем мгновенного охлаждения. Затем жидкую смесь можно снова гомогенизировать, например, в две стадии: под давлением в диапазоне от около 10 МПа до около 30 МПа на первой стадии и от около 2 МПа до около 10 МПа на второй стадии. Затем гомогенизированную смесь можно дополнительно охлаждать для добавления любых термочувствительных компонентов, например, витаминов и минеральных веществ. На данной стадии для удобства регулируют рН и содержание твердых веществ в гомогенизированной смеси.
Если конечный продукт должен представлять собой порошок, гомогенизированную смесь переносят в подходящий сушильный аппарат, такой как распылительная сушилка или сублимационная сушилка, и превращают в порошок. Влагосодержание порошка должно составлять менее около 5 мас.%. Альтернативно на данной стадии также можно добавлять фукозилированный (-ые) олигосахарид (-ы) и N-ацетилированный (-ые) олигосахарид (-ы) путем сухого смешивания или путем перемешивания их в форме сиропа из кристаллов вместе с пробиотическим (-ими) штаммом (-ами) (при наличии), и смесь подвергают распылительной сушке или сублимационной сушке.
Если предпочтительна жидкая композиция, гомогенизированную смесь можно стерилизовать, а затем асептически разливать в подходящие контейнеры или можно сначала разливать в контейнеры, а затем стерилизовать в автоклаве.
В другом варианте осуществления композиция изобретения может представлять собой добавку.
Добавка может быть представлена, например, в форме таблеток, капсул, пастилок или жидкости. Добавка может дополнительно содержать защитные гидроколлоиды (такие как камеди, белки, модифицированные крахмалы), связующие вещества, пленкообразующие агенты, инкапсулирующие агенты/материалы, материалы стенок/оболочек, матричные соединения, покрытия, эмульгаторы, поверхностно-активные агенты, солюбилизирующие агенты (масла, жиры, воски, лецитины и т.п.), адсорбенты, носители, наполнители, вспомогательные соединения, диспергирующие агенты, увлажняющие агенты, технологические добавки (растворители), антислеживающие агенты, маскирующие вкус агенты, утяжеляющие агенты, желирующие агенты и гелеобразующие агенты. Добавка также может содержать традиционные фармацевтические добавки и адъюванты, эксципиенты и разбавители, включая, без ограничений, воду, желатин любого происхождения, растительные камеди, лигнинсульфонат, тальк, сахара, крахмал, гуммиарабик, растительные масла, полиалкиленгликоли, ароматизирующие агенты, консерванты, стабилизаторы, эмульгирующие агенты, буферы, смазывающие вещества, красители, увлажняющие агенты, наполнители и т.п.
Дополнительно добавка может содержать органический или неорганический материал-носитель, подходящий для перорального или парентерального введения, а также витамины, минеральные микроэлементы и другие микроэлементы в соответствии с рекомендациями государственных органов, такими как рекомендуемые нормы потребления (RDA) США.
Питательная композиция в соответствии с изобретением подходит для применения у младенцев или детей младшего возраста. Особенно она рассчитана на младенцев в возрасте менее 6 месяцев.
Младенцы или дети младшего возраста могут рождаться в срок или могут быть недоношенными. В конкретном варианте осуществления питательная композиция изобретения предназначена для применения у младенцев или детей младшего возраста, которые были рождены недоношенными. В конкретном варианте осуществления питательная композиция изобретения предназначена для применения у недоношенных младенцев.
В одном варианте осуществления питательная композиция настоящего изобретения может также применяться у младенцев или детей младшего возраста, которые родились маленькими для своего гестационного возраста или имели низкий вес при рождении.
Младенцы или дети младшего возраста с низким весом при рождении могут быть или не быть недоношенными, и, таким же образом, младенцы или дети младшего возраста, маленькие для своего гестационного возраста, могут быть или не быть недоношенными.
Питательная композиция настоящего изобретения может также применяться у младенцев или детей младшего возраста, рожденных посредством кесарева сечения или посредством вагинальных родов.
Все младенцы и дети младшего возраста могут получать пользу от изобретения, поскольку все они являются или могут быть в определенном возрасте подвержены возникновению дисбаланса кишечной микробиоты.
В некоторых преимущественных вариантах осуществления изобретения питательная композиция предназначена для применения у младенцев или детей младшего возраста, имеющих ослабленную или несбалансированную микробиоту или дисбиоз микробиоты, например недоношенных младенцев, младенцев, рожденных посредством кесарева сечения, младенцев, рожденных маленькими для своего гестационного возраста или с низким весом при рождении, госпитализированных младенцев/детей младшего возраста, младенцев/детей младшего возраста, получавших или получающих лечение антибиотиками, и/или младенцев/детей младшего возраста, страдающих или страдавших от кишечной инфекции и/или воспаления кишечника.
Действительно, ожидается, что еще большую пользу композиция изобретения может принести младенцам, рожденным с возможным нарушением кишечной микробиоты, или ослабленным младенцам/детям младшего возраста (таким как преждевременно родившиеся младенцы и/или младенцы, рожденные посредством кесарева сечения). Кроме того, ожидается, что еще большую пользу композиция изобретения может принести младенцам/детям младшего возраста, у которых наблюдаются кишечные расстройства (такие как диарея, инфекции или колики), особенно после рождения, например, в течение первых 4 недель после рождения.
В вариантах осуществления изобретения целью для терапии композицией настоящего изобретения являются младенцы, родившиеся недоношенными или родившиеся посредством кесарева сечения, или родившиеся маленькими для своего гестационного возраста, или имевшие низкий вес при рождении, или проявляющие дисбаланс или аномальную кишечную микробиоту, страдающие или страдавшие от кишечной инфекции и/или воспаления кишечника, особенно если возраст младенцев составляет 0–6 месяцев. Без ограничений, накладываемых какой-либо конкретной теорией, считается, что младенцы младшего возраста получают еще большую пользу от композиции настоящего изобретения, особенно если младенцы имеют (или подвержены риску иметь) несбалансированную кишечную микробиоту и/или имеют ослабленное состояние здоровья (примерами которого являются вышеприведенные состояния).
У таких младенцев особый интерес представляет приобретение кишечной микробиоты, которая похожа на кишечную микробиоту младенцев на грудном вскармливании (предпочтительно находящихся исключительно на грудном вскармливании). Действительно, это обеспечивает им нормальное количество необходимых для здоровья элементов, что может быть полезным, особенно для таких ослабленных младенцев.
Возраст для введения (или применения, или скармливания) питательной композиции, а также продолжительность такого введения зависят от потребностей.
В одном варианте осуществления возраст младенцев и детей младшего возраста составляет 0–36 месяцев, например, 0–12 месяцев или 0–6 месяцев. Ожидается, еще большую пользу композиция изобретения может принести новорожденным младенцам (в возрасте 0–4 недель или 0–8 недель), поскольку их кишечный тракт может быть более ослабленным.
В некоторых конкретных вариантах осуществления питательная композиция может представлять собой детскую смесь, и она может специально предназначаться для младенцев в возрасте от 0 до 12 месяцев, вскармливаемых преимущественно детской смесью.
В некоторых преимущественных вариантах осуществления питательную композицию можно, например, давать младенцам сразу же после рождения. Композицию изобретения также можно давать в течение первой недели жизни младенца, или в течение первых 2 недель жизни, или в течение первых 3 недель жизни, или в течение первого месяца жизни, или в течение первых 2 месяцев жизни, или в течение первых 3 месяцев жизни, или в течение первых 4 месяцев жизни, или в течение первых 6 месяцев жизни, или в течение первых 8 месяцев жизни, или в течение первых 10 месяцев жизни, или в течение первого года жизни, или в течение первых двух лет жизни, или даже в течение более длительного периода времени. В ряде конкретных преимущественных вариантов осуществления изобретения питательную композицию дают (или вводят) младенцу в период первых 4–6 месяцев после рождения указанного младенца.
В некоторых других вариантах осуществления питательную композицию изобретения дают в течение несколько дней (например, 1, 2, 3, 5, 10, 15, 20 и т.п.), или нескольких недель (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.п.), или нескольких месяцев (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 и т.п.) после рождения.
В зависимости от потребностей питательную композицию настоящего изобретения можно давать в течение нескольких дней (1, 2, 3, 4, 5, 6 и т.п.), или в течение нескольких недель (1, 2, 3, 4, 5, 6, 7, 8 или даже более), или в течение нескольких месяцев (1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или даже более).
В некоторых вариантах осуществления композиция в соответствии с изобретением может быть предназначена для применения до и/или во время периода отлучения от груди.
В одном варианте осуществления композицию изобретения дают младенцу или ребенку младшего возраста в качестве композиции, дополнительной к материнскому молоку. В некоторых вариантах осуществления изобретения младенец или ребенок младшего возраста получает материнское молоко в течение по меньшей мере первых 2 недель или первых 1, 2, 4 или 6 месяцев. В одном варианте осуществления питательную композицию изобретения дают младенцу или ребенку младшего возраста после такого периода питания материнским молоком или дают во время такого периода питания материнским молоком. В другом варианте осуществления композицию дают младенцу или ребенку младшего возраста в качестве единственной или основной питательной композиции в течение по меньшей мере одного периода времени, например, после 1-го, 2-го или 4-го месяца жизни, в течение по меньшей мере 1, 2, 4 или 6 месяцев.
В одном варианте осуществления питательная композиция изобретения является полной питательной композицией (удовлетворяющей все или большинство питательных потребностей пациента). В другом варианте осуществления питательная композиция представляет собой добавку или обогатитель, предназначенные, например, для дополнения грудного молока или для дополнения детской смеси или смеси для прикармливаемых детей/смеси последующего уровня.
Композиция настоящего изобретения оказывает положительное влияние на общую микробиоту младенцев или детей младшего возраста: она стимулирует и/или индуцирует в кишечнике младенцев или детей младшего возраста, вскармливаемых питательной композицией настоящего изобретения, общую микробиоту, которая похожа на микробиоту младенцев или детей младшего возраста, вскармливаемых исключительно человеческим грудным молоком, по сравнению с общей микробиотой кишечника у младенцев или дети младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания указанных олигосахаридов (т.е. без содержания по меньшей мере одного фукозилированного олигосахарида и по меньшей мере одного N-ацетилированного олигосахарида).
Главный и неожиданно обнаруженный полезный для здоровья эффект питательной композиции настоящего изобретения состоит в том, что композиция глобальным образом модулирует общую микробиоту младенцев, вскармливаемых питательной композицией изобретения, делая ее похожей на микробиоту младенцев на грудном вскармливании. Меняются не только некоторые определенные таксоны микробиоты, но питательная композиция, в частности, индуцирует сдвиг композиции общей микробиоты в сторону такой композиции, которая индуцируется грудным вскармливанием. Кроме этого, как показывают эксперименты, сходство с теми же аспектами у младенцев на грудном вскармливании наблюдается как у композиции кишечной микробиоты (т.е. относительное таксономическое богатство и/или разнообразие общей микробиоты), так и функции кишечной микробиоты (т.е. ее активность и/или функциональность, например, получающиеся метаболиты). Таким образом, в случае композиции кишечной микробиоты индуцированная/стимулированная микробиота является специфичной по 2 аспектам:
«количественному»: кишечная флора содержит больше полезных бактерий и меньше неполезных или вредных бактерий;
«качественному»: разнообразие бактериальных таксонов больше напоминает микробиоту младенцев на грудном вскармливании.
Разнообразие общей микробиоты может выражаться альфа-разнообразием (подробности приведены в разделе с примером) и может быть показано измерением PD_whole_tree (филогенетическое разнообразие по всему филогенетическому древу). Влияние на здоровье, обеспечиваемое питательной композицией изобретения, можно измерить у младенцев или детей младшего возраста в возрасте 0–36 месяцев, необязательно 0–12 месяцев. Его можно наблюдать после нескольких дней или недель применения композиции — например, после 4 недель, или 6 недель, или 8 недель применения. Однако перед наблюдением индуцируемой микробиоты может пройти 4, 6, 8 недель. Однако перед наблюдением этой стимулируемой/индуцируемой общей микробиоты может пройти 4, 6, 8 недель. Влияние можно измерить, например, в кале младенцев/детей младшего возраста. В контексте изобретения полезный для здоровья эффект смещает общую микробиоту кишечника младенцев или детей младшего возраста ближе к микробиоте младенцев или детей младшего возраста на грудном вскармливании. Эффект особенно виден при сравнении с младенцами или детьми младшего возраста, которые не получают композицию настоящего изобретения.
Такой положительный эффект может включать в себя i) угнетение, уменьшение или ингибирование роста патогенных бактерий или снижение нагрузки патогенными бактериями и/или ii) усиление, увеличение или стимуляцию роста полезных бактерий. В некоторых вариантах осуществления питательная композиция настоящего изобретения предусматривает (или включает, или сопровождается, или характеризуется) увеличение популяции Bifidobacterium и/или угнетение популяции Escherichia и/или Peptostreptococcaceae по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией. Этот эффект можно измерить в кале указанных младенцев или детей младшего возраста, например, в возрасте или старше 1, 4, 6 или 8 недель и, например, после 1, 4, 6 или 8 недель вскармливания указанной питательной композицией. Композицию микробиоты кала можно измерить, например, анализом рДНК 16S или метагеномным анализом (подробности приводятся в разделе с примером).
За счет угнетения, снижения и/или ингибирования роста популяций патогенных бактерий и/или индукции более полезных бактерий, в количественном и качественном аспектах, композиция изобретения обеспечивает положительное влияние на здоровье. Такая здоровая кишечная микробиота в конечном счете связана с надлежащим всасыванием питательных веществ, адекватным ростом, уменьшением колик, уменьшением инфекции, уменьшением диареи и улучшением состояния кишечника.
Воздействие изобретения может быть профилактическим (например, предотвращение дисбаланса кишечной микробиоты, предотвращение кишечных инфекций, поддержание здоровой кишечной микробиоты, введение здоровой кишечной микробиоты) или лечебным (восстановление здоровой кишечной микробиоты при ее нарушении, помощь в устранении или сокращении популяций патогенных бактерий в кишечнике, введение здоровой микробиоты после ожидаемых нарушений, например, из-за диареи или инфекций).
В некоторых вариантах осуществления питательная композиция настоящего изобретения предусматривает (или включает, или сопровождается, или характеризуется) уменьшение патогена (-ов) и/или уменьшение болезнетворного (-ых) фактора (-ов) по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания олигосахаридов. Эти эффекты можно измерить в кале указанных младенцев или детей младшего возраста, например, в возрасте или старше 1, 4, 6 или 8 недель и, например, после 1, 4, 6 или 8 недель вскармливания указанной питательной композицией.
Уменьшение патогена (-ов) означает уменьшение частоты появления и/или количества (например, нагрузки, числа) патогена (-ов). Ее можно измерить, например, методом Luminex ПЦР (подробности приводятся в разделе с примером). Возможно уменьшение таких патогенов, как вирусы, бактерии и/или протисты. К конкретным примерам вирусных патогенов относятся норовирус (например, норовирус GI/GII) и/или ротавирус (например, ротавирус A). К конкретным примерам бактериальных патогенов относятся Clostridium difficile (например, Clostridium difficile toxin A/B), Campylobacter, Escherichia coli (например, E. coli O157). К конкретным примерам протистных патогенов относится Cryptosporidium.
В одном конкретном примере питательная композиция предусматривает уменьшение бактериального патогена Clostridium difficile.
Болезнетворный (-ые) фактор (-ы) может (могут) представлять собой болезнетворные гены и/или гены резистентности к антибиотикам, которые могут определяться, например, метагеномным анализом (подробности приводятся в разделе с примером). Конкретными примерами болезнетворных генов являются gi:16767513 (yjcB — предполагаемый внутренний мембранный белок) из Salmonella enterica LT2, gi:21284341 (cna — предшественник адгезина-коллагена) из Staphylococcus aureus MW2, gi:24528016 (l7045 — L7045) из Escherichia coli 536, gi:15808725 (fecB — FecB) из Shigella flexneri YSH6000 и gi:21282741 (isdA — белок клеточной поверхности) из Staphylococcus aureus MW2.
В некоторых вариантах осуществления питательная композиция настоящего изобретения предусматривает (или включает в себя, или сопровождается, или характеризуется) уменьшение продукции свободных аминокислот и/или стимуляцию продукции лактата по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания олигосахаридов.
Лактат продуцируется молочнокислыми бактериями, такими как лактобактерии и бифидобактерии, и он может препятствовать росту других бактерий, в том числе патогенных. К конкретным примерам свободных аминокислот относятся фенилаланин, тирозин и изолейцин. Эти эффекты можно измерить в кале указанных младенцев или детей младшего возраста, например, в возрасте или старше 1, 4, 6 или 8 недель и, например, после 1, 4, 6 или 8 недель вскармливания указанной питательной композицией. Измерения можно выполнять с использованием общепризнанного метабономного подхода, основанного на протонной ядерной магнитно-резонансной спектрометрии (1H ЯМР) (Moco et al, 2013, Metabolomics perspectives in pediatric research, Pediatr.Res. 73, 570–576).
Влияние на здоровье, оказываемое на младенцев или детей младшего возраста, можно измерить различными методами, как показано ниже в примере.
В одном варианте осуществления влияние на общую микробиоту измеряют путем вычисления альфа-разнообразия в каждом образце и анализа распределения (подробности представлены в разделе с примером).
В одном варианте осуществления влияние на общую микробиоту измеряют путем вычисления бета-разнообразия между группами с использованием показателя, учитывающего филогенетические расстояния между OTU (операционными таксономическими единицами), например, с использованием метода UniFrac, и анализа распределения. В альтернативном варианте бета-разнообразие между контрольной группой, исследуемой группой и группой на грудном вскармливании можно оценить при помощи многопараметрической ординации с проверкой гипотезы на основе процедур рандомизации (например, канонический корреспондентный анализ (CCA), анализ избыточности (RDA)) или многовариантный параметрический или непараметрический тест (например, Adonis, ANOSIM, многопараметрический дисперсионный анализ). В одном конкретном примере бета-разнообразие вычисляют с использованием RDA.
В одном варианте осуществления изобретения стимулированная и/или индуцированная общая микробиота кишечника у младенцев и/или детей младшего возраста, вскармливаемых питательной композицией изобретения, имеет существенно сниженное альфа-разнообразие (например, сниженное на по меньшей мере 0,10 единицы, например по меньшей мере 0,12 единицы или по меньшей мере 0,15 единицы, например на 0,19 единицы) по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания олигосахаридов, присутствующих в питательной композиции изобретения (например, по меньшей мере одного фукозилированного олигосахарида и по меньшей мере одного N-ацетилированного олигосахарида), и, следовательно, похожа на микробиоту младенцев на грудном вскармливании.
Подходящая и здоровая кишечная микробиота является ключевым фактором для развития иммунной системы в слизистой оболочке младенца. Питательную композицию настоящего изобретения можно применять для целей профилактики и/или лечения.
В одном конкретном аспекте настоящее изобретение также относится к питательной композиции для применения при обеспечении здорового роста, для применения при обеспечении здоровой иммунной системы, для применения при обеспечении нормальной работы кишечника и/или для применения в профилактике и/или лечении дисбиоза микробиоты кишечника у младенцев или детей младшего возраста.
Полезные для здоровья эффекты, которые обеспечиваются композицией изобретения, могут представлять собой кратковременные и/или долговременные эффекты.
Эффект может наблюдаться сразу после введения композиции настоящего изобретения или проявляться в дальнейшей жизни, т.е. после введения композиции, например, от 1 недели до нескольких месяцев, например, от 2 до 4 недель, от 2 до 6 недель, от 2 до 8 недель, от 1 до 6 месяцев или от 2 до 12 месяцев после указанного введения.
Другие объекты
Другим объектом настоящего изобретения является применение по меньшей мере одного фукозилированного олигосахарида и по меньшей мере одного N-ацетилированного олигосахарида при получении питательной композиции для стимуляции и/или индукции у младенцев или детей младшего возраста общей микробиоты кишечника, которая похожа на общую микробиоту кишечника у младенцев или детей младшего возраста, вскармливаемых исключительно человеческим грудным молоком, по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания указанных олигосахаридов.
Еще одним объектом настоящего изобретения является применение питательной композиции в соответствии с настоящим изобретением для обеспечения здорового роста, для обеспечения здоровой иммунной системы, для обеспечения нормальной работы кишечника и/или для профилактики и/или лечения дисбиоза микробиоты кишечника у младенцев или детей младшего возраста.
Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид, для стимуляции и/или индукции у младенцев или детей младшего возраста общей микробиоты кишечника, которая похожа на общую микробиоту кишечника у младенцев или детей младшего возраста, вскармливаемых исключительно человеческим рудным молоком, по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания указанных олигосахаридов.
Эту фармацевтическую композицию можно использовать для обеспечения здорового роста, для обеспечения здоровой иммунной системы, для обеспечения нормальной работы кишечника и/или для профилактики и/или лечения дисбиоза микробиоты кишечника у младенцев или детей младшего возраста.
Еще один объект настоящего изобретения относится к способу стимуляции и/или индукции у младенцев или детей младшего возраста общей микробиоты кишечника, которая похожа на общую микробиоту кишечника у младенцев или детей младшего возраста, вскармливаемых исключительно человеческим грудным молоком, по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания указанных олигосахаридов, причем указанный способ включает введение указанному младенцу или ребенку младшего возраста питательной композиции, содержащей по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид.
Еще один объект настоящего изобретения представляет собой способ обеспечения здорового роста, обеспечения здоровой иммунной системы, обеспечения нормальной работы кишечника и/или профилактики и/или лечения дисбиоза микробиоты кишечника у младенцев или детей младшего возраста, причем указанный способ включает введение указанному младенцу или ребенку младшего возраста питательной композиции, содержащей по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид.
Указанные ранее варианты осуществления и примеры (например, относящиеся к типам и количествам олигосахарида, питательной композиции, введению, целевой популяции и т.п.) также применимы к перечисленным различным объектам (т.е. фармацевтическим композициям, способам и т.п.).
Примеры
Следующие примеры демонстрируют некоторые конкретные варианты осуществления композиции для применения в соответствии с настоящим изобретением. Эти примеры приведены исключительно с целью иллюстрации, и их не следует рассматривать как ограничения настоящего изобретения, поскольку в пределах сущности изобретения возможны его многочисленные варианты.
Пример 1
Ниже в таблице 1 приведен пример состава питательной композиции (например, детской смеси) в соответствии с настоящим изобретением. Эта композиция приводится исключительно в качестве иллюстрации.
Таблица 1. Пример состава питательной композиции (например, детской смеси) в соответствии с настоящим изобретением
|
Пример 2
Описание клинического исследования
Исследование безопасности было проведено в Dipartimento Materno Infantile, Unità Operativa Complessa di Neonatologia e Terapia Intensiva Neonatale, AOUP «Paolo Giaccone», г. Палермо, Италия и Kinderartsenpraktijk, г. Хасселт, Бельгия.
Это исследование представляло собой рандомизированное контролируемое двухцентровое интервенционное клиническое исследование с 2 параллельными группами вскармливания смесями. Исследуемая популяция для групп, вскармливаемых смесями, состояла из здоровых полностью доношенных младенцев мужского и женского пола в возрасте от 0 до 14 дней на момент привлечения к исследованию, которых на момент привлечения к исследованию вскармливали исключительно смесями. Пригодных для участия младенцев случайным образом распределяли в группы двух исследуемых смесей (контрольной и исследуемой), применяя в качестве факторов стратификации тип родов (вагинальные или кесарево сечение) и пол. На стадии 1 этих рандомизированных младенцев вскармливали исключительно исследуемой или контрольной смесью с момента начала исследования и до возраста 4 месяцев в количестве, соответствующем их массе, возрасту и аппетиту. Родители/специалисты по уходу, исследователи, вспомогательный персонал исследования и руководитель клинического проекта не имели возможности идентифицировать исследуемые смеси.
В исследовании применяли следующие детские смеси:
контрольную смесь давали контрольной группе: это была стандартная начальная детская смесь с преобладанием молочной сыворотки, содержащая длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFA) и не содержащая пробиотиков (66,9 ккал/100 мл растворенной смеси, 1,889 г белка/100 ккал порошка с соотношением сыворотки : казеина 71,6% : 28,4%, подробная композиция приведена в таблице 2);
исследуемую смесь давали исследуемой группе: это была контрольная смесь, за исключением того, что часть лактозы заменили двумя 2 ОГМ (2FL и LNnT) в следующих количествах 0,5-0,6 г LNnT и 1,0–1,2 г 2’FL на литр растворенной смеси (подробная композиция приведена в таблице 2).
В качестве референтной группы (группы с грудным вскармливанием = группа BF) у младенцев, находящихся исключительно на грудном вскармливании по меньшей мере в течение 3 месяцев, отбирали образцы кала по меньшей мере в возрасте 3 месяцев.
Таблица 2. Композиция контрольной смеси и исследуемой смеси
|
Оценку микробиоты кала делали для каждой группы в возрасте 3 месяцев с использованием разных методов, см. таблицу 3.
Таблица 3. Количество младенцев в группах выборки «начавшие получать лечение» (ITT), выборки «выполнившие требования протокола» (PP) и количество образцов кала, доступных для групп, выполнивших требования протокола, или референтной группы, находящейся на грудном вскармливании, для анализа микробиоты методами общего секвенирования рДНК 16S, патоген-специфической амплификации Luminex ПЦР, глобального метагеномного секвенирования и профилирования метаболитов по ЯМР.
|
Материалы и способы
Забор образцов кала
Родители дома отбирали образцы кала у всех субъектов за 48 часов до посещения в возрасте 3 месяцев. Для этого родителям был предоставлен набор (мешок-термос, пузырь со льдом, сосуды со шпателем, запечатываемые пластиковые пакеты, лист с инструкцией). Родителей попросили взять 2 образца, хранить их дома в морозильнике при -20°C и принести образцы кала в мешке-термосе, содержащем пузырь с замороженным льдом, в пункт посещения, где образцы хранились в замороженном виде при -80°C. Далее образцы транспортировали в Исследовательский центр Nestle, Швейцария, на сухом льду и до анализа хранили замороженными при -80°C.
Выделение ДНК из фекалий
Общую ДНК выделяли с использованием набора QIAamp DNA Stool Mini Kit (QIAGEN) в соответствии с инструкциями производителя, за исключением добавления ряда стадий механического измельчения (11 × 45 с) с использованием аппарата FastPrep и пробирок Lysing Matrix B (MP Biochemicals) (Junick and Blaut, 2012, Quantification of human fecal bifidobacterium species by use of quantitative real-time PCR analysis targeting the groEL gene. Appl Environ Microbiol 78: 2613–2622).
Амплификация генов 16S и секвенирование
Далее выполняли ПЦР-амплификацию вариабельных участков 16S V3–V4, используя универсальные праймеры (Klindworth et al., 2013, Evaluation of general 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies. Nucleic Acids Res 41: e1) и секвенирование при помощи технологии Illumina Miseq, как описано ранее (Caporaso et al., 2012, Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME J 6: 1621–1624).
Анализ данных 16S
После качественной фильтрации 6 710 039 последовательностей, описывающих микробиоту 154 образцов выборки «выполнившие требования протокола» (PP) (см. таблицу 3), со средним покрытием 42 739 последовательностей на образец, классифицировали на 173 OTU. Три образца с менее 10 000 последовательностей исключали из анализа рДНК 16S.
Необработанные данные последовательностей анализировали, используя комбинацию программных пакетов Mothur (Schloss et al., 2009, Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Appl Environ Microbiol 75: 7537–7541) и QIIME (Caporaso et al., 2010, QIIME allows analysis of high-throughput community sequencing data. Nat Methods 7: 335–336). Спаренные концевые последовательности демультиплексировали и соединяли в соответствии с описанием (Kozich et al., 2013 Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform. Appl Environ Microbiol 79: 5112–5120). Далее последовательности расщепляли на отдельные fasta-файлы для каждого образца, используя команды Mothur [deunique.seqs(), degap.seqs() и split.groups()]. Преобразование в формат QIIME с использованием add_qiime_labels.py и дальнейшие стадии анализа выполняли в QIIME. Проверку на химеризацию и подбор OTU с идентичностью 97% выполняли с применением алгоритма Uchime (Edgar et al., 2011, UCHIME improves sensitivity and speed of chimera detection. Bioinformatics 27: 2194–2200), используя pick_open_reference.py. Назначение в таксономические категории выполняли на репрезентативных последовательностях с использованием RDP Classifier с доверительным порогом 0,6 (Wang et al., 2007, Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Appl Environ Microbiol 73: 5261–5267). Выполняли выравнивание репрезентативных последовательностей OTU, используя метод PyNast (Caporaso et al., 2010, PyNAST: a flexible tool for aligning sequences to a template alignment. Bioinformatics 26: 266–267), а также Uclust в качестве способа попарного выравнивания. Полученные множественные выравнивания затем подвергали фильтрации и использовали для построения филогенетического дерева методом FastTree (Price et al., 2009, FastTree: computing large minimum evolution trees with profiles instead of a distance matrix. Mol Biol Evol 26: 1641–1650). После качественной фильтрации (Bokulich et al., 2013, Quality-filtering vastly improves diversity estimates from Illumina amplicon sequencing. Nat Methods 10: 57–59) выполняли анализы альфа-разнообразия в QIIME, а также анализ избыточности (RDA) (Kindt R and Coe R., 2005, Tree diversity analysis. A manual and software for common statistical methods for ecological and biodiversity studies. Nairobi: World Agroforestry Centre — ICRAF) на уровне родов, используя веб-сайты Calypso по адресу http://bioinfo.qimr.edu.au/calypso.
Метагеномный анализ
Микробную композицию образцов кала из трех групп определяли путем высокопроизводительного секвенирования с мультиплексированием выделенной из кала ДНК с использованием прибора Illumina HiSeq, с применением парно-концевых ридов длиной 100 п. н. (PE 100). Библиотеки ДНК получали с использованием протокола Nextera XT. Образцы секвенировали на 6 высокопроизводительных проточных ячейках.
Первые риды разрезали, используя алгоритм DynamicTrim (v2.1) из пакета SolexaQA (Cox, M.P. et al., BMC Bioinformatics, 2010, SolexaQA: At-a-glance quality assessment of Illumina second-generation sequencing data. BMC Bioinformatics 11:485–490) с отсечкой вероятности 0,05. Полученные нарезанные последовательности затем фильтровали по порогу длины 25 п. н., используя алгоритм LengthSort (v2.1) из пакета SolexaQA. Прошедшие фильтрацию риды картировали на полном человеческом геноме hg19, используя алгоритм bowtie v2.2.5 (Langmead, B. and Salzberg, S., Nature Methods., 2012, Fast gapped-read alignment with Bowtie 2. Nature Methods 9:357–359) для удаления человеческих ридов. В среднем, в контрольной группе, исследуемой группе и группе грудного вскармливания выявлено 0,9, 0,02 и 3,3% человеческих ридов соответственно. Для повышения эффективности вычислений количество ридов дополнительно уменьшали, используя функцию unique.seqs из пакета mothur v1.35 (Schloss, P.D., et al., Appl Environ Microbiol, 2009, Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Appl Environ Microbiol 75: 7537–7541), которая возвращает только уникальные найденные последовательности. Эта стадия уменьшила количество ридов на ~ 50%. После качественной фильтрации было получено медианное количество от 76 до 80 миллионов последовательностей из 157 образцов для выборки «выполнившие требования протокола» (PP) (см. таблицу 3) с равным покрытием в контрольной, исследуемой и референтной (BF) группе. Было получено медианное количество от 36 до 42 миллионов уникальных последовательностей, также равномерно распределенных между группами. Один образец, имевший всего 53661 последовательностей, был исключен из метагеномного анализа. Оставшиеся риды затем использовали для профилирования композиции микробных популяций с применением пакета MetaPhlAn v2 (Segata, N. et al., Nature Methods, 2012, Metagenomic microbial community profiling using unique clade-specific marker genes. Nature Methods 9:811–814).
Присутствие генов, кодирующих известные болезнетворные факторы, или генов резистентности к антибиотикам исследовали с использованием ShortBRED. ShortBRED представляет собой систему обработки информации, которая принимает набор белковых последовательностей, группирует их по семействам, извлекает набор отличительных строк («маркеров»), а затем производит поиск этих маркеров в метагеномных данных и определяет присутствие и количество интересующих семейств белков. Маркеры болезнетворных факторов были основаны на всех белковых последовательностях (2447 белковых последовательностей) из релиза R3 базы данных болезнетворных факторов патогенных бактерий Virulence Factor of Pathogenic Bacteria Database (http://www.mgc.ac.cn/VFs/ — Chen, L.H. et al., 2012, Toward the genetic diversity and molecular evolution of bacterial virulence factors. Nucleic Acids Res 40 (Database issue):D641–D645). Маркеры генов резистентности к антибиотикам были основаны на всех белковых последовательностях (7828 белковых последовательностей) из версии 1.1 базы данных генов резистентности к антибиотикам Antibiotic Resistance Genes Database (http://ardb.cbcb.umd.edu/ — Liu, B. and Pop., M., NAR, 2009, ARDB-Antibiotic Resistance Genes Database. Nucleic Acids Res 37(Database issue):D443–D447). Достоверность различий между группами оценивали по аппроксимации моделью отрицательной биномиальной регрессии, учитывая при необходимости лишние нулевые данные.
Определение патогенов методом Luminex в образцах кала
Образцы кала подвергали ряду стадий механического измельчения (3 × 60 с) с использованием аппарата FastPrep и пробирок Lysing Matrix B (MP Biochemicals), одновременное выделение ДНК и РНК выполняли с использованием набора QIAamp MinElute Virus Spin Kit (QIAGEN). Нуклеиновые кислоты определяли с использованием специфичных к последовательности праймеров из панели желудочно-кишечных патогенов (Gastrointestinal Pathogen Panel) (xTAG GPP) с применением системы Luminex 200 в соответствии с рекомендациями производителя (Luminex Molecular Diagnostics, Inc., г. Торонто, Канада). Определяемыми аналитами были аденовирусы серотипов 40/41, Campylobacter (C. jejuni, C. coli и C. lari), токсины A/B Clostridium difficile, Cryptosporidium (C. parvum и C. hominis), Entamoeba histolytica, Escherichia coli O157, энтеротоксигенные токсины LT/ST E. coli (ETEC), Giardia (G. lamblia также известная как G. intestinalis и G. duodenalis), норовирус GI/GII, ротавирус A, продуцирующие шигаподобный токсин E. coli (STEC) stx1/stx2, Vibrio cholera и Yersinia enterocolitica. Результаты определения Salmonella и Shigella не рассматривали из-за неединообразия в контрольных образцах.
Анализ кала на метаболиты
Для получения информации, выходящей за рамки аспекта композиции микробиоты кала, авторы изобретения исследовали биохимическую композицию кала, используя общепризнанный метабономный подход, основанный на протонной ядерной магнитно-резонансной спектроскопии (1H ЯМР). 1H ЯМР-метабономика позволяет получить количественный профиль основных метаболитов, включая аминокислоты, основные органические кислоты (лактат, сукцинат, цитрат и т.п.) и углеводов и, следовательно, открывает уникальное окно для отслеживания метаболических функций кишечника.
Метаболическое профилирование образцов кала было адаптировано из ранее опубликованного метода (Martin et al., 2014, Impact of breast-feeding and high- and low-protein formula on the metabolism and growth of infants from overweight and obese mothers. Pediatr Res 75, 535–543. doi: 10,1038/pr,2013,250). Если коротко, 80–100 мг замороженного кала отбирали из пробирки с образцом кала, взвешивали и высушивали сублимацией. Высушенные образцы суспендировали в 1,2 мл дейтерированного фосфатного буферного раствора 0,2 M KH2PO4, содержащего 0,3 мМ азида натрия в качестве антибактериального средства и 1 мМ 3-(триметилсилил)-[2,2,3,3-2H4]-1-пропионата натрия в качестве референта химического сдвига ЯМР. Гомогенаты центрифугировали при 17 000 x g в течение 10 минут и 5 500 мкл супернатанта переносили в пробирки для ЯМР объемом 5 мм. Метаболические 1H ЯМР-профили получали при помощи спектрометра Bruker Avance III 600 МГц, оснащенного 5 мм криозондом при 300 K (Bruker, Biospin, Германия), с использованием стандартной импульсной последовательности и импульсной последовательности спинового эхо с подавлением воды и обрабатывали с использованием программного пакета TOPSPIN (vs 3.2., Bruker). Обработку и анализ данных проводили, как описано ранее (Martin et al., 2014). Значимые матаболиты, идентифицированные при многопараметрическом анализе данных, оценивали относительно количественным методом с использованием интеграции сигнала и анализировали с применением критериев Краскела — Уоллиса. Учитывая исследовательский характер работы, значения p не корректировали на множественные сравнения.
Результаты
Композиция микробиоты кала на основе анализа рДНК 16S
Усредненный общий профиль для трех групп на уровне родов показал, что хотя композиция общей микробиоты контрольной и исследуемой групп продемонстрировала сходную картину, характерную для вскармливания смесью, исследуемая группа показала большую тенденцию к сходству с группой BF, чем контрольная группа. См. фиг. 1, где представлен общий профиль для 3 групп.
Статистический анализ выявил несколько таксонов, по-разному представленных в контрольной и исследуемой группах. Действительно, при проведении статистического анализа различий композиции микробиоты на уровне родов (ранговый критерий Уилкоксона без коррекции на множественные сравнения) контрольная и исследуемая группы отличались по шести таксонам (см. таблицу 4). Три таксона имели медианные нулевые значения во всех группах, и количества были представлены только по нескольким выпадающим значениям. Остальные показаны на фиг. 2. Значимость этих трех таксонов (Bifidobacterium, Escherichia и Peptostreptococacceae_uncl) в качестве основных отличительных признаков между контрольной и исследуемой группами была подтверждена анализом методом «случайный лес» (средняя погрешность уменьшения от 0,013 до 0,006). В частности, присутствует увеличение популяции Bifidobacteria и угнетение популяций Escherichia и/или Peptostreptococcaceae по сравнению с общей микробиотой контрольной группы.
Таблица 4. Для оценки достоверных отличий между контрольной и исследуемой группами использовали ранговый критерий Уилкоксона на уровне родов, обозначенный значением p. Группу BF не использовали в статистических тестах, но значения представлены как референтные. Значения для исследуемой группы, контрольной группы и группы BF представляют собой медианы относительной численности для указанного рода. Значения q FDR представляют собой значения p с коррекцией на множественные сравнения с заданной долей ложноположительных результатов.
|
Альфа-разнообразие для каждого образца вычисляли, используя показатель, учитывающий филогенетические расстояния между OTU и их распределение по трем сравниваемым группам, см. фиг. 3. Хотя разнообразие в группе BF существенно ниже разнообразия в группах обеих смесей, разнообразие в исследуемой группе достоверно снижено (среднее снижено на 0,19 единицы) по сравнению с контрольной группой и, следовательно, является более близким к группе BF.
Различие композиции общей микробиоты по данным рДНК 16S для трех групп оценивали при помощи ординации (см. фиг. 4). Статистика, основанная на случайных перестановках в анализе избыточности (RDA), показала, что три группы можно достоверно различать на уровне родов (p < 0,001). Центроиды группы BF и контрольной группы четко различались, тогда как исследуемая группа находилась в промежуточном положении между группой BF и контрольной группой.
Нагрузка патогенами образцов кала
Часть набора образцов кала была доступна для анализа нагрузки определенными патогенами с использованием панели желудочно-кишечных патогенов Luminex xTAG Gastrointestinal Pathogen Panel. В таблице 5 представлено количество младенцев, у которых в кале, собранном в возрасте 3 месяцев, определялся по меньшей мере один патоген. Количество младенцев с определяемым вирусным патогеном было очень сходным в исследуемой и контрольной группах и составило 28% и 31,5% соответственно. Чаще всего определялся норовирус. С другой стороны, определяемые бактериальные патогены находили в кале у 14% младенцев, вскармливаемых исследуемой смесью, тогда как в контрольной группе в 26% образцов кала определялся по меньшей мере один бактериальный патоген. Однако данное различие не достигало статистической значимости (коэффициент несогласия 0,46, p = 0,15). У этих европейских младенцев чаще всего определяемым патогеном с большим отрывом стал Clostridium difficile, по токсину A/B. Эукариотические (протистные) патогены определялись очень редко, у 2% младенцев, получавших исследуемую смесь, и у 5,6% младенцев, получавших контрольную смесь, причем в кале встречались Cryptosporidium.
Таблица 5. Количество младенцев, у которых в возрасте 3 месяцев в кале присутствовал по меньшей мере один патоген. Вычисляли коэффициент несогласия и значение p двустороннего критерия точной вероятности Фишера.
|
Нагрузку патогенами образцов кала младенцев также оценивали с использованием метагеномного набора данных. В случае Clostridium difficile 36% младенцев в исследуемой группе и 46% в контрольной группе были носителями в соответствии с метагеномными данными. Сходная картина наблюдалась по токсину А/В C. difficile при анализе методом Luminex ПЦР, где определяемые уровни наблюдались у 14% младенцев в исследуемой группе и 22% младенцев в контрольной группе.
Выбранные первые функциональные аспекты микробиоты кала
Помимо изучения патогенов авторы изобретения также сделали запросы к метагеномным данным на присутствие генов, кодирующих известные болезнетворные факторы или гены резистентности к антибиотикам. На фиг. 5 приведены обобщенные результаты по известным болезнетворным генам с коррекцией на множественные сравнения или без нее. Всего авторы изобретения определили 7 генов, кодирующих известные болезнетворные факторы, уровень которых достоверно отличался в контрольной и исследуемой группах. Из этих 7 генов 5 генов очевидно различались между контрольной и исследуемой группами, а также между контрольной группой и группой BF, но не между исследуемой группой и группой BF, и это показывает, что исследуемая группа была ближе к референтной группе BF по этим генам. Еще 2 разных гена оказались различающимися между всеми 3 группами.
Что касается генов, кодирующих резистентность к антибиотикам, то авторы изобретения определили всего 8 генов, кодирующих известные гены резистентности к антибиотикам, уровни которых оказались достоверно различающимися между контрольной и исследуемой группами, см. фиг. 6. Из этих 8 генов 4 гена очевидно различались между контрольной и исследуемой группами, а также между контрольной группой и группой BF, но не между исследуемой группой и группой BF, и это показывает, что исследуемая группа была ближе к референтной группе BF по этим генам. 4 других гена различались между контрольной и исследуемой группами, но не имели различий между любой из групп смесей и референтной группой BF.
Характерные метаболические признаки в кале
Многофакторный анализ данных выявил значимые метаболиты, различающие исследуемую группу и контрольную группу, а также референтную группу с грудным вскармливанием (см. фиг. 7). Содержание в кале некоторых аминокислот и органических кислот было разным в исследуемой и контрольной группах, причем отличия, наблюдаемые в исследуемой группе, склонялись в сторону значений, наблюдаемых в кале младенцев, на грудном вскармливании. Более конкретно, уровни фенилаланина и изолейцина различались между младенцами, вскармливаемыми исследуемой и контрольной смесями, и отличались от наблюдаемых в кале младенцев на грудном вскармливании. Уровни тирозина не различались между исследуемой и контрольной группами, но отличались от референтной группы на грудном вскармливании. С другой стороны, уровни лактата были выше у младенцев, получавших исследуемую смесь, чем у младенцев, получавших контрольную смесь, тогда как референтные образцы от младенцев на грудном вскармливании не достигали статистически значимых различий от образцов младенцев, вскармливаемых смесями.
Заключение
Все эти разные анализы показывают, что композиция общей микробиоты исследуемой группы (т.е. младенцев, вскармливаемых детской смесью в соответствии с изобретением) имеет тенденцию к большему сходству с группой BF (т.е. младенцами, вскармливаемыми исключительно человеческим грудным молоком), чем контрольная группа (т.е. младенцы, вскармливаемые традиционной питательной композицией).
Действительно, это рандомизированное плацебо-контролируемое двухцентровое клиническое исследование показало, что обогащение стандартной начальной детской смеси двумя специфическими олигосахаридами человеческого молока 2’FL и LNnT изменяет кишечную микробиоту в возрасте 3 месяцев, что показывает анализ образцов кала. Следует отметить, что композиция общей микробиоты и функциональные показатели для младенцев, вскармливаемых исследуемой смесью, не только отличались от контрольной группы, но и приближались к референтной группе на грудном вскармливании. В частности, это промежуточное положение микробиоты кала исследуемой группы между контрольной группой и референтной группой на грудном вскармливании наблюдается на графике альфа-разнообразия, при анализе избыточности на уровне родов, а также при сравнении относительной численности конкретных таксонов на уровне родов. Основной вклад в наблюдаемый сдвиг исследуемой группы в сторону референтной группы BF вносят бактерии из таксонов Bifidobacterium, Escherichia и Peptostreptococcaceae. Такой сдвиг композиции микробиоты дополнительно подтверждается наблюдаемым изменением содержания в кале метаболитов кишечных бактерий, образующихся при расщеплении молока, что видно по данным 1H-ЯМР-метабономики. Это показывает, что ОГМ 2’FL и LNnT в исследуемой смеси влияют не только на композицию, но также и на функции микроорганизмов кишечника.
Чтобы дополнительно подчеркнуть полезный для здоровья младенца эффект, авторы изобретения также изучили присутствие конкретных истинных патогенов и болезнетворных факторов в целом. Бактериальный патоген C. difficile демонстрирует очевидно более низкие уровни, как по данным специфичной к токсину A/B ПЦР-амплификации, так и по данным метагеномного анализа, в исследуемой группе по сравнению с контрольной группой и приближается к более низким уровням, наблюдаемым в референтной группе BF по метагеномным данным, хотя и не достигает статистической значимости. Следует отметить, что несколько известных болезнетворных генов и генов резистентности к антибиотикам, определяемых метагеномным анализом, в исследуемой группе имели иной уровень по сравнению с контрольной группой и были сходными с количеством, наблюдаемым в референтной группе BF. В совокупности, и при допущении, что референтная группа BF является стандартной, эти наблюдения указывают, что экология микроорганизмов в кишечнике организма-хозяина в исследуемой группе может быть менее благоприятной для предполагаемых вредных бактерий.
Более высокие уровни в кале свободных аминокислот фенилаланина, тирозина и изолейцина в группах смесей по сравнению с референтной группой BF могут быть либо связаны с повышенной протеолитической активностью, либо с избытком аминокислот, входящих в смесь, но не поглощенных в верхних отделах кишечника.
Настоящие данные по исследуемой смеси показывают, что добавление ОГМ 2’FL и LNnT к смеси, как правило, снижает содержание свободных аминокислот в кале и стимулирует продукцию лактата. Эти изменения описывают потенциал 2’FL и LNnT для индукции изменений микробного метаболизма в кишечнике в сторону уровня метаболитов, наблюдаемого в кале младенцев группы BF, и, следовательно, в сторону индукции метаболической эквивалентности с грудным молоком.
В совокупности, микробиота кала и характерные метаболические признаки показывают, что добавление двух индивидуальных и очень специфичных по структуре ОГМ к начальной детской смеси сдвигает кишечную микробиоту, оцениваемую в кале, как по композиции, так и по функции, в сторону микробиоты, наблюдаемой у младенцев группы BF. В целом исследуемая группа располагается между младенцами контрольной группы и младенцами группы BF. Однако по некоторым специфическим показателям исследуемая группа оказывается даже идентичной референтной группе BF.
Питательная композиция, содержащая по меньшей мере один фукозилированный олигосахарид и по меньшей мере один N-ацетилированный олигосахарид, такой как 2FL и LNnT, оказывается очень эффективной у младенцев или детей младшего возраста в плане стимуляции и/или индукции у указанных младенцев или детей младшего возраста общей микробиоты кишечника, которая похожа на общую микробиоту кишечника у младенцев или детей младшего возраста, вскармливаемых исключительно человеческим грудным молоком, по сравнению с общей микробиотой кишечника у младенцев или детей младшего возраста, вскармливаемых преимущественно или исключительно традиционной питательной композицией без содержания указанных олигосахаридов.
Следовательно, она также считается особенно эффективной для применения при обеспечении здорового роста, для применения при обеспечении здоровой иммунной системы, для применения при обеспечении нормальной работы кишечника и/или для применения в профилактике и/или лечении дисбиоза микробиоты кишечника у младенцев или детей младшего возраста.