Результат интеллектуальной деятельности: 3-ТРИАЗЕНОИНДОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ПРОТИВ МИКОБАКТЕРИЙ
Вид РИД
Изобретение
Настоящее изобретение относится к соединениям, которые обладают антимикобактериальной активностью. Более конкретно, оно относится к применению замещенных 3-триазеноиндолов против различных микобактерий, в том числе против их мультирезистентных штаммов.
Быстрое распространение туберкулеза с устойчивостью к ряду лекарственных препаратов привело к тому, что в настоящее время очень высок спрос на новые антимикобактериальные соединения (агенты) для их терапевтического применения. Выявление и исследование соединений со способностью ингибировать микобактерий, особенно Mycobacterium tuberculosis и Mycobacterium avium, имеют первостепенное значение.
Арсенал потенциальных противотуберкулезных препаратов в последнее время активно пополняется редокс-активными соединениями индольного ряда, которые также обладают и другими видами биологической активности [Karaaslan С., Suzen S. // Int. J. Electrochem., 2011, Article ID 154804]. Особая привлекательность привилегированных индольных скаффолдов в значительной мере обусловлена их высокой афинностью к большому числу биомишеней (т.н. «druggability»), возможно, первопричиной которой является эволюционная связь с незаменимой аминокислотой индольного ряда триптофаном. В частности, индольные скаффолды представляют интерес при конструировании противотуберкулезных агентов-потенциальных ингибиторов недавно обнаруженного фермента, который участвует в катаболизме триптофана, - индоламин-2,3-диоксигеназы (ИДО), и других ингибиторов процессов окислительного метаболизма микобактерий [Plain K.М., de Silva K., Earl J., et al. // Infect. Immun. 2011, 79, 3821]. Ингибиторы ИДО в настоящее время рассматриваются как перспективные средства для лечения иммунорезистентного рака, туберкулеза и некоторых других заболеваний. Установлено также, что индольные соединения являются ингибиторами синтеза ряда соединений, из которых состоит клеточная стенка микобактерий, в том числе являются ингибиторами фермента InhA «прямого» действия. За последнее время удалось идентифицировать мишени многих выявленных индольных агентов, обладающих антимикобактериальной активностью, что позволяет теперь проводить направленный поиск высокоэффективных противотуберкулезных средств, опираясь на данные о взаимосвязи структуры и активности.
В статье Каппоена и его коллег [Cappoen D., Vajs J., Uythethofken С., et al. // European Journal of Medicinal Chemistry, 2014, 77, 193e203] ряд замещенных 1,3-диарилтриазенов оценивали в качестве потенциальных антимикобактериальных агентов (против М. tuberculosis и других клинически значимых микобактерий, таких как Mycobacterium bovis, Mycobacterium avium и Mycobacterium ulcerans). 1,3-Бис[(4-хлор-3-(трифторметил)фенил)]триазен (обозначенный авторами статьи номером 14) показал лучшие результаты против штамма М. tuberculosis H37Rv (IC50 = 3,26 мкМ, NI50 = 24,22 мкМ). 1,3-Бис[(4-хлор-3-(трифторметил)фенил)]триазен способен ингибировать рост внутриклеточно реплицирующегося и мультирезистентного штамма М. tuberculosis. По совокупности существенных признаков работа Каппоенса и его коллег является наиболее близкой к настоящему изобретению и может быть выбрана в качестве прототипа. Недостатками прототипа является то, что замещенные 1,3-диарилтриазены показали значительную острую цитотоксичность (для триазена 14 SI = 7,44), и также то, что из всего ряда замещенных 1,3-диарилтриазенов лишь 1,3-бис[(4-хлор-3-(трифторметил)фенил)]триазен показал относительно приемлемые результаты по антимикобактериальной активности.
Задачей настоящего изобретения является поиск новых соединений, которые при низкой цитотоксичности проявляли бы высокую активность против микобактерий, в том числе против их мультирезистентных штаммов.
Технический результат - повышение эффективности антимикобактериальных агентов против лекарственно-резистентных штаммов микобактерий, снижение цитотоксичности антимикобактериальных агентов, расширение арсенала антимикобактериальных агентов.
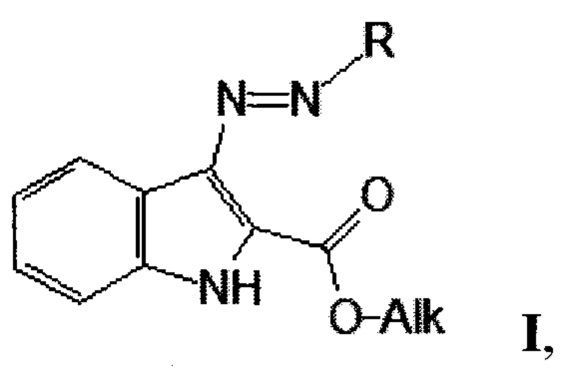
Технический результат достигается посредством 3-триазеноиндола формулы (I)
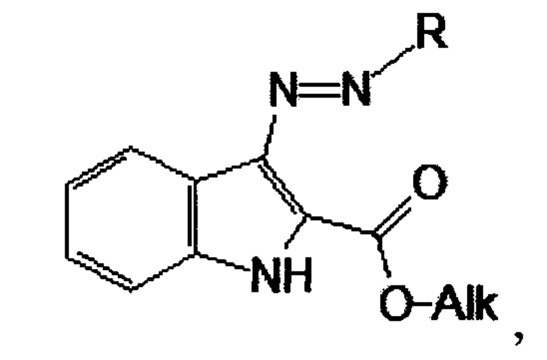
обладающего активностью против микобактерий. При этом R представляет собой заместитель, который содержит аминогруппу, a Alk представляет собой алкильный заместитель.
Согласно предпочтительным вариантам реализации изобретения указанный технический результат также достигается тем, что:
- заместитель R соединен атомом азота с диазеновым фрагментом;
- R представляет собой заместитель, который выбирают из группы гомоциклических, гетероциклических и ациклических аминов;
- R представляет собой заместитель, который выбирают из группы, включающей алкиламины, диалкиламины, морфолины, пиперидины, пиперазины, пирролидины, пергидроазепины, в том числе замещенные;
- R представляет собой заместитель, который выбирают из группы, включающей диэтиламин, морфолин, пиперидин, метилпиперидин, метилпиперазин, пирролидин, пергидроазепин;
- Alk представляет собой алкильный заместитель, выбранный из группы, включающей метил, этил, пропил, бутил, амил, гексил, гептил, октил, нонил и децил;
- Alk представляет собой этил;
- микобактерий выбраны из группы, включающей Mycobacterium tuberculosis и Mycobacterium avium;
- микобактерий Mycobacterium tuberculosis представляют собой штамм Mycobacterium tuberculosis H37Rv или изониазид-резистентный штамм Mycobacterium tuberculosis CN-40.
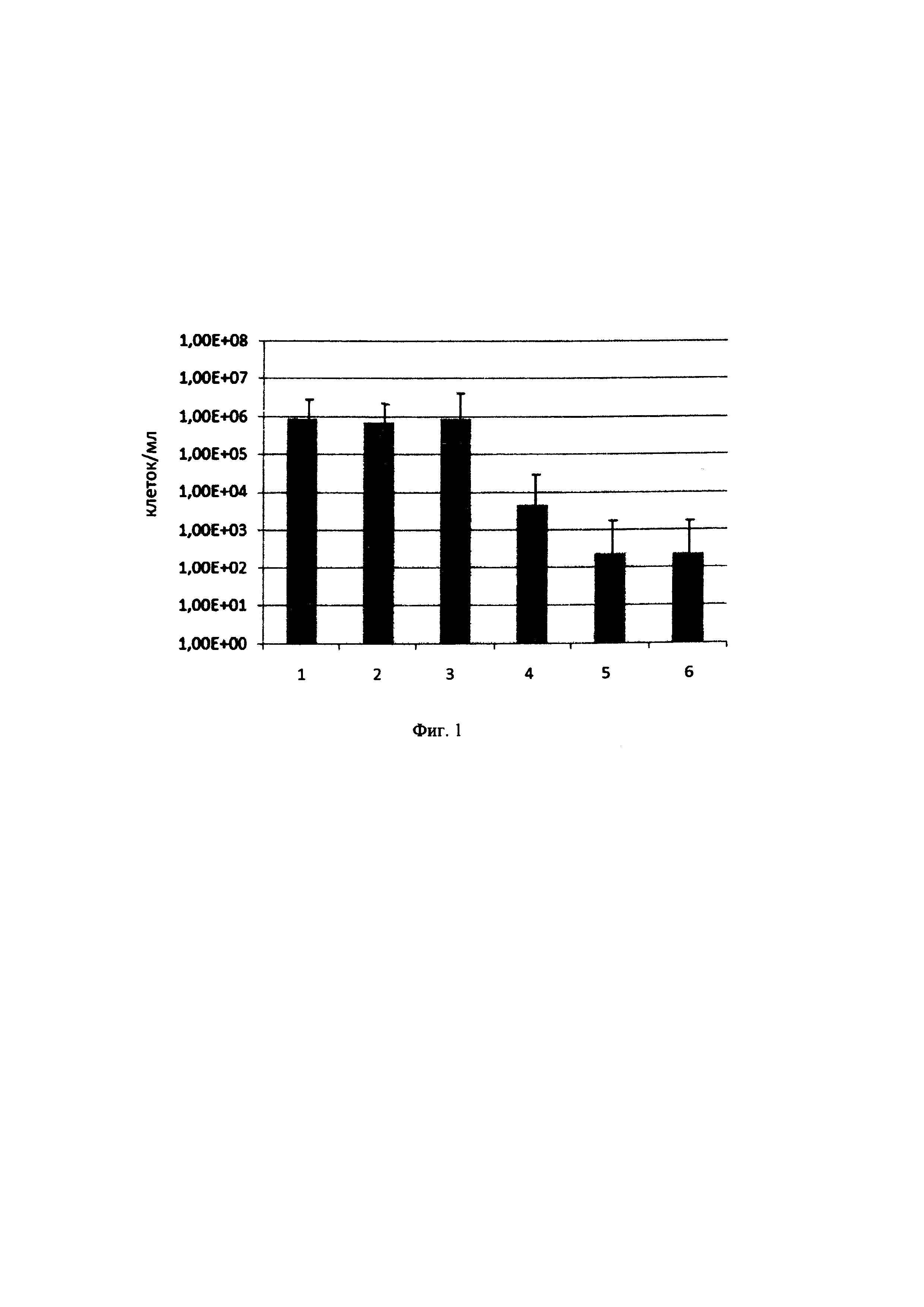
Далее изобретение подробно описывается со ссылкой на фигуру 1.
На фиг. 1 показана активность соединения TU112 против не поддающихся культивированию, "дремлющих" клеток штамма H37Rv М. tuberculosis. На фиг. 1 используются следующие обозначения:
1 - контроль;
2 - рифампицин, 10 мкг/мл;
3 - изониазид, 10 мкг/мл;
4 - TU112, 1 мкг/мл;
5 - TU112, 5 мкг/мл;
6 - TU112, 10 мкг/мл.
Задача решена выбором группы соединений (замещенных 3-триазеноиндолов), которые проявляют высокую in vitro активность против микобактерий Mycobacterium tuberculosis и Mycobacterium avium.
Отличительной особенностью 3-триазеноидолов является наличие в структуре привилегированного гетероциклического скаффолда и экзоциклической связи N-N. Привилегированные скаффолды - уникальные кольцевые структуры, которые имеют аффинность к разнообразным молекулярным биомишеням и нередко обладают комплексом плейотропных свойств. Именно они являются структурной основой большинства применяемых в медицинской практике лекарственных препаратов, и именно препараты этого типа вносят наибольший вклад в обновление имеющегося арсенала лекарств и биологически активных веществ, включая антимикобактериальные агенты. К числу наиболее эффективных привилегированных скаффолдов относится индольный скелет, который входит в состав рассматриваемых соединений-лекарственных кандидатов. Для модификации структуры индольных соединений использованы фармакофорные группировки, которые ранее не применялись при создании противотуберкулезных лекарственных препаратов. Именно эти группировки и их комбинации, встроенные в структуры привилегированных скаффолдов, придают целевым веществам высокую активность против INH-резистентных штаммов М. tuberculosis, а также против М. avium. Таким образом, заявленное изобретение позволяет сконструировать противотуберкулезные агенты нового типа путем направленной трансформации ряда привилегированных скаффолдов введением фармакофорных групп, благодаря чему соединение может влиять на редокс-статус структуры, ее стерические и липофильные свойства и опосредованно - на окислительный метаболизм микобактерий, в том числе, ее ответ на окислительный стресс (в настоящее время предполагается, что развитие резистентности к препарату первого ряда изониазиду связано с окислительным стрессом у патогенна).
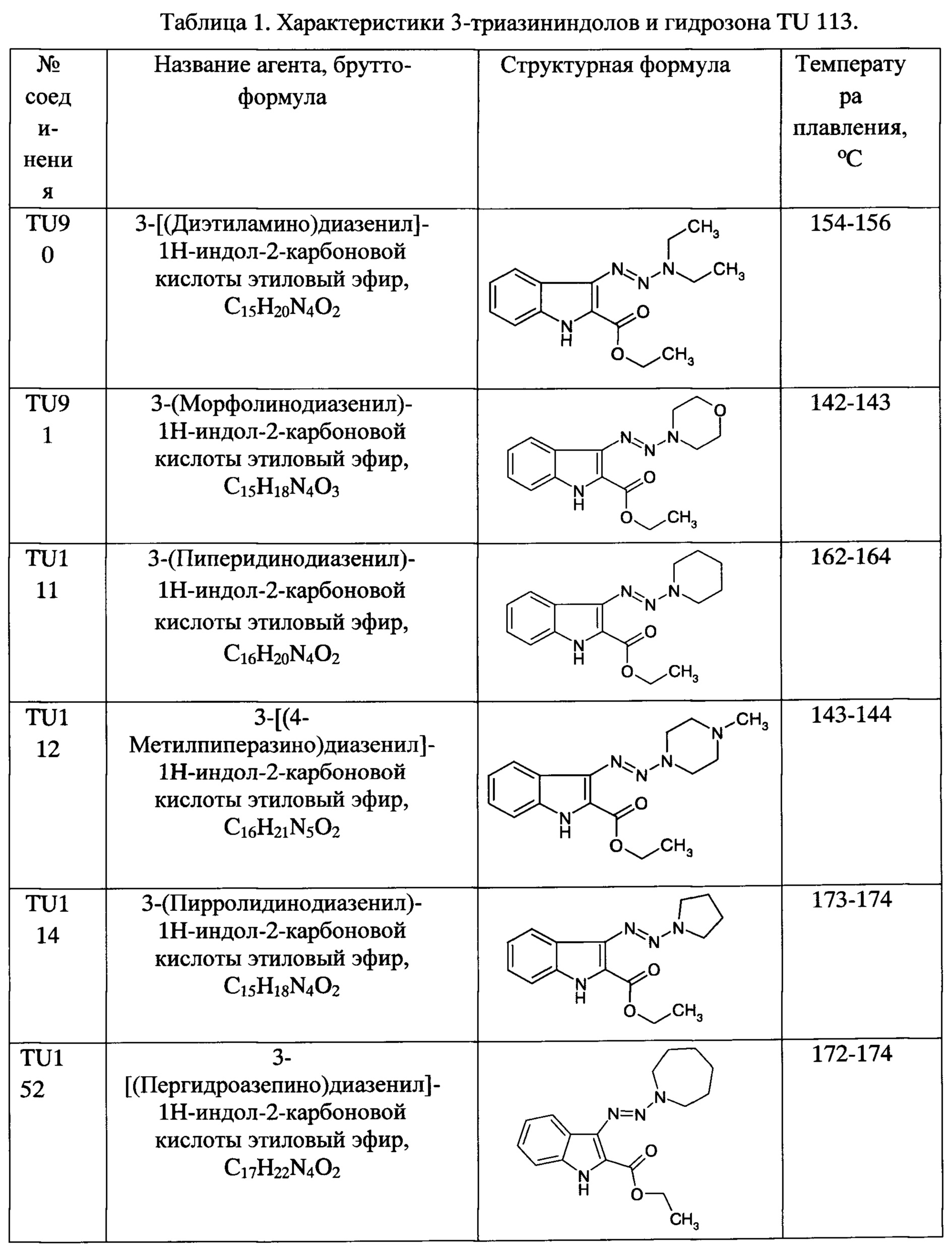
Выбранные для in vitro испытаний 3-триазиноиндолы приведены в таблице 1.
Далее приводятся примеры осуществления изобретения со ссылкой на прилагаемую фигуру.
Примеры осуществления изобретения и реализации назначения
Материалы и методы
Все исходные реагенты и растворители получены из коммерческих источников и использовались без дальнейшей очистки. Выходы приведены для очищенных продуктов и не оптимизированы.
Температуры плавления не корректировались. Инфракрасные спектры (ИК) записаны в таблетках KBr на инфракрасном Фурье-спектрометре Magna 750 IR Nicolet. Спектры 1Н ЯМР и 13С ЯМР выполнены на Bruker Avance™ 300 и Bruker Avance™ 400 (с рабочей частотой 300 и 400 МГц, соответственно) с использованием тетраметилсилана (ТМС) в качестве внутреннего стандарта и ДМСО-d6 (дейтерированный диметилсульфоксид) и CDCl3 (дейтерированный хлороформ) в качестве растворителей. Расщепленные сигналы описаны как синглет (с), дублет (д), триплет (т), квадруплет (кв), мультиплет (м), уширение сигнала (уш); химические сдвиги выражены в миллионных долях δ (м.д.), константы спин-спинового взаимодействия (J) даны в герцах (Гц). Элементный анализ выполнен в лаборатории микроанализа Института Элементоорганических Соединений им. А.Н. Несмеянова, Москва. Масс-спектры записаны на Finnigan Polaris Q.
Культура микобактерий
В экспериментах использовали М. tuberculosis штамм H37Rv из коллекции ЦНИИ туберкулеза РАМН, Москва. Приготовление суспензии, содержащей практически исключительно отдельные микобактерий, подробно описано в статье Лядовой [Lyadova I., Yeremeev V., Majorov K., et al. // Infect. Immun., 1998, 66, 4981-4988]. Сток микобактерий в аликвотах хранили при температуре -80°С. Для получения бактерий в log-фазе, свежеразмороженную культуру бактерий добавляли в бульон Дюбо и инкубировали 14 дней при 37°С в закрытых колбах.
Клинический изолят М. tuberculosis CN-40, обладающий селективной устойчивостью к изониазиду, но чувствительный к рифампицину, этамбутолу и стрептомицину, выделили у туберкулезного больного в ЦНИИ туберкулеза РАМН 19 апреля 2011 г. Штамм был клонирован и добавлен в коллекцию Института. Взвесь данных микобактерий для экспериментов будет готовиться так же, как штамм H37Rv.
Пример 1. Общая методика получения замещенных 3-триазеноидолов
К 0.15 г (0.7 ммоль) 2-этоксикарбонил-3-диазоиндола в 3.5 мл этанола добавляют 1 ммоль соответствующего вторичного амина при перемешивании при 65-70°С. Реакционную смесь нагревают до кипения и оставляют при 20-25°С на 3 часа. Затем реакционную массу выливают в ледяную воду, полученный осадок отфильтровывают, промывают водой, охлажденным этанолом и сушат. После перекристаллизации из изопропилового спирта получают соответствующие триазеноиндолы с выходом 23-89%.
Пример 2. Получение этилового эфира 3-[(диэтиламино)диазенил]-1Н-индол-2-карбоновой кислоты (TU-90)
Этиловый эфир 3-[(диэтиламино)диазенил]-1Н-индол-2-карбоновой кислоты получали в соответствии с Примером 1. В качестве вторичного амина использовали диэтиламин. Выход составил 58%.
Физико-химические данные: C15H20N4O2 (288.35); Тпл=154-156°С (лит. 156-158°С, 151-152°С); 1Н ЯМР (400 МГц, CDCl3, δ м.д.): 8.64 (s, 1Н, NH), 8.24 (д J=8.1 Гц, 1Н, HAr), 7.34-7.28 (м, 2Н, 2HAr), 7.14 (м, 1Н, HAr), 4.43 (кв J=7.1 Гц, 2Н, OCH2CH3), 3.85 (q, J=7.1 Гц, 4Н, NCH2CH3), 1.43 (т J=7.1 Гц, 3Н, ОСН2СН3), 1-35 (уш t, J=7 Гц, 6Н, NCH2CH3); 13С ЯМР (75.47 МГц, CDCl3, δ м.д.): 162.53, 135.68, 134.60, 125.88, 124.51, 120.87, 120.30, 118.70, 111.51, 60.81, 14.42.
Пример 3. Получение этилового эфира 3-(морфолинодиазенил)-1Н-индол-2-карбоновой кислоты (TU-91)
Этиловый эфир 3-(морфолинодиазенил)-1Н-индол-2-карбоновой кислоты получали в соответствии с Примером 1. В качестве вторичного амина использовали морфолин (тетрагидро-1,4-оксазин). Выход составил 51%.
Физико-химические данные: C15H18N4O3 (302.34); Тпл.=142-143°С (лит. 140-141°С); 1H ЯМР (400 МГц, CDCl3, δ м.д.): 8.81 (с, 1Н, NH), 8.23 (д J=8.2 Гц, 1Н, HAr), 7.37-7.31 (м, 2Н, 2HAr), 7.16 (м, 1Н, HAr), 4.44 (кв J=7.1 Гц, 2Н, OCH2CH3), 3.89 (м, 8Н, 2СН2СН2), 1.43 (т J=7.1 Гц, 3Н, OCH2CH3); 13С ЯМР (75.47 МГц, CDCl3, δ м.д.): 161.92, 135.49, 133.16, 126.15, 124.35, 121.53, 120.14, 119.82, 111.68, 66.47, 61.01, 14.45.
Пример 4. Получение этилового эфира 3-(пиперидинодиазенил)-1Н-индол-2-карбоновой кислоты (TU-111)
Этиловый эфир 3-(пиперидинодиазенил)-1Н-индол-2-карбоновой кислоты получали в соответствии с Примером 1. В качестве вторичного амина использовали пиперидин (пентаметиленимин). Выход составил 41%.
Физико-химические данные: Тпл.=162-164°С; ИК (KBr, cm-1): νmax 3309 (NH-индол), 1668 (С=O), 1523; 1H ЯМР (400 МГц, ДМСО-d6, δ м.д.): 11.56 (с, 1Н, NH), 8.10 (д J=8.2 Гц, 1Н, HAr), 7.401 (д J=8.2 Гц, 1Н, HAr), 7.26 (т J=7.6 Гц, 1Н, HAr), 7.06 (т J=7.6 Гц, 1Н, HAr), 4.31 (кв J=7.1 Гц, 2Н, OCH2CH3), 3.78 (уш м, 4Н, NCH2), 1.67 (уш м, 6Н, СН2), 1.34 (т J=7.1 Гц, 3Н, OCH2CH3); 13С ЯМР (75.47 МГц, ДМСО-d6, δ м.д.): 161.94, 136.40, 133.00, 125.79, 124.18, 121.21, 119.87, 119.35, 112.91, 60.62, 47.8, 25.36, 24.40, 14.75; MS m/z (%) 300 [М+, 100]. Вычислено C16H20N4O2 (300.36), %: С, 63.98; Н, 6.71; N, 18.65. Найдено, %: С, 63.71; Н, 6.56; N, 18.52.
Пример 5. Получение этилового эфира 3-[(4-метилпиперазино)диазенил]-1Н-индол-2-карбоновой кислоты (TU-112)
Этиловый эфир 3-[(4-метилпиперазино)диазенил]-1Н-индол-2-карбоновой кислоты получали в соответствии с Примером 1. В качестве вторичного амина использовали N-метилпиперазин. Выход составил 23%.
Физико-химические данные: Тпл.=143-144°С; ИК (KBr, cm-1): νmax 3314 (NH-индол), 1672 (С=O), 1523; 1Н ЯМР (400 МГц, ДМСО-d6, δ м.д.): 11.65 (с, 1Н, NH); 8.09 (д J=8.1 Гц, 1Н, HAr); 7.41 (д J=8.1 Гц, 2Н, HAr); 7.27 (т J=7.51, 1Н, HAr); 7.07 (т J=7.5, 1Н, HAr); 4.32 (кв J=7.0 Гц, 2Н, OCH2CH3); 3.75 (уш м, 4Н); 2.52 (уш м, перекрыт сигналом ДМСО); 2.26 (с, 3Н, NCH3); 1.34 (т J=7.0 Гц, 3Н, OCH2CH3); 13С ЯМР (100.61 МГц, ДМСО-d6, δ м.д.): 161.20, 135.75, 131.93, 125.24, 123.45, 120.80, 119.84, 118.63, 112.36, 60.09, 53.71, 45.51, 14.14; MS m/z (%) 315 [М+, 100]. Вычислено C16H21N5O2 (315.38), %: С, 60.93; Н, 6.71; N, 21.21. Найдено, %: С, 60.72; Н, 6.62; N, 21.87.
Пример 6. Получение этилового эфира 3-(пирролидинодиазенил)-1Н-индол-2-карбоновой кислоты (TU-114)
Этиловый эфир 3-(пирролидинодиазенил)-1Н-индол-2-карбоновой кислоты получали в соответствии с Примером 1. В качестве вторичного амина использовали пирролидин (тетраметиленимин). Выход составил 78%.
Физико-химические данные: Тпл.=173-174°С; ИК (KBr, cm-1): νmax 3306 (NH-индол), 1663 (С=O), 1520; 1H ЯМР (400 МГц, ДМСО-d6, δ м.д.): 11.45 (с, 1Н, NH), 8.06 (д J=8.3 Гц, 1Н, HAr), 7.38 (д J=8.3 Гц, 2Н, HAr), 7.24 (т J=7.6 Гц, 2Н, HAr), 7.04 (т J=7.6 Гц, 1Н, HAr), 4.30 (кв J=7.0 Гц, 2Н, OCH2CH3), 3.76 (уш м, 4Н, NCH2), 1.99 (уш м, 4Н, СН2СН2), 1.34 (т J=7.0 Гц, 3Н, OCH2CH3); 13С ЯМР (100.61 МГц, ДМСО-d6, δ м.д.): 161.52, 135.81, 133.52, 125.10, 123.54, 120.27, 118.96, 118.49, 112.24, 59.89, 23.29, 14.20; MS m/z (%) 286 [М+, 100]. Вычислено C15H18N4O2 (286.33), %: С, 62.91; Н, 6.34; N, 19.57. Найдено, %: С, 63.29; Н, 6.11; N, 19.54.
Пример 7. Получение этилового эфира 3-[(пергидроазепино)диазенил]-1Н-индол-2-карбоновой кислоты (TU-152)
Этиловый эфир 3-[(пергидроазепино)диазенил]-1Н-индол-2-карбоновой кислоты получали в соответствии с Примером 1. В качестве вторичного амина использовали пергидроазепин (гексаметиленимин). Выход составил 89%.
Физико-химические данные: Тпл.=172-174°С; ИК (KBr, cm-1): νmax 3313 (NH-indole), 1666 (C=O), 1522; lH ЯМР (400 МГц, ДМСО-d6, δ м.д.): 11.42 (с, 1H, NH), 8.09 (д J=8.3 Гц, 1H, HAr), 7.38 (д J=8.3 Гц, 1Н, HAr), 7.24 (т J=8.3 Гц, 1Н, HAr), 7.04 (т J=8.2 Гц, 1Н, HAr), 4.30 (кв J=7.0 Гц, 2H, OCH2CH3), 4.00 (уш м, 2Н, NCH2), 3.80 (уш м, 2Н, NCH2), 1.86 (уш м, 2Н), 1.77 (уш м, 4Н), 1.56 (уш м, 4Н, СН2), 1.33 (т J=7.0 Гц, 3Н, OCH2CH3); 13С ЯМР (100.61 МГц, ДМСО-d6, δ м.д.): 162.08, 136.39, 133.88, 125.63, 124.12, 120.80, 119.60, 118.97, 112.79, 60.43, 54.01, 47.78, 30.25, 28.74, 27.86, 24.83, 14.74; MS m/z (%) 314 [M+, 100]. Вычислено C17H22N4O2 (314.38), %: С, 64.94; H, 7.05; N, 17.82. Найдено, %: С, 64.94; Н, 6.79; N, 17.17.
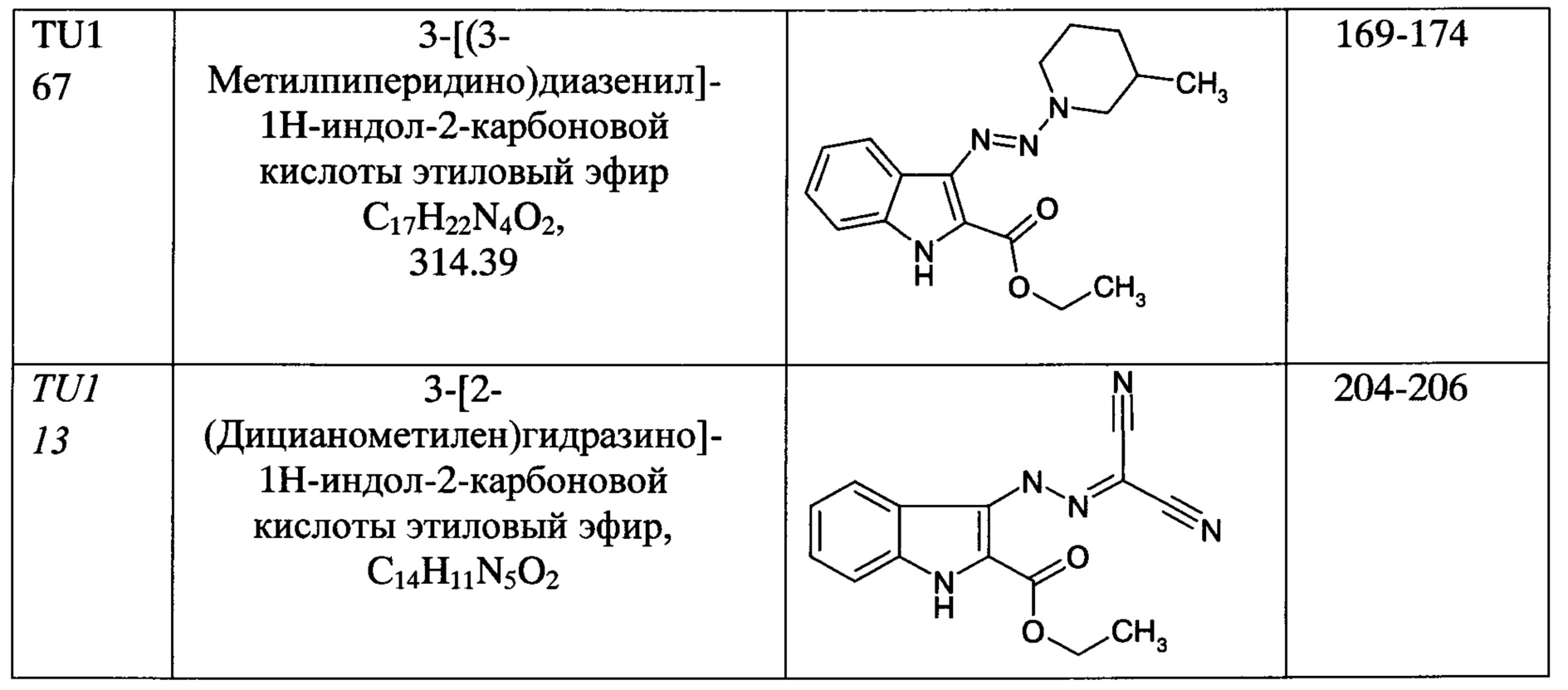
Пример 8. Получение этилового эфира 3-[(3-метилпиперидино)диазенил]-1Н-индол-2-карбоновой кислоты (TU-167)
Этиловый эфир 3-[(3-метилпиперидино)диазенил]-1H-индол-2-карбоновой кислоты получали в соответствии с Примером 1. В качестве вторичного амина использовали 3-метилгашеридин. Выход составил 85%.
Физико-химические данные: Tпл.=153-155°C; ИК (KBr, cm-1): νmax 3317 (NH-indole), 1666 (C=O), 1522; 1H ЯМР (400 МГц, ДМСО-d6, δ м.д.): 11.56 (с, 1Н, NH), 8.10 (д J=8.1 Гц, 1H, HAr), 7.40 (д J=8.1 Гц, 1Н, HAr), 7.26 (т J=7.6 Гц, 1Н, HAr), 7.06 (т J=7.6 Гц, 1Н, HAr), 4.40 (уш с, 2Н), 4.24 (кв J=7.1 Гц, 2Н, OCH2CH3), 3.11 (уш с, 1Н), 1.83-1.72 (м, 3Н), 1.57 (м, 1Н), 1.34 (т J=7.1 Гц, 3Н, OCH2CH3), 1.24 (м, 1Н), 0.96 (д J=7.0 Гц, 3Н); 13С ЯМР (100.61 МГц, ДМСО-d6, δ м.д.): 161.40, 135.83, 132.39, 125.18, 123.59, 120.58, 119.27, 118.78, 112.30, 60.01, 32.27, 18.90, 14.13; MS m/z (%) 314 [М+, 100]. Вычислено C17H22N4O2 (314.39), %: С, 64.94; Н, 7.00; N, 17.50. Найдено, %: С, 64.94; Н, 7.05; N, 17.82.
Пример 9. Получение этилового эфира 3-[2-(дицианометилен)гидразино]-1Н-индол-2-карбоновой кислоты (TU-113)
Этиловый эфир 3-[2-(дицианометилен)гидразино]-1Н-индол-2-карбоновой кислоты получали по методике, описанной в Примере 1, но вместо вторичного амина к 2-этоксикарбонил-3-диазоиндолу в этаноле добавляли малононитрил (динитрил малоновой кислоты). Выход составил 47%.
Физико-химические данные: Тпл.=204-206°С; ИК (KBr, cm-1): νmax 3304 (NH-индол), 1676 (С=O), 2209, 2223, 1518; 1H ЯМР (400 МГц, ДМСО-d6, δ м.д.): 12.13 (уш с, 1Н, NH), 11.88 (уш с, 1Н, NH), 7.92 (д J=8.3 Гц, 1Н, HAr), 7.48 (д J=8.3 Гц, 1Н, HAr), 7.40 (т J=7.5 Гц, 1H, HAr), 7.19 (т J=7.5 Гц, 1H, HAr), 4.42 (кв J=7.1 Гц, 2Н, OCH2CH3), 1.41 (т J=7.1 Гц, 3Н, OCH2CH3); 13С ЯМР (100.61 МГц, ДМСО-d6, δ м.д.): 161.07, 135.64, 126.75, 124.50, 121.50, 121.11, 117.07, 113.80, 113.29, 113.13, 109.12, 85.05, 61.51, 14.10; MS m/z (%) 281 [М+, 100]. Вычислено C14H11N5O2 (281.28), %: С, 60.00; Н, 3.60; N, 24.99. Найдено, %: С, 59.47; Н, 3.92; N, 24.70.
Пример 10. Испытания противотуберкулезной активности новых соединений in vitro
Микобактерий ресуспендировали в среде RPMI-1640 без антибиотиков с добавлением 2% эмбриональной телячьей сыворотки. Суспензии культивировали в лунках 96-луночного плейта (250×103 микобактерий/лунку). Исследуемые соединения растворяли в ДМСО (2 мг/мл) и добавляли в лунки до конечной концентрации 20, 2 и 0,2 мкг/мл в трипликатах через 24 часа после начала культивирования микобактерий. Культуры инкубировали дополнительно 65 ч, при этом последние 18 ч в присутствии [3Н]-урацила; жизнеспособность микобактерий оценивают по уровню включения радиоактивной метки. Для наиболее перспективных соединений определяли минимальную ингибирующую концентрацию (МИК), как с помощью стандартного метода разведений соединений в жидкой культуральной среде Дюбо или 7Н9 в течение 14 дней [Dubuisson Т., Bogatcheva Е., Krishnan М. Y., et al. // J. Antimicrob. Chemother. 2010, 65, 2590-2597], так и с помощью адаптированного микрометода, который основан на измерении под микроскопом объема растущей компактной микобактериальной культуры в 96-луночных круглодонных планшетах в присутствии или в отсутствие анализируемого соединения (К. Майоров, неопубликованный данные). МИК для М. avium определяли идентичным образом, за исключением того, с однонедельной инкубации вместо двухнедельной. Тестирование токсичности соединений в отношении клеток хозяина определяли in vitro, используя CytoTox 96 kit (Promega), по высвобождению в культуральную среду цитозольного маркера макрофагов - лактатдегидрогеназы (LDH), появляющейся в супернатантах макрофагальных культур в результате лизиса макрофагов. Специфический лизис, индуцированный тестируемыми соединениями, подсчитывали по формуле в соответствии с рекомендацией производителя [Majorov K.В., Lyadova I.V., Kondratieva Т.K., Eruslanov Е.В., et al. // Infect. Immun., 2003, 71, 697-707].
Индекс селективности (SI) рассчитывался путем деления значения концентрации полумаксимального ингибирования (IC50) на значение минимальной ингибирующей концентрации.
Результаты in vitro испытаний антимикобактериальной активности замещенных 3-триазеноиндолов в сравнении с классическими антимикобактериальными препаратами (изониазид, рифампицин, кларитромицин) представлены в таблице 2.
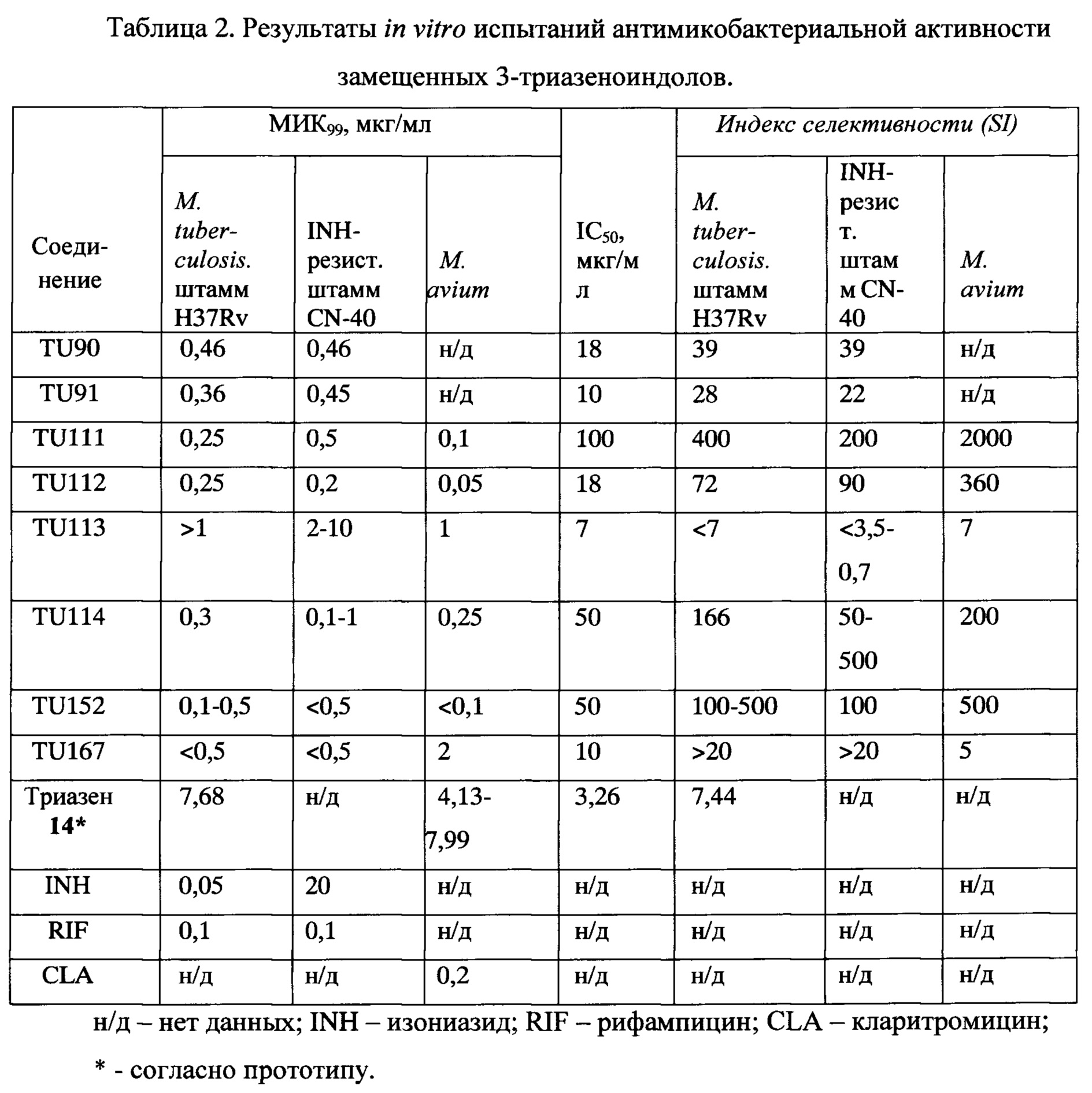
Все синтезированные замещенные 3-триазеноиндолы, приведенные в таблице 2, продемонстрировали высокий уровень in vitro активности против штамма М. tuberculosis H37Rv (МИК99=0,25-0,5 мкг/мл, сравнима с изониазидом) и против INH-резистентного штамма CN-40 (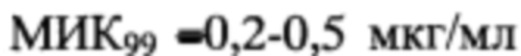 , сравнима с рифампицином). Эти соединения также продемонстрировали высокий уровень активности против вирулентного штамма М. avium 724R, сравнимый с кларитромицином. Значение индекса селективности (SI) для соединений TU111, 112, 114 и 152 был значительно выше 10 для всех трех штаммов микобактерий, что указывает на их низкую цитотоксичность и необходимость их дальнейшего тестирования. Взятый для сравнения гидразон TU113 показал довольно низкий уровень антимикобактериальной активности, а триазен 14 (1,3-бис[(4-хлор-3-(трифторметил)фенил)]триазен) согласно прототипу показал недопустимо низкое значение индекса селективности (7,44).
, сравнима с рифампицином). Эти соединения также продемонстрировали высокий уровень активности против вирулентного штамма М. avium 724R, сравнимый с кларитромицином. Значение индекса селективности (SI) для соединений TU111, 112, 114 и 152 был значительно выше 10 для всех трех штаммов микобактерий, что указывает на их низкую цитотоксичность и необходимость их дальнейшего тестирования. Взятый для сравнения гидразон TU113 показал довольно низкий уровень антимикобактериальной активности, а триазен 14 (1,3-бис[(4-хлор-3-(трифторметил)фенил)]триазен) согласно прототипу показал недопустимо низкое значение индекса селективности (7,44).
Помимо всего прочего, соединения TU111 и TU112 были протестированы в отношении их активности против не поддающихся культивированию, "дремлющих" клеток штамма H37Rv М. tuberculosis. Поскольку соединение TU111 не продемонстрировало заметной активности в этом тесте, более подробная оценка была выполнена с соединением TU112. Примечательно, что в то время как рифампицин и изониазид оказались неэффективны против метаболически неактивных микобактерий, TU112 убивал эти клетки даже при вдесятеро более низких концентрациях (см. фигуру 1). Что касается химической структуры исследованных соединений, оказалось, что наличие трех непосредственно связанных атомов азота (триазеновый фрагмент) является необходимым условием для проявления антимикобактериальной активности (таблица 2). Соединения TU111, 112, 114 и 152, представленные здесь, следует рассматривать в качестве очень перспективных лекарственных кандидатов для дальнейшего тестирования в дополнительных моделях, в том числе в условиях тестирования in vivo.
Приведенные выше данные свидетельствуют о высокой результативности выбранного подхода к конструированию молекул-кандидатов и являются основанием для перехода к доклиническим испытаниям in vivo.
Тот факт, что созданные потенциальные лекарственные кандидаты получены из доступных предшественников в результате проведения всего лишь двухстадийного несложного синтеза, является основанием для создания дешевой и простой технологии их производства. Это выгодно отличает описанные в настоящем изобретении простые по строению малые молекулы от сложных структур новых лекарственных кандидатов бедаквилина и SQ-109, получаемых путем технологически сложных многостадийных процессов.
В случае успешного прохождения клинических испытаний созданный препарат будет использован при производстве новых лекарственных средств для лечения заболеваний, возбудителями которых являются микобактерий, в частности туберкулеза.
Соединения, сконструированные на основе индольного скаффолда, показали in vitro активность против изониазид-резистентного штамма М. tuberculosis и М. avium. Приведенные данные свидетельствуют о высокой результативности заявленного изобретения в отношении конструирования молекул-кандидатов, активных как против чувствительных, так и против резистентных штаммов М. tuberculosis. Изобретение позволит создать противотуберкулезный препарат, не уступающий по своим характеристикам известным лекарственным препаратам 1-ого ряда (в том числе, изониазиду), но превосходящий его по активности против резистентных штаммов микобактерий.