Результат интеллектуальной деятельности: СПОСОБЫ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка заявляет приоритет относительно предварительной заявки на патент США № 61/937472, поданной 8 февраля 2014 г., предварительной заявки на патент США № 61/971479, поданной 27 марта 2014 г., предварительной заявки на патент США № 62/010259, поданной 10 июня 2014 г., и предварительной заявки на патент США № 62/081992, поданной 19 ноября 2014 г., причем содержание вышеуказанных заявок включено в настоящее описание в качестве ссылки во всей их полноте.
ОБЛАСТЬ ТЕХНИКИ
[0002] Предложены способы лечения пациентов, страдающих болезнью Альцгеймера от легкой до умеренной степени, с использованием антител, нацеленных на β-амилоид.
УРОВЕНЬ ТЕХНИКИ
[0003] Болезнь Альцгеймера (БА) является наиболее частой причиной деменции, поражающей около 4,5 миллионов человек в Соединенных Штатах Америки и 26,6 миллионов во всем мире (Hebert et al, Arch. Neurol. 2003; 60:1119-22; Brookmeyer et al., Alzheimers Dement. 2007; 3:186-91). Заболевание характеризуется патологически накоплением внеклеточных β-амилоидных (Aβ) бляшек и внутриклеточных нейрофибриллярных клубков в головном мозге. Диагноз ставится на основании клинической оценки неврологических и психоневрологических признаков и симптомов БА и исключения других причин деменции. БА обычно разделяют на заболевание легкой, средней и тяжелой стадии с использованием краткого когнитивного скринингового обследования по Краткой шкале оценки психического статуса (MMSE). Одобренные медицинские лекарственные средства, ингибирующие активность ацетилхолинэстеразы (AChE) или оказывающие антагонистическое влияние на рецепторы N-метил-D-аспартата в головном мозге, могут временно улучшать симптомы БА у некоторых пациентов, но не изменяют прогрессирование заболевания (Cummings, N. Engl. J. Med. 2004; 351:56-67).
[0004] В настоящее время хорошо известны генетические факторы семейной БА с ранним и поздним началом заболевания. Аллель ApoE4 тесно связан с семейной БА с поздним началом и спорадическим заболеванием, причем зарегистрированная частота аллеля у пациентов с БА составляет 50%-65%, что примерно в три раза выше по сравнению с общей популяцией и по сравнению с другими неврологическими расстройствами (Saunders et al., Neurology 1993; 43:1467-72,; Prekumar et al., Am. J. Pathol. 1996; 148:2083-95). Кроме БА, аллель ApoE4 участвует в других расстройствах с образованием амилоида, включая церебральную амилоидную ангиопатию (ЦАА) (Prekumar et al., Am. J. Pathol. 1996; 148:2083-95). Таким образом, пациенты, несущие аллель ApoE4, могут представлять собой популяцию пациентов с БА с определенной этиологией.
[0005] Отложение внеклеточных амилоидных бляшек в головном мозге является отличительным патологическим признаком БА, о котором в 1906 году впервые сообщил Алоис Альцгеймер. Эти амилоидные бляшки в основном состоят из Abeta-пептидов (Haass and Selkoe, Nature 2007; 8:656-67), которые генерируется путем последовательного расщепления белка-предшественника амилоида (АРР) посредством активности β- и γ-секретазы. Бета-амилоид (Abeta), в частности в его олигомеризованных формах, является токсичным для нейронов и считается этиологическим фактором БА. Лекарственные средства, снижающие уровни Abeta в головном мозге, могут облегчать когнитивную дисфункцию и блокировать дальнейшее ухудшение синаптической передачи, дегенерацию аксонов и гибель нервных клеток. Abeta может активно транспортироваться через гематоэнцефалический барьер (Deane et al., Stroke 2004; 35(Suppl I):2628-31). В мышиных моделях БА системная доставка антител к Abeta повышает уровни Abeta в плазме, одновременном снижая его уровни в центральной нервной системе (ЦНС) посредством нескольких предполагаемых механизмов, включающих растворение бляшек Abeta в головном мозге, фагоцитарное удаление опсонизированного Abeta и, наконец, посредством оттока Abeta из головного мозга в результате равновесного сдвига Abeta, к которому приводят циркулирующие антитела (Morgan, Neurodegener. Dis. 2005; 2:261-6).
[0006] Разработка терапевтических антител для лечения БА потерпела значительные неудачи. Крупномасштабные клинические исследования третьей фазы бапинейзумаба (антитела, которое специфически связывается с N-концевой частью Abeta) были прекращены после того, как введение лекарственного средства не смогло задержать когнитивные нарушения у пациентов, получавших лечение (Miles et al., Scientific Reports 2013; 3:1-4 Johnston & Johnson пресс релиз от 6 августа 2012 г., озаглавленный Johnson & Johnson Announces Discontinuation of Phase 3 Development of Bapineuzumab Intravenous (IV) in Mild-To-Moderate Alzheimer's Disease). Следует отметить, что, как оказалось, бапинейзумаб стабилизирует уровни бляшек и сниженные уровни фосфорилированного тау-белка в спинномозговой жидкости, означая, что модификация этих биомаркеров в одиночку не обязательно является прогностической для клинической эффективности (Miles et al., Scientific Reports 2013; 3:1-4). Аналогичным образом, в третьей фазе клинических исследований соланезумаба, антитела, специфического для мономерного Abeta, которое связывается со средней частью пептида, первичные когнитивные и функциональные конечные точки не были достигнуты (пресс релиз от Eli Lilly and Company от 24 августа 2012 г., озаглавленный Eli Lilly and Company Aanounces Top-Line Results on Solanezumab Phase 3 Clinical Trials in Patients with Alzheimer's Disease). Проблемы безопасности также возникли в ходе исследования некоторых иммунотерапевтических средств для лечения БА; например, частота обнаруживаемых при визуализации патологий, связанных с отложением амилоида (ARIA-E и ARIA-H) во второй фазе клинических исследований бапинейзумаба у пациентов, получавших лекарственное средство, составила более 20% (Sperling et al., The Lancet 2012; 11:241-249). Предполагается, что один из девяти человек в возрасте старше 65 лет имеет БА. Суммарные ежегодные затраты на здравоохранение, долгосрочный уход и уход в хосписе за пациентами, страдающими БА, и на защиту их интересов, составили более 200 миллиардов долларов США в 2013 году, и по оценкам к 2050 году возрастет до 1,2 триллиона долларов США (на лиц, пораженных заболеваниям, и на защиту их интересов) (Alzheimer's Association 2013 Alzheimer's Disease Facts and Figures, Alzheimer's and Dementia 9:2). БА являлась шестой ведущей причиной смерти в Соединенных Штатах в 2013 г. (id.). В настоящее время одобренные лекарственные средства лечат только некоторые симптомы БА, а не лежащую в основе заболевания дегенерацию. Существует огромная неудовлетворенная потребность в терапевтическом средстве для лечения БА, изменяющем заболевание.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0007] Кренезумаб (также известный как MABT5102A) представляет собой полностью гуманизированное моноклональное антитело IgG4 к Abeta, выбранное за его способность связываться как с мономерными, так и с олигомерными формами Abeta in vitro. Кренезумаб связывается как с Abeta1-40, так и с Abeta 1-42, ингибирует агрегацию Abeta и стимулирует дезагрегацию Abeta. Поскольку кренезумаб является основой антитела IgG4 человека, он уменьшает аффинность связывания рецептора Fcγ (FcλR) по сравнению с IgG1 или IgG2 человека, что является прогностическим в отношении снижения ответа иммунного эффектора. Эти свойства, в сочетании со способностью доставляемого системно кренезумаба снижать уровни Abeta в ЦНС в мышиной модели БА, дают возможность предположить, что указанный терапевтический подход с использованием антител к Abeta может обеспечить клиническую эффективность при одновременном снижении риска токсичности, и потенциально может быть способен модифицировать прогрессирование заболевания БА с более низким риском развития потенциально неблагоприятных побочных эффектов, таких как церебральный вазогенный отек или кровоизлияния, которые ранее наблюдались в клинических исследованиях других лекарственных антител к Abeta.
[0008] Результаты второй фазы клинических исследований у пациентов с БА, описанные в настоящем документе, показывают, что кренезумаб действительно замедляет прогрессирование заболевания при легкой и умеренной степени тяжести БА, имеет даже более выраженный эффект у ApoE4-положительных пациентов и у пациентов, страдающих БА легкой степени тяжести, и показывает наибольший терапевтический эффект у пациентов с самой легкой степенью тяжести БА. Кроме того, эффект наблюдается у пациентов, имеющих амилоидную нагрузку в головном мозге, которая, как правило, наблюдается у пациентов с диагнозом БА. Кроме того, результаты показывают, что эти эффекты имеют место без значительной частоты возникновения неблагоприятных событий, таких как ARIA-E и ARIA-H. Таким образом, в настоящей заявке предложены способы лечения и наблюдения пациентов с диагнозом БА от легкой до умеренной степени тяжести, особенно с БА легкой степени тяжести, и ApoE4-положительных пациентов, а также пациентов с накоплением амилоида в головном мозге, которое, как правило, наблюдается у пациентов с диагнозом БА. Как показано в качестве примера в настоящем документе, на сегодняшний день обнаружено, что гуманизированное моноклональное антитело к бета-амилоиду с конформационным эпитопом, специфическим для средней области пептида бета-амилоида (Aβ) (т. е., в пределах аминокислот 13-24, например, кренезумаб) является эффективным для лечения БА от легкой до умеренной степени тяжести, особенно ApoE4-положительных пациентов и пациентов с более легкими формами БА, таких как, но не ограничиваясь перечисленным, БА легкой степени тяжести без повышенной частоты возникновения ARIA-E или ARIA-H. Соответственно, в настоящей заявке предложены терапевтические средства для модулирования тяжести БА и улучшенные способы применения этих средств.
[0009] Следовательно, в настоящей заявке предложены способы лечения пациентов, страдающих БА и другими амилоидозами, включающие введение гуманизированного моноклонального антитела к бета-амилоиду (Aβ или Abeta) или его антиген-связывающего фрагмента, который связывается в пределах остатков 13 и 24 β-амилоида (1-42) (SEQ ID NO: 1). В некоторых вариантах реализации настоящего изобретения антитело или его антиген-связывающий фрагмент способны связываться с фибриллярной, олигомерной и мономерной формами Abeta. В некоторых вариантах реализации настоящего изобретения антитело представляет собой антитело IgG4. В конкретных вариантах реализации настоящего изобретения антитело или его антиген-связывающий фрагмент содержит шесть гипервариабельных участков (HVR), где HVR-H1 представляет собой SEQ ID NO: 2, HVR-H2 представляет собой SEQ ID NO: 3, HVR-H3 представляет собой SEQ ID NO: 4, HVR-L1 представляет собой SEQ ID NO: 6, HVR-L2 представляет собой SEQ ID NO: 7 и HVR-L3 представляет собой SEQ ID NO: 8. В некоторых вариантах реализации настоящего изобретения антитело или его антиген-связывающий фрагмент содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, которая содержит вариабельную область тяжелой цепи, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9, которая содержит вариабельную область легкой цепи. В конкретном примере антитело представляет собой кренезумаб.
[0010] Способы лечения, предложенные в настоящем документе, можно применять у пациентов, страдающих БА или другим амилоидозом, как описано далее в настоящем документе. Подходящие пациенты включают пациентов, страдающих БА от легкой до умеренной степени тяжести, пациентов с оценкой по шкале MMSE от 18 до 26 баллов, пациентов, страдающих БА легкой степени тяжести, пациентов с оценкой по шкале MMSE 20 баллов или выше (например, 20-30, 20-26, 24-30, 21-26, 22-26, 22-28, 23-26, 24-26 или 25-26), пациентов, страдающих ранней БА (включая пациентов с легким когнитивным нарушением, связанным с БА, и пациентов, имеющих доклиническую БА), пациентов с наличием амилоида (или пациентов, имеющих амилоидную нагрузку в головном мозге, которая согласуется с наблюдаемой у пациентов с диагнозом БА) и ApoE4-положительных пациентов, страдающих БА от легкой до умеренной степени тяжести или заболеванием легкой степени тяжести.
[0011] В некоторых аспектах способы, предложенные в настоящем документе, представляют собой способы уменьшения ухудшения, связанного с БА, у пациентов, страдающих ранней БА, заболеванием легкой степени тяжести или заболеванием от легкой до умеренной степени тяжести. В некоторых вариантах реализации настоящего изобретения ухудшение представляет собой одно или более из: клинического ухудшения, когнитивного ухудшения и функционального ухудшения. В некоторых вариантах реализации настоящего изобретения ухудшение представляет собой клиническое ухудшение. В некоторых вариантах реализации настоящего изобретения ухудшение представляет собой ухудшение когнитивной способности или когнитивное ухудшение. В некоторых вариантах реализации настоящего изобретения ухудшение представляет собой ухудшение функциональной способности или функциональное ухудшение. Для измерения когнитивной способности (включая память) и/или функцию были разработаны различные тесты и шкалы. В различных вариантах реализации настоящего изобретения для измерения клинического, функционального или когнитивного ухудшения используют один или более тестов. В качестве стандартного измерения когнитивной способности используют исследование по шкале оценки когнитивной функции при болезни Альцгеймера (ADAS-Cog), например, ADAS-Cog с 12 предметами или ADAS-Cog12. Таким образом, в некоторых вариантах реализации настоящего изобретения уменьшение или замедление ухудшения когнитивной способности (или когнитивного ухудшения) у пациентов, пролеченных антителами по настоящему изобретению, определяют с помощью исследования ADAS-Cog12. Увеличение оценки по шкале ADAS-Cog12 указывает на ухудшение состояния пациента. В некоторых вариантах реализации настоящего изобретения уменьшение или замедление когнитивного ухудшения (или ухудшения когнитивной способности) у пациентов, пролеченных антителами по настоящему изобретению, определяют по клинической рейтинговой шкале деменции/сумме боксированных баллов (CDR-SOB). В некоторых вариантах реализации настоящего изобретения уменьшение или замедление функционального ухудшения (или ухудшения функциональной способности) у пациентов, пролеченных антителами по настоящему изобретению, определяют с помощью шкалы инструментальной активности в повседневной жизни (iADL). В некоторых вариантах реализации настоящего изобретения оценивают ухудшение одного или более типов, и для измерения уменьшения или замедления ухудшения используют один или более из указанных выше тестов или шкал.
[0012] Антитело или его антиген-связывающий фрагмент по настоящему изобретению вводят в дозе, которая является эффективной для лечения БА или другого амилоидоза, описанного в настоящем документе. Подходящие дозы описаны в настоящем документе и могут находиться в диапазоне от около 0,3 мг/кг до 100 мг/кг. В иллюстративном варианте реализации настоящего изобретения доза составляет 15 мг/кг. В дополнительном иллюстративном варианте реализации настоящего изобретения доза составляет 30 мг/кг. В дополнительном иллюстративном варианте реализации настоящего изобретения доза составляет 45 мг/кг. В некоторых вариантах реализации настоящего изобретения доза находится в диапазоне от 500 мг до 1000 мг, например 500 мг, 700 мг, 720 мг, 750 мг, 800 мг, 820 мг, 900 мг, или от 1000 мг до 2500 мг, например 1050 мг, 1500 мг или 2100 мг. В предлагаемых в настоящем описании способах предусмотрены схемы дозирования, включая схемы дозирования, в которых антитело вводят многократно, например, один раз в неделю или ежемесячно, в течение длительного периода времени, например, в течение периода от нескольких месяцев до лет.
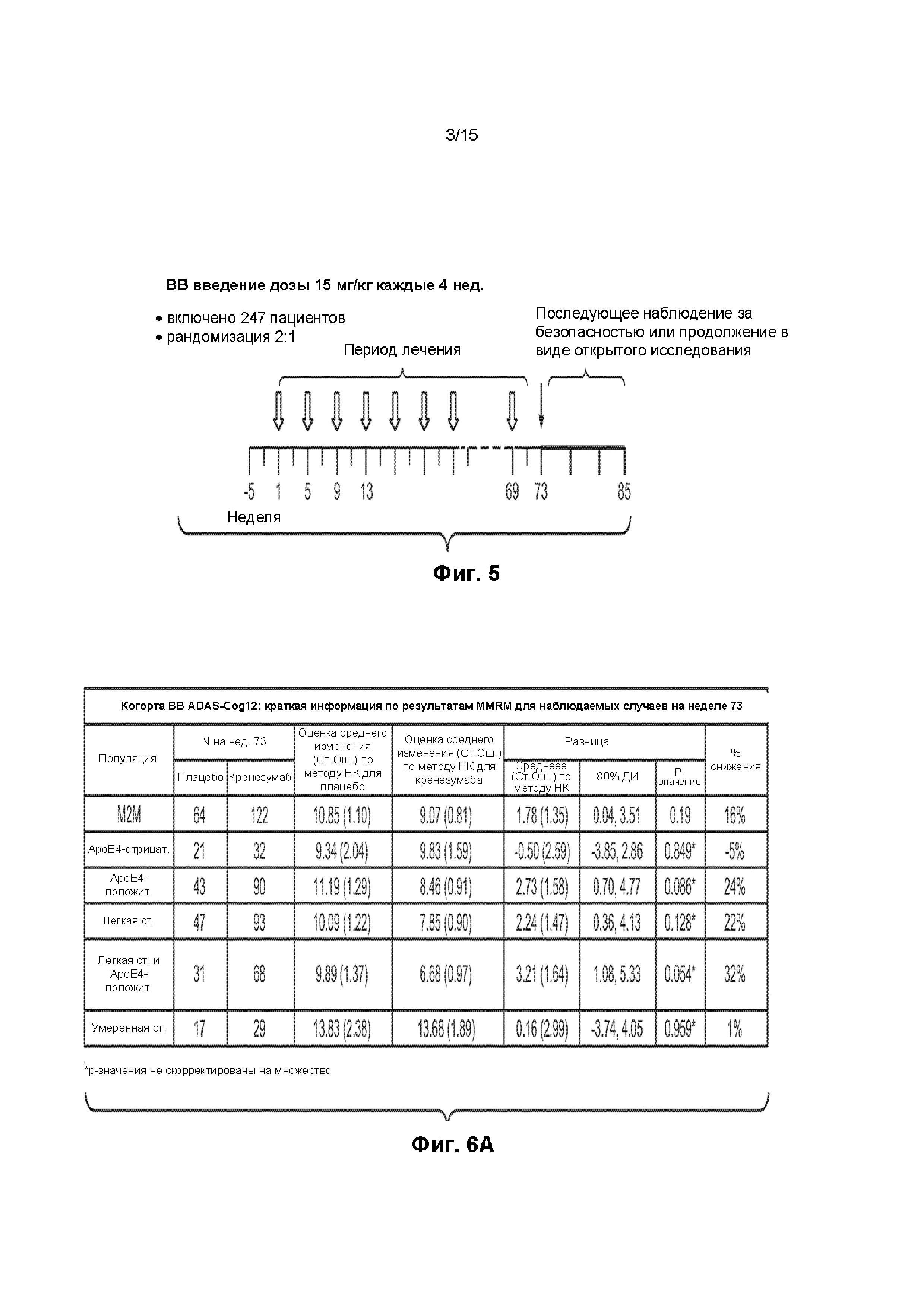
[0013] Гуманизированное моноклональное антитело к Abeta по настоящему изобретению обеспечивает дополнительное преимущество в том, что оно не приводит к увеличению частоты возникновения неблагоприятных событий, таких как ARIA-E и ARIA-H. Как показано в настоящем документе, в группе, получавшей лечение, по сравнению с группой, получавшей плацебо, не наблюдалось увеличения числа этих неблагоприятных событий. Таким образом, в настоящем изобретении также предложены способы лечения пациентов, страдающих БА от легкой до умеренной степени тяжести или БА легкой степени тяжести без увеличения частоты возникновения неблагоприятных событий, таких как ARIA-E и/или ARIA-H.
[0014] В настоящем изобретении дополнительно предложены фармацевтические препараты, подходящие для применения в способах лечения, описанных в настоящем документе. Рецептура фармацевтических препаратов может быть разработана для любого удобного пути введения, например для парентеральной или внутривенной инъекции и, как правило, в дополнение к антителу к Abeta по настоящему изобретению включает один или более приемлемых носителей, вспомогательных веществ и/или разбавителей, подходящих для желаемого способа введения. В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению может быть введено в состав для внутривенного введения. В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению может быть введено в состав с аргининовым буфером, например, буфером аргининсукцината. Буфер может содержать одно или более поверхностно-активных веществ, например полисорбат. В некоторых вариантах реализации настоящего изобретения концентрация буфера составляет 50 мМ или больше. В некоторых вариантах реализации настоящего изобретения уровень pH находится в диапазоне от 4,5 до 7,0, например pH 5,5. Дополнительные варианты реализации настоящего изобретения описаны в настоящем документе. Для простоты применения фармацевтические препараты могут быть упакованы в единичные лекарственные формы.
[0015] Лечение антителами к Abeta для лечения БА или другого амилоидоза, описанного в настоящем документе, можно комбинировать с другим видом терапии, включая одно или более антител к Abeta, отличное от кренезумаба. Не имеющие ограничительного характера примеры другого вида терапии включают неврологические лекарственные средства, кортикостероиды, антибиотики и противовирусные средства. Не имеющие ограничительного характера примеры антител к Abeta, отличных от кренезумаба, включают соланезумаб, бапинейзумаб, адуканумаб и гантенерумаб.
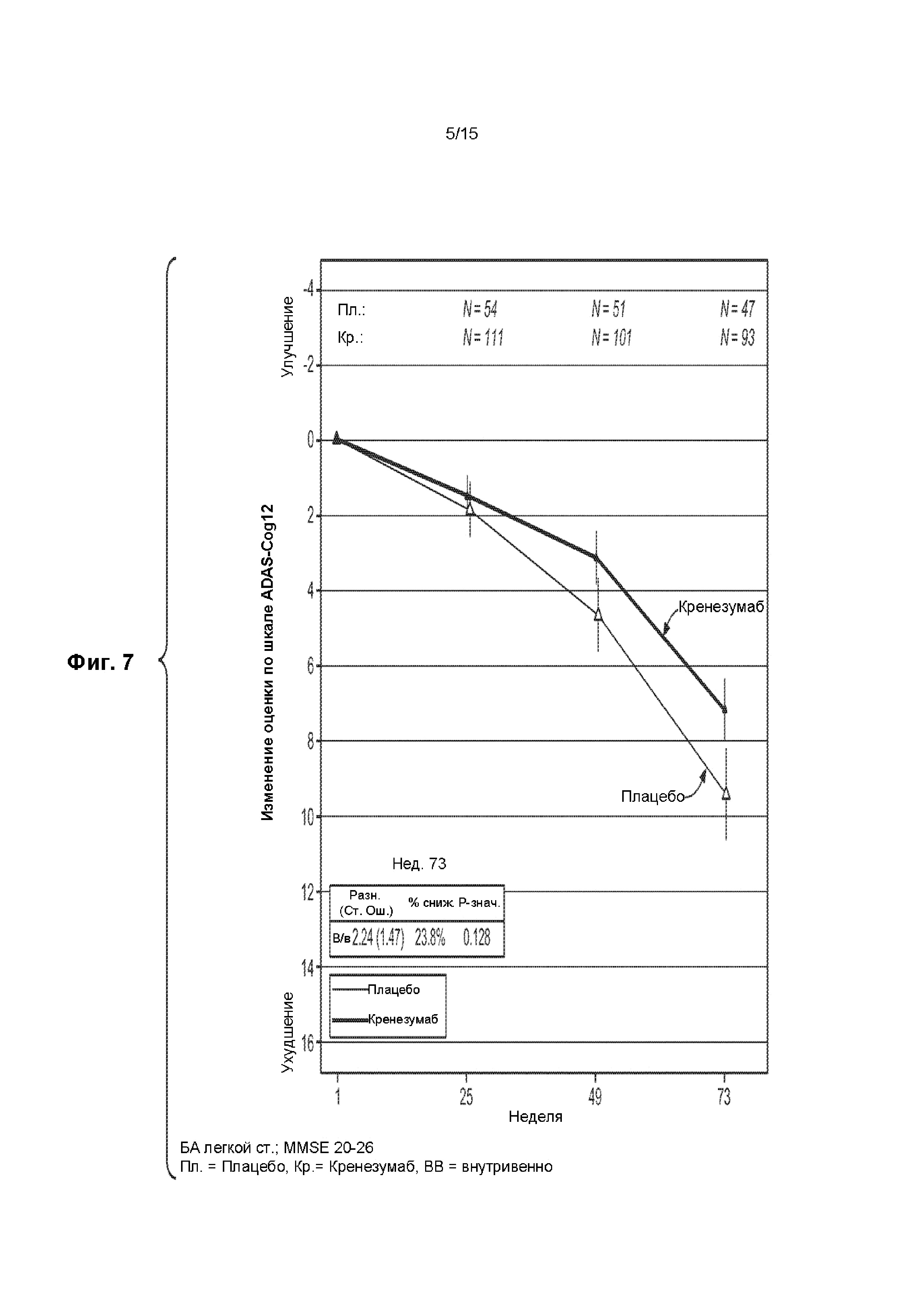
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0016] На ФИГ. 1 представлена аминокислотная последовательность Abeta (1-42) (SEQ ID NO: 1) с подчеркнутыми аминокислотами 13-24.
[0017] На ФИГ. 2 представлены аминокислотные последовательности трех гипервариабельных участков тяжелой цепи (HVR-H1, HVR-H2 и HVR-H3, соответственно) и аминокислотные последовательности трех участков легкой цепи (HVR-L1, HVR-L2, HVR-L3, соответственно).
[0018] На ФИГ. 3 представлена аминокислотная последовательность тяжелой цепи (SEQ ID NO: 5), содержащая связующие аминокислоты 1-112 SEQ ID NO: 5 вариабельной области тяжелой цепи, и легкой цепи (SEQ ID NO: 9), содержащая связующие аминокислоты 1-112 SEQ ID NO: 9 вариабельной области легкой цепи кренезумаба. Подчеркивание в SEQ ID NO: 5 и 9 показывает аминокислотные последовательности трех HVR тяжелой цепи, соответствующие SEQ ID NO: 2-4 и трех HVR легкой цепи, соответствующие SEQ ID NO: 6-8, соответственно.
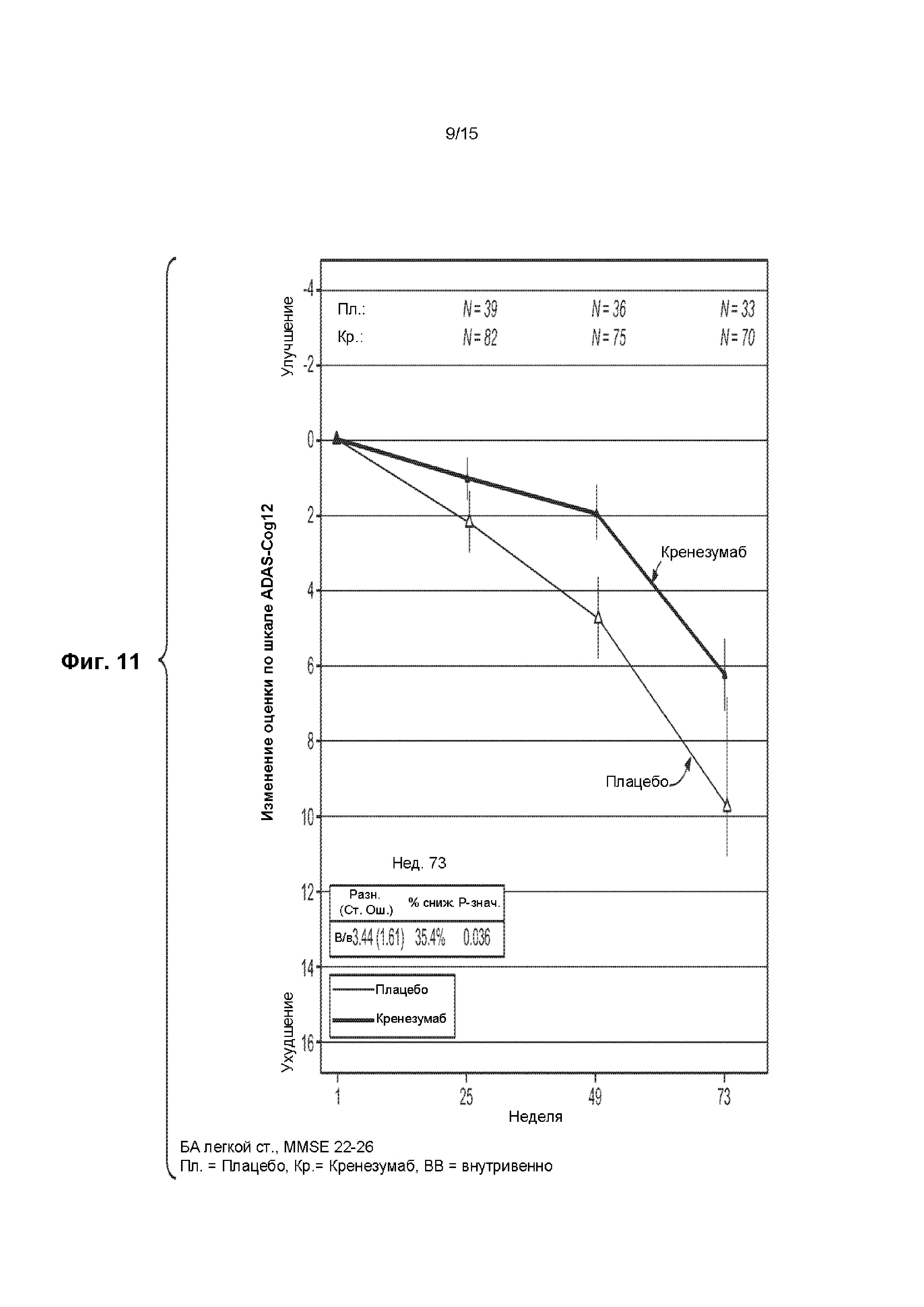
[0019] На ФИГ. 4A-B представлена краткая информация о пациентах, включенных в клиническое исследование, описанное в примере 1, со сведением в таблицу числа пациентов, включенных в каждую группу (лечение в сравнении с плацебо), статуса ApoE4 (отсутствие ApoE4/наличие ApoE4), стадии БА (легкая или умеренная) и оценки по шкале MMSE при скрининге, наличия и типа сопутствующей терапии (использование традиционной терапии) симптомов БА.
[0020] На ФИГ. 5 представлена схема клинических исследований, описанных в примере 1, показывающая график введения доз, количество и путь введения.
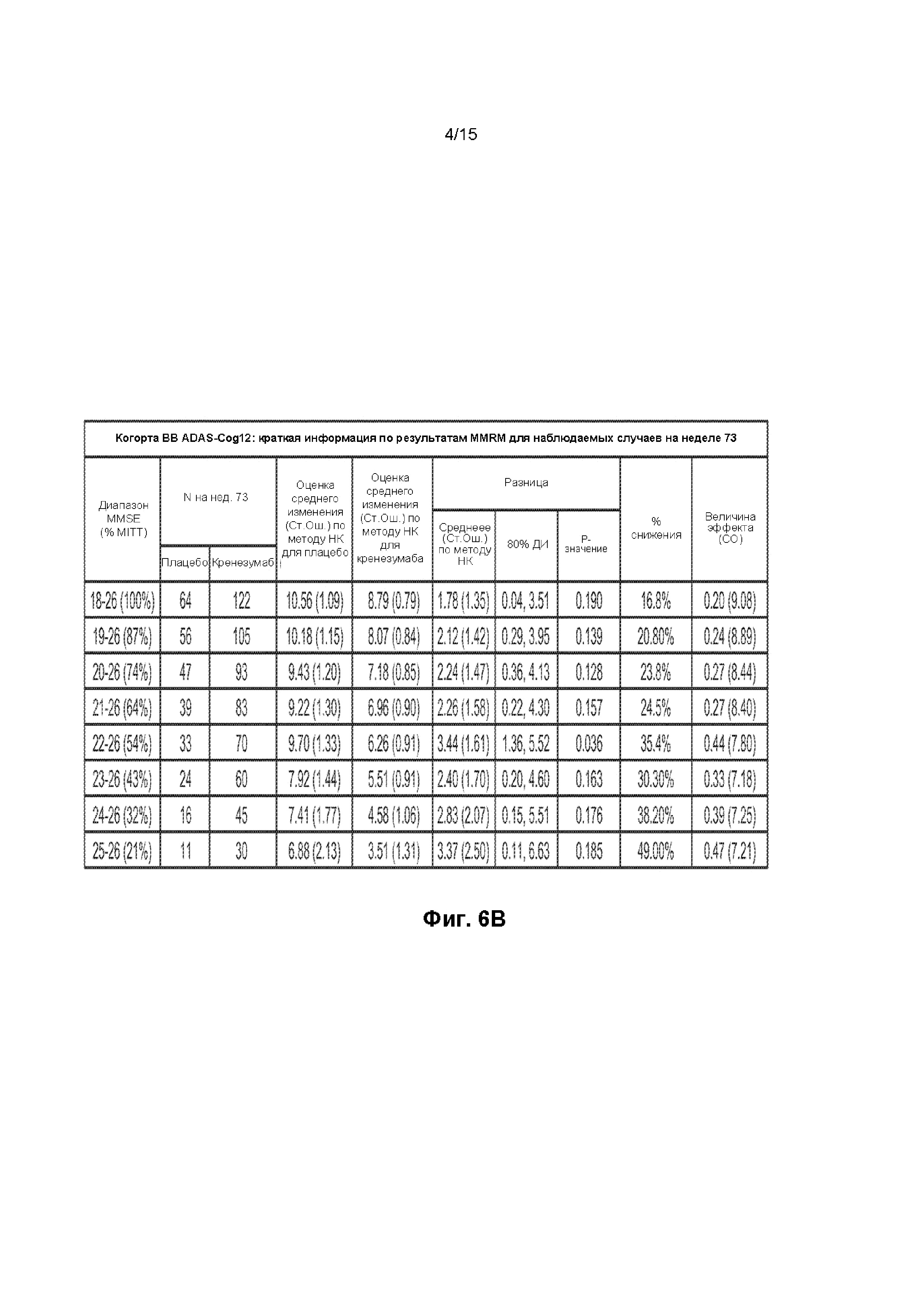
[0021] На ФИГ. 6A-B представлены таблицы данных, демонстрирующие изменение оценки по шкале ADAS-Cog12 через 73 недели относительно исходного уровня в группе лечения и в группе плацебо. На ФИГ. 6A представлены данные для пациентов с БА от легкой до умеренной степени тяжести, БА легкой степени тяжести, БА умеренной степени тяжести и пациентов с наличием и отсутствием ApoE4. На ФИГ. 6B представлены данные для пациентов в соответствии с оценкой по шкале MMSE.
[0022] На ФИГ. 7 представлен график изменения оценки по шкале ADAS-Cog12 для пациентов с БА легкой степени тяжести, имеющих оценку по шкале MMSE от 20 до 26 баллов, получавших лечение кренезумабом (темная сплошная линия) или плацебо (светлая сплошная линия).
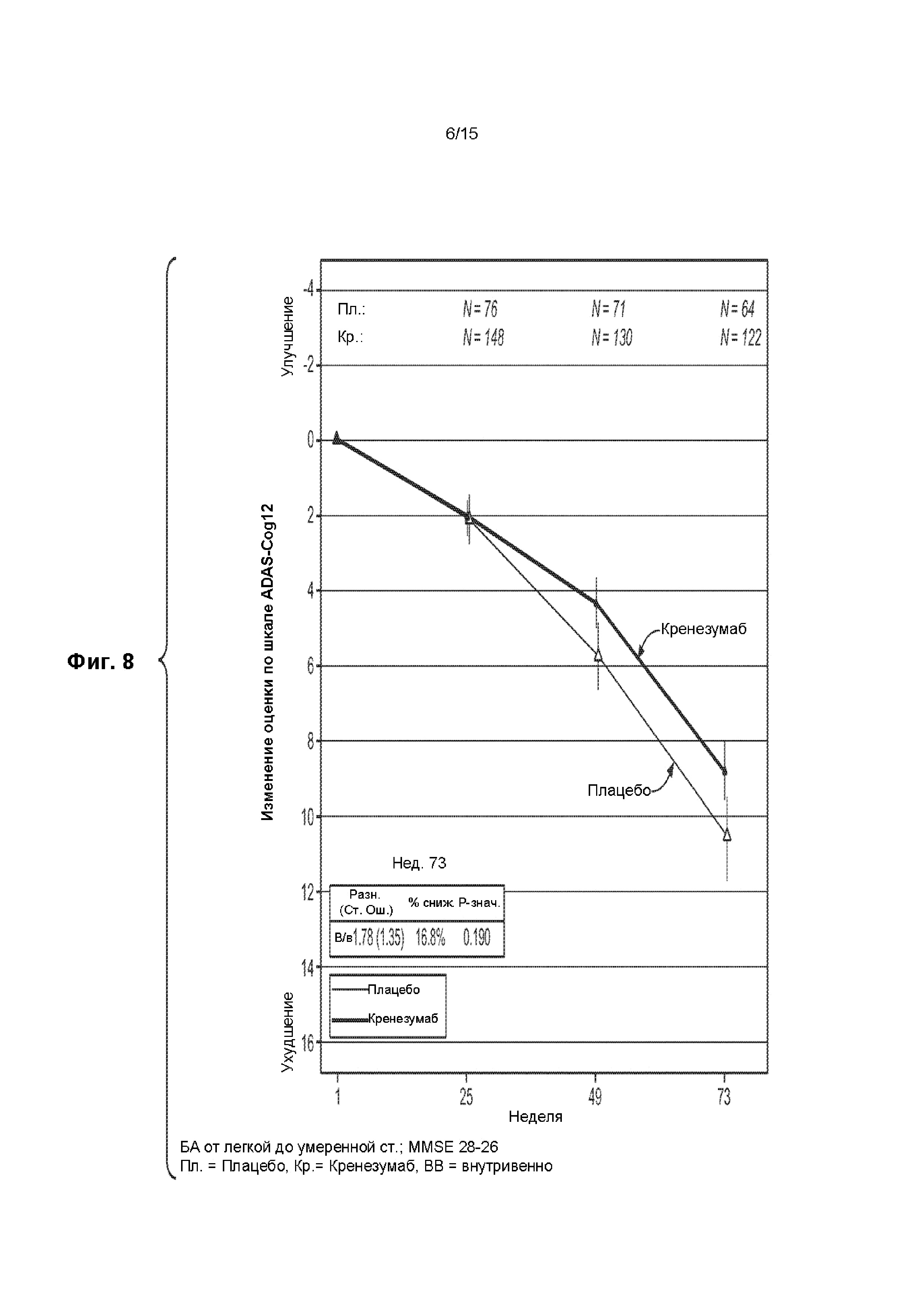
[0023] На ФИГ. 8 представлен график изменения оценки по шкале ADAS-Cog12 для пациентов с БА от легкой до умеренной степени тяжести, имеющих оценку по шкале MMSE от 18 до 26 баллов, получавших лечение кренезумабом (темная сплошная линия) или плацебо (светлая сплошная линия).
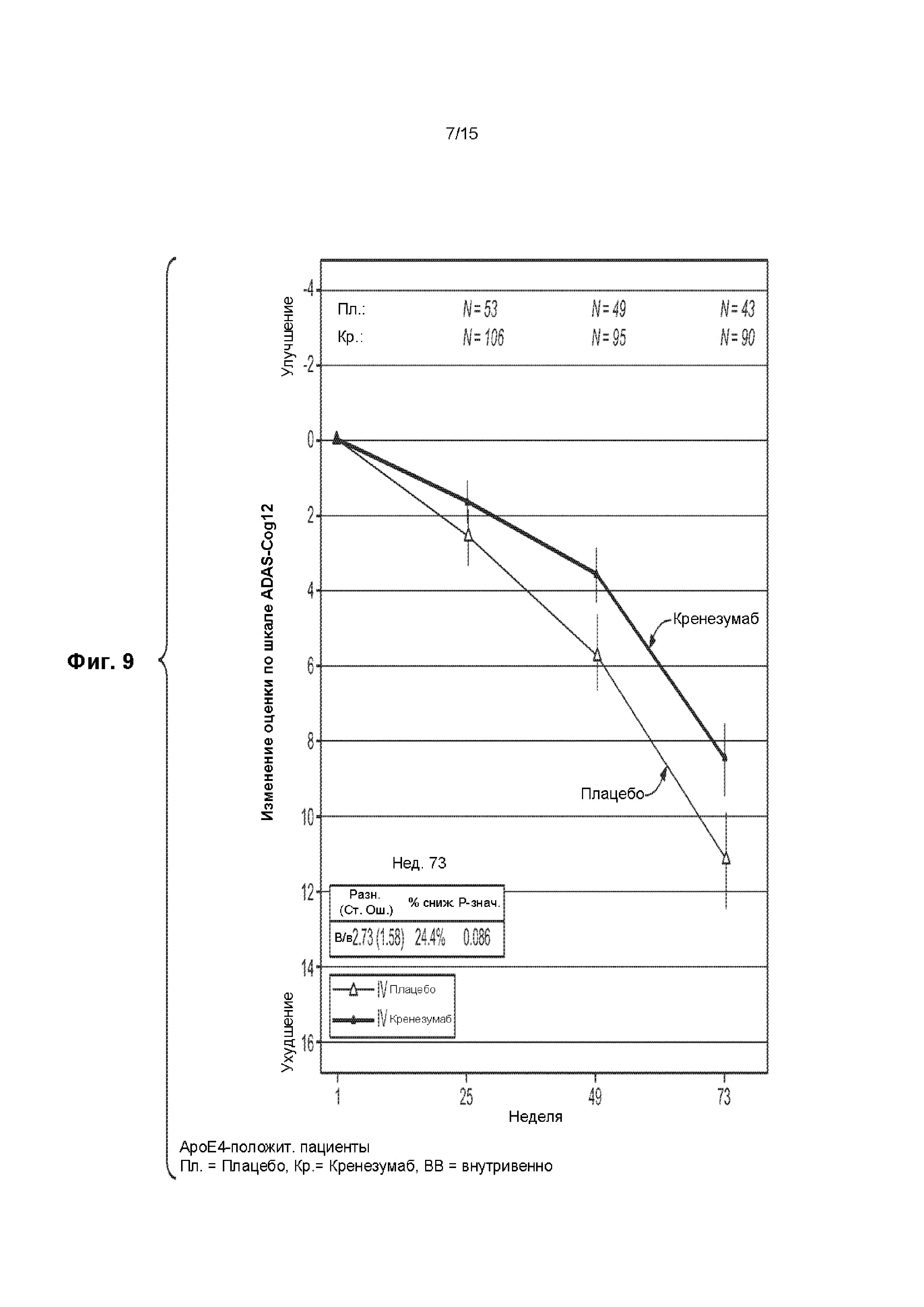
[0024] На ФИГ. 9 представлен график изменения оценки по шкале ADAS-Cog12 для ApoE4-положительных пациентов с БА от легкой умеренной степени тяжести, получавших лечение кренезумабом (темная сплошная линия) или плацебо (светлая сплошная линия).
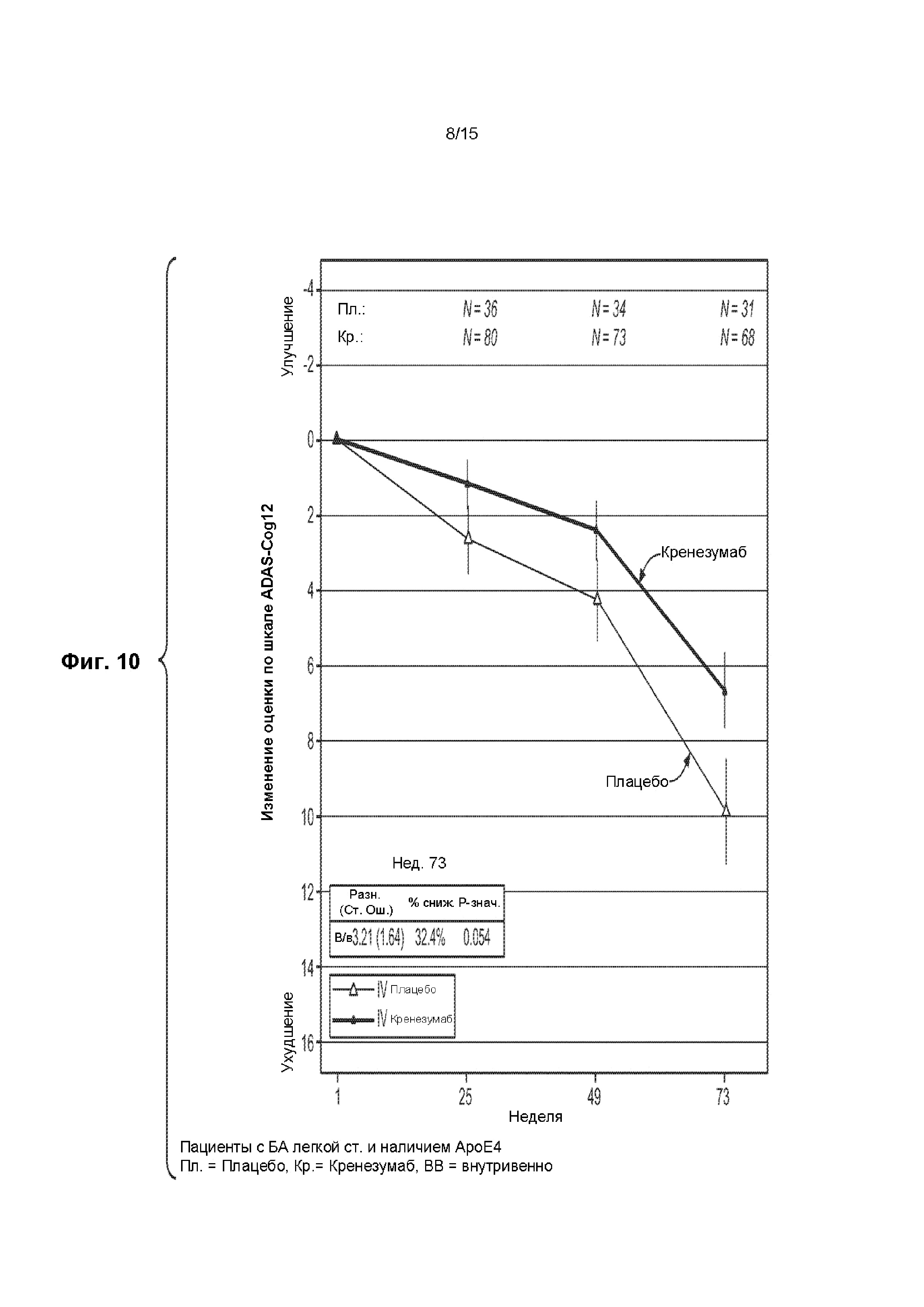
[0025] На ФИГ. 10 представлен график изменения оценки по шкале ADAS-Cog12 у всех ApoE4-положительных пациентов и пациентов с БА легкой степени тяжести, получавших лечение кренезумабом (темная сплошная линия) или плацебо (светлая сплошная линия).
[0026] На ФИГ. 11 представлен график изменения оценки по шкале ADAS-Cog12 у пациентов с БА легкой степени тяжести, имеющих оценку по шкале MMSE от 22 до 26, получавших лечение кренезумабом или плацебо.
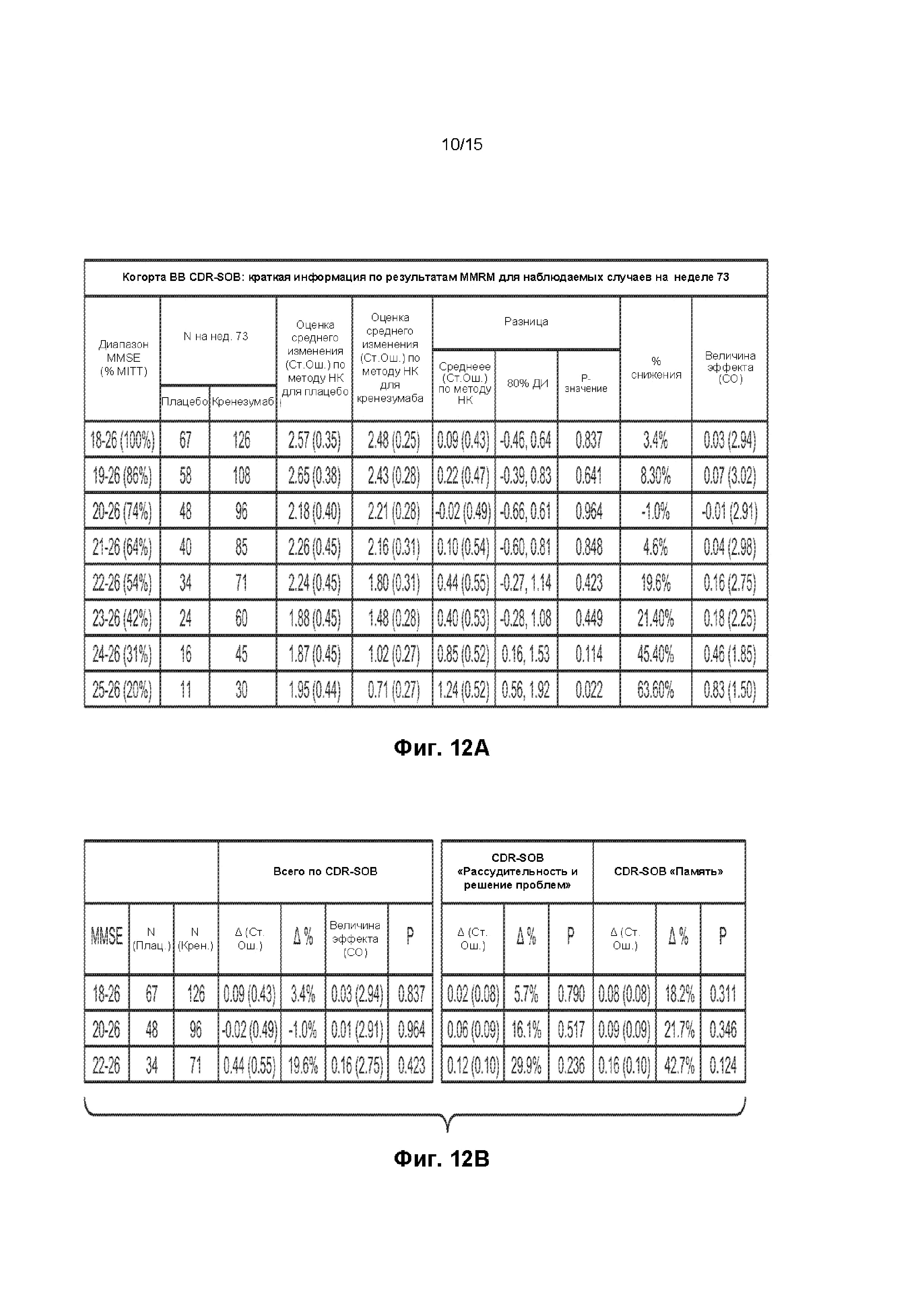
[0027] На ФИГ. 12A-B представлены таблицы данных, демонстрирующие изменение оценки по шкале CDR-SOB через 73 недели относительно исходного уровня в группе лечения и в группе плацебо. На ФИГ. 12A представлены данные изменения у пациентов оценки по шкале CDR-SOB в соответствии с оценкой по шкале MMSE. ФИГ. 12B представлены данные оценки по шкале CDR-SOB, а также оценки компонента «Рассудительность и решение проблем» шкалы CDR и компонента «Память» шкалы CDR для пациентов с оценками по шкале MMSE в диапазонах 18-26, 20-26 и 22-26.
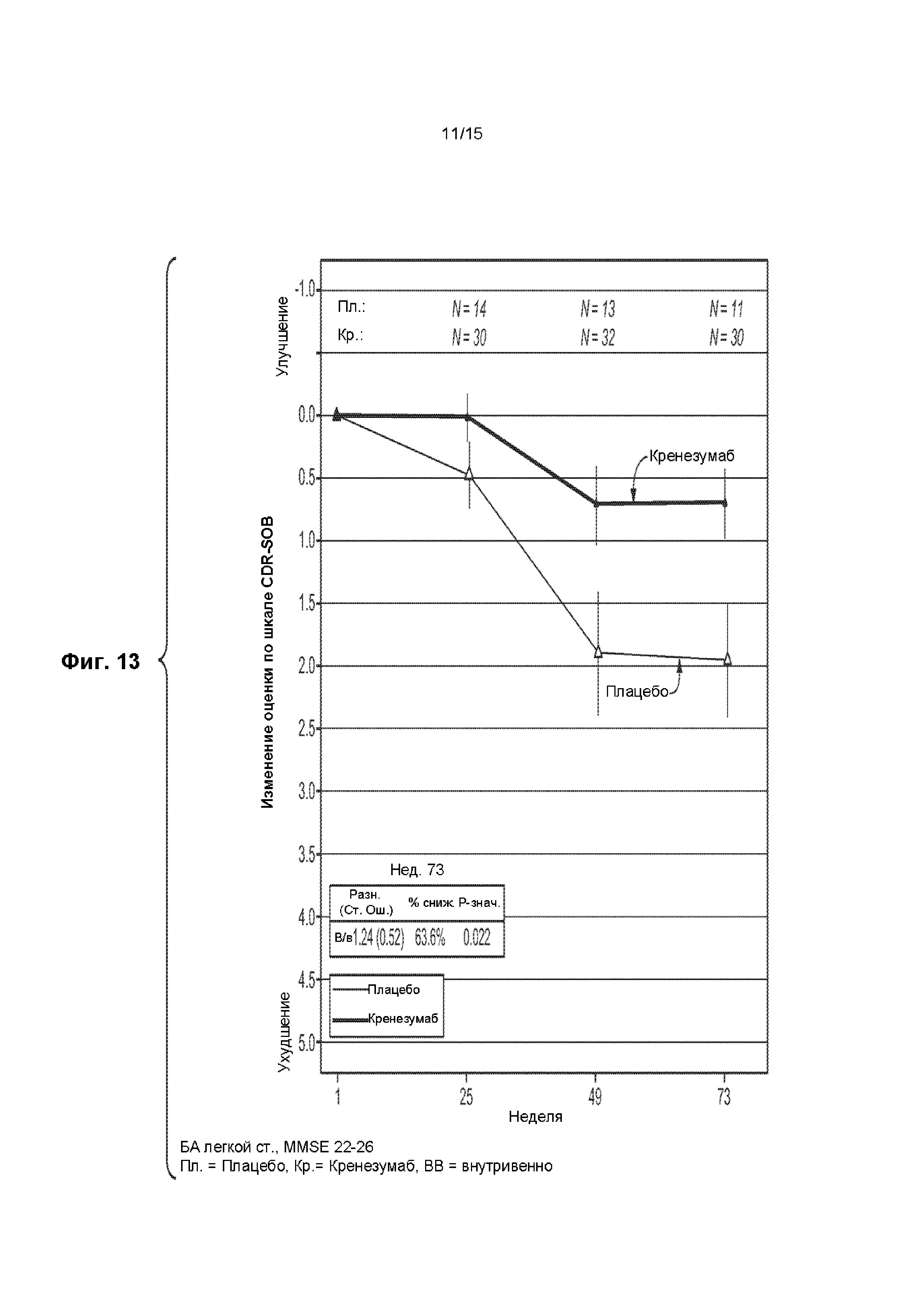
[0028] На ФИГ. 13 представлен график изменения оценки по шкале CDR-SOB у пациентов с БА легкой степени тяжести, имеющих оценку по шкале MMSE 25 или 26, получавших лечение кренезумабом или плацебо, как указано.
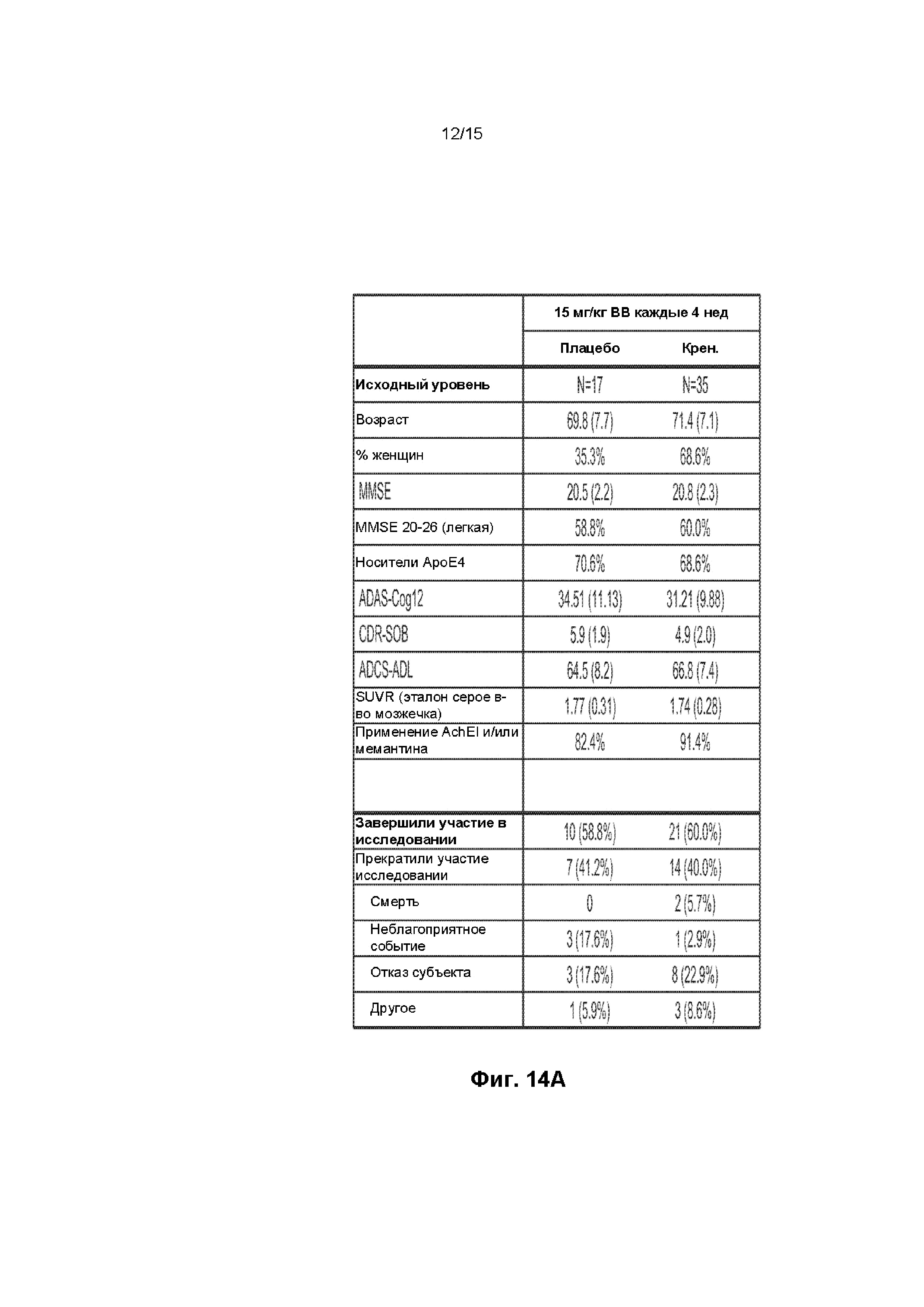
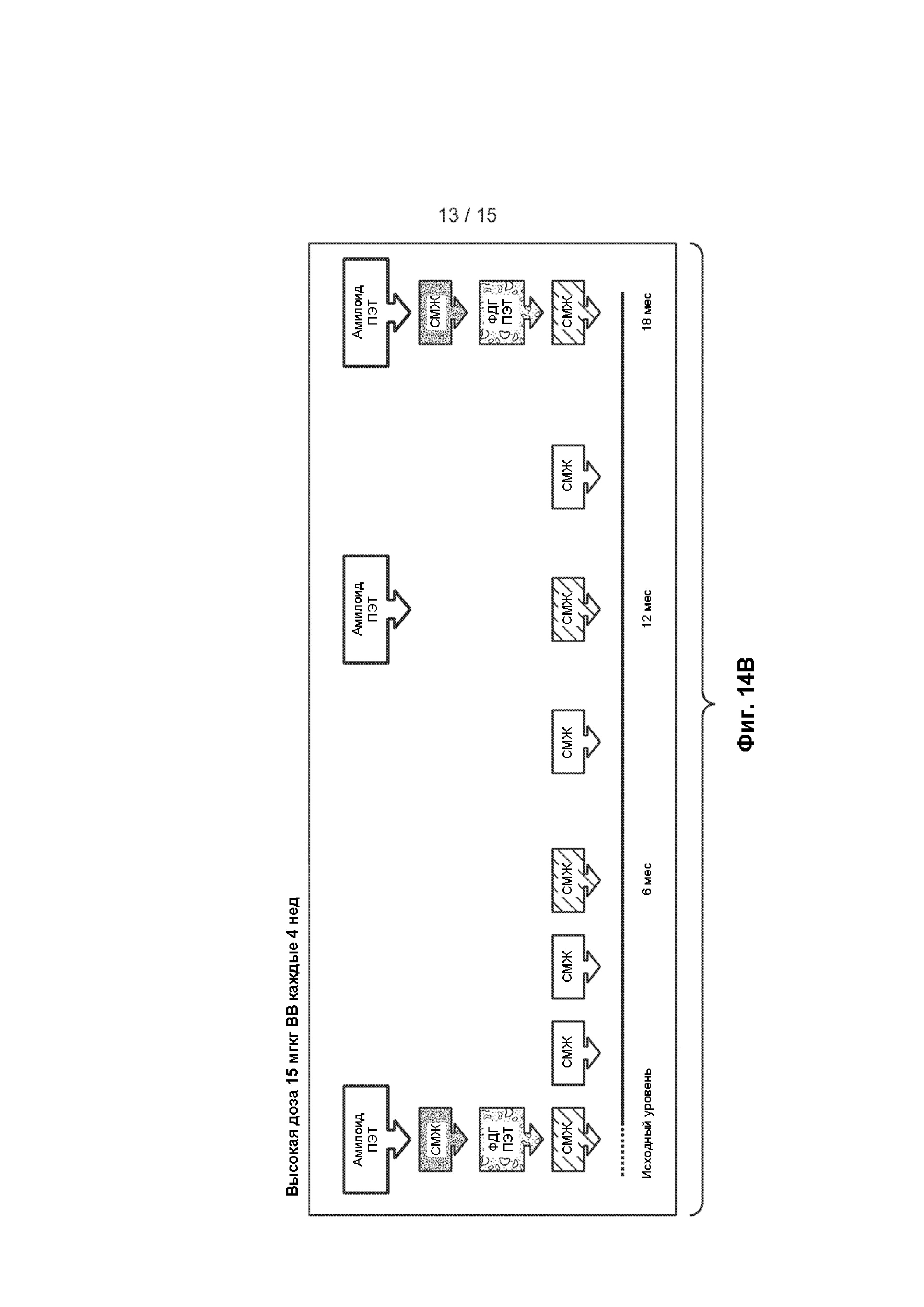
[0029] На ФИГ. 14A-B представлена краткая информация о пациентах, включенных в клиническое исследование, описанное в примере 2, на исходном уровне и после лечения, включая данные о неблагоприятных событиях (A) и график, показывающий время, когда в клиническом исследовании выполняли позитронно-эмиссионную томографию (ПЭТ), магнитно-резонансную томографию (МРТ) и отбор проб спинно-мозговой жидкости (СМЖ) (B).
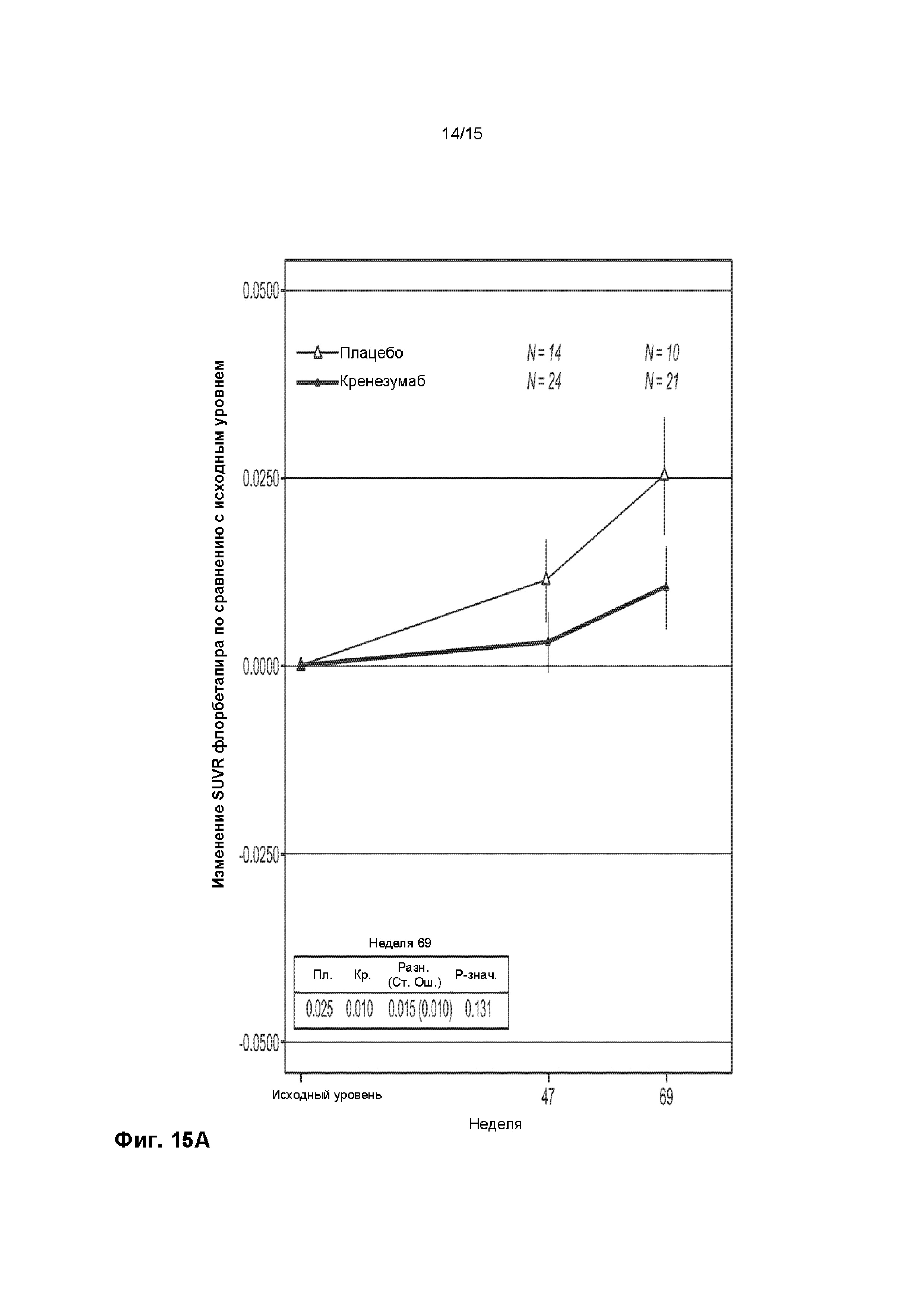
[0030] На ФИГ. 15A-B представлены графики, демонстрирующие уровни амилоида у пациентов, получающих плацебо (пунктирная линия) или кренезумаб (сплошная линия), по результатам визуализации флорбетапира с помощью анализа ПЭТ (A) и уровни Abeta в СМЖ у пациентов получающих плацебо или кренезумаб (B).
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0031] Если не указано иное, технические и научные термины, используемые в настоящем документе, имеют то же значение, что обычно понимается обычным специалистом в той области техники, к которой относится настоящее изобретение. Singleton et al.et al., Dictionary of Microbiology and Molecular Biology 2nd ed., J. Wiley & Sons (New York, N.Y. 1994) и March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4th ed., John Wiley & Sons (New York, N.Y. 1992), обеспечивают обычному специалисту в данной области общее руководство по многим терминам, используемым в настоящей заявке.
Некоторые определения и сокращения
[0032] Для целей пояснения в этом описании, будут использоваться следующие определения и там,где это уместно, термины, использованные в единственном числе будет также включать в себя множественное число и наоборот. В том случае, когда любое определение, представленное ниже, вступает в конфликт с любым документом, вводимым в данное описание путем ссылки, представленное ниже определение является главным.
[0033] При использовании в данном описании и прилагаемой формуле изобретения форм единственного числа, они включают ссылки на множественное число, если из контекста явно не следует иное. Таким образом, например, ссылка на «белок» или «антитело» включает в себя множество белков или антител, соответственно; ссылка на «клетку» включает в себя смеси клеток и т. п.
[0034] Диапазоны значений, представленные в описании и прилагаемой формуле изобретения, включают в себя как конечные точки, так и все точки между конечными точками. Таким образом, например, диапазон от 2,0 до 3,0 включает 2,0, 3,0 и все точки от 2,0 до 3,0.
[0035] Фраза «по существу аналогичный» или «по существу такой же» в контексте настоящего документа обозначает достаточно высокую степень сходства между двумя числовыми значениями (обычно одно связано с антителом по настоящему изобретению, а другое связано с эталонным/сравнительным антителом), такую что специалист в данной области техники посчитает разницу между этими двумя значениями незначительной или вообще не имеющей биологической и/или статистической значимости в контексте биологической характеристики, измеренной с помощью указанного значения (например, значения Kd). Различие между указанными двумя значениями составляет менее чем около 50%, менее чем около 40%, менее чем около 30%, менее чем около 20%, менее чем около 10% в зависимости от значения для эталонного/сравнительного антитела.
[0036] В контексте настоящего документа термин «образец» или «исследуемый образец» относится к композиции, полученной от субъекта, представляющего интерес, содержащей клеточный и/или другой молекулярный объект, который необходимо охарактеризовать и/или идентифицировать, например, на основании физических, биохимических, химических и/или физиологических характеристик. В одном варианте реализации настоящего изобретения это определение охватывает образцы крови и другие жидкие образцы биологического происхождения, а также образцы тканей, такие как образец, полученный в результате биопсии, или культуры тканей или клеток, полученные из них. Источником образца ткани может быть твердая ткань, например, из свежего, замороженного и/или законсервированного образца органа или ткани, или биопсии, или аспирата; кровь или любые составляющие крови; жидкости организма; и клетки, полученные в любой момент времени в период беременности или развития субъекта, или плазма. В контексте настоящего документа термин «биологический образец» включает, но не ограничивается перечисленным, кровь, сыворотку, плазму, мокроту, биоптаты тканей (например, образцы легкого), и образцы из носа, включая носовые мазки или носовые полипы.
[0037] Термин «образец», «биологический образец» или «исследуемый образец» включает биологические образцы, которые после получения были каким-либо образом обработаны, например, посредством обработки реагентами, солюбилизации или обогащения определенными компонентами, такими как белки или полинуклеотиды, или залиты в полутвердую или твердую матрицу с целью получения срезов. Для целей настоящего описания «срез» образца ткани означает отдельную часть или кусочек образца ткани, например тонкий срез ткани или клеток, вырезанный из образца ткани. Образцы включают, но не ограничиваются перечисленным, цельную кровь, кровяные клетки, сыворотку, плазму, лимфатическую жидкость, синовиальную жидкость, клеточные экстракты и их комбинации. В одном варианте реализации настоящего изобретения образец представляет собой клинический образец. В другом варианте реализации настоящего изобретения образец используют в диагностическом анализе.
[0038] В одном варианте реализации настоящего изобретения образец получают от субъекта или пациента до начала лечения антителом к Abeta. В другом варианте реализации настоящего изобретения образец получают от субъекта или пациента после проведения по меньшей мере одного курса лечения антителом к Abeta.
[0039] В контексте настоящего документа термин «эталонный образец» относится к любому образцу, стандарту или уровню, который используется для целей сравнения. В одном варианте реализации настоящего изобретения эталонный образец получают из здоровой и/или непораженной части организма (например, ткани или клеток) того же субъекта или пациента. В другом варианте реализации настоящего изобретения эталонный образец получают из не подвергавшейся лечению ткани и/или клетки организма того же субъекта или пациента. В еще одном варианте реализации настоящего изобретения эталонный образец получают из здоровой и/или непораженной части организма (например, тканей или клеток) индивидуума, не являющегося субъектом или пациентом. В еще одном варианте реализации настоящего изобретения эталонный образец получают из не подвергавшейся лечению ткани и/или клетки из участка организма индивидуума, не являющегося субъектом или пациентом.
[0040] В некоторых вариантах реализации настоящего изобретения эталонный образец представляет собой единственный образец или объединенные множественные образцы от того же субъекта или пациента, полученные в одном или более различных моментов времени, отличающихся от времени получения исследуемого образца. Например, эталонный образец получают от того же субъекта или пациента в более ранний момент времени по сравнению со временем получения исследуемого образца. В некоторых вариантах реализации настоящего изобретения эталонный образец включает все виды биологических образцов, определенных выше термином «образец», которые получают от одного или более индивидуумов, не являющихся субъектом или пациентом. В некоторых вариантах реализации настоящего изобретения эталонный образец получают от одного или более индивидуумов с амилоидозом, например болезнью Альцгеймера, не являющихся субъектом или пациентом.
[0041] В некоторых вариантах реализации настоящего изобретения эталонный образец представляет собой объединенные множественные образцы от одного или более здоровых индивидуумов, не являющихся субъектом или пациентом. В некоторых вариантах реализации настоящего изобретения эталонный образец представляет собой объединенные множественные образцы от одного или более индивидуумов с заболеванием или нарушением (например, амиоридозом, таким как, например, болезнь Альцгеймера), не являющихся субъектом или пациентом. В некоторых вариантах реализации настоящего изобретения эталонный образец представляет собой объединенные образцы РНК из нормальных тканей или объединенные образцы плазмы или сыворотки от одного или более индивидуумов, не являющихся субъектом или пациентом.
[0042] Термин «малая молекула» относится к органической молекуле, имеющей молекулярную массу от 50 дальтон до 2500 дальтон.
[0043] Термины «антитело» и «иммуноглобулин» (Ig) используются взаимозаменяемо в самом широком смысле и включают, но не ограничиваются перечисленным, моноклональные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, мультивалентные антитела, антитела с полиэпитопной специфичностью, одноцепочечные антитела, мультиспецифические антитела (например, биспецифические антитела, триспецифические антитела, тетраспецифические антитела) и фрагменты антител при условии, что они проявляют желаемую биологическую активность. Такие антитела могут быть химерными, гуманизированными, человеческими, синтетическими и/или со зрелой аффинностью. Такие антитела и способы их получения описаны более подробно в настоящем документе.
[0044] «Фрагменты антител» содержат только часть интактного антитела, причем указанная часть предпочтительно сохраняет по меньшей мере одну, а обычно большинство или все функции, обычно связанные с этой частью при ее наличии в интактном антителе. В одном варианте реализации настоящего изобретения фрагмент антитела содержит антигенсвязывающий участок интактного антитела и, таким образом, сохраняет способность связывать антиген. В другом варианте реализации настоящего изобретения фрагмент антитела, например фрагмент, содержащий Fc-область, сохраняет по меньшей мере одну из биологических функций, обычно связанных с Fc-областью при присутствии в интактном антителе, например, связывание FcRn, модуляцию периода полураспада антитела, функцию ADCC и связывание комплемента. В одном варианте реализации настоящего изобретения фрагмент антитела является одновалентным антителом, которое имеет период полураспада in vivo по существу аналогичный таковому у интактного антитела. Например, такой фрагмент антитела может содержать антигенсвязывающую участок, связанный с последовательностью Fc, способной in vivo придавать фрагменту стабильность. Примеры фрагментов антитела включают, но не ограничиваются перечисленным, Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например scFv); и мультиспецифические антитела, образованные из фрагментов антител.
[0045] Термин «мишень» в контексте настоящего документа, относится к любой нативной молекуле из любого источника позвоночного животного, включая млекопитающих, таких как приматы (например люди) м грызуны (например, мыши и крысы), если не указано иное. Термин охватывает «полноразмерную» необработанную мишень, а также любую форму мишени, которая является результатом обработки в клетке. Термин также охватывает встречающиеся в природе варианты мишеней, например сплайсинговые варианты или аллельные варианты.
[0046] Термины «амилоид бета» «бета-амилоид» «Abeta» «β-амилоид» и «Aβ», используемые в настоящем документе взаимозаменяемо, относятся к фрагменту белка-предшественника амилоида (APP), который продуцируется при расщеплении APP β-секретазой 1 (BACE1), а также к его модификациям, фрагментам и любым функциональным эквивалентам, включая, но не ограничиваясь перечисленным, Aβ1-40 и Aβ1-42. Как известно, Aβ существует в мономерной форме, а также связан с образованием олигомеров и фибрильных структур, которые могут быть обнаружены в качестве составляющих элементов амилоидной бляшки. Структура и последовательности таких пептидов Aβ хорошо известны обычному специалисту в данной области, а способы получения указанных пептидов или способы извлечения их из головного мозга и других тканей описаны, например, в работе Glenner and Wong, Biochem Biophys Res. Comm. 129: 885-890 (1984). Кроме того, различные формы пептидов Aβ также являются коммерчески доступными. Пример аминокислотной последовательности Aβ1-42 человека представляет собой последовательность DAEFRHDSGYEVHHQKLVFFAED VGSNKGAIIGLMVGGVVIA (SEQ ID NO: 1).
[0047] Термины «антитело к мишени» и «антитело, связывающееся с мишенью» относятся к антителу, которое способно связываться с мишенью с достаточной аффинностью, таким образом антитело может использоваться в качестве диагностического и/или терапевтического средства для целевого воздействия на мишень. В одном варианте реализации настоящего изобретения степень связывания антитела с мишенью, представляющей собой неродственный нецелевой белок, составляет менее чем около 10% связывания антитела с мишенью, например, по результатам измерения посредством радиоиммуноанализа (РИА) или анализа Biacore. В некоторых вариантах реализации настоящего изобретения антитело, которое связывается с мишенью, имеет константу диссоциации (Kd) ≤ 1 мкМ, ≤ 100 нМ, ≤ 10 нМ, ≤ 1 нМ, ≤ 0,1 нМ, ≤ 0,01 нМ или ≤ 0,001 нМ (например, 10-8 M или меньше, например, от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M). В некоторых вариантах реализации настоящего изобретения антитело к мишени связывается с эпитопом мишени, который является консервативным среди различных видов.
[0048] Термины «иммуноглобулин к Abeta» «антитело к Abeta» и «антитело, которое связывается с Abeta» используются в настоящем документе взаимозаменяемо и относятся к антителу, которое специфически связывается с Abeta человека. Не имеющим ограничительного характера примером антитела к Abeta является кренезумаб. Другие не имеющие ограничительного характера примеры антител к Abeta представляют собой соланезумаб, бапинейзумаб, адуканумаб и гантенерумаб.
[0049] Термины «кренезумаб» и «MABT5102A» используются в настоящем документе взаимозаменяемо и относятся к специфическому антителу к Abeta, которое связывается с мономерной, олигомерной и фибриллярной формами Abeta, и которые связаны с регистрационным номером CAS 1095207. В одном варианте реализации настоящего изобретения такое антитело содержит последовательности HVR участка, приведенные на ФИГ. 2. В другом таком варианте реализации настоящего изобретения такое антитело содержит: (1) HVR-H1, содержащий аминокислотную последовательность SEQ ID NO: 2; (2) последовательность HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 3; (3) последовательность HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 4; (4) последовательность HVR-L1, содержащую аминокислотную последовательность SEQ ID NO: 6; (5) последовательность HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 7; и (6) последовательность HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 8. В другом варианте реализации настоящего изобретения специфическое антитело к Abeta содержит домены VH и VL, имеющие аминокислотные последовательности, приведенные на ФИГ. 3. В другом таком варианте реализации настоящего изобретения такое специфическое антитело к Abeta содержит домен VH, содержащий аминокислотную последовательность SEQ ID NO: 5 и домен VL, содержащий аминокислотную последовательность SEQ ID NO: 9. В другом варианте реализации настоящего изобретения антитело представляет собой антитело IgG4. В другом таком варианте реализации настоящего изобретения антитело IgG4 содержит мутацию в своем константном домене таким образом, что пролин замещен серином 228.
[0050] В контексте настоящего документа термин «амилоидоз» относится к группе заболеваний и нарушений, вызванных или связанных с амилоидными или амилоидоподобными белками, и включает, но не ограничивается перечисленным, заболевания и нарушения, вызванные наличием или активностью амилоидоподобных белков в мономерном, фибриллярном или полимерном состоянии, или в любой комбинации из этих трех состояний, включая посредством амилоидных бляшек. Такие заболевания включают, но не ограничиваются перечисленным, вторичный амилоидоз и связанный с возрастом амилоидоз, например заболевания, которые включают, но не ограничиваются перечисленным, неврологические расстройства, такие как болезнь Альцгеймера (БА), заболевания или состояния, характеризующиеся утратой способности когнитивной памяти, такие как, например, легкое когнитивное нарушение (ЛКН), деменция с тельцами Леви, синдром Дауна, наследственное мозговое кровоизлияние с амилоидозом (голландского типа), комплекс болезни острова Гуам с паркинсонизмом и деменцией и другие заболевания, которые основаны на амилоидоподобных белках или связаны с ними, такие как прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейцфельда - Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, БАС (боковой амиотрофический склероз), миозит с тельцами включения (МТВ), сахарный диабет с началом во взрослом возрасте, эндокринные опухоли и старческий амилоидоз сердца, а также различные глазные заболевания, включая дегенерацию желтого пятна, оптическую нейропатию, связанную с друзами, глаукому и катаракту вследствие отложения бета-амилоида.
[0051] Глаукома представляет собой группу заболеваний зрительного нерва, включающих потерю ганглиозных клеток сетчатки (RGC) с характерным узором оптической нейропатии. RGC представляют собой нервные клетки, которые передают зрительные сигналы от глаза к головному мозгу. В процессе, ведущем к апоптозу RGC, происходит активация каспазы-3 и каспаза-8, двух главных ферментов процесса апоптоза. Каспаза-3 расщепляет белок-предшественник амилоида (APP) с образованием нейротоксических фрагментов, включая Abeta. Без защитного эффекта АРР накопление Abeta в слое ганглиозных клеток сетчатки приводит к гибели RGC и необратимой потере зрения.
[0052] Глаукома часто, но не всегда, сопровождается повышением внутриглазного давления, что может быть результатом блокирования циркуляции водной жидкости или ее дренирования. Хотя повышенное внутриглазное давление является существенным фактором риска для развития глаукомы, не может быть определен порог внутриглазного давления, который точно приведет к возникновению глаукомы. Повреждение может быть также вызвано плохим кровоснабжением жизненно важных волокон зрительного нерва, слабостью структуры нерва и/или проблемами в состоянии самих нервных волокон. Не подвергающаяся лечению глаукома приводит к постоянному повреждению зрительного нерва и, как результат, сокращению поля зрения, которое может прогрессировать до слепоты.
[0053] Различные типы глаукомы классифицируются как открытоугольные глаукомы, если состояние является хроническим, или закрытоугольные глаукомы, если острая глаукома возникает внезапно. Глаукома обычно поражает оба глаза, но прогрессирование заболевания в одном глазу может происходить быстрее, чем в другом.
[0054] Хроническая открытоугольная глаукома (COAG), также известная как первичная открытоугольная глаукома (POAG), является наиболее распространенным типом глаукомы. COAG вызывается микроскопической блокировкой трабекулярной сети, которая уменьшает дренирование оттока водной жидкости в шлеммов канал, и повышает внутриглазное давление (IOP). POAG обычно поражает оба глаза и тесно связана с возрастом и положительным семейным анамнезом. Частота ее появления увеличивается у пожилых людей, поскольку дренажная система глаза с возрастом может постепенно забиваться. Повышение внутриглазного давления у субъектов, подверженных хронической открытоугольной глаукоме, не сопровождается никакими симптомами, пока не они не почувствуют потерю центральной области зрения.
[0055] Острая закрытоугольная глаукома (AACG) или закрытоугольная глаукома представляет собой относительно редкий тип глаукомы, отличающийся внезапным увеличением внутриглазного давления до 35-80 мм рт. ст., приводя к сильной боли и необратимой потере зрения. Внезапное повышение давления вызывается перекрыванием угла фильтрования и блокировкой дренажных каналов. Индивидуумы с узкими углами имеют повышенный риск внезапного закрытия угла. AACG обычно возникает в одном глазу, но риск существует для обоих глаз. Возраст, катаракта и псевдоэксфолиация также являются факторами риска, поскольку они связаны с увеличением хрусталика и расширением или сужением угла. Внезапный приступ глаукомы может быть связан с сильной глазной болью и головной болью, воспалением глаза, тошнотой, рвотой и размытым зрения.
[0056] Смешанная глаукома или глаукома с сочетанным механизмом представляет собой сочетание или комбинацию открытоугольной и закрытоугольной глаукомы. Она поражает пациентов с острой ACG, у которых угол открывается после лазерной иридотомии, но которые продолжают нуждаться в лекарственных средствах для контроля IOP, а также у пациентов с POAG или с псевдоэксфолиативной глаукомой, у которых постепенно развивается сужение угла.
[0057] Глаукома с нормальным давлением (NTG), также известная как глаукома с низким давлением (LTG), характеризуется прогрессирующим повреждением зрительного нерва и потерей периферического зрения, аналогичной той, которая наблюдается при других типах глаукомы, однако внутриглазное давление находится в нормальном диапазоне, или оно даже ниже нормального.
[0058] Врожденная (младенческая) глаукома представляет собой относительно редкий наследуемый тип открытоугольной глаукомы. Недостаточное развитие области дренирования приводит к повышению давления в глазу, которое может приводить к потере зрения из-за повреждения зрительного нерва и к увеличению глаза. Ранняя диагностика и лечение являются решающими для сохранения зрения у младенцев и детей, пораженных этим заболеванием.
[0059] Вторичная глаукома может возникнуть в результате травмы глаза, воспаления радужной оболочки глаза (ирита), сахарного диабета, катаракты или применения стероидов у индивидуумов, чувствительных к стероидам. Вторичная глаукома может также быть связана с отслоением сетчатки или окклюзией или блокированием вен сетчатки.
[0060] Пигментная глаукома характеризуется отслоением гранул пигмента в радужной оболочке глаза. Гранулы вызывают блокирование дренажной системы глаза, что приводит к повышению внутриглазного давления и повреждению зрительного нерва. Эксфолиативная глаукома (псевдоэксфолиация) характеризуется отложением хлопьевидного материала в передней капсуле и в углу глаза. Накопление хлопьевидного материала блокирует дренажную систему и повышает глазное давление.
[0061] Диагностику глаукомы можно проводить с использованием различных тестов. Тонометрия определяет глазное давление путем измерения тонуса или твердости глазной поверхности. В данном тесте используются несколько видов тонометров, но наиболее распространенным является аппланационный тонометр. Пахиметрия определяет толщину роговой оболочки, которая, в свою очередь, является показателем внутриглазного давления. Гониоскопия позволяет изучить фильтрационный угол и дренажную область глаза. Гониоскопия может также определить блокируют ли патологически измененные кровеносные сосуды дренаж водной жидкости из глаза. Офтальмоскопия позволяет изучить зрительный нерв и может обнаружить повреждения слоя нервного волокна, изменения в зрительном диске или образование вдавлений (образование чашеобразных углублений) в этой структуре, которые могут быть вызваны увеличением внутриглазного давления или отмиранием аксонов. Гониоскопия также полезна при оценке повреждения нерва вследствие слабого кровотока или повышенного внутриглазного давления. Карты для тестирования поля зрения могут субъективно определять признаки глаукоматозных повреждений зрительного нерва. Они представлены специфическими моделями потери поля зрения. Оптическая когерентная томография, средство объективного измерения потери слоя нервных волокон, осуществляется путем изучения толщины слоя волокон зрительного нерва (измененной при глаукоме) с помощью различий в светопропускании через поврежденные ткани аксона.
[0062] «Антитело, которое связывается с тем же эпитопом» в качестве эталонного антитела относится к антителу, которое блокирует связывание эталонного антитела с его антигеном в конкурентном анализе на 50% или более, и, наоборот, эталонное антитело блокирует связывание антитела с его антигеном в конкурентном анализе на 50% или более. Иллюстративный конкурентный анализ представлен в настоящем документе.
[0063] Термин «терапевтическое средство» относится к любому средству, которое используется для лечения заболевания, включая, но не ограничиваясь перечисленным, средство, которое лечит симптом заболевания.
[0064] В настоящем описании термин «лечение» (и его грамматические варианты, такие как «лечить» или «проводить лечение») относится к клиническому вмешательству с целью изменить естественное течение заболевания у индивидуума, которого лечат, и может проводиться в процессе клинического проявления патологии. Желательные эффекты лечения включают, но не ограничиваются перечисленным, ослабление или облегчение одного или более симптомов, уменьшение или отсрочка появления или ухудшения любых прямых или косвенных патологических последствий заболевания, уменьшение скорости прогрессирования заболевания и облегчение или временное улучшение состояния заболевания. В некоторых вариантах реализации настоящего изобретения антитела используются для задержки развития заболевания или замедления прогрессирование заболевания.
[0065] Термин «возникшее в результате лечения» в контексте настоящего документа относится к событию, которое происходит после введения первой дозы терапевтического средства. Например, «возникшее в результате лечения неблагоприятное событие» представляет собой событие, которое идентифицируют во время или после введения первой дозы лечения в клиническом исследовании.
[0066] «Схема лечения» относится к комбинации дозы, частоте введения или продолжительности лечения, с добавлением или без добавления второго лекарственного средства.
[0067] «Эффетивная схема лечения» относится к схеме лечения, которая обеспечит благоприятный ответ у пациента, получающего лечение.
[0068] «Изменение лечения» относится к изменению схемы лечения, включая изменение дозы, частоты введения или длительности лечения и/или добавление второго лекарственного средства.
[0069] Термин «эффективное количество» или «эффективная доза» средства относится к количеству или дозе, которые при применении в течение требуемых периодов времени являются эффективным для достижения желательного результата. Например, «терапевтически эффективное количество» представляет собой количество, которое при применении в течение требуемых периодов времени является эффективным для лечения указанного заболевания, патологического состояния, клинической патологии или симптома, т. е. для изменения хода прогрессии БА и/или для облегчения и/или предотвращения одного или боле симптомов БА.
[0070] Термин «аффинность» или «аффинность связывания» относится интенсивности суммарных общих нековалентных взаимодействий между отдельным участком связывания молекулы (например, антитела) и его партнером по связыванию (например, антигеном). Если не указано иное, в контексте настоящего документа, «аффинность связывания» относится к природной аффинности связывания, которая отражает взаимодействие 1:1 между членами участвующей в связывании пары (например, антителом и антигенсвязывающим плечом). Аффинность молекулы X к ее партнеру Y, как правило, можно представить в виде константы диссоциации (Kd). Аффинность можно измерить с помощью традиционных способов, известных в данной области, включая описанные в настоящем документе, причем любой из них можно использовать для целей настоящего изобретения. Конкретные иллюстративные и типичные варианты реализации настоящего изобретения, связанные с измерением аффинности связывания, описаны в настоящем документе.
[0071] Термин «аффинно-зрелое» антитело относится к антителу, содержащему одно или более изменений в одном или нескольких гипервариабельных участках (HVR) по сравнению с исходным антителом, не содержащим таких изменений, которые приводят к повышению аффинности антитела к антигену.
[0072] В контексте настоящего документа термин «пациент» относится к любому субъекту, которому требуется лечение. В некоторых вариантах реализации настоящего изобретения пациент в настоящем документе является человеком.
[0073] В настоящем документе «субъект» обычно является человеком. В некоторых вариантах реализации настоящего изобретения субъект представляет собой не являющееся человеком млекопитающее. Примеры млекопитающих, не являющихся человеком, включают лабораторных, домашних животных, домашних питомцев, спортивных и сельскохозяйственных животных, например, мышей, кошек, собак, лошадей и коров. Как правило, субъект подходит для лечения, например, у него наблюдаются один или более признаков заболевания. Обычно такой субъект или пациент подходит для лечения амилоидоза, например, БА. В одном варианте реализации настоящего изобретения такой подходящий субъект или пациент испытывает или испытывал один или более признаков, симптомов или других проявлений БА, или ему был поставлен диагноз БА, независимо от того, например, поставлен ли диагноз заболевания впервые, ранее, или пациент имеет риск развития БА. Диагноз БА может быть поставлен на основании истории болезни, клинического обследования и установленных методов визуализации. Термин «пациент» или «субъект» в настоящем документе включает любого отдельного субъекта-человека, подходящего для лечения, который испытывает или испытывал один или более признаков, симптомов или других проявлений БА. Для включения в качестве субъекта подходят любые субъекты, участвующие в клинических научных исследованиях, или субъекты, участвующие в эпидемиологических исследованиях, или субъекты, ранее используемые в качестве контроля. Субъект может быть предварительно пролечен антителом к Abeta или его антиген-связывающим фрагментом, или другим лекарственным средством, или может не быть пролечен таким образом. Субъект может не подергаться действию дополнительного лекарственного средства (средств), используемого (-ых) в начале описанного в настоящем документе лечения, т. е., субъект может предварительно не подвергаться лечению, например другими лекарственными средствами, кроме антител к Abeta, на «исходном уровне» (т. е., в заданный момент времени перед введением первой дозы антитела к Abeta в способе лечения, описанном в настоящем документе, например, в день скрининга субъекта перед назначением лечения). Такие «интактные» субъекты, как правило, рассматриваются как кандидаты для лечения таким дополнительным лекарственным средством (средствами).
[0074] В контексте настоящего документа термин «время жизни» субъекта относится к оставшейся части жизни субъекта после начала лечения.
[0075] В контексте настоящего документа термин «моноклональные антитело» относится к антителу, полученному из популяции практически однородных антител, т. е. из популяции, отдельные антитела в которой являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифическими, направленными против единственного антигена. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено на одну детерминанту антигена.
[0076] Моноклональные антитела в настоящем документе конкретно включают «химерные» антитела, в которых участок тяжелой и/или легкой цепи идентичен или гомологичен соответствующим последовательностям антител, полученных от конкретного вида или относящихся к конкретному классу или подклассу антител, тогда как остаток цепи (цепей) идентичен или гомологичен соответствующим последовательностям антител, полученным от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител при условии, что они проявляют заданную биологическую активность (описано в патенте США № 4816567; и в Morrison et al., Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984)).
[0077] «Класс» антитела относится к типу константного домена или константной области его тяжелой цепи. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, причем некоторые из них могут дополнительно подразделяться на подклассы (или изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют разным классам иммуноглобулинов, называют α, δ, ε, γ и μ, соответственно.
[0078] «Гуманизированными» формами антител нечеловеческого происхождения(например, мышиных) являются химерные антитела, которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. В большинстве случаев гуманизированные антитела представляют собой иммуноглобулины человека (антитело реципиента), в которых остатки из гипервариабельного участка реципиента замещены остатками из гипервариабельного участка видов, отличных от человека (антитело донора), таких как мышь, крыса, кролик или отличный от человека примат, обладающими желаемой специфичностью, аффинностью и эффективностью. В некоторых примерах остатки каркасного участка (FR) человеческого иммуноглобулина заменены на соответствующие остатки иммуноглобулина нечеловеческого происхождения. Кроме того, гуманизированные антитела могут содержать остатки, отсутствующие в антителе реципиента или в антителе донора. Эти модификации можно выполнять для дальнейшего улучшения эффективности антитела. Как правило, гуманизированное антитело содержит по существу все или по меньшей мере один, а обычно два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют гипервариабельным петлям иммуноглобулина нечеловеческого происхождения, а все или по существу все FR представляют собой те, что относятся к последовательности человеческого иммуноглобулина. Гуманизированное антитело, необязательно, также содержит по меньшей мере участок константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина. Дополнительные подробности описаны в Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2:593-596 (1992). Смотрите также следующие обзорные статьи и приведенные в них ссылки: Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1: 105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994).
[0079] «Человеческое антитело» представляет собой антитело, имеющее аминокислотную последовательность, которая соответствует последовательности антитела, вырабатываемого человеком или клеткой человека и/или полученного из нечеловеческого источника, в котором используются репертуары человеческих антител или другие последовательности, кодирующие человеческие антитела, например, полученное с использованием любой из методик получения человеческих антител, раскрытых в настоящем документе. Такие методики включают, но не ограничиваются перечисленным, скрининг полученных от человека комбинаторных библиотек, таких как библиотеки фагового дисплея (см., например, Marks et al., J. Mol. Biol., 222: 581-597 (1991) и Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991)); использование клеточных линий человеческой миеломы и мышиной-человеческой гетеромиеломы для получения моноклональных антител человека (см., например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 55-93 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991)); и получение моноклональных антител в трансгенных животных (например, мышах), которые способны после иммунизации продуцировать полный репертуар человеческих антител, не продуцируя эндогенный иммуноглобулин (см., например, Jakobovits et al., Proc. Natl. Acad. Sci USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255 (1993); Bruggermann et al.,Year in Immunol., 7: 33 (1993)). Это определение человеческого антитела определенно исключает гуманизированное антитело, содержащее антигенсвязывающие остатки антитела нечеловеческого происхождения.
[0080] «Выделенное» антитело представляет собой антитело, идентифицированное и отделенное и/или извлеченное из компонентов среды, окружающей его в природе. Загрязняющие компоненты среды, окружающей его в природе, представляют собой материалы, которые могут помешать применению антитела для диагностических или терапевтических целей и могут включать ферменты, гормоны и другие белковые или небелковые растворенные вещества. В некоторых вариантах реализации настоящего изобретения очищают до степени, превышающей 95% или 99% по результатам определения, например, способом электрофореза (например, электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), изоэлектрического фокусирования (IEF), капиллярного электрофореза) или хроматографии (например, ионообменной или обращенно-фазовой ВЭЖХ). Обзор способов анализа чистоты антител см., например, в Flatman et al., J. Chromatogr. B 848:79-87 (2007).
[0081] Термин «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно имеют подобные структуры, причем каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR). (См., например, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) Для придания антиген-связывающей специфичности может быть достаточно одного домена VH или VL. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделить, используя домен VH или VL антитела, связывающийся с антигеном, для скрининга библиотеки последовательностей, комплементарных доменам VL или VH, соответственно. См., например, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
[0082] Термин «гипервариабельный участок», «HVR» или «HV» в контексте настоящего описания относится к участкам вариабельного домена антитела, которые характеризуются гипервариабельностью последовательностей и/или образуют определенные структурой петли. Как правило, антитела содержат шесть гипервариабельных участков; три в VH (H1, H2, H3) и три в VL (L1, L2, L3). В настоящем документе используется и охватывается ряд делинеаций гипервариабельного участка. Области, определяющие комплементарность, по Kabat (CDR) основаны на вариабельности последовательностей и являются наиболее часто используемыми (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Напротив, Chothia обращает внимание на локализацию структурных петель (Chothia and Lesk J. Mol. Biol. 196:901-917 (1987)). Гипервариабельные участки AbM представляют компромисс между CDR по Kabat и структурными петлями по Chothia и используются в Оксфордском программном обеспечении для молекулярного моделирования антител AbM. «Контактные» гипервариабельные участки основаны на анализе имеющихся сложных кристаллических структур. Остатки из каждого из этих HVR отмечены ниже.
Петля Kabat AbM Chothia Контакт
L1 L24-L34 L24-L34 L26-L32 L30-L36
L2 L50-L56 L50-L56 L50-L52 L46-L55
L3 L89-L97 L89-L97 L91-L96 L89-L96
H1 H31-H35B H26-H35B H26-H32 H30-H35B (нумерация Kabat)
H1 H31-H35 H26-H35 H26-H32 H30-H35 (нумерация Chothia)
H2 H50-H65 H50-H58 H53-H55 H47-H58
H3 H95-H102 H95-H102 H96-H101 H93-H101
[0083] Гипервариабельные участки могут содержать «удлиненные гипервариабельные участки», представленные ниже: 24-36 или 24-34 (L1), 46-56, или 49-56, или 50-56, или 52-56 (L2) и 89-97 (L3) в VL и 26-35 (H1), 50-65 или 49-65 (H2) и 93-102, 94-102 или 95-102 (H3) в VH. Для каждого из этих определений остатки в вариабельных доменах нумеруются по Kabat et al., выше.
[0084] Остатки «каркасных участков» или «FR» представляют собой остатки вариабельных доменов, отличные от определяемых в настоящем документе остатков гипервариабельных участков. FR вариабельного домена обычно состоит из четырех доменов FR: FR1, FR2, FR3 и FR4. Соответственно, последовательности HVR и FR в составе VH (или VL), как правило, появляются в следующей последовательности: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
[0085] «Акцепторный человеческий каркасный участок» для целей настоящего описания представляет собой каркасный участок, содержащий аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасного участка вариабельного домена тяжелой цепи (VH), полученного из каркасного участка человеческого иммуноглобулина или консенсусного человеческого каркасного участка, как описано ниже. Акцепторный человеческий каркасный участок «полученный из» каркасного участка человеческого иммуноглобулина или консенсусной последовательности человеческого каркасного участка, может иметь такую же аминокислотную последовательность, как у них, или может содержать изменения в аминокислотной последовательности. В некоторых вариантах реализации настоящего изобретения число аминокислотных изменений составляет 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше или 2 или меньше. В некоторых вариантах реализации настоящего изобретения последовательность VL акцепторного человеческого каркасного участка идентична последовательности VL каркасного участка человеческого иммуноглобулина или консенсусной последовательности человеческого каркасного участка.
[0086] «Консенсусный человеческий каркасный участок» является каркасным участком, который представляет наиболее часто встречающиеся аминокислотные остатки в отборе VL или VH каркасных последовательностей человеческого иммуноглобулина. Обычно отбор последовательностей VL или VH человеческого иммуноглобулина осуществляют из подгруппы последовательностей вариабельного домена. Обычно подгруппа последовательностей представляет собой подгруппу по Kabat et al. Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. et al.et al.
[0087] Термин «обнаруживаемая при визуализации патология, связанная с отложением амилоида - отек» или «ARIA-E» охватывает вазогенный отек головного мозга и сулькулярный выпот.
[0088] Термин «обнаруживаемая при визуализации патология, связанная с отложением амилоида - кровоизлияние» или «ARIA-H» охватывает микрокровоизлияние и поверхностный сидероз центральной нервной системы.
[0089] Термин «носитель аполипопротеина E4» или «носитель ApoE4», который в настоящем документе используется взаимозаменяемо с термином «с наличием аполипопротеина E4» или «ApoE4-положительный», относится к индивидууму, имеющему по меньшей мере один аллель аполипопротеина E4 (или ApoE4). Индивидуум с отсутствием аллелей ApoE4 в настоящем документе описаны как «ApoE4-отрицательные» или «не являющиеся носителем ApoE4». См. также Prekumar, et al., 1996, Am. J Pathol. 148:2083-95.
[0090] Термин «вазогенный отек головного мозга» относится к избыточному накоплению внутрисосудистой жидкости или белка во внутриклеточных или внеклеточных пространствах головного мозга. Вазогенный отек головного мозга можно обнаружить с помощью, например, МРТ головного мозга, включая, но не ограничиваясь перечисленным, FLAIR МРТ, и он может быть бессимптомным («бессимптомный вазогенный отек») или связанным с неврологическими симптомами, такими как спутанность сознания, головокружение, рвота и вялость («симптоматический вазогенный отек») (см. Sperling et al. Alzheimer's & Dementia, 7:367, 2011).
[0091] Термин «мозговое макрокровоизлияние» относится к внутричерепному кровоизлиянию или кровотечению в головном мозге с площадью, превышающей приблизительно 1 см в диаметре. Мозговое макрокровоизлияние можно обнаружить с помощью, например, МРТ головного мозга, включая, но не ограничиваясь перечисленным, T2*-взвешенную GRE МРТ, и оно может быть бессимптомным («бессимптомное макрокровоизлияние») или связанным с симптомами, такими как преходящее или постоянное фокальное двигательное или чувствительное поражение, атаксия, афазия и дизартрия («симптоматическое макрокровоизлияние») (см., например, Chalela JA, Gomes J. Expert Rev. Neurother. 2004 4:267, 2004 and Sperling et al. Alzheimer's & Dementia, 7:367, 2011).
[0092] Термин «мозговое микрокровоизлияние» относится к внутричерепному кровоизлиянию или кровотечению в головном мозге с площадью меньше, чем приблизительно 1 см в диаметре. Мозговое микрокровоизлияние можно обнаружить с помощью, например, МРТ головного мозга, включая, но не ограничиваясь перечисленным, T2*-взвешенную GRE МРТ, и оно может быть бессимптомным («бессимптомное микрокровоизлияние») или связанным с симптомами, такими как преходящее или постоянное фокальное двигательное или чувствительное поражение, атаксия, афазия и дизартрия («симптоматическое микрокровоизлияние»). См., например, Greenberg, et al., 2009, Lancet Neurol. 8:165-74.
[0093] Термин «сулькулярный выпот» относится к выпоту жидкости в борозды или извилины головного мозга. Сулькулярные выпоты можно обнаружить с помощью, например, МРТ головного мозга, включая, но не ограничиваясь перечисленным, FLAIR МРТ. См. Sperling et al. Alzheimer's & Dementia, 7:367, 2011.
[0094] Термин «поверхностный сидероз центральной нервной системы» относится к кровотечению или кровоизлиянию в субарахноидальное пространство головного мозга, и его можно обнаружить с помощью, например, МРТ головного мозга, включая, но не ограничиваясь перечисленным, T2*-взвешенную GRE МРТ. Симптомы, указывающие на поверхностный сидероз центральной нервной системы включают нейросенсорную глухоту, мозжечковую атаксию и пирамидные знаки. См. Kumara-N, Am J Neuroradiol. 31:5, 2010.
[0095] Термин «прогрессирование» в контексте настоящего документа относится к ухудшению заболевания с течением времени. Термин «скорость прогрессирования» или «степень прогрессирования заболевания относится к тому, насколько быстро или медленно происходит развитие заболевания с течением времени у пациента с установленным диагнозом заболевания. Скорость прогрессирования заболевания может быть представлена изменениями с течением времени конкретных характеристик заболевания,поддающимися измерению. Считают, что пациент, несущий определенный генетический признак, имеет или с большей вероятностью будет иметь «повышенную скорость прогрессирования заболевания», если состояние его заболевания прогрессирует быстрее, чем у пациентов без такого генетического признака. С другой стороны, считают, что если пациент отвечает на терапию, он имеет или с большей вероятностью будет иметь «снижение скорости прогрессирования», если после проведения терапии прогрессирование заболевания у него замедляется по сравнению с состоянием заболевания перед лечением или по сравнению с другими пациентами, не получавшими лечения.
[0096] «С большей вероятностью ответит» в контексте настоящего документа относится к пациентам, которые с большей вероятностью продемонстрируют замедление или предотвращение прогрессирования амилоидоза, например, БА. В отношении БА фраза «с большей вероятностью ответит» относится к пациентам, которые с наибольшей вероятностью демонстрируют снижение потери функции или познания при проведении лечения. Фраза «чувствителен к» в контексте настоящего изобретения означает, что у пациента, страдающего расстройством, с прогнозом или склонностью наличия или с установленным диагнозом расстройства, описанного в настоящем документе, наблюдается ответ на лечение антителами к Abeta.
[0097] Фраза «выбор пациента» или «идентификация пациента» в контексте настоящего документа относится к использованию информации или данных, генерируемых относительно наличия аллеля в образце, полученном от пациента, для определения или выбора пациента как имеющего большую вероятность получения преимуществ от лечения, включающего назначение антитела к Abeta. Информация или данные, используемые или сгенерированные, могут быть предоставлены любой форме: письменной, устной или электронной. В некоторых вариантах реализации настоящего изобретения использование информации или сгенерированных данных включает передачу, представление, протоколирование, хранение, отправку, пересылку, подачу, сообщение, распределение информации или комбинацию перечисленного. В некоторых вариантах реализации настоящего изобретения передачу, представление, протоколирование, хранение, отправку, пересылку, подачу, сообщение, распределение информации или их комбинацию осуществляют с помощью вычислительного устройства, блока анализатора или их комбинации. В некоторых дополнительных вариантах реализации настоящего изобретения, передачу, представление, протоколирование, хранение, отправку, пересылку, подачу, сообщение, распределение информации или их комбинацию осуществляет лаборант или медработник. В некоторых вариантах реализации настоящего изобретения информация или данные включают указание, что в образце присутствует или отсутствует конкретный аллель. В некоторых вариантах реализации настоящего изобретения информация или данные включают указание, что пациент с большей вероятностью ответит на терапию, включающую антитела к Abeta.
[0098] Термин «эффекторные функции» относится к тем видам биологической активности, присущей Fc-области антитела, которые изменяются в зависимости от изотипа антитела. Примеры эффекторных функций антител включают: связывание C1q и комплемент-зависимую цитотоксичность (CDC); связывание с рецептором Fc; антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию клеточных поверхностных рецепторов (например рецептора B-клеток); и активацию B-клеток. В данной области известно, что антитела IgG4 дикого типа имеют меньшую эффекторную функцию, чем антитела IgG1 дикого типа.
[0099] Термин «Fc-область» в настоящем документе используется для обозначения C-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Термин включает Fc-области с нативными последовательностями и вариантные Fc-области. В одном варианте реализации настоящего изобретения Fc-область тяжелой цепи IgG человека продолжается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако Fc-область может содержать или не содержать C-концевой лизин (Lys447). Если не указано иное, нумерация аминокислотных остатков Fc-области или константной области соответствует системе нумерации EU, также называемой индексом EU, как описано в Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
[0131] Термины «полноразмерное антитело», «интактное антитело» и «целое антитело» в настоящем документе используются взаимозаменяемо и относятся к антителу, обладающему практически такой же структурой, как и нативное антитело, или содержащему тяжелые цепи, в состав которых входит Fc-область, определенная в настоящем документе.
[0132] Термины «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» в настоящем документе используются взаимозаменяемо и относятся к клеткам, в которые введена экзогенная нуклеиновая кислота, включая потомство таких клеток. Клетки-хозяева включают «трансформанты» и «трансформированные клетки», которые включают первично трансформированные клетки и полученное из них потомство, независимо от числа пассажей. Потомство может не быть полностью ижентичным родительской клетке по содержанию нуклеиновых кислот и может содержать мутации. В объем настоящего описания входит мутантное потомство, полученное путем скрининга или отбора, которое обладает такой же функцией или биологической активностью, как и исходно трансформированная клетка.
[0133] «Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или более гетерологичными молекулами, включая, но не ограничиваясь перечисленным, дополнительное терапевтическое средство.
[0134] «Выделенная» нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, отделенную от компонентов среды, окружающей ее в природе. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетках, которые обычно содержат такую молекулу нуклеиновой кислоты, однако указанная молекула нуклеиновой кислоты присутствует вне хромосомы или в участке хромосомы, который отличается от природного местонахождения данной молекулы в хромосоме.
[0135] Выражение «выделенная нуклеиновая кислота, кодирующая антитело к Abeta» относится к одной или более молекулам нуклеиновой кислоты, кодирующим тяжелые и легкие цепи антител (или их фрагменты), включая такие молекулы нуклеиновых кислот, находящиеся в одном векторе, или в разных векторах, и такие молекулы нуклеиновых кислот, присутствующие в одном или более участках клетки-хозяина.
[0136] Термин «ранняя болезнь Альцгеймера» или «ранняя БА» в контексте настоящего документа (например, «пациент с диагнозом ранней БА» или «пациент, страдающий ранней БА») включает пациентов с легким когнитивным нарушением, таким как дефицит памяти из-за БА, и пациентов с наличием биомаркеров БА, например пациентов с наличием отложения амилоида.
[0137] Термин «болезнь Альцгеймера легкой степени тяжести» или «БА легкой степени тяжести» в контексте настоящего документа (например, «пациент с диагнозом БА легкой степени тяжести») относится к стадии БА, которая характеризуется оценкой по шкале MMSE от 20 до 26 баллов.
[0138] Термин «болезнь Альцгеймера от легкой до умеренной степени тяжести» или «БА от легкой до умеренной степени тяжести» в контексте настоящего документа охватывает БА как легкой, так и умеренной степени тяжести и характеризуется оценкой по шкале MMSE от 18 до 26 баллов.
[0139] Термин «болезнь Альцгеймера умеренной степени тяжести» или «БА умеренной степени тяжести» в контексте настоящего документа (например, «пациент с диагнозом БА умеренной степени тяжести») относится к стадии БА, которая характеризуется оценкой по шкале MMSE от 18 до 19 баллов.
[0140] «Голое антитело» относится к антителу, не конъюгированному с гетерологичным фрагментом (например, дополнительным терапевтическим фрагментом) или радиоизотопной меткой. Голое антитело может присутствовать в фармацевтическом препарате.
[0141] Термин «нативные антитела» относится к природным молекулам иммуноглобулинов, имеющим разные структуры. Например, нативные антитела IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой около 150000 дальтон, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, соединенных дисульфидными связями. В направлении от N- к C-концу каждая тяжелая цепь имеет вариабельную область (VH), также называемую вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, сопровождающуюся тремя константными доменами (CH1, CH2 и CH3). Подобным образом, в направлении от N- к C-концу каждая легкая цепь имеет вариабельную область (VL), также называемую вариабельным легким доменом или вариабельным доменом легкой цепи, сопровождающуюся константным легким (CL) доменом. В зависимости от аминокислотной последовательности константного домена легкую цепь антитела можно отнести к одному из двух типов, называемых каппа (κ) и лямбда (λ).
[0142] Термин «вкладыш в упаковку» относится к инструкциям, которые обычно вкладывают в коммерческие упаковки терапевтических продуктов, и которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях, касающихся применения таких терапевтических продуктов. Термин «вкладыш в упаковку» относится к инструкциям, которые обычно вкладывают в коммерческие упаковки диагностических продуктов, и которые содержат информацию о предполагаемом применении, принципах исследования, получении и обработке реагентов, сборе и подготовке образцов, калибровке анализа и процедуре анализа, выполнении и точности представления данных, такой как чувствительность и специфичность анализа.
[0143] «Процент ( %) идентичности аминокислотной последовательности» в отношении эталонной полипептидной последовательности определяют как процент аминокислотных остатков последовательности-кандидата, идентичных аминокислотным остаткам эталонной полипептидной последовательности после выравнивания последовательностей и введения гэпов, если это необходимо для достижения максимального процента идентичности последовательностей, причем при определении идентичности последовательностей консервативные замены не учитываются. Выравнивание аминокислотных последовательностей с целью определения процента их идентичности можно осуществить разными способами, известными специалистам в данной области, например, с помощью широко доступного программного обеспечения, такого как программы BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определить параметры, подходящие для выравнивания последовательностей, в том числе любые алгоритмы, необходимые для достижения максимального выравнивания сравниваемых последовательностей по всей длине. Однако в настоящем документе значения % идентичности аминокислотных последовательностей получают с помощью компьютерной программы для сравнения последовательностей ALIGN-2. Компьютерная программа для сравнения последовательностей ALIGN-2 разработана Genentech, Inc., а исходный код бы зарегистрирован наряду с информацией для пользователя в Бюро регистрации авторских прав США, Washington D.C., 20559, под номером регистрации авторского права США. TXU510087. Программа ALIGN-2 находится в свободном доступе в Genentech, Inc., South San Francisco, California, или ее можно скомпилировать из исходного кода. Для применения в операционной системе UNIX, включающей цифровую версию UNIX V4.0D, программу ALIGN-2 нужно компилировать. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и остаются неизменными.
[0144] В случаях, когда ALIGN-2 используют для сравнения аминокислотных последовательностей, % идентичности данной аминокислотной последовательности A и данной аминокислотной последовательности B (то можно также сформулировать как данная аминокислотная последовательность A обладает или характеризуется определенным % идентичности последовательностей по отношению к, по сравнению с или относительно данной аминокислотной последовательности B) рассчитывают следующим образом:
100 умножают на дробь (X/Y),
где X обозначает число идентичных совпадений аминокислотных остатков, определенное при выравнивании последовательностей A и B программой для выравнивания последовательностей ALIGN-2, а Y обозначает общее число аминокислотных остатков в последовательности B. Следует понимать, что, если длина аминокислотной последовательности A не равна длине аминокислотной последовательности B, % идентичности аминокислотной последовательности A аминокислотной последовательности B не равен % идентичности аминокислотной последовательности B аминокислотной последовательности A. Если не указано иначе, все значения % идентичности аминокислотных последовательностей, используемые в настоящем документе, получают в соответствии со способом, описанным в предшествующем параграфе, с помощью компьютерной программы ALIGN-2.
[0145] Термины «фармацевтический препарат» и «фармацевтическая композиция» используются взаимозаменяемо и относятся к препарату, который находится в такой форме, которая обеспечивает эффективную биологическую активность содержащегося в ней активного ингредиента, и не содержит других компонентов, обладающих неприемлемой токсичностью для субъекта, которому будут вводить препарат.
[0146] Термин «фармацевтически приемлемый носитель» относится к ингредиенту фармацевтического препарата, отличному от активного ингредиента, который является нетоксичным для субъекта. Фармацевтически приемлемый носитель включает, но не ограничивается перечисленным, буфер, вспомогательное вещество, стабилизатор или консервант.
[0147] Термин «вектор» в контексте настоящего документа относится к молекуле нуклеиновой кислоты, способной обеспечивать репродукцию другой, связанной с ней нуклеиновой кислоты. Термин включает вектор, находящийся в виде самореплицирующейся нуклеиновой кислоты, а также вектор, способный внедряться в геном клетки-хозяина, в которую его вводят. Некоторые векторы способны управлять экспрессией нуклеиновых кислот, с которыми они находятся в функциональной связи. Такие векторы в настоящем документе называют «экспрессирующими векторами».
[0148] «Визуализирующее средство» представляет собой соединение, которое имеет одно или более свойств, позволяющих прямое или косвенное обнаружение его присутствия и/или местонахождения. Примеры таких визуализирующих средств включают белки и низкомолекулярные соединения, включающие меченый фрагмент, который обеспечивает детекцию.
[0149] «Метка» представляет собой маркер, соединенный с молекулой, предназначенный для использования с целью детекции или визуализации. Примеры таких меток включают: радиоактивную метку, флуорофор, хромофор или аффинную метку. В одном варианте реализации настоящего изобретения метка представляет собой радиоактивную метку, используемую для медицинской визуализации, например tc99m или I123, или спиновую метку, применяющуюся для визуализации ядерного магнитного резонанса (ЯМР) (также известного как магнитно-резонансная томография, МРТ), такую как, опять же, йод-123, йод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец, железо и т. д.
СПОСОБЫ И КОМПОЗИЦИИ
[0150] В настоящем изобретении предложены композиции и способы лечения, прогноза, выбора и/ или идентификации пациентов с риском развития или с наличием амилоидоза. В одном аспекте изобретение отчасти основывается на усовершенствованных способах лечения.
[0151] В некоторых вариантах реализации настоящего изобретения предложены антитела, которые связываются с Abeta. Антитела по настоящему изобретению можно использовать, например, для диагностики или лечения болезни Альцгеймера (БА) и других заболеваний.
Примеры антител
[0152] В одном аспекте в изобретении предложены выделенные антитела, способные связываться с Abeta. В некоторых вариантах реализации настоящего изобретения в изобретении предложено антитело к Abeta, которое может связываться с мономерной, олигомерной и фибриллярной формами Abeta человека с высокой аффинностью. В одном варианте реализации настоящего изобретения антитело к Abeta представляет собой антитело, которое связывается с эпитопом Abeta а пределах остатков 13-24 Abeta. В одном таком варианте реализации настоящего изобретения антитело представляет собой кренезумаб.
[0153] В одном варианте реализации настоящего изобретения, антитело содержит аминокислотную последовательность тяжелой цепи, представленную в SEQ ID NO: 5, и аминокислотную последовательность легкой цепи, представленную в SEQ ID NO: 9. В другом варианте реализации настоящего изобретения антитело содержит вариабельную область тяжелой цепи, состоящую из аминокислот 1-112 аминокислотной последовательности, представленной в SEQ ID NO: 5, и вариабельную область легкой цепи, состоящую из аминокислот 1-112 аминокислотной последовательности, представленной в SEQ ID NO: 9. В другом варианте реализации настоящего изобретения антитело содержит последовательности HVR SEQ ID NO: 5 и SEQ ID NO: 9. В другом варианте реализации настоящего изобретения антитело содержит последовательности HVR, которые на 95%, 96%, 97%, 98% или 99% или более идентичны последовательностям HVR SEQ ID NO: 5 и SEQ ID NO: 9.
[0154] В любом из приведенных выше вариантов реализации настоящего изобретения антитело к Abeta является гуманизированным. В одном варианте реализации настоящего изобретения антитело к Abeta содержит HVR, описанные в любом из приведенных выше вариантов реализации настоящего изобретения, и дополнительно содержит акцепторный человеческий каркасный участок, например, каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок.
[0155] В другом аспекте антитело к Abeta содержит последовательность вариабельного домена тяжелой цепи (VH), по меньшей мере, на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную аминокислотам 1-112 аминокислотной последовательности SEQ ID NO: 5. В некоторых вариантах реализации настоящего изобретения последовательность VH, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная эталонной последовательности, содержит замены (например, консервативные замены), инсерции или делеции по сравнению с эталонной последовательностью, однако антитело к Abeta, содержащее указанную последовательность, сохраняет способность связываться с Abeta. В некоторых вариантах реализации настоящего изобретения в SEQ ID NO: 5 присутствует всего от 1 до 10 аминокислотных замен, инсерций и/или делеций. В некоторых вариантах реализации настоящего изобретения замены, инсерции или делеции встречаются в участках, находящихся за пределами HVR (т. е. в FR). Антитело к Abeta необязательно содержит последовательность VH SEQ ID NO: 5, включающую посттрансляционные модификации этой последовательности.
[0156] В другом аспекте предложено антитело к Abeta, причем это антитело содержит последовательность вариабельного домена легкой цепи (VL), по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичную аминокислотам 1-112 аминокислотной последовательности SEQ ID NO: 9. В некоторых вариантах реализации настоящего изобретения последовательность VL, по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичная эталонной последовательности, содержит замены (например, консервативные замены), инсерции или делеции по сравнению с эталонной последовательностью, однако антитело к Abeta, содержащее указанную последовательность, сохраняет способность связываться с Abeta. В некоторых вариантах реализации настоящего изобретения в SEQ ID NO: 9 присутствует всего от 1 до 10 аминокислотных замен, инсерций и/или делеций. В некоторых вариантах реализации настоящего изобретения замены, инсерции или делеции встречаются в участках, находящихся за пределами HVR (т. е. в FR). Антитело к Abeta необязательно содержит последовательность VL SEQ ID NO: 9, включающую посттрансляционные модификации этой последовательности.
[0157] В другом аспекте предложено антитело к Abeta, причем это антитело содержит VH, как описано выше в любом из вариантов реализации настоящего изобретения, и VL, как описано выше в любом из вариантов реализации настоящего изобретения.
[0158] В дополнительном аспекте в настоящем изобретении предложено антитело, способное связываться с тем же эпитопом, что и описанное в настоящем документе антитело к Abeta. Например, в некоторых вариантах реализации настоящего изобретения предложено антитело, которое связывается с тем же эпитопом, что и антитело к Abeta, содержащее последовательность VH SEQ ID NO: 5 и последовательность VL SEQ ID NO: 9.
[0159] В дополнительном аспекте настоящего изобретения антитело к Abeta в соответствии с любым из вышеописанных вариантов реализации настоящего изобретения представляет собой моноклональное антитело, включая химерное, гуманизированное или человеческое антитело. В одном варианте реализации настоящего изобретения антитело к Abeta представляет собой фрагмент антитела, например, фрагмент Fv, Fab, Fab', scFv, диатело или F(ab')2. В другом варианте реализации настоящего изобретения антитело представляет собой полноразмерное антитело, например, интактное антитело IgG4 или антитело, относящееся к другому классу или изотипу, как определено в настоящем документе. В другом варианте реализации настоящего изобретения антитело представляет собой биспецифическое антитело.
[0160] В дополнительном аспекте антитело к Abeta в соответствии с любым из вышеописанных вариантов реализации настоящего изобретения может иметь любой один из признаков, описанных в приведенных ниже разделах 1-7, или сочетание указанных признаков.
[0161] В одном варианте реализации настоящего изобретения антитело к Abeta содержит HVR-L1 с аминокислотной последовательностью SEQ ID NO: 6; HVR-L2 с аминокислотной последовательностью SEQ ID NO: 7; HVR-L3 с аминокислотной последовательностью SEQ ID NO: 8; HVR-H1 с аминокислотной последовательностью SEQ ID NO: 2; HVR-H2 с аминокислотной последовательностью SEQ ID NO: 3; и HVR-H3 с аминокислотной последовательностью SEQ ID NO: 4.
[0162] В другом варианте реализации настоящего изобретения антитело содержит последовательности SEQ ID NO: 5 и SEQ ID NO: 9 тяжелой и легкой цепи.
[0163] В другом варианте реализации настоящего изобретения антитело содержит последовательности вариабельных областей SEQ ID NO: 5 и SEQ ID NO: 9.
[0164] В любом из приведенных выше вариантов реализации настоящего изобретения антитело к Abeta может быть гуманизироанным. В одном варианте реализации настоящего изобретения антитело к Abeta содержит HVR, описанные в любом из приведенных выше вариантов реализации настоящего изобретения, и дополнительно содержит акцепторный человеческий каркасный участок, например, каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок.
1. Аффинность антител
[0165] В некоторых вариантах реализации настоящего изобретения предложенное в настоящем документе антитело имеет константу диссоциации (Kd) ≤ 1 мкМ, ≤ 100 нМ, ≤ 10 нМ, ≤ 1 нМ, ≤ 0,1 нМ, ≤ 0,01 нМ или r ≤ 0,001 нМ (например, 10-8 M или меньше, например от 10-8 M до 10-13 M, например, от 10-9 M до 10-13 M).
[0166] В одном варианте реализации настоящего изобретения Kd измеряют с помощью анализа связывания антигена, меченного радиоактивным изотопом (RIA), с использованием Fab-версии представляющего интерес антитела и его антигена в соответствии с описанным ниже анализом. Аффинность связывания Fab с антигеном в растворе измеряют путем уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии ряда титровочных концентраций немеченого антигена с последующим улавливанием связанного антигена на планшете, покрытом антителом к Fab (см., например, Chen et al.et al., J. Mol. Biol. 293:865-881(1999)). Чтобы определить условия анализа, многолуночные планшеты MICROTITER® (Thermo Scientific) покрывают в течение ночи улавливающим антителом к Fab (Cappel Labs) в концентрации 5 мкг/мл в 50 мМ растворе карбоната натрия (pH 9,6), а затем блокируют 2% (мас./об.) раствором бычьего сывороточного альбумина в PBS в течение двух-пяти часов при комнатной температуре (около 23 °C). В планшете, не содержащем адсорбента (Nunc № 269620), смешивают 100 пМ или 26 пМ [125I]-антигена с серийными разведениями представляющего интерес Fab (например, в соответствии с оценкой антитела к VEGF, Fab-12, описанного в Presta et al., Cancer Res. 57:4593-4599 (1997)). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубацию можно продолжать в течение более длительного периода (например, в течение около 65 часов), чтобы гарантировать достижение равновесия. После этого смеси переносят в планшет для улавливания и инкубируют при комнатной температуре (например, в течение одного часа). После инкубации раствор удаляют и планшет промывают восемь раз 0,1% раствором полисорбата 20 (TWEEN-20®) в PBS. Планшеты сушат, затем добавляют 150 мкл/лунку сцинтиллятора (MICROSCINT-20 TM; Packard) и считают на гамма-счетчике TOPCOUNT TM (Packard) в течение десяти минут. Концентрации каждого Fab, обеспечивающие связывание, составляющее 20% или меньше от максимального, выбирают для применения в анализе конкурентного связывания.
[0167] В соответствии с другим вариантом реализации настоящего изобретения, Kd измеряют с использованием анализа поверхностного плазмонного резонанса при 25 °C, используя BIACORE®-2000 или BIACORE ®-3000 (BIAcore, Inc., Piscataway, NJ) и чипы с иммобилизованным антигеном CM5 при ~10 единицах ответа (RU). Коротко говоря, биосенсорные чипы на основе карбоксиметилированного декстрана (CM5, BIACORE, Inc.) активируют гидрохлоридом N-этил-N'-(3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимидом (NHS) в соответствии с инструкциями поставщика. Антиген разбавляют 10 мМ ацетата натрия, pH 4,8, до 5 мкг/мл (~0,2 мкМ) и затем вводят его со скоростью потока 5 мкл/минуту до достижения примерно 10 единиц ответа (RU) от присоединенного белка. После введения антигена вводят 1 M этаноламина, чтобы блокировать непрореагировавшие группы. Для измерения кинетических параметров двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) вводят в PBS, содержащий 0,05% полисорбата 20 (TWEEN-20TM) в качестве поверхностно-активного вещества (PBST) при 25°C со скоростью потока, составляющей около 25 мкл/мин. Скорости ассоциации (kon) и скорости диссоциации (koff) рассчитывают, используя простую взаимно однозначную модель связывания Ленгмюра (программа для обработки данных BIACORE®, версия 3.2) путем одновременной подгонки сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывают как соотношение koff/kon. См., например, Chen et al., J. Mol. Biol. 293:865-881 (1999). Если скорость ассоциации превышает 106 M-1с-1 по данным приведенного выше анализа поверхностного плазмонного резонанса, то скорость ассоциации можно определить посредством методики гашения флуоресценции, которая позволяет измерять увеличение или уменьшение интенсивности флуоресценции (длина волны возбуждения=295 нМ; длина волны испускания=340 нМ, полоса пропускания 16 нМ) при 25°C в присутствии 20 нМ комплекса антиген-антитело (форма Fab) в PBS, pH 7,2, и повышающихся концентраций антигена с помощью измерения спектрометром, таким как спектрофотометр с оборудованием для исследования по способу остановленного потока (Aviv Instruments), или спектрофотометр SLM-AMINCO TM, серия 8000 (ThermoSpectronic), оборудованный перемешиваемой кюветой.
2. Фрагменты антител
[0168] В некоторых вариантах реализации настоящего изобретения предложенное в настоящем описании антитело представляет собой фрагмент антитела. Фрагменты антител включают, но не ограничиваются перечисленным, фрагменты Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv, а также другие фрагменты, описанные ниже. Обзор некоторых фрагментов антител приведен в Hudson et al. Nat. Med. 9:129-134 (2003). Обзор фрагментов scFv приведен например, Pluckthün, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); см также WO 93/16185; и патенты США №№ 5571894 и 5587458. Описание фрагментов Fab и F(ab')2, содержащих остатки, связывающие эпитоп реутилизационного рецептора, и имеющие увеличенный период полураспада in vivo см. в патенте США № 5869046.
[0169] Диатела представляют собой фрагменты антител, содержащие два антиген-связывающих участка, и могут быть двухвалентными или биспецифическими. См., например, EP 404097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); и Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в Hudson et al., Nat. Med. 9:129-134 (2003).
[0170] Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи антитела или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах реализации настоящего изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (Domantis, Inc., Waltham, MA; см., например, патент США № 6248516 B1). В некоторых вариантах реализации настоящего изобретения два или более однодоменных антитела могут быть соединены вместе с образованием конструкции иммуноглобулина с многовалентной аффинностью (т. е. N- или C-конец первого однодоменного антитела может быть слит или соединен другим образом с N- или C-концом второго однодоменного антитела).
[0171] Фрагменты антител можно получить разными способами, включающими, но не ограничивающимися перечисленным, протеолитическое расщепление интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например E. coli или фагом), описанными в настоящем документе.
3. Химерные и гуманизированные антитела
[0172] В некоторых вариантах реализации настоящего изобретения предложенное в настоящем документе антитело представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в. патенте США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). В одном примере химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область, полученную из мыши, крысы, хомячка, кролика или отличного от человека примата, такого как мартышка) и человеческую константную область. В дополнительном примере химерное антитело представляет собой антитело «переключенного класса», полученное в результате изменения класса или подкласса исходного антитела. Термин «химерные антитела» включает антиген-связывающие фрагменты таких антител.
[0173] В некоторых вариантах реализации настоящего изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют, чтобы уменьшить иммуногенность для человека и сохранить при этом специфичность и аффинность исходного нечеловеческого антитела. Обычно гуманизированное антитело содержит один или более вариабельных доменов, в состав которых входят HVR, например, CDR (или их части), полученные из нечеловеческого антитела, и FR (или их части), полученные из последовательностей человеческих антител. Гуманизированное антитело также необязательно содержит по меньшей мере часть человеческой константной области. В некоторых вариантах реализации настоящего изобретения отдельные остатки FR гуманизированного антитела замещены соответствующими остатками нечеловеческого антитела (например, антитела, из которого получены остатки HVR), например, с целью сохранения или улучшения специфичности или аффинности антитела.
[0174] Обзоры по гуманизированным антителам и способам их получения можно найти, например, в Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), а дополнительное описание, например, в Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989); патентах США №№ 5821337, 7527791, 6982321 и 7087409; Kashmiri et al., Methods 36:25-34 (2005) (описывает прививание SDR (a-CDR)); Padlan, Mol. Immunol. 28:489-498 (1991) (описывает «изменение поверхности»); Dall'Acqua et al., Methods 36:43-60 (2005) (описывает «перетасовку FR»); и Osbourn et al., Methods 36:61-68 (2005) и Klimka et al., Br. J. Cancer, 83:252-260 (2000) (описывает подход «управляемой селекции» при перетасовке FR).
[0175] Человеческие каркасные участки, которые можно использовать для гуманизации, включают, но не ограничиваются перечисленным: каркасные участки, выбранные с использованием «наилучшего соответствия» (см., например, Sims.et al. J. Immunol. 151:2296 (1993)); каркасные участки консенсусной последовательности человеческих антител, содержащей конкретную подгруппу вариабельных областей легкой или тяжелой цепи см., например, Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); и Presta et al. J. Immunol., 151:2623 (1993)); человеческие зрелые (образовавшиеся в результате соматических мутаций) каркасные участки или человеческие каркасные участки зародышевого типа (см., например, Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); и каркасные участки, полученные в результате скрининга библиотек FR (см., например, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) и Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)).
4. Человеческие антитела
[0176] В некоторых вариантах реализации настоящего изобретения предложенное в настоящем документе антитело представляет собой человеческое антитело. Человеческие антитела можно получать с помощью разных методик, известных в данной области. Человеческие антитела описаны в общих чертах в van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) и Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
[0177] Человеческие антитела можно получить путем введения иммуногена трансгенному животному, модифицированному с целью придания ему способности продуцировать интактные человеческие антитела или интактные антитела, содержащие человеческие вариабельные области, в ответ на введение антигена. Такие животные обычно содержат все локусы человеческих иммуноглобулинов (или часть), которые заменяют эндогенные локусы иммуноглобулинов, или которые присутствует вне хромосом, или интегрируются случайным образом в хромосомы животного. У таких трансгенных мышей эндогенные локусы иммуноглобулинов обычно инактивируют. Обзор способов получения человеческих антител с использованием трансгенных животных можно см. в Lonberg, Nat. Biotech. 23:1117-1125 (2005). См. также, например, патенты США №№ 6075181 и 6150584. в которых описана методика XENOMOUSETM; патент США № 5770429, в котором описана методика HUMAB®; патент США № 7041870, в котором описана методика K-M MOUSE®, и патентную публикацию № US 2007/0061900, в которой описана методика VELOCIMOUSE®). Человеческие вариабельные области интактных антител, полученных с использованием таких животных, можно дополнительно модифицировать, например, путем объединения с другой человеческой константной областью.
[0178] Человеческие антитела также можно получить с помощью гибридомных способов. Описаны человеческие миеломные и мышино-человеческие гетеромиеломные клеточные линии, используемые для получения человеческих моноклональных антител. (См., например, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).) Человеческие антитела, полученные с использованием методики человеческих B-клеточных гибридом, также описаны в Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). Дополнительные способы включают те, что описаны, например, в патенте США № 7189826 (описывает получение моноклональных человеческих антител IgM из гибридомных клеточных линий) и Ni, Xiandai Mianyixue, 26(4):265-268 (2006) (описывает полностью человеческие гибридомы). Методика человеческих гибридом (методика Trioma) также описана в Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005).
[0179] Человеческие антитела также можно получить путем выделения последовательностей вариабельного домена клона Fv, выбранных из человеческих библиотек фаговых дисплеев. Такие последовательности вариабельного домена можно затем объединить с желательным человеческим константным доменом. Методики выбора человеческих антител из библиотек антител описаны ниже.
5. Антитела, полученные из библиотек
[0180] Антитела по настоящему изобретению можно выделить путем скрининга комбинаторных библиотек на антитела, обладающие желательной активностью или желательными активностями. Например, в данной области известен ряд способов получения библиотек фаговых дисплеев и скрининга таких библиотек на антитела, обладающие желательными характеристиками связывания. Обзор таких способов можно найти, например, в Hoogenboom et al. в Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, 2001), а дополнительное описание, например, в McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004).
[0181] В некоторых способах фаговых дисплеев репертуары генов VH и VL отдельно клонируют посредством полимеразной цепной реакции (ПЦР) и рекомбинируют случайным образом в фаговых библиотеках, которые затем можно подвергнуть скринингу на антиген-связывающие фаги, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Как правило, фаг отображает фрагменты антител либо в виде одноцепочечных фрагментов Fv (scFv), либо в виде фрагментов Fab. Библиотеки, полученные из иммунизированных источников, содержат антитела, обладающие высокой аффинностью к иммуногену, следовательно, необходимость конструирования гибридом отпадает. Альтернативно можно клонировать наивный репертуар (например, от человека) с получением одного источника антител против широкого ряда собственных и не собственных антигенов без какой-либо иммунизации, как описано Griffiths et al., EMBO J, 12: 725-734 (1993). Наконец, наивные библиотеки также можно получить синтетически путем клонирования не подвергавшихся реаранжировке сегментов V-гена из стволовых клеток, с использованием праймеров ПЦР, содержащих статистическую последовательность, кодирующую высоко вариабельные области CDR3, и с проведением реаранжировки in vitro, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Патентные публикации, описывающие фаговые библиотеки человеческих антител, включают, например: патент США № 5750373 и патентные публикации США №№ 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
[0182] Антитела или фрагменты антител, выделенные из библиотек человеческих антител, в данном документе относят к человеческим антителам или фрагментам человеческих антител.
6. Мультиспецифические антитела
[0183] В некоторых вариантах реализации настоящего изобретения предложенное в настоящем документе антитело представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые содержат по меньшей мере два разных участка специфического связывания. В некоторых вариантах реализации настоящего изобретения один участок специфического связывания отвечает за связывание с Abeta, а другой ─ с любым другим антигеном. В некоторых вариантах реализации настоящего изобретения биспецифические антитела могут связываться с двумя разными эпитопами Abeta. Биспецифические антитела также можно использовать для направления цитотоксических средств к клеткам. Биспецифические антитела можно получить в виде полноразмерных антител или в виде фрагментов антител.
[0184] Методики получения мультиспецифических антител включают, но не ограничиваются перечисленным, рекомбинантную совместную экспрессию двух пар тяжелая цепь-легкая цепь иммуноглобулина, обладающих разными специфичностями (см. Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829 и Traunecker et al., EMBO J. 10: 3655 (1991)) и рекомбинантную технологию «выступ-во-впадину» (см., например, патент США № 5731168). Мультиспецифические антитела также можно получить конструированием способом, обеспечивающим электростатические направляющие эффекты, которые позволяют получать Fc-гетеродимерные молекулы антитела (WO 2009/089004A1); путем поперечной сшивки двух или более антител или фрагментов (см., например, патент США № 4676980 и Brennan et al., Science, 229: 81 (1985)); с использованием лейциновых молний, позволяющих получать биспецифические антитела (см., например, Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)); с использованием методики «диател», позволяющей получать фрагменты биспецифических антител (см., например, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); и с использованием димеров одноцепочечных Fv (sFv) (см.,например, Gruber et al., J. Immunol., 152:5368 (1994)); а также можно получить триспецифические антитела, как описано, например, в Tutt et al. J. Immunol. 147: 60 (1991).
[0185] Сконструированные антитела, содержащие три или более функциональных антиген-связывающих участка, включая «антитела-осьминоги», также включены в настоящий документ (см., например US 2006/0025576A1).
[0186] В соответствии с настоящим документом антитело или его фрагмент также включает «Fab двойного действия» или DAF, содержащий антиген-связывающий участок, способный связываться с Abeta наряду с другим, отличным от него антигеном (см., например, US 2008/0069820).
7. Варианты антител
[0187] В некоторых вариантах реализации настоящего изобретения предусмотрены варианты аминокислотных последовательностей антител, предложенных в настоящем документе. Например, может возникнуть необходимость в улучшении аффинности связывания и/или других биологических свойств антитела. Варианты аминокислотных последовательностей антител можно получить путем введения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации включают, например, делеции и/или инсерции и/или замены остатков в аминокислотной последовательности антитела. Чтобы получить конечную конструкцию, можно осуществить любое сочетание делеций, инсерций и замен, при условии, что конечная конструкция обладает желательными характеристиками, например, способностью связывать антиген.
Варианты, полученные в результате замен, инсерций и делеций
[0188] В некоторых вариантах реализации настоящего изобретения предложены варианты антител, содержащих одну или несколько аминокислотных замен. Участки, представляющие интерес с точки зрения заместительного мутагенеза, включают HVR и FR. Консервативные замены приведены в таблице 1 под заголовком «Консервативные замены». Более конкретные замены приведены в таблице 1 под заголовком «Иллюстративные замены» и, как дополнительно описано ниже, с учетом классов боковых цепей аминокислот. Аминокислотные замены вводят в представляющее интерес антитело, после чего полученные продукты подвергают скринингу на желательную активность, например, сохранение/улучшение способности связывать антиген, пониженную иммуногенность или улучшенные ADCC или CDC.
ТАБЛИЦА 1.
|
[0189] Аминокислоты можно классифицировать в соответствии с общими свойствами боковых цепей:
[0190] (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
[0191] (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
[0192] (3) кислые: Asp, Glu;
[0193] (4) основные: His, Lys, Arg;
[0194] (5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
[0195] (6) ароматические: Trp, Tyr, Phe.
[0196] Неконсервативные замены представляют собой замену члена одного из указанных классов членом другого класса.
[0197] Заместительный вариант одного типа можно получить путем замены одного или более остатков гипервариабельного участка исходного антитела (например, гуманизированного или человеческого антитела). Как правило, полученный вариант (-ы), выбранный для дальнейшего исследования, характеризуется изменениями (например, улучшениями) некоторых биологических свойств (например, повышенной аффинностью, пониженной иммуногенностью) по сравнению с исходным антителом и/или практически сохраняет некоторые биологические свойства исходного антитела неизменными. Примером заместительного варианта является аффинно-зрелое антитело. В некоторых вариантах реализации настоящего изобретения аффинно-зрелые антитела проявляет аффинность к антигену-мишени, выражаемую в наномолях или даже в пикомолях. Аффинно-зрелые антитела получают с помощью способов, известных в данной области, включая, например, использование методик аффинного созревания на основе фаговых дисплеев, как описано в настоящем документе. Коротко, один или более остатков HVR подвергаются мутации,после чего вариантные антитела, отображенные на фаге, подвергают скринингу на конкретный вид биологической активности (например, на аффинность связывания). Также известны другие способы. Marks et al. Bio/Technology 10:779-783 (1992) описывает созревание аффинности посредством перетасовки доменов VH и VL. Случайный мутагенез HVR и/или остатков каркасных участков описан в: Barbas et al. Proc Nat. Acad. Sci, USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1996); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al. J. Mol. Biol. 226:889-896 (1992).
[0198] Изменения (например, замены) в HVR можно осуществить, например, с целью улучшения аффинности антитела. Такие изменения можно осуществить в «горячих точках» HVR, т. е. в остатках, кодируемых кодонами, которые в процессе соматического созревания подвергаются мутациям с высокой частотой (см., например, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)) и/или SDR (a-CDR), с тестированием полученного варианта VH или VL на аффинность связывания. Аффинное созревание путем конструирования и повторного выбора из вторичных библиотек описано, например, в Hoogenboom et al. в Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, NJ, (2001).) В некоторых вариантах реализации настоящего изобретения, касающихся аффинного созревания, в гены вариабельных участков, выбранных для созревания, вводят разнообразие с помощью одного из ряда способов (включающих,например, ПЦР с внесением ошибок, перетасовку цепей или олигонуклеотид-направленный мутагенез). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу с целью идентификации любых вариантов антител, обладающих желательной аффинностью. Другой способ введения разнообразия включает HVR-направленные подходы с рандомизацией некоторых остатков HVR (например, 4-6 остатков одновременно). Можно конкретно идентифицировать остатки HVR, участвующие в связывании антигена, например, с помощью сканирующего аланином мутагенеза или моделирования. При этом мишенями часто являются CDR-H3 и CDR-L3.
[0199] В некоторых вариантах реализации настоящего изобретения замены, инсерции или делеции могут встречаться в одном или более HVR при условии, что такие изменения практически не снижают способность антитела связывать антиген. Например, в HVR можно осуществить консервативные изменения (например, консервативные замены, описанные в настоящем документе), которые практически не снижают аффинность связывания. Такие изменения могут находиться за пределами «горячих точек» HVR или SDR. В некоторых вариантах реализации настоящего изобретения в описанных выше вариантных последовательностях VH и VL, каждый HVR либо остается неизменным, либо содержит не более одной, двух или трех аминокислотных замен.
[0200] Идентификацию остатков или участков антитела, которые могут служить мишенью для мутагенеза, проводят с помощью способа, называемого «сканирующий аланином мутагенез», описанного в Cunningham and Wells (1989) Science, 244:1081-1085. В этом способе идентифицируют остаток или группу целевых остатков (например, заряженные остатки, такие как arg, asp, his, lys и glu) и заменяют их нейтральными или отрицательно заряженными аминокислотами (например, аланином или полиаланином), чтобы определить, влияют ли они на взаимодействие антитела с антигеном. В аминокислотные положения, характеризующиеся функциональной чувствительностью к исходным заменам, можно вводить дополнительные замены. Альтернативно или дополнительно, точки контакта антитела с антигеном идентифицируют с использованием кристаллической структуры комплекса антиген-антитело. Такие контактные или соседние с ними остатки можно использовать в качестве мишеней для замены, или они могут не рассматриваться как кандидаты для замены. Варианты можно подвергнуть скринингу, чтобы определить, обладают ли они желательными свойствами.
[0201] Инсерции в аминокислотную последовательность включают амино- и/или карбокси-концевые слияния, которые могут содержать в длину от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции в центральную часть последовательности одного или множества аминокислотных остатков. Примеры концевых инсерций включают инсерцию в антитело N-концевого остатка метионила. Другие инсерционные варианты молекулы антитела включают слияние на N- или C-конце с ферментом (например, ADEPT) или полипептидом, который увеличивает период полураспада антитела в сыворотке.
Варианты, полученные в результате гликозилирования
[0202] В некоторых вариантах реализации настоящего изобретения предложенное в настоящем документе антитело изменяют с целью увеличения или уменьшения степени его гликозилирования. Добавление или делецию участков гликозилирования антитела можно осуществить путем изменения аминокислотной последовательности с введением или удалением одного или нескольких участков гликозилирования.
[0203] Если антитело содержит Fc-область, можно изменить присоединенный к нему углевод. Нативные антитела, продуцируемые клетками млекопитающих, как правило, содержат разветвленный, биантенный олигосахарид, обычно присоединенный N-связью к Asn297 домена CH2 Fc-области. См., например, Wright et al. TIBTECH 15:26-32 (1997). Олигосахарид может содержать разные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в части «ствола» биантенной структуры олигосахарида. В некоторых вариантах реализации настоящего изобретения модификации олигосахарида в антителе по настоящему изобретению можно осуществить с целью создания вариантов антител, обладающих определенными улучшенными свойствами.
[0204] В одном варианте реализации настоящего изобретения предложены варианты антител, содержащие углевод, в котором отсутствует фукоза, присоединенная (непосредственно или косвенно) к Fc-области. Например,количество фукозы в таком антителе может варьировать от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Содержание фукозы определяют путем расчета отношения среднего количества фукозы в цепи сахара, присоединенного к Asn297, к сумме всех углеводных структур, присоединенных к Asn297 (например, комплексных структур, гибридных структур и структур с высоким содержанием маннозы), используя результаты метода масс-спектрометрии MALDI-TOF, описанного, например, в WO 2008/077546. Asn297 обозначает остаток аспарагина, расположенный примерно в положении 297 Fc-области (нумерация Eu остатков Fc-области); однако Asn297 также может находиться на расстоянии около ± 3 аминокислот выше или ниже положения 297, т. е. между положениями 294 и 300, вследствие незначительных вариаций последовательности антитела. Такие фукозилированные варианты могут улучшать функцию ADCC. См., например, патентные публикации США №№ US 2003/0157108 (Presta, L.); US 2004/0093621 (Kyowa Hakko Kogyo Co., Ltd). Примеры публикаций, описывающих «дефукозилированные» или «фукоза-дефицитные» варианты антител, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 CHO, дефицитные по фукозилированию белков (Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); патентная заявка США № US 2003/0157108 A1, Presta, L; и WO 2004/056312 A1, Adams et al., особенно пример 11), и клеточные линии с нокаутом, например, гена альфа-1,6-фукозилтрансферазы, FUT8, нокаутные клетки CHO (см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); и WO2003/085107).
[0205] Дополнительно предложены варианты антител, содержащие бисектные олигосахариды, например, в которых разделение пополам биантенного олигосахарида, присоединенного к Fc-области антитела, осуществляется с помощью GlcNAc. Такие варианты антител могут характеризоваться пониженным фукозилированием и/или улучшенной функцией ADCC. Примеры таких вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet et al.); патенте США № 6602684 (Umana et al.); и US 2005/0123546 (Umana et al.). Также предложены варианты антител, содержащие по меньшей мере один остаток галактозы в олигосахариде, присоединенном к Fc-области. Такие варианты антител могут иметь улучшенную функцию CDC. Такие варианты антител описаны, например, в WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); и WO 1999/22764 (Raju, S.).
Варианты Fc-области
[0206] В некоторых вариантах реализации настоящего изобретения одну или более аминокислотных модификаций можно ввести в Fc-область антитела, предложенного в настоящем документе, с получением варианта Fc-области. Вариант Fc-области может содержать человеческую последовательность Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одном или более аминокислотных положений.
[0207] В некоторых вариантах реализации в настоящем изобретении предложен вариант антитела, который обладает некоторыми, но не всеми эффекторными функциями, делающими его желательным кандидатом для применений, в которых важное значение имеет период полураспада антитела in vivo, хотя отдельные эффекторные функции (такие как комплемент и ADCC) не являются необходимыми или являются вредными. Чтобы подтвердить уменьшение/истощение активности CDC и/или ADCC можно провести анализы цитотоксичности in vitro и/или in vivo. Например, с помощью анализа связывания рецептора Fc (FcR) можно подтвердить, что антитело не связывается с FcγR (следовательно, по всей вероятности, утрачивает активность ADCC), однако сохраняет способность связываться с FcRn. NK-клетки (первичные клетки, опосредующие ADCC) экспрессируют только FcλRIII, тогда как моноциты экспрессируют FcλRI, FcλRII и FcλRIII. Краткая информация об экспрессии FcR на гемопоэтических клетках приведена в таблице 3 на странице 464 публикации Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Не имеющие ограничительного характера примеры анализов in vitro, позволяющих оценить активность ADCC представляющей интерес молекулы, описаны в патенте США № 5500362 (см., например Hellstrom, I. et al. Proc. Nat'l Acad. Sci. USA 83:7059-7063 (1986)) и Hellstrom, I et al., Proc. Nat'l Acad. Sci. USA 82:1499-1502 (1985); 5821337 (см. Bruggemann, M. et al., J. Exp. Med. 166:1351-1361 (1987)). Альтернативно можно использовать нерадиоактивные способы анализов (см., например, нерадиоактивный анализ цитотоксичности способом проточной цитометрии ACTI™ (CellTechnology, Inc. Mountain View, CA); и нерадиоактивный анализ цитотоксичности CytoTox 96® (Promega, Madison, WI)). В качестве эффекторных клеток в таких анализах можно использовать мононуклеарные клетки периферической крови (PBMC) и клетки-натуральные киллеры (NK). Альтернативно или дополнительно, активность ADCC представляющей интерес молекулы можно определить in vivo, например, в животной модели, такой как, описанная в Clynes et al. Proc. Nat'l Acad. Sci. USA 95:652-656 (1998). Чтобы подтвердить, что антитело не способно связывать C1q и, следовательно, не обладает активностью CDC, можно провести анализы связывания C1q. См., например, анализ связывания C1q и C3c методом ELISA в WO 2006/029879 и WO 2005/100402. Активацию комплемента можно определить с помощью анализа CDC (см., например, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg, M.S. et al., Blood 101:1045-1052 (2003); и Cragg, M.S. and M.J. Glennie, Blood 103:2738-2743 (2004)). Анализ связывания FcRn и определение клиренса/периода полураспада in vivo можно проводить с помощью известных в данной области способов (см., например, Petkova, S.B. et al., Int'l. Immunol. 18(12):1759-1769 (2006)).
[0208] Антитела с пониженной эффекторной функцией включают антитела, содержащие замены одного или более из остатков Fc-области 238, 265, 269, 270, 297, 327 и 329 (патент США № 6737056). Такие Fc-мутанты включают Fc-мутанты, содержащие замены по двум или более из аминокислотных положений 265, 269, 270, 297 и 327, в том числе так называемый Fc-мутант DANA, содержащий замену остатков в положениях 265 и 297 на аланин (патент США № 7332581).
[0209] Описаны некоторые варианты антител, обладающие улучшенным или ухудшенным связыванием с FcR. (См., например, патент США № 6737056; WO 2004/056312 и Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).)
[0210] В некоторых вариантах реализации настоящего изобретения вариант антитела содержит Fc-область с одной или более аминокислотными заменами, приводящими к улучшению ADCC, например, заменами в положениях 298, 333 и/или 334 Fc-области (нумерация остатков по EU).
[0211] В некоторых вариантах реализации настоящего изобретения в Fc-области осуществляют изменения, которые приводят к изменению (т. е. к улучшению или ухудшению) связывания с C1q и/или комплемент-зависимой цитотоксичности (CDC), например, как описано в патенте США № 6194551, WO 99/51642 и Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
[0212] Антитела с повышенным периодом полураспада и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG плоду (Guyer et al., J. Immunol. 117:587 (1976) и Kim et al., J. Immunol. 24:249 (1994)), описаны в US2005/0014934A1 (Hinton et al.). Указанные антитела содержат Fc-область с одной или более заменами, приводящими к улучшению связывания Fc-области с FcRn. Такие Fc-варианты включают варианты, содержащие замены по одному или нескольким из следующих остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 Fc-области (патент США № 7371826). См. также Duncan & Winter, Nature 322:738-40 (1988); патент США № 5648260; патент США № 5624821; и WO 94/29351 описывающие другие примеры вариантов Fc-области.
Варианты антител, созданные путем введения цистеина
[0213] В некоторых вариантах реализации настоящего изобретения может быть желательно получать антитела, созданные путем введения цистеина, например, thioMAb, в которых один или более остатков антитела замещены остатками цистеина. В конкретных варианты реализации настоящего изобретения замещенные остатки находятся в доступных участках антитела. В результате замещения указанных остатков цистеином в доступных участках антитела располагаются реакционноспособные тиольные группы, которые можно использовать для конъюгирования антитела с другими фрагментами, такими как фрагменты лекарственных средств или фрагменты линкер-лекарственное средство, с получением иммуноконъюгата, как дополнительно описано в настоящем документе. В некоторых вариантах реализации настоящего изобретения цистеином можно заменить один или более из следующих остатков: V205 (нумерация Кабат) легкой цепи; A118 (нумерация EU) тяжелой цепи и S400 (нумерация EU) Fc-области тяжелой цепи. Антитела, созданные путем введения цистеина, могут быть получены как описано например в. патенте США № 7521541.
Производные антител
[0214] В некоторых вариантах реализации настоящего изобретения антитело, предлагаемое в настоящем документе, можно дополнительно модифицировать путем введения дополнительных небелковых фрагментов, известных в данной области и легко доступных. Фрагменты, которые можно использовать для дериватизации антитела, включают, но не ограничиваются перечисленным, водорастворимые полимеры. Не имеющие ограничительного характера примеры водорастворимых полимеров включают, но не ограничиваются перечисленным, полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлозу, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (в виде гомополимеров или статистических сополимеров), декстран или поли(н-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры полипропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Преимуществом пропионового альдегида полиэтиленгликоля в производстве является его стабильность в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Число полимеров, присоединенных к антителу, может изменяться, и, в случае присоединения более одного полимера, они могут представлять собой одинаковые или разные молекулы. Как правило, число и/или тип полимеров, используемых для дериватизации, можно определить с учетом факторов, включающих, но не ограничиваясь перечисленным, конкретные свойства или функции антитела, подлежащие улучшению, независимо от того, будет ли производное антитела использоваться в терапии при определенных условиях, и др.
[0215] В другом варианте реализации настоящего изобретения предложены конъюгаты антитела с небелковым фрагментом, который можно избирательно нагревать посредством облучения. В одном варианте реализации настоящего изобретения небелковый фрагмент представляет собой углеродную нанотрубку (Kam et al., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). Облучение может быть любой длины волны, включая, но не ограничиваясь перечисленным, длины волн, которые не приносят вреда обычным клеткам, но нагревают небелковый фрагмент до температуры, при которой клетки, находящиеся по соседству с небелковым фрагментом, погибают.
Рекомбинантные способы и композиции
[0216] Антитела можно получить с помощью рекомбинантных способов и композиций, например, описанных в патенте США № 4816567. В одном варианте реализации настоящего изобретения предложена выделенная нуклеиновая кислота, кодирующая антитело к Abeta, описанное в настоящем документе. Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В дополнительном варианте реализации настоящего изобретения предложен один или более векторов (например, векторы экспрессии), содержащих такую нуклеиновую кислоту. В дополнительном варианте реализации настоящего изобретения предложена клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном таком варианте реализации настоящего изобретения клетка-хозяин содержит (например, в результате трансформации): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном варианте реализации настоящего изобретения клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (CHO) или лимфоидную клетку (например, клетку Y0, NS0, Sp20). В одном варианте реализации настоящего изобретения предложен способ получения антитела к Abeta, причем указанный способ включает культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как описано выше, в условиях, подходящих для экспрессии антитела, и, необязательно, извлечение антитела из клетки-хозяина (или среды, в которой культивируют клетку-хозяина).
[0217] Для рекомбинантного получения антитела к Abeta, нуклеиновую кислоту, кодирующую антитело, например описанную выше, выделяют и вставляют в один или несколько векторов с целью последующего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту можно легко выделить и секвенировать с помощью традиционных способов (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелую и легкую цепи антитела).
[0218] Клетки-хозяева, подходящие для клонирования или экспрессии векторов, кодирующих антитело, включают прокариотические или эукариотические клетки, описанные в настоящем документе. Например, антитела можно получать в бактериях, в особенности, если гликозилирование и эффекторная функция Fc не являются необходимыми. Способы экспрессии фрагментов антител и полипептидов в бактериях можно найти, например, в патентах США №№ 5648237, 5789199 и 5840523. (См. также Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, описывающих экспрессию фрагментов антител в E. coli). После экспрессии антитело можно перевести из массы бактериальных клеток в растворимую фракцию, после чего дополнительно очистить.
[0219] Помимо прокариотов в качестве хозяев, подходящих для клонирования или экспрессии векторов, кодирующих антитело, можно использовать эукариотические микроорганизмы, такие как гифомицеты или дрожжи, включающие штаммы грибков и дрожжей с «гуманизированными» путями гликозилирования, которые позволяют получать антитело с частично или полностью человеческой моделью гликозилирования. См. Gerngross, Nat. Biotech. 22:1409-1414 (2004) и Li et al., Nat. Biotech. 24:210-215 (2006).
[0220] Клетки-хозяева, подходящие для экспрессии гликозилированного антитела, также можно получить из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Идентифицированы многочисленные бакуловирусные штаммы, которые можно использовать в сочетании с клетками насекомых, в частности, для трансфекции клеток Spodoptera frugiperda.
[0221] В качестве хозяев также можно использовать культуры растительных клеток. См., например, патенты США №№ 5959177, 6040498, 6420548, 7125978 и 6417429 (описывающие технологию PLANTIBODIESTM для получения антител в трансгенных растениях).
[0222] В качестве хозяев также можно использовать клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, адаптированные для роста в суспензии. Другие примеры подходящих, полученных из млекопитающих, линий клеток-хозяев включают линию клеток почки мартышки CV1 трансформированных посредством SV40 (COS-7); линию клеток почки эмбриона человека (293 или клетки 293, описанные, например, в Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки детеныша хомячка (BHK); мышиные клетки Сертоли (клетки TM4, описанные, например, в Mather, Biol. Reprod. 23:243-251 (1980)); клетки почки мартышки (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени крысы линии Buffalo (BRL 3A); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (MMT 060562); клетки TRI, описанные, например, в Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982); клетки MRC 5 и клетки FS4. Другие подходящие, полученные из млекопитающих, линии клеток-хозяев включают клетки яичника китайского хомячка (CHO), в том числе клетки DHFR- CHO (Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)); и миеломные клеточные линии, такие как Y0, NS0 и Sp2/0. Обзор по некоторым полученным из млекопитающих линиям клеток-хозяев, подходящих для получения антител, можно найти, например, в Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003).
Анализы
[0223] Антитела к Abeta, предложенные в настоящем документе, можно идентифицировать, подвергнуть скринингу или охарактеризовать по их физическим/химическим свойствам и/или видам биологической активности с помощью разных анализов, известных в данной области.
Анализы связывания и другие анализы
[0224] В одном аспекте антитело по настоящему изобретению исследуют на антиген-связывающую активность, например, с помощью известных способов, таких как ELISA, вестерн-блоттинг и т. п.
[0225] В другом аспекте можно использовать конкурентные анализы для идентификации антитела, способного конкурировать с антителом к Abeta по настоящему изобретению за связывание с Abeta. В некоторых вариантах реализации настоящего изобретения такое конкурентное антитело связывается с тем же эпитопом (таким как, например, линейный или конформационный эпитоп), с которым связывается кренезумаб или другое антитело к Abeta, описанное в настоящем документе. Подробное описание иллюстративных способов картирования эпитопа, с которым связывается антитело, можно найти в Morris (1996) Epitope Mapping Protocols in Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ).
[0226] В иллюстративном конкурентном анализе иммобилизованный Abeta в желаемой форме (например, мономерной, олигомерной или фибриллярной) инкубируют в растворе, содержащем первое меченое антитело, которое связывается с Abeta (например, кренезумаб), и второе немеченое антитело, подлежащее исследованию на способность конкурировать с первым антителом за связывание с Abeta. Второе антитело может присутствовать в супернатанте гибридом. В качестве контроля иммобилизованный Abeta инкубируют в растворе, который содержит первое меченое антитело, но не содержит второе немеченое антитело. После инкубации в условиях, обеспечивающих связывание первого антитела с Abeta, удаляют избыток несвязанного антитела и измеряют количество метки, связанной с иммобилизованным Abeta. Если количество метки, связанной с иммобилизованным Abeta, в тестируемом образце значительно снижено по сравнению с контрольным образцом, это означает, что второе антитело конкурирует с первым антителом за связывание с Abeta. См. Harlow and Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
Анализы активности
[0227] В одном аспекте предлагаются анализы для идентификации антител к Abeta, обладающих биологической активностью, например биологической активностью кренезумаба. Биологическая активность может включать, но не ограничивается перечисленным, например, предотвращение агрегации мономерного Abeta в олигомерный Abeta или дезинтеграции олигомерного Abeta в мономерный Abeta. Также предложены антитела, обладающие такой биологической активностью in vivo и/или in vitro.
[0228] В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению исследуют на такую биологическую активность.
Способы и композиции для диагностики и детекции
[0229] В некоторых вариантах реализации настоящего изобретения любое из предлагаемых в настоящем описании антител к Abeta можно использовать для детекции присутствия Abeta в биологическом образце. В контексте настоящего документа термин «детекция» охватывает количественную или качественную детекцию. В некоторых вариантах реализации настоящего изобретения биологический образец содержит клетку или ткань, такую как сыворотка, плазма, носовые мазки, мокрота, спинномозговая жидкость, водянистая влага глаза и т. п., или образцы тканей или клеток получают из организма, например образцы, содержащие нервную ткань или ткань головного мозга.
[0230] В одном варианте реализации настоящего изобретения предложено антитело к Abeta для применения в способе диагностики или детекции. В дополнительном аспекте предложен способ детекции присутствия Abeta в биологическом образце. В некоторых вариантах реализации настоящего изобретения способ включает приведение в контакт биологического образца с антителом к Abeta, как описано в настоящем документе, в условиях, обеспечивающих связывание антитела к Abeta с Abeta, и детекцию образования комплекса антитела к Abeta с Abeta. Такой способ можно проводить in vitro или in vivo.
[0231] Иллюстративные нарушения, которые могут быть диагностированы с помощью антитела по настоящему изобретению, представляют собой заболевания и нарушения, вызванные или связанные с амилоидными или амилоидоподобными белками. Они включают, но не ограничиваются перечисленным, заболевания и нарушения, вызванные наличием или активностью амилоидоподобных белков в мономерном, фибриллярном или полимерном состоянии, или в любой комбинации из этих трех состояний, включая посредством амилоидных бляшек. Иллюстративные заболевания включают, но не ограничиваются перечисленным, вторичный амилоидоз и связанный с возрастом амилоидоз, например заболевания, которые включают, но не ограничиваются перечисленным, неврологические расстройства, такие как болезнь Альцгеймера (БА), заболевания или состояния, характеризующиеся утратой способности когнитивной памяти, такие как, например, легкое когнитивное нарушение (ЛКН), деменция с тельцами Леви, синдром Дауна, наследственное мозговое кровоизлияние с амилоидозом (голландского типа), комплекс болезни острова Гуам с паркинсонизмом и деменцией и другие заболевания, которые основаны на амилоидоподобных белках или связаны с ними, такие как прогрессирующий надъядерный паралич, рассеянный склероз, болезнь Крейцфельда - Якоба, болезнь Паркинсона, связанная с ВИЧ деменция, БАС (боковой амиотрофический склероз), миозит с тельцами включения (МТВ), сахарный диабет с началом во взрослом возрасте, эндокринные опухоли и старческий амилоидоз сердца, а также различные глазные заболевания, включая дегенерацию желтого пятна, оптическую нейропатию, связанную с друзами, глаукому и катаракту вследствие отложения бета-амилоида.
[0232] В некоторых вариантах реализации настоящего изобретения предлагаются меченые антитела к Abeta. Метки включают, но не ограничиваются перечисленным, метки или фрагменты, которые можно детектировать непосредственно (такие как флуоресцентные, хромофорные, электроноплотные, хемилюминесцентные и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые можно детектировать косвенно, например, как результат ферментативной реакции или молекулярного взаимодействия. Иллюстративные метки включают, но не ограничиваются перечисленным, радиоизотопы 32P, 14C, 125I, 3H и 131I, флуорофоры, такие как редкоземельные хелаты или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люцифераза светлячка и бактериальная люцифераза (описана в патенте США № 4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (HRP), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизозим, сахаридоксидазы, например, глюкооксидаза, галактооксидаза и глюкоза-6-фосфат дегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, присоединенные к ферменту, который использует пероксид водорода для окисления предшественника красителя, такому как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, бактериофаговые метки, стабильные свободные радикалы и т. п.
Фармацевтические препараты
[0233] Фармацевтические препараты, содержащие антитело к Abeta, описанные в настоящем документе получают путем смешивания такого антитела или молекулы, имеющих желательную степень чистоты, с одним или более необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в виде лиофилизированных препаратов или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают, но не ограничиваются перечисленным: буферы, например, на основе фосфорной, лимонной и других органических кислот; антиоксиданты, включающие аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид; бензетония хлорид; феноловый, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включающие глюкозу, маннозу или декстрины; хелатирующие средства, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например комплексы Zn-белок); и/или неионные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Примеры фармацевтически приемлемых носителей в настоящем описании дополнительно включают средства, обеспечивающие внутритканевое распределение лекарственных средств, такие как растворимые нейтрально-активные гликобелки, содержащие гиалуронидазу (sHASEGP), например, растворимые гликобелки PH-20 человека, содержащие гиалуронидазу, такие как rHuPH20 (HYLENEX®, Baxter International, Inc.). Некоторые примеры sHASEGP и способы их применения, включая rHuPH20, описаны в патентных публикациях США №№. 2005/0260186 и 2006/0104968. В одном аспекте sHASEGP объединяют с одной или более дополнительными глюкозаминогликаназами, такими как хондроитиназы.
[0234] В одном варианте реализации настоящего изобретения антитело по настоящему изобретению может быть введено в состав с аргининовым буфером. В одном аспекте аргининовый буфер может представлять собой буфер аргининсукцината. В одном таком аспекте концентрация буфера аргининсукцината может составлять 50 мМ или больше. В другом таком аспекте концентрация буфера аргининсукцината может составлять 100 мМ или больше. В другом таком аспекте концентрация буфера аргининсукцината может составлять 150 мМ или больше. В другом таком аспекте концентрация буфера аргининсукцината может составлять 200 мМ или больше. В другом аспекте препарат с аргининовым буфером может дополнительно содержать поверхностно-активное вещество. В другом таком аспекте поверхностно-активное вещество представляет собой полисорбат. В другом таком аспекте полисорбат представляет собой полисорбат 20. В другом таком аспекте концентрация полисорбата 20 в препарате составляет 0,1% или меньше. В другом таком аспекте концентрация полисорбата 20 в препарате составляет 0,05% или меньше. В другом аспекте pH препарата с аргининовым буфером находится в диапазоне от 4,5 до 7,0. В другом аспекте pH препарата с аргининовым буфером находится в диапазоне от 5,0 до 6,5. В другом аспекте pH препарата с аргининовым буфером находится в диапазоне от 5,0 до 6,0. В другом аспекте pH препарата с аргининовым буфером составляет 5,5. В любом из вышеописанных вариантов реализации и аспектов настоящего изобретения антитело по настоящему изобретению может представлять собой кренезумаб.
[0235] Примеры лиофилизированных препаратов антител описаны в патенте США № 6267958. Водные препараты антител включают те, что описаны в патенте США № 6171586 и WO2006/044908, причем последние препараты содержат гистидин-ацетатный буфер.
[0236] Предложенный в настоящем документе препарат также может содержать более одного активного ингредиента, если это необходимо для конкретного показания для лечения, предпочтительно активности таких ингредиентов дополняют друг друга и не оказывают неблагоприятного влияния друг на друга. Например, может быть желательно обеспечить одно или более соединений для предотвращения или лечения болезни Альцгеймера. Соответственно, такие активные ингредиенты присутствуют в комбинации в количествах, эффективных для предполагаемой цели.
[0237] Активные ингредиенты можно заключать в микрокапсулы, полученные, например, с помощью методики коацервации или межфазной полимеризации, например такие как гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли-(метилметакрилатные) микрокапсулы, соответственно, в коллоидные системы доставки лекарственных средств (такие как липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики раскрыты в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
[0238] Можно изготовить препараты с замедленным высвобождением. Походящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие антитело, причем указанные матрицы находятся в форме формованных изделий, таких как, например, пленки или микрокапсулы.
[0239] Композиции, предназначенные для применения in vivo, обычно являются стерильными. Стерильности можно легко достичь, например, посредством фильтрации через стерильные фильтрационные мембраны.
Терапевтические способы и композиции
[0240] Как показано в настоящем документе, внутривенное введение кренезумаба снижает прогрессирование заболевания у пациентов, страдающих БА. В частности, у пациентов с БА от легкой до умеренной степени тяжести, включая пациентов с БА легкой степени тяжести и наличием ApoE4, а также у пациентов с амилоидной нагрузкой в головном мозге, которая, как правило, встречается у пациентов с диагнозом БА, при лечении кренезумабом наблюдается снижение скорости когнитивного ухудшения по сравнению с плацебо. Чем легче степень тяжести заболевания (на основании увеличения оценки по шкале MMSE), тем более выражено снижение ухудшения в группе лечения по сравнению с группой плацебо. Эти результаты были дополнительно подтверждены другими признаками целевого воздействия кренезумаба, включая увеличение уровней Abeta, обнаруживаемых в спинномозговой жидкости, и уменьшение накопления амилоида в головном мозге. Кроме того, сравнительно высокая доза антитела, составляющая 15 мг/кг, не увеличивает частоту возникновения неблагоприятных событий ARIA-типа, которые наблюдались в исследованиях других антител к Abeta.
[0241] Таким образом, в одном варианте реализации настоящего изобретения антитело по настоящему изобретению применяют для лечения БА, включая БА от легкой до умеренной степени тяжести, БА легкой степени тяжести и раннюю БА. В другом варианте реализации настоящего изобретения антитело по настоящему изобретению применяют для лечения амилоидоза. В одном таком варианте реализации настоящего изобретения амилоидоз представляет собой когнитивное нарушение легкой степени. В другом таком варианте реализации настоящего изобретения амилоидоз представляет собой синдром Дауна. В другом таком варианте реализации настоящего изобретения амилоидоз представляет собой наследственное мозговое кровоизлияние с амилоидозом (голландского типа). В другом таком варианте реализации настоящего изобретения амилоидоз представляет собой комплекс болезни острова Гуам с паркинсонизмом и деменцией. В другом таком варианте реализации настоящего изобретения амилоидоз представляет собой глазное заболевание, связанное с друзами или другим отложением амилоида в глазу. В одном аспекте глазное заболевание представляет собой дегенерацию желтого пятна. В другом аспекте глазное заболевание представляет собой оптическую нейропатию, связанную с друзами. В другом аспекте глазное заболевание представляет собой глаукому. В другом аспекте глазное заболевание представляет собой катаракту. В любом из вышеописанных вариантов реализации и аспектов настоящего изобретения антитело по настоящему изобретению может представлять собой кренезумаб.
[0242] Как правило, в первую очередь у пациента оценивают наличие одного или более типов амилоидоза, а потом определяют возможность лечения такого пациента антителом по настоящему изобретению. В одном, не имеющем ограничительного характера примере, диагноз БА может быть поставлен пациенту с использованием критериев NINCDS-ADRDA (Национальный институт неврологических и коммуникативных расстройств и инсульта - Ассоциация болезни Альцгеймера и связанных расстройств). См. McKhann, et al., 1984, Neurology 34:939-44. Пациент, которому потенциально можно вводить одно или более антител по настоящему изобретению, также может быть исследован на наличие или отсутствие одного или более генетических маркеров, которые могут предрасполагать такого пациента либо к (i) более высокой или более низкой вероятности возможности такого пациента испытывать один или более видов амилоидоза, либо к (ii) более высокой или более низкой вероятности возможности такого пациента испытывать один или более неблагоприятных событий или побочных эффектов в ходе лечения с введением антитела по настоящему изобретению. В одном, не имеющем ограничительного характера примере, известно, что пациенты-носители аллеля ApoE4 по сути имеют более высокий риск развития БА, чем те, у которых этот аллель отсутствует (Saunders et al., Neurology 1993; 43:1467-72; Prekumar et al., Am. J. Pathol. 1996; 148:2083-95), и что такие пациенты были непропорционально представлены в группе неблагоприятных событий типа ARIA, которые наблюдались в клиническом исследовании бапинейзумаба, другого антитела к Abeta (Sperling et al., Alzheimer's & Dementia 2011, 7:367-385; Salloway et al., N. Engl. J. Med. 2014, 370:322-333).
[0243] В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению применяют для лечения у пациента БА от легкой до умеренной степени тяжести. Пациент может быть с наличием ApoE4 или без наличия ApoE4. В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению применяют для лечения БА легкой степени тяжести. В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению применяют для лечения пациента с наличием ApoE4, страдающего БА от легкой до умеренной степени тяжести или БА легкой степени тяжести. В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению применяют для лечения пациента, страдающего БА легкой степени тяжести.
[0244] В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению применяют для лечения пациента с оценкой по шкале MMSE от 20 до 30, от 20 до 26, от 24 до 30, от 21 до 26, от 22 до 26, от 22 до 28, от 23 до 26, от 24 до 26 или от 25 до 26. В некоторых вариантах реализации настоящего изобретения пациент имеет оценку по шкале MMSE от 22 до 26. В контексте настоящего документа оценка по шкале MMSE в диапазоне между двумя числами включает числа на каждом конце диапазона. Например, оценка по шкале MMSE от 22 до 26 включает оценки MMSE 22 и 26.
[0245] В некоторых вариантах реализации настоящего изобретения антитела по настоящему изобретению применяют для лечения пациента с «наличием амилоида», например, пациента, имеющего отложения амилоида в головном мозге, который обычно представляет собой пациента с диагнозом БА или пациента с положительной визуализацией флорбетапира при ПЭТ. В некоторых вариантах реализации настоящего изобретения антитела по настоящему изобретению применяют для уменьшения накопления и отложения в головном мозге амилоида или нейритных бляшек (т. е. для уменьшения увеличения нагрузки или тяжести амилоида в головном мозге).
[0246] Кроме того, антитела по настоящему изобретению применяют для лечения БА от легкой до умеренной степени тяжести без увеличения частоты возникновения ARIA-E или ARIA-H. В некоторых вариантах реализации настоящего изобретения пациенты страдают БА легкой степени тяжести. В некоторых вариантах реализации настоящего изобретения пациенты являются ApoE4-положительными. В некоторых вариантах реализации настоящего изобретения пациенты являются ApoE4-положительными и страдают БА легкой степени тяжести.
[0247] Как видно из приведенных в настоящем документе примеров, терапевтический эффект увеличивается у пациентов с более легкими формами БА. Поэтому в некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению применяют для лечения пациента с ранней БА. В некоторых вариантах реализации настоящего изобретения пациент, которого лечат, имеет одну или более из следующих характеристик: (a) легкое когнитивное нарушение (ЛКН) из-за БА; (b) наличие одного или более биомаркеров, указывающих на болезнь Альцгеймера без клинически обнаруживаемого дефицита; (c) объективная потеря памяти, определяемая количественно с использованием теста свободного и ассоциированного селективного распознавания (FCSRT) как оценка 27 баллов или выше; оценка MMSE 24-30; (d) общая оценка по клинической рейтинговой шкале деменции (CDR) 0,5; и (e) наличие амилоида при проведении ПЭТ (при определении квалифицированным специалистом).
[0248] Антитела по настоящему изобретению можно включать в состав препарата, дозировать и вводить с помощью способов, согласующихся с надлежащей медицинской практикой. Факторы, учитываемые в данном контексте, включают конкретный вид нарушения, подлежащего лечению, конкретный вид млекопитающего, подлежащего лечению, клиническое состояние отдельного субъекта, причину расстройства, участок доставки средства, способ введения, схему введения и другие факторы, известные практикующим врачам.
Пути введения
[0249] Антитело по настоящему изобретению (и любое дополнительное терапевтическое средство) можно вводить любым подходящим способом, включающим парентеральное, внутрилегочное, интраназальное введение и, если это необходимо для местного лечения, введение в очаг повреждения. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Введение дозы лекарственного средства можно осуществлять любым подходящим путем, например, с помощью инъекций, таких как внутривенные или подкожные инъекции, что отчасти зависит от того, является ли введение кратковременным или длительным. В одном варианте реализации настоящего изобретения антитело вводят подкожно. В другом варианте реализации настоящего изобретения антитело вводят внутривенно. В другом варианте реализации настоящего изобретения антитело вводят с использованием шприца (например, заполненного предварительно или не заполненного предварительно) или автоинжектора. В другом варианте реализации настоящего изобретения антитело вводят посредством ингаляции.
Дозирование
[0250] Для лечения амилоидоза подходящая доза антитела по настоящему изобретению (используемого отдельно или в комбинации с одним или более другими дополнительными терапевтическими средствами) будет зависеть от типа заболевания, подлежащего лечению, типа антитела, тяжести и течения заболевания, предыдущей терапии, истории болезни пациента, чувствительности к антителу и предписания лечащего врача. Антитело подходит для введения пациенту однократно или в несколько приемов. В настоящем документе предусмотрены разные схемы введения лекарственных средств, включая, но не ограничиваясь перечисленным, однократное или многократное введение в течение разных периодов времени, болюсное введение и импульсную инфузию.
[0251] В зависимости от типа и тяжести заболевания, в качестве исходной подходящей дозы пациенту можно вводить от около 0,3 мг/кг до 100 мг/кг (например, от 15 мг/кг до 100 мг/кг или любую дозу в пределах этого диапазона), например, за одно или более отдельных введений или путем непрерывной инфузии. Типичная суточная доза может варьировать от около 15 мг/кг до 100 мг/кг или более, в зависимости от указанных выше факторов. Дозу можно вводить в виде однократной дозы или в виде разделенной дозы (например, две дозы по 15 мг/кг для достижения общей дозы 30 мг/кг). В случае многократного введения в течение нескольких недель или дольше, в зависимости от состояния, лечение, как правило, проводят до достижения желательной степени подавления симптомов заболевания. Одна иллюстративная доза антитела будет находиться в диапазоне от около 10 мг/кг до около 50 мг/кг. Таким образом, пациенту можно вводить одну или более доз, составляющих около 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2,0 мг/кг, 3 мг/кг, 4,0 мг/кг, 5 мг/кг, 10 мг/кг, 15 мг/кг, 20 мг/кг, 25 мг/кг, 30 мг/кг, 35 мг/кг, 40 мг/кг, 50 мг/к, 60 мг/к, 70 мг/кг, 80 мг/кг, 90 мг/кг или 100 мг/кг (или любую их комбинацию). В некоторых вариантах реализации настоящего изобретения общая доза, которую вводят, находится в диапазоне от 50 мг до 2500 мг. Пациенту можно вводить дозу, примеры которой составляю 50 мг, около 100 мг, 200 мг, 300 мг, 400 мг, около 500 мг, около 600 мг, около 700 мг, около 720 мг, около 1000 мг, около 1050 мг, около 1100 мг, около 1200 мг, около 1300 мг, около 1400 мг, около 1500 мг, около 1600 мг, около 1700 мг, около 1800 мг, около 1900 мг, около 2000 мг, около 2050 мг, около 2100 мг, около 2200 мг, около 2300 мг, около 2400 мг или около 2500 мг (или любую их комбинацию). Такие дозы можно вводить через определенные интервалы времени, например, каждую неделю, каждые две недели, каждые три недели, каждые четыре недели, каждый месяц, каждые два месяца, каждые три месяца или каждые шесть месяцев. В некоторых вариантах реализации настоящего изобретения пациент получает от одной до тридцати пяти доз антитела (например около восемнадцати доз антитела). Однако можно использовать и другие схемы введения доз. Результаты данной терапии можно легко отслеживать с помощью традиционных способов и анализов.
[0252] В некоторых вариантах реализации настоящего изобретения антитело по настоящему изобретению вводят в дозе 15 мг/кг, 30 мг/кг, 40 мг/кг, 45 мг/кг, 50 мг/кг, 60 мг/кг или, например, в фиксированной дозе 300 мг, 500 мг, 700 мг, 800 мг или выше. В некоторых вариантах реализации настоящего изобретения дозу вводят путем внутривенной инъекции каждые 2 недели или каждые 4 недели в течение определенного периода времени. В некоторых вариантах реализации настоящего изобретения дозу вводят путем подкожной инъекции каждые 2 недели или каждые 4 недели в течение определенного периода времени. В некоторых вариантах реализации настоящего изобретения этот период времени составляет 6 месяцев, один год, восемнадцать месяцев, два года, пять лет, десять лет, 15 лет, 20 лет или в течение всей жизни пациента.
Мониторинг/оценка реакции на терапевтическое лечение
[0253] Используемое в способах по настоящему изобретению антитело или его антиген-связывающий фрагмент, обеспечивает терапевтический эффект или преимущество для пациента. В некоторых вариантах реализации настоящего изобретения терапевтическое преимущество представляет собой задержку или ингибирование прогрессирования БА или уменьшение клинического, функционального или когнитивного ухудшения. В некоторых вариантах реализации настоящего изобретения терапевтический эффект или преимущество отражается в «ответе пациента» или «ответе» (и грамматических вариантах этого термина). Ответ пациента можно оценить с использованием любой конечной точки, указывающей на преимущества для пациента, включая, без ограничения, (1) ингибирование до определенной степени прогрессирования заболевания, включая замедление и полное прекращение; (2) уменьшение числа бляшек или уменьшение накопления амилоида в головном мозге; (3) улучшение одной или более измерительной оценки, включая, но не ограничиваясь перечисленным, оценки по шкалам ADAS-Cog, iADL и CDR-SOB; (4) улучшение ежедневного функционирования пациента; (5) увеличение концентрации одного или более биомаркеров, например, Abeta, в спинномозговой жидкости; и (6) снижение концентрации одного или более биомаркеров, свидетельствующих о наличии БА. Оценка ответа пациента может также включать оценку любых возможных неблагоприятных событий, которые могут быть связаны с лечением.
[0254] В одном варианте реализации настоящего изобретения когнитивная способность и ежедневное функционирование пациента оценивают перед, во время и/или после курса терапии с применением антитела по настоящему изобретению. Для использования в определении, диагностике и оценке психической функции, когнитивной способности и неврологического дефицита был разработан ряд когнитивных и функциональных инструментов оценки. Эти инструменты включают, но не ограничиваются перечисленным, шкалы ADAS-Cog, включая ADAS-Cog с 12 предметами (ADAS-Cog12), ADAS-Cog с 13 предметами (ADAS-Cog13), ADAS-Cog с 14 предметами (ADAS-Cog14); CDR-SOB, включая компонент CDR «Рассудительность и решение проблем» и компонент CDR «Память»; шкалу инструментальной активности в повседневной жизни (iADL); и MMSE.
[0255] ADAS-Cog относится к подшкале когнитивной оценки, состоящей из нескольких частей, шкалы оценки когнитивной функции при болезни Альцгеймера. См. Rosen et al., 1984, Amer. J. Psych. 141:1356-1364; Mohs et al., 1997, Alzheimer's Disease Assoc. Disorders 11(2):S13-S21. Чем выше балльная оценка по шкале ADAS-Cog, тем больше у обследованного пациента дефицит или ухудшение по сравнению с другим индивидуумом с более низкой оценкой. Шкалу ADAS-Cog можно использовать в качестве одного из показателей для оценки того, является ли лечение БА терапевтически эффективным. Увеличение оценки по шкале ADAS-Cog свидетельствует об ухудшении состояния пациента, в то время как снижение оценки по шкале ADAS-Cog означает улучшение состояния пациента. В контексте настоящего документа выражение «ухудшение показателей ADAS-Cog» или «увеличение оценки ADAS-Cog» указывает на ухудшение состояния пациента и может отражать прогрессирование БА. ADAS-Cog является проводимой экзаменатором группой исследований, которая оценивает множество когнитивных доменов, включая память, понимание, практические действия, ориентацию и спонтанную речь (Rosen et al. 1984, Am J Psychiatr 141:1356-64; Mohs et al. 1997, Alzheimer Dis Assoc Disord 11(S2):S13-S21). Шкала ADAS-Cog является стандартной первичной конечной точкой в исследованиях лечения БА (Mani 2004, Stat Med 23:305-14). Шкала ADAS-Cog 12 является версией из 70 пунктов шкалы ADAS-Cog с 10 пунктами шкалы отсроченного воспроизведения слов-названий предметов, оценивающей воспроизведение списка выученных слов. Другие шкалы ADAS-Cog включают ADAS-Cog13 и ADAS-Cog14.
[0256] В некоторых вариантах реализации настоящего изобретения предложенные в настоящем документе способы лечения обеспечивают уменьшение когнитивного ухудшения по результатам оценивания по шкале ADAS-Cog по меньшей мере на около 30%, по меньшей мере на около 35%, по меньшей мере на около 40% или по меньшей мере на около 45% по сравнению с группой, получающей плацебо.
[0257] MMSE относится к краткой шкале оценки психического статуса, оценка по которой находится в диапазоне от 1 до 30. См. Folstein, et al., 1975, J. Psychiatr. Res. 12:189-98. Оценки 26 и ниже, как правило, считаются признаком дефицита. Чем ниже балльная оценка по шкале MMSE, тем больше у обследованного пациента дефицит или ухудшение по сравнению с другим индивидуумом с более низкой оценкой. Увеличение оценки по шкале MMSE свидетельствует об улучшении состояния пациента, в то время как снижение оценки по шкале MMSE может означать ухудшение состояния пациента.
[0258] CDR-SOB относится к клинической рейтинговой шкале деменции/суммы боксированных баллов. См. Hughes et al, 1982. Шкала CDR оценивает 6 компонентов: память, ориентацию, рассудительность/решение проблем, участие в общественной жизни, дом и хобби, и соблюдение личной гигиены. Тест проводят у пациента и ухаживающего за ним лица, и каждый компонент (или каждый «бокс») оценивают по шкале от 0 до 3. Полная оценка по шкале CDR-SOB основана на сумме баллов по всем 6 боксам. Оценки могут быть также подсчитаны для каждого из боксов или компонентов по отдельности, например, CDR/память или CDR/рассудительность и решение проблем. В контексте настоящего документа выражение «ухудшение показателей CDR-SOB» или «увеличение оценки CDR-SOB» указывает на ухудшение состояния пациента и может отражать прогрессирование БА. В некоторых вариантах реализации настоящего изобретения предложенные в настоящем документе способы лечения обеспечивают уменьшение ухудшения показателей по шкале CDR-SOB по меньшей мере на около 30%, по меньшей мере на около 35% или по меньшей мере на около 40% по сравнению с группой, получающей плацебо.
[0259] iADL относится к шкале инструментальной активности в повседневной жизни. См. Lawton, M.P., and Brody, E.M., 1969, Gerontologist 9:179-186. Эта шкала измеряет способность выполнять типичные ежедневные действия, такие как уборка дома, стирка, эксплуатация телефона, совершение покупок, приготовление пищи и т. д. Чем ниже оценка, тем большее ухудшение наблюдается у индивидуума при выполнении видов деятельности в повседневной жизни. В некоторых вариантах реализации настоящего изобретения предложенные в настоящем документе способы лечения обеспечивают уменьшение ухудшения оценки по шкале iADL по меньшей мере на около 10%, по меньшей мере на около 15% или по меньшей мере на около 20% по сравнению с группой, получающей плацебо.
[0260] Нагрузку или тяжесть амилоида в головном мозге можно определить с использованием неврологических методик и инструментов визуализации, например, с использованием сканирования ПЭТ (позитронно-эмиссионная томография). Ряд снимков ПЭТ пациента, полученные с течением времени, например, перед и после проведения лечения (или через один или более временных интервалов в ходе выполнения назначенной схемы лечения), может позволить выявить увеличение, уменьшение или отсутствие изменений в отношении амилоида в головном мозге. Этот способ можно дополнительно использовать для определения того, что происходит с накоплением амилоида: увеличение или уменьшение. В некоторых вариантах реализации настоящего изобретения обнаружение отложений амилоида в головном мозге осуществляется с использованием флорбетапира 18F. В некоторых вариантах реализации настоящего изобретения ПЭТ с использованием флорбетапира считается положительным, если на основании централизованного визуального считывания снимка устанавливается наличие от умеренных до частых невритических бляшек.
Совместное введение
[0261] Хотя и нет такой необходимости, но антитело может быть введено в препарат вместе с одним или более средствами, используемыми в настоящее время для предотвращения или лечения рассматриваемого расстройства или одного или более из его симптомов. Эффективное количество таких других средств зависит от количества присутствующего в препарате антитела, типа расстройства или лечения и других факторов, описанных выше. Их, как правило, используют в тех же дозах и вводят теми же способами, которые описаны в настоящем документе, или в дозе от около 1 до 99% от дозы, описанной в настоящем документе, или в любой дозе и любым способом, который эмпирически/клинически определен как подходящий. Обычному специалисту в данной области будет понятно, что совместное введение антитела по настоящему изобретению можно осуществлять и одновременно с любым из указанных выше соединений, или его можно вводить до или после введения любого из вышеуказанных соединений.
[0262] При лечении амилоидоза антителом по настоящему изобретению можно совместно с ним вводить неврологическое лекарственное средство. Такое неврологическое лекарственное средство можно выбрать из группы, которая включает, но не ограничивается перечисленным, антитело или другую связывающую молекулу (включая, но не ограничиваясь перечисленным, малую молекулу, пептид, аптамер или другую молекулу, которая связывается с белком), которая специфически связывается с мишенью, выбранной из: бета-секретазы, тау-белка, пресенилина, белка-предшественника амилоида или их участков, пептида бета-амилоида или его олигомеров или фибрилл, рецептора смерти 6 (DR6), рецептора продуктов конечного гликирования (RAGE), генов паркина и хантингтина; ингибитора холинэстеразы (т. е., галантамина, донепезила, ривастигмина и такрина); агониста рецептора NMDA (т. е., мемантина), средства, истощающего запасы моноаминов (т. е., тетрабеназина); эрголоида мезилата; противопаркинсонического антихолинергического средства (т. е., проциклидина, дифенгидрамина, тригексилфенидила, бензтропина, биперидена и тригексифенидила); противопаркинсонического допаминергического средства (т. е., энтакапона, селегилина, прамипексола, бромокриптина, ротиготина, селегилина, ропинирола, разагилина, апоморфина, карбидопы, леводопы, перголида, толкапона и амантадина); тетрабеназина; противовоспалительных средств (включая, но не ограничиваясь перечисленным, нестероидное противовоспалительное лекарственное средство (т. е., индометацин и другие соединения, перечисленные выше); гормона (т. е., эстрогена, прогестерона и лейпролида); витамина (т. е., фолата и никотинамида); димеболина; гомотаурина (т. е., 3-аминопропансульфокислоты; 3APS); модулятора активности серотониновых рецепторов (т. е., ксалипродена); интерферона и глюкокортикоида или кортикостероида. В некоторых вариантах реализации настоящего изобретения совместно вводят одно или более антител к Abeta, отличное от кренезумаба. Не имеющие ограничительного характера примеры таких антител к Abeta включают соланезумаб, бапинейзумаб, адуканумаб и гантенерумаб. Термин «кортикостероид» включает, но не ограничивается перечисленным, флутиказон (включая флутиказона пропионат (ФП)), беклометазон, будезонид, циклезонид, мометазон, флунизолид, бетаметазон и триамцинолон. «Ингаляционный кортикостероид» означает кортикостероид, который пригоден для доставки посредством ингаляции. Примерами ингаляционных кортикостероидов являются флутиказон, беклометазон дипропионат, буденозид, мометазона фуроат, циклезонид, флунизолид и триамцинолона ацетонид.
[0263] При лечении антителом по настоящему изобретению амилоидоза, представляющего собой глазное заболевание или нарушение, может быть выбрано неврологическое лекарственное средство, которое является антиангиогенным офтальмологическим средством (т. е., бевацизумаб, ранибизумаба и пегаптаниб), офтальмологическим средством для лечения глаукомы (т. е., карбахол, эпинефрин, демекария бромид, апраклонидин, бримонидин, бринзоламид, левобунолол, тимолол, бетаксолол, дорзоламид, биматопрост, картеолол, метипранолол, дипивефрин, травопрост и латанопрост), ингибитором карбоангидразы (т. е., метазоламид и ацетазоламид), офтальмологическим антигистаминным средством (т. е., нафазолин, фенилэфрин и тетрагидрозолин), глазной смазкой, офтальмологическим стероидом (т. е., фторметолон, преднизолон, лотепреднол, дексаметазон, дифлупреднат, римексолон, флуоцинолон, медризон и триамцинолон), офтальмологическим анестезирующим средством (т. е., лидокаин, пропаракаин и тетракаин), офтальмологическим противоинфекционным средством (т. е., левофлоксацин, гатифлоксацин, ципрофлоксацин, моксифлоксацин, хлорамфеникол, бацитрацин/полимиксин В, сульфацетамид, тобрамицин, азитромицин, безифлоксацин, норфлоксацин, сульфисоксазол, гентамицин, идоксуридин, эритромицин, натамицин, грамицидин, неомицин, офлоксацин, трифлуридин, ганцикловир, видарабин), офтальмологическим противовоспалительным средством (т. е., непафенак, кеторолак, флурбипрофен, супрофен, циклоспорин, триамцинолон, диклофенак и бромфенак) и офтальмологического антигистаминного или противозастойного средства (т. е., кетотифен, олопатадин, эпинастин, нафазолин, кромолин, тетрагидрозолин, пемироласт, бепотастин, нафазолин, фенилэфрин, недокромил, лодоксамид, фенилэфрин, эмедастин и азеластин). Следует понимать, что любой из указанных выше препаратов или терапевтических способов может быть осуществлен с использованием иммуноконъюгата по изобретению вместо антитела к Abeta или в дополнение к нему.
Изделия
[0264] В другом аспекте настоящего изобретения предложено изделие, содержащие материалы, используемые для лечения, предупреждения и/или диагностики описанных выше нарушений. Изделие содержит контейнер и связанную с контейнером или находящуюся на нем этикетку или вкладыш в упаковку. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы, пакеты для растворов для внутривенного введения и т. д. Контейнер может быть образован из множества материалов, таких как стекло или пластмасса. В контейнере содержится композиция, которая сама по себе или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностики патологического состояния, и может иметь стерильное отверстие доступа (например, контейнер может представлять собой пакет или флакон с раствором для внутривенного введения, имеющий пробку, выполненную с возможностью прокалывания иглой для подкожных инъекций). По меньшей мере одно активное средство в композиции является антителом по настоящему изобретению. На этикетке или на вкладыше в упаковку указано, что композиция используется для лечения состояния выбора. Кроме того, изделие может содержать (a) первый контейнер с содержащейся в нем композицией, причем композиция содержит антитело по настоящему изобретению; и (b) второй контейнер с содержащейся в нем композицией, причем композиция включает дополнительное цитотоксическое или иное терапевтическое средство. Изделие в данном варианте реализации настоящего изобретения может дополнительно содержать вкладыш в упаковку, в котором указано, что композиции можно применять для лечения конкретного состояния. Альтернативно или дополнительно изделие может также содержать второй (или третий) контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Изделие может включать другие материалы, целесообразные с точки зрения производителя или потребителя, включая другие буферы, разбавители, фильтры, иглы и шприцы.
[0265] Следует понимать, что любое из указанных выше изделий вместо антитела к Abeta или в дополнение к нему может включать иммуноконъюгат по настоящему изобретению.
ИЛЛЮСТРАТИВНЫЕ ВАРИАНТЫ РЕАЛИЗАЦИИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0266] В настоящем документе для иллюстрации предложены примеры вариантов реализации настоящего изобретения.
1. Способ уменьшения ухудшения функциональной или когнитивной способности у пациента с диагнозом ранней болезни Альцгеймера или болезни Альцгеймера (БА) от легкой до умеренной степени тяжести, включающий введение пациенту, страдающему ранней болезнью Альцгеймера или БА от легкой до умеренной степени тяжести, гуманизированного моноклонального антитела к бета-амилоиду (Aβ), которое связывается в пределах остатков 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, эффективном для замедления ухудшения функциональной или когнитивной способности у пациента.
2. Способ в соответствии с вариантом реализации настоящего изобретения 1, отличающийся тем, что антитело способно связываться с олигомерными и мономерными формами β-амилоида.
3. Способ по п. 1, отличающийся тем, что антитело представляет собой антитело IgG4.
4. Способ в соответствии с вариантом реализации настоящего изобретения 2 или 3, отличающийся тем, что антитело содержит шесть гипервариабельных участков (HVR), причем:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
5. Способ в соответствии с вариантом реализации настоящего изобретения 4, отличающийся тем, что антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
6. Способ в соответствии с вариантом реализации настоящего изобретения 5, отличающийся тем, что антитело представляет собой кренезумаб.
7. Способ в соответствии с любым предшествующим вариантом реализации настоящего изобретения, отличающийся тем, что ухудшение когнитивной способности оценивают посредством определения у пациента показателя перед и после введения указанного антитела с использованием тестирования по шкале оценки когнитивной функции при болезни Альцгеймера с 12 предметами (ADAS-Cog12), по шкале оценки когнитивной функции при болезни Альцгеймера с 13 предметами (ADAS-Cog13) или по шкале оценки когнитивной функции при болезни Альцгеймера с 14 предметами (ADAS-Cog12), причем необязательно уменьшение когнитивного ухудшения по результатам измерения по шкале ADAS-Cog составляет по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% по сравнению с группой, получающей плацебо.
8. Способ в соответствии с вариантом реализации настоящего изобретения 7, отличающийся тем, что пациент является ApoE4-положительным.
9. Способ в соответствии с вариантом реализации настоящего изобретения 7, отличающийся тем, что пациент страдает БА легкой степени тяжести.
10. Способ в соответствии с вариантом реализации настоящего изобретения 7, отличающийся тем, что пациент страдает ранней БА.
11. Способ в соответствии с любым из вариантов реализации настоящего изобретения 1-8, отличающийся тем, что оценка пациента по шкале MMSE перед началом лечения составляет по меньшей мере 20, от 20 до 30, от 20 до 26, от 24 до 30, от 21 до 26, от 22 до 26, от 22 до 28, от 23 до 26, от 24 до 26 или от 25 до 26 баллов.
12. Способ в соответствии с вариантом реализации настоящего изобретения 11, отличающийся тем, что оценка пациента по шкале MMSE составляет от 22 до 26 баллов.
13. Способ в соответствии с любым из предшествующих вариантов реализации настоящего изобретения, отличающийся тем, что антитело вводят в дозе 10 мг/кг-100 мг/кг массы тела пациента.
14. Способ в соответствии с вариантом реализации настоящего изобретения 13, отличающийся тем, что антитело вводят в дозе по меньшей мере 15 мг/кг.
15. Способ в соответствии с вариантом реализации настоящего изобретения 14, отличающийся тем, что антитело вводят в дозе 15 мг/кг, 30 мг/кг, 45 мг/кг, 50 мг/кг или 60 мг/кг.
16. Способ в соответствии с вариантом реализации настоящего изобретения 13 или 14, отличающийся тем, что антитело вводят посредством внутривенной инъекции.
17. Способ в соответствии с любым из вариантов реализации настоящего изобретения 13-16, отличающийся тем, что антитело вводят каждые 2 недели, каждые 4 недели, каждый месяц, каждые два месяца или каждые шесть месяцев.
18. Способ лечения ранней болезни Альцгеймера или БА от легкой до умеренной степени тяжести без повышения риска развития неблагоприятного события, включающий введение пациенту с диагнозом ранней болезни Альцгеймера или БА от легкой до умеренной степени тяжести гуманизированного моноклонального антитела к Aβ, которое связывается в пределах остатков 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, которое является эффективным для лечения БА без повышения риска развития возникшего в результате лечения неблагоприятного события, причем неблагоприятное событие выбирают из: (i) обнаруживаемой при визуализации патологии, связанной с отложением амилоида, в виде отека (ARIA-E) и (ii) обнаруживаемой при визуализации патологии, связанной с отложением амилоида, в виде кровоизлияния (ARIA-H).
19. Способ в соответствии с вариантом реализации настоящего изобретения 18, отличающийся тем, что антитело способно связываться с олигомерными и мономерными формами β-амилоида.
20. Способ в соответствии с вариантом реализации настоящего изобретения 18, отличающийся тем, что антитело представляет собой антитело IgG4.
21. Способ в соответствии с вариантом реализации настоящего изобретения 19, отличающийся тем, что антитело содержит шесть гипервариабельных участков (HVR), причем:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
22. Способ в соответствии с вариантом реализации настоящего изобретения 21, отличающийся тем, что антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
23. Способ в соответствии с вариантом реализации настоящего изобретения 22, отличающийся тем, что антитело представляет собой кренезумаб.
24. Способ в соответствии с любым из вариантов реализации настоящего изобретения 18-23, отличающийся тем, что пациент является ApoE4-положительным.
25. Способ в соответствии с любым из вариантов реализации настоящего изобретения 18-23, отличающийся тем, что неблагоприятное событие представляет собой ARIA-E.
26. Способ в соответствии с вариантом реализации настоящего изобретения 25, отличающийся тем, что при обнаружении возникшего в результате лечения ARIA-E, введение антитела прекращают и, необязательно, назначают лечение ARIA-E.
27. Способ в соответствии с вариантом реализации настоящего изобретения 26, дополнительно включающий возобновление введения указанного антитела после разрешения ARIA-E, отличающийся тем, что антитело вводят в более низкой дозе, чем до прекращения введения.
28. Способ в соответствии с вариантом реализации настоящего изобретения 18, отличающийся тем, что при обнаружении у пациента во время лечения указанным антителом одного или более новых ARIA-E, антитело больше не вводят и, необязательно, пациенту назначают введение кортикостероида.
29. Способ в соответствии с вариантом реализации настоящего изобретения 28, отличающийся тем, что пациент является ApoE4-положительным.
30. Способ уменьшения ухудшения функциональной или когнитивной способности у пациента с диагнозом ранней болезни Альцгеймера или болезни Альцгеймера (БА) от легкой до умеренной степени тяжести, включающий введение ApoE4-положительному пациенту, страдающему ранней болезнью Альцгеймера или БА от легкой до умеренной степени тяжести, гуманизированного моноклонального антитела к бета-амилоиду (Aβ), которое связывается в пределах остатков 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, эффективном для замедления ухудшения функциональной или когнитивной способности у пациента.
31. Способ в соответствии с вариантом реализации настоящего изобретения 30, отличающийся тем, что антитело способно связываться с олигомерными и мономерными формами β-амилоида.
32. Способ в соответствии с вариантом реализации настоящего изобретения 30, отличающийся тем, что антитело представляет собой антитело IgG4.
33. Способ в соответствии с вариантом реализации настоящего изобретения 31 или 32, отличающийся тем, что антитело содержит шесть гипервариабельных участков (HVR), причем:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
34. Способ в соответствии с вариантом реализации настоящего изобретения 33, отличающийся тем, что антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
35. Способ в соответствии с вариантом реализации настоящего изобретения 34, отличающийся тем, что антитело представляет собой кренезумаб.
36. Способ в соответствии с любым из вариантов реализации настоящего изобретения 30-35, отличающийся тем, что ухудшение когнитивной способности оценивают посредством определения у пациента показателя перед и после введения указанного антитела с использованием исследования по шкалам ADAS-Cog12, ADAS-Cog13 или ADAS-Cog14, причем необязательно уменьшение когнитивного ухудшения по результатам оценивания по шкале ADAS-Cog составляет по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% по сравнению с группой, получающей плацебо.
37. Способ в соответствии с вариантом реализации настоящего изобретения 36, отличающийся тем, что пациент имеет БА легкой степени тяжести.
38. Способ в соответствии с вариантом реализации настоящего изобретения 36, отличающийся тем, что пациент имеет раннюю БА.
39. Способ в соответствии с любым из вариантов реализации настоящего изобретения 30-37, отличающийся тем, что оценка пациента по шкале MMSE перед началом лечения составляет по меньшей мере 20, от 20 до 30, от 20 до 26, от 24 до 30, от 21 до 26, от 22 до 26, от 22 до 28, от 23 до 26, от 24 до 26 или от 25 до 26 баллов.
40. Способ в соответствии с вариантом реализации настоящего изобретения 39, отличающийся тем, что оценка пациента по шкале MMSE составляет от 22 до 26 баллов.
41. Способ в соответствии с любым из вариантов реализации настоящего изобретения 30-39, отличающийся тем, что антитело вводят в дозе 10 мг/кг-100 мг/кг массы тела пациента.
42. Способ в соответствии с вариантом реализации настоящего изобретения 41, отличающийся тем, что антитело вводят в дозе по меньшей мере 15 мг/кг.
43. Способ в соответствии с вариантом реализации настоящего изобретения 42, отличающийся тем, что антитело вводят в дозе 15 мг/кг, 30 мг/кг, 45 мг/кг, 50 мг/кг или 60 мг/кг.
44. Способ в соответствии с вариантом реализации настоящего изобретения 41 или 42, отличающийся тем, что антитело вводят посредством внутривенной инъекции.
45. Способ в соответствии с любым из вариантов реализации настоящего изобретения 41-44, отличающийся тем, что антитело вводят каждые 2 недели, каждые 4 недели, каждый месяц, каждые два месяца или каждые шесть месяцев.
46. Способ лечения ранней болезни Альцгеймера или БА от легкой до умеренной степени тяжести без повышения риска развития неблагоприятного события, включающий введение ApoE4-положительному пациенту с диагнозом ранней болезни Альцгеймера или БА от легкой до умеренной степени тяжести гуманизированного моноклонального антитела к Aβ, которое связывается в пределах остатков 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, которое является эффективным для лечения БА без повышения риска развития возникшего в результате лечения неблагоприятного события, причем неблагоприятное событие выбирают из: (i) обнаруживаемой при визуализации патологии, связанной с отложением амилоида, в виде отека (ARIA-E) и (ii) обнаруживаемой при визуализации патологии, связанной с отложением амилоида, в виде кровоизлияния (ARIA-H).
47. Способ в соответствии с вариантом реализации настоящего изобретения 46, отличающийся тем, что антитело способно связываться с олигомерными и мономерными формами β-амилоида.
48. Способ в соответствии с вариантом реализации настоящего изобретения 46, отличающийся тем, что антитело представляет собой антитело IgG4.
49. Способ в соответствии с вариантом реализации настоящего изобретения 47, отличающийся тем, что антитело содержит шесть гипервариабельных участков (HVR), причем:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
50. Способ в соответствии с вариантом реализации настоящего изобретения 49, отличающийся тем, что антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
51. Способ в соответствии с вариантом реализации настоящего изобретения 50, отличающийся тем, что антитело представляет собой кренезумаб.
52. Способ в соответствии с любым из вариантов реализации настоящего изобретения 46-51, отличающийся тем, что неблагоприятное событие представляет собой ARIA-E.
53. Способ в соответствии с вариантом реализации настоящего изобретения 52, отличающийся тем, что при обнаружении возникшего в результате лечения ARIA-E, введение антитела прекращают и, необязательно, назначают лечение ARIA-E.
54. Способ в соответствии с вариантом реализации настоящего изобретения 53, дополнительно включающий возобновление введения указанного антитела после разрешения ARIA-E, необязательно включающий возобновление введения указанного антитела в более низкой дозе, чем до прекращения введения.
55. Способ в соответствии с вариантом реализации настоящего изобретения 46, отличающийся тем, что при обнаружении у пациента во время лечения указанным антителом одного или более новых ARIA-E, антитело больше не вводят и, необязательно, пациенту назначают введение кортикостероида.
56. Способ в соответствии с любым из предшествующих вариантов реализации настоящего изобретения, отличающийся тем, что пациента одновременно лечат одним или более средствами, выбранными из группы, состоящей из: терапевтического средства, которое специфически связывается с мишенью; ингибитора холинэстеразы; антагониста рецептора NMDA; средства, истощающего запасы моноаминов; эрголоида мезилата; противопаркинсонического антихолинергического средства; противопаркинсонического допаминергического средства; тетрабеназина; противовоспалительного средства; гормона; витамина; димеболина; гомотаурина; модулятора активности серотониновых рецепторов; интерферона и глюкокортикоида; антитела к Abeta, отличное от кренезумаба; антибиотика; противовирусного средства.
57. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой ингибитор холинэстеразы.
58. Способ в соответствии с вариантом реализации настоящего изобретения 57, отличающийся тем, что ингибитор холинэстеразы выбирают из группы, состоящей из галантамина, донепезила, ривастигмина и такрина.
59. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой антагонист рецептора NMDA.
60. Способ в соответствии с вариантом реализации настоящего изобретения 59, отличающийся тем, что антагонист рецептора NMDA представляет собой мемантин или его соль.
61. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой терапевтическое средство, которое специфически связывается с мишенью, причем мишень выбирают из группы, состоящей из бета-секретазы, тау-белка, пресенилина, белка-предшественника амилоида или их участков, пептида бета-амилоида или его олигомеров или фибрилл, рецептора смерти 6 (DR6), рецептора продуктов конечного гликирования (RAGE), генов паркина и хантингтина.
62. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой средство, истощающее запасы моноаминов, необязательно, тетрабеназин.
63. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой противопаркинсоническое антихолинергическое средство, выбранное из группы, состоящей из проциклидина, дифенгидрамина, тригексилфенидила, бензтропина, биперидена и тригексифенидила.
64. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой противопаркинсоническое допаминергическое средство, выбранное из группы, состоящей из: энтакапона, селегилина, прамипексола, бромокриптина, ротиготина, селегилина, ропинирола, разагилина, апоморфина, карбидопы, леводопы, перголида, толкапона и амантадина.
65. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой противовоспалительное средство, выбранное из группы, состоящей из: нестероидного противовоспалительного лекарственного средства и индометацина.
66. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой гормон, выбранный из группы, состоящей из: эстрогена, прогестерона и лейпролида.
67. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой витамин, выбранный из группы, состоящей из: фолата и никотинамида.
68. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой гомотаурин, представляющий собой 3-аминопропансульфокислоту или 3APS.
69. Способ в соответствии с вариантом реализации настоящего изобретения 56, отличающийся тем, что средство представляет собой ксалипроден.
70. Способ замедления клинического ухудшения у пациента с диагнозом ранней болезни Альцгеймера или болезни Альцгеймера (БА) от легкой до умеренной степени тяжести, включающий введение пациенту, страдающему ранней болезнью Альцгеймера или БА от легкой до умеренной степени тяжести, гуманизированного моноклонального антитела к бета-амилоиду (Aβ), которое связывается в пределах остатков 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, эффективном для замедления ухудшения у пациента.
71. Способ в соответствии с вариантом реализации настоящего изобретения 70, отличающийся тем, что антитело способно связываться с олигомерными и мономерными формами β-амилоида.
72. Способ в соответствии с вариантом реализации настоящего изобретения 70, отличающийся тем, что антитело представляет собой антитело IgG4.
73. Способ в соответствии с вариантом реализации настоящего изобретения 71 или 72, отличающийся тем, что антитело содержит шесть гипервариабельных участков (HVR), причем:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
74. Способ в соответствии с вариантом реализации настоящего изобретения 73, отличающийся тем, что антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
75. Способ в соответствии с вариантом реализации настоящего изобретения 74, отличающийся тем, что антитело представляет собой кренезумаб.
76. Способ в соответствии с любым из вариантов реализации настоящего изобретения 70-75, дополнительно включающий оценку ухудшения когнитивной способности посредством определения у пациента показателя перед и после введения указанного антитела с использованием тестирования по шкале оценки когнитивной функции при болезни Альцгеймера с 12 предметами (ADAS-Cog12), по шкале оценки когнитивной функции при болезни Альцгеймера с 13 предметами (ADAS-Cog13) или по шкале оценки когнитивной функции при болезни Альцгеймера с 14 предметами (ADAS-Cog12), причем необязательно уменьшение когнитивного ухудшения по результатам измерения по шкале ADAS-Cog составляет по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% по сравнению с группой, получающей плацебо.
77. Способ в соответствии с вариантом реализации настоящего изобретения 76, отличающийся тем, что пациент является ApoE4-положительным.
78. Способ в соответствии с вариантом реализации настоящего изобретения 76, отличающийся тем, что пациент страдает БА легкой степени тяжести.
79. Способ в соответствии с вариантом реализации настоящего изобретения 76, отличающийся тем, что пациент страдает ранней БА.
80. Способ в соответствии с любым из вариантов реализации настоящего изобретения 70-78, отличающийся тем, что оценка пациента по шкале MMSE перед началом лечения составляет по меньшей мере 20, от 20 до 30, от 20 до 26, от 24 до 30, от 21 до 26, от 22 до 26, от 22 до 28, от 23 до 26, от 24 до 26 или от 25 до 26 баллов.
81. Способ в соответствии с вариантом реализации настоящего изобретения 80, отличающийся тем, что оценка пациента по шкале MMSE составляет от 22 до 26 баллов.
82. Способ в соответствии с любым из вариантов реализации настоящего изобретения 70-80, отличающийся тем, что антитело вводят в дозе 10 мг/кг-100 мг/кг массы тела пациента.
83. Способ в соответствии с вариантом реализации настоящего изобретения 82, отличающийся тем, что антитело вводят в дозе по меньшей мере 15 мг/кг.
84. Способ в соответствии с вариантом реализации настоящего изобретения 83, отличающийся тем, что антитело вводят в дозе 15 мг/кг, 30 мг/кг, 45 мг/кг, 50 мг/кг или 60 мг/кг.
85. Способ в соответствии с вариантом реализации настоящего изобретения 82 или 83, отличающийся тем, что антитело вводят посредством внутривенной инъекции.
86. Способ в соответствии с любым из вариантов реализации настоящего изобретения 82-85, отличающийся тем, что антитело вводят каждые 2 недели, каждые 4 недели, каждый месяц, каждые два месяца или каждые шесть месяцев.
87. Способ лечения субъекта с ранней болезнью Альцгеймера или БА от легкой до умеренной степени тяжести, страдающему ранней болезнью Альцгеймера или БА легкой степени тяжести гуманизированного моноклонального антитела к бета-амилоиду (Aβ), которое связывается в пределах остатков 13-24 β-амилоида (1-42) (SEQ ID NO: 1), в количестве, эффективном для лечения БА.
88. Способ в соответствии с вариантом реализации настоящего изобретения 87, отличающийся тем, что антитело способно связываться с олигомерными и мономерными формами β-амилоида.
89. Способ в соответствии с вариантом реализации настоящего изобретения 87, отличающийся тем, что антитело представляет собой антитело IgG4.
90. Способ в соответствии с вариантом реализации настоящего изобретения 88 или 89, отличающийся тем, что антитело содержит шесть гипервариабельных участков (HVR), причем:
(i) HVR-H1 представляет собой SEQ ID NO: 2;
(ii) HVR-H2 представляет собой SEQ ID NO: 3;
(iii) HVR-H3 представляет собой SEQ ID NO: 4;
(iv) HVR-L1 представляет собой SEQ ID NO: 6;
(v) HVR-L2 представляет собой SEQ ID NO: 7; и
(vi) HVR-L3 представляет собой SEQ ID NO: 8.
91. Способ в соответствии с вариантом реализации настоящего изобретения 90, отличающийся тем, что антитело содержит тяжелую цепь, имеющую аминокислотную последовательность SEQ ID NO: 5, и легкую цепь, имеющую аминокислотную последовательность SEQ ID NO: 9.
92. Способ в соответствии с вариантом реализации настоящего изобретения 91, отличающийся тем, что антитело представляет собой кренезумаб.
93. Способ в соответствии с любым из вариантов реализации настоящего изобретения 87-92, отличающийся тем, что количество является эффективным для уменьшения ухудшения когнитивной способности, которую оценивают посредством определения у пациента показателя перед и после введения указанного антитела с использованием тестирования по шкале оценки когнитивной функции при болезни Альцгеймера с 12 предметами (ADAS-Cog12), по шкале оценки когнитивной функции при болезни Альцгеймера с 13 предметами (ADAS-Cog13) или по шкале оценки когнитивной функции при болезни Альцгеймера с 14 предметами (ADAS-Cog12), причем необязательно уменьшение когнитивного ухудшения по результатам измерения по шкале ADAS-Cog составляет по меньшей мере 30%, по меньшей мере 35%, по меньшей мере 40% или по меньшей мере 45% по сравнению с группой, получающей плацебо.
94. Способ в соответствии с вариантом реализации настоящего изобретения 93, отличающийся тем, что пациент является ApoE4-положительным.
95. Способ в соответствии с любым из вариантов реализации настоящего изобретения 87-94, отличающийся тем, что оценка пациента по шкале MMSE перед началом лечения составляет по меньшей мере 20, от 20 до 30, от 20 до 26, от 24 до 30, от 21 до 26, от 22 до 26, от 22 до 28, от 23 до 26, от 24 до 26 или от 25 до 26 баллов.
96. Способ в соответствии с вариантом реализации настоящего изобретения 95, отличающийся тем, что оценка пациента по шкале MMSE составляет от 22 до 26 баллов.
97. Способ в соответствии с любым из вариантов реализации настоящего изобретения 87-95, отличающийся тем, что антитело вводят в дозе 10 мг/кг-100 мг/кг массы тела пациента.
98. Способ в соответствии с вариантом реализации настоящего изобретения 97, отличающийся тем, что антитело вводят в дозе по меньшей мере 15 мг/кг.
99. Способ в соответствии с вариантом реализации настоящего изобретения 98, отличающийся тем, что антитело вводят в дозе 15 мг/кг, 30 мг/кг, 45 мг/кг, 50 мг/кг или 60 мг/кг.
100. Способ в соответствии с вариантом реализации настоящего изобретения 97 или 98, отличающийся тем, что антитело вводят посредством внутривенной инъекции.
101. Способ в соответствии с любым из вариантов реализации настоящего изобретения 97-100, отличающийся тем, что антитело вводят каждые 2 недели, каждые 4 недели, каждый месяц, каждые два месяца или каждые шесть месяцев.
102. Способ в соответствии с любым из вариантов реализации настоящего изобретения 70-101, отличающийся тем, что пациента одновременно лечат одним или более средствами, выбранными из группы, состоящей из: терапевтического средства, которое специфически связывается с мишенью; ингибитора холинэстеразы; антагониста рецептора NMDA; средства, истощающего запасы моноаминов; эрголоида мезилата; противопаркинсонического антихолинергического средства; противопаркинсонического допаминергического средства; тетрабеназина; противовоспалительного средства; гормона; витамина; димеболина; гомотаурина; модулятора активности серотониновых рецепторов; интерферона и глюкокортикоида; антитела к Abeta; антибиотика; противовирусного средства.
103. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой ингибитор холинэстеразы.
104. Способ в соответствии с вариантом реализации настоящего изобретения 103, отличающийся тем, что ингибитор холинэстеразы выбирают из группы, состоящей из галантамина, донепезила, ривастигмина и такрина.
105. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой антагонист рецептора NMDA.
106. Способ в соответствии с вариантом реализации настоящего изобретения 105, отличающийся тем, что антагонист рецептора NMDA представляет собой мемантин или его соль.
107. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой терапевтическое средство, которое специфически связывается с мишенью, причем мишень выбирают из группы, состоящей из бета-секретазы, тау-белка, пресенилина, белка-предшественника амилоида или их участков, пептида бета-амилоида или его олигомеров или фибрилл, рецептора смерти 6 (DR6), рецептора продуктов конечного гликирования (RAGE), генов паркина и хантингтина.
108. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой средство, истощающее запасы моноаминов, необязательно, тетрабеназин.
109. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой противопаркинсоническое антихолинергическое средство, выбранное из группы, состоящей из проциклидина, дифенгидрамина, тригексилфенидила, бензтропина, биперидена и тригексифенидила.
110. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой противопаркинсоническое допаминергическое средство, выбранное из группы, состоящей из: энтакапона, селегилина, прамипексола, бромокриптина, ротиготина, селегилина, ропинирола, разагилина, апоморфина, карбидопы, леводопы, перголида, толкапона и амантадина.
111. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой противовоспалительное средство, выбранное из группы, состоящей из: нестероидного противовоспалительного лекарственного средства и индометацина.
112. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой гормон, выбранный из группы, состоящей из: эстрогена, прогестерона и лейпролида.
113. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой витамин, выбранный из группы, состоящей из: фолата и никотинамида.
114. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой гомотаурин, представляющий собой 3-аминопропансульфокислоту или 3APS.
115. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой ксалипроден.
116. Способ в соответствии с вариантом реализации настоящего изобретения 102, отличающийся тем, что средство представляет собой антитело к Abeta, отличное от кренезумаба.
ПРИМЕРЫ
ПРИМЕР 1 -- клиническое исследование кренезумаба, гуманизированного моноклонального антитела к Aβ, в лечении болезни Альцгеймера от легкой до умеренной степени тяжести
План и цели исследования
[0267] Проводили рандомизированное, двойное слепое исследование фазы II, с использованием плацебо-контроля, чтобы оценить влияние гуманизированного моноклонального антитела к бета-амилоиду (Aβ) кренезумаба у пациентов с диагнозом болезни Альцгеймера (БА) от легкой до умеренной степени тяжести. Пациенты, включенные в исследование, во время скрининга были в возрасте от 50 до 80 лет и имели диагноз вероятной БА в соответствии с критериями NINCDS-ADRDA и имели: оценку по краткой шкале оценки психического статуса (MMSE) от 18 до 26 баллов, оценку по гериатрической шкала депрессии (GDS-15) менее 6, завершенные 6 лет образования (или хорошую историю работы для исключения умственной отсталости или других первазивных нарушений развития). Кроме того, для тех пациентов, которые получали сопутствующее лечение БА (например, ингибиторы ацетилхолинэстеразы или мемантин), было получено подтверждение, что пациент принимал лекарственное средство в течение по меньшей мере 3 месяцев, и при этом в течение по меньшей мере 2 месяцев до рандомизации прием был в стабильной дозе. По меньшей мере 50% включенных в исследование пациентов были ApoE4-положительными (были носителями по меньшей мере одного ApoE4 аллеля). Пациентам, одновременно получавшим один или более не запрещенных для приема рецептурных или безрецептурных лекарственных средств, таких как неантихолинергический антидепрессант (-ы), атипичное антипсихотическое средство (-а), небензодиазепиновый транквилизатор (-ы), снотворное (-ые), антихолинергическое антигистаминное средство (-а) центрального действия и антихолинергическое спазмолитическое средство (-а) центрального действия, было также разрешено участвовать в исследовании при условии, что доза была постоянной в течение по меньшей мере 1 месяца до рандомизации и оставалась одинаковой на протяжении всего исследования.
[0268] Субъектов исключали из исследования, если: они страдали от тяжелого или нестабильного медицинского состояния, которое, по мнению исследователя или спонсора, мешало бы способности пациента выполнять оценочные исследования или потребовало бы вмешательства, эквивалентного институциональной или стационарной медицинской помощи; в анамнезе или в настоящее время имелось наличие клинически очевидного сосудистого заболевания, которое могло оказывать влияние на головной мозг; в анамнезе имелась тяжелая, клинически значимая травма центральной нервной системы (например, стойкий неврологический дефицит или структурное повреждение головного мозга); если пациенты были госпитализированы в течение 4 недель до скрининга; они ранее лечились кренезумабом или любым другим средством, оказывающим целевое действие на Aβ; или если они получили лечение с применением любой биологической терапии (за исключением обычных вакцинаций) в течение более 5 периодов полураспада терапевтического средства при биологической терапии или в течение 3 месяцев до начала исследования.
[0269] В исследовании было три периода: период скрининга продолжительностью до 35 дней, период лечения продолжительностью 68 недель (называемый здесь неделя 1, неделя 2 и т. д. вплоть до недели 69) и период наблюдения безопасности, длящийся на протяжении дополнительных 16 недель (упоминаемый в настоящем документе как неделя 70 и т. д. вплоть до недели 85). Лечение (или плацебо) вводили с помощью внутривенной инфузии.
[0270] Пациентов включали в исследование и рандомизировали в одну из двух групп: рандомизация в группу лечения (т. е., получения кренезумаба) и группу плацебо происходила в соотношении 2:1 (группа лечения:группа плацебо). В исследование были включены 249 пациентов с оценкой по шкале MMSE от 18 до 26 баллов (с категорией БА от легкой до умеренной степени тяжести), из которых 165 получали лечение и 84 получали плацебо. 121 пациент в группе лечения и 61 пациент в группе плацебо имели оценку по шкале MMSE от 20 до 26 баллов (с категорией БА легкой степени тяжести). В группе лечения 117 (или 70,9%) участников были ApoE4-положительными. В группе плацебо 60 пациентов (или 71,4%) были ApoE4-положительными. См. ФИГ. 4A-B (таблица распределения пациентов).
[0271] Через 43 дня проводили вводную оценку безопасности с целью определения безопасности и переносимости внутривенного введения дозы 15 мг/кг по сравнению с внутривенным введением дозы 10 мг/кг, и была выбрана доза 15 мг/кг. Пациенты в обеих группах исследования получали слепым способом внутривенные инъекции каждые четыре недели в течение 68 недель; основываясь на результатах вводного исследования безопасности. Пациенты в группе лечения получали дозу 15 мг/кг, в то время как пациенты в группе плацебо получали внутривенные инъекции плацебо. См. ФИГ.5 (схема протокола).
[0272] Через 72 недели проводили оценку пациентов в отношении (a) изменения балла по шкале ADAS-Cog12 и изменения балла по шкале CDR-SOB баллов на неделе 25, 49, и 73 по сравнению с исходной оценкой в начале исследования для оценки ингибирования прогрессирования заболевания и (b) безопасности и переносимости кренезумаба по сравнению с плацебо. Для оценки статистической значимости любого измеренного изменения проводили анализ ковариации, и рассчитывали доверительные интервалы и разницу в среднем изменении от исходного уровня по способу наименьших квадратов.
[0273] Безопасность и переносимость кренезумаба оценивали путем измерения частоты и тяжести лечения возникающих неблагоприятных событий в течение всего исследования, особенно случаи симптоматической или бессимптомной ARIA-E (включая вазогенный отек головного мозга), симптоматической или бессимптомной ARIA-H (включая мозговое микрокровоизлияние) и мозговое макрокровоизлияние. Наличие и/или число случаев вазогенного отека головного мозга в период скрининга (до начала введения дозы) или в течение периода лечения (после начала введения плацебо или кренезумаба) оценивали с помощью магнитно-резонансной томографии в режиме с подавлением сигнала свободной воды (FLAIR МРТ). См., например, Sperling et al., 2011, Alzheimer's & Dementia 7:367-385. Наличие и/или число случаев мозгового микрокровоизлияния) в период скрининга (до начала введения дозы) или в течение периода лечения (после начала введения плацебо или кренезумаба) оценивали по времени релаксации поперечной намагниченности с дополнительным неоднородным градиентом дефазировки, называемым эхо-магнитно-резонансной томографией (T2*-взвешенная GRE МРТ).
Результаты
[0274] Оценивание по шкале ADAS-Cog12 через 73 недели показало, что у пациентов, получавших кренезумаб, наблюдалось меньшее прогрессирование заболевания, чем у пациентов, получавших плацебо. Как показано в таблицах, представленных на ФИГ. 6A-B и на диаграммах, представленных на ФИГ. 7-8, изменение оценки по шкале ADAS-Cog12 было на около 24% (p=0,12) меньше в группе лечения, чем в группе, получавшей плацебо, для пациентов с БА легкой степени тяжести и на около 16% (p=0,19) меньше в группе лечения, чем в группе, получавшей плацебо, для пациентов с БА от легкой до умеренной степени тяжести. Также наблюдался эффект среди ApoE4-положительных пациентов в группе лечения по сравнению с группой плацебо: наблюдалось менее 24,4% (p=0,08, без коррекции на множество) увеличения оценки по шкале ADAS-Cog12 (увеличение баллов по шкале ADAS-Cog12 свидетельствует о прогрессировании заболевания) у пациентов, получавших кренезумаб, по сравнению с пациентами, получавшими плацебо. См. ФИГ. 6A и ФИГ. 9. ApoE4-положительные пациенты включали пациентов как с легкой, так и с умеренной БА. Эффект был еще более выраженным при объединении результатовдля пациентов с легкой болезнью Альцгеймера и ApoE4-положительных пациентов: наблюдалось уменьшение на 32,4% (p=0,05, без коррекции на множество) в группе лечения по сравнению с группой плацебо. См. ФИГ. 6A и ФИГ. 10. Терапевтический эффект возрастает с увеличением оценки MMSE при регистрации в исследовании. Как показано на ФИГ. 6B, чем выше оценка по шкале MMSE, тем больше процентное уменьшение по ADAS-Cog12 в группе лечения по сравнению с группой плацебо, в диапазоне от около 16% для пациентов с оценкой по шкале MMSE 18-26 баллов вплоть до 49% уменьшения у пациентов с оценкой по шкале MMSE от 25 до 26 баллов. См. также, ФИГ. 11. Для пациентов с оценкой по шкале MMSE от 22 до 26 балов процентное уменьшение по ADAS-Cog12 в группе лечения по сравнению с группой плацебо составило около 35%.
[0275] Изменение оценки по шкале CDR-SOB показало аналогичную тенденцию эффективности лечения. Как показано на ФИГ. 12A, наблюдалось 19% уменьшения для изменений оценки по шкале CDR-SOB в группе лечения по сравнению с группой плацебо у пациентов с оценкой по шкале MMSE 22-26 баллов, и этот эффект был еще более выраженным у пациентов с оценкой по шкале MMSE 25-26 баллов, причем процент уменьшения составил около 63% (см. также ФИГ. 13). На ФИГ. 12B показано, что при рассмотрении оценок компонента «Память» или «Рассудительность и решение проблем» у пациентов с оценкой по шкале MMSE 22-26 баллов, процент уменьшения составил около 42% и 30% соответственно.
[0276] В исследовании также показано, что кренезумаб не приводил к увеличению частоты возникновения событий ARIA-типа при введении дозы 15 мг/кг. В исследовании наблюдалось единственное бессимптомное событие ARIA-E у пациента, получавшего кренезумаб. Число событий ARIA-H между группой лечения и группой плацебо было сбалансированным.
[0277] Эти данные свидетельствуют о том, что при введении в дозе 15 мг/кг кренезумаб ингибирует прогрессирование заболевания у пациентов, страдающих БА от легкой до умеренной степени тяжести, особенно у пациентов с БА легкой степени тяжести и/или у тех, которые являются ApoE4-положительными, без увеличения частоты развития возникших в результате лечения неблагоприятных событий, таких как ARIA-E или ARIA-H.
ПРИМЕР 2 -- клиническое исследование кренезумаба, гуманизированного моноклонального антитела к Aβ, в лечении болезни Альцгеймера от легкой до умеренной степени тяжести и оценка влияния на амилоидную нагрузку
План и цели исследования
[0278] Проводили рандомизированное, двойное слепое исследование фазы II, с использованием плацебо-контроля, чтобы оценить влияние гуманизированного моноклонального антитела к бета-амилоиду (Aβ) кренезумаба у пациентов с диагнозом болезни Альцгеймера (БА) от легкой до умеренной степени тяжести. Пациенты, включенные в исследование, во время скрининга были в возрасте от 50 до 80 лет и имели диагноз вероятной БА в соответствии с критериями NINCDS-ADRDA и имели: оценку по краткой шкале оценки психического статуса (MMSE) от 18 до 26 баллов, оценку по гериатрической шкала депрессии (GDS-15) менее 6, завершенные 6 лет образования (или хорошую историю работы для исключения умственной отсталости или других первазивных нарушений развития). В исследование были включены только пациенты с положительным исследованием ПЭТ с флорбетапиром («с наличием амилоида») при проведении скрининга, что свидетельствовало об увеличенной амилоидной нагрузке в головном мозге в диапазоне, ожидаемом для пациентов с диагнозом БА при исследовании флорбетапир-ПЭТ. Кроме того, по меньшей мере 50% включенных в исследование пациентов были ApoE4-положительными.
[0279] Пациентов включали в исследование и рандомизировали в одну из двух групп: рандомизация в группу лечения (т. е. получения кренезумаба) и группу плацебо происходила в соотношении 2:1 (группа лечения:группа плацебо). 52 пациента в обеих группах исследования получали слепым способом внутривенные инъекции каждые четыре недели в течение 73 недель. В группе лечения пациенты получали кренезумаб в дозе 15 мг/кг. Пациентов стратифицировали в соответствии со статусом ApoE4 (носитель в сравнении с не носителем) и оценкой по шкале MMSE.
[0280] Собирали данные, касающиеся изменений в: оценке по шкале ADAS-Cog12, амилоидной нагрузке по данным флорбетапир-ПЭТ и уровнях Abeta в спинномозговой жидкости (СМЖ). Исследования ПЭТ с флорбетапиром проводили при скрининге, при визите через 12 месяцев и 18 месяцев с использованием 10 мКи флорбетапира, с 50-минутным периодом поглощения и 30-минутным сканированием эмиссии. Изображения из кадров 6X5 минут (или кадров 1×15 минут на сканерах без динамической способности) были нормированы на стандартное пространство, где для извлечения средних сигналов из нескольких областей, представляющих интерес (ROI) был использован шаблон. Для уточнения объемов шаблона ROI для трансформирования использовали исходную T1-взвешенную МРТ. Анализы были проведены с использованием в качестве эталонной области коры мозжечка или подкоркового белого вещества. СМЖ собирали при скрининге и перед введением дозы на 18 месяце. Измеряли уровни Abeta, белка тау и фосфорилированного тау(181) в СМЖ. Для статистического анализа различий лечения в конечных точках исследования использовали анализ ANCOVA или смешанную модель для повторных измерений.
[0281] Характеристики пациентов, неблагоприятные события, и сроки проведения ПЭТ, МРТ и отбора проб спинно-мозговой жидкости показаны на ФИГ. 14A-B.
[0282] Результаты Оценивание по шкале ADAS-Cog12 в конце периода лечения показало, что у пациентов, получавших кренезумаб, наблюдалось меньшее прогрессирование заболевания, чем у пациентов, получавших плацебо. У пациентов с исходной оценкой по шкале MMSE от 20 до 26 баллов наблюдалось уменьшение когнитивного ухудшения на 54,3% (p=0,2). С этим согласуется наблюдение замедления прогрессирования заболевания, а также наблюдение при анализе ПЭТ (с использованием в качестве эталонной области подкоркового белого вещества) уменьшения накопления амилоидных отложений у пациентов, получавших кренезумаб по сравнению с пациентами, получавшими плацебо. См. ФИГ. 15A. Кроме того, в группе лечения было обнаружено увеличение концентрации Abeta в спинномозговой жидкости, что согласуется с целевым воздействии кренезумаба на мишень. См. ФИГ. 15B. Аналогичное увеличение концентрации Abeta в спинномозговой жидкости было обнаружено у пациентов, которым в качестве лечения каждые две недели подкожно вводили кренезумаб в дозе 300 мг по сравнению с пациентами, получавшими плацебо.
[0283] Эти данные свидетельствуют о том, что кренезумаб оказывает целевое воздействие на свою мишень, бета-амилоид, и ингибирует прогрессирование заболевания при введении в дозе 15 мг/кг у пациентов, страдающих БА от легкой до умеренной степени тяжести, особенно у пациентов с БА легкой степени тяжести, включая пациентов, имеющих нагрузку амилоида в головном мозге, которая, как правило, встречается у пациентов с диагнозом БА.
[0284] Хотя настоящее изобретение было подробно описано посредством иллюстрации и примера в целях ясности понимания, описания и примеры не должны быть истолкованы как ограничивающие объем изобретения. Раскрытия всех патентных заявок и публикаций и научной литературы, процитированные в настоящем документе, явно включены в него во всей своей полноте путем ссылки для любых целей.
[0285] КЛЮЧЕВОЙ ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
|
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> GENENTECH, INC., ET AL.
<120> СПОСОБЫ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
<130> P5696R1-WO
<140>
<141>
<150> 62/081992
<151> 2014-11-19
<150> 62/010259
<151> 2014-06-10
<150> 61/971479
<151> 2014-03-27
<150> 61/9371472
<151> 2014-02-08
<160> 9
<170> PatentIn версии 3.5
<210> 1
<211> 42
<212> ПРТ
<213> Homo sapiens
<400> 1
Asp Ala Glu Phe Arg His Asp Ser Gly Tyr Glu Val His His Gln Lys
1 5 10 15
Leu Val Phe Phe Ala Glu Asp Val Gly Ser Asn Lys Gly Ala Ile Ile
20 25 30
Gly Leu Met Val Gly Gly Val Val Ile Ala
35 40
<210> 2
<211> 10
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> источник
<223> /note= "Описание искусственной последовательности: синтетический пептид"
<400> 2
Gly Phe Thr Phe Ser Ser Tyr Gly Met Ser
1 5 10
<210> 3
<211> 16
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> источник
<223> /note= "Описание искусственной последовательности: синтетический пептид"
<400> 3
Ser Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val Lys
1 5 10 15
<210> 4
<211> 3
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> источник
<223> /note= "Описание искусственной последовательности: синтетический пептид"
<400> 4
Gly Asp Tyr
1
<210> 5
<211> 438
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> источник
<223> /note= "Описание искусственной последовательности: синтетический полипептид"
<400> 5
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Ser Ile Asn Ser Asn Gly Gly Ser Thr Tyr Tyr Pro Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Gly Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
115 120 125
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
180 185 190
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
305 310 315 320
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
340 345 350
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Leu Gly
435
<210> 6
<211> 16
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> источник
<223> /note= "Описание искусственной последовательности: синтетический пептид"
<400> 6
Arg Ser Ser Gln Ser Leu Val Tyr Ser Asn Gly Asp Thr Tyr Leu His
1 5 10 15
<210> 7
<211> 7
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> источник
<223> /note= "Описание искусственной последовательности: синтетический пептид"
<400> 7
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 8
<211> 9
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> источник
<223> /note= "Описание искусственной последовательности: синтетический пептид"
<400> 8
Ser Gln Ser Thr His Val Pro Trp Thr
1 5
<210> 9
<211> 219
<212> ПРТ
<213> Искусственная последовательность
<220>
<221> источник
<223> /note= "Описание искусственной последовательности: синтетический полипептид"
<400> 9
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val Tyr Ser
20 25 30
Asn Gly Asp Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<---