Результат интеллектуальной деятельности: СПОСОБ МОНОМЕРИЗАЦИИ АГРЕГАТА МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ 7 (MMP-7)
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к способу мономеризации агрегатов матриксной металлопротеиназы 7 (далее в настоящем описании также называемой "MMP-7"). Конкретно, настоящее изобретение относится к способу мономеризации агрегатов MMP-7, который содержит обработку агрегатов MMP-7 с раствором, содержащим низкую концентрацию моновалентного катионного соединения, или с раствором, не содержащим указанное соединение, процессу приготовления MMP-7, который задействует указанный способ для мономеризации агрегатов MMP-7, и композиции (фармацевтической), содержащей MMP-7 в вышеупомянутом растворе, в котором дополнительно растворены сахарные спирты или сахара.
Предшествующий уровень техники
MMP-7 является одной матричных металлопротеиназ (далее в настоящем описании также называемых "MMP"), принадлежащей к семейству цинковых металлопротеиназ, которое имеет молекулу цинка в активном сайте (см., например, непатентную ссылку 1). MMP бывает продуцирована в виде предшественника, ее сигнальная последовательность бывает процессирована при внеклеточной секреции, и затем пропоследовательность бывает процессирована с получением активной формы. Внеклеточно секретируемая MMP контролирует метаболизм внеклеточного матрикса. С другой стороны, было сообщено, что MMP-7 в основном секретируется из раковых клеток и задействована в инвазии и метастазе (см. например, непатентную ссылку 2). У MMP-7 отсутствует шарнирная область и гемопексин-подобный домен, общие для многих других MMP, и она состоит из минимального звена макромолекулы по сравнению с другими MMP. Субстратом MMP-7 являются компоненты, составляющие коллаген или внеклеточный матрикс (фибронектин, витронектин, ламинин, аггрекан).
Предполагается, что MMP-7 задействован в спонтанной ремиссии пульпозного ядра, существующего в эпидуральном (спинальном) пространстве, что принимает во внимание, что субстратом MMP-7 является аггрекан, который является основным компонентом хрящевой ткани, и что макрофаги из образца операции от смещения межпозвоночного диска экпрессируют MMP-7 (см. например, непатентную ссылку 3). Впоследствии Haro et al. ввели MMP-7 в межпозвоночный диск собаки c грыжей и наблюдали снижение объема пульпозного ядра в межпозвоночном диске для того, чтобы таким образом продемонстрировать возможность применять MMP-7 в качестве медицинского средства для лечения смещения межпозвоночного диска (см. например, непатентную ссылку 4). Требуется разработка MMP-7 в качестве лекарства. Однако, MMP-7 существует в живом организме только в следовом количестве, и таким образом чрезвычайно сложно выделить и очистить MMP-7 из живого организма. Кроме того, когда применены компоненты из живого организма, это затрагивает вопроc безопасности такой, как потенциальная вирусная инфекция. Хотя MMP-7 может быть получен из раковых клеток, не является предпочтительным использовать раковые клетки, в качестве источника для получения (см. например, непатентную ссылку 5).
Для разрешения таких проблем была предпринята попытка получения MMP-7 посредством технологии рекомбинантных ДНК. Имеется сообщение Barnett et al. о том, что MMP-7 экспрессирован в клетках CHO (см. например, непатентную ссылку 6), сообщение о том, что фрагмент нуклеиновой кислоты, генерированный связыванием нуклеотидной последовательности сигнальной последовательности щелочной фосфотазы с генной последовательностью про-матриксной металлопротеиназы 7 (далее в настоящем описании также называемой "proMMP-7"), оптимизированный для использования кодонов E. coli, растворимая proMMP-7 была экпрессирована при 34°C и нерастворимая proMMP-7 была экпрессирована при 42°C (см. например, патентную ссылку 1), и сообщение о том, что посредством применения фрагмента нуклеиновой кислоты, генерированного посредством связывания модифицированного сигнального пептида с генным фрагментом proMMP-7, proMMP-7 экспрессирован в виде тела включения в большом количестве (см. например, патентную ссылку 2).
Относительно превращения proMMP-7 в активный MMP-7, сообщалось, что proMMP-7 нагревали при 37°C в присутствии 1 мМ (4-аминофенил) ацетата ртути (APMA) или 0,2 мкМ трипсина, или раствор содержащего proMMP-7, нагревали при 53°C (см. например, непатентную ссылку 7). Было выявлено, что после того, как низкие концентрации (менее чем 1 мг/мл) активированной MMP-7 (также известной как Матрилизин) хранили -20°C в течение 6 месяцев и при комнатной температуре в течение 28 дней, не имело место изменения ее активности и поведения при электрофорезе. Хотя не существует определенного описания об изменении, по-видимому, предполагается, что не наблюдалось разложение матрилизина по результатам электрофореза. В добавление к этому, существует множество сообщений об очистке proMMP-7 и MMP-7, таких как Kihira и Oneda et al. (см. например, патентную ссылку 1, непатентную ссылку 8), и таким образом способ для очистки MMP-7 в некоторой степени был разработан на экспериментальном уровне. Обычно способ для очистки MMP-7 на экпериментальном уровне бывает масштабирован для производства в большом масштабе. Однако не был разработан способ для производства MMP-7 в большем количестве. Было мало сообщений о проблеме в производстве MMP-7 в большом количестве и ее разрешении.
Сообщалось о композиции, содержащей MMP-7, которая содержит трис(гидроксиметил)аминометан гидрохлорид (Трис гидрохлорид), хлорид кальция и хлорид натрия (см. например, патентные ссылки 3-5, непатентные ссылки 7, 9). Известно, что металлопротеаза, такая как MMP-7, в состоянии растворенной композиции, стабилизирована при совместном присутствии хлорида кальция и хлорида натрия (см. например, патентную ссылку 6). Так, в частности, обычно требуется, чтобы лекарственное средство имело осмотическое давление, схожее с осмотическим давлением тела жидкостей организма с точки зрения безопасности. Хлорид натрия обычно применяют в качестве регулятора осмотического давления жидкой композиции. На практике большинство из композиций, раскрытых в этих документах, содержит моновалентное катионное соединение, такое как хлорид натрия в концентрации, изотонической или большей чем концентрация жидкости организма. Кроме того, композиции, раскрытые в этих документах, не содержат сахарные спирты или сахара.
Патентные ссылки
Патентная ссылка 1: патент Японии 2938352
Патентная ссылка 2: WO 2010/047347A1
Патентная ссылка 3: патент Японии 2000-344672
Патентная ссылка 4: патент Японии 2000-226329
Патентная ссылка 5: патент Японии 2002-173424
Патентная ссылка 6: патент Японии 2005-6509
Непатентные ссылки
Непатентная ссылка 1: Soler et al., Biochem Biophys Res Commun, 1994, vol.201, p.917-923
Непатентная ссылка 2: Ii et al., Exp Biol Med (Maywood), 2006, vol.231, p.20-27
Непатентная ссылка 3: Haro et al., J Spinal Disord, 1999, vol.13, p.245-249
Непатентная ссылка 4: Haro et al., J Orthop Res, 2005, vol.23, p.412-419
Непатентная ссылка 5: Miyazaki et al., Cancer Research, 1990, vol.50, p.7758-7764
Непатентная ссылка 6: Barnett et al., Protein Exp Purif, 1994, vol.5, p.27-36
Непатентная ссылка 7: Crabbe et al., Biochemistry, 1992, vol.31, p.8500-8507
Непатентная ссылка 8: Oneda et al., J Biochem, 1999, vol.126, p.905-911
Непатентная ссылка 9: Browner et al., Biochemistry, 1995, vol.34, p.6602-6610
Раскрытие изобретения
Техническая задача, разрешаемая изобретением
В ходе разработки лекарственного средства, содержащего MMP-7, авторы изобретения обнаружили, что MMP-7 образует агрегаты в условиях, когда моновалентное катионное соединение, такое как хлорид натрия, представлено при 150 мМ или более, что является изотоническим по отношению к жидкости организма, как в случае общепринятых медицинских продуктов, в особенности жидкой композиции металлопротеазы, как описано выше и что MMP-7 бывает адсорбирван к гелю в приборе, обычно используемом для производства белков или их препаратов, или к контейнеру, такому как флакон, обычно применяемый для хранения препаратов. Таким образом, задача заключалась в разработке способа для мономеризации агрегатов MMP-7, в котором адсорбция MMP-7 к прибору для производства подавлена, в то время когда произведен MMP-7, процесса для приготовления MMP-7, который задействует указанный способ для мономеризации агрегатов MMP-7, и композиции (фармацевтическая), содержащей MMP-7, когда формирование агрегата и адсорбция MMP-7 подавлена.
Средство для разрешения задачи
Авторы изобретения провели глубокие исследования для того, чтобы разрешить вышеприведенные задачи и в результате обнаружили следующее (1)-(4) для осуществления настоящего изобретения.
(1) MMP-7 агрегаты диссоциированы с образованием мономеров посредством обработки с раствором, таким как Трис-буфер (pH 6-8), содержащим низкую концентрацию хлорида моновалентного катиона (хлорид натрия и хлорид калия). Также, агрегаты MMP-7 подобным образом образуют мономеры, когда они обработаны с раствором, не содержащим хлорид моновалентного катиона.
(2) Посредством включения способа для мономеризации агрегатов MMP-7 с обработкой, как упомянуто выше (далее в настоящем описании также называется просто "способ мономеризации") в процессе производства MMP-7, эффективность продуцирования MMP-7 может быть увеличена. В частности, посредством включения способа мономеризации в процесс обработки с ультрафильтрационной мембраной непосредственно после превращения proMMP-7 в MMP-7 посредством самоактивации могут быть получены более значительные эффекты.
(3) Мономеры MMP-7 сохраняют высокую ферментативную активность.
(4) Посредством добавления сахара или сахарных спиртов, таких как маннит и сахароза, в Трис-буфер, как упомянуто выше, подавлено не только образование агрегатов MMP-7, но также подавлена адсорбция MMP-7 к гелю и стенке флакона. То есть, посредством получения композиции, содержащей хлорид моновалентного катиона в концентрации около 150 мМ, что является изотонической по отношению к концентрации жидкости организма или менее, при приготовлении в водном растворе, и сахарные спирты или сахара, полученный в результате раствор становится фармацевтическим препаратом, в котором образование агрегатов MMP-7 и адсорбция MMP-7 подавлены
Соответственно, настоящее изобретение охватывает способ мономеризации агрегатов MMP-7 (способ мономеризации), процесс для приготовления MMP-7, который задействует указанный способ мономеризации, и композицию (фармацевтическую), содержащую MMP-7, приготовленный посредством применения вышеупомянутого буфера, и относится к следующему:
[1] Способ мономеризации агрегатов матриксной металлопротеиназы 7 (MMP-7), который включает обработку агрегатов MMP-7 раствором, содержащим моновалентное катионное соединение при 130 мМ или менее, или раствором, не содержащим моновалентное катионное соединение.
[2] Способ мономеризации в соответствии с [1], при этом агрегаты MMP-7 обрабатывают раствором, содержащим моновалентное катионное соединение при 130 мМ или менее.
[3] Способ мономеризации в соответствии с [1], при этом агрегаты MMP-7 обрабатывают раствором, не содержащим моновалентное катионное соединение.
[4] Способ мономеризации в соответствии с [1] или [2], при этом моновалентное катионное соединение представлено при 100 мМ или менее.
[5] Способ мономеризации в соответствии с [1], [2] или [4], при этом моновалентное катионное соединение представлено при 80 мМ или менее.
[6] Способ мономеризации в соответствии с [1], [2], [4] или [5], при этом моновалентное катионное соединение представлено при 40 мМ или менее.
[7] Способ мономеризации в соответствии с [1], [2], [4], [5] или [6], при этом моновалентное катионное соединение выбрано из группы, состоящей из хлорида натрия, хлорида калия, сульфата натрия, сульфата калия, карбоната натрия, карбоната калия, ортофосфата натрия и ортофосфата калия.
[8] Способ мономеризации в соответствии с [1], [2], [4], [5] или [6], при этом моновалентное катионное соединение получено из хлорида моновалентного катиона.
[9] Способ мономеризации в соответствии с [8], при этом моновалентное катионное соединение выбрано из группы, состоящей из хлорида натрия и хлорида калия.
[10] Способ мономеризации в соответствии с любым из [1] - [9], при этом раствор дополнительно содержит хлорид кальция.
[11] Способ мономеризации в соответствии с [10], при этом хлорид кальция представлен при 30 мМ или менее.
[12] Способ мономеризации в соответствии с любым из [1]-[11], при этом раствор представляет собой буферный раствор.
[13] Способ мономеризации в соответствии с [12], при этом буферный раствор представляет собой Трис-буфер от 5 до 25 мМ.
[14] Способ мономеризации в соответствии с любым из [1] - [13], при этом MMP-7 представлена при 20 мг/мл или менее.
[15] Способ мономеризации в соответствии с [13] или [14], при этом раствор представляет собой Трис-буфер от 5 до 25 мМ (pH 6-8), содержащий от 30 до 40 мМ хлорида натрия и от 5 до 30 мМ хлорида кальция.
[16] Способ мономеризации в соответствии с любым из [1]-[15], при этом раствор дополнительно содержит сахарные спирты и/или сахара.
[17] Способ мономеризации в соответствии с [16], при этом сахарные спирты и/или сахара выбраны из группы, состоящей из сахарозы, лактозы, мальтозы, ксилозы, трегалозы, маннита, сорбита, ксилита, мальтита, лактита и олигосахаридных спиртов.
[18] Способ мономеризации в соответствии с [16] или [17], при этом сахарные спирты и/или сахара представлены при 2% или более.
[19] Способ мономеризации в соответствии с [18], при этом сахарные спирты и/или сахара представлены при от 2 до 7%
[20] Способ мономеризации в соответствии с любым из [17]-[19], при этом сахарные спирты и/или сахара представляют собой маннит или сахарозу.
[21] Способ мономеризации в соответствии с [20], при этом маннит представлен при от 2 до 5% и сахароза представлена при от 2 до 7%.
[22] Способ получения MMP-7, который включает стадию, состоящую из способа мономеризации, как предусмотрено в любом из [1]-[21].
[23] Способ получения в соответствии с [22], в котором стадию осуществляют после стадии обработки с применением раствора, содержащего моновалентное катионное соединение при 130 мМ или более.
[24] Способ получения в соответствии с [22] или [23], при этом способ включает следующие стадии (1) по (5):
(1) стадию разрушения клеток, продуцирующих тело включения proMMP-7;
(2) стадию обработки с растворением /рефолдингом тела включения proMMP-7;
(3) стадию очистки proMMP-7;
(4) стадию самоактивации proMMP-7 в MMP -7; и
(5) стадию, состоящую из способа мономеризации, как предусмотрено в любом из [1]-[21].
[25] Способ получения в соответствии с [24], в котором стадия (5) представляет собой стадию концентрации с использованием ультрафильтрационной мембраны.
[26] (Фармацевтическая) композиция, содержащая матриксную металлопротеиназу 7 (MMP-7) в качестве активного ингредиента в растворе, содержащем моновалентное катионное соединение при 130 мМ или менее, или в растворе, не содержащем моновалентное катионное соединение.
[27] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [26], при этом композиция содержит MMP-7 в качестве активного ингредиента в растворе, содержащем моновалентное катионное соединение при 130 мМ или менее.
[28] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [26], при этом композиция содержит MMP-7 в качестве активного ингредиента в растворе, не содержащем моновалентное катионное соединение.
[29] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [26] или [27], при этом моновалентное катионное соединение выбрано из группы, состоящей из хлорида натрия, хлорида калия, сульфата натрия, сульфата калия, карбоната натрия, карбоната калия, ортофосфата натрия и ортофосфата калия.
[30] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [26] или [27], при этом моновалентное катионное соединение получено из хлорида моновалентного катиона.
[31] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [30], при этом моновалентное катионное соединение выбрано из группы, состоящей из хлорида натрия и хлорида калия.
[32] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с любым из [26]-[31], при этом композиция дополнительно содержит хлорид кальция.
[33] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [32], при этом хлорид кальция представлен при 30 мМ или менее.
[34] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с любым из [26]-[33], при этом раствор представляет собой буферный раствор.
[35] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [34], при этом буферный раствор представляет собой Трис-буфер от 5 до 25 мМ.
[36] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с любым из [26]-[35], при этом MMP-7 представлена при 20 мг/мл или менее.
[37] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [36], при этом MMP-7 представлена при 1 мкг/мл до 1 мг/мл.
[38] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [35], [36] или [37], при этом раствор представляет собой Трис-буфер от 5 до 25 мМ (pH 6-8), содержащий от 30 до 40 мМ хлорида натрия и от 5 до 30 мМ хлорида кальция.
[39] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с любым из [26]-[38], при этом раствор дополнительно содержит сахарные спирты и/или сахара.
[40] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [39], при этом сахарные спирты и/или сахара выбраны из группы, состоящей из сахарозы, лактозы, мальтозы, ксилозы, трегалозы, маннита, сорбита, ксилита, мальтита, лактита и олигосахаридных спиртов.
[41] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [39] или [40], при этом сахарные спирты и/или сахара представлены при 2% или более.
[42] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [41], при этом сахарные спирты и/или сахара представлены при от 2 до 7%.
[43] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с любым из [40]-[42], при этом сахарные спирты и/или сахара представляют собой маннит или сахарозу.
[44] (Фармацевтическая) композиция, содержащая MMP-7 в соответствии с [43], при этом маннит представлен в количестве от 2 до 5% и сахароза представлена в количестве от 2 до 7%.
[45] Твердая (фармацевтическая) композиция, содержащая MMP-7, при этом композиция может быть растворена в растворителе и композиция после растворения представляет собой композицию, как предусмотрено в любом из [26]-[44].
[46] Лекарственное средство для лечения смещения межпозвоночного диска, которое содержит композицию (фармацевтическую), содержащую MMP-7, как предусмотрено в любом из [26]-[45].
Эффекты изобретения
Настоящее изобретение относится к способу незатруднительной мономеризации агрегатов MMP-7. Таким образом, посредством включения способа в процесс производства MMP-7 может быть увеличена продуктивность и эффективность извлечения MMP-7.
Кроме того, MMP-7 в мономеризированном посредством настоящего способа виде имеет более высокую специфическую активность фермента по сравнению с агрегатами MMP-7 и таким образом может являться пригодным материалом для предоставления препарата MMP-7 высокого качества.
Кроме того, в варианте осуществления настоящего изобретения, посредством хранения MMP-7 в буфере, содержащем хлорид натрия при низкой концентрации, и сахарные спирты или сахара, MMP-7 не только сохраняет его мономерные формы, но также высокую ферментативную активность, и также может быть подавлена адсорбция MMP-7 в контейнер для хранения. Следовательно, буфер, применяемый в способе мономеризации по настоящему изобретению, пригоден в качестве консервирующего раствора для препарата MMP-7. Композиция MMP-7 по настоящему изобретению, которая содержит хлорид натрия при низкой концентрации, когда она приготовлена в водном растворе, и сахарные спирты или сахара, пригодна в качестве жидкой композиции для медицинского применения и композиции для приготовления этого, когда образование агрегатов MMP-7 подавлено и адсорбция MMP-7 в контейнер подавлена.
Краткое описание чертежей
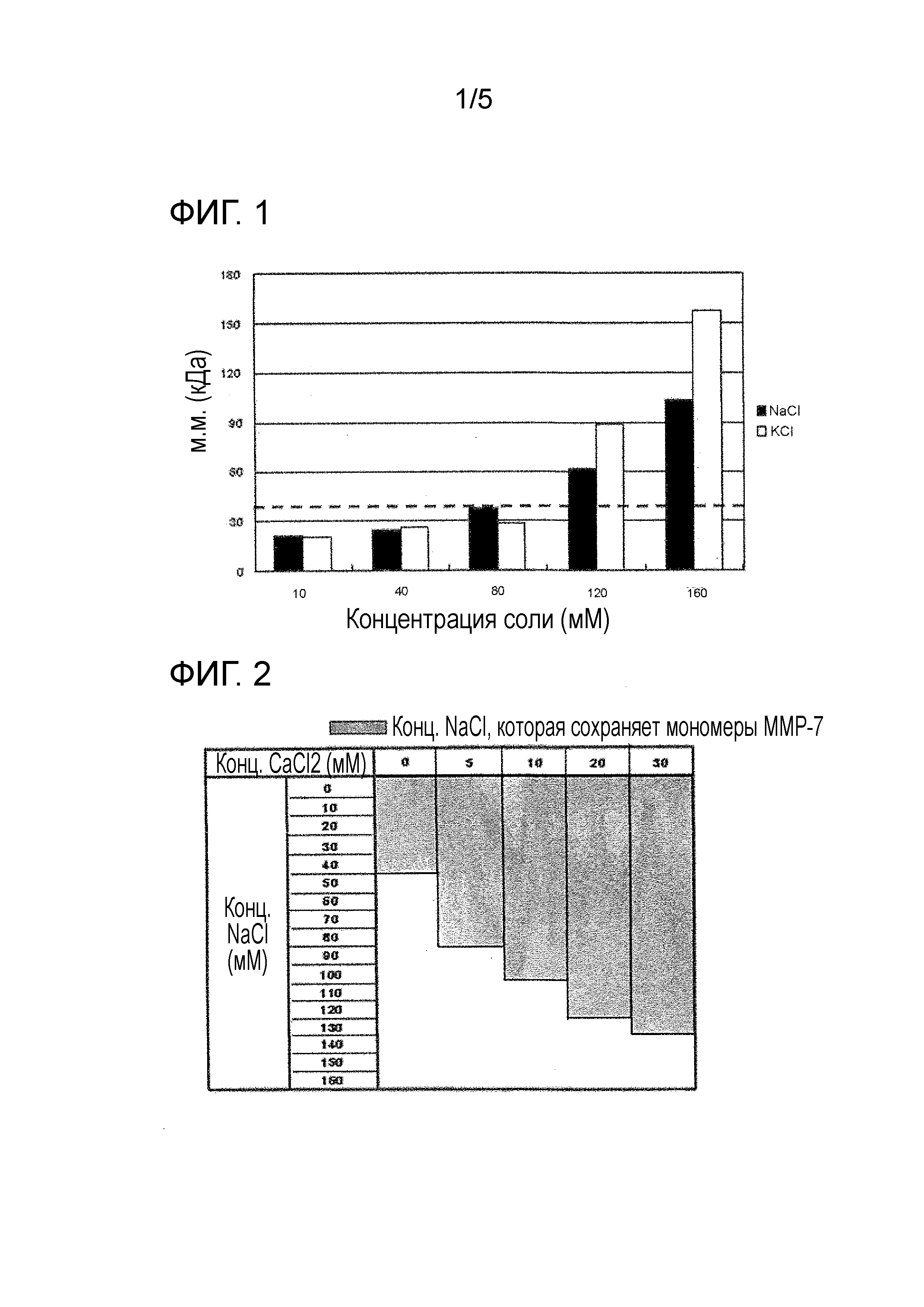
Фиг. 1 демонстрирует супрессорные эффекты хлорида натрия (NaCl) и хлорида калия (KCl) на формирование агрегата MMP-7 на основании анализа молекулярной массы MMP-7, измеренной посредством динамического рассеяния света.
Фиг. 2 демонстрирует эффекты хлорида кальция (CaCl2) на супрессию формирования агрегата MMP-7 на основании анализа молекулярной массы MMP-7, измеренной посредством динамического рассеяния света.
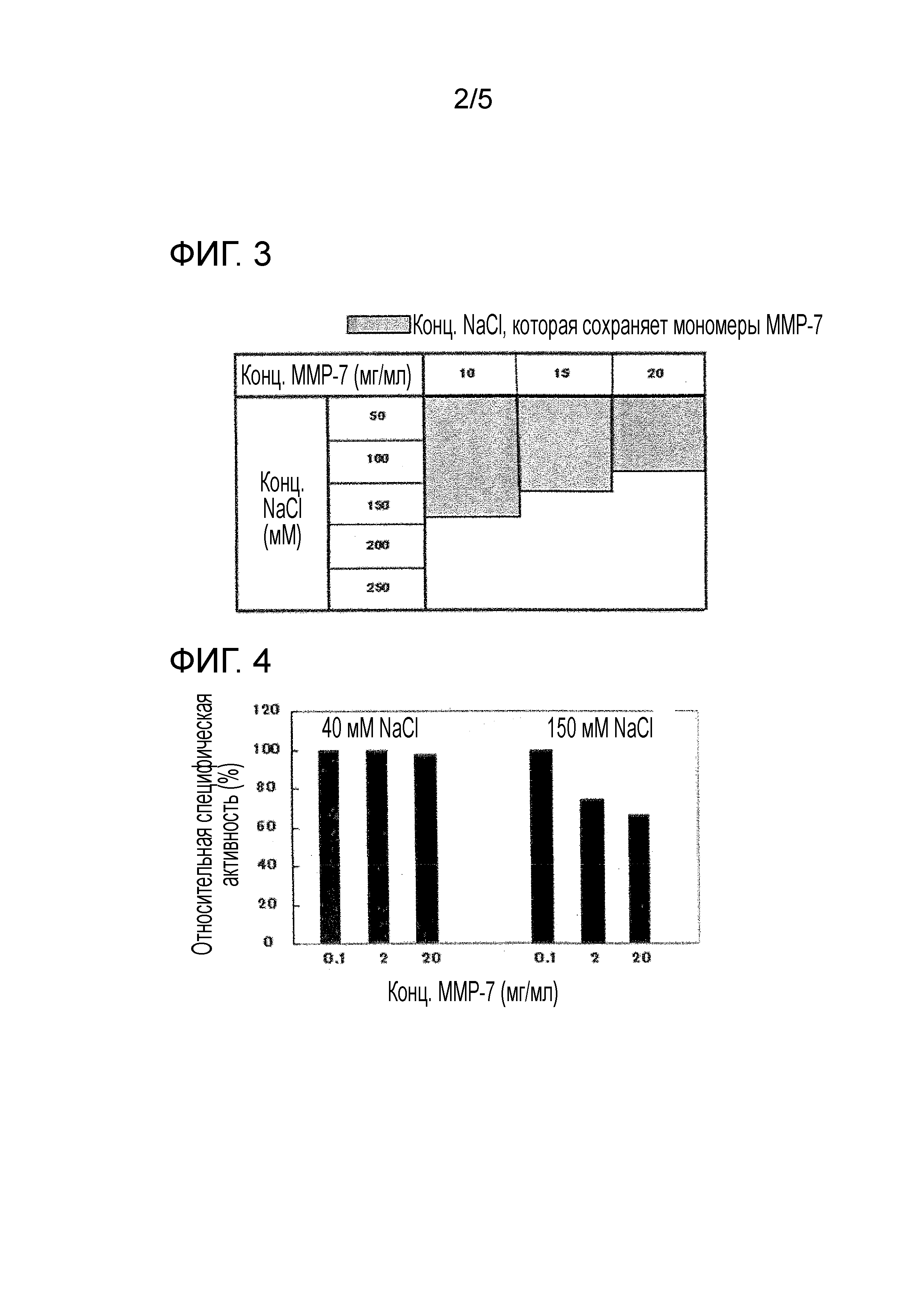
Фиг. 3 демонстрирует эффекты концентрации MMP-7 на формирование агрегата MMP-7 на основании анализа молекулярной массы MMP-7, измеренной посредством гель-проникающей хроматографии.
Фиг. 4 демонстрирует эффекты хлорида натрия (NaCl) на ферментативную активность MMP-7, когда MMP-7 при 0,1 мг/мл, 2 мг/мл или 20 мг/мл разбавлен Трис-буфером, содержащим 150 мМ NaCl или 40 мМ NaCl.
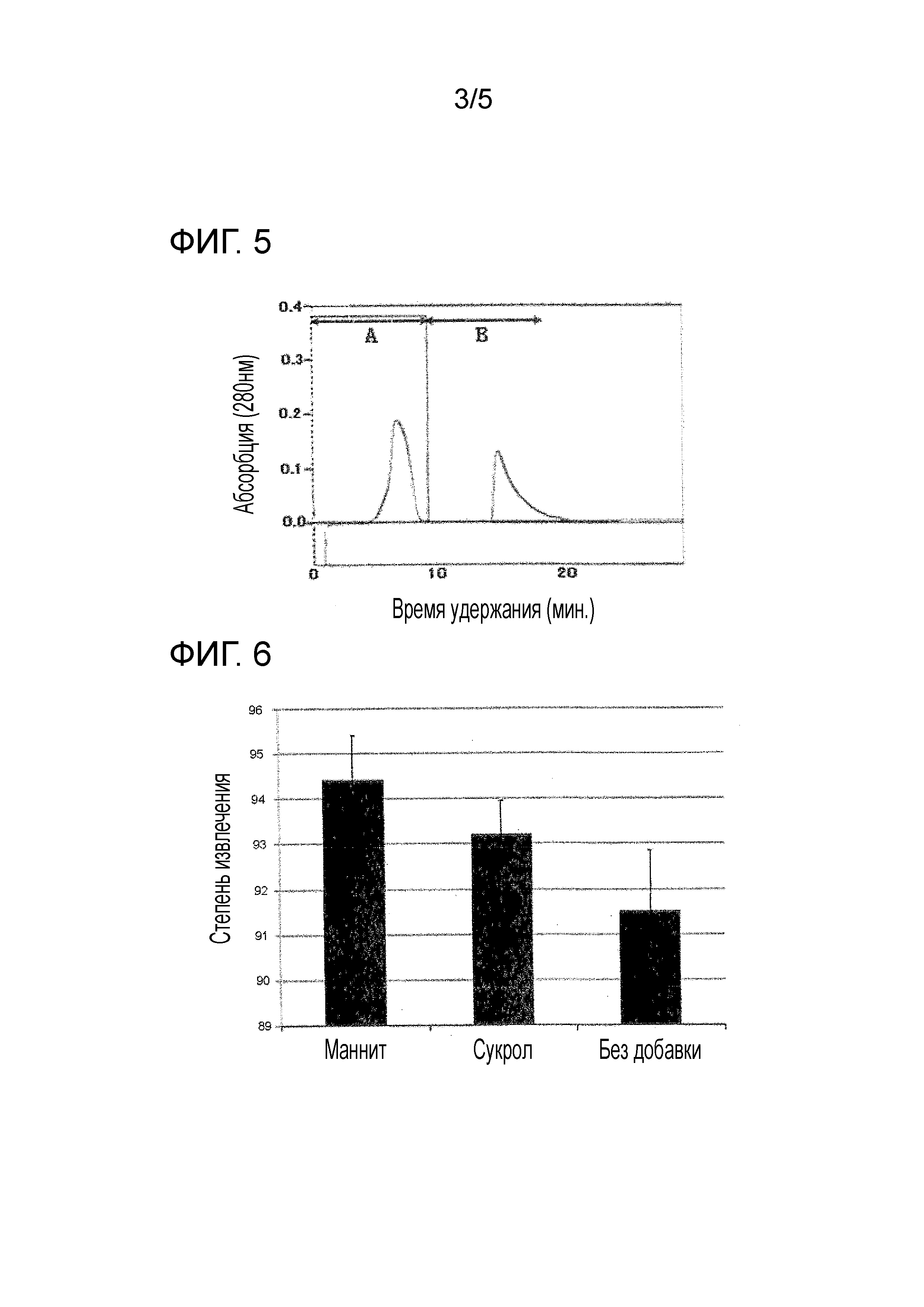
Фиг. 5 демонстрирует супрессорные эффекты маннита на адсорбцию MMP-7 к гелю. A: 5 мМ Трис-буфер (pH 7)/10 мМ CaCl2/40 мМ NaCl; B: 5 мМ Трис-буфер (pH 7)/10 мМ CaCl2/40 мМ NaCl/3,5% маннит.
Фиг. 6 демонстрирует супрессорные эффекты маннита и сахарозы на адсорбцию MMP-7 к стенке флакона.
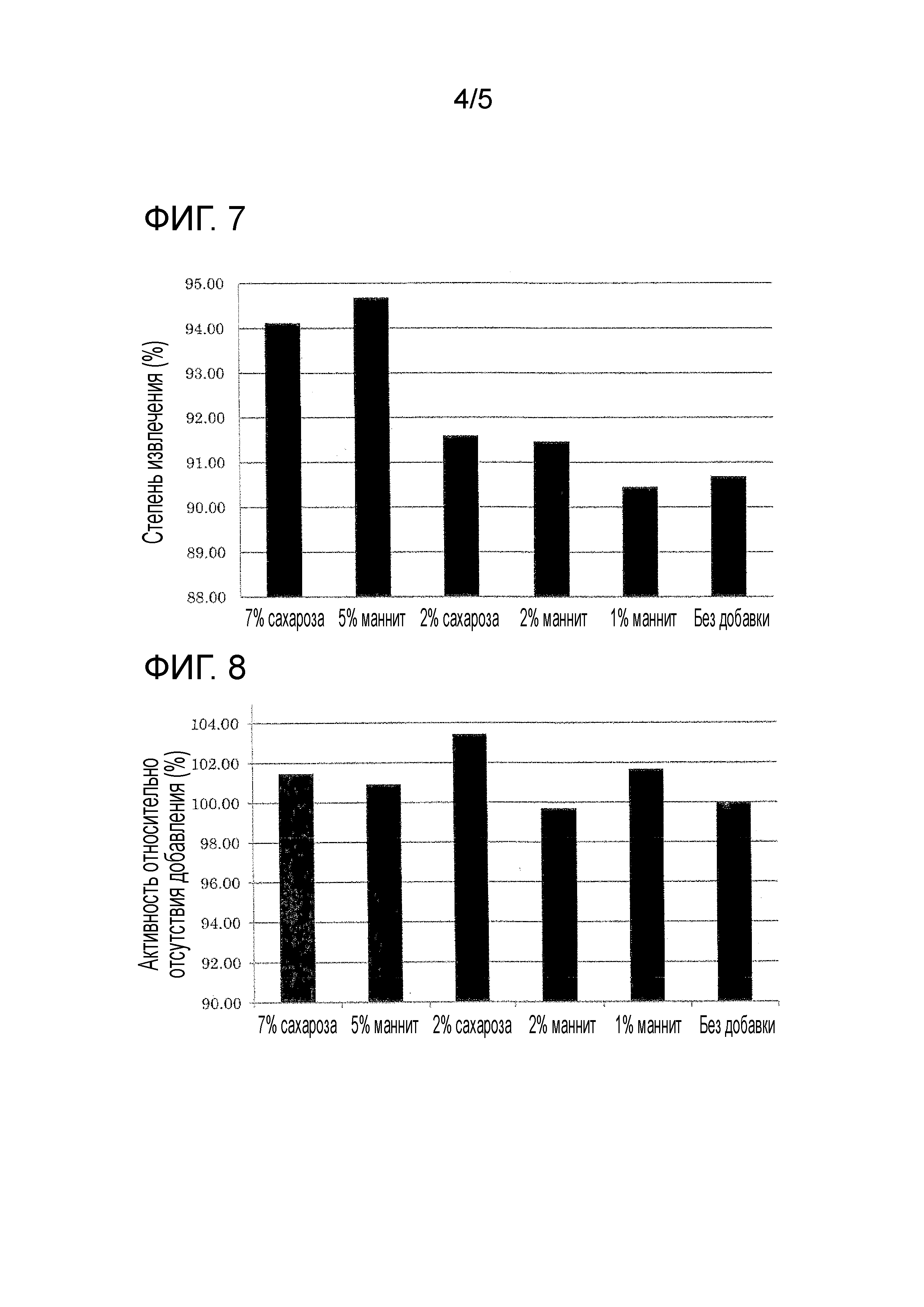
Фиг. 7 демонстрирует супрессорные эффекты маннита и сахарозы в каждой концентрации на адсорбцию MMP-7 к стенке флакона.
Фиг. 8 демонстрирует эффекты маннита и сахарозы в каждой концентрации на ферментативную активность MMP-7.
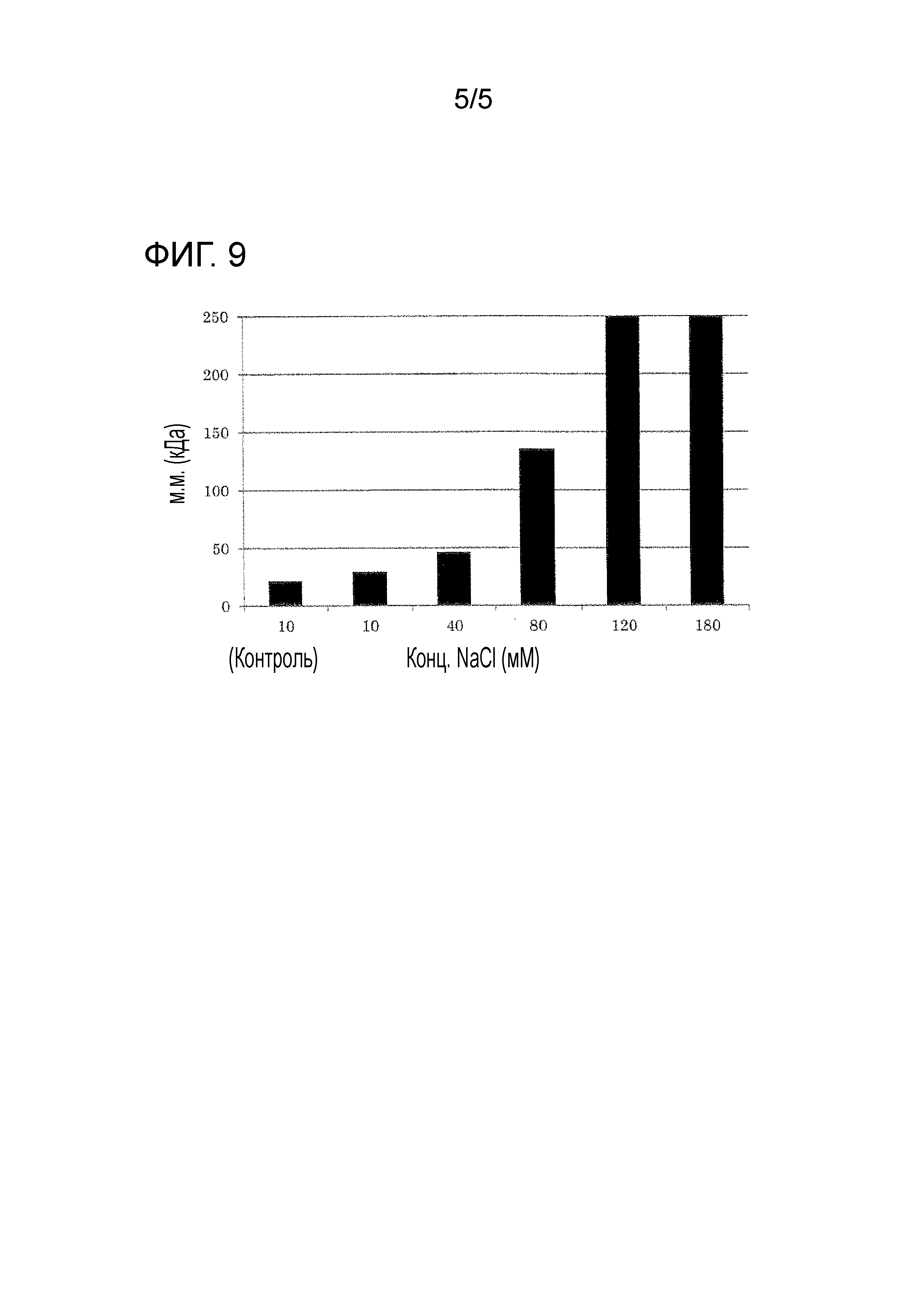
Фиг. 9 демонстрирует эффекты маннита на супрессию образования агрегата MMP-7.
Наилучший способ осуществления изобретения
Настоящее изобретение относится к способу мономеризации агрегатов MMP-7, процессу для приготовления MMP-7, который задействует указанный способ мономеризации и композицию (фармацевтическую), содержащую MMP-7. Настоящее изобретение характеризуется тем, что агрегаты MMP-7 обработаны с раствором, содержащим низкую концентрацию моновалентного катионного соединения и дополнительно содержащим сахарные спирты или сахара (далее в настоящем описании также называемые "раствор для мономеризации"), так что MMP-7 хранится в указанном растворе и что композиция MMP-7 содержит низкую концентрацию моновалентного катионного соединения и сахарные спирты или сахара, когда она переведена в водный раствор.
Детекция агрегатов MMP-7 осуществлена посредством измерения молекулярной массы MMP-7 посредством динамического рассеяния света, гель-проникающей хроматографии, ультрацентрифугирования и тому подобного и сравнения измеренной массы с молекулярной массой мономерной MMP-7 (приблизительно 19 кДа), рассчитанной по аминокислотной последовательности. В настоящем изобретении MMP-7 определяли как мономерную в случае, если молекулярная масса MMP-7 в образце была в пределах диапазона от 19 кДа до 38 кДа, тогда как MMP-7 определяли как образующую агрегаты в случае, если она составляла 38 кДа или более. Вышеприведенные критерии определения осуществлены принимая в расчет точность измерений посредством динамического рассеяния света, так что MMP-7 очевидно образовывал агрегаты, когда молекулярная масса была больше, чем масса димера, тогда как MMP-7 был мономерным, когда она была меньше, чем у димера.
Мономеризация MMP-7 осуществлена посредством обработки агрегатов MMP-7 с раствором для мономеризации. Как применено в настоящем описании, "обработка агрегатов MMP-7 с раствором для мономеризации" означает, что агрегаты MMP-7 подвержены воздействию раствора для мономеризации, и содержит растворение в указанном растворе и заключается в том, что агрегаты MMP-7 растворены в растворе, содержащем моновалентное катионное соединение при высокой концентрации 130 мМ или более, обмен буфера осуществляется с ультрафильтрационной мембраной или диализной мембраной с применением раствора для мономеризации. Для того, чтобы поддерживать pH раствора для мономеризации постоянным, возможно применять Трис-буфер, ортофосфатный буфер, глициновый буфер и бикарбонатный буфер, среди которых пригодный буфер может быть выбран в зависимости от pH при мономеризационной обработке. Концентрация буфера может быть в диапазоне от 5 до 25 мМ, предпочтительно от 5 до 20 мМ. pH может быть в диапазоне от 5 до 9, предпочтительно от 6 до 8. Более предпочтительно выбран Трис-буфер, который проявляет эффект на улучшение стабильности металлопротеазы с Трис-буфером, имеющим концентрацию от 5 до 10 мМ и pH от 6 до 8 (см. патент Японии 2011-521906).
Как применено в настоящем описании, "моновалентное катионное соединение" означает соединение, состоящее из моновалентного катиона и соответствующего аниона, включая хлорид натрия, хлорид калия, сульфат натрия, сульфат калия, карбонат натрия, карбонат калия, ортофосфат натрия, ортофосфат калия и тому подобное. Также, как применено в настоящем описании "хлорид моновалентного катиона" означает соединение, состоящее из моновалентного катиона и хлорид-иона. Для моновалентного катионного соединения, как применено в настоящем описании, любое моновалентное катионное соединение может быть применено, но предпочтительно применен хлорид моновалентного катиона. Более конкретно, применен хлорид натрия и хлорид калия, предпочтительно хлорид натрия.
Для диссоциирования агрегатов MMP-7 в мономерные MMP-7 применена низкая концентрация моновалентного катионного соединения. MMP-7, диссоциированная в мономеры, сохраняется в виде мономеров в растворе для мономеризации, содержащем низкую концентрацию моновалентного катионного соединения. Такой же эффект может быть получен посредством применения раствора для мономеризации или воды, не содержащей моновалентное катионное соединение. Следовательно, настоящее изобретение охватывает способ мономеризации агрегатов MMP-7 с применением раствора для мономеризации, при этом раствор содержит жидкость, такую как вода в соответствии с настоящим изобретением, не содержащую моновалентное катионное соединение. Далее в настоящем описании, раствор, содержащий низкую концентрацию моновалентного катионного соединения, и раствор, не содержащий моновалентное катионное соединение, также совместно называются просто "раствор для мономеризации".
Посредством добавления поливалентного катионного соединения в раствор для мономеризации диапазон концентраций моновалентного катионного соединения, которые могут быть обработаны, может быть увеличен. Поливалентное катионное соединение предпочтительно является двухвалентным катионным соединением, более предпочтительно соединением двухвалентного иона кальция, и наиболее предпочтительно хлоридом кальция. Подобно моновалентному катионному соединению "поливалентное катионное соединение" означает соединение, состоящее из поливалентного катиона и соответствующего аниона.
Более конкретно в случае, когда в качестве раствора для мономеризации бывает применена вода, бывает применено моновалентное катионное соединение при 40 мМ или менее, и посредством добавления хлорида кальция в раствор для мономеризации становится возможна обработка с раствором для мономеризации, содержащим моновалентное катионное соединение при более чем 40 мМ. Более конкретно может быть применен раствор для мономеризации, содержащий моновалентное катионное соединение при 80 мМ или менее, когда он содержит от 5 мМ до 10 мМ хлорида кальция, раствор, содержащий моновалентное катионное соединение при 100 мМ или менее, когда он содержит 10 мМ до 30 мМ хлорида кальция, и раствор, содержащий моновалентное катионное соединение при 130 мМ или менее, когда он содержит 30 мМ хлорида кальция. Этот результат демонстрирует, что посредством добавления хлорида кальция, был усилен эффект диссоциации агрегатов MMP-7 в мономеры и супрессорный эффект на формирование агрегата MMP-7. Кроме того, как видно из результатов примера 2 (Фиг. 2), этот эффект пропорционален концентрации хлорида кальция. То есть посредством применения более высокой концентрации хлорида кальция, можно ожидать более высокие эффекты мономеризации MMP-7 и сохранение мономеров MMP-7. Исходя из вышеприведенного концентрация моновалентного катионного соединения составляет 130 мМ или менее, предпочтительно 100 мМ или менее, более предпочтительно 80 мМ или менее, и наиболее предпочтительно 40 мМ или менее, в случае водного раствора. Хотя раствор для мономеризации может не содержать моновалентное катионное соединение, раствор, содержащий моновалентное катионное соединение, предпочтителен с точки зрения качества фармацевтической композиции.
В соответствии с настоящим изобретением может предпочтительно быть применен раствор для мономеризации, состоящий из Трис-буфера от 5 до 25 мМ (pH 6-8), содержащего от 30 до 40 мМ хлорида натрия и от 5 до 30 мМ хлорида кальция или раствор для мономеризации без хлорида натрия.
Способ мономеризации агрегатов MMP-7 по настоящему изобретению может быть включен в процесс производства MMP-7, так чтобы эффективно продуцировать мономеры MMP-7 высокого качества. Общий процесс для продуцирования MMP-7 посредством рекомбинантных ДНК технологий осуществлен посредством этапов культивирования клеток, высвобождения тел включения, растворения и рефолдинга тел включения, очистки proMMP-7, превращения proMMP-7 в MMP-7 посредством самоактивации, очистки и концентрации MMP-7.
Более конкретно, способ мономеризации агрегатов MMP-7 по настоящему изобретению бывает применен в процессе производства MMP-7, как описано далее. Сперва приготовлена E. coli, продуцирующая proMMP-7. В целом, она может быть приготовлена введением гена proMMP-7, встроенного в экпрессионный вектор, в E. coli посредством обычной процедуры. Однако, так как proMMP-7 имеет сильную токсичность против E. coli, продуктивность может быть сильно снижена. Для того, чтобы решить эту задачу разработано добавление сигнального пептида на N-конец proMMP-7. Однако, в случае proMMP-7, наблюдались явления, заключающееся в том, что уровень экспрессии proMMP-7 повышен не просто посредством добавления сигнального пептида, и экпрессированный участок proMMP-7 бывает расщеплен. Такие явления могут представлять препятствие для создания процесса для эффективного продуцирования MMP-7. Следовательно, в качестве исходного материала для продуцирования MMP-7, предпочтительно применять E. coli, продуцирующую proMMP-7, которая имеет увеличенный уровень экспрессии proMMP-7 и увеличенную супрессию разложения протеазами proMMP-7. Такая E. coli, продуцирующая proMMP-7, может быть приготовлена посредством способа, описанного в WO2010/047347 (более конкретно, см. приготовление в нем).
Полученная таким образом E. coli, продуцирующая proMMP-7, после очистки посредством повторного клонирования сохранена в качестве работающего клеточного банка и применяется в качестве затравки для крупномасштабного культивирования для продуцирования препарата MMP-7. Рабочий банк клеток может храниться при условиях, обычно применяемых для сохранения рекомбинантной E. coli, напр., в растворе, содержащем от 7 до 10% диметилсульфоксида или от 10 до 50% глицерина в морозильнике при от -80° до -20°C или в жидком азоте или лиофилизированным в ампуле для хранения в холодильнике при от 2 до 10°C.
Культивирование E. coli, продуцирующей proMMP-7 в промышленном масштабе, осуществлено в две стадии, т.е., предкультура в маленьком масштабе и основная культура в большом масштабе. Для предкультуры для размножения E. coli, продуцирующей proMMP-7, может быть применена среда LB обычно применяемая для рекомбинантных E. coli, необязательно дополненная с антибиотиками, такими как ампициллин, для сохранения плазмиды. Однако, в качестве основной культуры предпочтительно применена культуральная среда, из которой извлечено вещество, вызывающее побочные эффекты, настолько, насколько это возможно. Такая культуральная среда содержит, к примеру, глюкозную среду, содержащую различные рассеянные металлы, такие как магний, кальций, медь и натрий, среду LB, среду M9 и тому подобное. Культуральные условия могут являться приспобленными для размножения E. coli, к примеру, культуральные условия pH (pH 6-8), температура (от 30° до 45°C) и время (4 до 16 часов). Эти культуральные условия могут быть пригодным образом отрегулированы в зависимости от культурального масштаба и обработки для индукции экспрессии. Индуктор экспрессии бывает применен для эффективной экспрессии proMMP-7 и содержит изопропил-β-тиогалактопиранозид (IPTG), лактозу и тому подобное.
Для выделения MMP-7 из E. coli, продуцирующей proMMP-7, культивируемой и размноженной в большом количестве после основного культивирования, осуществляли процедуры, описанные ниже. Во-первых, E. coli, продуцирующую proMMP-7, культивировали и размноженные клетки разрушали пригодным средством для высвобождения из клеток тел включения, состоящих из proMMP-7. Для разрушения клеток могут быть применены лизис с химическим веществом (напр., EDTA в качестве хелатирующего агента), поверхностно-активное вещество (напр., Triton X100) и фермент (напр., лизоцим) или физическая обработка с Френч-прессом, обработка ультразвуком и тому подобное. Посредством комбинирования нескольких из этих процедур клетки могут быть разрушены более эффективно. Раствор, полученный после разрушения клеток, включающий тела включения, подвергается фракционированию с ультрафильтрационной мембраной или центрифугой для повторяемости концентраций и промыванию для удаления большинства из клеточных компонентов. Для промывания может быть применен обычно применяемый буфер, такой как Трис-буфер, фосфатный буфер, глициновый буфер, бикарбонатный буфер. Существует много сообщений о размере пор ультрафильтрационной мембраны и условий центрифугирования, на которые может быть осуществлена ссылка. В случае обработки в большом количестве тела включения предпочтительно выделены фракционированием с ультрафильтрационной мембраной.
Выделенные тела включения временно растворены в растворе, содержащем восстанавливающий агент и денатурирующий агент. Для такого восстанавливающего агента могут быть применены цистеин, глутатион, дитиотреитол, 2-меркаптоэтанол и тому подобное. Некоторое из этого может быть применено в комбинации. Концентрация восстанавливающего агента может зависеть от количества тел включения, которые должны быть растворены, и может быть в диапазоне от 10 до 200 мМ. В качестве денатурирующего агента могут быть применены мочевина, гуанидин гидрохлорид и тому подобное. Мочевина и гуанидингидрохлорид могут быть применены в концентрации от 4 до 8M и от 2 до 6M, соответственно. В качестве буфера может быть применен буфер, который бывает применен для выделения тел включения такой как, к примеру, фосфатный буфер и Трис-буфер (pH 7,0 до 9). Температура при растворении не ограничена особым образом при условии, что она составляет 40°C или ниже. Время растворения может быть установлено, в зависимости от условий растворения тел включения. Обычно, раствор перемешивают в течение от 30 минут до 1 часа.
Затем выполнен рефолдинг proMMP-7, т.е., конструирование нормальной пространственной структуры посредством добавления рефолдинг-буфера, содержащего поверхностно-активное вещество и ионы металла для растворения тел включения. Применяли Brij 35 в качестве поверхностно-активного вещества и ацетат цинка или хлорид кобальта в качестве ионов металла в концентрации от 0,5 до 2% и от 0,05 мМ до 0,2 мМ, соответственно. Вид и концентрация буфера, применяемого для рефолдинга, могут быть такими же, как применяемые, когда растворены тела включения. Обработка для рефолдинга осуществлена посредством оставления раствора в покое в течение дня или более.
Для очистки proMMP-7 из раствора для рефолдинга могут быть применены в комбинации процедуры очистки обычно, применяемые в химии белка, такие как центрифугирование, высаливание, ультрафильтрация, изоэлектрическое осаждение, электрофорез, ионообменная хроматография, гельфильтрационная хроматография, аффинная хроматография, гидрофобная хроматография, гидроксиапатитовая хроматография и тому подобное. proMMP-7 в настоящем изобретении может быть очищена этапами, состоящими из ионообменной хроматографии, гидрофобной хроматографии и обработки с ультрафильтрационной мембраной. Обе хроматографии могут быть осуществлены обычным образом. Количество полученных белков и полипептидов может быть измерено с реагентом для измерения количества белка, таким как Набор BCA Protein Assay Reagent (Pierce Biotechnology, Inc) и Набор Protein Assay (BIO-RAD, Inc).
Затем осуществлено превращение proMMP-7 в MMP-7. Способ для превращения содержит нагревание раствора, содержащего proMMP-7 при 37°C в присутствии 1 мМ (4-аминофенил)ацетата ртути (APMA) или 0,2 мкМ трипсина или нагревание раствора, содержащего proMMP-7 при 53°C (Crabbe et al., Biochemistry, 1992, vol.31, 8500-8507), может быть применен любой из способов. В это время может необязательно быть добавлено от 30 до 200 мМ хлорида натрия (Crabbe et al., Biochemistry, 1992, vol.31, 8500-8507, WO 2010/047347 A1). Время нагревания находится в диапазоне от 1 до 5 часов и пригодным образом отрегулировано в зависимости от концентрации и количества, которое должно быть обработано реагента и proMMP-7. В качестве трипсина может быть применен обработанный с N-тозил-L-фенилаланинхлорметилкетоном (TPCK).
Для измерения ферментативной активности MMP-7 расщепление флуоресцентного субстрата (Dnp-Pro-Leu-Gly-Leu-Trp-Ala-D-Arg-NH2; SEQ ID NO: 7) посредством MMP-7 может быть измерено с прибором для измерения флуоресценции (Crabbe et al., Biochemistry, 1992, vol.31, 8500-8507). На практике набор для измерения активности MMP-7 (ANASPEC) на основании вышеприведенного принципа коммерчески доступен. Таким образом, активность может быть измерена с применением этого набора в соответствии с протоколом, прилагаемым к нему. Для выделения и очистки MMP-7, полученной из proMMP-7, могут быть применены процедуры очистки белка, как описано выше.
MMP-7 после превращения образует агрегаты в растворе, содержащем высокую концентрацию соли. Это более вероятно происходит в случае, если концентрации MMP-7 в растворе составляет 1 мг/мл или более. Наличие агрегатов MMP-7 приводит к снижению продуктивности и качества, когда MMP-7 произведен и приготовлен в препарат MMP-7. Как описано выше, агрегаты MMP-7 бывают мономеризированы и мономеры MMP-7 бывают сохранены в растворе для мономеризации, содержащем моновалентное катионное соединение при 130 мМ или менее в присутствии хлорида кальция. Однако, предположено, что в растворе, содержащем моновалентное катионное соединение в концентрации более чем 130 мМ, возможность образовывать агрегаты MMP-7 является высокой. Следовательно, способ мономеризации по настоящему изобретению включен после обработки с моновалентным катионным соединением при 130 мМ или более. Более конкретно, он включен непосредственно после превращения proMMP-7 в MMP-7 посредством самоактивации.
Обработку способом мономеризации по настоящему изобретению предпочтительно осуществлять по отношению к MMP-7 при 20 мг/мл или менее. Однако, когда MMP-7 при 20 мг/мл или более бывает обработан, как описано выше, такой же супрессорный эффект на формирование агрегата MMP-7 можно ожидать при регулировании концентрации хлорида кальция.
Раствор, содержащий приготовленные таким образом мономеры MMP-7, после этапов очистки и концентрации MMP-7 посредством ультрафильтрационной мембраны при необходимости бывает применен в качестве исходного материала для продуцирования препарата MMP-7. В этапах также может быть применен раствор для мономеризации по настоящему изобретению. Когда MMP-7 мономеризирован, мономеры MMP-7 бывают сохранены поскольку они представлены в растворе для мономеризации и снижение ферментативной активности не наблюдается в течение длительного промежутка времени. Таким образом, раствор для мономеризации по настоящему изобретению может быть применен для сохранения MMP-7 перед продуцированием препарата MMP-7 и для производства композиции (фармацевтической), содержащей MMP-7 в качестве активного ингредиента, чтобы посредством этого предоставить возможность сохранения MMP-7 высокого качества.
В способе мономеризации агрегатов MMP-7 и процессе для приготовления MMP-7, который задействует указанный способ мономеризации настоящего изобретения, сахарные спирты и сахара проявляют супрессорный эффект на адсорбцию MMP-7 к гелю, широко применяемому в производстве MMP-7, и супрессорный эффект на адсорбцию MMP-7 к стенке флакона, применяемого для продуцирования препарата MMP-7. Такие сахарные спирты и сахара содержат сахарозу, лактозу, мальтозу, ксилозу, трегалозу, маннит, сорбит, ксилит, мальтит, лактит, олигосахаридные спирты и тому подобное, предпочтительно маннит и сахарозу и наиболее предпочтительно маннит.
В случае, если приготовлена низкая концентрация (напр., 1 мкг/мл до 1 мг/мл) MMP-7 для приготовления препарата MMP-7, бывает предусмотрена потеря MMP-7 из-за его адсорбции к стенке флакона и таким образом особенно эффективно, чтобы раствор для мономеризации содержал сахарные спирты и сахара, как описано выше. В случае MMP-7 сахарные спирты или сахара бывают добавлены при 2% или более, когда супрессорный эффект на адсорбцию к стенке флакона бывает проявлен или при от 2 до 7%, когда осмотическое давление в организме может быть отрегулировано. В соответствии с настоящим изобретением бывает применен раствор для мономеризации, который содержит от 2 до 5% маннита или от 2 до 7% сахарозы, при этом активность MMP-7 может быть сохранена. Более предпочтительно бывает применен раствор для мономеризации, который состоит из Трис-буфера от 5 до 25 мМ (pH 6-8), содержащего от 2 до 5% маннита, 30 до 40 мМ хлорида натрия и от 5 до 30 мМ хлорида кальция.
MMP-7, растворенный в указанном растворе для мономеризации, может быть применен в таком виде в качестве композиции (фармацевтической), содержащей MMP-7 настоящего изобретения. Композиция (фармацевтическая), содержащая MMP-7, предпочтительно содержит 2% или более сахарных спиртов и/или сахара и моновалентное катионное соединение (хлорид натрия или хлорид кальция) при от 30 до 40 мМ с точки зрения супрессии образования агрегатов MMP-7, сохранение активности MMP-7, супрессии на адсорбцию MMP-7 к контейнеру и обеспечивая качество в виде водной фармацевтической композиции. Более конкретно, в случае, если концентрация MMP-7 составляет 20 мг/мл или менее, композиция (фармацевтическая), содержащая MMP-7 по настоящему изобретению, предпочтительно содержит от 2 до 5% маннита или от 2 до 7% сахарозы, от 30 до 40 мМ хлорида натрия и от 5 до 30 мМ хлорида кальция. Композицию (фармацевтическую), содержащую MMP-7 по настоящему изобретению, можно хранить в жидкой, лиофилизированной или замороженной форме. С этой целью для того, чтобы сохранить безопасность и изотоничность в виде лекарства, композиция (фармацевтическую), содержащая MMP-7, дополнительно дополнена с соединением, которое разрешено для введения людям и другим животным, таким как стабилизирующий агент, изотонизирующий агент и консервант. Композиция (фармацевтическая), содержащая MMP-7 по настоящему изобретению, может содержать твердую композицию, которая может быть растворена в растворителе, и композиция при растворении представляет собой жидкую композицию (фармацевтическую), содержащую MMP-7 по настоящему изобретению, как описано выше. Твердая композиция получена удалением растворителя из жидкой композиции (фармацевтической), содержащей MMP-7 по настоящему изобретению, посредством лиофолизации. Растворитель является таким, как определенный в качестве растворителя в словаре фармацевтических вспомогательных веществ, и содержит воду, этанол и тому подобное
Полученная таким образом композиция (фармацевтическая), содержащая MMP-7 по настоящему изобретению, имеет специфическую ферментативную активность MMP-7 с супрессией формирования агрегата MMP-7 и супрессией адсорбции и может быть применена в качестве медицинского средства для лечения или диагностирования смещения межпозвоночного диска.
Настоящее изобретение дополнительно разъяснено в больших подробностях посредством следующих примеров, но не должно считаться ограничиваемым ими.
Пример приготовления
(1) Конструкция экпрессионного вектора proMMP-7 (pET MMP7) с APSP
Применяя праймеры P1 (SEQ ID NO: 1) и P2 (SEQ ID NO: 2), амплифицировали ген proMMP-7 в библиотеке почечной кДНК(HumanMTC Panel I, Catalog#: K1420-1 BD) посредством ПЦР. Амплифицированные ДНК встраивали в клонирующий вектор (ПЦРII-TOPO, Invitrogen) и определяли нуклеотидные последовательности полученных ДНК. Определение нуклеотидных последовательностей осуществляли с секвенатором ДНК. Осуществляли поиск гомологии между определенными нуклеотидными последовательностями и нуклеотидной последовательностью proMMP-7, зарегистрированной в базе данных, (Accession Numbers: НМ002423), для получения плазмиды (pCRproMMP-7), в которую был встроен ген proMMP-7.
Затем, выполняли ПЦР, применяя PCRproMMP-7 в качестве матрицы и праймер P3 (SEQ ID NO: 3), который состоит из последовательности распознавания рестрикционным ферментом NdeI, нуклеотидной последовательности кодирующей последовательности сигнального пептида (APSP) PhoA-щелочной фосфотазы и N-терминальной последовательности proMMP-7, и праймер P4 (SEQ ID NO: 4), который состоит из последовательности распознования рестрикционным ферментом BamHI и C-терминальной последовательности proMMP-7. ДНК, амплифицированные, как представлено выше, встраивали в клонирующий вектор и определяли нуклеотидные последовательности полученных ДНК. После подтверждения того, что не происходило изменение нуклеотидной последовательности, полученную плазмиду расщепляли с рестрикционными ферментами NdeI и BamHI и полученный фрагмент встраивали в экпрессионный вектор pET22b (Merck, product cord; 69744-3), предварительно расщепленный с такими же рестрикционными ферментами с получением плазмиды (pET MMP7), куда был встроен ген proMMP-7.
(2) Конструирование экпрессионного вектора pETMMP7(L13P-A21E) с модифицированным APSP и экспрессия
Применяя систему для сайт-направленного мутагенеза GeneTailor (Invitrogen) в соответствии с протоколом, прилагаемым к ней, вводили мутацию в последовательность распознавания сигнальной пептидазой последовательности APSP (Met-Lys-Gln-Ser-Thr-Ile-Ala-Leu-Ala-Leu-Leu-Pro-Leu-Leu-Phe-Thr-Pro-Val-Thr-Lys-Ala; SEQ ID NO: 8) в pETMMP7, полученную в (1) выше, [лейцин (Leu) в положении 13 аминокислотной последовательности APSP был замещен с пролином (Pro) и аланин (Ala) в положении 21 был замещен с глутаминовой кислотой (Glu)]. Для модификации APSP применяли последовательности M2 (SEQ ID NO: 5) в качестве 5' праймера и P6 (SEQ ID NO: 6) в качестве 3' праймера. E. coli была трансформирована с полученной pETMMP7(L13P-A21E) с модифицированным APSP с получением рекомбинантной E. coli (MMP7L13P-A21E), экспрессирующий proMMP-7.
Индукцию экспрессии осуществляли с Overnight Express Autoinduction System 1 (Merck; product cord 71300-3) в соответствии с протоколом, прилагаемым к ней. Кратко, каждую колонию суспендировали в 50 мл среды LB, содержащей 50 мкг/мл ампициллина (Wako Pure Chemical Industries, Ltd.) в 125 мл колбе Эрленмейера, реагенты набора добавляли и колбу инкубировали при 37°C в течение 16 часов. Измеряли OD 600нм клеточной суспензии и собирали 1 мл клеток, соответствующих OD 600нм=20, в осадках посредством центрифуги. Осадки разрушали с 200 мкл BugBuster и центрифугировали с получением осадков. Осадки солюбилизировали с буфером для образца для электрофореза в полиакриломидном геле с добавлением ДСН (ДСН-ПААГ-электрофорез), подвергали ДСН-ПААГ-электрофорезу в 15% акриломидном геле и осуществляли окрашивание с CBB. В результате было подтверждено возрастание уровня экспрессии proMMP-7 и усиление супрессорных эффектов на разложение.
В этом примере приготовления применяли праймеры со следующими последовательностями.
P1: ccataggtcc aagaacaatt gtctctg (SEQ ID NO: 1)
P2: caatccaatg aatgaatgaa tggatg (SEQ ID NO: 2)
P3: catatgaaac aaagcactat tgcactggca ctcttaccgt tactgtttac ccctgtgacc aaggccctgc cgctgcctca g (SEQ ID NO: 3)
P4: ggatccctat ttctttcttg aattac (SEQ ID NO: 4)
M2: ctgtttaccc ctgtgaccaa ggaactgccg ctgcc (SEQ ID NO: 5)
P6: cttggtcaca ggggtaaaca gtggcggtaa gag (SEQ ID NO: 6)
Пример 1
Супрессорный эффект на формирование агрегата MMP-7 хлоридом моновалентного катиона
(1) Производство MMP-7
E. coli (MMP7L13P-A21E), экспрессирующую proMMP-7, полученную процедурами, описанными в примере приготовления, культивировали и размножали в виде посева в глюкозной среде и выполняли индукцию экспрессии proMMP-7 с изопропил-β-тиогалактопиранозидом (IPTG). Клетки выделяли из культурального раствора и разрушали с Френч-прессом. Полученный после разрушения клеток раствор центрифугировали и выделяли тела включения в осадках. Затем, тела включения растворяли в 6M гуанидингидрохлориде, содержащем 0,1 M Tris-HCl (pH 7,5) и 0,1 M дитиотреитола, и рефолдировали с 50 мМ буфером HEPES (pH 7,5), содержащем 0,1 мМ ацетат цинка, 10 мМ хлорида кальция, 0,2 M хлорид натрия и 1,0% Brij 35. Впоследствии, proMMP-7 очищали ионообменной хроматографией и гидрофобной хроматографией обычным образом. Полученный proMMP-7 нагревали при от 47° до 48°C для самоактивации с получением MMP-7. Полученный MMP-7 подвергали повторению разбавления и концентрации с ультрафильтрационной мембраной, применяя 5 мМ Трис-буфер (pH 7), содержащий 40 мМ NaCl, 10 мМ CaCl2 и 3,5% маннит и хранили при -80°C.
(2) Измерение агрегатов MMP-7
Раствор, содержащий высокую концентрацию MMP-7, полученную в (1) выше, разбавляли с водным раствором, содержащим 5 мМ хлорида кальция (CaCl2), в котором хлорид натрия (NaCl) или хлорид калия (KCl) растворяли для приготовления образца 1 и образца 2.
Образец 1: 1 мг/мл MMP-7/5 мМ CaCl2/каждая концентрация NaCl (10 до 160 мМ)
Образец 2: 1 мг/мл MMP-7/5 мМ CaCl2/каждая концентрация KCl (10 до 160 мМ)
Применяя каждые 100 мкл представленных выше образцов, исследовали эффект хлорида натрия и хлорида калия на образование агрегатов MMP-7 посредством динамического рассеяния света (устройство; Wyatt Technology DynaPro (Protein Solutions) Titan, cell; Wyatt Technology 12uL Cell 8.5mm Centre Height, температура; 20°C). Молекулярную массу MMP-7 в каждом образце измеряли и анализировали. MMP-7 с молекулярной массой 38 кДа или менее считали являющейся мономерной на основании молекулярной массы мономеров MMP-7 (приблизительно 19 кДа). В результате молекулярная масса MMP-7 в растворе от 10 мМ до 80 мМ NaCl составляла от 20 до 29 кДа, что указывало на то, что MMP-7 был представлен как мономер. Подобным образом, когда применяли хлорид калия, получали такие результаты, что MMP-7 был представлен в виде мономера в растворе с от 10 мМ до 80 мМ KCl (Фиг. 1). Пунктирная линия на фигуре демонстрирует молекулярную массу 38 кДа.
Пример 2
Эффект хлорида кальция на супрессию образования агрегата MMP-7
Раствор MMP-7, полученный в примере 1-(1), разбавляли с водным раствором, в котором растворяли хлорид кальция и хлорид натрия для приготовления образца 3.
Образец 3: 1 мг/мл MMP-7/каждая концентрация CaCl2 (от 0 до 30 мМ)/каждая концентрация NaCl (от 0 до 160 мМ)
Исследовали эффект наличия каждой концентрации хлорида кальция на супрессию формирования агрегата MMP-7, как описано в примере 1-(2).
В результате, было продемонстрировано, что мономер MMP-7 был образован с 40 мМ или менее NaCl в случае 0 мМ CaCl2, с 80 мМ или менее NaCl в случае 5 мМ CaCl2, с 100 мМ или менее NaCl в случае 10 мМ CaCl2, с 120 мМ или менее NaCl в случае 20 мМ CaCl2, и с 130 мМ или менее NaCl в случае 30 мМ CaCl2. Кроме того, также в случае разбавления только с водой наблюдали образование мономера MMP-7. Таким образом, было выявлено, что агрегаты MMP-7 были образованы в присутствии 130 мМ или более NaCl, но совместное присутствие 30 мМ или менее (вплоть до 30 мМ) CaCl2 подавляло образование мономеров MMP-7. Именно, эта концентрация хлорида кальция имеет более эффективный эффект поддержания и стабилизации мономеров MMP-7 (Фиг. 2).
Пример 3
Эффект концентрации MMP-7 на образование агрегата MMP-7
Раствор MMP-7, полученный в примере 1-(1), разбавляли с раствором, содержащим 10 мМ CaCl2 и каждую концентрацию хлорида натрия для приготовления образца 4, содержащего каждую концентрацию MMP-7.
Образец 4: каждая концентрация MMP-7 (10, 15, 20 мг/мл)/10 мМ CaCl2/каждая концентрация NaCl (50 до 250 мМ)
Эффект концентрации MMP-7 на супрессорный эффект на формирование агрегата MMP-7 исследовали посредством гель-проникающей хроматографии (устройство HPLC; HEWLETT PACKED 1100 series, носитель; TOYOPARL HW50S, температура; 25°C, скорость потока 0,5 мл/мин, длина волны 280 нм). Размеры колонки составляли: диаметр 5 мМ и длина 150 мМ, и уравновешивание колонки проводили с раствором, содержащим 5 мМ Tis-HCl (pH 7), 10 мМ CaCl2, 3,5% маннита и 40 до 500 мМ NaCl.
При этих условиях белки с молекулярной массой от 60 кДа до 80 кДа появляются в свободном объеме (1,8 минут после инициации хроматографии). Таким образом, пик в приблизительно 2 минуты после инициации хроматографии (или главный пик) считали являющимся агрегатами MMP-7 и, применяя площадь пика в качестве индекса, рассчитывали концентрацию хлорида натрия, с которой были образованы агрегаты MMP-7.
В результате, было обнаружено, что хотя супрессорный эффект хлорида натрия на формирование агрегата MMP-7 был ослаблен в зависимости от концентрации MMP-7, MMP-7 была представлена в виде мономеров с от 0 до 80 мМ NaCl в случае MMP-7 при 20 мг/мл или менее (Фиг. 3). Из результатов примера 2 (Фиг. 2), очевидно, что концентрация хлорида натрия, с которой мономеры MMP-7 бывают сохранены, возрастает пропорционально с возрастанием концентрации хлорида кальция. В настоящем примере, если применено 30 мМ CaCl2, предположено, что MMP-7 при 20 мг/мл существует в виде мономеров даже в присутствии 100 мМ NaCl. Кроме того, когда применена MMP-7 при больше чем 20 мг/мл, предположено, что MMP-7 может быть сохранена в виде мономеров посредством увеличения концентрации хлорида кальция.
Такой же эксперимент, как приведено выше, проводили после того, как образец 4 оставляли при 4°C в течение ночи с получением таких же результатов как на фиг. 3.
Пример 4
Эффект формирования агрегата MMP-7 на ферментативную активность
Раствор MMP-7, полученный в примере 1-(1), разбавляли с 5 мМ Трис-буфером (pH 7), содержащим 40 мМ NaCl и 10 мМ CaCl2, для приготовления образца 5, содержащего каждую концентрацию MMP-7.
Образец 5: каждая концентрация MMP-7 (0,1, 2, 20 мг/мл)/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH7)
Растворы, содержащие каждую концентрацию MMP-7, разбавляли до 0,1 мг/мл с 50 мМ Трис-буфером (pH 7), содержащим 150 мМ NaCl и 10 мМ CaCl2 или 10 мМ Трис-буфером (pH 7), содержащим 40 мМ NaCl и 10 мМ CaCl2 (первичное разбавление) и дополнительно разбавляли до 5 нг/мл с 50 мМ Трис-буфером (pH 7), содержащим 150 мМ NaCl и 10 мМ CaCl2 (вторичное разбавление). Для полученных в результате разбавлений измеряли активность расщепления флуоресцентного субстрата (Dnp-Pro-Leu-Gly-Leu-Trp-Ala-D-Arg-NH2; SEQ ID NO: 7), применяя набор для измерения активности MMP-7 (ANASPEC) в соответствии с протоколом, прилагаемым к нему.
В результате ферментативная активность была снижена для MMP-7 при 2 мг/мл или более, разбавленном с Трис-буфером (pH7), содержащим 150 мМ NaCl в первичном разбавлении (Фиг. 4). Это снижение ферментативной активности соотносится с образованием агрегата MMP-7. С другой стороны при концентрациях 0,1 мг/мл или менее не наблюдалось снижения ферментативной активности, что предполагает, что формирование агрегата посредством 150 мМ NaCl не происходило при этой концентрации MMP-7.
Пример 5
Эффект концентрации хлорида натрия на этап концентрации MMP-7 посредством ультрафильтрационной мембраны
Раствор MMP-7, полученный в примере 1-(1), разбавляли с 5 мМ Трис-буфером (pH 7), содержащим 10 мМ CaCl2, для приготовления образца 6, содержащего каждую концентрацию хлорида натрия.
Образец 6: 4 мг/мл MMP-7/10 мМ CaCl2/каждая концентрация NaCl (40 мМ, 80 мМ, 200 мМ, 500 мМ)/5 мМ Трис-буфер (pH 7)
Каждые 4 мл образца 6 концентрировали с центрифугой (2500 g), применяя ультрафильтрационную мембрану (Amicon Ultra-4 10K) и объем фильтрата и абсорбционную способность концентрата при постоянном временном интервале.
В результате MMP-7 мог быть сконцентрирован за более короткое время, когда применяли более низкую концентрацию хлорида натрия, тогда как требовалось более длительное время для концентрации, когда применяли более высокую концентрацию хлорида натрия (Таблица 1). В таблице 1 символ (-) обозначает окончание концентрации.
Таблица 1
|
Пример 6
Супрессорный эффект маннита на адсорбцию MMP-7
(1) Супрессия на адсорбцию MMP-7 к гелю
Раствор MMP-7, полученный в примере 1-(1), разбавляли с 5 мМ Трис-буфером (pH 7), содержащим 10 мМ CaCl2 и 40 мМ NaCl, для приготовления образца 7.
Образец 7: 5,5 мг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl
Образец 7 (1 мл) наносили на колонку (HW40F, 26×6см, Tosoh Corporation) предварительно уравновешенную с 5 мМ Трис-буфером (pH 7), содержащим 10 мМ CaCl2 и 40 мМ NaCl, и после промывания с Трис-буфером, элюировали с Трис-буфером, содержащим 3,5% маннита (скорость потока: 5 мл/мин).
В результате, MMP-7, абсорбированный к гелю, элюировали маннитом (Фиг. 5). Этот результат предполагает, что маннит имеет супрессорный эффект на адсорбцию MMP-7 к гелю.
(2) Супрессия на адсорбцию MMP-7 к стенке контейнера
Раствор MMP-7, полученный в примере 1-(1), разбавляли с 5 мМ Трис-буфером (pH 7), содержащим 10 мМ CaCl2, 40 мМ NaCl и маннит или сахарозу для приготовления растворов (1 мл) образцов 8 до 10 во флаконах. Концентрации регулировали так, чтобы каждый образец имел одинаковое осмотическое давление. Контролем являлся раствор MMP-7, разбавленный с Трис-буфером, не содержащим маннит и сахарозу (Образец 10).
Образец 8: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH 7)/3,5% маннит
Образец 9: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH 7)/6.6% сахароза
Образец 10: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH 7)
После оставления при комнатной температуре в течение 3 часов, каждый раствор во флаконах разбавляли в два этапа. Для первичного разбавления применяли 5 мМ Трис-буфер (pH 7), содержащий 10 мМ CaCl2 и 40 мМ NaCl. Для вторичного разбавления применяли 1% Block Ace (Block Ace powder: DS Pharma Biomedical)/TBS-T (0,05% Tween20/50 мМ Tris/150 мМ NaCl). MMP-7 в растворе определяли количественно посредством ELISA. Для ELISA применяли кроличье анти-MMP-7 антитело, полученное иммунизацией кролика с MMP-7, меченное биотином кроличье анти-MMP-7 антитело, при этом кроличье анти-MMP-7 антитело метили с биотин-метящим реагентом (Biotin (Long Arm) NHS-Water Soluble: Vector Laboratories), меченный пероксидазой хрена (HRP) стрептавидин (Концентрат пероксидаза хрена стрептавидин: Vector Laboratories) и HRP субстрат раствор (субстрат пероксидазы раствор B: KPL). В качестве контроля для реакции ELISA применяли стандарт MMP-7 для ELISA с фиксированной концентрацией MMP-7. Концентрацию MMP-7 рассчитывали посредством измерения поглощения.
В результате по сравнению с образцом без добавления (Образец 10), была продемонстрирована более высокая степень выделения MMP-7, когда добавляли маннит (Образец 8) или сахарозу (Образец 9) для подтверждения их супрессорного эффекта (Фиг. 6).
Затем исследовали эффективную концентрацию маннита или сахарозы для супрессии абсорбции MMP-7 к стенке контейнера и эффект маннита или сахарозы на ферментативную активность MMP-7. Раствор MMP-7, полученный в примере 1-(1), разбавляли с 5 мМ Трис-буфером (pH 7), содержащим 10 мМ CaCl2, 40 мМ NaCl и маннит или сахарозу для приготовления раствора (1 мл) образцов с 12 по 16 в флаконах. Контролем являлся раствор MMP-7, разбавленный с трис-буфером, не содержащим маннит и сахарозу (Образец 11).
Образец 11: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH 7)
Образец 12: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH7)/1% маннит
Образец 13: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH7)/2% маннит
Образец 14: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH7)/2% сахароза
Образец 15: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH7)/5% маннит
Образец 16: 50 мкг/мл MMP-7/10 мМ CaCl2/40 мМ NaCl/5 мМ Трис-буфер (pH7)/7% сахароза
После оставления при комнатной температуре в течение 3 часов каждый раствор во флаконах разбавляли в два этапа. Каждый раствор во флаконах разбавляли с раствором для первичного разбавления 50 мМ Трис-буфера (pH 7), содержащим 0,01% Briji35, 0,01% BSA, 150 мМ NaCl и 10 мМ CaCl2 до 5 нг/мл и измеряли активность расщепления флуоресцентного субстрата (ферментативная активность MMP-7), как в примере 4. В этом эксперименте применяли флуоресцентный субстрат, полученный у PEPTIDE INSTITUTE, INC. (MOCAc-Pro-Leu-Gly-Leu-A2pr(Dnp)-Ala-Arg-NH2;(7-метоксикумарин-4-ил)ацетил-L-пролил-L-лейцилглицил-L-лейцил-[Nβ-(2,4-динитрофенил)-L-2,3-диаминопропионил]-L-аланил-L-аргинина амид; SEQ ID NO: 9). Для вторичного разбавления применяли 1% Block Ace (Block Ace powder: DS Pharma Biomedical)/TBS-T (0,05% Tween20/50 мМ Tris/150 мМ NaCl) и измеряли концентрацию MMP-7 в растворе посредством ELISA, как указано выше.
В результате по сравнению с образцом без добавления (образец 11), была продемонстрирована более высокая степень выделения MMP-7, когда добавляли от 2 до 5% маннита (образцы 13, 15) или от 2 до 7% сахарозы (образцы 14, 15) для подтверждения их супрессорного эффекта на адсорбцию к стенке контейнера (Фиг. 7). Не наблюдали снижения ферментативной активности MMP-7 после добавления маннита или сахарозы (Фиг. 8).
Пример 7
Эффект маннита на супрессию образования агрегата MMP-7
Раствор MMP-7, полученный в примере 1-(1), подвергали замене буфера с 5 мМ Трис-буфером (pH 7), содержащим каждую концентрация NaCl, 5 мМ CaCl2 и 3,5% маннит, применяя спин-фильтр и затем разбавляли с Трис-буфером для приготовления образцов с 17 по 22. Контролем являлся раствор MMP-7, обработанный с Трис-буфером, не содержащим маннит (образец 17).
Образец 17: 10 мМ NaCl/1мг/мл MMP-7/5 мМ CaCl2
Образец 18: 10 мМ NaCl/1мг/мл MMP-7/5 мМ CaCl2/3,5% маннит
Образец 19: 40 мМ NaCl/1мг/мл MMP-7/5 мМ CaCl2/3,5% маннит
Образец 20: 80 мМ NaCl/1мг/мл MMP-7/5 мМ CaCl2/3,5% маннит
Образец 21: 120 мМ NaCl/1мг/мл MMP-7/5 мМ CaCl2/3,5% маннит
Образец 22: 180 мМ NaCl/1мг/мл MMP-7/5 мМ CaCl2/3,5% маннит
Молекулярную массу MMP-7 в каждом образце измеряли посредством динамического рассеяния света, как описано в примере 1-(2). В результате было продемонстрировано, что MMP-7 образовывал агрегаты с 40 мМ или более хлорида натрия (Фиг. 9).
Промышленная применимость
Способ для мономеризации агрегатов MMP-7 по настоящему изобретению может быть применен для производства MMP-7 и продуцирования препарата MMP-7.
--->
Список последовательностей
<110> THE CHEMO-SERO-THERAPEUTIC RESEARCH INSTITUTE
<120> Способ мономеризирования агрегата матриксной металлопротеиназы-7 (Mmp-7)
<130> 672389
<150> Патент Японии 2014-105452
<151> 2014-05-21
<160> 9
<170> PatentIn version 3.4
<210> 1
<211> 27
<212> ДНК
<213> Искусственная
<220>
<223> Праймер, примененный для клонирования гена проматриксной металлопротеиназы-7
<400> 1
ccataggtcc aagaacaatt gtctctg 27
<210> 2
<211> 26
<212> ДНК
<213> Искусственная
<220>
<223> Праймер, примененный для клонирования гена проматриксной металлопротеиназы-7
<400> 2
caatccaatg aatgaatgaa tggatg 26
<210> 3
<211> 81
<212> ДНК
<213> Искусственная
<220>
<223> Праймер, примененный для получения фрагмента ДНК, состоящего из сигнального пептида щелочной фосфатазы и проматриксной металлопротеиназы-7
<400> 3
catatgaaac aaagcactat tgcactggca ctcttaccgt tactgtttac ccctgtgacc 60
aaggccctgc cgctgcctca g 81
<210> 4
<211> 26
<212> ДНК
<213> Искусственная
<220>
<223> Праймер, примененный для получения фрагмента ДНК, состоящего из сигнального пептида щелочной фосфатазы и проматриксной металлопротеиназы-7
<400> 4
ggatccctat ttctttcttg aattac 26
<210> 5
<211> 35
<212> ДНК
<213> Искусственная
<220>
<223> Праймер, примененный для получения фрагмента ДНК, состоящего из модифицированного сигнального пептида щелочной фосфатазы и проматриксной металлопротеиназы-7
<400> 5
ctgtttaccc ctgtgaccaa ggaactgccg ctgcc 35
<210> 6
<211> 33
<212> ДНК
<213> Искусственная
<220>
<223> Праймер, примененный для получения фрагмента ДНК, состоящего из модифицированного сигнального пептида щелочной фосфатазы и проматриксной металлопротеиназы-7
<400> 6
cttggtcaca ggggtaaaca gtggcggtaa gag 33
<210> 7
<211> 7
<212> PRT
<213> Искусственная
<220>
<223> DNP-белок флуоресцентного субстрата, примененный для измерения активности MMP-7
<400> 7
Pro Leu Gly Leu Trp Ala Arg
1 5
<210> 8
<211> 21
<212> PRT
<213> Искусственная
<220>
<223> Аминокислотная последовательность сигнального пептида щелочной фосфатазы
<400> 8
Met Lys Gln Ser Thr Ile Ala Leu Ala Leu Leu Pro Leu Leu Phe Thr
1 5 10 15
Pro Val Thr Lys Ala
20
<210> 9
<211> 7
<212> PRT
<213> Искусственная
<220>
<223> MOCAc-белок луоресцентного субстрата, примененный для измерения активности MMP-7
<220>
<221> прочий_признак
<222> (5)..(5)
<223> Xaa=N-бета-(2,4-динитрофенил)-L-2,3-диаминопропионил
<400> 9
Pro Leu Gly Leu Xaa Ala Arg
1 5
<---