Результат интеллектуальной деятельности: Микрофлюидный чип смешения
Вид РИД
Изобретение
Настоящее изобретение относится к области микрофлюидной технологии, а именно к микрофлюидному чипу смешения.
Микрофлюидика - это междисциплинарная наука, включающая в себя такие разделы, как физика, гидродинамика, тепло- и массообмен, кинетика реакции, биология и инженерные дисциплины, вследствие чего при создании микрофлюидных устройств необходим комплексный подход.
Импульсом для активного развития этого направления стало создание микроэлектромеханических систем (MEMS - micro-electromechanical systems), получивших название микроэлектронные системы на кристалле/чипе (System-on-a-Chip) и позволяющих разместить несколько функциональных компонентов на одном микроустройстве, а также тенденция к миниатюризации, повышению производительности и чувствительности приборов для проведения химических и биологических процессов, аналитических процедур [Sackmann Е.K., Fulton A.L., Beebe D.J. The present and future role of microfluidics in biomedical research // Nature. 2014. Vol. 507. №7491. P. 181-189]. Главным отличием микрофлюидных систем от прочего распространенного сегодня аналитического лабораторного оборудования является использование микрообъемов жидкостей (порядка микролитров), что позволяет значительно снизить расход реагентов, электроэнергии, объем исследуемого вещества или биопробы и в совокупности позволяет уменьшить затраты на проведение различных процессов, анализов, исследований.
Благодаря возможностям микрофлюидных устройств (МФУ), связанным с массо- и теплопереносом, данное направление нашло множество практических приложений: при организации охлаждающей системы в высокопроизводительных микросхемах, по которым посредством микроканалов прокачивается охлаждающая жидкость; в аналитических системах различных видов для экспериментальных исследований; при синтезе микро- и наночастиц; в приборах для экспресс-тестирования с возможностью анализа одновременно нескольких веществ на одном микрочипе. Исходя из сказанного выше, микрофлюидика - это востребованное научное направление, нашедшее применение в различных областях: от интегральных схем (электронное охлаждение) и прикладной кристаллографии (рост кристаллов белков) до биологических и медицинских исследований (биологический анализ, химический синтез).
Микрофлюидный чип (микрореактор) - это устройство, которое объединяет одну или несколько функций при переходе от реагента к продукту или от пробы к анализу в единую комплексную систему размером от нескольких миллиметров до нескольких квадратных сантиметров [Demello A.J. Control and detection of chemical reactions in microfluidic systems // Nature. 2006. Vol. 442. №. 7101. P. 394-402.]. Микрофлюидный чип представляет собой компактное устройство, которое оперирует небольшим количеством жидкости (нано/микролитровыми объемами), используя каналы диаметром порядка десятков-сотен микрон. Топология и конструкция микрочипа определяется теми операциями, которые планируется реализовать с его использованием.
В простейшем случае МФЧ представляют собой конструкцию из двух герметично соединенных пластин: на одной пластине формируются микроканалы, реакторы, клапаны, электроды и другие необходимые функциональные элементы, другая пластина - защитная. Сеть микроканалов внутри МФЧ связана несколькими наружными отверстиями различных размеров (отверстия входа, выхода) с внешней средой. Через эти отверстия жидкости (или газы) впрыскиваются и удаляются из МФЧ (через трубки, переходники шприца или даже простые отверстия в чипе) с помощью внешних активных систем (регулятор давления, нажимной шприц или перистальтический насос) или пассивным путем (например, путем создания гидростатического давления).
Важной особенностью в обеспечении работы МФЧ является организация движения потоков жидкости (или газа) по микроканалам. Для точного управления жидкостями внутри микроканалов требуются специальные системы, которые могут быть встроены в МФЧ (например, Quake-клапаны), либо находиться снаружи (например, регуляторы давления). В общем случае способы и методы управления движением частиц и потоков в микрофлюидных устройствах можно классифицировать, исходя из природы воздействующего поля, побуждающего движение потоков и частиц: силовые поля (давление, разрежение, гравитация, центробежные силы и др.); электрические постоянные (электроосмос, электроротация и т.д.); электромагнитные поля (фотофорез, оптофорез, ээлектромагнитофорез, оптический пинцет); магнитные поля (магнитофорез и т.д.), ультразвуковые поля. Конструкция сети микроканалов должна быть точно разработана в зависимости от заданных функций МФЧ («лаборатория в чипе», обнаружение патогенных микроорганизмов, электрофорез, анализ ДНК и т.д.) [А.А. Евстрапов, Микрофлюидные чипы для биологических и медицинских исследований, Рос. хим. ж., 2011, т. LV6№2].
Возможно использование разнообразных материалов для производства МФЧ, таких, как полимеры (например, PDMS), керамика (например, стекло), полупроводники (например, кремний) и металлы.
Чипы, выполненные из стекла, отличаются высокой химической стойкостью, превосходной оптической прозрачностью и хорошими термическими свойствами. Поверхность сформированных в стекле каналов очень гладкая, шероховатость не превышает 8 нм. Кварцевое стекло сочетает очень высокую температурную стабильность (до 900°С) и химическую стойкость. Кроме того, оно обладает важными оптическими свойствами, прежде всего - однородностью и прозрачностью для УФ-излучения, что важно, например, для осуществления полимеризации. Металлические микрофлюидные чипы применяются в тех случаях, когда необходимо обеспечить быструю теплопередачу, высокое давление или электропроводность. Поверхность микроканалов может быть модифицирована различными реагентами. В частности, для этого используются гидрофильные, либо гидрофобные функциональные покрытия, фторофильные покрытия, а для формирования систем электродов - металлизацию (Pt, Au, Ag) [В.Родченкова, И. Шахнович. Микрофлюидные чипы - конструктор для разработчика. Решения компании Dolomite. Научно-технический журнал Аналитика, №3/2017(34)].
Таким образом, в настоящее время разрабатываются различные инновационные подходы к созданию микрофлюидных чипов с заданными функциями.
Микрофлюидные чипы для смешивания, так называемые микросмесители (микромиксеры), применяются для контроля и ускорения процесса смешивания [Nguyen N.T., Wu Z. Micromixers - a review // J. Micromech. Microeng. 2005. Vol. 15. P. R1-R16; Cai G., Xue L., Zhang H., Lin J. A Review on Micromixers // Micromachines (Basel). 2017. Vol. 8. Iss. 9. pii: E274.]. Микросмесители классифицируют на чипы активного и пассивного типа. В чипах активного смешивания для усиления процесса используют дополнительное оборудование, обеспечивающее внешнее воздействие на поток жидкости (например, пьезоакустические преобразователи, намагниченные частицы и др.). При создании пассивных микрофлюидных смесителей разработчики руководствуются геометрическими параметрами каналов микросмесителя и показателями текучести жидкости [Demello A.J. Control and detection of chemical reactions in microfluidic systems // Nature. 2006. Vol. 442. №. 7101. P. 394-402]. В пассивных микросмесителях смешивание потоков жидкости усиливается с помощью различных конструктивных особенностей микрофлюидных каналов, позволяющих увеличить площадь поверхности между смешиваемыми жидкостями и уменьшить диффузионный путь. Например, в каналах микросмесителя изготавливают препятствия или используют каналы с изгибами различных конфигураций, позволяющими резко изменять направление потока, сталкивать потоки, создавать вихри (тем самым повышая эффективность смешивания разных растворов). Применяются различные конфигурации точек смешения потоков [Soleymani A., Kolehmainen Е., Turunen I. Numerical and experimental investigations of liquid mixing in T-type micromixers // Chemical Engineering Journal. 2008. Vol.135. P. S219-S228; Sudarsan A.P., Ugaz V.M. Multivortex micromixing // Proc. Natl. Acad. Sci. USA. 2006. Vol. 103. №19. P. 7228-7233]. Также в каналах чипа используются супергидрофобные подложки, которые позволяют улучшить скольжение растворов веществ у стенок каналов и увеличить скорость потока [Nizkaya Т. V., Asmolov Е. S., Vinogradova О. I. Advective superdiffusion in superhydrophobic microchannels // Physical Review E - Statistical, Nonlinear, and Soft Matter Physics. 2017. Vol. 96. P. 033109]. Таким образом, изменяя геометрию перечисленных зон конструкции чипов, разработчики микрофлюидных систем добиваются максимально эффективного перемешивания различных растворов.
Малые дозы и сверхмалые дозы (высокие и сверхвысокие разведения) лекарственных средств давно изучаются в фармакологии. К сверхвысоким разведениям (сверхмалым дозам) относятся вещества в концентрации равной или выше 10-12 М, обладающие при этом биологической активностью [Бурлакова Е.Б., Действие сверхмалых доз биологически активных веществ и низкоинтенсивных физических факторов, Институт биохимической физики им. Н.М. Эмануэля, Российская академия наук, Москва, стр. 391-392]. Наблюдаемый фармакологический эффект действия на биологические объекты сверхмалых доз биологически активных веществ сопоставим с воздействием того же препарата, но имеющего в десятки раз большую концентрацию или интенсивность [Бурлакова Е.Б. Эффект сверх малых доз. ВЕСТНИК РОССИЙСКОЙ АКАДЕМИИ НАУК, 1994, том 64, М 5, с.425-431].
Авторами было обнаружено, что за счет совокупности конструкционных особенностей элементов, входящих в состав чипа, можно получить сверхвысокие разведения веществ, обладающие биологической активностью.
Из уровня техники известно лекарственное средство на основе антител для лечения аллергических и псевдоаллергических реакций, отличающееся тем, что содержит активированную форму моноклональных, поликлональных или естественных антител к гистамину в малых или сверхмалых дозах, приготовленную путем многократного последовательного разведения и внешнего воздействия [RU 2191602]; лекарственное средство для лечения патологического синдрома на основе антител, отличающееся тем, что содержит активированную форму сверхмалых доз моноклональных, поликлональных или естественных антител к интерферону, приготовленную путем многократного последовательного разведения и внешнего воздействия [RU 2192888]; лекарственное средство для уменьшения резистентности к инсулину и/или для лечения сахарного диабета и/или снижения уровня глюкозы, содержащее активированную-потенцированную форму антител к рецептору инсулина, отличающееся тем, что выполнено в виде фармацевтической композиции и включает в качестве дополнительного - усиливающего компонента активированную-потенцированную форму антител к эндотелиальной NO-синтазе [RU 2509572] и др. Все указанные выше лекарственные средства, представляющие собой сверхвысокие разведения и обладающие активностью, получают в результате сложных технологических процессов, производимых вручную, описанных в данных патентах.
Из уровня техники известна группа изобретений, включающая оснастку для получения заготовки микрофлюидного чипа, способ получения заготовки микрофлюидного чипа, заготовку микрофлюидного чипа, способ изготовления микрофлюидного чипа и микрофлюидный чип [патент RU 2658495C1, 16.08.2018]. Оснастка выполнена в виде детали из двух частей и снабжена отверстием для заливки формовочного материала. Обе части оснастки выполнены с возможностью образования при их соединении полости для размещения основы заготовки и с возможностью формирования на основе микрофлюидной системы в слое формовочного материала, при этом внутренняя поверхность первой части оснастки содержит соответствующий топологии микрофлюидной системы рельеф. Способ получения заготовки осуществляют с использованием оснастки и включает размещение основы заготовки в полости оснастки, заливку в оснастку формовочного материала, центрифугирование оснастки, отверждение формовочного материала и извлечение полученной заготовки. Способ изготовления микрофлюидного чипа включает формирование заготовки вышеуказанным способом и фиксацию на ее поверхности со стороны микрофлюидной системы пластины из оптически прозрачного материала.
Из уровня техники известна заготовка микрофлюидного чипа и микрофлюидный чип для культивирования и/или исследования клеток [RU 2675998C1, 02.02.2018]. Заготовка включает представляющую собой пластину с отверстиями основу. На одной из сторон основы размещен слой формовочного материала с микрофлюидной системой заданной топологии, а на противоположной стороне основы размещен уплотнительный слой в виде единой эластичной детали из формовочного материала. При этом уплотнительный слой размещен на поверхности основы и на внутренней поверхности отверстий основы. Микрофлюидный чип включает вышеуказанную заготовку и пластину из оптически прозрачного материала, зафиксированную на заготовке со стороны микрофлюидной системы с обеспечением ее герметизации.
Из уровня техники известен способ получения фармацевтических композиций на основе полимерных наночастиц методом микрофлюидной технологии [RU 2637653C1, 10.08.2016]. Способ заключается в пропускании через проточный микрореактор, выполненный из боросиликатного стекла, водного раствора, содержащего поливиниловый спирт и раствор в ацетоне или ацетонитриле этопозида или никлозамида и биодеградируемого полимера в виде сополимера молочной и гликолевой кислот или его смесь с полиметилметакрилатом для медицинского применения Eudragit, при этом предварительно через проточный микрореактор из боросиликатного стекла пропускают водный раствор поливинилового спирта.
Из уровня техники известен микрофлюидный чип для получения частиц для доставки лекарств субъекту [WO 2007150030 A2, 27.12.2007]. Микрофлюидная система для получения органических частиц, содержащая, по меньшей мере, два канала, которые сходятся в смесительное устройство, в котором ширина или высота каждого канала составляет от 1 мкм до 1000 мкм, посредством чего поток текучей среды способен протекать через каждый канал и смесительное устройство, и при этом потоки из по меньшей мере двух каналов соединяются и поступают в смесительное устройство и благодаря чему смесительный аппарат позволяет получать органические частицы.
Из уровня техники известно устройство микромиксер (микросмеситель), содержащее, по меньшей мере, один входной канал для жидкости и, по меньшей мере, один выходной канал для жидкости; и множество путей между одним впускным каналом для жидкости и по одним выпускным каналом для жидкости, причем ширина некоторых из множества путей изменяется по существу по параболическому принципу вдоль, по меньшей мере, одного размера микромиксера [US 8414182 B2, 09.04. 2013].
Настоящее изобретение направлено на создание конструкции микрофлюидного чипа обеспечивающего эффективное смешение микрообъемов жидкостей, снижение расхода реагентов и затрат на проведение анализов, при этом, позволяющей получать большие объемы продукта, который может представлять собой сверхмалые дозы (сверхвысоких разведений) исходных веществ. Таким образом, МФЧ по настоящему изобретению может быть использован для получения сверхвысоких разведений.
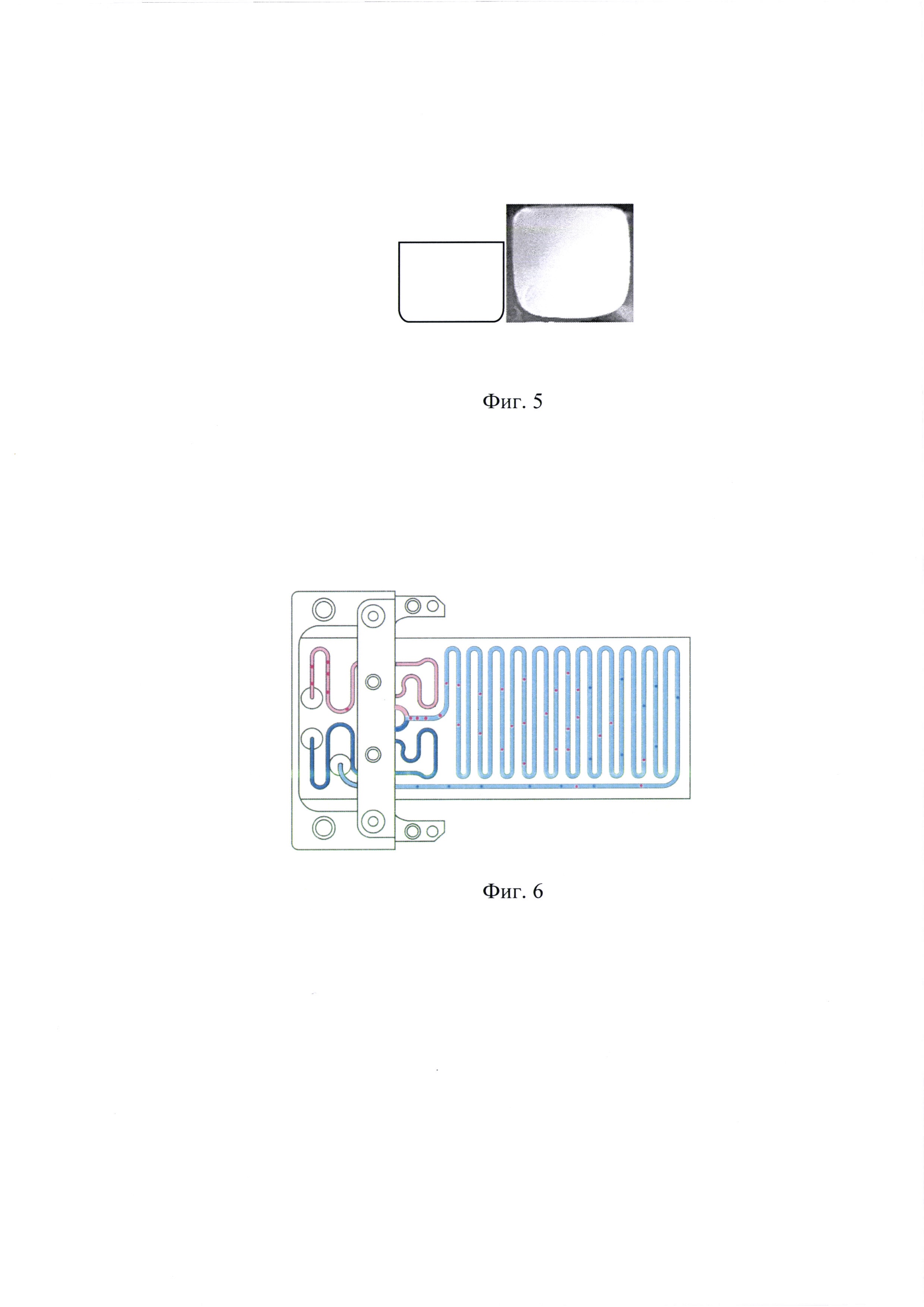
Решение поставленной задачи обеспечивается тем, что микрофлюидный чип смешения состоит из двух герметично спеченных между собой пластин с прорезанным в одной из пластин каналом, имеющим в своей траектории две точки ввода [1], два канала дестабилизации подаваемых потоков, перекресток смешения каналов с точкой смешения [2], канал смешения [3], точку вывода продукта [4], полученного при смешивании двух жидкостей и, необязательно, отверстия для крепления в ложементе (Фиг. 1).
Технический результат заявленного изобретения заключается в расширении арсенала микрофлюидных чипов, в частности микромиксеров (микросмесителей), обеспечивающих эффективное перемешивание жидкостей, без дополнительного оборудования, например, мешалок, с получением однородных растворов и большого объема смеси за счет проточного механизма действия, а также позволяющих получать сверхвысокие разведения различных веществ, обладающие биологической активностью. Конструкция микрофлюидного чипа по настоящему изобретению, обеспечивает интенсификацию процесса смешивания растворов за счет достигаемых больших площадей межфазных поверхностей, малого пути диффузии, тесного взаимодействия между молекулами в изогнутых каналах смешения.
Заявленный микрофлюидный чип представляет собой закрытую герметичную систему каналов для смешивания, которая позволяет свести к минимуму влияние внешних факторов окружающей среды на процесс смешения, повысить точность и технологичность процесса и снизить влияние человеческого фактора при приготовлении растворов.
Технический результат достигается тем, что микрофлюидный чип по настоящему изобретению может быть выполнен из эластомеров, термопластлов, стекла, например, из кварцевого стекла или из стекла лабораторного или медицинского назначения. Предпочтительным вариантом, по настоящему изобретению, является микрофлюидный чип, выполненный из стекла лабораторного или медицинского назначения. Объем микрореактора, по настоящему изобретению, может составлять от 200 до 1000 мкл, при этом размер микрофлюидного чипа может составлять: длина, мм: от 90 до 100; ширина, мм: от 40 до 50; толщина, мм: от 3 до 5.
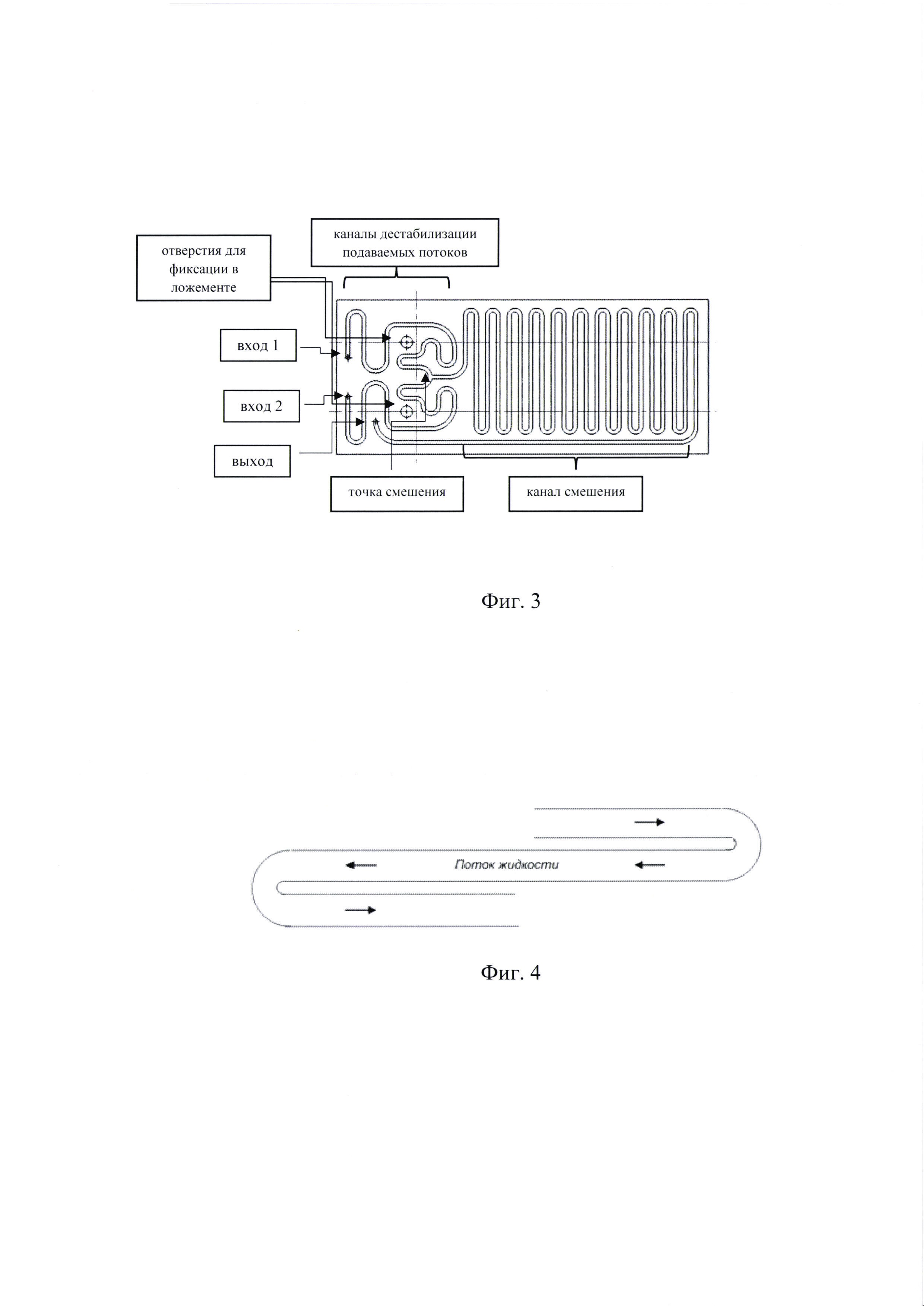
Микрофлюидный чип, по настоящему изобретению, содержит каналы дестабилизации подаваемых потоков. Каналы дестабилизации имеют по 8 поворотов канала разной геометрии с разным радиусом, подобранные опытным путем, что позволяет подвергнуть поток вводимой жидкости расслоению, дестабилизации. Это повышает эффективность смешивания двух подаваемых (дестабилизированных) потоков в канале смешения. Протяженность каналов дестабилизации от входов 1 и 2 до точки смешения составляет по 110-120 мм, в зависимости от объема микроректора.
Ключевыми зонами конструкции чипа, обеспечивающими эффективность перемешивания, являются точка и канал смешивания. Точка смешивания - это зона чипа, в которой происходит соединение двух или более каналов (в которые подаются потоки смешиваемых жидкостей). Канал, в котором смешиваемые жидкости протекают вместе, называется каналом смешивания (Фиг. 3).
Перекресток смешения каналов в микрофлюидном чипе, по настоящему изобретению, может быть выполнен в виде Т-образного, U-образного или стреловидного перекрестков. Предпочтительным вариантом, по настоящему изобретению, является перекресток смешения, выполненный в U-образном виде.
Каналы смешения по настоящему изобретению, могут быть выполнены в форме змеевидного канала, прямого плоского канала с дополнительной ребристой поверхностью, зигзагообразного канала. Предпочтительным вариантом, по настоящему изобретению, является канал смешения, выполненный в форме змеевидного канала.
Протекая по змеевидному каналу смешивания, жидкость изменяет направление движения, попадая в повороты канала (колена канала) (Фиг. 4). В результате действия изгибающей силы слои потока начинают течь неравномерно, разделяются на слои, что и приводит к повышению эффективности смешивания. При этом количество колен в микромиксере подбирается опытным путем. В случае использования заявленного микрофлюидного чипа для получения сверхвысоких разведений предпочтительным вариантом выполнения настоящего изобретения является канал смешения с 21 и более колен (поворотов канала).
Поперечное сечение канала в микрофлюидном чипе, по настоящему изобретению, может быть выполнено в форме квадратного сечения, овального сечения, круглого или полукруглого сечения. Предпочтительным вариантом, по настоящему изобретению, является квадратное сечение канала (Фиг. 5). При этом микрофлюидный канал имеет площадь поперечного сечения от 0,5 мм2 до 1,5 мм2, а его протяженность может составлять от 800 до 1100 мм. При этом площадь поперечного сечения канала по всей длине чипа одинакова.
Вариантом выполнения микрофлюидного чипа, по настоящему изобретению, является наличие гидрофобный или супергидрофобной подложки в каналах чипа, которая позволяет улучшить скольжение растворов веществ у стенок каналов и увеличить скорость потока за счет снижения гидродинамического сопротивления течению жидкостей. Вариантами гидрофобного или супергидрофобного покрытия могут быть тефлоновые покрытия, фторпласты (например, полимер тетрафторэтилена (ПТФЭ)), перфторэйкозан и другие.
Кроме того, на процесс смешивания растворов оказывают влияние их характеристики, связанные с природой растворенного вещества и растворителя, такие, как вязкость, коэффициент диффузии и скорость подачи жидкостей (Фиг. 6). Для эффективного процесса смешивания жидкостей в микрофлюидном чипе следует руководствоваться гидродинамическими коэффициентами подобия: числом Пекле (Ре), характеризующим отношение адвективных процессов в потоке к диффузным; числом Прандтля (Pr), характеризующим термодинамику смешиваемых жидкостей; числом Рейнольдса (Re), характеризующим режим течения жидкости; числом Дина (Dn), характеризующим возникающие поперечные потоки жидкости в местах поворота/кривизны каналов. Расчет указанных параметров приведен ниже в Примере 1.
Скорость подачи жидкостей в заявленный микрофлюидный чип подбирается опытным путем и зависит от таких параметров, как плотность жидкостей, объем шприца и природа смешиваемых жидкостей. При этом в случае известного объема канала от точки ввода до точки смешения (канал дестабилизации) и возможности ограничения объема вводимой жидкости, скорость подачи жидкости может составлять любое значение, в рамках технических возможностей используемого оборудования.
Заявленный микрофлюидный чип может быть закреплен в ложементе, который обеспечивает защиту и целостность микрофлюидного чипа. Ложемент может быть выполнен из пластика, сплава алюминия, нержавеющей стали или оргстекла (Фиг. 7).
Микрофлюидный чип, по настоящему изобретению, совместим с насадкой, которая обеспечивает герметичное соединение капилляров (внешний диаметр - 1,6 мм, внутренний диаметр - 0,5 мм), необходимых для введения жидкостей в чип с помощью шприцев или шприцевых насосов. Указанная насадка крепится к ложементу, тем самым обеспечивается герметичное подключение капиллярных каналов к отверстиям ввода и вывода.
Заявитель обращает внимание на то, что термины «микрофлюидный чип», «микрореактор», «микросмеситель», «микромиксер» в рамках настоящей заявки взаимозаменяемые понятия.
Настоящее изобретение проиллюстрировано ниже представленными примерами вместе с прилагаемыми чертежами:
Фиг. 1. Принципиальная схема микрофлюидного чипа-микросмесителя: 1 - две точки ввода смешиваемых жидкостей; 2 - точка смешивания; 3 - канал смешивания; 4 - точка вывода полученного раствора.
Фиг. 2. Вариант исполнения микрофлюидного чипа проточного действия на 1000 мкл.
Фиг. 3. Схема заявленного микрофлюидного чипа.
Фиг. 4. Схема участка канала смешивания формы змеевика с двумя изгибами.
Фиг. 5. Форма сечения каналов микрореактора (фотография, сделанная с помощью электронного микроскопа).
Фиг. 6. Принципиальная схема смешивания в микрофлюидном чипе.
Фиг. 7. Фото чипа в ложементе с насадкой.
Фиг. 8. Изменение значений числа Dn и числа Ре при изменении скоростей потока в ходе смешивания раствора азорубина и воды Milli-Q (слева - для канала в форме змеевика, справа - для прямого канала (прямая синего цвета) и для канала в форме змеевика (прямая красного цвета)).
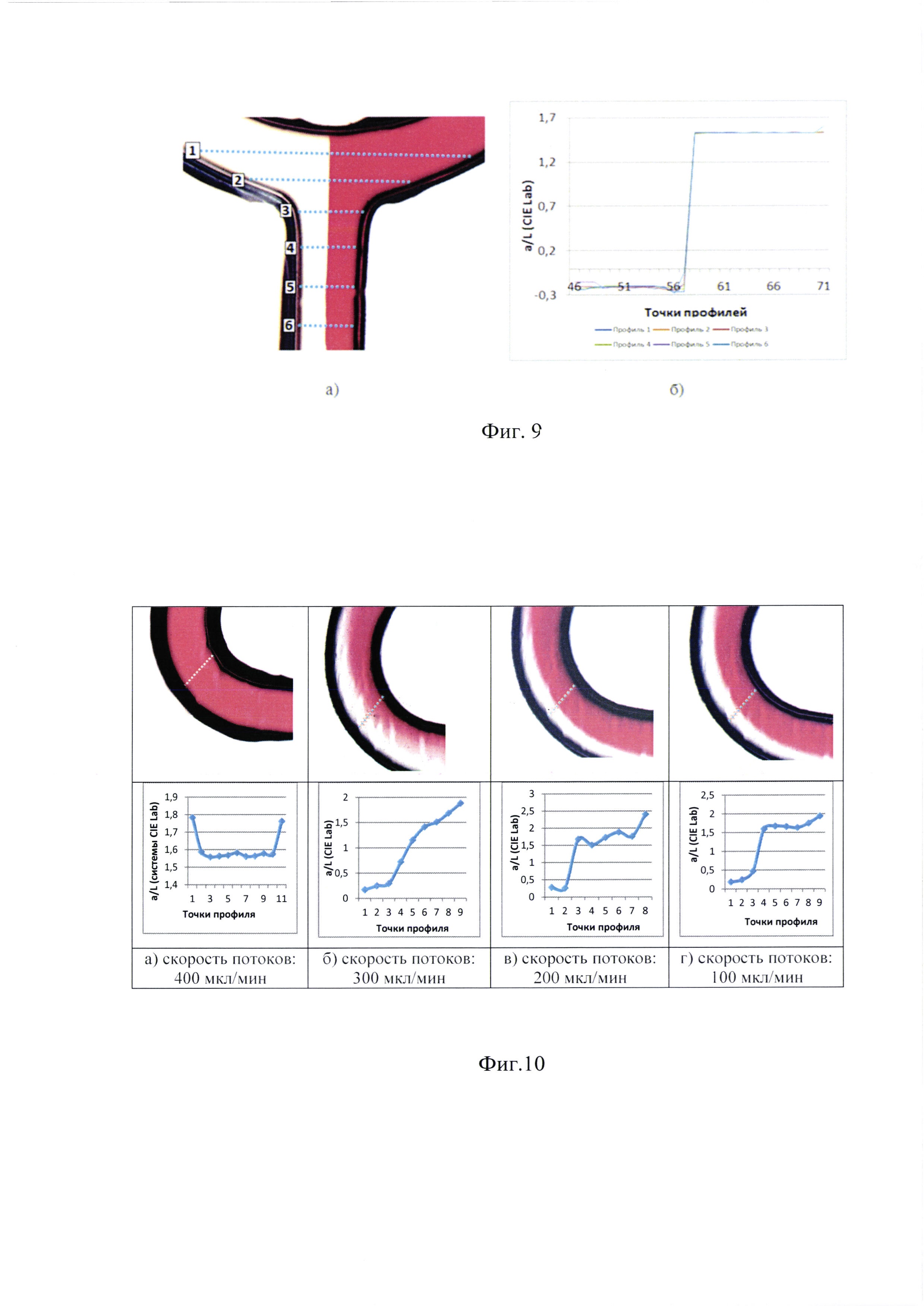
Фиг. 9. а) Микроскопическая фотография (увеличение в 4 раза) U-образного перекрестка смешивания с протекающим по нему 5% водного раствора азорубина и воды Milli-Q. Синими пунктирными линиями отмечены цветометрические профили - линии измерения оттенков цвета, б) Кривые значений цветности.
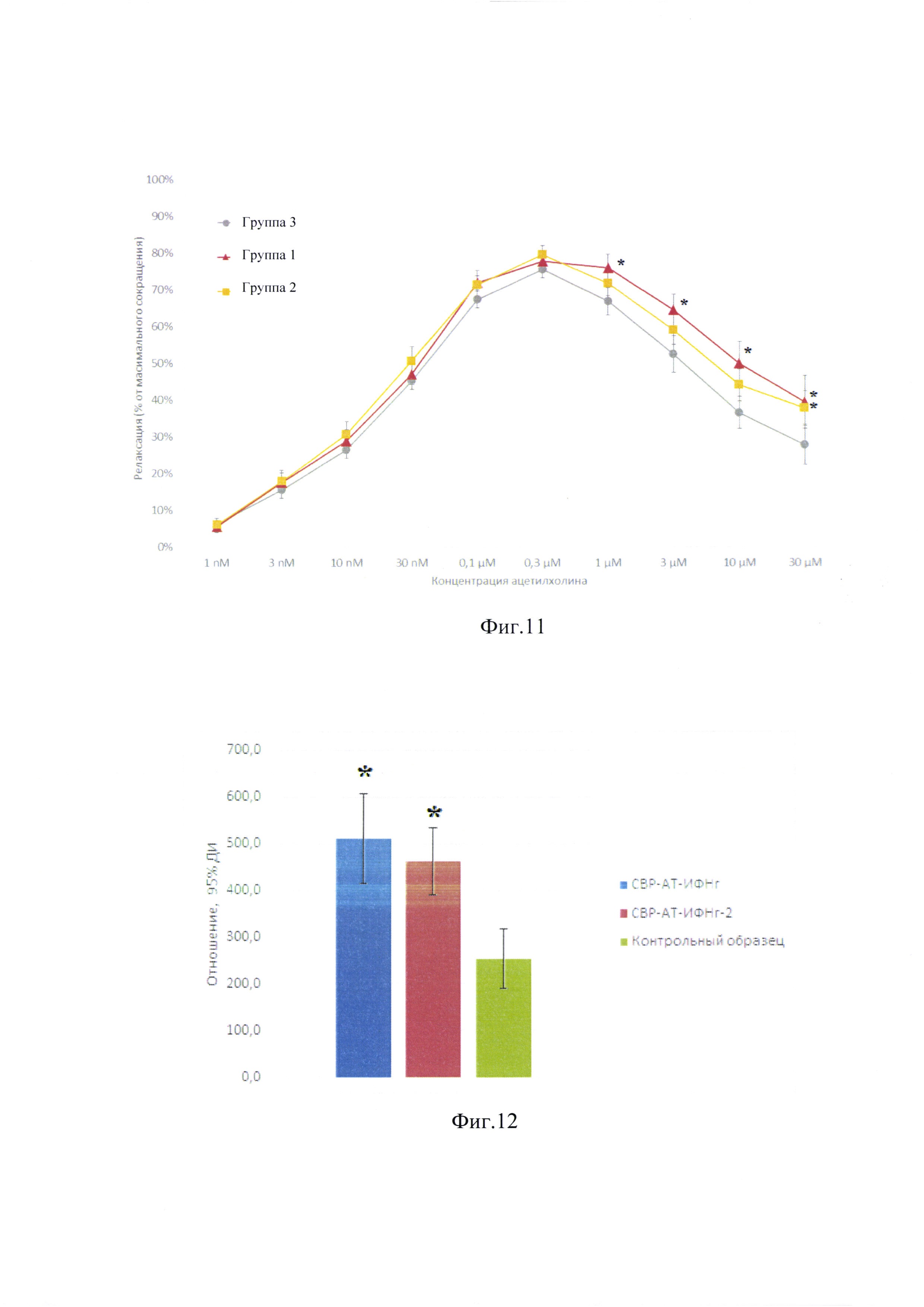
Фиг. 10. Микроскопические фотографии и кривые распределения интенсивности цвета смешивания в изогнутом канале микросмесителя при уменьшении скорости двух потоков.
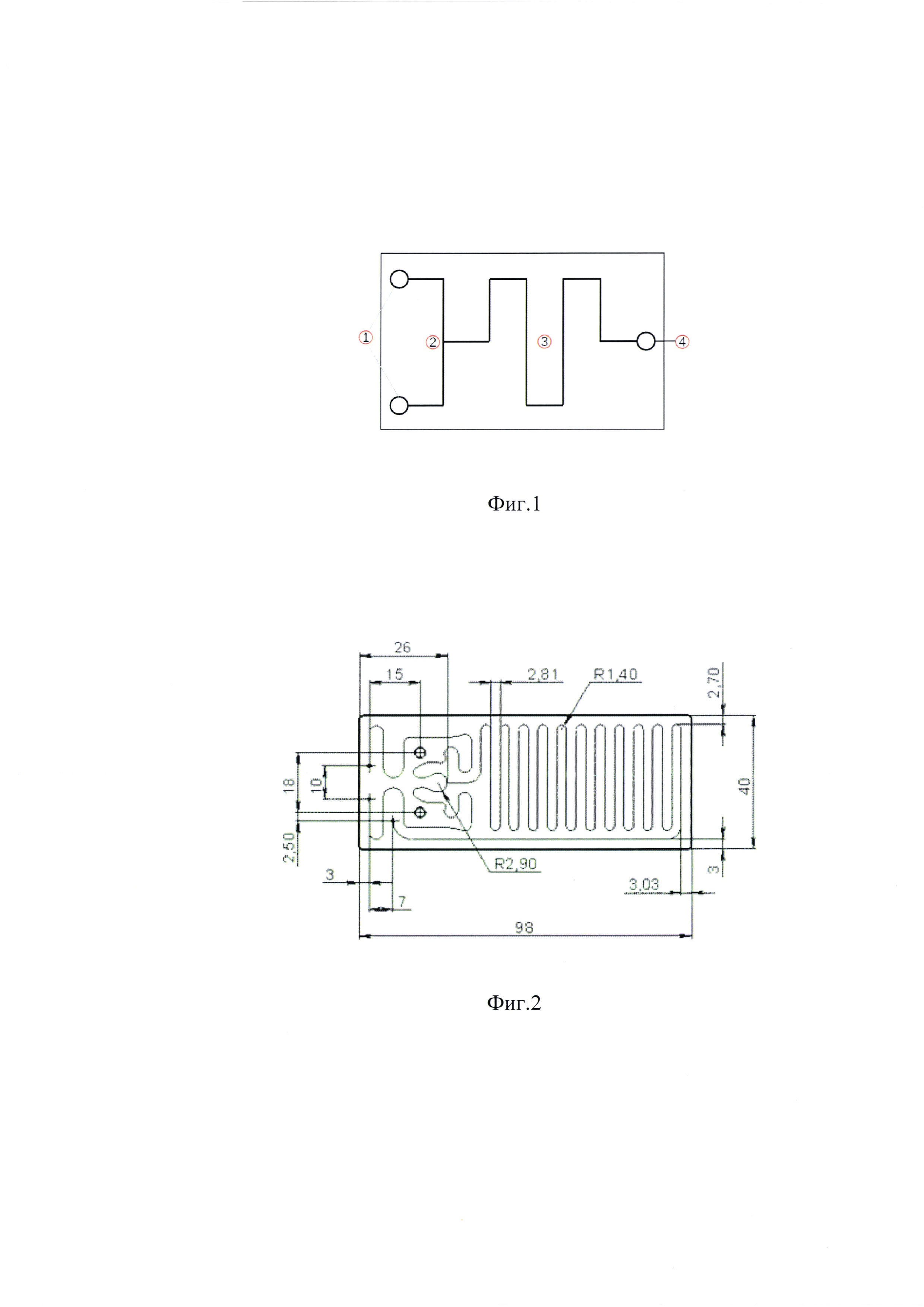
Фиг. 11. Зависимость эффекта Ach на кольца тканей аорты крыс SHR от вводимой дозы Ach (0,001-30 мкМ) в присутствии исследуемых образцов. Все данные представлены в виде М ± SEM. * - значимые отличия (р<0,05) от группы 3.
Фиг. 12. Влияние исследуемых образцов на продукцию ИЛ-2. * - статистически значимые отличия от контрольного образца (р<0,05).
Пример 1.
Целью настоящего эксперимента является исследование параметров процесса смешивания в микрофлюидных каналах чипов пассивного типа с Т-образным перекрестком двух конфигураций: прямой и в форме змеевика.
В рамках эксперимента производилось смешение 5% водного раствора азорубина (кармуазина, пищевого красителя Е122 красного цвета компании Roha Dyechem Pvt. Ltd., каталожный номер RD-09, Индия) и воды бидистиллированной деионизированной (полученной на установке очистки воды Milli-Q Integral 5, Merck Millipore, Франция, далее по тексту «вода Milli-Q»), то есть разбавление водой исходного раствора красителя и получение однородного раствора.
Микрофлюидный канал на протяжении всего чипа имеет одинаковую площадь поперечного сечения 1 мм2, его протяженность составляет 1080 мм. Два раствора подаются в каналы микросмесителя со скоростью 400 мкл/мин.
Рассчитаем число Re (1) [18].

где, р - плотность среды; v - характерная скорость; d - гидравлический диаметр; η - динамическая вязкость среды.
Таким образом, число Re в прямом канале при скорости потока 400 мкл/мин составило 6,6.
В целях оценки массообмена при смешивании раствора красителя с водой корректно оценивать соотношение значений критериев адвективных процессов к критериям диффузных процессов. Для такой оценки рассчитывается число Пекле (Ре) согласно следующей формуле (2) [18].

Число Прандтля (Pr) для потока водного раствора азорубина при 20°С равно 7,02 [19]. Следовательно, для потока жидкости со значением Re=6,6 (скорость потока 400 мкл/мин) в прямом канале число Пекле составило 46,33.
Что касается змеевидного канала, то используя коэффициенты подобия, течение в таком криволинейном канале можно охарактеризовать числом Дина [18]:

где  - кинематическая вязкость, ν - скорость течения, L - характеристическая длина, r - радиус кривизны.
- кинематическая вязкость, ν - скорость течения, L - характеристическая длина, r - радиус кривизны.
Число Дина можно также выразить через число Re [18]:

Тогда число Ре для данного типа канала смешивания можно описать следующей формулой:

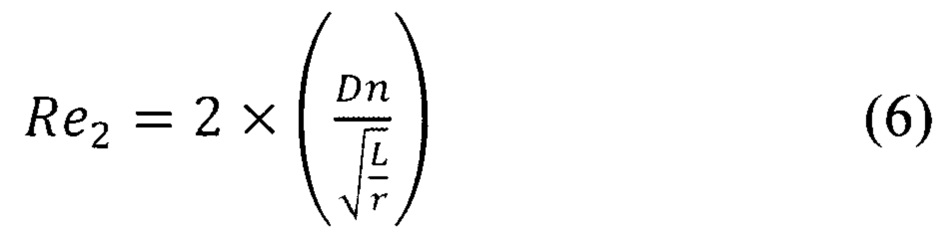
где Re2 характеризует движение жидкости в изгибах змеевидного канала, a Re1, - критерий Рейнольдса для прямого участка канала. Необходимо умножить значение Re на число (см. формулу (6)), характеризующее количество изменений направления движения потока (для двух изгибов каналов равное 2). Суммарное число Re3 для такого канала будет равно 35,5. Таким образом, число Ре для канала смешивания формы змеевика будет равно 250,6. Ниже в таблице 1 представлены сводные результаты вышеупомянутых расчетов.

Вышеописанные расчеты подтверждают, что при использовании канала формы змеевика доля адвективных процессов смешивания в потоке жидкостей существенно выше, чем при использовании прямого канала. Это свидетельствует о целесообразности увеличения количества изгибов микрофлюидных каналов для быстрого и эффективного перемешивания жидкостей. Аналогично были рассчитаны числа Пекле и Дина для прямого канала и канала формы змеевика при различных скоростях потока. Полученные зависимости вышеупомянутых критериев подобия от повышения скоростей потоков подаваемых растворов изображены на фиг. 8.
Согласно полученным графикам для канала в форме змеевика критерий Ре (характеризующий отношение адвективных процессов в потоке к диффузным) увеличивается прямо пропорционально критерию Re, то есть в значительной степени зависит от изменения скорости подачи жидкостей. Чем больше появляется вихревых потоков в изгибах канала смешивания, тем больше будет площадь взаимодействия смешивающихся жидкостей и, следовательно, перемешивание происходит эффективнее.
Пример 2.
Целью настоящего эксперимента является исследование процесса протекания и перемешивания растворов в микрофлюидном чипе пассивного смешивания.
Для этого исследования использована информационно-измерительная система (ИИС) контроля динамики протекания жидкостей, состоящая из микроскопа с цифровым окуляром (для выполнения фотографий и записи видео при подключении к компьютеру, «ЛОМО» МИБ, Россия), шприцевого насоса Atlas (для подачи жидкостей с заданной скоростью в микрофлюидный чип, Syrris Ltd., Великобритания) и заявленного микрофлюидного чипа пассивного смешивания с каналами формы змеевика.
В ходе модельных экспериментов получена серия микрофотографий, характеризующих процесс смешивания 5% водного раствора азорубина (красителя красного цвета) с водой Milli-Q. Для цветометрического анализа использовался алгоритм, составленный с помощью скриптового языка программирования AutoHotKey. Полученные результаты в координатах цветометрического пространства RGB преобразованы в систему цветовых координат CIE Lab. Оттенок красного цвета рассчитан путем деления координаты (зеленый-красный) «а» на координату (яркость) «L» [20].
С помощью разработанной ИИС был проведен цветометрический анализ протекания (при скорости потоков 400 мкл/мин) в U-образной точке смешивания микрофлюидного чипа 5% водного раствора азорубина (раствор насыщенного красного цвета) и воды Milli-Q (фиг. 9).
Согласно полученным данным, интенсивность оттенка красного цвета всегда постоянна и между потоками заметна четкая граница. Это позволяет предположить, что концентрация также не изменяется, а значит, в точке смешивания не происходит конвективных процессов массопереноса.
Для цветометрического анализа режимов смешивания 5% водного раствора азорубина и воды Milli-Q пропускали в микросмеситель с каналами в форме змеевика со скоростями: 100, 200, 300, 400 мкл/мин. Полученные микрофотографии и кривые распределения интенсивности цвета представлены на фиг. 10.
Из полученных данных о цветометрическом профиле канала можно сделать вывод о том, что снижение скорости потока вызывает его расслоение. При скорости потоков 400 мкл/мин в изогнутом канале окрашенный раствор заполняет все поперечное сечение равномерно, что подтверждает эффективное смешивание двух потоков. Кривая оттенка красного цвета при скорости в 300 мкл/мин свидетельствует о возникновении градиента концентрации красителя. При скорости в 200 мкл/мин формирующееся плато концентрации красителя. На кривой значений интенсивности окраски при скорости потоков в 100 мкл/мин течение стабилизировалось в виде двух ламинарных потоков, концентрация красителя в правом потоке равномерная, что отражено на графике в виде четко определимого плато от точки профиля 4 до точки 8.
Таким образом было показано, что в исследованном в данной работе микросмесителе скорости потока, равной 400 мкл/мин, оказалось достаточно для эффективного перемешивания жидкостей.
Пример 3.
Целью настоящего эксперимента является проверка однородности смешивания раствора, приготовленного с помощью микрофлюидного чипа (фиг. 2).
Для приготовления испытуемого раствора был использован исходный водный раствор иммуноглобулина G человека (далее по тексту - IgG) в концентрации 100 мкг/мл. В качестве растворителя использовали 15% водный раствор этанола. С помощью шприцевого насоса точно дозируются в микрореактор: одним шприцем - исходный раствор IgG, вторым шприцем - растворитель. Каждый шприц работает с установленной скоростью, чтобы направить два потока от каждого шприца (один шприц - один поток, второй шприц - второй поток) до соответствующего входа микрореактора, затем до точки смешения и затем по изогнутому микроканалу смешения, в котором происходит эффективное перемешивание.
Одним шприцем довели в микрореактор (вход 1) до точки смешения 10 мкл водного раствора IgG концентрации 100 мкг/мл со скоростью 400 мкл/мин. Вторым шприцем (вход 2) довели в микрореактор до точки смешения 90 мкл 15% водного раствора этанола со скоростью 1000 мкл/мин. Затем при одновременной работе двух шприцев со скоростью 400 мкл/мин два потока протекают в канале смешения, и полученный смешанный раствор через точку вывода продукта поступает во флакон. Повторили процедуру еще 99 раз, чтобы в итоге получить во флаконе 10 мл водно-спиртового раствора IgG (с концентрацией 10 мкг/мл).
Из полученного водно-спиртового раствора IgG без перемешивания раствора, отобрали 10 проб по 200 мкл. Отбор проб раствора проводили четыре раза из середины флакона, три раза в нижней части флакона и три раза у поверхности раствора.
10 отобранных проб были проанализированы разработанной и валидированной УВЭЖХ методикой по количественному определению IgG в водных и водно-спиртовых растворах IgG.
Определение количества IgG в водных и водно-спиртовых растворах IgG проводились при помощи хроматографической системы 1290 Infinity II Agilent Technologies, укомплектованной диодно-матричным и флуориметрическим детекторами (США); колонки аналитической 150 мм × 2,1 мм, заполненной бутилсиланизированным силикагелем с размером частиц 1,7 мкм и размером пор 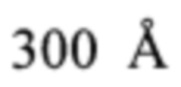 (ACQUITY UPLC Protein ВЕН С4, Waters Corporation, США); насоса вакуумно-нагнетательного, Millipore (Германия); ультразвуковой ванны УЗВ-12 ТТЦ, Сапфир (Россия); центрифуги FVL-2400N, BioSan (Латвия); поверенных аналитических весов Ohaus Discovery DV215CD (Швейцария).
(ACQUITY UPLC Protein ВЕН С4, Waters Corporation, США); насоса вакуумно-нагнетательного, Millipore (Германия); ультразвуковой ванны УЗВ-12 ТТЦ, Сапфир (Россия); центрифуги FVL-2400N, BioSan (Латвия); поверенных аналитических весов Ohaus Discovery DV215CD (Швейцария).
В работе использовались следующие реактивы: вода бидистиллированная деионизированная, полученная на установке очистки воды Milli-Q Integral 5, Merck Millipore, Франция (далее по тексту - вода); изопропанол для ВЭЖХ, Panreac, каталожный номер 221090.1612; кислота трифторуксусная (TFA), Panreac, каталожный номер А0697,0100; этиловый спирт, раствор для наружного применения и приготовления лекарственных форм 95%, серия 040615, ЗАО «РФК»; иммуноглобулин гамма человека (IgG), стандартный образец, MyBioSource, каталожный номер MBS173110.
Проверку пригодности разработанной хроматографической системы проводят следующим образом. Хроматографируют стандартный раствор 5 раз, регистрируют хроматограммы, измеряют площади и времена удерживания пиков. Хроматографическая система считается пригодной, если при хроматографии раствора стандартного образца IgG выполняются следующие условия: эффективность хроматографической колонки, рассчитанная по пику IgG - не менее 1500 теоретических тарелок; фактор асимметрии площади пика IgG - не менее 0,8 и не более 1,5; относительное стандартное отклонение площади пика IgG, рассчитанное по 5 последовательным хроматограммам - не более 2%. Анализ результатов, полученных на разработанной хроматографической системе, является достоверным, поскольку выполняются требования теста «Проверка пригодности хроматографической системы».
Результаты количественного определения IgG в пробах представлены в таблице 2.

Согласно полученным результатам измерений 10 проб раствора IgG относительное стандартное отклонение (SD) составило 0,028, следовательно, коэффициент вариации (RSD) составил 0,28%. Данное значение согласуется с погрешностью методики, не более 1%. Таким образом, раствор, приготовленный с помощью заявленного микрофлюидного чипа, был полностью однородным. Концентрация IgG в растворе составляла 10 мкг/мл.
Пример 4.
Приготовление сверх высоких разведений (СВР) антител к эндотелиальной NO-синтазе (eNOS) с помощью заявленного микрофлюидного чипа (фиг. 2).
Способ 1 (дозирование двух потоков в микрореактор и их смешивание в нем):
Для приготовления растворов использовался шприцевой насос Atlas с двумя шприцами и распределительными клапанами (производства Syrris Ltd, Великобритания). Капилляры от шприцев были подсоединены к соответствующим входам микрофлюидного чипа. К выходу из чипа подсоединен капилляр, который опущен во флакон для сбора продукта. К шприцевому насосу подключен персональный компьютер с установленной программой управления процессом приготовления растворов, разработанной на программной платформе Labview.
Приготовление состояло из следующих этапов:
1. Наполнили один шприц исходным раствором антител к eNOS в концентрации 1,0 мг/мл, другой шприц 25% водным раствором этанола. Одним шприцем довели в микрореактор (вход 1) до точки смешения 10 мкл матричного раствора со скоростью 200 мкл/мин. Вторым шприцем довели в микрореактор (вход 2) до точки смешения 990 мкл 25% водного раствора этанола со скоростью 1000 мкл/мин. Затем при одновременной работе двух шприцев со скоростью 400 мкл/мин дозировали 1 мкл матричного раствора антител к eNOS 1 и 99 мкл 25% водного раствора этанола, два потока протекают в канале смешения и полученный смешанный раствор через точку вывода продукта собирали во флакон. Повторили дозирование еще 9 раз и получили во флаконе 1 мл раствора 1.
2. Провели промывку двух шприцев и каналов микрореактора водно-спиртовым раствором.
3. Повторили этапы 1-2 для получения растворов 2-197 с использованием соответственно растворов 1-196.
4. Смешали во флаконе в соотношении 1:1:1, полученные в п. 3 растворы 9, 27 и 197.
5. Наполнили один шприц смесью растворов 9, 27 и 197, другой шприц 25% водным раствором этанола. Одним шприцем довели в микрореактор (вход 1) до точки смешения 30 мкл смеси растворов 9, 27 и 197 со скоростью 200 мкл/мин. Вторым шприцем довели в микрореактор (вход 2) до точки смешения 970 мкл 25% водного раствора этанола со скоростью 1000 мкл/мин. Затем при одновременной работе двух шприцев со скоростью 400 мкл/мин дозировали 3 мкл раствора 1 и 97 мкл 25% водного раствора этанола, два потока протекали в канале смешения и полученный смешанный раствор через точку вывода продукта собирали во флакон. Повторили дозирование еще 9 раз и получили во флаконе 1 мл смеси растворов 10, 28 и 198.
6. Провели промывку двух шприцев и каналов микрореактора водно-спиртовым раствором.
7. Повторили этапы 5-6 для получения необходимого количества конечной смеси растворов 12, 30, 200
Конечный продукт, полученный указанным выше способом, представляет собой сверхвысокое разведение антител к эндотелиальной NO-синтазе в смеси растворов 12, 30, 200, соответствующее смеси разведений 10012, 10030, 100200.
Способ 2 (дозирование двух потоков во флакон с последующей подачей полученного раствора в микрореактор для смешивания):
Для приготовления растворов использовался шприцевой насос Atlas с двумя шприцами и распределительными клапанами (производства Syrris Ltd, Великобритания). Капилляры от шприцев были подсоединены к соответствующим входам микрофлюидного чипа. К выходу из чипа подсоединен капилляр, который опущен во флакон для сбора продукта. К шприцевому насосу подключен персональный компьютер со специальной программой управления процессом приготовления растворов, разработанной на программной платформе Labview.
Приготовление состояло из следующих этапов:
1. Наполнили один шприц матричным раствором антител к eNOS в концентрации 5 мг/мг, другой шприц 25% водным раствором этанола. Одним шприцем дозировали во флакон 10 мкл матричного раствора со скоростью 200 мкл/мин, одновременно вторым шприцем в этот же флакон дозировали 990 мкл 25% водного раствора этанола со скоростью 1000 мкл/мин. Затем полученный во флаконе раствор подавался шприцем со скоростью 400 мкл/мин в микрореактор для смешивания. На выходе из микрореактора получили смешанный раствор, который поступал в приемный флакон. Получили во флаконе 1 мл раствора 1.
2. Провели промывку двух шприцев и каналов микрореактора водно-спиртовым раствором.
3. Повторили этапы 1-2 для получения растворов 2-197 с использованием соответственно растворов 1-196.
4. Смешали во флаконе в соотношении 1:1:1, полученные выше растворы 9, 27 и 197.
5. Наполнили один шприц смесью растворов 9, 27 и 197, другой шприц 25% водным раствором этанола. Одним шприцем дозировали во флакон 30 мкл смеси растворов 9, 27 и 197 со скоростью 200 мкл/мин., одновременно вторым шприцем в этот же флакон дозировали 970 мкл 25% водного раствора этанола со скоростью 1000 мкл/мин. Затем полученный во флаконе раствор подавался шприцем со скоростью 400 мкл/мин в микрореактор для смешивания. На выходе из микрореактора получили смешанный раствор, который поступает в приемный флакон. Получили во флаконе 1 мл раствора 10, 28 и 198.
6. Провели промывку двух шприцев и каналов микрореактора водно-спиртовым раствором.
7. Повторили этапы 5-6 для получения необходимого количества конечной смеси растворов 12, 30, 200.
Конечный продукт, полученный указанным выше способом, представляет собой сверхвысокое разведение антител к эндотелиальной NO-синтазе в смеси растворов 12, 30, 200, соответствующее смеси разведений 10012, 10030, 100200.
Пример 5.
Целью настоящего исследования является изучение биологической активности сверхвысоких разведений (СВР) антител к эндотелиальной NO-синтазе (eNOS), полученных с помощью заявленного микрофлюидного чипа, на модели вазомоторной дисфункции ex vivo. Производилась оценка влияния полученных СВР на функциональные изменения аортальных колец, вызванных гипертензией.
Материалы и методы:
Исследование проведено на спонтанно-гипертензивных самцах крыс в возрасте 12-14 недель (SHR, n=7) с весом 300-350 г. Животных содержали группами по две особи, с соблюдением обычного 12-часового цикла дня и ночи (в 19 часов свет выключали), температура воздуха 22±2°С и относительная влажность 55±10%. На протяжении всего эксперимента стандартный корм (Safe R04-10) и водопроводная вода представлялись животным свободно.
Экспериментальные образцы:
Технология получения СВР антител к eNOS в смеси разведений 10012 10030 100200 заключается в использовании заявленного микрофлюидного чипа для получения СВР согласно способу 1 раскрытому в примере 4. Микрофлюидный чип, используемый в этом способе, выполнен из медицинского стекла, состоит из двух точек ввода, двух каналов дестабилизации подаваемых потоков (по 8 поворотов канала в каждом) при этом протяженность каналов дестабилизации от входов 1 и 2 до точки смешения составляет по 115 мм, U-образного перекрестка смешения каналов с точкой смешения, змеевидного канала смешения (с 21 поворотом канала) при этом протяженность канала смешения от точки смешения до выхода составляет 808 мм, точки вывода продукта, поперечное сечение каналов имеет форму квадратного сечения, площадь поперечного сечения каналов составляет 1,1 мм2.
Вторая технология получения СВР антител к eNOS в смеси разведений 10012 10030 100200 заключается в традиционном приготовлении СВР в соответствии с патентом RU 2191601 (согласно принятой технологии).
Экспериментальные группы:
Группа 1 - СВР антител к eNOS, полученные с использованием микрофлюидного чипа (1 мл).
Группа 2 - Группа 2 - СВР антител к eNOS полученные согласно второй технологии (1 мл).
Группа 3 - контроль, вода очищенная (1 мл)
В каждой группе использовалось от 8 до 12 аортальных колец, полученных от 7 спонтанно-гипертензивных самцов крыс.
Дизайн эксперимента:
После 5-дневного периода акклиматизации животным проводили терминальную анестезию посредством пентобарбитала натрия (50 мг/кг, в/б). Затем у каждого животного иссекали грудную аорту, очищали от всех прилегающих тканей и помещали в охлажденный модифицированный буфер Кребса, имеющий следующий состав (мМ): 118,5 NaCl, 25 NaHCO3, 4,7 KCl, 1,2 MgSO4-7H2O, 1,2 KH2PO4, 11 глюкоза и 2,5 CaCl2-H2O. Аорты разрезали на кольца (длиной 4-5 мм), и через просвет помещали два тонких держателя из нержавеющей стали. Аортальные сегменты промывали в камерах для изолированных органов, содержащих буфер Кребса (5 мл) при 37°С, с постоянным барботажем смесью 95% O2 и 5% CO2 в целях поддержания рН 7.4. Каждое кольцо присоединялось к преобразователю перемещения для измерения изометрической силы, которая непрерывно регистрировалась в режиме реального времени на компьютере с помощью 8-канальной системы сбора данных. Аортальные кольца подвергались напряжению 2 г. Напряжение корректировали каждые 15 минут в течение 60-мин периода уравновешивания. Буфер в камерах для изолированных органов заменяли каждые 15 минут в течение указанного периода. Затем в целях контроля сократительной реакции аортальных колец ткани последовательно подвергали воздействию различных агентов в соответствии с Таблицей 3 (этапы #1-5), после чего оценивали влияние испытуемых образцов на эндотелий-зависимое расслабление (релаксацию), вызванное ацетилхолином (Ach) (этап #6).

Статистический анализ:
Результаты исследования представлены как средние значения ± стандартная ошибка среднего (M±SEM). При использовании ацетилхолина (Ach) для стимуляции расслабления реакция выражается как релаксация после ФЭ-индуцированного предварительного сокращения и рассчитывается как релаксация = [(максимальное напряжение, вызываемое ФЭ - напряжение, вызванное Ach) / (максимальное напряжение - базальное напряжение)] × 100.
Статистический анализ проводили с использованием R-языка версии 3.4.0. Данные представлены в виде относительных значений в диапазоне [0; 1] (от 0% до 100%). В этой связи для данного анализа проводилось логит-преобразование.
После преобразования была использована модель смешанных эффектов для оценки различий между группами. Две различные версии СВР антител к eNOS сравнивали с помощью дисперсионного анализа с последующими множественными сравнениями между группами с поправкой Тьюки. Различия считались статистически значимыми, если значение р-критерия было менее 0,05.
Результаты:
Добавление СВР антител к eNOS, изготовленных с использованием двух различных технологий, к кольцам аорты приводило к усилению Ach-индуцированного расслабления. Эффект расслабления (релаксации), вызванный Ach, являлся более выраженным при использовании обеих технологических версий СВР антител к eNOS, по сравнению с указанным эффектом в группе SHR + контроль. При этом статистически значимые различия эффектов двух технологических версий СВР антител к eNOS не наблюдались (Фиг. 11).
Выводы:
Результаты исследования подтверждают, что СВР антител к eNOS, полученные с помощью заявленного микрофлюидного чипа, способствуют усилению эндотелий-зависимого расслабления. Таким образом, СВР антител к eNOS, полученные с помощью заявленного микрофлюидного чипа, обладают выраженной биологической активностью и не отличаются от СВР, полученных по известному способу.
Пример 6.
Исследование влияния СВР антител к интерферону-гамма на продукцию ИЛ-2
Цель эксперимента - оценка влияния образцов СВР антител к интерферону-гамма (СВР AT ИФНг), приготовленных в соответствии с двумя различными способами, на активацию Th1 (Т-хелперов 1-го типа), дифференцировка которых происходила в его присутствии. Было проведено исследование влияния двух образцов СВР, приготовленных с использованием двух различных технологий, на продукцию ИЛ-2 Т-лимфоцитарной клеточной линией Jurkat под действием стандартных веществ, стимулирующих дифференцировку клеток: сочетание ФМА и иономицина приводит к активации и дифференцировке наивных Т-лимфоцитов (Th0) в Т-хелперы 1-го типа (Th1). Активированные Th1 экспрессируют ряд цитокинов, в частности, селективными цитокинами для данных клеток являются ИЛ-2 и ИФН-гамма. В качестве маркера активации был выбран ИЛ-2, синтезируемый в основном данными Т-хелперными лимфоцитами и участвующий в стимуляции таких важных звеньев реализации противовирусного иммунного ответа, как пролиферация лимфоцитов, NK-клеток, моноцитов, что, в свою очередь, ведет к повышению секреции других цитокинов, соответствующих рецепторов, некоторых иммуноглобулинов, а также АФК.
Материалы и методы:
Технология получения СВР антител к интерферону-гамма (Образец СВР-АТ-ИФНг) в смеси разведений 100121003010050 заключается в использовании заявленного микрофлюидного чипа для получения СВР согласно способу 2 раскрытому в примере 4. Микрофлюидный чип, используемый в этом способе, выполнен из медицинского стекла, состоит из двух точек ввода, двух каналов дестабилизации подаваемых потоков (по 8 поворотов канала в каждом) при этом протяженность каналов дестабилизации от входов 1 и 2 до точки смешения составляет по 115 мм, U-образного перекрестка смешения каналов с точкой смешения, змеевидного канала смешения (с 21 поворотом канала) при этом протяженность канала смешения от точки смешения до выхода составляет 808 мм, точки вывода продукта, поперечное сечение каналов имеет форму квадратного сечения, площадь поперечного сечения каналов составляет 1,1 мм2.
Вторая технология получения СВР антител к интерферону-гамма (Образец СВР-АТ-ИФНг-2) в смеси разведений 100121003010050 заключается в приготовлении СВР в соответствии с патентом RU 2192888 (согласно принятой технологии).
Активность образцов СВР AT ИФН-г оценивалась в лабораторных условиях (in vitro) на экспериментальной модели опухолевой клеточной линии Jurkat (Т-лимфобластного лейкоза человека). Культивирование клеток проводили суспензионным методом в полной питательной среде RPMI-1640 ("Sigma") с 10% ЭТС ("Sigma") и 100 мкг/мл пенициллина-стрептомицина ("ПанЭко") при 37°С и 5% CO2. Клетки поддерживали в логарифмической фазе роста и пассировали через 48 ч. В качестве тестируемых образцов использовали образцы СВР-АТ-ИФНг, СВР-АТ-ИФНг-2, а также контрольный образец, приготовленный по аналогичной технологии, что и СВР-АТ-ИФНг-2, но не содержащий действующего вещества. Для эксперимента клетки высевали в 24-луночные планшеты (по 0.3×106 в лунку) в 300 мкл культуральной среды, непосредственно после посева добавляли СВР AT ИФНг или контрольный образец в количестве 1/4 от общего объема лунок (т.е. по 100 мкл в лунку) - максимальная нетоксичная доза, установленная в предварительных исследованиях. Культуру инкубировали в течение 24 ч (37°С, 5% CO2), затем вносили 100 мкл 5-кратного коктейля для стимуляции клеток, содержащего ФМА и иономицин ("eBioscience") - активатор протеинкиназы С и ионофор кальция, соответственно. Инкубацию культуры с ФМА/иономицином и образцами продолжали в течение 6 ч (37°С, 5% CO2). После стадии инкубации отбирали клеточную суспензию, центрифугировали в течение 5 мин при 1000 rpm и отбирали супернатанты. Было проведено 16 повторов эксперимента для минимизации влияния на конечный результат неравномерности посева клеток и прочих факторов. Уровень продукции ИЛ-2 в супернатантах измеряли методом ИФА по протоколу производителя ("Вектор-Бест"). Измерения проводили при 450 нм на микропланшетном фотометре "Multiscan" ("Thermo Fisher Scientific") и при значении референс-длины волны 620 нм. Количество цитокина в образцах определяли по калибровочной кривой и выражали в пг/мл. Статистический анализ полученных результатов проводили с помощью средств языка R (версия 3.4.0). Среднее значение выраженности эффекта вычисляли по результатам 16 повторов эксперимента. Анализ проводили с использованием однофакторного дисперсионного анализа с апостериорными сравнениями по критерию Тьюки. Различия считали статистически значимыми при р<0,05.
Анализ продукции ИЛ-2 в супернатантах культуры Jurkat под действием ФМА и иономицина показал увеличение его продукции клетками после 6 ч инкубирования. Присутствие образцов, содержащих СВР в течение 24 ч перед внесением стимулирующего коктейля оказало существенное влияние на продукцию ИЛ-2 под действием ФМА/иономицина по сравнению с контрольным раствором. Концентрация ИЛ-2 при использовании образца СВР-АТ-ИФНг увеличилась в 1,9 раза, что достигало статистической значимости (р<0,05) по сравнению с контрольным образцом. Концентрация ИЛ-2 при использовании образца СВР-АТ-ИФНг-2 увеличилась в 1,8 раза, что также достигало статистической значимости (р<0,05) по сравнению с плацебо (фиг. 12).
Выводы:
Таким образом, проведенное исследование показало способность образцов СВР антител к интерферону-гамма эффективно активировать внутриклеточные процессы, продуктом которых является ИЛ-2. Полученные результаты представляют интерес для понимания механизма реализации биологического эффекта изучаемых образцов т.к. ИЛ-2 - один из важнейших цитокинов, вовлеченных в реализацию противовирусного иммунного ответа, воздействующий на иммунокомпетентные клетки как фактор роста и дифференцировки. Статистической значимости отличий образца СВР антител к интерферону-гамма человека, полученных с помощью двух различных технологий, друг от друга не выявлено.