Результат интеллектуальной деятельности: ПРИМЕНЕНИЕ L. REUTERI ДЛЯ ВОССТАНОВЛЕНИЯ ПОСЛЕ ДИСБИОЗА МИКРОБИОТЫ НА РАННИХ ЭТАПАХ РАЗВИТИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится по существу к области здоровья младенцев, в частности, к микробной колонизации кишечника молодых млекопитающих. В частности, изобретение относится к введению L. reuteri молодым млекопитающим в возрасте до трех лет для людей и в эквивалентном возрасте для животных, чтобы стимулировать восстановление после дисбиоза микробиоты. Изобретение также относится к профилактике или лечению расстройств, связанных с дисбиозом микробиоты.
Уровень техники
Настоящее изобретение относится ко всем млекопитающим, включая животных и человека.
Микробная колонизация кишечника младенцев является ключевым стимулирующим фактором развития кишечника и иммунной системы младенцев. Предполагается, что непосредственно перед появлением на свет желудочно-кишечный тракт младенца практически стерилен. В ходе нормального процесса родов он встречается с бактериями влагалища, желудочно-кишечного тракта и кожи матери, и начинается его колонизация. В фекальной микробиоте здорового, рожденного посредством вагинальных родов, находящегося на грудном вскармливании младенца в возрасте от 2 до 6 месяцев, как правило, преобладают виды бифидобактерий вместе с некоторыми видами лактобактерий и гораздо меньшими количествами других групп бактерий, например бактероидов и протеобактерий, включая потенциально патогенный род, например Escherichia, Shigella и Klebsiella.
У здорового ребенка грудного возраста, рожденного посредством вагинальных родов и находящегося на грудном вскармливании, бифидобактерии образуют основу микробиоты, и на их долю приходится 30–50% от всех бактерий в кишечнике младенца.
Этот показатель можно рассматривать как оптимальный уровень микробиоты для данной возрастной группы, но при этом следует иметь в виду, что значительное влияние на состояние микробиоты оказывают и географические факторы. Таким образом, микробиота здорового младенца, рожденного посредством вагинальных родов и находящегося на грудном вскармливании, в возрасте от 2 до 6 месяцев, который родился в одной части света, может отличаться от микробиоты рожденного в другом месте младенца.
В любом случае после завершения отлучения от груди в возрасте приблизительно 2–3 лет устанавливается структура кишечной микробиоты, которая напоминает структуру микробиоты взрослых.
Дисбиоз микробиоты можно определить как значительное отклонение от сбалансированного состояния микробиоты с точки зрения глобального профиля микробиоты, метаболизма или уровней определенных видов. Дисбиоз микробиоты обычно связывают с уязвимостью по отношению к заболеваниям и повышением такой уязвимости. Например, пониженные концентрации бифидобактерий связаны с повышенным риском инфекции и других патологий у младенцев.
Все большее количество данных свидетельствует о том, что способ родоразрешения оказывает значительное влияние на такой процесс колонизации. В ходе родоразрешения посредством вагинальных родов влагалище и кишечник матери обеспечивают бактерии, которые инициируют колонизацию кишечника младенца. Напротив, при кесаревом сечении отсутствует непосредственный контакт с фекальной и вагинальной микробиотой матери, и исходными колониеобразователями по сути являются бактерии окружающей среды. Таким образом, малыши, родившиеся посредством кесарева сечения, обладают по существу отличной по составу зарождающейся микробиотой, и для них характерна отсроченная колонизация микробиоты по сравнению с малышами, рожденными посредством вагинальных родов. Для микробиоты при кесаревом сечении характерны изменения в бактериальном разнообразии, пониженная численность Bifidobacterium spp. и Bacteroides spp. и повышенные концентрации C. difficile [Adlerberth, I., (2009), AE Wold Establishment of the gut microbiota in Western infants, Acta Pædiatrica, 98, 229–238]. Изменения состава микробиоты могут представлять собой продолжительный процесс и регистрировались через несколько лет после рождения [Salminen, S., Gibson, G. R., McCartney, A. L. and Isolauri, E. (2004), Influence of mode of delivery on gut microbiota composition in seven year old children, Gut, 53, 1388-1389]. У младенцев, родившихся посредством кесарева сечения, также отмечали повышенные концентрации типов протеобактерий, в том числе потенциально патогенных родов, например, Escherichia, Shigella и Klebsiella.
Число родов посредством кесарева сечения растет во всем мире и в настоящее время составляет более 30% родов в наиболее населенных странах (например, США, Китай, Бразилия).
Помимо родов посредством кесарева сечения дисбиоз микробиоты может вызываться и другими факторами, в том числе преждевременными родами, воздействием антибиотиков в период внутриутробного развития, в ходе родов или после появления на свет, парентеральным кормлением, госпитализацией или психологическим стрессом. Дисбиоз микробиоты может также быть следствием нарушений функции желудочно-кишечного тракта (включая расстройства пищеварения, расстройства моторики, желудочно-кишечный рефлюкс, медленный желудочно-кишечный транзит, непереносимость перорального вскармливания, запор, диарею), болезни Гиршпрунга, синдрома короткого кишечника, желудочно-кишечной инфекции и воспаления, охватывающего желудочно-кишечный тракт (например, некротизирующего энтероколита), и обструктивных патологических состояний.
Таким образом, молодые млекопитающие, в частности, младенцы, которые страдают от любого из этих факторов, подвержены риску дисбиоза микробиоты (аберрантной колонизации микробиоты).
Считается, что аберрантная колонизация микробиоты позволяет объяснить растущую частоту некоторых расстройств у лиц, рожденных посредством кесарева сечения.
К таким расстройствам относятся тяжелые и/или широко распространенные нарушения, такие как инфекция, аллергия, сахарный диабет I типа [Neu, J., Rushing, J. (2011), Caesarean versus Vaginal Delivery: Long term infant outcomes and the Hygiene Hypothesis, Clin. Perinatol., 38, 321–331], целиакия, периферическое и центральное ожирение [Mesquita, (2013)] или тучность [HAS Goldani, HAS, Bettiol H., Barbieri MA. et al. (2011), Caesarean delivery is associated with an increased risk of obesity in adulthood in a Brazilian birth cohort study, Am. J. Clin. Nutr., 93, 1344–7], которые существенно снижают качество жизни человека, а также приводят к значительным затратам на социальное обеспечение и здравоохранение.
Риск возникновения таких расстройств увеличивается у страдающих дисбиозом микробиоты независимо от причины дисбиоза. Таким образом, преждевременно родившиеся дети (посредством вагинальных родов или кесарева сечения), которые подвергались воздействию антибиотиков в период внутриутробного развития, в ходе родов или после появления на свет или получали парентеральное питание, страдали нарушениями функции желудочно-кишечного тракта (расстройствами пищеварения, расстройствами моторики, желудочно-кишечным рефлюксом, медленным желудочно-кишечным транзитом, непереносимостью перорального вскармливания), болезнью Гиршпрунга и воспалением, охватывающим желудочно-кишечный тракт (например, некротизирующим энтероколитом), и обструктивными патологическими состояниями в первые три года жизни, также подвержены риску перечисленных выше расстройств.
С другой стороны, дисбиоз микробиоты может быть не только следствием желудочно-кишечных расстройств, но и на самом деле может приводить к их возникновению. Таким образом, дисбиоз микробиоты может, например, приводить к возникновению расстройств пищеварения, расстройств моторики, желудочно-кишечного рефлюкса, медленного желудочно-кишечного транзита, непереносимости перорального вскармливания, болезни Гиршпрунга и воспаления, охватывающего желудочно-кишечный тракт (например, некротизирующего энтероколита), и обструктивных патологических состояний.
Таким образом, профилактика и лечение дисбиоза микробиоты, проводимые на ранних этапах развития (например, в возрасте до трех лет), могут предупреждать или лечить многие связанные с ним расстройства независимо от того, проявляются ли такие расстройства в младенчестве или в дальнейшей жизни.
Лечение дисбиоза микробиоты включает восстановление микробиоты, которая существенно не отличается от микробиоты, наблюдаемой у здоровых молодых млекопитающих, которые не страдают дисбиозом микробиоты. Это означает, что различные бактериальные популяции восстанавливаются до своей оптимальной относительной численности.
В качестве средства улучшения состава микробиоты у детей, рожденных посредством кесарева сечения, предлагали пре- и пробиотики. Однако в настоящее время нет опубликованных данных, подтверждающих способность пробиотика восстанавливать здоровую сбалансированную микробиоту - такую, в которой различные кишечные бактерии присутствуют в оптимальной относительной численности.
Описан эффект введения L. reuteri матерям с семейным анамнезом атопических заболеваний в течение последних 4 недель беременности и их детям от момента появления на свет до 12 месяцев. Хотя применение пробиотиков приводило к более высоким показателям численности L. reuteri в пробах кала у младенцев из активной группы по сравнению с группой, получавшей плацебо, в течение первого года жизни, интересно, что введение L. reuteri не оказывало влияния на колонизацию бифидобактериями или C. difficile [Abrahamsson et al (2009) Probiotic Lactobacilli in Breast milk and infant stool in relation to oral intake during the first year of life, J. Ped. Gastroenterology and Nutrition 49, стр. 1–6].
В международной заявке на патент WO2008116892 описано, каким образом введение Bifidobacterium lactis CNCM I-3446 мышам в модели кесарева сечения на животных приводило к повышению концентрации Bifidobacterium breve, но не оказывало влияния на концентрации Bifidobacterimum longum.
В WO2010/010021 было показано, что младенцы, рожденные посредством кесарева сечения, отличались более низкими концентрациями фекального IgA по сравнению с младенцами, рожденными посредством вагинальных родов. Введение детской смеси, содержащей Bifidobacterium longum, повышало концентрации фекального IgA у младенцев, рожденных посредством кесарева сечения. Микробиоту младенцев не изучали.
Существует потребность в предупреждении расстройств, связанных с дисбиозом микробиоты, в том числе склонности к инфекциям, аллергии, сахарного диабета I типа, резистентности к инсулину, диабета 2 типа, целиакии, периферического и центрального ожирения, тучности, некротизирующего энтероколита, воспалительного заболевания кишечника, такого как болезнь Крона и язвенный колит, и функциональных желудочно-кишечных расстройств, таких как синдром раздраженного кишечника (СРК), функциональная диарея, функциональный запор, рецидивирующая боль в животе и диспепсия.
Раскрытие изобретения
Изобретение относится к Lactobacillus reuteri для применения в профилактике или лечении дисбиоза микробиоты у молодого млекопитающего, подверженного риску или страдающего дисбиозом микробиоты.
В соответствии с одним аспектом изобретения введение L. reuteri увеличивает или поддерживает концентрации актинобактерий и/или снижает или поддерживает концентрации протеобактерий, так что концентрации существенно не отличаются от наблюдаемых у молодых млекопитающих, которые не страдают дисбиозом микробиоты.
Лечение по существу предназначается для молодых млекопитающих в возрасте до примерно трех лет для людей и в эквивалентном возрасте для животных.
Изобретение также касается применения Lactobacillus reuteri для профилактики или лечения расстройств, связанных с дисбиозом микробиоты. Расстройства могут возникать в ранний период жизни животного, например, в возрасте менее трех лет для человека или в эквивалентном возрасте для животных, или же они могут проявляться в дальнейшей жизни млекопитающего.
Молодое млекопитающее, подверженное риску или страдающее дисбиозом микробиоты, возможно, родилось или будет рождено посредством кесарева сечения, подвергалось или подвергается воздействию антибиотиков в период внутриутробного развития, во время родов или после появления на свет или же получало или получает парентеральное питание. Молодое млекопитающее, подверженное риску или страдающее дисбиозом микробиоты, может быть или, возможно, было госпитализировано, страдало от психологического стресса или от нарушений функции желудочно-кишечного тракта, включая расстройства пищеварения, расстройства моторики, желудочно-кишечный рефлюкс, медленный желудочно-кишечный транзит, непереносимость перорального вскармливания, запор, диарею, болезнь Гиршпрунга, синдром короткого кишечника, желудочно-кишечную инфекцию и воспаление, охватывающее желудочно-кишечный тракт, например, некротизирующий энтероколит, и обструктивные патологические состояния.
К расстройствам, которые можно лечить или предупреждать за счет профилактики или лечения дисбиоза микробиоты, относятся склонность к инфекциям, аллергия, сахарный диабет I типа, резистентность к инсулину, диабет 2 типа, целиакия, периферическое и центральное ожирение, тучность, некротизирующий энтероколит, воспалительное заболевание кишечника, такое как болезнь Крона и язвенный колит, и функциональные желудочно-кишечные расстройства, такие как СРК, функциональная диарея, функциональный запор, рецидивирующая боль в животе и диспепсия.
Молодым млекопитающим, получающим лечение, может быть плод животного или человека, недоношенный или доношенный младенец или ребенок, начинающий ходить.
Lactobacillus reuteri может вводиться плоду через организм беременной матери или может вводиться молодому млекопитающему напрямую или опосредованно через организм кормящей матери.
Период введения для плода по существу составляет по меньшей мере одну неделю, предпочтительно две недели, более предпочтительно по меньшей мере один месяц, а еще более предпочтительно - в течение всего периода беременности. Период введения для молодого млекопитающего по существу составляет по меньшей мере 4 недели, предпочтительно - 2–36 месяцев для людей и в эквивалентном возрасте для животных.
Lactobacillus reuteri можно непосредственно вводить младенцу или ребенку, начинающему ходить, в виде чистого продукта или с разбавлением в воде или в грудном молоке, в биологически активной добавке к пище или в обогатителе молока, или в любой молочной добавке, применяемой в алиментарном питании, или в молочной смеси для детей от 1 до 3 лет, или в молочном напитке, или в детской смеси, такой как смесь для преждевременно родившихся младенцев, начальная смесь или смесь для прикармливаемых детей, в составе фармацевтической или нутрицевтической композиции, молочной смеси для детей от 1 до 3 лет, молочного напитка, биологически активной добавки к пище, детского питания, продукта энтерального питания, молочного йогурта, десерта или пудинга, в печенье или зерновом батончике, каше или фруктовом напитке.
Lactobacillus reuteri можно вводить беременной или кормящей матери перорально, предпочтительно в продуктах питания, напитках, диетических добавках или фармацевтических композициях.
Lactobacillus reuteri можно вводить младенцу или ребенку, начинающему ходить, в суточной дозе от 1 x 103 до 1 x 1012, предпочтительно от 1 x 107 до 1 x 1011 КОЕ (КОЕ = колониеобразующая единица).
Lactobacillus reuteri можно вводить беременной или кормящей матери или младенцу в виде композиции, содержащей от 1 x 103 до 1 x 1012 КОЕ/г сухой композиции. Композиция может содержать дополнительные ингредиенты или пребиотики, которые предпочтительно выбирают из инулина, фруктоолигосахаридов (ФОС), короткоцепочечных фруктоолигосахаридов (короткоцепочечных ФОС), галактоолигосахаридов (ГОС), фукозилированных олигосахаридов, сиалилированных олигосахаридов, олигосахаридов грудного молока (ОГМ) и олигосахаридов коровьего молока (ОКМ).
Композиция может содержать один или более дополнительных пробиотиков, которые предпочтительно выбирают из Bifidobacterium longum BB536 (ATCC BAA-999); Lactobacillus rhamnosus (CGMCC 1.3724), Bifidobacterium lactis (NCC2818) или их смесей.
Lactobacillus reuteri может представлять собой живую, инактивированную или мертвую фрагментированную культуру или может быть в форме продуктов ферментации или метаболитов или представлять собой смесь любых или всех из перечисленных выше состояний.
Предпочтительно Lactobacillus reuteri представляет собой Lactobacillus reuteri DSM 17938.
Введение L. reuteri плоду может осуществляться посредством матери. Введение также можно осуществлять недоношенному или доношенному младенцу напрямую или через материнское молоко.
Краткое описание фигур
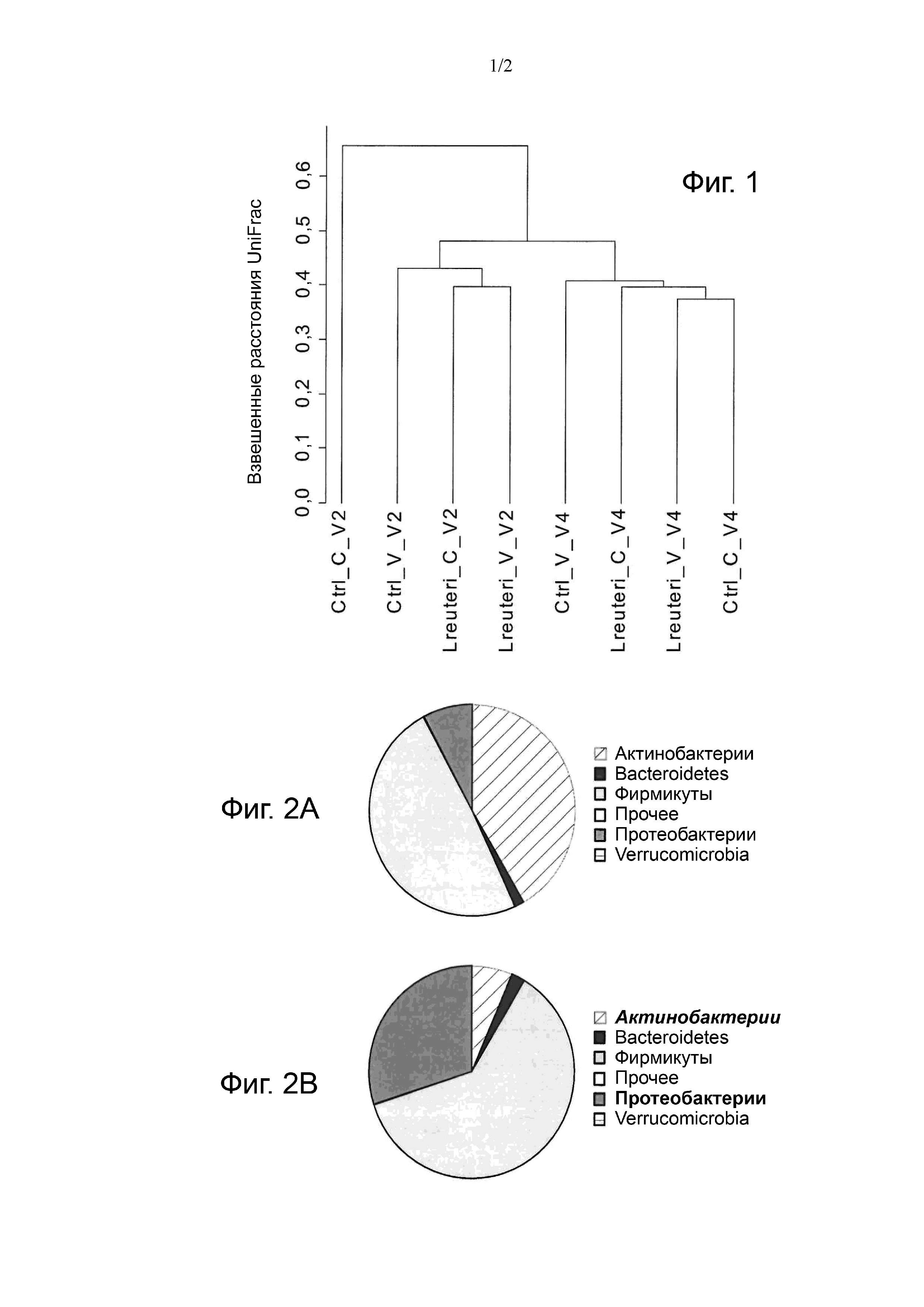
Фиг. 1. Иерархическая кластеризация, проведенная для средневзвешенной матрицы расстояний UniFrac (т. е. расстояний UniFrac, определяющих филогенетическое расхождение состава микробиоты) для 4 групп — субъектов, родившихся посредством вагинальных родов (V) и кесарева сечения (C), получавших контроль (Ctrl) или состав с L. reuteri (L. reuteri), — для двух возрастных групп: 14 дней (V2) и 4 месяца (V4). В этой дендрограмме группы объединены вместе иерархическим образом от ближайших, т. е. наиболее филогенетически близких, до наиболее удаленных, т. е. наиболее отличающихся.
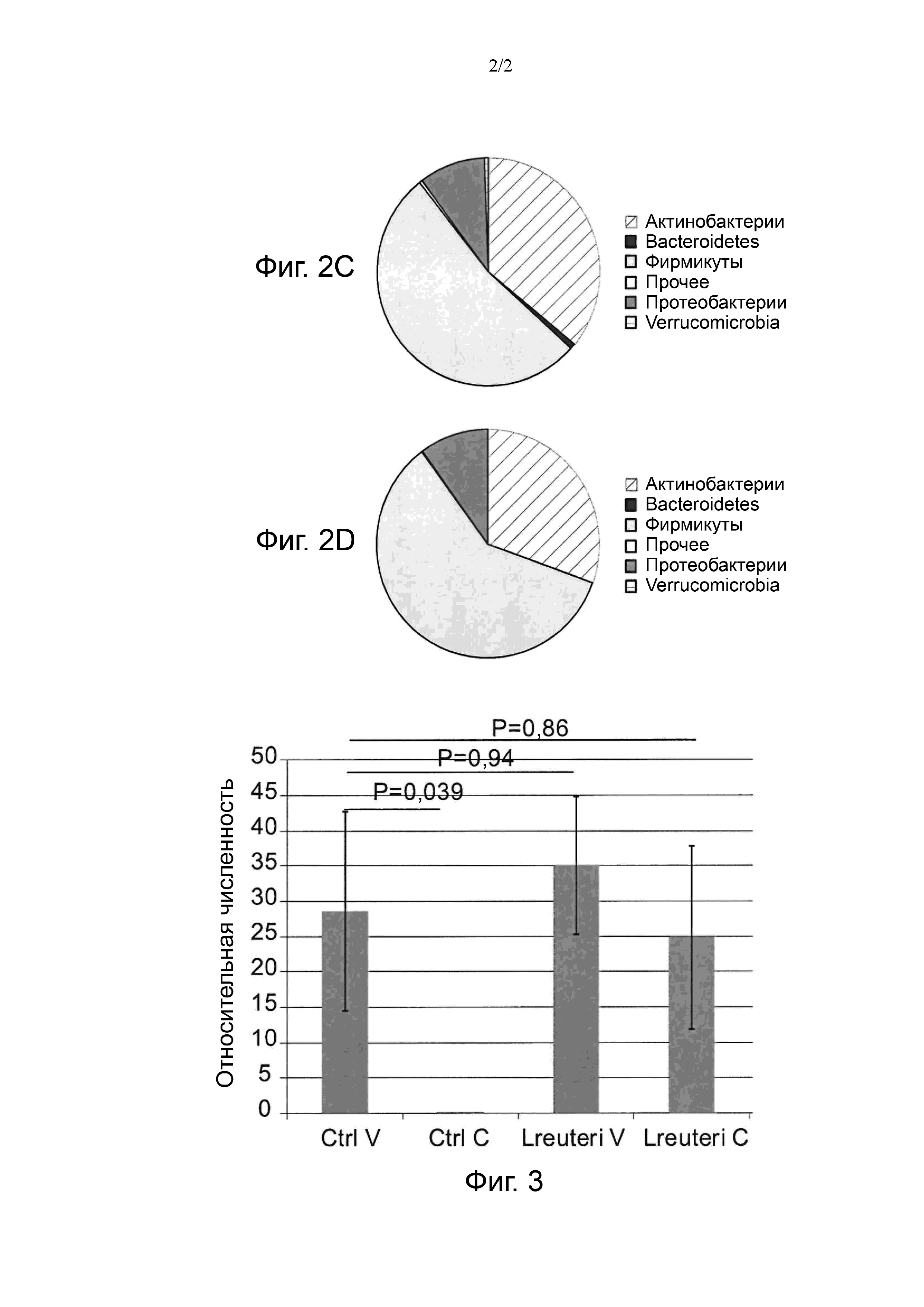
Фиг. 2. Относительная численность видов типа в кале каждой экспериментальной группы по состоянию на 2 недели.
Контроль рожденных посредством вагинальных родов (A), контроль рожденных посредством кесарева сечения (B), L. reuteri рожденных посредством вагинальных родов (C) и L. reuteri рожденных посредством кесарева сечения (D). Виды с существенно отличающейся относительной численностью выделены полужирным, если их численность больше по сравнению с контрольной группой рожденных посредством вагинальных родов, или выделены полужирным и курсивом, если их численность меньше, чем в контрольной группе рожденных посредством вагинальных родов.
Фиг. 3. Относительная численность Bifidobacterium spp. в кале каждой экспериментальной группы по состоянию на 2 недели.
Контроль рожденных посредством вагинальных родов (Ctrl V), контроль рожденных посредством кесарева сечения (Ctrl C), L. reuteri рожденных посредством вагинальных родов (L. reuteri V) и L. reuteri рожденных посредством кесарева сечения (L. reuteri C). Ошибка отражает медианное значение средней ошибки. Представлены P-значения для попарных сопоставлений между каждой группой по сравнению с контрольной группой рожденных посредством вагинальных родов (Ctrl V) (критерий Уилкоксона). Различия считают статистически значимыми при P < 0,05.
Осуществление изобретения
Определения
В данном описании следующие термины имеют приведенные ниже значения.
«Младенцы» — в соответствии с Директивой Комиссии ЕС 2006/141/EC от 22 декабря 2006 г. о детских смесях и смесях для прикармливаемых детей, пункт 1.2 (a), термин «младенцы» означает детей младше 12 месяцев.
«Недоношенный младенец» по существу означает младенца, рожденного ранее 37 недель беременности.
«Доношенный младенец» по существу означает младенца, рожденного после 37 недель беременности.
«Ребенок, начинающий ходить» по существу означает ребенка с момента, когда он научился ходить, до трех лет.
«Молодое млекопитающее» в контексте настоящего изобретения означает млекопитающее, не достигшее периода полового созревания. Это соответствует младенчеству и детству у людей и эквивалентному возрасту у животных.
«Пробиотик» означает препараты из клеток микроорганизмов, или компонентов или метаболитов клеток микроорганизмов, которые оказывают благоприятное воздействие на здоровье или состояние организма-хозяина [Salminen, S. et al. (1999); Probiotics: how should they be defined, Trends Food Sci. Technol.,10 107–10]. Определение пробиотика является по существу признанным и соответствует определению ВОЗ. Пробиотик может включать уникальный штамм микроорганизма, смесь различных штаммов и/или смесь различных видов и родов бактерий. В случае смесей для обозначения смеси или препарата пробиотиков можно по-прежнему применять один термин «пробиотик». Для целей настоящего изобретения микроорганизмы рода Lactobacillus считаются пробиотиками.
«Пребиотик» по существу означает неперевариваемый пищевой ингредиент, который благоприятно влияет на организм-хозяина посредством селективного стимулирования роста и/или активности микроорганизмов, присутствующих в кишечнике организма-хозяина, и, следовательно, может способствовать улучшению здоровья организма-хозяина.
«Аллергия» означает аллергию, которая была выявлена врачом и которую можно лечить эпизодически или более длительным образом. «Пищевая аллергия» означает аллергию, связанную с каким-либо пищевым компонентом.
«Детские смеси» — в соответствии с Директивами Комиссии ЕС 2006/141/EC от 22 декабря 2006 г. и/или 91/321/EEC от 14 мая 1991 г. по детским смесям и смесям для прикармливаемых детей, пункт 1.2 (с), термин «детские смеси» означает продукты питания, предназначенные для специального применения в пищу младенцами в первые четыре–шесть месяцев жизни, которые сами по себе удовлетворяют потребности в питании этой категории лиц. Необходимо понимать, что младенцев можно вскармливать исключительно детскими смесями или же лицо, осуществляющее уход за ребенком, может применять детскую смесь в качестве дополнения к грудному молоку. Это синоним широко распространенного выражения «начальная смесь».
«Смеси для прикармливаемых детей» — в соответствии с Директивами Комиссии ЕС 2006/141/EC от 22 декабря 2006 г. и/или 91/321/EEC от 14 мая 1991 г. по детским смесям и смесям для прикармливаемых детей, пункт 1.2 (d), термин «смеси для прикармливаемых детей» означает продукты питания, предназначенные для специального применения в пищу младенцами старше четырех месяцев и составляющие основной жидкий компонент в рационе питания с постепенно увеличивающимся разнообразием у этой категории лиц.
«Молочная смесь для детей от 1 до 3 лет» — питательная композиция на основе молока, главным образом адаптированная для ребенка в возрасте от одного года до трех лет.
«Обогатитель грудного молока» — питательная композиция для младенцев или детей младшего возраста, предназначенная для добавления в грудное молоко или разведения грудным молоком.
Термин «гипоаллергенная композиция» означает композицию, которая с малой вероятностью может вызывать аллергические реакции.
Термин «сиалилированный олигосахарид» означает олигосахарид, имеющий остаток сиаловой кислоты.
Термин «фукозилированный олигосахарид» означает олигосахарид, имеющий остаток фукозы.
Все приведенные процентные значения даны в процентах по массе, если не указано иное.
В данном описании слова «содержит», «содержащий» и аналогичные слова не следует интерпретировать в исключительном или исчерпывающем смысле. Иными словами, под ними подразумевается «включающий без ограничений».
Любую ссылку на документы предшествующего уровня техники в данном описании не следует рассматривать как признание того, что такой предшествующий уровень техники является широко известным или составляет часть общеизвестных знаний в области.
Авторы изобретения показали, что введение L. reuteri молодым млекопитающим, как правило, в возрасте до трех лет для людей и в эквивалентном возрасте для животных препятствует возникновению дисбиоза микробиоты.
Таким образом, введение L. reuteri обеспечивает профилактику возникновения расстройств, связанных с дисбиозом микробиоты. К таким расстройствам относятся склонность к инфекциям, аллергия, сахарный диабет I типа, резистентность к инсулину, диабет 2 типа, целиакия, периферическое и центральное ожирение, тучность, некротизирующий энтероколит, воспалительное заболевание кишечника, такое как болезнь Крона и язвенный колит, и функциональные желудочно-кишечные расстройства, такие как СРК, функциональная диарея, функциональный запор, рецидивирующая боль в животе и диспепсия.
Дисбиоз микробиоты может быть следствием родов посредством кесарева сечения, преждевременных родов, воздействия антибиотиков в период внутриутробного развития или после появления на свет, парентерального кормления, госпитализации или психологического стресса, нарушений функции желудочно-кишечного тракта (расстройств пищеварения, расстройств моторики, желудочно-кишечного рефлюкса, медленного желудочно-кишечного транзита, непереносимости перорального вскармливания, запора, диареи), болезни Гиршпрунга, синдрома короткого кишечника, желудочно-кишечной инфекции и воспаления, охватывающего желудочно-кишечный тракт (например, некротизирующий энтероколит), и обструктивных патологических состояний.
Таким образом, введение L. reuteri будет особенно полезно для лиц, у которых наблюдается/наблюдалось по меньшей мере одно из перечисленных состояний.
В соответствии с предпочтительным вариантом осуществления изобретения введение L. reuteri обеспечивает профилактику или лечение дисбиоза микробиоты и связанных с ним расстройств у младенцев, родившихся посредством кесарева сечения.
В соответствии с другими вариантами осуществления изобретения L. reuteri вводят молодому млекопитающему, которое подвергалось воздействию антибиотиков в период внутриутробного развития или после рождения, или которое получало парентеральное питание, в целях профилактики или лечения дисбиоза микробиоты и связанных с ним расстройств.
У молодых млекопитающих, в частности, у младенцев, которые страдали дисбиозом микробиоты в момент рождения или в течение нескольких месяцев, или в первые три года после рождения вследствие любого из упомянутых выше состояний, могут впоследствии возникать любые из перечисленных выше расстройств в течение нескольких недель, или месяцев, или даже лет после первого проявления дисбиоза микробиоты. Таким образом, лечение L. reuteri до родов (пренатально), или в первые три года жизни человека, или в эквивалентный период времени у животных позволяет обеспечивать профилактику или лечение расстройств, которые:
(a) могут возникать в первые три года жизни у людей (или в эквивалентном возрасте у животных) и
(b) могут проявляться в дальнейшей жизни (например, во взрослом возрасте), но были первоначально вызваны дисбиозом микробиоты в момент появления на свет и/или в течение трех лет после появления на свет.
К примерам расстройств, которые проявляются в дальнейшей жизни, относятся низкая сопротивляемость инфекциям, аллергия, астма, атопические заболевания, сахарный диабет I типа, резистентность к инсулину, диабет 2 типа, целиакия, периферическое и центральное ожирение и тучность, некротизирующий энтероколит и воспалительные расстройства/или заболевания кишечника.
Хотя в общем случае факторы, вызывающие дисбиоз микробиоты, могут возникать в любой период жизни индивида, в настоящем изобретении основное внимание уделяется лечению молодого млекопитающего в возрасте до трех лет для людей и в эквивалентном возрасте для животных. В этот период происходит развитие кишечника и иммунной системы, и этот процесс модулируется составом микробиоты, колонизирующей кишечник. Таким образом, профилактика и лечение дисбиоза микробиоты в этот критический период приводит к положительным результатам для индивидов в раннем детстве и после него, а также достигающих взрослого возраста.
В соответствии с несколькими вариантами осуществления изобретения введение L. reuteri людям в возрасте до трех лет или животным в эквивалентном возрасте, которые страдают дисбиозом микробиоты или подвержены риску его возникновения, предупреждает или лечит расстройства, связанные с дисбиозом микробиоты.
В соответствии с одним вариантом осуществления изобретения одним из расстройств, связанных с дисбиозом микробиоты, которое можно предупреждать или лечить, является низкая сопротивляемость инфекциям.
В соответствии с другим вариантом осуществления изобретения одним из расстройств, связанных с дисбиозом микробиоты, которое можно предупреждать или лечить, является периферическое и центральное ожирение и/или тучность.
В соответствии с другим вариантом осуществления изобретения расстройствами, связанными с дисбиозом микробиоты, которые можно предупреждать или лечить, являются сахарный диабет I типа, резистентность к инсулину или диабет 2 типа.
В соответствии с другим вариантом осуществления изобретения расстройствами, связанными с дисбиозом микробиоты, которые можно предупреждать или лечить, являются воспалительное заболевание кишечника или некротизирующий энтероколит.
В соответствии с другим вариантом осуществления изобретения расстройствами, связанными с дисбиозом микробиоты, которые можно предупреждать или лечить, являются аллергия, астма и/или атопические заболевания.
Для всех перечисленных выше вариантов осуществления дисбиоз микробиоты и, таким образом, вызванные им расстройства могут быть вызваны любым одним или более факторами, такими как роды посредством кесарева сечения, преждевременные роды (посредством вагинальных родов или кесарева сечения), воздействие антибиотиков в период внутриутробного развития или после появления на свет, парентеральное кормление в первые три года жизни, госпитализация или психологический стресс, нарушения функции желудочно-кишечного тракта (расстройства пищеварения, расстройства моторики, желудочно-кишечный рефлюкс, медленный желудочно-кишечный транзит, непереносимость перорального вскармливания, запор, диарея), болезнь Гиршпрунга, синдром короткого кишечника, желудочно-кишечная инфекция и воспаление, охватывающее желудочно-кишечный тракт (например, некротизирующий энтероколит), и обструктивные патологические состояния.
В соответствии с предпочтительным вариантом осуществления изобретения введение L. reuteri проводят младенцам и детям, начинающим ходить, которые родились посредством кесарева сечения.
В соответствии с изобретением можно использовать любой штамм L. reuteri. В соответствии с предпочтительным вариантом осуществления изобретения L. reuteri представляет собой Lactobacillus reuteri DSM 17938, штамм L. reuteri, принадлежащий Biogaia AB, Швеция, научное обозначение штамма — DSM 17938, прошлое название — L. reuteri ATCC 55730. Идентификация DSM определяется в соответствии с требованиями DSMZ Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH Inhoffenstr. 7b, D-38124 Braunschweig, Germany. DSM 17938. Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH Inhoffenstr. 7b D-38124 г. Брауншвейг – Германия.
Если говорить о других примерах L. reuteri, пригодных для применения в соответствии с изобретением, L. reuteri представляет собой ATCC PTA 6475, L. reuteri ATCC PTA 4659 и L. reuteri ATCC PTA 5289 (поставляются Biogaia, Швеция), L. reuteri RC-14 (поставляются Christian Hansen, Франция), L. reuteri NCIMB 30242 (поставляются в форме биологически активной добавки к пище Cardiovivа компанией Micropharma Ltd., Канада) и L. reuteri DSMZ 17648 (поставляются под коммерческим названием Pylopass, компанией Lonza, Швейцария)
Введение L. reuteri плоду может осуществляться посредством матери. Введение также можно осуществлять недоношенному или доношенному младенцу напрямую или через материнское молоко.
Введение можно осуществлять по существу ребенку вплоть до возраста трех лет или животному эквивалентного возраста.
Дозы пробиотика
Пробиотик может вводиться в форме суточной дозы или в форме композиции. Суточная доза L. reuteri, которую вводят беременным или кормящим матерям, составляет от 1 x 106 до 1 x 1012 КОЕ, предпочтительно от 1 x 108 до 1 x 1011 КОЕ (КОЕ = колониеобразующая единица). Суточная доза, подходящая для новорожденных, находится в пределах от 1 x 103 до 1 x 1012, предпочтительно от 1 x 107 до 1 x 1011 КОЕ.
Таким образом, L. reuteri может присутствовать в композиции в широком диапазоне процентного содержания при условии, что он обеспечивает описанное благоприятное воздействие. Однако L. reuteri предпочтительно присутствует в композиции в количестве, эквивалентном от 1 x 103 до 1 x 1012 КОЕ/г сухой композиции. Предпочтительно при введении беременным или кормящим матерям, или молодым взрослым пробиотик присутствует в количестве, эквивалентном от 1 x 104 до 1 x 1011 КОЕ/г сухой композиции. Количество пробиотика на каждый грамм сухой композиции для введения новорожденным, детям, начинающим ходить, и детям младшего возраста может быть меньше, предпочтительно от 1 x 106 до 1 x 109, и, конечно, следует придерживаться перечисленных выше суточных доз.
Приведенные выше дозы учитывают возможность использования живых, инактивированных или мертвых бактерий, или даже бактерий, присутствующих в виде фрагментов, например, ДНК или клеточных стенок, или цитоплазматических материалов, или в виде продуктов ферментации бактерий, или в виде метаболитов бактерий. Иными словами, количество бактерий, содержащихся в составе, выражается в колониеобразующей способности этого количества бактерий, которая проявлялась бы, если бы все бактерии были живыми, независимо от того, являются ли они фактически живыми, инактивированными или мертвыми фрагментированными, или в форме продуктов ферментации или метаболитов, или в виде смеси любых или всех перечисленных состояний.
Способ введения
(i) Введение беременным матерям
L. reuteri можно вводить беременным матерям различными способами при условии, что при этом обеспечивается контакт с желудочно-кишечным трактом или влагалищем беременных матерей. Например, L. reuteri можно вводить вагинально в форме капсулы, суппозитория или таблетки. Предпочтительным является пероральное введение. L. reuteri предпочтительно вводят перорально в композиции в составе пищи, напитков, таблеток, капсул, пастилок или жевательной резинки, или диетических добавок для беременных матерей. Композиции также можно вводить в составе фармацевтической композиции. Однако при патологических состояниях или при использовании энтерального кормления в других случаях введение композиции можно осуществлять в виде добавления в композицию для энтерального кормления. Энтеральное кормление может быть назогастральным, назоеюнальным или посредством чрескожной эндоскопической гастростомии или еюностомии.
(ii) Введение новорожденным млекопитающим
L. reuteri можно также вводить перорально, непосредственно молодому млекопитающему в чистом виде (в чистом виде или, например, с разбавлением в воде или материнском молоке), в качестве добавки (например, в качестве добавки обогатителя грудного молока), или в качестве фармацевтической или нутрицевтической композиции, или в качестве ингредиента в детской молочной смеси. Такая смесь может представлять собой «смесь для недоношенных младенцев», если молодое млекопитающее родилось преждевременно или с низким весом при рождении, «начальную смесь» или «смесь для прикармливаемых детей». Смесь для прикармливаемых детей обычно используют для младенцев в возрасте старше шести месяцев. Смесь может также представлять собой гипоаллергенную (НА) смесь, в которой гидролизованы белки коровьего молока. Пример начальной смеси приведен в примере 2.
(iv) Введение детям, начинающим ходить
L. reuteri можно также вводить перорально детям, начинающим ходить, и детям младшего возраста в форме фармацевтической или нутрицевтической композиции, в молочной смеси для детей от 1 до 3 лет, молочном напитке, биологической активной добавке к пище, в детском питании, в продукте энтерального питания, молочном йогурте, десерте или пудинге, в печенье или зерновом батончике, каше или фруктовом напитке.
(v) Введение животным
L. reuteri можно также вводить перорально животным отдельно, или в воде, или в форме биологически активной добавки к пище, фармацевтической или нутрицевтической композиции, или молока, или корма для домашних животных.
Введение с другими соединениями
L. reuteri можно вводить отдельно (например, в чистом виде или с разбавлением водой или молоком, включая грудное молоко) или в смеси с другими соединениями (такими как диетические добавки, питательные добавки, лекарственные препараты, носители, ароматизаторы, перевариваемые или неперевариваемые ингредиенты). Примерами типичных диетических добавок являются витамины и минеральные вещества. В предпочтительном варианте осуществления изобретения L. reuteri вводят в композиции, например детской смеси, вместе с другими соединениями, которые усиливают описанное благоприятное воздействие на молодых млекопитающих. Такими синергическими соединениями могут быть носители или матрица, которые способствуют доставке L. reuteri в кишечный тракт, или же они могут иным способом усиливать эффект воздействия композиции на микробиоту потомства. Такими соединениями могут быть другие активные соединения, которые синергически или независимым образом влияют на развитие энтеральной нервной системы младенца и/или усиливают эффект пробиотика. Примером таких синергических соединений является мальтодекстрин. Одним из факторов воздействия мальтодекстрина является функция носителя для пробиотика, что усиливает его эффект и препятствует агрегированию.
Другими примерами синергетических соединений, которые можно включить в композиции, особенно в детскую смесь изобретения, являются пребиотические соединения. Пребиотик представляет собой неперевариваемый пищевой ингредиент, который благоприятно влияет на организм хозяина путем селективной стимуляции роста и/или активности одного вида или ограниченного числа бактерий в толстом кишечнике и, таким образом, улучшает состояние здоровья хозяина. Такие ингредиенты являются неперевариваемыми в том смысле, что они не расщепляются и не всасываются в желудке или тонком кишечнике и, таким образом, в интактном виде проходят в толстый кишечник, в котором они селективно ферментируются полезными бактериями. Примеры пребиотиков включают некоторые олигосахариды, такие как фруктоолигосахариды (ФОС), олигосахариды коровьего молока (ОКМ) и галактоолигосахариды (ГОС). Можно использовать комбинацию пребиотиков, например, 90% ГОС и 10% короткоцепочечных фруктоолигосахаридов, например, в виде продукта, продаваемого под торговой маркой Raftilose®, или 10% инулина, например, в виде продукта, продаваемого под торговой маркой Raftiline®. Другие примеры пребиотиков, которые можно применять в контексте настоящего изобретения, включают группу олигосахаридов, получаемых из молока или других источников, необязательно содержащих сиаловую кислоту, фруктозу, фукозу, галактозу или маннозу. Предпочтительными пребиотиками являются сиалоолигосахариды (SOS), фруктоолигосахариды (ФОС), галактоолигосахариды (ГОС), изомальтоолигосахариды (IMO), ксилоолигосахариды (XOS), арабиноксилоолигосахариды (AXOS), маннанолигосахариды (MOS), соевые олигосахариды, гликозилсахароза (GS), лактосахароза (LS), сиалиллактоза (SL), фукозиллактоза (FL), лакто-N-неотетраоза (LNNT), лактонеотетраоза (LNT); лактулоза (LA), палатинозаолигосахариды (PAO), мальтоолигосахариды, смолы/или их гидролизаты, пектины, крахмалы и/или их гидролизаты. Детская смесь в соответствии с изобретением предпочтительно дополнительно содержит по меньшей мере один пребиотик в количестве от 0,3 до 10% общей массы сухой композиции.
В частности, в композицию в соответствии с изобретением можно включить олигосахариды грудного молока, например сиалилированные олигосахариды, описанные в документе WO 2012/069416, опубликованном 31 мая 2012 г. Последние олигосахариды могут действовать синергично с L. reuteri изобретения, чтобы способствовать восстановлению после дисбиоза микробиоты, вызванного кесаревым сечением.
Можно также вводить другие пробиотики. Предпочтительно пробиотик для этой цели можно выбирать из группы, состоящей из Bifidobacterium, Lactobacillus, Lactococcus, Enterococcus, Streptococcus, Kluyveromyces, Saccharomyces, Candida, в частности, можно выбирать из группы, состоящей из Bifidobacterium longum, Bifidobacterium lactis, Bifidobacterium animalis, Bifidobacterium breve, Bifidobacterium infantis, Bifidobacterium adolescentis, Lactobacillus acidophilus, Lactobacillus casei, Lactobacillus paracasei, Lactobacillus salivarius, Lactobacillus lactis, Lactobacillus rhamnosus, Lactobacillus johnsonii, Lactobacillus plantarum, Lactobacillus salivarius, Lactococcus lactis, Enterococcus faecium, Saccharomyces cerevisiae, Saccharomyces boulardii или их смесей, предпочтительно выбирать из группы, состоящей из Bifidobacterium longum NCC3001 (ATCC BAA-999), Bifidobacterium longum NCC2705 (CNCM I-2618), Bifidobacterium longum NCC490 (CNCM I-2170), Bifidobacterium lactis NCC2818 (CNCM I-3446), Bifidobacterium breve штамм A, Lactobacillus paracasei NCC2461 (CNCM I-2116), Lactobacillus johnsonii NCC533 (CNCM I-1225), Lactobacillus rhamnosus GG (ATCC53103), Lactobacillus rhamnosus NCC4007 (CGMCC 1.3724), Enterococcus faecium SF 68 (NCC2768; NCIMB10415) и их смесей.
Суточные дозы углеводов и всех остальных соединений, вводимых с L. reuteri, должны в любом случае соответствовать опубликованным руководящим указаниям по безопасности и нормативным требованиям. Это особенно важно в отношении введения новорожденным младенцам, в частности, рожденным с низким весом при рождении, с очень низким или чрезвычайно низким весом при рождении.
Детские смеси, содержащие L. reuteri, могут содержать источник белка в количестве не более 4,0, 3,0 или 2,0 г/418,4 кДж (100 ккал), предпочтительно от 1,8 до 2,0 г/418,4 кДж (100 ккал). Тип белка не считается важным для настоящего изобретения при условии, что соблюдены минимальные требования по содержанию незаменимых аминокислот и обеспечивается удовлетворительной рост, хотя предпочтительно, чтобы более 50 мас.% источника белка обеспечивалось за счет молочной сыворотки. В одном варианте осуществления изобретения содержание белка составляет от 30% до 80% белков молочной сыворотки. Таким образом, можно применять источники белка на основе молочной сыворотки, казеина и их смесей, а также источники белка на основе сои. Что касается белков молочной сыворотки, источник белка может быть основан на кислой сыворотке или сладкой молочной сыворотке либо на их смесях и может включать альфа-лактальбумин и бета-лактоглобулин в любых желаемых соотношениях.
Белки могут быть интактными или гидролизованными, или могут представлять собой смесь интактных и гидролизованных белков. Может быть желательно вводить частично гидролизованные белки (степень гидролиза от 2 до 20%), например, младенцам, предположительно подверженным риску развития аллергии на коровье молоко. При необходимости применения гидролизованных белков процесс гидролиза может проводиться по желанию и так, как известно в данной области. Например, гидролизат белка молочной сыворотки можно приготовить ферментативным гидролизом фракции молочной сыворотки за один или более этапов. Если фракция молочной сыворотки, которая используется в качестве исходного материала, по существу не содержит лактозу, установлено, что в процессе гидролиза блокировка лизина в белке проявляется в гораздо меньшей степени. Это позволяет снизить степень блокировки лизина от приблизительно 15 мас.% общего лизина до менее приблизительно 10 мас.% лизина; например, приблизительно 7 мас.% лизина, что значительно улучшает питательное качество источника белка.
Композиция может также содержать источник углеводов и/или источник жира. Детская смесь может содержать источник липидов. Источник липидов может представлять собой любой липид или жир, который подходит для применения в детских смесях. Предпочтительные источники жиров включают пальмовый олеин, молочный жир, подсолнечное масло с высоким содержанием олеиновой кислоты и сафлоровое масло с высоким содержанием олеиновой кислоты. Также можно добавлять незаменимые жирные кислоты, линолевую кислоту и α-линоленовую кислоту, а также небольшие количества масел, содержащих большие количества арахидоновой кислоты и докозагексаеновой кислоты в готовом виде, например, рыбьи жиры или микробные масла. В целом, содержание жиров должно быть предпочтительно таким, чтобы составлять 30–55% от общей энергетической ценности детской смеси. Источник жиров предпочтительно имеет соотношение жирных кислот n-6 к n-3 от приблизительно 5 : 1 до приблизительно 15 : 1, например от приблизительно 8 : 1 до приблизительно 10 : 1.
К питательной композиции можно добавлять дополнительный источник углеводов. Предпочтительно он должен обеспечивать от приблизительно 40% до приблизительно 80% энергетической ценности питательной композиции. Можно применять любой подходящий углевод, например сахарозу, лактозу, глюкозу, фруктозу, сухой кукурузный сироп, мальтодекстрин или их смесь.
При желании также можно добавлять дополнительное пищевое волокно. В случае добавления предпочтительно пищевое волокно должно составлять до приблизительно 5% энергетической ценности питательной композиции. Пищевые волокна могут происходить из любого подходящего источника, включая, например, сою, горох, овес, пектин, гуаровую камедь, аравийскую камедь, фруктоолигосахариды или их смесь. В питательную композицию можно включать подходящие витамины и минеральные вещества в количестве, соответствующем руководящим указаниям.
Примеры минеральных веществ, витаминов и других питательных веществ, необязательно присутствующих в детской смеси, включают витамин А, витамин В1, витамин В2, витамин В6, витамин В12, витамин Е, витамин К, витамин С, витамин D, фолиевую кислоту, инозит, ниацин, биотин, пантотеновую кислоту, холин, кальций, фосфор, йод, железо, магний, медь, цинк, марганец, хлорид, калий, натрий, селен, хром, молибден, таурин и L-карнитин. Минеральные вещества обычно добавляют в форме соли. Присутствие и количества конкретных минеральных веществ и других витаминов зависят от целевой популяции младенцев.
Детская смесь может необязательно содержать другие вещества, которые могут оказывать благоприятное воздействие, такие как волокна, лактоферрин, нуклеотиды, нуклеозиды и т.п.
В композицию можно включить одну или более незаменимых длинноцепочечных жирных кислот (ДЦ-ПНЖК). Примерами ДЦ-ПНЖК, которые можно добавлять, являются докозагексаеновая кислота (ДГК) и арахидоновая кислота (АРК). ДЦ-ПНЖК можно добавлять в таких концентрациях, которые составляют более 0,01% жирных кислот, присутствующих в композиции.
При желании в питательную композицию можно включить один или более пищевых эмульгаторов; например сложные эфиры диацетилвинной кислоты и моно- и диглицеридов, лецитин и моно- или диглицериды или их смесь. Аналогично можно включить подходящие соли и/или стабилизаторы. В композицию можно добавлять ароматизаторы.
Период введения
Продолжительность введения может быть различной. Хотя положительные эффекты ожидаются в течение относительно небольшого периода введения (например, ежедневного введения новорожденным в течение от одной до двух недель), предполагается, что при более длительном введении эффект будет более сильным или по меньшей мере сохранится у младенцев более старшего возраста или детей, начинающих ходить (например, при длительности введения три, пять, восемь, 12, 24 и 36 месяцев). При введении животным применяют соответствующую продолжительность введения.
Беременная мать может начать принимать L. reuteri сразу после того, как ей станет известно о своей беременности. Однако введение можно начинать также до начала беременности, например, если женщина стремится забеременеть. Введение можно начинать в любое время после начала беременности. Его можно начинать на относительно позднем сроке беременности, предпочтительно на 3, 4, 5, 6, 7, 8 или 9 месяце беременности в случае человеческой беременности, или в соответствующие периоды для других млекопитающих, или не позднее чем за одну неделю до предполагаемой даты родов.
Период введения может быть непрерывным (например, до и включая лактацию и вплоть до отлучения от груди) или прерывистым. Непрерывное введение является предпочтительным в связи с развитием более устойчивого эффекта. Однако предполагается, что прерывистое введение (например, ежедневное введение в течение одной недели в месяц или каждую вторую неделю) может оказывать положительное воздействие на потомство.
Введение может охватывать по меньшей мере часть периода беременности и по меньшей мере часть периода лактации, если новорожденный вскармливается материнским молоком, или эквивалентный период, если новорожденный не вскармливается материнским молоком.
Предпочтительно период введения для беременной матери охватывает по существу весь период беременности, хотя он может быть меньше. Аналогичным образом период введения для кормящей матери предпочтительно охватывает по существу весь период лактации, хотя данный период тоже может быть меньше.
Предпочтительно введение матери осуществляют посредством ежедневного приема внутрь (один или два раза в день) или еженедельного приема внутрь (один или два раза в неделю).
L. reuteri можно непосредственно вводить ребенку грудного возраста. В частности, это актуально, если мать не кормит грудью, или после прекращения кормления грудью. Однако ребенок грудного возраста, находящийся на грудном вскармливании, также может получать L. reuteri путем непосредственного введения.
Предпочтительно введение младенцу осуществляют путем ежедневного приема внутрь. Например, если L. reuteri вводят в составе детской смеси, введение осуществляют во время каждого кормления, т. е. от приблизительно четырех до приблизительно шести раз в сутки для младенцев младше одного года, причем число кормлений уменьшается с возрастом.
Введение младенцу путем либо грудного вскармливания, либо непосредственного введения, либо обоими способами можно продолжать вплоть до шестимесячного возраста или дольше. Таким образом, L. reuteri можно вводить во время лактации, если она имеет место, или после частичного или полного отнятия от груди.
Эффект введения L. reuteri
Авторы настоящего изобретения неожиданно обнаружили, что введение L. reuteri младенцам, родившимся посредством кесарева сечения, приводит не только к колонизации L. reuteri, как можно было бы ожидать, но к полному восстановлению «нормальной» микробиоты, характерной для младенца, рожденного посредством вагинальных родов, который не подвергался воздействию антибиотиков и не страдал от факторов, которые, как известно, нарушают состав микробиоты кишечника у младенцев. Это было продемонстрировано в ходе клинического исследования, включающего генетический анализ микробиоты из проб кала младенцев (см. пример 1).
На основании полученных данных можно сделать вывод о том, что введение L. reuteri молодым млекопитающим, в частности младенцам, позволяет лечить или предупреждать дисбиоз микробиоты. Дисбиоз микробиоты в примере 1 был вызван родами посредством кесарева сечения. В общем случае дисбиоз микробиоты может также быть следствием преждевременных родов (посредством кесарева сечения или вагинальных родов), воздействия антибиотиков в период внутриутробного развития или после появления на свет, парентерального кормления, госпитализации, психологического стресса, нарушений функции желудочно-кишечного тракта (расстройств пищеварения, расстройств моторики, желудочно-кишечного рефлюкса, медленного желудочно-кишечного транзита, непереносимости перорального вскармливания, запора, диареи), болезни Гиршпрунга, синдрома короткого кишечника, желудочно-кишечной инфекции и воспаления, охватывающего желудочно-кишечный тракт (например, некротизирующего энтероколита), и обструктивных патологических состояний.
Введение L. reuteri способствует восстановлению «нормальной» популяции микробиоты, которая наблюдается у младенцев, рожденных посредством вагинальных родов. L. reuteri способствует восстановлению после дисбиоза, вызванного кесаревым сечением. В клиническом эксперименте, который подробно описан в примере 1, оценивали действие введения L. reuteri на восстановление после дисбиоза микробиоты, вызванного кесаревым сечением. Авторы изобретения сопоставили эволюцию состава микробиоты у младенцев, рожденных посредством кесарева сечения и получавших детскую смесь, содержащую L. reuteri DSM 17938, или контрольную смесь сходного состава, но без пробиотика.
Роды посредством кесарева сечения вызывали серьезные изменения в глобальном профиле микробиоты и численности видов в контрольной группе, особенно через 2 недели после появления на свет, но по-прежнему обнаруживались в возрасте 4 месяцев.
На фиг. 1 приводится дендрограмма кластеризации четырех групп в соответствии с филогенетическим сходством их профиля микробиоты в возрасте 2 недель и 4 месяцев. В возрасте 2 недель группы родившихся посредством вагинальных родов близко кластеризуются с группой родившихся посредством кесарева сечения и получавших детскую смесь с L. reuteri, с четким выделением из группы кесарева сечения, получавшей контрольную смесь. В этом возрасте профиль микробиоты младенцев, родившихся посредством кесарева сечения и получавших контрольную смесь, значительно отличался от наблюдавшегося у рожденных посредством вагинальных родов (Cont C и Cont V: p = 0,009; Cont C и L. reuteri V: p = 0,01). Напротив, младенцы, рожденные посредством кесарева сечения, которые получали детскую смесь с L. reuteri, отличались профилем микробиоты, близким и статистически незначимо отклоняющимся от групп рожденных посредством вагинальных родов (L reuteri C и Cont V: p = 0,332; L. reuteri C и L. reuteri V: p = 0,682; L reuteri C и Cont C: p = 0,013).
Относительная численность в возрасте 2 недель для видов типа в различных группах приводится на фиг. 2 и в таблице 1. P-значения сопоставлений между каждой группой и контрольной группой младенцев, рожденных посредством вагинальных родов, приводятся в таблице 2.
Таблица 1. Медианные (средняя ошибка медианы) значения относительной численности для видов типа в каждой группе в возрасте 2 недель1
|
1Значения, выделенные полужирным и черным цветом, относятся к конкретной группе типов, которые статистически значимо отличаются от контрольной группы младенцев, рожденных посредством вагинальных родов (ср. таблицу 2).
Таблица 2. P-значения для каждого попарного сопоставления (критерий Уилкоксона) медианного значения относительной численности видов типа в возрасте 2 недель1
|
* P-значение не вычислялось, поскольку почти ни у кого из младенцев не было Verrucomicrobia
1Различия считают значимыми при p < 0,05.
В возрасте двух недель относительная численность актинобактерий резко сократилась у младенцев, рожденных посредством кесарева сечения и получавших контрольную смесь, тогда как численность протеобактерий в этой группе заметно увеличилась. Напротив, младенцы, рожденные посредством кесарева сечения, получавшие смесь с L. reuteri, отличались близкими концентрациями актинобактерий и протеобактерий без заметных отклонений от групп рожденных посредством вагинальных родов. Следует отметить, что тип актинобактерий включает полезные микроорганизмы, например, рода Bifidobacterium, тогда как тип протеобактерий включает потенциально патогенный род, такой как Escherichia, Shigella и Klebsiella.
Bifidobacterium не обнаруживали у большинства младенцев в контрольной группе рожденных посредством кесарева сечения. Этот факт проиллюстрирован на фиг. 3, где приводится относительная численность Bifidobacterium spp. в каждой группе в возрасте 2 недели. Bifidobacterium spp. не обнаруживали у большинства младенцев в контрольной группе рожденных посредством кесарева сечения. В результате, медианное значение для данной группы было равно 0 и статистически значимо ниже медианного значения контрольной группы рожденных посредством вагинальных родов. Напротив, концентрации Bifidobacterium spp. в группе рожденных посредством кесарева сечения, получавшей смесь с L. reuteri, приближались к показателям группы рожденных посредством вагинальных родов и статистически значимо не отличались от них.
Потенциально опасные роды Klebsiella и Escherichia/Shigella отличались гораздо более высокой численностью в контрольной группе рожденных посредством кесарева сечения (3,0% и 18,2% соответственно) по сравнению с аналогичной группой рожденных посредством вагинальных родов (0,3% и 5,6% соответственно). Относительная численность этих родов приближалась к концентрациям для рожденных посредством вагинальных родов в группе кесарева сечения с L. reuteri (1,2% и 7,4% соответственно).
В возрасте 4 месяца глобальный профиль микробиоты в каждой группе по сравнению с контрольной группой рожденных посредством вагинальных родов уже не имел существенного значения (фиг. 1), что ожидаемым образом свидетельствовало о более умеренном влиянии кесарева сечения на состав микробиоты в этом возрасте. Однако существенное влияние способа родоразрешения на относительную численность нескольких видов по-прежнему наблюдалось в группе, получавшей контрольную смесь. Кесарево сечение приводило к росту относительной численности типа фирмикутов из семейства Enterococcaceae и родов Enterococcus и Coprococcus, а также пониженной относительной численности семейства Coriobacteriaceae и рода Collinsella.
Интересно, что по сравнению с младенцами, рожденными посредством вагинальных родов, не отмечалось статистически значимых отличий в относительной численности любого из видов для группы кесарева сечения, получавшей смесь с добавкой L. reuteri.
Таким образом, смесь, содержавшая L. reuteri, вызывала сдвиг в составе микробиоты детей после кесарева сечения в сторону профиля/концентраций у рожденных посредством вагинальных родов, при этом значительный эффект наблюдался в возрасте две недели с полным восстановлением микробиоты в возрасте четыре месяца.
Смесь с L. reuteri способствовала восстановлению после дисбиоза микробиоты, вызванного кесаревым сечением. В частности, L. reuteri вызывал увеличение концентрации актинобактерий и снижение уровней протеобактерий, так что концентрации указанных типов существенно не отличались от наблюдаемых у младенцев, рожденных посредством вагинальных родов. Такое общее восстановление после дисбиоза микробиоты у младенцев после кесарева сечения, которое близко воспроизводит показатели младенцев, рожденных посредством вагинальных родов, представляет собой важное преимущество для сохранения здоровья рожденных посредством кесарева сечения в младенчестве, детстве и в дальнейшей жизни. Таким образом, введение L. reuteri может предупреждать или лечить расстройства, связанные с дисбиозом микробиоты, вызванным кесаревым сечением, у молодых млекопитающих. Насколько известно авторам настоящего изобретения, в известном уровне техники ни одно из пероральных средств лечения не демонстрировало такую возможность лечения дисбиоза микробиоты.
Изобретение приносит пользу для тех молодых млекопитающих, которые страдают от дисбиоза микробиоты или подвержены риску его возникновения. В частности, к популяции, на которую введение L. reuteri в соответствии с изобретением может оказать благотворное влияние, относятся такие молодые млекопитающие в возрасте до 3 лет, которые:
- были рождены посредством кесарева сечения,
- подвергались воздействию антибиотиков в период внутриутробного развития, или сразу после рождения подвергались или по-прежнему подвергаются воздействию антибиотиков,
- родились преждевременно (посредством вагинальных родов или кесарева сечения),
- получали или получают парентеральное питание,
- перенесли или по-прежнему переносят госпитализацию или психологический стресс,
- страдали или по-прежнему страдают нарушениями функции желудочно-кишечного тракта, включая расстройства пищеварения, расстройства моторики, желудочно-кишечный рефлюкс, медленный желудочно-кишечный транзит, непереносимость перорального вскармливания, болезнь Гиршпрунга и воспаление, охватывающие желудочно-кишечный тракт (например, некротизирующий энтероколит), и обструктивные патологические состояния.
Хотя изобретение описано при помощи примера, следует понимать, что возможно внесение изменений и модификаций без отклонения от объема изобретения, определяемого формулой изобретения. Кроме того, если существуют эквиваленты конкретных элементов, такие эквиваленты включены так, как если бы они были конкретно упомянуты в настоящем описании.
Пример 1
Клиническое исследование
Структура исследования
Проводилось одноцентровое, рандомизированное, контролируемое, двойное слепое клиническое исследование двух параллельных групп. В исследовании участвовали здоровые доношенные младенцы, которые предположительно получали питание исключительно в виде смеси. Младенцев включали в исследование в течение 48 часов после рождения и рандомизировали в одну из 2 групп по варианту лечения:
1. субъекты, получающие начальную смесь, содержащую Lactobacillus reuteri (108 КОЕ L. reuteri в день) с момента рождения до 6 месяцев (n = 60);
2. субъекты, получающие начальную смесь без Lactobacillus reuteri с момента рождения до 6 месяцев (n = 60).
Пробы кала собирали у младенцев в возрасте 14 дней и 4 месяца, выдерживали при температуре 4°C в течение максимум 10 часов после выделения и хранили замороженными при –80°C до проведения анализа микробиоты.
Анализ фекальной микробиоты
Двадцать младенцев в каждой группе отбирали для изучения состава фекальной микробиоты. Выбор проводили случайным образом, но по двум критериям стратификации: полу (10 мальчиков и 10 девочек в каждой группе) и способу родоразрешения (10 младенцев, рожденных посредством вагинальных родов, и 10 младенцев, рожденных посредством кесарева сечения, в каждой группе).
Состав фекальной микробиоты измеряли путем пиросеквенирования вариабельных участков генов 16S РНК, присутствующих в микробной популяции, в обеих временных точках. Для извлечения ДНК из проб кала использовали Qiacube (QIAgen). Структура праймеров опиралась на ранее предложенный подход [Hamady, M., Walker, J. J., Harris, J. K., N. et al. (2008), Error-correcting barcoded primers for pyrosequencing hundreds of samples in multiplex, Nat. Methods, 5:235-237], чтобы обеспечить амплификацию вариабельных областей с V1 по V3 гена 16S, обладающих высоким уровнем таксономической информативности. Проводили мультиплексное пиросеквенирование с использованием методик штрих-кодирования. Каждую пробу в среднем характеризовали посредством 1500 результатов секвенирования. Считывания высокого качества выявляли и анализировали с помощью аналитического пакета QIIME [Caporaso, J.G., Kuczynski, J., Stombaugh, J. et al. (2010), QIIME allows analysis of high-throughput community sequencing data, Nat Methods, 7(5):335-6]. Результаты считывания группировали в операционные таксономические группы (OTU) с идентичностью 97% и затем классифицировали с использованием RDP-классификатора с доверительным уровнем 0,6 [Wang, Q., Garrity, G. M., Tiedje, J. M. and Cole, J. R. (2007), Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy, Appl. Environ. Microbiol., 73:5261–5267].
Статистический анализ данных микробиоты проводили с использованием программы R 2.14.1 [R Development Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org/]. Эффекты влияния пола и способа родоразрешения тестировали с использованием NP MANOVA (непараметрического многофакторного дисперсионного анализа) на каждом таксономическом уровне и для области 16S, при этом пол или способ родоразрешения рассматривали в качестве одной из объясняющих переменных.
Не отмечалось никаких заметных влияний пола, и данные для мальчиков и девочек затем анализировали вместе. Напротив, способ родоразрешения в значительной степени модулировал как глобальный профиль микробиоты, так и относительную численность видов. Для более подробного исследования влияния способа родоразрешения данные анализировали путем сопоставления следующих 4 групп: получавшая контроль группа рожденных посредством вагинальных родов (контроль рожденных посредством вагинальных родов) или получавшая смесь с L. reuteri (рожденные посредством вагинальных родов, L. reuteri) и получавшая контроль группа рожденных посредством кесарева сечения (контроль рожденных посредством кесарева сечения) или получавшая смесь с L. reuteri (рожденные посредством кесарева сечения, L. reuteri). NP MANOVA использовали для анализа многофакторных данных евклидова расстояния между двумя группами. Для попарного сопоставления относительной численности каждого индивидуального вида использовали знаковый ранговый критерий Уилкоксона.
Пример 2
Ниже приведен пример композиции детской смеси для применения в соответствии с настоящим изобретением. Эта композиция приводится только в качестве иллюстрации. Источник белка представляет собой смесь 60% MSWP28 и 40% казеина.
|