Результат интеллектуальной деятельности: Трансформант дрожжей Komagataella kurtzmanii, продуцирующий бета-глюканазу
Вид РИД
Изобретение
Изобретение относится к микробиологии и биотехнологии и касается получения штамма дрожжей Komagataella kurtzmanii, способного продуцировать бета-глюканазу (β-глюканазу).
β-глюканы представляют собой семейство полисахаридов, состоящих из мономеров D-глюкозы, соединенных посредством β-гликозидных связей и являются естественным компонентом клеточных стенок бактерий, грибов, дрожжей и злаков, таких как овес и ячмень. β-глюканы различного происхождения различаются структурой, уровнем разветвления и молекулярной массой, а также физико-химическими свойствами.
β- глюканазы - группа ферментов, катализирующих расщепление β-глюканов с β-1,2-, β-1,3-, β-1,4- и β-1,6-связями.
Важное значение среди ферментов, относящихся к этой группе имеют β-1,3-1,4-глюканазы, которые находят широкое применение, в частности, в пивоварении и при производстве пищевых добавок [FEBS Lett., 1975, 52, 202-207].
Применение β-глюканаз в процессе пивной ферментации приводит к увеличению экстракции семян ячменя и уменьшению количества сусла, снижению образования избыточной вязкости и уменьшения появления осадка в пиве.
β-1,3-1,4-глюканазы применяют также в качестве добавки к кормам сельскохозяйственных животных с однокамерным желудком. В птицеводческих и свиноводческих отраслях водорастворимый некрахмальный полисахарид β-глюкан действует как анти-питательный агент. Корм для домашних животных, смешанный с ферментами β-1,3-1,4-глюканазы и ксиланазы, усиливает увеличение веса, потребление корма и усвояемость азота (+5,6%) и липидов (+6,2%), а также уменьшает образование липкого помета, что существенно уменьшает санитарные проблемы [Trends in Biotechnology, 1993, 11(10), 424-430].
Природными источниками β-глюканаз являются различные микроорганизмы: бактерии, грибы, дрожжи и актиномицеты
Большинство кормовых ферментных препаратов, в состав которых входят β-глюканазы, имеют грибное происхождение. Однако, с научной и технологической точки зрения большой интерес представляет разработка рекомбинантных продуцентов ферментов на основе дрожжей, поскольку они более удобны для проведения генно-инженерных работ и быстрее накапливают целевой фермент в сравнении с грибными продуцентами. Существенным преимуществом дрожжевых продуцентов является также то, что на их основе значительно легче создавать продуценты моноферментов, тогда как грибные продуценты обычно синтезируют комплексы целлюлитических ферментов. Промышленное получение моноферментов позволяет более эффективно решать задачи составления оптимальной композиции ферментов при использовании различных субстратов.
В настоящее время наиболее перспективным является создание продуцентов на основе рекомбинантных штаммов метилотрофных дрожжей рода Pichia, Komagataella или Hansenula [J Ind Microbiol Biotechnol 2009, 36: 1435-1438],
Использование метилотрофных дрожжей позволяет достичь высоких скоростей экспрессии гетерологичных белков с высокой плотностью клеток, а также высокого уровня и качества N-гликозилирования белков.
Особенно часто для высокоуровневой экспрессии геретологичных белков используют метилотрофные дрожжи Pichia pastoris [FEMS Microbiol. Rev., 2000, 24, 45-66].
Показано [J. Ind. Microbiol. Biotechnol., 2012 39(6), 869-876], что ген bgl16C1 из Penicillium pinophilum, кодирующий эндо-1,3(4)-β-D-глюканазу, эффективно экспрессируется в клетках дрожжей Pichia pastoris, при этом активность рекомбинантной β-глюканазы в культуральной жидкости при культивировании в 15-литровом ферментере составляет 28721 U/ml.
Известны также рекомбинантные штаммы Pichia pastoris, продуцирующие термостабильную β-1,3-1,4-глюканазу из Bacillus amyloliquefaciens. [CN 101899458]
В работе [Биотехнология, 2018, Т. 34, №5, С. 12-22] описан ген bgl из Bacillus pumilus, кодирующий β-глюканазу, относящуюся к классу эндо-β-1,3(4)-D-глюканаз (Е.С. 3.2.1.6).
Поскольку гены β-глюканаз различного происхождения экспрессируются в метилотрофных дрожжах с различной эффективностью [Биотехнология, 2018, 34(4), 26-36], важной задачей для конструирования эффективных продуцентов является выбор генов, кодирующих β-глюканазу и эффективно работающих в дрожжах.
Поиск новых высокоактивных β-глюканаз, обладающих свойствами, необходимыми для их индустриального использования и способных эффективно выражаться в дрожжах, а также создание на их основе промышленно значимых продуцентов является актуальной задачей.
Komagataella kurtzmanii - новый вид метилотрофных дрожжей, выделен из Pichia pastoris [Antonie van Leeuwenhoek, 2013, 104(3), Published online, DOI 10.1007/s10482-013-9956-7].
В работе [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.] описана система экспрессии для таких дрожжей и на модельных штаммах показана ее эффективность для продукции гетерологических белков.
Задачей заявляемого изобретения является расширение арсенала рекомбинантных микроорганизмов, продуцирующих β-глюканазу.
Задача решена путем получения трансформанта дрожжей Komagataella kurtzmanii, продуцирующего β-глюканазу, содержащего ген bgl, кодирующий эндо-β-1,3(4)-D-глюканазу из Bacillus pumilus или фермент, аминокислотная последовательность которого гомологична ей не менее, чем на 96%.
К ферментам, аминокислотная последовательность которых гомологична эндо-β-l,3(4)-D глюканазе из Bacillus pumilus [NCBI: МН553379] не менее, чем на 96% относятся, например, эндо-β-1,3(4)-D-глюканаза из Bacillus safensis [NCBI: WP_034622736.1], или эндо-β-1,3(4)-D-глюканаза из Bacillus stratosphericus [NCBI: WP_103132685.1], или эндо-β-1,3(4)-D-глюканаза из Bacillus altitudinis [NCBI: WP_073416011.1], или эндо-β-1,3(4)-D-глюканаза из Bacillus aerius [NCBI: PYH23823.1], или эндо-β-1,3(4)-D-глюканаза из Bacillus cellulasensis [NCBI: KIL24001.1], или эндо-β-1,3(4)-D-глюканаза из Bacillus australimaris [NCBI: WP_060698046.]
Получение заявленных трансформантов включает введение гена bgl из Bacillus pumilus в клетки дрожжей Komagataella kurtzmanii с помощью экспрессионной кассеты, включающей в свой состав ген bgl, промотор, подходящий для работы в дрожжах Komagataella kurtzmanii, сигнальный пептид для осуществления секреции фермента в культуральную жидкость, терминатор, маркерный ген и, предпочтительно, сайт для гомологичной интеграции в хромосому. Интеграция может быть осуществлена путем как гомологичной, так и негомологичной рекомбинации. Трансформация экспрессионной кассеты в клетки дрожжей Komagataella kurtzmanii может быть осуществлена любым подходящим методом, например, методом электоропорации [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.]
Конструирование экспрессионных кассет осуществляют стандартными методами генетической инженерии [Рыбчин В.Н. Основы генетической инженерии. - СПб.: СПбГТУ, 1999. Sambrook J., Maniatis Т., Fritsch E. Molecular cloning: a laboratory manual. - N.Y. Cold Spring Harbor Laboratory, 1989.] с использованием генетических элементов, подходящих для работы с дрожжами Komagataella kurtzmanii [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.]
Изобретение проиллюстрировано следующими фигурами:
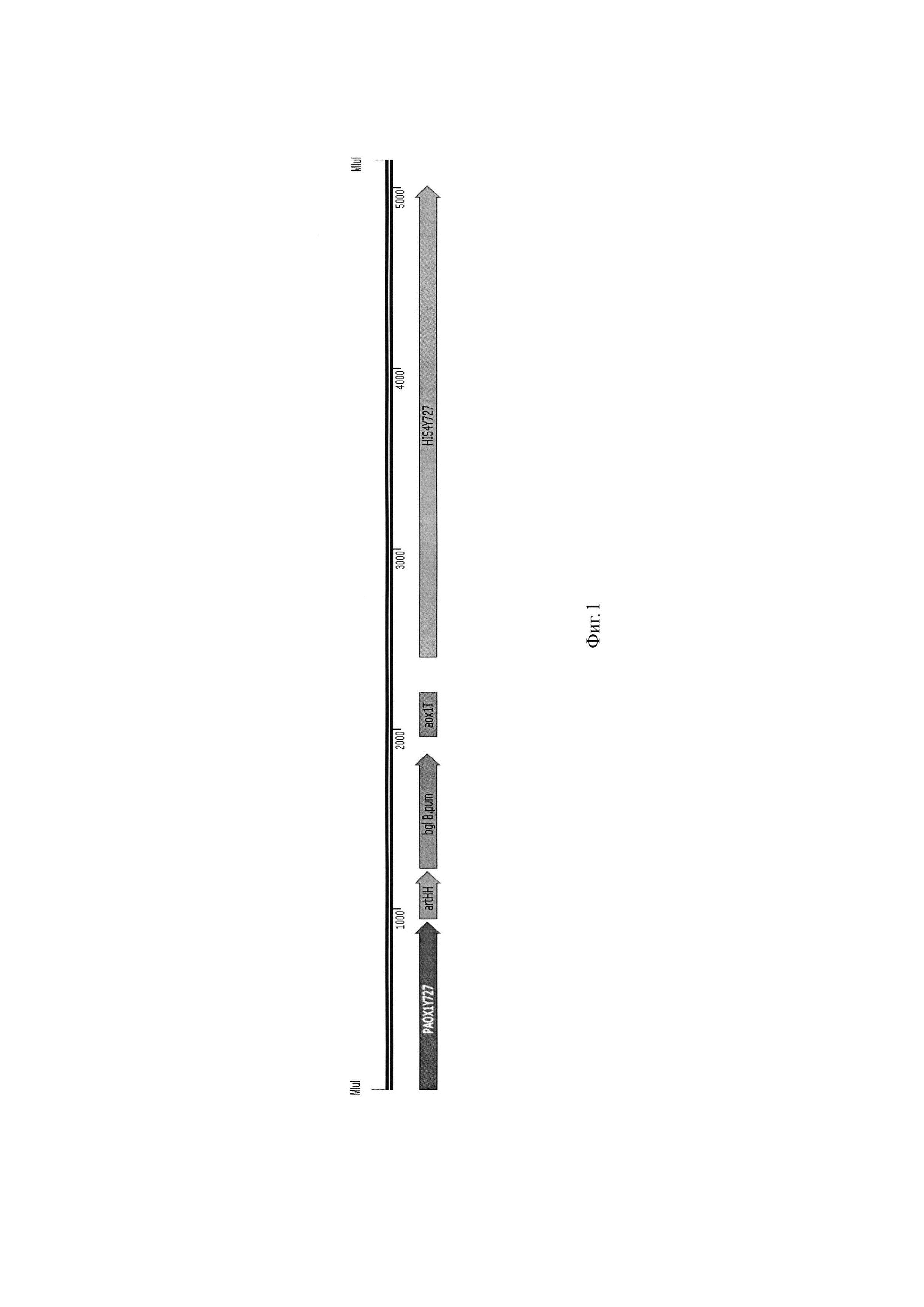
Фиг. 1 Экспрессионная кассета AOX1-artHH-Bgl1ng.
Фиг. 2 Электрофорез гена bgl Bacillus pumilus
Изобретение подтверждено следующими примерами.
Пример 1. Получение плазмиды pUC19mx-Bgl1.
Структурный ген bgl амплифицируют с использованием ПЦР. В качестве матрицы для ПЦР используют хромосомную ДНК штамма Bacillus pumilus Bg57 ВКПМ В-13195 [Биотехнология, 2018, Т. 34, №5, С. 12-22].
Праймерами для ПЦР служат N1344m (5'-catccatggaaaagagatcccaaacgggcgggtcgttttat) и N1345m (5'-atactcgagttatctttttgtgtaacgcacccag).
Липкие концы в амплифицированном фрагменте ДНК открывают с использованием рестриктаз NcoI и XhoI, и полученный NcoI/XhoI фрагмент ДНК клонируют в лабораторном векторе pUC19mx, производном стандартного вектора pUC19, содержащем составе модифицированного полилинкера сайты узнавания рестриктазы NcoI и XhoI. В результате клонирования получают плазмиду pUC19mx-Bgl1, в которой ген bgl имеет направление, противоположное гену lacZ', и которую впоследствии используют в качестве источника фрагмента ДНК, кодирующего bgl.
Пример 2. Модификация структурного гена bgl Bacillus pumilus
Определяют нуклеотидную последовательность структурного гена bgl штамма Bacillus pumilus Bg57 ВКПМ В-13195, клонированного в векторе pUC19mx-Bgll.
Последовательность ДНК клонированного гена подвергают модификации с целью инактивации уникального сайта BamHI и среднего из трех потенциальных сайтов N-гликозилирования. Для осуществления модификации используют ПЦР-опосредованный сайт-направленный мутагенез.
Матрицей для ПЦР служит ДНК плазмиды pUC19mx-Bgl1. ПЦР-амплификацию осуществляют в 2 этапа.
На первом этапе последовательность мутантного гена получают в виде 3 фрагментов ДНК, амплифицируемых с помощью ПЦР и имеющих попарно перекрывающиеся концы:
Фрагмент 1 получают, используя праймеры N1344m (5'-catccatggaaaagagatcccaaacgggcgggtcgttttat) и N1426 (5'-atttgcacgccacgtacagtt)
Фрагмент 2 получают, используя праймеры N1425 (5'-aactgtacgtggcgtgcaaataacgtggctatgacctcat) и N1430 (5'-aacaccgttgtaagatccgagcca)
Фрагмент 3 получают, используя праймеры N1431 (5'-tggctcggatcttacaacggtgtt) и N1345m (5'-atactcgagttatctttttgtgtaacgcacccag)
Амплифицированные фрагменты ДНК очищают, используя набор Qiagen (Qiagen, cat. №28706).
На следующем этапе проводят ПЦР-опосредованное лигирование 3 очищенных фрагментов ДНК. С этой целью осуществляют ПЦР с использованием в качестве матрицы смеси фрагментов 1, 2 и 3. Праймерами для ПЦР-амплификации служат N1344m и N1345m. Амплифицированный фрагмент ДНК элюируют из агарозного геля и после открывания концов с использованием рестриктаз NcoI и XhoI клонируют в плазмиде pUC19mx (см. пример 1), расщепленной по тем же сайтам. В результате клонирования получают плазмиду pUC19mx-Bgl1ng, в составе которой нуклеотидную последовательность клонированного гена подтверждают секвенированием.
Таким образом, при осуществлении мутагенеза последовательности bgl сайт узнавания рестриктазы BamHI инактивируют с использованием нуклеотидной замены, не приводящей к замене аминокислотного остатка, а сайт N-гликозилирования инактивируют путем нуклеотидной замены, приводящей к замене остатка аспарагина на остаток глутамина. Модифицированный ген, заключающий обе мутации, называют Bgl1ng.
Результирующая плазмида pUC19mx-Bgl1ng содержит NcoI/XhoI фрагмент ДНК, заключающий модифицированный ген Bgl1ng.
Пример 3. Конструирование плазмиды для интеграции гена Bgl1ng в геном дрожжей K.kurtzmanii
Плазмиду для интеграции конструируют на базе вектора pPH93-AOX1Y727-HSA [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.].
Данный вектор содержит в своем составе генетические элементы штамма K.kurtzmanii_ ВКПМ Y-727 [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014]. К их числу относят селективный маркерный ген His4, а также фрагмент ДНК, заключающий промоторную область гена АОХ1. При этом промоторная область АОХ1 вместо природного уникального сайта SacI содержит искусственную нуклеотидную последовательность, кодирующую сайты MluI и BamHI, причем в сайт MluI клонирована последовательность известного бактериального вектора pUC18, заключающая ори джин репликации и ген устойчивости к антибиотику ампициллину. 3'-концевая область промотора АОХ1 в составе вектора pPH93-AOX1Y727-HSA слита с последовательностью ДНК, кодирующей сигнальный пептид art. Целевую интегративную плазмиду рРН727-Bgl1ng для транформации клеток дрожжей конструируют путем лигирования трех фрагментов ДНК, а именно:
- XhoI/PstI фрагмента ДНК вектора pPH93-AOX1Y727-HSA, заключающего в своем составе все векторные элементы и последовательность ДНК, кодирующую сигнальный пептид art;
- PstI/NcoI фрагмента ДНК плазмиды pUC18x-GAL1matHH-GH, кодирующего часть лидерного полипептида, заключающего удвоенную аминокислотную последовательность про-области белка HSP150 дрожжей S. cerevisiae [RU 2460795];
- NcoI/XhoI фрагмента ДНК плазмиды pUC19mx-Bgl1ng, заключающего модифицированный структурный ген Bgl1ng β-глюканазы Bacillus pumilus.
В результате лигирования получают целевую интегративную плазмиду pPH727-Bgl1ng, содержащую интегративный MluI/MluI фрагмент ДНК, заключающий 1 копию целевой экспрессионной кассеты AOX1-artHH-Bgl1ng.. В клетках дрожжей эта плазмида опосредует экспрессию структурного гена Bgl1ng β-глюканазы Bacillus pumilus под контролем метанол-индуцируемого промотора АОХ1, а секреция β-глюканазы направляется лидерным полипептидом artHH, заключающим сигнальный пептид art и удвоенную про-область белка HSP150 дрожжей S. cerevisiae.
MluI/MluI интегративный фрагмент ДНК плазмиды pPH727-Bgl1ng используют для трансформации клеток дрожжей. Данный фрагмент ДНК не содержит в своем составе ДНК E.coli.
Пример 4. Конструирование вспомогательной плазмиды A3d-Bgl1ng
Вспомогательную плазмиду получают на базе модифицированного бактериального вектора pUC18, сайт EcoRI которого инактивируют с использованием линкера BglII (5'-gagatctc). Модифицированный вектор называют pUC18b.
Осуществляют ПЦР-амплификацию фрагмента ДНК геномной ДНК штамма ВКПМ Y-727 дрожжей K.kurtzmanii, заключающий область терминации транскрипции гена АОХ1. Амплификацию осуществляют с использованием праймеров AOX1T-dir (5'-taactcgagaaaagagaggctgaagctgg) и AOX1T-rev (5'-ttgagatctcgtacgagaagaaacaaaatgac). В результате амплификации получают фрагмент ДНК размером около 220 нуклеотидных остатков. Липкие концы амплифицированного фрагмента ДНК открывают с использованием рестриктаз XhoI и BglII.
Вспомогательную плазмиду A3d-Bgl1ng конструируют путем направленного лигирования следующих трех фрагментов ДНК:
- AatII/XhoI фрагмента ДНК плазмиды pPH727-Bgl1ng, заключающего промотор АОХ1, слитый со структурным геном artHH-Bgl1ng, опосредующий экспрессию и секрецию β-глюканазы Bacillus pumilus, в клетках дрожжей;
- XhoI/BglII фрагмента ДНК, полученного в результате амплификации геномной ДНК штамма дрожжей K.kurtzmanii ВКПМ Y-727, заключающего область терминации транскрипции гена АОХ1;
- BglII/AatII фрагмента ДНК модифицированного вектора pUC18b, заключающего ориджин репликации и ген устойчивости к ампициллину бактериального вектора pUC18.
Результирующая вспомогательная плазмида A3d-Bgl1ng заключает в своем составе BamHI/BglII фрагмент ДНК, кодирующий целевую экспрессионную кассету AOX1-artHH-Bgl1ng-aox1T, включающую промотор АОХ1, лидерную область artHH, структурный ген β-глюканазы Bacillus pumilus и терминатор транскрипции aox1T, соответственно. Указанная кассета находится в окружении уникальных сайтов рестрикции AatII, BamHI и BglII, расположение которых позволяет осуществлять генно-инженерные манипуляции, приводящие к удвоению и утроению кассеты на данном вспомогательном векторе.
Пример 5. Конструирование плазмиды для многокопийной интеграции гена Bgl1ng в геном дрожжей K.kurtzmanii
На первом этапе, используя вспомогательную плазмиду A3d-Bgl1ng, осуществляют удвоение целевой экспрессионной кассеты AOX1-artHH-Bgl1ng-aox1T. С этой целью AatII/BglII фрагмент ДНК вспомогательной плазмиды A3d-Bgl1ng клонируют в составе этой же плазмиды, расщепленной по сайтам AatII/BamHI. В результате этой генно-инженерной манипуляции получают плазмиду A3d-(Bgl1ng)x2, содержащую AatII/BglII фрагмент ДНК, заключающий 2 тандемно расположенные копии целевой экспрессионной кассеты AOX1-artHH-Bgl1ng-aox1T.
На следующем этапе 2 копии целевой копии целевой экспрессионной кассеты AOX1-artHH-Bgl1ng-aox1T из состава вспомогательной плазмиды переносят в интегративную плазмиду pPH727-Bgl1ng, содержащую еще 1 копию экспрессионной кассеты. С этой целью AatIIl/BglII фрагмент ДНК вспомогательной плазмиды A3d-(Bgl1ng)x2 клонируют в плазмиде pPH727-Bgl1ng, расщепленной по сайтам AatII/BamHI.
В результате клонирования получают плазмиду pPH727-(Bgl1ng)x3, содержащую интегративный MluI/MluI фрагмент ДНК, заключающий 3 тандемно расположенные копии целевой экспрессионной кассеты AOX1-artHH-Bgl1ng, включающей в себя (фиг. 1):
1. Ген bgl Bacillus pumilus, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида artHH, под контролем AOX1Y727 промотора
2. Терминатор транскрипции аох1Т
3. Дрожжевой селективный маркер His4
MluI/MluI интегративный фрагмент ДНК плазмиды pPH727-(Bgl1ng)x3 используют для трансформации клеток дрожжей. Данный фрагмент ДНК не содержит в своем составе ДНК E.coli.
Пример 6. Получение трансформантов дрожжей Komagataella kurtzmanii несущих ген bgl из Bacillus pumilus
MluI/MluI фрагмент ДНК сконструированной плазмиды pPH727-(Bgl1ng)x3 (пример 5) используют для трансформации клеток лабораторного реципиентного штамма К. kurtzmanii 727ΔHis4 ВКПМ Y-4462, полученного на основе штамма K.kurtzmanii ВКПМ Y-727 путем делеции гена His4.
Процедуру трансформации осуществляют методом электропорации, как описано в [Тюрин О.В. Разработка системы экспрессии генов на основе метилотрофных дрожжей Komagataella kurtzmanii: диссертация канд. биол. наук. ГосНИИгенетика, Москва, 2014.].
Интегративный MluI/MluI фрагмент содержит на открытых концах последовательности ДНК, гомологичные промоторной области АОХ1, позволяющие направить его интеграцию в промоторную область АОХ1 генома дрожжей.
В результате осуществления указанной процедуры получают трансформанты Y727-Bgl1, в геном каждого из которых интегрировано различное число копий целевой экспрессионной кассеты, включающий ген β-глюканазы Bacillus pumilus.
Пример 7. Культивирование трансформированных штаммов.
Трансформанты дрожжей K. kurtzmanii культивируют в колбах при температуре 29°С на ротационной качалке (250 об/мин). Культивирование проводят в жидкой среде YPgM следующего состава (мас. %): пептон - 2, дрожжевой экстракт - 1, глицерин - 0,5, метанол - 0,5, вода - остальное. Трансформанты засевают в начальном титре 5×105-5×106 мл-1. Культуры выращивают в течение 69 часов, через 24 и 48 часов после начала культивирования в колбы вносят раствор 50% метанола в количестве 1/100 от объема среды. По истечении 69 часов роста клеточную биомассу отделяют от среды культивирования центрифугированием при 16000 g в течение 2 мин, используя пробирки на 1,5 мл, после чего осветленную культуральную жидкость переливают в чистые пробирки и хранят в холодильнике при температуре +4°С.
Отбор трансформантов, характеризующихся высокой концентрацией β-глюканазы Bacillus pumilus в культуральной жидкости, осуществляют методом электрофоретического анализа.
Образцы для электрофоретического анализа уровня продукции получают путем концентрирования белков культуральной жидкости. Анализ проводят в 15% полиакриламидном геле в денатурирующих восстанавливающих условиях по стандартной процедуре, например, с использованием системы Mini-PROTEAN Tetra Cell (#165-8000). Буферы, подготовка образцов, нанесение и проведение электрофореза делают согласно инструкции "BIO-RAD", прилагаемой к системе. В качестве маркеров используют смесь предокрашенных белков с известной молекулярной массой в диапазоне от 10 до 250 кДа ("Thermo Scientific™", PageRuler™ Plus Prestained Protein Ladder, #26620). Окрашивание геля раствором кумасси проводят при помощи набора фирмы "Thermo Scientific™" (Pierce™ Mini Gel Power Staining Kit, #22840) согласно прилагаемой инструкции.
В результате из набора полученных трансформантов отбирают трансформант №89, характеризующийся максимально высокой концентрацией целевого белка β-глюканазы Bacillus pumilus в культуральной жидкости.
Количество фермента β-глюканазы в культуральной жидкости определяют с использованием ДНС метода [Anal. Chem., 1959, 31 (3), 426-428].
При культивировании в описанных условиях отобранный трансформант №89 обеспечивает продукцию β-глюканазы Bacillus pumilus в количестве 3000 ед в 1 мл культуральной жидкости.
Для подтверждения наличия в хромосоме отобранного трансформанта вставки гена bgl Bacillus pumilus методом полимеразной цепной реакции (ПЦР) используют хромосомальную ДНК, выделенную из клеток отобранного трансформанта и специфические праймеры BglPum-f и BglPum -r
BglPum -f 5'-ggttatgtgttctgggaacctc-3',
BglPum-r 5'-ttatctttttgtgtaacgca-3'
Режим реакции ПЦР:
95°С - 3 мин - 1 цикл
30 циклов:
95°С - 30 сек.
60°С - 30 сек.
72°С - 60 сек.
72°С - 5 мин. - 1 цикл
Для контроля величины амплифицированного фрагмента ДНК при электрофорезе использован молекулярный маркер GeneRuler 1 kb DNA Ladder (Fermentas) (линия 2, фиг. 2, размер фрагментов снизу вверх 10000, 8000, 6000, 5000, 4000, 3500, 3000, 2500, 2000, 1500, 1000, 750, 500, 250 п.н.). Наработка фрагмента ДНК размером 642 п.н. (линия 1 фиг. 2) свидетельствует о присутствии в хромосоме штамма вставки гена bgl Bacillus pumilus
Пример 8. Получение трансформантов дрожжей Komagataella kurtzmanii, несущих ген bgl из Bacillus safensis
Получают плазмидный вектор pPIC-bglSaf, содержащий интегративную экспрессионную кассету. В качестве источника гена bgl используют тотальную геномную ДНК природного штамма Bacillus safensis ВКПМ В- 13331. Синтезируют ДНК гена bgl методом ПЦР с использованием праймеров bgl-saf-1 и bgl-saf-2, содержащих на 5'-концах сайты рестрикции для клонирования - EcoRI и NotI, соответственно:
bgl-saf-1 5'-aagaattccaaacgggcggttcgttatatga-3'
bgl-saf-1 5'-aagcggccgcttatctaattgtgtaaggca-3'
Полученный фрагмент ДНК обрабатывают рестриктазами EcoRI и NotI и клонируют в состав экспрессионного вектора pPIC9
(htttp://www.thermofisher.com/order/catalog/product/V17520).
Для получения интегративной экспрессионной кассеты плазмиду pPIC-bglPum обрабатывают эндонуклеазой рестрикции BglII.
В состав интегративной экспрессионной кассеты входят следующие элементы:
1. Ген bgl_Bacillus safensis, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора
2. Терминатор транскрипции ТТАОХ1
3. Дрожжевой селективный маркер His4
4. Область интеграции - нуклеотидная последовательность гена АОХ1
Трансформацию указанной интегративной экспрессионной кассеры в дрожжи Komagataella kurtzmanii 727ΔHis4 ВКПМ Y-4462, отбор наиболее активных трансформантов и определение активности β-глюканазы в культуральной жидкости проводят как описано в примерах 6 и 7. Наличие в хромосоме отобранного трансформанта вставки гена bgl из Bacillus safensis подтверждают методом полимеразной цепной реакции (ПЦР).
По результатам ферментации отбирают наиболее продуктивный трансформант №154, который при культивировании синтезирует β-глюканазу в количестве 1134 ед/мл культуральной жидкости.
Пример 9. Получение трансформантов дрожжей Pichia pastoris, несущих ген bgl из Bacillus altitudinis.
Получают плазмидный вектор pPIC-bglAlt, содержащий интегративную экспрессионную кассету. В качестве источника гена bgl используют тотальную геномную ДНК штамма Bacillus altitudinis ВКПМ В- 11231. Синтезируют ДНК гена bgl методом ПЦР с использованием праймеров bgl-saf-1 и bgl-saf-2, содержащих на 5'-концах сайты рестрикции для клонирования - EcoRI и NotI, соответственно:
bgl-alt-1 5'-aagaattccaaacgggcggttcgttatatga-3'
bgl-alt-1 5'-aagcggccgcttatctaattgtgtaaggca-3'
Полученный фрагмент ДНК обрабатывают рестриктазами EcoRI и NotI и клонируют в состав экспрессионного вектора pPIC9
(http://www.thermofisher.com/order/catalog/product/V17520).
Для получения интегративной экспрессионной кассеты плазмиду pPIC-bglPum обрабатывают эндонуклеазой рестрикции BglII.
В состав интегративной экспрессионной кассеты входят следующие элементы:
1. Ген bgl_Bacillus altitudinis, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора
2. Терминатор транскрипции ТТАОХ1
3. Дрожжевой селективный маркер His4
4. Область интеграции - нуклеотидная последовательность гена АОХ1
Трансформацию указанной интегративной экспрессионной кассеты в дрожжи Komagataella kurtzmanii 727ΔHis4 ВКПМ Y-4462, отбор наиболее активных трансформантов и определение активности β-глюканазы в культуральной жидкости проводят как описано в примерах 6 и 7. Наличие в хромосоме отобранного трансформанта вставки гена bgl из Bacillus altitudinis подтверждают методом полимеразной цепной реакции (ПЦР)
По результатам ферментации отобран наиболее продуктивный трансформант №27, который при культивировании синтезирует β-глюканазу в количестве 998 ед/мл культуральной жидкости.