Результат интеллектуальной деятельности: КОВАЛЕНТНЫЕ КОНЪЮГАТЫ НА ОСНОВЕ ФТАЛОЦИАНИНОВ И МЕТИЛФЕОФОРБИДА а, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ В МЕДИЦИНЕ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к конъюгатам на основе макрогетероциклов тетрапиррольного типа, которые могут найти применение в качестве фотосенсибилизатора в фотодинамической терапии и тераностике - современном направлении в медицине, сочетающем терапию и диагностику онкологических заболеваний.
Уровень техники
К настоящему времени молекулярные и супрамолекулярные системы на основе функциональных производных макрогетероциклов тетрапиррольного типа вызывают повышенный интерес исследователей в связи с возможностью сочетания ряда полезных свойств. Особый интерес представляют ковалентные диады, являющиеся модельной системой специальной пары хлорофилла - реакционного центра фотосинтетических реакций, используемые в последнее время в качестве фотосенсибилизаторов (ФС) для фото динамической терапии рака (ФДТ). В литературе представлен достаточно широкий спектр ковалентно связанных конъюгатов на основе производных хлоринового ряда, в частности, включающих в состав порфирины и производные метилфеофорбида a [Shinoda, S., Tsukube, Н., Nishimura, Y., Yamazaki, I., Osuka, A. (1997). Energy and Electron Transfer Properties of Methyl Pheophorbide-a in Zinc Porphyrin-Pheophorbide Dyads. Tetrahedron, 53(40), 13657-13666, https://doi.org/10.1016/S0040-4020(97)00902-2; Shinoda, S., Osuka, A. (1996). Transesterification of the α-Keto Ester in Methyl Pheophorbide-а. Tetrahedron Letters, 37(28), 4945-1948, https://doi.org/10.1016/0040-4039(96)01075-1; Zheng, G., Pandey, R.K., Forsyth, T.P., Kozyrev, A.N., Dougherty, T.J., Smith, K.M. (1997). Syntheses and Spectroscopic Studies of Some Novel Porphyrin-Pyropheophorbide Dimers and Trimers with Fixed Distances. Tetrahedron Letters, 38(14), 2409-2412, https://doi.org/10.1016/S0040-4039(97)00369-91, которые обладают рядом преимуществ, таких как оптимальное соотношение флюоресценция/интерконверсия, высокая световая токсичность по сравнению со многими известными ФС при низкой темновой токсичности, растворимость в биосовместимых средах, что значительно облегчает введение данных ФС в организм. Вместе с тем, существующие системы имеют и ряд недостатков, таких как сравнительно низкие коэффициенты экстинкции в видимом диапазоне и относительно невысокие квантовые выходы флуоресценции, которые можно улучшить, заменив один из компонентов конъюгата на тетрапиррольный макроцикл, обладающий более эффективным поглощением/флуоресценцией, в частности, фталоцианин. Так, системы, комбинирующие в своем составе фталоцианиновые и порфириновые макроциклы, вызывают особый интерес благодаря характерному расширению спектрального диапазона, а также возникающим возможностям протекания внутримолекулярных процессов переноса энергии и/или заряда. Данные свойства особенно важны в таких областях как солнечная энергетика, оптоэлектроника и молекулярная фотоника. Уникальная модификация фотофизических свойств в порфирин-фталоцианиновых конъюгатах в сравнении со свойствами индивидуальных компонент делает данные системы также перспективными тераностиками. Вместе с тем, в литературе практически полностью отсутствует упоминание о структурах, включающих фрагмент природного тетрапиррола, например, хлоринового производного, и синтетического - фталоцианина. Объединение в одной молекуле синтетической и природной тетрапиррольных структур, обладающих взаимодополняющими свойствами, представляется интересным с точки зрения различных практических приложений, в том числе, и с целью получения новых перспективных ФС и тераностиков. Близкими к данному изобретению являются описанные конъюгаты состава фталоцианин-порфирин [Lo, Р.-С., Leng, X., Ng, D.K.P. (2007). Hetero-arrays of porphyrins and phthalocyanines. Coordination Chemistry Reviews, 251(17-20), 2334-2353, https://doi.org/10.1016/j.ccr.2007.03.007; Pereira, A.M.V.M., Hausmann, A., Tome, J.P.C., Trukhina, O., Urbani, M., Neves, M.G.P.M.S., Cavaleiro, J.A.S., Guldi, D.M., Torres, T. (2012). Porphyrin-Phthalocyanine/Pyridylfullerene Supramolecular Assemblies. Chemistry - A European Journal, 18(11), 3210-3219, https://doi.org/10.1002/chem.201103776; KC, С.В., Lim, G.N., Karr, P.A., D'Souza, F. (2014). Supramolecular Tetrad Featuring Covalently Linked Bis(porphyrin)-Phthalocyanine Coordinated to Fullerene: Construction and Photochemical Studies. Chemistry - A European Journal, 20(25), 7725-7735, https://doi.org/10.1002/chem.201402402], а также недавно описанный конъюгат формулы
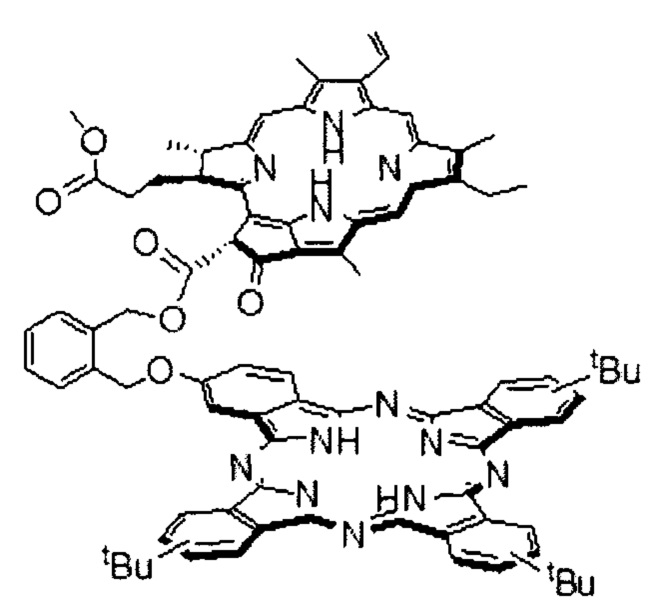
в работе [I.O. Balashova, V.E. Pushkarev, V.I. Shestov, L.G. Tomilova, O.I. Koifman, G.V. Ponomarev. Synthesis and spectral properties of phthalocyanine-methylpheophorbide a covalently linked dyad // Macroheterocycles, 2015, V. 8, №3, 233-238, https://doi.org/10.6060/mhc150767p]. Данный конъюгат принят за прототип. Способ его получения заключается в переэтерификации с участием метилфеофорбида а и функционально замещенного фталоцианина с концевой ОН-группой бензильного типа. Взаимодействие проводилось в присутствии основания ДМАП. Выделение продукта осуществляли с помощью гель-проникающей хроматографии на полимерном носителе Bio-Beads S-X1 (BIORAD), используя толуол в качестве элюента.
Однако данный конъюгат обладает рядом недостатков: он не содержит в составе фталоцианиновой компоненты центрального иона металла, который может способствовать улучшению фотофизических свойств, также фталоцианиновая компонента не содержит функциональных групп, которые позволяют вводить в состав конъюгата дополнительные молекулы метилфеофорбида а или другие функциональные фрагменты.
Способ получения данного конъюгата содержит ряд недостатков: он разработан только для трет-бутилзамещенного фталоцианина и метилфеофорбида а, не содержащего функциональные фрагменты.
Раскрытие изобретения
Технической проблемой, на решение которой направлено настоящее изобретение является синтез конъюгатов на основе фталоцианинов А3В и А4 типов и метилфеофорбида а.
Техническим результатом заявляемого изобретения является получение конъюгатов в виде диад из фталоцианинов А3В и А4 типов и метилфеофорбида а для применения в качестве фотосенсибилизатора в фотодинамической терапии и тераностике. Использование в качестве оснований ДБУ, пиридина, ТЭА и других триалкиламинов, позволило повысить выход целевых конъюгатов по сравнению с прототипом. Полученные ковалентно связанные конъюгаты содержат структурно родственные макрогетероциклы тетрапиррольного типа, одновременно включающие порфириновое и фталоцианиновое макроциклы. Соединения получены впервые, методы их синтеза характеризуются высокими выходами. Полученные конъюгаты обладают высокими квантовыми выходами по сравнению с прототипом и могут найти применение в тераностике - современном направлении в медицине, сочетающем терапию и диагностику онкологических заболеваний. Оптические свойства полученных диад свидетельствуют о высокой перспективности практического использования этого нового класса по сравнению с прототипом.
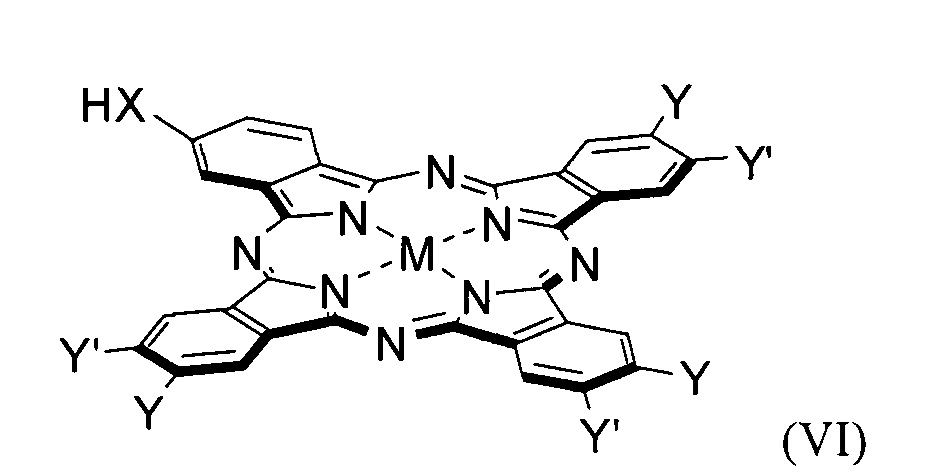
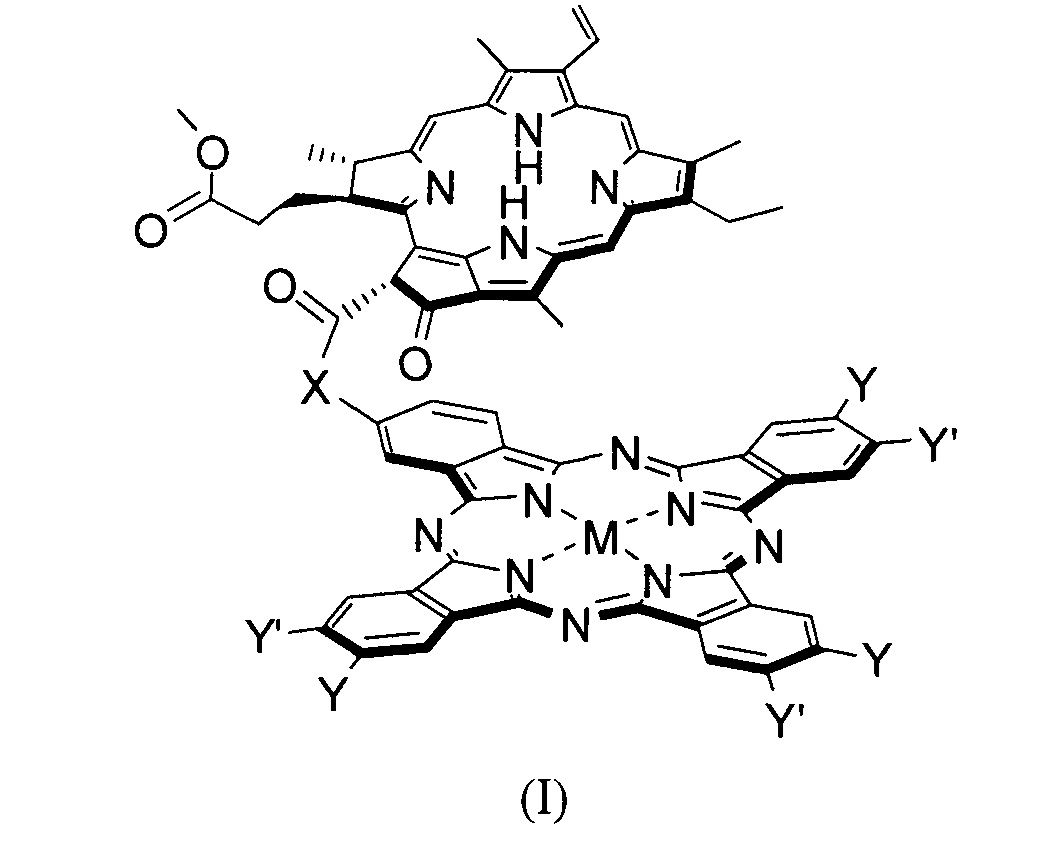
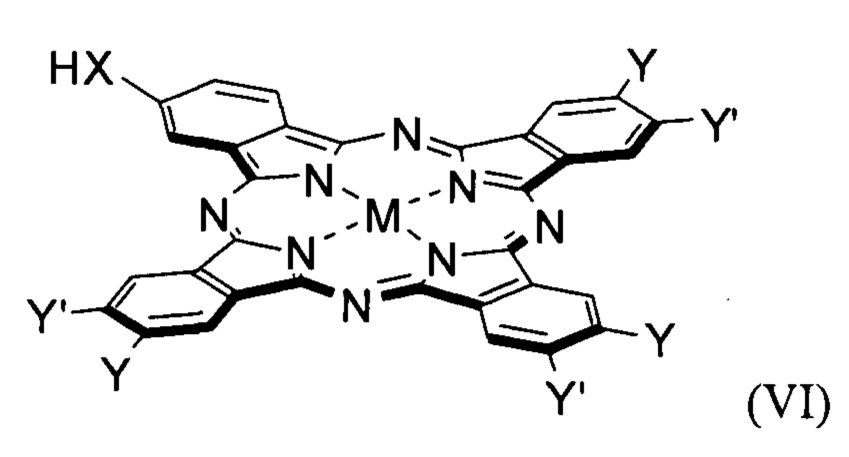
Технический результат достигается настоящим изобретением, а именно конъюгатами общей формулы (I):
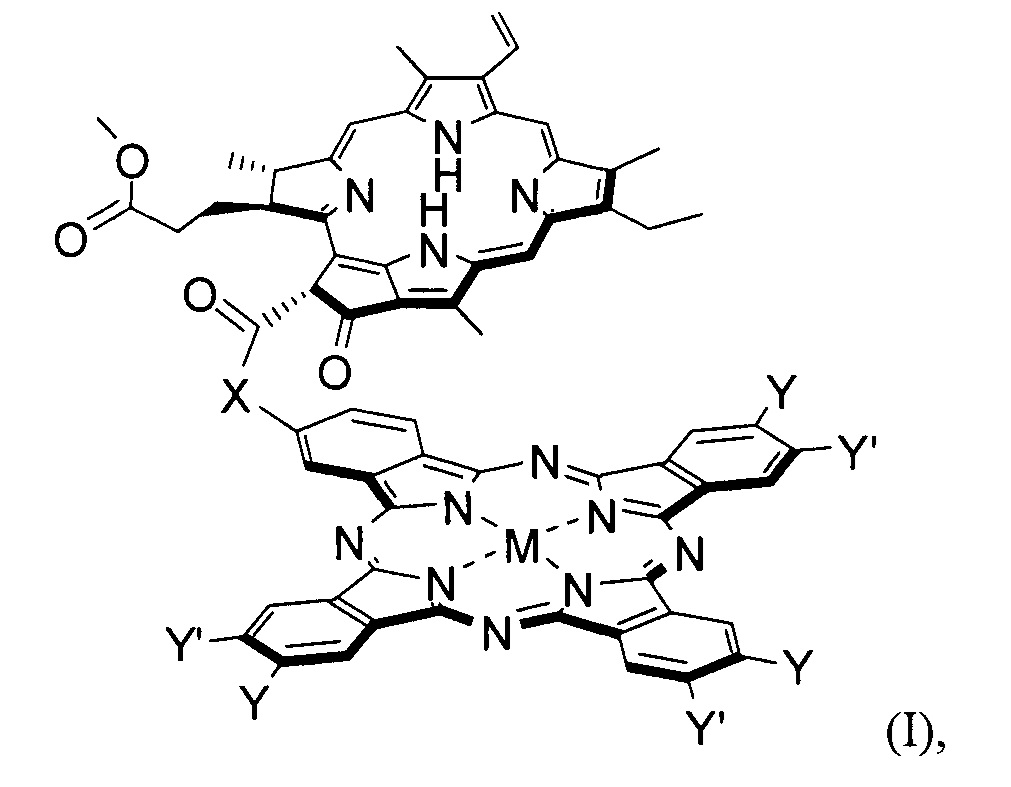
где
X = О, -ОСН2С6Н4СН2О-;
М = Mg, Zn, AlCl;
Y = Y' = H, низший алкил;
Y ≠ Y': Y = H, Y' = низший алкил, ОН, -ОСН2С6Н4СН2ОН, pheo, -ОСН2С6Н4СН2(pheo);
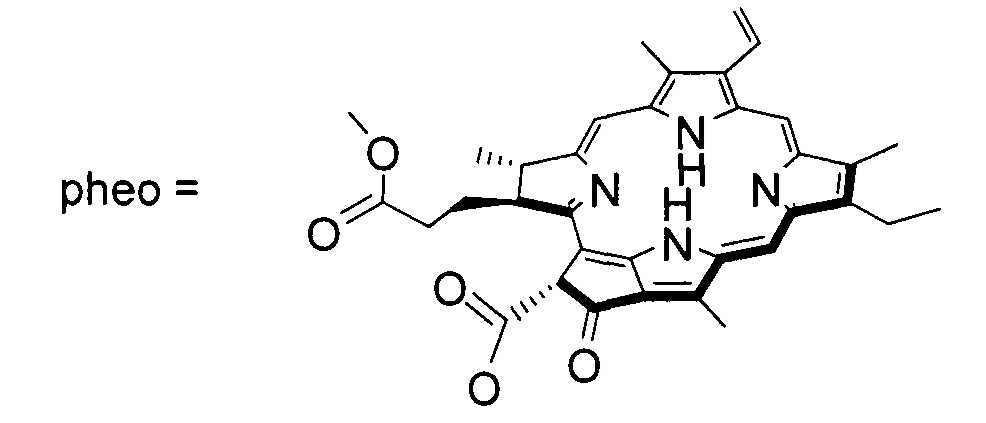
В частности, конъюгатами следующего строения (II - V):
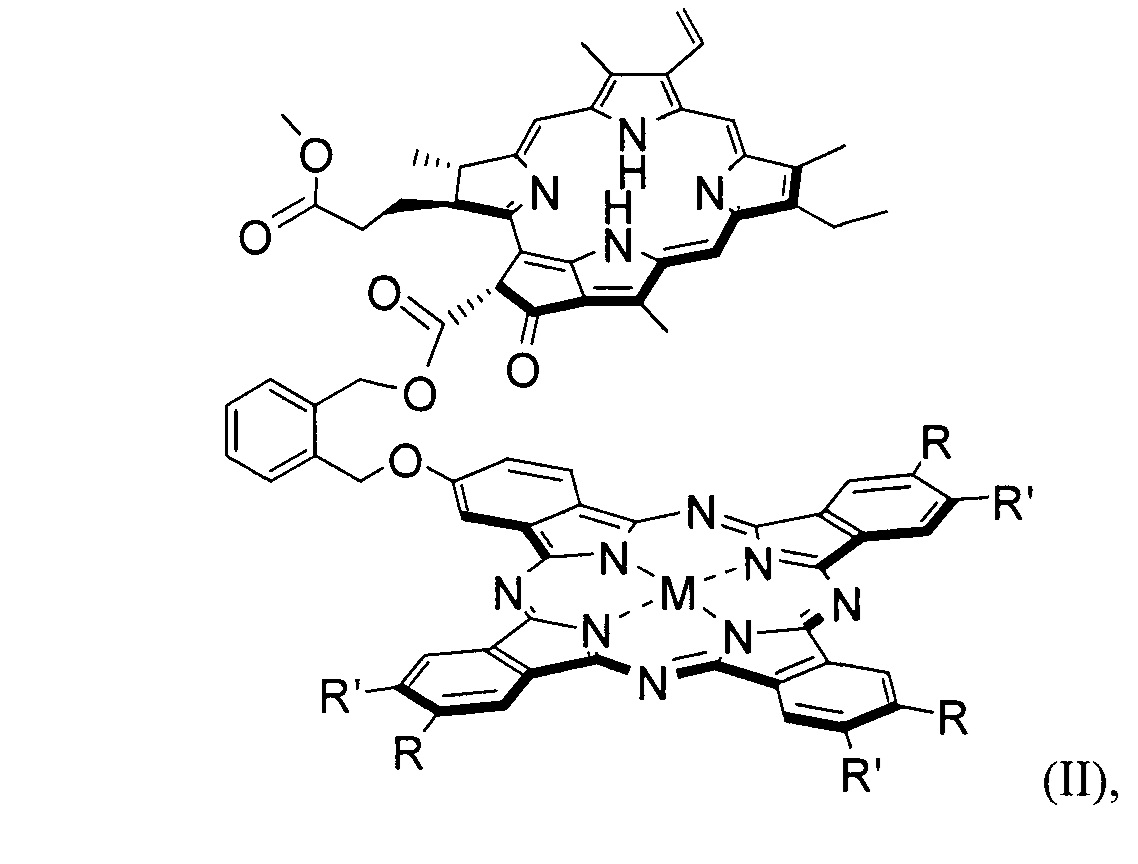
где R = tBu, R' = H, M = Mg, Zn, AlCl; или R = R' = H, Et, Bu, M = Mg, Zn, AlCl.
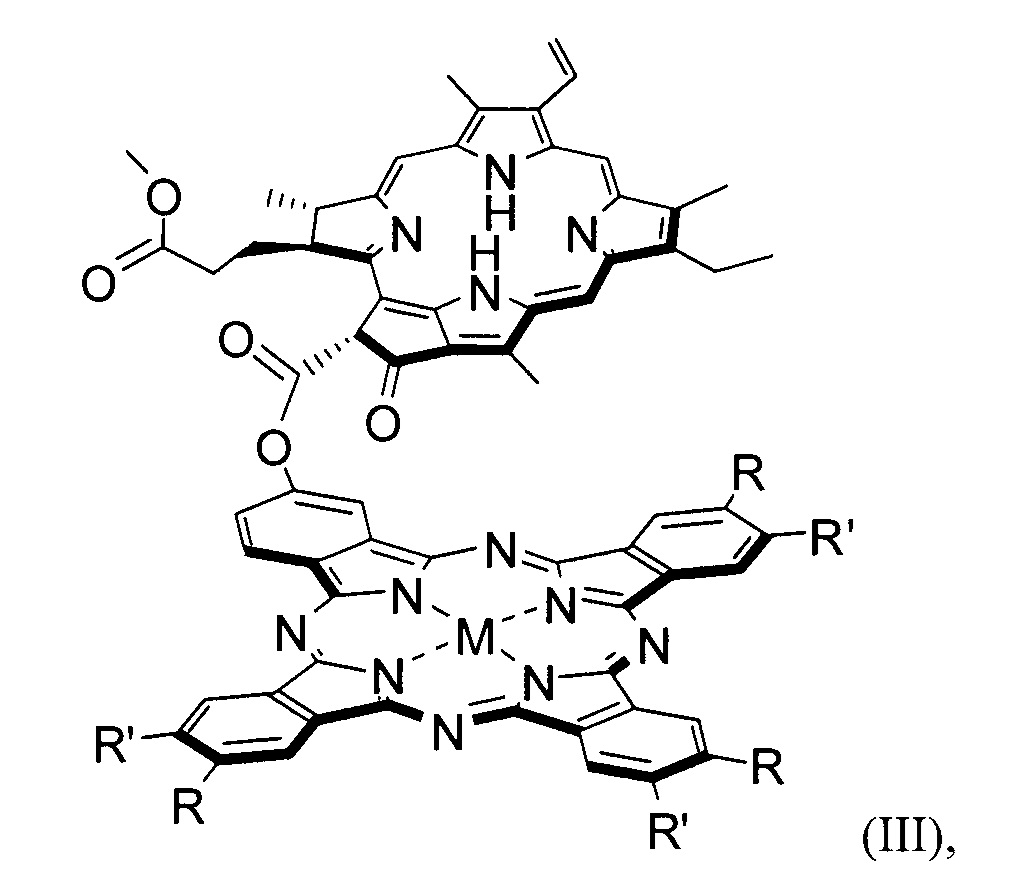
где R = tBu, R' = H, M = Mg, Zn, AlCl; или R = R' = H, Et, Bu, M = Mg, Zn, AlCl.
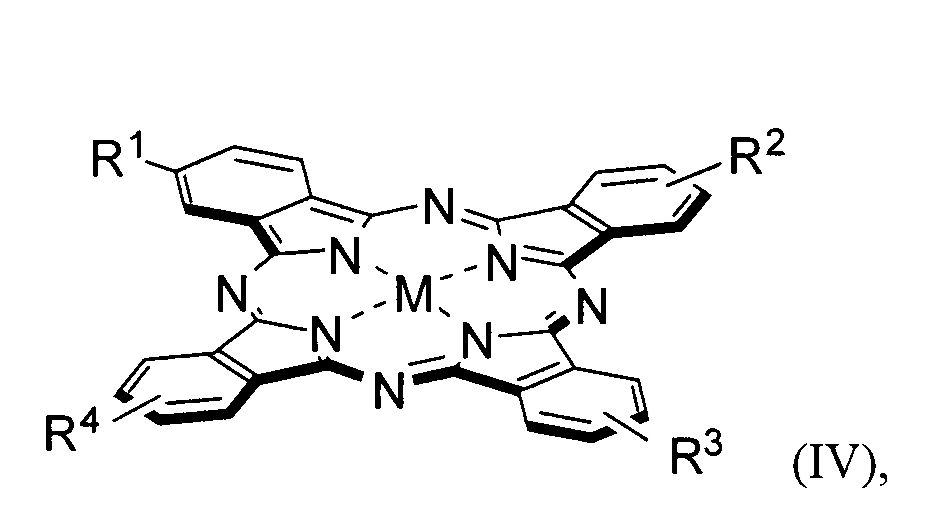
где R1 = pheo, R2 = R3 = R4 = OH, M = Mg, Zn, AlCl; или R1 = R2 = pheo, R3 = R4 = OH, M = Mg, Zn, AlCl; или R1 = R3 = pheo, R2 = R4 = OH, M = Mg, Zn, AlCl; или R1 = R2 = R3 = pheo, R4 = OH, M = Mg, Zn, AlCl; или R1 = R2 = R3 = R4 = pheo, M = Mg, Zn, AlCl.
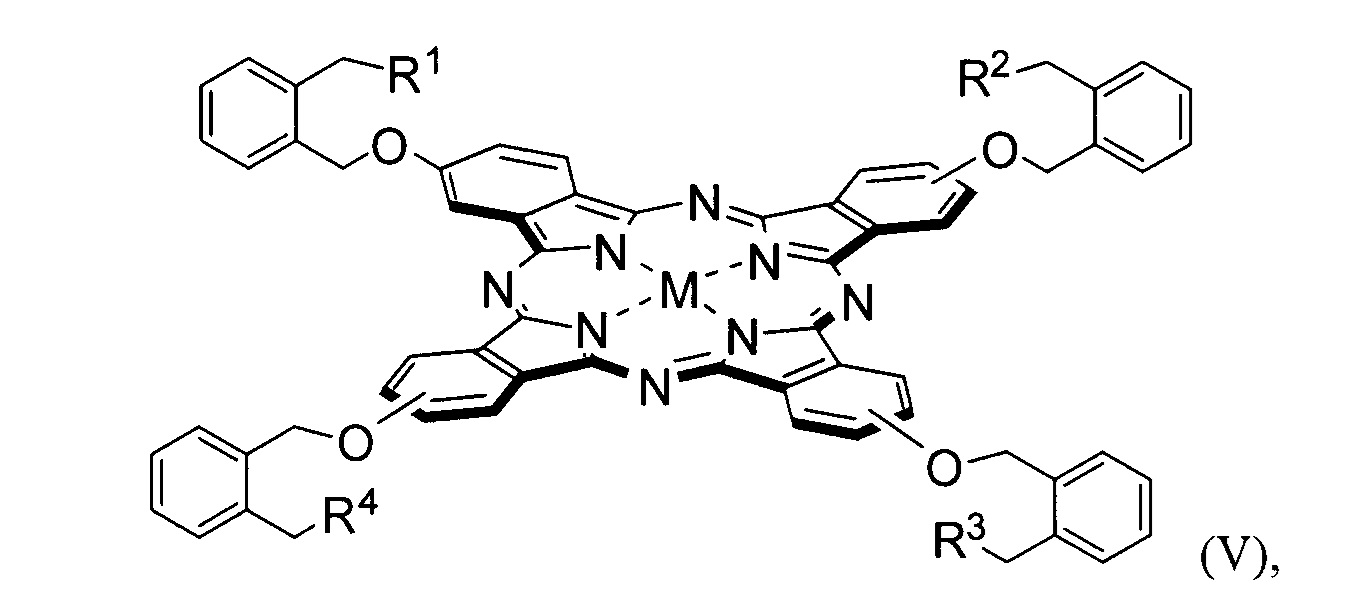
где R1 = pheo, R2 = R3 = R4 = OH, M = Mg, Zn, AlCl; или R1 = R2 = pheo, R3 = R4 = OH, M = Mg, Zn, AlCl; или R1 = R3 = pheo, R2 = R4 = OH, M = Mg, Zn, AlCl; или R1 = R2 = R3 = pheo, R4 = OH, M = Mg, Zn, AlCl; или R1 = R2 = R3 = R4 = pheo, M = Mg, Zn, AlCl.
Поставленная проблема также решается способом получения конъюгата общей формулы (I), заключающемся в растворении метилфеофорбида формулы (pheo) и фталоцианина общей формулы (VI) в органическом растворителе с температурой кипения выше 100°С, взятых в мольном соотношении 1:1-1.7, добавлении основания, взятого в полуторакратном избытке по отношению к фталоцианину и каталитического количества I2 (не более 2.5 мольных %).
Полученную смесь нагревают до кипения и выдерживают при кипении до полного связывания фталоцианина. Затем упаривают растворитель, переосаждают реакционную массу из смеси метанола-вода (70:30 об. %), для частичного отделения непрореагировавшего метилфеофорбида. Твердый остаток растворяют в органическом растворителе с температурой кипения более 100°С и подвергают очистке методом гель-проникающей хроматографии, выделяя вторую фракцию сине-зеленого цвета с последующей сушкой. Затем проводят дополнительную очистку методом препаративной ТСХ на силикагеле (элюент - толуол ÷ метанол, 10:1 об.), выделяя фракцию сине-зеленого цвета представляющую собой конъюгат общей формулы (I).
Предпочтительно в качестве органического растворителя с температурой кипения более 100°С использовать толуол, ДМФА, ДМСО, о-, мета- и пара-ксилолы, диоксан.
Предпочтительно в качестве основания использовать ДБУ, пиридин и ТЭА и другие триалкиламины.
Время необходимое для полного связывания метилфеофорбида составляет приблизительно 1,5-3 часа.
Упаривание растворителя осуществляют при пониженном давлении любым известным из уровня техники способом, например на роторном испарителе.
Гель-проникающую хроматографию проводят на полимерном носителе Bio-Beads (BIORAD), например на носителе Bio-Beads S-X1 (элюент - толуол).
Синтез представленных конъюгатов был реализован согласно схемам 1-4.
Схема 1. i: I2, 4-диметиламинопиридин (ДМАП), толуол, 110°С.
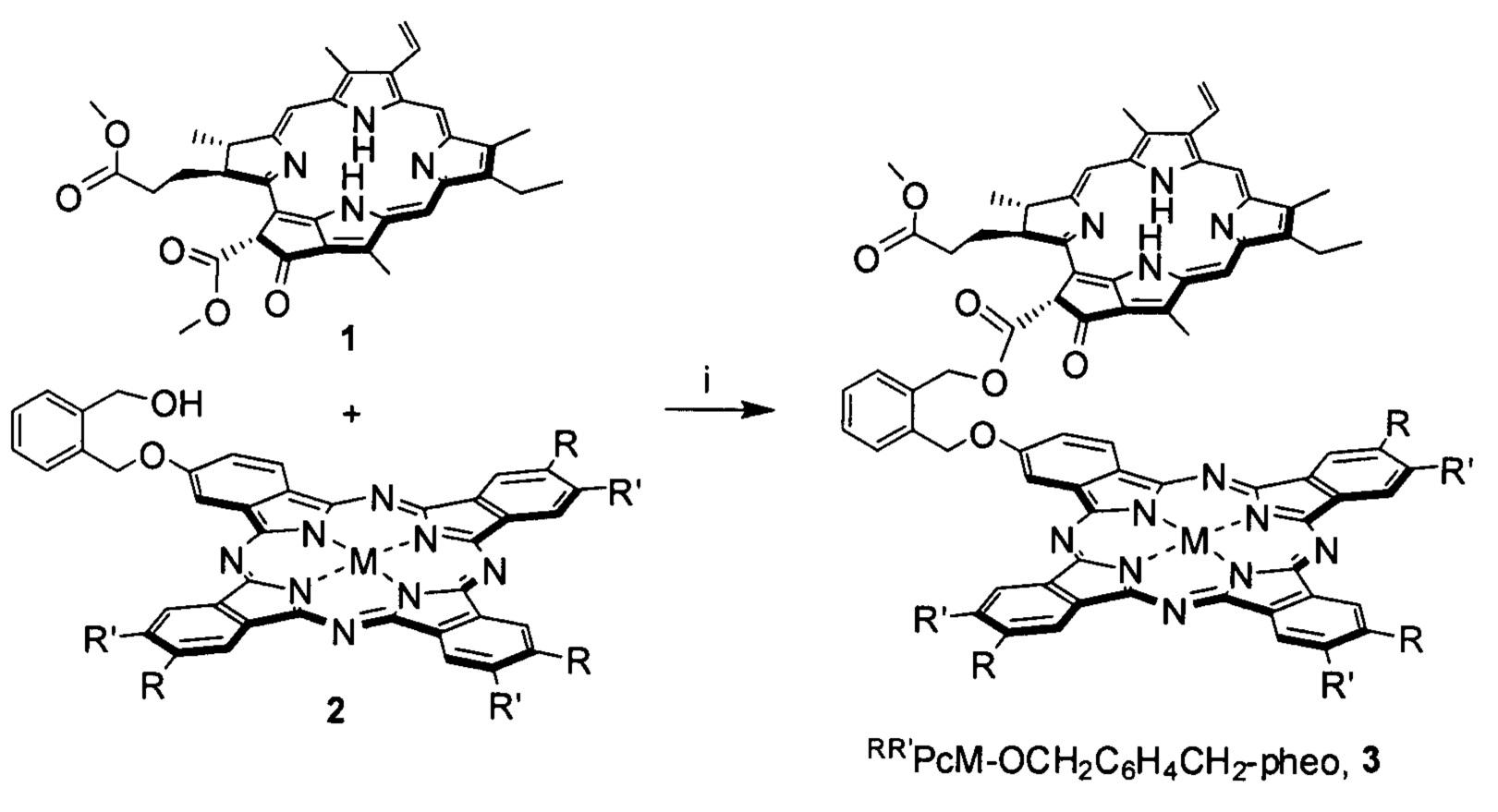
Схема 2. i: I2, ДМАП, толуол, 110°С.
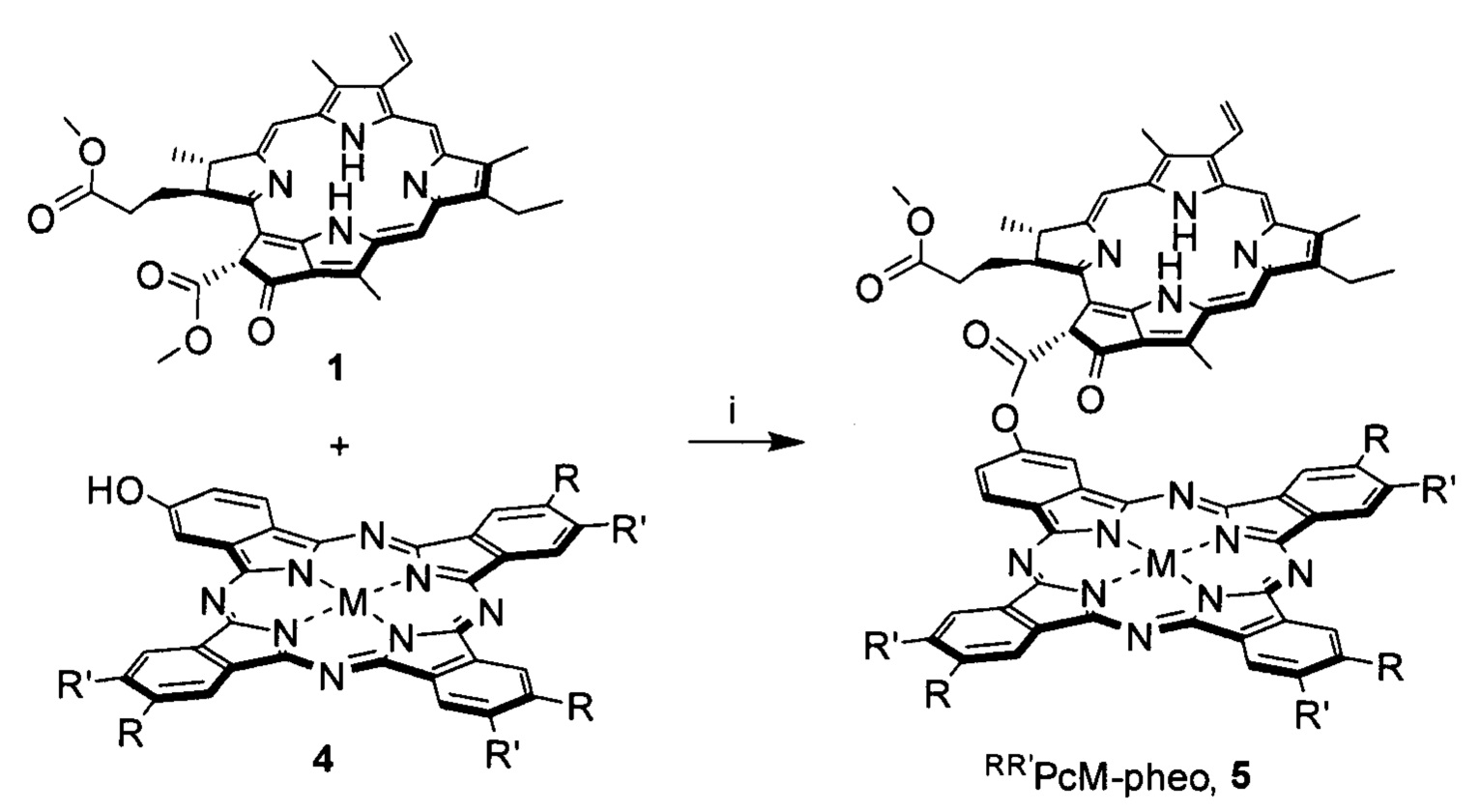
Схема 3. i: I2, ДМАП, ДМФА, 153°С.
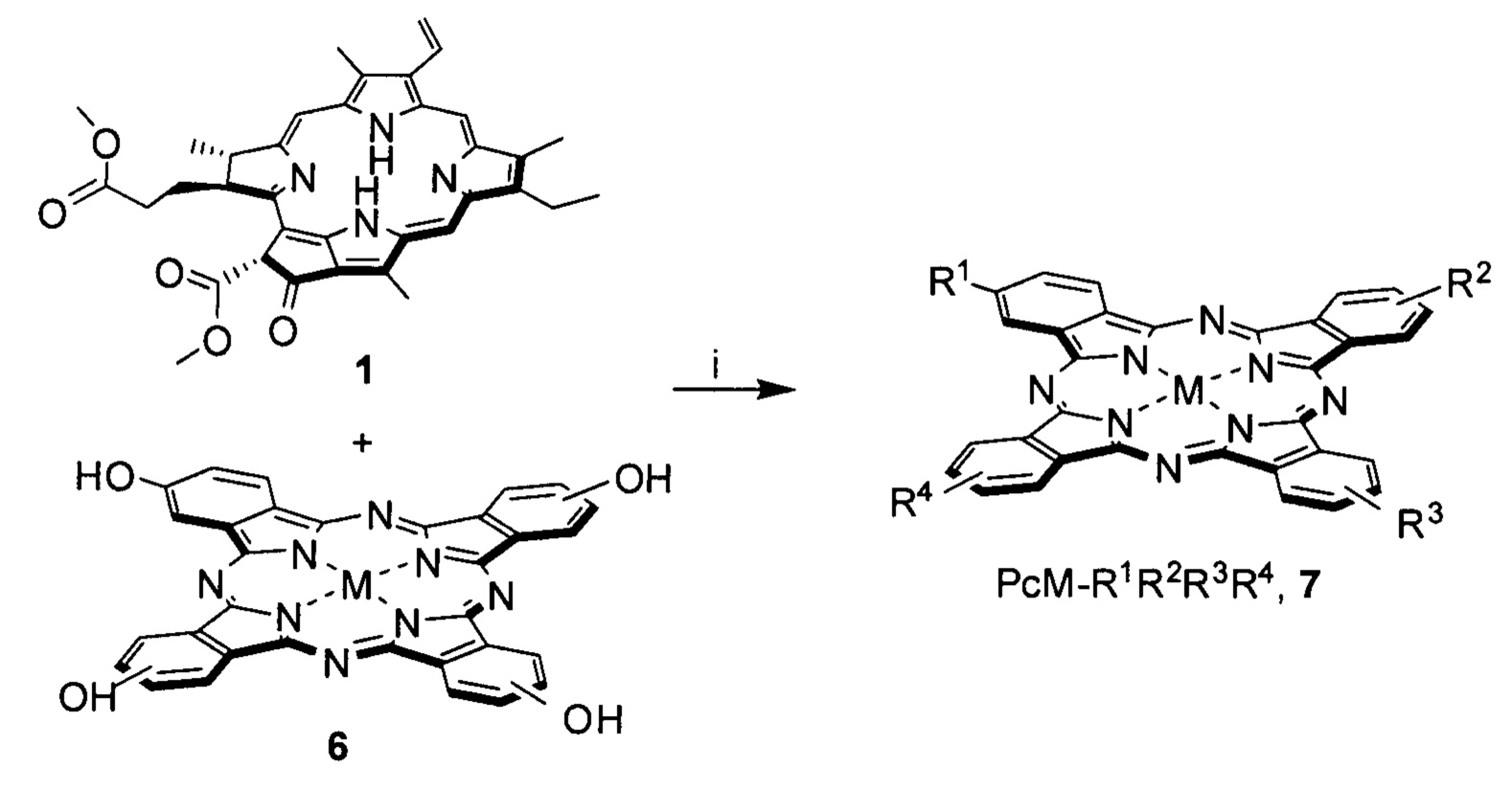
Схема 4. i: I2, ДМАП, толуол, 110°С (или I2, ДМАП, ДМФА, 153°С).
Целевые соединения 3, 5, 7 и 9 были выделены с помощью гельпроникающей хроматографии на полимерном носителе Bio-Beads S-X1 (BIORAD) с использованием толуола в качестве элюента, их строение было подтверждено методами ЭСП, масс-спектрометрии MALDI-TOF, 1Н ЯМР спектроскопии. Выходы продуктов превышают 55%. Также были проведены исследования флуоресценции диад 3, 5, 7 и 9 и стехиометрической смеси отдельных компонентов 1 и 2, или 1 и 4, или 1 и 6, или 1 и 8, соответственно, которые продемонстрировали наличие внутримолекулярного переноса энергии от фрагментов метилфеофорбида а к фталоцианину. ЭСП конъюгатов 3, 5, 7 и 9 представляют собой суперпозицию спектров входящих в их состав компонентов и близки к ЭСП стехиометрической смеси исходных соединений 1 и 2, или 1 и 4, или 1 и 6, или 1 и 8, соответственно.
ЭСП регистрировали с помощью спектрофотометра U-2900 (Hitachi), спектры флуоресценции - с помощью спектрофлуориметра Сагу Eclipse (Varian), в 1 см кварцевых кюветах для растворов соединений в хлороформе с концентрацией порядка 5⋅10-5 М для спектров поглощения и 10-6 М для спектров флуоресценции, соответственно. Масс-спектры матричной лазерной десорбционной ионизации с времяпролетным детектором (matrix-assisted laser desorption-ionization time-of-flight, MALDI-TOF) регистрировали на приборе VISION-2000 (Thermo BioAnalysis) с использованием α-циано-4-гидроксикоричной кислоты (α-cyano-4-hydroxycinnamic acid, НССА) в качестве матрицы. Спектры 1Н ЯМР регистрировали на спектрометре Bruker Avance 500 (500 МГц) с использованием CDCl3 в качестве растворителя, химический сдвиг (м.д.) определяли относительно тетраметилсилана (SiMe4).
Краткое описание чертежей
Изобретение поясняется следующими чертежами.
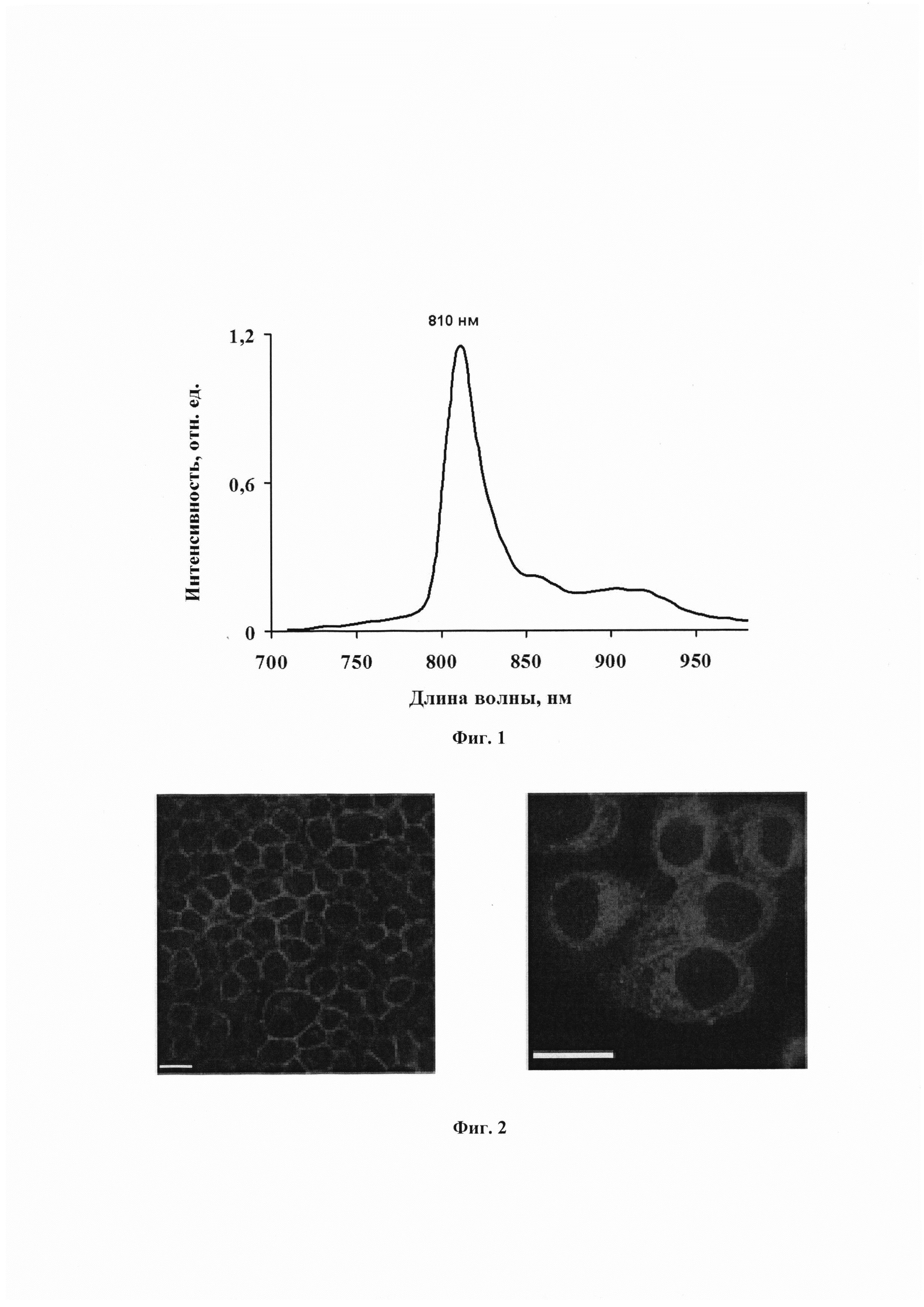
На фиг. 1. Показан спектр фосфоресценции конъюгата при 298К.
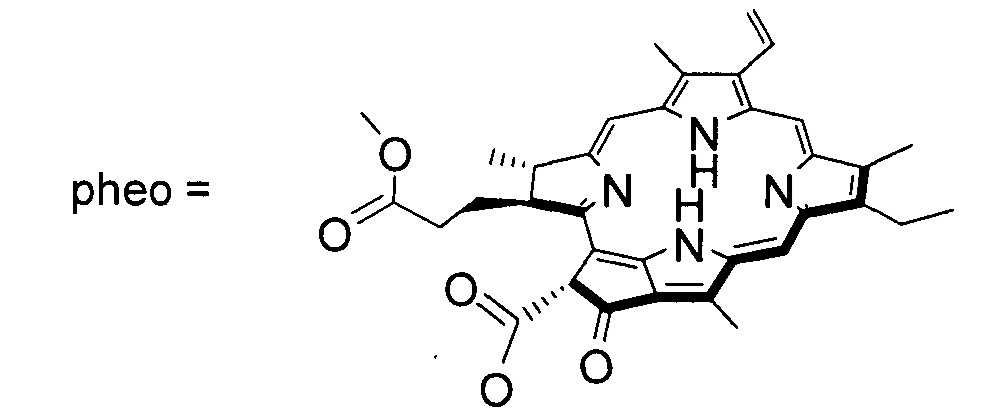
На фиг. 2. Представлены фотографии, демонстрирующие локализацию конъюгата в клетках Тса8113 после 30 мин и 1 ч инкубирования (масштаб 20 мкм).
На фиг. 3 представлен график зависимости токсичности (%) от концентрации фотосенсибилизатора (мг/мл). Клетки Тса8113 обработанные конъюгатом и инкубированные в течение 24 ч в темноте.
На фиг. 4 представлен график зависимости токсичности (%) от мощности лазера без обработки клеток конъюгатом.
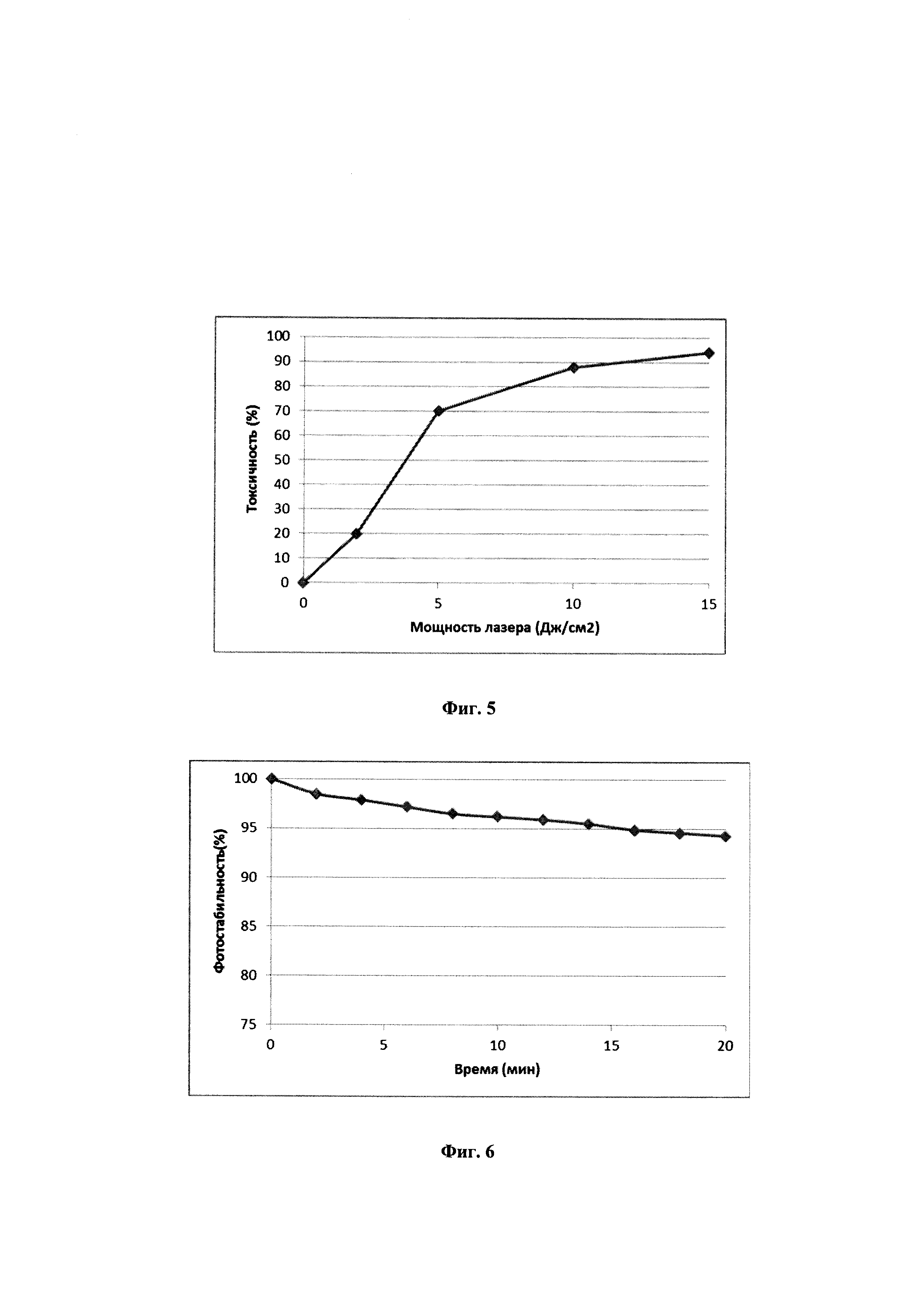
На фиг. 5 представлен график зависимости токсичности (%) от мощности лазера.
На фиг. 6 показан график зависимости фотостабильности фотосенсибилизатора при облучении в течение 20 мин с мощностью 15 Дж/см2.
Осуществление изобретения
Ниже приведены основные термины и определения, используемые при описании осуществления изобретения.
ДМФА - N,N-Диметилформамид
ДМСО - диметилсульфоксид
ДБУ - диазабициклоундецен, 1,8-Диазабицикло[5.4.0]ундец-7-ен
ДМАП - 4-Диметиламинопиридин
ДФИБФ - 1,3-дифенилизобензофуран
ТСХ - тонкослойная хроматография
ТЭА - триэтаноламин, N,N-(2-гидроксиэтил)-2-аминоэтанол
ФС - фотосенсибилизатор
ФДТ - фотодинамическая терапия
ЭСП - электронная абсорбционная спектроскопия
Каталитическое количество - не более 2.5 мольных %.
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°С; выпаривание растворителя осуществляли с использованием роторного испарителя, при пониженном давлении при температуре бани примерно 50°С; контроль за ходом реакции осуществляли при помощи тонкослойной хроматографии (ТСХ), структуру и чистоту всех выделенных соединений подтверждали, по меньшей мере, одним из следующих методов: ТСХ (пластины для ТСХ с предварительно нанесенным силикагелем 60 F254 Merck), масс-спектрометрия или ядерный магнитный резонанс (ЯМР).
Приведенные ниже примеры иллюстрируют, но не ограничивают настоящее изобретение.
Пример 1. Синтез диады 3 HtBuPcZn-OCH2C6H4CH2-pheo (R=трет-C4H9, R'=Н, М=Zn).
В 5 мл толуола растворяли 15.2 мг (0.025 ммоль) метилфеофорбида а 1, 13.3 мг (0.015 ммоль) фталоцианина 2 (R=трет-C4H9, R'=Н, М=Zn), добавляли 1.8 мг (0.015 ммоль) 4-диметиламинопиридина (ДМАП) и каталитическое количество I2, после чего полученную смесь выдерживали при кипении в течение 3 ч. Затем упаривали толуол на роторном испарителе, переосаждали реакционную массу из смеси метанол ÷ вода (70:30 об. %), что сопровождалось частичным отделением непрореагировавшего метилфеофорбида 1. Твердый остаток растворяли в толуоле и подвергали очистке методом гель-проникающей хроматографии на носителе Bio-Beads S-X1 (элюент - толуол), выделяя вторую фракцию сине-зеленого цвета с последующей сушкой под вакуумом. Дополнительную очистку проводили методом препаративной тонкослойной хроматографии (ТСХ) на силикагеле (элюент - толуол ÷ метанол, 10:1 об.), выделяя фракцию сине-зеленого цвета с Rf=0.65 (11.8 мг, 54%), представляющую собой 3 (R=трет-C4H9, R'=Н, М=Zn). MS MALDI-TOF (m/z) 1455.69 [M+H]+ (рассчитано для C87H83N12O6Zn: 1455.58); ЭСП (CHCl3) λмакс нм (I/Iмакс):348 (0.828), 411 (0.686), 507 (0.128), 538 (0.123), 618 (0.291), 680 (1); 1Н ЯМР (CDCl3) δН м.д.: 8.77-9.65 (m, 8Н, α-HAr,Рс), 8.21-8.45 (m, 4Н, β-HAr,Рс), 7.35-9.65 (group s, 3Н, 5,10,20-Hpheo; m 1H, 31-Hpheo), 7.36-7.75 (m, 4Н, HAr,sp), 5.86, 5.89 (2 s, 1H, 132-Hpheo), 5.69-5.80 (m, 2Н, 32-Hpheo), 5.37-5.85 (m, 4Н, HCH2,sp), 3.83-3.98 (m, 1H, 18-Hpheo), 3.69-3.81 (m, 1Н, 17-Hpheo), 3.52-3.62 (m, 3Н, HMeO,pheo), 3.19-3.26 (m, 2Н, 81-Hpheo), 2.60-2.89 (group s, 3Н, 71-Hpheo), 2.37-2.52 (m, 2Н, 171-Hpheo), 2.18-2.38 (m, 2Н, 172-Hpheo), 1.48-1.98 (group s, 36Н, HtBu,Pc 21,121,181-Hpheo), 1.32-1.43 (m, 3Н, 82-Hpheo), -1.71, -2.18, -4.25, -4.51 (4 br s, 2H, N-Hpheo).
Пример 2. Синтез диады 5 HtBuPcZn-pheo (R=трет-С4Н9, R'=H, M=Zn).
В 5 мл ДМСО растворяли 15.2 мг (0.025 ммоль) метилфеофорбида а 1, 11.4 мг (0.015 ммоль) фталоцианина 4 (R=трет-С4Н9, R'=Н, М=Zn), добавляли 2.28 мг (0.015 ммоль) ДБУ и каталитическое количество I2, после чего полученную смесь выдерживали при кипении в течение 3 ч. Затем упаривали толуол на роторном испарителе, переосаждали реакционную массу из смеси метанол ÷ вода (70:30 об. %), что сопровождалось частичным отделением непрореагировавшего метилфеофорбида 1. Твердый остаток растворяли в толуоле и подвергали очистке методом гель-проникающей хроматографии на носителе Bio-Beads S-X1 (элюент - толуол), выделяя вторую фракцию сине-зеленого цвета с последующей сушкой под вакуумом. Дополнительную очистку проводили методом препаративной ТСХ на силикагеле (элюент - толуол ÷ метанол, 10:1 об.), выделяя фракцию сине-зеленого цвета с Rf=0.6 (10.4 мг, 52%), представляющую собой 5 (R=трет-C4H9, R'=Н, М=Zn). MS MALDI-TOF (m/z) 1335.56 [M+H]+ (рассчитано для C79H75N12O5Zn: 1335.52); ЭСП (CHCl3) λмакс нм (I/Iмакс):348 (0.835), 411 (0.695), 508 (0.123), 538 (0.115), 617 (0.295), 678 (1); 1Н ЯМР (CDC13) δН м.д.: 8.57-9.68 (m, 8Н, α-HAr,Рс), 8.11-8.46 (m, 4Н, β-HAr,Рс), 7.35-9.65 (group s, 3Н, 5,10,20-Hpheo; m 1H, 31-Hpheo), 5.75, 5.86 (2 s, 1H, 132-Hpheo), 5.69-5.80 (m, 2Н, 32-Hpheo), 3.85-4.01 (m, 1H, 18-Hpheo), 3.72-3.80 (m, 1Н, 17-Hpheo), 3.52-3.62 (m, 3Н, HMeO,pheo), 3.18-3.26 (m, 2Н, 81-Hpheo), 2.56-2.89 (group s, 3Н, 71-Hpheo), 2.36-2.51 (m, 2Н, 171-Hpheo), 2.17-2.35 (m, 2Н, 172-Hpheo), 1.49-1.99 (group s, 36Н, HtBu,Pc 21,121,181-Hpheo), 1.31-1.45 (m, 3H, 82-Hpheo), -1.65, -2.15, -4.22, -4.45 (4 br s, 2H, N-Hpheo).
Пример 3. Синтез диады 7 PcZn-(OH)3-pheo (R1=R2=R3=OH, R4=pheo, M=Zn).
В 5 мл ДМФА растворяли 15.2 мг (0.025 ммоль) метилфеофорбида а 1, 9.6 мг (0.015 ммоль) фталоцианина 6 (М=Zn), добавляли 1.19 мг (0.015 ммоль) пиридина и каталитическое количество I2, после чего полученную смесь выдерживали при кипении в течение 3 ч. Затем упаривали толуол на роторном испарителе, переосаждали реакционную массу из смеси метанола ÷ вода (70:30 об. %), что сопровождалось частичным отделением непрореагировавшего метилфеофорбида 1. Твердый остаток растворяли в толуоле и подвергали очистке методом гель-проникающей хроматографии на носителе Bio-Beads S-X1 (элюент - толуол), выделяя вторую фракцию сине-зеленого цвета с последующей сушкой под вакуумом. Дополнительную очистку проводили методом препаративной ТСХ на силикагеле (элюент - толуол ÷ метанол, 10:1 об.), выделяя фракцию сине-зеленого цвета с Rf=0.46 (6.7 мг, 37%), представляющую собой 7 (R1=R2=R3=ОН, R4=pheo, М=Zn). MS MALDI-TOF (m/z) 1221.38 [M+Li]+ (рассчитано для C67H50N12O8LiZn: 1221.33); ЭСП (CHCl3) λмакс нм (I/Iмакс):352 (0.855), 411 (0.692), 508 (0.125), 538 (0.117), 619 (0.307), 686 (1); 1Н ЯМР (CDCl3) δН м.д.: 8.65-9.88 (m, 8Н, α-HAr,Рс), 8.23-8.56 (m, 4Н, β-HAr,Рс), 7.35-9.65 (group s, 3Н, 5,10,20-Hpheo; m 1Н, 31-Hpheo), 5.77, 5.88 (2 s, 1Н, 132-Hpheo), 5.67-5.78 (m, 2H, 32-Hpheo), 5.38 (с, 3Н, OH), 3.88-4.01 (m, 1H, 18-Hpheo), 3.75-3.81 (m, 1H, 17-Hpheo), 3.51-3.62 (m, 3H, HMeO,pheo), 3.19-3.28 (m, 2H, 81-Hpheo), 2.55-2.87 (group s, 3H, 71-Hpheo), 2.34-2.50 (m, 2H, 171-Hpheo), 2.14-2.35 (m, 2H, 172-Hpheo), 1.43-1.94 (group s, 9H, 21,121,181-Hpheo), 1.30-1.45 (m, 3H, 82-Hpheo), -1.63, -2.16, -4.23, -4.43 (4 br s, 2H, N-Hpheo).
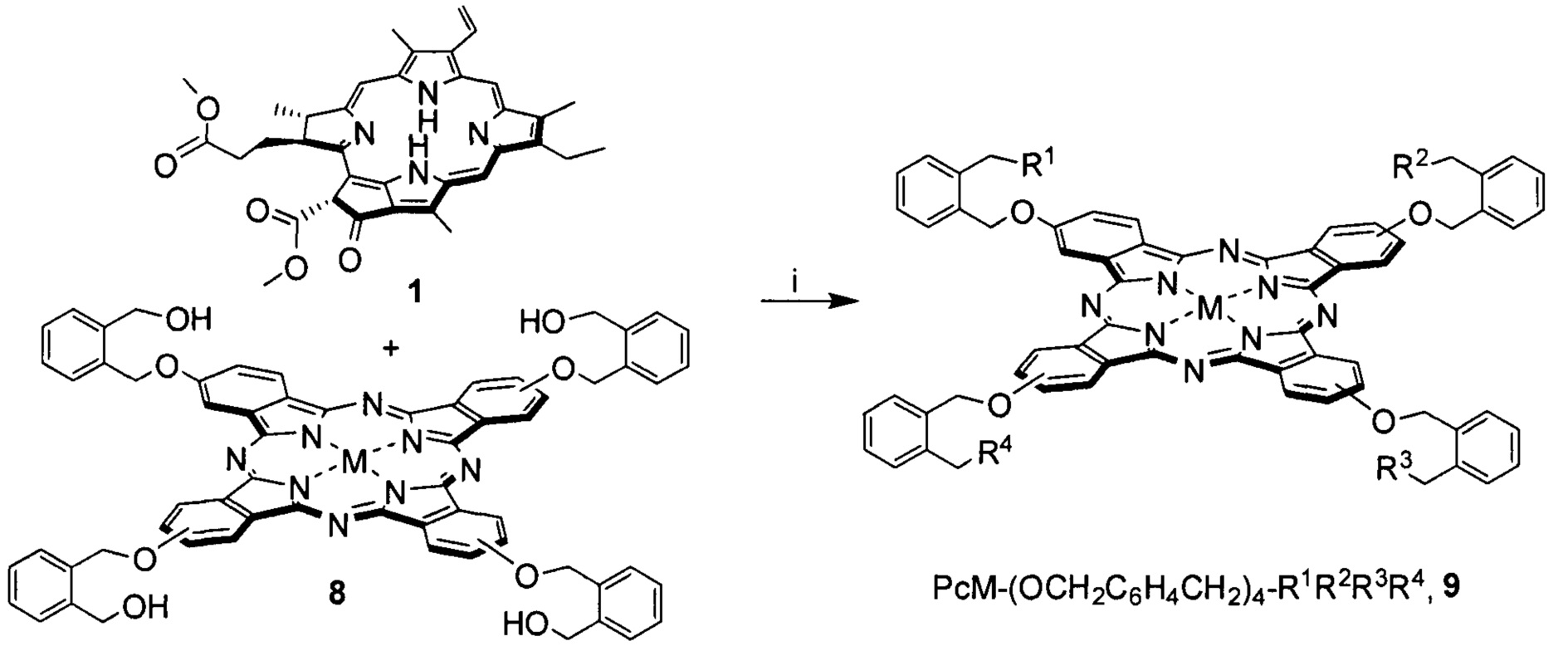
Пример 4. Синтез диады 9 PcM-(OCH2C6H4CH2OH)3-(OCH2C6H4CH2-pheo) (R1=R2=R3=OH, R4=pheo, M=Zn).
В 5 мл диоксана растворяли 15.2 мг (0.025 ммоль) метилфеофорбида а 1, 16.8 мг (0.015 ммоль) фталоцианина 8 (М=Zn), добавляли 2.02 мг (0.020 ммоль) ТЭА и каталитическое количество I2, после чего полученную смесь выдерживали при кипении в течение 3 ч. Затем упаривали толуол на роторном испарителе, переосаждали реакционную массу из смеси метанола ÷ вода (70:30 об. %), что сопровождалось частичным отделением непрореагировавшего метилфеофорбида 1. Твердый остаток растворяли в толуоле и подвергали очистке методом гель-проникающей хроматографии на носителе Bio-Beads S-X1 (элюент - толуол), выделяя вторую фракцию сине-зеленого цвета с последующей сушкой под вакуумом. Дополнительную очистку проводили методом препаративной ТСХ на силикагеле (элюент - толуол ÷ метанол, 10:1 об.), выделяя фракцию сине-зеленого цвета с Rf=0.55 (10.7 мг, 42%), представляющую собой 9 (R1=R2=R3=ОН, R4=pheo, М=Zn). MS MALDI-TOF (m/z) 1696.86 [M+H]+ (рассчитано для C99H83N12O12Zn: 1696.55); ЭСП (CHCl3) λмакс нм (I/Iмакс):352 (0.867), 411 (0.702), 507 (0.131), 538 (0.118), 618 (0.311), 684 (1); 1Н ЯМР (CDCl3) δH м.д.: 8.55-9.69 (m, 8Н, α-HAr,Рс), 8.32-8.59 (m, 4Н, β-HAr,Рс), 7.33-9.69 (group s, 3Н, 5,10,20-Hpheo; m 1H, 31-Hpheo), 7.29-7.75 (m, 16Н, HAr, HAr,sp), 5.84, 5.87 (2 s, 1Н, 132-Hpheo), 5.68-5.81 (m, 2H, 32-Hpheo), 5.35-5.85 (m, 16H, HCH2, HCH2,sp), 4.78 (с, 3Н, OH), 3.84-3.99 (m, 1H, 18-Hpheo), 3.69-3.80 (m, 1H, 17-Hpheo), 3.52-3.62 (m, 3H, HMeO,pheo), 3.17-3.27 (m, 2H, 81-Hpheo), 2.58-2.89 (group s, 3H, 71-Hpheo), 2.33-2.52 (m, 2H, 171-Hpheo), 2.14-2.37 (m, 2H, 172-Hpheo), 1.45-1.99 (group s, 9H, 21,121,181-Hpheo), 1.30-1.46 (m, 3H, 82-Hpheo), -1.77, -2.24, -4.29, -4.58 (4 br s, 2H, N-Hpheo).
Биологические испытания
Объектом исследования являлся конъюгат цинкового комплекса фталоцианина с метилфеофорбидом а 3 (формула 1, диада 3 tBuHPcZn-OCH2C6H4CH2-pheo (R=трет-С4Н9, R'=Н, М=Zn). На первом этапе необходимо было оценить фотохимические характеристики данного соединения (фосфоресценция и квантовый выход генерации синглетного кислорода) и перспективность его как фотосенсибилизатора и дальнейшем использовании в фотодинамической терапии рака.
Исследование фосфоресценции образца при 298К.
Фосфоресценцию конъюгата измеряли при 298К на установке с фосфороскопом. Раствор конъюгата помещали в специальные металлические рамки толщиной 5 мм. Растворы в рамках с помощью специальных держателей помещали внутрь фосфороскопа. Оптическая плотность раствора 0,1 в 5 мм в длинноволновом максимуме поглощения при комнатной температуре. Фосфоресценцию возбуждали фокусированным светом ксеноновой лампы 1 кВт через красный граничный светофильтр КС-11 (λ≥680 нм). Спектр фосфоресценции измеряли с помощью монохроматора с репликой дифракционной решетки. Ширина щели соответствовала 8 нм. Полученный спектр фосфоресценции конъюгата показан на фиг. 1. Главный максимум соответствует 810 нм. Полуширина полосы фосфоресценции 24 нм.
Время жизни фосфоресценции, оцененное с помощью фосфороскопа по методу, описанному в работе [Krasnovsky Jr., А.А. (1979). Photoluminescence of singlet oxygen in pigment solutions. Photochemistry and Photobiology, 29(1), 29-36, https://doi.org/10.1002/chem.201402402], составляет 350±50 мкс.
Исследование квантового выхода генерации синглетного кислорода
Квантовый выход генерации синглетного кислорода этим соединением определяли относительным методом с помощью химической ловушки. В качестве соединения-стандарта использовали ТРР (мезо-тетрафенилпорфин). Согласно литературным данным, наиболее вероятное значение квантового выхода генерации синглетного кислорода этим порфирином в ацетоне составляет 0,65±0,05 [Krasnovsky Jr., А.А., Kozlov, A.S., Roumbal, Ya.V. (2012). Photochemical investigation of the IR absorption bands of molecular oxygen in organic and aqueous environment. Photochemical & Photobiological Sciences, 11(6), 988-997, https://doi.org/10.1039/C2PP05350K, Wilkinson, F., Helman, W.P., Ross, A.B. (1993).
Quantum yields of the photosensitized formation of the lowest electronically excited singlet states of molecular oxygen. Journal of Physical and Chemical Reference Data, 22(1), 113-262, https://doi.org/10.1063/L5559349]. В качестве химической ловушки использовали 1,3-дифенилизобензофуран (ДФИБФ). Взаимодействие этой ловушки с синглетным кислородом определяется химической реакцией, указанной на нижеприведенной (см. Рис. 3) схеме [Young, R.H., Brewer, D., Keller, R.A. (1973). The determination of rate constants of reaction and lifetimes of singlet oxygen in solution by a flash photolysis technique. Journal of the American Chemical Society, 95(2), 375-379, https://doi.org/10.1021/ja00783a012]. Продукты реакции не имеют полос поглощения в видимом диапазоне спектра. Поэтому о количестве синглетного кислорода, образовавшегося за время фотореакции, можно судить по убыли оптической плотности в области максимума поглощения ДФИБФ.
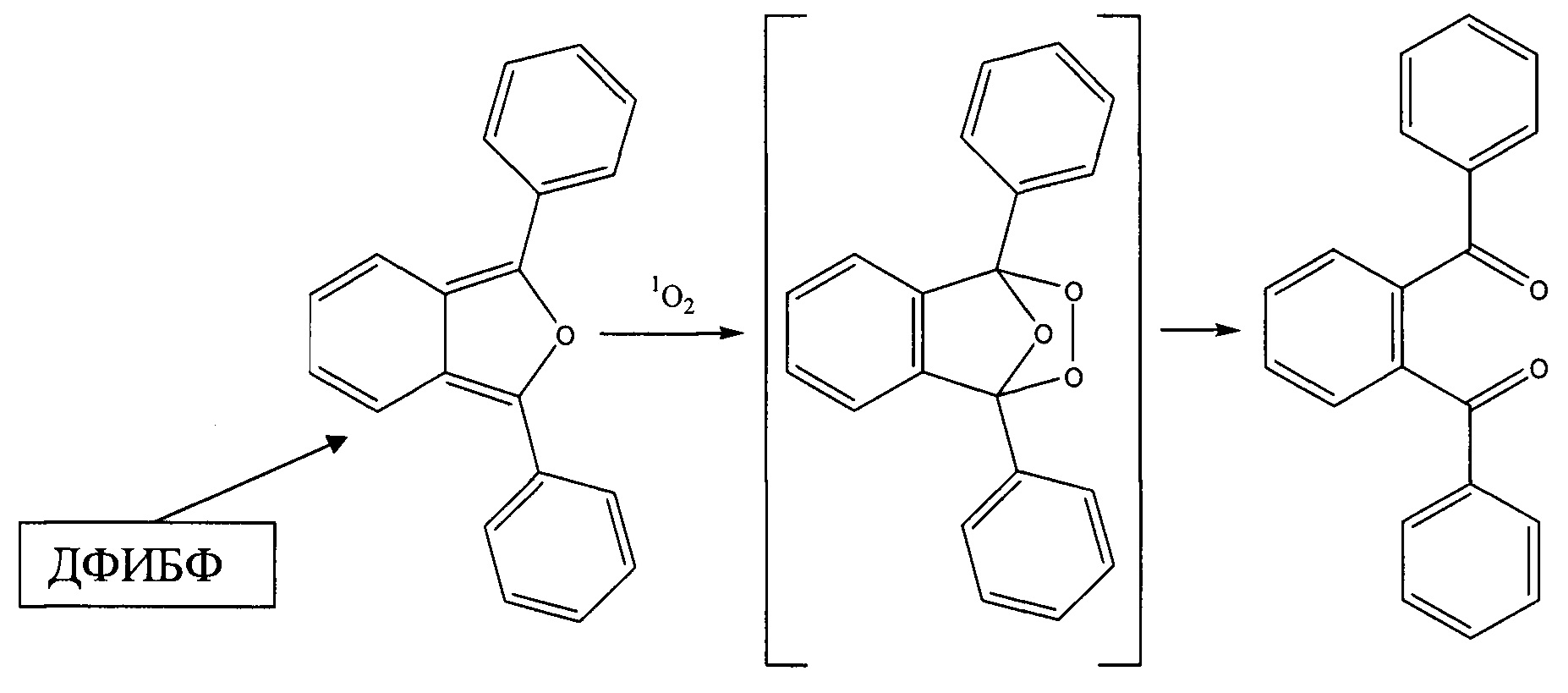
Механизм взаимодействия химической ловушки с синлетным кислородом.
Для определения квантовых выходов генерации синглетного кислорода готовили смешанные растворы исследуемого соединения и ДФИБФ в фиксированном объеме растворителя. Измерения проводили в квадратных кварцевых флуоресцентных кюветах с длиной оптического пути 1 см. Растворы облучали определенное время светом, проходящим через монохроматор от ксеноновой лампы флуориметра Perkin Elmer MPF-44В, его мощность измеряли с помощью прибора ThorLabs PM-100D с сенсорной головкой S120VC (Германия). Длина волны света, которым облучались пробы, была подобрана по положению максимума красной полосы исследуемого соединения. Спектральная ширина щели соответствовала 5 нм. При облучении контролировали не только изменение оптической плотности в области максимума поглощения ДФИБФ, но и при длине волны возбуждающего света. За время облучения полоса поглощения сенсибилизатора не выцветала, т.е. оптическая плотность сенсибилизатора при длине волны возбуждающего света не изменялась. Оптическую плотность определяли с помощью двухлучевого спектрофотометра Hitachi U-3400. Данные Табл. 1 рассчитаны для концентрации ДФИБФ в пробе, соответствующей оптической плотности, равной 1, в максимуме поглощения ДФИБФ (412 нм) в кювете 1 см.
При расчете квантового выхода относительным методом производится сравнение убыли оптической плотности ДФИБФ и времени облучения в экспериментах, проводимых для исследуемого соединения и соединения-стандарта. С каждым соединением проводили три эксперимента. Расчет производили по следующей формуле:
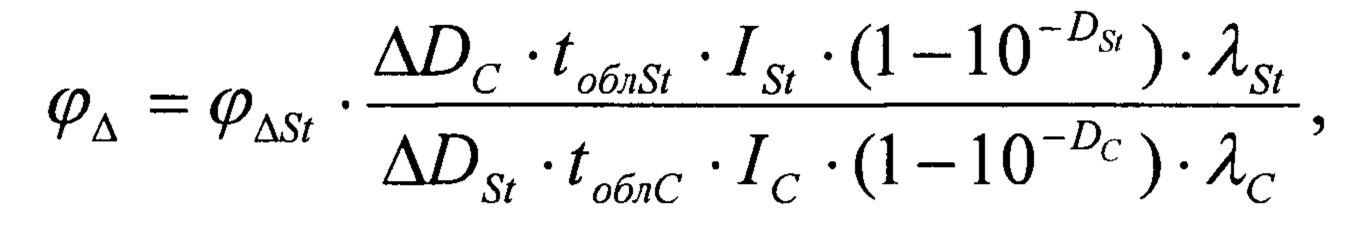
где ϕΔSt - квантовый выход генерации синглетного кислорода соединения-стандарта;
ΔDC - средняя убыль оптической плотности ДФИБФ в экспериментах с исследуемым соединением, ΔDSt - средняя убыль оптической плотности ДФИБФ в экспериментах со стандартом, tоблС - длительность облучения смеси ДФИБФ с исследуемым соединением в с, tоблSt - длительность облучения смеси ДФИБФ с соединением-стандартом в с, IC и ISt - интенсивности светового потока от ксеноновой лампы в экспериментах с исследуемым соединением и соединением-стандартом в мкВт, DC и DSt - оптические плотности исследуемого соединения и соединения-стандарта, соответствующие длинам волн возбуждающего света λC и λSt (в нм). Расчеты проводили в программе MS Excel.

Вывод: энергия триплетного состояния изученного соединения существенно больше синглетного 1Δg состояния кислорода. Учитывая этот факт и относительно большую длительность триплетного состояния, можно ожидать, что указанное вещество должно эффективно генерировать синглетный кислород.
После определения фотохимических характеристик конъюгата (определения время жизни фосфоресценции и квантового выхода генерации синглетного кислорода) были проведены исследования распределения и фотодинамического терапевтического эффекта конъюгата на клеточной линии клеточной карциномы человека Тса8113 in vitro.
Распределение конъюгата в клетках Тса8113 наблюдалось in situ в сочетании с митохондриальными и лизосомальными флуоресцентными зондами. Затем проводилось облучение полупроводникового лазера на 680 нм. Колориметрический метод МТС использовался для определения выживаемости клеток. Для выявления раннего апоптоза после фотодинамической терапии (ФДТ) использовалось двойное окрашивание изотиоцианатом флуоресцеина / пропидий ионидом.
Человеческая клеточная линия Тса8113 была предоставлена Третьим военным медицинским университетом. Клетки Тса8113 культивировали в модифицированной Дульбекко среде Eagle и 10% фетальной телячьей сыворотки, дополненной стрептомицином 100 U/мл и 100 мкг/мл пенициллина. Набор для определения апоптоза был приобретен у Sigma. Митохондриальные (ab112143) и лизосомальные (ab112137) зонды были приобретены у Abeam (Cambridge, UK). Комплект MTS был приобретен у Promega (Madison, WI, USA). 96- и 6-луночные планшеты, колбы на 50 мл и 35-миллиметровые чашки для культивирования клеток были приобретены у Corning Costar (Амстердам, Нидерланды).
В общей сложности 10000 клеток Тса8113 предварительно обрабатывали раствором конъюгата в течение от 30 мин до 5 ч в чашке для культивирования. После двухкратного промывания фосфатным буфером в чашку добавляли митохондриальные и лизосомальные зонды. Флуоресцентные изображения собирали с использованием конфокального лазерно-сканирующего микроскопа (UltraView VOX, PerkinElmer, Waltham, MA, USA).
В общей сложности 5000 клеток Тса8113 высевали в 96-луночные культуральные планшеты. Клетки предварительно обрабатывали раствором конъюгата в течение 3 ч в инкубаторе при 37°С, затем дважды промывали фосфатным буфером и инкубировали еще 30 мин. Затем клетки облучались в темной комнате в течение 5-150 секунд с помощью лазерного излучения полупроводникового диодного лазера LD680.
Результаты
Исследования по локализации конъюгата в клетках Тса8113. Интенсивность флуоресценции фотосенсибилизатора постепенно увеличивалась с увеличением времени совместной инкубации. Через 3 ч интенсивность флуоресценции стабилизировалась. Не было обнаружено статистически значимой разницы в интенсивности флуоресценции через 3, 4 и 5 ч. В начале инкубирования фотосенсибилизатора большая часть конъюгата была расположена вокруг клеточной мембраны, с меньшим наблюдением в цитоплазме. По мере увеличения времени инкубации конъюгат преимущественно распределялся гранулярно в цитоплазме с небольшим распределением в ядре (фиг. 2).
Используя колориметрический анализ МТС, токсичность конъюгата на клетках Тса8113 анализировали путем измерения активности фермента дегидрогеназы. После 24 ч инкубации 10 и 5 мкг/мл конъюгата индуцировали токсичность менее 10% и 5% соответственно. Учитывая, что накопление фотосенсибилизатора достигло плотности насыщения через 3 ч после инкубации, основываясь на данных МТС можно предположить, что безопасная доза препарата ≤ 10 мкг/мл, так как это может привести к темной токсичности (фиг. 3).
После анализа данных МТС исследовали клетки Тса8113, инкубированные с различными концентрациями конъюгата (диапазон от 0.5 до 20 мкг/мл) и дозы облучения (диапазон 0.5-15 Дж/см2). Анализ МТС показал, что облучение или обработка клеток только с помощью конъюгата не вызывает значительной клеточной токсичности (Фиг. 3, 4).
Комбинация обработки фотосенсибилизатором и облучения продемонстрировала почти линейные корреляции с облучаемой дозой, концентрацией конъюгата и токсичностью. Увеличение дозы облучения от 0 до 15 Дж/см2 в клетках, обработанных 2 мкг/мл фотосенсибилизатором, приводило к постепенному увеличению клеточной токсичности (Фиг. 5). Также были проведены исследования по изучению фотодеградации данного фотосенсибилизатора и было установлено что даже при облучении лазером с мощностью 15 Дж/см2 не происходит выцветания конъюгата в течение 30 мин (Фиг. 6).
Таким образом, с использованием модели ФДТ in vitro на основе человеческих раковых клеточных линий настоящее исследование показало, что фотосенсибилизатор 3 (R=трет-С4Н9, R'=Н, М=Zn) может быть использован для лечения карциномы человека. Однако фармакокинетика и цитотоксические механизмы требуют дальнейшего изучения, чтобы заложить экспериментальную основу для будущего клинического применения.
Таким образом, способ получения таких конъюгатов, заключающийся в реакции замещения α-кето метилового эфирного фрагмента метилфеофорбида а соответствующим производным фталоцианина, содержащим одну или несколько гидрокси- или 2-гидроксиметилбензилокси-групп на периферии позволяет получить ковалентно связанные конъюгаты, содержащие структурно родственные макрогетероциклы тетрапиррольного типа, одновременно включающие порфириновое и фталоцианиновое ядро с высоким выходом. Обнаруженные в молекуле впервые полученных диад фталоцианин-феофорбид взаимодействия и проявляемые оптические свойства свидетельствуют о высокой перспективности этого нового класса соединений для дальнейших исследований и практического приложения в качестве материалов для электронной техники. Полученные конъюгаты могут быть использованы в качестве ФС в ФДТ рака и тераностике.