Результат интеллектуальной деятельности: СПОСОБЫ ЛЕЧЕНИЯ РАКА, ИМЕЮЩЕГО ГЕМИЗИГОТНУЮ ПОТЕРЮ ТР53
Вид РИД
Изобретение
УРОВЕНЬ ТЕХНИКИ
[0001] По настоящей заявке испрашивается приоритет на основании предварительной заявки на патент США 62/128,480, поданной 4 марта 2015 года, все содержание которой настоящим включено посредством отсылки.
[0002] Изобретение было подготовлено с правительственной поддержкой по грантам R01 CA136549 и U54 CA151668, выданным Национальными институтами здравоохранения США. Правительство обладает некоторыми правами на изобретение.
1. Область техники, к которой относится изобретение
[0003] Настоящее изобретение в целом относится к областям медицины и онкобиологии. В частности оно относится к способам лечения злокачественных новообразований, имеющих гемизиготную потерю TP53.
2. Описание предшествующего уровня техники
[0004] TP53, известный ген-супрессор опухоли, часто инактивируется в результате мутации или делеции в большинстве человеческих опухолей (Petitgean et al., 2007; Vazquez et al., 2008). Огромные усилия были приложены для восстановления активности p53 в противоопухолевых терапиях (Chene, 2003; Wade et al., 2013). Несмотря на то, что генотерапия с применением аденовирусных векторов, экспрессирующих p53 дикого типа, показала активность в нескольких клинических исследованиях, переменная и недостаточная доставка гена в каждую опухолевую клетку и присутствие антител реципиента против аденовируса ограничивала их клиническое применение (Lane et al., 2010; Haupt and Haupt, 2004). Также был разработан ряд низкомолекулярных химических соединений, которые повышают активность p53. Однако их можно применять только в случае человеческих злокачественных новообразований, имеющих p53 дикого типа (Cheok et al., 2011; Goldstein et al., 2011). Между тем, ни одной эффективной терапии на основе p53 не удалось успешно перевести в клиническое лечение рака из-за сложности регуляторов p53 и их низкой применимости в качестве лекарственных средств. Таким образом, необходимы новые стратегии для лечения p53-дефицитных злокачественных новообразований.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] В некоторых вариантах осуществления предложены способы лечения больного, имеющего раковые клетки, которые демонстрируют: (i) гемизиготную потерю гена TP53; (ii) гемизиготную потерю гена POLR2A; и/или (iii) пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня экспрессии (например, уровня экспрессии в нераковом образце), где способ включает введение терапевтически эффективного количества ингибитора POLR2A такому больному. В некоторых аспектах больной имеет раковые клетки, которые демонстрируют гемизиготную потерю гена TP53. В некоторых аспектах больной имеет раковые клетки, которые демонстрируют гемизиготную потерю гена POLR2A. В некоторых аспектах больной имеет раковые клетки, которые демонстрируют пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня экспрессии.
[0006] В некоторых аспектах ингибитор POLR2A включает нуклеиновую кислоту, которая ингибирует экспрессию белка POLR2A. В некоторых аспектах ингибитор POLR2A включает альфа-аманитин. В некоторых аспектах альфа-аманитин конъюгирован с антителом, таким как антитело, которое направлено против раковых клеток (например, антитело к опухолеассоциированному антигену). В некоторых аспектах антитело может быть EpCAM-специфичным антителом.
[0007] В некоторых аспектах продуктом гена POLR2A является мРНК. Уровень экспрессии мРНК может быть определен с помощью Нозерн-блоттинга, количественной ПЦР в реальном времени с обратной транскрипцией (ОТ-кПЦР), анализа с защитой от нуклеаз, транскриптомного анализа, гибридизационного анализа, платформы экспрессии на основе чипов или платформы анализа РНК Invader. В некоторых аспектах продуктом гена POLR2A является белок. Уровень экспрессии белка может быть определен с помощью масс-спектрометрии, вестерн-блоттинга, ELISA, иммунопреципитационного, иммуногистохимического или радиоиммуноанализа. В некоторых аспектах число копий в геноме определяют с целью обнаружения гемизиготной потери гена TP53 или гемизиготной потери гена POLR2A. В некоторых аспектах число копий в геноме определяют с помощью технологии геномной гибридизации (например, анализа FISH), ПЦР-анализа (например, ПЦР в реальном времени) или анализа рестрикционных фрагментов.
[0008] В некоторых аспектах рак является раком легкого, раком головного мозга, раком молочной железы, раком печени, раком яичника, раком толстой и прямой кишки, раком предстательной железы или раком поджелудочной железы. В некоторых аспектах рак является метастатическим, рецидивирующим или имеет множественную лекарственную устойчивость.
[0009] В некоторых аспектах способы дополнительно включают применение по меньшей мере второй противоопухолевой терапии у субъекта. В некоторых аспектах вторая противоопухолевая терапия является хирургической терапией, химиотерапией, лучевой терапией, криотерапией, гормональной терапией, терапией токсинами, иммунотерапией или терапией цитокинами. В некоторых аспектах химиотерапию проводят с применением 5-фторурацила, оксалиплатина или SN-38.
[0010] В некоторых аспектах больной является человеком. В некоторых аспектах больной является не относящимся к человеку млекопитающим.
[0011] В некоторых аспектах больной проходит лечение по меньшей мере второй раз. В некоторых аспектах больной проходит лечение в течение периода продолжительностью от 1 недели до 6 месяцев. В некоторых аспектах больной ранее проходил по меньшей мере один курс противоопухолевой терапии.
[0012] В некоторых вариантах осуществления предложены способы лечения больного, имеющего рак, включающие: (a) отбор больного, у которого обнаружены раковые клетки, включающие: (i) гемизиготную потерю гена TP53; (ii) гемизиготную потерю гена POLR2A; и/или (iii) пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня; и (b) введение такому больному терапевтически эффективного количества ингибитора POLR2A.
[0013] В некоторых аспектах отбор больного включает получение образца рака и определение, включают ли клетки рака: (i) гемизиготную потерю гена TP53; (ii) гемизиготную потерю гена POLR2A; и/или (iii) пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня. В некоторых аспектах способы дополнительно включают предоставление отчета об определении. В некоторых аспектах отчет является отчетом в письменной или электронной форме. В некоторых аспектах отчет предоставляют больному, лицу, оплачивающему медицинские услуги, врачу, страховому агенту или вводят в электронную систему.
[0014] В некоторых аспектах отбор больного включает получение результатов исследования, в котором определяют, включают ли клетки рака: (i) гемизиготную потерю гена TP53; (ii) гемизиготную потерю гена POLR2A; и/или (iii) пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня.
[0015] В некоторых аспектах клетки рака включают гемизиготную потерю гена TP53. В некоторых аспектах клетки рака включают гемизиготную потерю гена POLR2A. В некоторых аспектах клетки рака включают пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня (например, уровня экспрессии в нераковом образце).
[0016] В некоторых вариантах осуществления предложены способы подбора лекарственной терапии для больного раком, включающие: (a) получение образца рака; (b) обнаружение наличия: (i) гемизиготной потери гена TP53; (ii) гемизиготной потери гена POLR2A; и/или (iii) пониженного уровня экспрессии продукта гена POLR2A относительно референсного уровня в клетках рака; и (c) подбор ингибитора POLR2A, если в клетках рака: (i) обнаружена гемизиготная потеря гена TP53; (ii) обнаружена гемизиготная потеря гена POLR2A; и/или (iii) обнаружен пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня.
[0017] В некоторых аспектах способы дополнительно включают введение терапевтически эффективного количества ингибитора POLR2A больному.
[0018] В некоторых аспектах клетки рака включают гемизиготную потерю гена TP53. В некоторых аспектах клетки рака включают гемизиготную потерю гена POLR2A. В некоторых аспектах клетки рака включают пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня (например, уровня экспрессии в нераковом образце).
[0019] В некоторых вариантах осуществления предложены композиции, включающие ингибитор POLR2A, для применения в лечении рака у субъекта, где было определено, что клетки рака включают: (i) гемизиготную потерю гена TP53; (ii) гемизиготную потерю гена POLR2A; или (iii) пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня (например, уровня экспрессии в клетках неракового образца).
[0020] В некоторых вариантах осуществления предложено применение ингибитора POLR2A в производстве лекарственного средства для лечения рака, где было определено, что клетки рака включают: (i) гемизиготную потерю гена TP53; (ii) гемизиготную потерю гена POLR2A; или (iii) пониженный уровень экспрессии продукта гена POLR2A относительно референсного уровня (например, уровня экспрессии в клетках неракового образца).
[0021] При использовании в настоящем описании фраза "по существу не содержит", в отношении указанного компонента, используется в настоящем описании в том смысле, что ни один из указанных компонентов не был специально включен в композицию и/или присутствует только как нежелательная примесь или в незначительных количествах. Общее количество указанного компонента, являющееся результатом какой-либо непреднамеренной контаминации композиции, таким образом, значительно ниже 0,05%, предпочтительно ниже 0,01%. Наиболее предпочтительна композиция, в которой никакое количество указанного компонента не может быть обнаружено с помощью стандартных аналитических методов.
[0022] При использовании в оригинальном тексте настоящего описания "a" или "an" могут означать один или более. При использовании в пункте(ах) настоящей формулы изобретения, в случае использования вместе со словом "включающий", слова "a" или "an" могут означать один или больше чем один.
[0023] Использование термина "или" в формуле изобретения используется в смысле "и/или", если прямо не указано его отношение к альтернативным вариантам, или альтернативные варианты являются взаимоисключающими, хотя настоящее описание поддерживает определение, которое относится только к альтернативным вариантам и "и/или". При использовании в настоящем описании "другой" может означать по меньшей мере второй или более.
[0024] По всему тексту настоящей заявки термин "приблизительно" используется для указания того, что значение включает изначальную вариацию погрешности для устройства, способа, применяемого для определения такого значения, или вариацию, которая присутствует между участниками исследования.
[0025] Другие объекты, признаки и преимущества настоящего изобретения станут очевидными из следующего подробного описания. Впрочем, следует понимать, что подробное описание и конкретные примеры, хотя и указывающие предпочтительные варианты осуществления изобретения, приведены исключительно в качестве иллюстрации, поскольку различные изменения и модификации в рамках сущности и объема изобретения станут очевидными для специалистов в данной области на основе этого подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0026] Следующие чертежи являются частью настоящего описания и включены для более полной демонстрации некоторых аспектов настоящего изобретения. Изобретение может быть лучше понято при обращении к одному или более таким чертежам в сочетании с подробным описанием определенных вариантов осуществления, представленных в настоящей заявке.
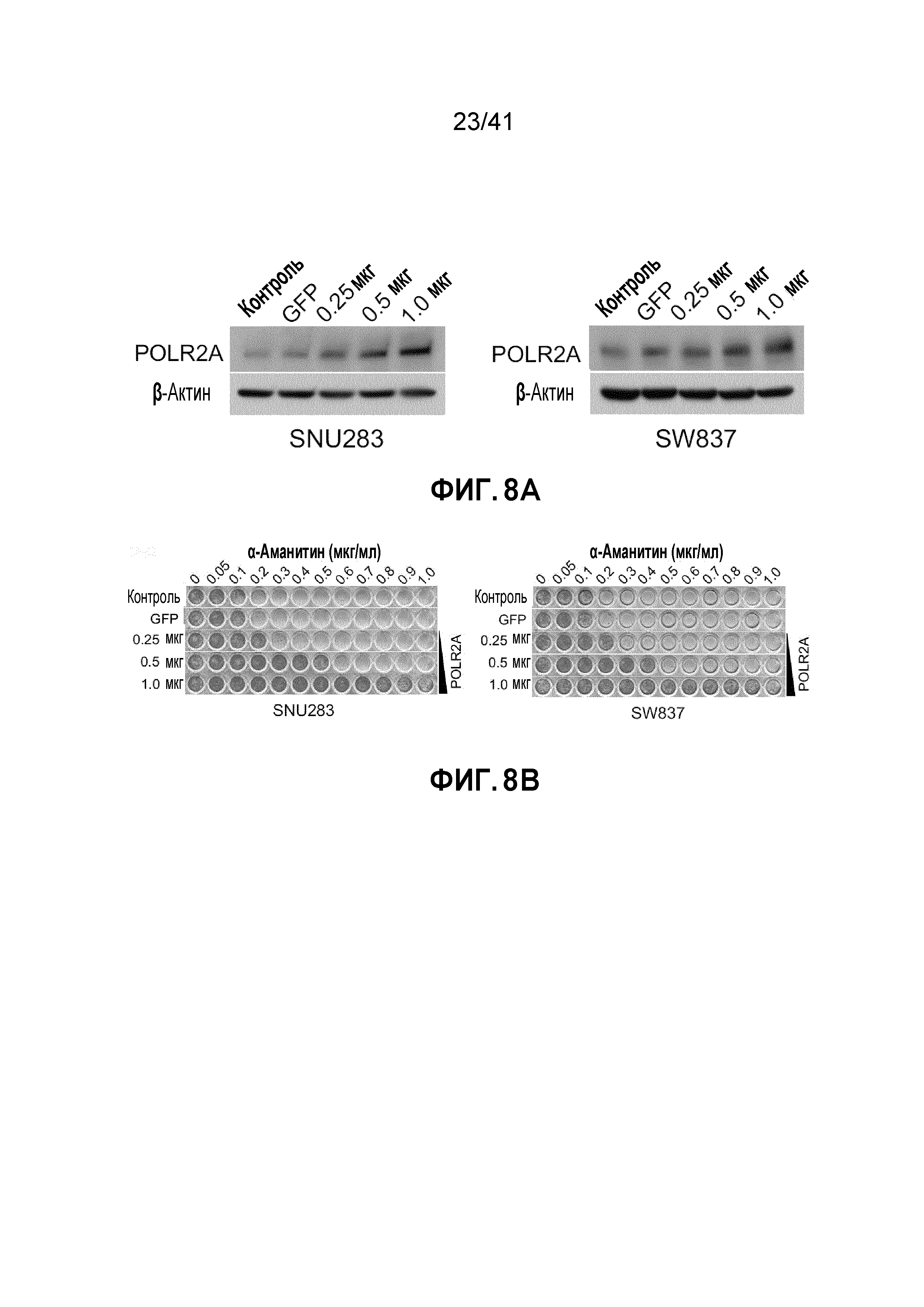
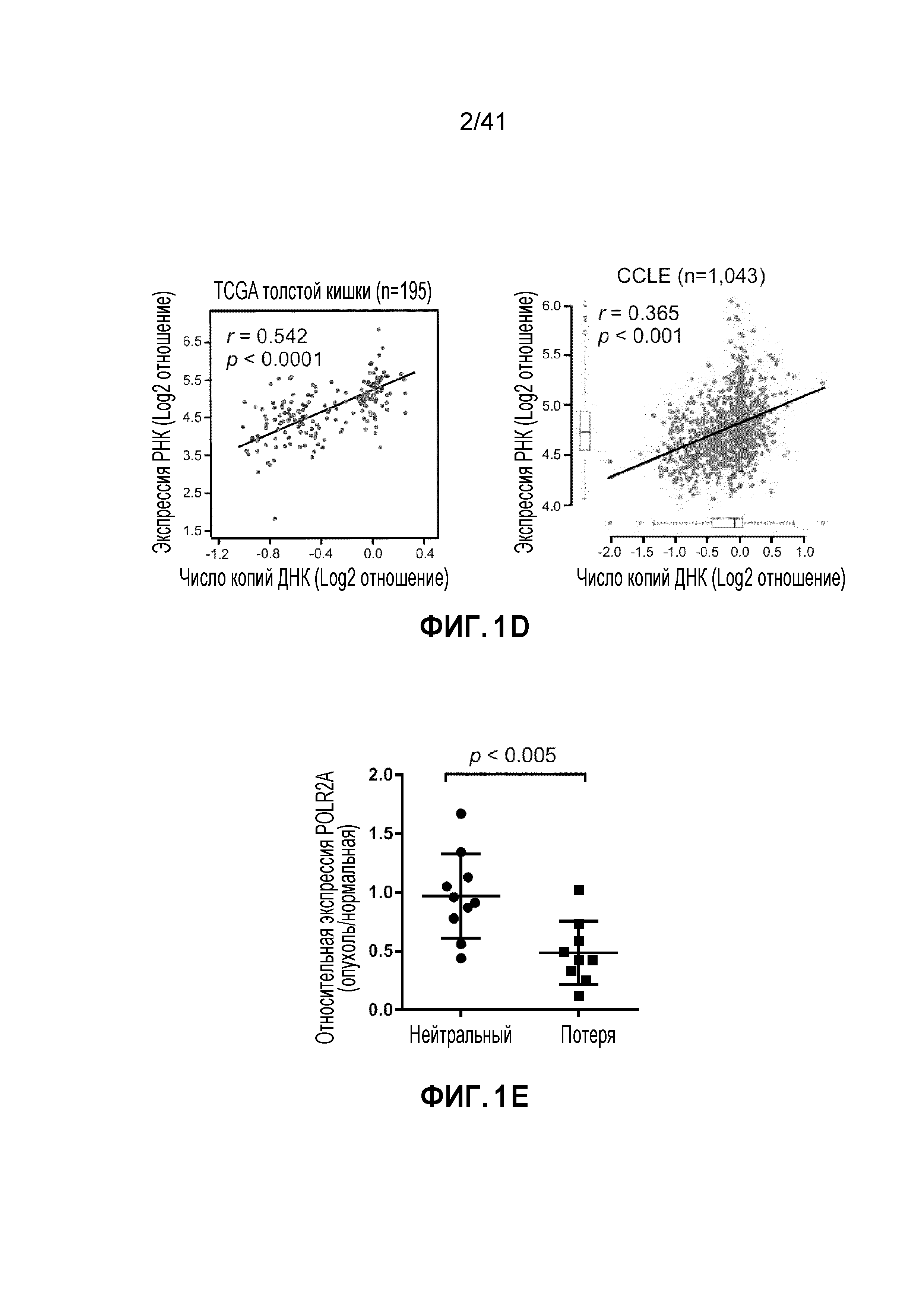
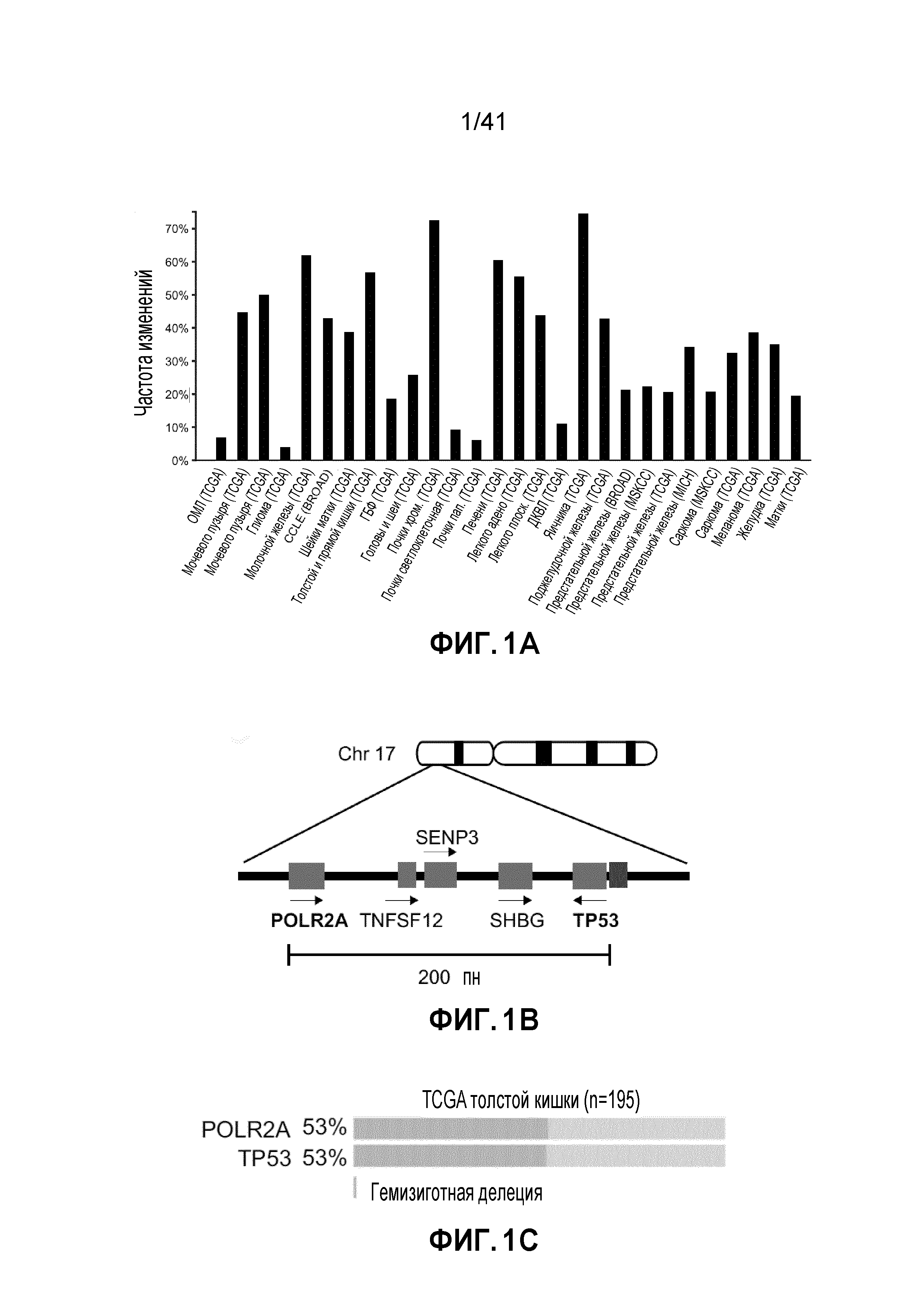
[0027] ФИГ. 1A-H. Экспрессия POLR2A, но не TP53, коррелирует с числом копий гена. (ФИГ. 1A) Анализ базы данных TCGA показывает частоту гемизиготной делеции локуса TP53 в различных злокачественных новообразованиях у человека. (ФИГ. 1B) Схематическая диаграмма генов, смежных с TP53 в геноме человека. (ФИГ. 1C) Сопутствующая делеция POLR2A в опухолях толстой и прямой кишки, имеющих гемизиготную потерю TP53. (ФИГ. 1D) Диаграммы рассеяния числа копий POLR2A в зависимости от экспрессии мРНК для клинических опухолей толстой и прямой кишки в TCGA и линий раковых клеток в CCLE. Показана линейная регрессия и коэффициент корреляции (r) Пирсона. (ФИГ. 1E) Количественное определение уровней белка POLR2A в эквивалентных нормальных образцах и образцах тканей CRC (нейтральные или с гемизиготной потерей POLR2A). (ФИГ. 1F) Вариации числа копий POLR2A и TP53 в линиях человеческих клеток CRC. Левые столбцы - TP53; правые столбцы - POLR2A. (ФИГ. 1G) Относительные уровни экспрессии POLR2A в линиях клеток CRC (нормализованные по HCT116). (ФИГ. 1H) Уровни белка POLR2A, p53 и β-актина в линиях клеток CRC.
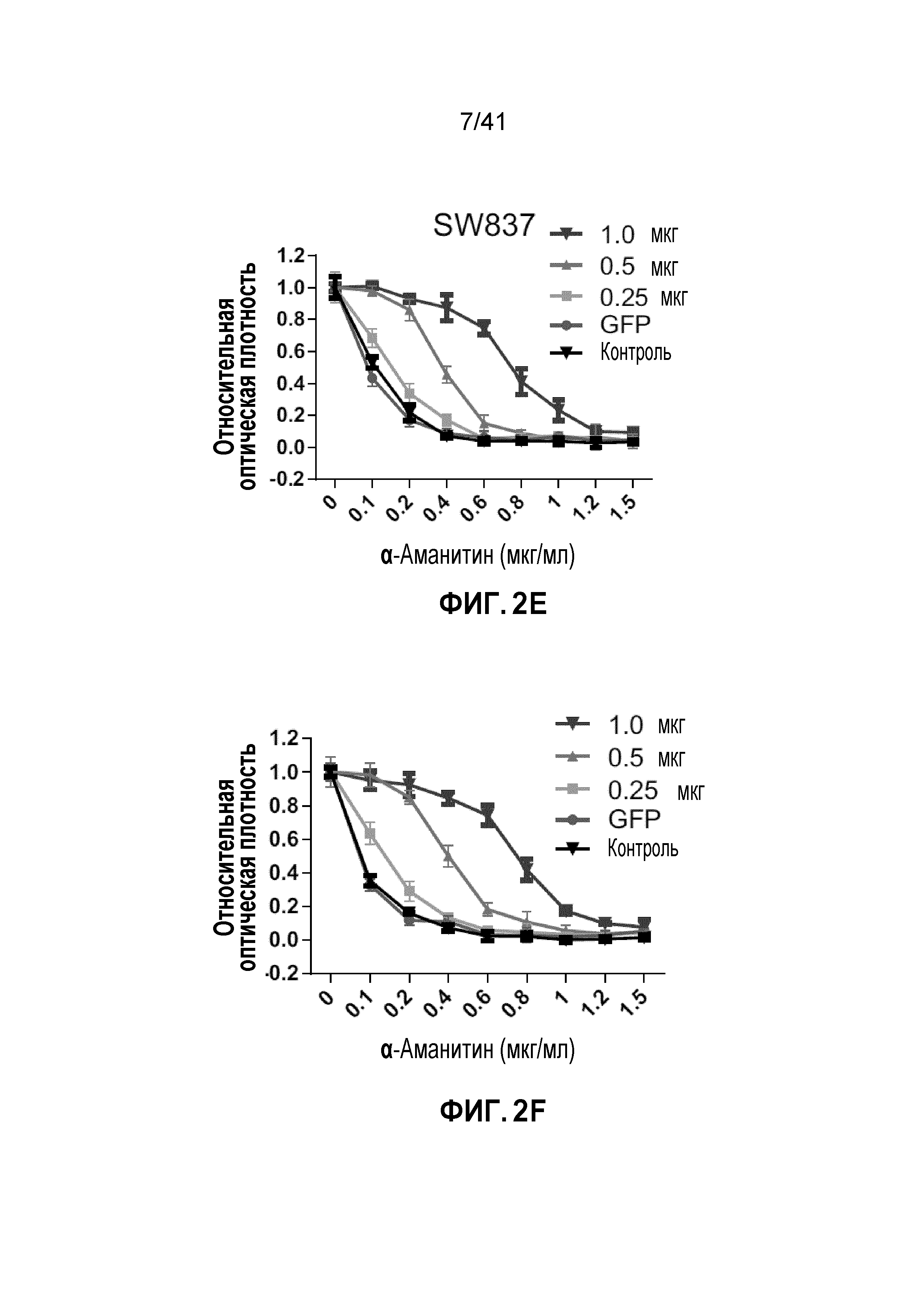
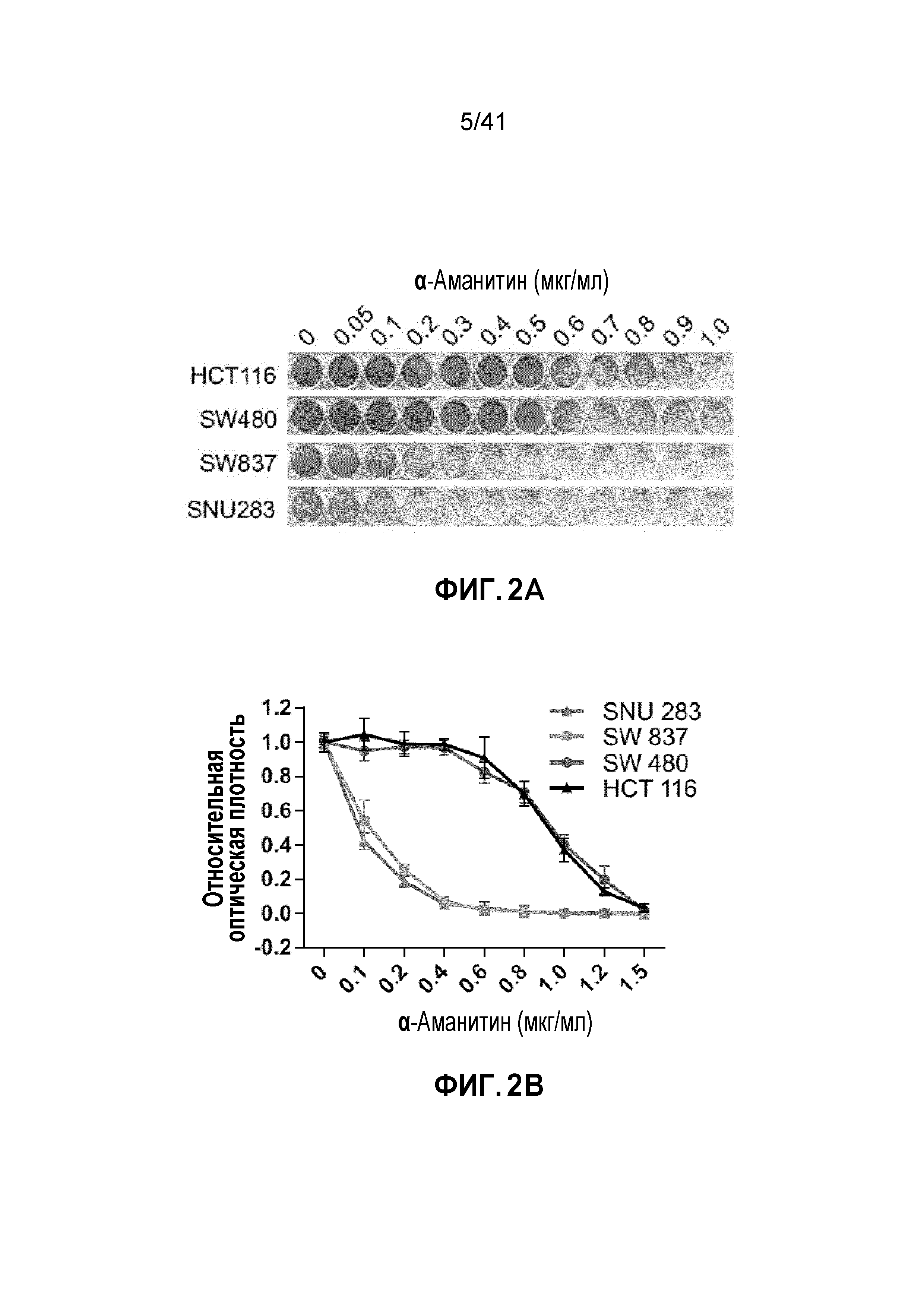
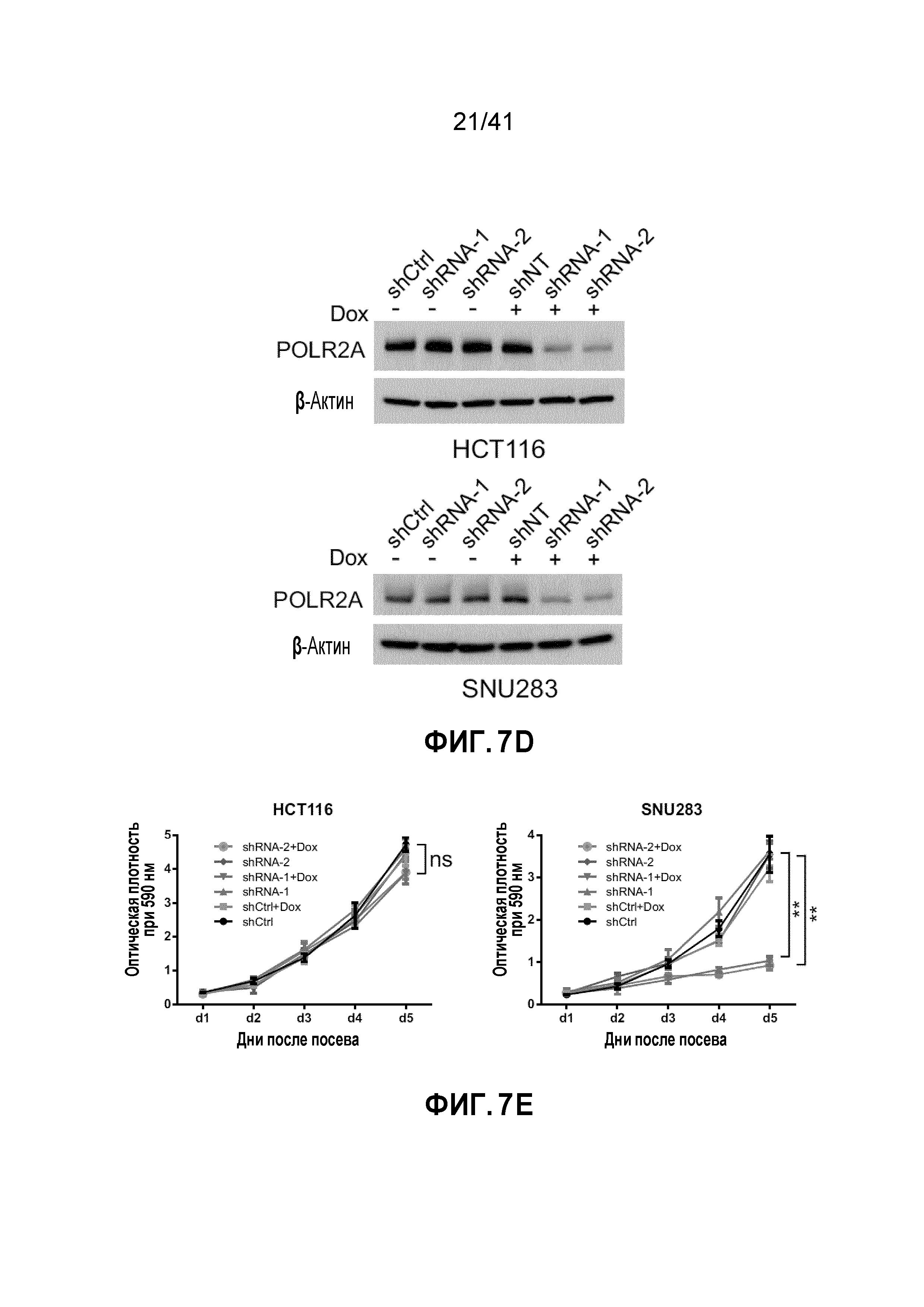
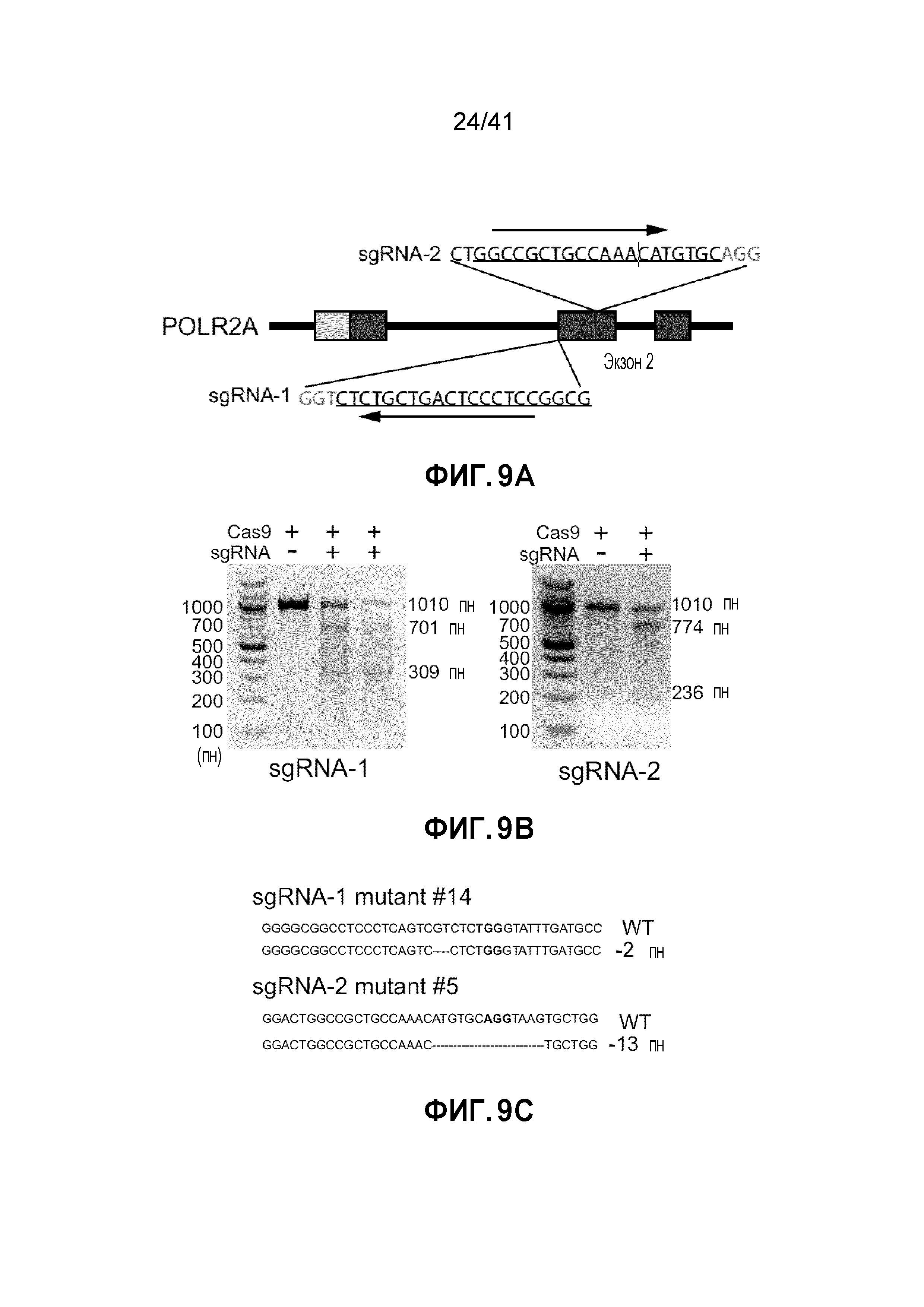
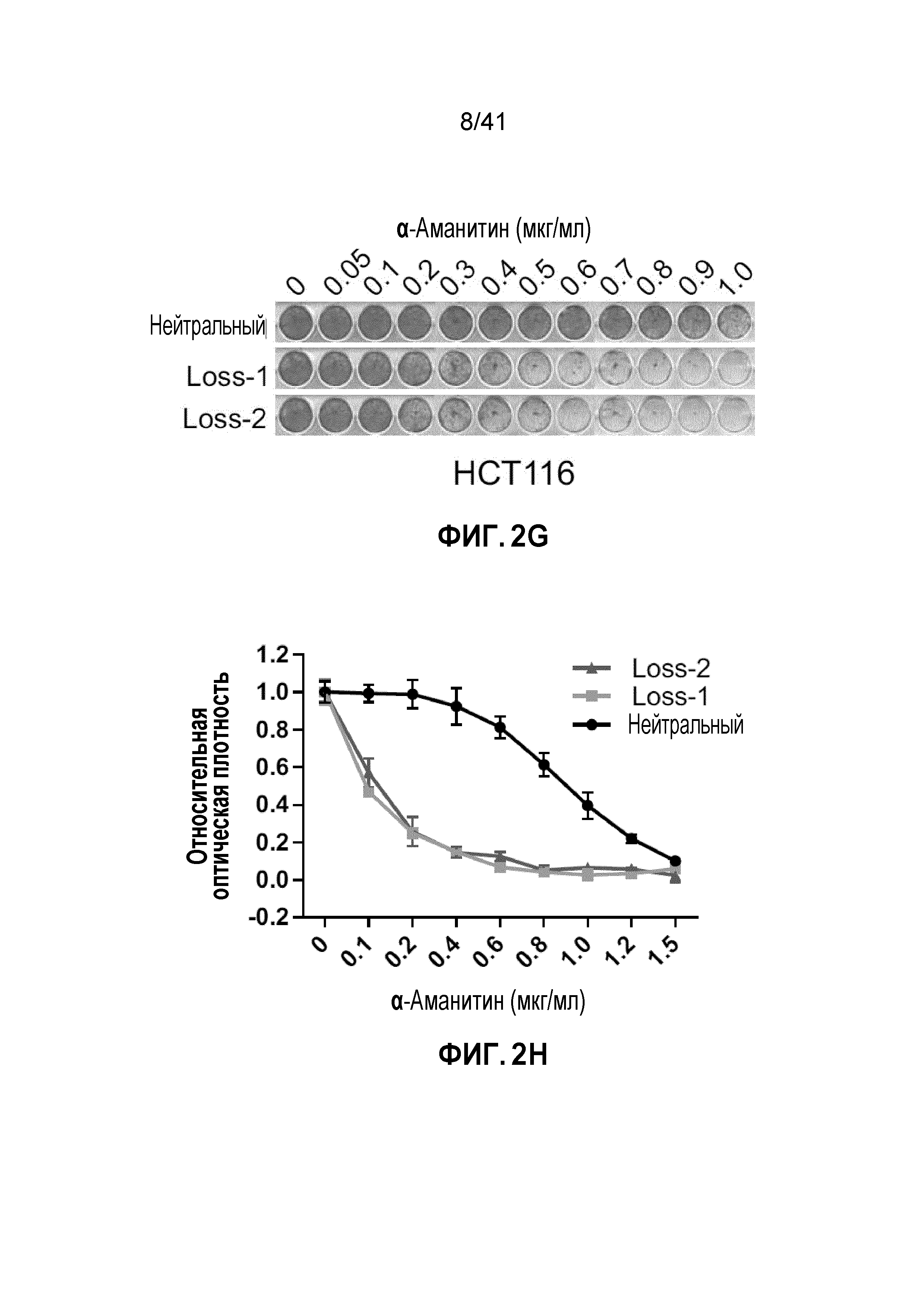
[0028] ФИГ. 2A-J. Клетки POLR2Aloss крайне чувствительны к ингибированию POLR2A. (ФИГ. 2A) Клетки POLR2Aloss (SW837, SNU283) значительно более чувствительны к обработке α-аманитином, чем клетки POLR2Aneutral (HCT116, SW480). Показана окраска клеток кристаллическим фиолетовым. (ФИГ. 2B) Пролиферация клеток POLR2Aneutral и клеток POLR2Aloss с обработкой α-аманитином. (ФИГ. 2C) Dox-индуцированная супрессия POLR2A ингибировала пролиферацию клеток SNU283, но не клеток HCT116. (ФИГ. 2D) Корреляция между экспрессией мРНК POLR2A и пролиферацией клеток HCT116 и SNU283, экспрессирующих Dox-индуцируемые POLR2A мшРНК. Данные представляют собой среднее±SD. Левые столбцы - мРНК POLR2A; правые столбцы - пролиферация. (ФИГ. 2E и 2F) Кривые выживания клеток SUN283 и SW837 в ответ на повышение доз при обработке α-аманитином после трансфекции увеличиваемыми количествами ДНК вектора экспрессии PORL2A. (ФИГ. 2G) Клетки POLR2Aloss HCT116 значительно более чувствительны к обработке α-аманитином, чем исходные клетки HCT116 POLR2Aneutral. Показана окраска клеток кристаллическим фиолетовым. (ФИГ. 2H) Пролиферация клеток POLR2Aneutral и POLR2Aloss HCT116, обработанных α-аманитином. (ФИГ. 2I и 2J) Корреляция между экспрессией мРНК POLR2A и пролиферацией клеток (ФИГ. 2I; левые столбцы - мРНК POLR2A; правые столбцы - пролиферация) или апоптозом (ФИГ. 2J; левые столбцы - shCtrl; средние столбцы - мшРНК-1; правые столбцы - мшРНК-2) в клетках POLR2Aneutral и POLR2Aloss HCT116. Данные представляют собой средние±SD.
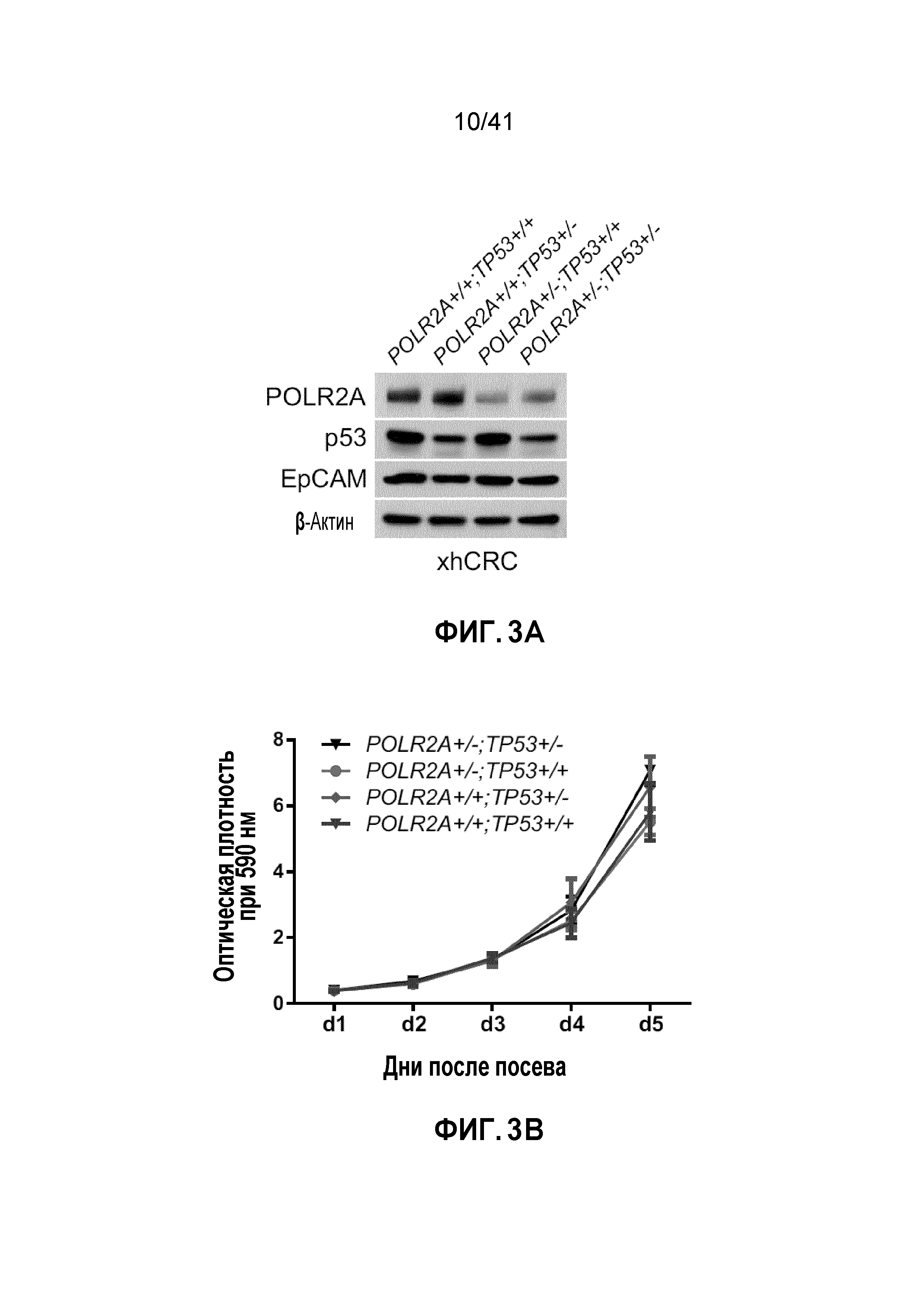
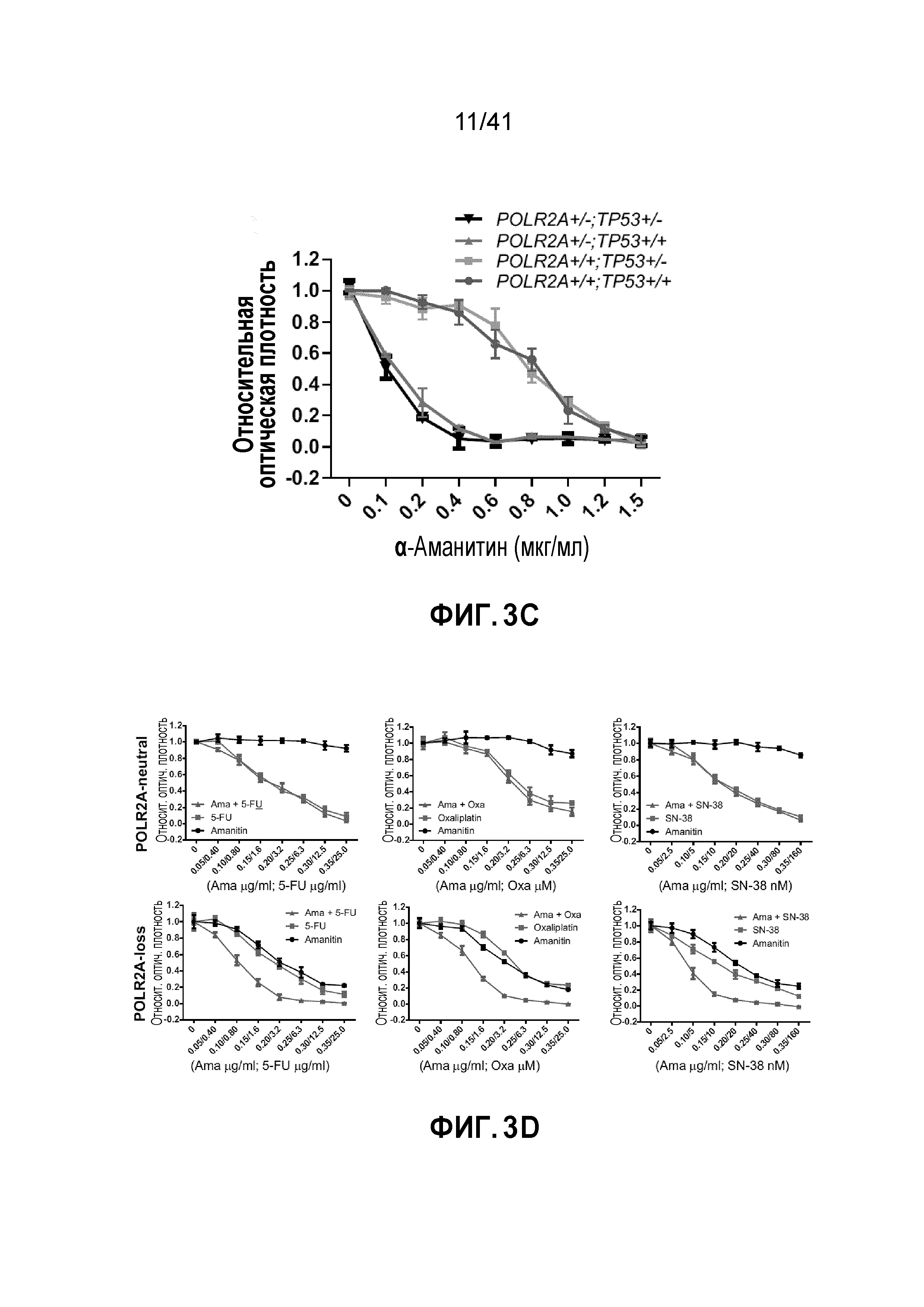
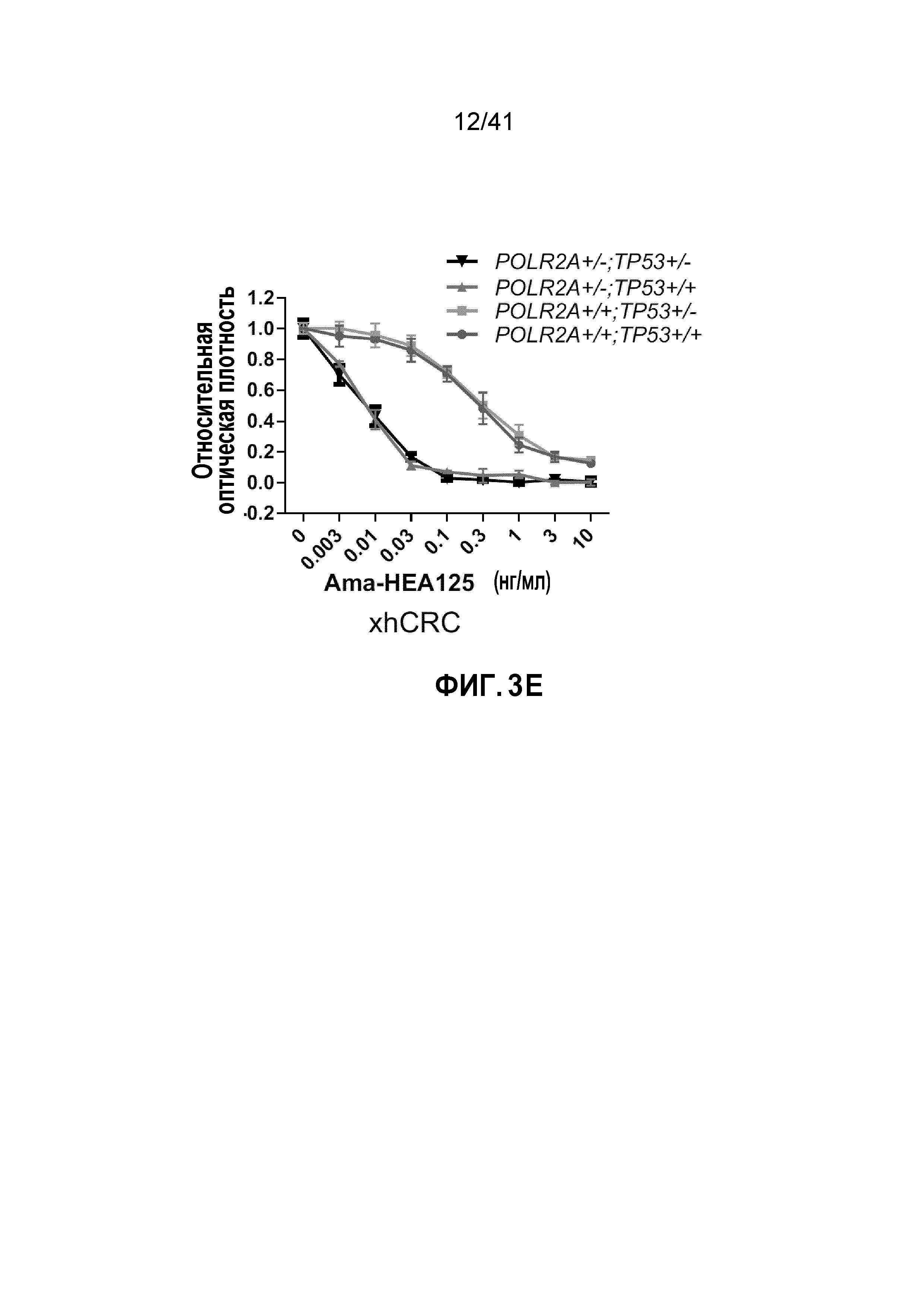
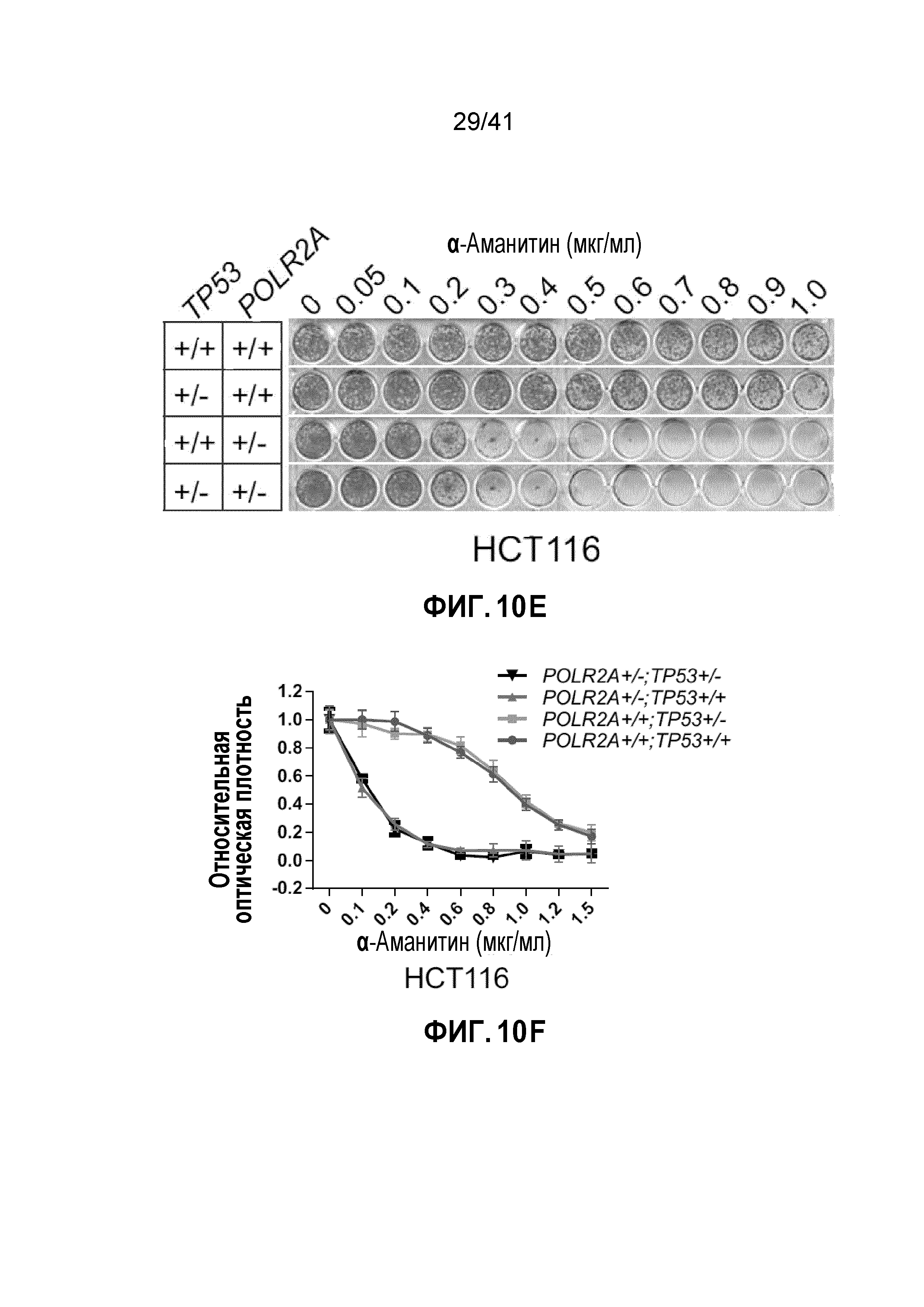
[0029] ФИГ. 3A-E. Чувствительность клеток POLR2Aloss к ингибированию POLR2A не зависит от p53. (ФИГ. 3A) Уровни белков POLR2A, p53, EpCAM и β-актина в группе изогенных линий клеток человеческого первичного рака толстой и прямой кишки xhCRC. (ФИГ. 3B) Кривая роста клеток xhCRC POLR2Aneutral и POLR2Aloss. (ФИГ. 3C) Пролиферация клеток xhCRC POLR2Aneutral и POLR2Aloss, обработанных α-аманитином. (ФИГ. 3D) Чувствительность клеток xhCRC POLR2Aneutral и POLR2Aloss к обработке 5-ФУ, оксалиплатином (Oxa) или SN-38 в комбинации с обработкой α-аманитином или без. (ФИГ. 3E) Пролиферация клеток xhCRC POLR2Aneutral и POLR2Aloss, обработанных конъюгатом антитела-лекарственного средства, ama-HEA125 (против EpCAM), в различных концентрациях.
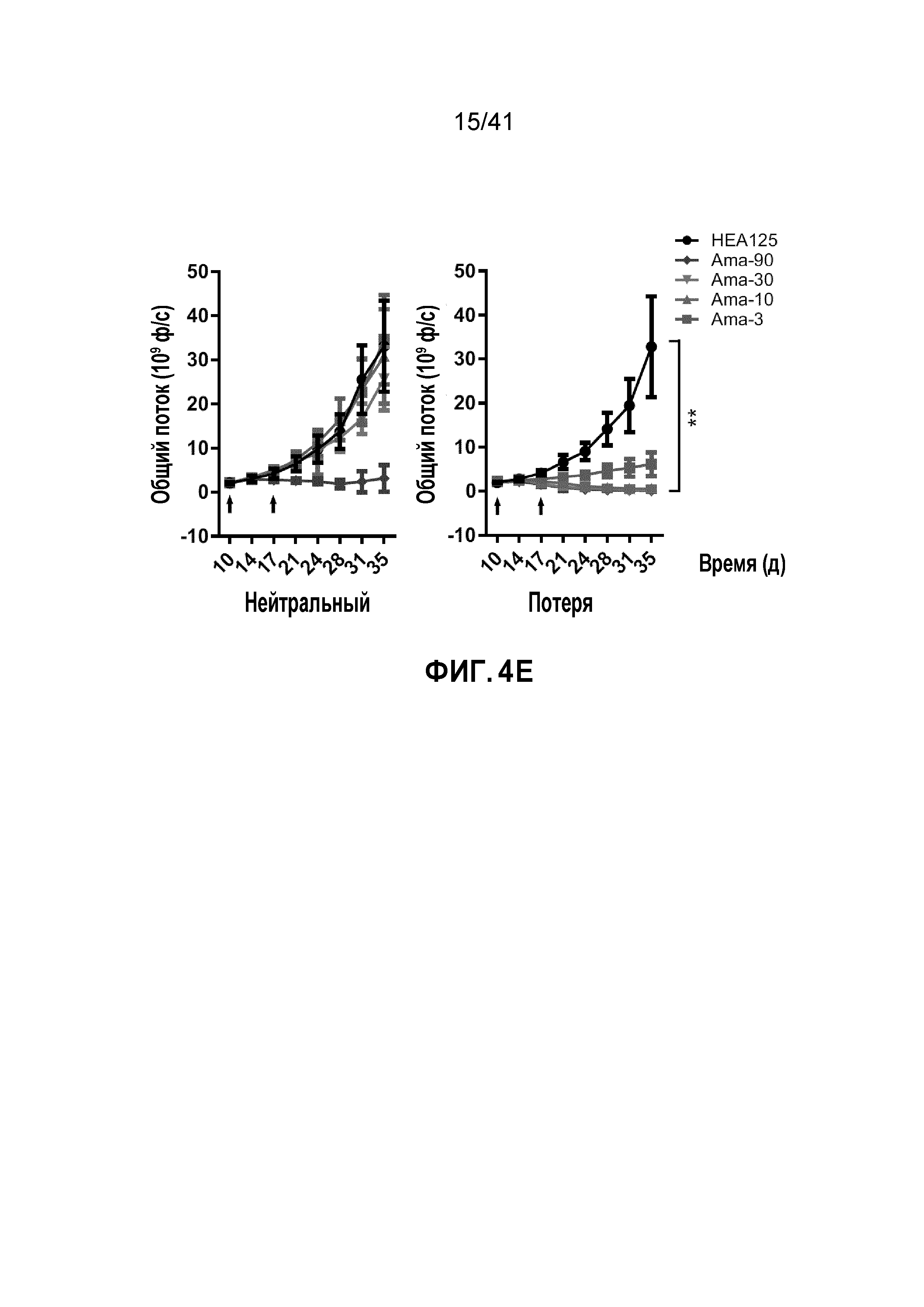
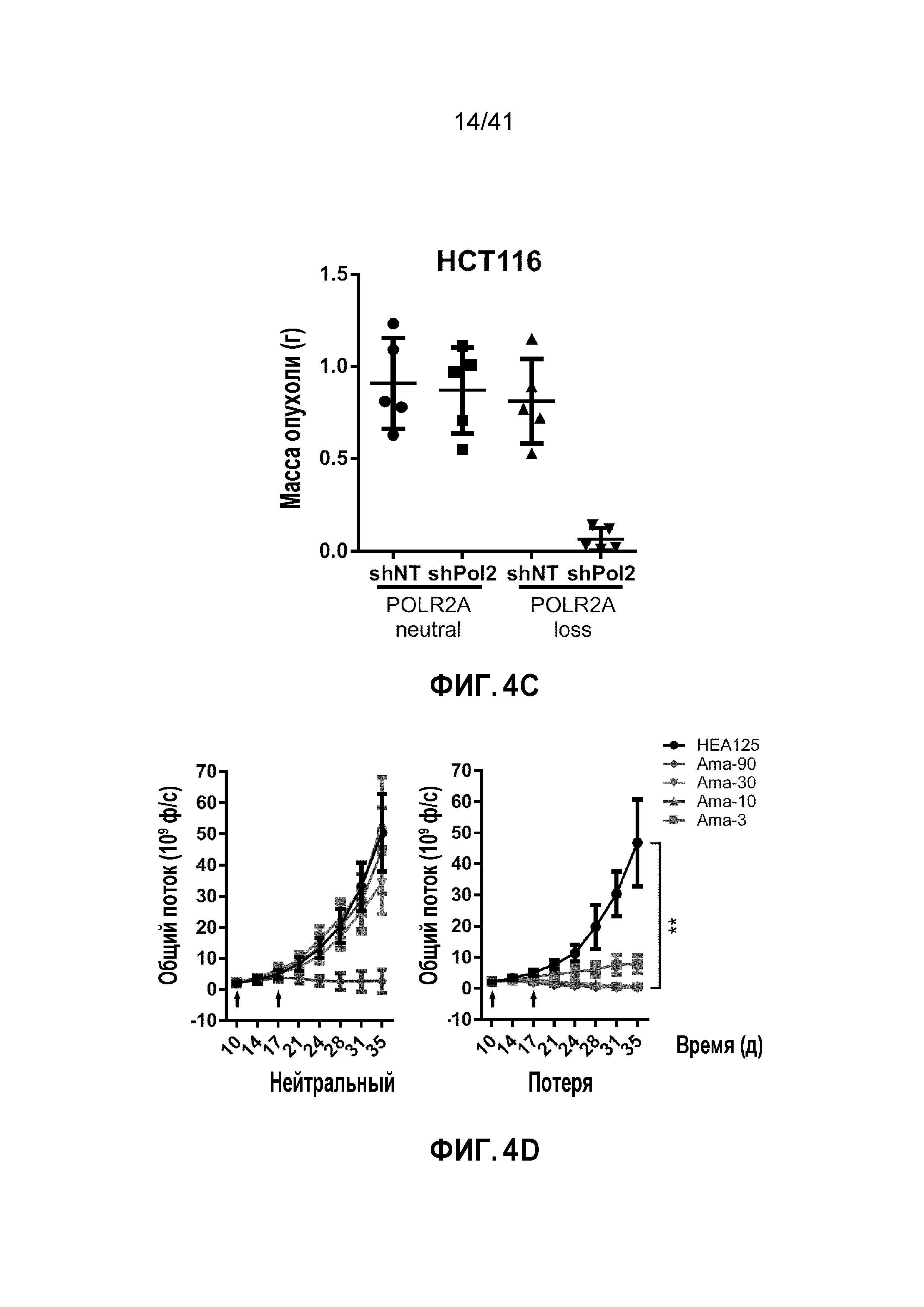
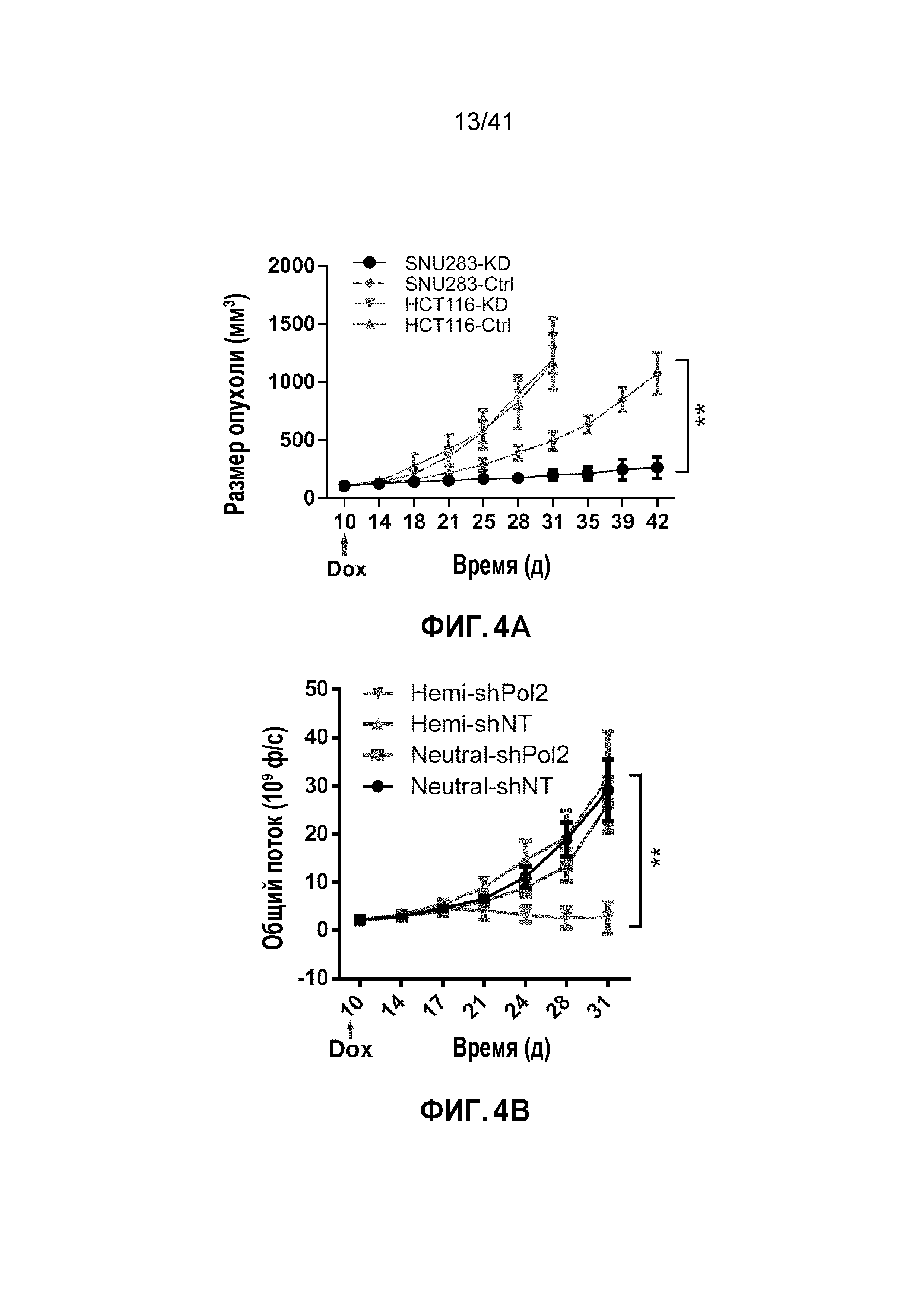
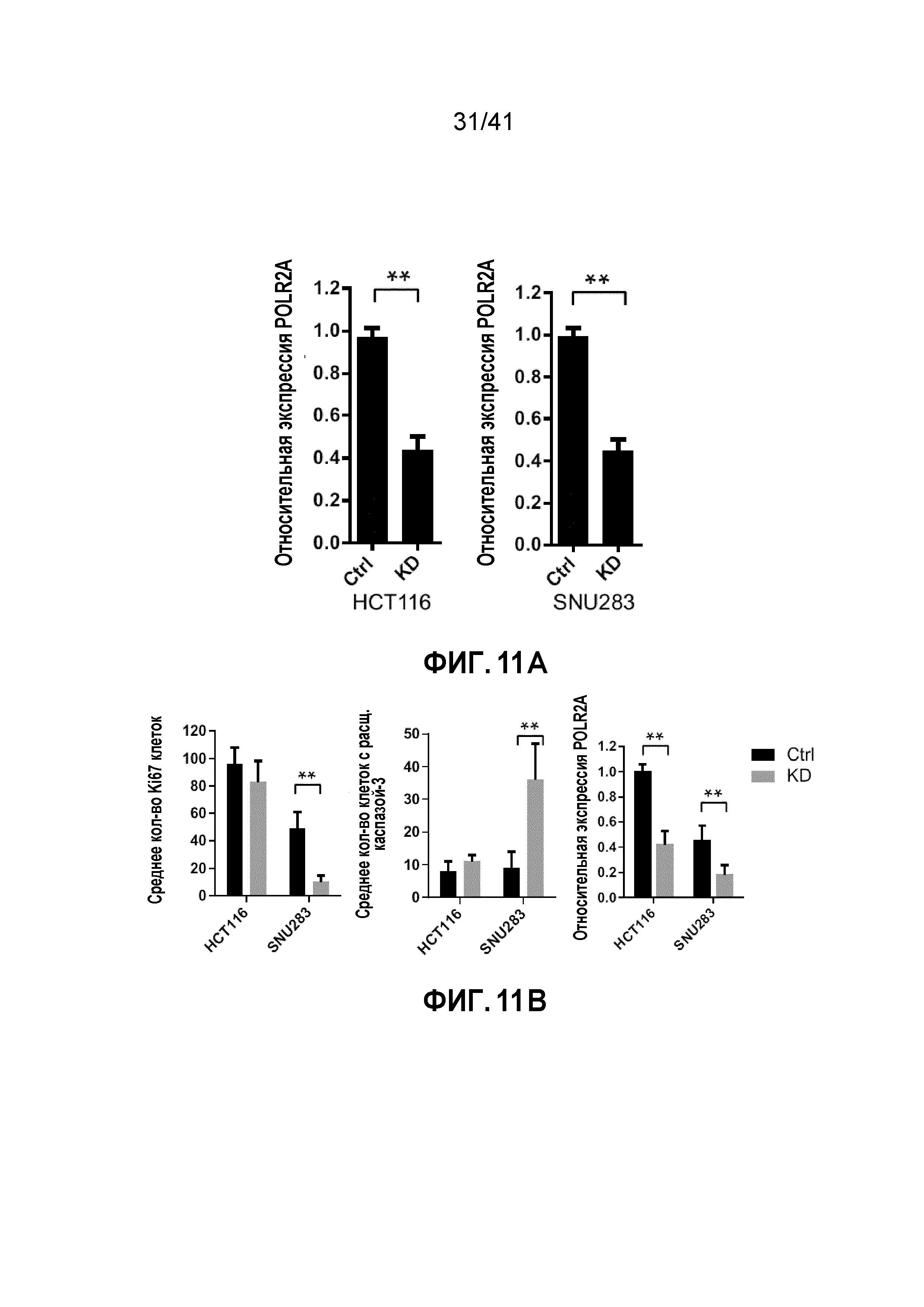
[0030] ФИГ. 4A-E. Супрессия POLR2A селективно ингибирует рост опухоли POLR2Aloss. (ФИГ. 4A) Кривые роста ксенотрансплантатных опухолей, полученных из подкожно имплантированных клеток HCT116 (1×106 клеток) и SNU283 (2×106 клеток). Обе линии клеток экспрессируют контрольные или Dox-индуцируемые POLR2A мшРНК. После первоначального разрастания опухолей (100 мм3), мышей обрабатывали 1 мкг мл-1 Dox в питьевой воде. n=5 мышей в группе. (ФИГ. 4B и 4C) Кривые роста (ФИГ. 4B) ксенотрансплантатных опухолей, полученных из ортотопически имплантированных POLR2Aneutral и POLR2Aloss клеток HCT116 (1×106 имплантированных клеток), экспрессирующих Dox-индуцируемые контрольные или POLR2A мшРНК. После первоначального разрастания опухолей, мышей обрабатывали 1 мкг мл-1 Dox в питьевой воде. Массу опухолей (ФИГ. 4C) измеряли (n=5 мышей в группе). **p<0,01. (ФИГ. 4D и 4E) Кривые роста ксенотрансплантированных опухолей, полученных из ортотопически имплантированных POLR2Aneutral и POLR2Aloss клеток HCT116 (ФИГ. 4D; 1,0×106 введенных клеток) или xhCRC (ФИГ. 4E; 0,5×106 введенных клеток), в которые делали двойные внутрибрюшинные инъекции антитела против EpCAM (3,6 мг кг-1) или конъюгата антитела-лекарственного средства ama-HEA125 (3, 10, 30 и 90 мкг кг-1, что соответствует 0,12, 0,4, 1,2 и 3,6 мг IgG кг-1). n=10 мышей в группе.
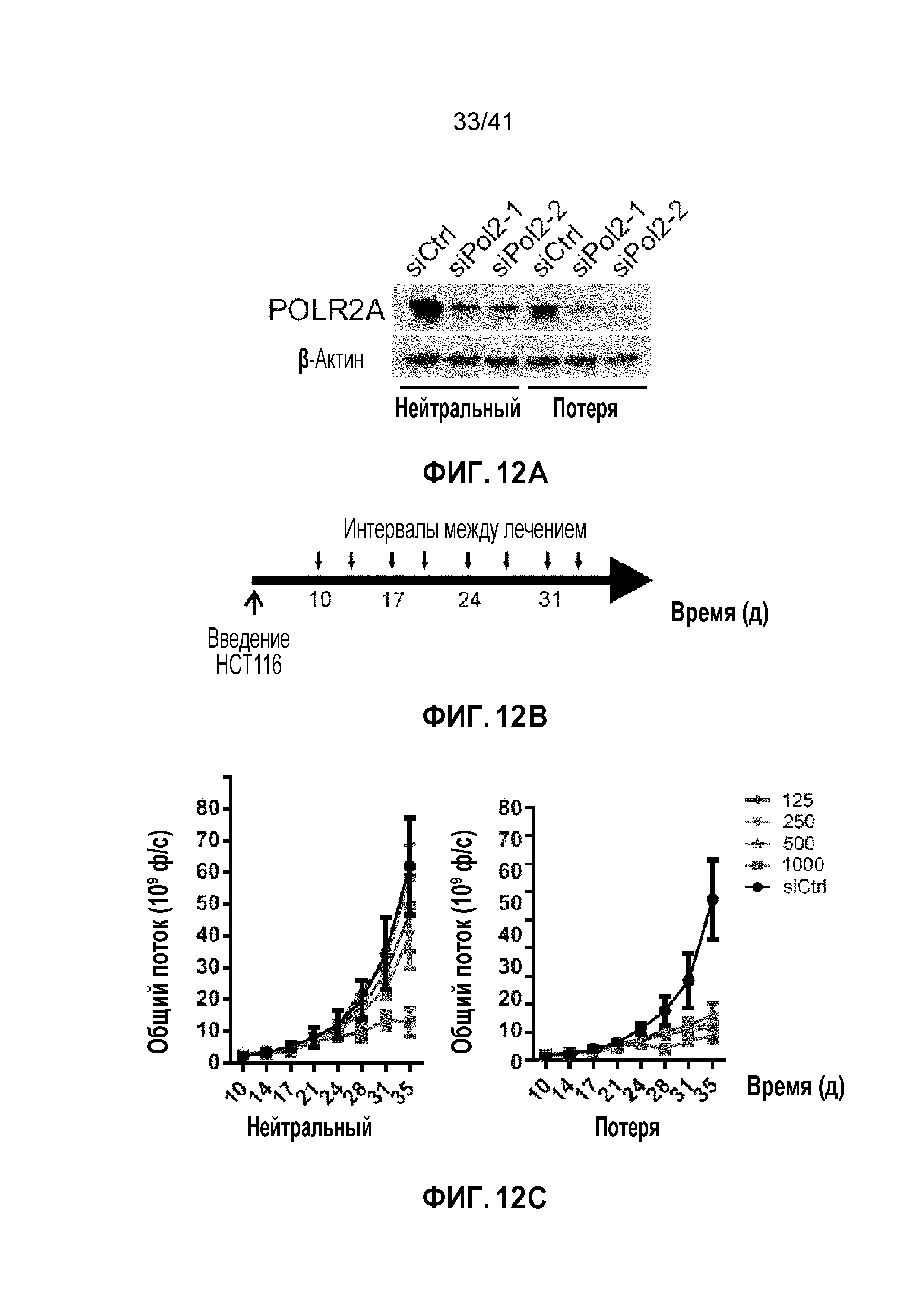
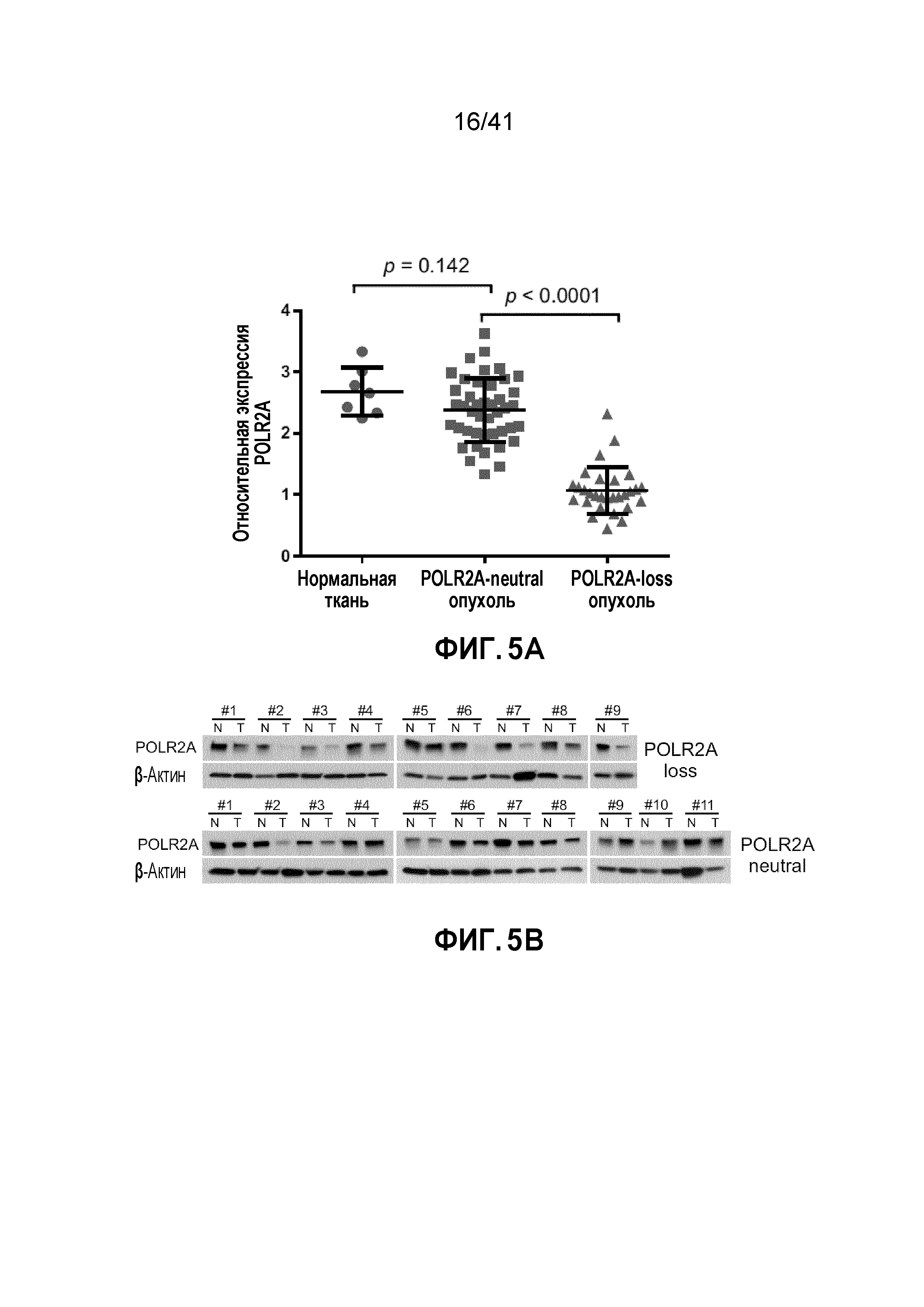
[0031] ФИГ. 5A-B. Экспрессия гена POLR2A коррелирует с числом его копий в человеческих опухолях толстой кишки. Двухцветный анализ FISH проводили при использовании зонда к центромере хромосомы 17 и локус-специфичного зонда к POLR2A на микроматрице тканей толстой кишки человека. Определяли гемизиготную потерю гена POLR2A, и результаты показаны в Таблице 2. (ФИГ. 5A) Количественный анализ экспрессии POLR2A в образцах нормальной толстой кишки человека, образцах POLR2A-neutral (нейстральный) или -loss (потеря POLR2A) опухолевой ткани. Планки погрешности, s.d. (ФИГ. 5B) Уровни белка POLR2A и β-актина в эквивалентных образцах нормальной и CRC ткани.
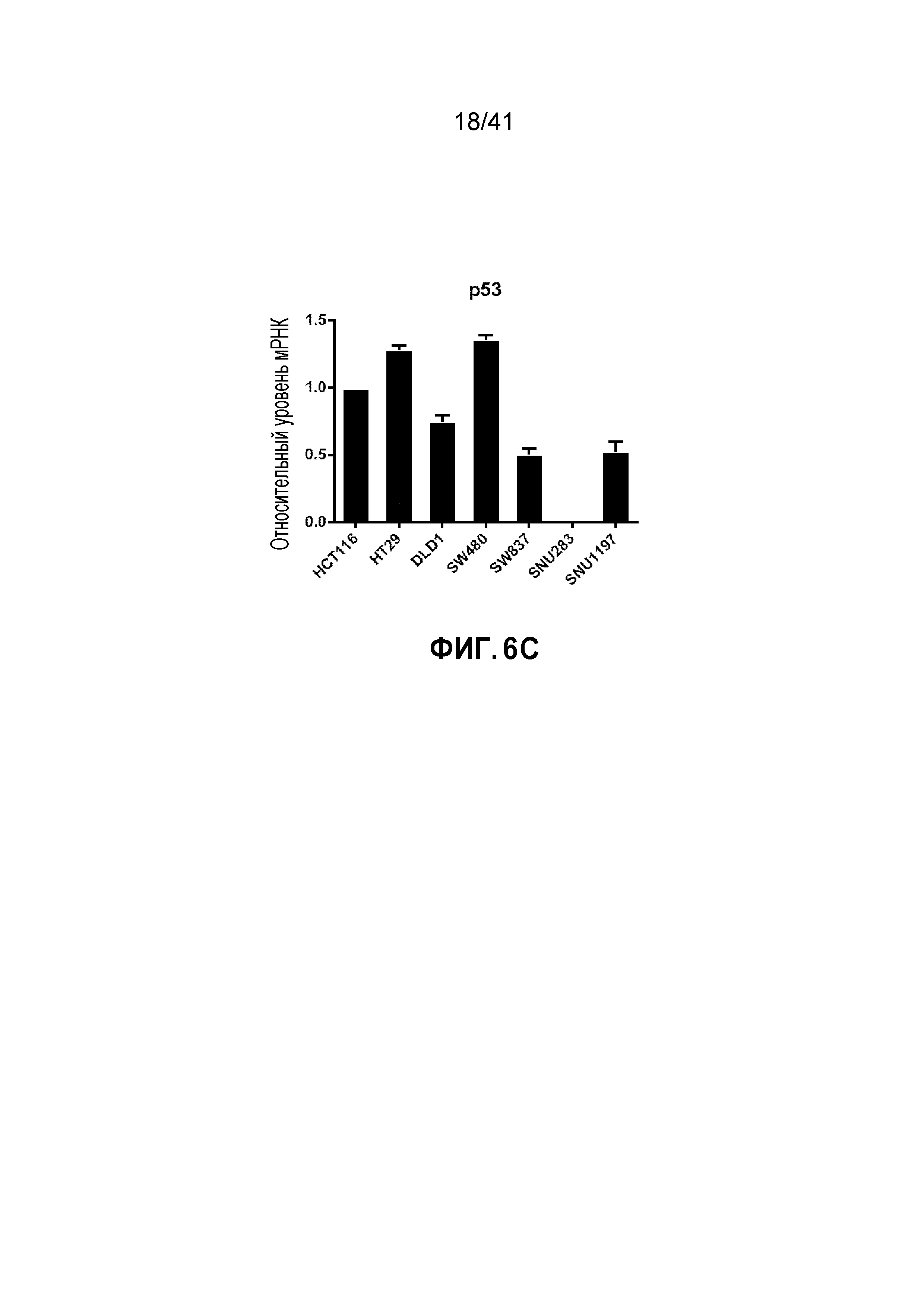
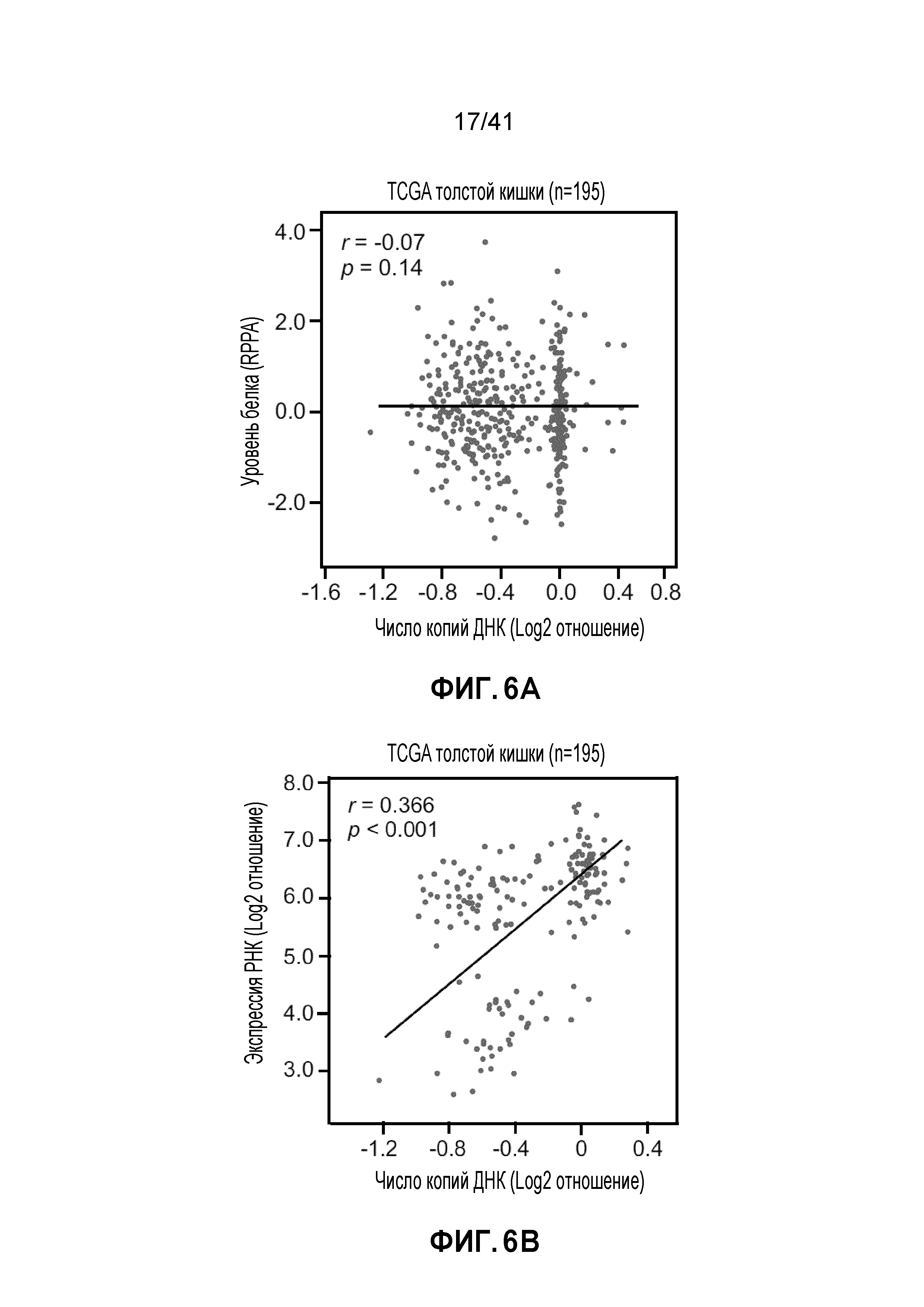
[0032] ФИГ. 6A-C. Экспрессия гена TP53 не связана с числом его копий. (ФИГ. 6А и 6B) Диаграммы рассеяния числа копий TP53 в зависимости от экспрессии белка (ФИГ. 6A) или экспрессии мРНК (ФИГ. 6B) в опухолях толстой и прямой кишки в базе данных TCGA. Показан коэффициент корреляции (r) Пирсона и p-значение. (Фиг. 6C) Относительная экспрессия мРНК TP53 в линиях клеток рака толстой и прямой кишки (нормализованная по экспрессии в линии клеток HCT116). Данные представляют собой средние и s.d. из трех независимых экспериментов.
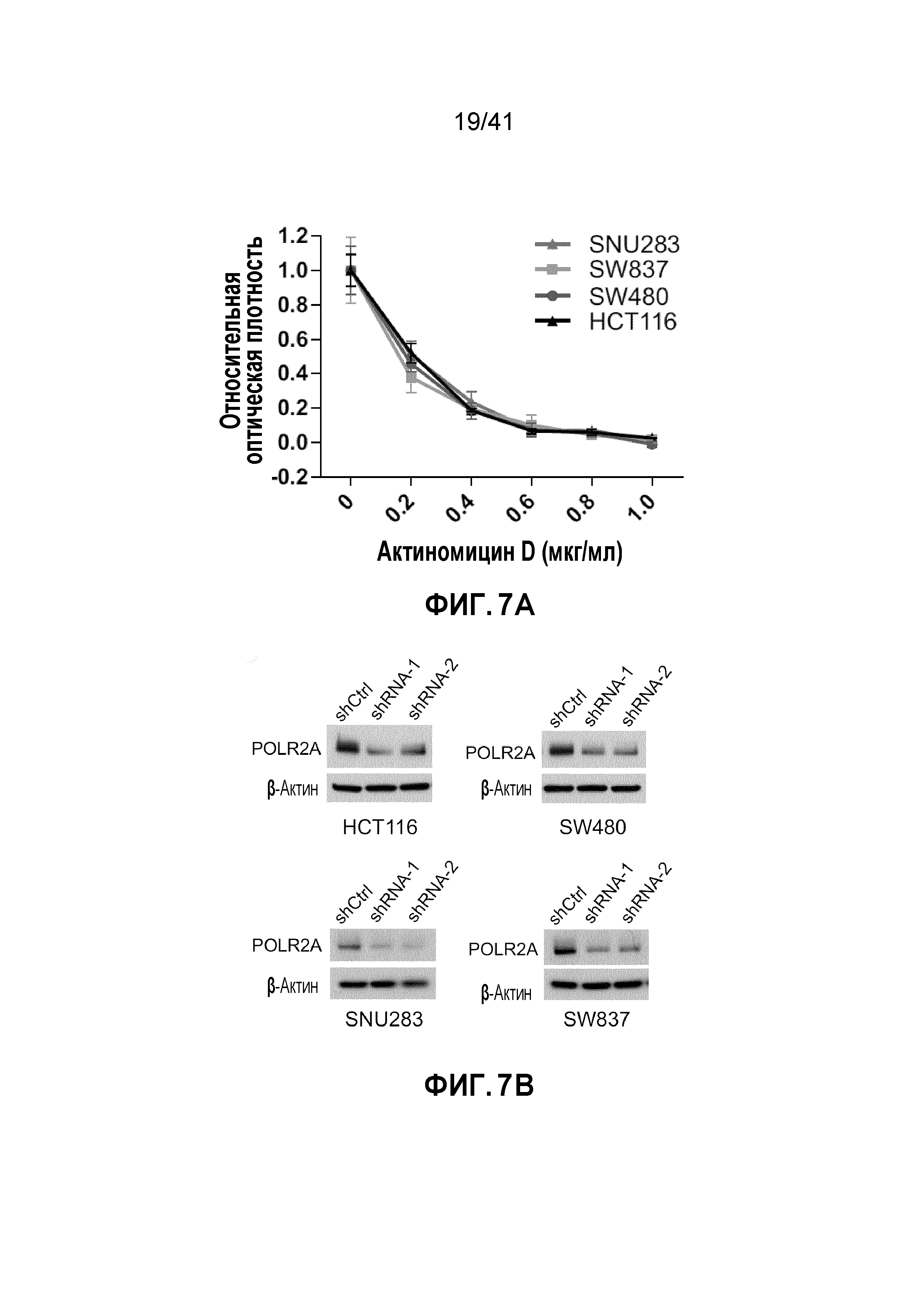
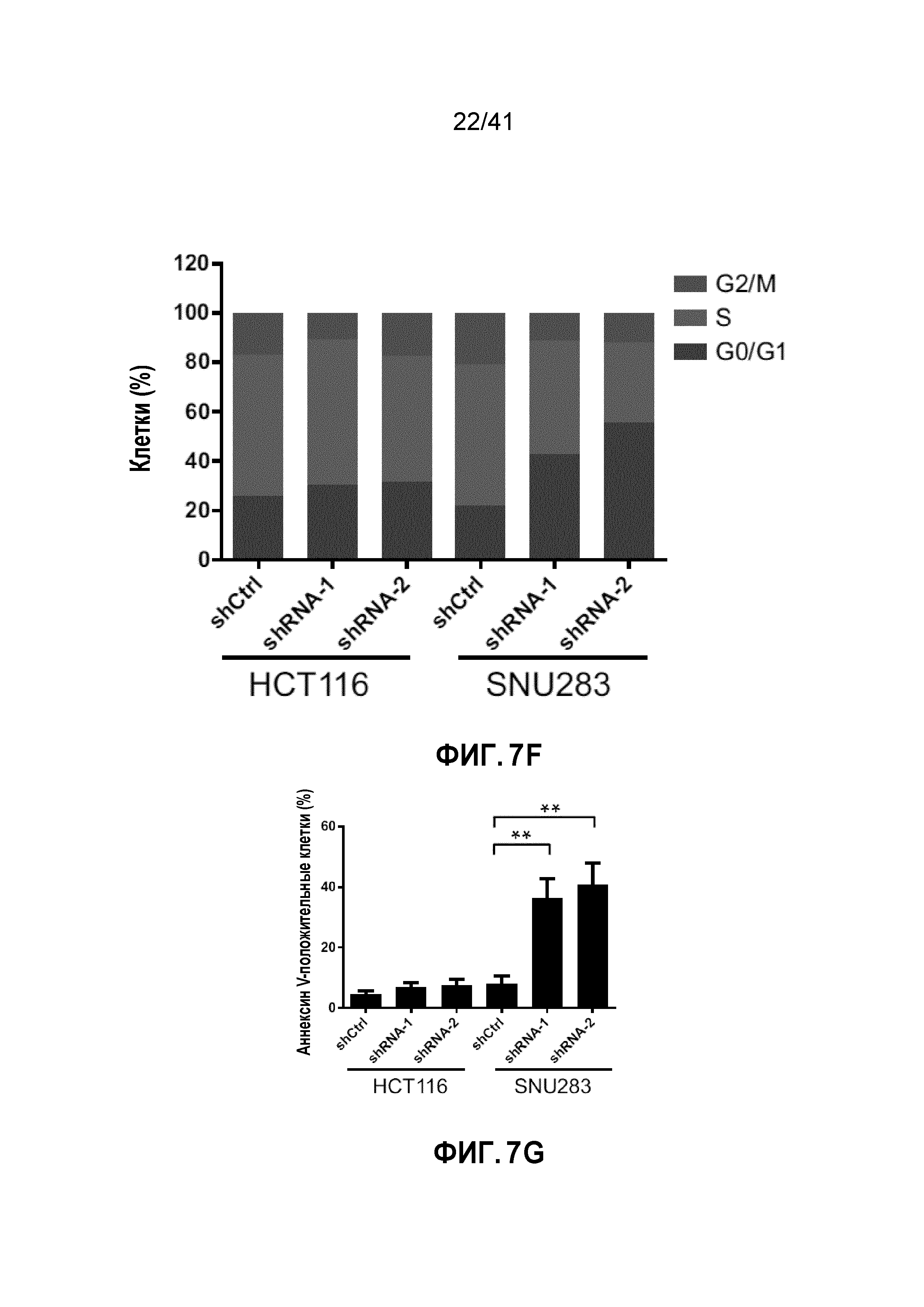
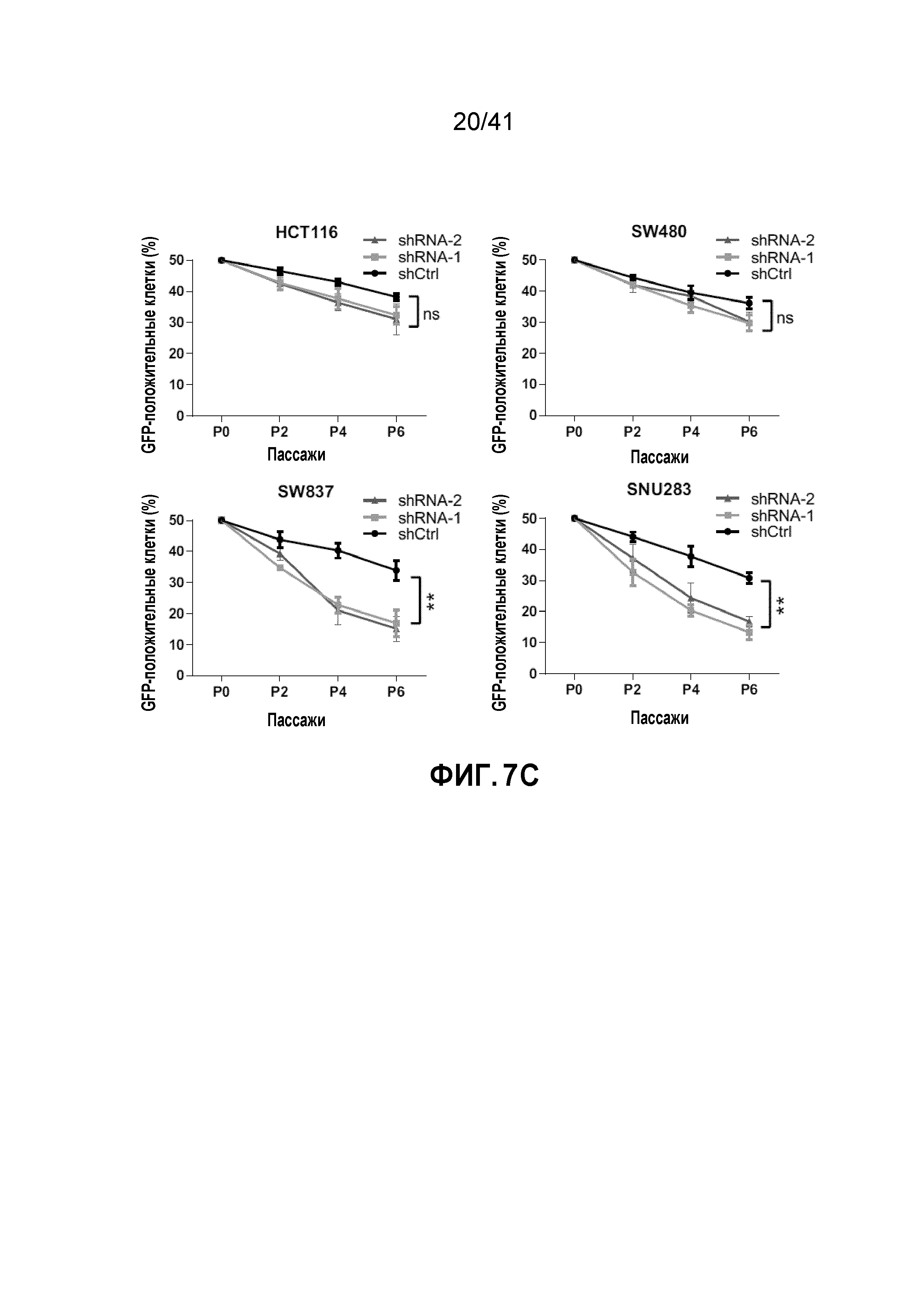
[0033] ФИГ. 7A-G. Клетки POLR2Aloss крайне чувствительны к ингибированию POLR2A. (ФИГ. 7A) Пролиферация клеток POLR2Aneutral и POLR2Aloss, обработанных актиномицином D. (ФИГ. 7B) Эффективность нокдауна POLR2A-специфичными мшРНК в клетках HCT116, SW480, SW837 и SNU283. (ФИГ. 7C) Влияние нокдауна POLR2A на пролиферацию четырех линий клеток рака толстой и прямой кишки. Клетки, экспрессирующие GFP и контрольные или POLR2A-специфичные мшРНК, сортировали и смешивали с контрольными GFP-отрицательными клетками (1:1) и подсчитывали количество GFP-положительных клеток при 2, 4 и 6 пассаже. **p<0,01, ns: незначимое. (ФИГ. 7D) Уровни белка POLR2A и β-актина в клетках HCT116 и SNU283, экспрессирующих Dox-индуцируемые POLR2A мшРНК (1,0 мкг мл-1 Dox). (ФИГ. 7E) Пролиферация клеток HCT116 и SNU283, экспрессирующих Dox-индуцируемые POLR2A мшРНК в присутствии 300 нг мл-1 Dox. **p<0,01. (ФИГ. 7F и 7G) Профили клеточного цикла (ФИГ. 7F; верхняя часть каждого столбца соответствует G2/M; средняя часть каждого столбца - S; нижняя часть каждого столбца - G0/G1) и апоптоз (ФИГ. 7G) контрольных или POLR2A мшРНК-экспрессирующих клеток HCT116 и SNU283. **p<0,01. Данные представляют собой средние и s.d. из трех независимых экспериментов.
[0034] ФИГ. 8A-B. Эктопическая экспрессия POLR2A восстанавливает устойчивость клеток POLR2Aloss к обработке α-аманитином. (ФИГ. 8A) Уровни белка POLR2A и β-актина в клетках SNU283 и SW837, экспрессирующих возрастающие количества экзогенного POLR2A. (ФИГ. 8B) Окраска кристаллическим фиолетовым клеток SNU283 и SW837, обработанных повышаемыми дозами α-аманитина после трансфекции увеличиваемыми количествами ДНК вектора экспрессии POLR2A.
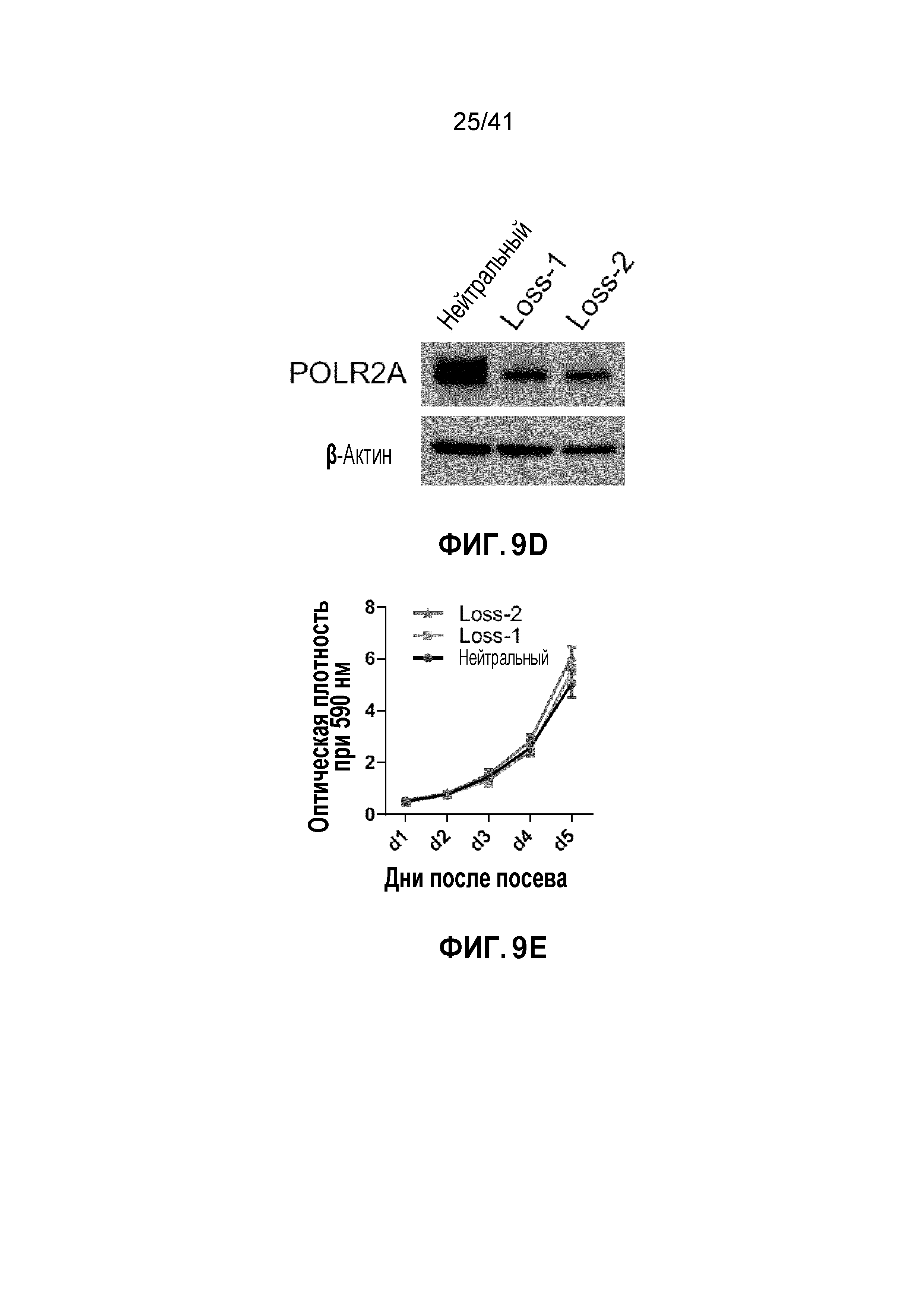
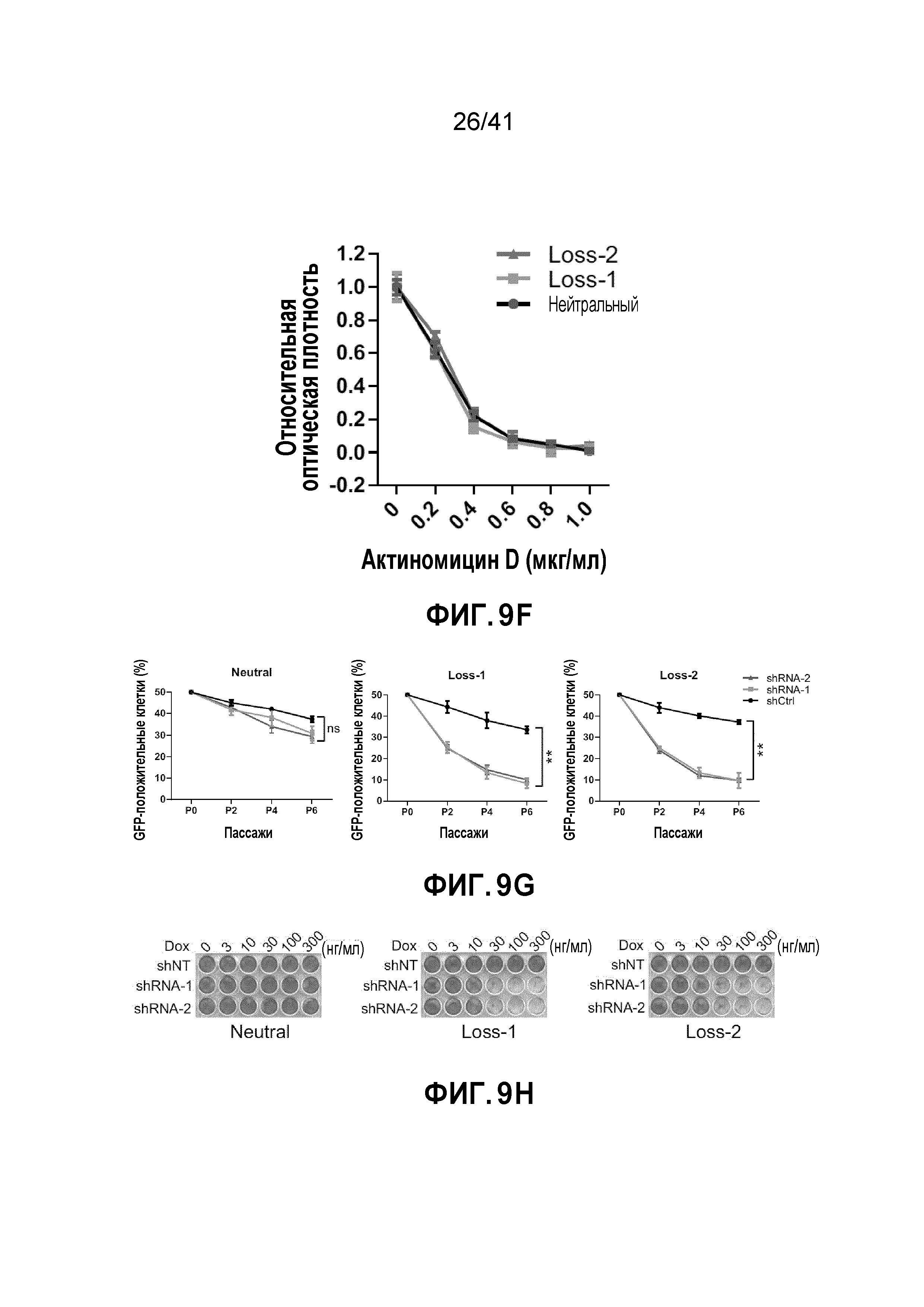
[0035] ФИГ. 9A-H. Моноаллельный нокаут POLR2A сенсибилизирует клетки HCT116 к ингибированию POLR2A. (ФИГ. 9A) Схематическая иллюстрация участков-мишеней Cas9/sgРНК в гене POLR2A. Показаны две sgРНК-направляющие последовательности (стрелка указывает направленность; последовательности представлены как SEQ ID NO: 25-26) и последовательности протоспейсер-смежного мотива (PAM) - три последних нуклеотида в каждой последовательности. (ФИГ. 9B) Эффективность Cas9-опосредованного расщепления POLR2A в клетках HCT116, измеренная с помощью теста с нуклеазой Surveyor. (ФИГ. 9C) Последовательности мутантных аллелей POLR2A в клетках колоний 14 и 5 (последовательности представлены как SEQ ID NO: 27-30). (ФИГ. 9D) Уровни белка POLR2A и β-актина в POLR2Aneutral и POLR2Aloss клетках HCT116. (ФИГ. 9E) Кривые роста POLR2Aneutral и POLR2Aloss клеток HCT116. (ФИГ. 9F) Относительная пролиферация клеток POLR2Aneutral и POLR2Aloss, обработанных актиномицином D. (ФИГ. 9G) Влияние нокдауна POLR2A на POLR2Aneutral и POLR2Aloss клетки HCT116. Эксперименты проводили, как описано на ФИГ. 7C. **p<0,01, ns: незначимое. (ФИГ. 9H) Dox-индуцированная частичная супрессия POLR2A ингибировала рост POLR2Aloss клеток HCT116, но не исходных POLR2Aneutral клеток HCT116. Данные представляют собой средние и s.d. из трех независимых экспериментов.
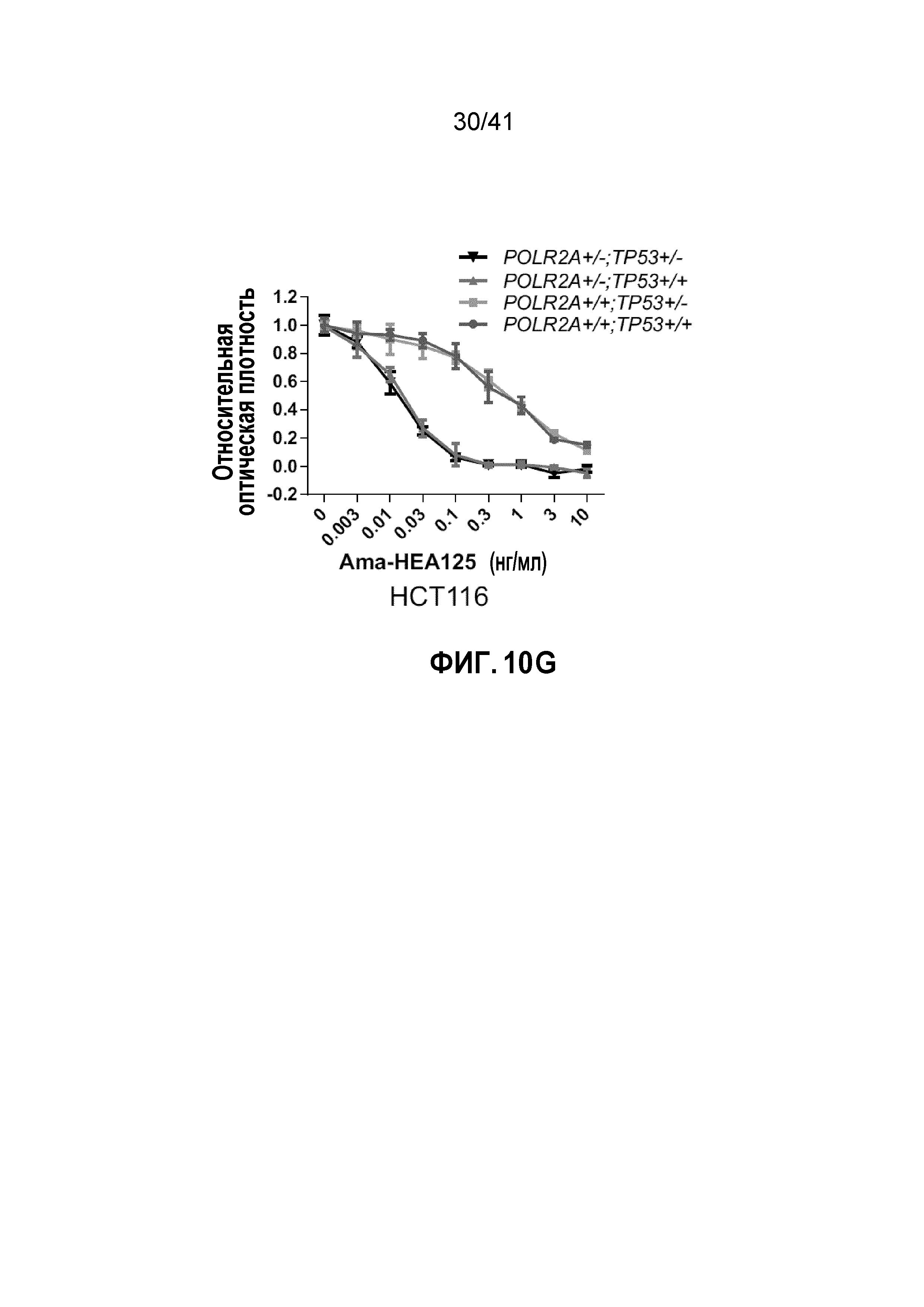
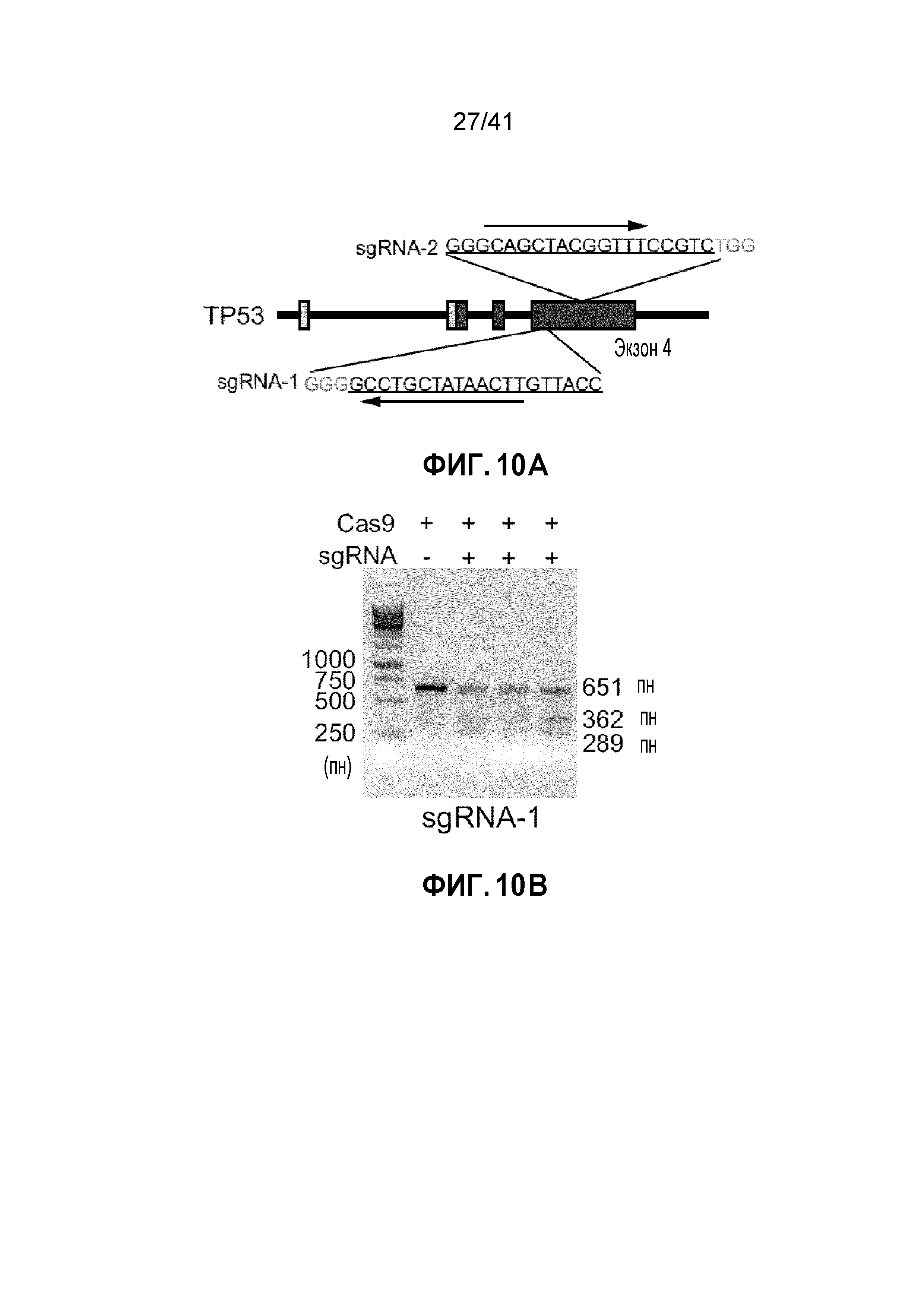
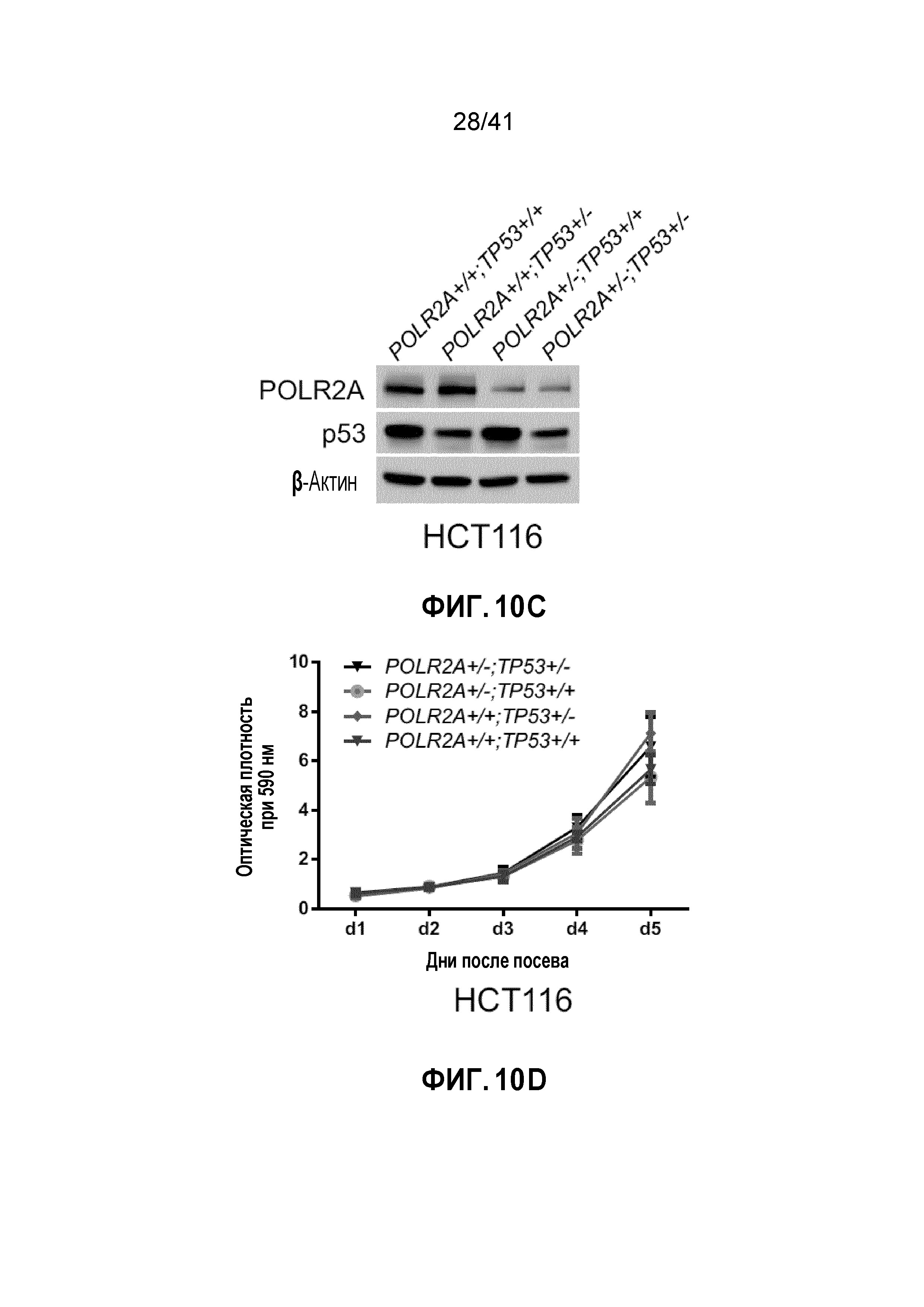
[0036] ФИГ. 10A-G. Чувствительность клеток POLR2Aloss к ингибированию POLR2A не зависит от p53. (ФИГ. 10A) Схематическая иллюстрация участков-мишеней Cas9/sgРНК в гене TP53. Показаны две sgРНК-направляющие последовательности (стрелка указывает направленность; последовательности представлены как SEQ ID NO: 31-32) и последовательности PAM - три последних нуклеотида в каждой последовательности. (ФИГ. 10B) Эффективность Cas9-опосредованного расщепления TP53 в клетках HCT116, измеренная с помощью теста с нуклеазой Surveyor. (ФИГ. 10C) Уровни белка POLR2A, p53 и β-актина в группе изогенных клеток HCT116. (ФИГ. 10D) Кривые роста POLR2Aneutral и POLR2Aloss клеток HCT116. (ФИГ. 10E и 10F) Изображения окраски кристаллическим (ФИГ. 10E) и кривые выживания (ФИГ. 10F) POLR2Aneutral и POLR2Aloss клеток HCT116 после обработки α-аманитином. (ФИГ. 10G) Кривые выживания POLR2Aneutral и POLR2Aloss клеток HCT116 в ответ на обработку ama-HEA125.
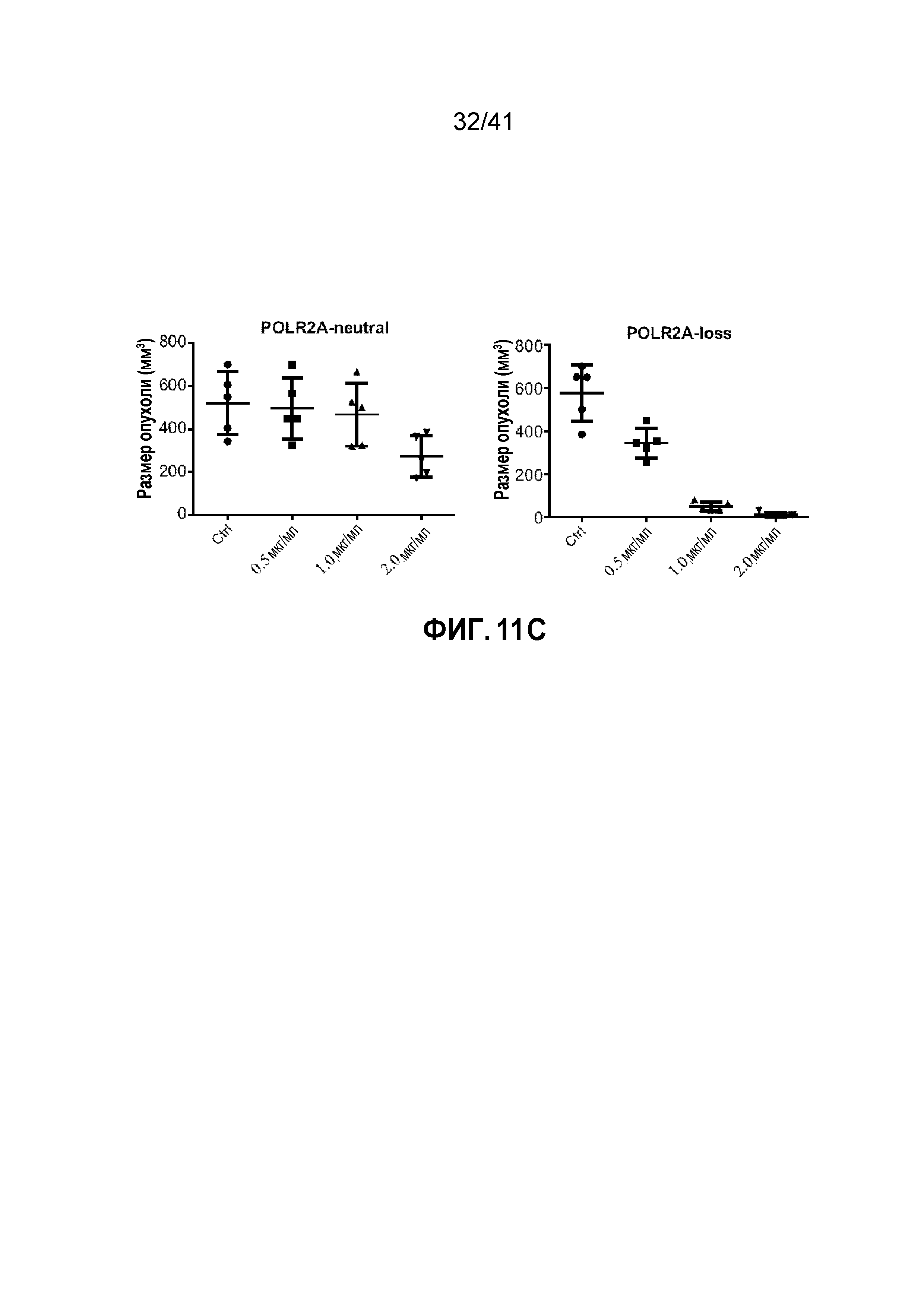
[0037] ФИГ. 11A-C. Дозозависимая супрессия POLR2A ингибирует туморогенез в POLR2Aloss, но не в POLR2Aneutral опухолях. (ФИГ. 11A) Количественный анализ уровней экспрессии мРНК POLR2A в подкожно ксенотрансплантированных опухолях HCT116 и SNU283, экспрессирующих контрольную или POLR2A мшРНК (n=5 мышей в группе). **p<0,01. (ФИГ. 11B) Количественно определяли клетки, положительные на Ki67 (пролиферация клеток) или расщепленную каспазу-3 (апоптоз), в поле зрения и экспрессию POLR2A с помощью иммуногистохимического окрашивания. **p<0.01. Данные представляют собой средние и s.d. (ФИГ. 11C) Количественное определение размеров ксенотрансплантатных опухолей, полученных из подкожно имплантированных POLR2Aneutral и POLR2Aloss клеток HCT116 (1×106 введенных клеток). Обе линии клеток экспрессируют контрольные или Dox-индуцируемые POLR2A мшРНК. После первоначального разрастания опухолей (100 мм3), мышей обрабатывали (0,5, 1 и 2 мкг мл-1) Dox в питьевой воде. n=5 мышей в группе. Данные представляют собой средние и s.d.
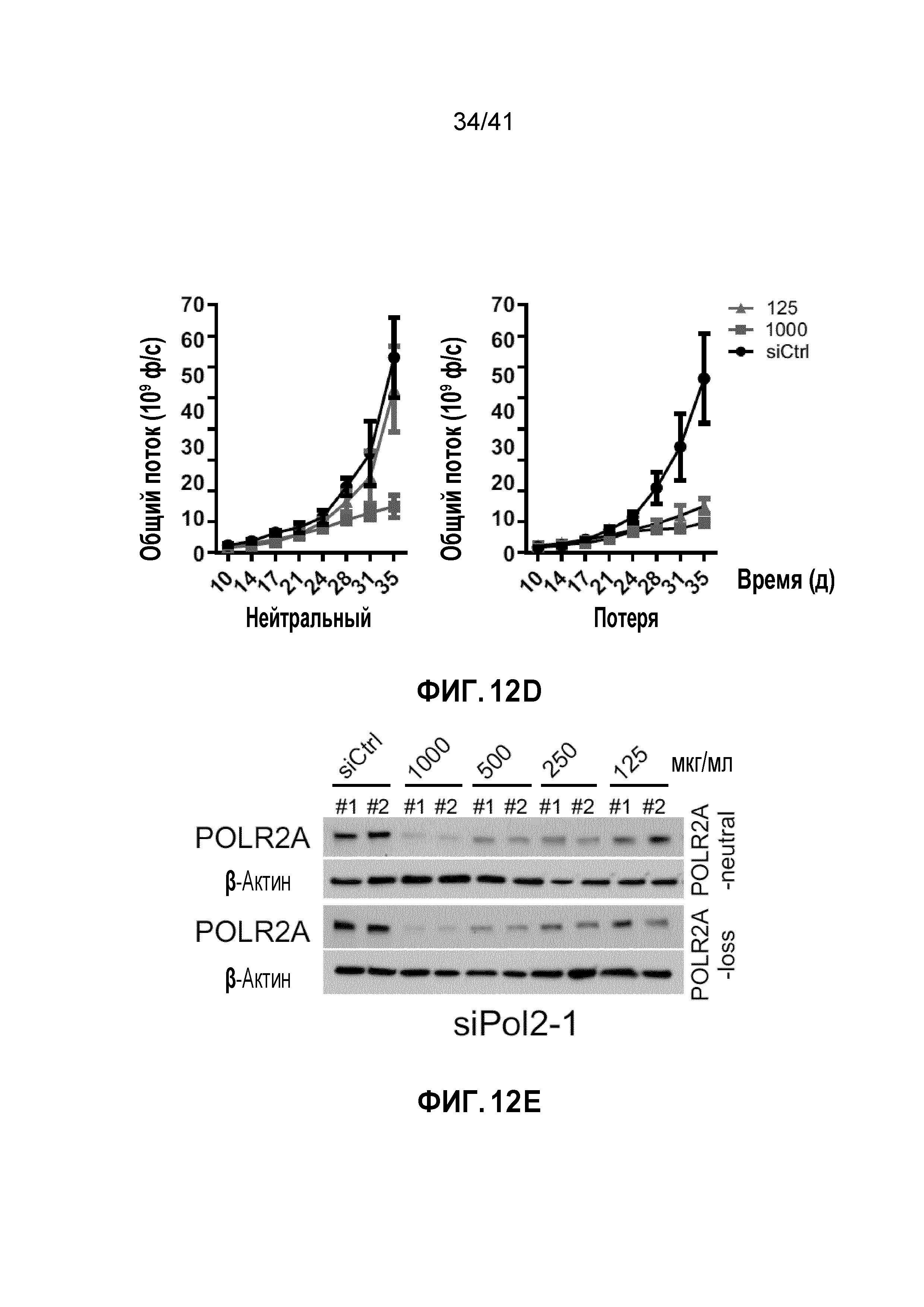
[0038] ФИГ. 12A-F. Супрессия POLR2A ДОФХ-инкапсулированной POLR2A миРНК ингибирует рост опухолей POLR2Aloss. (ФИГ. 12A) Вестерн-блоты POLR2A и β-актина после трансфекции контрольной миРНК или POLR2A миРНК (#1 и #2) в клетки HCT116. (ФИГ. 12B) Схематическая иллюстрация ортотопической инъекции клеток HCT116 (1×106 клеток) с последующими обработками нанолипосомами ДОФХ с интервалами. (ФИГ. 12C и 12D) Кривые роста ортотопических ксенотрансплантатных опухолей, полученных из POLR2Aneutral и POLR2Aloss клеток HCT116 (ФИГ. 12C - siPol2-1; ФИГ. 12D - siPol2-2), в которые делали внутрибрюшинные инъекции контрольной (1000 мкг кг-1) или POLR2A миРНК (125, 250, 500 и 1000 мкг кг-1) два раза в неделю. n=10 мышей в группе. (ФИГ. 12E и 12F) Репрезентативные уровни белка POLR2A и β-актина в ксенотрансплантатных опухолях после обработки контрольной или POLR2A миРНК (ФИГ. 12E - siPol2-1; ФИГ. 12F - siPol2-2).
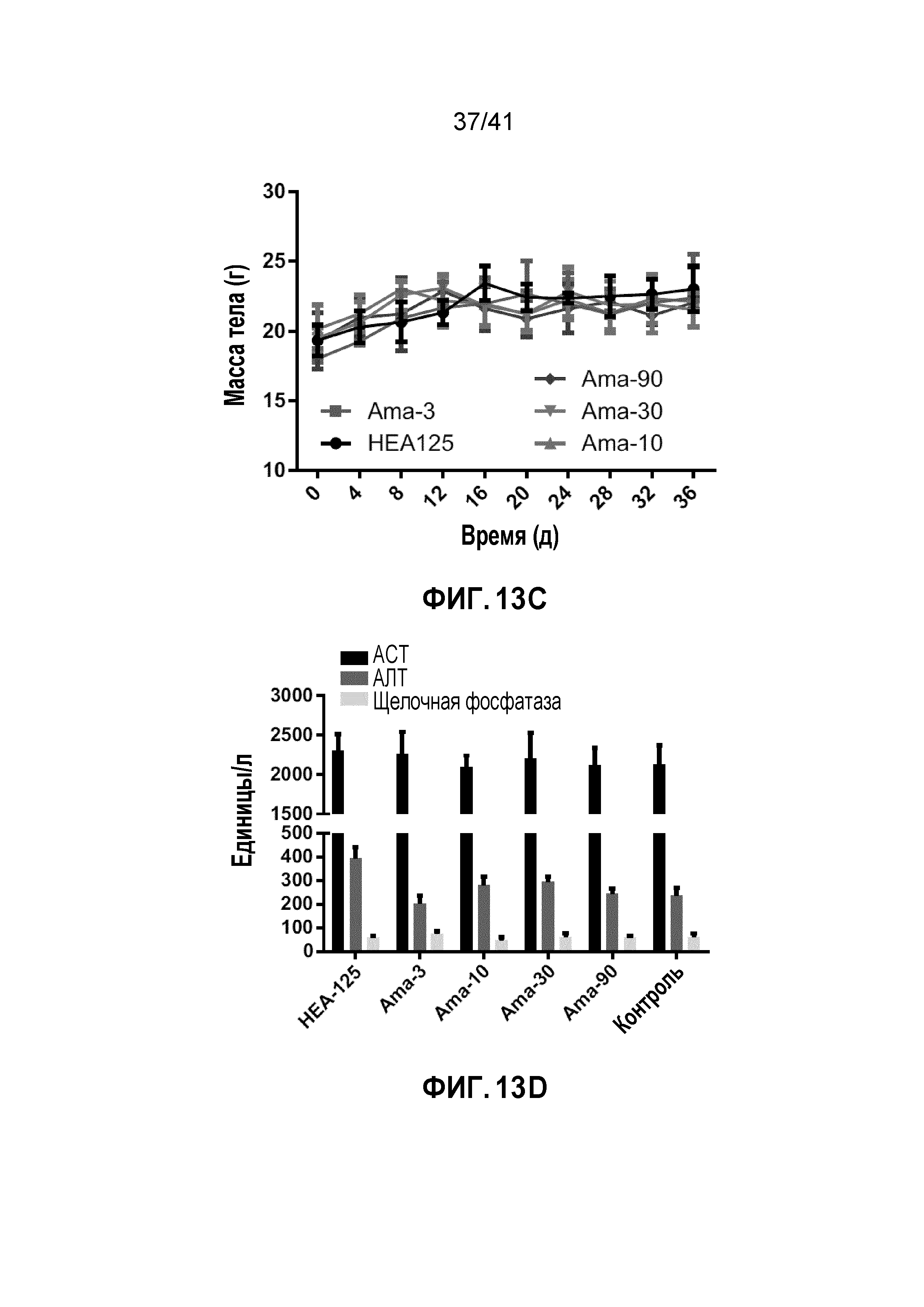
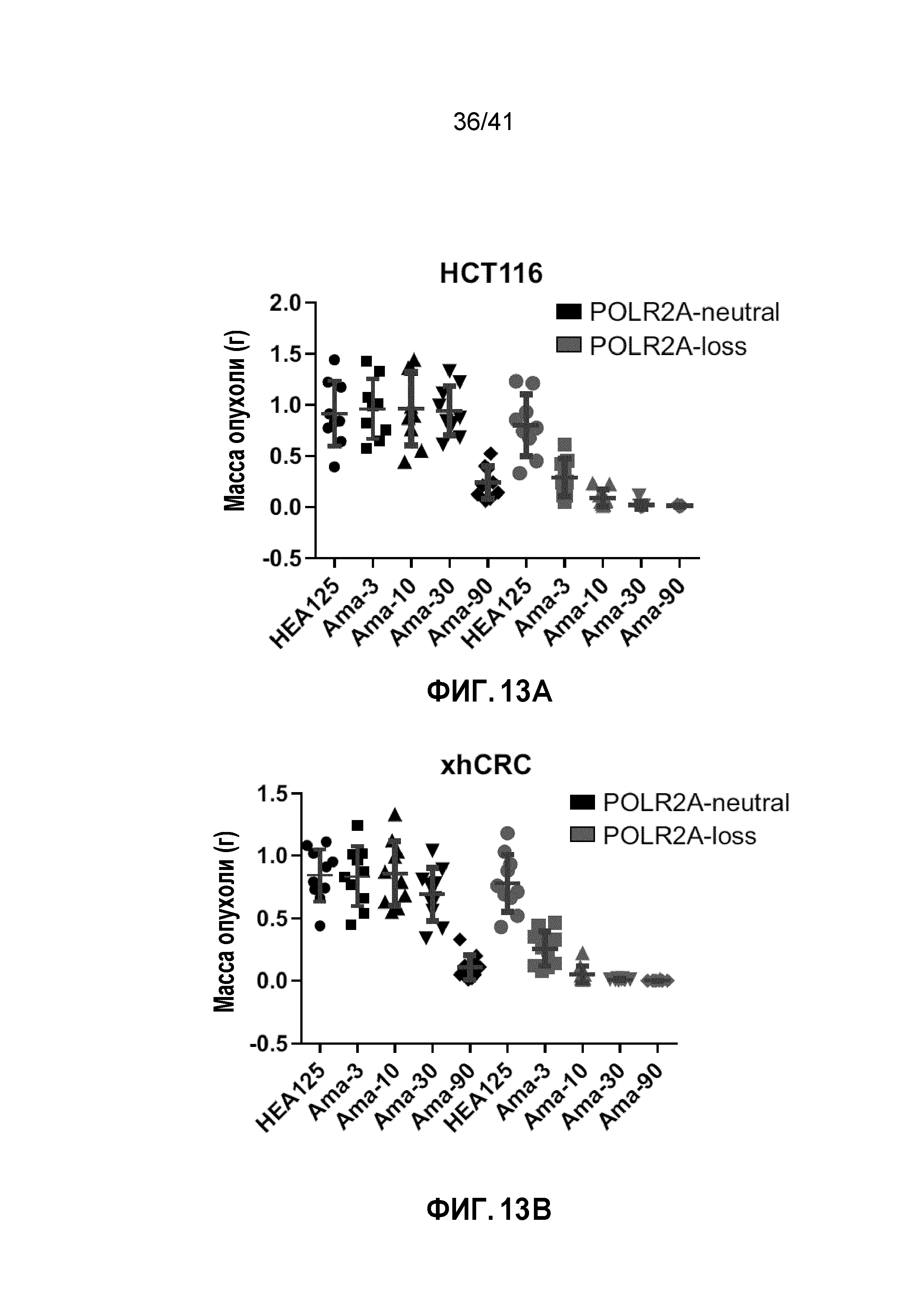
[0039] ФИГ. 13A-D. Супрессия POLR2A селективно ингибирует рост опухоли POLR2Aloss. (ФИГ. 13А И 13B) Массу ортотопически имплантированных опухолей HCT116 (ФИГ. 13A) и xhCRC (ФИГ. 13B) измеряли (n=10 мышей в группе). (ФИГ. 13C и 13D) Регистрировали массу тела (ФИГ. 13C) и уровни ферментов печени (ФИГ. 13D), включая аланинаминотрансферазу (АЛТ), аспартатаминотрансферазу (АСТ) и щелочную фосфатазу, в периферической крови, как описано в Методах. Показанные данные представляют собой средние значения пяти мышей в каждой группе.
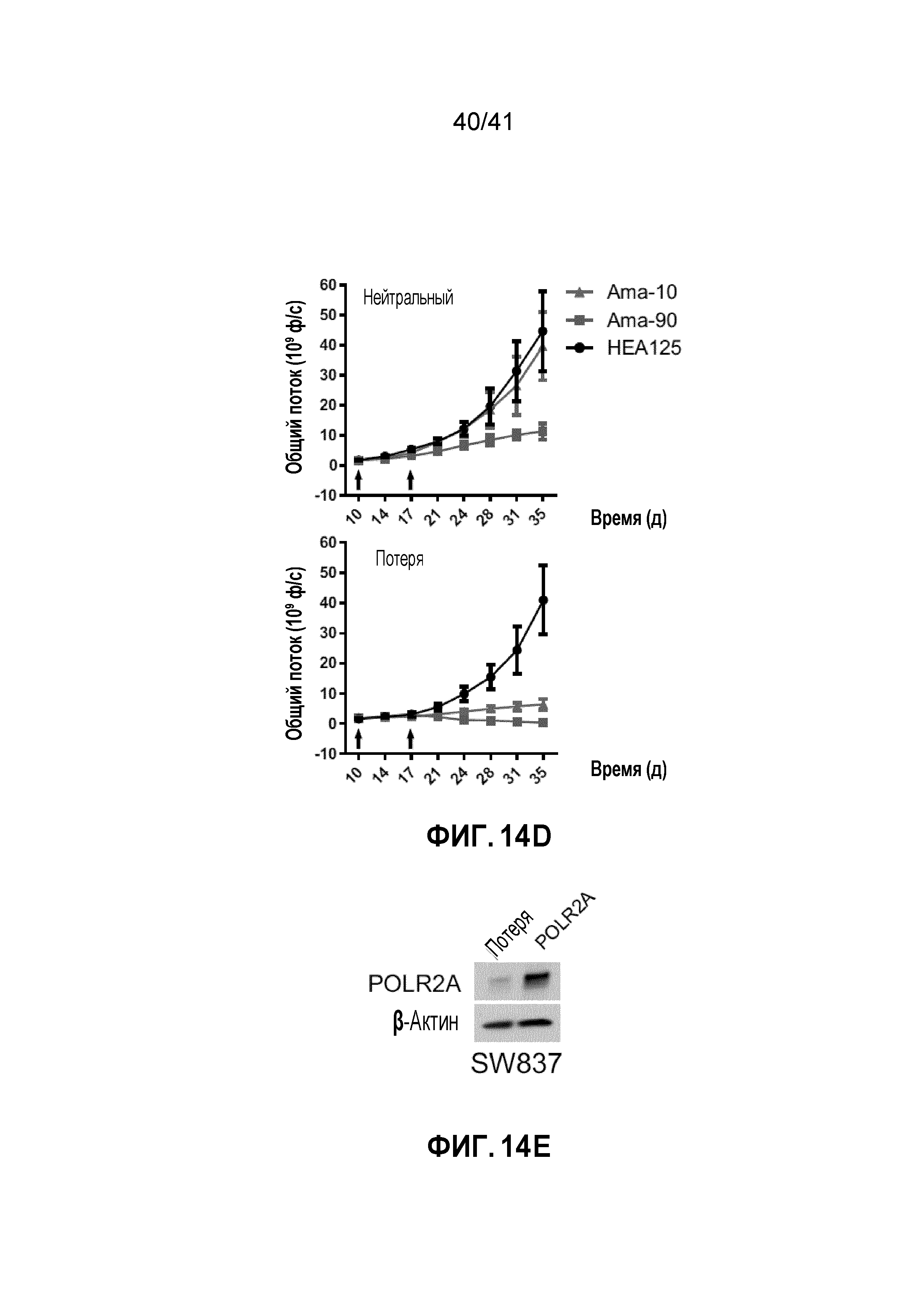
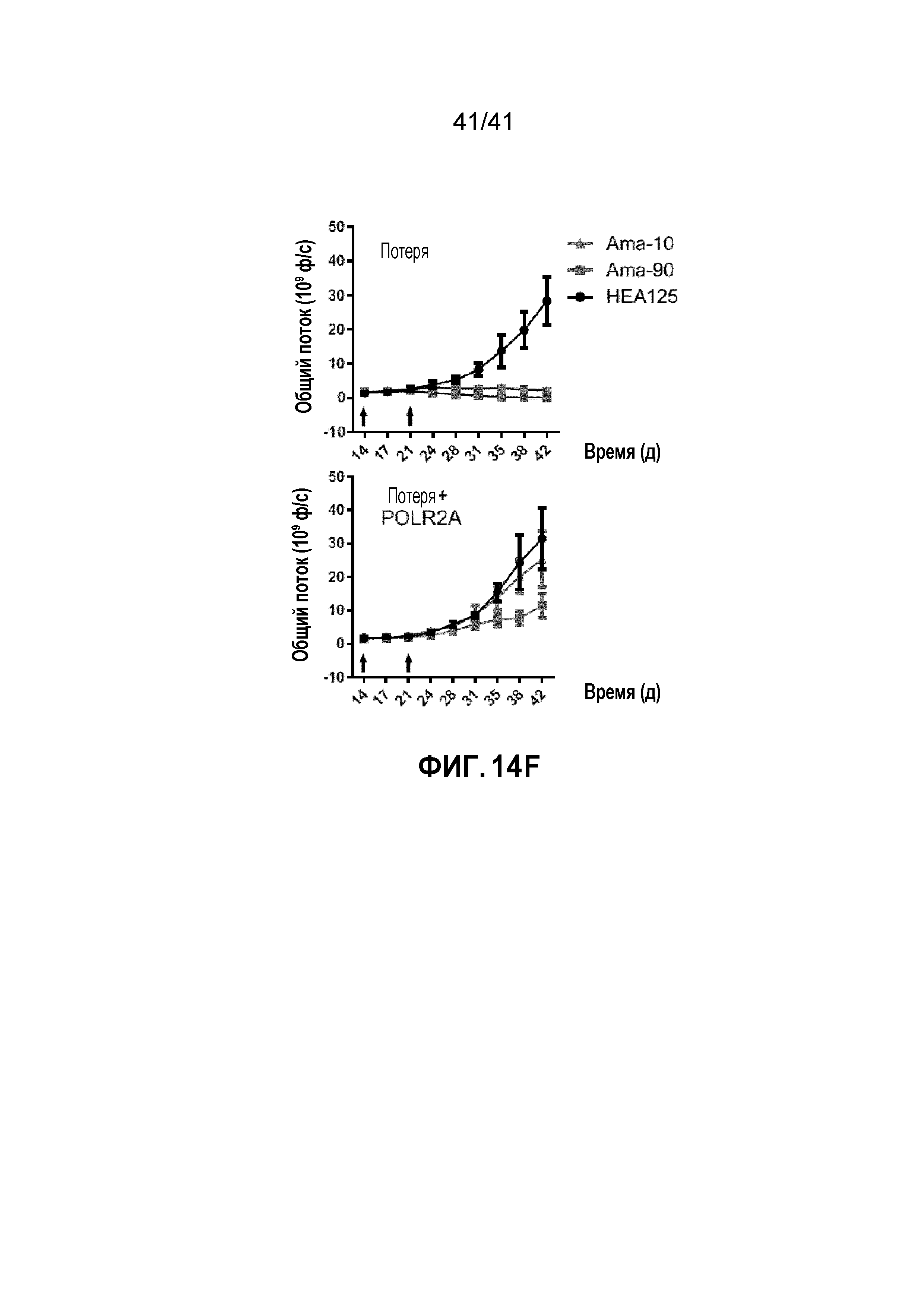
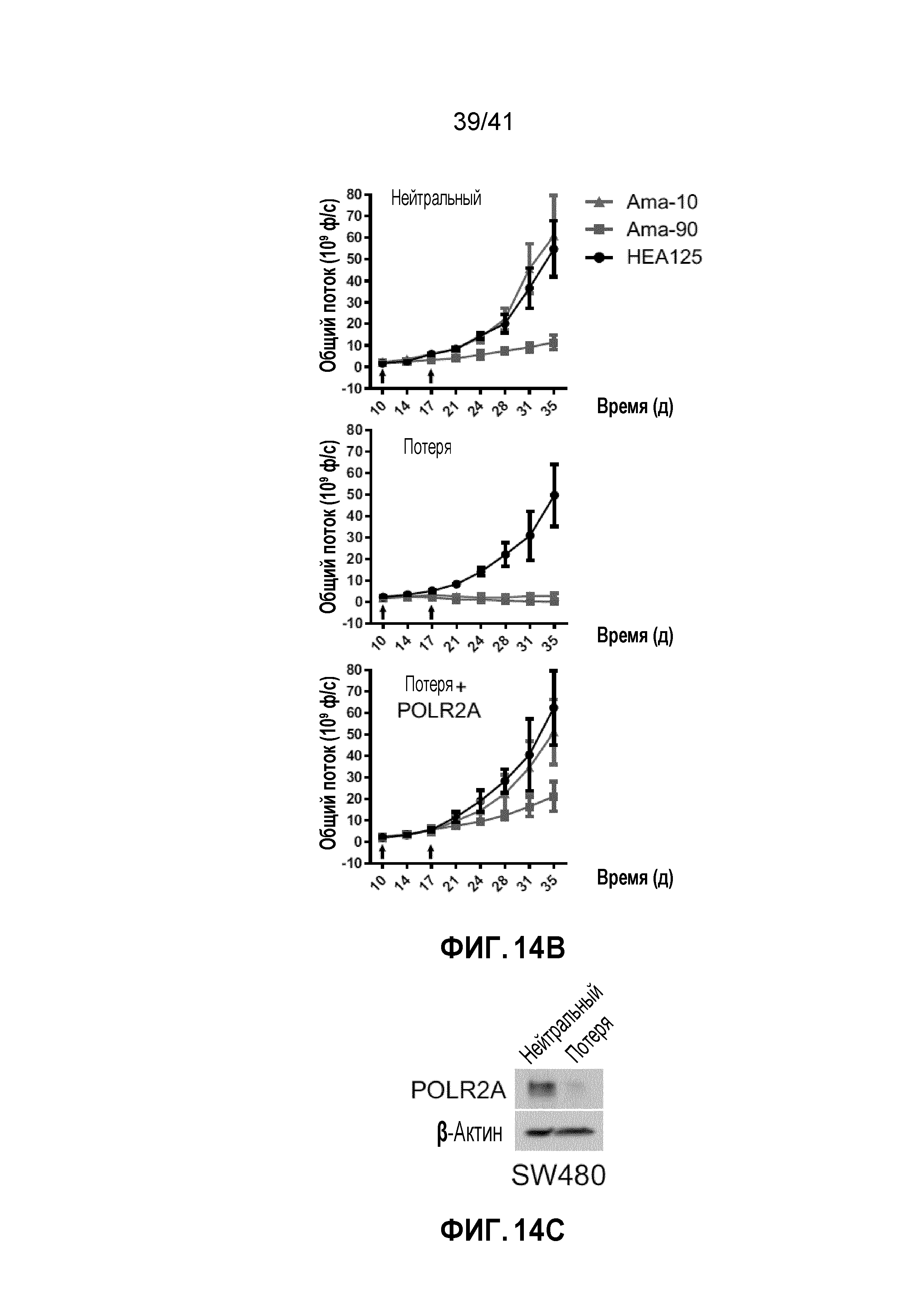
[0040] ФИГ. 14A-F. Супрессия POLR2A под действием ama-HEA125 ингибирует рост опухолей POLR2Aloss. (ФИГ. 14А, 14C и 14E) Уровни белка POLR2A и β-актина в клетках HCT116 (ФИГ. 14A), SW480 (ФИГ. 14C) или SW837 (ФИГ. 14E). Эти линии клеток являются POLR2A-neutral, POLR2A-loss или POLR2A-restored (с восстановленной функцией POLR2A). (ФИГ. 14B, 14D и 14F) Кривые роста ортотопических ксенотрансплантатных опухолей, полученных из соответствующих клеток, как указано. Все они получали двойные внутрибрюшинные инъекции антитела против EpCAM (3,6 мг кг-1) или конъюгата антитела-лекарственного средства ama-HEA125 (10 и 90 мкг кг-1, что соответствует 0,4 и 3,6 мг IgG кг-1). n=10 мышей в группе.
ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0041] Исследования, представленные в настоящей заявке, демонстрируют, что геномная делеция TP53 часто охватывает соседние жизненно важные гены, делая раковые клетки с гемизиготной делецией TP53 уязвимыми к дальнейшей супрессии таких генов. POLR2A идентифицирован в качестве такого существенного гена домашнего хозяйства, который фактически удален вместе с TP53 во многих типах рака у человека. Он кодирует наиболее крупную и каталитическую субъединицу комплекса РНК-полимеразы II, которую специфично ингибирует α-аманитин (Bensaude, 2011; Lindell et al., 1970). Таким образом, вместо фармакологического вмешательства в p53 или его регуляторов, принцип параллельной чувствительности к ингибированию POLR2A предоставляет абсолютно новую стратегию лечения рака.
[0042] Настоящий анализ клинических образцов и линий раковых клеток в The Cancer Genome Atlas (TCGA) и Cancer Cell Line Encyclopaedia (CCLE) показывает, что уровни экспрессии гена POLR2A непосредственно коррелируют с количеством его копий в человеческих опухолях толстой и прямой кишки. Супрессия POLR2A α-аманитином, малыми интеферирующими РНК или малыми (или короткими) шпилечными РНК селективно ингибирует пролиферацию, выживание и туморогенный потенциал клеток рака толстой и прямой кишки с гемизиготной потерей TP53 независимо от p53. Кроме того, настоящие доклинические исследования с α-аманитином предсказывают терапевтическую эффективность лекарственных средств или ингибиторов POLR2A на основе α-аманитина для лечения рака толстой и прямой кишки, при этом он должен найти применение в случае многих типов человеческих злокачественных новообразований с гемизиготной потерей TP53.
[0043] Предыдущие клинические применения α-аманитина были ограничены вследствие его гепатотоксичности (Letschert et al., 2006). Свободный α-аманитин токсичен для печени, поскольку его специфично связывает OATP1B3, белок-переносчик, экспрессирующийся исключительно на мембране гепатоцитов (Letschert et al., 2006). Однако α-аманитин при конъюгровании со специфическими антителами больше не является субстратом для OATP1B3 (Letschert et al., 2006; Moldenhauer et al., 2012; Faulstich and Fiume, 1985). В данном случае показано, что низкие дозы конъюгата α-аманитина-антитела (например, α-аманитин- конъюгированного антитела против EpCAM (молекулы адгезии эпителиальных клеток)) приводят к регрессии опухоли в мышиных моделях человеческого рака толстой и прямой кишки с гемизиготной делецией POLR2A. Ингибирование POLR2A является новым методом лечения злокачественных новообразований, имеющих такие общие геномные изменения.
I. Конъюгаты, направленно воздействующие на клетки
[0044] Может быть необходимым конъюгировать молекулу α-аманитина (или любого аматоксина) по меньшей мере с одним средством, направленно взаимодействующим с клетками, с целью повысить применимость α-аманитина и снизить гепатотоксичность. Такой конъюгат можно назвать "иммунотоксином". Например, для повышения эффективности и применимости α-аманитина в качестве терапевтического средства, он может быть конъюгирован или ковалентно связан с требуемой молекулой, направленно взаимодействующей с клетками. Такая молекула может быть любой молекулой с достаточной селективностью, специфичностью или аффинностью для направленного взаимодействия с клетками требуемого типа путем связывания с внешним рецептором или связывающим участком на клетках указанных типов, таких как раковая клетка (патентная публикация США 2009/0304666). Примеры таких молекул включают, без ограничения перечисленными, антитела или их антигенсвязывающие фрагменты, антителоподобные белки и аптамеры. Примеры антигенсвязывающих фрагментов антител включают без ограничения: (i) Fab-фрагмент, состоящий из VL, VH, CL и CH1 доменов; (ii) "Fd" фрагмент, состоящий из VH и CH1 доменов; (iii) "Fv" фрагмент, состоящий из VL и VH доменов одного антитела; (iv) "dAb" фрагмент, который состоит из VH домена; (v) выделенные CDR-области; (vi) F(ab')2 фрагмент, бивалентный фрагмент, включающий два связанных Fab-фрагмента; (vii) одноцепочечные Fv молекулы ("scFv"), в которых VH домен и VL домен связаны пептидным линкером, который позволяет связывать эти два домена с формированием связывающего домена; (viii) биспецифические одноцепочечные Fv димеры (см. патент США 5,091,513) и (ix) диатела, мультивалентные или мультиспецифические фрагменты, сконструированные в результате слияния генов (патентная публикация США 2005/0214860). Молекулы Fv, scFv или диател можно стабилизировать путем введения дисульфидных мостиков, связывающих VH и VL домены. Направленно взаимодействующая с клетками молекула может специфично связываться с любым опухолеассоциированным антигеном, таким как, например, CD19, CD20, CD30, CD33, CD52, EpCAM, раково-эмбриональный антиген, альфа-фетопротеин, gpA33, муцины, CA-125, MUC-1, CD56, EGFR, ERBB2, ERBB3, c-Met, IGF1R, EPHA3, TRAILR1, TRAILR2, RANKL, FAP, тенасцин, AKT, Her2/neu, Her3, эпителиальный опухолевый антиген, меланома-ассоциированный антиген, мутантный p53, мутантный ras, дектин-1, gp100, MART-1/MelanA, TRP-1 (gp75), тирозиназа, TAG-72, CAIX, PSMA, фолат-связывающий белок, ганглиозиды (например, GD2, GD3, GM2), MAGE-1, MAGE-3, BAGE, GAGE-1, GAGE-2, N-ацетилглюкозаминил-трансфераза-V, p15, β-катенин, MUM-1, CDK4, HPV-E6, HPV-E7, ZFP161, убиквилин-1, HOX-B6, IFI27, YB-1, KIAA0136, остеонектин, уникальный белок F-бокса 21, ILF3, SSX-2, PSMA, NY-ESO-1, PRAME, мезотелин, VEGF, VEGFR, интегрин альфаVбета3, интегрин альфа5бета1 или PLK1.
[0045] В уровне техники известны несколько способов соединения или конъюгирования направленно взаимодействующей с клетками молекулы (например, антитела, направленного против опухолеассоциированного антигена) с конъюгатом (например, α-аманитином) (см. публ. PCT WO2012/119787, которая полностью включена в настоящую заявку посредством отсылки). Например, в иммунотоксине может применяться отщепляемый дисульфидный линкер, известный в уровне техники. Токсин может быть конъюгирован с направленно взаимодействующей с клетками молекулой при обработке токсина с введением сульфгидрильных групп, а направленно взаимодействующей с клетками молекулы с введением пиридилдисульфидных остатков. Другими связями, которые обычно применяют и считают пригодными для конъюгирования токсина с направленно взаимодействующими с клетки молекулами, являются иминотиолан/сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилатные и карбодиимидные связи. Многие другие связи для конъюгирования белков различной длины, стабильности, гибкости и химической активности известны в уровне техники и во многих случаях доступны в продаже. Некоторые примеры способов присоединения включают применение реакции дисульфидного обмена; создание тиоэфирной связи; применение металлохелатного комплекса, например, органического хелатообразующего агента, такого как ангидрид диэтилентриаминпентауксусной кислоты (DTPA); этилентриаминтетрауксусная кислота; N-хлор-п-толуолсульфонамид; и/или тетрахлор-3-6α-дифенилгликолурил-3, присоединенных к направленно взаимодействующей с клетками молекуле. Направленно взаимодействующие с клетками молекулы также могут реагировать с ферментом в присутствии сшивающего агента, такого как глутаровый альдегид или периодат. Предпочтительно, чтобы любой конъюгат α-аманитина и молекулы, направленно взаимодействующей с клетками, был стабильным при длительном контакте с сывороткой. В таком качестве α-аманитин может быть конъюгирован с остатком лизина молекулы, направленно взаимодействующей с клетками, через стабильный карбамидный линкер, который стабилен в сыворотке, но высвобождает свободный α-аманитин в клетке после лизосомного расщепления молекулы, направленно взаимодействующей с клетками.
II. Лечение заболевания
[0046] Некоторые аспекты настоящих вариантов осуществления могут применяться для предотвращения или лечения заболевания или нарушения, связанного с гемизиготной потерей TP53 и ассоциированной потерей POLR2A. Функционирование POLR2A может быть понижено любыми подходящими веществами для лечения рака, имеющего гемизиготную потерю TP53 и/или POLR2A. Такие примерные вещества могут быть любым аматоксином, α-аманитином или направленно взаимодействующими с клетками молекулами, конъюгированными с любым аматоксином или α-аманитином.
[0047] Рак, имеющий гемизиготную потерю TP53 и/или POLR2A, может не быть гомогенным в отношении потери TP53 и/или POLR2A. В различных аспектах приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 100% клеток, которые составляют рак, могут иметь гемизиготную потерю TP53 и/или POLR2A. Таким образом, в некоторых аспектах приблизительно 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99% клеток, которые составляют рак, могут включать обе копии TP53 и/или POLR2A. В других аспектах различные проценты клеток, составляющих рак, могут иметь гомозиготную потерю TP53 и гемизиготную потерю POLR2A.
[0048] "Лечение" и "лечить" относятся к введению или применению терапевтического средства субъекту или к проведению процедуры или применению методики лечения у субъекта с целью получения терапевтического действия при заболевании или патологическом состоянии. Например, лечение может включать введение фармацевтически эффективного количества вещества, которое ингибирует функцию POLR2A.
[0049] "Субъект" относится к человеку или не к человеку, такому как приматы, млекопитающие и позвоночные. В определенных вариантах осуществления субъектом является человек.
[0050] Термин "терапевтическое действие" или "терапевтически эффективный" при использовании по всему тексту настоящей заявки относится к чему-либо, что способствует или улучшает хорошее самочувствие субъекта в отношении консервативного лечения данного состояния. Это включает, без ограничения перечисленным, уменьшение частоты или тяжести проявлений или симптомов заболевания. Например, лечение рака может включать, например, уменьшение размера опухоли, уменьшение инвазивности опухоли, уменьшение скорости роста рака или предотвращение метастаза. Лечение рака также может относиться к увеличению продолжительности жизни субъекта, имеющего рак.
[0051] Конъюгат α-аманитина может быть введен с целью лечения рака. Типы рака, при которых могут применяться настоящие способы лечения, включают любой тип злокачественной клетки, такой как клетки, присутствующие в солидной опухоли или гематологической опухоли. Примеры солидных опухолей могут включать, без ограничения перечисленными, опухоль органа, выбранного из группы, состоящей из поджелудочной железы, толстой кишки, слепой кишки, желудка, мозга, головы, шеи, яичника, почки, гортани, саркомы, легкого, мочевого пузыря, меланомы, предстательной железы и молочной железы. Примеры гематологических опухолей включают опухоли костного мозга, T- или В-клеточные неоплазии, лейкозы, лимфомы, бластомы, миеломы и т.п. Другие примеры злокачественных новообразований, которые можно лечить с применением способов, предложенных в настоящей заявке, включают, без ограничения перечисленными, рак легкого (в том числе мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточную карциному легкого), рак брюшной полости, рак желудка (в том числе желудочно-кишечный рак и желудочно-кишечный стромальный рак), рак поджелудочной железы, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, рак молочной железы, рак толстой кишки, рак толстой и прямой кишки, карциному эндометрия или матки, рак слюнной железы, рак почки, рак предстательной железы, рак вульвы, рак щитовидной железы, различные типы рака головы и шеи и меланому.
[0052] Рак может, в частности, относиться к следующему гистологическому типу, хотя он не ограничивается этим: неоплазия, злокачественная; карцинома; карцинома, недифференцированная; гигантоклеточная и веретеноклеточная карцинома; мелкоклеточная карцинома; папиллярная карцинома; плоскоклеточная карцинома; лимфоэпителиальная карцинома; базальноклеточная карцинома; пиломатриксная карцинома; переходноклеточная карцинома; папиллярная переходноклеточная карцинома; аденокарцинома; гастринома, злокачественная; холангиокарцинома; гепатоцеллюлярная карцинома; комбинированная гепатоцеллюлярная карцинома и холангиокарцинома; трабекулярная аденокарцинома; аденокистозная карцинома; аденокарцинома в аденоматозном полипе; аденокарцинома, семейный коли-полипоз; солидная карцинома; карциноидная опухоль, злокачественная; бронхоальвеолярная аденокарцинома; папиллярная аденокарцинома; хромофобная карцинома; ацидофильная карцинома; оксифильная аденокарцинома; базофильная карцинома; светлоклеточная аденокарцинома; зернисто-клеточная карцинома; фолликулярная аденокарцинома; папиллярная и фолликулярная аденокарцинома; неинкапсулирующая склерозирующая карцинома; карцинома коры надпочечников; эндометриоидная карцинома; карцинома из придатков кожи; апокринная аденокарцинома; сальная аденокарцинома; церуминозная аденокарцинома; мукоэпидермоидная карцинома; цистаденокарцинома; папиллярная цистаденокарцинома; папиллярная серозная цистаденокарцинома; муцинозная цистаденокарцинома; муцинозная аденокарцинома; перстневидноклеточная карцинома; инфильтрирующая протоковая карцинома; медуллярная карцинома; дольковая карцинома; воспалительная карцинома; болезнь Педжета, молочной железы; ацинарноклеточная карцинома; аденосквамозная карцинома; аденокарцинома с плоскоклеточной метаплазией; тимома, злокачественная; стромальная опухоль яичника, злокачественная; текома, злокачественная; гранулезоклеточная опухоль, злокачественная; андробластома, злокачественная; карцинома из клеток Сертоли; опухоль из клеток Лейдига, злокачественная; липидноклеточная опухоль, злокачественная; параганглиома, злокачественная; экстрамамиллярная параганглиома, злокачественная; феохромоцитома; гломангиосаркома; злокачественная меланома; амеланотическая меланома; поверхностная распространяющаяся меланома; злокачественное лентиго, меланома; акральные лентигинозные меланомы; нодулярные меланомы; злокачественная меланома в гигантском пигментном невусе; эпителиоидноклеточная меланома; синий невус, злокачественный; саркома; фибросаркомы; фиброзная гистиоцитома, злокачественная; миксосаркома; липосаркома; лейомиосаркома; рабдомиосаркома; эмбриональная рабдомиосаркома; альвеолярная рабдомиосаркома; стромальная саркома; смешанная опухоль, злокачественная; смешанная мюллерова опухоль; нефробластома; гепатобластома; карциносаркома; мезенхимома, злокачественная; опухоль Бреннера, злокачественная; филлоидная опухоль, злокачественная; синовиальная саркома; мезотелиома, злокачественная; дисгерминома; эмбриональная карцинома; тератома, злокачественная; струма яичника, злокачественная; хориокарцинома; мезонефрома, злокачественная; гемангиосаркома; гемангиоэндотелиома, злокачественная; саркома Капоши; гемангиоперицитома, злокачественная; лимфангиосаркома; остеосаркома; юкстакортикальная остеосаркома; хондросаркома; хондробластома, злокачественная; мезенхимальная хондросаркома; гигантоклеточная опухоль кости; саркома Юинга; одонтогенная опухоль, злокачественная; амелобластная одонтосаркома; амелобластома, злокачественная; амелобластная фибросаркома; пинеалома, злокачественная; хордома; глиома, злокачественная; эпендимома; астроцитома; протоплазматическая астроцитома; фибриллярная астроцитома; астробластома; глиобластома; олигодендроглиома; олигодендробластома; примитивная нейроэктодермальная опухоль; саркома мозжечка; ганглионейробластома; нейробластома; ретинобластома; ольфакторная нейрогенная опухоль; менингиома, злокачественная; нейрофибросаркома; неврилеммома, злокачественная; зернистоклеточная опухоль, злокачественная; злокачественная лимфома; болезнь Ходжкина; парагранулема, Ходжкина; злокачественная лимфома, мелкоклеточная лимфоцитарная; злокачественная лимфома, крупноклеточная, диффузная; злокачественная лимфома, фолликулярная; грибовидный микоз; другие уточненные неходжкинские лимфомы; В-клеточная лимфома; низкой степени злокачественности/фолликулярная неходжкинская лимфома (НХЛ); мелкоклеточная лимфоцитарная (МЛ) НХЛ; промежуточной степени злокачественности/фолликулярная НХЛ; диффузная НХЛ промежуточной степени злокачественности; иммунобластная НХЛ высокой степени злокачественности; лимфобластная НХЛ высокой степени злокачественности; мелкоклеточная НХЛ с нерассеченными ядрами, высокой степени злокачественности; массивные поражения лимфатических узлов при НХЛ; мантийноклеточная лимфома; СПИД-ассоциированная лимфома; макроглобулинемия Вальденстрема; злокачественный гистиоцитоз; множественная миелома; тучноклеточная саркома; иммунопролиферативная болезнь тонкого кишечника; лейкоз; лимфолейкоз; плазмаклеточный лейкоз; эритролейкоз; лимфосаркомоклеточный лейкоз; миелоидный лейкоз; базофильный лейкоз; эозинофильный лейкоз; моноцитарный лейкоз; тучноклеточный лейкоз; мегакариобластный лейкоз; миелоидная саркома; волосатоклеточный лейкоз; хронический лимфоцитарный лейкоз (ХЛЛ); острый лимфобластный лейкоз (ОЛЛ); острый миелоидный лейкоз (ОМЛ); и хронический миелобластный лейкоз.
III. Комбинированное лечение
[0053] В некоторых вариантах осуществления композиции и способы настоящего изобретения включают направленно взаимодействующие с клетками молекулы, конъюгированные с α-аманитином, в комбинации со второй или дополнительной терапией. Такая терапия может применяться при лечении любого заболевания, которое связано с гемизиготной потерей TP53 и/или POLR2A. Например, заболеванием может быть рак.
[0054] Способы и композиции, включающие комбинированную терапию, увеличивают терапевтический или защитный эффект и/или увеличивают терапевтический эффект другой противоопухолевой или антигиперпролиферативной терапии. Терапевтические и профилактические способы и композиции могут быть предоставлены в комбинированном количестве, эффективном для достижения требуемого эффекта, такого как уничтожение раковой клетки и/или ингибирование клеточной гиперпролиферации. Данный процесс может включать контакт клеток с направленно взаимодействующей с клетками молекулой, конъюгированной с α-аманитином, и со второй терапией. Ткань, опухоль или клетка могут подвергаться контакту с одной или более композициями или лекарственной формой(ами), включающей одно или более средств (т.е. противоопухолевое средство), или при контакте ткани, опухоли и/или клетки с двумя или более различными композициями или лекарственными формами, где одна композиция предоставляет: 1) направленно взаимодействующую с клетками молекулу, конъюгированную с α-аманитином; 2) противоопухолевое средство, или 3) направленно взаимодействующую с клетками молекулу, конъюгированную с α-аманитином, и противоопухолевое средство. Кроме того, предполагается, что такая комбинированная терапия может применяться в сочетании с химиотерапией, лучевой терапией, хирургическим вмешательством или иммунотерапией.
[0055] Термины "подвергается контакту" и "подвергается воздействию", применительно к клетке, используются в настоящей заявке для описания процесса, посредством которого терапевтическое антитело и химиотерапевтическое или радиотерапевтическое средство доставляют в клетку-мишень или приводят в непосредственное соприкосновение с клеткой-мишенью. Чтобы обеспечить уничтожение клетки, например, оба вещества доставляют в клетку в комбинированном количестве, эффективном для уничтожения клетки или предотвращения ее деления.
[0056] Направленно взаимодействующую с клетками молекулу, конъюгированную с α-аманитином, можно вводить до, во время, после или в различных комбинациях по отношению к противоопухолевому лечению. Введения можно производить с интервалами, изменяющимися в пределах от и одновременно до минут, дней и недель. В таких вариантах осуществления, в которых ингибитор экспрессии гена предоставляют больному отдельно от противоопухолевого средства, обычно нужно гарантировать, чтобы значительный период времени не проходил между временем каждой доставки, чтобы два соединения все еще могли с преимуществами оказывать комбинированное воздействие на больного. В таких случаях предполагается, что больному можно предоставлять направленно взаимодействующую с клетками молекулу, конъюгированную с α-аманитином, и противоопухолевую терапию в течение приблизительно через 12-24 или 72 ч и, более конкретно, в течение приблизительно через 6-12 ч. В некоторых ситуациях может потребоваться значительно увеличить продолжительность периода лечения, где между соответствующими введениями проходит от нескольких дней (2, 3, 4, 5, 6 или 7) до нескольких недель (1, 2, 3, 4, 5, 6, 7 или 8).
[0057] В некоторых вариантах осуществления курс лечения длится 1-90 дней или больше (такой диапазон включает промежуточные дни). Предполагается, что одно средство можно давать в любой день от дня 1 до дня 90 (такой диапазон включает промежуточные дни), или их любую комбинацию, а другое средство дают в любой день от дня 1 до дня 90 (такой диапазон включает промежуточные дни), или их любую комбинацию. В течение одного дня (24-часовой период) больному можно делать одно или множество введений средства (средств). Кроме того, предполагается, что после завершения курса лечения присутствует период времени, в течение которого не назначают никакое противоопухолевое лечение. Этот период времени может длиться 1-7 дней и/или 1-5 недель, и/или 1-12 месяцев, или больше (такой диапазон включает промежуточные дни), в зависимости от состояния больного, например, от прогноза, выносливости, состояния здоровья и т.д. Ожидается, что курсы лечения будут повторяться при необходимости.
[0058] Могут применяться различные комбинации. В качестве примера ниже, терапия направленно взаимодействующей с клетками молекулой, конъюгированной с α-аманитином, обозначена "A", а противоопухолевая терапия обозначена "B":
A/B/AB/A/BB/B/AA/A/BA/B/BB/A/AA/B/B/BB/A/B/B
B/B/B/A B/B/A/B A/A/B/B A/B/A/BA/B/B/AB/B/A/A
B/A/B/A B/A/A/B A/A/A/BB/A/A/AA/B/A/AA/A/B/A
[0059] Введение больному любого соединения или применение терапии согласно настоящему изобретению будет выполняться в соответствии с общими протоколами применения таких соединений, с учетом токсичности средств, если таковая присутствует. Таким образом, в некоторых вариантах осуществления присутствует этап контроля токсичности, которая может быть связана с комбинированной терапией.
[0060] В некоторых аспектах предполагается, что стандартная терапия будет включать химиотерапию, лучевую терапию, иммунотерапию, хирургическое вмешательство или генотерапию и может применяться в сочетании с ингибирующим антителом, противоопухолевой терапией, или и с ингибирующим антителом, и противоопухолевой терапией, как описано в настоящей заявке.
A. Химиотерапия
[0061] Целый ряд химиотерапевтических средств можно применять в соответствии с настоящим изобретением. Термин "химиотерапия" относится к применению лекарственных средств для лечения рака. "Химиотерапевтическое средство" используется для обозначения соединения или композиции, которую вводят при лечении рака. Указанные вещества или лекарственные средства классифицируют по их механизму действия в клетке, например, воздействуют ли они на клеточный цикл и на какой стадии. В альтернативе средство может быть охарактеризовано по его способности непосредственно сшивать ДНК, встраиваться в ДНК или вызывать хромосомные и митотические аберрации, воздействуя на синтез нуклеиновых кислот. Большинство химиотерапевтических средств подразделяется на следующие группы: алкилирующие средства, антиметаболиты, противоопухолевые антибиотики, ингибиторы митоза и производные нитрозомочевины.
[0062] Примеры химиотерапевтических средств включают алкилирующие средства, таких как тиотепа и циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включающие алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилоломеламин; ацетогенины (в особенности, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлоретамин, мехлорэтамина оксид гидрохлорид; мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацил мустард; производные нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в особенности калихеамицин гамма1I и калихеамицин омега1I (см., например, Agnew, Chem Intl. Ed. Engl., 33:183-186 (1994)); динемицин, включая динемицин A; бисфосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарциностатина и хромофоры родственных хромопротеиновых энедииновых антибиотиков), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карцинофилин, хромомицин, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-ФУ); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пуринов, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидинов, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; ингибиторы синтеза гормонов коры надпочечников, такие как митотан, трилостан; средство, восполняющее дефицит фолиевой кислоты, такое как фолиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; эфлорнитин; эллиптиния ацетат; эпотилон; этоглюцид; галлия нитрат; гидроксимочевину; лентинан; лонидамин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопидамол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; PSK-полисахаридный комплекс; разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2''-трихлортриэтиламин; трихотецены (в особенности, Т-2 токсин, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-C"); циклофосфамид; таксоиды, например, паклитаксел и доксетаксел; гемцитабин; 6-тиогуанин; меркаптопурин; комплексные соединения платины, такие как цисплатин, оксалиплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин; новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; кселоду; ибандронат; иринотекан (например, CPT-11); ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин; карбоплатин, прокарбазин, пликомицин, гемцитабин, навелбин, ингибиторы фарнезил-протеинтрансферазы, трансплатин и фармацевтически приемлемые соли, кислоты или производные любого из перечисленных выше.
[0063] Также в рамки данного определения включены антигормональные средства, которые обеспечивают регуляцию или ингибирование действия гормонов на опухоли, такие как антиэстрогены и селективные модуляторы эстрогеновых рецепторов (СМЭР), включающие, например, тамоксифен, ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен; ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует синтез эстрогенов в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, мегестрола ацетат, эксеместан, форместан, фадрозол, ворозол, летрозол и анастрозол; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (1,3-диоксолановый аналог нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов в сигнальных путях, участвующих в аберрантной пролиферации клеток, таких как, например PKC-альфа, Ralf и H-Ras; рибозимы, такие как ингибитор экспрессии VEGF и ингибитор экспрессии HER2; вакцины, такие как генотерапевтические вакцины, а также фармацевтически приемлемые соли, кислоты или производные любого из перечисленных выше.
B. Лучевая терапия
[0064] Другие факторы, которые вызывают повреждение ДНК и широко применялись, включают то, что обычно известно как γ-излучение, рентгеновское излучение и/или направленная доставка радиоизотопов в опухолевые клетки. Также рассматриваются другие формы факторов, повреждающих ДНК, такие как микроволновое излучение, облучение протонным пучком (патенты США 5,760,395 и 4,870,287) и УФ-излучение. Наиболее вероятно то, что все эти факторы вызывают широкий спектр повреждений ДНК, предшественников ДНК, при репликации и репарации ДНК и при сборке и поддержании хромосом. Доза изменяется в случае рентгеновского излучения от суточных доз 50-200 рентген в течение длительных периодов времени (3-4 недели) до однократных доз 2000-6000 рентген. Диапазоны дозы для радиоизотопов изменяются в широких пределах и зависят от периода полураспада изотопа, мощности и типа испускаемого излучения, и захвата неопластическими клетками.
[0065] Термины "подвергается контакту" и "подвергается воздействию", применительно к клетке, используются в настоящей заявке для описания процесса, посредством которого терапевтическая конструкция и химиотерапевтическое или радиотерапевтическое средство доставляют в клетку-мишень или приводят в непосредственное соприкосновение с клеткой-мишенью. Чтобы обеспечить уничтожение клетки, например, оба вещества доставляют в клетку в комбинированном количестве, эффективном для уничтожения клетки или предотвращения ее деления.
C. Иммунотерапия
[0066] В отношении лечения рака иммунотерапевтические средства, как правило, основаны на применении иммунных эффекторных клеток и молекул, которые направленно взаимодействуют с раковыми клетками и разрушают их. Трастузумаб (ГерцептинTM) является таким примером. Иммунный эффектор может быть, например, антителом, специфичным к некоторому маркеру на поверхности опухолевой клетки. Антитело самостоятельно может служить эффектором терапии, или оно может рекрутировать другие клетки, которые фактически уничтожают клетки. Антитело также может быть конъюгировано с лекарственным средством или токсином (химиотерапевтическим средством, радионуклидом, цепью A рицина, токсином холеры, токсином коклюша и т.д.) и служит просто в качестве направляющего средства. В альтернативе эффектор может быть лимфоцитом, несущим поверхностную молекулу, которая взаимодействует, прямо или косвенно, с опухолевой клеткой-мишенью. Различные эффекторные клетки включают цитотоксические Т-клетки и NK-клетки. Комбинация терапевтических воздействий, т.е. прямая цитотоксическая активность и ингибирование или снижение ErbB2, может предоставить терапевтический эффект при лечении злокачественных новообразований с оверэкспрессией ErbB2.
[0067] Другая иммунотерапия может также применяться в качестве части комбинированной терапии с терапией сайленсинга генов, обсуждаемой выше. В одном аспекте иммунотерапии опухолевая клетка должна нести некий маркер, который поддается направленному воздействию, т.е. не присутствует на большинстве других клеток. Существует множество онкомаркеров, при этом любой из них может подходить для направленного воздействия в рамках настоящего изобретения. Обычные онкомаркеры включают раково-эмбриональный антиген, простатический специфический антиген, опухолеассоциированный антиген в моче, фетальный антиген, тирозиназу (p97), gp68, TAG-72, HMFG, сиалированный антиген Льюис, MucA, MucB, PLAP, эстрогеновый рецептор, рецептор ламинина, erb B и p155. Альтернативный аспект иммунотерапии состоит в объединении противоопухолевого действия с иммуностимулирующим действием. Также существуют иммуностимулирующие молекулы, включающие цитокины, такие как IL-2, IL-4, IL-12, ГМ-КСФ и гамма-ИФН, хемокины, такие как MIP-1, MCP-1 и IL-8, а также факторы роста, такие как лиганд FLT3. Было показано, что объединение иммуностимулирующих молекул, либо в виде белков, либо при использовании доставки генов, в комбинации с супрессором опухоли, усиливало противоопухолевое действие (Ju et al., 2000). Кроме того, антитела против любого из указанных соединений могут применяться для направленной доставки противоопухолевых средств, обсуждаемых в настоящем описании.
[0068] Примерами иммунотерапий, исследуемых или применяемых в настоящее время, являются иммунные адъюванты, например, Mycobacterium bovis, Plasmodium falciparum, динитрохлорбензол и ароматические соединения (патенты США 5,801,005 и 5,739,169; Hui and Hashimoto, 1998; Christodoulides et al., 1998), терапия цитокинами, например, интерферонами α, β и γ; IL-1, ГМ-КСФ и ФНО (Bukowski et al., 1998; Davidson et al., 1998; Hellstrand et al., 1998) генотерапия, например, ФНО, IL-1, IL-2, p53 (Qin et al., 1998; Austin-Ward and Villaseca, 1998; патенты США 5,830,880 и 5,846,945) и моноклональные антитела, например, антитело к ганглиозиду GM2, антитело к HER-2, антитело к p185 (Hanibuchi et al., 1998; патент США 5,824,311). Предполагается, что одна или несколько противоопухолевых терапий могут применяться с терапиями сайленсинга генов, описанных в настоящей заявке.
[0069] В активной иммунотерапии, антигенный пептид, полипептид или белок, или композицию аутологичных или аллогеннных опухолевых клеток или "вакцину" вводят, как правило, с определенным бактериальным адъювантом. В адоптивной иммунотерапии циркулирующие лимфоциты или инфильтрирующие опухоль лимфоциты больного выделяют in vitro, активируют лимфокинами, такими как IL-2, или трансдуцируют генами для некроза опухоли и повторно вводят больному.
D. Хирургия
[0070] Приблизительно 60% людей с раком подвергнутся хирургическому вмешательству некоторого типа, которое включает профилактическую, диагностическую или направленную на определение стадии, лечебную и паллиативную хирургию. Лечебная хирургия представляет собой лечение рака, которое может применяться в сочетании с другими терапиями, такими как лечение согласно настоящему изобретению, химиотерапия, лучевая терапия, гормональная терапия, генотерапия, иммунотерапия и/или альтернативные терапии.
[0071] Лечебная хирургия включает резекцию, при которой всю или часть раковой ткани физически удаляют, вырезают и/или разрушают. Резекция опухоли относится к физическому удалению, по меньшей мере, части опухоли. В дополнение к резекции опухоли хирургическое лечение включает лазерную хирургию, криохирургию, электрохирургию и микроскопически контролируемую хирургию (хирургию Моса). Также предполагается, что некоторые аспекты настоящего изобретения могут применяться в сочетании с удалением поверхностных злокачественных новообразований, предраковых опухолей или случайных количеств нормальной ткани.
[0072] При вырезании части или всех раковых клеток, ткани или опухоли в теле может образоваться полость. Лечение может быть выполнено путем перфузии, прямой инъекции или местного применения в этой области дополнительной противораковой терапии. Такое лечение можно повторять, например, каждый 1, 2, 3, 4, 5, 6 или 7 дней или каждую 1, 2, 3, 4 и 5 недель, или каждый 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев. Такое лечение может также включать различные дозы.
E. Другие средства
[0073] Предполагается, что другие средства могут применяться в комбинации с некоторыми аспектами настоящего изобретения для повышения терапевтической эффективности лечения. Такие дополнительные средства включают иммуномодулирующие средства, средства, которые воздействуют на апрегуляцию рецепторов клеточной поверхности и щелевые контакты, цитостатические средства и средства, индуцирующие дифференцировку, ингибиторы клеточной адгезии, средства, которые повышают чувствительность гиперпролиферативных клеток к индукторам апоптоза, или другие биологические средства. Иммуномодулирующие средства включают фактор некроза опухоли; интерферон-альфа, бета и гамма; IL-2 и другие цитокины; F42K и другие аналоги цитокинов; или MIP-1, MIP-1бета, MCP-1, RANTES и другие хемокины. Также предполагается, что апрегуляция рецепторов клеточной поверхности или их лигандов, таких как Fas/Fas лиганд, DR4 или DR5/TRAIL (лиганд Apo-2) могут потенцировать способности индукции апоптоза согласно настоящему изобретению посредством установления аутокринного или паракринного действия в отношении гиперпролиферативных клеток. Усиление межклеточной сигнализации при увеличении количества щелевых контактов может увеличить антигиперпролиферативное действие в отношении соседней популяции гиперпролиферативных клеток. В других вариантах осуществления цитостатические средства или средства, индуцирующие дифференцировку, могут применяться в комбинации с некоторыми аспектами настоящего изобретения для повышения антигиперпролиферативной эффективности лечения. Ингибиторы клеточной адгезии рассматриваются для повышения эффективности настоящего изобретения. Примерами ингибиторов клеточной адгезии являются ингибиторы киназы фокальной адгезии (FAK) и ловастатин. Также предполагается, что другие средства, которые увеличивают чувствительность гиперпролиферативной клетки к апоптозу, такому как антитело c225, могут применяться в комбинации с некоторыми аспектами настоящего изобретения для повышения эффективности лечения.
[0074] Гормональная терапия также может применяться в сочетании с некоторыми аспектами настоящего изобретения или в комбинации с любой другой противоопухолевой терапией, описанной ранее. Применение гормонов может использоваться при лечении некоторых злокачественных новообразований, таких как рак молочной железы, предстательной железы, яичника или шейки матки, для понижения уровня или блокирования действия некоторых гормонов, таких как тестостерон или эстроген. Такое лечение часто применяют в комбинации по меньшей мере с еще одной противоопухолевой терапией в качестве варианта лечения или для снижения риска метастазов.
IV. Примеры
[0075] Следующие примеры включены для демонстрации предпочтительных вариантов осуществления изобретения. Специалистам в данной области будет очевидно, что способы, раскрытые в примерах ниже, представляют собой методики, которые, как было раскрыто автором изобретения, хорошо функционируют при практическом осуществлении изобретения и, таким образом, могут рассматриваться в качестве составляющих предпочтительные варианты для его практического осуществления. Впрочем, специалистам в данной области, с учетом настоящего описания, должно быть очевидным, что многие изменения могут быть внесены в определенные варианты осуществления, которые раскрыты, и все же обеспечивают получение подобного или аналогичного результата, без отступления от сущности и объема изобретения.
Материалы и методы
[0076] Культура клеток, антитела и вестерн-блот анализ. Линии клеток HCT116, SW480, SW837, HT29, DLD1 и HT29 получали из Американской коллекции типовых культур и культивировали при стандартных условиях, указанных производителем. Линии клеток SNU283 и SNU1197 получали из Корейского банка линий клеток и культивировали в среде RMPI 1640 с добавкой 10% FBS и 2 мМ L-глутамина. Выделение, культивирование и поддержание ксенотрансплантатных клеток первичной CRC человека (xhCRC) выполняли, как описано ранее (Lu et al., 2013). Коротко, полученные от больного ксенотрансплантаты собирали в стерильных условиях и механически разделяли с последующим инкубированием 30 мин в коллагеназе II при 37°C. Образец фильтровали через стерильный фильтр с порами 100 мкм. Эритроциты удаляли с помощью гипоосмотического буфера для лизиса эритроцитов (eBioscience). Клетки мыши в образцах ксенотрансплантатных человеческих CRC удаляли при отрицательной селекции с использованием антитела H-2K к молекуле MHC класса I мыши с последующим применением набора для очистки магнитными сферами (Miltenyi). Фибробласты удаляли при отрицательной селекции с использованием набора для разделения магнитными сферами MACS (Miltenyi). Недавно выделенные клетки xhCRC хранили на культуральных планшетах, покрытых коллагеном-1 (BD Biosciences), и культивировали в MEM с добавкой 10% FBS, витаминов (1×), заменимых аминокислот (1×), пенициллина-стрептомицина (1×), пирувата натрия (1×) и L-глутамина (1×). Все добавки для сред были приобретены у Sigma.
[0077] Антитела против POLR2A были приобретены у Santa Cruz (#sc-47701) и Abcam (#ab140509). Антитело против Ki67 (#D3B5) и антитело против расщепленной каспазы-3 (Asp175, #5A1E) получали от Cell Signalling. Антитела против p53 (#sc-126), против β-актина (#sc-1616), HRP-конъюгат против IgG козы (#sc-2020), HRP-конъюгат против IgG кролика (#sc-2054) и HRP-конъюгат против IgG мыши (#sc-2055) приобретали у Santa Cruz. Получение лизата клеток, ДСН-ПААГЭ и Вестерн-блоттинг выполняли, как описано ранее (Liu et al., 2012).
[0078] Выделение РНК и количественная ПЦР. Суммарную РНК выделяли при использовании реактива TRIzol (Life Technologies) и затем подвергали обратной транскрипции при использовании набора для синтеза кДНК iScript (Bio-Rad). Полученную кДНК использовали для кПЦР с использованием iTaq Universal SYBR Green Supermix (Bio-Rad) с геноспецифичными праймерами, и результаты нормализовали по β-актину в качестве контроля. В анализах ОТ-ПЦР последовательности праймеров к TP53 являлись следующими: 5'-GAGGTTGGCTCTGACTGTACC-3' (SEQ ID NO: 1) и 5'-TCCGTCCCAGTAGATTACCAC-3' (SEQ ID NO: 2), а к POLR2A: 5'-TTGTATCCGTACCCACAGCA-3' (SEQ ID NO: 3) и 5'-CATGATCAGCTCCCCATTCT-3' (SEQ ID NO: 4).
[0079] мшРНК-опосредованный нокдаун POLR2A. Клоны POLR2A-специфичной мшРНК получали из MD Anderson shRNA and ORFeome Core Facility (первоначально от Open Biosystems). Двенадцать мшРНК, направленных против POLR2A, подвергали скринингу, из них две мшРНК вызывали нокдаун уровней белка по меньшей мере на 50% во всех четырех протестированных линиях клеток рака толстой и прямой кишки. Идентификационные номера клонов и последовательности мшРНК являются следующими: V3LHS_645674 (5'-TTAGCTTTGTTCTTCCCGA-3' [SEQ ID NO: 5]) и V3LHS_64029 (5'-TGTTGTCCATCTCCTCCCC-3' [SEQ ID NO: 6]). Последовательности шпилек в векторе GIPZ клонировали в вектор TRIPZ (Dharmacon) при использовании протокола, предоставленного производителем. Вектор TRIPZ представляет собой Dox-индуцируемую систему с красным флуоресцентным белком-репортером.
[0080] Получение клеток, стабильно экспрессирующих Dox-индуцируемые мшРНК. Рекомбинантные лентивирусные частицы получали из клеток 293T. Коротко, 72 мкг ДНК мшРНК-кодирующего вектора, 54 мкг ДНК Delta 8.9 вектора и 18 мкг ДНК VSVG-кодирующего вектора трансфицировали в клетки 293T (посеянные на чашку 245 мм2) при использовании X-tremeGENE (Roche). Супернатант, содержащий вирусные частицы, собирали и фильтровали через 72 ч после трансфекции, концентрировали с помощью ультрацентрифугирования при 90000 g и ресуспендировали в среде для роста клеток. Для получения стабильных Dox-индуцируемых клеток, клетки HCT116 и SNU283 инфицировали мшРНК-экспрессирующими вирусными частицами при множественности заражения (MOI) 1. Вирусные растворы добавляли в среду клеточной культуры, содержащую 4 мкг/мл полибрена. Клетки отбирали в течение 48 ч после заражения на 2 мкг/мл пуромицина. Одиночные колонии культивировали и размножали, и колонии, несущие одну копию встроенной лентивирусной ДНК, идентифицировали и анализировали на эффективность нокдауна.
[0081] Конкурентный анализ с использованием мшРНК POLR2A. Одиночная лентивирусная копия, экспрессирующая мшРНК-1 или мшРНК-2, была достаточной для подавления уровней экспрессии POLR2A во всех четырех протестированных линиях клеток толстой и прямой кишки (ФИГ. 6A). Раковые клетки инфицировали контрольными или POLR2A мшРНК-экспрессирующими лентивирусами (каркас pGIPZ, экспрессирующий GFP) при MOI 2. Через два дня после заражения, GFP-положительные клетки сортировали при помощи клеточного сортера BD FACSJazzTM (BD Biosciences) в MD Anderson Flow Cytometry and Cellular Imaging Core Facility. Затем GFP-положительные клетки смешивали с незараженными и GFP-отрицательными клетками в соотношении 1:1 и культивировали с шестью пассажами. Количество GFP-положительных клеток и общее количество всех клеток в каждом пассаже анализировали и определяли количественно с помощью проточной цитометрии, и вычисляли процент GFP-положительных клеток.
[0082] Получение sgРНК-экспрессирующих векторов и тест Surveyor. Бицистронный вектор экспрессии, экспрессирующий Cas9 и sgРНК, расщепляли BbsI и обрабатывали щелочной фосфатазой, и очищали линеаризованный вектор при выделении из геля для клонирования sgРНК-кодирующей ДНК (Cong et al., 2013). Пару олиго ДНК для каждой sgРНК, направленной против TP53 или POLR2A, отжигали, фосфорилировали и лигировали в линеаризованный вектор. Последовательности олиго ДНК перечислены в Таблице 1. Тест Surveyor проводили с целью проверки эффективности редактирования генома, как описано ранее (Ran et al., 2013; Guschin et al., 2010). Коротко, клетки сеяли в шестилуночные планшеты при плотности 2×105 клеток в лунке. Через один день после первоначального посева, клетки трансфицировали 2 мкг ДНК Cas9/sgРНК-экспрессирующего вектора и собирали через 48 ч после трансфекции. Геномную ДНК выделяли и 1 тпн фрагмент ДНК, содержащий сайт-мишень sgРНК, амплифицировали с помощью ПЦР высокой точности и расщепляли T7 эндонуклеазой I. Геномную ДНК, выделенную из клеток HCT116, трансфицированных контрольной векторной ДНК, использовали в качестве контроля. Чтобы комплементарные, но содержащие ошибки спаривания, цепи могли отжигаться, ПЦР-продукты инкубировали при 95°C в течение 5 мин, 95°C-85°C со скоростью -2°C⋅с-1 и 85°C-25°C со скоростью -0,1°C⋅с-1. Добавляли T7 эндонуклеазу I и образцы инкубировали при 37°C в течение 60 мин для расщепления отожженных ПЦР-продуктов на участках ошибочного спаривания. Расщепленные T7 эндонуклеазой I ПЦР-продукты анализировали с помощью электрофореза в агарозном геле. Последовательности олигонуклеотидов, используемых для ПЦР амплификации, перечислены в Таблице 1. ПЦР-продукты из положительных клонов лигировали в вектор pGEM-T Easy (Promega) и затем подтверждали с помощью секвенирования ДНК.
Таблица 1. Последовательность олигонуклеотидов для sgРНК и тестов Surveyor.
|
[0083] Пролиферация клеток и анализ выживания. Равные количества клеток сеяли в 12-луночные планшеты в трех экземплярах. Клетки фиксировали 10% метанолом и окрашивали 0,1% кристаллическим фиолетовым (растворенным в 10% метаноле) в указанные моменты времени. После окраски, лунки три раза промывали PBS и обесцвечивали уксусной кислотой. Оптическую плотность раствора кристаллического фиолетового измеряли при 590 нм. Для анализа выживания клеток клетки сеяли в концентрации 1000 клеток в лунке в 96-луночные планшеты и обрабатывали указанными концентрациями α-аманитина или актиномицина D через 24 часа. Жизнеспособность клеток определяли количественно при использовании реактива WST-1 (Roche) согласно инструкциям производителя. Все эксперименты проводили в трех экземплярах.
[0084] Апоптоз и анализ клеточного цикла. Линии клеток HCT116 и SNU283 обрабатывали с или без α-аманитина в течение 2 дней, или доксициклином в течение 4 дней при указанных концентрациях и окрашивали аннексином V-PE и 7-AAD (Biovision). Апоптоз анализировали с помощью проточной цитометрии при использовании проточного цитометра Guava EasyCyte (Millipore) согласно протоколу производителя. В анализ включали предапоптотические (аннексин V-положительные и 7-AAD-отрицательные) и апоптотические (аннексин V-положительные и 7-AAD-положительные) клетки. Для анализа клеточного цикла клетки фиксировали в 75% этаноле при -20°C в течение ночи. Клетки промывали холодным PBS, обрабатывали 100 мкг РНКазы A (Qiagen) и окрашивали 50 мкг иодистого пропидия (Roche). Профили клеточного цикла анализировали с помощью проточной цитометрии при использовании проточного цитометра Guava EasyCyte (Millipore).
[0085] Флуоресцентная гибридизация in situ (FISH). Анализ FISH выполняли при использовании флуоресцеин-меченного (красный) зонда к POLR2A и контрольного зонда к центромере (Хр. 17, зеленый) производства Empire Genomics. Гибридизацию и детектирование выполняли согласно протоколам производителя. Препараты контрастировали DAPI и делали снимки с помощью микроскопа Nikon E800, оборудованного охлаждаемой камерой на приборах с зарядовой связью (ПЗС). Для определения гемизиготной потери гена POLR2A, в каждом случае анализировали 100 отдельных ядер. Изображения покоящихся ядер фиксировали и обрабатывали при использовании системы Quantitative Image Processing System (Applied Imaging).
[0086] Образцы больных. Эквивалентные образцы нормальных тканей и тканей колоректальных опухолей от больных были получены из онкологического центра им. М.Д. Андерсона (MD Anderson Cancer Center (MDACC)) при надлежащем информированном согласии после одобрения экспертным советом учреждения (IRB# PA11-0767). Для определения уровней экспрессии белка POLR2A, образцы ткани (20-40 мг) помещали в пробирки, содержащие керамические сферы, и гомогенизировали при помощи гомогенизатора Precellys 24 (Bertin Technologies). Лизаты два раза центрифугировали (15 мин, 16000 g) и собирали супернатант.
[0087] Выделение геномной ДНК и проверка числа копий. Суммарную геномную ДНК выделяли из образцов человеческих тканей и линий клеток при использовании набора DNeasy Blood & Tissue Kit (Qiagen) согласно предоставленным производителем инструкциям по очистке. Все образцы ДНК хранили при -20°C. Изменения числа копий POLR2A определяли при использовании зондов TaqMan (Hs02023849_cn и Hs01252684_cn) и стандартного набора TaqMan PCR на системе Applied Biosystems 7900HT Sequence Detection System. Референсный ген TERT одновременно подвергали количественному анализу в той же пробирке для каждого образца ДНК.
[0088] Конъюгирование α-аманитина с антителом против EpCAM (HEA125). Конъюгат антитела-лекарственного средства ama-HEA125 конструировали путем сшивания α-аманитина с остатками лизина антитела HEA125 через стабильную линкерную структуру. HEA125 связывается с EpCAM-экспрессирующими клетками с высокой аффинностью (KD приблизительно 2,2×10-9 М) и высокой специфичностью. HEA125 очищали с помощью афинной хроматографии при использовании колонки с белок A-сефарозой CL-4B (GE Healthcare). α-Аманитин присоединяли к молекулам иммуноглобулина через стабильную в плазме карбамидную связь, предназначенную для высвобождения свободного α-аманитина в опухолевой клетке после лизосомального расщепления молекулы антитела. Соотношение антитела-лекарственного средства (DAR) молекулы α-аманитина:IgG составило 4:1. Биохимические свойства ama-HEA125 оценивали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) при использовании системы ВЭЖХ PlatinBlue (Knauer). Кроме того, HEA125 и ama-HEA125 анализировали с помощью восстанавливающего ДСН-ПААГЭ и окрашивания кумасси согласно стандартным методикам. Подтверждение связывания лекарственного средства с антителом выполняли с помощью иммуноблоттинга с антителом против аманитина с 30 нг HEA125 и ama-HEA125 при использовании стандартных методик.
[0089] Получение липосомных наночастиц. Молекулы миРНК для in vivo доставки инкапсулировали в ДОФХ (1,2-диолеил-sn-глицеро-3-фосфатидилхолин). ДОФХ и миРНК смешивали в присутствии избытка третичного бутанола при соотношении 1:10 (в/в) миРНК/ДОФХ. К смеси добавляли Tween 20 в соотношении 1:19 Tween 20:миРНК/ДОФХ. Смесь обрабатывали на вортексе, замораживали в бане с ацетоном/сухим льдом и лиофилизировали. Перед введением in vivo этот препарат гидратировали в PBS при комнатной температуре при концентрации 150-1000 мкг миРНК/кг на инъекцию (каждая мышь получила 200 мкл раствора ДОФХ:миРНК:PBS внутрибрюшинным путем).
[0090] Исследования ксенотрансплантатов опухолей. Самок мышей ДБО/ТКИД возрастом четыре-шесть недель приобретали в Jackson Laboratories и содержали в беспатогенных условиях. Все исследования были одобрены и контролировались Комитетом по институциональному уходу за животными и их использованию Онкологического центра им. М.Д. Андерсона. В случае использования при расчете мощности, настоящие эксперименты по предварительному определению объема выборки показали, что 5 мышей в группе могут обеспечить определение ожидаемого воздействия POLR2A на размер и вес опухоли (p<0,05) с 90% мощностью. Животных рандомизированно распределяли в разные группы. Dox-индуцируемые клетки HCT116 (1×106) и SNU283 (2×106) в 50 мкл среды для выращивания (смешанной с матригелем 1:1) вводили подкожно в бок при использовании микрошприца Hamilton на 100 мкл. Размер опухоли измеряли каждые пять дней при помощи штангенциркуля, и объем опухоли вычисляли при использовании стандартной формулы: 0,5×L×W2, где L - наибольший диаметр, а W - наименьший диаметр. Для ортотопической модели на мышах, ТКИД мышам делали анестезию и разрез на коже с обнажением слепой кишки. Dox-индуцируемые клетки HCT116 (1×106), экспрессирующие люциферазу, вводили в стенку слепой кишки при использовании 100 мкл микрошприца Hamilton, и затем разрез закрывали при помощи хирургических клипсов. Опухоли наблюдали с помощью системы IVIS после инъекции люциферина в течение 15 мин. После первоначального разрастания опухоли (100 мм3 для подкожных имплантатов и 2×108 фотонов/секунда, полный световой поток для ортотопических имплантатов) мышей обрабатывали 1 мкг мл-1 доксициклина в питьевой воде в течение 3-4 недель. Воду с доксициклином меняли раз в два дня.
[0091] Для исследований ксенотрансплантатов опухолей при использовании ДОФХ-инкапсулированных миРНК, изогенные пары клеток HCT116 (1×106) пересаживали в стенку слепой кишки с помощью 100 мкл микрошприца Hamilton. Через десять дней после инъекции клеток, мышей рандомизированно распределяли и определяли для получения контрольной миРНК-ДОФХ или POLR2A миРНК-ДОФХ. Последовательности миРНК являлись следующими: контрольная миРНК (5'-UUCUCCGAACGUGUCACGU-3' [SEQ ID NO: 19] и 5'-ACGUGACACGUUCGGAGAA-3' [SEQ ID NO: 20]); POL2 миРНК-1 (5'-CCAACAUGCUGACAGAUAU-3' [SEQ ID NO: 21] и 5'-AUAUCUGUCAGCAUGUUGG-3' [SEQ ID NO: 22]); POL2 миРНК-2 (5'-CCAAGAAGCGGCUCACACA-3' [SEQ ID NO: 23] и 5'-UGUGUGAGCCGCUUCUUGG-3' [SEQ ID NO: 24]). Дозу 150-1000 мкг миРНК/кг веса мыши вводили внутрибрюшинно с интервалами, два раза в неделю. Такой диапазон концентраций гарантирует эффективную доставку и нокдаун генов-мишеней, как описано ранее (Pecot et al., 2014).
[0092] Для исследований ксенотрансплантатов опухолей с использованием конъюгата антитела-лекарственного средства (ADC) α-аманитин-HEA125, изогенные пары клеток HCT116 (1×106), xhCRC (0,5×106), SW480 (1×106) или SW837 (2×106) пересаживали в стенку слепой кишки при использовании 100 мкл микрошприца Hamilton. Мышей, несущих 10-дневные опухоли, рандомизировали в пять групп (n=10 мышей/группа) и вводили две внутрибрюшинных дозы (с интервалом 1 неделя) следующего: 1) контрольное неконъюгированное мАт HEA125 в дозе 3,6 мг кг-1 массы тела; 2) Ama-HEA125 в дозе 90 мкг кг-1 в пересчете на α-аманитин (что соответствует 3,6 мг кг-1 IgG); 3) Ama-HEA125, 30 мкг кг-1 в пересчете на α-аманитин (что соответствует 1,2 мг кг-1 IgG); 4) Ama-HE125, 10 мкг кг-1 в пересчете на α-аманитин (что соответствует 0,4 мг кг-1 IgG); и 5) Ama-HEA125, 3 мкг кг-1 в пересчете на α-аманитин (что соответствует 0,12 мг кг-1 IgG). Опухоли наблюдали при помощи системы визуализации в реальном времени IVIS два раза в неделю после инъекции люциферина в течение 15 мин. Массу тела регистрировали раз в четыре дня. Кровь забирали из ретроорбитального синуса после анестезии в день 21 и уровни ферментов печени в крови (АСТ: аспартатаминотрансфераза, АЛТ: аланинаминотрансфераза и щелочная фосфатаза) определяли в отделениях Клинической патологии, Ветеринарии и Хирургии Онкологического центра им. М.Д. Андерсона.
[0093] Мышей усыпляли, когда они соответствовали институциональным критериям усыпления по размеру опухоли и общему состоянию здоровья. Опухоли удаляли, фотографировали и взвешивали. Недавно извлеченные ткани опухоли фиксировали в 10% буферизированном формалине в течение ночи, промывали PBS, переносили в 70% этанол, заливали в парафин, изготавливали срезы и окрашивали гематоксилином и эозином. Исследователи не были осведомлены относительно распределения в группах в ходе эксперимента и при оценке результата исследования.
[0094] Иммуногистохимия и микроматрица человеческих тканей толстой кишки. В Biomax приобретали микроматрицу тканей рака толстой кишки (BC051110a), содержащую 110 образцов опухолей толстой кишки и 10 образцов нормальной ткани толстой кишки. Образцы депарафинировали и регидратировали. Антиген выделяли при использовании 0,01 М натрий цитратного буфера (pH 6,0) при температуре ниже температуры кипения в течение 10 минут после кипячения в микроволновой печи. Для блокирования эндогенной пероксидазной активности, срезы инкубировали с 3% перекисью водорода в течение 10 минут. После 1 ч преинкубирования в 5% нормальной сыворотке козы для предотвращения неспецифичного окрашивания, образцы инкубировали с антителом против POLR2A (#sc-47701, Santa Cruz), Ki67, (#D3B5, Cell Signaling) или расщепленной каспазы-3 (#5A1E, Cell Signaling) при 4°C в течение ночи. Срезы инкубировали с биотинилированным вторичным антителом (биотинилированное антитело 4Plus против мышиного или кроличьего IgG, BioCARE), затем инкубировали с раствором авидин-биотин пероксидазного комплекса и проявляли при использовании набора DAB (диаминобензидин) субстрата (#550880, BD Biosciences) согласно протоколу производителя. Контрастное окрашивание выполняли при использовании модифицированного гематоксилина Харриса. Все иммуноокрашенные слайды сканировали на системе визуализации Automate Cellular Image System III (ACIS III) с целью количественного анализа при обработке цифрового изображения.
[0095] Биоинформационный анализ. Корреляцию между числом копий гена и соответствующей экспрессией гена анализировали при использовании данных, полученных из CCLE (адрес в Интернет broadinstitute.org/ccle) и TCGA (адрес в Интернет cbioportal.org/public-portal/), как описано ранее (Nijhawan et al., 2012). Обогащение коэффициентов корреляции Пирсона определяли при перестановке названий генов. Для определения, функционирует ли удаленный ген как ген домашнего хозяйства, сначала исследовали его профили экспрессии в опухолевых и нормальных тканях, а также его общие функции на основе литературных данных. Во-вторых, консервативность генов у различных видов и летальность нокаута гена проверяли при поиске в доступных базах данных модельных организмов (Saccharomyces Genome Database, WormBase, FlyBase и Mouse Genome Informatics). В-третьих, проверяли близость потенциального гена-мишени к гену TP53 и исследовали его коделецию с TP53 в злокачественных новообразованиях у человека. Наконец, линии раковых клеток с делецией TP53 и гена-мишени подбирали для проверки настоящей гипотезы.
[0096] Статистический анализ. Каждый эксперимент повторяли три раза или больше. Если не указано иное, данные представлены как средние и s.d. или s.e.m., и t-критерий Стьюдента (непарный, двусторонний) использовали для сравнения двух групп независимых выборок. В непарном t-критерии была принята равная дисперсия, при этом из анализа не исключили ни один образец. Статистические методы, используемые для анализа данных TCGA, описаны выше. p<0,05 считали статистически значимым.
Пример 1 - Экспрессия POLR2A, но не TP53, коррелирует с числом копий гена
[0097] Геномная делеция гена-супрессора опухоли часто охватывает множество соседних генов, которые могут не способствовать развитию рака, но важны для пролиферации клеток и выживания (Negrini et al., 2010). Такая частичная потеря подобных генов домашнего хозяйства, как предположили, делала раковые клетки крайне уязвимыми для дальнейшего ингибирования таких генов (Nijhawan et al., 2012). Анализ TCGA показал, что гемизиготная делеция гена TP53 часто происходит в большом количестве злокачественных новообразований человека (ФИГ. 1A). POLR2A идентифицировали как ген домашнего хозяйства вблизи от TP53 (расположен на удалении ~200 тысяч нуклеотидов в геноме человека), который важен для выживания клетки (ФИГ. 1B). Параллельная делеция POLR2A происходит фактически во всех человеческих опухолях толстой и прямой кишки, имеющих гемизиготную делецию TP53 (ФИГ. 1C).
[0098] Из двенадцати субъединиц в комплексе РНК-полимеразы II человека, POLR2A кодирует самую крупную субъединицу, которая обязательна для активности полимеразы в синтезе мРНК (Shalem et al., 2014). Ингибирование POLR2A специфичным ингибитором, α-аманитином, вызывает обширную гибель клеток, и, кроме того, гомозиготная делеция POLR2A летальна в клетках человека (Lindell et al., 1970; Shalem et al., 2014). Было обнаружено, что 104 (53%) из 195 случаев рака толстой и прямой кишки (CRC) имеют частичную потерю области 17p13, что приводит к параллельной делеции TP53 и POLR2A (ФИГ. 1C). Однако гомозиготной делеции POLR2A не наблюдали, что согласуется с концепцией, что POLR2A важен для выживания клетки. Анализ баз данных TCGA и CCLE показал, что экспрессия гена POLR2A непосредственно коррелирует с числом его копий (ФИГ. 1D). Такая положительная корреляция также подтверждалась в двадцати парах эквивалентных образцов нормальной ткани и ткани CRC, и микроматрицы человеческих тканей CRC (ФИГ. 1E, 5А и 5B, и Таблица 2). Число копий POLR2A определяли в наборе клеток рака толстой и прямой кишки (ФИГ. 1F) и обнаружили, что все три линии клеток POLR2Aloss (с гемизиготной потерей POLR2A) экспрессировали белки POLR2A на значительно более низких уровнях, чем линии клеток POLR2Aneutral (ФИГ. 1G и 1H). В отличие от POLR2A, уровни p53 определяются сложностью посттранскрипционных и посттрансляционных событий (Toledo and Wahl, 2006). Несмотря на корреляцию между числом копий и экспрессией мРНК TP53, уровни белка p53 не связаны с числом копий гена в опухолях и линиях клеток толстой и прямой кишки (ФИГ. 6A-6C и 1H).
Таблица 2. Гемизиготную потерю POLR2A в микроматрице человеческого рака толстой кишки (#BC051110a, Biomax) определяли с помощью анализа FISH
|
Пример 2 - Клетки POLR2Aloss высокочувствительны к ингибированию POLR2A
[0099] Для оценки чувствительности клеток с или без гемизиготной потери TP53/POLR2A к ингибированию POLR2A, набор клеток POLR2Aneutral (HCT116, SW480) и POLR2Aloss (SW837, SNU283) обрабатывали α-аманитином. Обработка α-аманитином в высоких концентрациях (≥1 мкг мл-1) сильно ингибировала рост клеток и вызывала полную гибель клеток во всех четырех клеточных линиях. Однако при концентрациях от 0 до 1,0 мкг мл-1 ингибирование α-аманитином оказывало значительно более высокое цитотоксическое воздействие на клетки POLR2Aloss, чем на контрольные клетки POLR2Aneutral (ФИГ. 2А и 2B). Полумаксимальная ингибирующая концентрация (IC50) составляла ~1,0 мкг мл-1 для клеток POLR2Aneutral, что было в 10 раз выше, чем в случае клеток POLR2Aloss. Напротив, клетки POLR2Aloss не показывали более высокой чувствительности к обработке актиномицином D, неспецифическим ингибитором транскрипции (ФИГ. 7A). На следующем этапе уязвимость клеток POLR2Aloss оценивали с помощью прямого конкурентного анализа. Скорость пролиферации клеток сравнивали у контрольных клеток и GFP-положительных клеток, экспрессирующих контрольные или POLR2A-специфические мшРНК. Две независимых мшРНК вызывали нокдаун экспрессии POLR2A на 50-70% во всех протестированных линиях клеток (ФИГ. 7B). После культивирования в шести пассажах, клетки POLR2Aneutral (HCT116, SW480), стабильно экспрессирующие мшРНК POLR2A, имели лишь немного пониженную пролиферацию по сравнению с соответствующими клетками, экспрессирующими контрольные мшРНК (ФИГ. 7C). Однако сайленсинг POLR2A в клетках POLR2Aloss (SNU283, SW837) привел к заметно пониженной пролиферации, что позволяет предположить, что гемизиготная потеря POLR2A делает раковые клетки более склонными к дальнейшему ингибированию POLR2A. Были получены линии клеток HCT116 и SNU283, стабильно экспрессирующие доксициклин (Dox)-индуцируемые мшРНК POLR2A (ФИГ. 7D). Несмотря на значительный нокдаун POLR2A, клетки HCT116 продолжали пролиферировать, тогда как клетки SNU283 демонстрировали резкую остановку клеточного цикла в фазе G1 и апоптоз (ФИГ. 2C, 2D и 7E-7G). Приблизительно 50% снижение экспрессии POLR2A (при добавлении 30-100 нг мл-1 Dox) заметно снижало пролиферацию клеток SNU283, но оказывало лишь незначительное воздействие на клетки HCT116 (ФИГ. 2D). После этого восстановительные эксперименты проводили в линиях клеток POLR2Aloss SNU283 и SW837. Постепенная реэкспрессия экзогенного POLR2A в обеих линиях клеток восстанавливала их устойчивость к α-аманитину до уровня, сопоставимого с устойчивостью POLR2Aneutral клеток HCT116 и SW480 (ФИГ. 2E, 2F и 8A-8B).
[00100] Чтобы исключить влияние различных генетических фоновых факторов на линии клеток, систему CRISPR (регулярно расположенные кластерами короткие палиндромные повторы)/Cas9 использовали для получения изогенной клеточной линии HCT116 с гемизиготной потерей POLR2A (Wang et al., 2014; Wang et al., 2013). Две единых направляющих РНК (sgРНК) создавали для направленного воздействия на второй экзон гена POLR2A (ФИГ. 9A). Они обе эффективно оказывали направленное воздействие и прерывали ген POLR2A, как было показано в анализе Surveyor (ФИГ. 9B). Одиночные колонии клеток HCT116, имеющих моноаллельную делецию POLR2A, отбирали и подтверждали с помощью секвенирования ДНК (ФИГ. 9C). Небольшая делеция в целевой области приводила к сдвигу открытой рамки считывания, в результате чего образовывался лишь короткий отрезок N-концевого пептида, не содержащий ни одного функционального домена POLR2A. В результате экспрессия POLR2A была значительно понижена в клетках POLR2Aloss (ФИГ. 9D). Клетки HCT116 POLR2Aloss и POLR2Aneutral демонстрировали аналогичные скорости пролиферации (ФИГ. 9E), что указывает на то, что один аллель POLR2A является достаточным, чтобы поддерживать пролиферацию и выживание клеток. Однако гемизиготная делеция POLR2A существенно повышала чувствительность клеток HCT116 к обработке α-аманитином с IC50 ~0,1 мкг мл-1, что в 8 раз ниже, чем у исходных клеток HCT116 (ФИГ. 2G и 2H). Что касается контроля, никаких значимых различий по их чувствительности к актиномицину D не наблюдали (ФИГ. 9F). Результат прямых конкурентных анализов продемонстрировал, что нокдаун POLR2A привел к заметно пониженной пролиферации в клетках POLR2Aloss, но не в изогенных клетках POLR2Aneutral (ФИГ. 9G). Также были получены клетки HCT116 POLR2Aloss и POLR2Aneutral, экспрессирующие Dox-индуцируемую мшРНК POLR2A. Повышенные концентрации Dox постепенно снижали экспрессию POLR2A. Хотя низкая доза Dox (100 нг мл-1) была достаточной для заметного уничтожения клеток POLR2Aloss, высокие дозы Dox оказывали минимальное воздействие на клетки POLR2Aneutral (ФИГ. 2I, 2J и 9H).
Пример 3 - Чувствительность клеток POLR2Aloss к ингибированию POLR2A не зависит от p53
[00101] Блокирование РНК-полимеразы может приводить к накоплению и активации p53 (Derheimer et al., 2007). Для исследования эффектов p53 в отношении реакции клеток на ингибирование POLR2A, одновременную делецию TP53 и POLR2A повторно проводили в линиях клеток HCT116 и xhCRC (ФИГ. 3А и 10A-10C). Линию клеток xhCRC (TP53 +/+; POLR2A +/+) получали из недавно выделенной ксенотрансплантированной человеческой колоректальной опухоли, которая демонстрировала повышенную онкогенность in vivo (Lu et al., 2013). За исключением немного повышенной пролиферации клеток, никаких значимых изменений в их чувствительности к α-аманитину не наблюдали ни в xhCRC, ни в HCT116 клетках с гемизиготной делецией TP53. В отличие от этого, гемизиготная потеря POLR2A заметно повышала чувствительность этих клеток к обработке α-аманитином, независимо от их статуса TP53 (ФИГ. 3B, 3C и 10D-10F). РНК-полимераза II отвечает за синтез мРНК, жизненно важную функцию для любого типа клеток, в том числе устойчивых к терапии опухолевых клеток. Исследовали лекарственную чувствительность клеток POLR2Aneutral и POLR2Aloss к трем главным химиотерапевтическим средствам для лечения рака толстой и прямой кишки (5-фторурацилу (5-ФУ), оксалиплатину и SN-38). Ингибирование POLR2A α-аманитином значительно усиливало цитотоксическое действие всех трех лекарственных средств в клетках POLR2Aloss xhCRC, но не оказывало никакого заметного действия в отношении клеток POLR2Aneutral (ФИГ. 3D), что указывает на терапевтическую чувствительность опухолей толстой и прямой кишки POLR2Aloss при терапии рака. Свободный α-аманитин токсичен для печени, поскольку его специфично связывает OATP1B3, белок-переносчик, экспрессирующийся исключительно на мембране гепатоцитов (Letschert et al., 2006). Однако α-аманитин при конъюгровании со специфичными антителами больше не является субстратом для OATP1B3 (Letschert et al., 2006; Moldenhauer et al., 2012; Faulstich and Fiume, 1985). Данная стратегия позволяет преодолеть токсичность α-аманитина для клинических применений. Использовали α-аманитин, конъюгрованный с моноклональным антителом (HEA125) против EpCAM (ama-HEA125), ракового антигена, повышенно экспрессируемого в большинстве аденокарцином (Moldenhauer et al., 2012; Went et al., 2004). Конъюгат ama-HEA125 селективно уничтожал POLR2Aloss раковые клетки xhCRC и HCT116 по p53-независимому механизму и уменьшал эффективные дозы α-аманитина по меньшей мере в 10000 раз (IC50 ~0,01 нг мл-1) in vitro (ФИГ. 3E и 10G).
Пример 4 - Супрессия POLR2A селективно ингибирует рост опухоли POLR2Aloss
[00102] Для проверки противоопухолевого действия при ингибировании POLR2A in vivo, клетки HCT116 и SNU283, экспрессирующие Dox-индуцируемую мшРНК POLR2A, подкожно вводили ТКИД мышам BALB/c с ослабленным иммунитетом. После первоначального разрастания опухоли введенние Dox в питьевой воде подавляло экспрессию POLR2A и, следовательно, ингибировало рост SNU283-производных опухолей (ФИГ. 4A). Однако никаких значимых различий не наблюдали между контрольными и HCT116-производными опухолями с нокдауном POLR2A. Гистопатологические анализы продемонстрировали, что опухоли SNU283 с нокдауном POLR2A (Dox: 1,0 мкг мл-1) имели значительно сниженную пролиферацию клеток (окрашивание на Ki67), но содержали большее количество апоптотических клеток (окрашивание на расщепленную каспазу-3) по сравнению с соответствующими контрольными опухолями (ФИГ. 11A-11B). Напротив, никаких значимых изменений в контрольных опухолях или опухолях HCT116 с нокдауном POLR2A не наблюдали. Впрочем, гетерозиготная делеция POLR2A сенсибилизировала POLR2A+/- HCT116-производные опухоли к супрессии Dox-индуцируемой POLR2A мшРНК (ФИГ. 11C). Затем ортотопическую модель опухоли использовали для проверки эффекта ингибирования POLR2A. Клетки HCT116 POLR2Aneutral и POLR2Aloss вводили в стену слепой кишки мышей с ТКИД. После разрастания ортотопических опухолей, мышами вводили Dox (1,0 мкг мл-1) в питьевой воде. In vivo биолюминесцентная визуализация опухолей продемонстрировала, что Dox-индуцированное ингибирование POLR2A приводило к значимому уменьшению кинетики роста опухоли в опухолях POLR2Aloss, но не в контрольной опухоли POLR2Aneutral (ФИГ. 4B-C). После 3-недельной обработки Dox, заметные опухоли наблюдали в группе POLR2Aneutral опухолей, тогда как значительно сниженный рост опухоли или отсутствие видимой опухоли отмечали в группе POLR2Aloss. Для дополнительной проверки эффективности сайленсинга POLR2A in vivo, платформу нанолипосомной доставки, ДОФХ (1,2-диолеил-sn-глицеро-3-фосфатидилхолин), использовали для системной доставки миРНК POLR2A (Pecot et al., 2014). Две специфичные миРНК POLR2A вызывали более чем 80% нокдаун белка POLR2A в изогенных клеточных линиях HCT116 (ФИГ. 12A). Через десять дней после ортотопической инъекции 1,0×106 изогенных клеток HCT116, мышей рандомизированно распределяли в группы лечения (n=10 мышей/группа). Начинали введение, два раза в неделю, миРНК, включенных в нанолипосомы ДОФХ (ФИГ. 12B). После четырех недель системной терапии, в сравнении с контролным лечением миРНК-ДОФХ, мыши в группах лечения 125 мкг кг-1 POLR2A миРНК-ДОФХ имели выраженное снижение роста опухолей POLR2Aloss, тогда как опухоли POLR2Aneutral показывали значимое ингибирование роста при дозе 1000 мкг кг-1 POLR2A миРНК-ДОФХ (ФИГ. 12C-F).
[00103] Конъюгат ama-HEA125 демонстрировал высокий уровень селективности в отношении раковых клеток POLR2Aloss in vitro (ФИГ. 3E и 10G). Затем исследовали противоопухолевую активность ama-HEA125 в ортотопических моделях опухолей, полученных из изогенных пар TP53/POLR2Aneutral и TP53/POLR2Aloss клеток xhCRC и HCT116 (ФИГ. 4D-4E и 13A-13B). В эксперименте с повышением дозы, ama-HEA125 вводили мышам-опухоленосителям в двойных внутрибрюшинных инъекциях при дозе 3, 10, 30 или 90 мкг в пересчете на α-аманитин на кг массы тела мыши (n=10 мышей в группе). Контрольные мыши получали неконъюгированное мАт HEA125 (n=10 мышей). В случае мышей, несущих опухоли POLR2Aloss, обработанные HEA125 контрольные мыши показывали непрерывный рост опухоли в течение 25 дней после инъекции антитела. Лечение ama-HEA125 показало сильное ингибирование роста опухоли даже при наименьшей дозе 3 мкг кг-1. Все опухоли POLR2Aloss поддавались лечению ama-HEA125, при этом объем опухоли существенно уменьшался (ФИГ. 4D-4E). Полную регрессию опухоли наблюдали у 10 из 10 (90 мкг кг-1), 8 из 10 (30 мкг кг-1) и 6 из 10 (10 мкг кг-1) мышей, несущих POLR2Aloss опухоли HCT116, через 25 дней после первого введения ama-HEA125 (ФИГ. 4D). В отличие от этого, значимое ингибирование опухоли наблюдали у мышей, несущих POLR2Aneutral опухоли, только при наиболее высокой дозе 90 мкг кг-1, но не при дозах 3-30 мкг кг-1. Подобные результаты наблюдали у мышей, несущих xhCRC-производные опухоли (ФИГ. 4E). В соответствии с предыдущими исследованиями (Moldenhauer et al., 2012), лечение ama-HEA125 в протестированных дозах не имело заметной токсичности in vivo. Анализ массы тела и ферментов печени в крови не выявил значимых различий между получавшей ama-HEA125 группой и контрольной группой, получавшей HEA125 (ФИГ. 13C и 13D), что предполагает незначительную системную токсичность конъюгата ama-HEA125. Кроме того, противоопухолевую активность ama-HEA125 также исследовали на ортотопических опухолях, полученных из POLR2Aneutral клеток SW480 и POLR2Aloss клеток SW837 (ФИГ. 14A-14F). Лечение ama-HEA125 в дозе 10 мкг кг-1 было достаточным для ингибирования роста опухоли во всех опухолях POLR2Aloss, тогда как POLR2Aneutral (SW480) или POLR2Aloss опухоли с повторно введенным POLR2A (SW837, экспрессирующие экзогенный POLR2A) показали значимое ингибирование лишь при дозе ama-HEA125 90 мкг кг-1.
[00104] Все способы, раскрытые и заявленные в настоящем документе, могут быть осуществлены и выполнены без излишних экспериментов с учетом настоящего описания. Хотя композиции и способы согласно настоящему изобретению были описаны в отношении предпочтительных вариантов осуществления, специалистам в данной области техники будет очевидно, что вариации могут применяться к способам и в этапах или в последовательности этапов описанного способа, без отступления от концепции, сущности и объема изобретения. В частности, будет очевидно, что некоторые средства, которые являются как химически, так и физиологически родственными, могут быть заменены средствами, описанными в настоящем документе, и при этом могут быть достигнуты такие же или сходные результаты. Все подобные аналогичные замены и модификации, очевидные для специалистов в данной области, считаются находящимися в рамках сущности, объема и концепции изобретения, как определено прилагаемой формулой изобретения.
Использованные источники
Следующие источники, в той степени, в какой они предоставляют примерные процедурные или другие детали, дополняющие представленные в настоящем документе, прямо включены в настоящий документ посредством отсылки.
Патент США 4,870,287
Патент США 5,091,513
Патент США 5,739,169
Патент США 5,760,395
Патент США 5,801,005
Патент США 5,824,311
Патент США 5,830,880
Патент США 5,846,945
Патентная публикация США 2005/0214860
Патентная публикация США 2009/0304666
Публикация PCT WO2012/119787
Austin-Ward and Villaseca, Revista Medica de Chile, 126(7):838-845, 1998.
Bensaude, "Inhibiting eukaryotic transcription: Which compound to choose? How to evaluate its activity?" Transcription, 2(3):103, 2011.
Bukowski et al., Clinical Cancer Res., 4(10):2337-2347, 1998.
Chene, "Inhibiting the p53-MDM2 interaction: an important target for cancer therapy," Nat. Rev. Cancer, 3(2):102, 2003.
Cheok et al., "Translating p53 into the clinic," Nat. Rev. Clin. Oncol., 8(1):25, 2011.
Christodoulides et al., Microbiology, 144(Pt 11):3027-3037, 1998.
Cong et al., "Multiplex genome engineering using CRISPR/Cas systems," Science, 339:819-823, 2013.
Davidson et al., J. Immunother., 21(5):389-398, 1998.
Derheimer et al., "RPA and ATR link transcriptional stress to p53," Proc. Natl. Acad. Sci. USA, 104(31):12778, 2007.
Faulstich and Fiume, "Protein conjugates of fungal toxins," Methods Enzymol., 112:225, 1985.
Goldstein et al., "Understanding wild-type and mutant p53 activities in human cancer: new landmarks on the way to targeted therapies," Cancer Gene Ther., 18(1):2, 2011.
Guschin et al., "A rapid and general assay for monitoring endogenous gene modification," Methods Mol. Biol., 649:247-256, 2010.
Hanibuchi et al., Int. J. Cancer, 78(4):480-485, 1998.
Haupt and Haupt, "Manipulation of the tumor suppressor p53 for potentiating cancer therapy," Semin. Cancer Biol., 14(4):244, 2004.
Hellstrand et al., Acta Oncologica, 37(4):347-353, 1998.
Hui and Hashimoto, Infection Immun., 66(11):5329-5336, 1998.
Lane et al., "p53-based cancer therapy," Cold Spring Harb. Perspect. Biol., 2(9):a001222, 2010.
Letschert et al., "Molecular characterization and inhibition of amanitin uptake into human hepatocytes," Toxicol. Sci., 91(1):140, 2006.
Lindell et al., "Specific inhibition of nuclear RNA polymerase II by alpha-amanitin," Science, 170(3956):447, 1970.
Liu et al., "Kaposi's sarcoma-associated herpesvirus-encoded microRNA miR-K12-11 attenuates transforming growth factor beta signaling through suppression of SMAD5," Journal of Virology, 86:1372-1381, 2012.
Lu et al., "Endothelial cells promote the colorectal cancer stem cell phenotype through a soluble form of Jagged-1," Cancer Cell, 23(2):171, 2013.
Moldenhauer et al., "Therapeutic potential of amanitin-conjugated anti-epithelial cell adhesion molecule monoclonal antibody against pancreatic carcinoma," J. Natl. Cancer Inst., 104(8):622, 2012.
Negrini et al., "Genomic instability--an evolving hallmark of cancer," Nat. Rev. Mol. Cell Biol., 11(3):220, 2010.
Nijhawan et al., "Cancer vulnerabilities unveiled by genomic loss," Cell, 150(4):842-854, 2012.
Pecot et al., "Therapeutic Silencing of KRAS Using Systemically Delivered siRNAs," Mol. Cancer Ther., 13(12):2876-2885, 2014.
Petitjean et al., "Impact of mutant p53 functional properties on TP53 mutation patterns and tumor phenotype: lessons from recent developments in the IARC TP53 database," Hum. Mutat., 28(6):622, 2007.
Qin et al., Proc. Natl. Acad. Sci. USA, 95(24):14411-14416, 1998.
Ran et al., "Genome engineering using the CRISPR-Cas9 system," Nature Protocols, 8:2281-2308, 2013.
Shalem et al., "Genome-scale CRISPR-Cas9 knockout screening in human cells," Science, 343(6166):84, 2014.
Toledo and Wahl, "Regulating the p53 pathway: in vitro hypotheses, in vivo veritas," Nat. Rev. Cancer, 6(12):909, 2006.
Vazquez et al., "The genetics of the p53 pathway, apoptosis and cancer therapy," Nat. Rev. Drug Discov., 7(12):979, 2008.
Wade et al., "MDM2, MDMX and p53 in oncogenesis and cancer therapy," Nat. Rev. Cancer, 13(2):83, 2013.
Wang et al., "Genetic screens in human cells using the CRISPR-Cas9 system," Science, 343(6166):80, 2014.
Wang et al., "One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering," Cell, 153(4):910, 2013.
Went et al., "Frequent EpCam protein expression in human carcinomas," Hum. Pathol., 35(1):122, 2004.