Результат интеллектуальной деятельности: Применение композиции наночастиц оксида меди и N-ацетилцистеина для индукции гибели клеток хронического миелоидного лейкоза
Вид РИД
Изобретение
Настоящее изобретение относится к области фармацевтики и медицины, конкретнее к композиции, предназначенной для индукции гибели клеток хронического миелоидного лейкоза, включающей наночастицы CuO (оксида меди двухвалентного) и N-ацетилцистеин.
Хронический миелоидный лейкоз (ХМЛ) - злокачественная опухоль из клеток белого ростка крови. В патогенезе ХМЛ важнейшую роль играет генетическое событие - транслокация участков 9-й и 22-й хромосом. Возникающий в результате генетической перестройки сливной (химерный) белок BCR-ABL является тирозинкиназой, фосфорилирующей белки-субстраты; активируются пути передачи внутриклеточных сигналов. BCR-ABL стимулирует ускоренную смену фаз клеточного цикла, пролиферацию и выживание клеток. В клетках миелоидной дифференцировки сигналинг посредством BCR-ABL приводит к малигнизации.
Первоначально для лечения ХМЛ применялись бусульфан, гидроксимочевина и интерферон - неспецифические цитостатики, но такое лечение сопровождалось выраженной общерезорбтивной токсичностью и низкой пятилетней выживаемостью.
В настоящее время для терапии ХМЛ разработаны и применяются более селективные агенты: ингибиторы BCR-ABL. Терапия приобрела направленный характер (таргетная терапия). Первым препаратом, изменившим подход к лечению, был иматиниб (STI571, Gleevec®). Его применение в ранних фазах заболевания приводило к полной ремиссии в 98% случаев (Druker В, Tamura S, Buchdunger Е, et al. Effects of a selective inhibitor of the Ab1 tyrosine kinase on the growth of Bcr-Ab1 positive cells. Nature Medicine 1996; 2(5): 561-566).
Однако, эффективность иматиниба в более поздних фазах заболевания падала до 34% и 31% для фазы акселерации и бластного кризиса, соответственно (Kerr D. J. et al. (ed.). Oxford textbook of oncology. - Oxford University Press, 2016.).
Частым явлением при применении иматиниба являлся рецидив заболевания спустя 10-12 месяцев. В этих ситуациях опухолевые клетки приобретали устойчивость к иматинибу. Выявлено два механизма такой устойчивости: 1) мутации в киназном домене ABL, приводящие к изменению в структуре полипептида, что препятствует успешному связыванию ингибитора с мишенью; 2) активация других сигнальных механизмов поддержания опухолевого фенотипа.
Для борьбы с мутационной устойчивостью опухолевых клеток были созданы следующие поколения ингибиторов: дазатиниб (BMS-354825, Spryce®) и нилотиниб (AMN107; Tasigna®), активные для большинства мутантных форм BCR-Ab1 за исключением замены остатка треонина на изолейцин в позиции 315 (T315I). Лишь с появлением понатиниба (АР24534; Iclusig®), препарата 3-го поколения, удалось получить препарат, действующий для опухоли с T315I.
Указанные препараты эффективны в случае лекарственной устойчивости, вызванной генетическими мутациями тирозинкиназы Ab1 Однако, если устойчивость опухолевых клеток обусловлена эпигенетическим событием - активацией других путей передачи внутриклеточных сигналов, помимо Bcr-Ab1 применения ингибиторов Bcr-Ab1 недостаточно. Такая устойчивость может быть вызвана, в частности, кооперацией опухолевых клеток и сигналами от микроокружения, поддерживающими злокачественный потенциал.
Таким образом, проблема создания соединений или их комбинаций, способных преодолевать кооперативную резистентность при хроническом миелоидном лейкозе, остается нерешенной в виду недостаточной изученности ее механизма.
Данную проблему пытались решить различными способами. Известно использование бусульфана и гидроксикарбамида. Эти лекарственные вещества применялись до изобретения тирозинкиназных ингибиторов, но вызывали значительные побочные эффекты - легочный фиброз, продолжительная аплазия костного мозга. В настоящее время такая терапия применяется в очень редких случаях как сдерживающий фактор (индукция) для опухоли перед введением ингибиторов.
Интерферон-альфа (IFNα) также использовался в клинической практике, но позже уступил место иматинибу как препарату с минимальной общерезорбтивной токсичностью. Важность IFN рассматривается именно для комбинированного лечения, однако каких-либо значительных результатов до сих пор получено не было.
Авторы настоящего изобретения связывают решение раскрытой выше проблемы с применением металлических наночастиц в комбинации с N-ацетилцистеином.
Использование наночастиц металлов в терапии опухолей известно из уровня техники. Например, авторами (Jin Y. et al. Hyaluronic acid modified tantalum oxide nanoparticles conjugating doxorubicin for targeted cancer theranostics //Bioconjugate chemistry. - 2015. - T. 26. - №. 12. - С. 2530-2541; Podsiadlo P. et al. Gold nanoparticles enhance the anti-leukemia action of a 6-mercaptopurine chemotherapeutic agent //Langmuir. - 2008. - T. 24. - №. 2. - C. 568-574.) показано, что применение наночастиц в качестве переносчиков повышает эффективность химиотерапевтических агентов. Однако, в случае лекарственной устойчивости этого может оказаться недостаточно, так как требуется собственно противоопухолевое средство, способное преодолевать молекулярный механизм устойчивости.
Известны также работы, в которых введение наночастиц металлов (медь, цинк, железо или золото) приводит к замедлению роста опухоли и ее регрессии (Патент РФ №2417942 от 25.09.2009; Патент РФ №2392668 от 15.12.2008). Затруднение заключается в том, что токсический эффект проявляется в довольно высоких концентрациях, которые неминуемо сказываются на функционировании и жизнеспособности неопухолевых клеток (общерезорбтивная токсичность).
Настоящее изобретение направлено на решение этой проблемы и устранение недостатков, присущих известным ранее решениям.
Заявлена композиция, предназначенная для индукции гибели клеток ХМЛ, включающая наночастицы CuO и N-ацетилцистеин (NAC) в качестве активных агентов в эффективных количествах.
Причем данная композиция эффективна также в отношении клеток хронического миелоидного лейкоза, обладающих лекарственной устойчивостью. Такая устойчивость может быть обусловлена мутациями в киназном домене ABL. Лекарственная устойчивость может быть обусловлена и активацией других сигнальных механизмов поддержания опухолевого фенотипа, в частности, кооперацией опухолевых клеток и сигналами от микроокружения, поддерживающими злокачественный потенциал.
Эффективность композиции в отношении различных типов ХМЛ обусловлена тем, что наночастицы оксида меди (CuO) проявляют цитотоксический эффект из-за генерации окислительного стресса, который значительно усиливается в присутствии NAC и приводит к гибели опухолевых клеток вне зависимости от отдельных генетических событий (мутаций) или межклеточных взаимодействий.
N-ацетилцистеин (NAC) - производное аминокислоты цистеин с ацетильной группой при атоме азота. В отечественной фармакологии NAC применяется для лечения и профилактики воспалительных заболеваний дыхательных путей. Антиоксидантные свойства реализуются за счет наличия тиольной (-SH) группы.
Технический результат изобретения состоит в эффективности композиции в отношении индукции гибели клеток ХМЛ различных типов, вне зависимости наличия у них устойчивости к другим противоопухолевым препаратам, например, к ингибиторам BCR-ABL, кооперативной устойчивости. Лекарственная устойчивость может быть обусловлена мутациями в киназном домене ABL или активацией других сигнальных механизмов поддержания опухолевого фенотипа, в частности, кооперацией опухолевых клеток и сигналами от микроокружения, поддерживающими злокачественный потенциал.
Совместное (комбинационное) применение наночастиц CuO и NAC приводит к возникновению синергетического эффекта: NAC не вызывает гибель клеток ХМЛ в разумных концентрациях, а применение наночастиц CuO как самостоятельного противоопухолевого агента неэффективно, поскольку они действуют в высоком диапазоне концентраций, оказывая негативное действие на неопухолевые клетки. Предлагаемая композиция эффективна в низком диапазоне концентраций каждого компонента.
Размеры наночастиц CuO, используемых в настоящем изобретении предпочтительно варьируются от 20 до 110 нм.
Например, средний размер наночастиц может составлять 80±20 нм.
Концентрация наночастиц в композиции может варьироваться от 0,1 до 50 μM, предпочтительно от 0,625 до 5 μM.
NAC, используемый в настоящем изобретении, может представлять собой N-ацетил-L-цистеин, N-ацетил-D-цистеин или их смесь.
Концентрация NAC в композиции может варьироваться от 0,1 до 50 mM, предпочтительно от 0,156 до 5 mM.
Композиция может содержать по меньшей мере один фармацевтически приемлемый носитель.
Таким носителем может быть вода, изотонический раствор или буферный раствор (фосфатный, ацетатно-аммиачный и др.), либо раствор глицерина в воде до 30%. Список изображений:
Рис. 1. Выживаемость культуры клеток К-562 (хронический миелоидный лейкоз) различной плотности при инкубации с различными концентрациями ингибитора тирозин-киназы BCR-ABL PF-114.
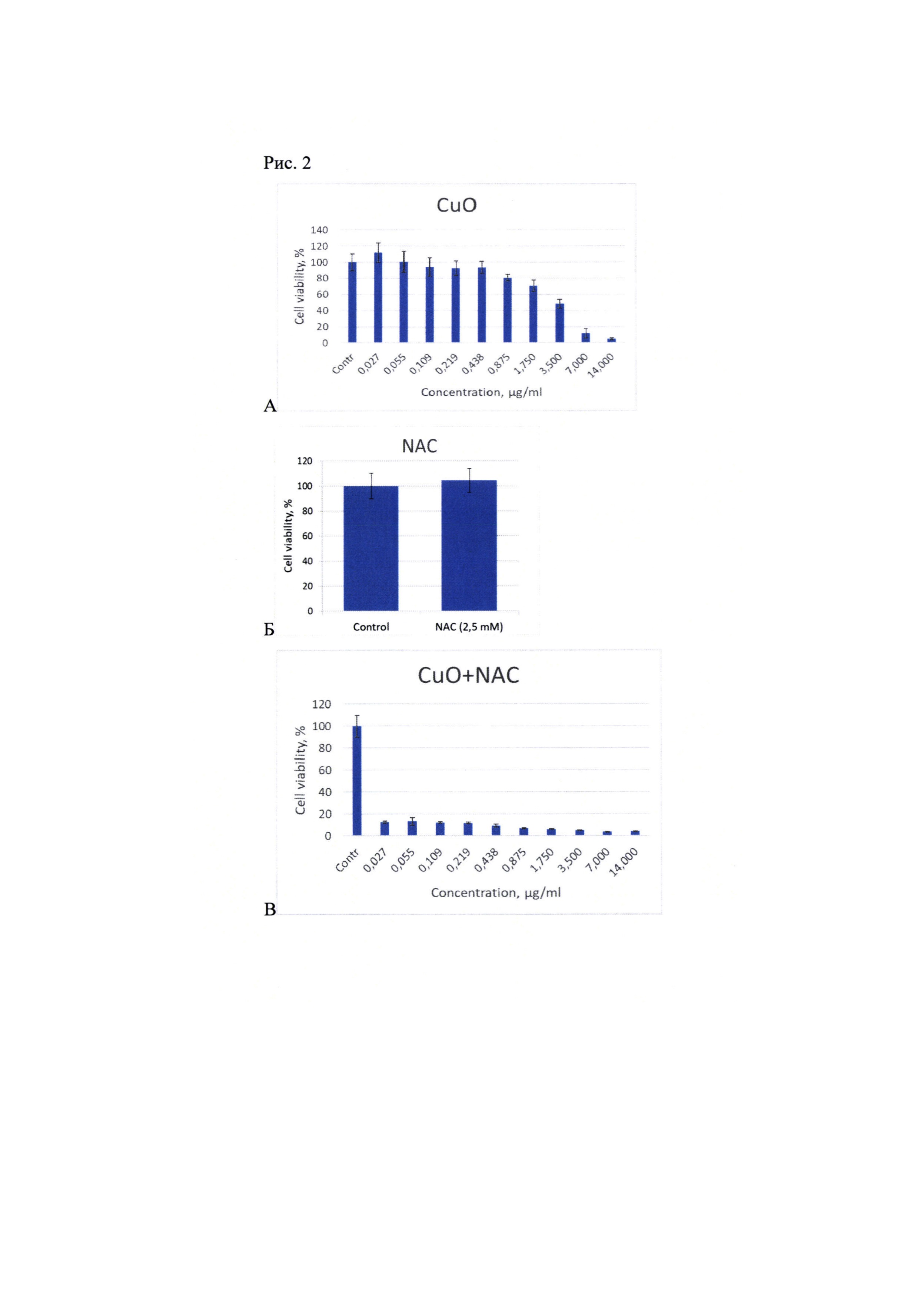
Рис. 2. Выживаемость клеток (%) при добавлении наночастиц CuO в моновоздействии (A), NAC 2,5 мМ (Б) и комбинации CuO + NAC (В). Плотность клеточной культуры 25 тыс/мл.
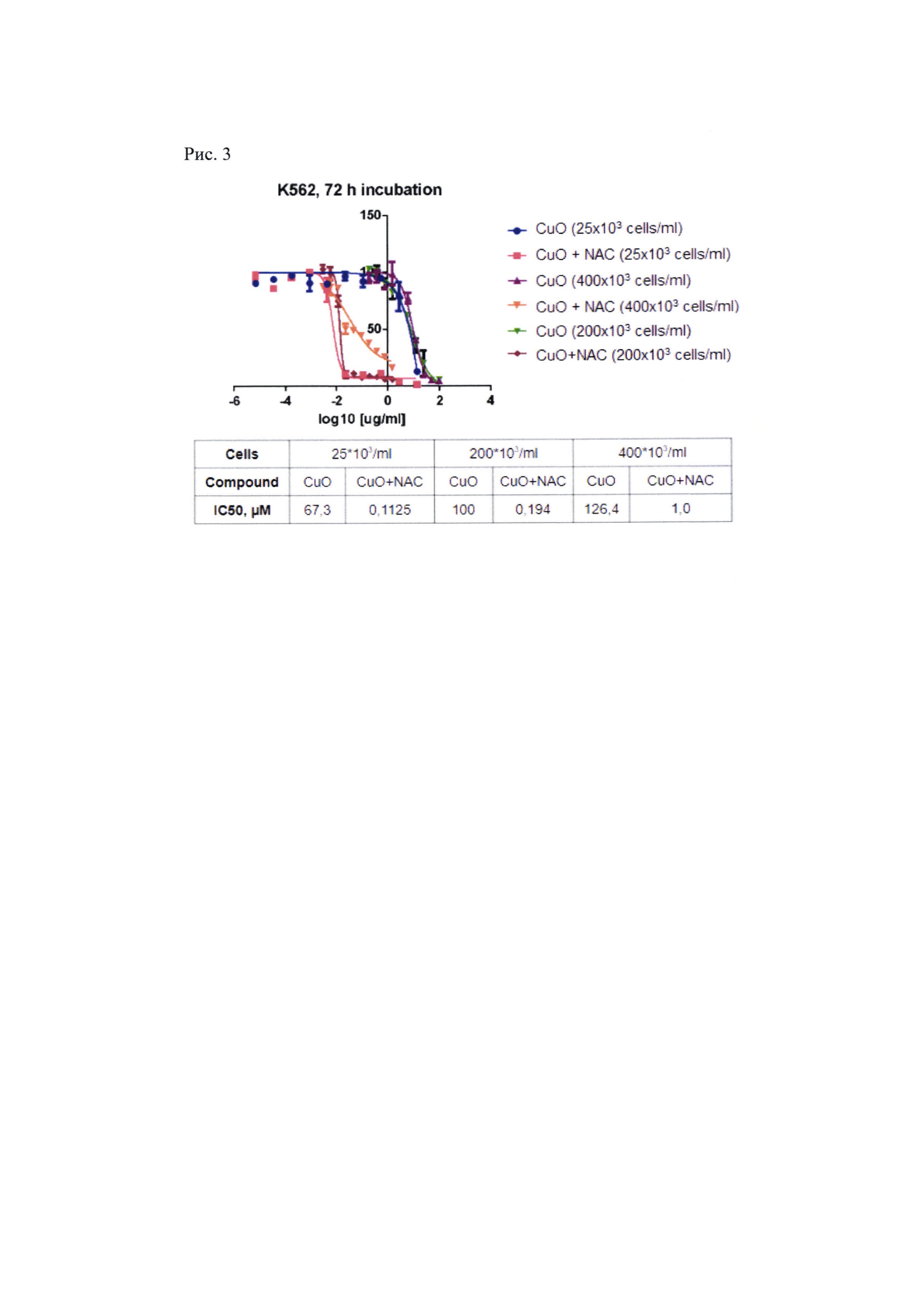
Рис. 3. Сравнение показателей IC50 для CuO и CuO + NAC при разной плотности клеточной культуры.
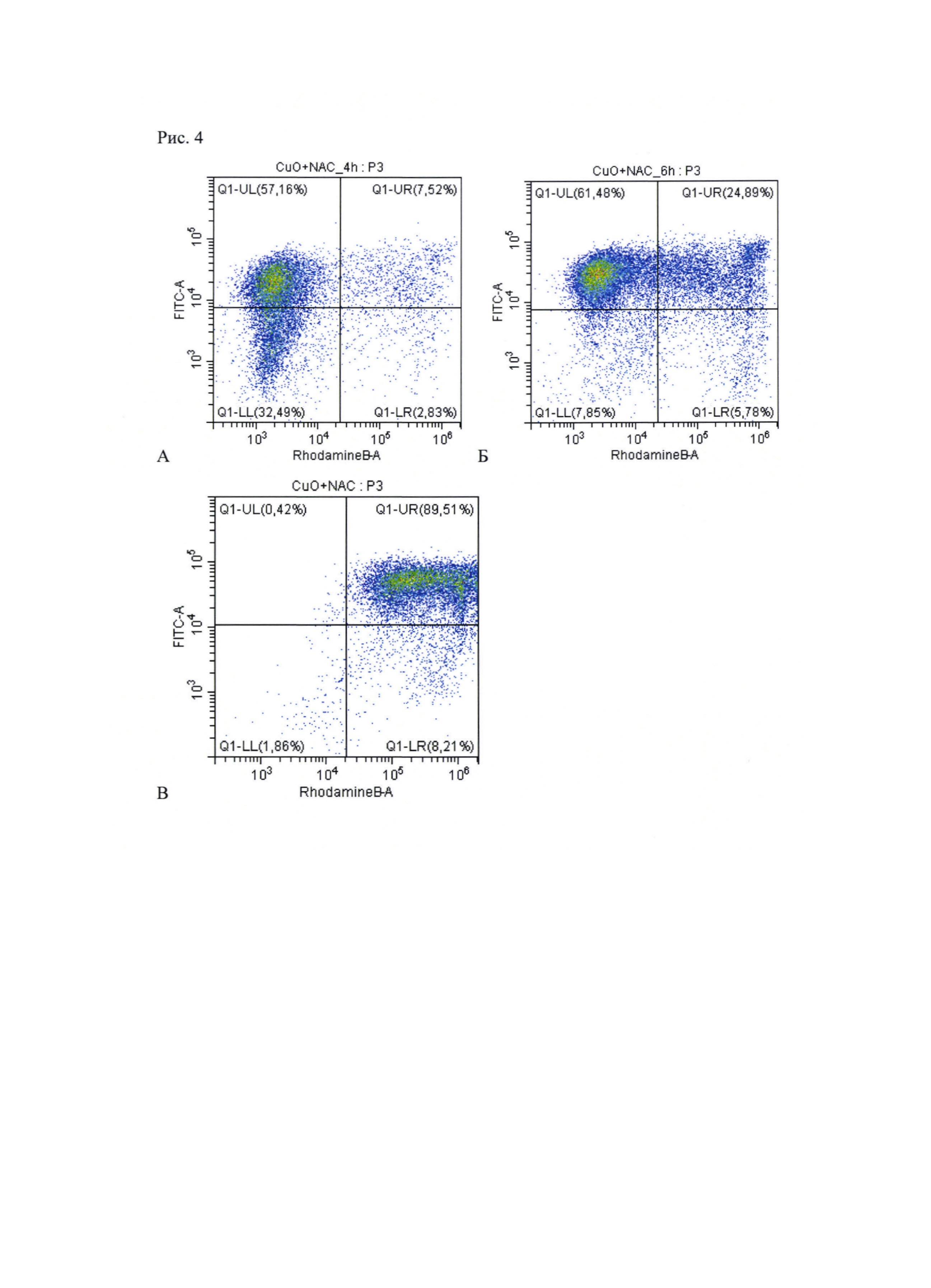
Рис. 4. Окрашивание Аннексин-PI для клеток с добавлением CuO + NAC:
А: Через 4 часа. Б: 6 часов. В: 24 часа.
Примеры:
1. Получение наночастиц
Наночастицы CuO синтезированы методом осаждения, используя CuSO4*3H2O в качестве предшественника. Его растворяли до концентрации 0,02М в 50 мл дистиллированной воды, нагревали до 80-90°С при постоянном интенсивном помешивании и добавляли 2 мл 0,1 М NaOH. Признаком успешного прохождения реакции было изменение цвета раствора с ярко-синего на черный. Затем осадок отмывали в этаноле и воде. Размер частиц (80±23 нм) установлен измерениями динамического рассеяния света с помощью анализатора размера частиц.
2. Приготовление композиции
Приготовление композиции осуществлялось непосредственно перед применением прямо в культуральной среде: RPMI с добавлением 5% эмбриональной сыворотки теленка и 0,5% гентамицина. К 2 мл среды, содержащей раковые клетки, добавили 0,2 мкл раствора наночастиц CuO в концентрации 0,14% (1,4 мкг/мл) и 5 мкл N-ацетилцистеина - 500 мМ.
3. Индукция гибели клеток ХМЛ
Резистентность ХМЛ к ингибиторам BCR-ABL моделируют культивированием клеток ХМЛ (линия К562) в повышенной плотности (4×105 клеток в 1 мл питательной среды), поскольку в плотной культуре повышена возможность паракринных межклеточных взаимодействий и возникновение "кооперативной" резистентности (Рис. 1).
В моновоздействии наночастицы CuO проявляли умеренный токсический эффект по отношению к клеткам ХМЛ (линия К562). Добавление NAC повысило токсичность наночастиц оксида меди на 2-3 порядка (Рис. 2).
Цитотоксичность CuO, NAC и их комбинации оценивали в МТТ-тесте. Клетки линии К562 рассевали в 96-луночные планшеты по 5×103 или 80*103 в 180 мкл среды RPMI с добавлением 5% эмбриональной сыворотки теленка и 0,5% гентамицина. В лунки вносили NAC и CuO в различных концентрациях. Культуры инкубировали 72 ч при 37°С, 5% СО2 в увлажненной атмосфере. По окончании инкубации в лунки добавляли по 20 мкл (100 мкг) водного раствора бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия (МТТ; 5 мг/мл), инкубировали 2 ч в тех же условиях, среду удаляли, клетки ресуспендировали в 100 мкл диметилсульфоксида и измеряли оптическую плотность раствора при длине волны 570 нм. Процент клеток, выживших при действии каждой дозы исследуемого соединения, подсчитывали как частное от деления оптической плотности в лунках (среднее значение 3-х измерений) после инкубации с данной концентрацией к средней оптической плотности контрольных лунок (значения последней принимали за 100%).
В результате выяснилось, что при плотности клеточной культуры 25000 шт/мл IC50 (концентрация вещества, при которой гибнет половина клеточной популяции) для наночастиц CuO составляет около 67 мкМ, а при добавлении NAC в концентрации 2,5 мМ уменьшается до 0,1125 мкМ, т.е. токсичность увеличивается в 520 раз. В плотной культуре (400 тыс/мл) эти значения несколько увеличиваются: для наночастиц CuO в моновоздействии до 126 мкМ; комбинации до 1 мкМ при той же концентрации NAC (Рис. 3). Однако, во-первых, разница в концентрациях остается высокой по сравнению с моновоздействием, а, во-вторых, ингибиторы BCR-Ab1 в аналогичных условиях не вызывают гибель опухолевых клеток, в отличие от комбинации CuO + NAC.
Для выяснения механизма гибели опухолевых клеток использовали окрашивание аннексином V, конъюнгированным с флуоресцеинизотиоцианатом (ФИТЦ) и иодидом пропидия (ИП), флуоресцирующем в канале фикоэритрина (ФЭ). По свечению клеток в том или другом канале судят об апоптозе (флуоресценция в канале ФИТЦ), некрозе (флуоресценция в канале ФЭ) или сочетании механизмов гибели (свечение в обоих каналах). Через 4 ч после добавления комбинации (0,7 мкг/мл CuO; 2,5 мМ NAC) к культуре клеток наблюдали увеличение интенсивности свечения в канале ФИТЦ, но не в канале ФЭ. Спустя еще 2 ч большинство клеток флуоресцировало в канале ФИТЦ, а часть популяции - и в канале ФЭ. Через 24 ч практически все клетки флуоресцировали в обоих каналах (Рис. 4). Это означает, что первоначальный апоптоз клеток дополняется некротическим компонентом - повреждением целостности плазматической мембраны; клетки получают нерепарируемые повреждения.
Кроме того, добавление ингибитора каспаз Z-VAD не влияло на выживаемость, что говорит о независимости гибели от активности каспаз и делает композицию эффективной в отношении различных типов ХМЛ.