Результат интеллектуальной деятельности: Способ выявления ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных с помощью полимеразной цепной реакции в режиме реального времени
Вид РИД
Изобретение
Изобретение относится к ветеринарной микробиологии, в частности к лабораторной диагностике возбудителей инфекционных заболеваний, а именно к средствам диагностики инфекции у животных с помощью полимеразной цепной реакции.
Известно использование ПЦР в реальном времени для определения ДНК вируса нодулярного дерматита КРС включающий отбор проб патологического материала из очага инфекционного заболевания от всех животных, находящихся в очаге инфекционного заболевания, и проведение экспресс-диагностики полученного патологического материала в течение суток методом ПЦР с флуоресцентным учетом результатов в режиме реального времени с применением термоциклера типа RotorGene для выявления животных-носителей вируса нодулярного дерматита на начальной стадии инфицирования, при этом учет результатов ПЦР проводят по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, если наблюдают рост специфического сигнала, то образец считают положительным - вирус нодулярного дерматита КРС присутствует, при этом значения контрольных образцов находятся в пределах нормы, если не наблюдают рост специфического сигнала, то образец считают отрицательным - вирус нодулярного дерматита крупного рогата скота отсутствует, и значения контрольных образцов также находятся в пределах нормы (патент RU 2648773, кл. G01N 33/533, 2018 г.).
Недостатком известного технического решения является, то что - не достаточно раскрыт, чтобы можно было использовать для диагностики вируса нодулярного дерматита у животных, т.к. не представлены олигонуклеотидные праймеры и флуоресцентно-меченные зонды, используемые для ПЦР в качестве внутреннего и положительного контролей.
Также известен способ для выявления генома полевых изолятов вируса заразного узелкового дерматита (нодулярного дерматита) КРС в реакции полимеразной цепной реакции в режиме реального времени с использованием олигонуклеотидных праймеров и флуоресцентно-меченого зонда для амплификации и детекции фрагмента гена наружного капсидного белка EEV вируса заразного узелкового дерматита (ЗУД) КРС (патент RU 2668398, кл. C12Q 1/68, 2018 г.).
Однако способ предназначен для выявления генетического материала полевого вируса ЗУД КРС в биологических и культуральных образцах для постановки и уточнения диагноза, для решения научно-исследовательских задач по мониторингу распространения вируса ЗУД КРС среди восприимчивых животных методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени (РВ) с использованием олигонуклеотидных праймеров и флуоресцентно-меченого зонда для амплификации и детекции фрагмента гена наружного капсидного белка EEV вируса заразного узелкового дерматита (ЗУД) КРС.
Наиболее близким по технической сущности является изобретение по патенту RU №2680094, кл. C12Q 1/68, 2019 г., которое включает: выделение ДНК возбудителя инфекционного заболевания из биологического материала инфицированного животного сорбционным методом, постановку одноэтапной полимеразной цепной реакции с флуоресцентной детекцией с проведением 40 циклов амплификации в реальном времени с использованием специфичных для участка генома ДНК возбудителя инфекционного заболевания животного олигонуклеотидных праймеров, зондов, флуоресцентных красителей, внутреннего контрольного образца в виде суспензии бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл и положительного контрольного образца в виде смеси содержащую в одинаковом объемном соотношении фрагменты геномов возбудителя инфекционного заболевания животного и бактериофага Т4 с нуклеотидной последовательностью:
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: СУ5-5'-ACATTGGCACTGACCGAGTTC-3' -BHQ1 - зонд, измерение накопления флуоресцентных сигналов по каналам соответствующих флуоресцентных красителей для специфического сигнала тестирования наличия возбудителя инфекционного заболевания животного и по каналу FAM/Green для внутреннего контрольного образца, проведение интерпретации результатов на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Недостатком известного технического решения является отсутствие возможности выявления ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных, недостаточная чувствительность из-за использования суспензии бактериофага для внутреннего контрольного образца, которая требует предварительную обработку, включая центрифугирование, концентрирование и перевод в определенный буферный раствор, что влечет за собой значительную трудоемкость и финансовые затраты.
Техническим результатом является расширение функциональных возможностей, повышение чувствительности и упрощение процесса подготовки внутреннего контрольного образца, а также уменьшение стоимости этого процесса.
Технический результат достигается тем, что в способе выявления ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных с помощью полимеразной цепной реакции в режиме реального времени, включающем выделение ДНК возбудителя инфекционного заболевания из биологического материала инфицированного животного сорбционным методом, постановку одноэтапной полимеразной цепной реакции с флуоресцентной детекцией с проведением 40 циклов амплификации в реальном времени с использованием специфичных для участка генома ДНК возбудителя инфекционного заболевания животного олигонуклеотидных праймеров, зондов, флуоресцентных красителей, внутреннего контрольного образца в виде суспензии бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл и положительного контрольного образца в виде смеси содержащую в одинаковом объемном соотношении фрагменты геномов возбудителя инфекционного заболевания животного и бактериофага Т4 с нуклеотидной последовательностью:
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: СУ5-5'-ACATTGGCACTGACCGAGTTC-3' -BHQ1 - зонд, измерение накопления флуоресцентных сигналов по каналам соответствующих флуоресцентных красителей для специфического сигнала тестирования наличия возбудителя инфекционного заболевания животного и по каналу FAM/Green для внутреннего контрольного образца, проведение интерпретации результатов на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный, согласно изобретению выделяют ДНК вируса нодулярного дерматита (LSDV) из биологического материала животных и для внутреннего контрольного образца используют фаголизат бактериофага Т4, а для положительного контрольного образца - фрагменты геномов нативного бактериофага Т4 и фрагмент генома вируса нодулярного дерматита (LSDV) со следующей нуклеотидной последовательностью:
LSDV-F 5-TTTAGGAGATAAGATTGTCAC-3' прямой праймер
LSDV-R 5'-GGAGATTTTATTATGAGTGGC-3' обратный праймер
LSDV-P ROX-5'-GGTTAATTTTTTACCACAAATAGG-3' -BHQ2 зонд, при этом для ДНК вируса нодулярного дерматита (LSDV) используют флуоресцентный краситель - ROX/Orange.
Новизна заявляемого способа состоит в идентификации ДНК вируса нодулярного дерматита с помощью полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени с использованием специфичных для участка генома олигонуклеотидных праймеров флуоресцентно-меченного зонда и разных видов контроля для которых используют различные формы материала бактериофага Т4: фаголизат и фрагмент нативного генома со специфическими к нему праймерами и зондом. Такая постановка ПЦР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации. Кроме того, флуоресцентная детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонуклеотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в специализированных ветеринарных, санитарно-эпидемиологических, животноводческих, сельскохозяйственных предприятиях, что соответствует критерию «промышленная применимость».
Способ выявления ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных с помощью полимеразной цепной реакции в режиме реального времени осуществляется следующим образом.
Предварительно выделяют ДНК из биологического материала животного сорбционным методом. В качестве биологического материала может быть использованы: цельная кровь, фрагменты пораженных кожных покровов (высыпания, корки, узелковые поражения - нодулы), легких, бронхов, селезенки, лимфоузлы, мазки со слизистых конъюнктивы и ротоглотки, молоко и сперма, которые подвергают определенной обработке.
Проводят полимеразную цепную реакцию с флуоресцентной детекцией с проведением 40 циклов амплификации в реальном времени с использованием специфичных для участка генома ДНК вируса LSDV олигонуклеотидных праймеров, зондов, флуоресцентных красителей: для специфического сигнала для ДНК вируса нодулярного дерматита (LSDV) используют флуоресцентный краситель - ROX/Orange и для внутреннего контрольного образца в виде фаголизата бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл - FAM/Green. Для положительного контрольного образца используют смесь, содержащую в одинаковом объемном соотношении фрагменты геномов вируса нодулярного дерматита (LSDV) и нативного бактериофага Т4 со следующими нуклеотидными последовательностями:
LSDV-F 5-TTTAGGAGATAAGATTGTCAC-3' прямой праймер
LSDV-R 5'-GGAGATTTTATTATGAGTGGC-3' обратный праймер
LSDV-P ROX-5'-GGTTAATTTTTTACCACAAATAGG-3 '-BHQ2 зонд
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: FAM-5'-ACATTGGCACTGACCGAGTTC-3' -BHQ1 - зонд. Затем измеряют накопления флуоресцентных сигналов по каналам соответствующих флуоресцентных красителей, проводят интерпретацию результатов на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считается положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Для повышения точности идентификации вируса нодулярного дерматита (LSDV) для внутреннего контрольного образца используют фаголизат бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл, если концентрация фаговых частиц отклоняется в большую или меньшую сторону, то наблюдаются повторности сомнительных образцов. Для положительного контрольного образца используют смесь, содержащую фрагменты геномов нативного бактериофага Т4 и ДНК вируса нодулярного дерматита (LSDV) взятых в соотношении 1:1, со следующими нуклеотидными последовательностями:
LSDV-F 5-TTTAGGAGATAAGATTGTCAC-3' прямой праймер
LSDV-R 5'-GGAGATTTTATTATGAGTGGC-3' обратный праймер
LSDV-P ROX-5'-GGTTAATTTTTTACCACAAATAGG-3' -BHQ2 зонд,
T4F: 5'-TACATATAAATCACGCAAAGC-3' - прямой праймер
T4R: 5'-TAGTATGGCTAATCTTATTGG-3' - обратный праймер
Т4Р: FAM-5'-ACATTGGCACTGACCGAGTTC-3' -BHQ1 - зонд.
Использование для разных видов контроля различные формы материала бактериофага Т4: фаголизата и фрагмента генома нативного бактериофага Т4 со специфическими к нему праймерами и зондом обусловлено тем, что это позволяет контролировать корректное прохождение реакции в каждой пробирки, а также контролируется этап выделения ДНК из образцов. Кроме того, использование фаголизата бактериофага Т4, представляющего собой суспензию бактериофага, полученную после лизиса зараженных фагом клеток ткани, повышает чувствительность и упрощает процесс идентификации вируса нодулярного дерматита. Использование нативного бактериофага, т.е. неповрежденного при исследовании, улучшает синтез ДНК, что также улучшает качество процесса идентификации.
При конструировании праймеров и зонда основными требованиями были: степень гомологии (комплементарность) с выбранным участком гена; отсутствие самокоплементарных участков внутри олигонуклеотидов и комплементарности друг другу, чтобы не допускать возникновения устойчивых вторичных структур (димеров); близость значений температуры отжига праймеров.
Конструирование специфических праймеров и зонда осуществляли с помощью компьютерных программ на основании анализа нуклеотидных последовательностей референтных штаммов и изолятов, опубликованных на ресурсе GenBank и подбора условий для проведения ПЦР в реальном времени с применением разработанных праймеров и зонда, несущего флуорофор и тушитель, и комплементарного части амплифицируемого со специфическими праймерами фрагмента. 1 Праймеры, специфичные для генома вируса нодулярного дерматита выбраны на участке между 18200 и 19000 нуклеотидами последовательности ДНК генома, кодирующей гипотетический белок гликопротеина (Lumpy skin disease virus strain LSDV/Russia/Saratov/2017, complete genome 150606 bp DNA linear VRL 18-NOV-2018, код доступа MH646674).
Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность. Для детекции продуктов амплификации были подобраны олигонуклеотидные флуоресцентно-меченные зонды LSDV-P (комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров LSDV-F и LSDV-R) Зонд был помечен красителем ROX (карбокси-Х-родамин - длина волны возбуждения -580 нм, флуоресценции - 602 нм.). Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР. Ни одна из выбранных последовательностей не обнаружена в геноме любых видов животных:
LSDV-F 5-TTTAGGAGATAAGATTGTCAC-3' прямой праймер
LSDV-R 5'-GGAGATTTTATTATGAGTGGC-3' обратный праймер
LSDV-P ROX-5'- GGTTAATTTTTTACCACAAATAGG-3' -BHQ2 зонд.
В качестве внутреннего контроля использовался фаголизат бактериофага Т4, имеющий геномную ДНК порядка 170 тысяч пар нуклеотидов (Enterobacteria phage Т4Т, complete genome GenBank: НМ13 7666.1). В результате анализа был выбран участок между 400 и 600 нуклеотидами, содержащий уникальные нуклеотидные последовательности, рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих выбранный участок генома. Праймеры были спроектированы с использованием Primer Express Software v3.0 (Applied Biosystems) и исследованы с использованием BLAST, чтобы подтвердить их специфичность.
Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентно-меченный зонд Т4Р, комплементарный участку нуклеотидной последовательности, ограниченной позициями отжига праймеров T4F и T4R. Зонд был помечен красителем FAM (Карбоксифлуоресцеин - длина волны возбуждения - 490 нм, флуоресценции - 520 нм). Используя программу "Oligo 6.0" описаны основные свойства рассчитанных олигонуклеотидов, определившие возможность их использования в ПЦР.
T4F TACATATAAATCACGCAAAGC прямой праймер
T4R TAGTATGGCTAATCTTATTGG обратный праймер
Т4Р FAM-5'-ACATTGGCACTGACCGAGTTC зонд.
Пример конкретного осуществления способа выявления ДНК вируса нодулярного дерматита (LSDV) в биологическом материале животных с помощью полимеразной цепной реакции в режиме реального времени
Для исследования используют следующий материал:
1. Цельная кровь (в ранний период заболевания, во время виремии). Кровь забирается в пробирку с 3-6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают.
2. Фрагменты пораженых кожных покровов (высыпания, корки, узелковые поражения-нодулы), легких, бронхов, селезенки отбирают в стерильный контейнер.
3. Лимфоузлы берут на исследование целиком.
4. Мазки со слизистых конъюнктивы и ротоглотки снимают с помощью стерильного зонда, зонд помещают в пластиковую микропробирку объемом 1,5 мл с 0,5 мл стерильного физиологического раствора/фосфатного буфера/транспортной среды.
5. Молоко отбирают в объеме 10-30 мл в стерильную посуду;
6. Сперму (0,5-1 мл) отбирают в стерильный контейнер.
Полученные образцы можно транспортировать и хранить в следующих режимах:
- при комнатной температуре - в течение 48 часов;
- при температуре от 2 до 8°С - в течение двух недель;
- при температуре не выше минус 20°С - в течение месяца;
- при температуре не выше минус 68°С - длительно,
- оттаивание биологического материала.
Чтобы избежать ложноположительных результатов необходимо после вакцинации выдержать 3-4 недели перед сдачей анализа.
Далее исследуемые образцы обрабатывают следующим образом:
Мазки со слизистых конъюнктивы, ротоглотки, пробы цельной крови, молоко исследуют без предварительной подготовки.
Сперму разводят физиологическим раствором 1:3, тщательно перемешивают на вортексе. Для экстракции ДНК используют аликвоту 0,1 мл суспензии.
Из тканей и органов вырезают небольшие кусочки до 1 г весом. Растирают пробы в фарфоровых ступках или гомогенизируют на автоматических гомогенизаторах. Затем готовят 20% суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 600-1000 g (2000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 2 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции ДН
Для подтверждения эффективности способа были использованы мазки со слизистых конъюнктивы, ротоглотки, пробы цельной крови, молоко, которые для исследования не требуют предварительной подготовки.
Лабораторные пробы (20-40 мг) отбирают на исследование в одноразовые микропробирки вместимостью 1,5 мл в двух повторах и направляют на выделения ДНК.
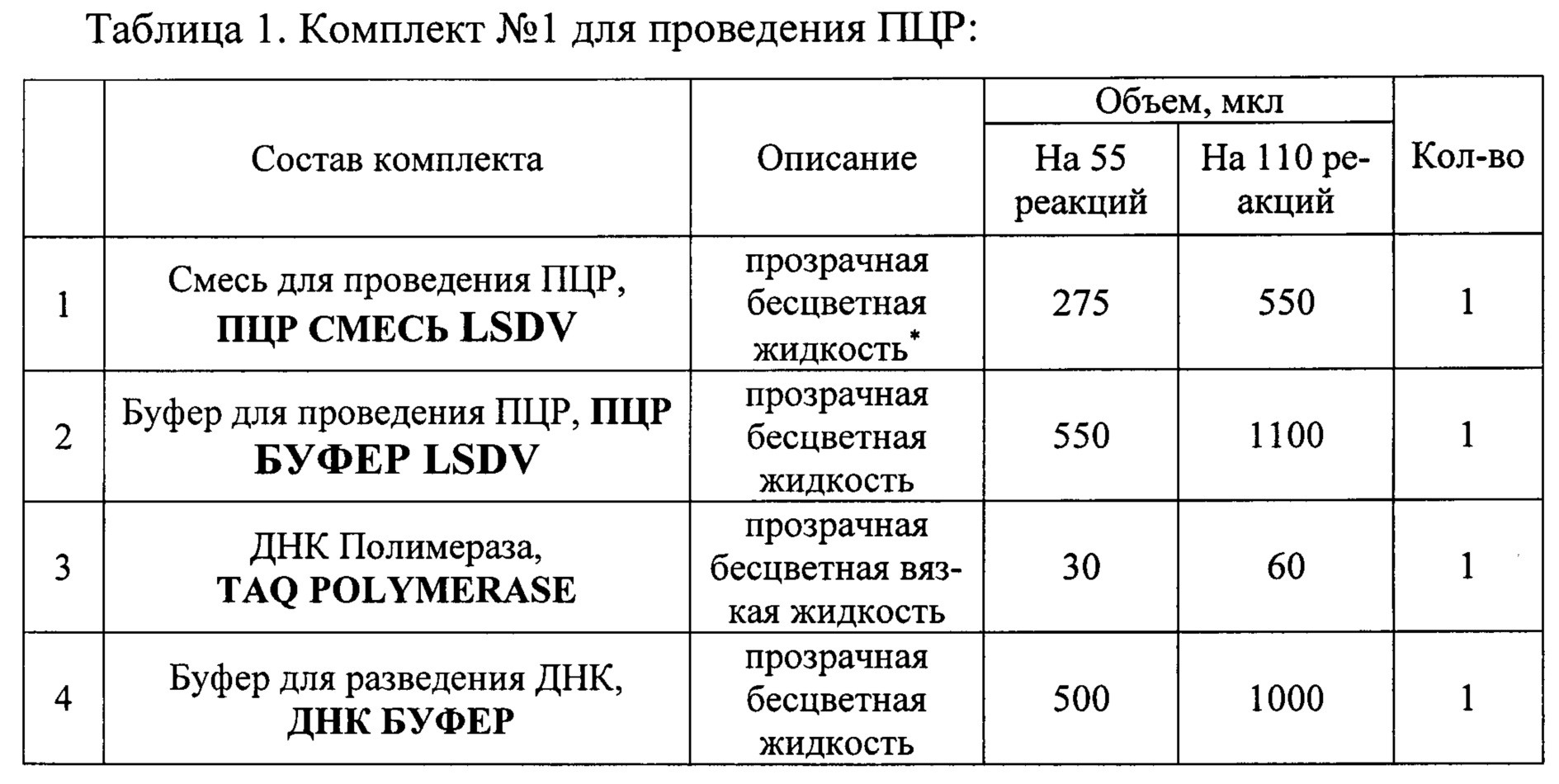
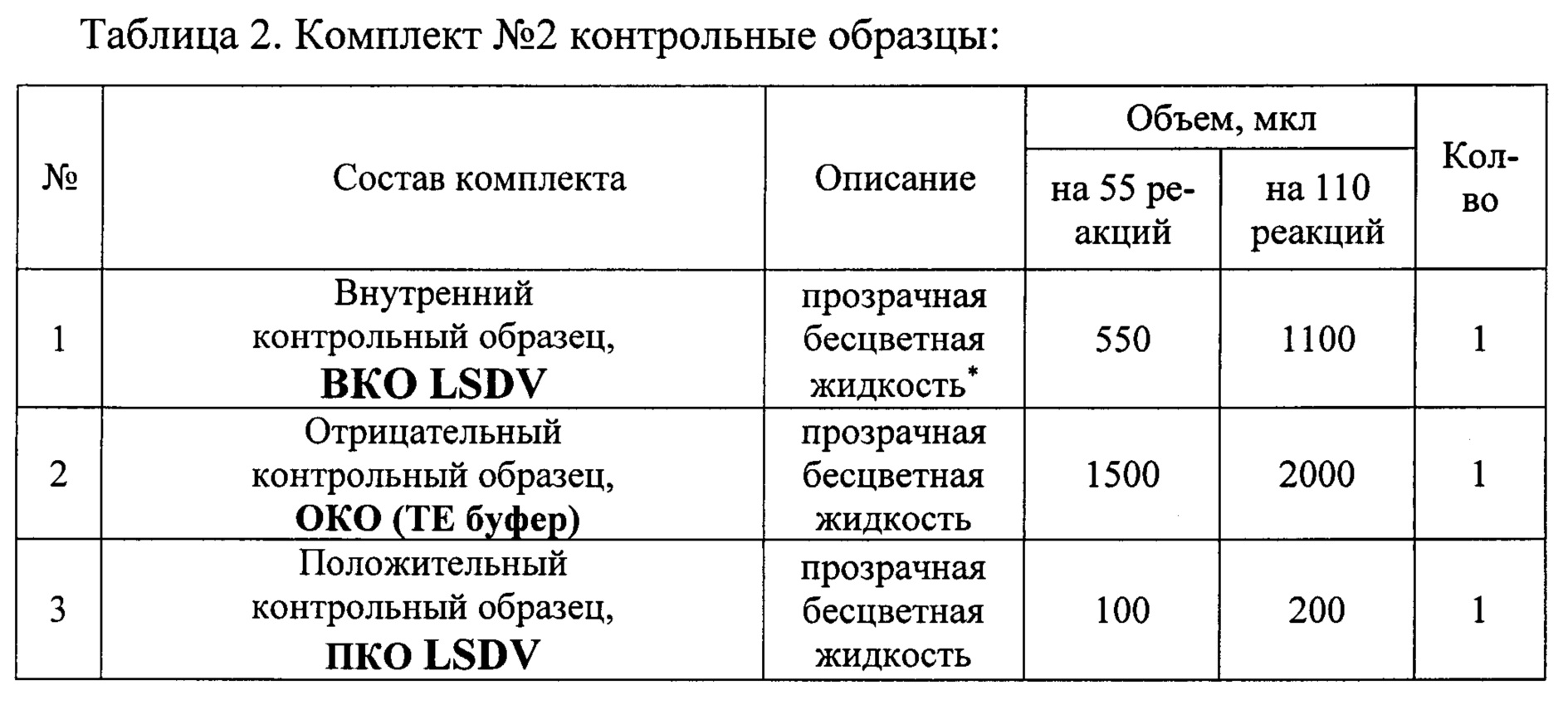
Исследование проводили с помощью набора реагентов «ПЦР-НОДУЛЯРНЫЙ-ДЕРМАТИТ-КРС-ФАКТОР». Набор состоит из комплекта реагентов для проведения мультиплексной ПНР (комплект №1) и комплекта контрольных образцов (комплект №2). Набор выпускается в двух вариантах: 1) Для анализа 55 образцов (включая контрольные образцы) 2) Для анализа 110 образцов (включая контрольные образцы). Наборы используют в соответствии с инструкцией по применению набора реагентов «ПЦР-НОДУЛЯРНЫЙ-ДЕРМАТИТ-КРС-ФАКТОР» для выявления ДНК вируса нодулярного дерматита (Lumpy skin disease virus, LSDV) в биологическом материале методом полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени, ТУ 21.10.60-124-51062356-2016, для диагностики in vitro, http://www.vetfaktor.ru/. Состав набора приведен в Таблицах 1 и 2.
Исследования состоит из трех этапов:
- экстракция нуклеиновая кислота (НК);
- проведение реакции ПЦР РВ;
- учет результатов анализа.
Для экстракции (выделение) НК из исследуемых проб отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Во все пробирки с исследуемыми образцами, включая пробирку для отрицательного контрольного образца (ОКО), вносят по 10 мкл внутреннего контрольного образца (ВКО) для ДНК вируса нодулярного дерматита, в качестве которого, используют фаголизат бактериофага Т4 с концентрацией 5×103 фаговых частиц на 1 мкл.
Следующий этап это подготовка образцов к проведению ПНР.
Общий объем реакционной смеси - 25 мкл, объем ДНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют использованием положительного контрольного образца (ПКО) LSDV, ВКО LSDV и ДНК буфера. В качестве ПКО используют смесь содержащую фрагменты геномов вируса нодулярного дерматита LSDV и нативного бактериофага Т4 взятых в соотношении 1:1 со следующими нуклеотидными последовательностями:
LSDV-F 5-TTTAGGAGATAAGATTGTCAC-3' прямой праймер
LSDV-R 5'-GGAGATTTTATTATGAGTGGC-3' обратный праймер
LSDV-P ROX-5'-GGTTAATTTTTTACCACAAATAGG-3' -BHQ2 зонд
T4F TACATATAAATCACGCAAAGC прямой праймер
T4R TAGTATGGCTAATCTTATTGG обратный праймер
Т4Р FAM-5'-ACATTGGCACTGACCGAGTTC зонд.
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
5 мкл ПЦР СМЕСЬ LSDV;
10 мкл ПЦР БУФЕР LSDV;
0,5 мкл TAQ POLYMERASE
Перемешивают смесь на вортексе и сбросывают капли кратковременным центрифугированием.
Отбирают необходимое количество пробирок для амплификации ДНК исследуемых и контрольных проб. Вносят по 15 мкл приготовленной реакционной смеси.
Помещают подготовленные для проведения ПЦР пробирки в ячейки амплификатора и используют программное обеспечение прибора. Далее проводят ПЦР РВ с флуоресцентной детекцией.
Параметры температурно-временного режима амплификации на приборе «Rotor-Gene Q» представлены в таблице 3.

Интерпретация результатов анализа. Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в соответствии с инструкцией производителя к прибору.
Учет результатов ПЦР РВ проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца).
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции ДНК в соответствии с таблицей 4.
Появление любого значения Ct в таблице 4 результатов для отрицательного контроля этапа экстракции ВК- на канале ROX/Orange и для отрицательного контроля этапа ПЦР К- на любом из каналов свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа для всех проб считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
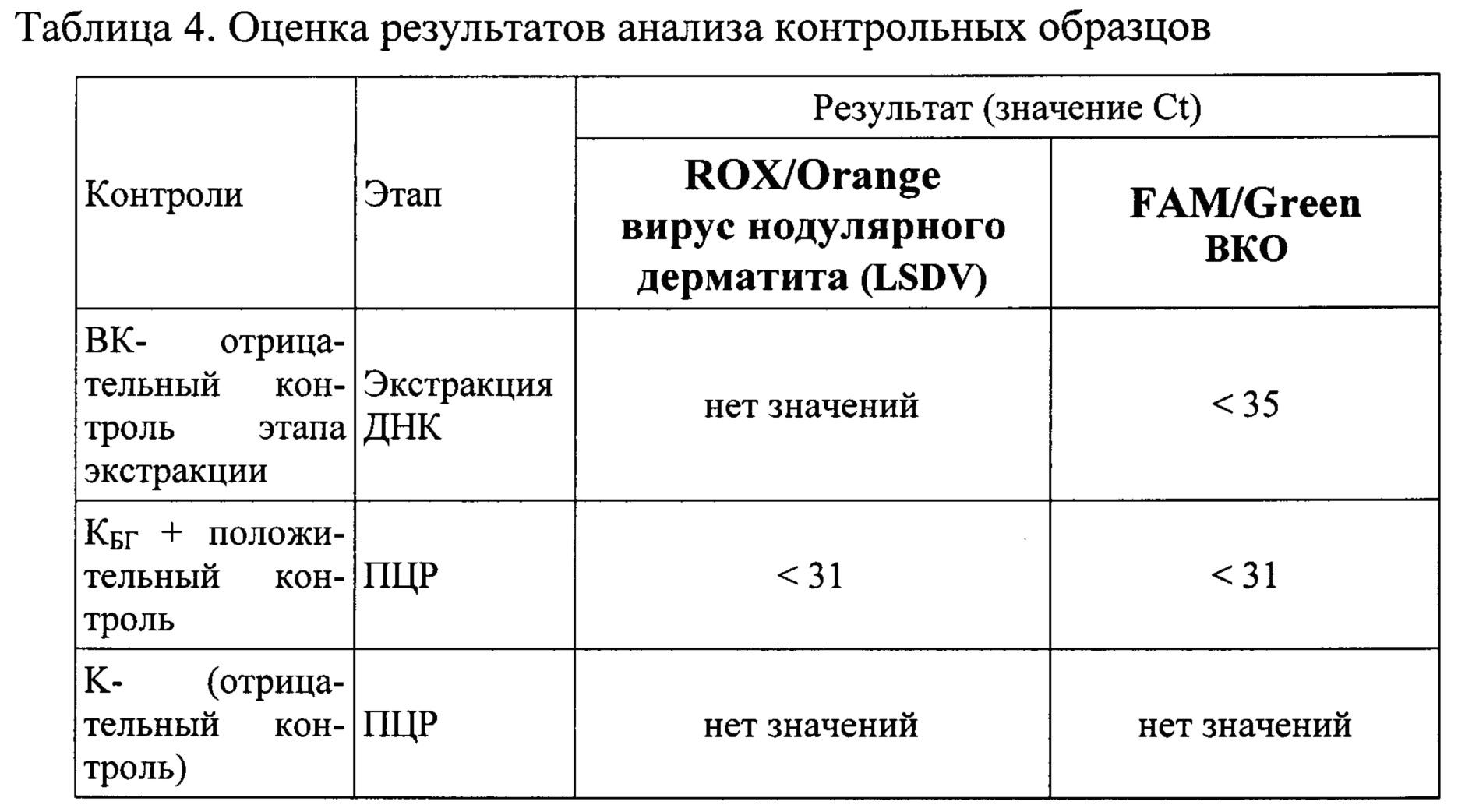
Образцы, для которых значение Ct по каналу FAM/Green отсутствует или превышает 35 цикл (и при этом не получен положительный результат на канале ROX/Orange) требуют повторного проведения исследования с этапа экстракции ДНК. Задержка в значениях пороговых циклов для исследуемых образцов указывает на присутствие ингибиторов в пробе(ах) или на ошибки при экстракции ДНК или при постановке реакции ПЦР РВ.
В образце обнаружена ДНК вируса нодулярного дерматита (LSDV), если наблюдается экспоненциальный рост сигнала на канале ROX/Orange, при этом значения Ct контрольных образцов находятся в пределах нормы (Табл. 4).
Если для исследуемого образца по каналам ROX/Orange значение Ct определяется позднее 37 цикла при корректном прохождении положительных и отрицательных контролей, образец исследуется повторно с этапа экстракция ДНК. Если при повторной постановке Ct более 37 результат считается отрицательным.
Образец считается отрицательным ДНК (LSDV не обнаружена), если не определяется значение Ct (не наблюдается рост специфического сигнала) на канале ROX/Orange, при этом значения Ct контрольных образцов находятся в пределах нормы (Табл. 4), а значение Ct по каналу FAM/Green менее 35.
Для доказательства эффективности использования ПЦР с флуоресцентной детекцией в режиме реального времени для выявления ДНК вируса нодулярного дерматита проводился сравнительный анализ чувствительности заявляемого способа с известными техническими решениями (патенты №№2648773, 2668398, а также с прототипом (патент №2680094) в котором использовался метод ПЦР с использованием внутреннего контроля в виде суспензии бактериофага, а в заявляемом - использовался фаголизат бактериофага и геном нативного бактериофага. Оказалось чувствительность ПЦР в заявляемом способе при обнаружении ДНК LSDV примерно выше в 1,42 раза, а трудоемкость и стоимость процесса определения ДНК LSDV снизилась на 3,2-4,2%.

