Результат интеллектуальной деятельности: НЕЙТРАЛИЗУЮЩЕЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ G ВИРУСА БЕШЕНСТВА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО, И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ
Вид РИД
Изобретение
Область техники
Изобретение относится к биотехнологии, а именно к моноклональным нейтрализующим антителам человека, связывающимся с гликопротеином вируса бешенства.
Уровень техники
Вирус бешенства - нейротропный вирус, вызывающий одно из самых опасных зоонотических заболеваний. Ежегодно от бешенства умирают 40000-60000 человек [Banyard, А.С., Horton, D.L., Freuling, С., Muller, Т., Fooks, A.R. (2013) Control and prevention of canine rabies: the need for building laboratory-based surveillance capacity, Antiviral Research, 98, 357-64], при этом чаще всего страдают подростки. В преобладающем большинстве случаев инфицирование людей является следствием укуса зараженной собакой. В 1802 George Zinke показал, что бешенство может передаваться через слюну от больной собаки к здоровой [Zinke, G. Neue Ansichten der Hundswuth, ihre Ursachen und Folgen, nebst einer sicheren Behandlungsart von tollen Tieren gebissenen Menschen. Jena Review 16, 212-218 (1804)]. Далее Louis Pasteur, продолжив работы Pierre-Victor Galtier, впервые продемонстрировавшего возможность переноса бешенства с одного вида на другой [Galtier, V. Etudes sur la rage. Annales Medicine Veterinaire 28, 627-639 (1879)], установил, что вирус бешенства накапливается в головном мозге [Pasteur, L. Methode pour prevenir la rage apres morsure. Compte Rendue Academie Science 101, 765-773 (1885)]. Понимание инфекционной специфики вируса бешенства дало возможность выработать стратегии экстренной профилактики, основанные на предотвращении проникновения вируса в нервную систему. На сегодняшний день единственным способом предотвращения развития бешенства у людей является пред- и постэкспозиционная профилактика (ПЭП). Предэкспозиционная профилактика включает в себя заблаговременную вакцинацию, которая необходима при повышенном риске заражения. ПЭП проводится сразу же после контакта с животными, подозреваемыми на бешенство. Данный способ профилактики представлен на сегодняшний день поликлональными сыворотками (ERIG и HRIG) и вакцинами, комбинирование которых необходимо для эффективного подавления развития и уничтожения вирусных частиц, попавших в организм. Рекомендованное проведение пассивной иммунизации посредством поликлональных сывороток необходимо для создания кратковременного иммунитета, препятствующего репликации вируса в период времени, необходимый для развития иммунного ответа и появления в организме человека нейтрализующих антител после вакцинации, однако иммуногенность ERIG, дороговизна и ограниченная доступность HRJG препятствуют их широкому применению. По вышеуказанным причинам Всемирная организация здравоохранения (ВОЗ) рекомендует заменить ERIG и HRIG моноклональными антителами человека, которые могут обеспечить наилучшую альтернативу для профилактики развития бешенства у человека.
Из 5 белков вируса бешенства только один - гликопротеин G - индуцирует образование нейтрализующих антител. Гликопротеин вируса бешенства (ГПВБ) представляет собой гомотример, выступающий над поверхностью вириона в виде шипов и играющий ключевую роль при вирусном заражении, опосредуя проникновение в клетку. На сегодняшний день известно несколько моноклональных антител, характеризующихся способностью нейтрализовывать вирус бешенства через связывание с наиболее консервативными антигенными сайтами ГПВБ, среди которых основными являются антитело человека CR57 (Crucell) [Dietzschold, В. et al. (1990) Biological characterization of human monoclonal antibodies to rabies virus, Journal of virology, 64(6), 3087-3090.], химерное антитело 62-71-3 [Both, L. et al. (2013) Production, characterization, and antigen specificity of recombinant 62-71-3, a candidate monoclonal antibody for rabies prophylaxis in humans, The FASEB Journal, 27(5), 2055-2065]; антитело человека RVC-20 [Paola De Benedictis et al. (2016) Development of broad-spectrum human monoclonal antibodies for rabies post-exposure prophylaxis, EMBO Molecular Medicine, 8, 407-421]; химерное антитело E559 [Tsekoa, T.L., Lotter-Stark, Т., Buthelezi, S., Chakauya, E., Stoychev, S.H., Sabeta, C, et al. (2016) Efficient In Vitro and In Vivo Activity of Glyco-Engineered Plant-Produced Rabies Monoclonal Antibodies E559 and 62-71-3, PLoS ONE, 11(7), 1-15]; антитело человека No254 [Matsumoto, Т., et al. (2010) Isolation and characterization of novel human monoclonal antibodies possessing neutralizing ability against rabies virus, Microbiology and immunology, 54(11), 673-683.]; антитело человека CR4098 (Crucell) [Kramer, R.A., et al. (2005) The human antibody repertoire specific for rabies virus glycoprotein as selected from immune libraries, Europ.J. of Immunol., 35(7), 2131-2145], RABV1 [Sloan, S.E., et al. (2007) Identification and characterization of a human monoclonal antibody that potently neutralizes a broad panel of rabies virus isolates, Vaccine, 25(15), 2800-2810.]; антитело человека RVC-58 [Paola De Benedictis et al. (2016) Development of broad-spectrum human monoclonal antibodies for rabies post-exposure prophylaxis, EMBO Molecular Medicine, 8, 407-421.]; антитело человека AR16 [Zhao, X.L., et al. (2008) Generation and characterization of human monoclonal antibodies to G5, a linear neutralization epitope on glycoprotein of rabies virus, by phage display technology, Microbiology and immunology, 52(2), 89-93.]; антитело человека 4D4 [Matsumoto, Т., et al. (2010) Isolation and characterization of novel human monoclonal antibodies possessing neutralizing ability against rabies virus, Microbiology and immunology, 54(11), 673-683]. Тем не менее, из-за большого разнообразия штаммов вируса по всему миру, отличающихся между собой точечными мутациями, локализованными, в том числе, в антигенных сайтах, и которые приводят к большому разнообразию эпитопов, продолжает существовать значительная потребность в новых вируснейтрализующих моноклональных антителах человека, имеющих высокий постэкспозиционный профилактический потенциал, в частности антителах, обладающих различной специфичностью распознавания эпитопов. Каждое новое нейтрализующее мАТ против ГПВБ должно быть исследовано на возможность комбинирования с уже полученными мАТ для подбора наиболее эффективной композиции антител, способной составить замену ERIG и HRIG. Известные антитела характеризуются недостаточной аффинностью, так, например, антитела 254 и 4D4 характеризуются аффинностью, выраженной значением константы диссоциации комплекса антиген-антитело 3.7×10-7 М и 2×10-8 М, соответственно. Также некоторые известные антитела, например, 62-71-3 и Е559, являются химерными, т.е. на 75% состоят из аминокислотной последовательности иммуноглобулинов мыши. Вследствие этого данные антитела могут проявлять сильную иммуногенность у людей. Таким образом, существует необходимость в разработке новых мАТ против вируса бешенства, применение которых в рамках ПЭП позволит нейтрализовать большинство или все известные штаммы.
Раскрытие изобретения
Задачей настоящего изобретения является получение нейтрализующего моноклонального антитела, способного к связыванию с ГПВБ, а также получение фрагментов ДНК, кодирующих участки легкой и тяжелой цепи указанного антитела и антиген-связывающего фрагмента указанного моноклонального антитела.
Техническим результатом является получение нового нейтрализующего моноклонального антитела человека IgG1-изотипа, способного к связыванию с ГПВБ и характеризующегося константой диссоциации комплекса антиген-антитело 2,2±0,3 нМ, что на 1-2 порядка выше, чем у известных антител. Высокая аффинность заявляемого антитела (мАТ RabD4) позволит снизить его дозировку при постэкспозиционной профилактике, что в свою очередь повысит рыночную востребованность объекта.
Также техническим результатом является расширение арсенала средств аналогичного назначения, а именно получение нового нейтрализующего моноклонального антитела человека к белкам вируса бешенства.
Поставленная задача решается получением нейтрализующего мАТ человека, селективно связывающего ГПВБ, включающего вариабельный домен тяжелой цепи иммуноглобулина (VH), который содержит последовательность гипервариабельных регионов CDRH1, CDRH2 и CDRH3, имеющих аминокислотную последовательность SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 соответственно, и вариабельный домен легкой цепи иммуноглобулина (VL), который содержит последовательность гипервариабельных регионов CDRL1, CDRL2 и CDRL3, при чем CDRL1 имеет аминокислотную последовательность SEQ ID NO: 4, CDRL2 имеет аминокислотную последовательность SEQ ID NO: 5 и CDR3 имеет аминокислотную последовательность SEQ ID NO: 6.
Поставленная задача также решается получением нейтрализующего мАТ человека, селективно связывающего ГПВБ, включающего вариабельный участок тяжелой цепи (VH) указанного антитела содержащего последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 7; а вариабельный участок легкой цепи (VL) указанного антитела содержит последовательность аминокислот, не менее чем на 90% гомологичную SEQIDNO: 8.
Поставленная задача решается также тем, что получено мАТ RabD4 человека.
Поставленная задача решается также тем, что получен фрагмент ДНК, кодирующий антитело или его фрагмент.
Поставленная задача решается также тем, что получен антиген-связывающий фрагмент указанного нейтрализующего моноклонального антитела человека, представляющий собой комбинацию вариабельного участка тяжелой цепи (VH) указанного антитела с последовательностью аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 7, и вариабельного участка легкой цепи (VL) указанного антитела с последовательностью аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 8.
Нейтрализующее моноклональное антитело человека, селективно связывающее ГПВБ, настоящего изобретения характеризуется тем, что вариабельный участок тяжелой цепи (VH) указанного антитела содержит:
(i) CDR1 с последовательностью аминокислот NHAMS (SEQ ID NO: 1);
(ii) CDR2 с последовательностью аминокислот TISGSGGRTYYTDSVAG (SEQ ID NO: 2);
(iii) CDR3 с последовательностью аминокислот DIIPLAGTGLDY (SEQ ID NO: 3).
При этом вариабельный участок легкой цепи (VL) указанного антитела содержит:
(i) CDR1 с последовательностью аминокислот SGSSSNIRDNTVH (SEQ ID NO: 4);
(ii) CDR2 с последовательностью аминокислот SDNQRPS (SEQ ID NO: 5);
(iii) CDR3 с последовательностью аминокислот AAWDDSLNGLYV (SEQ ID NO: 6).
Как хорошо известно, минорные изменения аминокислотной последовательности, такие как деления, добавление или замена одной, небольшого количества или даже нескольких аминокислот, могут приводить к получению аллельной формы исходного белка, которая обладает практически идентичными свойствами.
Нейтрализующее моноклональное антитело человека получено путем in vitro иммунизации В-лимфоцитов человека рекомбинантным ГПВБ, получением гетерогибридом иммунных В-лимфоцитов человека и клеток мышиной миеломы путем соматической гибридизации с применением полиэтиленгликоля с молекулярным весом 4000 и селекцией гетерогибридом, продуцирующих нейтрализующие моноклональные антитела к рекомбинантному ГПВБ вируса бешенства, анализа аффинности и специфичности отобранного мАТ, определения нуклеотидной и аминокислотной последовательности его вариабельных доменов.
Антитела обычно состоят из двух тяжелых цепей, связанных между собой дисульфидными связями, и легких цепей, ассоциированными с N-концом каждой из тяжелых цепей. Каждая тяжелая цепь содержит на N-конце вариабельный домен с константным доменом на другом конце. Каждая легкая цепь содержит на N-конце вариабельный домен с константным доменом на другом конце. Вариабельные домены каждой пары легкой и тяжелой цепей образуют антигенсвязьтающий участок. Вариабельные домены легкой и тяжелой цепей обладают похожей общей структурой, и каждый домен включает каркас из четырех участков, последовательности которых являются относительно консервативными, связанных посредством трех участков, определяющих комплементарность (complementarity determining regions, CDRs). Четыре каркасных участка формируют конформацию типа бета-складчатого слоя. Участки CDRs расположены в близком соседстве друг с другом благодаря каркасным участкам и вносят вклад в образование антигенсвязывающего участка. Участки CDRs и каркасные участки антител могут быть определены путем ссылки на нумерационную систему Кабата [Kabat numbering system, Kabat et al., 1987 "Sequences of Proteins of Immunological Interest", US Dept. of Health and Human Services, US Government Printing Office] в сочетании с данными рентгеноструктурного анализа, как указано в заявке WO 91/09967. Участки CDRs и каркасные участки антител могут также быть определены по номенклатуре Международной информационной системы по иммуногенетике (International Immunogenetics Information System, www.imgt.org).
Если не указано иное, любая представленная в описании полипептидная цепь имеет аминокислотную последовательность, которая начинается на N-конце и заканчивается на С-конце. Если антигенсвязывающий центр содержит и VH-, и VL-области, то они могут быть расположены на одной и той же полипептидной молекуле или предпочтительно каждая область может располагаться на разных цепях, VH-область может быть частью тяжелой цепи иммуноглобулина или ее фрагмента, а VL-область - частью легкой цепи иммуноглобулина или ее фрагмента.
мАТ человека являются минимально иммуногенными молекулами, поэтому многие современные методы направлены на их получение. Для этого могут использоваться выделенные из периферической крови В лимфоциты человека, иммунизированные in vitro. Далее В клетки иммортализуют посредством слияния с миеломным партнером (чаще всего клетки мыши). In vitro иммунизация подразумевает активацию В лимфоцитов непосредственно в пробирке, где создаются условия для созревания В клеток, что дает возможность получить антитела практически к любому антигену.
Подходящий способ для выделения антител, эффективных для использования в рамках настоящего изобретения, включает (а) добавление к В-лимфоцитам человека эффективного количества факторов роста, цитокинов, нагруженных ГПБВ дендритных клеток, активированных CD4+ Т-лимфоцитов с целью эффективной стимуляции В-лимфоцитов человека in vitro и получения антител, (b) выделение указанных антител, (с) определение последовательности антител.[Ueki, Y., I. S. Goldfarb, N. Harindranath, М. Gore, Н. Koprowski, A. L. Notkins, and P. Casali. 1990. Clonal analysis of a human antibody response. Quantitation of precursors and antibody-producing cells and generation and characterization of monoclonal IgM, IgG and IgA to rabies virus. J. Exp. Med. 171:19-34.]
На первом этапе работы были выделены субпопуляции моноцитов, В-лимфоцитов и CD4+ Т-лимфоцитов из периферической крови человека. Для эффективной иммунизации В-лимфоцитов человека in vitro и повышения качества получаемых моноклональных антител были получены зрелые дендритные клетки человека, нагруженные ГПВБ путем инкубации моноцитов с ГПВБ в присутствии цитокинов.
Затем для получения продуцентов антител против ГПВБ В-лимфоциты человека были стимулированы in vitro. Полученные иммунные лимфоциты гибридизовали с клетками миеломы в присутствии ПЭГ 4000. Как правило, гибридизация клеток разного видового происхождения приводит к образованию генетически нестабильных гибридов. Для получения более стабильных продуцентов предварительно была получена гетерогибридома человек-мышь, продуцирующая антитела класса IgG. При этом была использована мышиная миелома NS1 и лимфоциты периферической крови человека.
После утраты гетерогибридомой антителопродукции были получены НАТ-чувствительные мутанты путем длительного культивирования на среде, содержащей 8-азагуанин. Чувствительность контролировали после удаления 8-азагуанина из культуральной среды и добавления HAT в концентрациях, рекомендованных производителем. Популяции гетерогибридомы, не содержащие резистентных к HAT клеток, использовали для соматической гибридизации с В-лимфоцитами.
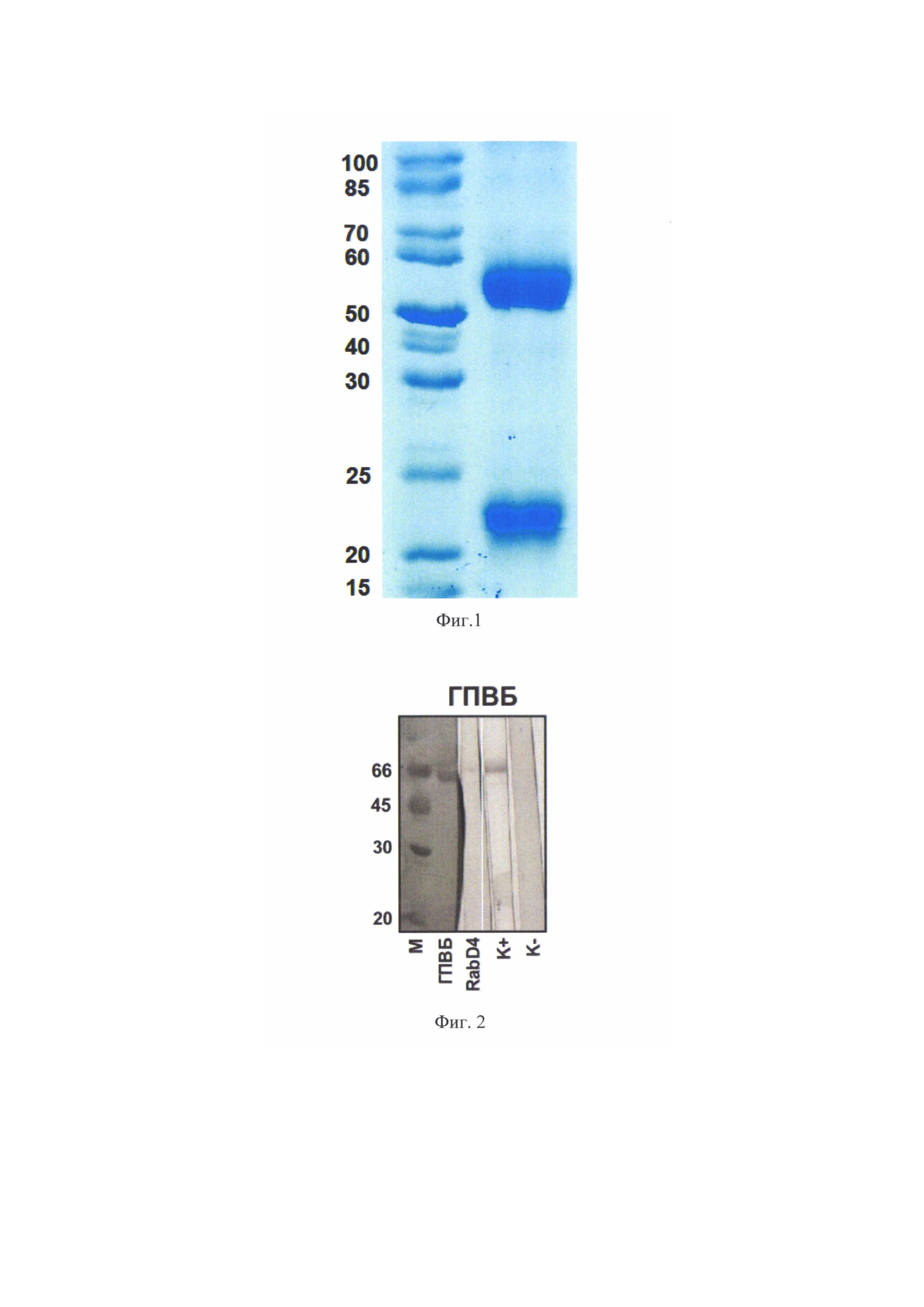
Тестирование супернатантов гибридом проводили методом непрямого иммуноферментного анализа (ИФА) с сорбцией ГПВБ или методом «сэндвич» ИФА с использованием вакцин Рабипур (Индия) и Рабикан (Россия) и мышиного мАТ 1С5 против ГПВБ (ОАО «ВНЦМДЛ», Россия). Все первичные культуры, показавшие активность в ИФА, были клонированы методом предельных разведений. Наработку супернатантов проводили, культивируя гибридомные клетки в полной ростовой среде. После клонирования наращивание клеточной массы производили в 96-луночных культуральных планшетах с перитонеальными макрофагами, постепенно увеличивая общий объем культивирования. Через неделю после клонирования супернатанты тестировали методом ИФА в том формате, в котором соответствующие первичные клоны имели положительный результат, в результате чего было отобрано антитело RabD4 (фиг. 1).
Затем определяли субизотип полученного антитела, оценивали специфичность полученного антитела методом иммуноблоттинга (фиг. 2), ИФА с ГПВБ и/или вакцинами и нейтрализующую способность методом FAVN (флюоресцентным вируснейтрализующим тестом) [F. Cliquet, М. Aubert, L. Sagne. 1998. Development of a fluorescent antibody virus neutralisation test (FAVN test) for the quantitation of rabies-neutralising antibody. Journal of Immunological Methods, 79-87]. Была определена константа диссоциации моноклонального антитела RabD4.
Далее клонировали и секвенировали последовательности кДНК, кодирующие вариабельные домены антитела человека RabD4 к ГПВБ. Для этого была выделена суммарная РНК из клеток гетерогибридомы, проведена реакция обратной транскрипции-амплификации. Полученные фрагменты ДНК клонировали и секвенировали. Результаты секвенирования ДНК различных клонов сравнивали между собой и с базами данных GeneBank (IgBlast). В результате были найдены нуклеотидные последовательности, на основании которых были определены аминокислотные последовательности SEQ ID NO: 7 и SEQ ID NO: 8 вариабельных доменов указанного антитела. Участки CDRs были определены по номенклатуре Kabat [Kabat numbering system, Kabat et al., 1987 "Sequences of Proteins of Immunological Interest", US Dept. of Health and Human Services, US Government Printing Office].
В частности, антителом согласно настоящему изобретению является моноклональное антитело человека, обладающее способностью к нейтрализации вируса бешенства благодаря связыванию ГПВБ.
Таким антителом является антитело, содержащее последовательность аминокислот не менее чем на 90% гомологичную SEQ ID NO: 7 в качестве вариабельного участка тяжелой цепи (VH) указанного антитела, последовательность аминокислот не менее чем на 90% гомологичную SEQ ID NO: 8 в качестве вариабельного участка легкой цепи (VL) указанного антитела и консервативные участки обеих цепей, необходимых для функционирования указанного антитела. Такое новое антитело человека селективно связывается с ГПВБ. Консервативные участки тяжелой цепи иммуноглобулина человека IgG, IgM, IgA, IgD или IgE могут быть использованы в качестве консервативных участков для тяжелой цепи согласно настоящему изобретению. Консервативные участки легкой цепи иммуноглобулина человека каппа или лямбда могут быть использованы в качестве консервативных участков для легкой цепи антитела согласно настоящему изобретению.
В настоящем изобретении термин "антитело" использован для описания иммуноглобулинов или их фрагментов, мономеров или димеров легкой цепи или тяжелой цепи, одноцепочечных антител, таких как одноцепочечные антитела Fv's, в которых вариабельные домены тяжелой и легкой цепей соединены пептидным линкером, а также как природных, так и полученных методами рекомбинантных ДНК или другим образом, при условии, что антитело содержит, по крайней мере, один антигенсвязывающий участок. Остальная часть антитела не должна обязательно включать только последовательность, производную от иммуноглобулина. Например, может быть сконструирован ген, в котором часть цепи, последовательность ДНК, кодирующая часть цепи иммуноглобулина человека, соединена с последовательностью ДНК, кодирующей последовательность аминокислот полипептида эффектора или молекулы-репортера. Используемый в заявляемом техническом решении термин «антитело» предназначен для обозначения молекул иммуноглобулина, составленных из четырех полипептидных цепей, при этом две тяжелые (Н) цепи и две легкие (L) цепи связываются друг с другом дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенно называемую в настоящем документе VH) и константную область тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов: CH1, СН2 и СН3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенно называемую в настоящем документе VL) и константную область легкой цепи.
Константная область легкой цепи состоит из одного домена: CL. Области VH и VL могут далее подразделяться на области гипервариабельности, которые называются определяющими комплементарность областями (CDR), перемежаемые областями с более высоким уровнем консервативности, называемыми каркасными областями (FR). Каждая область VH и VL образована тремя CDR и четырьмя FR, расположенными от амино-терминального конца к карбокси-терминальному концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Настоящее изобретение не ограничивается последовательностью вариабельных доменов SEQ ID NO: 7 и SEQ ID NO: 8, а также может представлять комбинацию гипервариабельных участков SEQ ID NO: 1-6 с любыми каркасными областями человека или других видов животных.
В настоящем изобретении фраза "антитело, обладающее способностью к нейтрализации вируса бешенства посредством связывания ГП данного вируса» означает молекулу, которая связывается с ГПВБ, образует стабильный комплекс и препятствует прикреплению и проникновению вируса бешенства в клетку. Способность антитела к связыванию с антигеном может быть определена специалистом в данной области с использованием методов, включающих, но не ограничивающихся методом иммуноферментного анализа (ИФА), равновесным диализом, с использованием плазмон-поверхностного резонанса. Методы определения аффинности хорошо известны специалисту в данной области техники, подробно описаны Janeway и др. (Irnmunobiology: The Immune System in Health and Disease (Garland Publishing Company, 1996)).
Фрагментом ДНК, кодирующим антитело, согласно настоящему изобретению является фрагмент ДНК, кодирующий вариабельные тяжелую или легкую цепи моноклонального антитела, селективно связывающего ГПВБ, содержащего последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 7, и последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 8.
Специалистам в данной области техники известно, что ввиду вырожденности трансляционного кода могут быть различия в последовательности ДНК [Льюин Б. Гены. Москва.: Мир, 1987.]. Фрагментами ДНК согласно настоящему изобретению могут быть любые фрагменты, кодирующие участки цепей антитела, содержащего последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 7, и последовательность аминокислот, не менее чем на 90% гомологичную SEQ ID NO: 8.
Используемый в настоящем документе термин «антиген-связывающая область» антитела обозначает один или несколько фрагментов антитела, которые сохраняют способность к специфическому связыванию с антигеном. К примерам связывающих фрагментов, включенных в термин «антиген-связывающая область» антитела, относятся (i) фрагмент Fab, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) фрагмент F(ab')2, бивалентный фрагмент, состоящий из двух фрагментов Fab, связанных дисульфидным мостиком в шарнирной области; (iii) фрагмент Fd, состоящий из доменов VH и CH1; (iv) фрагмент Fv, состоящий из доменов VL и VH отдельной области антитела; (v) фрагмент dAb (Ward et al. (1989) Nature 241:544-546), состоящий из домена VH; и (vi) отдельная определяющая комплементарность область (CDR). Более того, несмотря на то что два домена во фрагменте Fv, VL и VH кодируются различными генами, их можно объединить, используя рекомбинантные технологии, посредством синтетического линкера, который позволяет построить из них единую белковую цепочку, в которой области VL и VH связываются с образованием моновалентных молекул (известных как одиночная цепь Fv (scFv); см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Такие одноцепочечные антитела также включаются в сферу охвата термина «антиген-связывающая область» антитела.
Существующий уровень техники является таким, что позволяет специалисту в данной области синтезировать молекулы ДНК, предлагаемые в изобретении на основе представленной в настоящем описании информации, т.е. аминокислотных последовательностей гипервариабельных участков и кодирующих их последовательностей ДНК. Метод конструирования гена вариабельной области описан, например, в ЕР 239400, и в целом состоит в следующем: клонируют ген, кодирующий вариабельную область мАТ, независимо от его специфичности. Определяют сегменты ДНК, кодирующие каркасные и гипервариабельные участки, и сегменты ДНК, кодирующие гипервариабельные участки, удаляют таким образом, чтобы сегменты ДНК, кодирующие каркасные участки, сливать в стыках с приемлемыми сайтами рестрикции. Сайты рестрикции можно создавать в требуемых положениях путем мутагенеза молекулы ДНК с использованием стандартных процедур. Реакцию связывания можно идентифицировать с помощью стандартных методов (качественные анализы), которые включают, например, анализ связывания, конкурентный анализ.
Краткое описание чертежей
На Фиг. 1 показана гель-электрофореграмма мАТ RabD4 в 10%-ном полиакриламидном геле в присутствии додецилсульфата натрия (SDS) и β-меркаптоэтанола; М - белковые маркеры молекулярного веса, 1 - мАТ RabD4.
На Фиг. 2 показан иммуноблоттинг рекомбинантного ГПВБ, окрашенный с помощью мАТ RabD4; М - белковые маркеры молекулярного веса, К+ - положительный контроль, К- - отрицательный контроль.
На Фиг. 3 показано расположение участков CDRs в вариабельном домене легкой RabD4L и тяжелой RabD4H цепей мАТ RabD4. Участки CDRs подчеркнуты.
Осуществление изобретения
Последующие примеры приведены для целей объяснения и не ограничивают каким-либо образом рамки настоящего изобретения.
Известно, что для успешной стимуляции В-лимфоцитов in vitro необходимо присутствие не только антигена в растворе, определенного набора цитокинов и факторов роста, но и активированных этим же антигеном CD4+ Т-лимфоцитов [US 2013/0196380 A1 «IN VITRO PROCESS FOR THE PREPARATION OF ANTIBODIES OF THE IGG TYPE»].
Пример 1. Получение моноклонального антитела человека против ГПВБ.
Для получения IgG-секретирующих В-лимфоцитов требуется три популяции клеток от одного донора (аутологичных): моноциты, CD4+ Т-лимфоциты, В-лимфоциты. Для получения этих популяций была взята свежая кровь здорового донора в пробирки с антикоагулянтом К+ ЭДТА, при процедурах были соблюдены условия, обеспечивающие стерильность крови. Субпопуляции получали с использованием наборов для выделения клеток RosetteSep (StemCell Technologies Inc, США). Клетки выделяли по следующей методике: 1) к цельной крови с антикоагулянтом К+ ЭДТА добавляли препарат RosetteSep, из расчета 50 мкл препарата на 1 мл крови, хорошо перемешивали; 2) инкубировали 20 минут при комнатной температуре (15-25°С); 3) разбавляли образец равным объемом фосфатно-солевого буфера с добавлением 2%-ной фетальной телячьей сыворотки и 1 мМ ЭДТА, осторожно перемешивали; 4) полученный образец аккуратно наслаивали на раствор Ficoll-Paque Plus, (StemCell Technologies Inc, США), избегая перемешивания; 5) центрифугировали в течение 20 минут при комнатной температуре и 1200g (угловую скорость вращения центрифуги-обороты в минуту или RPM-рассчитывали по формуле: RPM=√RCF/((1,118×10-5) × радиус), где RCF - относительная центробежная сила в g, радиус- радиус вращения ротора в см, в итоге для получения центробежной силы 1200g понадобилась угловая скорость 3361 об/мин), центрифугировали без принудительной остановки ротора; 6) осторожно отбирали слой клеток между плазмой и раствором Ficoll-Paque Plus, забирая часть фиколла для более полного извлечения клеток; 7) клетки промывали дважды раствором ФСБ с добавлением 2% фетальной телячьей сыворотки и 1 мМ ЭДТА; 8) клетки подсчитывали в камере Горяева, аликвоты клеток замораживали в среде, содержащей 40% ФСБ и 10% ДМСО. Всего было выделено и заморожено: 4,1 млн CD4+ Т-лимфоцитов; 2,8 млн В-лимфоцитов; 3 млн моноцитов. Активацию CD4+ Т-лимфоцитов осуществляли посредством инкубации их со зрелыми дендритными клетками человека, нагруженными гликопротеидом вируса бешенства, путем инкубации моноцитов с ГПВБ в присутствии цитокинов. Моноциты высевали в 6-луночный планшет по 170 тыс клеток в лунку в 3 мл среды Cell Gro с добавлением 500 ед/мл ИЛ-4 и 800 ед/мл ГМ-КСФ, культивировали в течение 5 суток при 37°С в атмосфере 5% углекислого газа, после чего в результате изучения морфологии клеток под микроскопом было установлено, что клетки соответствуют незрелым дендритным клеткам. К этим незрелым дендритным клеткам добавляли антирабическую вакцину Рабипур (Rabipur®, концентрация 2,5МЕ в мл, Индия) до разведения 1:200, либо коммерческий рекомбинантный ГПВБ (MyBioSource, США, штамм ERA) до конечной концентрации 5 мкг/мл. Для получения продуцентов антител против ГПВБ В-лимфоциты были стимулированы in vitro. В-лимфоциты размораживали в количестве 2,8 млн клеток, центрифугировали в течение 10 мин при 1020g, ресуспендировали в среде Cell Gro и высевали в лунки 6-луночного планшета. Затем добавляли либо вакцину Рабипур до разведения 1:200, либо ГПВБ до конечной концентрации 5 мкг/мл и культивировали в течение 4 ч. По истечении 4 ч разморозили CD4+ Т-лимфоциты в количестве 4,1 млн. клеток, центрифугировали в течение 10 мин при 1020g, ресуспендировали в среде Cell Gro и высевали в 2 культуральных флакона площадью 25 см. Образовавшиеся из моноцитов дендритные клетки снимали скребком со дна 6-луночного планшета и добавляли к CD4+ Т - лимфоцитам в количестве 70 тыс.клеток в каждый флакон. Инкубировали 3,5 ч при 37°С в атмосфере 5% углекислого газа. По истечении 3,5 ч В-лимфоциты добавляли в культуральные флаконы с CD4+ Т - лимфоцитами и дендритными клетками в соответствии с добавленными антигенами, затем добавляли цитокины ИЛ-2 до конечной концентрации 20 ед/мл, ИЛ-4 до конечной концентрации 500 ед/мл, ИЛ-6 до конечной концентрации 1800 ед/мл, ИЛ-10 до конечной концентрации 2 ед/мл и митоген pokeweed из растения Phytolacca americana до конечной концентрации 4 мкг/мл. Инкубировали 3 суток при 37°С в атмосфере 5% углекислого газа. По истечении 3 суток наблюдали образование клеточных синапсов в культуральных флаконах. Клетки переносили в центрифужные пробирки, центрифугировали при 1200 об/мин в течение 10 минут. Супернатанты отбирали для дальнейшего тестирования. Клеточный осадок использовали для получения гетерогибридом. Полученные иммунные В-лимфоциты гибридизовали с использованием ПЭГ 4000 с предварительно полученной гетерогибридомой человек-мышь (была использована мышиная миелома NS1 и лимфоциты периферической крови человека), утратившей способность к антителопродукции. Клетки высевали в 96-луночные культуральные планшеты с предварительно высеянными перитонеальными макрофагами в ростовой среде DMEM с добавлением фетальной бычьей сыворотки до концентрации 8%, L-глутамина, пирувата, гентамицина, а также гипоксантина, тимидина и аминоптерина (HAT) в концентрациях, рекомендованных производителями добавок (полная селективная ростовая среда). Планшеты культивировали при 37°С в атмосфере 5% СО2 в течение недели, рост клеточных колоний оценивали визуально. Всего было получено около 2000 НАТ-устойчивых гибридомных клонов. Супернатанты тестировали методом непрямого ИФА с сорбцией ГПВБ в ФСБ в концентрации 1 мкг/мл и методом «сэндвич» ИФА с использованием антирабических вакцин Рабипур (Индия) и Рабикан (Россия) и мышиного моноклонального антитела 1С5 против ГПВБ (ОАО «ВНЦМДЛ», Россия). Наработку супернатантов проводили, культивируя гибридомные клетки в полной ростовой среде. После клонирования наращивание клеточной массы производили в 96-луночных культуральных планшетах с перитонеальными макрофагами, постепенно увеличивая общий объем культивирования.
Пример 2. Определение вируснейтрализующей активности мАТ человека RabD4 методом FAVN.
FAVN анализ был выполнен с использованием Стандарта ВОЗ (WHO), International Laboratory For Biological Standards, Copengagen, Denmark: Second International Standard for Rabies Immunoglobulin. 30 IU/ml of Rabies Antibodies in the amp.и Стандарт European Pharmacopoeia Reference Standard Human rabies immunoglobulin BPR, Strasburg. Batch: 1.1, Id: 004X14, 91МЕ/мл. Антитело RabD4 и вирус штамма CVS 11 были проинкубированы в течение 1 ч при 37°С (5% СО2) перед добавлением к 2×104 ВНК-21 С13 клеток в каждой лунке. Инкубировали плашки в течении 48 ч при 37°С (5% СО2). После этого удаляли среду, лунки промывали PBS и фиксировали клетки с помощью 80% ацетона. Окрашивание было выполнено путем добавления в каждую лунку 50 мкл флуоресцеин изотиоцинат антирабического конъюгата. После 30 мин инкубации при 37°С (5% СО2) каждая лунка дважды промывалась PBS, а нейтрализующий титр антитела был оценен с помощью методов флуоресцентной микроскопии.
Таким образом, по итогам исследований методом FAVN было установлено, что мАТ RabD4 обладает высокой вируснейтрализующей антирабической активностью, значение которой 305,7 МЕ/мг (IU/mg).
Пример 3. Клонирование и секвенирование последовательностей кДНК, кодирующих вариабельные домены нейтрализующего антитела человека RabD4 к ГПВБ.
Гены вариабельных доменов легкой и тяжелой цепей мАТ RabD4 были получены с помощью реакции обратной транскрипции-амплификации тотальной РНК RabD4. РНК выделяли из 30000 клеток гетерогибридомы RabD4 с помощью реагента Trizol (Life Technologies, США) согласно рекомендуемому производителем протоколу. Обратную транскрипцию проводили, применяя обратную транскриптазу M-MuLV (Fermentas, США) а также праймеры SMribo и RToligo. Полученную кДНК амплифицировали с помощью ДНК-полимеразы Tersus (Евроген, Россия) с использованием набора праймеров, комплементарных областям константных доменов мАт:
2NesHuG 5'-GATGGGCCCTTGGTGGA
NesHuLam 5'-GCTCCTC AGAGGAGGG
Полученные ПЦР-фрагменты длиной 600-650 п.о. клонировали в вектор pALT2 (Евроген, Россия) и отбирали не менее 10 положительных клонов как для легкой, так и для тяжелой цепи мАТ, после чего с помощью секвенирования определяли нуклеотидные последовательности, кодирующие вариабельные фрагменты. Затем проводили сравнение нуклеотидных последовательностей с помощью программ UniproUgene и GeneRunner. В результате анализа были определены консенсусные нуклеотидные последовательности вариабельных доменов тяжелой и легкой цепей мАт RabD4. На их основании с учетом трансляционного кода были определены аминокислотные последовательности вариабельных доменов тяжелой (SEQ ID NO: 7) и легкой (SEQ ID NO: 8) цепей мАт RabD4. Для подтверждения достоверности определения аминокислотных последовательностей мАт RabD4 был проведен масс-спектрометрический анализ фрагментов трипсинового гидролиза легких и тяжелых цепей исходного мАт RabD4. Полученные последовательности оценивали с помощью сравнения с гомологичными последовательностями, находящимися в базе данных GeneBank (IgBlast), что подтвердило их принадлежность к генам вариабельных доменов тяжелой и легкой цепи антител Homo Sapiens. Участки CDRs VL и VH (Фиг. 3) были определены по номенклатуре Kabat [Kabat numbering system, Kabat et al., 1987 "Sequences of Proteins of Immunological Interest", US Dept. of Health and Human Services, US Government Printing Office].
Таким образом, были получены аминокислотные последовательности SEQ ID NO: 7 и SEQ ID NO: 8, а также кодирующие их нуклеотидные последовательности.
Пример 4. Анализ аффинности мАТ человека RabD4 против ГПВБ.
Константу диссоциации мАТ определяли в соответствии с методикой, предложенной Klotz I.M. (The Proteins. Ed. H. Neurath and K. Bailey Academic Press, New York. 1953. V. 1. P. 727) с модификациями из В. Friguet и др. (В. Friguet et. al. Measurements of the True Affinity Constant in Solution of Antigen-Antibody Complex by Enzyme-Linked Immunosorbent Assay. Journal of Immunological Methods, 77 (1985) 305-319). На первом этапе проводят инкубацию мАт в постоянной концентрации 1 нМ (150 нг/мл) с антигеном, ГПВБ в диапазоне концентраций 0.1-10 нМ (10-1000 нг/мл) в течение 2 ч при комнатной температуре с постоянным перемешиванием на шейкере для достижения термодинамического равновесия в трехкомпонентной системе: свободный антиген, свободное антитело и комплекс антиген-антитело. На втором этапе осуществляют измерение концентрации свободных антител методом твердофазного ИФА с иммобилизованным на планшет ГПВБ. На заключительном этапе рассчитывают Кд по уравнению Клотца:
Ао/Ао-А=1+1/а Кд,
где Ао - оптическая плотность, измеренная для антител в отсутствии антигена;
А - оптическая плотность, измеренная для свободных антител в смеси антиген-антитело;
а - концентрация антигена.
Для мАт RabD4 значение константы диссоциации комплекса антиген-антитело составило 2,2×10-9±0,3 М.
Пример 5.
С целью подтверждения того, что при замене отдельных а.о. в каркасных регионах на другие а.о. остатки человека или других видов животных было получено модифицированное антитело, в котором отдельные а.о. изменены на мышиные. Были получены модифицированные последовательности SEQ ID NO: 7М и SEQ ID NO: 8М, имеющие гомологию не менее чем на 90% (модифицированные а.о. выделены жирным) с SEQ ID NO: 7 (степень гомологии - 87,6%) и SEQ ID NO: 8 (степень гомологии - 88,3%).
Полученные антитела специфически взаимодействовали с ГПВБ и значение констант диссоциации комплексов антиген-антитело не отличалось от антител с последовательностями SEQ ID NO: 7 и SEQ ID NO: 8.
Пример 6. Фрагменты ДНК, кодирующий вариабельные тяжелую и легкую цепи мАТ, селективно связывающего ГПВБ, содержащего последовательность аминокислот, гомологичную SEQ ID NO: 7 и последовательность аминокислот, гомологичную SEQ ID NO: 8 приведены в перечне последовательностей - SEQ ID NO: 9 и SEQ ID NO: 10.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Московский государственный университет имени М.В.Ломоносова" (МГУ)
<120> НЕЙТРАЛИЗУЮЩЕЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕСЯ С ГПВБ, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ
<160> SEQ ID NО:1
<210> 1
<211> 5
<212> PRT
<213> Natural sequence
<223> CDRH1 of heavy chain of monoclonal antibody RabD4 to Rabies virus glycoprotein G
<400> 1
1 NHAMS
<160> SEQ ID NО:2
<210> 2
<211> 17
<212> PRT
<213> Natural sequence
<223> CDRH2 of heavy chain of monoclonal antibody RabD4 to Rabies virus glycoprotein G
<400> 2
1 TISGSGGRTY YTDSVAG
<160> SEQ ID NО:3
<210> 3
<211> 12
<212> PRT
<213> Natural sequence
<223> CDRH3 of heavy chain of monoclonal antibody RabD4 to Rabies virus glycoprotein G
<400> 3
1 DIIPLAGTGL DY
<160> SEQ ID NО:4
<210> 4
<211> 13
<212> PRT
<213> Natural sequence
<223> CDRL1 of light chain of monoclonal antibody RabD4 to Rabies virus glycoprotein G
<400> 4
1 SGSSSNIRDN TVH
<160> SEQ ID NО:5
<210> 5
<211> 7
<212> PRT
<213> Natural sequence
<223> CDRL2 of light chain of monoclonal antibody RabD4 to Rabies virus glycoprotein G
<400> 5
1 SDNQRPS
<160> SEQ ID NО:6
<210> 6
<211> 12
<212> PRT
<213> Natural sequence
<223> CDRL3 of light chain of monoclonal antibody RabD4 to Rabies virus glycoprotein G
<400> 6
1 AAWDDSLNGL YV
<160> SEQ ID NО:7
<210> 7
<211> 121
<212> PRT
<213> Natural sequence
<223> VH fragment of heavy chain of monoclonal antibody RabD4 to Rabies virus glycoprotein G
<400> 7
1 EVQLLESGGG LVQPGRSLRL SCAASGFTFS NHAMSWVRQA PGKGLEWIST
51 ISGSGGRTYY TDSVAGRFTI SRDNSEYTLY LQMNSLTAED TAVYSCARDI
101 IPLAGTGLDY WGQGTLVTVS S
<160> SEQ ID NО:7М
<400> 7М
1 QVQLLESGPG LVKPSQSLSL TCTVTGFTFS NHAMSWVRQA PGKGLEWIST
51 ISGSGGRTYY TDSVAGRFTI SRDNSEYTLY LQMNSLTAED TAVYSCARDI
101 IPLAGTGLDY WGQGTLLTVS A
<160> SEQ ID NО:8
<210> 8
<211> 111
<212> PRT
<213> Natural sequence
<223> VH fragment of light chain of monoclonal antibody RabD4 to Rabies virus glycoprotein G
<400> 8
1 QSVLTQPPSA SGTPGQRVTI SCSGSSSNIR DNTVHWYQLL PGTAPKLLIY
51 SDNQRPSGVP DRFSGSKSGS SASLAISGLQ SEDEADYYCA AWDDSLNGLY
101 VFGTGTKVTV L
<160> SEQ ID NО:8М
<400> 8М
1 QSALTQPRSV SGSPGQSVTI SCSGSSSNIR DNTVHWYQQH PGKAPKLMIY
51 SDNQRPSGVP DRFSGSKSGN TASLAISGLQ SEDEADYYCA AWDDSLNGLY
101 VFGGGTKLTV L
<160> SEQ ID NО:9
<210> 9
<211> 363
<212> DNA
<213> Human
<400> 9
1 GAGGTGCAGT TGTTGGAGTC TGGGGGAGGC TTGGTACAGC CGGGGCGGTC
51 CCTGAGACTC TCCTGTGCAG CCTCTGGATT CACCTTTAGT AACCATGCCA
101 TGAGCTGGGT CCGCCAGGCT CCAGGGAAGG GACTGGAGTG GATCTCCACC
151 ATTAGTGGTA GTGGTGGTCG CACATACTAC ACAGACTCCG TGGCGGGCCG
201 GTTCACCATC TCCAGAGACA ATTCCGAGTA CACCCTGTAT TTGCAAATGA
251 ACAGCCTGAC AGCCGAGGAC ACAGCCGTAT ATTCCTGTGC GAGAGATATC
301 ATACCATTGG CTGGAACGGG GTTGGACTAC TGGGGCCAGG GAACCCTGGT
351 CACCGTCTCC TCA
<160> SEQ ID NО:10
<210> 10
<211> 333
<212> DNA
<213> Human
<400> 10
1 CAGTCTGTGC TGACTCAGCC ACCCTCAGCG TCTGGGACCC CCGGGCAGAG
51 GGTCACCATC TCTTGTTCTG GAAGCAGTTC CAATATCAGA GATAATACTG
101 TGCACTGGTA CCAGCTGCTC CCAGGAACGG CCCCCAAACT CCTCATCTAT
151 AGTGATAATC AGCGGCCCTC AGGGGTCCCT GACCGATTCT CTGGCTCCAA
201 GTCTGGCTCC TCAGCCTCCC TGGCCATCAG TGGGCTCCAG TCTGAGGATG
251 AGGCTGATTA TTACTGTGCA GCATGGGATG ACAGCCTGAA TGGTCTCTAT
301 GTCTTCGGAA CTGGGACCAA GGTCACCGTC CTA
<---