Результат интеллектуальной деятельности: КОМПОЗИЦИИ КЛЕТОЧНЫХ КУЛЬТУР С АНТИОКСИДАНТАМИ И СПОСОБЫ ПОЛУЧЕНИЯ ПОЛИПЕПТИДОВ
Вид РИД
Изобретение
Перекрестные ссылки на родственные заявки
[0001] В данной заявке испрашивается приоритет по дате подачи предварительной заявки на патент США с регистрационным номером 61/799602, поданной 15 марта 2013 г., описание которой в полном объеме включено в данное описание посредством ссылки.
Область техники, к которой относится изобретение
[0002] Настоящее изобретение относится к клеточной культуральной среде, содержащей антиоксиданты, к способам использования указанной среды для клеточных культур и для получения полипептидов, а также к композициям и наборам реагентов, включающим полипептиды, которые получены по способам, приведенным в данном описании.
Уровень техники
[0003] Технология приготовления клеточных культур широко используется для получения продуктов на основе белков, таких как фармацевтические препараты лечебных белков. Коммерческое производство продуктов на основе белков, таких как антитела, требует оптимизации параметров клеточных культур с тем, чтобы клетки продуцировали достаточное количество белкового продукта для удовлетворения требований производства. Однако в процессе оптимизации параметров клеточной культуры, с целью улучшения продуцирования белкового продукта, необходимо также поддерживать требуемые показатели качества продукта, такие как профиль гликозилирования, уровни агрегатов, неоднородность заряда и целостность аминокислотной последовательности (Li et al., mAbs, 2010, 2(5):466-477). Еще одним необходимым показателем качества является цвет продуцируемого белка. Должны быть выполнены требования нормативных документов, касающиеся приемлемых уровней цвета для жидких составов терапевтических продуктов, предназначенных для человека (United States Pharmacopoeia Inc., 2000, p. 1926-1927 и Council of Europe. European Pharmacopoeia, 2008, 7th Ed. p. 22). Таким образом, продуцирование белка, который имеет приемлемый цвет, является важным аспектом производства лекарственных белков.
[0004] Последние тенденции, касающиеся подкожной доставки лечебных белков, таких как моноклональные антитела, сопровождается увеличением концентрации белковых веществ в композициях, например, до концентрации приблизительно 100 мг/мл или больше (Daugherty et al., Adv. Drug Deliver Rev., 2006, 58(5-6):686-706). Наблюдается корреляция между увеличением интенсивности окрашивания в композициях, содержащих повышенные количества лечебного белка, и данная зависимость может быть связана с образующимися в небольших количествах вариантами продуцируемого белка, которые ранее не могли быть определены с помощью стандартных методов контролирования интенсивности окрашивания продукта в композиции.
[0005] Окисление является основным путем химической деградации белковых лекарственных препаратов. Например, метионин, цистеин, гистидин, триптофан и тирозин представляют собой аминокислотные остатки, которые чувствительны к окислению вследствие их способности взаимодействовать с активными формами кислорода (ROS), и подобное окисление часто наблюдается в фармацевтических белковых препаратах в процессе хранения. Известно, что условия культивирования клеток могут повлиять на показатели качества продуцируемого белка, такие как производство достаточных количеств для крупномасштабного производства, тем не менее, влияние указанных условий на интенсивность окрашивания конечного белкового продукта остается неясным.
[0006] Сохраняется потребность в разработке усовершенствованных и экономически эффективных методов получения белков (например, антител), имеющих приемлемые показатели качества, такие как интенсивность окрашивания. Клеточная культуральная среда, как с неизвестным химическим составом, так и с известным химическим составом, включающая компоненты, которые позволяют стабильно продуцировать белковые продукты с более низкой интенсивностью окрашивания при сохранении требуемой концентрации белка (например, ≥100 мг/мл), могли бы найти применение при разработке белковых продуктов, таких как антитела.
Сущность изобретения
[0007] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается способ культивирования клетки, содержащей нуклеиновую кислоту, которая кодирует полипептид, при этом указанный способ включает стадию контактирования клетки со средой для культивирования клеток, содержащей гипотаурин, или его аналог, или его предшественник, где среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по сравнению с интенсивностью окрашивания композиции, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не содержащей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая гипотаурин или его аналог, или его предшественник, уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по меньшей мере, приблизительно на 0,1%, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, выращенной в среде для культивирования клеток, которая не включает гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, на величину от приблизительно 5% до приблизительно 50%, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, которая выращена в среде для культивирования клеток, не включающей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией, равной, по меньшей мере, приблизительно 0,0001 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 0,0001 мМ до приблизительно 500,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 1,0 мМ до приблизительно 40,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 1,0 мМ до приблизительно 10,0 мМ. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник выбран из группы, включающей гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, представляет собой среду для культивирования клеток с известным химическим составом. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, представляет собой среду для культивирования клеток с неизвестным химическим составом. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, представляет собой минимальную среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, представляет собой питательную среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения клетка контактирует со средой для культивирования клеток, содержащей гипотаурин, или его аналог, или его предшественник, в течение фазы роста клетки. В некоторых вариантах осуществления настоящего изобретения клетка контактирует со средой для культивирования клеток, содержащей гипотаурин, или его аналог, или его предшественник, в течение продуктивной фазы клетки. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник, добавляют в среду для культивирования клеток, по крайней мере, на один день цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник добавляют в среду для культивирования клеток в день 0 из 14-дневного цикла культивирования клеток. В любом из вариантов осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник может быть добавлен в среду для культивирования клеток в любой день цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения клетка является клеткой млекопитающего. В некоторых вариантах осуществления настоящего изобретения клетка млекопитающего представляет собой клетку яичников китайского хомячка (СНО). В некоторых вариантах осуществления настоящего изобретения полипептид представляет собой антитело или его фрагмент.
[0008] В соответствии с другими аспектами, в настоящем изобретении предлагаются способы культивирования клетки, содержащей нуклеиновую кислоту, которая кодирует полипептид, при этом указанный способ включает стадию контактирования клетки со средой для культивирования клеток, где среда для культивирования клеток содержит один или более из следующих компонентов (a)-(h): (a) гипотаурин; (b) s-карбоксиметилцистеин; (c) карнозин; (d) ансерин; (е) бутилзамещенный гидроксианизол; (f) липоевая кислота; (g) гидрат кверцитрина; и (h) аминогуанидин; и где среда для культивирования клеток, содержащая один или несколько компонентов (а)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клетками, по сравнению с композицией, которая содержит полипептид, продуцированный клетками, выращенными в среде для культивирования клеток, которая не содержит один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая один или несколько компонентов (a)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клетками, по меньшей мере, приблизительно на 0,1%, по сравнению с композицией, которая содержит полипептид, продуцированный клетками, которые выращивают в среде для культивирования клеток, не включающей один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая один или несколько компонентов (a)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клетками, на величину от приблизительно 5% до приблизительно 75%, по сравнению с композицией, которая содержит полипептид, продуцированный клетками, которые выращивают в среде для культивирования клеток, не включающей один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая один или несколько компонентов (a)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клетками, на величину от приблизительно 5% до приблизительно 50%, по сравнению с композицией, которая содержит полипептид, продуцированный клетками, которые выращивают в среде для культивирования клеток, не включающей один или более компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая один или несколько компонентов (a)-(h), включает один или несколько компонентов (a)-(h) в количестве, выбранном из: (a) гипотаурин с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (b) s-карбоксиметилцистеин с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (c) карнозин с концентрации, по меньшей мере, от приблизительно 0,0001 мМ; (d) ансерин с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (e) бутилзамещенный гидроксианизол с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (f) липоевая кислота с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (g) гидрат кверцитрина с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; и (h) аминогуанидин с концентрацией, по меньшей мере, от приблизительно 0,0003 мМ. В другом варианте осуществления настоящего изобретения среда для культивирования клеток содержит гипотаурин с концентрацией от приблизительно 2,0 мМ до приблизительно 50,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит s-карбоксиметилцистеин с концентрацией от приблизительно 8,0 мМ до приблизительно 12,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит карнозин с концентрацией от приблизительно 8,0 мМ до приблизительно 12,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит ансерин с концентрацией от приблизительно 3,0 мМ до приблизительно 5,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит бутилзамещенный гидроксианизол с концентрацией от приблизительно 0,025 мМ до приблизительно 0,040 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит липоевую кислоту с концентрацией от приблизительно 0,040 мМ до приблизительно 0,060 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гидрат кверцитрина с концентрацией от приблизительно 0,010 мМ до приблизительно 0,020 мМ. В некоторых вариантах осуществления настоящего изобретения, среда для культивирования клеток включает аминогуанидин с концентрацией от приблизительно 0,0003 мМ до приблизительно 245 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает аминогуанидин с концентрацией от приблизительно 0,0003 мМ до приблизительно 10 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой среду для культивирования клеток с известным химическим составом. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой среду для культивирования клеток с неизвестным химическим составом. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой минимальную среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой питательную среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения клетка контактирует со средой для культивирования клеток в течение фазы роста клетки. В некоторых вариантах осуществления настоящего изобретения клетка контактирует со средой для культивирования клеток в течение фазы продуцирования продукта клеткой. В некоторых вариантах осуществления настоящего изобретения один или несколько компонентов (a)-(h) добавляют к среде для культивирования клеток, по крайней мере, на один день цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения один или несколько компонентов (a)-(h) добавляют к среде для культивирования клеток в день 0 из 14-дневного цикла культивирования клеток. В любом из вариантов осуществления настоящего изобретения один или несколько компонентов (a)-(h) может быть добавлен к среде для культивирования клеток в любой день цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения клетка представляет собой клетку млекопитающего. В некоторых вариантах осуществления настоящего изобретения клетка млекопитающего представляет собой клетку яичников китайского хомячка (СНО). В некоторых вариантах осуществления настоящего изобретения полипептид представляет собой антитело или его фрагмент.
[0009] В соответствии с некоторыми аспектами, в настоящем изобретении предлагаются также способы получения полипептидов, включающие стадию выращивания клетки, содержащей нуклеиновую кислоту, которая кодирует полипептид, в среде для культивирования клеток, содержащей гипотаурин, или его аналог, или его предшественник, где среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по сравнению с интенсивностью цвета композиции, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не содержащей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения, среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по меньшей мере, приблизительно на 0,1%, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не включающей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, на величину от приблизительно 5% до приблизительно 50%, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не включающей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, содержит гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 0,0001 мМ до приблизительно 500,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 1,0 мМ до приблизительно 40,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 1,0 мМ до приблизительно 10,0 мМ. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник выбран из группы, включающей гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой среду для культивирования клеток с известным химическим составом. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой среду для культивирования клеток с неизвестным химическим составом. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой минимальную среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой питательную среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник добавляют в среду для культивирования клеток, по крайней мере, на один день цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник добавляют в среду для культивирования клеток в день 0 из 14-дневного цикла культивирования клеток. В любом из вариантов осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник может быть добавлен в среду для культивирования клеток в любой день цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения клетка является клеткой млекопитающего. В некоторых вариантах осуществления настоящего изобретения клетка млекопитающего является клеткой яичников китайского хомячка (СНО). В некоторых вариантах осуществления настоящего изобретения полипептид представляет собой антитело. В некоторых вариантах осуществления настоящего изобретения антитело представляет собой антитело IgG1. В некоторых вариантах осуществления настоящего изобретения антитело секретируется в среду для культивирования клеток, содержащую гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения способ дополнительно включает стадию извлечения полипептида из среды для культивирования клеток, содержащей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения композиция, содержащая извлеченный полипептид, представляет собой жидкую композицию или не содержащую жидкость композицию. В некоторых вариантах осуществления настоящего изобретения композиция, содержащая извлеченный полипептид, представляет собой бесцветную или слегка окрашенную жидкость.
[0010] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается способ получения полипептидов, включающий стадию выращивания клетки, которая содержит нуклеиновую кислоту, кодирующую полипептид, в среде для культивирования клеток, где среда для культивирования клеток включает один или несколько компонентов (a)-(h): (a) гипотаурин; (b) s-карбоксиметилцистеин; (c) карнозин; (d) ансерин; (e) бутилзамещенный гидроксианизол; (f) липоевая кислота; (g) гидрат кверцитрина; и (h) аминогуанидин; и где среда для культивирования клеток, включающая один или несколько компонентов (а)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не содержащей один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения, среда для культивирования клеток, включающая один или несколько компонентов (a)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клетками, по меньшей мере, на приблизительно 0,1%, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не включающей один или несколько компонентов (а)-(h). В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, включающая один или несколько компонентов (a)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клетками, на величину от приблизительно 5% до приблизительно 50%, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не включающей один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, включающая один или несколько компонентов (a)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клетками, на величину от приблизительно 5% до приблизительно 75%, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не включающей один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает один или несколько компонентов (а)-(h) в количестве, выбранном из: (a) гипотаурин с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (b) s-карбоксиметилцистеин с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (c) карнозин с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (d) ансерин с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (e) бутилзамещенный гидроксианизол с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (f) липоевая кислота с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; (g) гидрат кверцитрина с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ; и (h) аминогуанидин с концентрацией, по меньшей мере, от приблизительно 0,0003 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает гипотаурин с концентрацией от приблизительно 2,0 мМ до приблизительно 50,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит s-карбоксиметилцистеин с концентрацией от приблизительно 8,0 мМ до приблизительно 12,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит карнозин с концентрацией от приблизительно 8,0 мМ до приблизительно 12,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит ансерин с концентрацией от приблизительно 3,0 мМ до приблизительно 5,0 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит бутилзамещенный гидроксианизол с концентрацией от приблизительно 0,025 мМ до приблизительно 0,040 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит липоевую кислоту с концентрацией от приблизительно 0,040 мМ до приблизительно 0,060 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит гидрат кверцитрина с концентрацией от приблизительно 0,010 мМ до приблизительно 0,020 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает аминогуанидин с концентрацией от приблизительно 0,0003 мМ до приблизительно 245 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает аминогуанидин с концентрацией от приблизительно 0,0003 мМ до приблизительно 10 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой среду для культивирования клеток с известным химическим составом. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой среду для культивирования клеток с неизвестным химическим составом. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой минимальную среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток представляет собой питательную среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения клетка контактирует со средой для культивирования клеток в течение фазы роста клетки. В некоторых вариантах осуществления настоящего изобретения клетка контактирует со средой для культивирования клеток течение фазы продуцирования продукта клеткой. В некоторых вариантах осуществления настоящего изобретения один или несколько компонентов (a)-(h) добавляют в среду для культивирования клеток, по крайней мере, на один день цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения один или несколько компонентов (a)-(h) добавляют в среду для культивирования клеток в день 0 из 14-дневного цикла культивирования клеток. В любом из вариантов осуществления настоящего изобретения один или несколько компонентов (a)-(h) могут быть добавлены в среду для культивирования клеток в любой день цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения клетка является клеткой млекопитающего. В некоторых вариантах осуществления настоящего изобретения клетка млекопитающего представляет собой клетку яичников китайского хомячка (СНО). В некоторых вариантах осуществления настоящего изобретения полипептид представляет собой антитело или его фрагмент. В некоторых вариантах осуществления настоящего изобретения антитело представляет собой антитело IgG1. В некоторых вариантах осуществления настоящего изобретения антитело секретируется в среду для культивирования клеток. В некоторых вариантах осуществления настоящего изобретения способ дополнительно включает стадию извлечения полипептида из среды для культивирования клеток, включающей один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения композиция, содержащая извлеченный полипептид, представляет собой жидкую композицию или не содержащую жидкость композицию. В некоторых вариантах осуществления настоящего изобретения композиция, содержащая извлеченный полипептид, представляет собой бесцветную или слегка окрашенную жидкость. В некоторых вариантах осуществления настоящего изобретения, полипептид может быть получен любым из способов, приведенных в данном описании.
[0011] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается фармацевтическая композиция, которая содержит полипептид, полученный любым из способов, приведенных в данном описании, и фармацевтически приемлемый носитель.
[0012] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается набор реагентов для дополнения среды для культивирования клеток известными химическими составляющими, при этом указанный набор реагентов включает гипотаурин, или его аналог, или его предшественник с концентрацией, по меньшей мере, приблизительно 0,0001 мМ, и где гипотаурин, или его аналог, или его предшественник выбран из группы, включающей гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин.
[0013] В соответствии с другими аспектами, в настоящем изобретении также предлагается набор реагентов для дополнения среды для культивирования клеток известными химическими составляющими, при этом набор реагентов включает одно или более из следующих веществ: (a) гипотаурин в количестве, обеспечивающем, по меньшей мере, от приблизительно 0,0001 мМ гипотаурина в среде для культивирования клеток; (b) s-карбоксиметилцистеин в количестве, обеспечивающем, по меньшей мере, от приблизительно 0,0001 мМ s-карбоксиметилцистеина в среде для культивирования клеток; (c) карнозин в количестве, обеспечивающем, по меньшей мере, от приблизительно 0,0001 мМ карнозина в среде для культивирования клеток; (d) ансерин в количестве, обеспечивающем, по меньшей мере, от приблизительно 0,0001 мМ ансерина в среде для культивирования клеток; (e) бутилзамещенный гидроксианизол в количестве, обеспечивающем, по меньшей мере, от приблизительно 0,0001 мМ бутилзамещенного гидроксианизола; (f) липоевая кислота в количестве, обеспечивающем, по меньшей мере, от приблизительно 0,0001 мМ липоевой кислоты в среде для культивирования клеток; (g) гидрат кверцитрина в количестве, обеспечивающем, по меньшей мере, от приблизительно 0,0001 мМ гидрата кверцитрина в среде для культивирования клеток; и (h) аминогуанидин в количестве, обеспечивающем, по меньшей мере, от приблизительно 0,0003 мМ аминогуанидина в среде для культивирования клеток.
[0014] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается среда для культивирования клеток, содержащая, по меньшей мере, от приблизительно 0,0001 мМ гипотаурина, или его аналога, или его предшественника, выбранного из группы, включающей гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин.
[0015] В соответствии с другими аспектами, в настоящем изобретении предлагается среда для культивирования клеток, содержащая один или несколько компонентов (a)-(h): (a) по меньшей мере, от приблизительно 0,0001 мМ гипотаурина; (b) по меньшей мере, от приблизительно 0,0001 мМ s-карбоксиметилцистеина; (c) по меньшей мере, от приблизительно 0,0001 мМ карнозина; (d) по меньшей мере, от приблизительно 0,0001 мМ ансерина; (e) по меньшей мере, от приблизительно 0,0001 мМ бутилзамещенного гидроксианизола; (f) по меньшей мере, от приблизительно 0,0001 мМ липоевой кислоты; (g) по меньшей мере, от приблизительно 0,0001 мМ гидрата кверцитрина; и (h) по меньшей мере, от приблизительно 0,0003 мМ аминогуанидина.
[0016] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается композиция, включающая (а) клетку, которая содержит нуклеиновую кислоту, кодирующую полипептид; и (b) любую среду для культивирования клеток, приведенную в данном описании.
[0017] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается композиция, включающая (а) полипептид; и (b) любую среду для культивирования клеток, приведенную в данном описании. В некоторых вариантах осуществления настоящего изобретения полипептид в среду для культивирования клеток секретируется клеткой, которая содержит нуклеиновую кислоту, кодирующую указанный полипептид.
[0018] Предполагается, что данное описание достаточно, чтобы позволить специалисту в данной области техники осуществить настоящее изобретение. Различные модификации настоящего изобретения, в дополнение к приведенным и рассмотренным в данном описании, станут очевидными специалистам в данной области из приведенного описания, и они входят в объем прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, цитируемые в данном описании, во всей их полноте и для всех целей включены в данное описание посредством ссылки.
Краткое описание чертежей
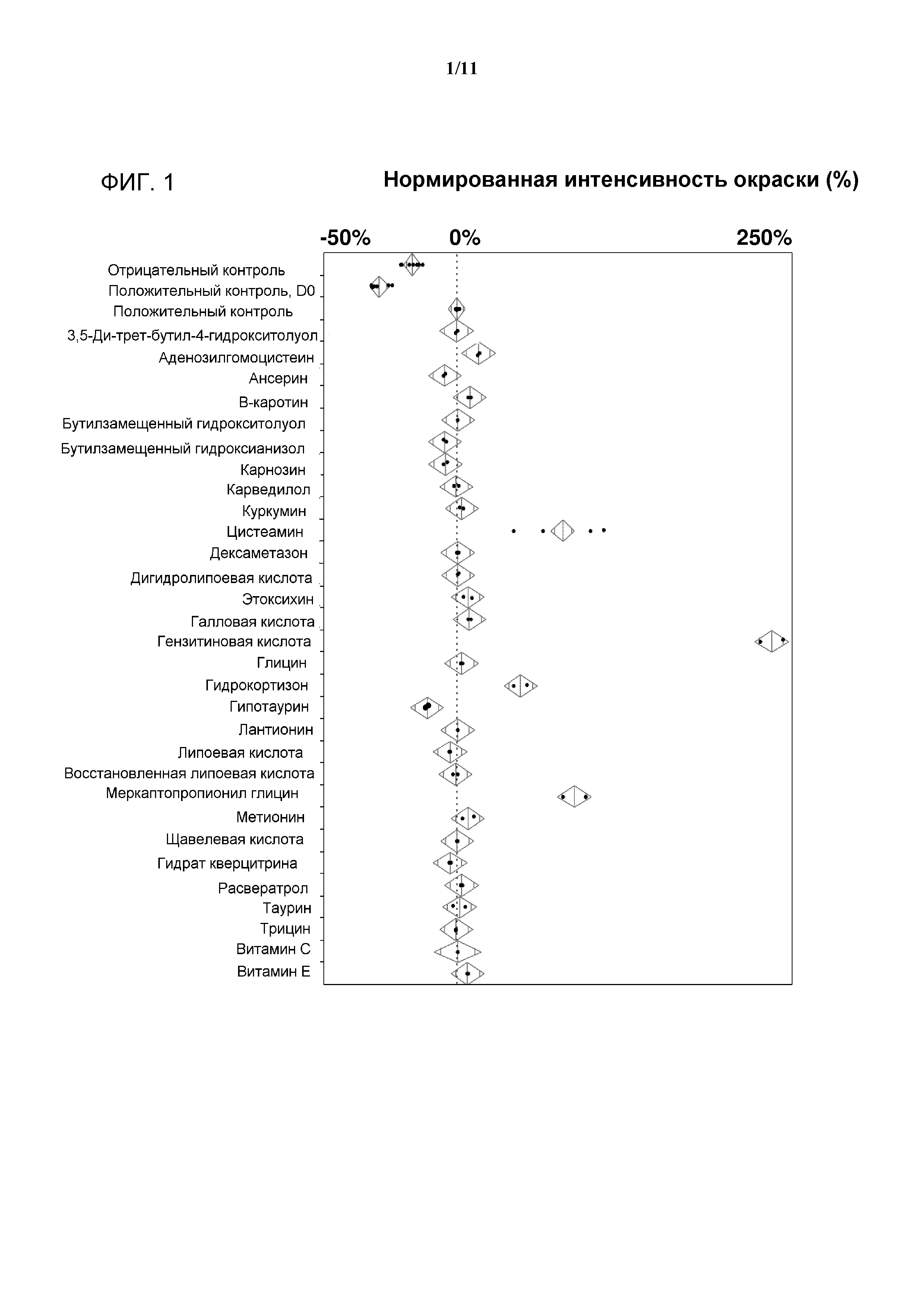
[0019] Фигура 1 представляет собой диаграмму для типичных соединений, испытанных по их влиянию на интенсивность окрашивания в типичной среде для культивирования клеток, содержащей антитело. Численные результаты нормируют к положительному контролю, при этом в качестве значения для положительного контроля устанавливают изменение в интенсивности цвета, равное 0%. Значения больше чем 0% указывают увеличение интенсивности цвета. Значения меньше чем 0% указывают на снижение интенсивности цвета.
[0020] Фигура 2 представляет собой делянку фигуры 1, которая показывает соединения, снижающие интенсивность окрашивания в типичной среде для культивирования клеток, содержащей антитело. Численные результаты нормируют к положительному контролю, при этом в качестве значения для положительного контроля устанавливают изменение в интенсивности цвета, равное 0%. Значения меньше чем 0% указывают на снижение интенсивности цвета.
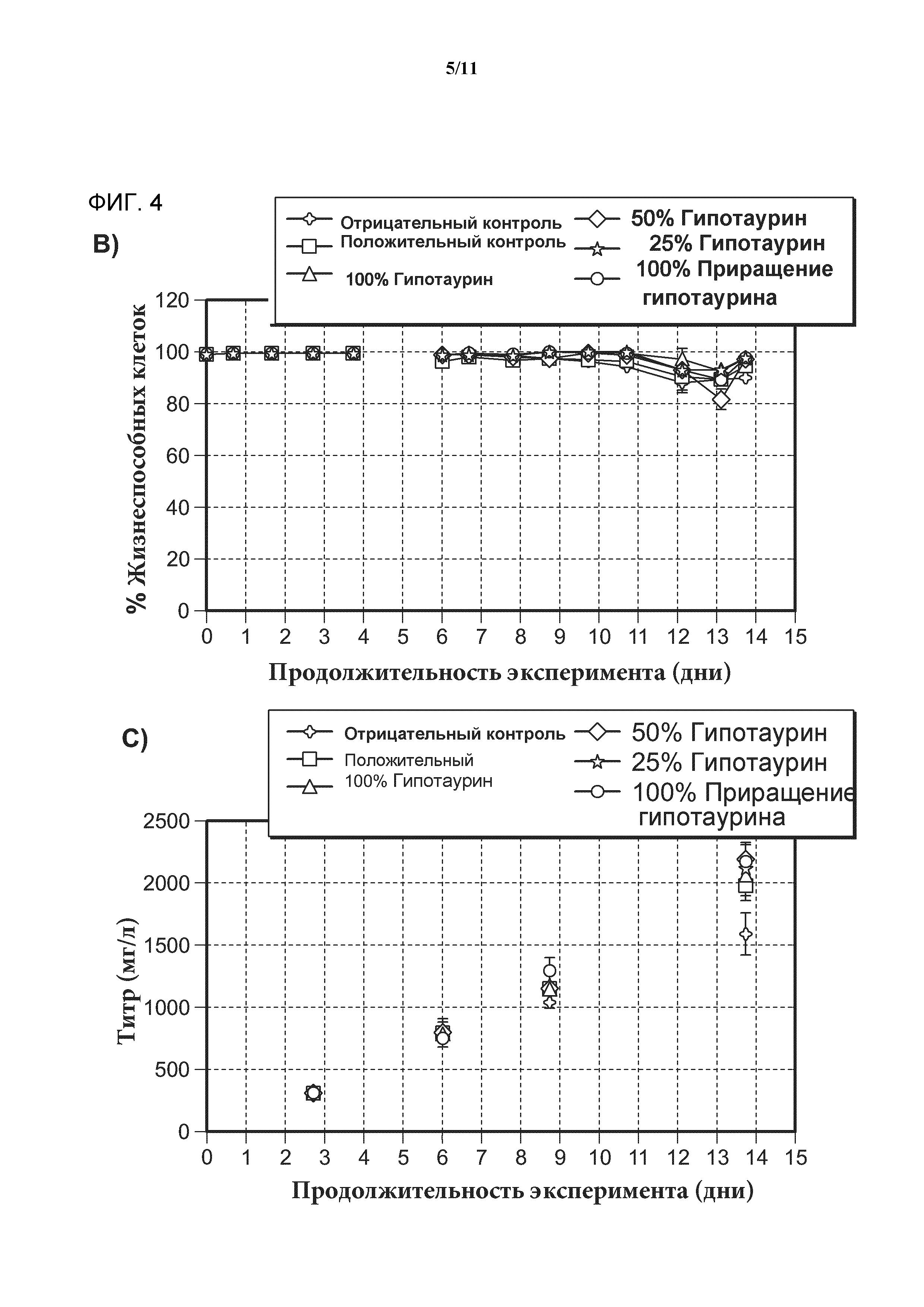
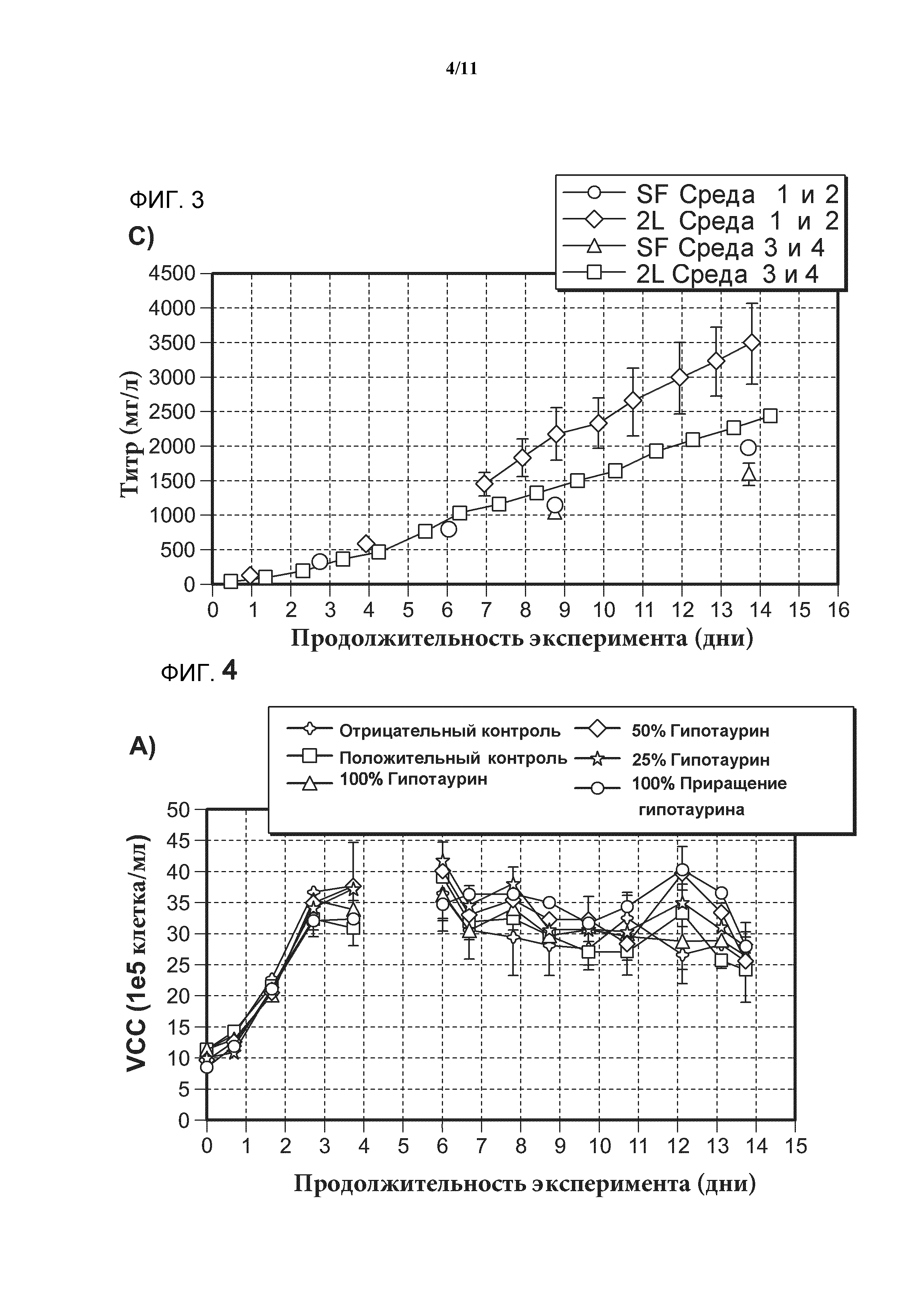
[0021] Фигура 3 представляет собой серию графиков, показывающих, что модель клеточной культуры, приготовленная в шейкере, сравнима с соответствующей более масштабной моделью 2-литровой клеточной культуры. А) Рост клеток в культуре в течение срока инкубации, определяемый по плотности жизнеспособных клеток (VCC) и выраженный в виде количества клеток на единицу объема клеточной культуры. B) Жизнеспособность клеток в культуре клеток в течение срока инкубации, определяемая по количеству жизнеспособных клеток в процентах от общего числа клеток. С) Продуцирование антитела в культуре клеток в течение срока инкубации, определяемое методом высокоэффективной жидкостной хроматографии и выраженное в виде титра антитела. SF обозначает модель клеточной культуры, приготовленной в шейкере. 2L обозначает модель клеточной культуры большего масштаба.
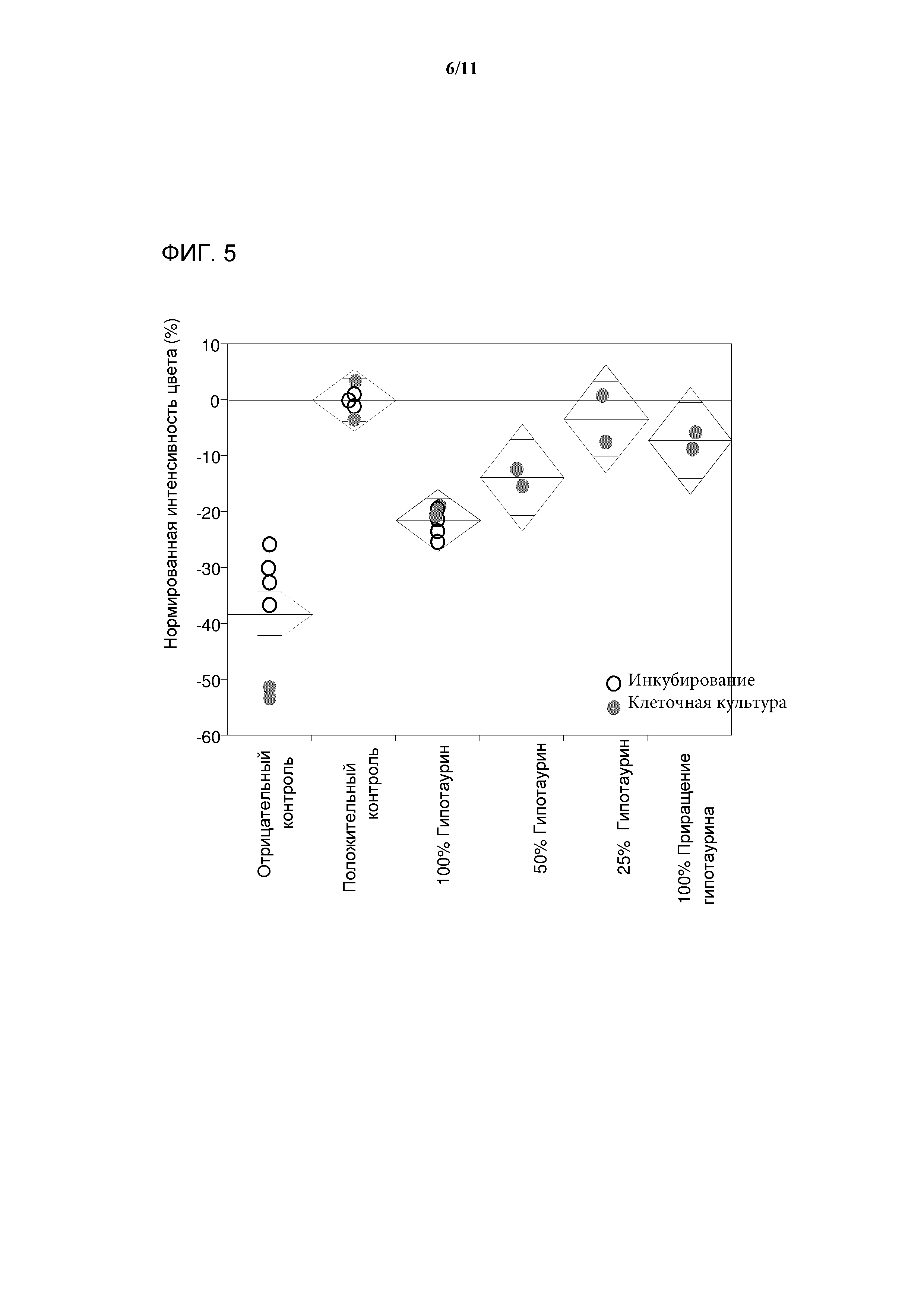
[0022] Фигура 4 представляет собой серию графиков, показывающих, что добавление гипотаурина к среде для культивирования клеток не оказывает негативного влияния на рост клеток, жизнеспособность клеток или продуцирование антител. А) Рост клеток в культуре в течение срока инкубации, определяемый по методу VCC и выраженный в виде количества клеток на единицу объема клеточной культуры. B) Жизнеспособность клеток в культуре клеток в течение срока инкубации, определяемая по количеству жизнеспособных клеток в процентах от общего числа клеток. С) Продуцирование антитела в культуре клеток в течение срока инкубации, определяемое методом высокоэффективной жидкостной хроматографии и выраженное в виде титра антитела.
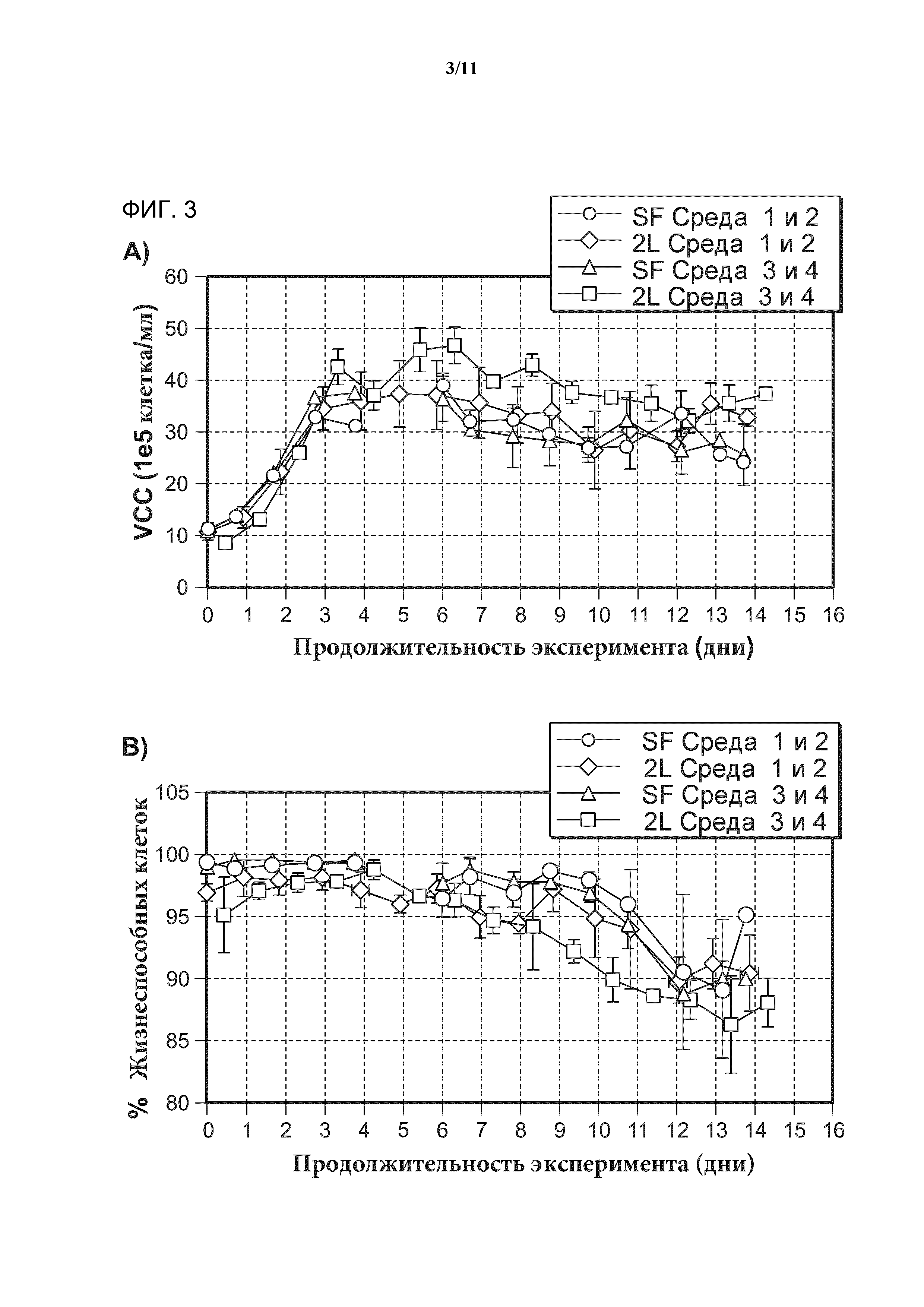
[0023] Фигура 5 представляет собой график, показывающий интенсивность окрашивания композиции антител, выделенных из клеточных культур, которые выращены в среде, дополненной гипотаурином. 100%, 50% или 25% обозначают минимальную Среду 1, дополненную 9,16 мМ, 4,58 мМ или 2,29 мМ гипотаурина, соответственно. Закрашенные кружки обозначают значения интенсивности цвета в экспериментах с культивированием клеток. Не закрашенные кружки обозначают значения интенсивности цвета для экспериментов по отбору при инкубировании. Численные результаты нормируют к положительному контролю, при этом в качестве значения для положительного контроля устанавливают изменение в интенсивности цвета, равное 0%. Значения меньше чем 0% указывают на снижение интенсивности цвета.
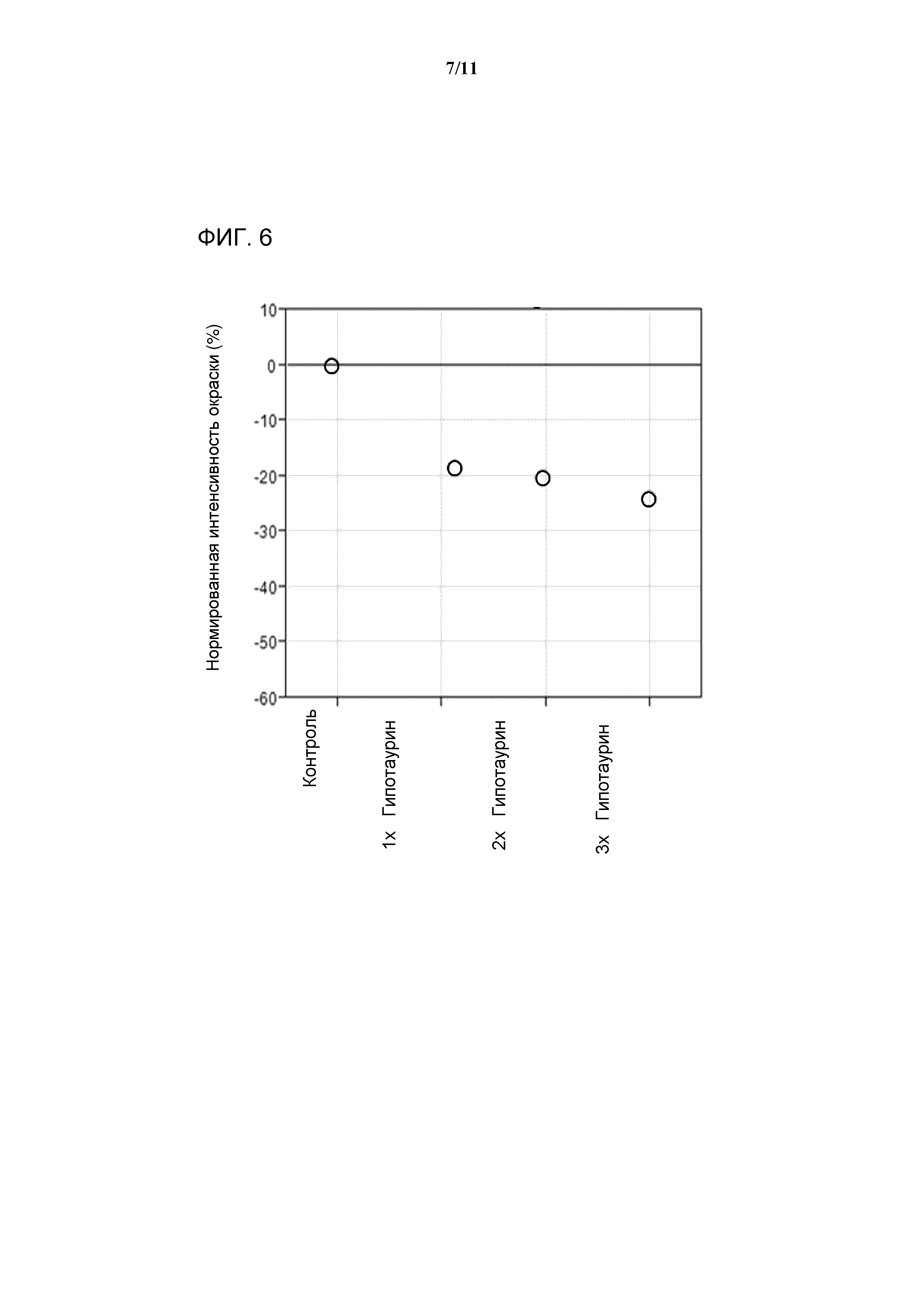
[0024] Фигура 6 представляет собой график, показывающий интенсивность окрашивания композиций антител, выделенных из клеточных культур, которые выращивают в среде с гипотаурином. 3X, 2X или 1X обозначают минимальную среду Media 3, дополненную 38,85 мМ, 25,9 мМ или 12,95 мМ гипотаурина, соответственно. Закрашенные кружки обозначают значения интенсивности окрашивания в экспериментах с культивированием клеток. Численные результаты нормируют к положительному контролю, при этом в качестве значения для положительного контроля устанавливают изменение в интенсивности цвета, равное 0%. Значения меньше чем 0% указывают на снижение интенсивности цвета.
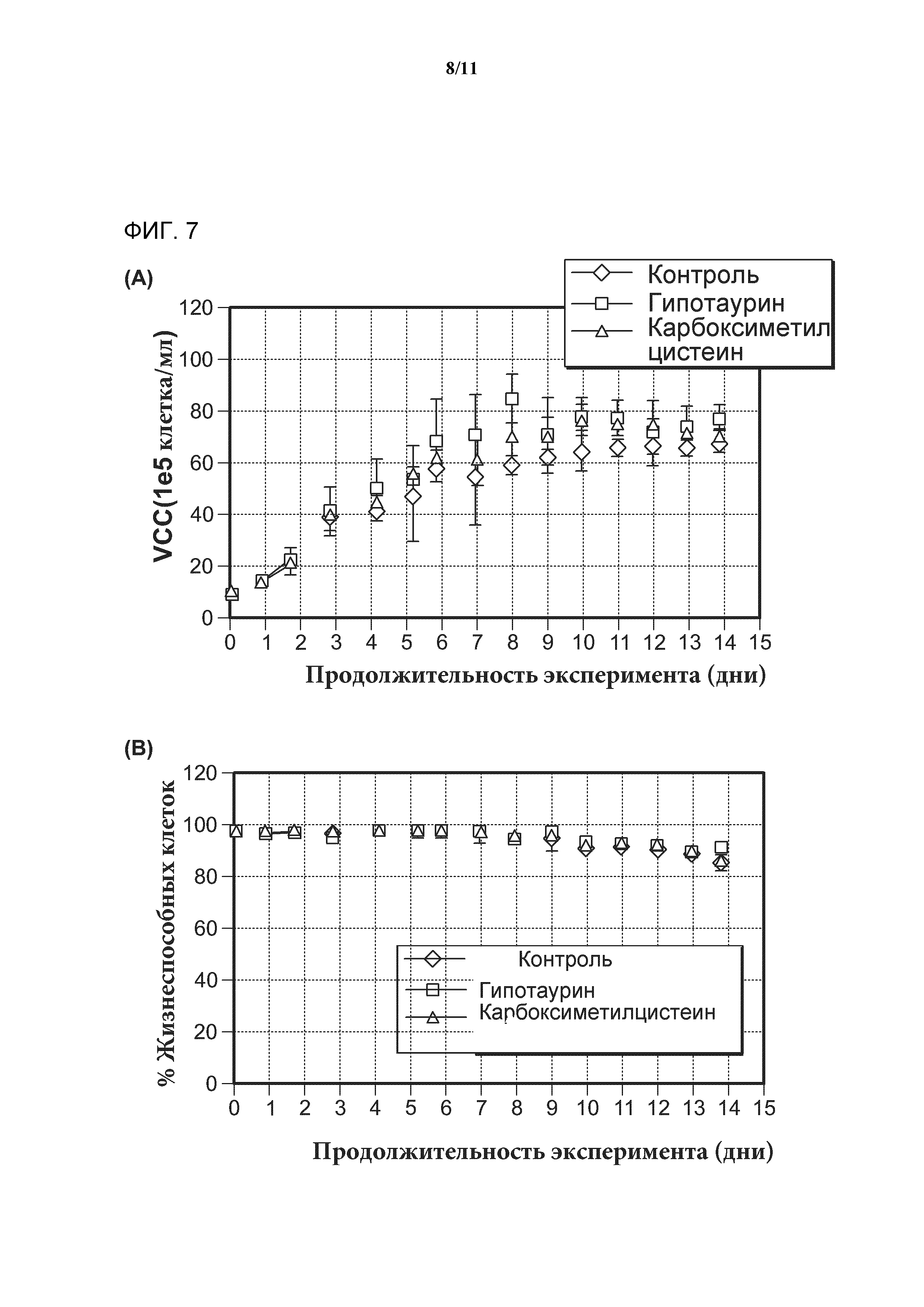
[0025] Фигура 7 включает графики, показывающие, что добавление гипотаурина или карбоксиметилцистеина в среду не оказывает негативного влияния на рост клеток или жизнеспособность клеток. А) Рост клеток в культуре в течение срока инкубации, определяемый по методу VCC и выраженный в виде количества клеток на единицу объема клеточной культуры. B) Жизнеспособность клеток в культуре клеток в течение срока инкубации, определяемая по количеству жизнеспособных клеток в процентах от общего числа клеток.
[0026] Фигура 8 представляет собой график, показывающий, что добавление гипотаурина или карбоксиметилцистеина в среду не снижают существенно продуцирование антител. Продуцирование антитела в культуре клеток в течение срока инкубации определяют методом высокоэффективной жидкостной хроматографии и выражают в виде титра антитела.
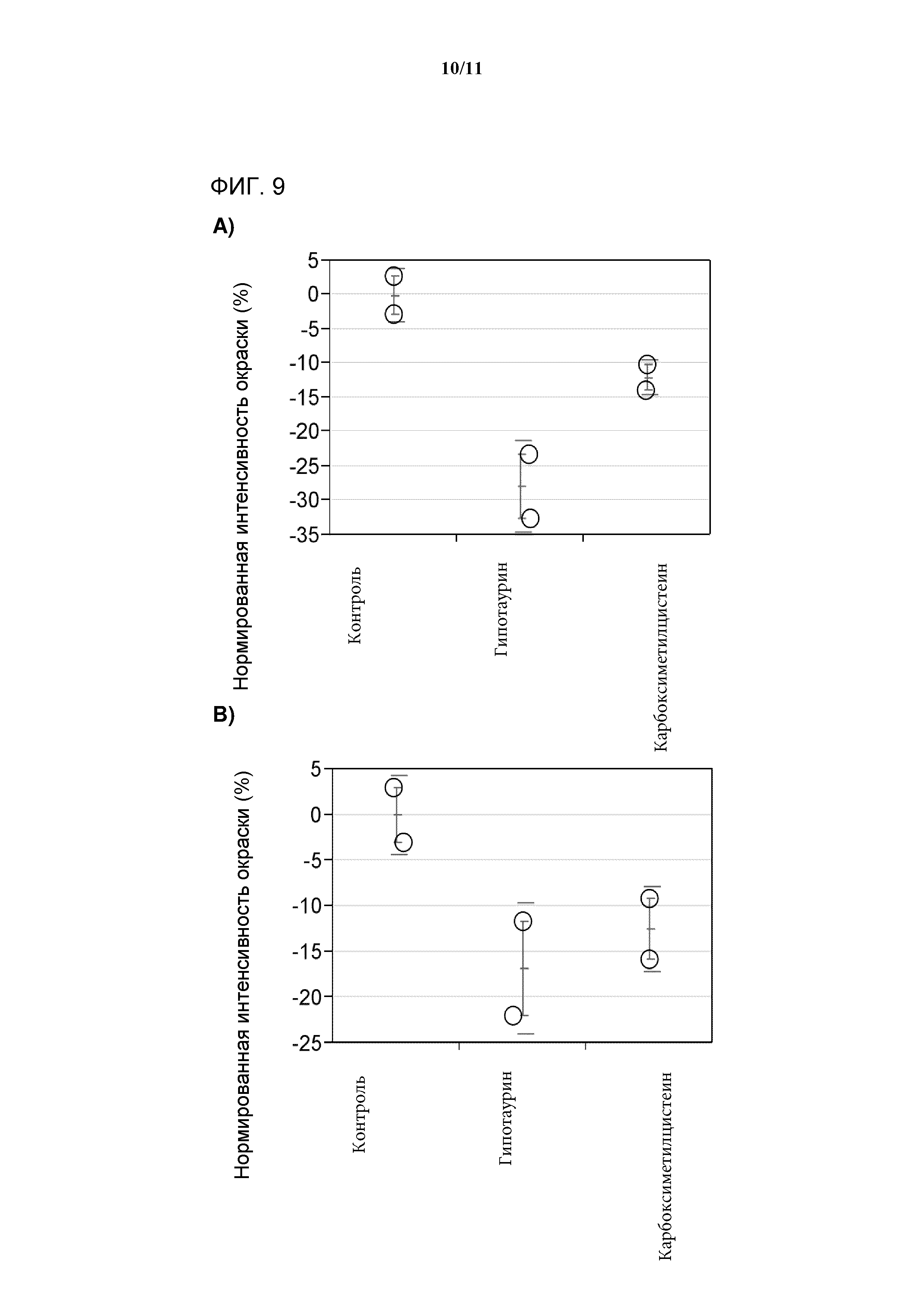
[0027] Фигура 9 представляет собой график, показывающий интенсивность окрашивания композиции антител, выделенных из клеточных культур, которую выращивают в среде, дополненной гипотаурином или карбоксиметилцистеином. А и B) Демонстрируют два разных анализа цвета, которые используют для определения интенсивности цвета. Численные результаты нормируют к положительному контролю, при этом в качестве значения для положительного контроля устанавливают изменение в интенсивности цвета, равное 0%. Значения меньше чем 0% указывают на снижение интенсивности цвета.
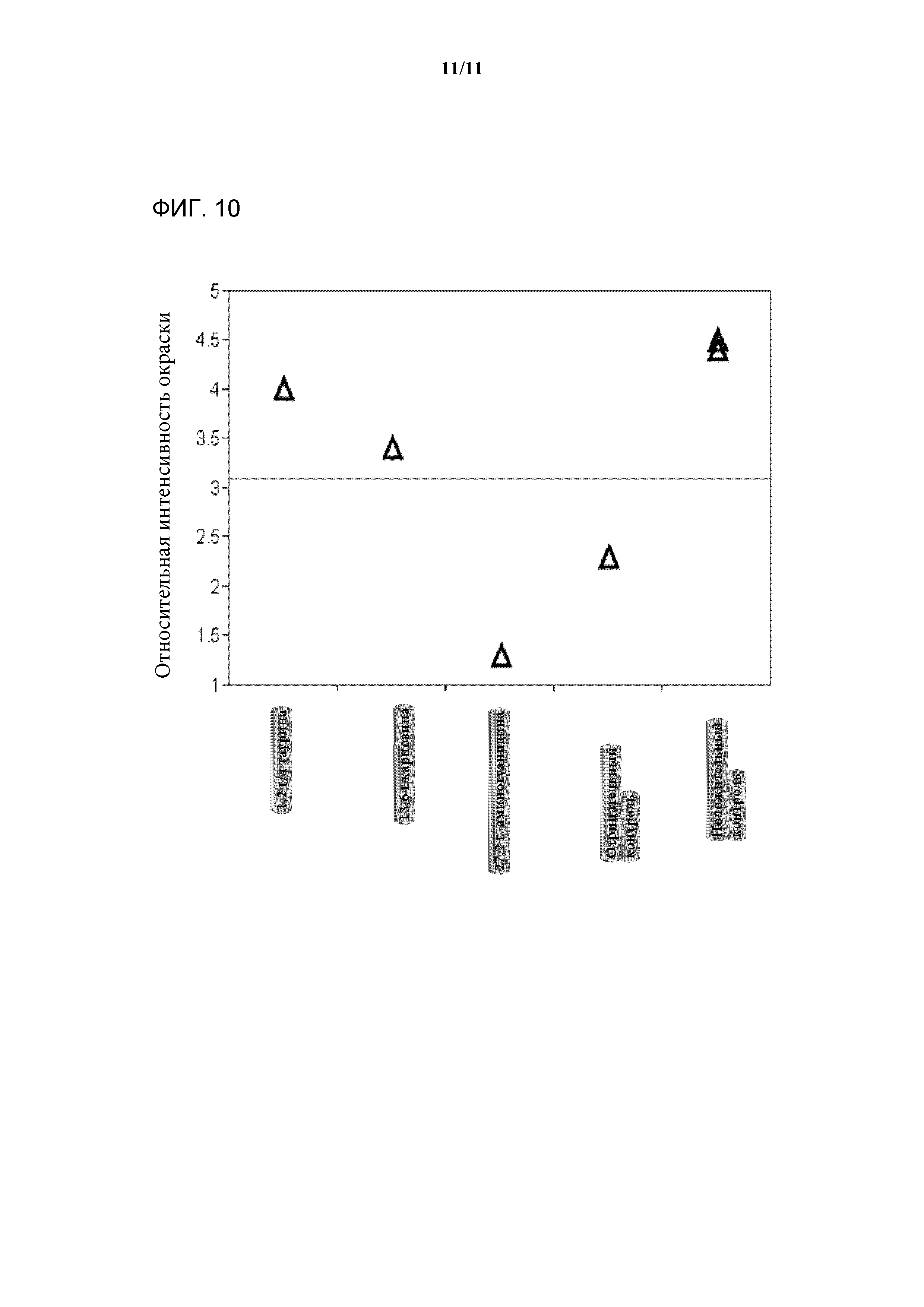
[0028] Фигура 10 представляет собой график, показывающий относительную интенсивность окрашивания композиции антител, выделенных из клеточных культур в среде, дополненной таурином, карнозином, аминогуанидином, отрицательным контролем или положительным контролем.
Подробное описание изобретения
I. Определения
[0029] Термины "среда" и "среда для культивирования клеток" относятся к источнику питательных веществ, который используют для выращивания или поддержания клеток. Как должно быть понятно специалисту в данной области техники, источник питательных веществ может содержать компоненты, необходимые клетке для роста и/или выживания, или может содержать компоненты, которые помогают росту и/или выживанию клеток. Примерами компонентов среды являются витамины, незаменимые или неосновные аминокислоты и микроэлементы.
[0030] "Среда для культивирования клеток с известным химическим составом", или "CDM", представляет собой среду с определенным химическим составом, которая не содержит продуктов, полученных из животных или растений, таких как, например, сыворотка животных и растительный пептон. Как должно быть понятно специалисту в данной области техники, CDM может использоваться в процессе продуцирования полипептида, при этом клетка находится в контакте с CDM и секретирует полипептид в CDM. Таким образом, следует понимать, что композиция может содержать CDM и продукт в виде полипептида и что присутствие продукта в виде полипептида не делает CDM средой с неизвестным химическим составом.
[0031] "Среда для культивирования клеток с неизвестным химическим составом" относится к среде, химический состав которой не может быть точно указан, и которая может содержать один или несколько продуктов, полученных из животных или растений, таких как, например, сыворотка животных и растительный пептон. Как должно быть понятно специалисту в данной области техники, среда для культивирования клеток с неизвестным химическим составом может содержать продукт, полученный из животного или растения в качестве источника питательных веществ.
[0032] "Культивирование" клетки относится к контактированию клетки со средой для культивирования клеток в условиях, подходящих для выживания, и/или роста, и/или пролиферации клетки.
[0033] "Порционная культура" относится к культуре, в которой все компоненты для выращивания клеток (в том числе указанные клетки и все питательные вещества для культуры) помещают в сосуд для культивирования в начале процесса культивирования.
[0034] Выражение "порционная питательная культура", используемое в данном описании, относится к порционной культуре, где вначале клетки и культуральную среду помещают в сосуд для культивирования, а дополнительные питательные вещества для культуры подают в культуру непрерывно или в дискретных количествах в процессе культивирования, с периодическим извлечением или без периодического извлечения клеток или продукта прежде, чем культивирование будет прекращено.
[0035] "Перфузионная культура" представляет собой культуру, в которой клетки удерживаются в культуре, например, с помощью фильтрации, инкапсулирования, закрепления на микроносителях и т.д., а культуральная среда непрерывно или периодически вводится и удаляется из сосуда для культивирования.
[0036] "Сосуд для культивирования" относится к контейнеру, используемому для выращивания клетки. Сосуд для культивирования может быть любого размера, при условии, что он пригоден для культивирования клеток.
[0037] В настоящем описании "аналог гипотаурина" относится к химическому соединению, которое структурно подобно гипотаурину, но отличается от гипотаурина химическим составом (например, отличается по количеству, местоположению или типу функциональных групп или заместителей в ядре гипотаурина). Аналог гипотаурина может обладать или может не обладать отличными от таурина химическими или физическими свойствами и может проявлять или может не проявлять большую активность в среде для культивирования клеток, по сравнению с гипотаурином, например, дополнительно уменьшать интенсивность окрашивания полипептида (в частности, антитела), продуцированного в среде для культивирования клеток, по сравнению с гипотаурин. Например, аналог гипотаурина может быть более гидрофильным или может обладать измененной реакционной способностью, по сравнению с гипотаурином. Аналог гипотаурина может имитировать химическую и/или биологическую активность гипотаурина (т.е. он может иметь подобную или идентичную активность), или в некоторых случаях может обладать повышенной или пониженной активностью, по сравнению с гипотаурином.
[0038] Термин "титр", используемый в данном описании, относится к общему количеству рекомбинантно экспрессированного полипептида, продуцированного клеточной культурой, которое поделено на заданную величину объема среды. Титр обычно выражается в единицах миллиграмм полипептида на миллилитр среды.
[0039] Термин "нуклеиновая кислота", который используют в данном описании взаимозаменяемо, относится к полимерам нуклеотидов любой длины и включает ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания и/или их аналоги, или любой субстрат, который может быть включен в полимер с помощью ДНК- или РНК-полимеразы или с помощью синтетической реакции. Полинуклеотид может включать модифицированные нуклеотиды, такие как метилзамещенные нуклеотиды и их аналоги. Если она присутствует, то модификация нуклеотидной структуры может быть осуществлена до или после сборки полимера.
[0040] "Изолированная молекула нуклеиновой кислоты" означает и включает не встречающуюся в природе, рекомбинантную или природную последовательность вне обычного окружения или выделенную из ее обычного окружения. Изолированная молекула нуклеиновой кислоты имеет другую форму или окружение, отличные от той формы и окружения, в которых она встречается в природе. Поэтому изолированные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, в виде которой они существуют в природных клетках. Однако изолированная молекула нуклеиновой кислоты включает молекулы нуклеиновой кислоты, содержащиеся в клетках, которые обычно экспрессируют белок, где, например, молекула нуклеиновой кислоты находится в положении в хромосоме, отличном от положения в хромосоме в природных клетках.
[0041] Термин "изолированный" белок (например, изолированное антитело) обозначает белок, который был идентифицирован и отделен и/или извлечен из его природного окружения, состоящего из определенных компонентов. Компоненты, являющиеся примесями в природном окружении указанного белка представляют собой вещества, которые могут помешать исследованию, диагностическому или терапевтическому применению указанного белка, и могут включать ферменты, гормоны и другие белковые или небелковые растворимые вещества. Выделенный белок включает белок in situ в рекомбинантных клетках, поскольку, по меньшей мере, один компонент природного окружения белка не будет присутствовать. Однако, как правило, выделенный белок получают, используя, по меньшей мере, одну стадию очистки.
[0042] "Очищенный" полипептид означает, что чистота полипептида была повышена таким образом, что он существует в форме, более чистой, чем форма, в которой он существует в своей естественной среде, и/или первоначально получен, и/или синтезирован, и/или амплифицирован в лабораторных условиях. Чистота является относительным понятием и не обязательно означает абсолютную чистоту.
[0043] "Загрязняющие вещества" относятся к веществам, которые отличаются от требуемого полипептидного продукта. Загрязняющее вещество включает, без ограничения: вещества клетки-хозяина, такие как CHOP; экстрагированный белок А; нуклеиновую кислоту; вариант, фрагмент или производное соединение требуемого полипептида; другой полипептид; эндотоксин; загрязняющее вещество вируса; компонент среды для культивирования клеток и т.д.
[0044] Термины "полипептид" и "белок" используются в данном описание взаимозаменяемо для обозначения полимеров аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может прерываться вставками, отличными от аминокислот. Указанные термины также включают полимер аминокислоты, который был изменен естественным образом или путем вмешательства; примером является образование дисульфидной связи, гликозилирование, липидизация, ацетилирование, фосфорилирование или любая другая манипуляция или модификация, такая как конъюгирование с вносящим метку компонентом. Кроме в данное определение включены, например, полипептиды, содержащие один или несколько аналогов аминокислоты (включая, например, неприродные аминокислоты и т.д.), а также другие модификации, известные из данной области техники. Примеры полипептидов, которые охватываются приведенным в данном описании определением, включают белки млекопитающих, такие как, например, ренин; гормон роста, в том числе гормон роста человека и бычий гормон роста; фактор высвобождения гормона роста; паратиреоидный гормон; тиреотропный гормон; липопротеины; альфа-1-антитрипсин; А-цепь инсулина; B-цепь инсулина; проинсулин; фолликулостимулирующий гормон; кальцитонин; лютеинизирующий гормон; глюкагон; факторы свертывания крови, такие как фактор VIIIC, фактор IX, тканевой фактор и фактор фон Виллебранда; факторы против свертывания крови, такие как белок C; предсердный натрийуретический фактор; легочный сурфактант; активатор плазминогена, такой как урокиназа или мочевой или тканевой активатор плазминогена (t-PA) человека; бомбезин; тромбин; гемопоэтический фактор роста; фактор некроза опухолей альфа и бета; энкефалиназа; RANTES (регулируемый за счет обычной экспрессии и секреции T-клетками при активации); макрофаговый воспалительный белок человека (MIP-1-альфа); сывороточный альбумин, такой как сывороточный альбумин человека; мюллерова ингибирующая субстанция; A-цепь релаксина; B-цепь релаксина; прорелаксин; мышиный гонадотропин-ассоциированный пептид; микробный белок, такой как бета-лактамаза; ДНКаза; IgE; антиген, ассоциированный антиген цитотоксических Т-лимфоцитов (CTLA), такой как CTLA-4; ингибин; активин; фактор роста эндотелия сосудов (VEGF); рецепторы гормонов или факторов роста; белок А или D; ревматоидные факторы; нейротрофический фактор, такой как нейротрофический фактор мозга (BDNF), нейротрофин-3, -4, -5 или -6 (NT-3, NT-4, NT-5 или NT-6) или фактор роста нервов, такой как NGF-б; тромбоцитарный фактор роста (PDGF); фактор роста фибробластов, такой как aFGF и bFGF; эпидермальный фактор роста (EGF); трансформирующий фактор роста (TGF), такой как TGF-альфа и TGF-бета, в том числе TGF-β1, TGF-β2, TGF-β3, TGF-β4 или TGF-β5; инсулин-подобный фактор роста-I и -II (IGF-I и IGF-II); дез(1-3)-IGF-I (мозговой IGF-I), инсулиноподобный фактор роста связывания белков (IGEBPs); CD белки, такие как CD3, CD4, CD8, CD19 и CD20; эритропоэтин; остеоиндуктивные факторы; иммунотоксины; костный морфогенетический белок (BMP); интерферон, такой как интерферон-альфа, -бета и -гамма; колониестимулирующие факторы (CSFs), в частности, M-CSF, GM-CSF и G-CSF; интерлейкины (ILs), в частности, от IL-1 до IL-10; супероксиддисмутаза; Т-клеточные рецепторы; белки поверхности мембраны; фактор, ускоряющий распад; вирусный антиген, такой как, например, часть оболочки вируса AIDS; транспортные белки; "хоминг"-рецепторы; аддрессины; регуляторные белки; интегрины, такие как CD11a, CD11b, CD11c, CD18 и ICAM, VLA-4 и VCAM; опухолеассоциированный антиген, такой как CA125 (антиген рака яичников) или рецептор HER2, HER3 или HER4; иммуноадгезины; и фрагменты и/или варианты любого из вышеперечисленных белков, а также антитела, в том числе фрагменты антител, связывающие белок, в том числе, например, любой из перечисленных выше белков.
[0045] Термин "антитело" в данном описании используется в самом широком смысле и, в частности, охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, мультиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител, при условии, что они проявляют требуемую биологическую активность. Антитело может быть антителом человека, гуманизированным антителом и/ или антителом с созревшей аффинностью.
[0046] Термин "моноклональное антитело" в данном описании относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, составляющие указанную популяцию, являются идентичными, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высоко специфичны, поскольку направлены против единственного участка антигена. Кроме того, в отличие от препаратов поликлональных антител, которые включают различные антитела, направленные против различных детерминант (эпитопов), каждое моноклональное антитело направлено против единственной детерминанты на антигене. Помимо их специфичности моноклональные антитела обладают тем преимуществом, что они могут быть синтезированы без загрязнения другими антителами. Определение "моноклональный" не следует истолковывать как требующий получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые предполагается использовать в соответствии с настоящим изобретением, могут быть изготовлены различными методами, в том числе, например, методом гибридомы (например, Kohler and Milstein, Nature, 256:495-97 (1975); Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)), методами рекомбинантных ДНК в бактериальных клетках, эукариотных клетках животных или растений (см., например, патент США № 4816567), методами фагового дисплея (см., например, Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); и Lee et al., J. Immunol. Methods 284(1-2): 119-132 (2004) и методами получения антител человека или человекоподобных антител у животных, которые имеют часть или все локусы иммуноглобулина человека или гены, кодирующие последовательности иммуноглобулина человека (см., например, WO 1998/24893, WO 1996/34096, WO 1996/33735, WO 1991/10741; Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993); патенты США №№ 5545807; 5545806; 5569825; 5625126; 5633425; и 5661016; Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996); и Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995).
[0047] Термин "фармацевтическая композиция" относится к препарату, который приготовлен в такой форме, которая обеспечивает эффективность биологической активности активного ингредиента и которая не содержит дополнительных компонентов, обладающих неприемлемой токсичностью для субъекта, которому будет вводиться композиция. Подобные композиции стерильны.
[0048] "Фармацевтически приемлемые" носители, наполнители или стабилизаторы приставляют собой носители, наполнители или стабилизаторы, которые нетоксичны для клетки или для млекопитающего, которое подвергается их воздействию в используемых дозах и концентрациях (Remington's Pharmaceutical Sciences (20th edition), ed. A. Gennaro, 2000, Lippincott, Williams & Wilkins, Philadelphia, PA). Часто физиологически приемлемый носитель представляет собой водный рН буферный раствор. Примеры физиологически приемлемых носителей включают буферные растворы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту; низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахарные спирты, такие как маннит или сорбит; солеобразующие противоионы, такие как ион натрия; и/или неионогенные поверхностно-активные вещества, такие как Tween™, полиэтиленгликоль (ПЭГ) и Pluronics™.
[0049] "Стерильный" состав является асептическим или практически свободен от всех живых микроорганизмов и их спор.
[0050] Термин "бесцветные или слегка окрашенные" жидкости относится к жидкой композиции, содержащий полипептид, который определяют методами количественного и/или качественного анализа. Качественный анализ включает визуальный осмотр, такой как сравнения композиции, которая содержит полипептид, со стандартным образцом.
[0051] В данном описании и прилагаемой формуле изобретения формы единственного включают ссылки на множественное число, если из контекста ясно не следует иное. Так, например, ссылка на "соединение" необязательно включает комбинацию двух или нескольких подобных соединений, и т.п.
[0052] Следует понимать, что аспекты и варианты осуществления настоящего изобретения, указанные в данном описании, включают "содержащий", "состоящий" и "состоящий практически из" в аспектах и вариантах осуществления настоящего изобретения.
[0053] Ссылка на "приблизительное" значение или параметр в данном описании включает (и описывает) варианты, направленных на указанное значению или параметр как таковой. Например, описание со ссылкой на "приблизительно X" включает в себя описание "X". Область числовых значений включает величины, определяющие указанный диапазон.
[0054] В том случае, когда аспекты или варианты осуществления настоящего изобретения описываются в терминах группы Маркуша или другого группирования альтернатив, настоящее изобретение охватывает не только всю группу, перечисленную как целое, но и индивидуально каждый член группы и все возможные подгруппы основной группы, а также основную группу, в которой отсутствует один или несколько членов группы. Настоящее изобретение также предусматривает явное исключение одного или нескольких любых членов группы в заявляемом изобретении.
II. Среды для культивирования клеток
[0055] Представленные в данное описание среды для культивирования клеток могут найти применение в способах (например, способах выращивания клеток и получения полипептидов) и в композициях (например, в фармацевтических составах), как подробно рассмотрено в данном описании. Компоненты сред были идентифицированы как способные образовать полипептидный продукт (например, лечебный белок) с приемлемыми показателями качества, такими как приемлемая интенсивность окрашивания. Один или несколько из указанных идентифицированных компонентов сред могут быть использованы для получения полипептидного продукта с приемлемой интенсивностью окрашивания. В данном описании термин "приемлемая интенсивность окрашивания" полипептидного продукта (в частности, композиции, содержащей полипептид) может относиться к интенсивности цвета, необходимой для одобрения полипептидного продукта регулирующей организацией или интенсивности окрашивания, требуемой для использования при оценке воспроизводимости от партии к партии полипептидной продукта. В некоторых вариантах осуществления настоящего изобретения одним или несколькими компонентами сред являются антиоксиданты. В некоторых вариантах осуществления настоящего изобретения один или несколько компонентов сред выбраны из группы, включающей гипотаурин, s-карбоксиметилцистеин, ансерин, бутилзамещенный гидроксианизол, карнозин, липоевую кислоту, гидрат кверцитрина и аминогуанидин. В некоторых вариантах осуществления настоящего изобретения одним или несколькими компонентами сред являются гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения гипотаурин или его аналог, или его предшественник выбран из группы, включающей гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин. В некоторых вариантах осуществления настоящего изобретения одним или несколькими компонентами сред являются таурин, восстановленная форма липоевой кислоты или карведилол.
[0056] Компоненты сред могут быть добавлены в среду для культивирования клеток в формах, которые известны из данной области техники. Например, гипотаурин может быть представлен в виде соединения, идентифицированного под номером CAS 300-84-5, s-карбоксиметилцистеин может быть представлен в виде соединения, идентифицированного под номером CAS 638-23-3, ансерин может быть представлен в виде соединения, идентифицированного под номером CAS 10030-52-1, бутилзамещенный гидроксианизол, может быть представлен в виде соединения, идентифицированного под номером CAS 25013-16-5, карнозин может быть представлен в виде соединения, идентифицированного под номером CAS 305-84-0, липоевая кислота может быть представлена в виде соединения, идентифицированного под номером CAS 1200-22-2, гидрат кверцитрина может быть представлен в виде соединения, идентифицированного под номером CAS 522-12-3. В качестве другого примера, аналоги или предшественники гипотаурина могут быть представлены как s-карбоксиметилцистеин, цистеамин, цистеинсульфиновая кислота и/или таурин. В некоторых вариантах осуществления настоящего изобретения s-карбоксиметилцистеин представлен в виде соединения, идентифицированного под номером CAS 638-23-3, цистеамин представлен в виде соединения, идентифицированного под номером CAS 60-23-1, цистеинсульфиновая кислота представлена в виде соединения, идентифицированного под номером 1115 CAS-65-7, и таурин представлен в виде соединения, идентифицированного под номером CAS 107-35-7. В некоторых вариантах осуществления настоящего изобретения представлено соединение, приведенное в таблице 4, такое как восстановленная форма липоевой кислоты, идентифицированная под номером CAS 462-20-4, или карведилол, идентифицированный под номером CAS 72956-09-3. В некоторых вариантах осуществления настоящего изобретения, аминогуанидин представлен как гидрохлорид аминогуанидина, идентифицированный под номером CAS 1937-19-5. Компоненты среды, приведенные в данном описании, могут быть добавлены в среду для культивирования клеток в виде соли, гидрата или гидрата соли или в любой другой форме, известной специалисту в данной области техники. Компоненты среды также могут быть добавлены в среду для культивирования клеток в виде раствора, экстракта либо в твердой форме. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток является средой с известным химическим составом. В других вариантах осуществления настоящего изобретения среда для культивирования клеток является средой с неизвестным химическим составом.
[0057] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается среда для культивирования клеток, содержащая один или несколько из следующих компонентов: (a) гипотаурин; (b) s-карбоксиметилцистеин; (c) карнозин; (d) ансерин; (е) бутилзамещенный гидроксианизол; (f) липоевая кислота; (g) гидрат кверцитрина; и (h) аминогуанидин. В соответствии с некоторыми вариантами осуществления настоящего изобретения, среда для культивирования клеток включает 2, или 3, или 4, или 5, или 6, или каждый из компонентов (a), (b), (c), (d), (e), (f), (g) и (h). Следует понимать, что среда для культивирования клеток, приведенная в данном описании, может содержать любую комбинацию компонентов (a), (b), (c), (d), (e), (f), (g) и (h) как если бы каждая комбинация была конкретно и индивидуально указана. Например, следует понимать, что среда для культивирования клеток, содержащая четыре из компонентов (a), (b), (c), (d), (e), (f), (g) и (h), может включать любое сочетание компонентов при условии, что присутствует, по меньшей мере, четыре компонента.
[0058] В соответствии с некоторыми аспектами, среда для культивирования клеток, приведенная в данном описании, содержит один или несколько компонентов сред, выбранные из группы, которая включает (a) гипотаурин; (b) s-карбоксиметилцистеин; (с) карнозин; (d) ансерин; (е) бутилзамещенный гидроксианизол; (f) липоевую кислоту; (g) гидрат кверцитрина; и (h) аминогуанидин в количествах, указанных в таблице 1. Следует понимать, что среда может включать любой один или несколько компонентов среды, приведенных в таблице 1 (например, любой один или несколько компонентов (а)-(h), например, среда, содержащая компоненты (a), (b), (c), (d) и (e), или среда, содержащая компоненты (a), (b) и (g), или среда, содержащая только один из компонентов (a)-(h)), в любом из количеств, указанных в таблице 1, как если бы каждая и любая комбинации компонентов и количеств была указана конкретно и индивидуально. В соответствии с одним аспектом, среда для культивирования клеток является средой с известным химическим составом. В соответствии с другим аспектом, среда для культивирования клеток является средой с неизвестным химическим составом. В некоторых вариантах осуществления настоящего изобретения, среда для культивирования клеток включает один или несколько компонентов (a)-(h), при этом (а) составляет, по меньшей мере, от приблизительно 0,0001 мМ гипотаурина, (b) составляет, по меньшей мере, от приблизительно 0,0001 мм s-карбоксиметилцистеина, (c) составляет, по меньшей мере, от приблизительно 0,0001 мМ карнозина, (d) составляет, по меньшей мере, от приблизительно 0,0001 мМ ансерина, (е) составляет, по меньшей мере, от приблизительно 0,0001 мМ бутилзамещенного гидроксианизола, (f) составляет, по меньшей мере, от приблизительно 0,0001 мМ липоевой кислоты, (g) составляет, по меньшей мере, от приблизительно 0,0001 мМ гидрата кверцитрина и (h) составляет, по меньшей мере, от приблизительно 0,0003 мМ аминогуанидина. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток содержит один или несколько компонентов (a)-(h), где (a) составляет от приблизительно 2,0 мМ до приблизительно 50,0 мМ гипотаурина, (b) составляет от приблизительно от 8,0 мМ до приблизительно 12,0 мМ s-карбоксиметилцистеина, (c) составляет от приблизительно 8,0 мМ до приблизительно 12,0 мМ карнозина, (d) составляет от приблизительно 3,0 мМ до приблизительно 5,0 мМ ансерина, (e) составляет от приблизительно 0,025 мМ до приблизительно 0,040 мМ бутилзамещенного гидроксианизола, (f) составляет от приблизительно 0,040 мМ до приблизительно 0,060 мМ липоевой кислоты, (g) составляет от приблизительно от 0,010 мМ до приблизительно 0,020 мМ гидрата кверцитрина и (h) составляет от приблизительно от 0,0003 мМ до приблизительно 10 мМ аминогуанидина.
|
|
|
|
|
|
[0059] В соответствии с некоторыми аспектами, в настоящем изобретении предлагается среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, выбранный из группы, которая включает гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин. В соответствии с некоторыми аспектами, среда для культивирования клеток включает один или несколько следующих компонентов: (a) гипотаурин; (b) S-карбоксиметилцистеин; (c) цистеамин; (d) цистеинсульфиновая кислота; и (e) таурин. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает 2, или 3, или 4, или каждый из компонентов (a), (b), (c), (d) и (e). Следует понимать, что среда для культивирования клеток по настоящему изобретению может включать любую комбинацию компонентов (a), (b), (c), (d) и (e) как если бы каждая и любая комбинация была указана конкретно и индивидуально. Например, следует понимать, что среда для культивирования клеток, содержащая три компонента из (a), (b), (c), (d) и (e), может включать любую комбинацию из указанных компонентов при условии, что присутствуют, по крайней мере, три из указанных компонентов. Аналоги гипотаурина включают, например, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин. Примеры предшественников гипотаурина хорошо известны специалистам из данной области техники, и в соответствии с некоторыми аспектами, предшественником гипотаурина может быть аналог гипотаурина.
[0060] В соответствии с некоторыми аспектами, среда для культивирования клеток, приведенная в данном описании, содержит гипотаурин, или его аналог, или его предшественник в количестве, приведенном в таблице 2. Следует понимать, что среда может включать любой один или несколько компонентов среды из таблицы 2 (например, любой один или несколько компонентов (а)-(е), как, например, среда, содержащая компоненты (a), (b), (c) и (d), или среда, содержащая компоненты (a), (b) и (c), или среда, содержащая только один из компонентов (а)-(е)) в любом из количеств, приведенных в таблице 2, как если бы каждая и любая комбинация компонентов и количеств была указана конкретно и индивидуально. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает гипотаурин, или его аналог, или его предшественник, такой как гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновая кислота и/или таурин с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает гипотаурин, или его аналог, или его предшественник, такой как гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновая кислота и/или таурин с концентрацией от приблизительно 0,5 мМ до приблизительно 500,0 мМ.
|
|
|
|
|
|
[0061] В соответствии с некоторыми аспектами, среда для культивирования клеток, представленная в данном описании, содержит восстановленную форму липоевой кислоты с концентрацией от приблизительно 0,0001 мМ до приблизительно 0,5 мМ. В соответствии с некоторыми аспектами, среда для культивирования клеток, представленная в данном описании, содержит карведилол с концентрацией от приблизительно 0,0001 мМ до приблизительно 1,5 мМ.
[0062] Индивидуальные компоненты среды, представленной в данном описании, могут присутствовать в количествах, которые приводят к формированию одного или нескольких выгодных свойств для культивирования клеток и/или продуцирования полипептида клеточной культурой. Выгодные свойства включают, однако этим не ограничиваясь, меньшее окисление полипептидов в клеточной культуре и/или снижение интенсивности окрашивания композиции, содержащей полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, представленной в данном описании. Выгодные свойства среды для культивирования клеток, представленной в данном описании, также включают снижение интенсивности окрашивания композиции, содержащей полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, при этом не оказывается воздействие на одно или более таких свойств продукта, как количество полипептида, продуцируемого клетками (в частности, титр антител), профиль гликозилирования (например, N-гликозилирование) полипептида, неоднородность заряда полипептида в композиции или целостность аминокислотной последовательности полипептида. В некоторых вариантах осуществления настоящего изобретения одним или несколькими выгодными свойствами для выращивания клетки в среде для культивирования клеток, представленной в данном описании, является сниженная интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, при этом не оказывается воздействие на жизнеспособность клеток, количество продуцируемого клетками полипептида, профиль гликозилирования (например, N-гликозилирования) полипептида, неоднородность заряда полипептида в композиции или целостность аминокислотной последовательности полипептида. В некоторых вариантах осуществления настоящего изобретения одним или несколькими выгодными свойствами для выращивания клетки в среде для культивирования клеток, приведенной в данном описании, является пониженная интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, и меньшее окисление полипептида в клеточной культуре. Указанные выгодные свойства могут найти применение в способах культивирования клетки, содержащей нуклеиновую кислоту, которая кодирует требуемый полипептид, и в способах получения требуемого полипептида в клеточной культуре, как указано в данном описании.
[0063] В соответствии с некоторыми аспектами, еще один компонент, выбранный из группы, которая включает гипотаурин, s-карбоксиметилцистеин, ансерин, бутилзамещенный гидроксианизол, карнозин, липоевую кислоту, гидрат кверцитрина и аминогуанидин, указан в данном описании в количестве, которое приводит к появлению одного или нескольких выгодных свойств для культивирования клеток и/или продуцирования полипептида культурой клеток. В некоторых вариантах осуществления настоящего изобретения количество гипотаурина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,5 мМ до приблизительно 100 мМ, от приблизительно 1,6 мМ до приблизительно 90 мМ, от приблизительно 1,7 мМ до приблизительно 80 мМ, от приблизительно 1,8 мМ до приблизительно 70 мМ, от приблизительно 1,9 мМ до приблизительно 60 мМ, от приблизительно 2,0 мМ до приблизительно 50 мМ или от приблизительно 1,75 мМ до приблизительно 50 мМ. В некоторых вариантах осуществления настоящего изобретения количество s-карбоксиметилцистеина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,5 мМ до приблизительно 120 мМ, от приблизительно 5,0 мМ до приблизительно 15 мМ, от приблизительно 6,0 мМ до приблизительно 14 мМ, от приблизительно 7,0 мМ до приблизительно 13 мМ или от 8,0 мМ до приблизительно 12 мМ. В некоторых вариантах осуществления настоящего изобретения количество ансерина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,5 мМ до приблизительно 20 мМ, от приблизительно 2,0 мМ до приблизительно 10 мМ или от приблизительно от 3,0 мМ до приблизительно 5,0 мМ. В некоторых вариантах осуществления настоящего изобретения количество бутилзамещенного гидроксианизола в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,005 мМ до приблизительно 0,2 мМ, от приблизительно 0,02 мМ до приблизительно 0,05 мМ или от приблизительно 0,025 мМ до приблизительно 0,04 мМ. В некоторых вариантах осуществления настоящего изобретения количество карнозина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,5 мМ до приблизительно 20 мМ, от приблизительно 6,0 мМ до приблизительно 14 мМ или от приблизительно 8,0 мМ до приблизительно 12 мМ. В некоторых вариантах осуществления настоящего изобретения количество липоевой кислоты в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,01 мМ до приблизительно 1,5 мМ липоевой кислоты, от приблизительно 0,036 мМ до приблизительно 0,08 мМ, от приблизительно 0,038 мМ до приблизительно 0,07 мМ или от приблизительно 0,04 мм до приблизительно 0,06 мм. В некоторых вариантах осуществления настоящего изобретения количество гидрата кверцитрина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,005 мМ до приблизительно 0,04 мМ, от приблизительно 0,01 мМ до приблизительно 0,03 мМ, от приблизительно 0,015 мМ до приблизительно 0,025 мМ или от приблизительно 0,01 мМ до приблизительно 0,02 мМ. В некоторых вариантах осуществления настоящего изобретения количество аминогуанидина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,0003 мМ до приблизительно 245 мМ, от приблизительно 0,003 мМ до приблизительно 150 мМ, от приблизительно 0,03 мМ до приблизительно 100 мМ, от приблизительно 0,03 мМ до приблизительно 50 мМ, от приблизительно 0,03 мМ до приблизительно 25 мМ, от приблизительно 0,03 до приблизительно 10 мМ. В некоторых вариантах осуществления настоящего изобретения количество еще одного компонента среды, выбранного из группы, которая включает гипотаурин, s-карбоксиметилцистеин, ансерин, бутилзамещенный гидроксианизол, карнозин, липоевую кислоту, гидрат кверцитрина и аминогуанидин, в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, указано таблице 1.
[0064] В соответствии с некоторыми аспектами, еще один компонент сред, выбранный из группы, которая включает гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин, указан в данном описании в количестве, которое приводит к появлению одного или нескольких выгодных свойств для культивирования клеток и/или продуцирования полипептида клеточной культурой. В некоторых вариантах осуществления настоящего изобретения количество гипотаурина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,5 мМ до приблизительно 100 мМ, от приблизительно 1,6 мМ до приблизительно 90 мМ, от приблизительно 1,7 мМ до приблизительно 80 мМ, от приблизительно 1,8 мМ до приблизительно 70 мМ, от приблизительно 1,9 мМ до приблизительно 60 мМ, от приблизительно 2,0 мМ до приблизительно 50 мМ или от приблизительно 1,75 мМ до приблизительно 50 мМ. В некоторых вариантах осуществления настоящего изобретения количество s-карбоксиметилцистеина среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,5 мМ до приблизительно 120 мМ, от приблизительно 5,0 мМ до приблизительно 15 мМ, от приблизительно 6,0 мМ до приблизительно 14 мМ, от приблизительно 7,0 мМ до приблизительно 13 мМ или от приблизительно 8,0 мМ до приблизительно 12 мМ. В некоторых вариантах количество цистеамина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,01 мМ до приблизительно 300 мМ, от приблизительно 0,02 мМ до приблизительно 1 мМ, от приблизительно 0,04 мМ до приблизительно 0,8 мМ, от приблизительно 0,06 мМ до приблизительно 0,6 мМ, от приблизительно 0,08 мМ до приблизительно 0,4 мМ или от приблизительно 0,1 мМ до приблизительно 0,2 мМ. В некоторых вариантах осуществления настоящего изобретения количество цистеинсульфиновой кислоты в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,1 мМ до 100 мМ, от приблизительно 0,2 мМ до приблизительно 10 мМ, от приблизительно 0,3 мМ до приблизительно 1 мМ, от приблизительно 0,1 мМ до приблизительно 1 мМ, от приблизительно 0,2 мм до приблизительно 0,8 мМ или от приблизительно 0,3 мМ до приблизительно 0,6 мМ. В некоторых вариантах количество таурина в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, составляет от приблизительно 0,5 мМ до 500 мМ, от приблизительно 4,0 мМ до приблизительно 100 мМ или от приблизительно 1,0 мМ до приблизительно 10 мМ. В некоторых вариантах осуществления настоящего изобретения количество еще одного компонента сред, выбранного из группы, включающей гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин, в среде для культивирования клеток, которое приводит к появлению одного или нескольких выгодных свойств, указано в таблице 2.
[0065] Среда для культивирования клеток, указанная в данном описании, в соответствии с одним аспектом, приводит к появлению одного или нескольких благоприятных показателей качества продукта или выгодных свойств, если ее используют в способе получения полипептида в клеточной культуре, по сравнению с показателями качества полипептида, если его получают в другой среде. Активные формы кислорода (ROS), образующиеся за счет использования определенных компонентов среды, могут окислить конкретные аминокислоты в полипептиде и привести к образованию окисленных полипептидных продуктов. Наличие подобных окисленных белковых соединений может также изменить показатели качества белкового продукта, такие как интенсивность окрашивания, которые могут быть особенно важны для полипептидных продуктов, из которых готовят составы с любой концентрацией, такая как, однако этим не ограничиваясь, концентрация больше чем любая из приблизительно 1 мг/мл, приблизительно 10 мг/мл, приблизительно 25 мг/мл, приблизительно 50 мг/мл или от приблизительно 75 мг/мл до 100 мг/мл. В некоторых вариантах осуществления настоящего изобретения присутствие окисленных белковых соединений может изменить показатели качества белкового продукта, такие как интенсивность окрашивания, которые могут быть особенно важны для полипептидных продуктов, из которых готовят составы с концентрацией, больше, чем любая из приблизительно 100 мг/мл, приблизительно 125 мг/мл, приблизительно 150 мг/мл, приблизительно 175 мг/мл, приблизительно 200 мг/мл или приблизительно 250 мг/мл. Интенсивность окрашивания композиции, которая включает полипептид, полученный в среде, подробно описанной в данном документе (в том числе композиции, содержащей, по меньшей мере, приблизительно 1 мг/мл, приблизительно 10 мг/мл, приблизительно 50 мг/мл, приблизительно 100 мг/мл, приблизительно 150 мг/мл, 200 мг/мл или приблизительно 250 мг/мл полипептида, такого как антитело) может быть проанализирована с использованием анализа цвета, такого как рассмотренный в данном описании, или, однако этим не ограничиваясь, цветового стандарта Фармакопеи США и цветового стандарта Европейской Фармакопеи. См. USP-24 Monograph 631 Color and Achromaticity. United States Pharmacopoeia Inc., 2000, p. 1926-1927 и Council of Europe. European Pharmacopoeia, 2008, 7th Ed. P.22, которые во всей их полноте включены в данное описание посредством ссылки. В любом из вариантов осуществления настоящего изобретения, приведенном в данном описании, среды для культивирования клеток, представленные в данном описании, могут быть использованы для приготовления композиций, содержащих полипептид, которые имеют пониженную интенсивность окрашивания, по сравнению со стандартным раствором, как измеряют с помощью анализа цвета. Например, интенсивность окрашивания композиции (например, фармацевтической композиции), которая содержит полипептид (например, лечебный полипептид), полученный с использованием среды для культивирования клеток, как указано в данном описании, может быть уменьшена на любую величину в том числе, однако этим не ограничиваясь, по крайней мере, приблизительно на 0,1%, 0,5%, 1%, 2%, 3%, 4%, 5% или более, по сравнению с композицией, которая содержит полипептид, полученный с использованием среды для культивирования клеток, которая не содержит один или несколько компонентов, приведенных в таблице 1 или Таблице 2.
[0066] Коммерчески доступные среды, такие как, однако этим не ограничиваясь, Ham's F10 (Sigma), минимальная достаточная среда ([MEM], Sigma), RPMI-1640 (Sigma), среда Игла, модифицированная Дульбекко ([DMEM], Sigma), бульон Лурия (LB) и среда Terrific (TB), которые подходят для культивирования клеток, могут быть дополнены любым из компонентов среды, подробно рассмотренных в данном описании (например, с использованием предлагаемого набора реагентов). Кроме того, любая из сред, описанных в Ham and Wallace, Meth. Enz., 58:44 (1979), Barnes and Sato, Anal. Biochem., 102:255 (1980), Vijayasankaran et al., Biomacromolecules, 6:605:611 (2005), Patkar et al., J. Biotechnology, 93:217-229 (2002), в патентах США. №№ 4767704; 4657866; 4927762; или 4560655; WO 90/03430; WO 87/00195; в заявке на патент США с номером регистрации 30985; или в патенте США № 5122469 (содержание всех указанных документов в полном объеме включено в данное описание посредством ссылки), может быть дополнена любым из компонентов среды, подробно рассмотренных в данном описании (например, с использованием предлагаемого набора реагентов).
[0067] В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, представленная в данном описании, содержит цистин и не содержит цистеин. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, представленная в данном описании, содержит цитрат железа(III) и не содержит сульфат железа(II). В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, представленная в данном описании, не содержит цистеин и сульфат железа(II). В некоторых вариантах осуществления настоящего изобретения указанная среда не содержит цистеин и сульфат железа(II) и включает цистин и/или цитрат железа(III). В любом из вариантов осуществления настоящего изобретения, приведенном в данном описании, среда для культивирования клеток может быть минимальной средой или питательной средой. Количество используемых аминокислот, витаминов, микроэлементов и других компонентов сред может в один или два раза превосходить диапазоны, указанные в европейском патенте ЕР 307247 или патенте США № 6180401, и указанные документы в полном объеме включены в данное описание посредством ссылки.
[0068] Любые среды, представленные в данном описании, при необходимости также могут быть дополнены гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), ионами (такими как ион натрия, хлорид, ион кальция, ион магния и фосфат), буферными добавками (такими как HEPES), нуклеозидами (такими как аденозин и тимидин), микроэлементами (определяются как неорганические соединения, обычно присутствующие в конечных концентрациях в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. В соответствии с некоторыми аспектами, среда для культивирования клеток, представленная в данном описании, содержит белки, полученные из растения или животного. В некоторых вариантах осуществления настоящего изобретения представленная в данном описании клеточная культура не содержит белки, полученные из растения или животного. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, которые известны специалистам в данной области техники.
III. Способы и применения по изобретению
[0069] В данном описании предлагаются способы выращивания клеток в среде для культивирования клеток, которая представлена в данном описании, с целью продуцирования требуемых полипептидов. В соответствии с некоторыми аспектами, предлагается способ культивирования клетки, содержащей нуклеиновую кислоту, которая кодирует требуемый полипептид, где указанный способ включает стадию контактирования клетки со средой для культивирования клеток, при этом среда для культивирования клеток содержит один или несколько компонентов, выбранный из группы, которая включает гипотаурин, s-карбоксиметилцистеин, карнозин, ансерин, бутилзамещенный гидроксианизол, липоевую кислоту и гидрат кверцитрина. В некоторых вариантах осуществления настоящего изобретения предлагается способ культивирования клетки, содержащей нуклеиновую кислоту, которая кодирует требуемый полипептид, где указанный способ включает стадию контактирования клетки со средой для культивирования клеток, при этом среда для культивирования клеток содержит один или несколько компонентов, выбранных из группы, которая включает (a) гипотаурин, (b) s-карбоксиметилцистеин, (c) карнозин, (d) ансерин, (e) бутилзамещенный гидроксианизол, (f) липоевую кислоту; (g) гидрат кверцитрина; и (h) аминогуанидин, и где среда для культивирования клеток, включающая один или несколько компонентов (а)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по сравнению с композицией, содержащей полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не включающей один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается, по меньшей мере, приблизительно на 0,1%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается, по меньшей мере, приблизительно на 5%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается на величину от приблизительно 10% до приблизительно 30%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается на величину от приблизительно 5% до приблизительно 75%. В некоторых вариантах осуществления настоящего изобретения, представленных в данном описании, среда для культивирования клеток включает один или несколько компонентов в количестве, выбранном из (a) гипотаурина с концентрацией от приблизительно 2,0 мМ до приблизительно 50,0 мМ, (b) s-карбоксиметилцистеина с концентрацией от приблизительно 8,0 мМ до приблизительно 12,0 мМ, (c) карнозина с концентрацией от приблизительно 8,0 мМ до приблизительно 12,0 мМ, (d) ансерина с концентрацией от приблизительно 3,0 мМ до приблизительно 5,0 мМ, (e) бутилзамещенного гидроксианизола с концентрацией от приблизительно 0,025 мМ до приблизительно 0,040 мМ, (f) липоевой кислоты с концентрацией от приблизительно 0,040 мМ до приблизительно 0,060 мМ, (g) гидрата кверцитрина с концентрацией от приблизительно 0,010 мМ до приблизительно 0,020 мМ и (h) аминогуанидина с концентрацией от приблизительно 0,0003 мМ до приблизительно 20 мМ. В некоторых вариантах осуществления настоящего изобретения один или несколько компонентов, выбранных из группы, которая включает (a) гипотаурин, (b) s-карбоксиметилцистеин, (c) карнозин, (d) ансерин, (e) бутилзамещенный гидроксианизол, (f) липоевую кислоту; (g) гидрат кверцитрина; и (h) аминогуанидин, добавляют в среду для культивирования клеток в день 0 из 14-дневного цикла культивирования клеток.
[0070] В соответствии с некоторыми другими аспектами, предлагается способ культивирования клетки, содержащей нуклеиновую кислоту, которая кодирует требуемый полипептид, где указанный способ включает стадию контактирования клетки со средой для культивирования клеток, содержащей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения предлагается способ культивирования клетки, содержащей нуклеиновую кислоту, которая кодирует требуемый полипептид, где указанный способ включает стадию контактирования клетки со средой для культивирования клеток, содержащей гипотаурин, или его аналог, или его предшественник, при этом среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по сравнению с интенсивностью цвета композиции, включающей полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не содержащей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается, по меньшей мере, приблизительно на 0,1%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается, по меньшей мере, приблизительно на 5%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается на величину от приблизительно 10% до приблизительно 30%. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией в диапазоне от приблизительно 0,5 мМ до приблизительно 500 мМ. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток включает гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 1,0 мМ до приблизительно 40 мМ. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, гипотаурин, или его аналог, или его предшественник выбран из группы, которая включает гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоты и таурин. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник добавляют в среду для культивирования клеток в день 0 из 14-дневного цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник не добавляют в среду для культивирования клеток порциями в течение цикла культивирования клеток.
[0071] В данном описании предлагаются также способы получения требуемого полипептида, включающие стадию выращивания клетки, содержащей нуклеиновую кислоту, которая кодирует полипептид, в среде для культивирования клеток, где среда для культивирования клеток содержит один или несколько компонентов, выбранных из группы, которая включает (a) гипотаурин, (b) s-карбоксиметилцистеин, (c) карнозин, (d) ансерин, (e) бутилзамещенный гидроксианизол, (f) липоевую кислоту, (g) гидрат кверцитрина и (h) аминогуанидин. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, предлагаются способы получения требуемого полипептида, которые включают стадию выращивания клетки, содержащей нуклеиновую кислоту, которая кодирует полипептид, в среде для культивирования клеток, где среда для культивирования клеток содержит один или несколько компонентов, выбранных из группы, которая включает (a) гипотаурин, (b) s-карбоксиметилцистеин, (c) карнозин, (d) ансерин, (e) бутилзамещенный гидроксианизол, (f) липоевую кислоту, (g) гидрат кверцитрина и (h) аминогуанидин, при этом среда для культивирования клеток, содержащая один или несколько компонентов (a)-(h), уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, выращенной среде для культивирования клеток, не включающей один или несколько компонентов (a)-(h). В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается, по меньшей мере, приблизительно на 0,1%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается, по меньшей мере, приблизительно на 5%. В некоторых вариантах осуществления настоящего изобретения, интенсивность окрашивания композиции, которая содержит полипептид, уменьшается на величину от приблизительно 10% до приблизительно 30%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается на величину от приблизительно 5% до приблизительно 75%. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, среда для культивирования клеток содержит один или несколько компонентов в количестве, выбранном из (a) гипотаурина с концентрацией от приблизительно 2,0 мМ до приблизительно 50,0 мМ, (b) s-карбоксиметилцистеина с концентрацией от приблизительно 8,0 мМ до приблизительно 12,0 мМ, (c) карнозина с концентрацией от приблизительно 8,0 мМ до приблизительно 12,0 мМ, (d) ансерина с концентрацией от приблизительно 3,0 мМ до приблизительно 5,0 мМ, (e) бутилзамещенного гидроксианизола с концентрацией от приблизительно 0,025 мМ до о 0,040 мМ, (f) липоевой кислоты с концентрацией от приблизительно 0,040 мМ до приблизительно 0,060 мМ, (g) гидрата кверцитрина с концентрацией от приблизительно 0,010 мМ до приблизительно 0,020 мМ и (h) аминогуанидина с концентрацией от приблизительно 0,0003 мМ до приблизительно 20 мМ. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, один или несколько компонентов, выбранных из группы, которая включает (a) гипотаурин, (b) s-карбоксиметилцистеин, (c) карнозин, (d) ансерин, (e) бутилзамещенный гидроксианизол, (f) липоевую кислоту; (g) гидрат кверцитрина; и (h) аминогуанидин, добавляют в среду для культивирования клеток в день 0 из 14-дневного цикла культивирования клеток.
[0072] В соответствии с другим аспектом, в настоящем изобретении предлагаются способы получения требуемого полипептида, которые включают стадию выращивания клетки, содержащей нуклеиновую кислоту, которая кодирует полипептид, в среде для культивирования клеток. В соответствии с другим аспектом, в настоящем изобретении предлагаются способы получения требуемого полипептида, которые включают стадию выращивания клетки, содержащей нуклеиновую кислоту, которая кодирует полипептид, в среде для культивирования клеток, где среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник, и где среда для культивирования клеток, содержащая гипотаурин, или его аналог, или его предшественник, уменьшает интенсивность окрашивания композиции, которая содержит полипептид, продуцированный клеткой, по сравнению с интенсивностью цвета композиции, содержащей полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не содержащей гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения, интенсивность окрашивания композиции, которая содержит полипептид, уменьшается, по меньшей мере, приблизительно на 0,1%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается, по меньшей мере, приблизительно на 5%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, которая содержит полипептид, уменьшается на величину от приблизительно 10% до приблизительно 30%. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией, по меньшей мере, от приблизительно 0,0001 мМ. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, среда для культивирования клеток содержит гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 0,5 мМ до приблизительно 500 мМ. В некоторых вариантах осуществления настоящего изобретения, среда для культивирования клеток включает гипотаурин, или его аналог, или его предшественник с концентрацией от приблизительно 1,0 мМ до приблизительно 40 мМ. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, гипотаурин, или его аналог, или его предшественник выбран из группы, которая включает гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоты и таурин. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник добавляют в среду для культивирования клеток в день 0 из 14-дневного цикла культивирования клеток. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник не добавляется порциями в среду для культивирования клеток в течение цикла выращивания клеток.
[0073] В любом из вариантов осуществления настоящего изобретения, приведенных в данном описании, среда для культивирования клеток, используемая в способах, представленных в данном описании, может быть средой для культивирования клеток с известным химическим составом или средой для культивирования клеток с неизвестным химическим составом. Среда для культивирования клеток, приведенная в данном описании, может быть использована как минимальная клеточная культуральная среда или как питательная клеточная среда. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, представленная в данном описании, используется в способе культивирование клетки в течение фазы роста клетки. В некоторых вариантах осуществления настоящего изобретения среда для культивирования клеток, представленная в данном описании, используется в способе культивирование клетки в течение продуктивной фазы клетки. В любом из способов, приведенных в данном описании, клетка может быть клеткой млекопитающего, такой как CHO клетка. В некоторых вариантах осуществления настоящего изобретения требуемый полипептид является антителом или его фрагментом.
[0074] В других вариантах осуществления настоящего изобретения, приведенных в данном описании, требуемый полипептид изолируют. Композиция, содержащая изолированный полипептид, может быть подвергнута, по меньшей мере, одной стадии очистки перед проведением оценки интенсивности окрашивания с использованием количественного или качественного анализа цвета, как указано в данном описании. В некоторых вариантах осуществления настоящего изобретения композиция, содержащая изолированный полипептид, представляет собой жидкую композицию или не жидкую композицию. В некоторых вариантах осуществления настоящего изобретения жидкая композиция или не жидкая композиция, содержащая изолированный полипептид, может быть оценена по интенсивности окрашивания с использование анализа цвета, как указано в данном описании или известно из данной области техники. Например, не жидкая композиция, содержащая изолированный полипептид, может представлять собой лиофилизованную композицию, которую впоследствии восстанавливают перед измерением интенсивности окрашивания. В некоторых вариантах осуществления настоящего изобретения, приведенных в данном описании, интенсивность окрашивания композиции, содержащей полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, представленной в данном описании, уменьшается, по меньшей мере, на 0,1% по сравнению с интенсивностью окрашивания композиции, которая содержит полипептид, продуцированный клеткой, которую выращивают в среде для культивирования клеток, не включающей компонент сред, приведенных в данном описании (например, гипотаурин, или его аналог, или его предшественник). В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания снижается, по меньшей мере, приблизительно на 0,1%, по меньшей мере, приблизительно на 0,2%, по меньшей мере, приблизительно на 0,3%, по меньшей мере, приблизительно на 0,4%, по меньшей мере, приблизительно на 0,5%, по меньшей мере, приблизительно на 0,6%, по меньшей мере, приблизительно на 0,7%, по меньшей мере, приблизительно на 0,8%, по меньшей мере, приблизительно на 0,8% или, по меньшей мере, от приблизительно 0,9% до приблизительно 1,0%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания снижается, по меньшей мере, приблизительно на 1%, по меньшей мере, приблизительно на 2%, по меньшей мере, приблизительно на 3%, по меньшей мере, приблизительно на 4%, по меньшей мере, приблизительно на 5%, по меньшей мере, приблизительно на 10%, по меньшей мере, приблизительно на 15%, по меньшей мере, приблизительно на 20%, по меньшей мере, приблизительно на 25%, по меньшей мере, приблизительно на 30%, по меньшей мере, приблизительно на 35%, по меньшей мере, приблизительно на 40%, по меньшей мере, приблизительно на 45%, по меньшей мере, приблизительно на 50%, по меньшей мере, приблизительно на 60%, по меньшей мере, приблизительно на 70%, по меньшей мере, приблизительно на 80% или, по меньшей мере, на величину от приблизительно 90% до приблизительно 100%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания снижается приблизительно на 0,1%, приблизительно на 0,2%, приблизительно на 0,3%, приблизительно на 0,4%, приблизительно на 0,5%, приблизительно на 0,6%, приблизительно на 0,7%, приблизительно на 0,8%, приблизительно от 0,9% до приблизительно 1,0%. В некоторых вариантах осуществления настоящего изобретения, интенсивность окрашивания снижается приблизительно на 1%, приблизительно на 2%, приблизительно на 3%, приблизительно на 4%, приблизительно на 5%, приблизительно на 6%, приблизительно на 7%, приблизительно на 8%, приблизительно на 9%, приблизительно на 10%, приблизительно на 11%, приблизительно на 12%, приблизительно на 13%, приблизительно на 14%, приблизительно на 15%, приблизительно на 16%, приблизительно на 17%, приблизительно на 18%, приблизительно на 19%, приблизительно на 20%, приблизительно на 21%, приблизительно на 22%, приблизительно на 23 %, приблизительно на 24%, приблизительно на 25%, приблизительно на 26%, приблизительно на 27%, приблизительно на 28%, приблизительно на 29%, приблизительно на 30%, приблизительно на 31%, приблизительно на 32%, приблизительно на 33%, приблизительно на 34%, приблизительно на 35%, приблизительно на 45%, приблизительно на 50%, приблизительно на 60%, приблизительно на 70%, приблизительно на 80%, на величину от приблизительно 90% до приблизительно 100%. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания снижается на величину от приблизительно 1% до приблизительно 10%, от приблизительно 5% до приблизительно 15%, от приблизительно 5% до приблизительно 20%, от приблизительно 5% до приблизительно 25%, от приблизительно 5% до приблизительно 30%, от приблизительно 5% до приблизительно 35%, от приблизительно 5% до приблизительно 40%, от приблизительно 5% до приблизительно 45%, от приблизительно 5% до приблизительно 50%, от приблизительно 10% до приблизительно 20% или от приблизительно 15% до приблизительно 25%. В некоторых вариантах осуществления настоящего изобретения композиция, содержащая изолированный полипептид, имеет вид бесцветной или слегка окрашенной жидкости или композиции. Определить, является ли жидкость или композиция бесцветной или слегка окрашенной, можно с помощью анализа цвета, как указано в данном описании, или с помощью анализа цвета, известного специалисту из данной области техники. В другом варианте осуществления настоящего изобретения композиция представляет собой фармацевтическую композицию, которая необязательно дополнительно включает фармацевтически приемлемый носитель, как указано в данном описании.
[0075] Предлагаются также способы введения полипептида, как подробно указано в данном описании. Например, предлагается способ введения индивиду композиции, включающей полипептид, где указанная композиция содержит полипептид с концентрацией, превышающей, по меньшей мере, приблизительно 100 мг/мл, по меньшей мере, приблизительно 125 мг/мл или, по меньшей мере, приблизительно 150 мг/мл, и имеет значение интенсивности окрашивания больше чем B3, B4, B5, B6, B7, B8 или B9, как определяют с помощью COC анализа. В соответствии с некоторыми аспектами, значение интенсивности окрашивания, как определяют с помощью COC анализа, может быть, однако этим не ограничиваясь, любым из B, BY, Y, GY или R, где более высокие значения обозначают меньшую интенсивность окрашивания. Препараты, содержащие требуемый полипептид, могут быть пригодны для введения индивиду, например, путем подкожной инъекцией (например, путем подкожной инъекции человеку). В соответствии с некоторыми аспектами, композиция, содержащая требуемый полипептид, пригодна для инъекции (например, пригодна для подкожной инъекции) с концентрацией, равной больше чем, по меньшей мере, 100 мг/мл, по меньшей мере, 125 мг/мл или, по меньшей мере, 150 мг/мл, и имеет значение интенсивности окрашивания больше чем B3, B4, B5, B6, B7, B8 или B9, как определяют с помощью COC анализа. В соответствии с некоторыми аспектами, значение интенсивности окрашивания, как определяют с помощью COC, анализа может быть, однако этим не ограничиваясь, любым из B, BY, Y, GY или R, где более высокие значения обозначают меньшую интенсивность окрашивания.
[0076] Другие способы приведены в данном описании, например, в разделе сущности изобретения и в других разделах.
Продуцирование полипептида
[0077] Среда для культивирования клеток, подробно рассмотренная в данном описании, может использоваться в способе выращивания клеток, предназначенных для получения полипептидов, в том числе конкретных антител. Указанная среда может быть использована в способе выращивания клеток либо в порционной клеточной культуре, либо в подпитываемой клеточной культуре, либо в перфузионной клеточной культуре, и может быть использована в способе получения любого полипептида, включая любые аспекты или варианты продуцирования полипептида, как указано в данном описании. Полипептиды, полученные с помощью композиций (например, клетки, выращенной в среде для культивирования клеток, приведенной в данном описании) и способов, приведенных в данном описании, и присутствующие в композиции (например, среде для культивирования клеток, содержащей продуцированный полипептид), которые представлены в данном описании, могут быть гомологичными клетке-хозяину или, предпочтительно, могут быть экзогенными, и это означает, что они являются гетерологичными, т.е. внешними по отношению к применяемой клетке-хозяину, такими как, например, белок человека, продуцируемый клетками яичников китайского хомячка, или дрожжевой полипептид, продуцируемый клеткой млекопитающего. В одном из вариантов полипептид представляет собой полипептид млекопитающего (такой как антитело), который секретируется непосредственно в среду для клетки хозяина. В другом варианте полипептид высвобождается в среду посредством лизиса клетки, содержащей нуклеиновую кислоту, которая кодирует полипептид.
[0078] Любой полипептид, способный экспрессироваться в клетке хозяина, может быть получен в соответствии с настоящим изобретением и может присутствовать в представленных композициях. Полипептид может экспрессироваться из гена, который является эндогенным для клетки хозяина, или из гена, который вводят в клетку хозяина с помощью методов генной инженерии. Полипептид может быть пептидом, который встречается в природе, или, в качестве альтернативы, может иметь последовательность, которая была сконструирована или отобрана рукой человека. Сконструированный полипептид может быть собран из других полипептидных сегментов, которые по отдельности встречаются в природе, или могут включать один или несколько сегментов, которые в природе не встречаются.
[0079] Полипептиды, которые подходящим образом могут быть экспрессированы в соответствии с настоящим изобретением, часто выбирают на основе необходимой биологической или химической активности. Например, настоящее изобретение может быть использовано для экспрессирования любого фармацевтического или подходящего коммерческого фермента, рецептора, антитела, гормона, регуляторного фактора, антигена, связывающего агента и т.д.
[0080] Способы получения полипептидов, таких как антитела, в клеточной культуре хорошо известны из данной области техники. В настоящем изобретении предлагаются не ограничивающие настоящее изобретение примеры способов продуцирования антител (например, полноразмерных антител, фрагментов антител и мультиспецифических антител) в клеточной культуре. Приведенные в данном описании способы могут быть адаптированы специалистом в данной области, с целью производства других белков, таких как ингибиторы на основе белков. См. документы Molecular Cloning: A Laboratory Manual (Sambrook et al., 4th ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2012); Current Protocols in Molecular Biology (F.M. Ausubel, et al. eds., 2003); Short Protocols in Molecular Biology (Ausubel et al., eds., J. Wiley and Sons, 2002); Current Protocols in Protein Science (Horswill et al., 2006); Antibodies, A Laboratory Manual (Harlow and Lane, eds., 1988); Culture of Animal Cells: A Manual of Basic Technique and Specialized Applications (R.I. Freshney, 6th ed., J. Wiley and Sons, 2010) для в целом хорошо изученных и широко используемых методик и процедур для получения белков (в частности, лечебных белков), все из которых во всей своей полноте все включены в данное описании посредством ссылки.
(A) Получение антител
[0081] Антитело, которое получают в клеточной культуре с использованием среды для культивирования клеток, приведенной в данном описании, направлена против требуемого антигена. Антиген, преимущественно, представляет собой биологически важный полипептид, и введение композиций, содержащих антитела, млекопитающему, страдающему от расстройства, может оказаться терапевтически полезным указанному млекопитающему.
(i) Получение антигенов
[0082] Растворимые антигены или их фрагменты, необязательно конъюгированные с другими молекулами, могут быть использованы в качестве иммуногенов для генерирования антител. Для трансмембранных молекул, таких как рецепторы, в качестве иммуногена могут быть использованы их фрагменты (например, внеклеточный домен рецептора). В качестве альтернативы, в качестве иммуногена могут быть использованы клетки, экспрессирующие трансмембранную молекулу. Подобные клетки могут быть получены из природного источника (например, из линий раковых клеток) или могут представлять собой клетки, которые были трансформированы рекомбинантными методами, с целью экспрессировать трансмембранную молекулу. Другие антигены и их формы, пригодные для получения антител, очевидны для специалистов в данной области техники.
(ii) Некоторые способы на основе антител
[0083] Необходимые моноклональные антитела могут быть приготовлены с помощью метода гибридомы, впервые описанного Kohler et al., Nature, 256:495 (1975) и далее описанного, например, в Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981) и Ni, Xiandai Mianyixue, 26(4):265-268 (2006) и касающегося гибридом человек-человек. Дополнительные методы включают методы, которые описаны, например, в патенте США № 7189826 и касаются продуцирования природных моноклональных тел IgM человека из клеточных линий гибридомы. Технология гибридомы человека (метод Trioma) описана в документах Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) и Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005).
[0084] Различные другие методы гибридомы см., например, в US 2006/258841; US 2006/183887 (полностью антитела человека), US 2006/059575; US 2005/287149; US 2005/100546; US 2005/026229; и в патентах США №№ 7078492 и 7153507. Примерная методика для получения моноклональных антител с использованием метода гибридомы выглядит следующим образом. В одном варианте осуществления настоящего изобретения мышь или другое подходящее животное-хозяина, такого как хомячок, иммунизируют, чтобы вызвать появление лимфоцитов, продуцирующих или способных продуцировать антитела, которые будут специфически связываться с белком, используемым для иммунизации. Антитела вызывают у животных путем нескольких подкожных (sc) или внутрибрюшинных (ip) инъекции требуемого полипептида или его фрагмента и вспомогательного соединения, такого как монофосфориллипид A (MPL)/дикриномиколят трегалозы (TDM) (Ribi Immunochem. Research Inc., Hamilton, Mont.). Сыворотку от иммунизированных животных анализируют на антитела к антигену и необязательно проводят повторные иммунизации. Выделяют у животных лимфоциты, продуцирующих антитела к антигену. В качестве альтернативы, лимфоциты могут быть иммунизированы в условиях in vitro.
[0085] Затем лимфоциты сливают с клетками миеломы с использованием подходящего фактора, вызывающего слияние клеток, такого как полиэтиленгликоль, с образованием клетки гибридомы. См., например, Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986). Могут быть использованы клетки миеломы, которые эффективно сливаются, поддерживают стабильно высокий уровень продуцирования антитела выбранными продуцирующими антитело клетками и чувствительны к среде, такой как среда НАТ. Примеры клеток миеломы включают, однако этим не ограничиваясь, линии миеломы мышей, такие как линии, полученные из опухолей мышей МОРС-21 и МРС-11, которые доступны из Центра распределения клеток Института Солка (Сан-Диего, Калифорния, США), и клетки SP-2 или X63-Ag8-653, доступные из Американской коллекции типовых культур (Роквилл, Мэриленд, США). Клетки миеломы человека и клеточные линии гетеромиеломы мышь-человек также описаны для получения моноклональных антител человека (Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
[0086] Полученные подобным образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, например, среде, содержащей одно или несколько веществ, которые ингибируют рост или выживание не слитых родительских клеток миеломы. Например, если родительские клетки миеломы лишены фермента гипоксантин-гуанин-фосфорибозилтрансфераза (HGPRT или HPRT), то культуральная среда для гибридом, как правило, включает гипоксантин, аминоптерин и тимидин (среда НАТ), в которой указанные вещества предотвращают рост HGPRT-дефицитных клеток. Предпочтительно используются способы культивирования клеток гибридомы без сыворотки с тем, чтобы сократить использования сыворотки животного происхождения, такой как фетальная бычья сыворотка, как описано, например, в Even et al., Trends in Biotechnology, 24(3), 105-108 (2006).
[0087] Олигопептиды как инструменты для повышения производительности культур клеток гибридомы описаны в Franek, Trends in Monoclonal Antibody Research, 111-122 (2005). В частности, стандартные культуральные среды обогащают определенными аминокислотами (аланином, серином, аспарагином, пролином) или фракциями белковых гидролизатов, и апоптоз может быть значительно подавлен синтетическими олигопептидами, включающими от трех до шести аминокислотных остатков. Пептиды присутствуют в миллимолярных или более высоких концентрациях.
[0088] Культуральную среду, в которой выращивают клетки гибридомы, можно анализировать на продуцирование моноклональных антител. Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, может быть определена путем иммунопреципитации или анализом связывания в условиях in vitro, такими как радиоиммуноанализ (RIA) или ферментный иммуносорбентный анализ (ELISA). Сродство связывания моноклонального антитела можно определить, например, с помощью анализа Скэтчарда. См., например, Munson et al., Anal. Biochem., 107:220 (1980).
[0089] После того как установлено, что клетки гибридомы продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны можно субклонировать, используя метод серийных разведений, и вырастить, используя стандартные методы. См., в частности, Goding, supra. Подходящие культуральные среды для этой цели включают, например, D-MEM или RPMI-1640. В некоторых вариантах осуществления настоящего изобретения, клетки гибридомы выращивают в среде для культивирования клеток, представленной в данном описании. В некоторых вариантах осуществления настоящего изобретения клетки гибридомы выращивают в среде для культивирования клеток, включающей один или несколько компонентов сред, выбранных из группы, которая включает гипотаурин, s-карбоксиметилцистеин, ансерин, бутилзамещенный гидроксианизол, карнозин, липоевую кислоту и гидрат кверцитрина. В некоторых вариантах осуществления настоящего изобретения одним или несколькими компонентами сред является гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник выбран из группы, которая включает гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислот и таурин.
[0090] Антитела могут быть получены с использованием рекомбинантных методов. Для рекомбинантного получения антител к антигену, нуклеиновую кислоту, которая кодирует антитело, выделяют и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификация ДНК) или для экспрессии. ДНК, которая кодирует антитело, может быть легко изолирована и секвенирована с помощью обычных методик (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Многие из векторов доступны. Компоненты вектора обычно включают, однако этим не ограничиваясь, один или несколько из следующих компонентов: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, элемент энхансера, промотор и последовательность терминации транскрипции.
(III) Методы скрининга определенных библиотек
[0091] Антитела могут быть получены с помощью комбинаторных библиотек для скрининга антител с требуемой активностью или требуемыми активностями. Например, из данной области техники известны различные методы генерирования библиотек фагового дисплея и скрининга подобных библиотек антител, обладающих требуемыми характеристиками связывания. Подобные способы в общем случае описаны Hoogenboom et al. в Methods in Molecular Biology 178:1-37 (O'Brien et al., ed., Human Press, Totowa, N.J., 2001).1-37. Например, один из способов получения требуемых антител заключается в использовании библиотеки антител бактериофагов, как описано в Lee et al., J. Mol. Biol. (2004), 340(5):1073-93.
[0092] В принципе, синтетические клоны антител отбирают путем скрининга фаговых библиотек, содержащих бактериофаг, который отображает различные фрагменты вариабельной области антитела (Fv), слитой с белком оболочки бактериофага. Подобные фаговые библиотеки сортируют способом пэннинга, используя аффинную хроматографию против требуемого антигена. Клоны, экспрессирующие Fv-фрагменты, которые способны связываться с требуемым антигеном, адсорбируются на антигене и, таким образом, отделяются от не связывающихся клонов в библиотеке. Связавшиеся клоны затем элюируются с антигена, и могут быть далее обогащены в дополнительных циклах адсорбции на антигене/элюировании. Любое необходимое антитело может быть получено в результате разработки подходящей методики скрининга антигена с тем, чтобы отобрать требуемый клон бактериофага с последующим конструированием клона полноразмерного антитела с использованием последовательностей Fv из требуемого клона бактериофага и подходящих последовательностей константной области (Fc), описанных в Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda Md. (1991), vols. 1-3.
[0093] В некоторых вариантах осуществления настоящего изобретения антигенсвязывающий домен антитела образован двумя вариабельными (V) областями, состоящими приблизительно из 110 аминокислот, по одной из легкой (VL) и тяжелой (VH) цепей, каждая из которых содержит три гипервариабельные петли (HVRs) или определяющие комплементарность области (CDR). Вариабельные домены могут быть функционально отображены на бактериофаге либо в виде одноцепочечных фрагментов Fv (scFv), в которых VH и VL ковалентно связаны посредством короткого гибкого пептида, либо в виде Fab-фрагментов, в которых каждый из них слит с константным доменом и взаимодействует нековалентным образом, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). В данном описании фаговые клоны, кодирующие ScFv, и фаговые клоны, кодирующие Fab, объединяют общим обозначением "фаговые клоны Fv" или "Fv-клоны."
[0094] Репертуары генов VH и VL могут быть клонированы отдельно с помощью полимеразной цепной реакции (ПЦР) и рекомбинированы случайным образом в фаговых библиотеках, в которых затем можно провести поиск антигенсвязывающих клонов, как описано в Winter et al., Ann. Rev. Immunol., 12: 433-455 (1994). Библиотеки из иммунизированных источников позволяют получать высокоаффинные антитела к иммуногену без необходимости в конструировании гибридом. В качестве альтернативы, можно клонировать исходный репертуар, чтобы получить единый источник антител человека к широкому спектру собственных, а также несобственных антигенов без какой-либо иммунизации, как описано в Griffiths et al., EMBO J., 12: 725-734 (1993). Наконец, исходные библиотеки могут быть также получены синтетически в результате клонирования не подвергнутых реаранжировке фрагментов V-генов и с использованием ПЦР-праймеров, содержащих случайную последовательность, чтобы кодировать высоко вариабельные области CDR3 и осуществить реаранжировку в условиях in vitro, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
[0095] В некоторых вариантах осуществления настоящего изобретения, нитевидный бактериофаг используют для отображения фрагментов антител посредством слияния с минорным белком оболочки pIII. Фрагменты антител могут быть отображены в виде одноцепочечных фрагментов Fv, в которых домены VH и VL связаны в одной и той же полипептидной цепи с помощью гибкого спейсерного полипептида, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или в виде фрагментов Fab, в которых одна цепь слита с pIII, а другая секретируется в периплазму бактериальной клетки-хозяина, где сборка белка оболочки Fab отображается на поверхности бактериофага за счет вытеснения некоторых белков оболочки дикого типа, как описано, например, в Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991).
[0096] В общем случае нуклеиновые кислоты, кодирующие фрагменты гена антитела, получают из иммунных клеток, взятых из организма человека или животных. Если необходима библиотека, смещенная преимущественно в сторону клонов против антигена, то субъекта иммунизируют антигеном, чтобы вызвать гуморальный иммунный ответ, и для конструирования библиотеки извлекают клетки селезенки и/или циркулирующие В-клетки, отличные от лимфоцитов периферической крови (PBLs). В одном варианте осуществления изобретения библиотеку фрагментов генов антител человека, смещенную преимущественно в сторону клонов против антигена, получают, генерируя иммунный ответ против антигена у трансгенных мышей, имеющих набор функциональных генов иммуноглобулина человека (и не имеющих функциональную систему продуцирования эндогенных антител), так что иммунизация антигеном вызывает образование В-клеток, продуцирующих антитела человека против антигена. Получение трансгенных мышей, продуцирующих антитела человека, описано ниже.
[0097] Дополнительное обогащение популяций активных клеток против антигена можно осуществить с помощью подходящего способа скрининга для выделения B-клеток, экспрессирующих антиген-специфичное антитело, связанное с мембраной, например, путем отделения клеток с помощью иммуно-аффинной хроматографии или с помощью адсорбции клеток на меченный флуорохромом антиген с последующей флуоресцентно активируемой сортировкой клеток в потоке (FACS).
[0098] В качестве альтернативы, использование клеток селезенки, и/или В-клеток, или других PBLs, взятых у не иммунизированного донора, дает лучшее представление возможного репертуара антител, а также позволяет сконструировать библиотеку антител с использованием любых видов животных (человека или отличного от человека животного), у которых антиген не является антигенным. В случае создания библиотек с привлечением конструирования генов антител в условиях in vivo из организма субъекта берут стволовые клетки, с целью получить нуклеиновые кислоты, кодирующие подвергнутые аранжировке участки генов антител. Нужные иммунные клетки можно получить от различных видов животных, таких как человек, мышь, крыса, зайцеобразные, волчьи, псовые, кошачьи, свиньи, крупный рогатый скот, лошадь, разные виды птиц и т.д.
[0099] Нуклеиновую кислоту, кодирующую гены вариабельных областей антитела (включая участки VH и VL), извлекают из нужных клеток и амплифицируют. В случае библиотек реаранжированных генов VH и VL требуемую ДНК можно получить путем выделения геномной ДНК или мРНК из лимфоцитов с последующим проведением полимеразной цепной реакции (ПЦР) с использованием праймеров, соответствующих 5'- и 3'-концам реаранжированных генов VH и VL, как описано в Orlandi et al., Proc. Natl. Acad. Sci. (USA), 86: 3833-3837 (1989), в результате чего получают отличный репертуар V-генов для экспрессии. V-Гены могут быть амплифицированы из кДНК и геномной ДНК с использованием обратных праймеров на 5'-конце экзона, кодирующего зрелый V-домен, и прямых праймеров, размещенных в J-сегменте, как описано Orlandi et al. (1989) и в Ward et al., Nature, 341: 544-546 (1989). Тем не менее, для амплифицирования из кДНК обратные праймеры могут также размещаться в лидерном экзоне, как описано в Jones et al., Biotechnol., 9: 88-89 (1991), а прямые праймеры - в константной области, как описано в Sastry et al., Proc. Natl. Acad. Sci. (USA), 86: 5728-5732 (1989). Чтобы максимально повысить комплементарность, в праймеры можно ввести вырожденность, как описано в Orlandi et al. (1989) или Sastry et al. (1989). В некоторых вариантах осуществления настоящего изобретения, разнообразие библиотек максимально увеличивают с помощью ПЦР-праймеров, нацеленных на каждое семейство V-генов с тем, чтобы амплифицировать все доступные реаранжировки VH и VL, присутствующие в образце нуклеиновой кислоты иммунных клеток, например, как описано в методе Marks et al., J. Mol. Biol., 222: 581-597 (1991) или как описано в методе Orum et al., Nucleic Acids Res., 21: 4491-4498 (1993). С целью клонирования амплифицированной ДНК в векторы экспрессии, в ПЦР-праймер в качестве метки на одном конце, как описано в Orlandi et al. (1989), могут быть введены маскированные сайты рестрикции, или же можно осуществить дополнительную амплификацию методом ПЦР с меченым праймером, как описано в Clackson et al., Nature, 352: 624-628 (1991).
[0100] Репертуары синтетически перестроенных генов V могут быть получены в условиях in vitro из фрагментов V-гена. Большинство фрагментов VH-гена человека было клонировано и секвенировано (сообщение в Tomlinson et al., J. Mol. Biol., 227: 776-798 (1992)), а также картировано (сообщение в Matsuda et al., Nature Genet., 3: 88-94 (1993); указанные клонированные сегменты (в том числе все основные конформации петли H1 и H2) можно использовать для создания отличных репертуаров VH-генов с ПЦР-праймерами, кодирующими петли H3 с разной последовательностью и с разной длиной, как описано в Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). Репертуар VH также можно получить с использованием полного разнообразия последовательностей, сфокусированного на петле H3 одной длины, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 89: 4457-4461 (1992). Фрагменты Vk и Vλ человека были клонированы и секвенированы (сообщение Williams and Winter, Eur. J. Immunol., 23: 1456-1461 (1993)), и могут быть использованы для получения совокупности синтетических легких цепей. Репертуар синтетических V-генов, основанный на разнообразии складок VH и VL и длин L3 и H3, будет кодировать антитела, характеризующиеся значительным структурным разнообразием. После амплификации молекул ДНК, кодирующих V-ген, фрагменты V-генов зародышевой линии могут быть реаранжированы в условиях in vitro, в соответствии с методами Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992).
[0101] Репертуар фрагментов антител может быть сконструирован посредством комбинирования репертуаров генов VH и VL друг с другом несколькими способами. Каждый репертуар можно создать в разных векторах и осуществить рекомбинацию векторов в условиях in vitro, например, как описано в Hogrefe et al., Gene, 128: 119-126 (1993), или в условиях in vivo путем комбинаторной инфекции, например, с использованием системы LoxP, описанной в Waterhouse et al., Nucl. Acids Res., 21: 2265-2266 (1993). В рекомбинационном подходе в условиях in vivo используют двухцепочечную природу фрагментов Fab, чтобы преодолеть ограничение по размеру библиотеки, которое накладывает эффективность трансформации E. coli. Исходные репертуары VH и VL клонируют по отдельности, один в фагмид, а другой - в фаговом векторе. Затем две библиотеки объединяют посредством фаговой инфекции содержащих фагмиду бактерий таким образом, чтобы каждая ячейка содержала различные комбинации, а размер библиотеки был ограничен только числом присутствующих клеток (приблизительно 1012 клонов). Оба вектора содержат in vivo сигналы рекомбинации, так что гены как VH, так и VL рекомбинируют в одном репликоне и упаковываются совместно в фаговые вирионы. Подобные гигантские библиотеки обеспечивают большое количество разнообразных антител с хорошей аффинностью (Kd-1 равно приблизительно 10-8 М).
[0102] В качестве альтернативы, репертуары можно клонировать последовательно в одном и том же векторе, например, как описано в Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991), или собрать вместе с помощью ПЦР, а затем клонировать, например, как описано в Clackson et al., Nature, 352: 624-628 (1991). ПЦР-сборку также можно использовать для соединения ДНК VH и VL с ДНК, кодирующей гибкий спейсерный пептид, с образованием репертуара одноцепочечных Fv (scFv). Еще один метод, "ПЦР-сборку в клетке", используют для комбинирования генов VH и VL в лимфоцитах с помощью ПЦР и последующего репертуара связанных генов, как описано в Embleton et al., Nucl. Acids Res., 20: 3831-3837 (1992).
[0103] Антитела, полученные из исходных библиотек (либо природных, либо синтетических) могут обладать умеренной аффинностью (Kd-1 приблизительно равно от 106 до 107 М-1), однако созревание аффинности также можно имитировать в условиях in vitro путем построения и повторного отбора из вторичных библиотек, как описано в Winter et al. (1994), supra. Например, мутации могут быть введены случайным образом в условиях in vitro с помощью ошибающейся полимеразы (Leung et al., Technique 1: 11-15 (1989)) по способу Hawkins et al., J. Mol. Biol., 226: 889-896 (1992) или по способу Gram et al., Proc. Natl. Acad. Sci USA, 89: 3576-3580 (1992). Кроме того, созревание аффинности можно осуществить путем произвольной мутации одной или нескольких CDR, например, с использованием ПЦР с праймерами, которые несут случайную последовательность, охватывающую требуемую CDR, в выбранных индивидуальных клонах Fv и скрининга в отношении клонов с более высокой аффинностью. В WO 9607754 (опубликован 14 марта 1996) описан способ индуцирования мутагенеза в определяющей комплементарность области легкой цепи иммуноглобулина для создания библиотеки генов легкой цепи. Другой эффективный подход заключается в рекомбинировании доменов VH или VL, отобранных методом фагового дисплея с репертуаром встречающихся в природе вариантов домена V, полученных из организма неиммунизированных доноров, и скрининге в отношении более высокой аффинности в нескольких раундах перетасовки цепей, как описано в Marks et al., Biotechnol., 10: 779-783 (1992). Указанная методика позволяет получать антитела и фрагменты антител с аффинностью приблизительно 10-9 М или меньше.
[0104] Скрининг библиотек можно осуществить различными методами, известными из данной области техники. Например, антиген может быть использован для покрытия лунок адсорбционных пластин, экспрессирован на клетках-хозяевах, закрепленных на адсорбционных пластинах или используемых в сортировке клеток, или конъюгирован с биотином для захвата покрытыми стрептавидином бусинами, или использован в любом другом способе пэннинга библиотек фагового дисплея.
[0105] Образцы фаговой библиотеки вводят в контакт с иммобилизованным антигеном в условиях, подходящих для связывания, по меньшей мере, части фаговых частиц с адсорбентом. Обычно условия, включая pH, ионную силу, температуру и т.п., выбирают таким образом, чтобы имитировать физиологические условия. Фаги, связанные с твердой фазой, промывают и затем элюируют кислотой, например, как описано в Barbas et al., Proc. Natl. Acad. Sci USA, 88: 7978-7982 (1991), или щелочью, например, как описано в Marks et al., J. Mol. Biol., 222: 581-597 (1991), или посредством антигенной конкуренции, в частности, в способе, подобном методу антигенной конкуренции, который описан в Clackson et al., Nature, 352: 624-628 (1991). Фаги могут быть обогащены в 20-1000 раз за один раунд селекции. Кроме того, обогащенные фаги могут быть выращены в бактериальной культуре и подвергнуты дальнейшим раундам селекции.
[0106] Эффективность селекции зависит от многих факторов, включая кинетику диссоциации в процессе промывки, и от того, сможет ли несколько фрагментов антитела на одном фаге одновременно поддерживать контакт с антигеном. Антитела с быстрой кинетикой диссоциации (и слабыми аффинностями связывания) могут удерживаться за счет применения кратковременных промывок, поливалентного фагового дисплея и высокой плотности покрытия антигеном в твердой фазе. Высокая плотность не только стабилизирует бактериофаг посредством поливалентных взаимодействий, но и способствует повторному связыванию бактериофага, который диссоциировал. Селекция антител с медленной кинетикой диссоциации (и хорошими аффинностями связывания) может быть осуществлена посредством использования длительных промывок и моновалентного фагового дисплея, как описано в Bass et al., Proteins, 8: 309-314 (1990) и в WO 92/09690, и низкой плотности покрывания антигеном, как описано в Marks et al., Biotechnol., 10: 779-783 (1992).
[0107] Можно провести селекцию фаговых антител с разными аффиностями по отношению антигену, даже с аффиностями, которые лишь незначительно различаются. Однако случайные мутации отобранного антитела (например, возникающие при некоторых способах созревания аффинности, описанных выше), видимо, приводят к образованию множества мутантов, большинство из которых связывается с антигеном, а немногие связываются с более высокой аффинностью. При ограничении гена редкий фаг, обладающий высокой аффинностью, может быть потерян в результате конкуренции. Чтобы сохранить все мутанты с более высокой аффинностью, бактериофаги могут быть инкубированы с избытком биотинилированного антигена, но с биотинилированным антигеном с более низкой молярной концентрацией, чем молярная константа аффинности по отношению к мишени для антигена. Затем фаги, связывающиеся с высокой аффинностью, можно захватить с помощью парамагнитных шариков, покрытых стрептавидином. Подобный "равновесный захват" предоставляет возможность отбирать антитела в соответствии с их аффинностями связывания с такой чувствительностью, которая позволяет выделять мутантные клоны со всего лишь в два раза более высокой аффинностью из большого избытка фагов с более низкой аффинностью. Можно также манипулировать условиями, которые используют для промывки бактериофагов, связанных с твердой фазой с тем, чтобы провести дифференцирование на основе кинетики диссоциации.
[0108] Клоны против антигена можно отбирать на основе активности. В некоторых вариантах осуществления настоящего изобретения предлагаются антитела к антигену, связывающиеся с живыми клетками, которые естественным образом экспрессируют антиген или связываются со свободно циркулирующим антигеном или антигеном, присоединенным к другим клеточных структурам. Fv-клоны, соответствующие подобным антителам к антигену, могут быть подвергнуты селекции путем (1) выделения клонов против антигена из фаговой библиотеки, как описано выше, и необязательно амплификации выделенной популяции фаговых клонов посредством выращивания указанной популяции в подходящем бактериальном хозяине; (2) селекции антигена и второго белка, против которых требуется блокирующая и не блокирующая активность, соответственно; (3) адсорбции фаговых клонов против антигена на иммобилизованном антигене; (4) использования избытка второго белка с тем, чтобы элюировать любые нежелательные клоны, распознающие связывающие антиген детерминанты, которые перекрываются или которые являются общими с детерминантами связывания второго белка; и (5) элюирования клонов, которые остаются адсорбированными после стадии (4). Клоны с требуемыми блокирующими/деблокирующими свойствами необязательно могут быть дополнительно обогащены путем повторения один или несколько раз способов селекции, приведенных в данном описании.
[0109] ДНК, кодирующую полученные из гибридомы моноклональные антитела, или необходимые Fv-клоны фагового дисплея, легко выделяют и секвенируют обычными способами (например, используя олигонуклеотидные праймеры, сконструированные для того, чтобы специфично амплифицировать требуемые кодирующие области тяжелой и легкой цепи из гибридомы или ДНК-матрицы фага). После выделения ДНК можно поместить в экспрессирующие векторы, которые затем трансфицируют в клетки-хозяева, такие как клетки E. coli, клетки обезьян COS, клетки яичника китайского хомячка (CHO) или клетки миеломы, которые в противном случае не продуцируют белок иммуноглобулина, чтобы осуществить синтез необходимых моноклональных антител в рекомбинантных клетках-хозяевах. Обзорные статьи, касающиеся рекомбинантной экспрессии ДНК, кодирующей антитела, в бактериях включают Skerra et al., Curr. Opinion in Immunol., 5: 256 (1993) и Pluckthun, Immunol. Revs, 130: 151 (1992).
[0110] ДНК, кодирующую Fv-клоны, можно комбинировать с известными последовательностями ДНК, которые кодируют константные области тяжелой цепи и/или легкой цепи (например, подходящие последовательности ДНК можно найти в Kabat et al., supra), чтобы образовать клоны, которые кодируют полноразмерные тяжелые и/или легкие цепи или их части. Должно быть понятно, что для данной цели можно использовать константные области любого изотипа, включая константные области IgG, IgM, IgA, IgD и IgE, и что подобные константные области могут быть получены из организма любого человека или любых видов животных. Fv-клон, полученный из ДНК вариабельного домена животного одного вида (такого как человек) и затем слитый с ДНК константной области животного другого вида с образованием кодирующей(их) последовательности(ей) для "гибридной" полноразмерной тяжелой цепи и/или легкой цепи, включен в определение "химерное" и "гибридное" антитело, которое используют в данном описании. В некоторых вариантах осуществления настоящего изобретения Fv-клон, полученный из ДНК вариабельной области человека, сливают с ДНК константной области человека с образованием кодирующей(их) последовательности(ей) для полноразмерных или частичных тяжелых и/или легких цепей человека.
[0111] ДНК, кодирующую антитело к антигену, которую получают из гибридомы, также можно модифицировать, например, путем замены гомологичных мышиных последовательностей, полученных из гибридомного клона (например, как в способе, описанном в Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)), на кодирующую последовательность для константных доменов тяжелой и легкой цепи человека. ДНК, которая кодирует полученное из гибридомы или из Fv-клона антитело или фрагмент, может быть дополнительно модифицирована ковалентным связыванием с кодирующей последовательностью иммуноглобулина, с полноразмерной или частичной кодирующей последовательностью неиммуноглобулинового полипептида. Подобным образом получают "химерные" или "гибридные" антитела, которые обладают специфичностью связывания требуемых антител, полученных из Fv-клона или гибридомного клона.
(iv) Гуманизированные антитела и антитела человека
[0112] Из данной области техники известны различные способы гуманизации антител, не принадлежащих человеку. Например, гуманизированное антитело содержит один или несколько аминокислотных остатков, введенных в него из источника, который отличен от человека. Указанные не принадлежащие человеку аминокислотные остатки часто называют "импортируемыми" остатками, которые, как правило, берут из "импортируемого" вариабельного домена. Гуманизацию можно эффективно осуществить, следуя способу Винтера и соавторов (Jones et al., Nature, 321: 522-525 (1986); Riechmann et al., Nature, 332: 323-327 (1988); Verhoeyen et al., Science, 239: 1534-1536 (1988)), путем замены соответствующих последовательностей антитела человека на мышиные последовательности CDRs или CDR. Соответственно, подобные "гуманизированные" антитела являются химерными антителами (патент США № 4816567), в которых значительно меньшая часть, чем исходный вариабельный домен человека, была заменена соответствующей последовательностью вида животного, отличного от человека. На практике гуманизированные антитела обычно представляют собой антитела человека, в которых некоторые остатки CDR и возможно некоторые остатки FR заменены остатками из аналогичных участков антител грызунов.
[0113] Выбор вариабельных доменов человека, как легкой, так и тяжелой цепи, которые предполагается использовать для получения гуманизированных антител, очень важен для снижения антигенности. Согласно так называемому способу "оптимальной подгонки", последовательность вариабельного домена антитела грызуна подвергают скринингу по отношению к полной библиотеке известных последовательностей вариабельных доменов человека. Последовательность человека, которая наиболее близка последовательности грызуна, затем используют в качестве каркаса человека (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151: 2296 (1993); Chothia et al., J. Mol. Biol., 196: 901 (1987)). В другом способе используют конкретный каркас, полученный из консенсусной последовательности полностью человеческих антител конкретной подгруппы легких или тяжелых цепей. Один и тот же каркас можно использовать для нескольких разных гуманизированных антител (Carter et al., Proc. Natl. Acad. Sci. USA, 89: 4285 (1992); Presta et al., J. Immunol., 151: 2623 (1993)).
[0114] Важно также, чтобы антитела были гуманизированы с сохранением высокой аффинности по отношению к антигену и других благоприятных биологических свойств. Для достижения указанной цели, согласно одному варианту осуществления способа по настоящему изобретению, гуманизированные антитела получают, проводя анализ родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулина общедоступны и известны специалистам в данной области техники. Доступны компьютерные программы, которые иллюстрируют и демонстрируют возможные трехмерные конформационные структуры выбранных для исследования последовательностей иммуноглобулина. Изучение подобных отображений позволяет проанализировать вероятную роль остатков в функционировании выбранной для исследования последовательности иммуноглобулина, т.е. провести анализ остатков, которые влияют на способность выбранного для исследования иммуноглобулина связывать соответствующий ему антиген. Подобным образом могут быть выбраны и объединены остатки FR из реципиентых и импортируемых последовательностей, так что достигаются требуемые характеристики антитела, такие как повышенная аффинность по отношению к антигену-мишени. В общем случае, остатки гипервариабельных областей непосредственно и в наибольшей степени оказывают влияние на связывание антигена.
[0115] Требуемые антитела человека могут быть сконструированы в результате объединения последовательности(ей) вариабельного домена Fv-клона, выбранной(ых) из библиотек в фаговом дисплее, полученных для антител человека, с известной(ыми) последовательностью(ями) константной области человека, как описано выше. В качестве альтернативы, требуемые моноклональные антитела человека могут быть получены способом гибридомы. Линии клеток миеломы человека и гетеромиеломы мыши-человека для получения моноклональных антител человека описаны, например, в Kozbor, J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); и Boerner et al., J. Immunol., 147: 86 (1991).
[0116] Можно получать трансгенных животных (например, мышей), которые способны после иммунизации продуцировать полный репертуар антител человека в отсутствие продукции эндогенных иммуноглобулинов. Например, описано, что гомозиготная делеция гена соединяющей области тяжелой цепи (JH) антитела у химерных и мутантных по зародышевой линии мышей приводит к полному ингибированию продукции эндогенных антител. Перенос ряда генов иммуноглобулина зародышевой линии человека в таких мутантных по зародышевой линии мышей будет приводить при антигенной стимуляции к продукции антител человека. См., например, Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90: 2551 (1993); Jakobovits et al., Nature, 362: 255-258 (1993); Bruggermann et al., Year in Immunol., 7: 33 (1993) и Duchosal et al. Nature 355:258 (1992).
[0117] Перетасовку генов также можно использовать для получения человеческих антител из антител животного, отличного от человека, например, грызунов, где антитело человека обладает аффинностью и специфичностью, сходными с изначальным антителом животного, отличного от человека. Согласно указанному способу, который также называют "эпитопным импринтингом", вариабельную область либо тяжелой, либо легкой цепи фрагмента антитела животного, отличного от человека, который получают по методу фагового дисплея, описанному выше, заменяют репертуаром генов V-домена человека, создавая популяцию химер scFv или Fab на основе цепи животного, отличного от человека/цепи человека. Селекции с использованием антигена приводит к выделению химерных scFv или Fab на основе цепи животного, отличного от человека/цепи человека, при этом цепь человека восстанавливает антигенсвязывающий участок, нарушенный при удалении соответствующей цепи животного, отличного от человека, в первичном клоне фагового дисплея, т.е. эпитоп регулирует (накладывает отпечаток) на выбор партнера цепи человека. Когда процесс повторяют, чтобы заменить оставшуюся цепь животного, отличного от человека, получают человеческое антитело (см. PCT WO 93/06213, опубликованную 1 апреля 1993 г.). В отличие от традиционной гуманизации антител животных, отличных от человека, путем прививки CDR, подобный способ позволяет получать полностью человеческие антитела, которые не имеют остатков FR или CDR животного, отличного от человека.
(v) Фрагменты антител
[0118] Фрагменты антител могут быть получены традиционными способами, такими как ферментативное расщепление или рекомбинантные методы. В некоторых случаях предпочтительно использование фрагментов антител, а не целых антител. Меньший размер фрагментов обеспечивает быстрый клиренс и может приводить к улучшенному доступу к солидным опухолям. Для обзора некоторых фрагментов антител см. Hudson et al. (2003) Nat. Med. 9:129-134.
[0119] Разработаны различные способы получения фрагментов антител. Традиционно подобные фрагменты получали в результате протеолитического расщепления исходных антител (см., в частности, Morimoto et al., Journal of Biochemical and Biophysical Methods 24: 107-117 (1992); и Brennan et al., Science, 229: 81 (1985)). Однако в настоящее время подобные фрагменты могут непосредственно продуцироваться рекомбинантными клетками-хозяевами. Все фрагменты антител Fab, Fv и ScFv могут быть экспрессированы и секретированы из E. coli, тем самым позволяя осуществить простое продуцирование больших количеств подобных фрагментов. Фрагменты антител могут быть выделены из фаговых библиотек антител, которые обсуждались выше. В качестве альтернативы фрагменты Fab'-SH могут быть непосредственно извлечены из клеток E. coli и химически связаны с образованием фрагментов F(ab')2 (Carter et al., Bio/Technology 10: 163-167 (1992)). Согласно другому способу, фрагменты F(ab')2 могут быть выделены непосредственно из культуры рекомбинантных клеток-хозяев. Фрагменты Fab и F(ab')2 с увеличенным временем полужизни в условиях in vivo, содержащие рецептор реутилизации, связывающий остатки эпитопа, описаны в патенте США № 5869046. Другие способы получения фрагментов антител известны специалистам в данной области техники. В некоторых вариантах осуществления настоящего изобретения антитело представляет собой одноцепочечный Fv-фрагмент (scFv). См. WO 93/16185, патенты США №№ 5571894 и 5587458. Fv и scFv являются единственными видами с неизмененными антигенсвязывающи активными центрами антитела, которые лишены константных областей; таким образом, они являются подходящими с точки зрения пониженного неспецифичного связывания для применения в условиях in vivo. Слитые белки scFv могут быть сконструированы, с целью получить слияние эффекторного белка либо с аминовым, либо с карбоксильным концом scFv. См. Antibody Engineering, ed. Borrebaeck, supra. Фрагмент антитела также может представлять собой "линейное антитело", в частности такое, как описано, например, в патенте США 5641870. Подобные линейные антитела могут быть моноспецифичными или биспецифичными.
(vi) Мультиспецифичные антитела
[0120] Мультиспецифичные антитела обладают специфичностями связывания, по меньшей мере, двух разных эпитопов, где эпитопы, как правило, получены из различных антигенов. Хотя подобные молекулы, обычно связывают лишь два различных эпитопа (т.е. представляют собой биспецифичные антитела, BsAb), в данном описании указанное выражение охватывает антитела с дополнительными специфичностями, такие как триспецифичные антитела. Биспецифичные антитела могут быть получены в виде полноразмерных антител или фрагментов антител (например, биспецифичные антитела F(аb')2).
[0121] Способы получения биспецифичных антител известны из данной области техники. Традиционно продукция полноразмерных биспецифичных антител основана на совместной экспрессии двух пар тяжелая цепь - легкая цепь иммуноглобулина, при этом две тяжелых цепи имеют разные специфичности (Millstein et al., Nature, 305: 537-539 (1983)). Вследствие случайного выбора тяжелых и легких цепей иммуноглобулина, указанные гибридомы (квадромы) продуцируют возможную смесь 10 разных молекул антител, из которых только одна имеет правильную биспецифичную структуру. Очистка правильной молекулы, которую обычно осуществляют, используя стадии аффинной хроматографии, является довольно громоздкой, а выходы продукта низки. Сходные методики описаны в патенте WO 93/08829, опубликованном 13 мая 1993 года, и в Traunecker et al., EMBO J., 10: 3655-3659 (1991).
[0122] Согласно другому способу, вариабельные домены антител с требуемыми специфичностями связывания (антигенсвязывающие активные центры антитело-антиген) сливают с последовательностями константных доменов иммуноглобулина. Слияние предпочтительно осуществляют с константным доменом тяжелой цепи иммуноглобулина, содержащим, по меньшей мере, часть шарнирной области, области CH2 и CH3. Как правило, получают первую константную область тяжелой цепи (CH1), содержащую участок, необходимый для связывания легкой цепи, который присутствует, по меньшей мере, в одном из слияний. ДНК, кодирующие слияния тяжелой цепи иммуноглобулина и, в случае необходимости, легкой цепи иммуноглобулина, встраивают в отдельные экспрессирующие векторы и совместно трансфицируют в подходящий организм хозяина. Это обеспечивает большую гибкость при корректировке взаимных соотношений трех полипептидных фрагментов в таких вариантах осуществления настоящего изобретения, когда неравные соотношения трех полипептидных цепей, используемых в конструкции, дают оптимальные выходы. Однако можно встраивать кодирующие последовательности для двух или всех трех полипептидных цепей в один экспрессирующий вектор в том случае, когда экспрессия, по меньшей мере, двух полипептидных цепей в равных соотношениях дает высокие выходы или когда соотношения не имеют особого значения.
[0123] В одном варианте осуществления данного способа биспецифичные антитела составляют из гибридной тяжелой цепи иммуноглобулина с первой специфичностью связывания в одном плече и гибридной пары тяжелая цепь - легкая цепь иммуноглобулина (которая обеспечивает вторую специфичность связывания) в другом плече. Обнаружено, что подобная асимметричная структура облегчает отделение требуемого биспецифичного соединения от нежелательных комбинаций цепей иммуноглобулина, так как наличие легкой цепи иммуноглобулина только в одной половине биспецифичной молекулы обеспечивает простой способ разделения. Подобный способ описан в WO 94/04690. Более подробное описание создания биспецифичных антител см., например, в Suresh et al., Methods in Enzymology, 121: 210 (1986).
[0124] Согласно другому способу, который описан в WO96/27011, область контакта между парой молекул антител может быть сконструирована таким образом, чтобы максимально увеличить процент гетеродимеров, которые извлекают из культуры рекомбинантных клеток. Одна область контакта содержит, по меньшей мере, часть домена CH3 константной области антитела. В указанном способе одну или несколько небольших боковых цепей аминокислот из области контакта первой молекулы антитела заменяют более крупными боковыми цепями (например, тирозином или триптофаном). В области контакта второй молекулы антитела создают компенсирующие "полости", имеющие размер, идентичный или сходный с размером большой боковой цепи (цепей), заменяя большие боковые цепи аминокислот меньшими боковыми цепями (например, аланином или треонином). Подобным образом создается механизм увеличения выхода гетеродимера, по сравнению с другими нежелательными конечными продуктами, такими как гомодимеры.
[0125] Биспецифичные антитела включают поперечно сшитые антитела или "гетероконъюгаты" антител. Например, одно из антител в гетероконъюгате может сочетаться с авидином, а другое - с биотином. Подобные антитела, например, были предложены для нацеливания клеток иммунной системы на нежелательные клетки-мишени (патент США № 4676980) и для лечения ВИЧ-инфекции (WO 91/00360, WO 92/200373 и EP 03089). Гетероконъюгаты антител могут быть получены с использованием любых способов образования поперечных сшивок. Подходящие агенты для поперечного сшивания хорошо известны из данной области техники и описаны в патенте США № 4676980 вместе с рядом способов образования поперечных сшивок.
[0126] Способы создания биспецифичных антител из фрагментов антител также описаны в литературе. Например, биспецифичные антитела могут быть получены путем химического связывания. Brennan et al., Science, 229: 81 (1985) описывают способ, в котором исходные антитела протеолитически расщепляют с образованием фрагментов F(ab')2. Полученные фрагменты восстанавливают в присутствии арсенита натрия, агента, образующего комплексы дитиола, с тем, чтобы стабилизировать соседние дитиолы и предотвратить образование межмолекулярных дисульфидных связей. Затем созданные фрагменты Fab' превращают в производные тионитробензоата (TNB). Одно из производных Fab'-TNB затем вновь превращают в Fab'-тиол путем восстановления меркаптоэтиламином и смешивают с эквимолярным количеством другого производного Fab'-TNB с образованием биспецифичного антитела. Полученные биспецифичные антитела можно использовать в качестве агентов для избирательной иммобилизации ферментов.
[0127] Недавние достижения облегчили прямое извлечение фрагментов Fab'-SH из E. coli, которые могут быть химически связаны с образованием биспецифичных антител. Shalaby et al., J. Exp. Med., 175: 217-225 (1992) описывают получение полностью гуманизованной молекулы биспецифичного антитела F(ab')2. Каждый фрагмент Fab' отдельно секретируют из клеток E. coli и подвергают химическому связыванию в условиях in vitro с образованием биспецифичного антитела.
[0128] Также описаны различные способы получения и выделения фрагментов биспецифичных антител непосредственно из культуры рекомбинантных клеток. Например, были получены биспецифичные антитела с использованием лейциновых "молний" (Kostelny et al., J. Immunol., 148(5): 1547-1553 (1992)). Пептиды лейциновой "молнии" из белков Fos и Jun связывали с частями Fab' двух разных антител посредством слияния генов. Гомодимеры антител восстанавливали в шарнирной области, чтобы образовать мономеры, и затем вновь окисляли с образованием гетеродимеров антител. Подобный способ также можно использовать для получения гомодимеров антител. Способ "диатела", описанный в Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993), предлагает альтернативный механизм получения фрагментов биспецифичных антител. Фрагменты включают вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) посредством линкера, который слишком короткий, чтобы позволить спаривание между двумя доменами на одной и той же цепи. Соответственно, домены VH и VL одного фрагмента вынуждены спариваться с комплементарными доменами VL и VH другого фрагмента, образуя при этом два антигенсвязывающих участка. Также сообщалось о другой стратегии получения фрагментов биспецифичных антител с использованием димеров одноцепочечного Fv (sFv). См. Gruber et al., J. Immunol., 152: 5368 (1994).
[0129] Возможны антитела с более чем двумя валентностями. Например, могут быть получены триспецифичные антитела. Tutt et al., J. Immunol. 147: 60 (1991).
(vii) Однодоменные антитела
[0130] В некоторых вариантах осуществления настоящего изобретения требуемое антитело является однодоменным антителом. Однодоменное антитело представляет собой единую полипептидную цепь, включающую весь вариабельный домен тяжелой цепи антитела или его часть или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления настоящего изобретения, однодоменное антитело является однодоменным антителом человека (Domantis, Inc., Waltham, Mass.; см., например, патент США. №. 6248516 В1). В одном варианте осуществления настоящего изобретения, однодоменное антитело состоит из всего вариабельного домена тяжелой цепи антитела или его части.
(viii) Варианты антител
[0131] В некоторых вариантах осуществления настоящего изобретения предполагается модификация аминокислотной последовательности антител, приведенных в настоящем описании. Например, может оказаться желательным улучшить аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела могут быть получены введением соответствующих изменений в нуклеотидную последовательность, кодирующую антитело, или в результате синтеза пептидов. Подобные модификации включают, например, делеции, и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Можно осуществлять любое сочетание делеции, инсерции и замены с тем, чтобы получить конечную конструкцию, при условии, что конечная конструкция обладает требуемыми характеристиками. Аминокислотные изменения могут быть введены в аминокислотную последовательность рассматриваемого антитела во время получения данной последовательности.
(B) Векторы, клетки-хозяева и рекомбинантные методы
[0132] Антитела, продуцируемые клеткой, которую выращивают в среде для культивирования клеток, представленной в данном документе, также могут быть получены с использованием рекомбинантных методов. Для рекомбинантной продукции антитела к антигену нуклеиновую кислоту, которая кодирует антитело, изолируют и встраивают в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, которая кодирует антитело, может быть легко изолирована и секвенирована с помощью обычных способов (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела). Доступно множество векторов. Компоненты вектора обычно включают, однако этим не ограничиваясь, одно или несколько из следующих: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
(i) Компонент - сигнальная последовательность
[0133] Антитело может быть получено рекомбинантными методами не только непосредственно, но и в виде слитого полипептида с гетерологичным полипептидом, который, предпочтительно, представляет собой сигнальную последовательность или другой полипептид, имеющий специфический сайт расщепления на N-конце зрелого белка или полипептида. Выбранной гетерологичной сигнальной последовательностью, предпочтительно, является последовательность, которая распознается и процессируется (например, расщепляется сигнальной пептидазой) клеткой хозяина. Для прокариотических клеток хозяина, которые не распознают и не обрабатывают нативную сигнальную последовательность антитела, сигнальную последовательность заменяют прокариотической сигнальной последовательностью, выбранной, например, из группы, которая включает щелочную фосфатазу, пенициллиназу, llp или доминанты термостабильного энтеротоксина II. Для секреции дрожжей нативная сигнальная последовательность может быть заменена, например, лидером инвертазы дрожжей, доминантным фактором (включая доминанты α-фактора Saccharomyces и Kluyveromyces) или лидером кислотной фосфатазы, лидером глюкоамилазы C. albicans или сигнальной последовательностью, описанной в WO 90/13646. Для экспрессии в клетках млекопитающих доступны сигнальные последовательности млекопитающих, а также вирусные лидеры секреции, например, сигнал последовательность gD простого герпеса.
(ii) Точка начала репликации
[0134] Как экспрессирующий вектор, так и клонирующий вектор содержат последовательность нуклеиновой кислоты, которая позволяет вектору реплицироваться в одной или нескольких выбранных клетках-хозяевах. Как правило, в клонирующих векторах указанная последовательность представляет собой такую последовательность, которая позволяет вектору реплицироваться независимо от хромосомной ДНК хозяина, и включает точки начала репликации или автономно реплицирующиеся последовательности. Подобные последовательности хорошо известны для множества бактерий, дрожжей и вирусов. Точка начала репликации из плазмиды pBR322 подходит для большинства грамотрицательных бактерий, 2μ, точка начала плазмиды подходит для дрожжей, а различные вирусные начала (SV40, полиома, аденовирус, VSV или BPV) пригодны для векторов клонирования в клетках млекопитающих. В общем случае, компонент точки начала репликации не является необходимым для векторов экспрессии млекопитающих (начало SV40 может быть, как правило, использовано только потому, что содержит ранний промотор).
(iii) Компонент - ген-селектор
[0135] Экспрессирующие и клонирующие векторы могут содержать ген-селектор, также называемый селектируемым маркером. Как правило, гены-селекторы кодируют белки, которые (a) придают резистентность к антибиотикам или другим токсинам, например, к ампициллину, неомицину, метотрексату или тетрациклину, (b) комплементируют ауксотрофные дефициты или (c) снабжают критичными питательными веществами, недоступными из сложных сред, в частности, ген, кодирующий D-аланинрацемазу для Bacilli.
[0136] В одном примере схемы селекции используют лекарственное средство для задержки роста клетки-хозяина. Те клетки, которые успешно трансформируются гетерологичным геном, продуцируют белок, придающий резистентность к лекарственному средству, и таким образом выживают в режиме селекции. В примерах такой доминантной селекции используют лекарственные средства неомицин, микофеноловую кислоту и гигромицин.
[0137] Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются маркеры, которые позволяют осуществить идентификацию клеток, компетентных в отношении поглощения нуклеиновой кислоты, кодирующей антитело, такие как DHFR, глутаминсинтетаза (GS), тимидинкиназа, металлотионеин-I и -II, предпочтительно, гены металлотионеинов приматов, аденозиндезаминаза, орнитиндекарбоксилаза и т.д.
[0138] Например, клетки, трансформированные геном DHFR, идентифицируют культивированием трансформированных клеток в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. В данных условиях ген DHFR амплифицируется вместе с любой совместно трансформированной молекулой нуклеиновой кислоты. Может быть использована линия клеток яичника китайского хомячка (CHO), дефицитных по активности эндогенного DHFR (в частности, ATCC CRL-9096).
[0139] В качестве альтернативы, клетки, трансформированные геном GS, идентифицируют посредством выращивания трансформированных клеток в культуральной среде, содержащей сульфоксимин L-метионина (Msx), ингибитор GS. В данных условиях, ген GS амплифицируется вместе с любой другой совместно трансформированной молекулой нуклеиновой кислоты. Система отбора/амплификации GS может быть использована в сочетании с системой отбора/амплификации DHFR, которая описана выше.
[0140] В качестве альтернативы, клетки (в частности, хозяева дикого типа, которые сдержат эндогенный DHFR) трансформированные или котрансфицированные последовательностями ДНК, кодирующими требуемое антитело, ген DHFR дикого типа и другой селектируемый маркер, такой как аминогликозид-3'-фосфотрансфераза (APH), можно отбирать по росту клеток в среде, содержащей агент для селекции, соответствующий селектируемому маркеру, такой как аминогликозидный антибиотик, например, канамицин, неомицин или G418. См. патент США № 4965199.
[0141] Подходящим геном-селектором для использования в дрожжах является ген trp1, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282: 39 (1979)). Ген trp1 дает селектируемый маркер для мутантного штамма дрожжей, у которого отсутствует способность расти в триптофане, например АТСС № 44076 или PEP4-1. Jones, Genetics, 85:12 (1977). Наличие trp1 повреждения в геноме дрожжевой клетке-хозяине обеспечивает эффективную среду для детектирования трансформации путем роста в отсутствие триптофана. Аналогично, Leu2-дефицитные дрожжевые штаммы АТСС 20622 или 38626) дополняются известными плазмидами, несущими ген Leu2.
[0142] Кроме того, векторы, полученные из 1,6 мкм кольцевой плазмиды pKD1, могут быть использованы для трансформации дрожжей Kluyveromyces. В качестве альтернативы, имеется сообщение о системе экспрессии для крупномасштабного продуцирования рекомбинантного химозина теленка для K. lactis. Van den Berg, Bio/Technology, 8:135 (1990). Также были описаны (Fleer et al., Bio/Technology, 9:968-975 (1991) стабильные многокопийные векторы экспрессии для секреции зрелого рекомбинантного сывороточного альбумина человека промышленными штаммами Kluyveromyces.
(iv) Промоторный компонент
[0143] Экспрессирующие и клонирующие векторы обычно содержат промотор, который распознается организмом-хозяином и функционально связан с нуклеиновой кислотой, кодирующей антитело. Промоторы, пригодные для использования в прокариотических хозяевах, включают промотор phoA, β-лактамазу и промоторные системы лактозы, промотор щелочной фосфатазы, промоторную систему триптофана (trp) и гибридные промоторы, такие как промотор tac. Тем не менее, подходят и другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах также будут содержать последовательность Шайна-Дальгарно (S.D.), функционально связанную с молекулой ДНК, кодирующей антитело.
[0144] Известны промоторные последовательности для эукариот. Практически все эукариотические гены имеют AT-богатую область, расположенную примерно на 25-30 оснований выше сайта инициации транскрипции. Другой последовательностью, обнаруживаемой на 70-80 оснований выше старта транскрипции многих генов, является область CNCAAT, где N может быть любым нуклеотидом. На 3'-конце большинства эукариотических генов находится последовательность AATAAA, которая может быть сигналом для добавления поли-A-хвоста к 3'-концу кодирующей последовательности. Все подобные последовательности соответствующим образом встраивают в эукариотические экспрессирующие векторы.
[0145] Примеры подходящих промоторных последовательностей для применения в дрожжевых хозяевах включают промоторы 3-фосфоглицераткиназы или другие гликолитические ферменты, такие как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пируват-декарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфат-изомераза, 3-фосфоглицератмутаза, пируваткиназы, триозофосфатизомераза, фосфорглюкозо-изомераза и глюкокиназа.
[0146] Другими дрожжевыми промоторами, которые представляют собой индуцируемые промоторы, обладающие дополнительным преимуществом, которое заключается в том, что транскрипция контролируется условиями роста, являются промоторные области алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, ферменты деградации, связанные с метаболизмом азота, металлотионеин, глицеральдегид-3-фосфатдегидрогеназа и ферменты, ответственные за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для применения в экспрессии дрожжей дополнительно описаны в патенте EP 73657. Дрожжевые энхансеры также успешно используются с дрожжевыми промоторами.
[0147] Транскрипцию полипептидов антител с векторов в клетках-хозяевах млекопитающих можно регулировать, используя, например, промоторы, полученные из геномов вирусов, таких как вирус полиомы, вирус оспы кур, аденовирус (такой как аденовирус 2), вирус бычьей папилломы, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита B и вирус обезьян 40 (SV40), или из гетерологичных промоторов млекопитающих, например, из промоторов актина или промоторов иммуноглобулина, из промоторов гена теплового шока, при условии, что подобные промоторы совместимы с системами клеток хозяев.
[0148] Ранний и поздний промоторы вируса SV40 легко получают в виде рестрикционного фрагмента SV40, который также содержит начало репликации вируса SV40. Предранний промотор цитомегаловируса человека легко получают в виде фрагмента рестрикции HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса бычьей папилломы в качестве вектора описана в патенте США № 4419446. Модификация подобной системы описана в патенте США № 4601978. См. также Reyes et al., Nature 297:598-601 (1982) при экспрессии β-интерферона человека кДНК в мышиных клетках под контролем промотора тимидинкиназы из вируса простого герпеса. В качестве альтернативы, как промотор можно использовать длинный концевой повтор вируса саркомы Рауса.
(v) Компонент - энхансерный элемент
[0149] Транскрипция молекулы ДНК, кодирующей антитело по настоящему изобретению, высшими эукариотами часто повышается за счет встраивания последовательности энхансера в вектор. В настоящее время известно много энхансерных последовательностей из генов млекопитающих (глобин, эластаза, альбумин, α-фетопротеин и инсулин). Однако, как правило, используют энхансер из вируса эукариотических клеток. Примерами являются энхансер SV40, расположенный со стороны поздних генов по отношению к началу репликации (100-270 пар нуклеотидов), энхансер раннего промотора цитомегаловируса, энхансер полиомы, расположенный со стороны поздних генов по отношению к началу репликации, и аденовирусные энхансеры. См. также Yaniv, Nature 297: 17-18 (1982) в отношении усиливающих элементов для активации эукариотических промоторов. Энхансер может быть сплайсирован в вектор в положении 5' или 3' по отношению к последовательности, кодирующей антитело, однако предпочтительно энхансер расположен на участке с 5'-стороны от промотора.
(vi) Компонент для терминации транскрипции
[0150] Экспрессирующие векторы, используемые в эукариотических клетках-хозяевах (клетках дрожжей, грибов, насекомых, растений, животных, человека или ядросодержащих клетках других многоклеточных организмов) также будут содержать последовательности, необходимые для терминации транскрипции и для стабилизации мРНК. Подобные последовательности обычно доступны из 5'- и иногда 3'-нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Указанные области содержат нуклеотидные участки, транскрибированные в виде полиаденилированных фрагментов в нетранслируемой части мРНК, кодирующей антитело. Одним из компонентов, пригодных для терминации транскрипции, является область полиаденилирования бычьего гормона роста. См. WO94/11026 и указанный в данном описании экспрессирующий вектор.
(vii) Селекция и трансформация клеток-хозяев
[0151] Подходящие клетки-хозяева для клонирования или экспрессии ДНК в векторах согласно настоящему изобретению включают клетки эукариот, дрожжей или высших эукариот, описанные выше. Подходящие прокариоты для этой цели включают эубактерии, такие как грамотрицательные или грамположительные организмы, например, энтеробактерии, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, в частности, Salmonella Typhimurium, Serratia, в частности, Serratia marcescans и Shigella, а также бациллы, такие как B. subtilis и B. licheniformis (например, B. licheniformis 41P, раскрыты в DD 266710, опубликованной 12 апреля 1989), Pseudomonas, такие как P. aeruginosa, и Streptomyces. Одним из предпочтительных хозяев E. coli для клонирования является E. coli 294 (АТСС 31446), хотя подходят и другие штаммы, такие как E. coli B, E. coli X1776 (ATCC 31537) и Е. coli W3110 (ATCC 27325). Эти примеры являются иллюстративными, а не ограничивающими.
[0152] В бактериях могут быть получены полноразмерное антитело, гибридные белки антитела и фрагменты антител, в частности, когда гликозилирование и функция Fc-эффектора не нужны, например, когда терапевтическое антитело конъюгировано с цитотоксическим агентом (например, токсином) что само по себе эффективно для уничтожения опухолевых клеток. Полноразмерные антитела обладают большим временем полужизни в кровотоке. Продуцирование в E. coli является более быстрым и более экономичным. Для экспрессии фрагментов антител и полипептидов в бактериях, см., например, патент США № 5648237 (Carter et. al.), патент США № 5789199 (Joly et al.), патент США № 5840523 (Simmons et al.), которые описывают точку инициации трансляции (TIR) и сигнальные последовательности для оптимизации экспрессии и секреции. См. также Charlton, Methods in Molecular Biology, Vol. 248 (B. K. C. Lo, ed., Humana Press, Totowa, N.J., 2003), на стр. 245-254, где описывается экспрессия фрагментов антител в E. coli. После экспрессии антитело может быть выделено из клеточной массы E. coli в растворимой фракции и может быть очищено, например, с помощью колонки с белком А или G в зависимости от изотипа. Окончательную очистку можно осуществить по аналогичному способу очистки антител, экспрессированных, например, в клетках СНО.
[0153] Помимо прокариот, подходящими для клонирования или экспрессии хозяевами для кодирующих антитело векторов являются эукариотические микробы, такие как нитевидные грибы или дрожжи. Saccharomyces cerevisiae, или обычные пекарские дрожжи, наиболее широко используются среди низших эукариотических микроорганизмов-хозяев. Тем не менее, ряд других родов, видов и штаммов являются общедоступными и могут быть применены в настоящем изобретении, такие как Schizosaccharomyces pombe; Kluyveromyces хозяева, такие как, например, K. lactis, K. fragilis (ATCC 12424), K. bulgaricus (ATCC 16045), K. wickeramii (ATCC 24,178), K. waltii (ATCC 56500), K. drosophilarum (ATCC 36906), K. thermotolerans и K. marxianus; yarrowia (EP 402226); Pichia pastoris (EP 183070); Candida; Trichoderma reesia (EP 244234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; и нитевидные грибы, такие как, например, Neurospora, Penicillium, Tolypocladium и Aspergillus хозяева, такие как A. nidulans и A. niger. Для обзора, где обсуждается использование дрожжей и нитевидных грибов для производства лечебных белков, см., в частности, Gerngross, Nat. Biotech. 22:1409-1414 (2004).
[0154] Могут быть выбраны определенные штаммы грибов и дрожжей, в которых пути гликозилирования были "гуманизированы", что приводит к продуцированию антитела с частично или полностью человеческим профилем гликозилирования. См., например, Li et al., Nat. Biotech. 24:210-215 (2006) (описывает гуманизация пути гликозилирования в Pichia pastoris); и Gerngross et al., supra.
[0155] Подходящие клетки-хозяева для экспрессии гликозилированного антитела также получают из многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные бакуловирусные штаммы и варианты и соответствующие пермиссивные клетки-хозяева насекомых из таких хозяев, как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Разнообразные вирусные штаммы для трансфекции являются общедоступными, в частности, L-1 вариант Autographa californica NPV и Bm-5 штамм Bombyx mori NPV, и подобные вирусы могут быть использованы в данном описании в качестве вируса по изобретению, в частности, для трансфекции клеток Spodoptera frugiperda.
[0156] Культуры растительных клеток хлопка, кукурузы, картофеля, сои, петунии, томатов, ряски (Leninaceae), люцерны (М. truncatula) и табака также можно использовать в качестве хозяев. См., например, патенты США №№ 5959177, 6040498, 6420548, 7125978 и 6417429 (описывают технологию PLANTIBODIES™ получения антител в трансгенных растениях).
[0157] Клетки позвоночных могут быть использованы в качестве хозяев, и размножение клеток позвоночных в культуре (тканевой культуре) является рутинной процедурой. Примерами пригодных клеток-хозяев млекопитающих являются линии клеток почки обезьяны CV1, трансформированных с помощью SV40 (COS-7, ATCC CRL 1651); линия клеток эмбриональной почки человека (293 или 293 субклонированные для роста в суспензии культуры, Graham et al., J. Gen Virol. 36:59 (1977)); клетки почки новорожденного хомяка (ВНК, АТСС CCL 10); клетки мышей Сертоли (ТМ4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почек обезьяны (CV1 АТСС CCL 70); клетки почек африканской зеленой обезьяны (VERO-76, ATCC CRL-1587); клетки карциномы шейки человека (HELA, АТСС CCL 2); клетки почек собаки (MDCK, АТСС CCL 34); клетки печени серой крысы (BRL 3А, АТСС CRL 1442); клетки легких человека (W138, АТСС CCL 75); клетки печени человека (Hep G2, HB 8065); клетки опухоли молочной железы мыши (ММТ 060562, АТСС CCL51); клетки TRI (Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)); клетки MRC 5; клетки FS-4; и клетки линии гепатомы человека (Нер G2). Другие пригодные хозяева млекопитающих включают клеточные линии яичника китайского хомячка (СНО), в том числе клетки DHFR- CHO (Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); и клеточные линии миеломы, такие как NS0 и Sp2/0. Для обзора некоторых линий клеток хозяев-млекопитающих, пригодных для продуцирования антител, см., например, Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B. K. C. Lo, ed., Humana Press, Totowa, N.J., 2003), pp. 255-268.
[0158] Клетки-хозяева трансформируют с помощью вышеуказанных экспрессирующих или клонирующих векторов для продуцирования антител и выращивают в среде для культивирования клеток, представленной в данном описании, которую модифицируют соответствующим образом для индукции промоторов, отбора трансформированных клеток или амплификации генов, кодирующих нужные последовательности.
Рост клеток и продуцирование полипептидов
[0159] Как правило, клетки объединяют (контактируют) с любой средой для культивирования клеток, приведенной в данном описании, в одном или нескольких условиях, которые способствуют либо росту клеток, либо их поддержанию, и/или продуцированию полипептидов. В способах культивирования клетки и продуцирования полипептидов используют сосуд для выращивания культуры (биореактор), чтобы содержать клетки и клеточную культуральную среду. Сосуд для выращивания культуры может быть изготовлен из любого материала, который подходит для культивирования клеток, в том числе из стекла, пластического материала или металла. Как правило, сосуд для выращивания культуры имеет объем, крайней мере, 1 л и может иметь объем 10, 100, 250, 500, 1000, 2500, 5000, 8000, 10000 л или больше. Условия культивирования, такие как температура, рН и т.п., те же, что и ранее использованные для клеток-хозяев, отобранных для экспрессии, и они очевидны специалисту в данной области. Условия культивирования, которые могут быть подобраны в процессе выращивания, включают, однако этим не ограничиваясь, значение рН и температуру.
[0160] Клеточную культуру, как правило, поддерживают в начальной фазе роста в условиях, благоприятных для выживания, роста и жизнеспособности (поддержание) клеточной культуры. Конкретные условия будут меняться в зависимости от типа клеток, организма, из которого получены клетки, и типа и характера экспрессированного полипептида.
[0161] Температуру культивирования клеток в начальной фазе роста выбирают в основном на основе диапазона температур, при которых клеточная культура остается жизнеспособной. Например, в начальной фазе роста клетки СНО хорошо растут при 37°С. В общем случае большинство клеток млекопитающих хорошо растет в диапазоне от приблизительно 25°С до 42°C. Предпочтительно, клетки млекопитающих хорошо растут в пределах от приблизительно 35°С до 40°С. Специалист в данной области техники в состоянии выбрать соответствующую температуру или соответствующие температуры, при которых осуществлять выращивание клетки, в зависимости от клеток и требований производства.
[0162] В одном варианте осуществления настоящего изобретения температуру в начальной фазе роста поддерживают при одной, постоянной температуре. В другом варианте осуществления настоящего изобретения температуру в начальной фазе роста поддерживают в диапазоне температур. Например, температуру можно устойчиво повышать или понижать в начальной фазе роста. В качестве альтернативы, температуру можно повышать или понижать на дискретную величину в различные моменты времени в течение начальной фазы роста. Специалист в данной области техники сможет определить, следует ли использовать одну или несколько температур, и следует ли температуру корректировать постоянно или на дискретную величину.
[0163] Клетки можно культивировать в начальной фазе роста в течение большего или меньшего промежутка времени. В одном варианте клетки культивируют в течение периода времени, достаточного для достижения плотности жизнеспособных клеток, которая составляет определенный процент от максимальной плотности жизнеспособных клеток, которую клетки, в конечном счете, достигают, если им позволить расти без помех. Например, клетки можно культивировать в течение периода времени, достаточного для достижения требуемой плотности жизнеспособных клеток, равной 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 99 процентов от максимальной плотности жизнеспособных клеток.
[0164] В другом варианте осуществления настоящего изобретения клеткам позволяют расти в течение определенного периода времени. Например, в зависимости от исходной концентрации клеточной культуры, температуры, при которой клетки культивируют, и собственной скорости роста клеток, клетки можно выращивать в течение 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более дней. В некоторых случаях клеткам дают расти в течение месяца или больше.
[0165] Культуру клеток можно перемешивать или встряхивать в течение начальной фазы культуры, с целью повышения насыщения кислородом и доставки питательных веществ в клетки. В соответствии с настоящим изобретением, специалисту в данной области техники должно быть понятно, что сказанное может быть полезным для контролирования или регулирования определенных условий внутри биореактора во время начальной фазы роста, в том числе, однако этим не ограничиваясь, для величины рН, температуры, насыщения кислородом и т.д. Например, величину рН можно контролировать путем добавления соответствующего количества кислоты или основания, а насыщение кислородом можно контролировать с помощью барботажных устройств, которые хорошо известны из данной области техники.
[0166] Первой стадией культивирование является фаза роста, в которой условия порционной клеточной культуры модифицируют, с целью усилить рост рекомбинантных клеток для получения системы посевных ферментеров. Фаза роста в общем случае относится к периоду экспоненциального роста клетки, где клетки, как правило, быстро делятся, в частности, растут. Во время данной фазы клетки культивируют в течение определенного периода времени, как правило, однако этим не ограничиваясь, в течение от 1 до 4 дней, например 1, 2, 3, или 4 дня, и в таких условиях, при которых рост клеток оптимален. Определение цикла роста для клетки-хозяина можно провести для конкретной клетки-хозяина, используя способы, известные специалистам в данной области техники.
[0167] В фазе роста минимальную культуральную среду, представленную в данном описании, и клетки можно вносить в сосуд для культивирования порциями. В соответствии с одним аспектом, культуральная среда содержит меньше чем приблизительно 5%, или меньше чем 1%, или меньше чем 0,1% сыворотки и других белков животного происхождения. Тем не менее, если необходимо, могут быть использованы сыворотки и белки животного происхождения. В определенный момент их роста клетки могут образовывать посевную культуру для инокуляции культуральной среды в начале выращивания в продуктивной фазе клетки. В качестве альтернативы, продуктивная фаза клетки может протекать одновременно с фазой роста. За фазой роста клеток обычно следует фаза продуцирования полипептида.
[0168] В фазе продуцирования полипептидов клеточную культуру можно поддерживать, используя второй набор условий культивирования (по сравнению с фазой роста), который способствует выживанию и поддержанию жизнеспособности клеточной культуры и подходит для экспрессии требуемого полипептида. Например, во время последующей продуктивной фазы клетки СНО экспрессируют рекомбинантные полипептиды и белки в диапазоне температур от 25°С до 38°С. Множество дискретных сдвигов температуры может быть использовано для увеличения плотности клеток или их жизнеспособность или для усиления экспрессии рекомбинантного полипептида или белка. В соответствии с одним аспектом, среда, представленная в данном описании, уменьшает присутствие побочных продуктов метаболизма при использовании в способе увеличения продуцирования полипептида, по сравнению загрязнениями, образующимися в том случае, когда полипептид продуцируют в другой среде. В одном варианте загрязняющие вещества представляют собой активные формы кислорода. В соответствии с одним аспектом, среда, представленная в данном описании, уменьшает интенсивность окрашивания полипептидного продукта при использовании в способе усиления продуцирования полипептида, по сравнению с интенсивностью окрашивания, которую получают, когда полипептидный продукт получают в другой среде. В одном варианте способ усиления продуцирования полипептида включает стадию сдвига температуры в течение фазы продуцирования полипептида. В другом варианте стадия сдвига температуры включает смещение температуры от 31°C до 38°C, от 32°C до 38°C, от 33°C до 38°C, от 34°C до 38°C, от 35°C до 38°C, от 36°C до 38°C, от 31°C до 32°C, от 31°C до 33°C, от 31°C до 34°C, от 31°C до 35°С или от 31°С до 36°С.
[0169] Клетки могут поддерживаться в последующей продуктивной фазе до тех пор, пока не будет достигнута требуемая плотности клеток или титр продукции. В одном варианте осуществления настоящего изобретения клетки поддерживают в последующей продуктивной фазе до тех пор, пока титр рекомбинантного полипептида не достигает максимума. В других вариантах осуществления настоящего изобретения культура может быть собрана до достижения этой точки. Например, клетки могут поддерживаться в течение времени, достаточного для достижения плотности жизнеспособных клеток, которая составляет 1, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70 , 75, 80, 85, 90, 95 или 99% от максимальной плотности жизнеспособных клеток. В некоторых случаях может оказаться желательным позволить плотности жизнеспособных клеток достигнуть максимума, а затем позволить плотности жизнеспособных клеток снизится до определенного уровня до сбора культуры.
[0170] В некоторых случаях может оказаться благоприятным или необходимым дополнить клеточную культуру в течение последующей продуктивной фазы питательными веществами или другими компонентами среды, которая была истощена либо принимала участие в метаболизме клеток. Например, может оказаться удобным дополнить клеточную культуру питательными веществами или другими компонентами среды, которые, как было установлено при контролировании культуры клеток, были истощены. В качестве альтернативы или дополнительно может оказаться благоприятным или необходимым дополнить клеточную культуру до начала последующей продуктивной фазы. В качестве не ограничивающих настоящее изобретение примеров, может оказаться благоприятным или необходимым дополнить клеточную культуру гормонами и/или другими факторами роста, определенными ионами (такими как ион натрия, хлорид, ион кальция, ион магния и фосфат), буферными добавками, витаминами, нуклеозидами или нуклеотидами, микроэлементами (неорганическими соединениями, которые обычно присутствуют в очень низких конечные концентрации), аминокислотами, липидами, глюкозой или другим источником энергии.
[0171] Компонент, представленный в данном описании (например, гипотаурин, или его аналог, или его предшественник) может быть добавлен в среду для культивирования клеток в любой момент во время цикла культивирования клеток. Например, гипотаурин может быть добавлен в любой один или более из дней 0-14 в течение 14-дневного цикла культивирования клеток (например, в любой один или более дней 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14) в любом количестве, необходимом чтобы обеспечить клетки культуральной средой, включающей гипотаурин с концентрацией, указанной в данном описании (в частности, равной, по меньшей мере, 0,0001 мМ). Таким образом, следует понимать, что в течение 14-дневного цикла культивирования клеток гипотаурин может быть добавлен в любой один или более из дней 0-14 (например, в один или более дней 0, 1, 2, 3, 4, 5, 6 , 7, 8, 9, 10, 11, 12, 13 или 14) в любом количестве. Используемый в данном описании термин "день 0" может относиться к среде для культивирования клеток, которая была дополнена компонентом, предложенным в данном описании (например, гипотаурин) до того, как среда для культивирования клеток будет применена для клеточной культуры. Следует понимать, что цикл культивирования клеток может длиться любое количество дней, пока клетки остаются жизнеспособными и/или пока продуцируется достаточный уровень полипептида, что может быть определено специалистом в данной области техники. Например, цикл культивирования клеток может длиться, по крайней мере, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней, 15 дней 16 дней, 17 дней, 18 дней, 19 дней, или 20 дней. В некоторых вариантах осуществления настоящего изобретения компонент, предложенный в данном описании (например, гипотаурин, или его аналог, или его предшественник), добавляют в среду для культивирования клеток, по крайней мере, в один день цикла культивирования клеток.
Очистка полипептида
[0172] Требуемый полипептид, предпочтительно, извлекают из культуральной среды в виде секретированного полипептида, хотя он также может быть выделен из клеточных лизатов клетки-хозяина, когда он непосредственно экспрессируется без секреторного сигнала. В соответствии с одним аспектом, продуцированный полипептид представляет собой антитело, такое как моноклональное антитело.
[0173] Культуральную среду или лизат можно центрифугировать для удаления частиц клеточного дебриса. Полипептид затем может быть очищен от загрязняющих его растворимых белков и полипептидов, и следующие методики являются примерами подходящих способов очистки: фракционирование на иммуноаффинных или ионообменных колонках; осаждение этанолом; ВЭЖХ с обращенной фазой; хроматографии на силикагеле или на катионообменной смоле, такой как DEAE; хроматофокусирование; SDS-PAGE; осаждение сульфатом аммония; фильтрация в геле с использованием, например, Sephadex G-75; и применение колонки белок А-сефароза для удаления таких примесей, как IgG. Ингибитор протеазы, такой, как фенилметилсульфонилфторид (PMSF), также может быть пригоден для подавления протеолитического распада во время очистки. Специалистам в данной области техники должно быть понятно, что способы очистки, пригодные для необходимого полипептида, могут потребовать модификации с учетом изменений свойств полипептида после экспрессии в рекомбинантной клеточной культуре. Полипептиды могут быть в общем случае очищены с использованием хроматографических методов (например, с использованием белка А, аффинной хроматографии со стадией элюирования при низкой величине рН и ионообменной хроматографии для удаления образующихся примесей). Для антител пригодность белка A в качестве аффинного лиганда зависит от вида и изотипа любого Fc-домена иммуноглобулина, который присутствует в антителе. Белок A можно использовать для очистки антител, которые основываются на тяжелых цепях γ1, γ2 или γ4 (Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G рекомендуется для всех изотипов мыши и для γ3 человека (Guss et al., EMBO J. 5:15671575 (1986)). Очищенные белки можно концентрировать и получить препарат концентрированного белкового продукта, как указано в данном описании, например, препарат с концентрацией белка, равной, по меньшей мере, 1 мг/мл, или 10 мг/мл, или 50 мг/мл, или 75 мг/мл, или 100 мг/мл, или 125 мг/мл, или 150 мг/мл, или с концентрацией приблизительно 1 мг/мл, или 10 мг/мл, или 50 мг/мл, или 75 мг/мл, или 100 мг/мл, или 125 мг/мл, или 150 мг/мл. Следует понимать, что концентрированные полипептидные продукты могут быть концентрированы до уровней, которые допустимы в условиях концентрирования, например, вплоть до концентрации, при которой полипептид больше не растворяется в растворе. Например, методика очистки полипептида может включать стадии сбора жидкости клеточной культуры из продуцирующих полипептид клеток и очистку полипептида с помощью аффинной хроматографии с использованием белка A с дальнейшей очистки с помощью анионной и катионной обменной хроматографии, фильтрации для удаления вирусов и конечной стадией ультрафильтрации и диафильтрации для конечной композиции и концентрирования полипептида. Не ограничивающие настоящее изобретение примеры способов получения и очистки полипептидов для приготовления лекарств описаны в документе Kelley, B. MAbs., 2009, 1(5):443-452, который в полном объеме включен в данное описание посредством ссылки.
Исследование окрашивания полипептида
[0174] Полипептиды, полученные по способам, подробно рассмотренным в данном описании, и присутствующие в предложенных композициях, могут быть исследованы на их цвет на любой стадии процесса очистки белков. Способ оценки окрашивания может включать сбор жидкости клеточной культуры из клеток, выращенных в среде, подробно рассмотренной в данном описании, выделение полипептида из жидкости клеточной культуры, с целью получить композицию (например, раствор), содержащую полипептид, и исследование окрашивания раствора, содержащего полипептид. В одном варианте оценивают окрашивание композиции, содержащей полипептид, после очистки аффинной хроматографией с использованием белка A. В другом варианте оценивают окрашивание композиции, которая содержит полипептид, после очистки с помощью ионообменной хроматографии. В другом варианте оценивают окрашивание композиции, содержащей полипептид, после очистки высокоэффективной жидкостной хроматографии. Наконец, в еще одном варианте оценивают окрашивание композиции, содержащей полипептид, после очистки хроматографией с гидрофобными взаимодействиями. В еще одном варианте оценивают окрашивание композиции, содержащей полипептид, после очистки эксклюзионной хроматографией. В одном варианте оценивают окрашивание композиции, содержащей полипептид, после очистки фильтрацией, включая микрофильтрацию или ультрафильтрацию. В одном варианте композицию, содержащую полипептид, концентрируют перед проведением оценки окрашивания (например, композиция может содержать, по меньшей мере, 1 мг/мл, 10 мг/мл, 50 мг/мл, 75 мг/мл, 100 мг/мл, 125 мг/мл или 150 мг/мл полипептида, такого как антитело). Композиция, содержащая полипептид, может быть концентрирована с помощью центрифугирования, фильтрующих устройств, полупроницаемых мембран, диализа, осаждения, ионообменной хроматографии, аффинной хроматографии, высокоэффективной жидкостной хроматографии или хроматографии с гидрофобными взаимодействиями. В одном варианте полипептид можно концентрировать лиофилизацией и вновь суспендировать перед проведением оценки окрашивания. Окрашивание композиции, содержащей полипептид, можно оценить после очистки с помощью одного или нескольких методов, рассмотренных в данном описании. В данном описании предполагается оценка окрашивания композиции, содержащей полипептид, которая была подвергнута одному или нескольким циклам замораживания-размораживания. Кроме того, в данном описании предполагаются способы оценки окрашивания культуральной жидкости, которая содержит полипептид, перед очисткой или концентрированием полипептида.
[0175] Оценку окрашивания полипептидов, полученных по способам, подробно рассмотренным в данном описании, вместе со средой, подробно рассмотренной в данном описании (или присутствующей в предложенных композициях), можно провести с использованием одного или нескольких эталонов для визуальной оценки цвета. Методы оценки окрашивания композиции, которая содержит полипептид, включают использование международного или национального стандарта цвета, такого, однако этим не ограничиваясь, как цветовой стандарт Фармакопеи США и цветовой стандарт Европейской фармакопеи. См. монографии USP-24 Monograph 631 Color and Achromaticity. United States Pharmacopoeia Inc., 2000, p. 1926-1927 и Council of Europe. European Pharmacopoeia, 2008, 7th Ed. P.22, которые во всей их полноте включены в данном описании посредством ссылки. Например, анализ на цвет, опалесценцию и окрашивание (COC) может быть использован для оценки окрашивания раствора, содержащего полипептид. В одном варианте идентичные пробирки из бесцветного, прозрачного, нейтрального стекла с внешним диаметром 12 мм используют для сравнения 2,0 мл композиции, которая содержит полипептид, и 2,0 мл воды, или растворителя, или контрольного раствора, предписанного в монографии. Цвета сравнивают при рассеянном дневном свете и рассматривают в горизонтальном положении по отношении к белому фону для определения, измерения или оценки цвета. В другом варианте, идентичные пробирки из бесцветного, прозрачного, нейтрального стекла с плоским дном и внутренним диаметром от 15 мм до 25 мм используют для сравнения композиции, которая содержит полипептид, и водой, или растворителем, или контрольным раствором, предписанным в монографии, при глубине слоя 40 мм. Цвета сравнивают при рассеянном дневном свете и рассматривают в вертикальном положении по отношению к белому фону для определения, измерения или оценки окрашивания. В одном варианте определение, измерение или оценку окрашивания может провести человек путем визуального осмотра. В другом варианте определение, измерение или оценку окрашивания можно провести с использованием автоматизированного процесса. Например, пробирки могут быть помещены в установку, которая визуализует пробирки для обработки изображений по алгоритму определения, измерения или оценки цвета. Следует понимать, что эталоны для анализа методом COC могут быть любыми, которые выбраны, однако этим не ограничиваясь, из коричневого цвета (B), коричневато-желтого цвета (BY), желтого цвета (Y), зеленовато-желтого цвета (GY) или красного цвета (R). Композициям, содержащим полипептид, которые сравнивают с эталоном коричневого цвета, могут быть присвоены значения эталона коричневого цвета B1 (самый темный), В2, В3, В4, В5, В6, В7, В8 или В9 (самый светлый). Композициям, содержащим полипептид, которые сравнивают с эталоном коричневато-желтого цвета, могут быть присвоены значения эталона коричневато-желтого цвета BY1 (самый темный), BY2, BY3, BY4, BY5, BY6 или BY7 (самый светлый). Композициям, содержащим полипептид, которые сравнивают с эталоном желтого цвета, могут быть присвоены значения эталона желтого цвета Y1 (самый темный), Y2, Y3, Y4, Y5, Y6 или Y7 (самый светлый). Композициям, содержащим полипептид, которые сравнивают с эталоном зеленовато-желтого цвета, могут быть присвоены значения эталона зеленовато-желтого цвета GY1 (самый темный), GY2, GY3, GY4, GY5, GY6 или GY7 (самый светлый). Композициям, содержащим полипептид, которые сравнивают с эталоном красного цвета, могут быть присвоены значения эталона красного цвета R1 (самый темный), R2, R3, R4, R5, R6 или R7 (самый светлый). В соответствии с одним аспектом, приемлемым цветом может быть любой цвет, за исключением цвета, который измеряют по самой темной шкале, представленной в данном описании (например, за исключением R1 для значения эталона красного цвета). В одном варианте цвет композиции, которая содержит полипептид, продуцированный клетками, которые выращивают в средах, подробно рассмотренных в данном описании, имеет значения стандартного образца, приведенные в таблице 3. В данном описании, следует понимать, что в соответствии с одним аспектом, среда, которая может быть использована в способах и композициях, приведенных в данном описании, дает полипептидную композицию (которая в одном из вариантов представляет собой композицию, содержащую, по меньшей мере, 100 мг/мл, или 125 мг/мл, или 150 мг/мл полипептида), имеющую значение цвета стандартного образца, выбранное из группы, которая включает В3, В4, В5, В6, В7, В8, В9, BY 3, BY4, BY5, BY6, BY7, Y3, Y4, Y5, Y6, Y7, GY3, GY4, GY5, GY6, GY7, R3, R4, R5, R6 и R7. В соответствии с одним аспектом, среда, которая может быть использована в способах и композициях, приведенных в данном описании, дает полипептидную композицию (которая в одном из вариантов представляет собой композицию, содержащую, по меньшей мере, 100 мг/мл, или 125 мг/мл, или 150 мг/мл полипептида), имеющую значение цвета стандартного образца больше чем любое из B4, B5, B6, B7, B8, BY4, BY5, BY6, Y4 Y5, Y6, GY4, GY5, GY6, GY7, R3, R4, R5 и R6. Как должно быть понятно специалисту в данной области техники, описания значений цвета стандартного образца, могут быть применены к любой среде, любым методам или композициям, приведенным в данном описании, и могут быть использованы для их дальнейшего изменения.
[0176] В некоторых вариантах осуществления настоящего изобретения, интенсивность окрашивания определяют с использованием полного анализа цвета. См. например, документ Vijayasankaran et al., Biotechol. Prog. 29:1270-1277, 2013, который включен в данное описании посредством ссылки. Для проведения полного анализа цвета количественное значение относительного цвета образца получают с помощью системы CIE измерения цвета, как описано в Berns et al., Billmeyer and Saltzman's Principles of Color Technology, 3rd Edition. New York, NY, John Wiley & Sons, Inc., (2000). Вкратце, после гашения водой, спектр поглощения испытуемого образца без растворителя измеряют в видимой области спектра (380-780 нм) с использованием спектрофотометра HP8453A (длина оптического пути кюветы 1 см). Спектр поглощения затем переводят в значения цветовой шкалы CIE L*a*b*, как описано ранее в Standard Practice for Calculation of Color Tolerances and Color Differences from Instrumentally Measured Color Coordinates, Annual Book of ASTM Standards, Vol. 06.01, (2011). L*a*b* представляет собой трехмерное цветовое пространство с приблизительно равномерными интервалами в визуальном восприятии. Цветовое пространство L*a*b* способно количественно оценить различия в визуальной оценке цвета. Например, два раствора, которые по визуальной оценке имеют весьма разные цвета, будут располагаться дальше друг от друга в цветовом пространстве L*a*b*, по сравнению с двумя растворами, имеющими сходный цвет, которые будут ближе друг к другу в цветовом пространстве L*a*b*. В трехмерном пространстве L*a*b* расстояние между точками рассчитывают как евклидово расстояние между точками (дельта Е). Это позволяет измерить дельта E между точками в цветовом пространстве L*a*b* и провести корреляцию этого расстояния с визуальной оценкой восприятия цветовых различий. Большая дельта Е описывает два раствора весьма разного цвета, а небольшая дельта E описывает два раствора сходного цвета. Преобразование спектра поглощения в цветовое пространство L*a*b* требует использования определенного источника света. Например, в качестве осветителя может быть использован искусственный равномерный спектр в видимой области. В некоторых вариантах осуществления настоящего изобретения "полный цвет" может представлять дельта E, которая соответствует евклидовому расстоянию между испытуемым образцом и водой в трехмерной цветовом пространстве CIE L*a*b*. Кроме того, "полный цвет" может представлять общий цвет тестируемого образца моноклонального антитела без дифференциации между различными оттенками. Измерение полного цвета может быть нормировано к значению, полученному для эталона сравнения. Например, значение интенсивности окрашивания в дальнейшем определяют путем расчета отношение измерения "полного цвета" тестируемого образца моноклонального антитела к образцу сравнения моноклонального антитела, имеющему значение COC≤B5.
[0177] Интенсивность окрашивания может быть определена с использованием анализа NIFTY (метод для нормированной собственной флуоресценции желтых/коричневых белков). В данном анализе флуоресценцию молекулы антитела используют в качестве эталона для визуальной оценки цвета, поскольку было показано, что интенсивность окрашивания и интенсивность флуоресценции хорошо коррелируют в пуле белка A (R2=0,84). См. Vijayasankaran et al., Biotechnol. Prog. 27: 1270-1277 (2013). Большее численное значение NIFTY указывает на более высокую интенсивность окрашивания, а меньшее численное значение NIFTY указывает на более низкую интенсивность окрашивания. Образцы моноклонального антитела приблизительно от 50 до 125 мкг анализируют методом эксклюзионной хроматографии (SEC), используя колонку G3000SWXL (TOSOH) с изократической скоростью потока 0,5 мл/мин. Подвижной фазой для SEC служит 0,2 М раствор фосфат калия, 0,25 М хлорида калия, рН 6,2. Температуру колонки поддерживают на уровне 15°C. В частности, за элюентом SEC можно следить по УФ поглощению при 280 нм и по флуоресценции с длиной волны возбуждения 350 нм и длиной волны испускания 425 нм. Указанные длины волн выбраны на основе сильной корреляции, а также максимальной ответной флуоресценции, наблюдаемой для указанных длин волн. Пики SEC видов моноклональных антител интегрируют, используя программное обеспечение Agilent Chemstation для хроматограмм УФ-поглощения и флуоресценции. Для каждого образца моноклонального антитела величину нормированной флуоресценции определяют путем деления площади пика флуоресценции основного пика на площадь пика УФ-поглощения основного пика, которая корректирует ответную флуоресценцию по вкладу массы антитела. Значение интенсивности окрашивания затем определяют путем расчета отношения нормированной флуоресценции тестируемого образца моноклонального антитела к образцу опорного моноклонального антитела (например, образца имеющего значение COC≤В5). Поскольку требования к образцу для NIFTY невелики, указанный анализ пригоден в качестве замены цвета, если объем культуры ограничен.
[0178] Значение NIFTY может быть вычислено, как указано ниже. F = площадь пика на хроматограмме флуоресценции; U = Площадь пика на хроматограмме УФ-поглощения; i = переменная; S = образец; R = эталон.
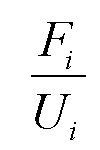 = Флюоресценция, нормированная к концентрации антитела
= Флюоресценция, нормированная к концентрации антитела
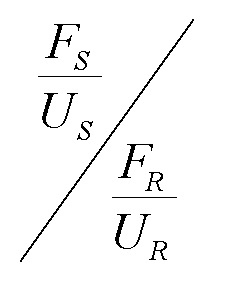 = Относительная флюоресценция (значение NIFTY)
= Относительная флюоресценция (значение NIFTY)
|
|
|
|
[0179] В другом примере полипептиды, полученные по способам, подробно изложенным в данном описании, со средами, приведенными в данном описании (или присутствующие в предложенных композициях) могут быть оценены по их цвету с помощью количественного анализа. В некоторых вариантах осуществления настоящего изобретения количественный анализ может быть проведен с использованием автоматизированного процесса. В некоторых вариантах осуществления настоящего изобретения, более высокое значение (например, большее численное значение), которое дает количественный анализ, указывает на более высокую интенсивность окрашивания, а более низкое значение (например, меньшее числовое значение) указывает на меньшую интенсивность окрашивания.
[0180] Анализ цвета, подробно изложенный в данном описании, может найти применение при оценке окрашивания любого раствора (например, содержащего полипептид раствора), в том числе, однако этим не ограничиваясь, полипептидных композиций, представленных в данном описании.
IV. Композиции и фармацевтические препараты
[0181] Предлагаются также композиции, содержащие среду для культивирования клеток, и один или несколько других компонентов, таких как клетка или требуемый полипептид (в частности, антитело). Клетка, содержащая нуклеиновую кислоту, которая кодирует требуемый полипептид (в частности, антитело) может секретировать полипептид в среду для культивирования клеток по настоящему изобретению в процессе выращивания клеток. Таким образом, композиции настоящего изобретения могут содержать клетку, которая продуцирует полипептид, и среду для культивирования клеток, приведенную в данном описании, в которую секретируется полипептид. Предлагаются также композиции, содержащие продуцированный полипептид и среду для культивирования клеток, приведенную в данном описании. В соответствии с некоторыми аспектами настоящего изобретения, в данном описании приведена композиция, включающая (a) клетку, содержащую нуклеиновую кислоту, которая кодирует полипептид; и (b) среду для культивирования клеток. В соответствии с некоторыми аспектами, композиция включает (a) полипептид; и (b) среду для культивирования клеток, представленную в данном описании, где полипептид секретируется в среду клеткой, содержащей изолированную нуклеиновую кислоту, которая кодирует полипептид. В соответствии с другими аспектами, композиция включает: (a) полипептид; и (b) среду для культивирования клеток, представленную в данном описании, где полипептид высвобождается в среду посредством лизиса клетки, содержащей изолированную нуклеиновую кислоту, которая кодирует полипептид. Клетка композиции может представлять собой любую клетку, подробно рассмотренную в данном описании (например, клетку СНО), а среда композиции может представлять собой любую среду, подробно рассмотренную в данном описании, такую как среда, содержащая одно или несколько соединений, приведенных в таблице 1 или 2. Аналогично, полипептид композиции может представлять собой любой полипептид, подробно рассмотренный в данном описании, например, антитело. В соответствии с некоторыми аспектами, композиция может иметь цвет. В некоторых вариантах осуществления настоящего изобретения цвет определяют, измеряют или оценивают с помощью одного или нескольких эталонов для визуальной оценки цвета. Эталон для визуальной оценки цвета может быть международным или национальным эталоном для визуальной оценки цвета, таким как, однако этим не ограничиваясь, цветовой стандарт Фармакопеи США и цветовой стандарт Европейской фармакопеи. См. USP-24 Monograph 631 Color and Achromaticity. United States Pharmacopoeia Inc., 2000, p. 1926-1927 и Council of Europe. European Pharmacopoeia, 2008, 7th Ed. P.22. Так, в некоторых вариантах осуществления настоящего изобретения композицию, содержащую (a) полипептид; и (b) среду для культивирования клеток, представленную в данном описании, оценивают на интенсивность окрашивания. В другом варианте осуществления настоящего изобретения полипептид выделяют и/или очищают, прежде чем провести оценку интенсивности окрашивания. В некоторых вариантах осуществления настоящего изобретения интенсивность окрашивания композиции, содержащей (a) полипептид; и (b) среду для культивирования клеток, представленную в данном описании, используют для прогнозирования интенсивности окрашивания конечной белковой композиции. Например, композицию, содержащую полипептид и среду для культивирования клеток, приведенную в данном описании, измеряют для определения интенсивности окрашивания, используя анализ COC, как указано в данном описании. Если значение интенсивности окрашивания больше, чем B3, B4, B5, B6, B7, B8 или В9, то существует повышенная вероятность того, что конечная белковая композиция будет иметь значение интенсивности окрашивания больше, чем В3, В4, В5, В6, В7, В8 или В9. В некоторых вариантах осуществления настоящего изобретения композицию, содержащую полипептид и среду для культивирования клеток, подвергают, по меньшей мере, одной стадии очистки перед измерением интенсивности окрашивания. В некоторых вариантах осуществления настоящего изобретения, конечная белковая композиция представляет собой фармацевтическую композицию. В соответствии с некоторыми аспектами, композиция, приведенная в данном описании, содержит полипептид с концентрацией, равной, по меньшей мере, приблизительно 1 мг/мл, 10 мг/мл, или от 25 мг/мл, или от 50 мг/мл, или от 75 мг/мл до приблизительно 100 мг/мл или с концентрацией приблизительно 1 мг/мл, 10 мг/мл или от 25 мг/мл, или от 50 мг/мл, или от 75 мг/мл до приблизительно 100 мг/мл. В соответствии с некоторыми аспектами, композиция, приведенная в данном описании, содержит полипептид с концентрацией, равной, по меньшей мере, 100 мг/мл, или 125 мг/мл, или 150 мг/мл, или с концентрацией приблизительно 100 мг/мл, или 125 мг/мл, или 150 мг/мл или с концентрацией 175 мг/мл, или 200 мг/мл.
[0182] Композиции (например, фармацевтические препараты) полипептидов (например, лечебного полипептида), полученные с помощью любого из способов, приведенных в данном описании, готовят путем смешивания полипептида с требуемой степенью чистоты с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)) в виде лиофилизованных композиций или водных растворов. Фармацевтически приемлемые носители, как правило, не токсичны для реципиентов в используемых дозах и концентрациях и включают, однако этим не ограничиваясь: буферные добавки, антиоксиданты, консерванты, низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды, белки; гидрофильные полимеры; аминокислоты; моносахариды, дисахариды и другие углеводы, хелатирующие агенты, сахара, солеобразующие противоионы, комплексы металлов (например, Zn-белковые комплексы) и/или неионогенные поверхностно-активные вещества. Примеры лиофилизованных полипептидных композиций описаны в патенте США № 6267958. Водные полипептидные композиции включают композиции, описанные в патенте США № 6171586 и в WO2006/044908, при этом последние композиции включают гистидин-ацетатный буфер. В некоторых вариантах осуществления настоящего изобретения фармацевтическую композицию назначают млекопитающему, такому как человек. Фармацевтические композиции полипептида (например, антитела) могут быть введены любыми подходящими способами, в том числе парентерально, внутрилегочно и интраназально, а если требуется для местного лечения, могут быть введены внутриочагово. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование может быть осуществлено любым подходящим способом, например, с помощью инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является ли введение краткосрочным или хроническим. Таким образом, содержащие полипептид фармацевтические составы, представленные в данном описании, могут быть пригодны для инъекции, такой как подкожная инъекция индивиду (например, подкожная инъекция в организм человека). Фармацевтические препараты, которые будут использоваться для введения в условиях in vivo, в общем случае стерильны. Стерильность может быть легко достигнута, например, путем фильтрации через стерильные фильтрационные мембраны.
[0183] В соответствии с некоторыми аспектами, композиция (например, фармацевтический препарат), приведенная в данном описании, содержит полипептид (в частности, лечебный полипептид) с концентрацией, по меньшей мере, приблизительно 1 мг/мл, 10 мг/мл, 25 мг/мл, 50 мг/мл или 75 мг/мл или с концентрацией приблизительно 1 мг/мл, 10 мг/мл, 25 мг/мл, 50 мг/мл или от приблизительно 75 мг/мл до приблизительно 100 мг/мл. В соответствии с другими аспектами, композиция (например, фармацевтический препарат), приведенный в данном описании, содержит полипептид (в частности, лечебный полипептид) с концентрацией, по меньшей мере, приблизительно 100 мг/мл, 125 мг/мл, 150 мг/мл, 200 мг/мл или 250 мг/мл или с концентрацией приблизительно 100 мг/мл, приблизительно 125 мг/мл, приблизительно 150 мг/мл, приблизительно 175 мг/мл, приблизительно 200 мг/мл или приблизительно 250 мг/мл. В некоторых вариантах осуществления настоящего изобретения фармацевтическая композиция, приведенная в данном описании, содержит полипептид с концентрацией, превышающей, по меньшей мере, приблизительно 1 мг/мл, по меньшей мере, приблизительно 10 мг/мл, по меньшей мере, приблизительно 25 мг/мл, по меньшей мере, приблизительно 50 мг/мл или, по меньшей мере, приблизительно 75 мг/мл, и имеет значение интенсивности окрашивания больше, чем B3, B4, B5, B6, B7, B8 или B9, как измеряют с помощью COC анализа. В некоторых вариантах осуществления настоящего изобретения фармацевтическая композиция, приведенная в данном описании, содержит полипептид с концентрацией, превышающей, по меньшей мере, приблизительно 100 мг/мл, по меньшей мере, приблизительно 125 мг/мл, по меньшей мере, приблизительно 150 мг/мл или, по меньшей мере, приблизительно 200 мг/мл, и имеет значение интенсивности окрашивания больше, чем B3, B4, B5, B6, B7, B8 или B9, как измеряют с помощью COC анализа. В соответствии с некоторыми аспектами, значение интенсивности окрашивания, определенное с помощью COC анализа может быть любым, однако этим не ограничиваясь, из B, BY, Y, GY или R, где более высокие значения указывают на меньшую интенсивность окрашивания. В соответствии с некоторыми аспектами, фармацевтическая композиция, приведенная в данном описании, содержит полипептид с концентрацией больше, чем, по меньшей мере, приблизительно 1 мг/мл, по меньшей мере, приблизительно 10 мг/мл, по меньшей мере, приблизительно 25 мг/мл, по меньшей мере, приблизительно 50 мг/мл или, по меньшей мере, приблизительно 75 мг/мл и имеет значение интенсивности окрашивания меньше, чем значение интенсивности окрашивания эталонного раствора, как определяют с помощью анализа цвета. В соответствии с некоторыми аспектами, фармацевтическая композиция, приведенная в данном описании, содержит полипептид с концентрацией, превышающей, по меньшей мере, приблизительно 100 мг/мл, по меньшей мере, приблизительно 125 мг/мл, по меньшей мере, приблизительно 150 мг/мл или, по меньшей мере, приблизительно 200 мг/мл, и имеет значение интенсивности окрашивания меньше, чем значение интенсивности окрашивания эталонного раствора, как определяют с помощью анализа цвета. Например, интенсивность окрашивания композиции (в частности, фармацевтической композиции), которая содержит полипептид (в частности, лечебный полипептид) может быть уменьшена, по меньшей мере, на 0,1% или от приблизительно 5% до приблизительно 50%, по сравнению с композицией, которая содержит полипептид, продуцированный клеткой, выращенной в среде для культивирования клеток, которая не включает один или несколько компонентов, указанных в таблице 1 или таблице 2.
V. Готовые изделия или наборы реагентов
[0184] Описывается набор реагентов для дополнения среды для культивирования клеток определенными химическими составляющими. Указанный набор реагентов может содержать высушенные компоненты, которые должны быть восстановлены, а также может содержать инструкции по применению (например, инструкции по использованию при дополнении среды компонентами набора реагентов). Указанный набор реагентов может содержать компоненты, представленные в данном описании в количествах, пригодных для дополнения среды для культивирования клеток. В соответствии с некоторыми аспектами, указанный набор реагентов содержит один или несколько компонентов, выбранных из группы, которая включает гипотаурин, s-карбоксиметилцистеин, ансерин, бутилзамещенный гидроксианизол, карнозин, липоевую кислоту и гидрат кверцитрина в количествах, необходимых для дополнения среды для культивирования клеток концентрацией компонента, указанной в таблице 1 или таблице 2. В некоторых вариантах осуществления настоящего изобретения набор реагентов содержит одно или несколько: (a) гипотаурин в количестве, обеспечивающем от приблизительно 2,0 мМ до приблизительно 50,0 мМ гипотаурина в среде для культивирования клеток; (b) s-карбоксиметилцистеин в количестве, обеспечивающем от приблизительно 8,0 мМ до приблизительно 12,0 мм s-карбоксиметилцистеина в среде для культивирования клеток; (c) карнозин в количестве, обеспечивающем от приблизительно 8,0 мМ до приблизительно 12,0 мМ карнозина в среде для культивирования клеток; (d) ансерин в количестве, обеспечивающем от приблизительно 3,0 мм до приблизительно 5,0 мм ансерина в среде для культивирования клеток; (e) бутилзамещенный гидроксианизол в количестве, обеспечивающем от приблизительно 0,025 мМ до приблизительно 0,040 мМ бутилзамещенного гидроксианизола; (f) липоевая кислота в количестве, обеспечивающем от приблизительно 0,040 мМ до приблизительно 0,060 мМ липоевой кислоты в среде для культивирования клеток; (g) гидрат кверцитрина в количестве, обеспечивающем от приблизительно 0,010 мМ до приблизительно 0,020 мМ гидрата кверцитрина в среде для культивирования клеток; и (h) аминогуанидин в количестве, обеспечивающем от приблизительно 0,0003 мМ до приблизительно 10 мМ аминогуанидина в среде для культивирования клеток. В соответствии с некоторыми аспектами, набор содержит один или несколько компонентов, где одним или несколькими компонентами являются гипотаурин, или его аналог, или его предшественник. В некоторых вариантах осуществления настоящего изобретения гипотаурин, или его аналог, или его предшественник выбран из группы, которая включает гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоты и таурин. В некоторых вариантах осуществления настоящего изобретения набор реагентов представляет собой набор для дополнения среды для культивирования клеток определенными химическими составляющими, при этом набор включает гипотаурин, или его аналог, или его предшественник с концентрацией, равной, по меньшей мере, приблизительно 0,0001 мМ, и где гипотаурин, или его аналог, или его предшественник выбран из группы, включающей гипотаурин, s-карбоксиметилцистеин, цистеамин, цистеинсульфиновую кислоту и таурин.
[0185] В соответствии с другим аспектом настоящего изобретения, предлагается готовое изделие, состоящее из контейнера, который содержит среду для культивирования клеток по настоящему изобретению и, необязательно, предлагается инструкции по ее применению. Подходящие контейнеры включают, например, бутылки и мешки. Контейнер может быть выполнен из различных материалов, таких как стекло или пластик. Контейнер содержит среду для культивирования клеток и этикетку, которая наклеена на контейнер или связана с ним, при этом контейнер может указывать порядок использования (например, при использовании для культивирования клеток). Готовое изделие может дополнительно включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая другие буферные добавки, разбавители и вкладыши с инструкциями по применению.
[0186] Следующие примеры приведены для иллюстрации, но не для ограничения настоящего изобретения.
ПРИМЕРЫ
[0187] Были идентифицированы среды, которые продуцируют белковый продукт (например, лекарственный белок) с приемлемыми показателями качества, такими как уменьшенная интенсивность окрашивания, в частности, когда белковый продукт присутствует в виде концентрированного раствора (например, с концентрацией, равной, по меньшей мере, приблизительно 1 мг/мл или, по меньшей мере, приблизительно 100 мг/мл). Описаны способы культивирования клеток в средах, представленных в данном описании, а также способы получения полипептида с использованием указанных сред. Среда A, в соответствии с одним аспектом, включает гипотаурин. В соответствии с некоторыми аспектами, представленными в данном описании, среда содержит один или несколько аналогов гипотаурина или его предшественников, таких как карбоксиметилцистеин. Каждый из компонентов сред может присутствие в любом указанном количестве. Среда может представлять собой среду с известным химическим составом или среду с неизвестным химическим составом. При использовании в способе получения полипептида среды могут снижать присутствие активных форм кислорода по сравнению с полипептидом, полученным в других средах. Среда находит применение на всех этапах выращивания клеток и производства полипептида и может быть использована в минимальной среде и/или в питательной среде. Предлагается полипептид, полученный любым из способов, приведенных в настоящем описании, предлагается также фармацевтическая композиция, содержащая полипептид, полученный, как описано в данном документе. В соответствии с одним аспектом, фармацевтические композиции содержат полипептид с концентрацией, равной, по меньшей мере, любому из значений 100 мг/мл, 125 мг/мл или 150 мг/мл. Также описываются наиболее предпочтительные способы получения и композиции, содержащие антитела. Также описываются наборы реагентов для дополнения среды для культивирования клеток определенными химическими составляющими
Пример 1: Идентификация соединений-антиоксидантов, способных снижать окрашивание композиций антител.
[0188] Соединения, которых, как сообщалось, вступают в реакцию с окислителем, отбирают по их способности уменьшать окрашивание композиций, содержащих белок (таблица 4). Для отбора антиоксидантов готовят среды общим объемом 40 мл путем смешивания 1 части минимальной среды 1 и 0,3 части питательной среды 2, чтобы отразить репрезентативное соотношение сред, используемых в условиях культивирования клеток (таблица 5). Смесь среды 1 и среды 2, которая, как было показано ранее, увеличивает интенсивность окрашивания содержащих антитело растворов, когда их используют для культивирования продуцирующих антитела клеток, дополняют одним из 30 соединений-антиоксидантов и вносят 2 г/л IgG1 моноклонального антитела. Образцы инкубируют при 37°С при встряхивании при 250 об./мин в течение пяти дней инкубационного периода. В скрининговый анализ включают два контрольных образца: 1) образец 40 мл смеси 1 и смеси 2, содержащий 2 г/л IgG1 моноклонального антитела инкубируют в течение 5 дней при 37°С при встряхивании при 250 об./мин без антиоксиданта (положительный контроль), и 2) образец 40 мл смеси сред готовят путем смешивания 1 части минимальной среды 3 и 0,3 части питательной среды 4 (таблица 5), которая, как было показано ранее, уменьшает интенсивность окрашивания растворов, содержащих антитело, когда ее используется для культивирования клеток, продуцирующих антитела, вносят 2 г л IgG1 моноклонального антитела и инкубируют в течение 5 дней при 37°С при встряхивании при 250 об./мин без антиоксиданта (отрицательный контроль).
|
|
|
|
|
[0189] После инкубирования моноклональное антитело очищают с помощью аффинной хроматографии. Интенсивность окрашивания концентрированной композиции антитела измеряют в очищенном пуле, с использованием анализа, где большие численные значения указывают на большую интенсивность окрашивания, а меньшие численные значения указывают на меньшую интенсивность окрашивания. Численные результаты нормируют к положительному контролю, при этом значение для положительного контроля принимают за 0% изменения интенсивности окрашивания. Было установлено, что из 30 исследованных соединений-антиоксидантов несколько соединений, таких как гентизиновая кислота, цистеамин, гидрокортизон и меркаптопропионил глицин, увеличивают окрашивание композиции антител (фиг. 1). Для сравнения, было установлено, что шесть соединений, таких как гипотаурин, ансерин, бутилзамещенный гидроксианизол, карнозин, липоевая кислота и гидрат кверцитрин, уменьшают окрашивание композиции антител (фиг. 2). Из антиоксидантов, которые уменьшают интенсивность окрашивания, гипотаурин демонстрирует наибольший эффект, снижая интенсивность окрашивания композиции, содержащей антитело, приблизительно на 25%. Таурин, аналог гипотаурина, также снижает интенсивность окрашивания приблизительно на 5%.
|
|
Пример 2: Определение характеристик антиоксидантов, способных уменьшить интенсивность окрашивания композиций антител, выделенных из клеточных линий, продуцирующих антитела.
[0190] Оценивают способность гипотаурина снижать интенсивность окрашивания композиций, содержащих антитела, которые получают непосредственно из клеточных культур. Для проведения указанных исследований используют модель культуры клеток в колбе шейкера, которая, как было установлено, может отражать более масштабную 2L модель культуры клеток. Вкратце, для модели культуры клеток в колбе шейкера продуцирующие антитела клетки СНО инокулируют приблизительно в количестве 1,0*106 клеток/мл в колбу емкостью 250 мл, содержащую 100 мл минимальной Среды 1 или минимальной Среды 3. Для более масштабных 2L клеточных культур продуцирующие антитела клетки СНО инокулируют приблизительно 1,0*106 клеток/мл в 2-литровом биореакторе при перемешивании (Applikon, Foster City, CA), содержащем 1 л минимальной Среды 1 или минимальной Среды 3. Для более масштабной модели выращивания клеток клетки выращивают в режиме периодического культивирования с подпиткой, добавляя 100 мл питательной Среды 2, если выращивание проводят в минимальной Среде 1, или 100 мл питательной Среды 4, если выращивание проводят в минимальной Среде 3, на литр жидкости клеточной культуры в дни 3, 6 и 9 для инициации продуктивной фазы. Для модели клеточной культуры в колбе шейкера клетки выращивают в режиме культивирования с подпиткой, добавляя 10 мл питательной Среды 2, если выращивание проводят в минимальной Среде 1, или 10 мл питательной Среды 4, если выращивание проводят в минимальной Среде 3, на литр жидкости клеточной культуры в дни 3, 6 и 9 для инициации продуктивной фазы. Концентрацию глюкозы анализируют ежедневно и, если концентрация глюкозы падает ниже 3 г/л, то ее пополняют из маточного 500 г/л раствора глюкозы, с целью предотвращения истощения глюкозы. Реакторы оснащены калиброванными датчиками определения растворенного кислорода, рН и температуры. Растворенный кислород контролируют в режиме реального времени, барботируя воздух и/или кислород. Для более масштабной 2L культуры клеток величину рН контролируют, добавляя CO2 или Na2CO3, и если необходимо, в культуры добавляют пеногаситель. Клеточные культуры поддерживают при рН 7,0 и температуре 37°С в течение от дня 0 до дня 3, а затем при температуре 35°С по прошествии 3 дней. Культуры клеток перемешивают со скоростью 275 об./мин при уровне растворенного кислорода, составляющем 30% от насыщения воздухом. Для клеточных культур в колбе шейкера культуры помещают на платформу шейкера и перемешивают при 150 об./мин в инкубаторе с 5% CO2 при температуре 37°С в дни 0-3 цикла культивирования клеток, а затем температуру смещают к 35°С на 4-й день до конца цикла культивирования клеток в 14 день. Осмоляльность контролируют с помощью осмометра, полученного от компании Advanced Instruments (Norwood, MA). Кроме того, значение рН и концентрацию метаболитов ежедневно определяют автономно с использованием Nova Bioprofile 400 (Nova Biomedical, Waltham, MA). Плотность жизнеспособных клеток (VCC) и жизнеспособность клеток определяют ежедневно с помощью автоматизированной счетчика клеток ViCell® (Beckman Coulter, Fullerton, CA). Культуральную жидкость отбирают ежедневно путем центрифугирования 1 мл культуральной жидкости для определения титра антител с помощью высокоэффективной жидкостной хроматографии. По окончании периода культивирования клеток на 14-й день культуральную жидкость из всех образцов собирают центрифугированием. Моноклональное антитело в собранной культуральной жидкости очищают с помощью аффинной хроматографии. Интенсивность окрашивания концентрированной композиции антитела определяют в очищенном пуле с использованием анализа, где большие численные значения указывают на более высокую интенсивность окрашивания, а меньшие численные значения указывают на меньшую интенсивность окрашивания. Рост, который определяют по VCC (фиг. 3А) и жизнеспособности клеток (фиг. 3В), сравнивают между моделью клеточной культуры большего масштаба (2L) и моделью клеточной культуры в колбе шейкера (SF) независимо от используемых сред. Продуцирование антител несколько ниже в модели культуры клеток в колбе шейкера, при этом наиболее высокий уровень продуцирования антител наблюдается в более масштабной модели культуры клеток, инкубированной в Среде 1 и Среде 2 (фиг. 3C). Интенсивность окрашивания композиции антител, полученной из модели клеточной культуры в колбе шейкера меньше со значением 1,07 при культивировании в Среде 3 и Среде 4, по сравнению с композициями антител, полученными из композиций клеточной культуры в колбе шейкера при культивировании в Среде 1 и Среде 2, которые имеют значение 2,25. Данные эксперименты показывают, что модель в колбе шейкера сопоставима с моделью 2L культивирования клеток и пригодна для использования в последующих экспериментах.
[0191] Для экспериментов с композициями сред для культивирования клеток, дополненными антиоксидантом гипотаурином, продуцирующие антитела клетки СНО инокулируют в количестве приблизительно 1,0*106 клеток/мл в колбу емкостью 250 мл, содержащую 100 мл минимальной Среды 1. Среду 1 дополняют с помощью 9,16 мМ (100%), 4,58 мМ (50%) или 2,29 мМ (25%) гипотаурина для использования в клеточной культуре в день 0. Клетки выращивают в режиме культивирования с подпиткой, добавляя 10 мл Среды 2 на литр культуральной жидкости в дни 3, 6 и 9 для инициации продуктивной фазы. Дополнительный экспериментальный образец включает постепенное добавление 9,16 мМ гипотаурина в течение всего периода культивирования клеток. В частности, 2,29 мМ (25%) гипотаурина добавляют в день 0 клеточной культуры в минимальной Среде 1, и 25% добавляют в День 3, День 6 и 9 день в питательной Среде 2. Положительный контроль включают путем культивирования клеток в Средах 1 и 2 без добавок гипотаурина. Отрицательный контроль включают путем культивирования клеток, которые выращивают в Среде 3 и Среде 4, без добавок гипотаурина. Как описано выше, концентрацию глюкозы анализируют ежедневно, и если концентрация глюкозы падает ниже 3 г/л, ее пополняют из маточного 500 г/л раствора глюкозы для предотвращения истощения глюкозы. Клеточные культуры поддерживают при рН 7,0 и температуре 37°С со дня 0 до дня 3, а затем при температуре 35°С по прошествии 3 дней. Культуры клеток перемешивают при 275 об./мин, и уровень растворенного кислорода составляет 30% от насыщения воздухом. VCC и жизнеспособность клеток измеряют ежедневно с помощью автоматизированного счетчика клеток ViCell® (Beckman Coulter, Fullerton, CA). Культуральную жидкость отбирают путем центрифугирования ежедневно по 1 мл культуральной жидкости для определения титра антител с помощью высокоэффективной жидкостной хроматографии. По окончании периода культивирования клеток на 14-й день культуральную жидкость из всех образцов собирают центрифугированием. Моноклональное антитело в собранной культуральной жидкости очищают с помощью аффинной хроматографии. Интенсивность окрашивания концентрированной композиции антитела определяют в очищенном пуле с использованием анализа, где большие численные значения указывают на большую интенсивность окрашивания, а меньшие численные значения указывают на меньшую интенсивность окрашивания. Численные результаты нормируют к положительному контролю, при этом значение для положительного контроля принимают за 0% изменения интенсивности окрашивания. Рост, который определяют по VCC (фиг. 4А) и жизнеспособности клеток (фиг. 4В), сопоставим для всех протестированных клеточных культур. Кроме того, за исключением порционного добавления дополнительного гипотаурина, клеточные культуры, выращенные в среде, дополненной гипотаурином, продуцируют тот же уровень титра антитела, что и клеточные культуры, культивированные в среде, не содержащей гипотаурин (фиг. 4C). Обнаружено, что интенсивность окрашивания уменьшается для более высокой концентрацией гипотаурина, и наибольшее снижение наблюдается в средах, содержащих 9,16 мМ гипотаурина (фиг. 5). Указанное уменьшение интенсивности окрашивания оптимально, когда гипотаурин добавляют в виде болюса в 1-й день, а не добавляют порциями в течение периода инкубирования культуры клеток. Сравнение значений интенсивности окрашивания, полученных из экспериментов с культурой клеток, и экспериментов с инкубированием (см. Пример 1), показывают, что результаты экспериментов по скринингу при инкубировании (фиг. 5, не заштрихованные кружки) хорошо коррелируют с результатами экспериментов клеточной культуры (фиг. 5, заштрихованные кружки).
[0192] Аналогичные эксперименты проводят для композиций антител, выделенных из клеточных культур, собранных из минимальной Среды 3 и питательной Среды 4, с целью определить, распространяется ли эффект гипотаурина, связанный с уменьшение окрашивания, и на другие культуры клеток. Вкратце, как описано выше, продуцирующие антитела клетки СНО инокулируют в количестве приблизительно 1,0*106 клеток/мл в колбу емкостью 250 мл, содержащую 100 мл минимальной Среды 3. Среду 3 дополняют с помощью 12,95 мМ (1X), 25,9 мМ (2X) или 38,85 мМ (3X) гипотаурина для использования в клеточной культуре в день 0. Клетки выращивают в режиме культивирования с подпиткой, добавляя 10 мл Среды 4 на литр культуральной жидкости в дни 3, 6 и 9 для инициации продуктивной фазы. Положительный контроль включают путем культивирования клеток в Средах 2 и 4 без дополнения гипотаурином. Культуры помещают на платформу шейкера и перемешивают при 150 об./мин в инкубаторе с 5% CO2 при температуре 37°С в дни с 0 по 3 цикла культивирования клеток, а затем температуру смещают к 35°С на 4-й день до конца цикла культивирования клеток в 14 день. Осмоляльность, рН и концентрацию метаболитов определяют автономно, как указано выше. VCC и жизнеспособность клеток определяют ежедневно с помощью автоматизированного счетчика клеток ViCell® (Beckman Coulter, Fullerton, CA). Культуральную жидкость отбирают ежедневно путем центрифугирования 1 мл культуральной жидкости для определения титра антител с помощью высокоэффективной жидкостной хроматографии. По окончании периода культивирования клеток на 14-й день культуральную жидкость из всех образцов собирают центрифугированием. Моноклональное антитело в собранной культуральной жидкости очищают с помощью аффинной хроматографии. Интенсивность окрашивания концентрированной композиции антитела определяют в очищенном пуле с использованием анализа, где большие численные значения указывают на большую интенсивность окрашивания, а меньшие численные значения указывают на меньшую интенсивность окрашивания. Численные результаты нормируют к положительному контролю, при этом значение для положительного контроля принимают за 0% изменения интенсивности окрашивания. Обнаружено, что интенсивность окрашивания уменьшается с увеличением концентрации гипотаурина, при этом наибольшее уменьшение наблюдается в средах, содержащих 38,85 мМ гипотаурина (фиг. 6).
Пример 3: Изучение характеристик аналогов гипотаурина для уменьшения окрашивания композиций антител, выделенных из клеточных линий, продуцирующих антитела.
[0193] Аналоги гипотаурина тестируют, с целью оценить, способны ли они вызывать эффект уменьшения окрашивания в композициях, содержащих антитела. Клетки СНО, продуцирующие антитело, инокулируют в количестве приблизительно 1,0*106 клеток/мл в 2-литровый перемешиваемые биореакторы (Applikon, Foster City, CA), содержащие 1 л минимальной Среды 1, дополненной 12,95 мМ гипотаурина или 10 мМ карбоксиметилцистеина (номер CAS 638-23-3). Клетки выращивают в режиме культивирования с подпиткой, добавляя 100 мл питательной Среды 2 на один литр культуральной жидкости в дни 3, 6 и 9 для инициирования продуктивной фазы. Положительный контроль включают путем культивирования клеток в Средах 1 и 2 без дополнения гипотаурином. Концентрацию глюкозы анализируют ежедневно, и если концентрация глюкозы падает ниже 2 г/л, то ее пополняют из маточного 1,5 г/л раствора глюкозы, с целью предотвращения истощения глюкозы. Реакторы были оснащены калиброванными датчиками для определения растворенного кислорода, рН и температуры. Растворенный кислород контролируют в режиме реального времени, барботируя воздух и/или кислород. Величину рН контролируют, добавляя CO2 или Na2CO3, и если необходимо, в культуры добавляют пеногаситель. Клеточные культуры поддерживают при рН 7,0 и температуре 37°С в период от дня 0 до дня 3, а затем при температуре 35°С по прошествии 3 дней. Культуры клеток перемешивают со скоростью 275 об./мин при уровне растворенного кислорода 30% за счет насыщения воздухом. Осмоляльность контролируют с помощью осмометра, полученного от компании Advanced Instruments (Norwood, MA). Кроме того, значение рН и концентрацию метаболитов ежедневно определяют автономно с использованием Nova Bioprofile 400 (Nova Biomedical, Waltham, MA). VCC и жизнеспособность клеток определяют ежедневно с помощью автоматизированного счетчика клеток ViCell® (Beckman Coulter, Fullerton, CA). Культуральную жидкость отбирают ежедневно путем центрифугирования 1 мл культуральной жидкости для определения титра антител с помощью высокоэффективной жидкостной хроматографии. По окончании периода культивирования клеток на 14-й день, когда количество белка в культурах составляет приблизительно 2-10 г/л, культуральную жидкость из всех образцов собирают центрифугированием. Моноклональное антитело в собранной культуральной жидкости очищают с помощью аффинной хроматографии, используя белок A. Пул белка A концентрируют до уровня 150 г/л, используя центробежные фильтры Amicon Centricon (Millipore Corporation, Billerica, MA). Интенсивность окрашивания концентрированной композиции антитела измеряют в концентрированном пуле белка A с использованием двух различных анализов, где большие численные значения указывают на более высокую интенсивность окрашивания, и меньшие численные значения указывают на меньшую интенсивность окрашивания. Рост, который определяют по VCC (фиг. 7А) и жизнеспособности клеток (фиг. 7В), сопоставим для всех исследованных клеточных культур. Клеточные культуры, выращиваемые в среде, дополненной гипотаурином или карбоксиметилцистеином, продуцируют сопоставимые уровни титра антител (фиг .8). Используя конкретный анализ цвета, определяют, что интенсивность окрашивания композиции изолированного антитела уменьшается на 27% и 13%, когда клетки, продуцирующие антитело, выращивают среде, дополненной гипотаурином и карбоксиметилцистеином, соответственно (фиг. 9А). Указанное уменьшение интенсивности окрашивания подтверждено с помощью второго анализа цвета, который обнаруживает уменьшение интенсивности окрашивания приблизительное на 17% и 13% в композициях антитела, выделенного из клеток, которые выращены в среде, дополненной гипотаурином и карбоксиметилцистеином, соответственно (фиг. 9B).
Пример 4: Изучение характеристик аминогуанидина для уменьшения окрашивания в композиции антител, выделенных из клеточных линий, продуцирующих антитела.
[0194] С целью определить соединение, которое восстанавливается в композициях антител и работает в условиях культивирования клеток, проводят скрининг в среде без клеток. Для скрининга выбирают таурин, карнозин и аминогуанидин. Указанные соединения растворяют в 25 мл культуральной среды с концентрацией 1,2 г/л (таурин), 13,6 г/л (карнозин) и 27,2 г/л (гидрохлорид аминогуанидина). После регулирования величины рН до уровня в диапазоне от 6,8 до 7,2 и стерилизации фильтрованием в фильтровальной установке Steriflip (Millipore, Billerica, MA) раствор инкубируют в пробирках Falcon емкостью 50 мл (BD Biosciences, Сан-Хосе, Калифорния), снабженных колпачками TubeSpin (TPP Techno Plastic Products AG, Trasadingen, Switzerland). Клетки СНО инкубируют в течение 7 дней в инкубаторе с контролем влаги при температуре 37°С и скорости вращения 250 об./мин без защиты от света, чтобы продуцировать моноклональное антитело.
[0195] Моноклональное антитело в собранной культуральной жидкости (HCCF) и инкубационный бульон дополнительно очищают аффинной хроматографией. Интенсивность окрашивания концентрированной композиции антитела измеряют в очищенном пуле с использованием анализа, где большие численные значения указывают на более высокую интенсивность окрашивания, а меньшие численные значения указывают на меньшую интенсивность окрашивания.
[0196] Относительная интенсивность окрашивания для антител, полученных в культуральной среде, содержащей таурин, карнозин или аминогуанидин, приведена на фиг. 10. Полученные данные показывают, что аминогуанидин способен уменьшить окрашивание приблизительно на 71%, а относительное значение интенсивности окрашивания даже ниже, чем значение для отрицательного контроля, в котором антитело инкубировали вообще без добавления глюкозы.