Моноклональное антиидиотипическое антитело АИ-G1, обладающее антигенными свойствами морфина
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, в частности, к антителам, имитирующим морфин-специфические антигенные свойства и способным связываться с опиоидными рецепторами.
В настоящее время, по данным федерального статистического управления Минздрава России, среди зарегистрированных больных наркоманией подавляющее большинство составляют больные с зависимостью от опиатов (78,4%) [Киржанова В.В., Григорова Н.И. О заболевании наркологическими расстройствами в 2014 г. // Вопросы наркологии, 2015; 4:19-28]. В этой связи в нашей стране проводится активный поиск эффективных путей лечения и профилактики опиатной зависимости. Лечение и профилактика наркомании тесно связаны с разработкой новых эффективных методов иммунотерапии с применением высокоспецифических вакцин к психоактивным веществам (ПАВ).
В мире широко применяется вакцинация против наркотической зависимости с применением конъюгатов высокомолекулярных соединений, таких как холерный токсин или гемоцианин улитки, и ПАВ [Bonese K.F., Wainer В.Н., Fitch F.W, Rothberg R.M., Schuster C.R. Changes in heroin self-administration by a rhesus monkey after morphine immunization // Nature, 1974; 252(5485):708-710; Anton В., Salazar A., Flores A., Matus M., Marin R., Hernandez J., Leff P. Vaccines against morphine/heroin and its use as effective medication for preventing relapse to opiate addictive behaviors // Human Vaccines, 2009; 5(4):214-229]. При таком способе вакцинации индуцируются антитела, специфичные не только к наркотикам, но и к эндогенным опиоидным пептидам. Так, предлагается вакцина, содержащая в качестве антигена алкалоиды опия, которая вызывает образование в организме антител к героину и морфину. Антитела образуют комплекс с героином, вводимым в организм, и таким образом уменьшается его проникновение в мозг (CN 1196955 А, 28.10.1998). Данный подход вступает в противоречие с действующим в РФ Федеральным законом №3-ФЗ от 08.01.1998 «О наркотических средствах и психотропных веществах», запрещающим лечение наркомании наркотическими средствами. Одним из наиболее перспективных направлений является создание вакцины на основе вторичных антиидиотипических антител - Ab2. Известен способ вакцинации от наркотической зависимости с применением моноклональных антиидиотипических (мАи) антител к кокаину [Schabacker D.S., Kirschbaum K.S., Segre М. Exploring the feasibility of an anti-idiotypic cocaine vaccine: analysis of the specificity of anticocaine antibodies (Ab1) capable of inducing Ab2b anti-idiotypic antibodies // Immunology, 2000; 100:48-56].
Поскольку основными активными метаболитами героина у человека являются 6-моноацетилморфин, морфин и морфин-6-глюкуронид [Берзина А.Г., Гамалея Н.Б. и др. Методологические подходы к разработке вакцины для лечения зависимости от опиатов // Наркология, 2015; 11(167):25-31], для лечения и профилактики зависимости от этих опиатов, а также для разработки методов специфической диагностики первоначально были получены мышиные моноклональные антитела (мАт) 6G1, которые узнают 6-гемисукцинильный (ГСМ) эфир морфина, коньюгированный с БСА [заявка на изобретение РФ №2018139993].
Технической задачей, решаемой авторами, являлось получение мАи антител к мАт 6G1, способных специфически связываться с опиоидными рецепторами и при вакцинации животных индуцировать выработку антител третьего поколения Ab3 к производным морфина.
Технический результат достигался созданием мАи антитела АИ-G1, которое с высокой аффинностью связывается с идиотипом антитела 6G1, индуцирует при иммунизации выработку антител, специфически распознающих производные морфина, то есть проявляет антигенные свойства морфина, и связывается с опиодными рецепторами.
Антиидиотипическое моноклональное антитело АИ-G1 содержит вариабельную область тяжелой цепи по SEQ ID NO: 3 и вариабельную область легкой цепи по SEQ ID NO: 4, а также гипервариабельные участки вариабельной области тяжелой цепи по SEQ ID NO: 5-7 и гипервариабельные участки вариабельной области легкой цепи по SEQ ID NO: 8-10.
Полученное мАи антитело АИ-G1 связывается с опиоидными рецепторами клеток глиобластомы человека линии T98G. АИ-G1 при иммунизации кролика индуцирует выработку Ab3 антител, которые связывают 6-гемисукцинильный (ГСМ), 3-О-карбоксиметильный (КММ) и 2-р-карбокси-фенилазометильный (ФАМ) эфиры морфина, конъюгированные с БСА с помощью бифункционального реагента 1-этил-3-(3-диметиламинопропил) карбодиимида гидрохлорида по методикам, описанным в статье: Берзина А.Г., Гамалея Н.Б., Ульянова Л.И, Шестаков К.А., Ульянова М.А., Капанадзе К.Д., Станкова Н.В., Ревякин А.О., Фокин Ю.В., Кротов Г.И., Родченков Г.М. Методологические подходы к разработке вакцины для лечения зависимости от опиатов // Наркология, 2015; 11(167):25-31].
Технология получения антитела включала в себя иммунизацию животных антигеном, представляющим собой мАт 6G1, коньюгированное с гемоцианином лимфы улитки (KLH) по методике, описанной в: Hermanson G.T. Bioconjugate Techniques. ISBN 9780123705013, Academic Press Inc., 2008.
Для отбора позитивных продуцентов мАи антител при постановке иммуноферментного анализа (ИФА) использовали в качестве сорбированного на планшетах антигена мАт 6G1, на последней стадии анализа детекцию специфических антител проводили конъюгатом 6G1-пероксидаза хрена.
Свойства и структура антитела иллюстрируются следующими графическими материалами:
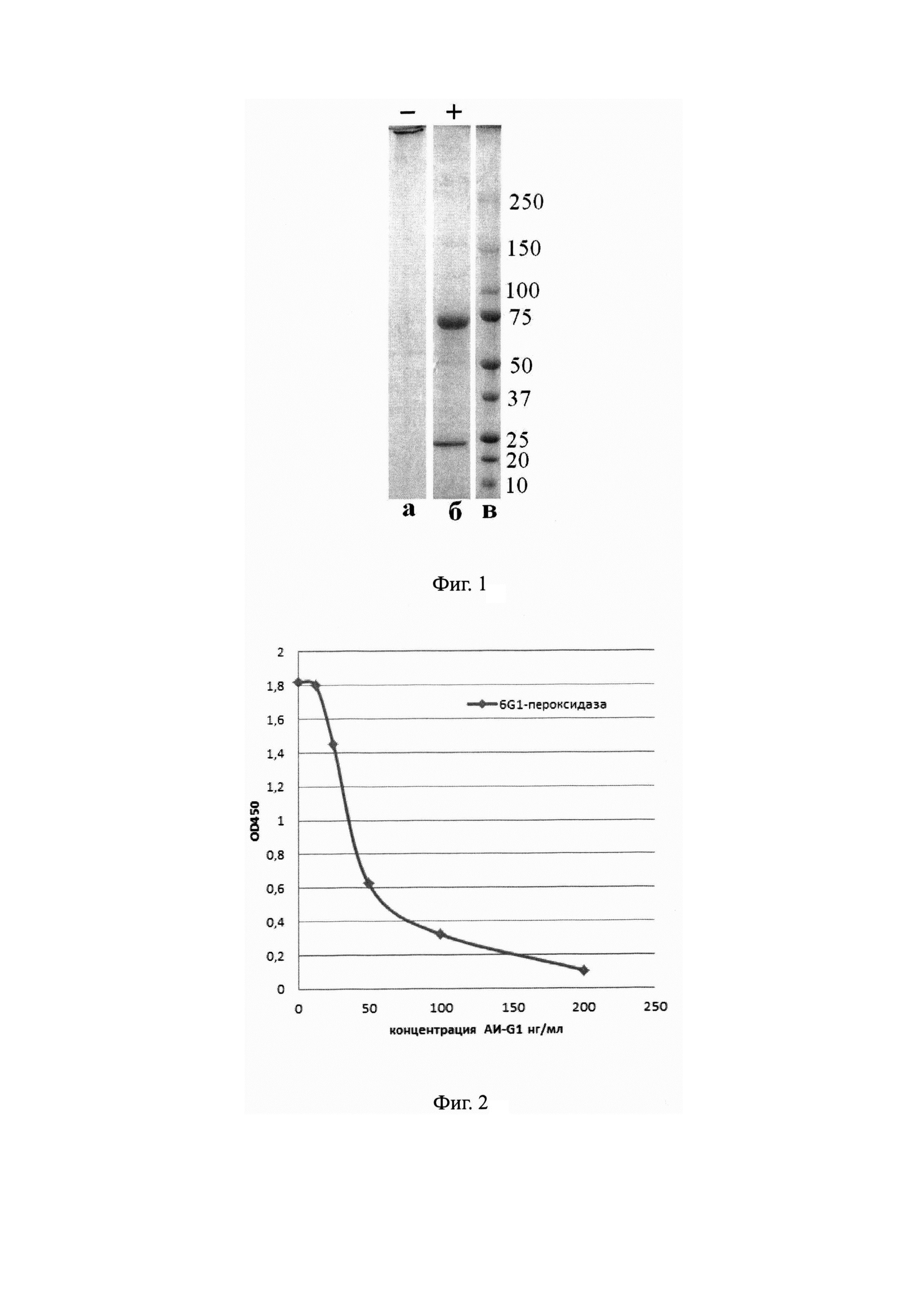
На Фиг. 1 показаны результаты электрофореза в 4-20% полиакриламидном геле мышиного моноклонального антитела АИ-G1;
а - невосстанавливающие условия;
б - восстанавливающие условия;
в - маркеры молекулярных весов (кД).
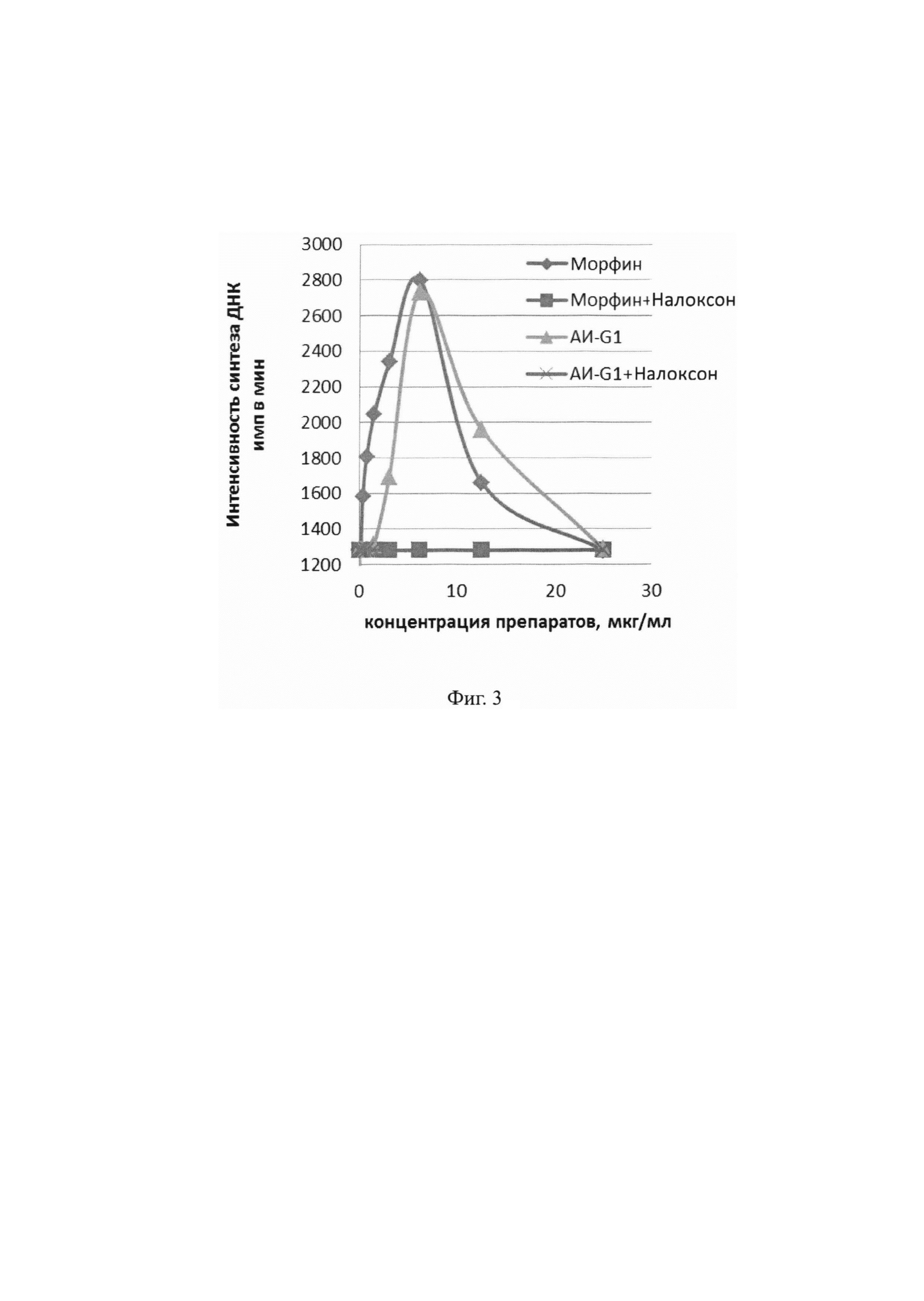
На Фиг. 2 представлена кривая конкурентного подавления антителами АИ-G1 связывания конъюгата мАт 6G1 - пероксидаза хрена с производным морфина ГСМ-БСА.
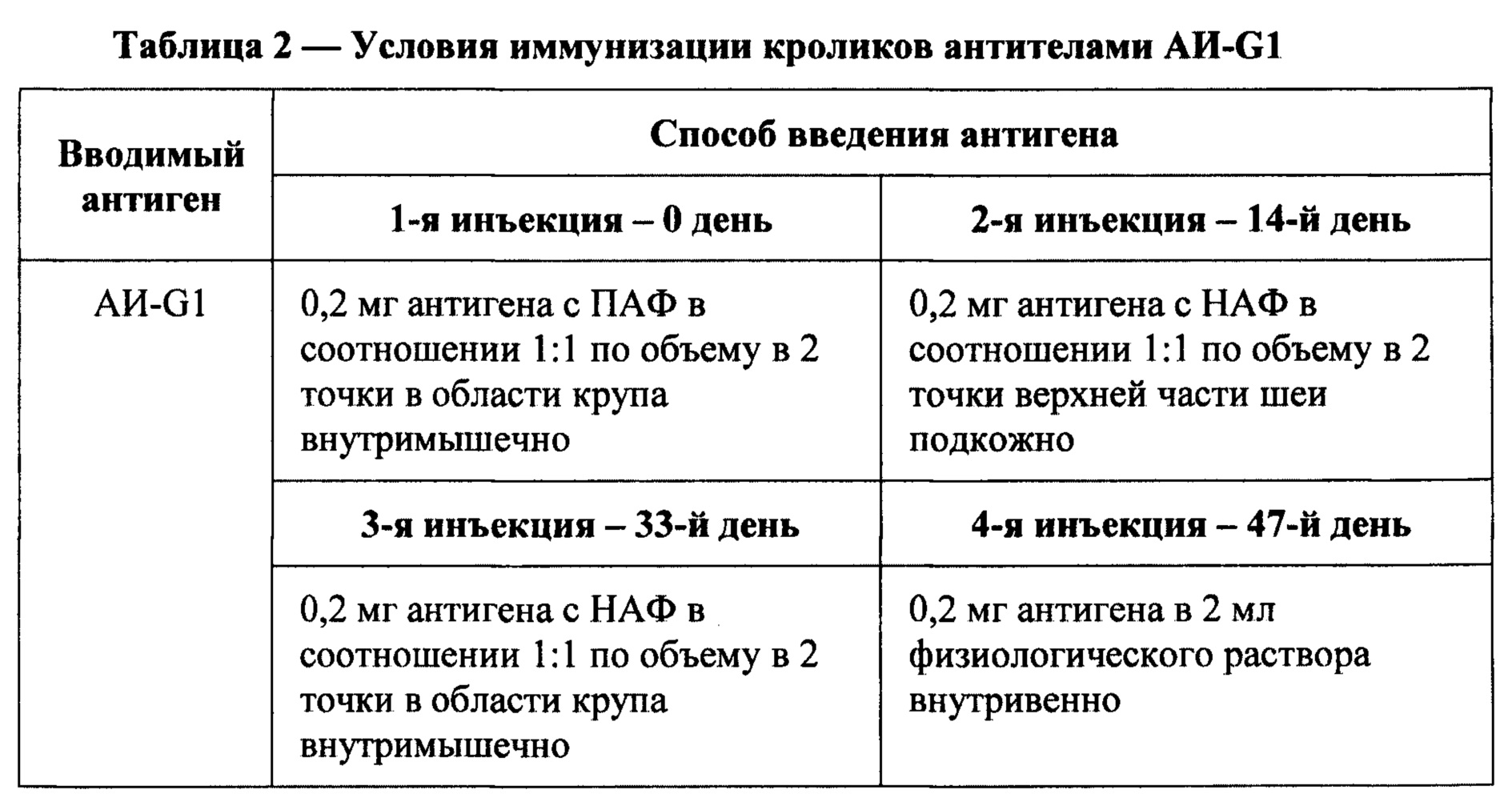
На Фиг. 3 демонстрируется влияние АИ-G1 и морфина на интенсивность синтеза ДНК (имп/мин), отражающую пролиферативную активность в культурах клеточной линии глиобластомы человека T98G в условиях свободного и сочетанного с налоксоном действия
Сущность и промышленная применимость изобретения поясняются следующими примерами:
Пример 1. Получение антигенов для иммунизации и скрининга гибридом, иммунизация мышей и отбор гибридомы АИ-G1.
Пример 1.1. Получение антигена. Для иммунизации использовали конъюгат гемоцианина лимфы улитки (KLH) с моноклональными антителами 6G1 (6G1-KLH), приготовленный по ранее описанной методике [Hermanson Greg Т., Bioconjugate Techniques. ISBN 0-12-342336-8, Academic Press Inc., 1996]. При постановке ИФА использовали антитела 6G1, коньюгированные с пероксидазой хрена по описанной методике [там же]. Приготовленные конъюгаты мАт 6G1 аликвотировали и хранили при -80°С.
Пример 1.2. Иммунизация мышей и скрининг гибридомы. Мышей линии Balb/c иммунизировали полученным как описано в примере 1.1. препаратом 6G1-KLH. Для этого эмульгированный в полном адъюванте Фрейнда (ПАФ) антиген в дозе 10 мкг на мышь вводили в подошвенный апоневроз задних конечностей. На 30-й день после иммунизации животным вводили внутривенно 5 мкг мАт 6G1 в физиологическом растворе. На 4-й день после инъекции животных умерщвляли цервикальной дислокацией и выделяли спленоциты и лимфоциты паховых и брюшных лимфоузлов. Полученные клетки смешивали с клетками миеломы мыши линии SP 2/0 в соотношении 2:1. Гибридизацию клеток проводили в 50% растворе полиэтиленгликоля (ПЭГ) с молекулярной массой 1500 Да в течение 1,5 мин с последующим 4-кратным добавлением через 1 мин среды RPMI-1640 в объеме, равном объему раствора ПЭГ. После слияния клетки дважды отмывали культуральной средой и высевали в 96-луночные культуральные планшеты с суточными перитонеальными макрофагами (5⋅103 клеток на лунку) из расчета 5⋅104 клеток миеломы на лунку. Селекцию гибридов проводили в среде RPMI-1640 с добавлением 10% фетальной бычьей сыворотки (Sigma, США), содержащей: 10-4 М гипоксантина, 4⋅10-7 М аминоптерина и 1,6⋅10-5 М тимидина [Pandey S. Hybridoma technology for production of monoclonal antibodies // Int. J. Pharm. Sci. Res., 2010; 1:88-94].
Скрининг антител проводили с помощью ИФА, используя в качестве антигена для адсорбции на твердой фазе мАт 6G1. Связавшиеся антитела затем выявляли конъюгатом 601-пероксидаза хрена (Sigma, США), приготовленным по протоколу производителя.
Первичный отбор позитивных клонов проводили по связыванию секретируемых антител с мАт 6G1, в качестве негативного контроля использовали мАт 3К11, связывающие КММ-БСА, и IgG-фракцию иммуноглобулинов мыши. Для этого в лунках полистирольных планшетов Corning (Sigma, США) в посадочном буфере (20 мМ боратный буфер, рН 8,0, содержащий 0,15 М NaCl) сорбировали одно из антител: мАт 6G1, 3К11 или IgG мыши с концентрацией 1,5 мкг/мл в течение 20 часов во влажной камере при комнатной температуре. По окончании сорбции планшеты отмывали промывочным буфером (посадочный буфер, содержащий 0,05% Tween-20). В лунки вносили 100 мкл промывочного буфера, содержащего 10% мышиной сыворотки и 50 мкл культуральной среды. Планшеты инкубировали 1 час при перемешивании при 37°С. Затем в промытую плату вносили раствор коньюгата 6G1-пероксидаза хрена в концентрации 100 нг/мл. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С, после чего тщательно отмывали и проводили окрашивание с помощью раствора субстрата тетраметилбензи-дина (ХЕМА, Россия).
Для подтверждения специфичности мАи антител из отобранных позитивных клонов к мАт 6G1 проводили конкурентный ИФА. В лунки полистирольных планшетов Corning (Costar) вносили 5 мкг/мл ГСМ-БСА в 20 мМ боратном буфере с рН 8,0, содержащем 0,15 М NaCl, и инкубировали в течение 20 часов во влажной камере. По окончании сорбции планшеты отмывали промывочным буфером (20 мМ боратный буфер с рН8,0, содержащий 0,15 М NaCl и 0,05% Tween-20). Предварительно мАи антитела в концентрации 12,5, 25, 50, 100 и 200 нг/мл инкубировали в течение 30 мин при комнатной температуре с коньюгатом 601-пероксидаза хрена в концентрации 200 нг/мл, а затем вносили в каждую лунку по 100 мкл полученных растворов. Результаты конкурентного анализа представлены на Фиг. 2.
На основе проведенного скрининга был отобран клон sАИ-G1, продуцирующий специфические антитела к мАт 6G1. Свойства моноклонального антитела АИ-G1 приведены в Таблице 1. Представлены данные по изотипу моноклонального антитела АИ-G1 и специфичности к IgG-мыши, мАт 6G1 и мАт 3К11.

В результате последующего культивирования, криоконсервирования и контроля чистоты клеток был получен штамм гибридомы sAM-G1, продуцент моноклонального антитела АИ-G1.
Пример 2. Исследование свойств моноклонального антитела АИ-G1.
Пример 2.1. Очистка мАт АИ-G1.
Антитело АИ-G1 выделяли из асцитной жидкости мышей линии Balb/c с внутрибрюшинно привитой гибридомой sAH-G1 методом гельпроникающей хроматографии на сорбенте HW-65S (TosoHaas, Japan) согласно инструкции.
Пример 2.2. Изучение молекулярных свойств антитела 6G1.
Обсчет, проведенный по результатам электрофореза в 4-20% полиакриламидном геле с додецилсульфатом натрия, показал, что молекулярная масса основной части препарата антител 6G1 в невосстанавливающих условиях составляет около 800 кДа, т.е. представлена пентамером иммуноглобулина класса IgM (Фиг. 1а), в то время как в восстанавливающих условиях антитело диссоциирует на тяжелую (70 кДа) и легкую (25 кДа) цепи (Фиг. 16). Изотип антитела АИ-G1, установленный с помощью набора «Моше monoclonal antibody isotyping reagents» (Sigma, США), - IgM. Препараты очищенного антитела АИ-G1 использовали для изучения его биологических свойств.
Пример 2.3. Исследование биологических свойств моноклонального антитела АИ-G1.
Пример 2.3.1. Изучение биологической активности моноклональных антител АИ-G1 проводили на модели пролиферативной реакции перевиваемой клеточной линии глиобластомы человека T98G in vitro. На поверхности клеток этой линии выявлено присутствие большого количества μ- и κ-опиоидных рецепторов и незначительного количества δ-опиоидных рецепторов [Lazarczyk М., Matyja Е., Lipkowski A.W. А comparative study of morphine stimulation and biphalin inhibition of human glioblastoma T98G cell proliferation in vitro // Peptides, 2010; 31:1606-1612].
На Фиг. 3 представлены данные по стимуляции морфином и АИ-G1 синтеза ДНК в культуре клеток. Показано нейтрализующее действие налоксона при совместном введении препаратов.
Как видно из полученных данных, мАт клона sAH-G1, как и морфин, обладает способностью усиливать синтез ДНК в культуре клеточной линии глиобластомы человека T98G. Этот эффект блокируется действием налоксона, который при совместном введении полностью устраняет стимулирующий эффект. Следует отметить, что блокада действия морфина налоксоном осуществляется на уровне опиоидных рецепторов, присутствующих на культивируемых клетках. Следовательно, мАт АИ-G1 способны также связываться с опиатными рецепторами.
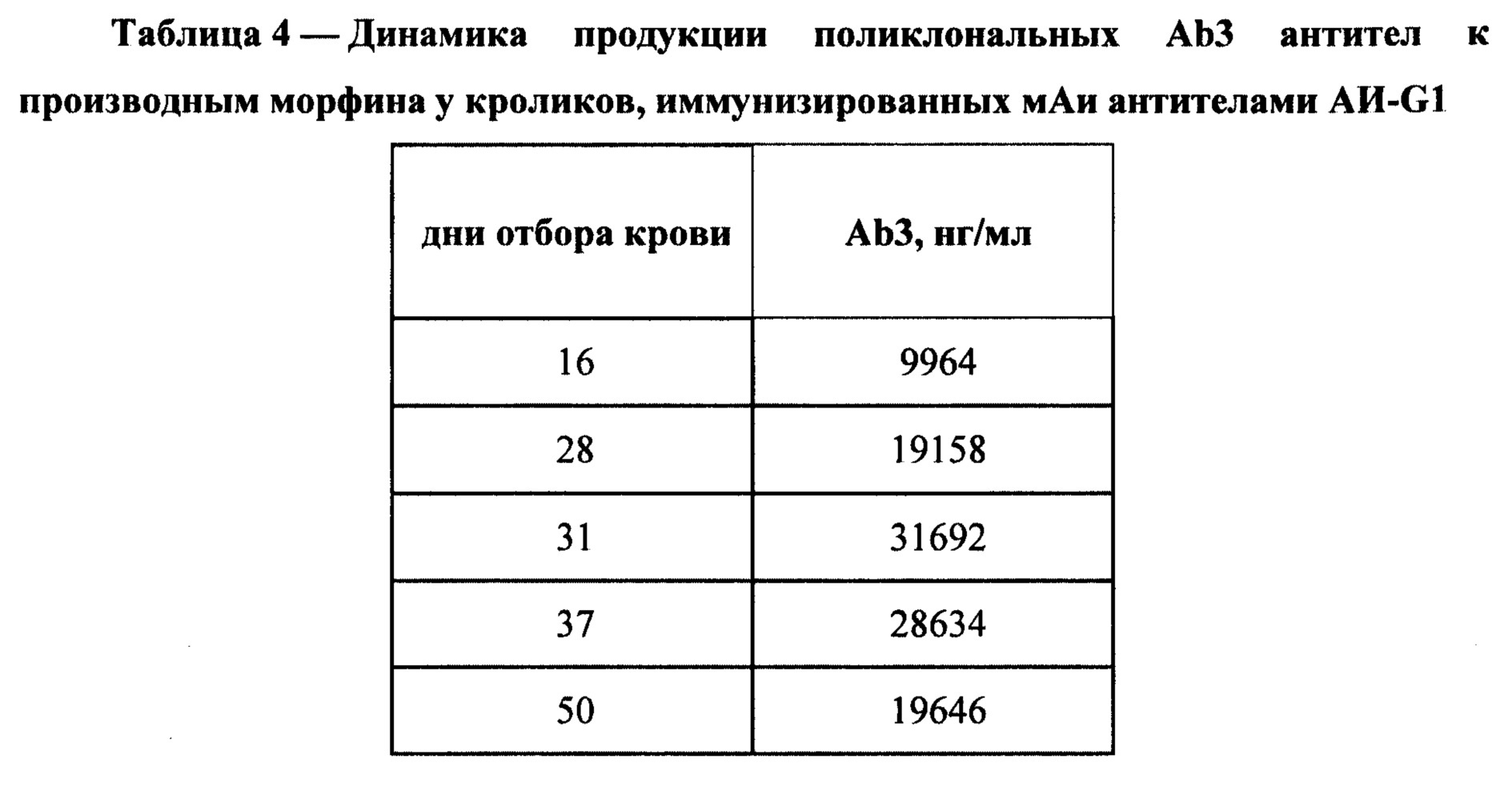
Пример 2.3.2. Изучение иммуногенных свойств мАи АИ-G1 на кроликах породы Советская шиншилла. В Таблице 2 схематично представлен способ иммунизации кролика мАи антителами АИ-G1 для получения Ab3 антител.
Определение специфичности Ab3 в сыворотке крови кроликов проводили методом ИФА. В качестве антигенов использовали: КММ-БСА, ФАМ-БСА, ГСМ-БСА, БСА как негативный контроль, которые иммобилизовали на дно лунок планшетов для ИФА путем инкубации 10 мкг/мл белка в 20 мМ боратном буфере, рН8,0, содержащем 0,15 М NaCl (посадочный буфер), в течение 20 часов при комнатной температуре. По окончании сорбции планшеты отмывали промывочным буфером (посадочный буфер, содержащий 0,05% Tween-20) и в лунки вносили по 100 мкл тестируемых Ab3 антител кролика. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С. Затем в трижды промытый планшет вносили растворы конъюгата пероксидазы хрена с антивидовыми антителами козы против иммуноглобулинов кролика или мыши (Sigma, США) с концентрацией 0,5 мкг/мл. Планшеты инкубировали в течение 1 часа при перемешивании при 37°С, после чего тщательно отмывали и проводили окрашивание с помощью раствора субстрата тетраметилбензидина (ХЕМА, Россия).
Установлено, что Ab3 антитела кролика, вакцинированного мАи антителом АИ-G1, специфичны ко всем тестируемым производным морфина (Таблица 3)

Для определения временной динамики образования антител кровь из ушной вены кроликов отбирали на 16, 28, 31, 37 и 50 дни после последней иммунизации. Уровень антител Ab3 в сыворотке крови кроликов определяли методом ИФА. В этом варианте анализа на дне лунок планшетов для ИФА иммобилизовали смесь конъюгатов КММ-БСА, ФАМ-БСА и ГСМ-БСА путем инкубации раствора, содержащего в посадочном буфере по 5 мкг/мл каждого конъюгата в течение 20 часов. По окончании сорбции антигена планшеты отмывали промывочным буфером и в лунки вносили по 100 мкл тестируемых сывороток кролика, которые предварительно готовили в виде десятикратных серийных разведений. В качестве стандарта для определения концентрации специфических антител в сыворотках иммунных животных использовали выделенные с помощью иммуноаффинной хроматографии антитела Ab1 кролика, иммунизированного конъюгатами КММ-БСА и ГСМ-БСА. Все дальнейшие стадии анализа совпадали с завершающими стадиями при определении специфичности антител. По калибровочной кривой зависимости интенсивности OD450 от концентрации антител с учетом разведения определяли содержание Ab3 в сыворотке. Результаты динамики продукции Ab3 у кроликов, иммунизированных АИ-G1, представлены в Таблице 4.
Пример 3. Синтез и секвенирование ДНК, кодирующей вариабельные части легкой и тяжелой цепей моноклонального антитела АИ-G1.
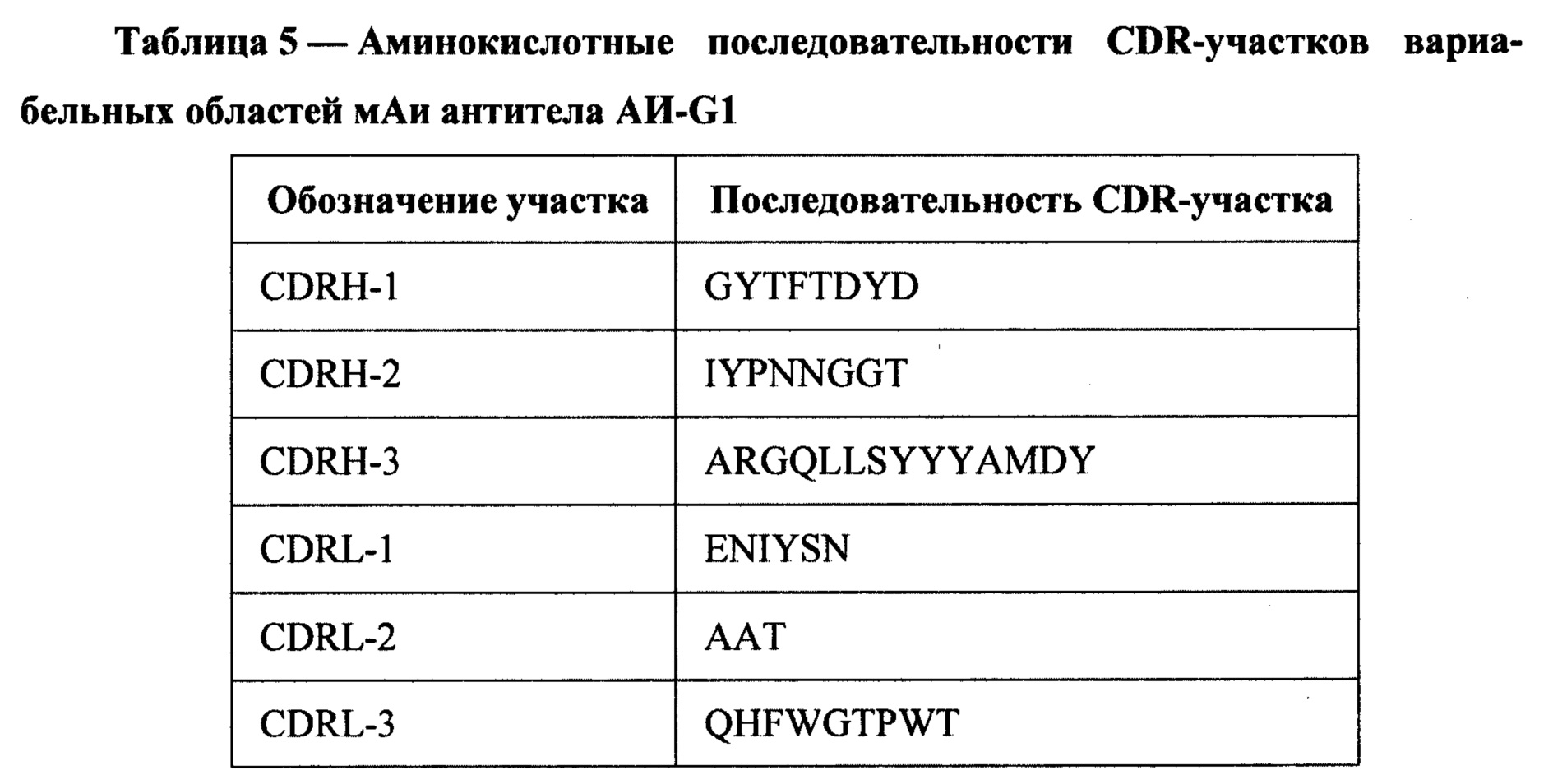
Из клеток гибридомы sAH-G1 выделяли РНК, на матрице которой с помощью наборов синтетических праймеров (Immunogenetics Information System http://www.imgt.org) были амплифицированы фрагменты ДНК, кодирующие вариабельные области тяжелой (VH) и легкой (VL) цепей антитела. Полученные фрагменты ДНК были клонированы в вектор pAL-ТА (Евроген) и секвенированы с использованием внешних праймеров (М13). Последовательности фрагментов ДНК, кодирующих VH и VL, представлены на SEQ ID NO: 1 и SEQ ID NO: 2, вычисленные аминокислотные последовательности VH и VL представлены на SEQ ID NO: 3 и SEQ ID NO: 4. Анализ последовательностей аминокислот вариабельных областей тяжелой и легкой цепей моноклонального антитела 6G1 производили по Кэботу (Kabat Е.А., Wu Т.Т., Perry Н., Gottesman K. and Foeller С. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition. NIH Publication №91:3242), что позволило выделить участки CDR, определяющие комплементарность антитела антигену (Таблица 5).
Моноклональное антитело АИ-G1 по настоящему изобретению может служить основой для создания химерных и гуманизированных антител, пригодных для создания вакцины и лекарственных препаратов, блокирующих биологическую активность морфина.
Заявители просят рассмотреть представленные материалы заявки «Моноклональное антиидиотипическое антитело АИ-G1, обладающее антигенными свойствами морфина» на предмет выдачи патента РФ на изобретение.
--->
Перечень последовательностей
<110> Федеральное государственное унитарное предприятие «Государственный научно-исследовательский институт особо чистых биопрепаратов» Федерального медико-биологического агентства
Federal State Unitary Enterprise «State Research Institute of Highly Pure Biopreparations» of the Federal Medical and Biological Agency
Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр психиатрии и наркологии имени В.П. Сербского» Министерства здравоохранения Российской Федерации
Federal State Budgetary Institution «V. Serbsky National Medical Research Centre for Psychiatry and Narcology» of the Ministry of Health of the Russian Federation
<120> Моноклональное антиидиотипическое антитело АИ-G1, обладающее антигенными свойствами морфина
<130>
<160> 10
<210> 1
<211> 363
<212> ДНК
<213> Mus musculus
<220>
<222> (1)…(363)
<223> Последовательность нуклеотидов, кодирующая вариабельную область тяжелой цепи моноклонального антитела АИ-G1
<400> 1
GAG GTC CAG CTG CAA CAG TCT GGA CCT GAC CTG GTG AAG CCT GGG GCT 48
Glu Val Gln Leu Gln Gln Ser Gly Pro Asp Leu Val Lys Pro Gly Ala
1 5 10 15
TCA GTG AAG ATA TCC TGC AAG GCT TCT GGA TAC ACA TTC ACT GAC TAC 96
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
GAC ATG AAC TGG GTG AAG CAG AGC CAT GGA AAG AGC CTT GAG TGG ATT 144
Asp Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
GGA TAT ATT TAT CCT AAC AAT GGT GGT ACT AGC TAC AAC CAG AAG TTC 192
Gly Tyr Ile Tyr Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
AAG GGC AAG GCC ACA TTG ACT GTA GAC AAG TCC TCC AGC ACA GCC TAC 240
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
ATG GAG CTC CGC AGC CTG ACA TCT GAG GAT TCT GCA GTC TAT TAC TGT 288
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
GCA AGA GGG CAG TTA CTA TCC TAT TAC TAT GCT ATG GAC TAC TGG GGT 336
Ala Arg Gly Gln Leu Leu Ser Tyr Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
CAA GGA ACC TCA GTC ACC GTC TCC TCA 363
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 121
<210> 2
<211> 321
<212> ДНК
<213> Mus musculus
<220>
<222> (1)…(321)
<223> Последовательность нуклеотидов, кодирующая вариабельную область легкой цепи антитела АИ-G1
<400> 2
GAC ATC CAG ATG ACT CAG TCT CCA GCC TCC CTA TCT GTA TCT GTG GGA 48
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
GAA ACT GTC ACC ATC ACA TGT CGA GCA AGT GAG AAT ATT TAC AGT AAT 96
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Asn
20 25 30
TTA GCA TGG TAT CAG CAG AAA CAG GGA AAA TCT CCT CAG CTC CTG GTC 144
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
TAT GCT GCA ACA AAC TTA GCA GAT GGT GTG CCA TCA AGG TTC AGT GGC 192
Tyr Ala Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
AGT GGA TCA GGC ACA CAG TAT TCC CTC AAG ATC AAC AGC CTG CAG TCT 240
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
GAA GAT TTT GGG AGT TAT TAC TGT CAA CAT TTT TGG GGT ACT CCG TGG 288
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His Phe Trp Gly Thr Pro Trp
85 90 95
ACG TTC GGT GGA GGC ACC AAG CTG GAA ATC AAA 321
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 107
<210> 3
<211> 121
<212> белок
<213> Mus musculus
<220>
<222> (1)…(121)
<223> Последовательность аминокислот вариабельной области тяжелой цепи моноклонального антитела АИ-G1
<400> 3
Glu Val Gln Leu Gln Gln Ser Gly Pro Asp Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Asp Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Tyr Pro Asn Asn Gly Gly Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gln Leu Leu Ser Tyr Tyr Tyr Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 121
<210> 4
<211> 107
<212> белок
<213> Mus musculus
<220>
<222> (1)…(107)
<223> Последовательность аминокислот вариабельной области лёгкой цепи моноклонального антитела АИ-G1
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Glu Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro Gln Leu Leu Val
35 40 45
Tyr Ala Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Tyr Ser Leu Lys Ile Asn Ser Leu Gln Ser
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His Phe Trp Gly Thr Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 107
<210> 5
<211> 8
<212> белок
<213> Mus musculus
<220>
<222> (1)…(8)
<223> Последовательность аминокислот участка CDRH-1 моноклонального антитела АИ-G1
<400> 5
Gly Tyr Thr Phe Thr Asp Tyr Asp
1 5 8
<210> 6
<211> 8
<212> белок
<213> Mus musculus
<220>
<222> (1)…(8)
<223> Последовательность аминокислот участка CDRH-2 моноклонального антитела АИ-G1
<400> 6
Ile Tyr Pro Asn Asn Gly Gly Thr
1 5 8
<210> 7
<211> 14
<212> белок
<213> Mus musculus
<220>
<222> (1)…(14)
<223> Последовательность аминокислот участка CDRH-3 моноклонального антитела АИ-G1
<400> 7
Ala Arg Gly Gln Leu Leu Ser Tyr Tyr Tyr Ala Met Asp Tyr
1 5 10 14
<210> 8
<211> 6
<212> белок
<213> Mus musculus
<220>
<222> (1)…(6)
<223> Последовательность аминокислот участка CDRL-1 моноклонального антитела АИ-G1
<400> 8
Glu Asn Ile Tyr Ser Asn
1 5 6
<210> 9
<211> 3
<212> белок
<213> Mus musculus
<220>
<222> (1)…(3)
<223> Последовательность аминокислот участка CDRL-2 моноклонального антитела АИ-G1
<400> 9
Ala Ala Thr
1 3
<210> 10
<211> 9
<212> белок
<213> Mus musculus
<220>
<222> (1)…(9)
<223> Последовательность аминокислот участка CDRL-3 моноклонального антитела АИ-G1
<400> 10
Gln His Phe Trp Gly Thr Pro Trp Thr
1 5 9
<---