Результат интеллектуальной деятельности: СПОСОБ ОБНАРУЖЕНИЯ ПРОСТРАНСТВЕННОЙ БЛИЗОСТИ ПЕРВОГО И ВТОРОГО ЭПИТОПОВ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Представленное изобретение относится к способу обнаружения пространственной близости первого и второго эпитопов белка или первого и второго белков белкового комплекса в образце больного. Представленное изобретение дополнительно относится к способу стратификации больного, страдающего от заболевания, для оценки пригодности лечения и/или для прогноза исхода заболевания больного и/или для прогнозирования и/или обнаружения невосприимчивости к лечению больного, страдающего от заболевания, по отношению к терапии. Кроме того, представленное изобретение относится к новому набору и соответствующим вариантам его применения.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Способ близкого лигирования (PLA) представляет собой способ, который способен сообщать о совместной локализации двух белков (см. Weibrecht I. et al., «Proximity ligation assays: A recent addition to the proteomics toolbox», Expert Review of Proteomics, Vol. 7, No. 3, 2010, pages 401 to 409). В способе используется два антитела, каждое из которых мечено олигонуклеотидом с одноцепочечной ДНК. Необходимо, чтобы оба олигонуклеотида образовали замкнутое кольцо из двух вторичных ДНК-олигонуклеотидов, которые добавляют к образцу после связывания антител с их эпитопами. После образования кольца используют амплификацию по типу катящегося кольца (RCA) для создания сотен копий кольцевой матрицы. В заключение, комплементарные зонды, меченные флуорофором, соединяют комплементарные нити ДНК с продуктом RCA, давая яркое пятно в месте, где совместно локализованы два белка.
Стандартный протокол PLA (даже с меченными первичными антителами) полностью занимает приблизительно 6,5 часов. Самая длинная стадия, на которой происходит RCA, занимает приблизительно 1 час и 40 минут и требует фермента. Помимо длительного времени, которое занимает данная реакция, применение фермента затрудняет интеграцию всего анализа в устройство, главным образом потому, что стабильное хранение чувствительных ферментов обычно является проблемой. Вследствие этого было бы желательно иметь технологию определения пространственной близости или совместной локализации двух белков посредством окрашивания in-situ тканей и/или клеток (клеточных агломератов) и/или текучей среды организма пациента, которое либо не требует применения фермента, либо которое, по меньшей мере, не требует сложных ферментативных реакций, таких как амплификация последовательности и тому подобное.
WO 2005/059509 A3 раскрывает композиции и способы, которые являются пригодными для идентификации и количественной оценки любого полипептида или макромолекулярного комплекса с использованием набора коаптамерных конструкций. Аптамерные конструкции построены так, что связываются с уникальными эпитопами полипептида макромолекулярной конструкции. Данные аптамерные конструкции заключают в себе участок связывания эпитопов, участок связывания коаптамеров и детектируемую метку. В присутствии когнатного полипептида, комплекса анализируемое вещество-полипептид или другого макромолекулярного комплекса коаптамеры связываются друг с другом с получением детектируемого сигнала. Коаптамерные конструкции могут быть соединены посредством линкера с получением бивалентной аптамерной конструкции.
WO 2012/152942 A1 относится к анализу обнаружения на основе бесконтактного зонда для обнаружения анализируемого вещества в образце и, в частности, к способу, который включает использование по меньшей мере одного набора, по меньшей мере, первого и второго бесконтактных зондов, при этом каждый зонд содержит домен связывания анализируемого вещества и нуклеиновокислотный домен и может одновременно связываться с анализируемым веществом непосредственно или опосредованно, при этом нуклеиновокислотный домен по меньшей мере одного из указанных бесконтактных зондов содержит шпилькообразную структуру, которая может быть развернута посредством расщепления нуклеиновокислотного домена с созданием по меньшей мере одного лигатируемого свободного конца или области комплементарности с молекулой другой нуклеиновой кислоты в указанном образце, при этом когда зонды связываются с указанным анализируемым веществом разворачивание указанной шпилькообразной структуры делает возможным непосредственное или опосредованное взаимодействие нуклеиновокислотных доменов указанных по меньшей мере первого и второго бесконтактных зондов.
WO 2010/006291 A1 предоставляет подход для определения состояний активации множества белков в отдельных клетках. Данный подход позволяет быстро обнаруживать гетерогенность в комплексе популяции клеток на основе состояний активации, маркеров экспрессии и других критериев и идентифицировать клеточные подмножества, которые демонстрируют коррелированные изменения активации в популяции клеток. Более того, данный подход делает возможной корреляцию клеточной активности или свойств. В дополнение, применение модуляторов клеточной активации позволяет характеризовать метаболические пути и популяции клеток. Некоторые иллюстративные заболевания, которые можно проанализировать посредством подхода, включают AML, MDS и MPN.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предоставление способа обнаружения пространственной близости первого и второго эпитопов белка или первого и второго белков белкового комплекса в образце больного, при этом способ решает, или по меньшей мере уменьшает упомянутую выше проблему PLA.
Изобретение предоставляет способ обнаружения пространственной близости первого и второго эпитопов белка или первого и второго белков белкового комплекса в образце больного, при этом способ включает:
- связывание первого связывающего элемента, имеющего первый олигонуклеотид, конъюгированный с ним, с первым эпитопом,
- связывание второго связывающего элемента, имеющего второй олигонуклеотид, конъюгированный с ним, со вторым эпитопом, и
- определение, присутствует ли между донорным флуорофором и акцепторным флуорофором, которые связаны с первым олигонуклеотидом и вторым олигонуклеотидом, эффект резонансного переноса энергии флуоресценции (FRET), при этом наличие эффекта FRET указывает на пространственную близость первого и второго олигонуклеотидов и, таким образом, пространственную близость первого и второго эпитопов,
при этом первый олигонуклеотид по меньшей мере частично комплементарен второму олигонуклеотиду,
при этом первый олигонуклеотид изначально снабжен первым отдельным защитным элементом, и/или второй олигонуклеотид изначально снабжен вторым отдельным защитным элементом для предотвращения преждевременной гибридизации первого и второго олигонуклеотидов.
Поскольку первый связывающий элемент, имеющий первый олигонуклеотид, присоединенный к нему, связан с первым эпитопом, а второй связывающий элемент, имеющий второй олигонуклеотид, присоединенный к нему, связан со вторым эпитопом, посредством определения, присутствует ли между донорным флуорофором и акцепторным флуорофором эффект FRET, причем наличие эффекта FRET указывает на пространственную близость первого и второго олигонуклеотидов, в образце больного можно определить пространственную близость первого и второго эпитопов белка или первого и второго белков белкового комплекса. По сравнению со стандартным протоколом PLA, варианты осуществления представленного изобретения могут быть выполнены за более короткое время. Более того, варианты осуществления представленного изобретения не требуют использования фермента либо, по меньшей мере, не требуют сложных ферментативных реакций, таких как амплификация последовательности и тому подобное.
Поскольку первый олигонуклеотид по меньшей мере частично комплементарен второму олигонуклеотиду, находясь в пространственной близости, первый и второй олигонуклеотиды будут гибридизироваться, посредством чего донорный флуорофор и акцепторный флуорофор могут быть приведены на такое подходящее расстояние друг от друга, чтобы эффект FRET происходил между донорным флуорофором и акцепторным флуорофором с большей вероятностью. Длина комплементарных сегментов предпочтительно должна составлять более чем 10 нуклеотидов. Более того, многочисленные комплементарные сегменты могут присутствовать в олигонуклеотидах с некомплементарными сегментами в промежутках. Последние могут иметь разную длину для первого и второго олигонуклеотидов.
Поскольку первый олигонуклеотид изначально снабжен первым отдельным защитным элементом, и/или второй олигонуклеотид изначально снабжен вторым отдельным защитным элементом для предотвращения преждевременной гибридизации первого и второго олигонуклеотидов, возможно предотвратить, чтобы первый и второй олигонуклеотиды были уже гибридизированы перед тем, как первый и второй связывающие элементы свяжутся с первым и вторым эпитопом. К тому же можно уменьшить или избежать ошибок обнаружения, которые могут быть вызваны, например, когда первый и второй олигонуклеотиды будут гибридизироваться до связывания - делая возможным появление эффекта FRET между донорным флуорофором и акцепторным флуорофором - и затем один из первого и второго связывающих элементов будет связываться с соответствующим эпитопом одного белка (либо белка, который не демонстрирует другой эпитоп. Более того, поскольку защитный элемент (элементы) представляет/представляют собой (a) отдельный защитный элемент (элементы), т.е., то есть до того, как он/они предоставляются соответствующему олигонуклеотиду (олигонуклеотидам), он/они находятся в форме (а) молекулы (молекул), которая/которые отделены от соответствующего олигонуклеотида (олигонуклеотидов), при этом, предпочтительно, его/их выбирают из молекул, которые по меньшей мере частично комплементарны соответствующему олигонуклеотиду (олигонуклеотидам) и гибридизированы с ними, функция защиты - а также функция снятия защиты, как описано дополнительно ниже - может быть обеспечена с высокой надежностью.
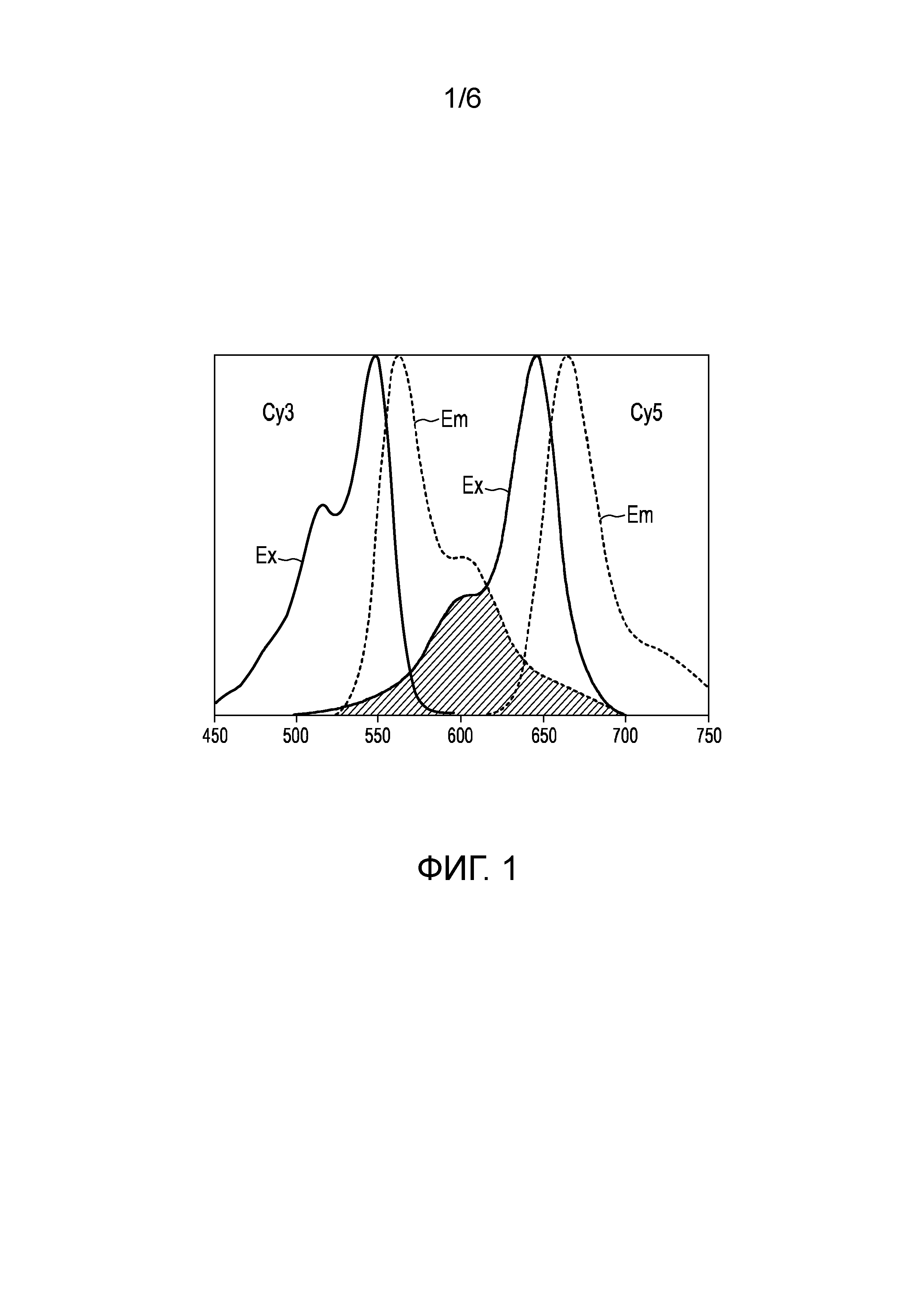
Резонансный перенос энергии флуоресценции (FRET) -также называемый резонансный перенос энергии Форстера по имени немецкого ученого Теодора Форстера - представляет собой механизм, описывающий передачу энергии между двумя флуорофорами, то есть флуоресцентными химическими соединениями, которые могут повторно излучать свет при световом возбуждении. Донорный флуорофор, первоначально в своем электронно-возбужденном состоянии, может передавать энергию акцепторному флуорофору через нерадиативную диполь-дипольную связь. Эффективность переноса данной энергии обратно пропорциональна шестой степени расстояния между донорным и акцепторным флуорофором, что делает FRET чрезвычайно чувствительным к малым расстояниям. Чтобы обеспечить эффект FRET, часть спектра излучения донорного флуорофора должна перекрывать спектр возбуждения акцепторного флуорофора, как это показано на рис. 1, который схематически и наглядно показывает спектры Су3 и Су5. Как видно из рисунка, спектр возбуждения Су3 (сплошная кривая Ех на левой стороне) имеет максимум возбуждения при длине волны 548 нм, а его спектр излучения (пунктирная кривая Ем на левой стороне) сдвигается на более высокие длины волн с максимумом излучения при длине волны 562 нм. Напротив, спектр возбуждения Cy5 (сплошная кривая Ex с правой стороны) имеет максимум возбуждения при длине волны 646 нм, и его спектр излучения (пунктирная кривая Em справа) смещается в область более высоких длин волн с максимумом излучения при длине волны 664 нм. Заштрихованная область ниже спектра излучения Су3 и спектра возбуждения Су5 указывает область перекрытия, требуемую для обеспечения эффекта FRET.
FRET используется в молекулярной биологии (иногда с использованием генетически кодируемых флуоресцентных белков), чтобы исследовать пространственную близость между двумя объектами, например, для изучения дыхания нуклеосом (см. Koopmans W.J. et al., «Engineering mononucleosomes for single-pair FRET experiments» Methods in Molecular Biology, Vol. 739, 2011, pages 291 to 303). Фактически, FRET представляет собой предпочтительный способ исследования (биологических) взаимодействий в масштабе от 1 до 10 нм. К числу популярных FRET донорно-акцепторных пар флуорофоров относятся: флуоресцеин изотиоцианат (FITC)-тетраметилтридамин (TRITC), Cy3-Cy5, усиленный зеленый флуоресцентный белок (EGFP)-Cy3, голубой флуоресцентный белок (CFP)-желтый флуоресцентный белок (YFP) и EGFP-YFP.
Наличие эффекта FRET можно определить путем спектрального анализа излучения флуоресценции пространственно разрешенным образом. Красители донорного флуорофора и акцепторного флуорофора выбраны так, чтобы донорный флуорофор мог быть возбужден без возбуждения акцепторного флуорофора при отсутствии эффекта FRET. Посредством возбуждения донорного флуорофора и измерения флуоресцентного излучения акцепторного флуорофора детектируемый сигнал в канале излучения акцепторного флуорофора указывает на наличие эффекта FRET. Известно, что эффективность FRET масштабируется с молекулярным расстоянием, что выражается в следующем уравнении:
|
где E обозначает эффективность FRET, r обозначает молекулярное расстояние, а R0 обозначает радиус Форстера, то есть параметр, который зависит от спектрального перекрытия донорного флуорофора и акцепторного флуорофора. Обычно это определяется как отношение интенсивностей излучения донорного флуорофора и акцепторного флуорофора - чем ближе молекулы, тем меньше наблюдается излучение от донорного флуорофора и тем больше излучение от акцепторного флуорофора.
Для обнаружения взаимодействия белков в ткани или в клетках могут быть получены флуоресцентные изображения с возбуждением в полосе возбуждения (поглощения) донорного флуорофора и обнаружение в полосе излучения акцепторного флуорофора. Для проверки эффективности FRET его можно сравнить с изображением, которое получается при возбуждении в полосе возбуждения (поглощения) акцепторного флуорофора.
Образец больного может представлять собой экстрагированный образец, то есть образец, который был экстрагирован у больного. Термин «больной», как используется в данном документе, относится любому живому существу. В некоторых вариантах осуществления больным является растение. В некоторых вариантах осуществления больным является животное, предпочтительно млекопитающее. В определенных вариантах осуществления термин «больной» относится к человеку, предпочтительно являющемуся пациентом.
Примеры образца включают, без ограничения, ткань, клетки, кровь и/или текучую среду организма больного.
В варианте осуществления первый и второй эпитопы представляют собой два, но одинаковых эпитопа. В другом варианте осуществления первый и второй эпитопы отличаются друг от друга.
Первый и второй связывающий элемент могут представлять собой первое и второе антитела, предпочтительно, первое и второе моноклональное антитело. В качестве альтернативы, однако, они также могут представлять собой, например, фрагмент первого и второго антитела, такого как антитело верблюда, аптамер или олигопептид. В более общем смысле, первый и второй связывающие элементы могут представлять собой любые виды элементов или структур, которые способны связываться, соответственно, с первым и вторым эпитопами и с которыми могут быть конъюгированы первый и второй олигонуклеотиды. В варианте осуществления первый и второй связывающие элементы являются одинаковыми. В другом варианте осуществления первый и второй связывающий элемент отличаются друг от друга.
Пригодная длина первого и второго олигонуклеотидов составляет от 20 до 1000 пар оснований, предпочтительно, от 30 до 600 пар оснований.
В варианте осуществления первый и второй олигонуклеотиды являются одинаковыми. В другом варианте осуществления первый и второй олигонуклеотиды отличаются друг от друга.
Следует заметить, что, хотя связывание первого и второго связывающих элементов определяют в две стадии, это не означает, что данные две стадии не могут быть выполнены в другом порядке или, предпочтительно, по существу одновременно.
Перед определением, присутствует ли эффект FRET между донорным флуорофором и акцепторным флуорофором, донорный флуорофор и акцепторный флуорофор ассоциировали с первым олигонуклеотидом и вторым олигонуклеотидом.
В некоторых вариантах осуществления флуорофоры могут быть прикреплены к олигонуклеотидам. Например, олигонуклеотиды могут быть предварительно меченными флуорофорами, т.е. олигонуклеотиды является меченным флуорофорами уже перед связыванием связывающих элементов, предпочтительно, перед тем, как в образец больного добавляют связывающие элементы, имеющие олигонуклеотиды, конъюгированные с ними. В варианте осуществления первый олигонуклеотид является предварительно меченным донорным флуорофором, и/или второй олигонуклеотид является предварительно меченным акцепторным флуорофором. Дополнительно или в качестве альтернативы, способ дополнительно включает после связывания первого связывающего элемента прикрепление донорного флуорофора к первому олигонуклеотиду, и/или после связывания второго связывающего элемента прикрепление акцепторного флуорофора ко второму олигонуклеотиду.
Поскольку первый олигонуклеотид является предварительно меченным донорным флуорофором, и/или поскольку второй олигонуклеотид является предварительно меченным акцепторным флуорофором, и/или поскольку способ дополнительно включает прикрепление донорного флуорофора к первому олигонуклеотиду после связывания первого связывающего элемента, и/или прикрепление акцепторного флуорофора ко второму олигонуклеотиду после связывания второго связывающего элемента, донорный флуорофор и акцепторный флуорофор могут быть приведены на такое подходящее расстояние друг от друга, чтобы эффект FRET происходил между донорным флуорофором и акцепторным флуорофором с большей вероятностью.
Следует заметить, что при том, что прикрепление донорного флуорофора и акцепторного флуорофора к первому и второму олигонуклеотиду после связывания первого и второго связывающих элементов определяется выше в две стадии, это не означает, что данные две стадии не могут быть выполнены в другом порядке или, предпочтительно, по существу одновременно.
Это обеспечивает возможность предотвращения гибридизации первого и второго олигонуклеотидов уже перед связыванием первого и второго связывающих элементов с первым и вторым эпитопом. К тому же можно уменьшить или избежать ошибки обнаружения, которые могут быть вызваны, например, когда первый и второй олигонуклеотиды будут гибридизироваться до связывания - делая возможным появление эффекта FRET между донорным флуорофором и акцепторным флуорофором - и затем один из первого и второго связывающих элементов будет связываться с соответствующим эпитопом одного белка (либо белка, который не демонстрирует другой эпитоп.
Предпочтительно, способ дополнительно включает:
- удаление первого отдельного защитного элемента из первого олигонуклеотида после связывания первого связывающего элемента, и/или
- удаление второго отдельного защитного элемента из второго олигонуклеотида после связывания второго связывающего элемента.
Следует заметить, что при том, что удаление первого и/или второго отдельных защитных элементов из первого и второго олигонуклеотидов после связывания первого и второго связывающих элементов определяется выше в две стадии, это не означает, что данные две стадии не могут быть выполнены в другом порядке или, предпочтительно, по существу одновременно. В частности, является предпочтительным, чтобы первый и/или второй отдельные защитные элементы удалялись только после того, как и первый, и второй связывающие элементы были связаны со своими соответствующими эпитопами.
Первый отдельный защитный элемент предпочтительно содержит нить первой ДНК или РНК, которая по меньшей мере частично комплементарна первому олигонуклеотиду и гибридизирована с ним, и/или второй отдельный защитный элемент предпочтительно содержит нить второй ДНК или РНК, которая по меньшей мере частично комплементарна второму олигонуклеотиду и гибридизирована с ним.
Является предпочтительным, чтобы удаление первой нити ДНК или РНК и/или второй нити ДНК или РНК включало плавление продукта гибридизации первого олигонуклеотида и первой нити ДНК или РНК и/или продукта гибридизации второго олигонуклеотида и второй нити ДНК или РНК.
Например, в одном примере температуру образца соответствующим образом увеличивают с целью достижения желаемого плавления продукта гибридизации. В еще одном примере изменяют растворитель образца с целью произвести плавление. После плавления немеченные первую и вторую нити ДНК, предпочтительно, отмывают на подходящей дополнительной стадии промывания, приводя, по существу, только к специфически связанным первому и второму связывающим элементам, имеющим первый и второй олигонуклеотид, присоединенный к нему, остающийся в образце.
В предпочтительном варианте нить первой ДНК или РНК представляет собой нить первой РНК, и/или нить второй ДНК или РНК представляет собой нить второй РНК, при этом удаление первой нити РНК и/или второй нити РНК включает применение фермента.
Фермент может представлять собой, например, РНКазу H, которая переваривает РНК. Данный вариант имеет преимущество в том, что весь процесс становится изотермическим; с другой стороны, однако, он требует применения фермента.
В другом варианте осуществления способ предпочтительно включает:
- после связывания первого связывающего элемента, предоставление третьего олигонуклеотида, предварительно меченного донорным флуорофором, при этом третий олигонуклеотид по меньшей мере частично комплементарен первому олигонуклеотиду, и прикрепление донорного флуорофора к первому олигонуклеотиду включает гибридизацию с ним третьего олигонуклеотида, и/или
- после связывания второго связывающего элемента, предоставление четвертого олигонуклеотида, предварительно меченного акцепторным флуорофором, при этом четвертый олигонуклеотид по меньшей мере частично комплементарен второму олигонуклеотиду, и прикрепление акцепторного флуорофора ко второму олигонуклеотиду включает гибридизацию с ним четвертого олигонуклеотида.
В данном документе является предпочтительным, чтобы первый и второй олигонуклеотиды являлись частично комплементарными с целью достижения желаемой пространственной близости. Тогда третий и четвертый олигонуклеотиды предпочтительно гибридизируются с первым и вторым олигонуклеотидами в промежутках в соответствии с комплементарными сегментами первого и второго олигонуклеотидов.
Следует заметить, что несмотря на то, что предоставление третьего и четвертого олигонуклеотидов, предварительно меченных донорным флуорофором и акцепторным флуорофором после связывания первого и второго связывающих элементов, определено выше в две стадии, это не означает, что данные две стадии не могут быть выполнены в другом порядке или, предпочтительно, по существу одновременно.
Преимущество данного варианта осуществления состоит в том, что олигонуклеотиды, предварительно меченные донорным флуорофором и акцепторным флуорофором, могут быть отделены от остальных обнаруживаемых элементов, что может позволить более простое тестирование и переключение флуорофоров (например, в случае мультиплексирования с интерферирующим флуорофором или высокоавтофлуоресцентными образцами). Более того, это может сделать возможным производство стандартизированных детектирующих тестов, в частности, когда применяют вторичный иммуноанализ, а тесты разработаны против, например, доменов мышиных и крысиных антител.
В дополнительном варианте осуществления первый олигонуклеотид является предварительно меченным донорным флуорофором, или второй олигонуклеотид является предварительно меченным акцепторным флуорофором, при этом способ включает:
- после связывания первого и второго связывающих элементов, добавление акцепторного флуорофора или донорного флуорофора, который встраивается в двойную цепь, образованную посредством гибридизации первого и второго олигонуклеотидов.
В данном случае донорный флуорофор и/или акцепторный флуорофор, который добавляют только после связывания первого и второго связывающих элементов, основан на интеркалирующем красителе, например, DAPI (4',6-диамидино-2-фенилиндол) или YOYO, который представляет собой тетракатионный гомодимер Оксазола Желтого. Поскольку интеркалирующие красители флуоресцируют, только когда они действительно интеркалированы в двухцепочечной ДНК, можно с успехом гарантировать, что эффект FRET вызывается только в желаемой локализации.
Изобретение также предоставляет способ обнаружения пространственной близости первого и второго эпитопов белка или первого и второго белков белкового комплекса в образце больного, при этом способ включает:
- связывание первого связывающего элемента, имеющего первый олигонуклеотид, конъюгированный с ним, с первым эпитопом,
- связывание второго связывающего элемента, имеющего второй олигонуклеотид, конъюгированный с ним, со вторым эпитопом, и
- определение, присутствует ли между донорным флуорофором и акцепторным флуорофором, которые ассоциированы с первым олигонуклеотидом и вторым олигонуклеотидом, эффект резонансного переноса энергии флуоресценции (FRET), при этом наличие эффекта FRET указывает на пространственную близость первого и второго олигонуклеотидов и, таким образом, на пространственную близость первого и второго эпитопов, при этом способ включает:
- после связывания первого и второго связывающих элементов, предоставление полимера, в котором пи-электроны делокализованы вдоль молекулы, при этом полимер способен связываться как с первым, так и со вторым олигонуклеотидом, и переносить энергию от донорного флуорофора к акцепторному флуорофору (см. Demchenko A.P., «Nanoparticles and nanocomposites for fluorescence sensing and imaging», Methods and Applications in Fluorescence, Vol. 1, No. 2, 2013).
Поскольку перенос энергии достигается посредством третьего элемента, то есть полимера, первый и второй олигонуклеотиды не должны быть обязательно по меньшей мере частично комплементарными. Это имеет то преимущество, что, если первый и второй олигонуклеотиды по существу вообще не являются комплементарными, нет необходимости обеспечивать защиту первого и второго олигонуклеотидов, что может привести к упрощенному процессу, поскольку в этом случае также можно избежать стадии устранения защиты.
Является предпочтительным, что для обнаружения пространственной близости первого и второго эпитопов первого и второго белков белкового комплекса, первый и второй связывающие элементы выбраны так, чтобы первый и второй эпитопы не загораживались на первом и втором белках белкового комплекса.
Является предпочтительным, чтобы определение, присутствует ли эффект FRET, включало:
- получение по меньшей мере одного флуоресцентного изображения образца, и
- выполнение пространственно разрешенного анализа по меньшей мере одного флуоресцентного изображения для обнаружения и локализации эффекта FRET.
Представленное изобретение также предоставляет способ стратификации больного, страдающего заболеванием, для оценки пригодности лечения, при этом лечение направлено на сигнальный путь, и/или для прогноза исхода заболевания больного и/или для прогнозирования и/или обнаружения устойчивости к лечению больного, страдающего от заболевания, в отношении лечения, при этом способ включает:
- определение статуса активации сигнального пути посредством применения способа, как определено выше, для обнаружения в образце больного, присутствует ли по меньшей мере один фактор транскрипции.
Способ изобретения может быть выполнен за короткое время. Более того, способ не требует применения фермента или, по меньшей мере, не требует сложных ферментативных реакций, таких как амплификация последовательности и тому подобное.
В некоторых вариантах осуществления заболевание может представлять собой рак.
Изобретение дополнительно предоставляет набор для осуществления способа, как определено посредством изобретения, при этом набор содержит следующие компоненты:
- первый связывающий элемент, имеющий первый олигонуклеотид, конъюгированный с ним, при этом первый связывающий элемент направлен против первого эпитопа,
- второй связывающий элемент, имеющий второй олигонуклеотид, конъюгированный с ним, при этом второй связывающий элемент направлен против второго эпитопа, и
- донорный флуорофор и акцепторный флуорофор,
при этом первый и второй эпитопы являются частью белка или первого и второго белков белкового комплекса,
при этом первый олигонуклеотид по меньшей мере частично комплементарен второму олигонуклеотиду,
при этом первый олигонуклеотид снабжен первым отдельным защитным элементом, и/или второй олигонуклеотид снабжен вторым отдельным защитным элементом для предотвращения преждевременной гибридизации первого и второго олигонуклеотидов.
Изобретение дополнительно предоставляет набор для осуществления способа, как определено посредством изобретения, при этом набор содержит следующие компоненты:
- первый связывающий элемент, имеющий первый олигонуклеотид, конъюгированный с ним, при этом первый связывающий элемент направлен против первого эпитопа,
- второй связывающий элемент, имеющий второй олигонуклеотид, конъюгированный с ним, при этом второй связывающий элемент направлен против второго эпитопа,
- донорный флуорофор и акцепторный флуорофор, и
- полимер, в котором пи-электроны делокализованы вдоль молекулы, при этом полимер способен связываться как с первым, так и со вторым олигонуклеотидом, и переносить энергию от донорного флуорофора к акцепторному флуорофору,
при этом первый и второй эпитопы являются частью белка или первого и второго белков белкового комплекса.
Наборы изобретения не требуют применения фермента или, по меньшей мере, не требуют агентов для сложных ферментативных реакций, таких как амплификация последовательности и тому подобное.
В варианте осуществления донорный флуорофор и/или акцепторный флуорофор ассоциирован и/или прикреплен к первому олигонуклеотиду и/или второму олигонуклеотиду.
Изобретение дополнительно предоставляет применение каждого из наборов изобретения в соответствии со способом изобретения.
Применение наборов для упомянутых выше способов позволяет выполнять способы за короткое время. Более того, применение наборов не требует применения фермента или, по меньшей мере, не требует сложных ферментативных реакций, таких как амплификация последовательности и тому подобное.
Способы и наборы изобретения имеют общее преимущество в том, что они могут уменьшать или избегать ошибок обнаружения, возникающих в результате нежелательного возникновения эффекта FRET между донорным флуорофором и акцепторным флуорофором, когда ни первый связывающий элемент, ни второй связывающий элемент не связаны с первым и вторым эпитопами белка или первого и второго белков белкового комплекса в образце больного, соответственно.
Следует понимать, что предпочтительный вариант осуществления изобретения также может представлять собой любую комбинацию зависимых пунктов формулы изобретения или упомянутых выше вариантов осуществления с соответствующим независимым пунктом формулы изобретения.
Данные и другие аспекты изобретения будут очевидны и разъяснены со ссылкой на варианты осуществления, описанные ниже.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На следующих иллюстративных и схематичных чертежах:
Фиг. 1 показывает спектр возбуждения и спектр излучения Cy3 и Cy5,
Фиг. 2 (a)-(e) показывает первый вариант осуществления в соответствии с изобретением,
Фиг. 3 иллюстрирует разновидность первого варианта осуществления, показанного на Фиг. 2 (a)-(e),
Фиг. 4 иллюстрирует второй вариант осуществления способа изобретения,
Фиг. 5 иллюстрирует третий вариант осуществления способа изобретения,
Фиг. 6 иллюстрирует четвертый вариант осуществления способа изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
На фигурах одинаковые элементы обозначены одинаковыми ссылочными номерами. Более того, когда на одной и той же фигуре или на части фигуры встречаются одинаковые элементы, ссылочным номером может быть обозначен только один фрагмент.
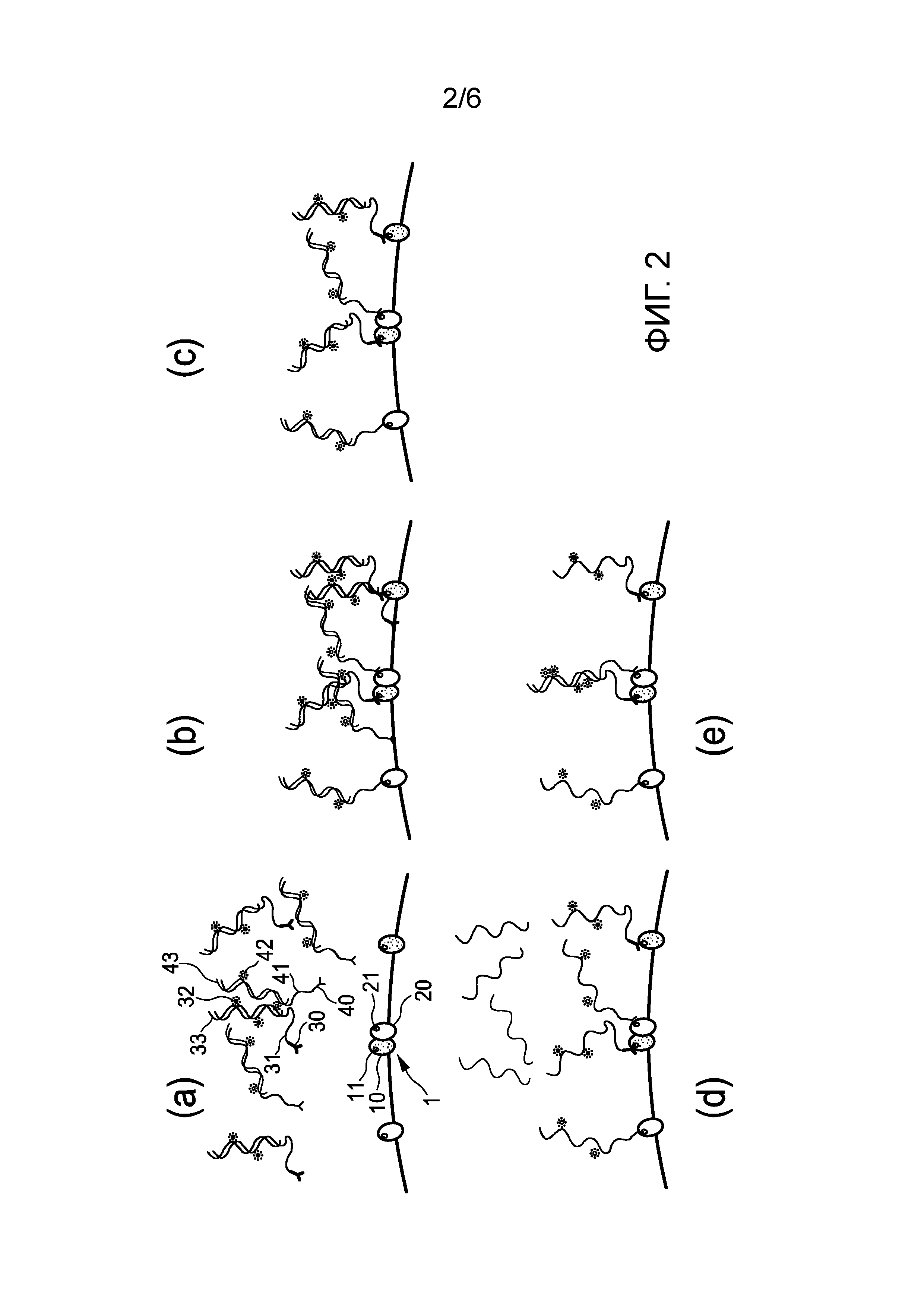
Фиг. 2 (a)-(e) показывает первый вариант осуществления способа обнаружения пространственной близости первого и второго эпитопов 11, 21 первого и второго белков 10, 20 белкового комплекса 1 в образце ткани и/или клеток и/или текучей среды организма пациента. Как можно видеть на фигуре, первый связывающий элемент 30, в данном случае, первое антитело, имеет первый олигонуклеотид 31, конъюгированный с ним, а второй связывающий элемент 40, в данном случае, второе антитело, имеет второй олигонуклеотид 41, конъюгированный с ним.
Как показано на Фиг. 2 (b), первое антитело 30, имеющее первый олигонуклеотид 31, конъюгированный с ним, связано с первым эпитопом 11, а второе антитело 40, имеющее второй олигонуклеотид 41, конъюгированный с ним, связано со вторым эпитопом 21. В частности, как показано на Фиг. 2 (a), первое антитело 30, имеющее первый олигонуклеотид 31, конъюгированный с ним, и второе антитело 40, имеющее второй олигонуклеотид 41, конъюгированный с ним, добавляют в образец, который содержит белковый комплекс 1, в данном примере, белковый димер, состоящий из первого и второго белка 10, 20. Дополнительно, образец также может содержать первый и второй белок по отдельности, как показано в данном случае. Далее, после определенного периода инкубирования, первое и второе антитела 30, 40 специфически связываются, то есть связываются с первым и вторым эпитопом 11, 21 или, в зависимости от обстоятельств, неспецифически связываются, то есть связываются с местами, не являющимися первым и вторым эпитопом 11, 21, но, возможно, аналогичными им, (см. антитела на Фиг. 2 (b), которые связываются в пространстве между проиллюстрированными белками). Затем используют подходящую стадию промывания для удаления возможных неспецифически связанных первых и вторых антител, результатом чего является по существу только специфически связанные первые и вторые антитела, оставшиеся в образце, как показано на Фиг. 2 (c).
В данном варианте осуществления первый олигонуклеотид 31 является предварительно меченным донорным флуорофором 32, а второй олигонуклеотид 41 является предварительно меченным акцепторным флуорофором 42. Подходящим выбором для пары донорного-акцепторного флуорофора может быть, например, флуоресцинизотиоцианат (FITC)-тетраметилродамин (TRITC), Cy3-Cy5, усиленный зеленый флуоресцентный белок (EGFP)-Cy3, голубой флуоресцентный белок (CFP)-желтый флуоресцентный белок (YFP) или EGFP-YFP.
В данном случае первый и второй олигонуклеотиды 31, 41 являются по меньшей мере частично комплементарными, так что они могут гибридизироваться, когда они находятся в пространственной близости друг к другу. С целью предотвращения преждевременной гибридизации первого и второго олигонуклеотидов 31, 41, то есть предотвращения гибридизации первого и второго олигонуклеотидов 31, 41 уже перед связыванием первого и второго антител 30, 40 с первым и вторым эпитопами 11, 21, первый олигонуклеотид 31 изначально снабжен первым отдельным защитным элементом 33, а второй олигонуклеотид 41 изначально снабжен вторым отдельным защитным элементом 43. Первый и/или второй отдельные защитные элементы 33, 43 могут быть значительно короче, чем первый и второй олигонуклеотиды 31, 41, или он/они могут состоять из множества коротких элементов при условии, что они позволяют сорвать гибридизацию первого и второго олигонуклеотидов 31, 41. В данном варианте осуществления первый отдельный защитный элемент 33 содержит первую нить ДНК, которая по меньшей мере частично комплементарна первому олигонуклеотиду 31 и гибридизирована с ним, а второй отдельный защитный элемент 43 содержит вторую нить ДНК, которая по меньшей мере частично комплементарна второму олигонуклеотиду 41 и гибридизирована с ними. В данном случае первая и вторая нити ДНК представляют собой немеченные нити ДНК, то есть они не являются предварительно меченными ни донорным флуорофором 32, ни акцепторным флуорофором 42.
Как показано на Фиг. 2 (d), после связывания первого антитела 30 первый отдельный защитный элемент 33, в данном случае, первую нить ДНК, удаляют с первого олигонуклеотида 31, а после связывания второго антитела 40 второй отдельный защитный элемент 43, в данном случае, вторую нить ДНК, удаляют со второго олигонуклеотида 41. В данном варианте осуществления удаление первой и второй нити ДНК включает плавление продукта гибридизации первого олигонуклеотида 31 и первой нити 33 ДНК и гибридизации второго олигонуклеотида 41 и второй нити 43 ДНК. Например, в одном примере температуру образца соответствующим образом повышают с целью достижения требуемого плавления продукта гибридизации. В другом примере с целью выполнения плавления изменяют растворитель образца. После плавления немеченные первую и вторую нити 33, 43 ДНК отмывают на подходящей дополнительной стадии промывания, как также показано на Фиг. 2 (d), результатом чего являются по существу только оставшиеся в образце специфически связанные первые и вторые антитела 30, 40, имеющие первый и второй олигонуклеотиды 31, 41, присоединенные к ним.
После того, как первый и второй отдельные защитные элементы 33, 43, в данном случае, первая и вторая нити ДНК, были удалены с первого и второго олигонуклеотидов 31, 41, два олигонуклеотида, которые являются по меньшей мере частично комплементарными, могут гибридизироваться, как показано в центре фиг. 2 (e), приводя донорный флуорофор 32 и акцепторный флуорофор 42 к пространственной близости, которая обеспечивает возможность возникновения между ними эффекта FRET. (Данная стадия предпочтительно включает вновь понижение температуры образца после предшествующей стадии плавления). Затем определение наличия между донорным флуорофором 32 и акцепторным флуорофором 42 эффекта FRET, при этом наличие эффекта FRET указывает на пространственную близость первого и второго олигонуклеотидов 31, 41, обеспечивает возможность обнаружения пространственной близости первого и второго эпитопов 11, 21 первого и второго белков 10, 20 белкового комплекса 1 в образце ткани и/или клеток и/или текучей среды организма пациента. В отличие от этого, как показано с левой и правой стороны фиг. 2 (e), антитела, которые специфически связаны с соответствующим эпитопом единственного белка, не будут приводить к эффекту FRET, поскольку предварительно меченный акцепторным/донорным флуорофором олигонуклеотид, конъюгированный с ними, не будет находиться в пространственной близости с олигонуклеотидом, предварительно меченным соответствующим донорным/акцепторным флуорофором.
Первый и второй олигонуклеотиды 31, 41 предпочтительно являются предварительно меченными на остове, а не только на 3' или 5'-конце, как это обычно бывает. Более того, метки можно наносить на конкретные участки с использованием мечения, как описано у Ozaki H. и McLaughlin L.W., «The estimation of distances between specific backbone-labeled sites in DNA using fluorescence resonance energy transfer», Nucleic Acids Research, Vol. 20, No. 19, 1992, pages 5205 to 5214. Также предпочтительно добавлять в последовательность основание, которое содержит молекулу, которая может быть использована для сайт-специфической конъюгации с антителами, а поверх нее предпочтительно должен быть линкер, составляющий по меньшей мере 10-20 нм (длиннее в случае, когда линкером является двухспиральная ДНК вследствие большой персистентной длины), так что первый и второй олигонуклеотиды 31, 41 могут иметь для гибридизации достаточную пространственную свободу.
В литературе были описаны различные пути достижения эффективного переноса энергии были (см. Demchenko A.P., "Nanoparticles and nanocomposites for fluorescence sensing and imaging", Methods and Applications in Fluorescence, Vol. 1, No. 2, 2013, 28 pages). Соответственно, необходимо иметь симметричное распределение донорного флуорофора 32 и акцепторного флуорофора 42 на первом и втором олигонуклеотидах 31, 41.
Нижняя граница обнаружения (LOD) флуоресцентного сканера или микроскопа очень сильно зависит от качества оптики и камеры, а также от условий измерения, таких как время интегрирования и интенсивность намагничивания. Грубая оценка состоит в том, что для обычной оптической схемы флуоресцентного микроскопа необходимо использовать около 100 молекул красителя на мишень, предполагая, что одна из мишеней имеет оптическое разрешение приблизительно 0,25 мкм2. Следовательно, для обнаружения отдельных олигонуклеотидов направляют интенсивность излучения, соответствующую приблизительно 100 молекулам красителя.
Другой аспект конструкции состоит в том, чтобы избежать гомо-FRET взаимодействий между красителями одного и того же типа. Оценка того, что возможно предоставлена на веб-сайте Invitrogen (Life Technologies/Thermo Fisher). В соответствии с ней, приблизительно при 1 молекуле красителя на 20 пар оснований, семейство красителей Alexa превосходит традиционные цианиновые красители. Однако следует отметить, что данная плотность 1:20 получается за счет случайного мечения посредством ник-трансляции, что означает, что она включает флуорофоры менее, чем 20 пар оснований. Посредством специфического мечения может быть достигнута более высокая плотность, составляющая по меньшей мере 1 FRET пару на 20 пар оснований на каждом олигонуклеотиде.
Преимущественно, олигонуклеотид, полностью насыщенный метками, будет показывать гомо-FRET, но все метки донорского флуорофора все-таки могут переносить свою энергию на свои метки акцепторного флуорофора, приводя к более низким требованиям мечения.
Более того, для генерирования изображения также может быть использовано гашение за счет вычитания изображения, полученного до, из изображения, полученного после активации олигонуклеотидов с резонансным переносом энергии флуоресценции.
В зависимости от конструкции и типа акцепторного флуорофора и донорного флуорофора, например, молекулы, квантовой точки, наночастицы или полимера, может быть выбран размер первого и второго олигонуклеотидов 31, 41.
В случае классической конструкции с органическими флуоресцентными красителями первый и второй олигонуклеотиды 31, 41 предпочтительно должны быть сделаны достаточно длинными, чтобы обеспечить достаточно положений приблизительно для 100 молекул красителя (например, 20×100=2000 оснований, или 5×100=500 оснований).
Однако также возможно выбрать настолько маленькое количество красителей, чтобы не мог быть обнаружен ни один из отдельных белковых комплексов, а вместо этого определенная концентрация комплексов, так чтобы граница обнаружения превышала бы общее излучение в пределах оптического разрешения детектора.
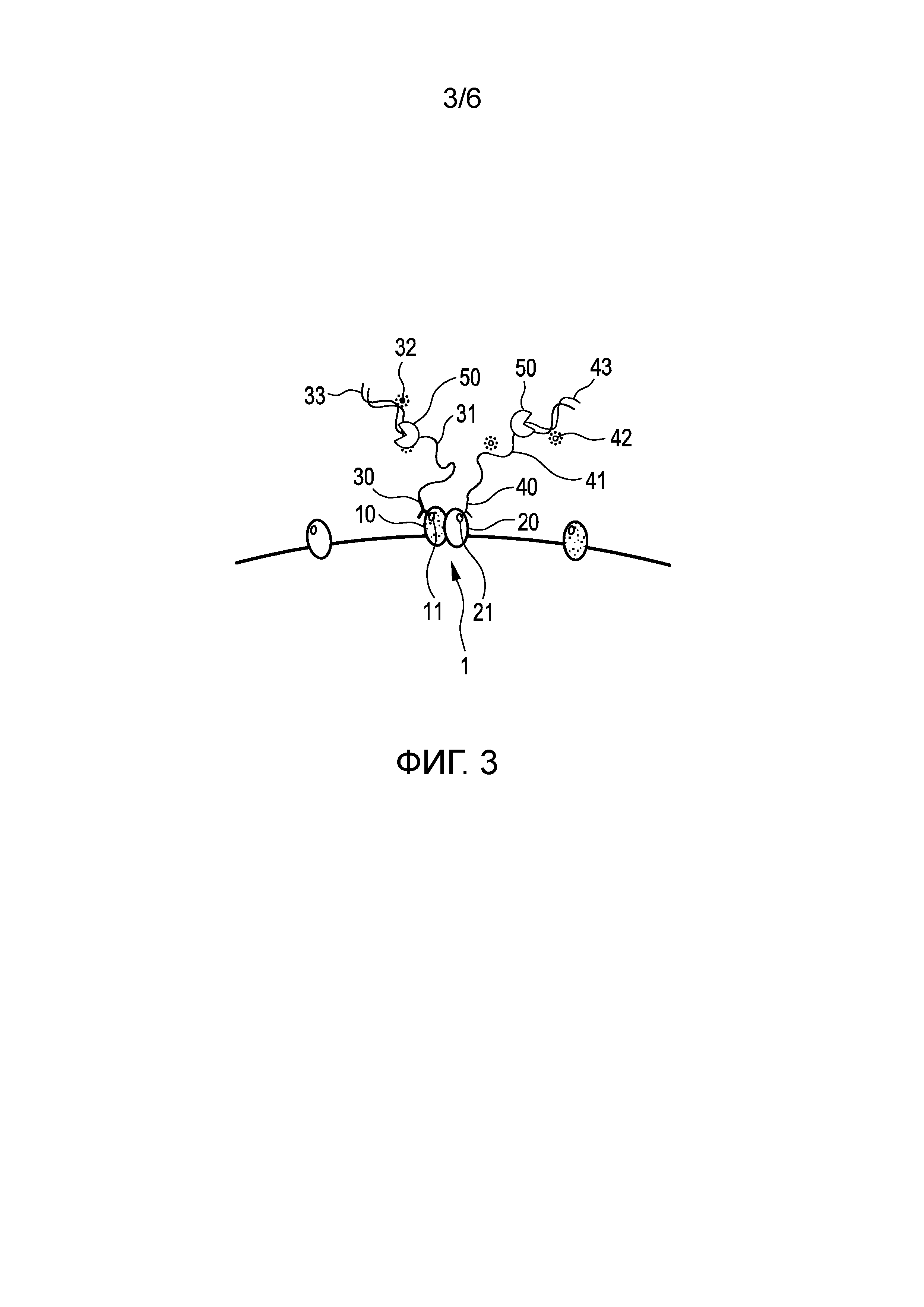
На Фиг. 3 проиллюстрирована разновидность первого варианта осуществления, показанного на Фиг. 2 (a)-(e). Данная разновидность по существу аналогична первому варианту осуществления. Отличие, однако, состоит в том, что в данном варианте первый отдельный защитный элемент 33 содержит первую нить РНК, которая по меньшей мере частично комплементарна первому олигонуклеотиду 31 и гибридизирована с ним, а второй отдельный защитный элемент 43 содержит вторую нить РНК, которая по меньшей мере частично комплементарна второму олигонуклеотиду 41 и гибридизирована с ним. Тогда удаление первой и второй нитей РНК включает применение фермента 50, например, РНКазы H, для разложения РНК. Данный вариант имеет преимущество в том, что весь процесс становится изотермическим; с другой стороны, однако, он требует применения фермента 50.
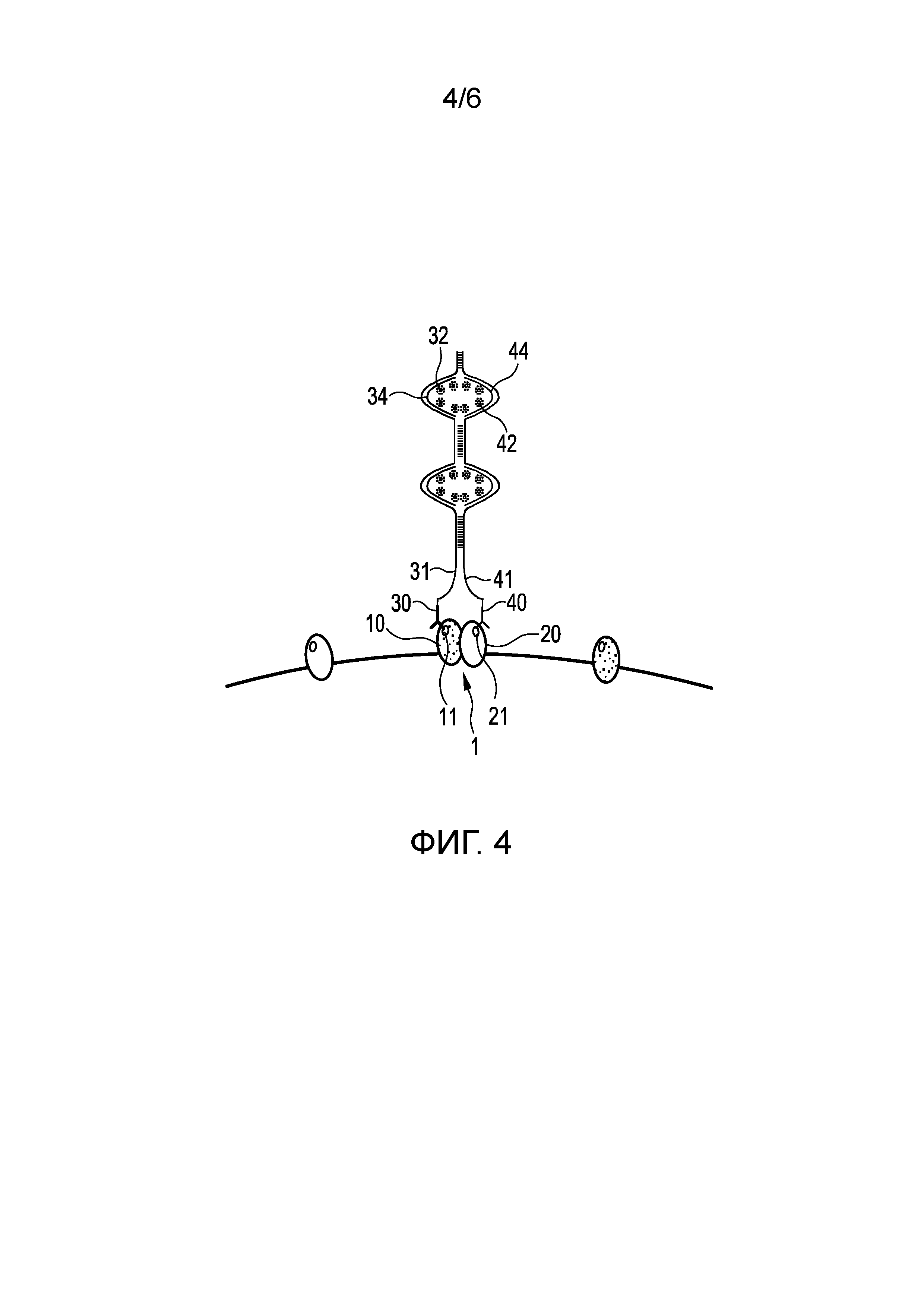
Фиг. 4 показывает второй вариант осуществления способа обнаружения пространственной близости первого и второго эпитопов 11, 21 первого и второго белков 10, 20 белкового комплекса 1 в образце ткани и/или клеток и/или текучей среды организма пациента.
Данный вариант осуществления по существу аналогичен первому варианту осуществления, показанному на Фиг. 2 (a)-(e). Отличие, однако, состоит в том, что в данном варианте осуществления донорный флуорофор 32 прикрепляется к первому олигонуклеотиду 31 только после связывания первого связывающего элемента 30, в данном случае, первого антитела, а акцепторный флуорофор 42 прикрепляется ко второму олигонуклеотиду 41 только после связывания второго связывающего элемента 40, в данном случае, второго антитела. В частности, как показано на Фиг. 4, после связывания первого антитела 30 предоставляют третий олигонуклеотид 34, меченный донорным флуорофором 32, при этом третий олигонуклеотид 34 по меньшей мере частично комплементарен первому олигонуклеотиду 31, а прикрепление донорного флуорофора 32 к первому олигонуклеотиду 31 включает гибридизацию с ним третьего олигонуклеотида 34. Аналогичным образом, после связывания второго антитела 40 предоставляют четвертый олигонуклеотид 44, меченный акцепторным флуорофором 42, при этом четвертый олигонуклеотид 44 по меньшей мере частично комплементарен второму олигонуклеотиду 41, а прикрепление акцепторного флуорофора 42 ко второму олигонуклеотиду 41 включает гибридизацию с ним четвертого олигонуклеотида 44.
В данном случае является предпочтительным, чтобы первый и второй олигонуклеотиды 31, 41 были частично комплементарными с целью достижения требуемой пространственной близости. Тогда третий и четвертый олигонуклеотиды 34, 44 предпочтительно гибридизируются с первым и вторым олигонуклеотидами 31, 41 между соответствующими комплементарными сегментами первого и второго олигонуклеотидов 31, 41, как показано на Фиг. 4.
Преимущество данного варианта осуществления состоит в том, что олигонуклеотиды, меченные донорным флуорофором 32 и акцепторным флуорофором 42, могут быть отсоединены от остальной части детектируемых элементов, что может обеспечить возможность более простого тестирования и переключения флуорофоров (например, в случае мультиплексирования с интерферирующим флуорофором или высокоавтофлуоресцентными образцами). Более того, можно предусмотреть разработку стандартизированных тестов обнаружения, в частности, когда используют вторичный иммуноанализ, и тесты разрабатывают, например, против доменов мышиных и крысиных антител.
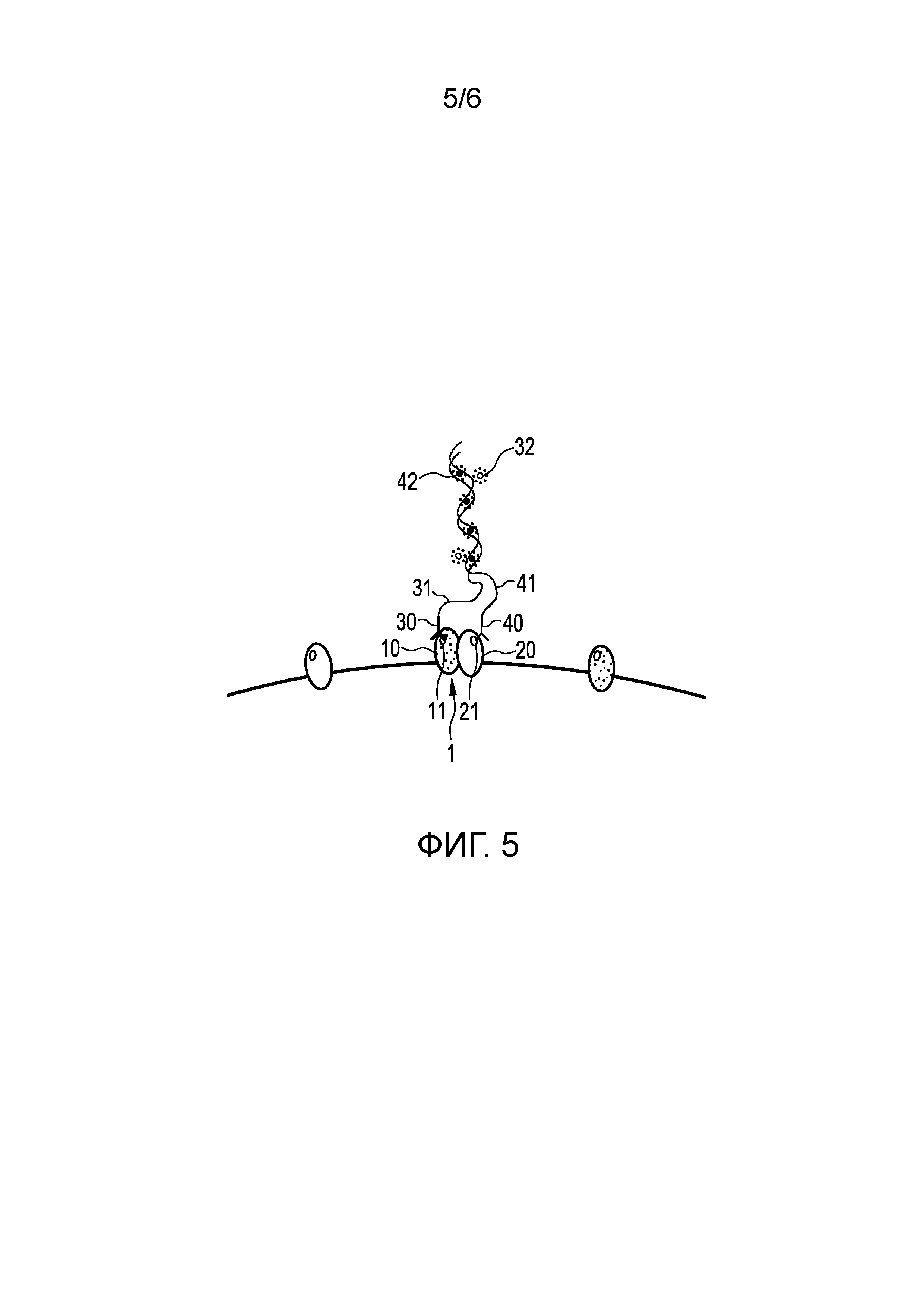
Фиг. 5 иллюстрирует третий вариант осуществления способа обнаружения пространственной близости первого и второго эпитопов 11, 21 первого и второго белков 10, 20 белкового комплекса 1 в образце ткани и/или клеток и/или текучей среды организма пациента.
Данный вариант осуществления по существу аналогичен первому варианту осуществления, показанному на Фиг. 2 (a)-(e). В частности, также в данном варианте осуществления, первый и второй олигонуклеотиды 31, 41 являются по меньшей мере частично комплементарными, так что они могут гибридизироваться, когда они находятся в пространственной близости друг к другу. Отличие, однако, состоит в том, что в данном варианте осуществления только второй олигонуклеотид 41 является меченным акцепторным флуорофором 42, и, как показано на Фиг. 5, после связывания первого и связывающего элемента 30, 40, в данном случае, первого и второго антител, добавляют донорный флуорофор 32, который встраивается в двойную цепь, образованную посредством гибридизации первого и второго олигонуклеотидов 31, 41.
В данном случае донорный флуорофор 32, который добавляют только после связывания первого и второго антител 30, 40, основан на интеркалирующем красителе, например, DAPI (4',6-диамидино-2-фенилиндоле) или YOYO, который представляет собой тетракатионный гомодимер Оксазола Желтого. Поскольку интеркалирующие красители флуоресцируют, только когда фактически встраиваются в двухспиральную ДНК, можно с уверенностью гарантировать, что эффект FRET вызывается только в нужном месте.
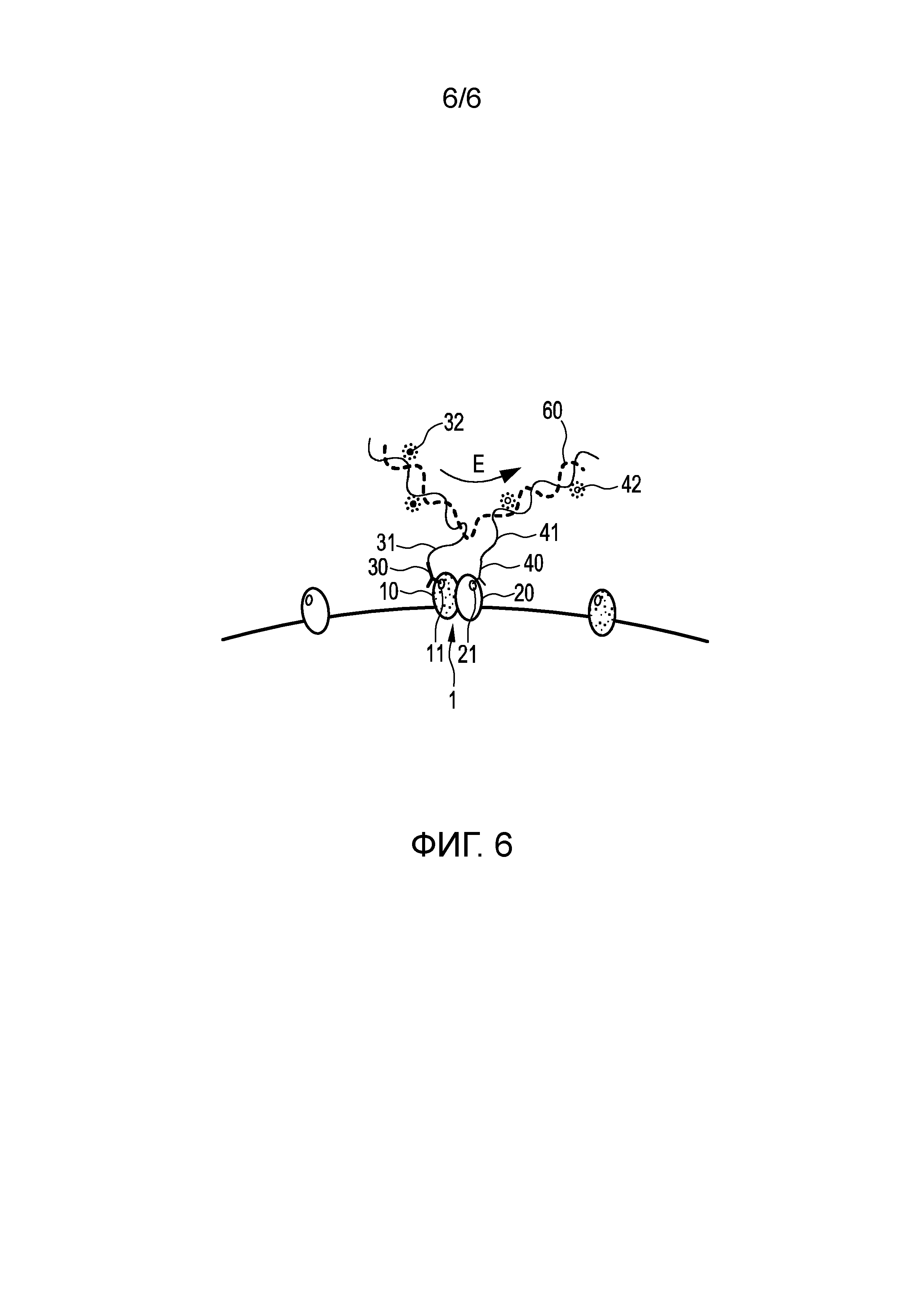
Фиг. 6 иллюстрирует четвертый вариант осуществления способа обнаружения пространственной близости первого и второго эпитопов 11, 21 первого и второго белков 10, 20 белкового комплекса 1 в образце ткани и/или клеток и/или текучей среды организма пациента.
Данный вариант осуществления по существу аналогичен первому варианту осуществления, показанному на Фиг. 2 (a)-(e). Отличие, однако, состоит в том, что в данном варианте осуществления после связывания первого и второго связывающих элементов 30, 40, в данном случае, первого и второго антител, предоставлен полимер 60, в котором пи-электроны делокализованы вдоль молекулы, при этом полимер 60 способен связываться как с первым, так и со вторым олигонуклеотидами 31, 41 и передавать энергию от донорного флуорофора 32 в акцепторный флуорофор 42, или выступать в качестве акцептора и/или донора для донорного флуорофора 32 и/или акцепторного флуорофора 42.
Поскольку в данном варианте осуществления перенос энергии достигается посредством третьего элемента, то есть полимера 60, первый и второй олигонуклеотиды 31, 41 не должны быть по меньшей мере частично комплементарными. Преимущество этого состоит в том, что если первый и второй олигонуклеотиды 31, 41 по существу совсем не являются комплементарными, нет необходимости предоставления защиты первого и второго олигонуклеотидов 31, 41, которая может привести к более простому процессу, поскольку в данном случае также можно избежать стадии удаления защиты.
Предпочтительно, один или более полимеров могут быть связаны с одним олигонуклеотидом и с одной или более квантовыми точками к комплементарному олигонуклеотиду, приводя к очень компактным элементам обнаружения, которые могут легко диффундировать в образец.
Несмотря на то, что в первом-четвертом варианте осуществления, описанном со ссылкой на Фиг. 2-6 выше, первым и вторым связывающими элементами 30, 40 являются первое и второе антитела, предпочтительно, первое и второе моноклональное антитело, в других вариантах осуществления они могут также представлять собой, например, фрагмент первого и второго антитела, такого как верблюжье антитело, аптамер или олигопептид. В более общем смысле, первым и вторым связывающим элементом 30, 40 могут быть любые типы элементов или структур, которые способны связываться с первым и вторым эпитопом 11, 21, соответственно, и с которыми могут быть конъюгированы первый и второй олигонуклеотиды 31, 41.
Несмотря на то, что в первом-четвертом варианте осуществления, описанном со ссылкой на Фиг. 2-6 выше, связывание первого и второго антител 30, 40 ограничено двумя стадиями, это не означает, что две эти стадии нельзя выполнить в ином порядке или, предпочтительно, по существу одновременно. То же самое верно для стадий удаления первого и второго отдельных защитных элементов 33, 43 с первого и второго олигонуклеотидов 31, 41 и прикрепления донорного флуорофора 32 и акцепторного флуорофора 42 к первому и второму олигонуклеотидам 31, 41 после связывания первого и второго антител 30, 40.
Несмотря на то, что в третьем варианте осуществления, описанном со ссылкой на Фиг. 5 выше, только второй олигонуклеотид 41 является меченным акцепторным флуорофором 42, а после связывания первого и второго антител 30, 40 добавляют донорный флуорофор 32, который встраивается в двойную цепь, образованную посредством гибридизации первого и второго олигонуклеотидов 31, 41, это также может происходить и наоборот. Другими словами: в другом варианте осуществления только первый олигонуклеотид 31 может быть мечен донорным флуорофором 32, а после связывания первого и второго антител 30, 40 может быть добавлен акцепторный флуорофор 42, который встраивается в двойную цепь, образованную посредством гибридизации первого и второго олигонуклеотидов 31, 41.
В первом-четвертом вариантах осуществления, описанных со ссылкой на Фиг. 2-6 выше, первое и второе антитела 30, 40 предпочтительно выбирают таким образом, чтобы первый и второй эпитопы 11, 21 не были загорожены на первом и втором белках 10, 20 белкового комплекса 1.
В первом-четвертом вариантах осуществления, описанных со ссылкой на Фиг. 2-6 выше, представленное изобретение было объяснено относительно обнаружения пространственной близости первого и второго эпитопов 11, 21 первого и второго белков 10, 20 белкового комплекса 1. Однако представленное изобретение также может быть использовано для обнаружения пространственной близости первого и второго эпитопов (единственного) белка.
В представленном изобретении, как описано в данном документе, термин «олигонуклеотид» используют также для охвата молекул PNA (пептидо-нуклеиновой кислоты) и LNA (запертой нуклеиновой кислоты).
Применение PNA и/или LNA для первого и/или второго олигонуклеотидов 31, 41 может быть предпочтительным, поскольку известно, что и та и другая связываются с ДНК (и РНК) с повышенной специфичностью. Данное свойство может быть использовано, например, для создания вариантов осуществления, в которых первый и второй олигонуклеотиды 31, 41 являются по меньшей мере комплементарными, еще более специфичными и устойчивыми за счет еще более надежного предотвращения преждевременной гибридизации первого и второго олигонуклеотидов 31, 41. В дополнение, если молекулу PNA и/или молекулу LNA используют для первого и/или второго олигонуклеотидов 31, 41, увеличение температуры, необходимое для удаления первого и второго отдельных защитных элементов 33, 43 может быть более низким. Кроме того, искусственные нуклеиновые кислоты, такие как PNA и LNA, могут иметь меньшую персистентную длину.
Дополнительно, гибкость олигонуклеотидов может быть улучшена, например, за счет увеличения концентрации соли, поскольку в данном случае персистентная длина в результате уменьшается. Manning G.S., "The persistence length of DNA is reached from the persistence length of its null isomer through an internal electrostatic stretching force", Biophysical Journal, Vol. 91, No. 10, 2006, pages 3607 to 3616 показывает, что за счет увеличения концентрации соли выше 0,1 М можно довести персистентную длину двухспиральной ДНК до 30 нм вместо обычных 50 нм.
Представленное изобретение может применяться в области диагностики заболеваний, в частности, диагностики рака. Примеры многомерных белковых агрегатов, таких как белковые димеры и/или посттрансляционные модификации белка, которые можно обнаруживать посредством представленного изобретения, включают:
- димеры HER2-HER2,
- димеры HER2-HER3,
- фосфорилирование HER2,
- фосфорилирование AKT,
- димеры ER-ER,
- димеры ER-p300,
- димеры AR-p300,
- димеры TCF4-β-катенин и т.д.
В общем, представленное изобретение также относится к способу стратификации больного, страдающего заболеванием, предпочтительно пациента, более предпочтительно, больного раком, для оценки пригодности лечения, при этом лечение направлено на сигнальный путь, и/или для прогноза исхода заболевания у больного, предпочтительно рака, у больного раком, и/или для прогнозирования и/или обнаружения устойчивости к лечению у больного, страдающего заболеванием, предпочтительно больного раком, в отношении лечения. Способ включает определение статуса активации сигнального пути за счет применения способа в соответствии с изобретением, как определено в данном документе выше, для обнаружения, присутствует ли в образце больного по меньшей мере один фактор транскрипции.
Подобный способ, например, может быть использован для обнаружения присутствия специфического белка, предпочтительно, фактора транскрипции, такого как мембранный рецептор HER2, или двух или более пространственно близких белков, предпочтительно, двух или более белков, являющихся частью комплекса факторов транскрипции, такого как ER и p300 (см. выше).
Например, с целью показать в полуколичественной форме присутствие HER2, иммуногистохимические (IHC) эксперименты обычно выполняют на образцах тканевых биоптатов. Присутствие или отсутствие данного рецептора является клинически значимым, так как оно указывает, будет ли пациент реагировать на препарат Герцептин направленного действия. Другие примеры подобных клинических тестов IHC включают обнаружение присутствия рецепторов гормонов, таких как ER и PR, но также, например, маркера пролиферации Ki67.
Хотя IHC имеет доказанное клиническое значение, она ограничена в отношении того, что простое присутствие белка не может доказать его активную роль в клеточной передаче сигналов. С целью получения возможности сказать, активно ли участвует белок в передаче сигналов или нет, необходим способ его применения для выявления статуса его фосфорилирования, или формируются ли комплексы с другими белками. Например, упомянутый выше белок HER2 может образовывать димеры с белком HER3 и обходить действие герцептина. Еще одним примером соответствующих взаимодействий являются комплексы факторов транскрипции, которые представляют собой агрегаты множества белков, присутствие которых может указывать на активацию транскрипции генов. Их присутствие возможно является показательным для пути движения опухоли и, таким образом, важным для лечения указанной опухоли. Примером является комплекс факторов транскрипции TGF-β/β-катенин: если может быть показано, что данные белки находятся в тесной пространственной близости в ядре, наиболее вероятно, что путь Wnt находится в рабочем состоянии, тогда как всего лишь присутствие только одного из двух данных белков не имеет такого же значения.
Как описано выше, представленное изобретение также относится к набору для осуществления способа в соответствии с изобретением. В зависимости от способа, подлежащего осуществлению, соответственно, следует выбирать компоненты подобного набора. Например, для осуществления способа оценки пригодности лечения герцептином, подобный набор может содержать первый связывающий элемент 30, например, первое антитело, имеющее первый олигонуклеотид 31, конъюгированный с ним, при этом первый связывающий элемент 30 направлен против первого эпитопа 11, второй связывающий элемент 40, например, второе антитело, имеющее второй олигонуклеотид 41, конъюгированный с ним, при этом второй связывающий элемент 40 направлен против второго эпитопа 21, и донорный флуорофор 32 и акцепторный флуорофор 42, при этом первый эпитоп 11 является частью HER2, а второй эпитоп 21 является частью HER3.
Другие варианты раскрытых вариантов осуществления могут быть понятны и реализованы квалифицированными специалистами в данной области техники при практическом воплощении заявленного изобретения, при изучении чертежей, раскрытия и приложенной формулы изобретения.
В формуле изобретения слово «содержащий» не исключает других элементов или стадий, а неопределенный артикль «a» или «an» не исключает множество.
Никакие ссылочные знаки в формуле изобретения не следует истолковывать, как ограничение объема правовых притязаний изобретения.