Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ БОГАТОЙ ТРОМБОЦИТАМИ ПЛАЗМЫ И СПОСОБ ПОЛУЧЕНИЯ ТРОМБОФИБРИНОВОГО ГЕЛЯ ИЛИ СГУСТКА С СЫВОРОТКОЙ, СОДЕРЖАЩИЕ ФАКТОРЫ РОСТА, ИЗ НЕСТАБИЛИЗИРОВАННОЙ ВЕНОЗНОЙ КРОВИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области медицины, а именно, регенеративной медицины, и может быть использовано для получения аутологичного трансплантата для местной стимуляции репаративных процессов.
Уровень техники
Трансплантаты, включающие тромбоциты, все более востребованы практическим здравоохранением. Это обусловлено тем, что данные клетки являются естественным депо стимулирующих регенерацию факторов и противовоспалительных цитокинов. При этом одной из наиболее часто используемых форм трансплантата является тромбофибриновый сгусток. К его преимуществам относится: возможность придания трансплантату трехмерной формы и его фиксации на поверхности дефекта, постепенное выделение факторов роста и противовоспалительных цитокинов в процессе лизиса. Способы изготовления тромбофибринового сгустка можно условно разделить на две группы: одни подразумевают работу со стабилизированной кровью, выделение из нее БоТП и добавление активаторов свертывания; другие - использование нестабилизированной крови и спонтанную самостоятельную коагуляцию. Однако, вне зависимости от способа запуска каскада реакций, его результатом всегда является массовый выход цитокинов из тромбоцитов и заключение их в тромбофибриновый гель. При этом состояние геля крайне не устойчиво и под влиянием внешнего воздействия он стремительно уплотняется в тромбофибриновый сгусток с отделением сыворотки, содержащей существенную долю ростстимулирующих и противовоспалительных.
Одним из наиболее близких к заявляемому является способ получения тромбоцитарного сгустка из богатой тромбоцитами плазмы (БоТП) путем внесения в образец активаторов свертывающей системы крови и нагревания биоматериала до 37°С [Применение аппликаций богатой тромбоцитами аутоплазмы в лечении больных с хроническими ранами различной этиологии. Методические рекомендации, авт. Оболенский В.Н., Ермолова Д.А, Макаров М.С., Конюшко О.И., Сторожева М.В., Лаберко Л.А., Боровкова Н.В. - М., Департамент здравоохранения города Москвы, 2013. - 16 с].
Венозную кровь забирают в пробирки с антикоагулянтом. Для выделения БоТП пробирки центрифугируют с ускорением 460g в течение 8 минут. Затем отбирают нижнюю фракцию плазмы, наиболее богатую тромбоцитами, и переносят в новую пробирку. Для получения сгустка в плазму с тромбоцитами добавляют 10% раствор хлорида кальция из расчета 50-70 мкл на 1 мл БоТП и инкубируют при 37°С в течение 20-30 мин.
У данного способа есть несколько существенных недостатков. Необходимость точного расчета количества активатора свертывающей системы крови, его аликвотирование и внесение в биоматериал не только увеличивает время приготовления сгустка, но и повышает риск нарушения стерильности биоматериала. Помимо этого для инкубирования биоматериала требуется использование дополнительного дорогостоящего оснащения (инкубатора).
Описанных недостатков лишен способ получения тромбофибринового сгустка из нестабилизированной крови [Santhakumar М, Yayathi S, Retnakumari N. А clinicoradiographic comparison of the effects of platelet-rich fibrin gel and platelet-rich fibrin membrane as scaffolds in the apexification treatment of young permanent teeth. J Indian Soc Pedod Prev Dent. 2018 Jan-Mar; 36(1):65-70] (прототип). Венозную кровь забирают в пробирки без антикоагулянта и сразу центрифугируют при 3000 об/м течение 10 минут. За это время в пробирке самостоятельно формируется сгусток. Однако простота метода обуславливает его недостатки. В частности из-за использования нестабилизированной крови отсутствует возможность отложенного приготовления сгустка - центрифугирование должно быть проведено сразу после забора. Это, в свою очередь, требует организации взятия крови непосредственно у центрифуги или перемещение прибора к пациенту. При этом из-за отсутствия антикоагулянта в биоматериале происходит спонтанное формирование тромбоцитарных конгломератов. При центрифугировании они смещаются к границе с эритроцитами из-за чего в получаемом сгустке тромбоциты не распределены равномерно по всему объему, а сконцентрированы в определенной зоне, для выделения которой необходима дополнительная препаровка трансплантата.
Важно отметить и общий недостаток описанных методик - возможность формирования трансплантата исключительно in vitro и, следовательно, необходимость его переноса в/на дефект. Данная манипуляция всегда приводит к стремительному уплотнению тромбофибринового геля в сгусток с отделением in vitro сыворотки, содержащей значимую долю ростстимулирующих и противовоспалительных цитокинов.
Таким образом, существующие методы получения тромбофибринового сгустка имеют ряд недостатков, способных как снизить эффективность их применения, так и ограничивающие возможности внедрения в повседневную клиническую практику.
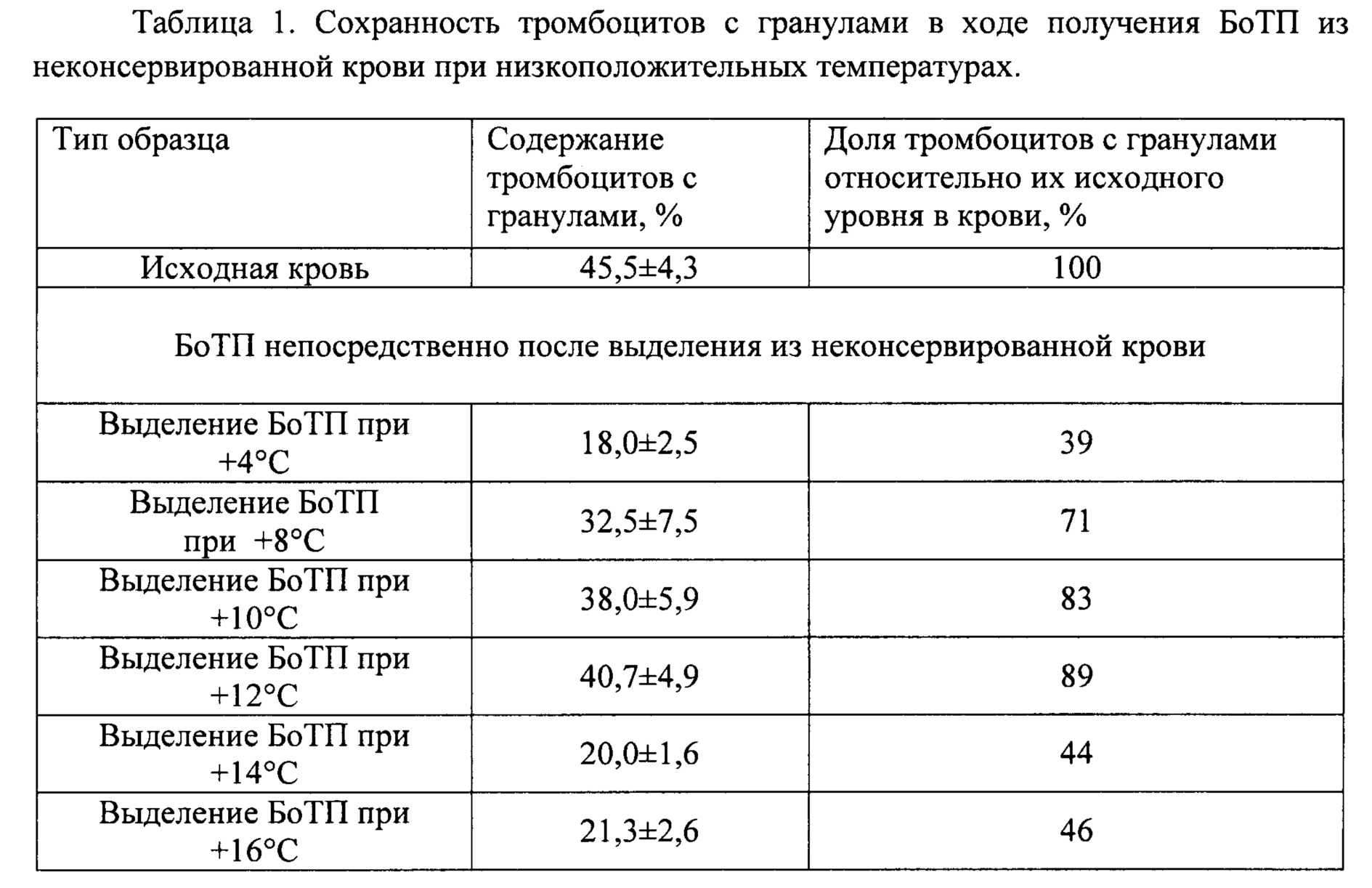
Технической проблемой, решение которой обеспечивается при осуществлении изобретения, является выделение богатой тромбоцитами плазмы (БоТП) из нестабилизированной антикоагулянтами венозной крови с сохранением тромбоцитов с гранулами не менее 44% от исходного количества (при разделении на компоненты не позднее 60 минут после забора крови), с последующим получением из БоТП тромбофибринового геля или сгустка с сывороткой, содержащие ростовые факторы.
Так выраженное снижение in vitro активности факторов свертывания крови в течение 60 минут дает возможность транспортировать биоматериал от места сбора до центрифуги, а затем выделить богатую тромбоцитами плазму (БоТП) для получения трансплантата с высокой концентрацией клеток и их равномерным распределением. При этом достижение стабилизирующего эффекта без применения антикоагулянтов позволит придать ему временный и обратимый характер. Это не только исключит необходимость добавления в биоматериал активаторов свертывания и инкубирования, но и обеспечит возможность формирования тромбофибринового геля непосредственно в месте повреждения путем нанесения БоТП.
Раскрытие изобретения
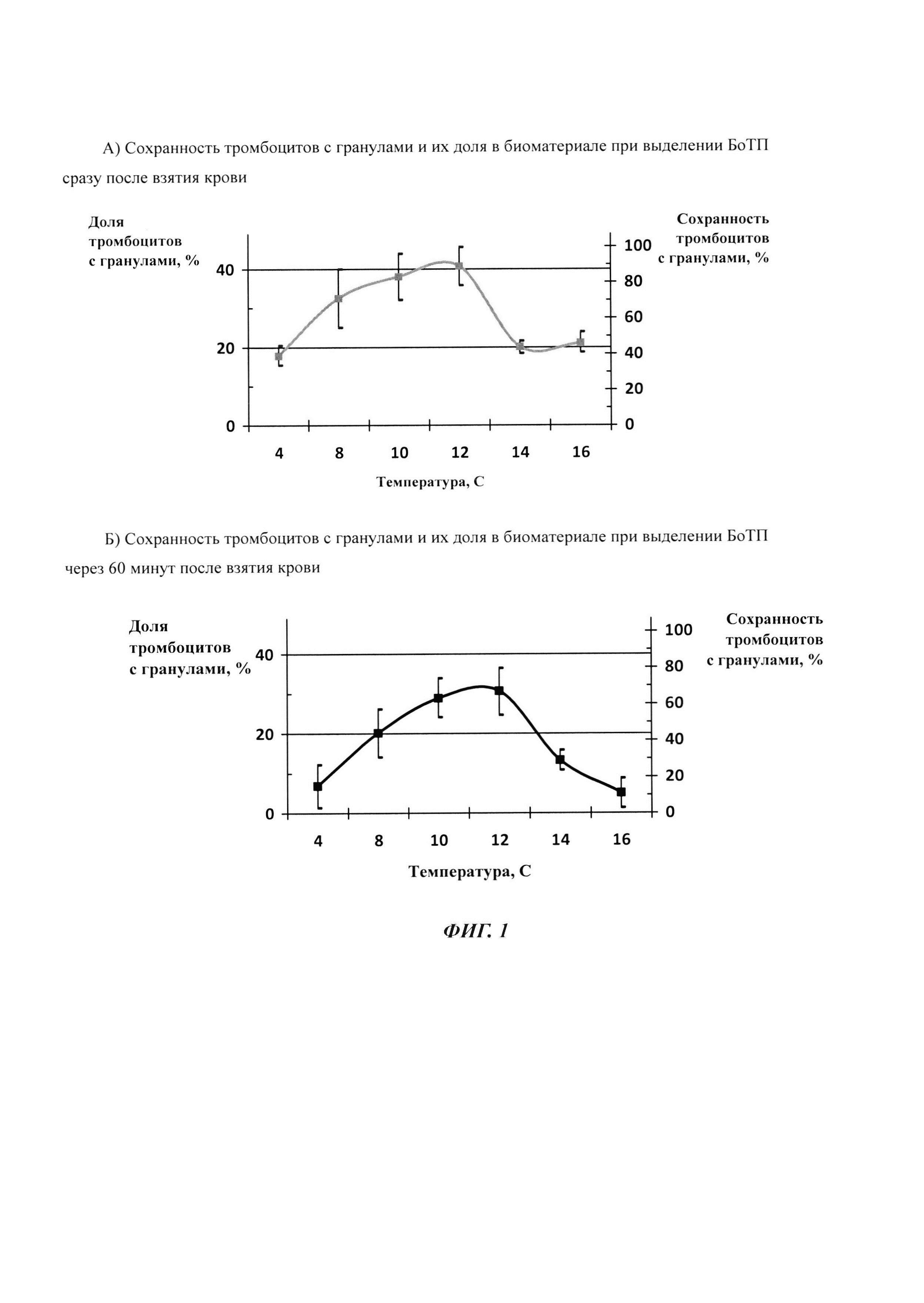
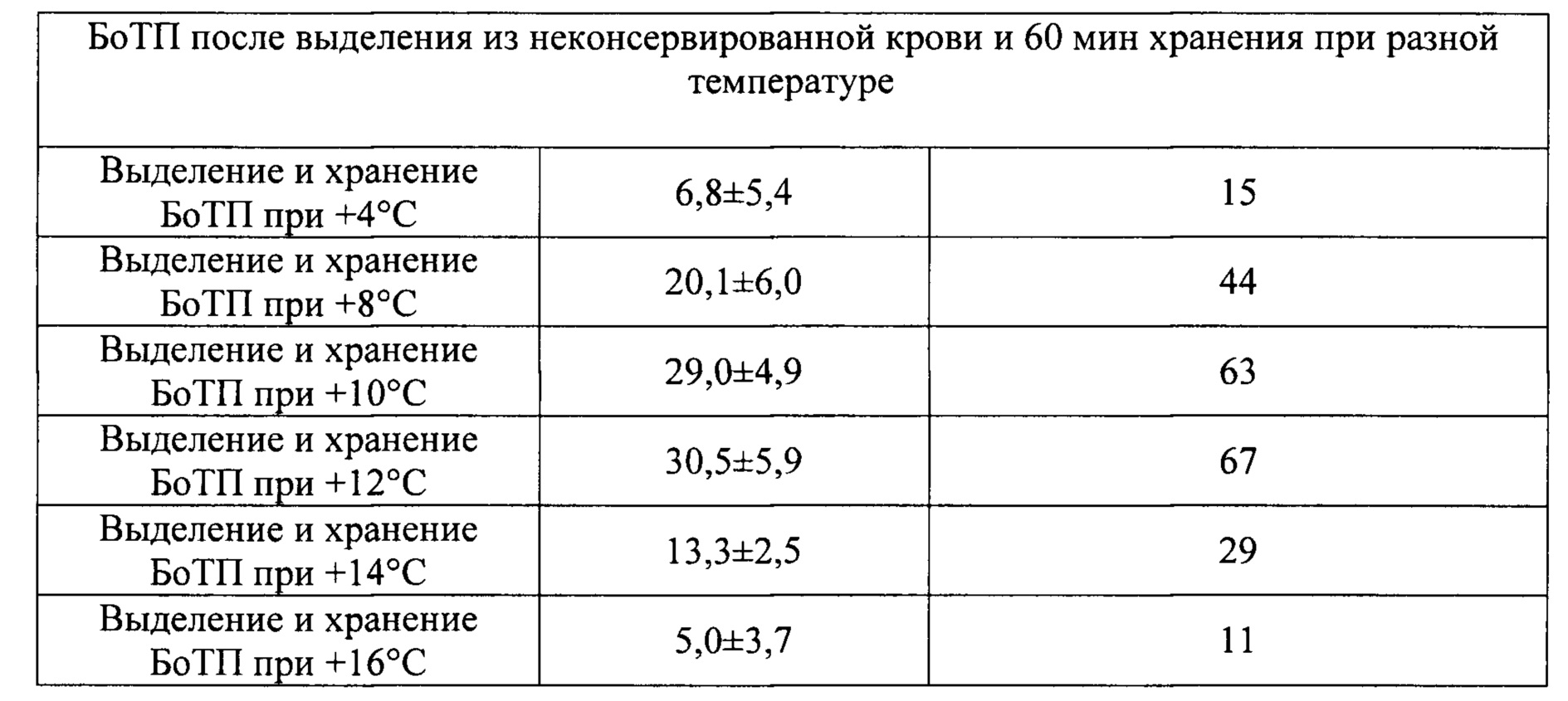
Техническим результатом, на достижение которого направлено заявленное изобретение, является без применения антикоагулянтов значительное замедление in vitro каскада активации плазменного и клеточного звена гемостаза в венозной крови до 60 минут с момента забора образца крови с последующим выделением богатой тромбоцитами плазмы (БоТП) с сохранением тромбоцитов с гранулами не менее 71% от исходного количества при разделении на компоненты (центрифугированием) сразу после забора образца крови, и не менее 44% от исходного количества при температуре хранения и/или разделения от 8-12°С, и получением из БоТП геля, а затем сгустка с сывороткой, содержащей факторы роста, без добавления активаторов свертывания. При температуре хранения и/или разделения 10-12°С возможно получение не менее 83% тромбоцитов с гранулами от исходного количества при разделении на компоненты сразу после забора биоматериала, и не менее 63% от исходного количества при центрифугировании до истечения 60 минут с момента забора образца крови.
Технический результат достигается посредством реализации способа получения богатой тромбоцитами плазмы (БоТП) из нестабилизированной антикоагулянтами венозной крови, включающего забор венозной крови в пробирку без антикоагулянта и активаторов свертывания, ее охлаждение до температуры 8-12°С с возможностью поддержания указанной температуры до 60 мин с последующим центрифугированием образца крови с ускорением 300g в течение 5 минут при температуре в камере 8-12°С, и отбором БоТП из нижней части супернатанта в объеме примерно 1/10 (с возможной погрешностью до 10%) от исходного количества крови в пробирке.
Гель, содержащий ростовые факторы, получают из БоТП без добавления активаторов свертывания посредством выдерживания БоТП в течение 15-20 мин при комнатной температуре (20-22°С) или нагревания в течение 15-20 мин теплом, излучаемым телом. Для разделения геля на сгусток и сыворотку, содержащие ростовые факторы, на него механически воздействуют каким-либо стерильным предметом, например, скальпелем, отделяя гель от стенок пробирки.
Краткое описание чертежей
Изобретение поясняется чертежами, где на фиг. 1 представлен график зависимости концентрации тромбоцитов с гранулами в БоТП от величины температуры и времени стабилизации крови: А) при выделении БоТП сразу после взятия крови, Б) через 60 минут после взятия крови; на фиг. 2 - фотография витально окрашенных мезенхимальных мультипотентных стромальных клеток человека через 3 суток культивирования: А - без сгустка (контроль), и Б - в присутствии сгустка, выделенного из неконсервированной крови (оригинальный метод). Окраска трипафлавином и акридиновым оранжевым. Увеличение х 40.
Осуществление изобретения
Сбор венозной крови осуществляют из локтевой вены в процедурном кабинете с соблюдением правил асептики и антисептики, по стандартной методике, используя шприц или специальное приспособление для работы с вакуумными пробирками. Кровь вносят в стерильную одноразовую вакуумную пробирку, не содержащую каких-либо добавок («сухая»). Пробирки с кровью без антикоагулянта помещают в термоконтейнер с аккумуляторами холода, либо иное устройство, способное охладить биоматериал до 8-12°С и поддерживать указанную температуру во время транспортировки, до 60 минут.
Для выделения плазмы с тромбоцитами биоматериал центрифугируют с ускорением 300g в течение 5 минут и температурой в камере 8-12°С. Затем с сохранением стерильности пипеткой собирают пограничную нижнюю часть супернатанта (богатую тромбоцитами плазму) в объеме примерно 1/10 от исходного количества крови в пробирке. При необходимости получения тромбофибринового геля in situ - БоТП помещают непосредственно на/в дефект. По мере нагревания биоматериала теплом, излучаемым телом, происходит его самостоятельная организация в гель. Для формирования трансплантата in vitro - отобранную плазму с тромбоцитами помещают в стерильную емкость необходимой формы, например - пробирку с круглым дном, и, при необходимости, ресуспендируют для равномерного распределения клеток по объему трансплантата. Затем емкость герметично закрывают и оставляют при комнатной температуре на 15-20 минут. В этом случае тромбофибриновый гель организуется за счет тепла окружающей среды. Для получения сгустка с сывороткой гель в емкости отделяют от стенок.
Авторами изобретения были проведены исследования, по итогам которых были выявлены значения температуры охлаждения биоматериала (8-12°С), поддержания при транспортировке биоматериала и разделении на компоненты, при которых обеспечивается получение качественного трансплатата, характеризующегося содержанием тромбоцитов с гранулами в исходном БоТП не менее 71% от первоначального количества при разделении на компоненты сразу после забора биоматериала, и не менее 44% от исходного количества при хранении при температуре от 8-12°С в течение 60 минут (за счет того, что с одной стороны, не происходит спонтанного свертывания нестабилизированной антикоагулянтами крови, с другой - не происходит спонтанной дегрануляции тромбоцитов). Указанный температурный диапазон не является очевидным и следующим из уровня техники для достижения указанного выше технического результата.
Известно, что гипотермия позволяет без использования антикоагулянтов существенно увеличить время свертывание крови. Под воздействием температуры менее 20°С в плазме активируются факторы, препятствующие полимеризации фибрина, образованию фибриновых сетей, а также частично блокируют контакт тромбоцитов с фибрином [Lai B.F., Zou Y., Yang X., Yu X., Kizhakkedathu J.N. Abnormal blood clot formation induced by temperature responsive polymers by altered fibrin polymerization and platelet binding. Biomaterials. 2014 Mar; 35(8):2518-28]. Однако неоднократно показано, что воздействие гипотермии на тромбоциты очень часто вызывает их спонтанную активацию с выбросом гранул [Shrivastava М. The platelet storage lesion. // Transfus Apher Sci. - 2009. - Vol. 41. - P. 105-113; Schubert P., Devine D.V. Towards targeting platelet storage lesion-related signaling pathways // Blood Transfus. - 2010. - №8. - P. 69-72.]. Последующее использование такого биоматериала с целью получения аутологичного трансплантата для стимуляции репаративных процессов не целесообразно, поскольку практически все тромбоциты в его составе уже не содержат необходимых цитокинов. В тоже время хранение при комнатной температуре (20-22°С), при блокировании свертывающей системы крови антикоагулянтами, способствует сохранению гранул в тромбоцитах. Серия проведенных авторами изобретения экспериментов по определению температуры, препятствующей как формированию сгустка в крови без использования антикоагулянтов, так и спонтанной дегрануляции тромбоцитов и допустимого времени ее воздействия на биоматериал показала следующее.
Температура от +4 до +16°С препятствует формированию сгустка в венозной крови, нестабилизированной антикоагулянтами, как при центрифугировании крови сразу после забора, так и хранении в течение 60 минут с последующим разделением на компоненты. Однако конкретная величина температуры и время воздействия влияет на интенсивность дегрануляции клеток в составе биоматериала (см. Таблицу 1, фиг. 1). Среди представленных данных приемлемыми можно считать результаты, полученные в экспериментах с температурами от 8 до 12°С. Так при центрифугировании нестабилизированной крови сразу после ее сбора - в условиях 8°С, в биоматериале сохраняется 71% биологически полноценных тромбоцитов от исходного числа; при 10°С эта величина составляет 83%; 12°С - 89%. В случае хранения нестабилизированной крови в течение 60 минут с последующим разделением на компоненты - при 8°С доля тромбоцитов с гранулами от исходного количества составляет 44%; при 10°С - 63%; 12°С - 67%. Следовательно температурный диапазон от 8 до 12°С является наиболее предпочтительным как для центрифугирования, так и хранения крови до 60 минут в случае отказа от использования антикоагулянтов.
Проведенные исследования также показали, что для получения качественного транстлантата из нестабилизированной антикоагулянтами венозной крови, помимо обеспечения температурного режима (8-12°С) необходимо однократное центрифугирование со скоростью 300g в течение 5 минут. В случае блокирования свертывающей системы крови антикоагулянтами тромбоциты при центрифугировании (в указанном режиме) остаются распределенными по всему объему супернатантной плазмы. И для их концентрации необходимо плазму дополнительно центрифугировать в более жестком режиме, что может отражаться на целостности клеток. Было обнаружено, что в случае отсутствия антикоагулянтов тромбоциты формируют конгломераты, которые при центрифугировании концентрируются в нижней части супернатантной плазмы, что облегчает их сбор и исключает необходимость дополнительной концентрации.
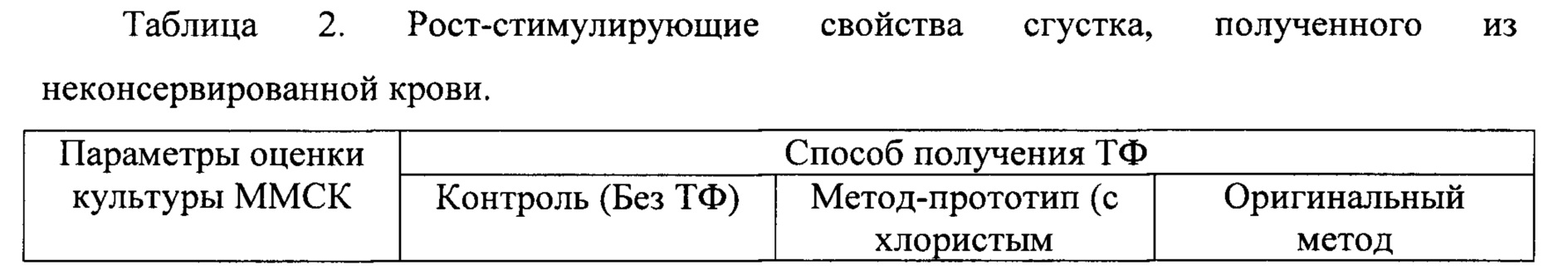
Оценку рост-стимулирующего действия тромбофибриновых сгустков (ТФС), выделенных по описанной методике, проводили в культуре клеток. На примере мезенхимальных мультипотентных стромальных клеток человека (ММСК) авторами настоящего изобретения было установлено, что ТФС, полученные стандартным способом (метод-прототип), in vitro увеличивают рост клеток лишь в 1,1 раза (см. Таблицу 2). В то же время, ТФС, полученные из БоТП с использованием оригинальной методики, увеличивают пролиферативную активность диплоидных клеток человека в 1,2-1,4 раз без видимого нарушения жизнеспособности клеток (фиг. 2, Таблица 2).
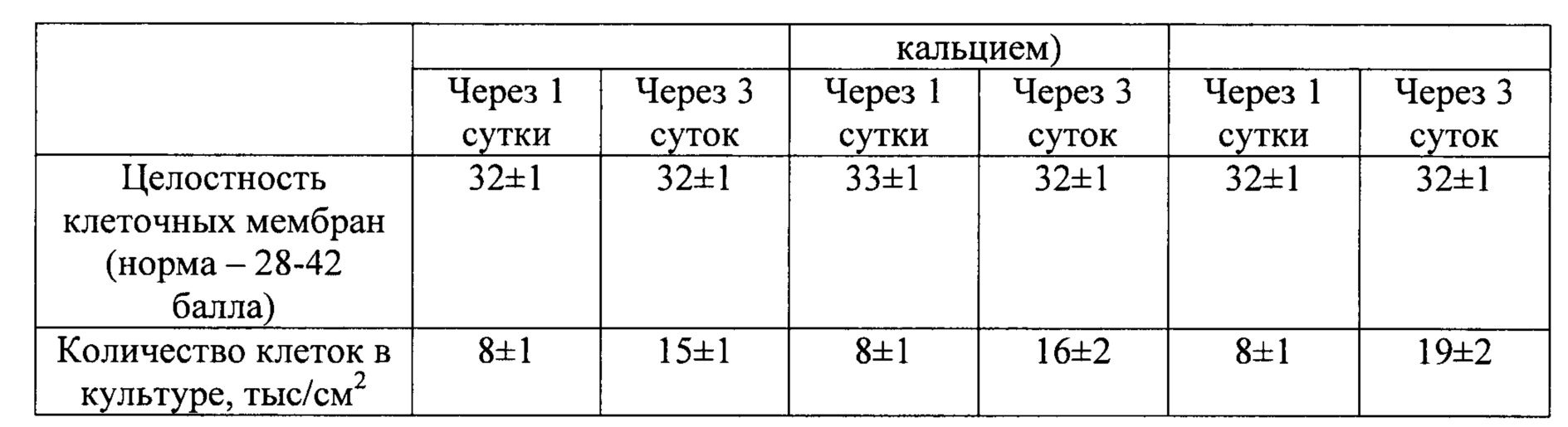
Таким образом технический результат обусловлен тем, что охлаждение in vitro крови сразу после сбора до 8-12°С и последующее поддержание указанного температурного диапазона биоматериала в течение 60 минут существенно снижает активность факторов свертывающей системы крови и сохраняет значимую долю тромбоцитов не дегранулировавшими. Это позволяет транспортировать биоматериал от места забора до центрифуги и выделять из него богатую тромбоцитами плазму без использования антикоагулянтов. В свою очередь использование богатой тромбоцитами плазмы для получения тромбофибринового геля обеспечивает не только возможность равномерно распределить клетки в трансплантате, но и более выраженные рост-стимулирующие свойства. При этом самостоятельная трансформация БоТП в тромбофибриновый гель по мере нагрева до температуры окружающей среды позволяет как отказаться от использования активаторов свертывания, так и получать трансплантат непосредственно in situ.