Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК L-HEP, ШТАММ ESCHERICHIA COLI ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА
Вид РИД
Изобретение
Область техники
Изобретение относится к биотехнологии, в частности к белковой инженерии. Оно может быть использовано для получения рекомбинантного рекомбинантного белка легкой цепи энтерокиназы человека, способного к иммобилизации.
Уровень техники
Энтеропептидаза (синоним: энтерокиназа, EC) представляет собой гетеродимерную сериновую протеазу, которая катализирует реакцию получения активного трипсина из предшественника трипсиногена высокоспецифическим отщеплением пептида активации трипсиногена после последовательности (Asp)4-Lys (SEQ ID NO 1). Он также имеет большой биотехнологический интерес из-за уникальной субстратной специфичности легкой цепи человеческой энтеропептидазы L-HEP.
Известно применение методов очистки на металл-аффинных сорбентах для производства энтеропептидазы L-HEP /патенты RU2011121471A, RU2011121471A, RU2495934C2/. Недостатком данных работ является наличие всего одного сайта специфического связывания, что не даёт возможности дальнейшей иммобилизации L-HEP.
Известна технология функционального фагового дисплея /Gasparian, M. E., Bobik, T. V., Kim, Y. V., Ponomarenko, N. A., Dolgikh, D. A., Gabibov, A. G., & Kirpichnikov, M. P. (2013). Heterogeneous catalysis on the phage surface: Display of active human enteropeptidase. Biochimie, 95(11), 2076-2081/, предлагающая способ производства активной энтеропептидазы, подходящей для удаления пептидных последовательностей в гибридных белках или функционального анализа мутантов. Недостатком приведённой технологии оказывается невысокий выход L-HEP, который ниже, чем в системах экспрессии на основе бактериальных клеток.
Известен способ иммобилизации L-HEP в глиоксилагарозных шариках /Suh, C. W., Choi, G. S., & Lee, E. K. (2003). Enzymic cleavage of fusion protein using immobilized urokinase covalently conjugated to glyoxyl‐agarose. Biotechnology and applied biochemistry, 37(2), 149-155/. Однако, полученный таким способом препарат сохранял свою активность не более одного цикла, что делает метод экономически неэффективным для применения в производстве.
Известна работа, в которой осуществили иммобилизацию энтерокиназы, обладающей высокой селективностью сайта расщепления и высокой скоростью расщепления /Suh, C. W., Park, S. H., Park, S. G., & Lee, E. K. (2005). Covalent immobilization and solid-phase refolding of enterokinase for fusion protein cleavage. Process Biochemistry, 40(5), 1755-1762/. Помимо приведённых преимуществ, авторы добились высокого выхода процесса рефолдинга иммобилизованной L-HEP, однако удельная активность фермента при продолжительном использовании составляла всего 20-30%., что делает метод экономически неэффективным для применения в производстве.
Известен способ иммобилизации L-HEP с использованием аминомодифицированных парамагнитных микросфер и гексаметиламино-модифицированных носителей «Sepabeads» /Kubitzki, T., Noll, T., & Lütz, S. (2008). Immobilisation of bovine enterokinase and application of the immobilised enzyme in fusion protein cleavage. Bioprocess and biosystems engineering, 31(3), 173-182/. Недостатком приведённого способа является существенное снижение скорости реакции уже после второго цикла, что делает метод экономически неэффективным для применения в производстве.
Известно повторное использование иммобилизованной L-HEP на протяжении 18-ти циклов, где иммобилизация проводится с использованием пористых гексаметиламино-модифицированных носителей «Sepabeads» /Kubitzki, T., Minör, D., Mackfeld, U., Oldiges, M., Noll, T., & Lütz, S. (2009). Application of immobilized bovine enterokinase in repetitive fusion protein cleavage for the production of mucin 1. Biotechnology Journal: Healthcare Nutrition Technology, 4(11), 1610-1618/. Недостатком приведённого способа является то, что результат расщепления контрольных гибридных белков обычно демонстрируется электрофорезом в додецилсульфат-полиакриламидном геле (SDS-PAGE). Данный метод предоставляет информацию о расщеплении рекомбинантного белка, однако не предоставляет данных о специфичности сайта расщепления, что не может считаться удовлетворительным для производства.
Известны методы иммобилизации L-HEP на различных эпоксидных смолах /Tengattini, S., Rinaldi, F., Piubelli, L., Kupfer, T., Peters, B., Bavaro, T., Temporini, C. (2018). Enterokinase monolithic bioreactor as an efficient tool for biopharmaceuticals preparation: on-line cleavage of fusion proteins and analytical characterization of released products. Journal of pharmaceutical and biomedical analysis, 157, 10-19/. Недостатком приведённого способа является проблема неспецифичного расщепления энтерокиназы в иммобилизованной форме с некоторыми субстратами, таким образом использование подобного метода не может считаться универсальным, что не может считаться удовлетворительным для производства.
Наиболее близким к заявленному изобретению является способ получения лёгкой цепи энтеропептидазы человека L-HEP, который заключающийся в экспрессии рекомбинантного белка, состоящего из L-HEP, сайта её расщепления и тиоредоксина /Marine E. Gasparian, Valeriy G. Ostapchenko, Alexey A. Schulga, Dmitry A. Dolgikh, Mikhail P. Kirpichnikov, Expression, purification, and characterization of human enteropeptidase catalytic subunit in Escherichia coli, Protein Expression and Purification, Volume 31, Issue 1, 2003, 133-139/. В данном способе получаемый в растворимой форме гибридный белок автокаталитически расщепляется, давая активную форму L-HEP. Основной недостаток данного способа заключается в том, что получаемый L-HEP является растворимым и не показана возможность его иммобилизации, необходимой для более эффективной утилизации в производстве. Таким образом, техническая проблема, на решение которой направлено настоящее изобретение, является получение рекомбинантного белка, обладающего каталитической активностью легкой цепи энтеропептидазы человека
Технический результат заключается в сохранении высокой каталитической активности рекомбинантного белка при иммобилизации на протяжении нескольких производственных циклов (возможность многократного использования рекомбинантного белка).
Для решения технической проблемы и достижения заявленного технического результата предлагается рекомбинантный белок (SEQ ID NO 2), включающий в себя сайты связывания металл-хелатного носителя (HG6), сайт узнавания хитинового носителя (CBD), лёгкую цепь энтерокиназы человека L-Hep.
Предлагается также рекомбинантный белок, имеющий аминокислотную последовательность SEQ ID NO 3, состоящий из модифицированного сайта расщепления L-HEP (SEQ ID NO 4), сайта связывания на металл-хелатном носителе (HG6), лёгкой цепи энтеропептидазы L-HEP, сайта связывания с хитиновым носителем (CBD).
Другим объектом изобретения является рекомбинантная плазмидная ДНК pET32b-L-HEP-HG6-CBD для экспрессии рекомбинантного белка, имеющего аминокислотную последовательность SEQ ID NO 3, имеющая длину 6365 пар оснований и состоящая из следующих ключевых генетических элементов:
а) гена устойчивости к антибиотику ампициллину (AmpR) и бактериального промотора гена устойчивости к ампициллину (AmpR promoter);
б) ориджина репликации бактериофага f1 (f1 ori);
в) промотора T7 и оператора lacO;
г) синтетической нуклеотидной последовательности, представленной в SEQ ID NO 5;
д) гена лактозного репрессора LacI и бактериального промотора гена лактозного репрессора (LacI promoter).
Объектом изобретения является также штамм Escherichia coli BL 21(DE3)/L-HEP-HG6-CBD, продуцирующий рекомбинантный белок, имеющий аминокислотную последовательность SEQ ID NO 3, содержащий рекомбинантную плазмидную ДНК pET32b-L-HEP-HG6-CBD.
Штамм Escherichia coli BL 21(DE3)/L-HEP-HG6-CBD получен путём трансформации клеток Escherichia coli рекомбинантной плазмидной ДНК pET32b-L-HEP-HG6-CBD.
Предлагается способ получения рекомбинантного белка L-HEP SEQ ID NO 2, включающий в себя стадии:
а) культивирования клеток штамма-продуцента Escherichia coli по любому из пунктов 4—5 с получением культуральной жидкости;
б) выделения L-HEP-HG6-CBD SEQ ID NO 3 из клеток штамма-продуцента Escherichia coli, получаемых на стадии а);
в) автокаталитического расщепления рекомбинантного белка, имеющего аминокислотную последовательность SEQ ID NO 3 с образованием рекомбинантного белка L-HEP-HG6-CBD, имеющего аминокислотную последовательность SEQ ID NO 2.
На стадии выделения рекомбинантного белка L-HEP-HG6-CBD (SEQ ID NO 2) осуществляют отделение клеток от культуральной жидкости, дезинтеграцию клеток, выделение тел включений из полученного дезинтеграта, солюбилизацию тел включения.
Культивирование клеток Escherichia coli BL21 (DE3)/L-HEP-HG6-CBD, в ростовой среде осуществляют на протяжении по меньшей мере 7 часов.
Индукцию биосинтеза рекомбинантного белка клетками Escherichia coli BL21 (DE3)/L-HEP-HG6-CBD осуществляют через 3 часа после начала культивирования при помощи изопропил-β-D-1-тиогалактоприанозида.
Отделение культуральной жидкости от клеток осуществляют центрифугированием.
Дезинтеграцию клеток осуществляют при помощи ультразвукового дезинтегратора.
Выделение тел включения из дезинтеграта осуществляют центрифугированием.
Выделение рекомбинантного белка L-HEP-HG6-CBD из полученных солюбилизированных тел включения осуществляют хроматографически на металл-хелатном или на хитиновом сорбенте.
Раскрытие изобретения
Рекомбинантный белок L-HEP-HG6-CBD (SEQ ID NO 2), способный к иммобилизации и состоящий из лёгкой цепи энтеропептидазы человека L-HEP, модифицирован по 112 аминокислотному остатку, сайта связывания металл-металл-халатного носителя HG6, и сайта связывания хитинового носителя CBD.
Гибридный белок, далее обозначаемой как BL21(DE3)/L-HEP-HG6-CBD, и имеющий последовательность SEQ ID NO 3 включает в себя модифицированный сайт узнавания энтеропептидазы человека L-HEP (SEQ ID NO 4), который, как известно из уровня техники /Marine E. Gasparian, Maxim L. Bychkov, Dmitry A. Dolgikh, Mikhail P. Kirpichnikov, Strategy for improvement of enteropeptidase efficiency in tag removal processes, Protein Expression and Purification, Volume 79, Issue 2, 2011, 191-196/, повышает эффективность каталитического расщепления.
Создание экспрессионной плазмиды.
В предлагаемом изобретении создают плазмидную ДНК (плазмиду) длиной 6365 п.о., обеспечивающую экспрессию рекомбинантного белка L-HEP-HG6-CBD в клетках Escherichia Coli, трансформированных указанной плазмидой.
Указанная плазмида, далее обозначаемая как pET32b-L-HEP-HG6-CBD, состоит из следующих ключевых генетических элементов, расположенных в соответствии с Фигурой 1:
(а) гена устойчивости к антибиотику ампициллину (AmpR) и бактериального промотора гена устойчивости к ампициллину (AmpR promoter);
(б) ориджина репликации бактериофага f1 (f1 ori);
(в) промотора T7 и оператора lacO;
(г) синтетической нуклеотидной последовательности, представленной в SEQ ID NO 5, кодирующей гибридный белок (SEQ ID NO 2), включающий в себя сайты связывания металл-хелатного носителя, сайт связывания хитиновго носителя, лёгкую цепь энтерокиназы человека L-Hep, пептид SEQ ID NO 4;
(д) гена лактозного репрессора LacI и бактериального промотора гена лактозного репрессора (LacI promoter).
В вышеуказанной плазмиде, строение которой раскрыто на Фигуре 1 настоящего описания, ген AmpR предназначен для селекции стабильных клеток Escherichia Coli. Бактериальный промотор гена устойчивости к ампициллину (AmpR promoter) предназначен для его экспрессии.
Ориджин репликации бактериофага f1 /Analysis of Genes and Genomes, John Wiley & Sons, 2004, S. 140/ широко используется для создания экспрессионных векторов.
Продуктом трансляции синтетической последовательности SEQ ID NO 5 является полипептид последовательности SEQ ID NO 3, включающий тиоредоксин E. Coli, модифицированный сайт расщепления энтеропептидазы человека (SEQ ID NO 4), лёгкую цепь энтеропептидазы человека L-HEP, гексагистидиновый участок HG6 и участок связывания хитина CBD.
Структура указанной плазмидной ДНК (плазмиды), состоящей из ключевых генетических элементов (а) – (д), представлена на Фигуре 1.
Плазмиду согласно изобретению получают из плазмидного вектора pET-32b, описанного в предшествующем уровне техники /http://www.merckmillipore.com/RU/ru/product/pET-32b+-DNA-Novagen,EMD_BIO-69016/. Для получения плазмиды по изобретению последовательность SEQ ID NO 5, полученную полным нуклеотидным синтезом, встраивают в плазмидный вектор pET-32b по сайтам рестрикции NdeI и BamHI.
Получение штамма-продуцента Е.coli BL21 (DE3)/L-HEP-HG6-CBD
Штамм BL21(DE3)/L-HEP-HG6-CBD получают трансформированием клеток Escherichia Coli BL21(DE3) экспрессионной плазмидой pET32b-L-HEP-HG6-CBD размером 6365 пар оснований (далее — п.о.), кодирующей гибридный белок SEQ ID NO 3, состоящей из следующих ключевых генетических элементов:
(а) гена устойчивости к антибиотику ампициллину (AmpR) и бактериального промотора гена устойчивости к ампициллину (AmpR promoter);
(б) ориджина репликации бактериофага f1;
(в) промотора T7 и оператора lacO;
(г) синтетической нуклеотидной последовательности, представленной в SEQ ID NO 5, кодирующей гибридный белок SEQ ID NO 3, включающий в себя сайты связывания металл-хелатного сорбента, узнавания хитина, лёгкую цепь энтерокиназы человека L-Hep, пептид SEQ ID NO 4;
(д) гена лактозного репрессора LacI и бактериального промотора гена лактозного репрессора (LacI promoter).
Исходным материалом для создания штамма-продуцента по изобретению является известный из уровня техники штамм Е.Coli BL21 (DE3) /Haeyoung Jeong, Valérie Barbe, Choong Hoon Lee, David Vallenet, Dong Su Yu, Sang-Haeng Choi, Arnaud Couloux, Seung-Won Lee, Sung Ho Yoon, Laurence Cattolico, Cheol-Goo Hur, Hong-Seog Park, Béatrice Ségurens, Sun Chang Kim, Tae Kwang Oh, Richard E. Lenski, F. William Studier, Patrick Daegelen, Jihyun F. Kim, Genome Sequences of Escherichia coli B strains REL606 and BL21(DE3), Journal of Molecular Biology, Volume 394, Issue 4, 2009, 644-652/. Экспрессионной плазмидой длиной 6365 п.о., состоящей из ключевых генетических элементов (а) – (д), расположенных друг относительно друга так, как представлено на Фигуре 1, трансформируют клетки штамма Е.Coli BL21 (DE3).
Предпочтительно (без ограничения), для введения указанной плазмиды в клетки штамма Е.Coli BL21 (DE3) используют метод электропорации, известный из уровня техники /Tamara Kleber-Janke, Wolf-Meinhard Becker, Use of Modified BL21(DE3) Escherichia coli Cells for High-Level Expression of Recombinant Peanut Allergens Affected by Poor Codon Usage, Protein Expression and Purification, Volume 19, Issue 3,2000, 419-424/ и включенный в настоящее описание посредством ссылки. Специалисту понятно, что в других воплощениях настоящего изобретения для введения плазмиды в клетки Е.Coli BL21 (DE3) могут использоваться и другие методы трансформации, известные из уровня техники, например, метод с использованием полиэтиленгликоля, кальций-хлоридный метод. Также для целей настоящего изобретения для введения в клетки Е.Coli BL21 (DE3) плазмиды, представленной на Фигуре 1 и состоящей из ключевых генетических элементов (а) – (д), могут использоваться и другие методы трансформации, не упомянутые в настоящем описании в явном виде, которые известны в уровне техники в настоящее время или будут созданы впоследствии. При осуществлении конкретных воплощений настоящего изобретения специалист, основываясь на существующем уровне знаний, может выбрать наиболее оптимальный метод трансформации клеток.
Трансформированные клетки рассевают на чашки Петри с агаризованной средой с добавлением селекционного агента ампициллина до конечно концентрации ампициллина 50 мкг/мл клетки. Из клонов, устойчивых к ампициллину, выделяют ДНК плазмиды pET32b-L-HEP-HG6-CBD, которую анализируют путём секвенирования.
Предлагаемый штамм-продуцент Escherichia coli BL21 (DE3)/L-HEP-HG6-CBD характеризуется следующими признаками:
Морфологические признаки. Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаризованной среде «LB» (на 1 литр 10г пептон, 5г дрожжевого экстракта,10 г NaCl, 20 г агара) – колонии круглые, гладкие, мутные, блестящие, серые, край ровный.
Физико-биологические признаки. Клетки растут при температуре от 4°С до 40°С при оптимальном значении рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к пенициллиновым антибиотикам (до 500 мкг/мл).
Получение, выделение и очистка рекомбинантного белка L-HEP-HG6-CBD
Способ получения рекомбинантного белка L-HEP-HG6-CBD включает культивирование клеток штамма-продуцента Escherichia coli BL21 (DE3)/L-HEP-HG6-CBD, полученной путем трансформации клеток Escherichia coli BL21 (DE3) раскрытой на Фигуре 1 плазмидой длиной 6365 п.о., состоящей из ключевых генетических элементов (а) – (д), на ростовой среде с получением культуральной жидкости, отделение клеток от культуральной жидкости, дезинтеграцию клеток, выделение тел включений из полученного дезинтеграта, солюбилизацию тел включения и выделение рекомбинантного белка L-HEP-HG6-CBD из полученных солюбилизированных тел включения.
В предпочтительном воплощении, однако без ограничения, культивирование клеток Escherichia coli BL21 (DE3)/L-HEP-HG6-CBD, в ростовой среде осуществляют на протяжении по меньшей мере 7 часов.
В предпочтительном воплощении, однако без ограничения, индукцию биосинтеза рекомбинантного белка клетками Escherichia coli BL21 (DE3)/L-HEP-HG6-CBD осуществляют на 3 часе культивирования при помощи изопропил-β-D-1-тиогалактоприанозида.
В предпочтительном воплощении, однако без ограничения, отделение культуральной жидкости от клеток осуществляют центрифугированием.
В предпочтительном воплощении, однако без ограничения, дезинтеграцию клеток осуществляют при помощи ультразвукового дезинтегратора.
В предпочтительном воплощении, однако без ограничения, выделение тел включения из дезинтеграта осуществляют центрифугированием.
Наконец, в предпочтительном воплощении, однако также без ограничения, выделение рекомбинантного белка L-HEP-HG6-CBD из полученных солюбилизированных тел включения осуществляют хроматографически. В более предпочтительных воплощениях, но без ограничения ими, выделение рекомбинантного белка L-HEP-HG6-CBD из солюбилизированных тел включения осуществляют на металл-хелатном хроматографическом сорбенте.
Изобретение иллюстрируют следующие рисунки:
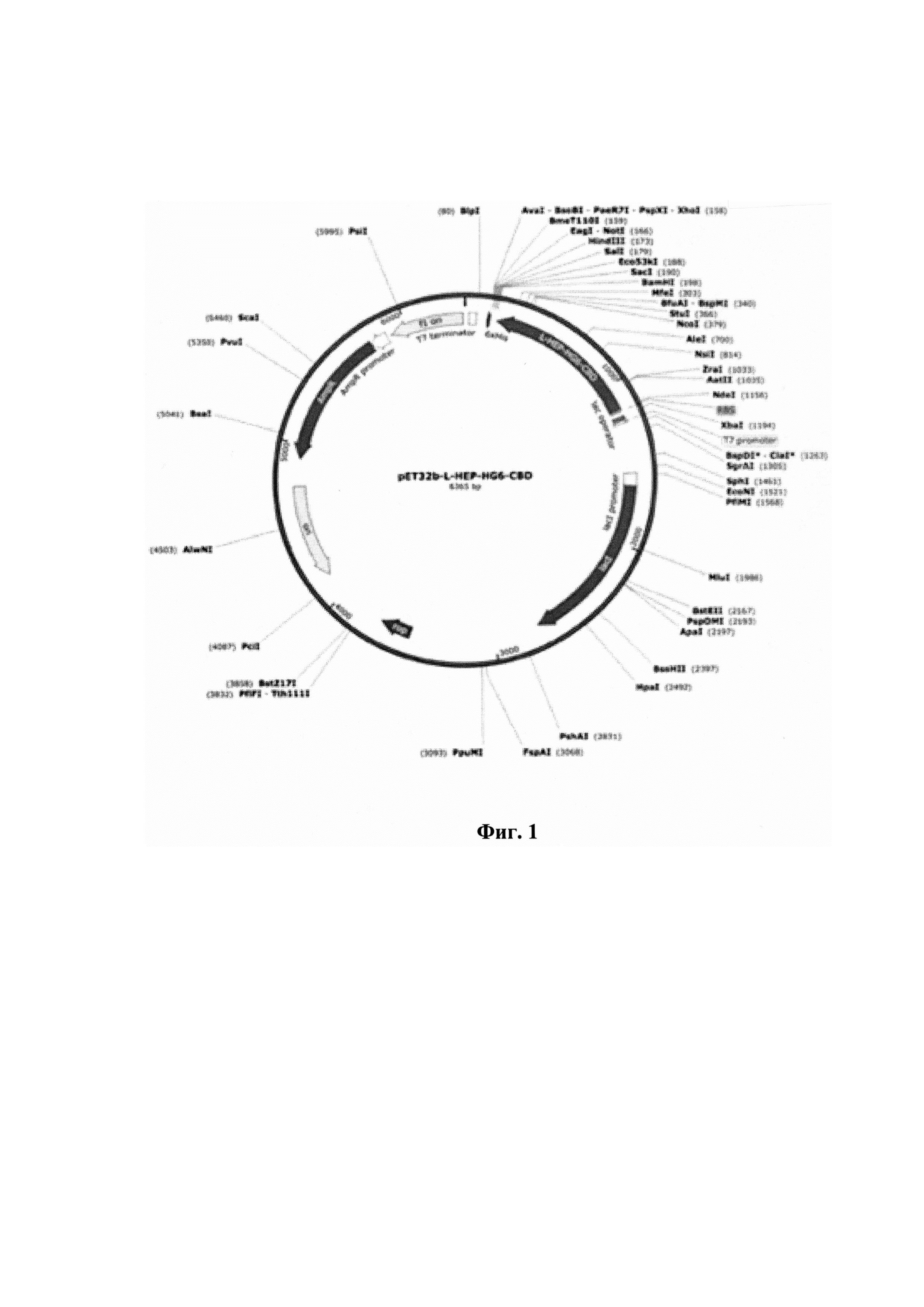
Фигура 1. Карта плазмиды; обозначения:
f1 ori - ориджин репликации бактериофага f1,
AmpR - ген резистентности к ампициллину (ген β-лактамазы),
ori - ориджин репликации colE1,
lacI - ген репрессора лактозного оперона,
T7 promoter - промотор бактериофага T7,
TrxA - ген тиоредоксина E. Coli,
L-HEP-HG6-CBD - ген рекомбинантного белка энтерокиназы человека с гексагистидиновой и хитин-связывающими последовательностями,
enterokinase site - сайт распознавания нтерокиназы человека,
T7 terminator - терминатор бактериофага T7.
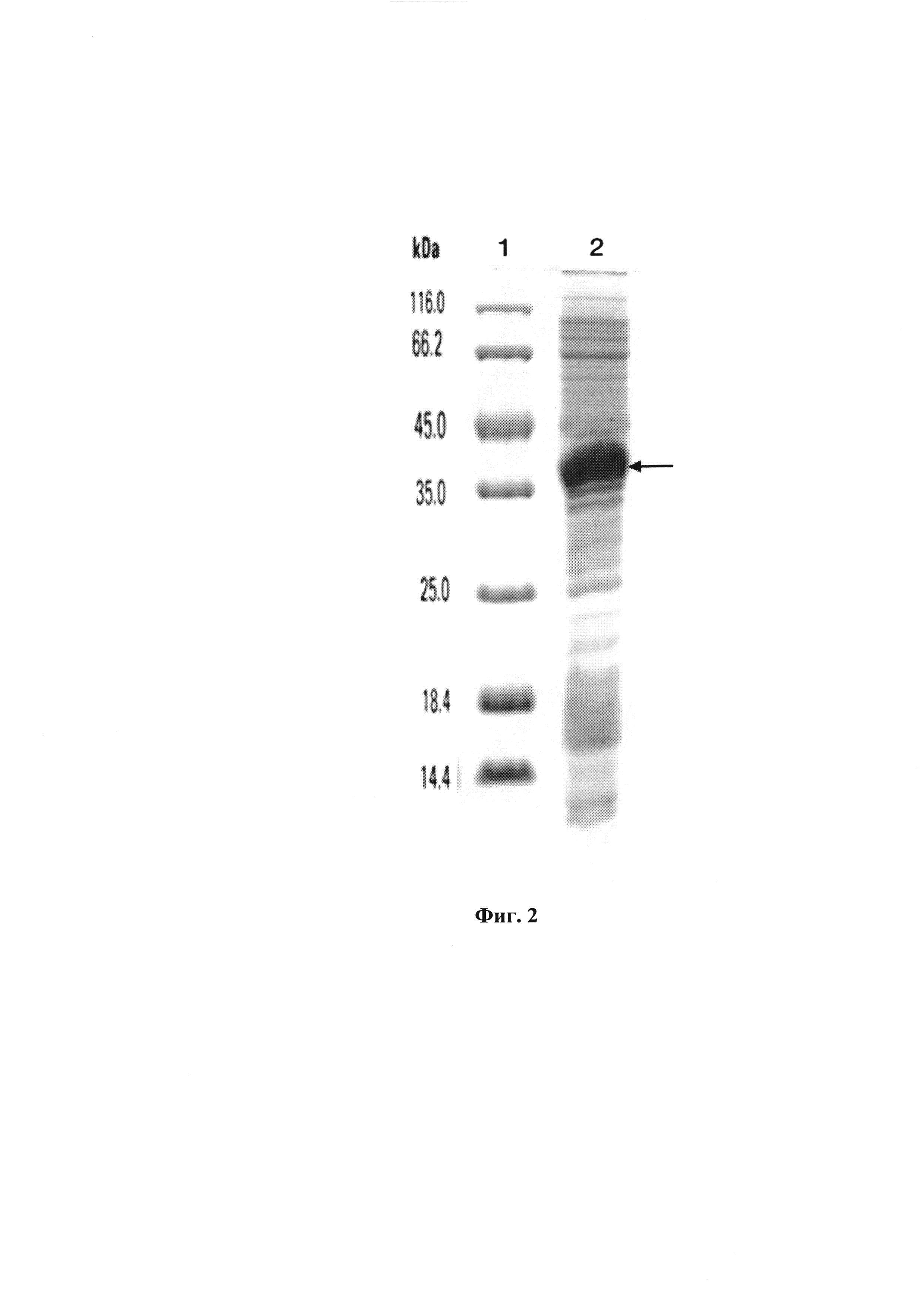
Фигура 2. Электрофореграмма лизата клеток штамма-продуцента E.coli BL21 (DE3) /L-HEP-HG6-CBD.
Фигура 3. Электрофореграмма расщепления гибридного белка интерферона.
Дорожка геля 1: Гибридный белое интерферона.
Дорожка геля 2: Расщепление гибридного белка интерферона иммобилизованным L-HEP-HG6-CBD.
Осуществление изобретения
Осуществление заявляемого изобретения иллюстрируется приведенными ниже примерами 1 – 4.
Пример 1. Конструирование экспрессионной плазмиды
Химический синтез олигонуклеотидов выполняют твердофазным фосфоамидитным методом на ДНК-синтезаторе ASM-102U (БИОССЕТ, Новосибирск) с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфамидитов – 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-O-(β-цианэтил-диизопропиламино)-фосфитов, активированных тетразолом. Синтез проводят в масштабе 0,5-0,7 мкмоль, используя в качестве носителя пористое стекло (размер пор 500 Å), к которому через 3'-сукцинатную связь присоединяют первое нуклеозидное звено (нагрузка 20-30 мкмоль/г). Используют синтетический цикл стандартного фосфоамидитного метода.
Для приготовления вектора ДНК плазмиды pET32b (3 мкг, 1 пмоль) обрабатывают в 40 мкл буфера 10 мМ Трис-HCl, 5 мМ MgCl2, 50 мМ ацетатат калия, 100 мМ KCl, 0.02% Triton X-100, 100 мкг/мл БСА рестриктазой BamHI (10 ед. акт.), а затем - в 40 мкл буфера 100 мМ NaCl, 50 мМ Трис-HCl, 10 мМ MgCl2, 100 мкг/мл БСА рестриктазой NdeI (10 ед. акт.) в течение 1 ч при 37°С. Векторный фрагмент после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT , растворяют при 50°С в течении 5-10 мин и наносят на колонку NucleoSpinExtractII . Промывают буфером NT 3 и элюируют 50 мкл буфера NE.
Олигонуклеотидную последовательность SEQ ID NO 5, кодирующую гибридный белок SEQ ID NO 3, получают полным нуклеотидным синтезом. Полученный синтетическую последовательность SEQ ID NO 5 обрабатывают в 40 мкл буфера 10 мМ Трис-HCl, 5 мМ MgCl2, 50 мМ ацетатат калия, 100 мМ KCl, 0.02% Triton X-100, 100 мкг/мл БСА рестриктазой BamHI (10 ед. акт.), а затем - в 40 мкл буфера 100 мМ NaCl, 50 мМ Трис-HCl, 10 мМ MgCl2, 100 мкг/мл БСА рестриктазой NdeI (10 ед.акт.) в течение 1 ч при 37°С. Синтетический фрагмент после электрофореза в 15% агарозном геле вырезают из геля и переносят в 200 мкл буфера NT, растворяют при 50°С в течение 5-10 мин и наносят на колонку NucleoSpinExtractII. Промывают буфером NT 3 и элюируют 50 мкл буфера NE.
Описанный выше полученный синтетический фрагмент в количестве 2 пмоль прибавляют к раствору 1 мкг, полученного из ДНК лазмиды pET32b, описанного выше векторного фрагмента в 10 мкл буфера (20 мМ трис-HCl, рН 7,56, 10 мМ MgCl2, 0,2 мМ rATP, 10 мМ дитиотреитол) и лигируют с помощью 10 ед. акт. Т4-ДНК-лигазы в течение 12 ч при 10°С.
Помещают на лёд пробирки с компетентными клетками (XL1-Blue, Евроген) до полного размораживания содержимого из расчёта одна пробирка на трансформацию. Аккуратно перемешивают суспензию клеток легким встряхиванием. Добавляют в каждую пробирку плазмидную ДНК, полученную в примере 1, аккуратно перемешивают содержимое легким встряхиванием. Инкубируют пробирки во льду в течение 20-30 мин. Переносят пробирки в водяную баню (42°C) на 30-45 сек. Быстро переносят пробирки из водяной бани в лёд и инкубируют в течение 3—5 мин. Добавляют не менее 3-х объёмов предварительно подогретой до 37-42°C среды SOB или SOC (Becton Dickinson), перемешивают содержимое и инкубируют при 37°C в течение 40-60 мин в орбитальном шейкере-инкубаторе (Multitron, Infors) при скорости 225-250 об/мин. Высеивают содержимое пробирок на чашки Петри диамтером 60 мм (Перинт).
Аликвоту полученной после обработки Т4-ДНК-лигазой реакционной смеси используют для трансформации компетентных клеток Е.coli BL21 (DE3). Трансформанты высевают на чашки с агаризованной средой LB, в которую добавляют ампициллин до конечной концентрации ампициллина 50 мкг/мл. Из клонов выделяют ДНК плазмиды L-HEP-HG6-CBD. Скрининг рекомбинантов проводят с помощью секвенирования.
Пример 2. Получение штамма-продуцента Е.coli BL21 (DE3)/L-HEP-HG6-CBD и характеристика его продуктивности.
Штамм-продуцент Е.coli BL21 (DE3)/L-HEP-HG6-CBD получают трансформацией компетентных клеток Е.coli BL21 (DE3) плазмидой, получение которой описано в примере 1.
Штамм-продуцент Е.coli BL21 (DE3)/ pET32b-L-HEP-HG6-CBD культивируют при 37°С в 100 мл жидкой питательной среды LB с добавкой ампициллина до конечной концентрации ампициллина 100 мкг/мл в течение 3 ч в колбах Ерленмейера (1л, Corning) в орбитальном шейкере-инкубаторе со скоростью вращения 220 об/мин до достижения оптической плотности культуральной жидкости при длине волны 600 нм 0,7-0,8 ед. Затем осуществляют индукцию биосинтеза рекомбинантного белка прибавлением изопропил-β-D-1-тиогалактоприанозида до конечной концентрации изопропил-β-D-1-тиогалактоприанозида 0,5 мМ и инкубируют в течение 4 ч. Каждый час отбирают пробу по 2 мл, количество культуры, соответствующее 1 мл, центрифугируют в течение 10 мин при 6000 об/мин. Осаждённые клетки переносят в 100 мкл лизирующего буфера с красителем бромфеноловым синим, с добавлением 2-меркаптоэтонола, инкубируют 5 мин при 98°С, аликвоты по 3 мкл используют для электрофореза в 14% SDS-ПААГ. Гель окрашивают добавлением 0,1% раствора Кумасси R-250 и сканируют с помощью денситометра Shimadzu CS-930. Результаты представлены на Фиг. 2. М — стандарт молекулярных масс, С - лизат клеток.
Пример 3. Получение рекомбинантного белка L-HEP-HG6-CBD.
После окончания культивирования по примеру 3 клетки продуцента рекомбинантного белка (биомассу) отделяют центрифугированием (5000 g, 20 мин, 4°С), разрушают на ультразвуковом дезинтеграторе (Elma) в буферном растворе (50 мМ Tрис/HCl, 10 мМ ЭДТА, рН 8) и отделяют тела включения центрифугированием (15000 g, 45 мин). Тела включения экстрагируют в буфере (50 мМ Тris pH11 8M Urea). Солюбилизированый белок наносят на металл-хелатный сорбент (Profinity IMAC, Ni-charged, Bio-Rad) и элюируют белок ступенью буферного раствора 0,250 M имидазол, 0,025 мМ Трис, 6 M мочевина, 0,1 M NaCl, pH 8 и ренатурируют при 22°С в течение 18 ч в буферном растворе 50мМ Трис, 20% глицерин, рН 10. Пробы по 40 мкл используют для электрофореза в 15% SDS-ПААГ. Гель окрашивают кумасси R-250 по стандартной методике и сканируют с помощью денситометра Shimadzu CS-930.
Пример 4. Иммобилизация рекомбинантного белка L-HEP-HG6-CBD и проверка его каталитической активности.
Иммобилизацию проводили на хитиновом носителе компании NEB.
Ренатурат очищенного L-HEP-HG6-CBD с концентрацией 1 мг/мл наносили на уравновешенный носитель буферным раствором 50 мМ Трис/HCl, 0,1 М NaCl, рН 8. Далее уравновешивали колонну буфером 50мМ Трис/HCl, 0,1 М NaCl, 2 М мочевина, рН 8. После ещё раз уравновешивали буфером 50мМ Трис/HCl, 0,1 М NaCl, рН 8.
Проверку каталитической активности проводили на гибридном белке, состоящем из тиоредоксина, сайта расщепления энтеропептидазы и интерферона. К 500 мкл буферного раствора (50мМ Трис/HCl 0,2М хлорид натрия, рН 8) с гибридным белком в концентрации 5 мг/мл добавили 40 мкл хитинового носителя с иммобилизованным L-HEP-HG6-CBD. Через 1 час реакции брали пробу, которую анализировали методом электрофореза в полиакрилаимдном геле. Эксперимент повторяли 5 раз. Результаты представлены на Фиг. 3. Расщеплению подвергается не меньше 90% гибридного белка, что свидетельствует об каталитической активности иммобилизирошванного L-HEP-HG6-CBD не менее 30000 МЕ/мг.
Таким образом, результаты проведенных исследований подтверждают получение рекомбинантного белка, обладающего высокой каталитической активностью, которая сохраняется на протяжении нескольких производственных циклов при иммобилизации.