Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРСОДЕРЖАЩЕЙ КОМПОЗИЦИИ СИЛИБИНА
Вид РИД
Изобретение
Область техники
Изобретение относится к фармацевтической технологии и представляет собой способ получения полимерсодержащей композиции в виде лиофилизата, состоящей из активного компонента - силибина и вспомогательных компонентов - сополимера молочной и гликолевой кислот, поливинилового спирта, хлорида натрия. Основная область применения - фармакологическая коррекция функции печени на фоне токсических поражений.
Уровень техники
Природный силибин (или силибинин) является основным биологически активным компонентом силимарина - экстракта семян расторопши (Silibum marianum L. Gaertn) и представляет собой смесь транс-диастереоизомеров А и В [1, 2].
Силимарин составляет 1.5-3% от сухого веса плодов расторопши и является в основном смесью различных флавоноидоподобных соединений - флавонолигнанов. В силимарине, наряду с силибином, присутствуют флавонолигнаны изосилибин, силихристин, изосилихристин, силидианин и силимонин. В химический состав плодов расторопши входят также флавоноиды таксифолин, кверцетин, дигидрокемпферол, кемпферол, апигенин, нарингин, эриодиктиол и хризоэриол. Содержатся также 5,7-дигидроксихромон, дигидроконифериловый спирт, нелетучее масло (60% линолевой кислоты; 30% олеиновая кислота; 9% пальмитиновая кислота), токоферол, стерины (холестерин, кампестерол, стигмастерол и ситостерин), сахара (арабиноза, рамноза, ксилоза и глюкоза) и белки. Однако, самое высокое содержание в экстракте у силибина (примерно 50-70%). Обычно в фармацевтических продуктах, содержащих силимарин, концентрация силибина находится в диапазоне 20-40% [1].
В обзорной статье [2] представлена информация о научных исследованиях эффектов, связанных с использованием силимарина и силибина при хронических заболеваниях печени, циррозе, гепатоцеллюлярной карциноме и др. Отмечается, что антиоксидантное и противовоспалительное действие препаратов направлено, в частности, на снижение вирусных повреждений печени за счет смягчения воспалительного каскада и модуляции иммунной системы.
Антиоксидантное и противовоспалительное действие силибина подтверждено для большинства клеток [3]. Антиоксидантное действие силибина заключается в подавлении образования и связывании некоторых видов радикалов, препятствовании перекисному окислению липидов мембран и пр. Антиоксидантные эффекты силибина обусловлены еще и тем, что он действует как хелатор железа. Основной механизм противовоспалительного действия силибина состоит в ингибировании NF-κВ-каскада. Противовоспалительное действие силибина также связано с его способностью вмешиваться в цитокининдуцированные сигнальные пути и оказывать понижающее регулирующее влияние на экспрессию индуцибельной синтазы оксида азота (iNOS) и др. факторами.
В исследовании in vitro с использованием модели фиброгенеза в печени человека [3] силибин продемонстрировал прямые и непрямые антифибротические свойства. Было показано, что силибин способен ингибировать сериновые протеазы, участвующие в процессе свертывания крови, а также снижать реакцию тромбоцитов на физиологические агонисты [1].
Силибин проявляет прямой противовирусный эффект [2-4], в частности, в концентрации 20 мкмоль/л он подавлял экспрессию и репликацию вируса гепатита С (HCV) в инфицированных полиморфоядерных клетках, полученных от пациентов с хронической HCV-инфекцией [3].
Силибин продемонстрировал химиопрофилактические свойства против многих типов рака. В обзоре [5] обобщены достижения в понимании молекулярных механизмов силибинин-индуцированного апоптоза при различных типах рака, в частности, рака молочной железы, мочевого пузыря, шейки матки, толстой кишки, легких, яичников, простаты, кожи.
Известны также и другие фармакологические свойства силибина [1-3].
Силибин является одним из наиболее изученных флавонолигнанов, многие его химические и физические характеристики представлены в обзоре [6]. В частности, отмечается, что силибин плохо растворим в полярных протонных растворителях (метанол, этанол) и нерастворим в неполярных растворителях (хлороформ, петролейный эфир). Однако, в полярных апротонных растворителях (ацетон, диметилформамид, тетрагидрофуран) силибин растворим. Растворимость силибина в воде низкая, но увеличивается с ростом температуры и значением рН среды. Например, при 25°С и рН 6.15 растворимость силибина составляет около 55 мг/л [6, 7].
Низкая биодоступность силибина, а также плохое всасывание в кишечнике во многом обусловлено его незначительной растворимостью в воде. Для увеличения растворимости в водных средах разрабатываются микронизированные лекарственные формы силибина/силимарина, в том числе с использованием биосовместимых полимеров, фосфолипидов, липосом, дендримеров и пр. [8]. Проводится изучение действия новых препаратов in vitro и in vivo.
В публикации [9] представлены данные по получению различных форм микрочастиц силибина методом эмульсионной диффузии растворителя (EDS) и сравнению растворимости микрочастиц с коммерческим препаратом. В приведенной методике профильтрованный через мембранный фильтр 0.45 мкм раствор силибина в ацетоне (концентрация 20 мг/мл) в количестве 10 мл прибавляли к 100 мл деионизированной воды, содержащей 0.01-0.10% додецилсульфата натрия (SDS), при перемешивании на магнитной мешалке (1000 об/мин). Опалесцирующий раствор перемешивали 1 мин и выдерживали в течение примерно 6-10 мин, пока прозрачные капли эмульсии не превращались в непрозрачные частицы. Затвердевшие частицы выделяли фильтрованием и промывали деионизированной водой. Профильтрованную пасту сушили при 60°С в течение 12 ч. Получались равномерные сферические и стержнеобразные частицы со средним размером 2.48 и 0.89 мкм при 30 и 15°С, соответственно. Испытания на растворение показали, что обе (сферическая и стержневидная) формы частиц силибина проявляют существенно большую скорость растворения по сравнению с коммерческим порошком силибина. Через 120 мин было растворено 81.1% сферического силибина и 93.1% стержневидного силибина соответственно, и только 22.8% коммерческого препарата. Увеличение скоростей растворения полученных продуктов в основном связано с гораздо более высокой их однородностью, уменьшением кристалличности, уменьшением размера частиц, увеличением площади поверхности и улучшением дисперсности частиц. Полученные данные позволяют преодолевать низкую растворимость силибина в воде (0.4 мг/мл) и повысить его биодоступность.
В работе [10] наносуспензии силибина получались методом гомогенизации под высоким давлением (НРН) с последующим использованием метода сублимационной сушки. Первоначально порошок силибина (1% мас/об) диспергировали в водном растворе поверхностно-активного вещества, содержащем 0.1% (мас/об) полоксамера 188, 0.2% (мас/об) лецитина и 0.1% (мас/об) гидроксипропил-метилцеллюлозы (НРМС) при перемешивании на магнитной мешалке. Предварительное смешивание проводилось погружным гомогенизатором Ultra-Turrax® Т25 (IKA) при 15000 об/мин в течение 2 мин. Суспензии дополнительно были пропущены через гомогенизатор высокого давления EmulsiFlex-C3 (Avestin Inc.), оснащенный теплообменником, с применением 5 циклов гомогенизации при 500 бар, а затем 15 циклов гомогенизации при 800 бар для наносуспензий силибина A (SN-A) или при 1800 бар для наносуспензий силибина В (SN-B). Полученные составы наносуспензий показали узкое распределение размеров частиц (637±9.4) нм и (132±4.8) нм для SN-A и SN-B соответственно. Частицы имели дзета-потенциал от минус 22 до минус 25 мВ. Индексы полидисперсности (PdI) двух составов наносуспензий были менее 0.3, что свидетельствует об удовлетворительном распределении частиц по размерам. Изучение биораспределения полимерных композиций силибина на мышах и фармакодинамические исследования на собаках показали, что частицы большего размера преимущественно накапливались в печени и селезенке. Наносуспензии силибина, вводимые внутривенно или перорально, оказывали значительный (р≤0.05) гепатопротекторный эффект за счет снижения уровня сывороточных маркерных ферментов, таких как аспартатаминотрансфераза (ACT), аланинаминотрансфераза (АЛТ), щелочная фосфатаза, билирубин общий и гамма-глютамилтранспептидаза. Гистопатологическое патоморфологическое исследование дополнительно подтвердило гепатопротекторную активность двух наносуспензионных препаратов силибина по сравнению с контрольной группой, получавшей четыреххлористый углерод. Представленные результаты демонстрируют, что силибин в форме наносуспензий имеет более высокую терапевтическую эффективность за счет повышения его биодоступности. Характер распределения наносуспензий силибина в живом организме с выраженным накоплением в печени позволяет в полной мере использовать его гепатопротективное действие.
В исследовании [4] частицы с силибином (SB-NPs) были получены методом наноэмульгирования с гидрофильным поливинилпирролидоном (PVP) в качестве носителя. Массовое соотношение силибина к PVP составляло 1:1. Силибин диспергировали в 20%-ном растворе этанола, содержащем PVP, затем гомогенизировали при 22000 об/мин в течение 30 мин с использованием гомогенизатора Polytron РТ 2100 (Kinematica AG, Littau/Luzern, Switzerland). Удаление этанола после гомогенизации проводили на роторном вакуумном испарителе. Оставшуюся часть пропускали через качественную фильтровальную бумагу Advantec No. 1 (Toyo Roshi Kaisha, Tokyo, Japan) для удаления агрегатов, хранили при 4°С до получения характеристик. Для длительного хранения, а также испытаний in vitro и in vivo продукт лиофилизировали и хранили при температуре минус 20°С. Композиция SB-NPs состояла из наноразмерных сферических частиц размером (166.1±5.5) нм, с индексом полидисперсности 0.228±0.024 и эффективностью инкапсуляции силибина (97.50±0.01) %. В тесте растворения при рН 7.4 была выявлена значительно улучшенная растворимость, достигая более 75% высвобождения свободного силибинина в течение 20 мин после ресуспендирования по сравнению с необработанным силибинином, который оставался в значительной степени нерастворенным. Высвобождение свободного силибинина при рН 1.2 не наблюдалось ни в контрольном, ни в наноэмульсионном препаратах. Лечение частицами SB-NPs эффективно ограничивало межклеточную передачу вируса по сравнению с контролем и раствором силибина в ДМСО. Кроме того, частицы SB-NPs оказывали антиоксидантное действие благодаря своей функции очистки от свободных радикалов. Пероральное введение частиц SB-NPs грызунам не вызывало явной токсичности in vivo, фармакокинетические исследования выявили повышенный уровень силибина в сыворотке и превосходное биораспределение в печени по сравнению с немодифицированным силибином. Наконец, частицы SB-NPs эффективно снижали HCV-инфекцию первичных гепатоцитов человека.
В статье [11] представлены результаты получения PLGA-полимерных частиц (85:15), нагруженных силибином, имеющих монодисперсные размеры. Использовались готовые формы из полиэтилентерефталатных (PET) листов, покрытые поливиниловым спиртом (PVA), полученные по специальной технологии. На них наносилась в виде тонкой пленки суспензия силибина и PLGA в хлороформе. Растворитель испарялся, PET-листы с пленкой подвергали тепловой обработке при 130°С с помощью специальной пресс-формы. Избыток PVA удаляли промывкой водой. Полимерные частицы выделяли с помощью фильтрации. Эффективность включения силибина составила 88%, средний диаметр - 223 нм, дзета-потенциал - минус 25 мВ, индекс полидисперсности - 0.194±0.016. Изучалась фармакокинетика полимерных композиций силибина в сравнении с суспензией чистого силибина на мышах с ксенотрансплантантами карциномы яичников человека линии SKOV-3. Концентрацию силибина определяли в опухоли, плазме, легких, селезенке и печени. Результаты изучения фармакокинетических параметров и анализ данных о пероральной биодоступности показали, что силибин в составе наночастиц имеет более выраженную пероральную абсорбцию, и является предпочтительным для достижения большей абсорбции в верхних отделах желудочно-кишечного тракта (ЖКТ).
В работе [12] использовалась методика диффузии органического растворителя в водную фазу (нанопреципитация). Раствор 10 мг силибина и 50 мг PLGA 50/50 в 3 мл ацетона с помощью шприцевого насоса дозировали со скоростью 15 мкл/с в 30 мл водного раствора, содержащего 1% мас/об плюроника F-127 при перемешивании на магнитной мешалке. Растворитель упаривали при перемешивании смеси еще в течение 12 часов. В результате получались частицы со средним гидродинамическим диаметром 229.7 нм, индексом полидисперсности 0.124 и дзета-потенциалом +21 мВ. Эффективность включения силибина в частицы составляла 92.11%. Полученную полимерную композицию силибина с PLGA, а также чистый силибин, впервые использовали для оценки влияния in vivo в экспериментальных условиях диабета крыс. Здоровье животных значительно восстановилось, а уровень глюкозы в крови снизился до почти нормальных значений после 28-дневного графика лечения с помощью разработанных наночастиц. Было прослежено восстановление уровня сывороточного инсулина от состояния гипергликемического повреждения до исходных значений. Уровень инсулина в сыворотке крови восстанавливался после повреждения поджелудочной железы, индуцированного стрептозотоцином, от уровня (0.17±0.01) до (0.57±0.11) мкг/л после лечения наночастицами.
В статье [13] представлено исследование по получению однородных по размеру микросфер из сополимера молочной и гликолевой кислоты (PLGA), нагруженных силибином, которое проводилось методом эмульгирования (экструзии) с помощью мембраны из нержавеющей стали. Условия приготовления полимерной композиции были оптимизированы с использованием однофакторного теста и ортогонального эксперимента при контроле средних диаметров, распределения частиц по размерам, загрузки лекарственного средства, эффективности захвата и морфологии микросфер. Полученные микросферы были круглыми, поверхность гладкой. Средний диаметр (4.961±0.56) мкм. Величина (Х90-Х10)/Х50 (span) составляла 1.75±0.18. Эффективность включения силибина равнялась (54.997±4.05) %, а среднее содержание препарата (23.6±1.70) %. Средние диаметры получаемых в публикации PLGA-микросфер, содержащих силибин, могут контролироваться на определенном уровне. Подобный метод эмульгирования имеет большой потенциал применения.
В работе [14] описано получение полимерсодержащих композиций силибина на основе сополимеров молочной и гликолевой кислот (PLGA 50/50, PLGA 75/25, PLGA-COOH 50/50), а также полимолочной кислоты (PLA) методом нанопреципитации и последующей обработкой смеси с помощью погружного или ультразвукового гомогенизаторов. Раствор смеси силибина и полимера при массовом соотношении 1:5 (или 1:10) в органическом растворителе (ацетон, ацетон-метанол 3:2 об/об, ДМСО) по каплям добавляли к водному раствору поливинилового спирта (0.5, 1 или 2%) при соотношении органической и водной фаз 1:5 (или 1:10) об/об. Смесь перемешивали в течение 30 мин. Далее проводили гомогенизацию смеси с использованием гомогенизаторов (погружного, либо ультразвукового). Растворитель удаляли в вакууме с помощью роторного испарителя (при 35°С около 40 мин). Полученную водную суспензию полимерных частиц центрифугировали при 14 тыс. об/мин и 4°С в течение 30 мин. После центрифугирования отбирали надосадочную жидкость. Осадок ресуспендировали в дистиллированной воде с использованием погружного гомогенизатора. Затем суспензию частиц пропускали через стеклянный пористый фильтр (47-111 мкм). К фильтрату добавляли D-маннит (10% масс). Смесь замораживали с использованием жидкого азота и лиофилизировали. Полученные композиции силибина представляли собой лиофилизаты с полимерными частицами. Общее содержание силибина в композициях - от 4 до 11% масс., средний размер частиц (после ресуспендирования в воде) - от 90 до 420 нм, степень включения силибина составляла от 15 до 63%; дзета-потенциал - от минус 15 до минус 26 мВ. В экспериментах in vitro на клетках гепатомы человека HepG2 для полимерных композиций силибина было отмечено увеличение гепатопротекторной активности (в 1.5-2 раза) по сравнению с субстанцией силибина.
В патенте [15] описаны способы получения комплексов включения силибинина (силибина) и различных циклодекстринов при молярном соотношении от 1:1 до 1:2.75 в воде при рН>7. По одному из примеров получения комплексов 10 г (0.019 моль) силибинина суспендировали в 200 мл деионизированной воды и при перемешивании на магнитной мешалке прикапывали 75 мл 35% раствора гидроксида аммония в течение 10 мин. Затем одной порцией добавляли 24.78 г (0.019 моль) β-циклодекстрина (влажность 13% по методу Фишера). Перемешивание продолжали 35 мин, затем отгоняли воду под вакуумом при температуре 50°С. Образовавшийся продукт дважды промывали ацетоном (30 мл) и сушили с получением 24.6 г светло-желтого твердого продукта, растворимого в воде. Рентгеноструктурный анализ показал характерные пики, соответствующие комплексу силибинин-β-циклодекстрин (1:1), температура плавления 250°С. УФ (макс.) 287 нм (СН3ОН). Опыты по изучению освобождения (вывода) силибинина из комплекса с β-циклодекстрином (1:1) были выполнены согласно фармакопее США (USP 22) при рН 7.5 и 37°С. Показано, что вывод (растворимость) комплекса составляет 96% в сравнении с 0% для силибинина и 53% - с общим выводом силимарина (что соответствует 37.1% силибинина). Представлены также примеры получения лекарственных составов, содержащих комплексы силибина и циклодектринов как активных компонентов. Некоторые лекарственные составы изучались на крысах линии Wistar при внутрижелудочном введении в сравнении со свободным силибином и силимарином. Полученные данные показали, что комплекс эффективнее абсорбируется, чем свободный силибин и силимарин.
Следует отметить, что в большинстве публикаций посвященных разработке полимерсодержащих композиций различных терапевтических агентов, предназначенных для перорального применения, фигурируют полимерные частицы размером от 100 до 1000 нм. Наиболее предпочтительный диапазон - от 200 до 400 нм [16-18]. Показано что полимерные частицы таких размеров эффективно подвергаются абсорбции и транспорту через слизистую оболочку желудочно-кишечного тракта. Возможно несколько путей абсорбции полимерных частиц из ЖКТ в кровь: в результате захвата эпителиальными клетками, выстилающими кишечник (энтероцитами); в результате трансцитоза, опосредованного М-клетками кишечника; путем поглощения через Пейеровы бляшки. Эффективность абсорбции также во многом зависит от вида полимерной основы частиц. Для полилактидгликолидных частиц показано, что они обладают высокими биоадгезивными свойствами и способствуют абсорбции связанных с ними лекарственных веществ из ЖКТ в кровь [19]. Использование полимерных частиц особенно эффективно в случае трудно растворимых лекарственных веществ с низкой биодоступностью [20]. При их пероральном введении в составе полимерных частиц увеличивается абсолютная биодоступность и происходит оптимизация биораспределения.
Так в патенте [21] описаны способы получения наночастиц силимарина и сополимера молочной и гликолевой кислот (PLGA) методом нанопреципитации. По одному из примеров раствор 0.7511 г силимарина и 0.7543 г PLGA в 10 мл ацетона при 20-40°С и высокоскоростном перемешивании медленно прикапывали (или распыляли в объеме) к раствору 3.1025 г поливинилового спирта в 60 мл сверхчистой воды. После завершения добавления перемешивание продолжали примерно 120 мин. Ацетон удаляли с помощью роторного испарителя на водяной бане при 50°С. Коллоидный раствор силимариновых PLGA-наночастиц центрифугировали при 12 тыс. об/мин (до 10 мин). Добавляли 6 г D-маннита, подвергали сублимационной сушке для получения наночастиц силимарина с PLGA. Размер полученных частиц составлял около 200 нм. По результатам перорального введения наночастиц крысам отмечены увеличение относительной биодоступности силимарина до 146% и его содержания в печени в 1.59 раза по сравнению с контрольным препаратом.
В патенте [22] приведен модифицированный вариант получения полимерных наночастиц, содержащих силимарин и PLGA, методом нанопреципитации. Отличие данного метода от представленного в патенте CN 105477039 А [21], заключается в добавлении фталата гидроксипропилметилцеллюлозы (НР55), предварительно растворенного в ацетоне, к водно-ацетоновому раствору силимарина и PLGA. Кроме того, после окончания добавления органической фазы к водному раствору PVA доводили значение рН до 4-8, затем перемешивали в течение 10-120 минут. Ацетон удаляли на роторном испарителе. К полученному коллоидному раствору добавляли D-маннит и проводили лиофилизацию. Изменения в технологии позволили увеличить эффективность включения силимарина в PLGA наночастицы. Размер полученных частиц не приводится. По результатам перорального введения наночастиц крысам отмечены увеличение относительной биодоступности силимарина до 152% и его содержания в печени в 1.63 раза по сравнению с контрольным препаратом.
В опубликованной заявке на патент США [23] приведено получение полимерных частиц силибинина (SBN) и PLGA методом преципитации. По представленной методике 40 мг PLGA (50:50 сополимер молочной и гликолевой кислот, мол. вес 7-17 кДа) и 4 или 12 мг SBN были растворены в 2 мл или в 1.9 мл ацетона с добавлением 100 мкл диметилсульфоксида (DMSO), для достижения 15 или 30% масс. соотношений загрузок соответственно. Полученный раствор гомогенизировали в течение 5 мин и затем медленно прикапывали к 2% водному раствору PVA. Для удаления органической фазы смесь оставляли перемешиваться на ночь при скорости 500 об/мин. Полимерные частицы собирали ультрацентрифугированием при 72000×g в течение 15 мин при 4°С, промывали три раза депонированной водой и снова проводили ультрацентрифугирование. Собранные очищенные частицы были лиофилизированы. Изучались свойства и гепатопротекторная активность SBN-нагруженных PLGA частиц (PLGA-SBN). Поскольку эффективность инкапсуляции силибинина в полимерные частицы была оптимизирована изменением условий получения (т.е. начальной концентрации SBN), это привело к двум составам с SBN: 15% и 30% общего веса PLGA-SBN частиц. Точного размера полученных частиц в заявке на патент не указано, приведен лишь диапазон - от 50 нм до 10 мкм, что говорит о том, что это могут быть наночастицы, микрочастицы или их смесь. Изучение релиза SBN из частиц в фосфатно-солевом буферном растворе (PBS) показало, что высвобождается силибинин медленно. Через 7 дней из частиц PLGA-SBN выделялось около 8% силибинина. Было установлено, что при проведении химиотерапии дакарбазином (DTIC) мышам с меланомой B16-F1 предварительное введение PLGA-SBN частиц усиливало активность АЛТ и концентрацию билирубина в большей степени, по сравнению с использованием свободного SBN. Морфологический анализ тканей печени после проведенной химиотерапии показал, что PLGA-SBN частицы эффективно смягчали такое патологическое изменение как мононуклеальная инфильтрация синусоид, которая является предпосылкой окклюзии вен - заболевания, считающегося наиболее опасным гепатотоксическим побочным эффектом, вызванным химиотерапией DTIC, по сравнению с группами со свободным SBN и без предварительного введения PLGA-SBN частиц. Кроме того, предварительное введение PLGA-SBN частиц также полностью предотвращало вызванный DTIC холестаз и очаговый некроз гепатоцитов.
В некоторых приведенных выше литературных источниках при получении полимерсодержащих композиций силибина/силимарина фигурируют примеры с использованием биодеградируемых сополимеров молочной и гликолевой кислот, которые разрешены при производстве лекарств и широко используются. В испытаниях in vitro и in vivo полученные композиции показали более высокую гепатопротекторную активность по сравнению со свободными силибином и силимарином.
В работах [24, 25] при получении наночастиц силибина в качестве полимера был использован поли-ε-капролактон, применялся метод эмульгирования с упариванием растворителя. Силибин (100 мг) и полимер (100, 200, 300 или 400 мг) растворялись в 15 мл дихлорметана путем встряхивания. Смесь (органическая фаза) добавлялась по каплям к 50 мл 2% раствора поливинилового спирта под воздействием ультразвука при 40 Вт в течение 10 мин. Полученная эмульсия помещалась на магнитную мешалку для полного испарения дихлорметана с образованием суспензии наночастиц. Ее центрифугировали при 10000 об/мин в течение 20 мин, что приводило к образованию осадка на дне пробирки. Его промывали раствором PBS, снова суспендировали и центрифугировали. Осадок собирали, давали ему полностью высохнуть. Порошкообразные частицы взвешивались и использовались для дальнейшего изучения. Средний диаметр частиц был 216 нм, индекс полидисперсности (PdI) равнялся 0.193±0.026. Дзета-потенциал составлял минус 15 мВ, что достаточно высоко для образования стабильной поверхности наносуспензии. Содержание действующего вещества было около 15%, эффективность включения - 88%. Изучалось антираковое действие силибина в полимерных наночастицах на модели гепатоцеллюлярной карциномы (НСС) крыс [24]. При пероральном введении полимерные наночастицы с силибином показали повышенную эффективность и безопасность для лечения НСС у крыс по сравнению со свободным силибином.
Аналогами-настоящего изобретения-являются технические решения, известные из статьи [14], а также из патентных документов CN 105477039 [21], CN 105477040 [22] и US 2019/0015335 [23]. В них раскрываются способы получения (нанопреципитация) и составы лиофилизированных наночастиц силибина/силимарина с сополимером PLGA. В качестве основного недостатка способа нанопреципитации следует отметить то, что при его реализации масштабирование технологического процесса оказывается весьма ресурсоемким, так как используются большие объемы водной и неводной (органической) фаз. Полимерные частицы, получаемые методом наноприципитации, обладают недостаточно высокой эффективностью включения (степенью сорбции) активного компонента - менее 70%. Следует отметить также, что часто используются комплексные неводные растворители, некоторые из которых трудноудаляемы из готового продукта, например DMSO, и будут являться нежелательной примесью.
Аналогом настоящего изобретения является также техническое решение, изложенное в статьях [24, 25]. Был использован метод эмульгирования смеси силибина и поли-ε-капролактона, растворенного в дихлорметане (органическая фаза) и 2% водного раствора PVA с помощью ультразвука. Удаление органического растворителя из образовавшейся системы в атмосферу проводилось при интенсивном перемешивании на магнитной мешалке. Недостатком приведенного способа является то, что после ультразвукового воздействия на смесь компонентов образуется не эмульсия типа «масло в воде» (o/w), а сложная система из жидких и твердой фаз, вследствие того, что силибин нерастворим в дихлорметане. (Нерастворим он также в хлороформе и петролейном эфире [6]). Данное обстоятельство может препятствовать масштабированию процесса.
Следовательно, существует необходимость в разработке способа получения композиции силибина методом эмульгирования на основе сополимеров молочной и гликолевой кислот с оптимальными технологическими и физико-химическими характеристиками.
Раскрытие изобретения
Задачей настоящего изобретения является разработка способа получения полимерсодержащей композиции силибина в виде лиофилизата на основе сополимера молочной и гликолевой кислот с использованием метода эмульгирования, который обеспечивает высокую эффективность включения активного вещества в частицы.
Технический результат по предлагаемому способу достигается тем, что при получении неводной (органической) фазы используется смесь двух органических растворителей этилацетат-дихлорметан.
Технический результат заключается в том, что предложен способ получения полимерсодержащей композиции силибина, свободный от недостатков, присущих аналогам, который позволяет получать продукт с высокой эффективностью включения силибина (более 90%), без существенных потерь активного компонента. Получаемый продукт - полимерсодержащая композиция силибина в виде лиофилизата, при смешивании которого с водой образуется суспензия частиц со средним размером 170-400 нм - пригоден для получения лекарственных форм перорального применения при фармакологической коррекции функции печени на фоне токсических поражений.
Для достижения технического результата предложен способ получения полимерсодержащей композиции силибина, характеризующийся тем, что он включает стадии: приготовления раствора силибина и сополимера молочной и гликолевой кислот с молярным соотношением звеньев 50:50 в смеси этилацетат-дихлорметан при массовом соотношении компонентов 1:9-1:10 и объемном соотношении растворителей 2:1-2.5:1 - неводная фаза; смешивания указанного раствора с 0.2-0.3% раствором поливинилового спирта (водная фаза) при объемном соотношении неводной и водной фаз 1:6.8-1:7.2; обработки полученной смеси ультразвуком с образованием эмульсии; добавления к полученной эмульсии 4-5% раствора хлорида натрия при массовом соотношении хлорида натрия к сополимеру 1:2.2-1:2.6, удаления из эмульсии органических растворителей путем упаривания в вакууме с образованием суспензии, фильтрования суспензии; замораживания профильтрованной суспензии и последующей лиофилизацией с получением лиофилизата, при этом компоненты смешивают в количестве, обеспечивающем их содержание в композиции, масс. %:
|
Частицы суспензии получаемого продукта (лиофилизата) в воде имеют средний размер 170-400 нм.
Совокупность приведенных выше существенных признаков приводит к тому, что: предложенный способ позволяет стабильно и с высоким выходом получать продукт, представляющий собой лиофилизат полимерных частиц с содержанием силибина не менее 4% масс.
Краткое описание чертежей
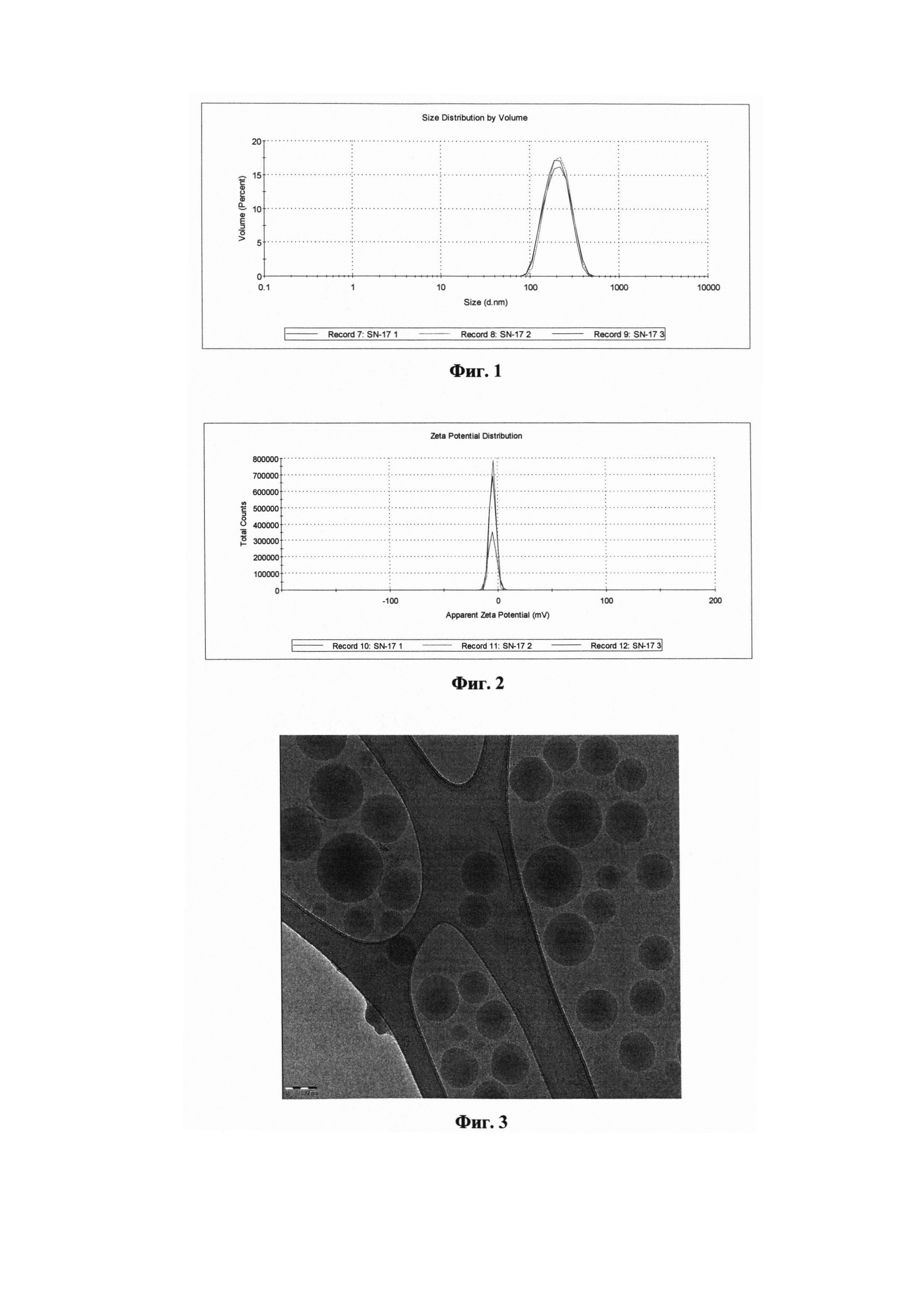
На Фигуре 1 представлено объемное распределение частиц по размерам в водной суспензии образца полимерсодежащей композиции силибина по результатам 3-х измерений. По оси абсцисс - диаметр фракции частиц, нм; по оси ординат - объем фракции, %.
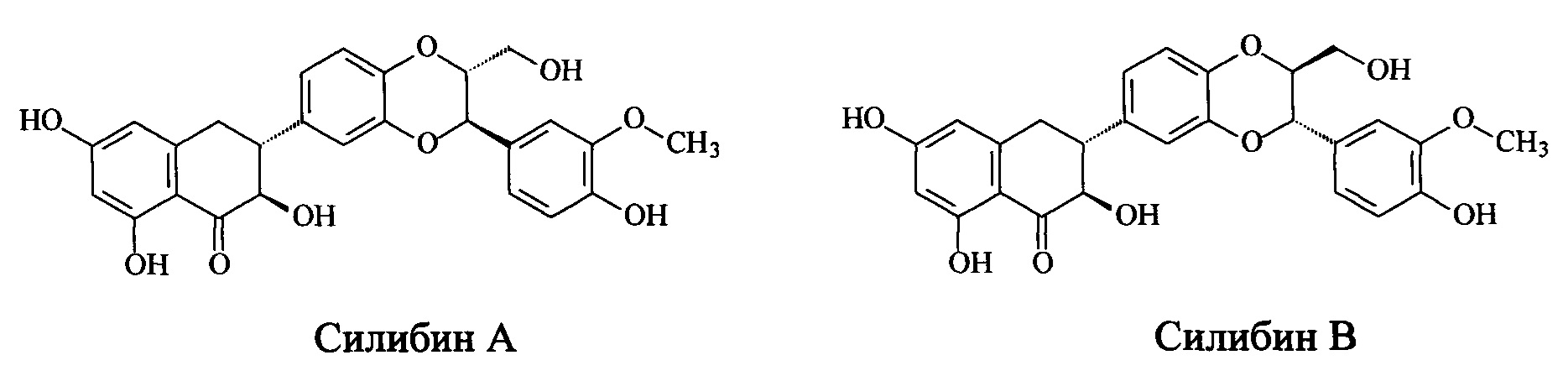
На Фигуре 2 представлено распределение дзета-потенциала частиц в водной суспензии образца полимерсодежащей композиции силибина по результатам 3-х измерений. По оси абсцисс - кажущийся дзета-потенциал, мВ; по оси ординат - общее количество, %.
На Фигуре 3 представлено изображение частиц полимерсодержащей композиции силибина, полученное с помощью просвечивающей электронной криомикроскопии (CryoTEM).
Осуществление и примеры реализации
Для получения заявляемой полимерсодержащей композиции силибина необходимо было разработать ее состав и технологически приемлемый способ получения. Полимер-носитель представляет собой разрешенный к применению при производстве лекарств и коммерчески доступный сополимер молочной и гликолевой кислот (с молярным соотношением полимерных звеньев 50:50), в который включено активное вещество силибин.
Для формирования полимерных частиц применялся известный метод простого (прямого) эмульгирования. В качестве органической (неводной) фазы использовалась смесь растворителей этилацетат-дихлорметан, один из которых - этилацетат - растворяет силибин и растворим в воде (до 7%), а второй - дихлорметан - умеренно растворим в воде (до 2%). При объемном соотношении растворителей этилацетат-дихлорметан в пропорции 2.0-2.5:1 плотность смеси близка к плотности водной фазы (около 1 г/мл), что облегчает образование стабильной эмульсии типа o/w («масло в воде»). При этом в процессе эмульгирования частично происходит растворение органической фазы в водной, что также способствует образованию эмульсии.
Следует отметить, что силибин умеренно растворим в этилацетате при нагревании. Например, для получения 0.06-0.065% раствора достаточен нагрев смеси до 52-55°С. При более низкой температуре полного растворения твердой фазы не происходит, при более высокой температуре заметно усиливается испарение этилацетата. Использование ультразвуковой ванны и перемешивание смеси ускоряет процесс растворения.
Важно также подчеркнуть, что применение смеси органических растворителей этилацетат-дихлорметан, в отличие от чистого этилацетата, по экспериментальным данным препятствовало образованию фракции микрочастиц в готовом продукте.
Таким образом, были подобраны условия, позволяющие получать полимерные частицы с содержанием включенного силибина 4-6% масс. Для достижения этого результата оптимальным оказалось массовое соотношение силибина и полимера 1:9-1:10 и объемное соотношение растворителей 2:1-2.5:1. Для стабилизации эмульсии был использован 0.25% водный раствор поливинилового спирта, в который постепенно вносилась органическая фаза с растворенными в ней компонентами. После смешивания водной и органической фаз проводилась обработка смеси ультразвуком с образованием эмульсии. К полученной эмульсии добавлялся 4-5% водный раствор хлорида натрия при массовом соотношении хлорида натрия к полимеру 1:2.2-1:2.6. Смесь растворителей удалялась из эмульсии упариванием в вакууме с образованием суспензии, которая затем фильтровалась через стеклянный пористый фильтр (10-40 мкм). Фильтрат замораживался и подвергался лиофилизации. Готовый продукт (лиофилизат) помещался на хранение при 4°С.
Применение метода эмульгирования с помощью ультразвука для формирования полимерных частиц позволило получать продукт с высокой эффективностью включения силибина (более 90%), без существенных потерь активного компонента. Использование хлорида натрия позволило добиться хорошей ресуспендируемости полимерных частиц и повышения их стабильности, в том числе при длительном хранении [26]. Дополнительным результатом было улучшение технологических свойств лиофилизата - получаемый продукт стал более удобен с точки зрения дозирования.
Таким образом, условия осуществления описанного выше способа позволяют стабильно и с высоким выходом получать продукт, представляющий собой лиофилизат полимерных частиц с содержанием силибина не менее 4% масс, предназначенный для перорального введения. При добавлении к нему воды и последующем встряхивании образуется суспензия частиц со средним размером от 170 до 400 нм, индексом полидисперсности не более 0.25. Подробное описание способа получения полимерсодержащей композиции силибина представлено ниже в Примере 1. В готовом продукте определялось содержание силибина и эффективность его включения в полимерные частицы (степень сорбции). После ресуспендирования полученной композиции в воде оценивались размер частиц, индекс полидисперсности, дзета-потенциал и морфология поверхности частиц.
Предлагаемое изобретение иллюстрируется нижеследующими примерами.
Пример 1. Получение полимерсодержащей композиции силибина заявленным способом
Силибин (> 98%, S0417 Sigma, Belgium) в количестве 0.0250 г растворяли в 4.5 мл этилацетата (хч, Химмед, РФ) при нагревании до 52-55°С с использованием ультразвуковой ванны и перемешивания на магнитной мешалке. В раствор силибина загружали 0.2509 г сополимера PURASORB® PDLG 5004 50/50 DL-Lactide/Glyco-lide copolymer (molar ratio) (Inherent viscosity 0.41 dL/g; PURAC biochemical, Netherlands) и растворяли его в том же режиме. К раствору смеси компонентов добавляли 2 мл дихлорметана (хч, Химмед, РФ) и перемешивали. Полученный раствор (неводную фазу) пропускали через шприцевой фильтр 0.45 мкм (PTFE). В качестве водной фазы использовали 0.25% раствор поливинилового спирта (PVA, 87-90% hydrol., average mol. wt 30,000-70,000; Sigma-Aldrich, USA) в количестве 44.00 г. Раствор PVA готовили заранее в дистиллированной воде при нагревании и перемешивании на магнитной мешалке, затем пропускали его через стекловолоконный фильтр 1 мкм и охлаждали. При интенсивном перемешивании на магнитной мешалке (700 об/мин) и комнатной температуре прикапывали неводную фазу на поверхность водной фазы в цилиндрическом сосуде (банке) на 100 мл (Simax) через шприц 10 мл с иглой для инъекций 22G (0.7×32 мм) в течение 6-8 мин. Перемешивание продолжали еще 2 мин. Затем смесь подвергали обработке с помощью погружного зонда ультразвукового гомогенизатора VCX-750 (SONICS Vibra-cell, USA) при охлаждении сосуда в бане со льдом в режиме: Energy - (50±10) Дж; Ampl - 65%; Pulse - 02 02 с; Time - 1 мин; 3 цикла - продолжительностью по 2 мин с 2 паузами по 1 мин. Полученную эмульсию (o/w) перегружали в круглодонную колбу вместимостью 0.5 л. Остатки смывали дистиллированной водой (4 мл × 2 раза). В колбу загружали раствор 0.1001 г натрия хлорида (хч, Химмед, РФ) в 2 мл дистиллированной воды. Проводили упаривание органических растворителей в вакууме на роторном испарителе. Остаточное давление в системе 30 мбар достигали с помощью мембранного вакуумного насоса, температуру в водяной бане постепенно поднимали до 40°С, температуру 4°С охлаждающей жидкости в обратном холодильнике поддерживали с помощью криостата. На начальном этапе процесса упаривания растворителей наблюдали пенообразование. Общее время процесса упаривания составило 30 мин. Собирали около 30 мл отгона (смеси водной и органической фаз). Полученную суспензию пропускали через стеклянный пористый фильтр (класс ПОР 41). Фильтрат собирали в круглодонную (грушевидную) колбу на 250 мл через прямой аллонж. Остатки смывали дистиллированной водой (4 мл × 2 раза). Профильтрованную суспензию замораживали, погружая колбу в пластиковую баню с жидким азотом, и используя для перемешивания смеси роторный испаритель. Проводили лиофилизацию при остаточном давлении в системе 0.04-0.05 мбар и комнатной температуре в помещении. Продолжительность сушки - около 20 ч. Продукт измельчали в колбе шпателем, выгружали в пластиковый (полипропиленовый) контейнер вместимостью 125 мл. Получали 0.4310 г лиофилизата белого цвета, выход 88.3% (от суммарной массы силибина, сополимера, поливинилового спирта и хлорида натрия). Продукт (шифр SN-17) хранили при 4°С.
Анализ полимерсодержащей композиции силибина
Композицию силибина, полученную по Примеру 1, анализировали на содержание действующего вещества методом обращенно-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) при УФ-детектировании с помощью хроматографической системы Agilent 1200 Series (США). Колонка: Agilent ZORBAX Eclipse XDB-C18, 250×4.6 мм, 5 мкм. Подвижная фаза: элюент А - ацетонитрил (40%), элюент Б - фосфатный буферный раствор, рН 3.0 (60%). Режим: изократический. Температура термостата колонок: 30°С. Скорость потока элюента: 1.1 мл/мин. Аналитическая длина волны: 288±4 нм. Объем вводимой пробы: 35 мкл. Время удерживания пика силибина в этих условиях - 6 мин.
Испытуемый образец в количестве 20 мг помещали в мерную колбу на 100 мл, растворяли в 1 мл ДМСО, доводили до метки смесью ацетонитрил-вода (1:1), тщательно перемешивали, отбирали 1 мл, центрифугировали при 14 тыс. об/мин в течение 10 мин и проводили анализ. Содержание силибина в образце полимерсодержащей композиции, полученной по Примеру 1, приведено в таблице 1.
В образце полимерсодержащей композиции силибина, полученной по Примеру 1, определяли степень сорбции (эффективность включения) активного вещества в частицы как отношение количества включенного (связанного) силибина к общему его количеству в навеске испытуемого образца [14]. Для анализа использовали метод обращенно-фазовой ВЭЖХ на хроматографической системе Agilent 1200 Series (условия см. выше). Испытуемый образец в количестве 30 мг суспендировали в 5.0 мл фосфатно-солевого буферного раствора (PBS, рН 7.4) при перемешивании на магнитной мешалке (300 об/мин) в течение 10 мин. Суспензию центрифугировали при 18 тыс. об/мин и 4°С в течение 20 мин. Супернатант отбирали. К осадку добавляли 5.0 мл раствора PBS и перемешивали на магнитной мешалке (300 об/мин) в течение 10 мин. Суспензию повторно центрифугировали в тех же условиях. Второй супернатант отбирали, объединяли с первым и перемешивали. Определяли содержание силибина в объединенном супернатанте (в мг/мл) методом ВЭЖХ (см. выше). Расчет степени сорбции силибина SSlb (в процентах) проводили по формуле (1):

где
SSlb - степень сорбции силибина, %;
WSlb - количество силибина в навеске образца, мг;
WSlbsup - количество силибина в объединенном супернатанте, мг.
Результат определения степени сорбции силибина в образце, полученном по Примеру 1, приведен в таблице 1.
Анализ частиц водной суспензии полимерсодержащей композиции силибина, полученной по Примеру 1, проводили на приборе Zetasizer Nano ZS ZEN 3600 (Malvern Instruments Ltd., United Kingdom). Методом динамического светорассеяния получали распределение частиц по размерам, средний размер частиц (Z-Average particle size) и индекс полидисперсности (PdI). Для получения распределения дзета-потенциала (Zeta potential distribution) использовался электрофоретический метод. Суспензию испытуемого образца (около 0.2 мг/мл) в количестве 3-5 мл готовили путем встряхивания навески в деионизированной воде в течение 1 мин. Ультразвуковую обработку образца не проводили. Для определения размеров частиц использовали стеклянную спектрофотометрическую кювету вместимостью 4 мл и длиной оптического пути 1 см, количество суспензии в кювете - 1.5 мл. Измерение дзета-потенциалов проводили в специальной U-образной пластиковой кювете вместимостью 1 мл. Температура рабочего раствора в кюветах 25°С, количество прогонов 3.
Результаты анализа частиц и другие характеристики полимерсодержащей композиции силибина, полученной по Примеру 1, приведены в таблице 1.

Морфологическое исследование поверхности частиц полимерсодержащей композиции силибина, полученной по Примеру 1, проводили с помощью просвечивающей электронной криомикроскопии (CryoTEM). Образец лиофилизата разбавляли в 1 мл очищенной воды, встряхивали в течение 1 мин и помещали на предварительно гидрофилизированную опорную решетку. После остекловывания в жидком этане образец переносили (в жидком азоте) на станцию прессования и помещали в кассетный держатель в криогенных условиях. Визуализацию проводили на приборе Titan Krios ТЕМ FEI (Thermo Fisher Scientific, Waltham, MA, USA) при увеличении 5000-18000 раз в режиме низких доз с использованием детектора электронов Falcon II.
Для суспензии полимерсодержащей композиции силибина, полученной по Примеру 1, приведены графические изображения объемного распределения частиц по размеру (Фиг. 1) и распределения дзета-потенциала (Фиг. 2). На Фиг. 3 представлено изображение частиц, полученное с помощью CryoTEM.
Пример 2. Определение гепатопротекторной активности полимерсодержащей композиции силибина, полученной заявленным способом
Исследование гепатопротекторной активности проводили с использованием модели острого токсического гепатита на самцах мышей линии C57bl/6 массой около 25 г. В качестве гепатотропного токсического агента применяли однократное внутрибрюшинное введение четыреххлористого углерода (CCl4) в виде 25% раствора в оливковом масле в дозе 1 мл/кг массы тела животного. Препараты вводили профилактически в течение 4-х дней до введения CCl4, при этом последнее введение препаратов осуществляли за 1 час до введения CCl4. Для испытания было сформировано 4 группы мышей по 5 особей в каждой - контрольная группа и опытные группы: группа с введением CCl4; группа с введением полимерсодержащей композиции силибина и CCl4; группа с введением препарата сравнения силибина и CCl4. Животным последней группы вводили субстанцию силибина (> 98%), использованную в Примере 1. Полимерсодержащую композицию силибина вводили в дозе 100 мг/кг внутрижелудочно в виде суспензии в воде в соответствии с описанной выше модельной схемой. Препарат сравнения силибин вводили в дозе 100 мг/кг внутрижелудочно в виде взвеси в 1% водном растворе крахмального клейстера. Препараты силибина вводили с использованием зонда. Животным опытных групп вводили внутрибрюшинно CCl4 (25% раствор в оливковом масле) в дозе 1 мл/кг в соответствии с описанной выше модельной схемой. Животным контрольной группы вводили внутрибрюшинно эквиобъемное количество оливкового масла. Через 24 часа после введения CCl4 всех животных подвергали декапитации. Проводили вскрытие и макроскопическую оценку печени, а также биохимическое исследование крови. Активность ферментов аланинаминотрансферазы и аспартатаминотрансферазы определяли методом Райтмана-Френкеля с использованием наборов реактивов фирмы «Ольвекс Диагностикум» (РФ). Активность щелочной фосфатазы определяли методом «по конечной точке» с 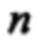 -нитрофенилфосфатом, используя набор реактивов фирмы «Витал Девелопмент Корпорейшн» (РФ).
-нитрофенилфосфатом, используя набор реактивов фирмы «Витал Девелопмент Корпорейшн» (РФ).
Известно, что гепатит, вызванный четыреххлористым углеродом, характеризуется развитием некроза и дистрофии гепатоцитов (синдром цитолиза гепатоцитов), вызывая высвобождение микросомальных ферментов гепатоцитов, на что указывают биохимические изменения в сыворотке крови, в том числе характерное повышение уровня аминотрансфераз. Кроме того, введение CCl4 провоцирует развитие воспалительного отека паренхимы, нарушение внутрипеченочной гемодинамики и, как следствие - нарушение динамики желчи (синдром холестаза), о чем свидетельствует повышение уровня щелочной фосфатазы в крови. Таким образом, для оценки степени выраженности токсического повреждения и воспалительного процесса в печени, а также для оценки эффективности гепатозащитного действия препаратов силибина проводили изучение динамики изменений биохимических показателей основных патологических синдромов, наблюдающихся при поражениях печени: синдрома цитолиза и холестаза - по активности в сыворотке аминотрансфераз и щелочной фосфатазы.
Было показано, что на следующие сутки после внутрибрюшинного введения четыреххлористого углерода в опытной группе мышей без введенных препаратов силибина наблюдается увеличение активности ферментов АЛТ в 6.7 раза и ACT в 1.5 раза по сравнению с контрольной группой, что свидетельствует о развитии явления цитолиза гепатоцитов. При этом коэффициент де Ритиса - соотношение активностей АСТ/АЛТ - составлял 0.35, что свидетельствует о развитии патологического процесса в печени (в норме значение коэффициента равно 1.33±0.42 или 0.91-1.75 [27]). Кроме того было выявлено повышение активности фермента щелочной фосфатазы в 4 раза, что указывает на развитие синдрома холестаза. Биохимические показатели крови мышей при экспериментальном остром токсическом гепатите приведены в таблице 2. Макроскопически печень была светло-вишневого цвета, плотная, с выраженной зернистостью.

В группе животных с четырехкратным пероральным введением полимерсодержащей композиции силибина, предшествующим интоксикации CCl4, было выявлено снижение уровней активности ферментов аланинаминотрансферазы на 25%, аспартатаминотрансферазы на 11% и щелочной фосфатазы на 43% по сравнению с группой с введением только CCl4. Однако данные показатели оставались на более высоком уровне по сравнению с контролем. Следует отметить, что в группе животных с пероральным введением силибина, предшествующим интоксикации CCl4, показатели активности аминотрансфераз были близки к значениям группы животных, получавших CCl4 без лечения, а уровень активности щелочной фосфатазы стал ниже на 12% (таблица 2).
Таким образом, результаты оценки биохимических показателей свидетельствуют о том, что профилактическое четырехкратное пероральное введение полимерсодержащей композиции силибина при экспериментальном токсическом гепатите мышей способствует снижению степени токсического поражения печени. В частности, на фоне испытуемого полимерсодержащего препарата уменьшаются признаки развития цитолитического и холестатического синдромов. Данный эффект по анализируемым показателям превышает эффект от введения свободного силибина, что связано, по-видимому, с повышением его биодоступности в составе полимерсодержащей композиции. Полученные результаты свидетельствуют о наличии потенциала применения полимерсодержащей композиции силибина, полученной по Примеру 1, в качестве гепатопротектора при фармакологической коррекции токсических поражений печени.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Bijak М. Silybin, a Major Bioactive Component of Milk Thistle (Silybum marianum L. Gaernt.) - Chemistry, Bioavailability, and Metabolism // Molecules 2017. - V. 22 (11). - E1942;
2 Federico A., Dallio M., Loguercio C. Silymarine/Silybin and Chronic Liver Disease: A Marriage of Many Years // Molecules 2017. - V. 22 (2). - E191;
3 Loguercio C., Festi D. Silybin and the liver: From basic research to clinical practice // World J. Gastroenterol. 2011. - V. 17 (18). - P. 2288-2301;
4 Liu C.H., Lin C.C., Hsu W.C., et al. Highly bioavailable silibinin nanoparticles inhibit HCV infection // Gut 2017. - V. 66 (10). - P. 1853-1861;
5 Tiwari P., Mishra K.P. Silibinin in cancer therapy: A promising prospect // Cancer Res. Front. - 2015. - V. 1 (3). - P. 303-318;
6 Biedermann D., 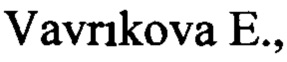 Cvak L., Kren V. Chemistry of silybin // Nat. Prod. Rep. 2014. - V. 31 (9). - P. 1138-1157;
Cvak L., Kren V. Chemistry of silybin // Nat. Prod. Rep. 2014. - V. 31 (9). - P. 1138-1157;
7 Bai T.C., Zhu J.J., Hu J., Zhang H.L., Huang C.G. Solubility of silybin in aqueous hydrochloric acid solution // Fluid Phase Equilib. 2007. - V. 254 (1-2). - P. 204-210;
8 Di Costanzo A., Angelico R. Formulation Strategies for Enhancing the Bioavailability of Silymarin: The State of the Art // Molecules 2019. - V. 24 (11). - P. 2155;
9 Zhang Z.-B., Shen Z.-G., Wang J.-X., et al. Micronization of silybin by the emulsion solvent diffusion method // Int. J. Pharmac. 2009. - V. 376 (1-2). - P. 116-122;
10 Wang Y., Wang L., Liu Z., et al. In Vivo Evaluation of Silybin Nanosuspensions Targeting Liver // J. Biomed. Nanotechnol. 2012. - V. 8 (5). - P. 760-769;
11 Guan X.L., Zhao S.Z., Hou R.J., et al. Pharmacokinetics of silybin nanoparticles in mice bearing SKOV-3 human ovarian carcinoma xenocraft // Int. J. Clin. Exp. Med. 2015. - V. 8 (10). - P. 17406-17417;
12 Das S., Roy P., Pal R., et al. Engineered Silybin Nanoparticles Educe Efficient Control in Experimental Diabetes // PloS One. 2014. - V. 9 (7): e101818;
13 Rong K., Liu B.L., Li M.Z., et al. Study and evaluation of preparation of silybin PLGA microspheres by stainless steel membrane emulsification technique // Zhongguo Zhong Yao Za Zhi [China Journal of Chinese Materia Medica]. 2014. - 39 (7). - 1229-1233;
14 Терещенко О.Г., Никольская Е.Д., Жунина О.А., Заварзина В.В. и др. Получение перспективных полимерных форм гепатопротекторов на основе силибина и урсодезоксихолевой кислоты // Изв. АН. Сер. хим. 2018. - №12. - С. 2290-2296;
15 Патент РФ №2108109. Способ получения комплекса силибинина с циклодекстрином, комплекс включения силибинина с циклодекстрином, фармацевтическая композиция антигепатотоксической активности и способ ее получения / Валкави У., Монтероссо В., Капони Р.И. др. - Опубл. 10.04.98.;
16 Gaumet М., Gurny R., Delie F. Localization and quantification of biodegradable particles in an intestinal cell model: the influence of particle size // Eur. J. Pharm. Sci. 2009. -V. 36. - P. 465-473;
17 Kreuter J.,  Munz K. Quantitative and microautoradiographic study on mouse intestinal distribution of polycyanoacrylate nanoparticles // Int. J. Pharm. 1989. - V. 55 (1). - P. 39-45;
Munz K. Quantitative and microautoradiographic study on mouse intestinal distribution of polycyanoacrylate nanoparticles // Int. J. Pharm. 1989. - V. 55 (1). - P. 39-45;
18 Griffiths G.,  Sable S.B., Khuller G.K. Nanobead-based interventions for the treatment and prevention of tuberculosis // Nat. Rev. Microbiol. 2010. - V. 8 (11). - P. 827-834;
Sable S.B., Khuller G.K. Nanobead-based interventions for the treatment and prevention of tuberculosis // Nat. Rev. Microbiol. 2010. - V. 8 (11). - P. 827-834;
19 Plapied L., Duhem N., Rieux A.,  Fate of polymeric nanocarriers for oral drug delivery // Curr. Opin. Colloid Interface Sci. 2011. - V. 16 (3). - P. 228-237;
Fate of polymeric nanocarriers for oral drug delivery // Curr. Opin. Colloid Interface Sci. 2011. - V. 16 (3). - P. 228-237;
20 Desai P.P., Date A.A., Patravale V.B. Overcoming poor oral bioavailability using nanoparticle formulations - opportunities and limitations // Drug Discovery Today: Technologies 2012. - V. 9 (2). - P. 87-95;
21 Патент Китая CN 105477039. Silymarin PLGA nanoparticles and preparation method thereof. Priority date 2012-04-25;
22 Патент Китая CN 105477040. Silymarin PLGA enteric nanoparticles and preparation method thereof. Priority date 2016-01-04;
23 Заявка на патент США US 2019/0015335. Hepatoprotective particles and systems and methods of use thereof / Reineke J., Durymanov M., Permyakova A.;
24 Zhang H., Wang C.B., Liu J.L. Silybin nanoparticles for liver cancer: development, optimization and in vitro - in vivo evaluation // J. BUON. 2016. - V. 21 (3). - P. 633-644;
25 Anandam S., Velmurugan R. Formulation development and characterization of silybin loaded nanoparticles // Intern. J. Chem. Pharm. Sci. 2014. - V. 5 (3). - P. 140-143;
26 Патент РФ №2694221. Противовоспалительный препарат на основе кетопрофена и способ его получения / Полтавец Ю.И., Воронцов Е.А., Заварзина В.В., Гукасова Н.В., Кузнецов С.Л., Тубашева И.А., Алешин С.В. и др. - Опубл. 10.07.2019;
27 Биохимия: Учебник / Под ред. Е.С. Северина. - 2-е изд., испр. - М.: ГЕОТАР-МЕД, 2004. - С. 472.