Результат интеллектуальной деятельности: АНТИТЕЛА АНТИ-PD-L1 И СПОСОБЫ ИХ ДИАГНОСТИЧЕСКОГО ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет по дате подачи предварительной заявки на патент США №62/023,741, поданной 11 июля 2014 года, полное содержание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к антителам против лиганда программируемой смерти 1 (PD-L1) и способам их применения.
УРОВЕНЬ ТЕХНИКИ
Лиганд программируемой смерти 1 (PD-L1) представляет собой белок, который участвует в подавлении реакций иммунной системы при хронических инфекциях, беременности, аллотрансплантации тканей, аутоиммунных заболеваниях и раке. PD-L1 регулирует иммунный ответ путем связывания с ингибирующим рецептором, известным как рецептор программируемой смерти 1 (PD-1), который экспрессируется на поверхности Т-клеток, В-клеток и моноцитов. PD-L1 отрицательно регулирует функцию Т-клеток также посредством взаимодействия с другим рецептором - В7.1 (также известным как В7-1 или CD80). Сформировавшиеся комплексы PD-L1/PD-1 и PD-L1/B7.1 отрицательно регулируют передачу сигналов Т-клеточного рецептора, что приводит к последующей понижающей регуляции активации Т-клеток и подавлению иммунной противоопухолевой активности. PD-L1 избыточно экспрессируется при многих видах рака, включая самые разнообразные солидные опухоли, таких как опухоли мочевого пузыря, молочной железы, ободочной кишки, легких, яичников, слюнных желез, желудка, щитовидной железы и меланома. Избыточная экспрессия PD-L1 в опухолевых клетках может вызвать прогрессирование опухолевой инвазии и часто ассоциируется с плохим прогнозом.
Учитывая роль PD-L1 в развитии рака и регуляции иммунной системы, необходимы дополнительные инструменты для обнаружения наличия PD-L1, например, для диагностики и/или отбора пациентов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антителам против лиганда программируемой смерти 1 (PD-L1) и способам их применения.
В одном из аспектов настоящего изобретения предлагается выделенное антитело, которое специфически связывается с PD-L1, причем антитело связывается с эпитопом, содержащим аминокислотные остатки 279-290 полипептида PD-L1 человека (SEQ ID NO: 1). В некоторых вариантах реализации изобретения антитело содержит следующие гипервариабельные области (HVR): (a) HVR-H1, содержащую аминокислотную последовательность SNGLT (SEQ ID NO: 2); (b) HVR-H2, содержащую аминокислотную последовательность TINKDASAYYASWAKG (SEQ ID NO: 3); и (с) HVR-H3, содержащую аминокислотную последовательность IAFKTGTSI (SEQ ID NO: 4). В некоторых вариантах реализации изобретения антитело дополнительно содержит следующие области каркаса вариабельного домена тяжелой цепи (FR): (a) FR-H1, содержащую аминокислотную последовательность QSLEESGGRLVKPDETLTITCTVSGIDLS (SEQ ID NO: 5); (b) FR-H2, содержащую аминокислотную последовательность WVRQAPGEGLEWIG (SEQ ID NO: 6); (с) FR-H3, содержащую аминокислотную последовательность RLTISKPSSTKVDLKITSPTTEDTATYFCGR (SEQ ID NO: 7); и (d) FR-H4, содержащую аминокислотную последовательность WGPGTLVTVSS (SEQ ID NO: 8). В некоторых вариантах реализации изобретения антитело дополнительно содержит следующие HVR: (а) HVR-L1, содержащую аминокислотную последовательность QASESVYSNNYLS (SEQ ID NO: 9); (b) HVR-L2, содержащую аминокислотную последовательность LASTLAS (SEQ ID NO: 10); и (с) HVR-L3, содержащую аминокислотную последовательность 1GGKSSSTDGNA (SEQ ID NO: 11). В некоторых вариантах реализации изобретения антитело дополнительно содержит следующие FR вариабельного домена легкой цепи: (а) FR-L1, содержащую аминокислотную последовательность AIVMTQTPSPVSAAVGGTVTINC (SEQ ID NO: 12); (b) FR-L2, содержащую аминокислотную последовательность WFQQKPGQPPKLLIY (SEQ ID NO: 13); (с) FR-L3, содержащую аминокислотную последовательность GVPSRFKGSGSGTQFTLTISGVQCDDAATYYC (SEQ ID NO: 14); и (d) FR-L4, содержащую аминокислотную последовательность FGGGTEVVVR (SEQ ID NO: 15). В некоторых вариантах реализации изобретения антитело содержит (а) последовательность VH, обладающую по меньшей мере 95% идентичностью с аминокислотной последовательностью SEQ ID NO: 16; (b) последовательность VL, обладающую по меньшей мере 95% идентичностью с аминокислотной последовательностью SEQ ID NO: 17; или (с) последовательность VH, аналогичную последовательности, описанной в (а), и последовательность VL, аналогичную последовательности, описанной в (b). В некоторых вариантах реализации изобретения антитело содержит последовательность VH из SEQ ID NO: 16. В некоторых вариантах реализации изобретения антитело содержит последовательность VL из SEQ ID NO: 17.
В других вариантах реализации изобретения антитело содержит следующие HVR: (a) HVR-L1, содержащую аминокислотную последовательность QASESVYSNNYLS (SEQ ID NO: 9); (b) HVR-L2, содержащую аминокислотную последовательность LASTLAS (SEQ ID NO: 10); и (с) HVR-L3, содержащую аминокислотную последовательность IGGKSSSTDGNA (SEQ ID NO: 11). В некоторых вариантах реализации изобретения антитело дополнительно содержит следующие FR вариабельного домена легкой цепи: (а) FR-L1, содержащую аминокислотную последовательность AIVMTQTPSPVSAAVGGTVT1NC (SEQ ID NO: 12); (b) FR-L2, содержащую аминокислотную последовательность WFQQKPGQPPKLLIY (SEQ ID NO: 13); (с) FR-L3, содержащую аминокислотную последовательность GVPSRFKGSGSGTQFTLTISGVQCDDAATYYC (SEQ ID NO: 14); и (d) FR-L4, содержащую аминокислотную последовательность FGGGTEVVVR (SEQ ID NO: 15).
В другом аспекте настоящего изобретения предлагается выделенное антитело, которое специфически связывается с PD-L1, причем антитело содержит следующие HVR: (a) HVR-H1, содержащую аминокислотную последовательность SNGLT (SEQ ID NO: 2); (b) HVR-H2, содержащую аминокислотную последовательность TINKDASAYYASWAKG (SEQ ID NO: 3); и (с) HVR-H3, содержащую аминокислотную последовательность IAFKTGTSI (SEQ ID NO: 4); (d) HVR-L1, содержащую аминокислотную последовательность QASESVYSNNYLS (SEQ ID NO: 9); (e) HVR-L2, содержащую аминокислотную последовательность LASTLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащую аминокислотную последовательность IGGKSSSTDGNA (SEQ ID NO: 11). В некоторых вариантах реализации изобретения антитело дополнительно содержит следующие FR вариабельного домена тяжелой цепи и вариабельного домена легкой цепи: (a) FR-H1. содержащую аминокислотную последовательность QSLEESGGRLVKPDETLTITCTVSGIDLS (SEQ ID NO: 5); (b) FR-H2, содержащую аминокислотную последовательность WVRQAPGEGLEWIG (SEQ ID NO: 6); (с) FR-H3, содержащую аминокислотную последовательность RLTISKPSSTKVDLKITSPTTEDTATYFCGR (SEQ ID NO: 7); (d) FR-H4, содержащую аминокислотную последовательность WGPGTLVTVSS (SEQ ID NO: 8); (е) FR-L1, содержащую аминокислотную последовательность AIVMTQTPSPVSAAVGGTVTINC (SEQ ID NO: 12); (f) FR-L2, содержащую аминокислотную последовательность WFQQKPGQPPKLLIY (SEQ ID NO: 13); (g) FR-L3, содержащую аминокислотную последовательность GVPSRFKGSGSGTQFTLTISGVQCDDAATYYC (SEQ ID NO: 14); и (h) FR-L4, содержащую аминокислотную последовательность FGGGTEVVVR (SEQ ID NO: 15). В некоторых вариантах реализации изобретения антитело содержит последовательность VH из SEQ ID NO: 16 и последовательность VL из SEQ ID NO: 17.
В другом аспекте настоящего изобретения предлагается выделенное антитело, которое конкурирует за связывание с PD-L1 с любым из описанных выше антител.
В другом аспекте настоящего изобретения предлагается выделенное антитело, которое связывается с тем же эпитопом, что и любое из описанных выше антител.
В некоторых вариантах реализации изобретения любое из описанных выше антител может быть моноклональным антителом. В некоторых вариантах реализации изобретения моноклональное антитело может быть кроличьим моноклональным антителом.
В неко торых вариантах реализации изобретения любое из описанных выше антител может быть антителом IgG (например, антителом IgG1).
В некоторых вариантах реализации изобретения любое из описанных выше антител может быть фрагментом антитела, который специфически связывает PD-L1. В некоторых вариантах реализации изобретения фрагмент антитела выбирают из группы, состоящей из Fab, одноцепочечного вариабельного фрагмента (ScFv), Fv, Fab', Fab'-SH, F(ab')2 и диатела.
В другом аспекте настоящего изобретения предлагается иммуноконъюгат, содержащий любое из описанных выше антител.
В другом аспекте настоящего изобретения предлагается выделенная нуклеиновая кислота, которая кодирует любое из антител, описанных в настоящем документе. В другом аспекте настоящего изобретения предлагается вектор (например, экспрессионный вектор), содержащий нуклеиновую кислоту для экспрессии антитела. В другом аспекте настоящего изобретения предлагаются клетки-хозяева, содержащие описанные выше нуклеиновые кислоты и/или векторы.
В некоторых аспектах изобретения любое из описанных выше антител может быть использовано для обнаружения наличия или уровня экспрессии PD-L1 в биологическом образце. В некоторых вариантах реализации изобретения обнаружение осуществляется с помощью иммуногистохимии (ИГХ), иммунофлуоресценции (ИФ), проточной цитометрии, твердофазного ИФА (ELISA) или иммуноблота. В некоторых вариантах реализации изобретения обнаружение осуществляется с помощью ИГХ. В некоторых вариантах реализации изобретения образец содержит фиксированную ткань. В некоторых вариантах реализации изобретения фиксированная ткань представляет собой фиксированную формалином и заключенную в парафин (ФФЗП) ткань. В некоторых вариантах реализации изобретения образец получают от субъекта, имеющего рак или иммунную дисфункцию, или подверженного риску их развития. В некоторых вариантах реализации изобретения иммунная дисфункция представляет собой Т-клеточное дисфункциональное нарушение. В некоторых вариантах реализации изобретения Т-клеточное дисфункциональное нарушение представляет собой неразрешенную острую инфекцию, хроническую инфекцию или невосприимчивость опухоли.
В дополнительном аспекте настоящего изобретения предлагается способ обнаружения наличия или уровня экспрессии PD-L1 в биологическом образце, включающий приведение в контакт биологического образца с любым из описанных выше антител и обнаружение наличия связанного антитела. В некоторых вариантах реализации изобретения обнаружение осуществляется с помощью ИГХ, ИФ, проточной цитометрии, твердофазного ИФА (ELISA) или иммуноблота. В некоторых вариантах реализации изобретения обнаружение осуществляется с помощью ИГХ. В некоторых вариантах реализации изобретения образец содержит фиксированную ткань. В некоторых вариантах реализации изобретения фиксированная ткань представляет собой ФФЗП-ткань. В некоторых вариантах реализации изобретения образец получают от субъекта, имеющего рак или иммунную дисфункцию, или подверженного риску их развития. В некоторых вариантах реализации изобретения иммунная дисфункция представляет собой Т-клеточное дисфункциональное нарушение. В некоторых вариантах реализации изобретения Т-клеточное дисфункциональное нарушение представляет собой неразрешенную острую инфекцию, хроническую инфекцию или невосприимчивость опухоли. В некоторых вариантах реализации изобретения образец получают от субъекта, имеющего рак. В некоторых вариантах реализации изобретения наличие или уровень экспрессии PD-L1 в образце указывает на то, что субъект, вероятно, будет отвечать на лечение с применением противоракового препарата. В некоторых вариантах реализации изобретения наличие или уровень экспрессии PD-L1 в образце указывает на то, что субъект с большой вероятностью будет отвечать на лечение с применением противоракового препарата. В некоторых вариантах реализации изобретения наличие или уровень экспрессии PD-L1 в образце указывает на вероятность того, что у субъекта будет отмечаться эффект от лечения с применением противоракового препарата. В некоторых вариантах реализации изобретения способ дополнительно включает выбор противораковой терапии для субъекта на основании наличия или уровня экспрессии PD-L1 в образце. В некоторых вариантах реализации изобретения способ дополнительно включает введение указанному субъекту терапевтически эффективного количества противоракового препарата. В некоторых вариантах реализации изобретения рак выбирают из группы, состоящей из немелкоклеточного рака легкого, плоскоклеточного рака, мелкоклеточного рака легкого, рака органов брюшной полости, гепатоцеллюлярного рака, рака органов желудочно-кишечного тракта, рака поджелудочной железы, глиомы, рака шейки матки, рака яичника, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака ободочной кишки, колоректального рака, карциномы эндометрия или матки, карциномы слюнных желез, рака почки, рака печени, рака предстательной железы, рака вульвы, рака щитовидной железы, карциномы печени, лейкоза и рака головы и шеи. В некоторых вариантах реализации изобретения рак представляет собой немелкоклеточный рак легкого (НМКРЛ). В некоторых вариантах реализации изобретения НМКРЛ представляет собой аденокарциному легкого или плоскоклеточную карциному легкого. В некоторых вариантах реализации образец представляет собой опухолевый образец. В некоторых вариантах реализации изобретения опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки или любую их комбинацию. В некоторых вариантах реализации изобретения опухолевый образец имеет обнаруживаемый уровень экспрессии PD-L1 в проникающих в опухоль иммунных клетках, которые составляют около 1% или более площади опухолевого образца. В некоторых вариантах реализации изобретения опухолевый образец имеет обнаруживаемый уровень экспрессии PD-L1 в проникающих в опухоль иммунных клетках, которые составляют около 5% или более площади опухолевого образца. В некоторых вариантах реализации изобретения опухолевый образец имеет обнаруживаемый уровень экспрессии PD-L1 в проникающих в опухоль иммунных клетках, которые составляют около 10% или более площади опухолевого образца. В некоторых вариантах реализации изобретения опухолевый образец имеет обнаруживаемый уровень экспрессии PD-L1 в около 1% или более опухолевых клетках в опухолевом образце. В некоторых вариантах реализации изобретения опухолевый образец имеет обнаруживаемый уровень экспрессии PD-L1 в около 5% или более опухолевых клетках в опухолевом образце. В некоторых вариантах реализации изобретения опухолевый образец имеет обнаруживаемый уровень экспрессии PD-L1 в около 10% или более опухолевых клетках в опухолевом образце. В некоторых вариантах реализации изобретения противораковый препарат содержит антагонист, связывающий ось PD-1. В некоторых вариантах реализации изобретения антагонист, связывающий ось PD-1, выбирают из группы, состоящей из антагониста, связывающего PD-L1, антагониста, связывающего PD-1, и антагониста, связывающего PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающий ось PD-1, представляет собой антагонист, связывающий PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающий PD-L1, ингибирует связывание PD-L1 с одним или более его партнерами по связыванию лиганда. В некоторых вариантах реализации изобретения антагонист, связывающий PD-L1. ингибирует связывание PD-L1 с PD-1. В некоторых вариантах реализации изобретения антагонист, связывающий PD-L1, ингибирует связывание PD-L1 с В7-1. В некоторых вариантах реализации изобретения антагонист, связывающий PD-L1, ингибирует связывание PD-L1 с как PD-1, так и с В7-1. В некоторых вариантах реализации изобретения антагонист, связывающий PD-L1, представляет собой антитело. В некоторых вариантах реализации изобретения антитело выбирают из группы, состоящей из: YW243.55.S70, MPDL3280A (атезолизумаб), MDX-1105, MEDI4736 (дурвалумаб) и MSB0010718C (авелумаб). В некоторых вариантах реализации изобретения антагонист, связывающий ось PD-1, представляет собой антагонист, связывающий PD-1. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, ингибирует связывание PD-1 с одним или более его партнерами по связыванию лиганда. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, ингибирует связывание PD-1 с PD-L1. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, ингибирует связывание PD-1 с PD L2. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, ингибирует связывание PD-1 с как PD-L1, так и с PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, представляет собой антитело. В некоторых вариантах реализации изобретения антитело выбирают из группы, состоящей из: MDX 1106 (ниволумаб), МК-3475 (пембролизумаб), СТ-011 (пидилизумаб), MEDI-0680 (АМР-514), PDR001, REGN2810 и BGB-108. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, представляет собой Fc-слитый белок. В некоторых вариантах реализации Fc-слитый белок представляет собой АМР-224. В некоторых вариантах реализации способ дополнительно включает введение указанному пациенту эффективного количества второго терапевтического агента. В некоторых вариантах реализации изобретения второй терапевтический агент выбирают из группы, состоящей из цитотоксического агента, агента, ингибирующего рост, агента лучевой терапии, антиангиогенного агента, а также их комбинации. В некоторых вариантах реализации изобретения субъектом является человек.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Файл приложения содержит по меньшей мере один рисунок, выполненный в цвете. Копии данного патента или заявки на патент с цветными графическим материалами будут предоставлены Управлением по запросу и после уплаты необходимой пошлины.
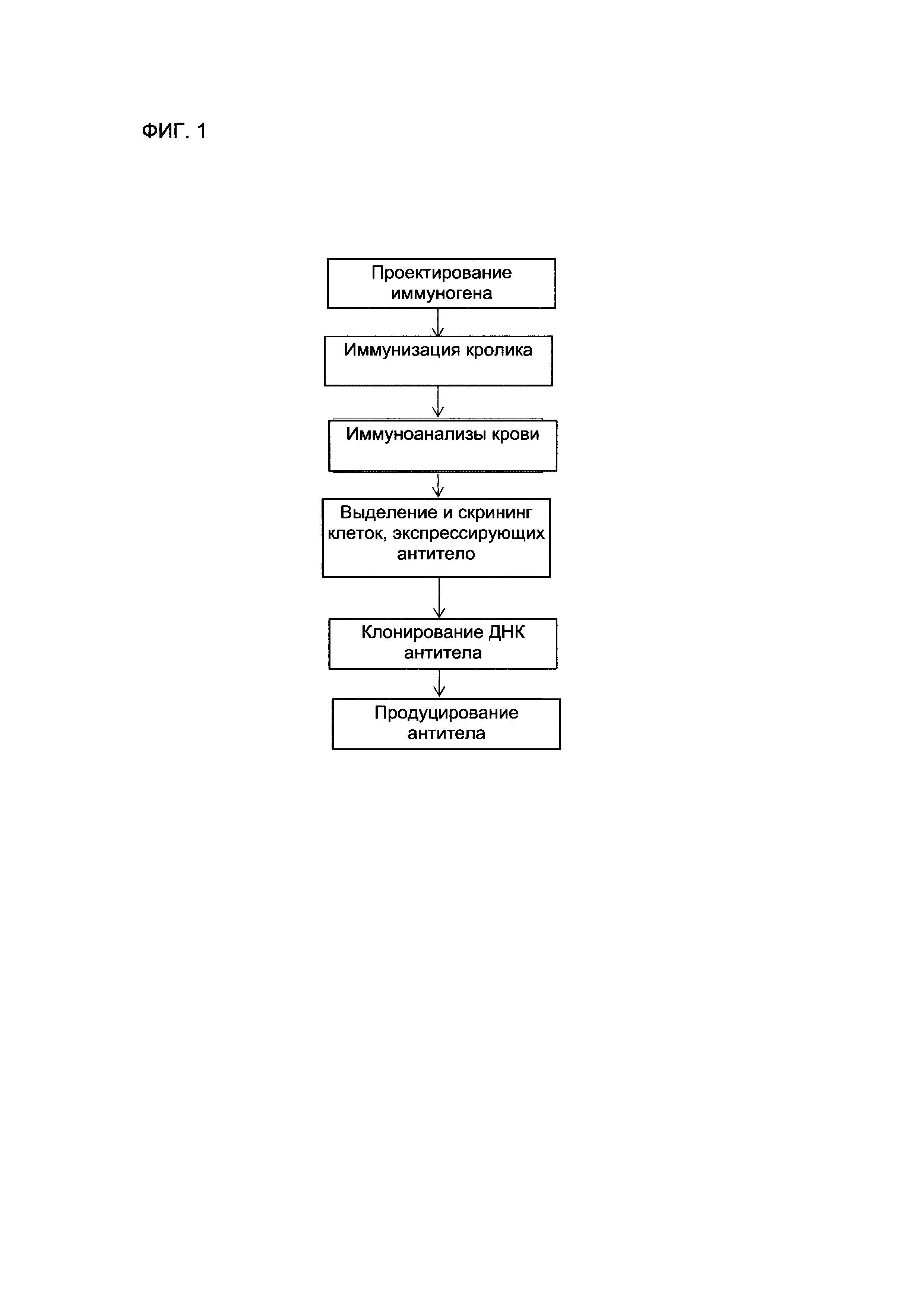
ФИГУРА 1 представляет собой схематическое изображение, демонстрирующее общий процесс продукции антитела SP142 анти-PD-L1.
ФИГУРА 2А представляет собой изображение, демонстрирующее результаты иммуногистохимического анализа (ИГХ) на фиксированных формалином и залитых парафином (ФФЗП) клетках НЕК-293, трансфицированных пустым вектором (отрицательный контроль), полученные с использованием антитела SP142 анти-PD-L1.
ФИГУРА 2В представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-клетках DOR-13 (от низкого до среднего уровня экспрессии), полученные с использованием антитела SP142 анти-PD-L1.
ФИГУРА 2С представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-клетках RKO рака ободочной кишки (средний уровень экспрессии), полученные с использованием антитела SP142 анти-PD-L1.
ФИГУРА 2D представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-клетках НЕК-293, трансфицированных полноразмерным человеческим PD-L1 (высокий уровень экспрессии), полученные с использованием антитела SP142 анти-PD-L1.
ФИГУРА 3А представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела SP142 анти-PD-L1.
ФИГУРА 3В представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе тонзиллярной ткани, полученные с использованием антитела SP142 анти-PD-L1.
ФИГУРА 3С представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани пациента с лимфомой Ходжкина (НК), полученные с использованием антитела SP142 анти-PD-L1.
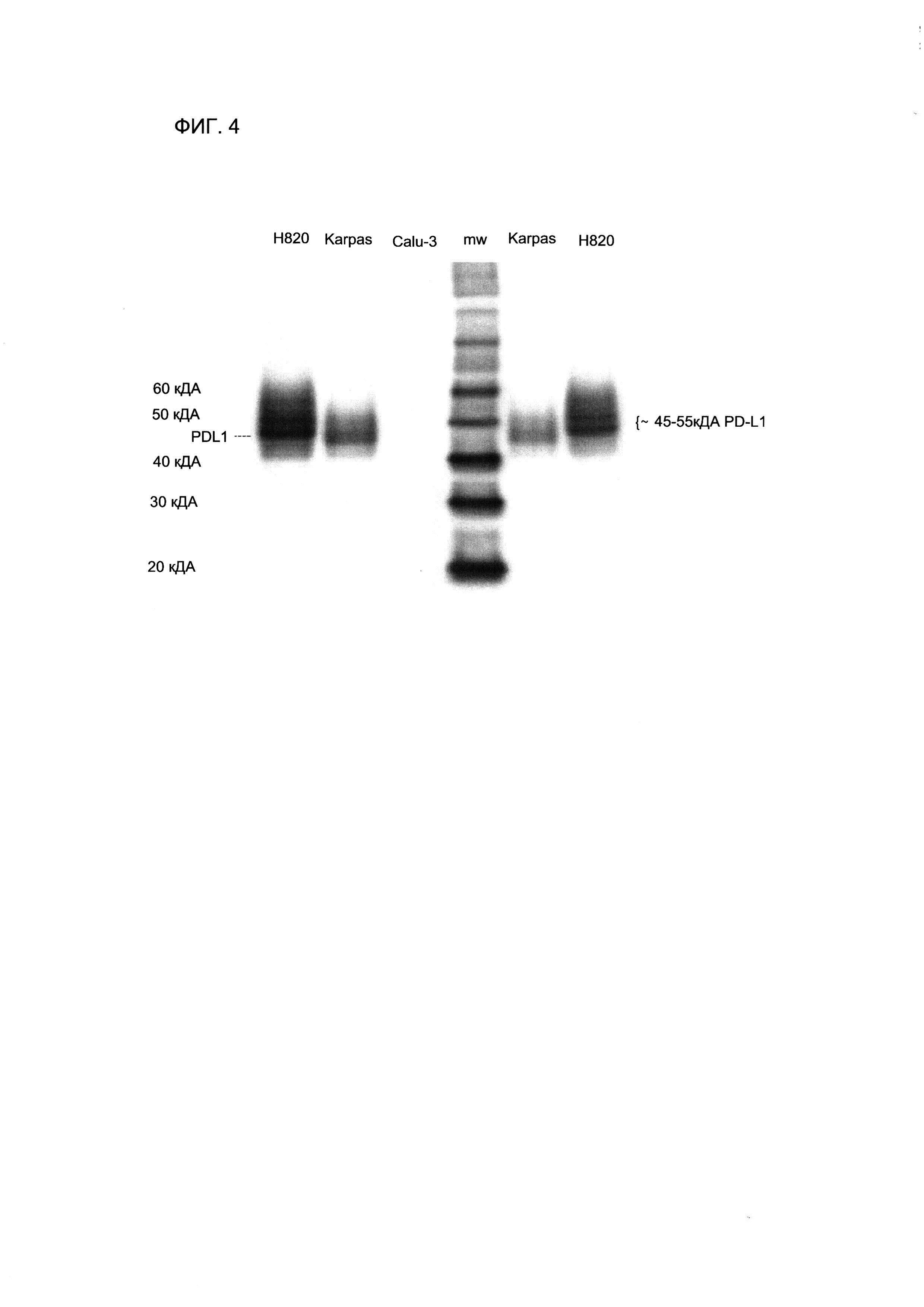
На Фигуре 4 представлен вестерн-блот, демонстрирующий экспрессию PD-L1 в клеточных лизатах ФФЗП-клеточной линии NIH Н820 аденокарциномы легкого (высокий уровень экспрессии), клеточной линии Karpas 299 Т-клеточной лимфомы (средний уровень экспрессии) и клеточной линии Calu-3 аденокарциномы легкого (отрицательный контроль), полученные с использованием антитела SP142 анти-PD-L1.
Фигура 5А представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 0,11 мкг/мл.
Фигура 5В представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 0.44 мкг/мл.
Фигура 5С представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 1,75 мкг/мл.
Фигура 5D представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 7,0 мкг/мл.
Фигура 5Е представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела Е1L3N анти-PD-L1 в концентрации 28,0 мкг/мл.
Фигура 5F представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 0,11 мкг/мл.
Фигура 5G представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 0,44 мкг/мл.
Фигура 5Н представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 1,75 мкг/мл.
Фигура 5I представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 7,0 мкг/мл.
Фигура 5J представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе плацентарной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 28,0 мкг/мл.
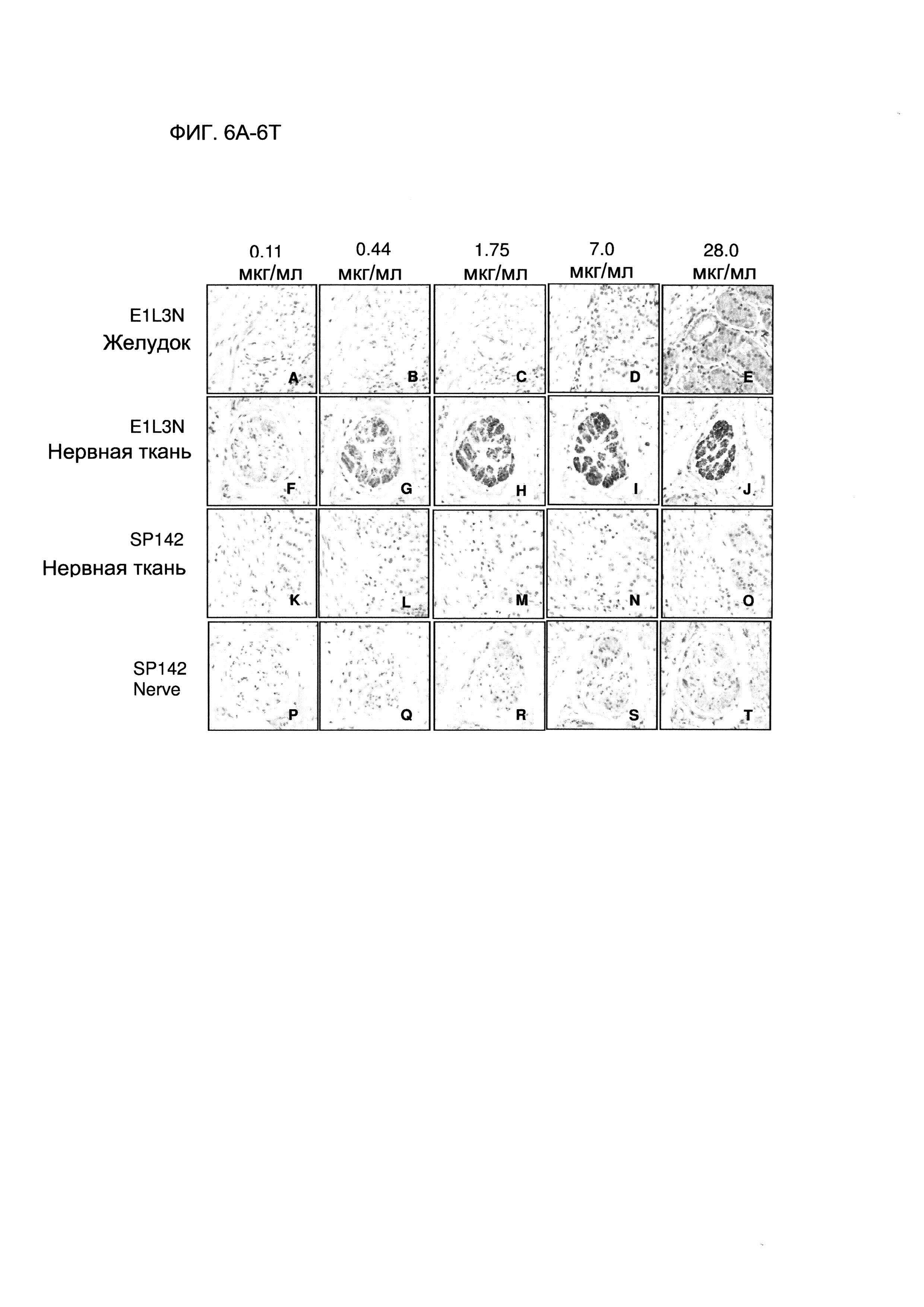
Фигура 6А представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 0,11 мкг/мл.
Фигура 6В представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 0,44 мкг/мл.
Фигура 6С представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 1,75 мкг/мл.
Фигура 6D представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 7,0 мкг/мл.
Фигура 6Е представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 28,0 мкг/мл.
Фигура 6F представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 0,11 мкг/мл.
Фигура 6G представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 0,44 мкг/мл.
Фигура 6Н представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 1,75 мкг/мл.
Фигура 6I представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 7,0 мкг/мл.
Фигура 6J представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела E1L3N анти-PD-L1 в концентрации 28,0 мкг/мл.
Фигура 6K представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 0,11 мкг/мл.
Фигура 6L представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 0,44 мкг/мл.
Фигура 6М представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 1,75 мкг/мл.
Фигура 6N представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 7,0 мкг/мл.
Фигура 6O представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 28,0 мкг/мл.
Фигура 6Р представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 0,11 мкг/мл.
Фигура 6Q представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 0,44 мкг/мл.
Фигура 6R представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 1,75 мкг/мл.
Фигура 6S представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 7,0 мкг/мл.
Фигура 6Т представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе нервной ткани, полученные с использованием антитела SP142 анти-PD-L1 в концентрации 28,0 мкг/мл.
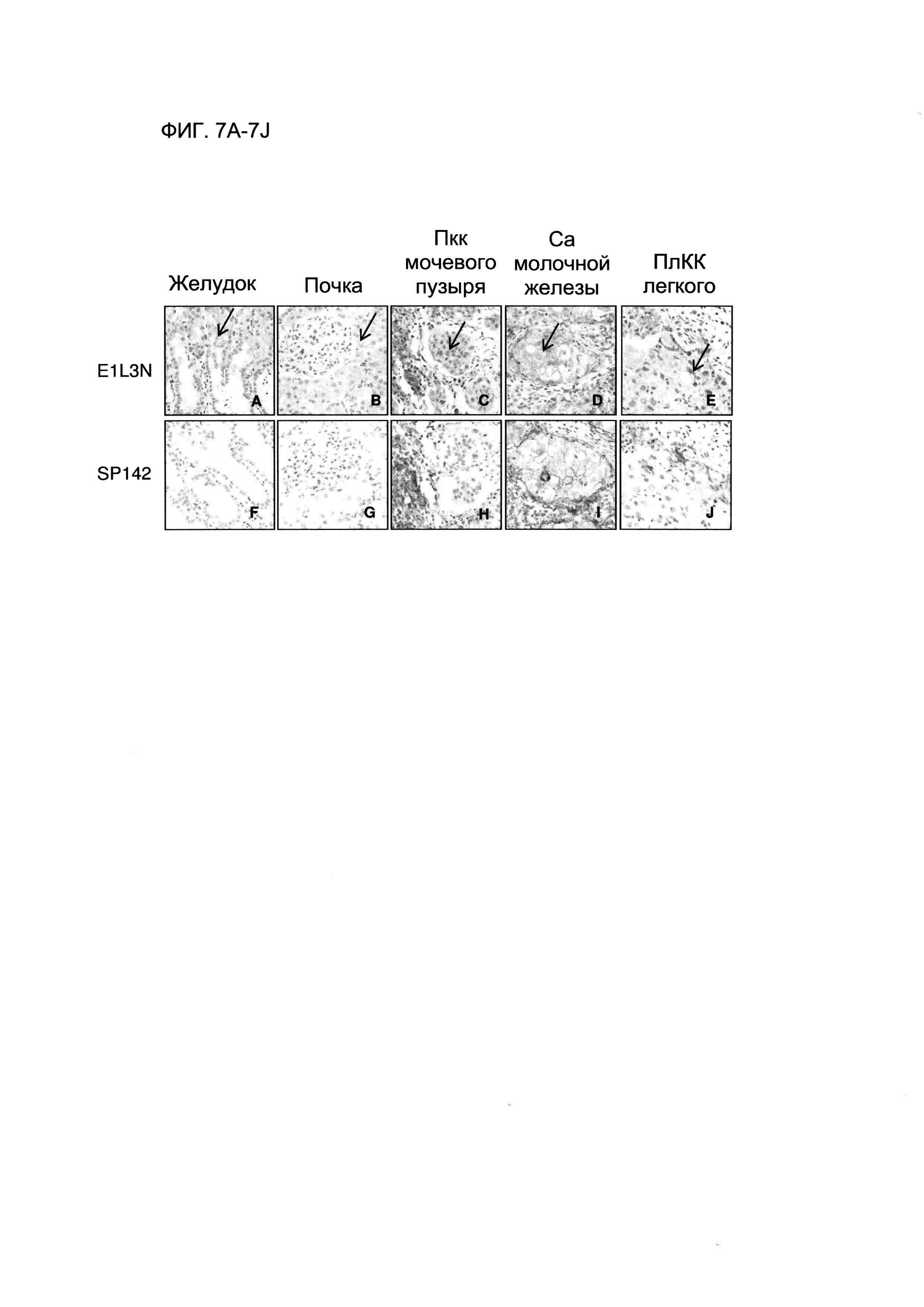
Фигура 7А представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 7В представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе почечной ткани, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 7С представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани переходно-клеточной карциномы (ПКК) мочевого пузыря, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 7D представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани протоковой карциномы (Са) молочной железы, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 7Е представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани плоскоклеточной карциномы легкого, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 7F представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе эпителиальной ткани желудка, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 7G представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе почечной ткани, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 7Н представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани переходно-клеточной карциномы (ПКК) мочевого пузыря, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 7I представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани протоковой карциномы (Са) молочной железы, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 7J представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани плоскоклеточной карциномы легкого, полученные с использованием антитела SP142 анти-PD-L1.
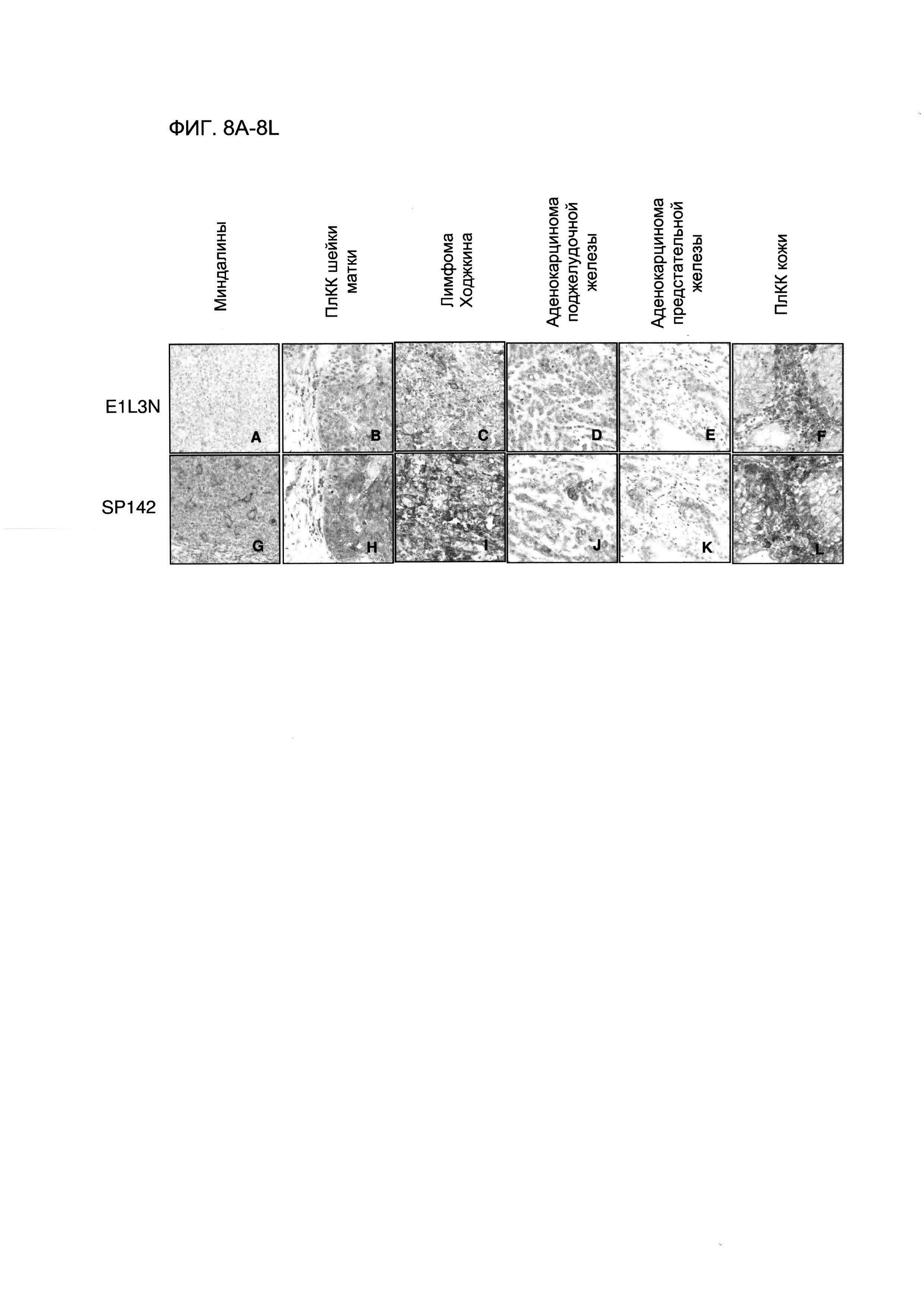
Фигура 8А представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе почечной ткани, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 8В представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани плоскоклеточной карциномы (ПлКК) шейки матки, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 8С представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани лимфомы Ходжкина (лимфома НК), полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 8D представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани аденокарциномы поджелудочной железы, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 8Е представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани аденокарциномы предстательной железы, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 8F представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани ПлКК кожи, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 8G представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе топзиллярной ткани, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 8Н представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани плоскоклеточной карциномы (ПлКК) шейки матки, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 8I представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани лимфомы Ходжкина (лимфома НК), полученные с использованием антитела SP142 анти-PD-L1.
Фигура 8J представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани аденокарциномы поджелудочной железы, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 8К представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани аденокарциномы предстательной железы, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 8L представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани ПлКК кожи, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 9А представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани от пациента с НМКРЛ, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 9В представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани от пациента с НМКРЛ, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 9С представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани от пациента с НМКРЛ, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 9D представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани от пациента с НМКРЛ, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 9Е представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани от пациента с НМКРЛ, полученные с использованием антитела E1L3N анти-PD-L1.
Фигура 9F представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-срезе ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 9G представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 9Н представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 9I представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 9J представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1.
Фигура 10 представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1. На изображении видно наличие PD-L1-положительных проникающих в опухоль иммунных клеток (ИК, темно-коричневое окрашивание) в виде агрегатов в опухолевой строме. Срез ткани контрастно окрашивали гематоксилином (синий).
Фигура 11 представляет собой изображение, демонстрирующее результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1. На изображении продемонстрировано окрашивание PD-L1-положительных опухолевых клеток (ОК). Сигнал PD-L1 показан темно-коричневым цветом. Срез ткани контрастно окрашивали гематоксилином (синий).
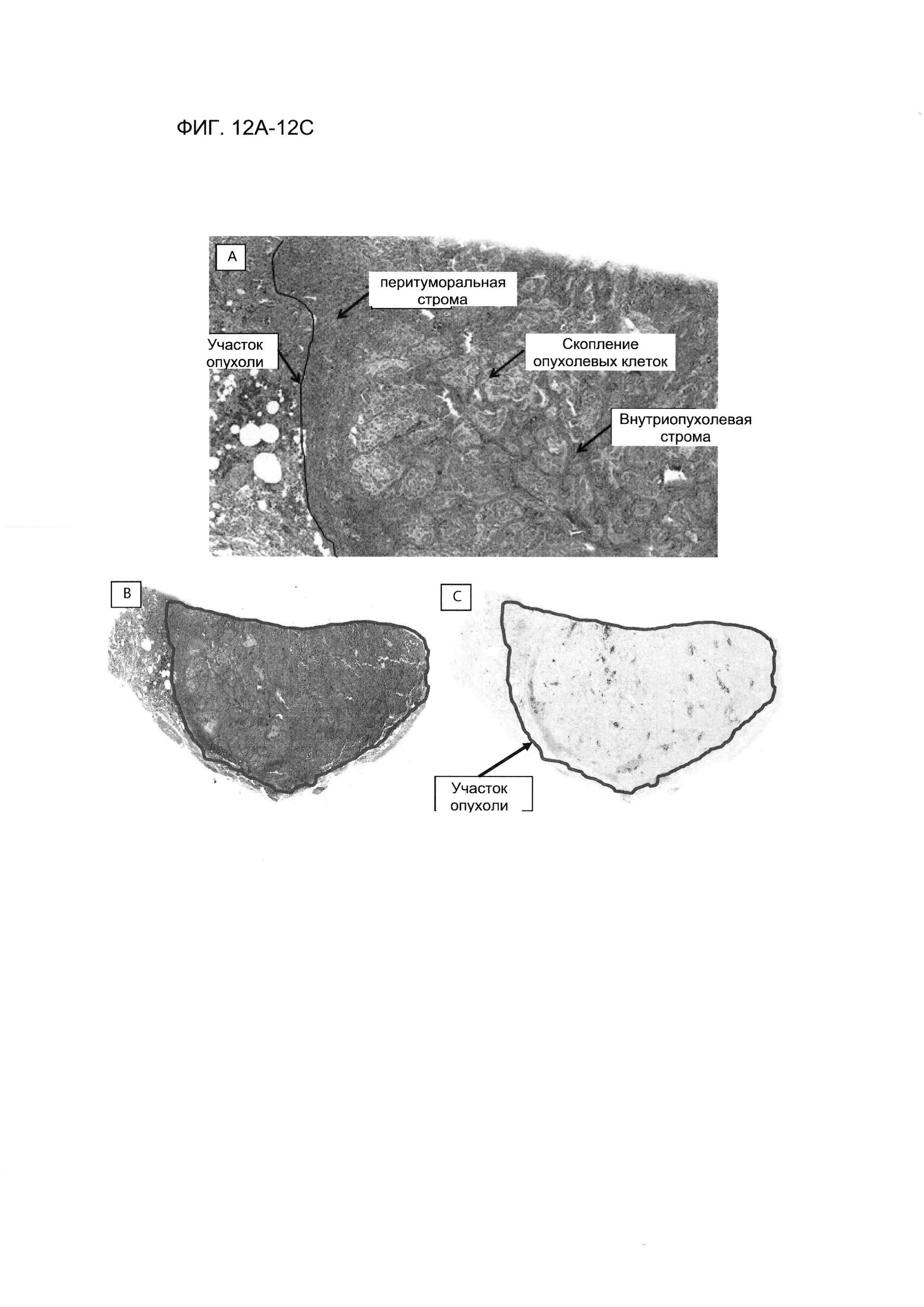
Фигура 12А представляет собой изображение, демонстрирующее области стромы и участки опухоли в образце резецированного НМКРЛ, окрашенном гематоксилином и эозином. Стрелки указывают на перитуморальную строму, массу опухолевых клеток и внутриопухолевую строму. Черная линия очерчивает края участка опухоли. Изображение было получено с большим увеличением.
Фигуры 12В-12С представляют собой изображения, демонстрирующие участок опухоли рецезированного образца НМКРЛ. Серийные срезы опухолевого образца окрашивали гематоксилином и эозином (Фигура 12 В) или с помощью ИГХ PD-L1 с использованием антитела SP142 (Фигура 12С). Сигнал PD-L1 на Фигуре 12С показан темно-коричневым цветом. Синяя линия очерчивает участок опухоли (см. Пример 5). Эти изображения соответствуют тому же образцу, что продемонстрирован на Фигуре 12А, но были получены при более низком увеличении.
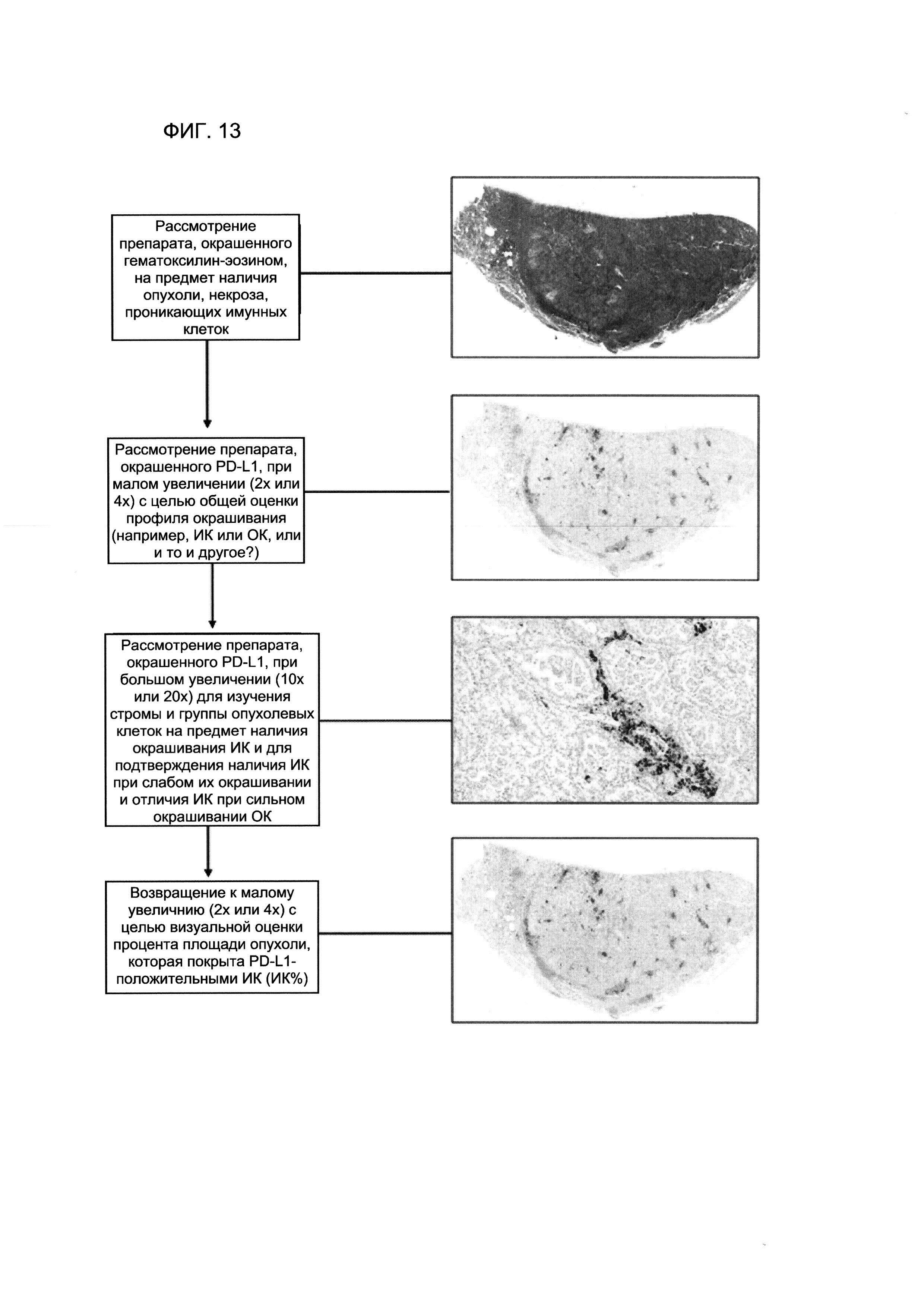
На Фигуре 13 схематически изображен примерный алгоритм определения процентного содержания площади опухоли, покрытой PD-L1-положительными проникающими в опухоль иммунными клетками (ИК %). В этом примере ИК % оцепивали визуально до достижения количества 10%.
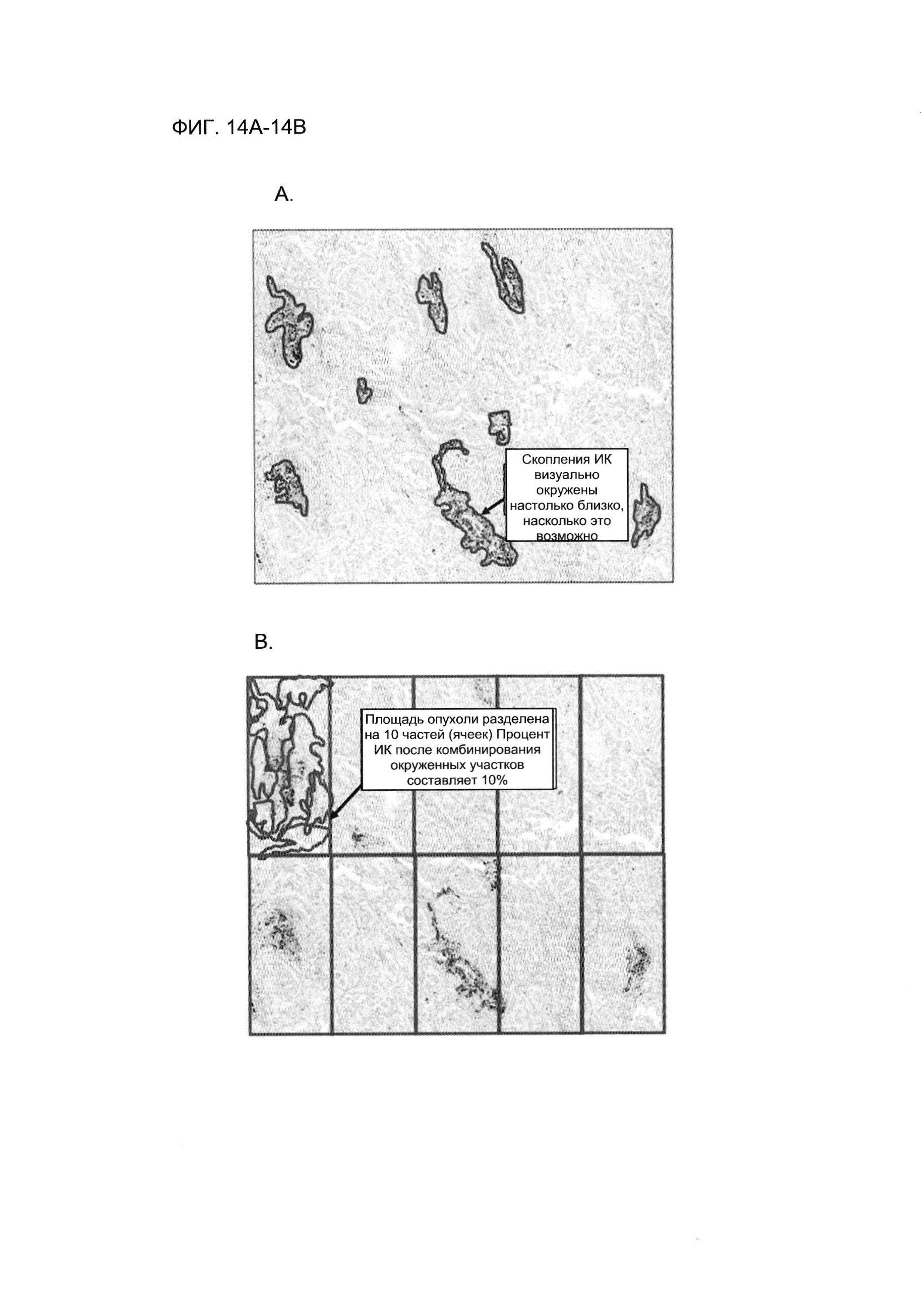
Фигуры 14А-14В показывают типичный способ подсчета результатов ИГХ PD-L1 с помощью профиля окрашивания скопления PD-L1-положительных ИК. Фигура 14А демонстрирует, что скопления PD-L1 -положительных ИК (темно-коричневый сигнал) визуально окружены настолько близко, насколько это возможно, что формирует контуры каждого скопления PD-L1 - положительных ИК (синие контуры). Эти участки объединяли и оцепивали их суммарную площадь в процентах от площади опухоли (Фигура 14В). На Фигуре 14В видно, как площадь опухоли разделяли на 10 частей (ячеек), а также объединяли контуры скопления PD-L1-положительных ИК из Фигуры 14А. Контурами наполняли одну из ячеек, и, следовательно, в этом примере процент площади опухоли, покрытой PD-L1-положительными ИК, составил 10%. Изображение демонстрирует результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1.
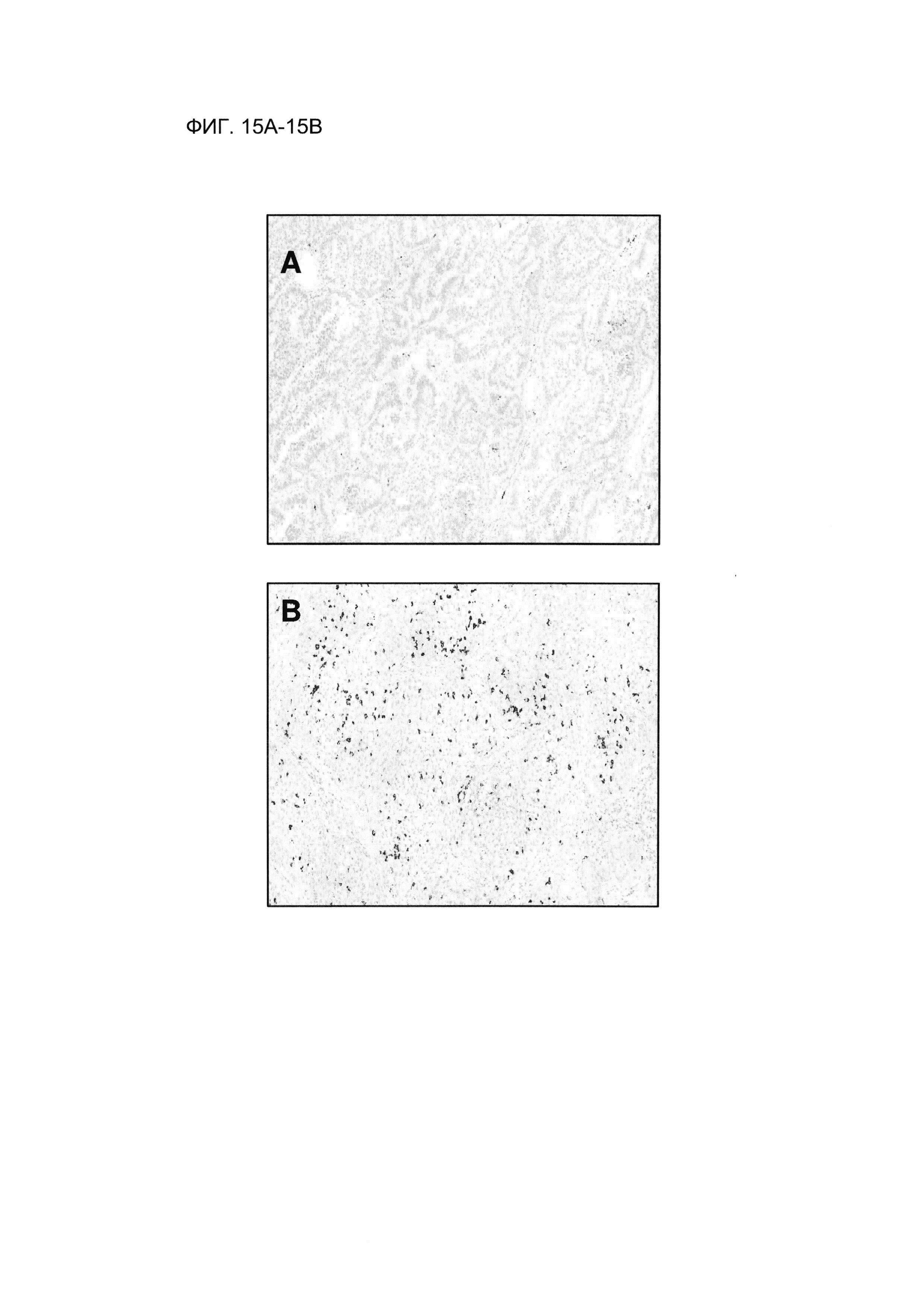
Фигуры 15А-15В демонстрируют изображения с профилем окрашивания PD-L1-положительных ИК с распространением по одной клетке. В этом примере изображения оцепивали на основании плотности распространения по одной клетке по сравнению с эталонными изображениями (см., например, Фигура 16). Фигура 15А демонстрирует изображение, в котором плотность PD-L1-положительных ИК с распространением по одной клетке составляла 1%. Фигура 15В демонстрирует изображение, в котором плотность PD-L1-положительных ИК с распространением по одной клетке составляла 5%. Изображение демонстрирует результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1.
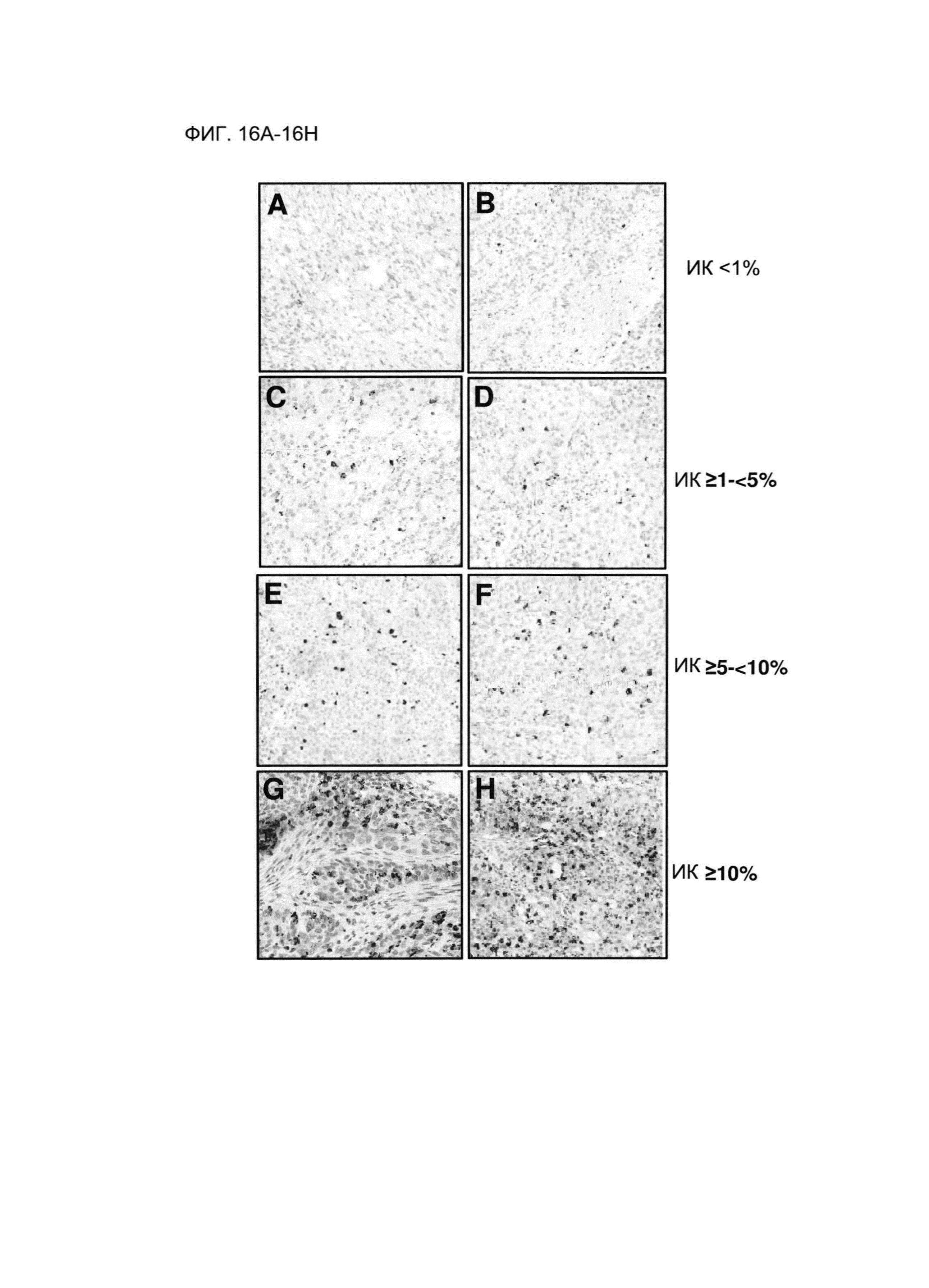
Фигуры 16А-16Н демонстрируют эталонные изображения с профилем окрашивания PD-L1-положительных ИК с распространением по одной клетке при указанных предельных уровнях экспрессии PD-L1 ИК. Изображение демонстрирует результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1. Фигуры 16А-16В демонстрируют изображения, в которых процент PD-L1-положительных ИК составлял менее 1%. Фигуры 16C-16D демонстрируют изображения, в которых процент PD-L1-положительных ИК составлял от 1% или более до менее чем 5%. Фигуры 16E-16F демонстрируют изображения, в которых процент PD-L1-положительных ИК составлял от 5% или более до менее чем 10%. Фигуры 16G-16H демонстрируют изображения, в которых процент PD-L1-положительных ИК составлял 10% или более.
На Фигуре 17А представлены изображения серийных ФФЗП-срезов ткани от пациента с НМКРЛ, окрашенных гематоксилином и эозином (верхняя панель), или обработанных для ИГХ-анализа антителом SP142 анти-PD-L1 (нижняя панель). В этом примере, в срезе, окрашенном гематоксилином и эозином, внутриопухолевые ИК не обнаруживали, в тоже время отмечали интенсивное окрашивание ОК с помощью PD-L1 при ИГХ. ИК подсчитывали в строме (указано стрелкой).
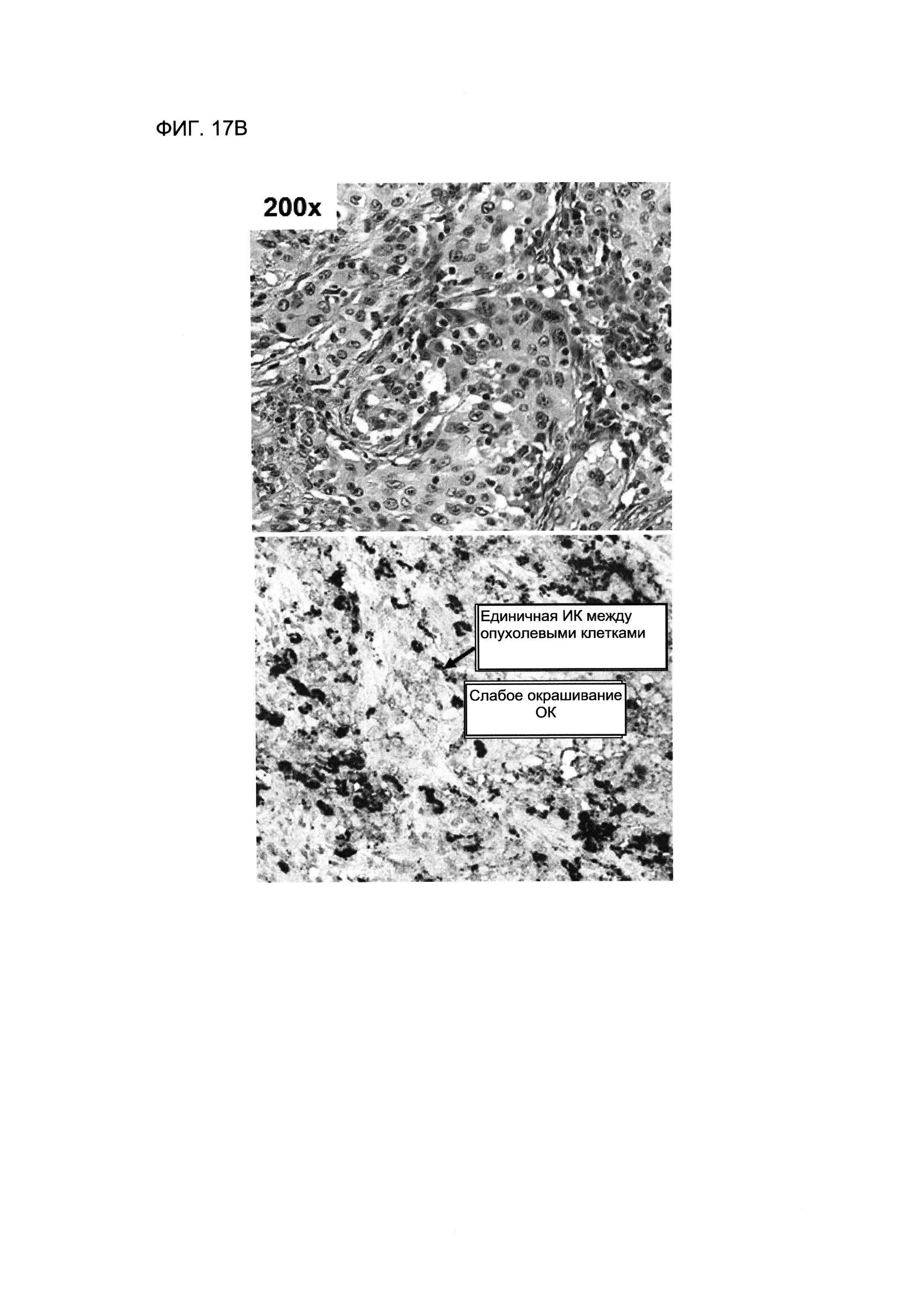
На ФИГУРЕ 17В представлены изображения серийных ФФЗП-срезов ткани от пациента с НМКРЛ, окрашенных гематоксилином и эозином (верхняя панель), или обработанных для ИГХ-анализа антителом SP142 анти-PD-L1 (нижняя панель). В этом примере, в срезе, окрашенном гематоксилином и эозином, обнаруживали внутриопухолевые ИК, в тоже время отмечали окрашивание от слабой до умеренной интенсивности ОК с помощью PD-L1 при ИГХ. ИК подсчитывали как в строме, так и в группах опухолевых клеток.
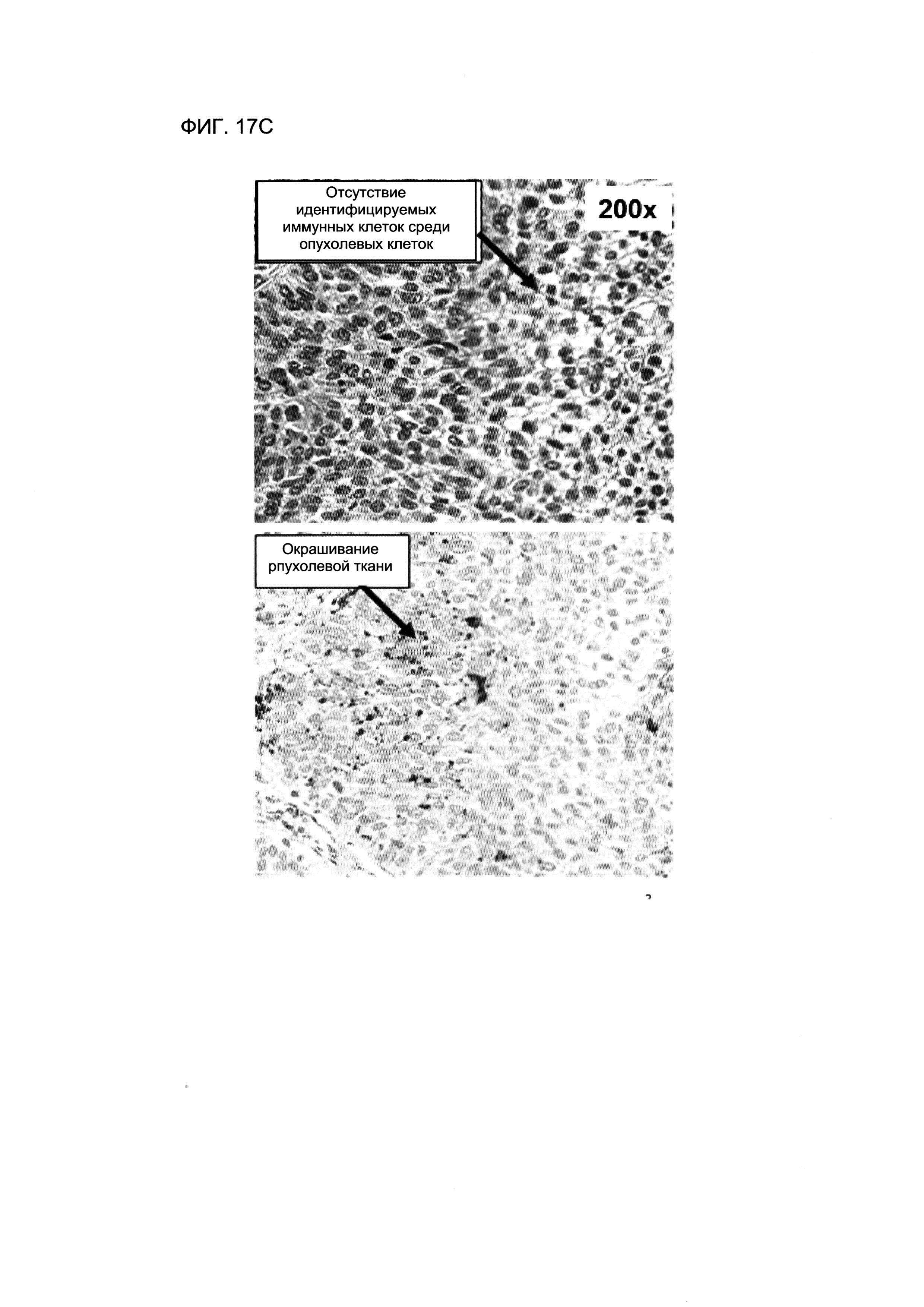
На ФИГУРЕ 17С представлены изображения серийных ФФЗП-срезов ткани от пациента с НМКРЛ, окрашенных гематоксилином и эозином (верхняя панель), или обработанных для ИГХ-анализа антителом SP142 анти-PD-L1 (нижняя панель). В этом примере, в срезе, окрашенном гематоксилином и эозином, внутриопухолевые ИК не обнаруживали, в тоже время отмечали гранулярное окрашивание ОК с помощью PD-L1 при ИГХ. Гранулярное окрашивание оцепивали как PD-L1-положительные ОК до тех пор, пока окрашивание располагалось линейно (т.е. вдоль контура клеточной мембраны).
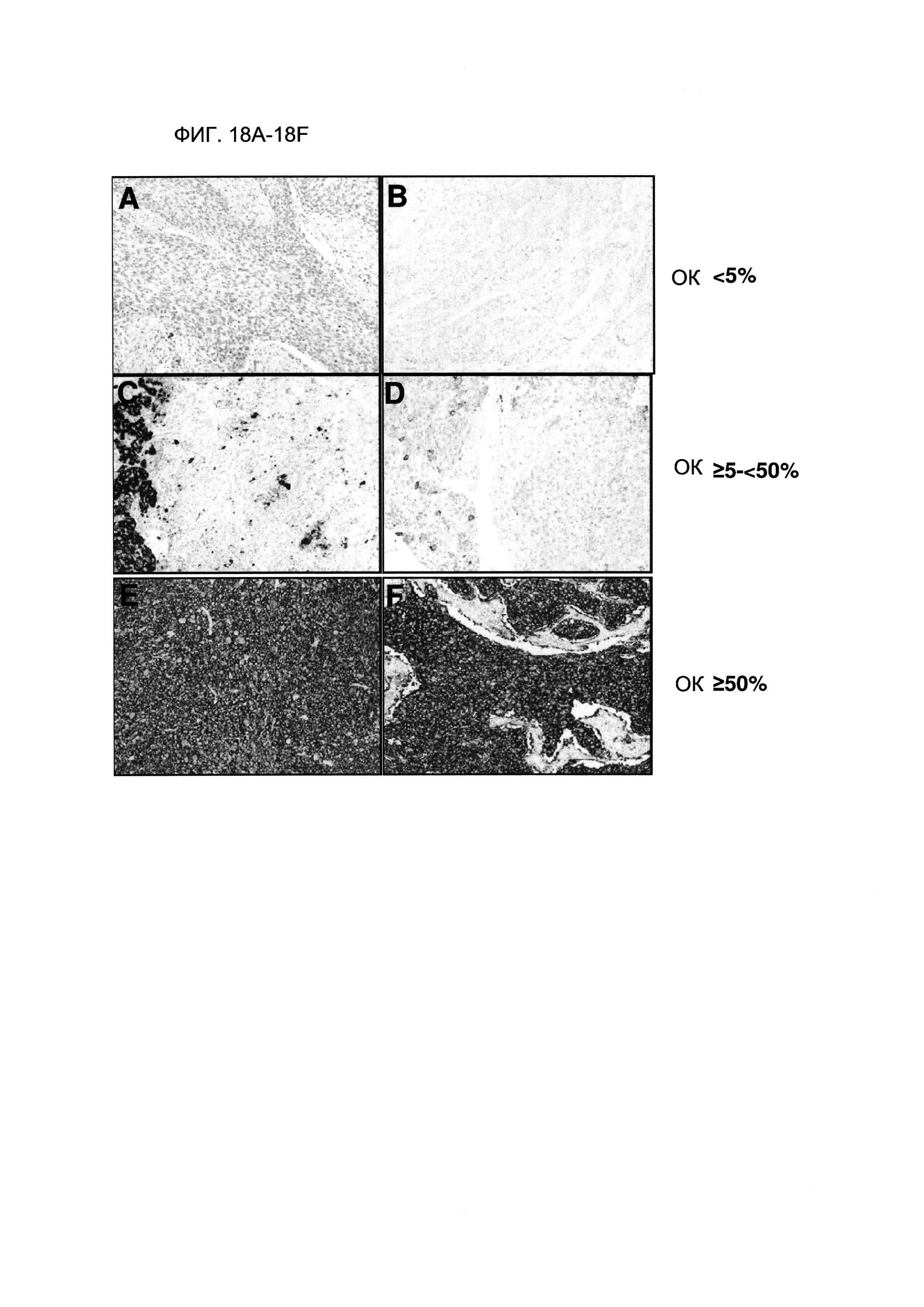
Фигуры 18А-18F демонстрируют типичные изображения профиля окрашивания PD-L1-положительных ОК при указанных предельных процентных количествах OK PD-L1. Изображение демонстрирует результаты ИГХ на ФФЗП-секции ткани от пациента с НМКРЛ, полученные с использованием антитела SP142 анти-PD-L1. Фигуры 18А-18В демонстрируют изображения, в которых процент ОК составлял менее 5%. Фигуры 18С-18D демонстрируют изображения, в которых процент ОК составлял от более или равно 5% до менее чем 50%. Фигуры 18E-18F демонстрируют изображения, в которых процент ОК составлял более или равнялся 50%.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
В данном контексте термин "около" относится к обычному диапазону ошибок для соответствующего значения, хорошо известному специалисту в данной области техники. Ссылка на "около" для значения или параметра в описании, включает (и описывает) варианты реализации изобретения, которые направляются к этому значению или параметру как таковому. Например, описание со ссылкой на "около X" включает описание "X".
"Аффинность" относится к силе общей суммы нековалентных взаимодействий между одиночным сайтом связывания молекулы (например, антитела) и ее партнера по связыванию (например, антигена). Если не указано иное, в настоящем документе "аффинность связывания" относится к присущей молекуле аффинности связывания, отражающей взаимодействие между членами пары связывающихся компонентов (например, антителом и антигеном) при их соотношении 1:1. Аффинность молекулы X к ее партнеру Y в целом можно выразить константой диссоциации (Kd). Аффинность можно измерить с помощью общепринятых в данной области техники способов, включая способы, описанные в настоящем документе. Конкретные иллюстративные и типичные варианты реализации измерения аффинности связывания описаны далее.
"Аффинность созревшего" антитела относится к антителу с одной или более модификациями в одной или более гипервариабельных областей (HVR) по сравнению с исходным антителом, которое не содержит таких модификаций, причем такие модификации приводят к усилению аффинности антитела к антигену.
Термин "анергия" относится к состоянию невосприимчивости к антигенной стимуляции в результате неполных или недостаточных сигналов, доставляемых посредством Т-клеточного рецептора (например, увеличение внутриклеточного Са+2 в отсутствие ras-активации). Т-клеточная анергия также может возникать при стимуляции антигеном при отсутствии костимуляции, в результате чего клетки становятся невосприимчивыми к последующей активации антигеном даже при костимуляции. Состояние неотвечаемости часто может быть преодолено при наличии интерлейкина-2. Анергические Т-клетки не подвергаются клональной экспансии и/или не приобретают эффекторные функции.
Термин "противораковая терапия" относится к терапии, пригодной для лечения рака. Примеры противораковых терапевтических агентов включают, но ограничиваются ими, цитотоксические агенты, химиотерапевтические агенты, агенты ингибирования роста, агенты, используемые в лучевой терапии, антиангиогенезные агенты, апоптотические агенты, антитубулиновые агенты и других агенты для лечения рака, например, антагонисты, связывающие ось PD-1, антитела анти-СD20, ингибиторы фактора роста тромбоцитов (например, Гливек™ (иматиниба мезилат)), ингибитор СОХ-2 (например, целекоксиб), интерфероны, цитокины, антагонисты (например, нейтрализующие антитела), которые связываются с одним или более из следующих мишеней: рецептор (ы) PDGFR-β, BLyS, APRIL, ВСМА, TRAIL/Apo2, другие биологически активные и органические химические агенты и тому подобное. Их комбинации также включены в настоящее изобретение.
Термины "антитело анти-PD-L1", "антитело анти-PD-L1", "антитело, которое специфически связывается с PD-L1" и "антитело, которое связывается с PD-L1" относятся к антителу, способному связывать PD-L1 с достаточной аффинностью, благодаря чему указанное антитело можно использовать в качестве диагностического и/или терапевтического агента при целевом воздействии на PD-L1. В одном варианте реализации изобретения степень связывания антитела анти-PD-L1 с неродственным белком, не являющимся PD-L1, составляет менее чем около 10% связывания антитела с PD-L1 при измерении, например, с помощью радиоиммуноанализа (РИА). В некоторых вариантах реализации изобретения антитело, связывающееся с PD-L1, характеризуется константой диссоциации (Kd), составляющей ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых вариантах реализации изобретения антитело анти-PD-L1 связывается с эпитопом PD-L1, который является консервативным среди PD-L1 различных видов организмов.
Термины "антитело анти-PD-1" или "антитело, связывающееся с PD-1" относятся к антителу, способному связывать PD-1 с достаточной аффинностью, благодаря чему указанное антитело можно использовать в качестве диагностического и/или терапевтического агента при целевом воздействии на PD-1. В одном варианте реализации изобретения степень связывания антитела анти-PD-1 с неродственным белком, не являющимся PD-1, составляет менее чем около 10% связывания антитела с PD-1 при измерении, например, с помощью радиоиммуноанализа (РИА). В некоторых вариантах реализации изобретения антитело, связывающееся с PD-1, характеризуется константой диссоциации (Kd), составляющей ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых вариантах реализации изобретения антитело анти-PD-1 связывается с эпитопом PD-1, который является консервативным среди PD-1 различных видов организмов. Типичные антитела анти-PD-1 включают, но не ограничиваются ими, MDX 1106 (ниволумаб), МК-3475 (пембролизумаб), СТ-011 (пидилизумаб).
Термин "антитело " в данном контексте используется в самом широком смысле и включает различные структуры антител, включая моноклональные антитела, поликлональные антитела, полиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они проявляют желательную антигенсвязывающую активность, но не ограничивается ими.
"Фрагмент антитела" относится к молекуле, не являющейся интактным антителом, но содержащей фрагмент интактного антитела, связывающий антиген, с которым связывается интактное антитело. Примеры фрагментов антител включают Fv, Fab, Fab', Fab'-SH, F(ab')2; диатела; линейные антитела; молекулы одноцепочечных антител (например, scFv); и полиспецифические антитела, образованные из фрагментов антител, но не ограничиваются ими.
В результате расщепления антител папаином получают два идентичных антигенсвязывающих фрагмента, называемых фрагментами "Fab", каждый из которых имеет один антигенсвязывающий сайт, и остаточный фрагмент "Fc", название которого отражает его способность легко кристаллизоваться. В результате обработки пепсином получают F(ab')2-фрагмент, который имеет два антиген-комбинированных сайта и сохраняет способность к перекрестному связыванию антигена.
"Fv" представляет собой минимальный фрагмент антитела, который содержит полный антигенсвязывающий сайт. В одном варианте реализации изобретения двухцепочечный вид Fv состоит из димера вариабельного домена одной тяжелой и одной легкой цепи в тесной, нековалентной связи. В одноцепочечных видах Fv (ScFv) один вариабельный домен тяжелой цепи и один вариабельный домен легкой цепи могут быть ковалентно связаны посредством гибкого пептидного линкера таким образом, что легкие и тяжелые цепи могут ассоциировать в "димерную" структуру аналогично той, что определяется в двухцепочных видах Fv. Именно в этой конфигурации три HVR каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности эти шесть HVR придают антителу антигенсвязывающую специфичность. Тем не менее, даже один вариабельный домен (или половина Fv, содержащая только три HVR специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем полный сайт связывания.
Fab-фрагмент содержит вариабельные домены тяжелой и легкой цепи, а также содержит константный домен легкой цепи и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбокси-конец домена тяжелой цепи СН1, включая один или более цистеинов из шарнирной области антитела. В настоящем документе Fab'-SH является обозначением для Fab', в котором цистеиновый остаток(и) константных доменов несет свободную тиольную группу. F(ab')2 - фрагменты антитела первоначально были получены как пары Fab'-фрагментов, которые имеют между собой шарнирные цистеины. Известны также другие химические связи фрагментов антитела.
"Одноцепочечные Fv" или фрагменты антител "ScFv" содержат VH- и VL-домены антитела, причем эти домены присутствуют в одной полипептидной цепи. Как правило, полипептид ScFv дополнительно содержит полипептидный линкер между VH- и VL-доменами, который дает возможность ScFv формировать желаемую структуру для связывания антигена. Для обзора ScFv, см., например,  , in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York, 1994), pp. 269-315.
, in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York, 1994), pp. 269-315.
Термин "диатела" относится к фрагментам антитела с двумя антигенсвязывающими сайтами, причем фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи (VH-VL). При использовании линкера, который является слишком коротким, чтобы позволить спаривание между двумя доменами на одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта. Диатела могут быть двухвалентными или биспецифическими. Диатела более подробно описаны, например, в ЕР 404,097; WO 1993/01161; Hudson et al., Nat. Med. 9: 129-134 (2003); and Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). Триатела и тетратела также описаны в публикации Hudson et al., Nat. Med. 9: 129-134 (2003).
Термин "антитело, которое связывается с тем же эпитопом" в качестве эталонного антитела, относится к антителу, блокирующему связывание эталонного антитела с его антигеном при конкурентном анализе на 50% или более, и наоборот, эталонное антитело блокирует связывание указанного антитела с его антигеном при конкурентном анализе на 50% или более. Типичный конкурентный анализ представлен в настоящем документе.
"Аутоиммунное заболевание" представляет собой заболевание или нарушение, возникающее из собственных тканей или органов индивидуума или направленное против них, или их коссгрегацию или манифестацию, или обусловленное этим состояние. Аутоиммунные заболевания могут быть органоспецифическими заболеваниями (т.е. иммунный ответ специфически направлен против системы органов, таких, как эндокринная система, кроветворная система, кожа, сердечно-легочная система, желудочно-кишечный тракт и гепатобилиарная система, почки, щитовидная железа, органы слуха, нервно-мышечная система, центральная нервная система и т.д.) или системными заболеваниями, которые могут поражать множество систем органов (например, системная красная волчанка (СКВ), ревматоидный артрит (РА), полимиозит и т.д.). Неограничивающие типичные аутоиммунные заболевания включают аутоиммунные ревматические патологии (такие как, например, РА, синдром Шегрена, склеродермия, волчанка, такая как СКВ и волчаночный нефрит, полимиозит-дерматомиозит, криоглобулинемия, синдром антифосфолипидного антитела и псориатический артрит), аутоиммунные желудочно-кишечные и печеночные патологии (такие как, например, воспалительные заболевания кишечника (например, неспецифический язвенный колит и болезнь Крона), аутоиммунный гастрит и пернициозная анемия, аутоиммунный гепатит, первичный билиарный цирроз печени, первичный склерозирующий холангит и целиакия), васкулит (такой как, например, АНЦА-негативный васкулит и АНЦА-ассоциированный васкулит, включая васкулит Черджа-Стросса, гранулематоз Вегенера и микроскопический полиангиит), аутоиммунные неврологические патологии (такие как, например, рассеянный склероз, опсо-миоклональный синдром, миастения, оптиконевромиелит, болезнь Паркинсона, болезнь Альцгеймера и аутоиммунные полинейропатии), патологии почек (такие как, например, гломерулонефрит, синдром Гудпасчера и болезнь Бергера), аутоиммунные дерматологические патологии (такие как, например, псориаз, уртикарная сыпь, крапивница, пузырчатка обыкновенная, буллезный пемфигоид и кожная красная волчанка), гематологические патологии (такие как, например, тромбоцитопеническая пурпура, тромботическая тромбоцитопеническая пурпура, посттрансфузионная пурпура и аутоиммунная гемолитическая анемия), атеросклероз, увеит, аутоиммунные заболевания органа слуха (такие как, например, патология внутреннего уха и потеря слуха), болезнь Бехчета, синдром Рейно, трансплантация органов и аутоиммунные эндокринные патологии (такие как, например, аутоиммунными заболевания, связанные с диабетом, такие как инсулин-зависимый сахарный диабет (ИЗСД), болезнь Аддисона и аутоиммунные заболевания щитовидной железы (например, болезнь Грейвса и тиреоидит)). Более предпочтительные такие заболевания включают, например, РА, неспецифический язвенный колит, АНЦА-ассоциированный васкулит, волчанку, рассеянный склероз, синдром Шегрена, болезнь Грейвса, ИЗСД, пернициозную анемию, тиреоидит и гломерулонефрит.
В данном контексте фраза "основанный на" означает, что информация об одном или более биомаркерах (например, PD-L1) используется для получения информации, необходимой для принятия решения о лечении, при этом информация приводится, например, в листке-вкладыше или маркетинговом/рекламном руководстве.
Под термином "биологический образец" понимают коллекцию подобных клеток, полученных от субъекта или пациента. Биологический образец может представлять собой тканевой или клеточный образец. Источником тканевого или клеточного образца может быть солидная ткань, например, из свежего, замороженного и/или консервированного органа или тканевого образца или биопсии или аспирата; кровь или любые составные элементы крови; биологические жидкости, такие как спинномозговая жидкость, амниотическая жидкость, перитонеальная жидкость, или межклеточная жидкость; клетки любого термина гестации или развития субъекта. Биологический образец может быть также получен из ткани или клеточной культурыш vitro. Тканевой образец может содержать соединения, которые не смешанные с тканью в природе естественным образом, такие как консерванты, антикоагулянты, буферы, фиксаторы, питательные вещества, антибиотики, или тому подобное. Примеры биологических образцов по данному изобретению включают, но не ограничиваются ими, образцы опухолевых биопсий, циркулирующие опухолевые клетки, сыворотку или плазму, циркулирующие белки плазмы, асцитическую жидкость, первичные клеточные культуры или клеточные линии, полученные из опухолей или проявляющие опухолеподобные свойства, а также сохранившиеся образцы опухоли, такие как фиксированные формалином и залитые парафином образцы опухолей или замороженные образцы опухолей.
В данном контексте термин "биомаркер" относится к показателю, например, предиктивному, диагностическому и/или прогностическому, который может быть обнаружен в образце, например, PD-L1. Биомаркер может служить индикатором определенного подтипа заболевания или нарушения (например, рака), которое характеризуется четкими, молекулярными, патологическими, гистологическими и/или клиническими признаками. В некоторых вариантах реализации изобретения биомаркер представляет собой ген. Биомаркеры включают, но не ограничиваются ими, полинуклеотиды (например, ДНК и/или РНК), изменения количества копий полинуклеотидов (например, количества копий ДНК), полипептиды, модификации полипептидов и полинуклеотидов (например, пост-трансляционные модификации), углеводы и/или молекулярные маркеры на основе гликолипидов.
"Блокирующее" антитело или "антагонистическое" антитело представляет собой антитело, ингибирующее или уменьшающее биологическую активность антигена, с которым оно связывается. Предпочтительные блокирующие антитела или антагонистические антитела по существу или полностью ингибируют биологическую активность антигена.
Термины "рак" и "раковый" относятся или описывают физиологическое состояние млекопитающих, обычно характеризующееся нерегулируемым ростом/пролиферацией клеток. Примеры рака включают, но не ограничиваются ими, карциному, лимфому (например, лимфому Ходжкина и неходжкинскую лимфому), бластому, саркому и лейкоз. Более конкретные примеры таких раковых заболеваний включают немелкоклеточный рак легких (НМКРЛ) (включая аденокарциному легкого и плоскоклеточную карциному легкого), плоскоклеточный рак, мелкоклеточный рак легкого, рак органов брюшной полости, гепатоцеллюлярный рак, рак органов желудочно-кишечного тракта, рак поджелудочной железы, глиому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, лейкоз и другие лимфопролиферативные патологии и разные виды рака головы и шеи. В конкретных вариантах реализации изобретения рак представляет собой НМКРЛ. В некоторых вариантах реализации изобретения НМКРЛ представляет собой аденокарциному легкого или плоскоклеточную карциному легкого. НМРЛ может быть плоскоклеточным НМКРЛ или неплоскоклеточным НМКРЛ.
"Химиотерапевтический агент" представляет собой химическое соединение, используемое для лечения рака. Примеры химиотерапевтических агентов включают алкилирующие агенты, такие как тиотепа и ЦИТОКСАН® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (особенно буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол (Дронабинол, МАРИНОЛ®); бета-лапакон; лапахол; колхицины; бетулиновая кислота; камптотецин (включая синтетический аналог топотекан (ГИКАМТИН®), СРТ-11 (иринотекан, КАМПТОЗАР®), ацетилкамптотекин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его адозелезиновые, карзелезиновые и бизелезиновые синтетические аналоги); подофиллотоксин; подофиллиновая кислота; тенипозид; криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги: KW-2189 и СВ1-ТМ1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; мустаргены, такие как хлорамбуцил, хлорнафазин, хлорфосфамид, эстрамустином, ифосфамид, мехлорэтамин, мехлорэтамин оксида гидрохлорид, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; препараты нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и раиимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, особенно калихеамицин γ11 и калихеамицин ω11 (см., например, Nicolaou et al.,. Angew. Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; эсперамицин; а также неокарциностатиновый хромофор и родственные хромопротеиновые энедииновые антибактериальные хромофоры), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, карминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, АДРИАМИЦИН® доксорубицин (включая морфолино-доксорубицин, цианоморфолино-доксорубицин, 2-пирролино-доксорубицин и дезоксидоксорубицин), эпирубицин, esorubicin, Идаруцибин, marcellomycin, mitomycins, такие как митомицин C, микофенолокислота, ногаламицина, olivomycins, peplomycin, potfiromycin, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностат, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, тримстрексат; пуриновые аналоги, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидиновые аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидеоксиуриин, доксифлуридин, эноцитаин, флоксуридин; андрогены, такие как калустерон, дромостанолона пропионат, эпитиостанол, мепитиостан, тестолактон; средства, угнетающие функции надпочечников, такие как аминоглютетимид, митотан, трилостан; компенсатор фолиевой кислоты, такой как фолиновая кислота; ацеглатон; алдофосфамида гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфорнитин; эллиптиния ацетат; эпотилон; этоглюцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; мейтансиноиды, такие как маитанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраерин; пеностатин; фенамет; пирарубицин; лозоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Юджин, Орегон); разоксан; ризоксин; сизофиран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2''-трихлортриэтил-амин; трихотецены (особенно Т-2 токсин, верракурин A, роридин A и ангуидин); уретан; виндезин (ЭЛДИЗИН®, ФИЛДЕЗИН®); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); тиотепа; таксоиды, например, таксаны, включая ТАКСОЛ® паклитаксел (Bristol-Myers Squibb Oncology, Принстон, Нью-Джерси), АБРАКСАН™, не содержащий кремофора, альбуминовые нанокомпозиции паклитаксела (American Pharmaceutical Partners, Шаумберг, Иллинойс) и ТАКСОТЕР® доцетаксел ( Rorer, Антони, Франция); хлоранбуцил; гемцитабин (ГЕМЗАР®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (ВЕЛБАН®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН®); оксалиплатин; леукововин; винорелбин (НАВЕЛБИН®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифлюорометилорнитн (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (КСЕЛОДА®); фармацевтически приемлемые соли, кислоты или производные любого из указанных выше веществ; а также комбинации двух или более из указанных выше веществ, такие как CHOP, аббревиатура комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, аббревиатура схемы лечения с оксалиплатином (ЭЛОКСАТИН™) в комбинации с 5-FU и лейковорином. Дополнительные химиотерапевтические агенты включают цитотоксические агенты, используемые в качестве конъюгатов лекарственного препарата с антителом, такие как мейтансиноиды (например, DM1) и, например, ауристатины ММАЕ и MMAF.
Rorer, Антони, Франция); хлоранбуцил; гемцитабин (ГЕМЗАР®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин (ВЕЛБАН®); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН®); оксалиплатин; леукововин; винорелбин (НАВЕЛБИН®); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифлюорометилорнитн (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (КСЕЛОДА®); фармацевтически приемлемые соли, кислоты или производные любого из указанных выше веществ; а также комбинации двух или более из указанных выше веществ, такие как CHOP, аббревиатура комбинированной терапии циклофосфамидом, доксорубицином, винкристином и преднизолоном, и FOLFOX, аббревиатура схемы лечения с оксалиплатином (ЭЛОКСАТИН™) в комбинации с 5-FU и лейковорином. Дополнительные химиотерапевтические агенты включают цитотоксические агенты, используемые в качестве конъюгатов лекарственного препарата с антителом, такие как мейтансиноиды (например, DM1) и, например, ауристатины ММАЕ и MMAF.
"Химиотерапевтические агенты" также включают "антигормональные препараты" или "эндокринные препараты", которые действуют для регулирования, уменьшения, блокирования или ингибирования действия гормонов, которые могут стимулировать рост рака, и часто вводятся в виде системной, или воздействующей на весь организм терапии. Это могут быть сами гормоны. Примеры включают антиэстрогены и селективные модуляторы рецепторов эстрогена (SERM), в том числе, например, тамоксифен (включая тамоксифен НОЛВАДЕКС®), ЭВИСТА® ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и ФАРЕСТОН® торемифен; анти-прогестероны; агенты с понижающей регуляцией рецептора эстрогена (ERD); агенты, подавляющие или "блокирующие" яичники, например, агонисты рилизинг-фактора лютеинизирующего гормона (LHRH), такие как ЛЮПРОН® и ЭЛИГАРД® лейпролида ацетат, гозерелина ацетат, бузерелина ацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, регулирующую выработку эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглютетимид, МЕГЕЙС® мегестролацетат, АРОМАЗИН® экземестан, форместан, фадрозол, РЕВИЗОР® ворозол, ФЕМАРА® летрозол и АРИМИДЕКС® анастрозол. Кроме того, такое определение химиотерапевтических агентов включает бисфосфонаты, такие как клодронат (например, БОНЕФОС® или ОСТАК®), ДИДРОКАЛ® этидронат, NE-58095, ЗОМЕТА® золедроновая кислота/золедронат, ФОЗАМАКС® алендронат, АРЕДИЯ® памидронат, СКЕЛИД® тилудронат или АКТОНЕЛ® ризедронат; а также троксацитабин (аналог 1,3-диоксолан нуклеозида цитозина); антисмысловые олигонуклеотиды, в частности те, которые ингибируют экспрессию генов в сигнальных путях, вовлеченных в пролиферацию аберантных клеток, такие как, например, РКС-альфа, Raf, H-Ras, и рецептор эпидермального фактора роста (EGFR); вакцины, такие как вакцина ТЕРАТОП®и вакцины для генной терапии, например, вакцина АЛЛОВЕКТИН®, вакцина ЛЕУВЕКТИН® и вакцина ВАКСИД®; ЛЮПРОТЕКАН® ингибитор топоизомеразы 1; АБАРЕЛИКС® rmRH; лапатиниба дитозилат (низкомолекулярный ингибитор ErbB-2 и EGFR, двойной тирозинкиназы, также известный как GW572016); и фармацевтически приемлемые соли, кислоты или производные любого из веществ, указанного выше.
Термин "химерное" антитело относится к антителу, в котором фрагмент тяжелой и/или легкой цепи происходит из конкретного источника или вида, в то время как остальная часть тяжелой и/или легкой цепи происходит из другого источника или вида.
"Класс" антитела относится к типу константного домена или константной области, содержащихся в его тяжелой цепи. Выделяют пять основных классов антител: IgA, IgD, IgE, IgG и IgM. и некоторые из них дополнительно делятся на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, соответствующие различным классам иммуноглобулинов, называются α, δ, ε, γ и μ, соответственно.
Под терминами "коррелировать" или "корреляция" подразумевается сравнение, тем или иным способом, параметров и/или результатов первого анализа или протокола с параметрами и/или результатами второго анализа или протокола. Например, можно использовать результаты первого анализа или протокола в проведении второго протокола и/или можно использовать результаты первого анализа или протокола, чтобы определить, следует ли проводить второй анализ или протокол. В отношении варианта осуществления полипептидного анализа или протокола, можно использовать результаты анализа или протокола экспрессии полипептида, чтобы определить, следует ли назначать конкретную схему лечения. В отношении варианта осуществления полинуклеотидного анализа или протокола, можно использовать результаты анализа или протокола экспрессии полинуклеотида, чтобы определить, следует ли назначать конкретную схему лечения.
В данном контексте термин "цитотоксический агент" относится к веществу, ингибирующему или предотвращающему функционирование клеток и/или приводящему к гибели или разрушению клеток. Цитотоксические агенты включают, но не ограничиваются ими, радиоактивные изотопы (например, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu), химиотерапевтические агенты или лекарственные вещества (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин C, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); ингибиторы роста; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибкового, растительного или животного происхождения, включая их фрагменты и/или варианты и различные противоопухолевые или противораковые агенты, описанные ниже.
Термин "обнаружение" включает любые способы обнаружения, в том числе прямого и опосредованного обнаружения.
В данном контексте термин "диагностика" используется для обозначения выявления или классификации молекулярного или патологического состояния, заболевания или патологии (например, рака). Например, "диагностика" может относиться к выявлению конкретного типа рака. "Диагностика" может также относиться к классификации конкретного подтипа рака, например, с помощью гистологических критериев, или молекулярных признаков (например, подтип характеризуется экспрессией одного или комбинации биомаркеров (например, конкретных генов или белков, кодируемых указанными генами)).
"Нарушение" представляет собой любое состояние, при котором будет отмечаться эффективность лечения, включая, но не ограничиваясь этим, хронические и острые нарушения или заболевания, включая такие патологические состояния, которые предрасполагают к развитию нарушения у млекопитающего.
"Эффекторные функции" относятся к биологической активности, приписываемой Fc-области антитела и зависящей от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплемент-зависимую цитотоксичность (CDC); связывание с рецептором Fc; антитело-зависимую клеточно-опосредованную цитотоксичность (ADCC); фагоцитоз; подавление рецепторов поверхности клетки (например, рецептора В-клеток); и активацию В-клеток.
Термин "Fc-область" в настоящем документе используется для обозначения С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере фрагмент константной области. Этот термин включает нативную последовательность Fc-области и варианты Fc-области. В одном варианте реализации изобретения Fc-область тяжелой цепи IgG человека простирается от Cys226 или от Pro230 до С-конца тяжелой цепи. Тем не менее, С-концевой лизин (Lys447) Fc-области может присутствовать или не присутствовать. Если не указано иное, нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации, принятой в ЕС, также называемой ЕС-индексом, описанной в работе Kabat et al. Sequences of Proteins of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
"Каркас" или "FR" относится к остаткам вариабельного домена, за исключением остатков гипервариабельной области (HVR). FR вариабельного домена обычно состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Соответственно, HVR- и FR-последовательности, как правило, располагаются в следующей последовательности в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
В данном контексте термины "полноразмерное антитело", "интактное антитело" и "целое антитело" являются взаимозаменяемыми и относятся к антителу, структура которого по существу аналогична структуре нативного антитела, или которое содержит тяжелые цепи, содержащие Fc-область, описанную в настоящем документе.
Термины "уровень экспрессии" или "экспрессионный уровень" в целом используются как взаимозаменяемые и, как правило, относятся к количеству полинуклеотида, мРНК, или продукта аминокислоты или белка в биологическом образце. Термин "экспрессия" в целом относится к процессу, посредством которого информация, закодированная геном, преобразуется в структуры, присутствующие и функционирующие в клетке. Таким образом, согласно настоящему изобретению термин "экспрессия" гена (например, гена PD-L1) может относиться к транскрипции в полинуклеотид, трансляции в белок, или даже посттрансляционной модификации белка. Фрагменты транскрибированного полинуклеотида, транслированного белка или посттрансляционно модифицированного белка также должны рассматриваться как экспрессионные, независимо от того, происходят ли они от транскрипта, полученного путем альтернативного сплайсинга, или выродившегося транскрипта, или пост-трансляционного процессинга белка, например, путем протеолиза. В некоторых вариантах реализации изобретения "уровень экспрессии" относится к количеству белка (например, PD-L1) в биологическом образце, что определяется с использованием методов, известных в данной области техники или описанных в настоящем документе, включая, но не ограничиваясь ими, иммуногистохимию (ИГХ), иммуноблоттинг (например, Вестерн-блоттинг), иммунофлюоресценцию (ИФ), проточную цитометрию, например, сортировка флуоресцентно-активированных клеток (FACS™) или иммуноферментный анализ (ELISA).
Термины "повышенная экспрессия", "повышенный уровень экспрессии", "повышенный уровень", "увеличенная экспрессия", "увеличенные уровни экспрессии," или "увеличенные уровни" относятся к повышенной экспрессии или повышенным уровням биомаркеров в индивидуума по отношению к лицам контрольной группы, таких как индивидуум или индивидуумы, которые не страдают от этого заболевания или нарушения (например, рак) или по отношению к внутреннему контролю (например, облигатным биомаркерам).
Термины "пониженная экспрессия", "пониженный уровень экспрессии", "пониженный уровень", "уменьшенная экспрессия", "уменьшенные уровни экспрессии," или "уменьшенные уровни" относятся к пониженной экспрессии или пониженным уровням биомаркеров в индивидуума по отношению к контролю, представляющего собой индивидуума или индивидуумов, которые не страдают от этого заболевания или нарушения (например, рак), или по отношению к внутреннему контролю (например, облигатным биомаркерам). В некоторых вариантах реализации изобретения пониженная экспрессия представляет собой минимальную экспрессию или полное ее отсутствие.
Термины "клетка-хозяин", "линия клеток-хозяев" и "культура клеток-хозяев" используются как взаимозаменяемые и относятся к клеткам, в которые ввели экзогенную нуклеиновую кислоту, включая потомство таких клеток. Клетки-хозяева включают "трансформантов" и "трансформированные клетки", которые включают первичные трансформированные клетки и потомство, происходящее от них, независимо от количества пассажей. Потомство может быть не полностью идентично родительской клетке по содержанию нуклеиновых кислот, но может содержать мутации. Это определение включает мутантное потомство, обладающее той же функцией или биологической активностью, которая наблюдается во время скрининга или отбирается из первоначально трансформированных клеток.
"Антитело человека" представляет собой антитело, обладающее аминокислотной последовательностью, соответствующей последовательности антитела, продуцированного в организме человека или клетке человека или происходящее из нечеловеческого источника, использующего репертуар антител человека или другие последовательности, кодирующие антитело человека. Из этого определения антитела человека, в частности, исключено гуманизированное антитело, содержащее антигенсвязывающие остатки нечеловеческого происхождения.
"Консенсусный каркас человека" является каркасом, представляющим наиболее распространенные аминокислотные остатки в выборке VL- или VH-каркасных последовательностей иммуноглобулина человека. В общем случае выборку VL- или VH-последовательностей иммуноглобулина человека получают из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу по Kabat et al., Sequences of Proteins of Immunological Interest. Fifth Edition, NIH Publication 91-3242, Bethesda MD, Vols. 1-3, 1991. В одном из вариантов реализации VL подгруппа представляет собой подгруппу каппа I по Kabat et al., выше. В одном из вариантов реализации VH подгруппа представляет собой подгруппу III по Kabat et al.. выше.
"Гуманизированное" антитело относится к химерному антителу, содержащему аминокислотные остатки из HVR нечеловеческого происхождения и аминокислотные остатки из FR человека. В некоторых вариантах реализации изобретения гуманизированное антитело содержит практически все из по меньшей мере одного, а обычно - двух вариабельных доменов, в которых все или практически все HVR (например, CDR) соответствуют аналогичным участкам из антитела нечеловеческого происхождения, и все или практически все FR-области соответствуют последовательности антитела человека. В некоторых случаях гуманизированное антитело может содержать по меньшей мере фрагмент константной области антитела, происходящий из антитела человека. "Гуманизированная форма" антитела, например, антитела нечеловеческого происхождения, относится к антителу, подвергшемуся гуманизации.
В данном контексте термин "гипервариабельная область" или "HVR" относится к каждой из областей вариабельного домена антитела, обладающих гипервариабельными последовательностями ("определяющие комплементарность области" или "CDR") и/или образующих структурно определенные петли ("гипервариабельные петли") и/или содержащих остатки, контактирующие с антигеном ("антигенные контакты"). Как правило, антитела содержат шесть HVR: три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). Примеры HVR, описанные в настоящем документе, включают:
(а) гипервариабельные петли, находящиеся в области аминокислотных остатков 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia et al. J. Mol. Biol. 196: 901-917, 1987);
(b) CDR, находящиеся в области аминокислотных остатков 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (H2) и 95-102 (H3) (Kabat et al., Sequences of Proteins of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991);
(c) антигенные контакты, находящиеся в области аминокислотных остатков 27 с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum et al. J. Mol. Biol. 262: 732-745, 1996); и
(d) комбинации (a), (b) и/или (с), включая HVR- аминокислотные остатки 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (H2), 93-102 (Н3) и 94-102 (Н3). Если не указано иное, HVR-остатки и другие остатки в вариабельном домене (например, FR-остатки) в настоящем документе нумеруют по Kabat et al., выше.
"Иммунная дисфункция" представляет собой нарушение или патологическое состояние, влияющие на иммунную систему и включает, например, аутоиммунных заболеваний и Т-клеточные дисфункциональные нарушения.
В данном описании термин "иммуноадгезин" обозначает антитело-подобные молекулы, которые сочетают в себе специфичность связывания гетерологичного белка ("адгезина") с эффекторными функциями константных доменов иммуноглобулина. Конструктивно иммуноадгезины включают сочетание аминокислотной последовательности, имеющей требуемую специфичность связывания, которая отличается распознаванием антигена и сайтом связывания антитела (т.е. является "гетерологичной"), с последовательностью константного домена иммуноглобулина. Адгезиновая часть молекулы иммуноадгезина обычно представляет собой непрерывную аминокислотную последовательность, содержащую по меньшей мере сайт связывания рецептора или лиганда. Последовательность константного домена иммуноглобулина в иммуноадгезине может быть получена из любого иммуноглобулина, такого как IgG1, IgG2 (включая IgG2A и IgG2B), IgG3 или подтипов IgG4, IgA (включая IgA1 и IgA2), IgE, IgD или IgM. Слитые Ig предпочтительно включают замену домена полипептида или антитела, описанного в настоящем документе, в месте по меньшей мере одной вариабельной области в молекуле Ig. В особенно предпочтительном варианте реализации изобретения слитый иммуноглобулин включает шарнирные области СН2 и СН3 или шарнирные области СН1, СН2 и СН3 в молекуле IgG1. Для получения информации о продукции слитых иммуноглобулинов см. также патент США №5428130. Например, пригодные иммуноадгезины в качестве лекарственных средств, пригодных для лечения по настоящему изобретению, включают полипептиды, которые включают внеклеточный домен (ECD) или PD-1-связывающие участки PD-L1 или PD-L2, или внеклеточные или PD-L1- или PD-L2-связывающие участки PD-1, слитые с константным доменом последовательности иммуноглобулина, такие как PD-L1 ECD-Fc, PD-L2 ECD-Fc и PD-1 ECD-Fc, соответственно. Иммуноадгезиновые комбинации Ig Fc и ECD рецепторов клеточной поверхности иногда называют растворимыми рецепторами.
Термины "слитый белок" и "слитый полипептид" относятся к полипептиду, имеющему два участка, ковалентно связанных друг с другом, причем каждый из участков представляет собой полипептид, имеющий разные свойства. Свойство может представлять собой биологическое свойство, такое как активность in vitro или in vivo. Свойство также может представлять собой простое химическое или физическое свойство, например, связывание с молекулой-мишенью, катализ реакции и тому подобное. Эти два участка могут быть соединены непосредственно с помощью одной пептидной связи или через пептидный линкер, но находятся в рамке считывания друг с другом.
"Иммуноконъюгат" представляет собой антитело, конъюгированное с одной или более гетерологичных молекул, включая цитогоксический агент, но не ограничиваясь им.
"Выделенное антитело" представляет собой антитело, отделенное от компонента своего природного окружения. В некоторых вариантах реализации изобретения антитело является очищенным до более чем 95% или 99% чистоты, определяемой, например, посредством электрофореза (например, электрофореза в ДСН-ПААГ, изоэлектрического фокусирования (ИЭФ), капиллярного электрофореза) или хроматографии (например, ионообменной или обращенно-фазной ВЭЖХ). Обзор способов оценки чистоты антител см., например, в публикации Flatman et al. J. Chromatogr. В. 848: 79-87, 2007.
Термин "выделенная нуклеиновая кислота" относится к молекуле нуклеиновой кислоты, отделенной от компонента своего природного окружения. Выделенная нуклеиновая кислота содержит молекулу нуклеиновой кислоты, содержащуюся в клетках, обычно включающих указанную молекулу нуклеиновой кислоты, однако указанная молекула нуклеиновой кислоты присутствует вне хромосомы или в области хромосомы, отличающейся от ее естественного местоположения в хромосоме.
"Выделенная нуклеиновая кислота, кодирующая антитело анти-PD-L1" относится к одной или более молекулам нуклеиновой кислоты, кодирующим тяжелые и легкие цепи антитела (или их фрагменты), включая такую(ие) молекулу(ы) нуклеиновой кислоты в составе одного вектора или отдельных векторов и такую(ие) молекулу(ы) нуклеиновой кислоты, присутствующую(ие) в одном или более местоположениях в клетке-хозяине.
Слово "метка" в данном контексте относится к соединению или композиции, которые конъюгированы или слиты непосредственно или опосредованно с реагентом, таким как полинуклеотидный зонд или антитело, и способствуют обнаружению реагента, с которым они конъюгированы или слиты. Метка сама по себе может быть обнаруживаемой (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментной метки, может катализировать химическое изменение субстратного соединения или композиции, которые можно обнаружить. Этим термином охватывается непосредственное мечение зонда или антитела путем связывания (т.е. физического связывания) детектируемого вещества с зондом или антителом, а также опосредованное мечение зонда или антитела путем вступления в реакцию с другим реагентом, который является непосредственно меченным. Примеры опосредованного мечения включают обнаружение первичного антитела с использованием флуоресцентно-меченного вторичного антитела и мечения конца ДНК-зонда биотином таким образом, что антитело может быть обнаружено с помощью флуоресцентно-меченного стрептавидина.
Термин "моноклональное антитело" в данном контексте относится к антителу, полученному из популяции по существу однородных антител, т.е., отдельные антитела, составляющие популяцию, являются идентичными и/или связывают один и тот же эпитоп, за исключением возможных вариантных антител, например, содержащих естественные мутации или возникающих по время продукции моноклонального антитела, причем такие варианты присутствуют в незначительных количествах. В отличие от препаратов поликлональных антител, которые обычно содержат различные антитела против различных детерминант (эпигонов), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты антигена. Таким образом, модификатор "моноклональное" указывает на то, что антитело получено из по существу однородной популяции антител; его не следует интерпретировать как требование о продукции антитела посредством какого-либо конкретного способа. Например, моноклональные антитела для использования согласно настоящему изобретению можно получить с помощью различных способов, включая, но не ограничиваясь ими, гибридомный способ, методики рекомбинантных ДНК, методики фагового дисплея и способы с использованием трансгенных животных, полностью или частично содержащих локусы иммуноглобулина человека или их комбинаций.
"Процент (%) идентичности аминокислотной последовательности" по отношению к последовательностям эталонных полипептидов определяют как процентное содержание аминокислотных остатков в кандидатной последовательности, идентичных аминокислотным остаткам в конкретной последовательности эталонного полипептида после выравнивания последовательностей и, при необходимости, внедрения разрывов для достижения максимальной процентной идентичности последовательности, без учета консервативных замен как части идентичности последовательностей. Выравнивание для целей определения процентной идентичности аминокислотных последовательностей можно осуществить различными способами, известными специалистам в данной области техники, например, используя общедоступное компьютерное программное обеспечение, например, программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить соответствующие параметры выравнивания последовательностей, включая алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения значения процентной идентичности аминокислотных последовательностей генерируются с использованием компьютерной программы сравнения последовательностей ALIGN-2. Автором компьютерной программы сравнения последовательностей ALIGN-2 является Genentech, Inc., а ее исходный код был подан с пользовательской документацией в Бюро по охране авторских прав США, Вашингтон, округ Колумбия, 20559, где зарегистрирован под номером регистрации авторских прав США TXU510087. Программа ALIGN-2 общедоступна в Genentech, Inc., Саут-Сан-Франциско, Калифорния, или может быть скомпилирована из исходного кода. Программу ALIGN-2 следует компилировать для использования в операционной системе UNIX, в том числе digital UNIX V4.0D. Все параметры сравнения последовательностей устанавливаются программой ALIGN-2 и не подлежат изменению.
В ситуациях, когда ALIGN-2 используют для сравнения аминокислотных последовательностей, % идентичности аминокислотной последовательности данной аминокислотной последовательности A с, по сравнению с или против данной аминокислотной последовательности B (что можно иначе сформулировать так, что данная аминокислотная последовательность A характеризуется или включает определенный % идентичности аминокислотной последовательности с, по сравнению с или против данной аминокислотной последовательности В) рассчитывают как:
100-кратное отношение X/Y
где X - количество аминокислотных остатков, считающихся идентичными совпадениями при выравнивании A и B с помощью программы выравнивания последовательностей ALIGN-2, и где Y - общее количество аминокислотных остатков в В. Следует принимать во внимание, что если длина аминокислотной последовательности А не равна длине аминокислотной последовательности В, то % идентичности аминокислотной последовательности А по отношению к В не равен % идентичности аминокислотной последовательности В по отношению к A. Если не указано иное, все используемые в настоящем документе процентные значения идентичности аминокислотных последовательностей получены, как описано непосредственно в предыдущем абзаце с использованием компьютерной программы ALIGN-2.
Термин "фармацевтический состав" относится к препарату, который находится в такой форме, чтобы обеспечить эффективную биологическую активность активного ингредиента, содержащегося в нем, и не содержит дополнительных компонентов, являющихся неприемлемо токсичными для субъекта, которому композиция должна быть введена.
Термин "фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтическом составе, отличающемуся от активного ингредиента и являющемуся нетоксичным для субъекта. Фармацевтически приемлемый носитель включает буфер, вспомогательное вещество, стабилизатор или консервант, но не ограничивается ими.
В данном контексте термин "лиганд 1 программированной гибели клеток 1", "PD-L1", "лиганд программированного отмирания клеток 1", "кластер дифференцировки 274", "CD274", или "В7 гомолог 1" относится к любому нативному PD-L1 от любого позвоночного животного, включая млекопитающих, таких как приматы (например, человек) и грызуны (например, мыши и крысы), если не указано иное. Этот термин включает "полноразмерный" непроцессированный PD-L1, а также любую форму PD-L1, которая является результатом процессинга в клетке. PD-L1 может существовать в виде трансмембранного белка или в виде растворимого белка. Данный термин также охватывает естественные варианты PD-L1, например, сплайс-варианты или аллельные варианты. Базовая структура PD-L1 состоит из 4 доменов: внеклеточный lg-подобный домен V-типа и внеклеточный lg-подобный домен С2-типа, трансмембранный домен и цитоплазматический домен. Дополнительную информация о человеческом гене PD-L1, в том числе последовательности геномной ДНК, можно найти в NCBI Gene ID NO: 29126. Дополнительную информация о мышином гене PD-L1, в том числе последовательности геномной ДНК, можно найти в NCBI Gene ID NO: 60533. Аминокислотная последовательность типичного полноразмерного человеческого белка PD-L1 показана в SEQ ID NO: 18. Аминокислотную последовательность типичного полноразмерного человеческого белка PD-L1, можно найти, например, под инвентарным номером NCBI NP 001254653 или под инвентарным номером UniProt Q9NZQ7, тогда как последовательность полноразмерного мышиного белка PD-L1 можно найти, например, под инвентарным номером NCBI NP_068693 или под инвентарным номером UniProt Q9EP73.
Термин "антагонист, связывающий ось PD-1" относится к молекуле, которая ингибирует взаимодействие партнера по связыванию оси PD-1 с одним или более из ее партнеров по связыванию с целью устранения дисфункции Т-клеток, возникающей вследствие передачи сигналов на ось передачи сигналов PD-1 - с ожидаемым в последствии восстановлением или усилением функции Т-клеток (например, пролиферации, продукции цитокинов и/или цитотоксического эффекта на клетки-мишени). В данном контексте антагонист, связывающий ось PD-1, включает антагониста, связывающего PD-1, антагониста, связывающего PD-L1, и антагониста, связывающего PD-L2.
В данном контексте термин "антагонист, связывающий PD-L1" представляет собой молекулу, которая уменьшает, блокирует, ингибирует, аннулирует или препятствует трансдукции сигнала в результате взаимодействия PD-L1 с одним или более его партнерами по связыванию, такими как PD-1 и/или В7-1. В некоторых вариантах реализации изобретения антагонист, связывающий PD-L1, представляет собой молекулу, которая ингибирует связывание PD-L1 с его партнерами по связыванию. В конкретном аспекте изобретения антагонист, связывающий PD-L1, ингибирует связывание PD-L1 с PD-1 и/или В7-1. В некоторых вариантах реализации изобретения антагонисты, связывающие PD-L1, включают антитела анти-PD-L1 и их антигенсвязывающие фрагменты, иммуноадгезины, слитые белки, олигопептиды, низкомолекулярные антагонисты, полинуклеотидные антагонисты и другие молекулы, которые уменьшают, блокируют, ингибируют, аннулируют или препятствуют трансдукции сигнала, являющейся следствием взаимодействия PD-L1 с одним или более его партнерами по связыванию, такими как PD-1 и/или В7-1. В одном варианте реализации изобретения антагонист, связывающий PD-L1, уменьшает отрицательный сигнал, опосредованный или проходящий через белки клеточной поверхности, экспрессированные на Т-лимфоцитах и других клетках, опосредующих передачу сигнала через PD-L1 или PD-1, что способствует превращению дисфункциональных Т-клеток в менее дисфункциональные. В некоторых вариантах реализации изобретения антагонист, связывающий PD-L1, представляет собой антитело анти-PD-L1. В конкретном аспекте изобретения антитело анти-PD-L1 представляет собой YW243.55.S70. В другом конкретном аспекте изобретения антитело анти-PD-L1 представляет собой MDX-1105. В еще одном конкретном аспекте изобретения антитело анти-PD-L1 представляет собой MPDL3280A (атезолизумаб). В еще одном конкретном аспекте изобретения антитело анти-PD-L1 представляет собой MEDI4736 (дурвалумаб). В еще одном конкретном аспекте изобретения антитело анти-PD-L1 представляет собой MSB0010718C (авелумаб). MDX-1105, также известный как BMS-936559, представляет собой антитело анти-PD-L1, описанное в WO 007/005874. Антитело YW243.55.S70 представляет собой антитело анти-PD-L1, описанное в WO 2010/077634 и US 8217149, при этом каждая из публикаций в полной мере включена в настоящее описание посредством ссылки.
В данном контексте термин "антагонист, связывающий PD-1" представляет собой молекулу, которая уменьшает, блокирует, ингибирует, аннулирует или препятствует трансдукции сигнала в результате взаимодействия PD-1 с одним или более его партнерами по связыванию, такими как PD-L1 и/или PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, представляет собой молекулу, которая ингибирует связывание PD-1 с его партнерами по связыванию. В конкретном аспекте изобретения антагонист, связывающий PD-1, ингибирует связывание PD-1 с PD- L 1 и/или PD-L2. Например, антагонисты, связывающие PD-1, включают антитела анти-PD-1 и их антигенсвязывающие фрагменты, иммуноадгезины, слитые белки, олигопептиды, низкомолекулярные антагонисты, полинуклеотидные антагонисты и другие молекулы, которые уменьшают, блокируют, ингибируют, аннулируют или препятствуют трансдукции сигнала, являющейся следствием взаимодействия PD-1 с PD-L1 и/или PD-L2. В одном варианте реализации изобретения антагонист, связывающий PD-1, уменьшает отрицательный сигнал, опосредованный или проходящий через белки клеточной поверхности, экспрессированные на Т-лимфоцитах и других клетках, опосредующих передачу сигнала через PD-1 или PD-L1, что способствует превращению дисфункциональных Т-клеток в менее дисфункциональные. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, представляет собой антитело анти-PD-1. В конкретном аспекте изобретения антагонист, связывающий PD-1, представляет собой MDX-1106 (ниволумаб). В другом конкретном аспекте изобретения антагонист, связывающий PD-1, представляет собой МК-3475 (пембролизумаб). В другом конкретном аспекте изобретения антагонист, связывающий PD-1 представляет собой СТ011 (пидилизумаб). В другом конкретном аспекте изобретения антагонист, связывающий PD-1, представляет собой MEDI-0680 (АМР-514). В другом конкретном аспекте изобретения антагонист, связывающий PD-1, представляет собой PDR001. В другом конкретном аспекте изобретения антагонист, связывающий PD-1, представляет собой REGN2810. В другом конкретном аспекте изобретения антагонист, связывающий PD-1, представляет собой BGB-108. В другом конкретном аспекте изобретения антагонист, связывающий PD-1, представляет собой АМР-224. MDX-1106, также известный как MDX 1106-04, ONO-4538, BMS-936558 или ниволумаб, представляет собой антитело анти-PD-l, описанное в WO 2006/121168. АМР-224, известный также как B7-DCIg, представляет собой слитый растворимый рецептор PD-L2-Fc, описанный в WO 2010/027827 и WO 2011/066342.
В данном контексте термины "эталонный образец", "эталонная клетка", "эталонная ткань", "контрольный образец", "контрольная клетка" или "контрольная ткань" относятся к образцу, клетке, ткани, стандарту или уровню, которые используются для целей сравнения. В одном варианте реализации изобретения эталонный образец, эталонную клетку, эталонную ткань, контрольный образец, контрольную клетку или контрольную ткань получают из здоровой и/или не пораженной части организма (например, из ткани или клеток) одного и того же субъекта или индивидуума Например, эталонным образцом, эталонной клеткой, эталонной тканью, контрольным образцом, контрольной клеткой или контрольной тканью могут быть здоровые и/или не пораженные клетки или ткань, прилегающие к пораженным клеткам или ткани (например, клетки или ткань, прилегающие к опухоли). В другом варианте реализации изобретения эталонный образец получают из ткани и/или клетки организма одного и того же субъекта или индивидуума, не получавшего лечения. В еще одном варианте реализации изобретения эталонный образец, эталонную клетку, эталонную ткань, контрольный образец, контрольную клетку или контрольную ткань получают из здоровой и/или не пораженной части организма (например, из тканей или клеток) индивидуума, который не является субъектом или индивидуумом. В еще одном варианте реализации изобретения эталонный образец, эталонную клетку, эталонную ткань, контрольный образец, контрольную клетку или контрольную ткань получают из ткани и/или клетки организма индивидуума, который не является субъектом или индивидуумом и не получал лечения.
"Индивидуальный ответ" или "ответ" может быть оценен с использованием любого критерия оценки, свидетельствующего об эффективности для индивидуума, включая, но не ограничиваясь этим: (1) ингибирование, до некоторой степени, прогрессирования заболевания (например, прогрессирование рака), включая замедление и полное подавление; (2) уменьшение размера опухоли; (3) ингибирование (т.е. уменьшение, замедление или полное прекращение) инфильтрации раковых клеток в прилегающих периферических органах и/или тканях; (4) ингибирование (т.е. уменьшение, замедление или полное прекращение) метастазирования; (5) купирование, до некоторой степени, одного или более симптомов, связанных с заболеванием или нарушением (например, раком); (6) увеличение или продолжение периода выживаемости, включая общую выживаемость и выживаемость без прогрессирования; и/или (9) снижение смертности в данный момент времени после лечения.
"Эффективный ответ" нациста "восприимчивость" пациента на лечение лекарственным средством и аналогичные формулировки относятся к клинической или терапевтической эффективности, которая отмечается у пациента, страдающего от заболевания или нарушения, такого как рак, или имеющего риск его развития. В одном варианте реализации изобретения такая эффективность включает любой один или более из следующих параметров: увеличение выживаемости (включая общую выживаемость и выживаемость без прогрессирования); полученный объективный ответ (включая полный ответ или частичный ответ); или купирование признаков или симптомов рака. В одном варианте реализации изобретения биомаркер (например, экспрессия PD-L1, определяемая, к примеру, с помощью ИГХ) используется для идентификации пациента, который, по прогнозам, с большей вероятностью будет отвечать на лечение лекарственным средством (например, на лечение, включающее противораковый препарат) по сравнению с пациентом, у которого биомаркер не экспрессируется. В одном варианте реализации изобретения биомаркер (например, экспрессия PD-L1, определяемая, к примеру, с помощью ИГХ) используется для идентификации пациента, который, по прогнозам, с большей вероятностью будет отвечать на лечение лекарственным средством (например, противораковым препаратом) по сравнению с пациентом, у которого биомаркер не экспрессируется на том же уровне. В одном варианте реализации изобретения наличие биомаркера используется для идентификации пациента, который с большей вероятностью будет отвечать на лечение лекарственным средством по сравнению с пациентом, у которого биомаркер не определяется. В другом варианте реализации изобретения наличие биомаркера используется для определения того, будет ли у пациента с большей вероятностью отмечаться эффективность лечения лекарственным средством по сравнению с пациентом, у которого биомаркер не определяется.
Термин "объективный ответ" относится к измеримому ответу, включая полный ответ (ПО) или частичный ответ (ЧO). В некоторых вариантах реализации изобретения "частота объективного ответа ЧOO)" относится к сумме частоты полного ответа (ПО) и частоты частичного ответа (ЧО).
Под термином "полный ответ" или "ПО" подразумевают исчезновение всех признаков рака (например, исчезновение всех целевых поражений) в ответ на лечение. Это не всегда означает, что рак вылечен.
Термин "устойчивый ответ" относится к устойчивому эффекту, проявляющемуся в замедлении роста опухоли после прекращения лечения. Например, размер опухоли может остаться тем же или уменьшиться по сравнению с размером в начале периода введения препарата. В некоторых вариантах реализации изобретения устойчивый ответ имеет длительность по меньшей мере такую же, как и длительность лечения, или по меньшей мере эквивалентную 1,5-, 2,0-, 2,5- или 3,0-кратному периоду длительности лечения или больше.
В данном контексте термин "ослабление или ингибирование рецидива рака" означает ослабление или ингибирование рецидива опухоли или рака заболевания или прогрессирования опухоли или рака. Как описано в настоящем документе, рецидивы рака и/или прогрессирование рака включают, без ограничения, раковые метастазы.
В данном контексте термин "частичный ответ" или "ЧО" относится к уменьшению размера одной или более опухолей или поражений, или к снижению степени рака в организме в ответ на лечение. Например, в некоторых вариантах реализации изобретения ЧО относится к уменьшению суммы самых длинных диаметров (ССДД) целевых поражений по меньшей мере на 30%, принимая в качестве эталона исходную ССДД.
В данном контексте термин "стабильное заболевание" или "СЗ" означает отсутствие как достаточной рецессии целевых поражений, чтобы претендовать на ЧО, так и достаточного увеличения, чтобы претендовать на прогрессирующее заболевание (ПЗ), принимая в качестве эталона наименьшую ССДД с момента начала лечения.
В данном контексте термин "прогрессирующее заболевание" или "ПЗ" относится к увеличению ССДД целевых поражений по меньшей мере на 20%, принимая в качестве эталона наименьшую ССДД с момента начала лечения, или наличию одного или более новых поражений.
Термин "выживаемость" относится к пациенту оставшихся в живых, и включает общую выживаемость, а также выживаемость без прогрессирования.
В данном контексте термин "выживаемость без прогрессирования" (ВБП) относится к продолжительности времени в ходе и после лечения, в течение которого заболевание, подлежащее лечению (например, рак), не прогрессирует. Выживаемость без прогрессирования может включать количество времени, когда у пациентов регистрировали полный ответ или частичный ответ, а также количество времени, когда у пациентов определяли стабильное заболевание.
В данном контексте термин "общая выживаемость" (ОВ) относится к проценту индивидуумов в группе, которые, вероятно, будут в живых по истечению определенного периода времени.
Под термином "удлинение выживаемости" подразумевается увеличение общей выживаемости или выживаемости без прогрессирования у пролеченного пациента, по сравнению с нелеченным пациентом (т.е. по сравнению с пациентом, не получавшим лечение лекарственным средством), или по сравнению с пациентом, у которого не определяется надлежащий уровень экспрессии биомаркеров, и/или по сравнению с пациентом, получавшим лечение противоопухолевым агентом, разрешенным к медицинскому применению.
В настоящем изобретении под термином "срез" образца ткани подразумевают отдельную часть или фрагмент образца ткани, например, тонкий срез ткани или клеток, вырезанный из образца ткани (например, опухолевый образец). Следует понимать, что могут быть получены и подвергнуты анализу множество срезов образцов ткани, при этом подразумевается, что один и тот же срез образца ткани может быть проанализирован как на морфологическом, так и на молекулярном уровне, или проанализирован в отношении полипептидов (например, иммуногистохимически) и/или полинуклеотидов (например, с помощью гибридизации in situ).
В данном контексте термин "специфически связывается с" или "специфический для" относится к поддающимся измерению и воспроизводимым взаимодействиям, таких как связывание между мишенью и антителом, которое является определяющим фактором наличия мишени при наличии гетерогенной популяции молекул, в том числе биологических молекул. Например, антитело, которое специфически связывается с мишенью (которой может быть эпитоп, например, аминокислотные остатки 279-290 человеческого PD-L1 (SEQ ID NO: 1)), представляет собой антитело, которое связывается с этой мишенью с большей аффинностью, авидностыо, большей легкостью и/или большей продолжительностью, чем он связывается с другими мишенями. В одном варианте реализации изобретения степень связывания антитела с неродственной мишенью составляет менее чем около 10% связывания антитела с мишенью при измерении, например, с помощью радиоиммуноанализа (РИА). В некоторых вариантах реализации изобретения антитело, которое специфически связывается с мишенью, имеет константы диссоциации (Kd) от ≤1 мкМ, ≤100 нМ, ≤10нМ, ≤1 нм или ≤0,1 нМ. В некоторых вариантах реализации изобретения антитело специфически связывается с эпитопом на белке, который является консервативным среди белка различных видов животных. В другом варианте реализации изобретения специфическое связывание может включать исключительное связывание, но не требует его.
"Субъект" или "индивидуум" является млекопитающим. Млекопитающие включают одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и приматов, не являющихся людьми, например, обезьян), кроликов и грызунов (например, мышей и крыс), но не ограничиваются ими. В некоторых вариантах реализации изобретения индивидуум или субъект является человеком.
В данном контексте термин "по существу аналогичный" обозначает достаточно высокую степень сходства между двумя числовыми значениями, заключающуюся в том, чтобы специалист в данной области техники, учитывая различие между этими двумя значениями, удостоверился в его незначительной или вообще отсутствующей биологической и/или статистической значимости для биологической характеристики, измеренной с помощью указанных значений (например, значения Kd или уровни экспрессии). Различие между указанными двумя значениями, составляет, например, менее чем около 50%, менее чем около 40%, менее чем около 30%, менее чем около 20%, и/или менее чем около 10%. как функция значения эталона/компаратора.
В данном контексте фраза "по существу несходный" обозначает достаточно высокую степень различия между двумя числовыми значениями, заключающуюся в том, чтобы специалист в данной области техники, учитывая различие между этими двумя значениями, удостоверился в его биологической и/или статистической значимости для биологической характеристики, измеренной с помощью указанных значений (например, значения Kd или уровни экспрессии). Различие между указанными двумя значениями, составляет, например, более чем около 10%, более чем около 20%, более чем около 30%, более чем около 40% и/или более чем около 50%, как функция значения эталонной/компараторной молекулы.
"Т-клеточная дисфункциональное нарушение" представляет собой нарушение или патологическое состояние Т-клеток, характеризующееся повышенной или пониженной чувствительностью к антигенной стимуляции. В конкретном варианте реализации изобретения Т-клеточное дисфункциональное нарушение представляет собой нарушение, которое специфически ассоциировано с нефизиологическим повышением передачи сигналов посредством PD-1/PD-L1 и/или PD-L1/B7.1. В другом варианте реализации изобретения Т-клеточное дисфункциональное нарушение является таким, при котором Т-клетки являются анергическими или имеют пониженную способность к секреции цитокинов, пролиферирации и выполнению цитолитических функций. В другом варианте реализации изобретения дисфункция Т-клетки является таким состоянием, при котором возникает истощение Т-клеток от непрерывной передачи сигналов TCR, что происходит при многих хронических инфекциях и раке. Это состояние отличается от анергии тем, что оно возникает не из-за неполной или недостаточной передачи сигналов, а от непрерывной передачи сигналов. Оно определяется слабой эффекторной функцией, устойчивой экспрессией ингибиторных рецепторов и транскрипционным состоянием, отличающимся от функциональных эффекторных клеток или Т-клеток памяти. Истощение препятствует оптимальному контролю за инфекцией и опухолью. Истощение может быть результатом как внешних отрицательных регуляторных путей (например, иммунорегуляторных цитокинов), гак и клеточных внутренних отрицательных регуляторных (костимуляторных) путей (PD-1, В7-Н3, В7-Н4 и т.д.) В конкретном аспекте изобретения сниженная иммунологическая реактивность приводит к неэффективному контролю патогена или опухоли, экспрессирующей иммуноген. Примеры Т-клеточных дисфункциональных нарушений, характеризующихся дисфункцией Т-клеток, включают неразрешенную острую инфекцию, хроническую инфекцию и невосприимчивость опухоли.
В настоящем документе термин "лечение" (и его грамматические варианты, такие как "лечить" или "воздействовать") относится к клиническому вмешательству в попытке изменить естественную динамику состояния индивидуума, подвергаемого лечению, и может применяться как для профилактики, так для воздействия на уже существующую клиническую патологию. Желательные эффекты лечения включают предотвращение возникновения или возобновления заболевания, облегчение симптомов, уменьшение прямых или косвенных патологических последствий заболевания, предотвращение метастазирования, снижение скорости прогрессирования заболевания, улучшение или паллиативное лечение патологического состояния, а также ремиссию или улучшение прогноза, но не ограничиваются ими. В некоторых вариантах реализации изобретения антитела (например, антитела анти-PD-l и/или антитела анти-PD-L1) используют для задержки развития заболевания или замедления прогрессирования заболевания.
В данном контексте термин "опухоль" относится ко всем процессам неопластического роста и пролиферации клеток, будь то злокачественные или доброкачественные процессы, и всем предраковым и раковым клеткам и тканям. Термины "рак", "раковый" и "опухоль" не являются взаимоисключающими, как это указано в данном описании.
В данном контексте термин "проникающая в опухоль иммунная клетка" относится к любой иммунной клетке, присутствующей в опухоли или ее образце. Проникающие в опухоль иммунные клетки включают, но не ограничиваются ими, внутриопухолевые иммунные клетки, перитуморальные иммунные клетки, другие опухолевые стромальные клетки (например, фибробласты) или любую их комбинацию. Такими проникающими в опухоль иммунными клетками могут быть, например, Т-лимфоциты (такие как CD8+ Т-лимфоциты и/или CD4+ Т-лимфоциты), В-лимфоциты или другие клетки, дифференцирующиеся в костном мозге, в том числе гранулоциты (например, нейтрофилы, эозинофилы и базофилы), моноциты, макрофаги, дендритные клетки (например, интердигитальные дендритные клетки), гистиоциты и натуральные клетки-киллеры.
В данном контексте термин "опухолевая клетка" относится к любой опухолевой клетке, присутствующей в опухоли или ее образце. Опухолевые клетки можно отличить от других клеток, которые могут присутствовать в образце опухоли, например, стромальных клеток и проникающих в опухоль иммунных клеток, с использованием способов, известных в данной области техники и/или описанных в настоящем документе.
"Невосприимчивость опухоли" относится к процессу, при котором опухоль уклоняется от иммунного распознавания и устранения. Таким образом, в качестве терапевтической концепции, невосприимчивость опухоли является "пролеченным", если такое уклонение ослабляется, а опухоли распознаются и атакуются иммунной системой. Примеры распознавания опухоли включают связывание опухоли, уменьшение размеров опухоли и устранение опухоли.
Термин "терапевтически эффективное количество" относится к количеству терапевтического агента для лечения или профилактики заболевания или нарушения у млекопитающего. В случае рака, терапевтически эффективное количество терапевтического агента может уменьшить число раковых клеток; уменьшить первичный размер опухоли; ингибировать (т.е. замедлить до некоторой степени и предпочтительно остановить) инфильтрацию раковых клеток в периферические органы; ингибировать (т.е. замедлить до некоторой степени и предпочтительно остановить) метастазирование опухоли; ингибировать до некоторой степени рост опухоли; и/или облегчить до некоторой степени один или более симптомов, связанных с нарушением. До некоторой степени препарат может предотвратить рост и/или разрушать существующие раковые клетки, причем он может быть цитостатическим и/или цитотоксическим. Для терапии рака эффективность in vivo может, например, быть измерена путем оценки длительности выживаемости, времени до прогрессирования заболевания (ВДПЗ), уровня ответа (например. ПО и ЧО), длительности ответа и/или качества жизни.
Термин "вариабельная область" или "вариабельный домен" относится к домену тяжелой или легкой цепи антитела, участвующему в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL, соответственно) нативного антитела обычно обладают аналогичной структурой, причем каждый домен содержит четыре консервативные каркасные области (FR) и три гипервариабельные области (HVR). См., например, Kindt et al. Kuby Immunology. 6th ed., page 91, W.H. Freeman and Co., 2007. Одного VH- или VL-домена может быть достаточно для придания антигенсвязывающей специфичности. Кроме того, антитела, связывающиеся с конкретным антигеном, можно выделить, используя VH- или VL-домен антитела, связывающегося с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов, соответственно. См., например, Portolano et al. J. Immunol. 150: 880-887, 1993 и Clarkson et al. Nature. 352: 624-628, 1991.
Термин "нумерация остатков вариабельных доменов по Кэботу" или "нумерация положений аминокислот по Кэботу" и их вариации, относятся к системе нумерации, используемой для вариабельных доменов тяжелой цепи или вариабельных доменов легкой цепи компиляции антител в Kabat et al., выше. Используя эту систему нумерации, фактическая линейная аминокислотная последовательность может содержать меньше аминокислот или дополнительные аминокислоты, соответствующие укорочению или вставке в FR или HVR вариабельного домена. Например, вариабельный домен тяжелой цепи может включать вставку одной аминокислоты (остаток 52а согласно нумерации Кэбота) после остатка 52 Н2 и вставленные остатки (например, остатки 82а, 82b и 82с и т.д. согласно нумерации Кэбота) после остатка 82 тяжелой цепи FR. Нумерация остатков по Кэботу может быть определена для данного антитела при выравнивании в областях гомологии последовательности антитела с помощью "стандартной" последовательности, нумерованной по Кэботу.
Как правило, система нумерации Кэбота используется, когда речь идет об остатке в вариабельном домене (приблизительно остатки 1-107 легкой цепи и остатки 1-113 тяжелой цепи) (например, Kabat et al., Sequences of Immunological Interest. 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Как правило, "система нумерации ЕС" или "индекс ЕС" используется, когда речь идет об остатке в константной области тяжелой цепи иммуноглобулина (например, индекс ЕС, описанный в Kabat et al., выше). "Индекс ЕС согласно нумерации Кэбота" относится к нумерации ЕС остатков антитела IgG1 человека.
В данном контексте термин "вектор" относится к молекуле нуклеиновой кислоты, способной репродуцировать другую нуклеиновую кислоту, с которой она связана. Этот термин включает вектор как самореплицирующуюся нуклеотидную структуру, а также вектор, включенный в геном клетки-хозяина, в которую он внедрен. Некоторые векторы способны управлять экспрессией нуклеиновых кислот, с которыми они функционально связаны. Такие векторы в настоящем документе называют "экспрессионными векторами".
В данном контексте "агент ингибирования роста" относится к соединению или композиции, которые ингибируют рост и/или пролиферацию клетки (например, клетки, рост которой зависит от экспрессии PD-L1) либо in vitro, либо in vivo. Таким образом, агентом ингибирования роста может быть такой агент, который значительно уменьшает процент клеток в S-фазе. Примеры агентов ингибирования роста включают агентов, которые блокируют прогрессию клеточного цикла (на месте, за исключением S-фазы), такие как агенты, индуцирующие полное подавление G1 и полное подавление М-фазы. Классические блокаторы М-фазы включают алкалоиды барвинка (винкристин и винбластин), таксаны и ингибиторы топоизомеразы II, такие как антрациклиновый антибиотик доксорубицин ((8S-цис) -10 -[(3-амино-2,3,6-тридеокси-α-L-ликсо-гексапиранозил)окси] -7,8,9,10-тетрагидро-6,8,11-тригидрокси-8- (гидроксиацетил)-1-метокси-5,12-нафтацендион), эпирубицин, даунорубицин, этопозид и блеомицин. Те агенты, которые полностью подавляют G1, также подавляют и S-фазу, например, ДНК-алкилирующие агенты, такие как тамоксифен, преднизон, дакарбазин, мехлорэтамин, цисплатин, метотрексат, 5-фторурацил и ara-С. Дополнительную информацию можно найти в "The Molecular Basis of Cancer," Mendelsohn and Israel, eds., Глава 1, имеющая название "Cell cycle regulation, oncogenes, and antineoplastic drugs" Murakami et al. (WB Saunders: Philadelphia, 1995), в частности ст. 13. Таксаны (паклитаксел и доцетаксел) представляют собой противораковые препараты, оба из которых получены из тисового дерева. Доцетаксел (ТАКСОТЕР®, Rhone-Poulenc Rorer), полученный из тиса европейского, представляет собой полусинтетический аналог паклитаксела (ТАКСОЛ®, Bristol-Myers Squibb). Паклитаксел и доцетаксел стимулируют сборку микротрубочек из димеров тубулина и стабилизируют микротрубочки путем предотвращения деполимеризации, что приводит к ингибированию митоза в клетках.
Под термином "лучевая терапия" подразумевают использование направленных гамма-лучей или бета-лучей для индуцирования достаточного повреждения клетки, чтобы ограничить ее способность функционировать в нормальном режиме или разрушить клетку в целом. Следует принять во внимание, что существует много способов для определения дозировки и длительности лечения, известных в данной области техники. Типичные способы лечения приведены как одноразовые введения и с типичным диапазоном дозы, составляющем от 10 до 200 единиц (грей) в сутки.
В данном контексте термины "пациент" или "субъект" используются взаимозаменяемо и относятся к любому одному животному, более предпочтительно - млекопитающему (включая животных нечеловеческого вида, таких как, например, собаки, кошки, лошади, кролики, животных зоопарка, коровы, свиньи, овцы и нечеловекообразные приматы), которому требуется лечение. В конкретных вариантах реализации настоящего изобретения пациентом являе тся человек.
В данном контексте термин "введение" означает способ получения дозы соединения (например, противоракового терапевтического агента) или фармацевтической композиции (например, фармацевтической композиции, включающей противораковый терапевтический агент) субъектом (например, пациентом). Введение может быть осуществлено любыми пригодными способами, включая парентеральный, внутрилегочной и назальный, и в случае желательного местного лечения - путем внутриочагового введения. Парентеральные инфузии включают, например, внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Введение дозы может быть осуществлено любым пригодным способом, например, с помощью инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является ли введение кратковременным или длительным. В настоящем документе рассмотрены различные схемы введения доз, включая одно или множество введений в различные моменты времени, болюсное введение и пульс-терапию, но не ограничиваясь ими.
В данном контексте термин "одновременно" используется для обозначения введения двух или более терапевтических агентов, когда по меньшей мере часть введения перекрывается по времени. Соответственно, одновременное введение включает схему введения, при которой введение одного или более агента (агентов) продолжается после прекращения введения одного или более других агентов.
II. Композиции и способы
Настоящее изобретение относится к новым антителам, которые связываются с PD-L1. Антитела по настоящему изобретению могут быть использованы, например, для обнаружения наличия PD-L1 или уровня экспрессии PD-L1 (например, в биологических образцах, включая образцы опухоли).
А. Типичные антитела анти-PD-L1
Настоящее изобретение относится к антителам анти-PD-L1, пригодным, например, для диагностического применения (например, иммуногистохимии (ИГХ), иммунофлюоресценции (ИФ) и иммуноблота (например, Вестерн-блота)). В одном примере настоящего изобретения предлагаются антитела анти-PD-L1, которые связываются с эпитопом, включая аминокислотные остатки 279-290 из PD-L1 (например, аминокислотные остатки 279-290 человеческого PD-L1 SKKQSDTHLEET (SEQ ID NO: 1)), который является частью N-концевой цитоплазматической области человеческого PD-L1. Эпитоп на PD-L1 может быть распознан в способ, который является конформационно-зависимым или конформационно-независимым.
В некоторых случаях антитела анти-PD-L1, которые связываются с аминокислотными остатками 279-290 из PD-L1, включают по меньшей мере один, два, три, четыре, пять или шесть HVR. выбранных из (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 3; (с) HVR-H3, содержащей аминокислотную последовательность SEQ ID NO: 4; (d) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO: 9; (e) HVR-L2, содержащей аминокислотную последовательность SEQ ID NO: 10; и (f) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11. Например, в некоторых случаях антитела анти-PD-L1 включают (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 3; и (с) HVR-Н3, содержащую аминокислотную последовательность SEQ ID NO: 4. В некоторых случаях антитела анти-PD-L1 включают (a) HVR- L1, содержащую аминокислотную последовательность SEQ ID NO: 9: (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (с) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11.
В некоторые случаях, когда антитела анти-PD-L1 связываются с аминокислотными остатками 279-290 из PD-L1, они включают (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 3; и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 4, антитела анти-PD-L1 дополнительно включают следующие каркасные области (FR) вариабельного домена тяжелой цепи: (a) FR-H1, содержащую аминокислотную последовательность QSLEESGGRLVKPDETLTITCTVSGIDLS (SEQ ID NO: 5); (b) FR-H2, содержащую аминокислотную последовательность WVRQAPGEGLEWIG (SEQ ID NO: 6); (c) FR-H3, содержащую аминокислотную последовательность RLTISKPSSTKVDLKITSPTTEDTATYFCGR (SEQ ID NO: 7); или (d) FR-H4, содержащую аминокислотную последовательность WGPGTLVTVSS (SEQ ID NO: 8). В некоторые случаях, когда антитела анти-PD-L1 связываются с аминокислотными остатками 279-290 из PD-L1, они включают (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 3; и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 4, антитела анти-PD-L1 дополнительно включают следующие каркасные области (FR) вариабельного домена тяжелой цепи: (a) FR-H1, содержащую аминокислотную последовательность QSLEESGGRLVKPDETLTITCTVSGIDLS (SEQ ID NO: 5); (b) FR-H2. содержащую аминокислотную последовательность WVRQAPGEGLEWIG (SEQ ID NO: 6), (c) FR-H3, содержащую аминокислотную последовательность RLTISKPSSTKVDLKITSPTTEDTATYFCGR (SEQ ID NO: 7); и (d) FR-H4, содержащую аминокислотную последовательность WGPGTLVTVSS (SEQ ID NO: 8).
В некоторые случаях, когда антитела анти-PD-L1 связываются с аминокислотными остатками 279-290 из PD-L1, антитела включают (a) FIVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 3; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 4; (d) HVR-L1, содержащей аминокислотную последовательность QASESVYSNNYLS (SEQ ID NO: 9); (e) HVR-L2, содержащую аминокислотную последовательность LASTLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащую аминокислотную последовательность IGGKSSSTDGNA (SEQ ID NO: 11). В некоторых случаях эти антитела анти-PD-L1 включают следующие FR: (a) FR-H1, содержащую аминокислотную последовательность QSLEESGGRLVKPDETLTITCTVSGIDLS (SEQ ID NO: 5); (b) FR-H2, содержащую аминокислотную последовательность WVRQAPGEGLEWIG (SEQ ID NO: 6); (с) FR-H3, содержащую аминокислотную последовательность RLTISKPSSTKVDLKITSPTTEDTATYFCGR (SEQ ID NO: 7); и (d) FR-H4, содержащую аминокислотную последовательность WGPGTLVTVSS (SEQ ID NO: 8) и может дополнительно или альтернативно включать (е) FR-L1, содержащую аминокислотную последовательность AIVMTQTPSPVSAAVGGTVTINC (SEQ ID NO: 12); (f) FR-L2, содержащую аминокислотную последовательность WFQQKPGQPPKLLIY (SEQ ID NO: 13); (g) FR-L3, содержащую аминокислотную последовательность GVPSRFKGSGSGTQFTLTISGVQCDDAATYYC (SEQ ID NO: 14); и (h) FR-L4, содержащую аминокислотную последовательность FGGGTEVVVR (SEQ ID NO: 15).
В некоторых случаях антитела анти-PD-L1, которые связываются с аминокислотными остатками 279-290 из PD-L1. могут также включать последовательность вариабельного домена тяжелой цепи (VH), имеющую по меньшей мере 80% (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%), по меньшей мере 90% (например, по меньшей мере 91%, 92%, 93%, или 94%), или по меньшей мере 95% (например, по меньшей мере 96%, 97%, 98%, или 99%) идентичность последовательности, или последовательности, аминокислотной последовательности SEQ ID NO: 16. В некоторых вариантах реализации изобретения VH-последовательность, обладающая по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), вставки или делеции по сравнению с эталонной последовательностью (SEQ ID NO: 16), а антитело анти-PD-L1, содержащее такую последовательность, сохраняет способность связываться с PD-L1. В некоторых вариантах реализации изобретения в общей сложности от 1 до 10 аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) замещены, вставлены и/или удалены в SEQ ID NO: 16. В некоторых вариантах реализации замены, вставки или делеции присутствуют в областях, расположенных вне HVR (т.е. в FR). В некоторых случаях антитела анти-PD-L1 включают VH-последовательность в SEQ ID NO: 16, включая посттрансляционные модификации этой последовательности. В конкретном варианте реализации изобретения VH содержит одну, две или три HVR, выбранные из: (a) HVR-H1, содержащей аминокислотную последовательность SEQ ID NO: 2, (b) HVR-H2, содержащей аминокислотную последовательность SEQ ID NO: 3, и (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 4.
В некоторых случаях антитела анти-PD-L1, которые связываются с аминокислотными остатками 279-290 из PD-L1, могут также включать вариабельный домен легкой цепи (VL), имеющую по меньшей мере 80% (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%), по меньшей мере 90% (например, по меньшей мере 91%, 92%. 93%, или 94%), или по меньшей мере 95% (например, по меньшей мере 96%, 97%, 98%, или 99%) идентичность последовательности, или последовательности, аминокислотной последовательности SEQ ID NO: 17. В некоторых вариантах реализации изобретения VL-последовательность, обладающая по меньшей мере 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью, содержит замены (например, консервативные замены), вставки или делеции по сравнению с эталонной последовательностью (SEQ ID NO: 17), а антитело анти-PD-L1, содержащее такую последовательность, сохраняет способность связываться с PD-L1. В некоторых вариантах реализации изобретения в общей сложности от 1 до 10 аминокислот (например, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) замещены, вставлены и/или удалены в SEQ ID NO: 17. В некоторых вариантах реализации замены, вставки или делеции присутствуют в областях, расположенных вне HVR (т.е. в FR). В некоторых случаях антитело анти-PD-L1 содержит VL-последовательность в SEQ ID NO: 17, включая посттрансляционные модификации этой последовательности. В конкретном варианте реализации изобретения VL содержит одну, две или три HVR, выбранные из (a) HVR-L1, содержащей аминокислотную последовательность SEQ ID NO:: 9; (b) HVR-L2, содержащую аминокислотную последовательность SEQ ID NO: 10; и (с) HVR-L3, содержащую аминокислотную последовательность SEQ ID NO: 11.
В некоторых случаях антитела анти-PD-L1, которые связываются с аминокислотными остатками 279-290 из PD-L1 включают как VH-, так и VL-последовательности, имеющие по меньшей мере 80% (например, по меньшей мере 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88% или 89%), по меньшей мере 90% (например, по меньшей мере 91%, 92%, 93%, или 94%), или по меньшей мере 95% (например, по меньшей мере 96%, 97%. 98%, или 99%) идентичность последовательности, или последовательностям, аминокислотным последовательностям SEQ ID NO: 16 и 17, соответственно, и могут включать или не включать посттрансляционные модификации этих последовательностей.
В некоторых случаях в настоящем изобретении предлагаются антитела, которые специфически связываются с PD-L1, причем антитела включают (a) HVR-H1, содержащую аминокислотную последовательность SEQ ID NO: 2; (b) HVR-H2, содержащую аминокислотную последовательность SEQ ID NO: 3; (с) HVR-H3, содержащую аминокислотную последовательность SEQ ID NO: 4; (d) HVR-L1, содержащей аминокислотную последовательность QASESVYSNNYLS (SEQ ID NO: 9); (e) HVR-L2, содержащую аминокислотную последовательность LASTLAS (SEQ ID NO: 10); и (f) HVR-L3, содержащую аминокислотную последовательность IGGKSSSTDGNA (SEQ ID NO: 11). В некоторых случаях эти антитела анти-PD-L1 включают следующие FR: (a) FR-H1, содержащую аминокислотную последовательность QSLEESGGRLVKPDETLTITCTVSGIDLS (SEQ ID NO: 5); (b) FR-H2, содержащую аминокислотную последовательность WVRQAPGEGLEWIG (SEQ ID NO: 6); (c) FR-H3, содержащую аминокислотную последовательность RLTISKPSSTKVDLKITSPTTEDTATYFCGR (SEQ ID NO: 7); и (d) FR-H4, содержащую аминокислотную последовательность WGPGTLVTVSS (SEQ ID NO: 8) и может дополнительно или альтернативно включать (е) FR-L1, содержащую аминокислотную последовательность AIVMTQTPSPVSAAVGGTVTINC (SEQ ID NO: 12); (f) FR-L2, содержащую аминокислотную последовательность WFQQKPGQPPKLLIY (SEQ ID NO: 13); (g) FR-L3, содержащую аминокислотную последовательность GVPSRFKGSGSGTQFTLTISGVQCDDAATYYC (SEQ ID NO: 14); и (h) FR-L4, содержащую аминокислотную последовательность FGGGTEVVVR (SEQ ID NO: 15). В некоторых вариантах реализации изобретения, например, антитела анти-PD-L1 включают как VH-, так и VL-последовательность, содержащих последовательности аминокислотных последовательностей SEQ ID NO: 16 и 17. соответственно, и могут включать или не включать посттрансляционные модификации.
Например, в настоящем изобретении предлагаются антитела анти-PD-L1, такие как антитело SP142 анти-PD-L1, со следующими последовательностями вариабельных областей тяжелой и легкой цепей.
Аминокислотная последовательность вариабельной области тяжелой цепи SP142 является следующей:
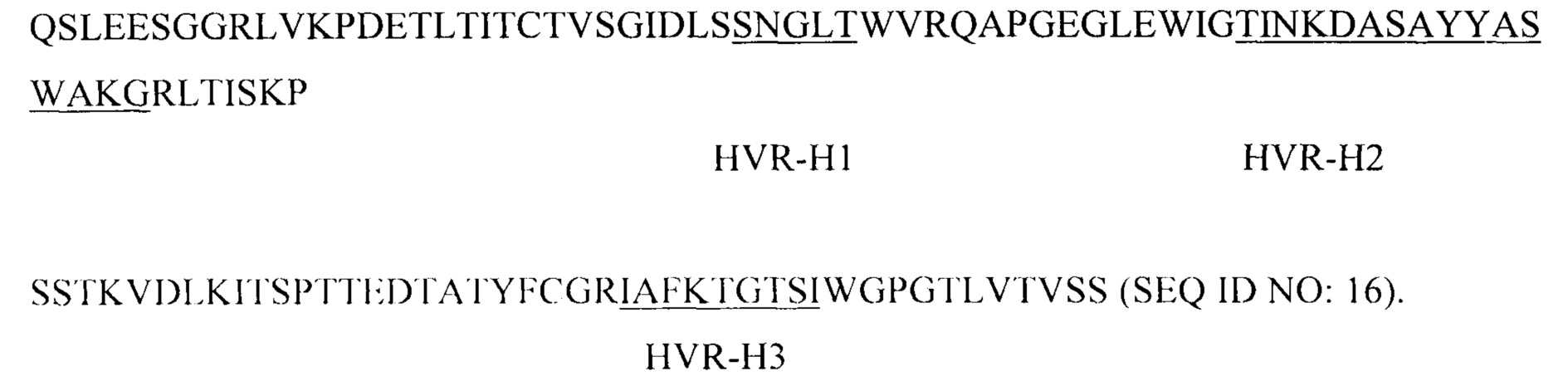
Аминокислотная последовательность вариабельной области легкой цепи SP142 является следующей:
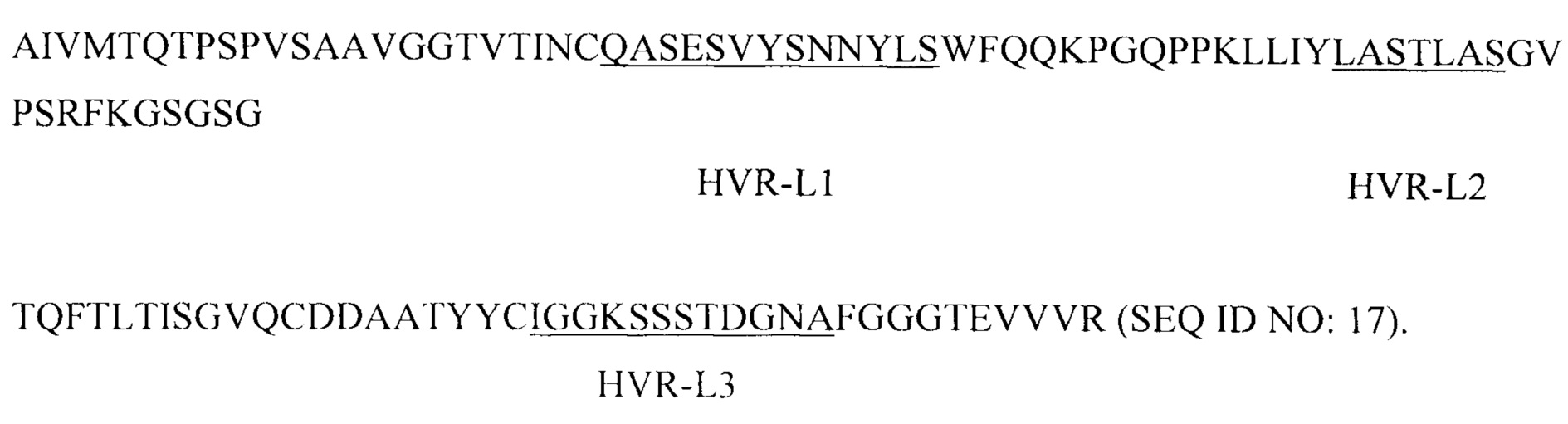
В некоторых случаях антитела анти-PD-L1 по настоящему изобретению представляют собой антитела, которые конкурируют за связывание с PD-L1 с любым одним или более антителами анти-PD-L1, описанными выше. В некоторых случаях антитела анти-PD-L1 по настоящему изобретению представляют собой антитела, которые связываются с тем же эпитопом или по существу с тем же эпитопом, что и любое одно или более антител анти-PD-L1, описанных выше.
В некоторых случаях антитело анти-PD-L1 согласно любому из вышеупомянутых вариантов реализации изобретения может быть моноклональным антителом, включая химерное, гуманизированное или человеческое антитело. В одном варианте реализации изобретения антитело анти-PD-L1 представляет собой фрагмент антитела, например, Fv, Fab, Fab', scFv, диатело или F(ab')2-фрагмснт. В еще одном варианте реализации изобретения антитело является полноразмерным антителом, например, интактным антителом IgG (например, интактным антителом IgG1) или антителом другого класса или изотипа, согласно определению в настоящем документе.
Следует понимать, что антитела анти-PD-L1 согласно настоящему изобретению, являясь пригодными для обнаружения наличия или уровня экспрессии PD-L1 в биологическом образце, как продемонстрировано в примерах ниже, также могут быть использованы или адаптированы для терапевтического применения.
В дополнительном аспекте антитела анти-PD-L1 согласно любому из вышеупомянутых вариантов реализации изобретения могут включать любую из характеристик по отдельности или в комбинации, как описано в разделах 1-5 ниже.
1. Аффинность антитела
В некоторых вариантах реализации изобретения антитело, описанное в настоящем документе, имеет константы диссоциации (Kd) от ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нм, ≤0,1 нм, ≤0,01 нм или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
В одном варианте реализации изобретения Kd измеряют с помощью анализа связывания антигена, меченого радиоактивной меткой (РИА), выполняемого с использованием Fab-версии исследуемого антитела и его антигена, как описано в следующем анализе. Аффинность связывания Fab с антигеном в растворе измеряют путем уравновешивания Fab с минимальной концентрацией (125I)-меченого антигена в присутствии серии разведений немеченого антигена, с последующим захватом связанного антигена с помощью планшета с иммобилизованным антителом против Fab (см., например, Chen et al. J. Mol. Biol. 293: 865-881, 1999). Для стабилизации условий анализа многолуночные планшеты MICROTITER® (Thermo Scientific) покрывали в течение ночи 5 мкг/мл антитела для захвата Fab (Cappel Labs) в 50 мМ растворе карбоната натрия (pH 9,6), а затем блокировали 2% (масс/об) раствором бычьего сывороточного альбумина в PBS в течение двух - пяти часов при комнатной температуре (около 23°C). В неадсорбирующем планшете (Nunc №269620) смешивали 100 пМ или 26 пМ [1251]-антигена с последовательно разбавленными растворами исследуемых Fab (например, в соответствии с оценкой антитела Fab-12 против ФРЭС (фактора роста эндотелия сосудов) в работе Presta et al. Cancer Res. 57: 4593-4599, 1997). Затем исследуемый Fab инкубировали в течение ночи; однако, инкубирование могло продолжаться в течение более длительного периода (например, около 65 часов) для гарантии достижения равновесия. Затем смесь переносили на планшет для захвата и инкубировали при комнатной температуре (например, в течение часа). Затем удаляли раствор и промывали планшет восемь раз 0,1% полисорбатом-20 (TWEEN-20™) в PBS. После высушивания планшетов добавляли 150 мкл сцинтиллятора (MICROSCINT-20™; Packard) на лунку и производили подсчет планшетов на гамма-счетчике TOPCOUNT™ (Packard) в течение десяти минут. Концентрации каждого Fab, обеспечивавшие связывание, меньшее или равное 20% от максимального, отбирали для использования в конкурентном анализе связывания.
Согласно еще одному варианту реализации изобретения, Kd измеряют с помощью анализа на основе поверхностного плазмонного резонанса с использованием BIACORE®-2000 или BIACORE®-3000 (BIAcore, Inc., Пискатауэй, Нью-Джерси) при 25°C с чипами с иммобилизованным антигеном СМ5 при ~10 единицах ответа (RU). Вкратце, чипы биосенсора с карбоксиметилированным декстраном (СМ5, BIACORE, Inc.) активировали N-этил-N'-(3-диметиламинопропил)-карбодиимидгидрохлоридом (EDC) и N-гидроксисукцинимидом (NHS) согласно инструкциям поставщика. Антиген разбавляли 10 мМ раствором ацетата натрия, pH 4.8, до 5 мкг/мл (-0,2 мкМ) и вводили при скорости потока 5 мкл/минуту до достижения около 10 единиц ответа (RU) связанного белка. После введения антигена вводили 1 М раствор этаноламина для блокирования непрореагировавших групп. Для измерений кинетики двукратные серийные разведения Fab (от 0,78 нМ до 500 нМ) вводили в PBS с 0,05% поверхностно-активным веществом полисорбатом-20 (TWEEN-20™) (PBST) при 25°C при скорости потока около 25 мкл/мин. Скорости ассоциации (kon) и диссоциации (koff) рассчитывали с помощью простейшей модели связывания Ленгмюра при соотношении один к одному (программное обеспечение BIACORE ® Evaluation Software версии 3.2) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Равновесную константу диссоциации (Kd) рассчитывали как отношение koff/kon. См., например, Chen et al. J. Mol. Biol. 293: 865-881, 1999. Если скорость ассоциации согласно вышеописанному анализу поверхностного плазмонного резонанса превышает 106 М-1 s-1, то ее можно определить с помощью методики гашения флуоресценции, измеряющей увеличение или снижение интенсивности испускания флуоресценции (возбуждение = 295 нм; испускание = 340 нм, полоса пропускания 16 нм) при 25°C для 20 нМ раствора антител против антигена (в форме Fab) в PBS, pH 7,2, в присутствии возрастающих концентраций антигена, измеренных на спектрометре, например, на спектрофотометре с устройством остановки потока (Aviv Instruments) или спектрофотометре SLM-AMINCO™ 8000 серии (ThermoSpectronic) с перемешиваемой кюветой.
2. Фрагменты антител
В некоторых вариантах реализации изобретения антитело, предложенное в настоящем документе, представляет собой фрагмент антитела. Фрагменты антитела включают Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv-фрагменты и другие фрагменты, описанные ниже, но не ограничиваются ими. Обзор некоторых фрагментов антител см. в статье Hudson et al. Nat. Med. 9: 129-134, 2003. Обзор scFv-фрагментов см., например, в Pluckthun. The Pharmacology of Monoclonal Antibodies. Vol. 113, pp. 269-315, Rosenburg and Moore eds. Springer-Verlag, New York, 1994: см. также WO 93/16185; и патентах США №5571894 и 5587458. Обсуждение Fab- и F(аb’)2-фрагментов, содержащих остатки эпитопа связывания рецептора реутилизации, и характеризиующихся увеличенным периодом полувыведения in vivo, см. в патенте США №5869046.
Диатела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифическими. См., например, EP 404,097; WO 1993/01161; Hudson et al. Nat. Med. 9: 129-134, 2003; и Hollinger et al. Proc. Natl. Acad. Sci. USA. 90: 6444-6448, 1993. Триатела и тетратела также описаны в Hudson et al. Nat. Med. 9: 129-134, 2003.
Однодоменные антитела представляют собой фрагменты антител, полностью или частично содержащие вариабельный домен тяжелой цепи или полностью или частично содержащие вариабельный домен легкой цепи антитела. В некоторых вариантах реализации изобретения однодоменное антитело представляет собой однодоменное антитело человека (Domantis, Inc, Уолтем, Массачусетс, см., например, патент США №6248516).
Фрагменты антител можно получить различными способами, включая протеолитический гидролиз интактного антитела, а также продукцию рекомбинантными клетками-хозяевами (например, Е. coli или фагом), как описано в настоящем документе, но не ограничиваясь ими.
3. Химерные и гуманизированные антитела
В некоторых вариантах реализации антитело, предложенное в настоящем документе, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в патенте США №4816567; и в работе Morrison et al. Proc. Natl. Acad. Sci. USA. 81: 6851-6855, 1984. Водном примере химерное антитело содержит вариабельную область нечеловеческого происхождения (например, вариабельную область, происходящую от антитела мыши, крысы, хомяка, кролика или примата, не являющегося человеком, например, обезьяны) и константную область человека. В еще одном примере химерное антитело представляет собой антитело с "переключенным изотипом", в котором изменен класс или подкласс по сравнению с родительским антителом. Химерные антитела содержат их антигенсвязывающие фрагменты.
В некоторых вариантах реализации химерное антитело является гуманизированным антителом. Как правило, антитело нечеловеческого происхождения гуманизируют с целью снижения иммуногенности для человека сохраняя при этом специфичность и аффинность родительского антитела нечеловеческого происхождения. Как правило, гуманизированное антитело содержит один или более вариабельных доменов, в которых HVR, например, CDR (или их фрагменты) происходят от антитела нечеловеческого происхождения, a FR (или их фрагменты) происходят от последовательностей антитела человека. В некоторых случаях гуманизированное также содержит по меньшей мере фрагмент константной области антитела человека. В некоторых вариантах реализации изобретения некоторые FR-остатки в гуманизированном антителе заменяют соответствующими остатками антитела нечеловеческого происхождения (например, антитела, из которого получены остатки HVR), например, с целью восстановления или улучшения специфичности или аффинности антитела.
Гуманизированные антитела и способы их изготовления рассмотрены, например, в публикации Almagro et al. Front. Biosci. 13: 1619-1633 (2008), и дополнительно описаны, например, в работах Riechmann et al. Nature. 332: 323-329, 1988; Queen et al. Proc. Natl. Acad. Sci. USA. 86: 10029-10033, 1989; патентах США 5821337, 7527791, 6982321 и 7087409: Kashmiri et al. Methods. 36: 25-34 (2005) (где описана пересадка SDR (a-CDR)); Padlan. Mol. Immunol. 28: 489-498 (1991) (где описано "изменение поверхности"); DaU'Acqua et al. Methods. 36: 43-60 (2005) (где описана "перетасовка FR"); и Osbourn et al. Methods 36: 61-68, 2005 и Klimka et al. Br. J. Cancer. 83: 252-260 (2000) (где описан подход "направленного отбора" к перетасовке FR).
Человеческие каркасные области, которые могут быть использованы для гуманизации, включают, но не ограничиваются ими: каркасные области, выбранные с помощью способа "наилучшего соответствия" (см., например, Sims et al. J. Immunol. 151: 2296 (1993)); каркасные области, происходящие от консенсусной последовательности антител человека конкретной подгруппы вариабельных областей легкой или тяжелой цепи (см., например, Carter et al. Proc. Natl. Acad. Sci. USA. 89: 4285, 1992; и Presta et al. J. Immunol. 151: 2623 (1993); зрелые (содержащие соматические мутации) каркасные области человека или эмбриональные каркасные области человека (см., например, Almagro et al. Front. Biosci. 13: 1619-1633 (2008)); и каркасные области, полученные при скрининге библиотек FR (см., например, Baca et al. J. Biol. Chem. 272: 10678-10684, 1997 и Rosok et al. J. Biol. Chem. 271: 22611-22618. 1996).
4. Мультиспецифические антитела
В некоторых вариантах реализации изобретения антитело, предложенное в настоящем документе, представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, специфически связывающиеся с по меньшей мере двумя различными сайтами. В некоторых вариантах реализации изобретения одна из специфичностей связывания относится к PD-L1, а другая - к любому другому антигену. В некоторых вариантах реализации биспецифические антитела могут связываться с двумя различными эпитопами PD-L1. Биспецифические антитела также можно использовать для локализации цитотоксических агентов в области клеток, экспрессирующих PD-L1. Биспецифические антитела можно получить в виде полноразмерных антител или фрагментов антител.
Способы получения мультиспецифических антител включают, но не ограничиваются ими, рекомбинантную совместную экспрессию двух пар тяжелая цепь - легкая цепь иммуноглобулина с различной специфичностью (см. Milstein et al. Nature. 305: 537, 1983, WO 93/08829, и Traunecker et al. EMBO J. 10: 3655, 1991), и инженерию согласно принципу «выступ-во-впадину» (см., например, патент США №5731168). Мультиспецифические антитела также можно получить за счет конструирования электростатических направляющих эффектов для создания гетеродимерных молекул на основе Fc антител (WO 2009/089004 А1); перекрестного сшивания двух или более антител или фрагментов (см., например, патент США №4676980 и Brennan et al. Science. 229: 81, 1985); использования лейциновых "молний" для получения биспецифических антител (см., например, Kostelny et al. J. Immunol. 148 (5): 1547-1553 (1992)); использование технологии "диател" для изготовления биспецифических фрагментов антител (см., например, Hollinger et al. Proc. Natl. Acad. Sci. USA., 90: 6444-6448 (1993)); и использования одноцепочечных Fv-(sFv-) димеров (см., например, Gruber et al. J. Immunol. 152: 5368 (1994)); и получения триспецифических антител, как описано, например, в статье Tutt et al. J. Immunol. 147: 60, 1991.
В настоящий документ также включено конструирование антител с тремя или более функциональными антиген-связывающими сайтами, включая "антитела-осьминоги" (см., например, US 2006/0025576 А1).
В настоящем документе антитело или фрагмент также включает "FAb двойного действия" или "DAF", содержащее антигенсвязывающий сайт, связывающийся с PD-L1, а также еще одним, отличающимся от него, антигеном (см., например, US 2008/0069820).
5. Варианты антитела
В некоторых вариантах реализации изобретения рассматривают варианты аминокислотных последовательностей антител, предложенных в настоящем документе. Например, может быть желательным улучшение аффинности и/или других биологических свойств антитела. Варианты аминокислотных последовательностей антитела можно получить путем внесения соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем пептидного синтеза. Такие модификации содержат, например, делеции и/или вставки и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечного конструкта можно внести любую комбинацию делений, вставок и замен при условии, что конечный конструкт обладает желательными характеристиками, например, связыванием с антигеном.
а) Варианты замен, вставок и делеции
В некоторых вариантах реализации изобретения предлагаются варианты антител, содержащие одну или более аминокислотные замены. Сайты, представляющие интерес для заместительного мутагенеза, включают HVR и FR. Консервативные замены приведены в таблице 1 под заголовком "предпочтительные замены". Более существенные изменения приведены в таблице 1 под заголовком "типичные замены" и подробно описаны ниже по отношению к классам боковой цепи аминокислот. В исследуемое антитело можно внедрить аминокислотные замены и исследовать продукты посредством скрининга на предмет желательной активности, например, сохранения/улучшения связывания антигена, снижения иммуногенности или улучшения ADCC или CDC.
Аминокислоты можно сгруппировать по общим свойствам боковой цепи:
(1) гидрофобные: норлейцин. Met, Ala. Val, Leu, Ilе;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4) основные: His, Lys, Arg;
(5) остатки, влияющие на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Неконсервативные замены приводят к замене представителя одного из этих классов на представителя другого класса.
Один тип вариантов, полученных путем замены, включает замену одного или более остатков гипервариабельной области родительского антитела (например, гуманизированного антитела или антитела человека). Как правило, полученный(е) вариант(ы), отобранные для дальнейшего исследования, характеризуются модификациями (например, улучшением) определенных биологических свойств (например, повышенной аффинностью, сниженной иммуногенностью) по сравнению с родительским антителом и/или в значительной степени сохраняют определенные биологические свойства родительского антитела. Типичный вариант, получаемый путем замены, представляет собой антитело с созревшей аффинностью, которое легко получить, например, с использованием методик созревания аффинности на основе фагового дисплея, например, описанных в настоящем документе. Вкратце, один или более остатков HVR мутируют и вариантные антитела подвергают фаговому дисплею и скринингу на предмет конкретной биологической активности (например, аффинности связывания).
Модификации (например, замены) можно внести в HVR, например, для улучшения аффинности антитела. Такие модификации можно внести в "горячие точки" HVR, т.е. остатки, кодируемые кодонами, с высокой частотой подвергающимися мутациям во время в процессе соматического созревания (см., например, Chowdhury. Methods Mol. Biol. 207: 179-196 (2008)), и/или SDR (a-CDR), с тестированием аффинности связывания полученного варианта VH или VL. Аффинность созревания путем конструирования и повторного выбора из вторичных библиотек описана, например, в Hoogenboom et al. Methods in Molecular Biology. 178: 1-37, O'Brien et al. eds., Human Press, Totowa, NJ, 2001. В некоторых вариантах реализации созревания аффинности вносят разнообразие в вариабельные гены, выбранные для созревания, любым из различных способов (например, ПЦР пониженной точности, перетасовки цепей или олигонуклеотид-направленного мутагенеза). Затем создают вторичную библиотеку. После этого библиотеку подвергают скринингу для выявления вариантов антитела с желательной аффинностью. Еще один способ внесения разнообразия включает HVR-направленные подходы, в которых рандомизируют несколько остатков HVR (например, 4-6 остатков за раз). Остатки HVR, участвующие в связывании антигена, можно специфически определить, например, с помощью мутагенеза с аланиновым сканированием или моделирования. В частности, мишенями часто являются HVR-H3 и HVR-L3.
В некоторых вариантах реализации изобретения замены, вставки или делеции могут возникать в одном или более HVR при условии, что такие модификации по существу не снижают способность антитела к связыванию антигена. Например, в HVR можно ввести консервативные модификации (например, консервативные замены, как предложено в настоящем документе), которые по существу не снижают аффинность. Такие модификации могут располагаться за пределами "горячих точек" HVR или SDR. В некоторых вариантах реализации вариантов VH- и VL-последовательностей, предложенных выше, каждая HVR является немодифицированной или содержит не более одной, двух или трех аминокислотных замен.
Пригодный способ выявления остатков или областей антитела, которые могут являться мишенями для мутагенеза, называется "мутагенезом с аланиновым сканированием", как описано в Cunningham et al. Science. 244: 1081-1085, 1989. В данном способе выявляют остаток или группу остатков-мишеней (например, заряженных остатков, таких как Arg, Asp, His, Lys и Glu) и замещают их нейтральными или отрицательно заряженными аминокислотами (например, аланином или полиаланином) с целью определить, влияет ли это на взаимодействие антитела с антигеном. В аминокислотные положения, демонстрирующие функциональную чувствительность к первоначальной замене, можно ввести дальнейшие замены. В альтернативном или дополнительном варианте для выявления точек контакта между антителом и антигеном используют кристаллическую структуру комплекса антиген-антитело. Такие контактные остатки и соседние остатки можно использовать в качестве мишеней или удалять как кандидатов для замещения. Варианты можно подвергать скринингу с целью определения наличия у них желательных свойств.
Вставки в аминокислотную последовательность включают амино- и/или карбо-концевые гибриды длиной от одного остатка до полипептидов, содержащих сто или более остатков, а также вставки одного или нескольких аминокислотных остатков внутри последовательности. Примеры концевых вставок включают антитело с N-концевым остатком метионина. Другие вставочные варианты молекулы антитела включают присоединение к N- или С-концу антитела фермента (например, для ADEPT) или полипептида, что увеличивает период полувыведения антитела из сыворотки.
b) Варианты гликозилирования
В некоторых вариантах реализации изобретения антитело, предложенное в настоящем документе, модифицируют с целью увеличения или уменьшения степени гликозилирования антитела. Добавление или делецию сайтов гликозилирования в антителе легко осуществить путем модификации аминокислотной последовательности, приводящей к созданию или удалению одного или более сайтов гликозилирования.
Если антитело содержит Fc-область, то можно модифицировать углевод, присоединенный к ней. Нативные антитела, продуцируемые клетками млекопитающих, обычно содержат разветвленный двухантенарный олигосахарид, обычно присоединенный с помощью N-связи к Asn297 в СН2-домене Fc-области. См., например, Wright et al. TIBTECH. 15: 26-32, 1997. Указанный олигосахарид может содержать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в "стебле" двухантенарной олигосахаридной структуры. В некоторых вариантах реализации изобретения можно выполнить модификации олигосахарида в антителе согласно настоящему изобретению с целью создания вариантов антител с определенными улучшенными свойствами.
В одном варианте реализации изобретения предложены варианты антител, содержащие углеводную структуру без фукозы, присоединенной (непосредственно или косвенно) к Fc-области. Например, количество фукозы в таком антителе может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Количество фукозы определяют путем расчета среднего количества фукозы в углеводной цепи при Asn297 по отношению к сумме всех углеводных структур, присоединенных к Asn297 (например, сложных гибридных структур с высоким содержанием маннозы), измеренной с помощью MALDI-TOF-масс-спектрометрии, как описано, например, в WO 2008/077546. Asn297 относится к остатку аспарагина, расположенному приблизительно в положении 297 в Fc-области (ЕС-нумерация остатков Fc-области); однако Asn297 также может располагаться на расстоянии около ±3 аминокислоты выше или ниже положения 297, т.е. между положениями 294 и 300, из-за незначительной изменчивости последовательности антител. Такие варианты фукозилирования могут обладать улучшенной ADCC-функцией. См., например, публикации патентов США №US 2003/0157108 и US 2004/0093621 Примеры публикаций, связанных с "дефукозилированными" или "фукозодефицитными" вариантами антитела, включают: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki et al. J. Mol. Biol. 336: 1239-1249, 2004; и Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614, 2004. Примеры клеточных линий, способных продуцировать дефукозилированные антитела, включают клетки Lec13 СНО, дефектные по фукозилированию белка (Ripka et al. Arch. Biochem. Biophys. 249: 533-545, 1986; US 2003/0157108 и WO 2004/056312, особенно Пример 11), и клеточные линии с нокаутом, такие как клетки СНО с нокаутом гена альфа-1,6-фукозилтрансферазы FUT8, (,см., например, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614, 2004; Kanda et al. Biotechnol. Bioeng. 94(4): 680-688, 2006; и WO 2003/085107).
Кроме того, предлагаются варианты антител с олигосахаридами, разделенными пополам, например, в которых двухантенарный олигосахарид, присоединенный к Fc-области антитела, разделен по GlcNAc. Такие варианты антител могут характеризоваться сниженным фукозилированием и/или улучшенной ADCC-функцией. Примеры таких вариантов антител описаны, например, в WO 2003/011878, патентах США №6602684 и US 2005/0123546. Кроме того, предлагаются варианты антител, содержащие по меньшей мере один остаток галактозы в составе олигосахарида, присоединенного к Fc-области. Такие варианты антител могут обладать улучшенной CDC-функцией. Такие варианты антител описаны, например, в WO 1997/30087, WO 1998/58964 и WO 1999/22764.
с) Варианты Fc-области
В некоторых вариантах реализации настоящего изобретения в Fc-область антитела анти-PD-L1 по изобретению можно ввести одну или более аминокислотных модификаций (например, SP142), тем самым получая вариант Fc-области. Вариант Fc-области может содержать последовательность Fc-области человека (например, Fc-область IgG1, IgG2, IgG3 или IgG4 человека), содержащую аминокислотную модификацию (например, замену) в одном или более аминокислотных положениях.
В некоторых вариантах реализации настоящего изобретения рассмотривается вариант антитела, обладающий некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для вариантов применения, при которых важен период полувыведения антитела in vivo, а некоторые эффекторные функции (например, комплемент и ADCC) не нужны или вредны. Для подтверждения снижения/ослабления CDC- и/или ADCC-активности можно выполнить анализ цитотоксичности in vitro и/или in vivo. Например, чтобы убедиться в отсутствии связывания антитела с FcyR (и, следовательно, отсутствии ADCC-активности) при сохранении способности связывания с FcRn можно выполнить анализ связывания Fc-рецептора (FcR). Основные клетки, опосредующие ADCC, NK-клетки, экспрессируют только FcyRIII, в то время как моноциты экспрессируют FcyRI, FcyRII and FcyRIII. Сводная информация об экспрессии FcR на кроветворных клетках приведена в Таблице 3 на странице 464 статьи Ravetch et al. Annu Rev. Immunol. 9: 457-492, 1991. Неограничивающие примеры анализа in vitro для оценки ADCC-активности исследуемой молекулы описаны в патентах США №5500362 и 5821337; Hellstrom et al. Proc. Natl. Acad. Sci. USA. 83: 7059-7063, 1986; Hellstrom et al. Proc. Natl Acad. Sci. USA. 82: 1499-1502, 1985; и Bruggemann et al. J. Exp. Med. 166: 1351-1361, 1987. В альтернативном варианте можно использовать анализы, не связанные с использованием радиоактивных веществ (см., например, анализ цитотоксичности ACTI™ для проточной цитометрии без использования радиоактивных веществ (CellTechnology, Inc. Маунтин-Вью, Калифорния; и анализ цитотоксичности CytoTox 96® без использования радиоактивных веществ (Promega, Мэдисон, Висконсин). Эффекторные клетки, пригодные для такого анализа, включают мононуклеары периферической крови (МНПК) и естественные киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность молекулы, представляющей интерес, можно оцепить in vivo, например, на животной модели, такой как описана в публикации Clynes et al. Proc. Natl. Acad. Sci. USA. 95: 652-656, 1998. Кроме того, можно выполнить анализ связывания Clq с целью подтверждения неспособности антитела связывать Clq и, следовательно, отсутствия CDC-активности. См., например, анализ ELISA по связыванию Clq и С3с в WO 2006/029879 и WO 2005/100402. Для оценки активации комплемента можно выполнить анализ CDC (см., например, Gazzano-Santoro et al. J. Immunol. Methods. 202: 163, 1996; Cragg et al. Blood. 101: 1045-1052, 2003; и Cragg et al. Blood 103: 2738-2743, 2004. Кроме того, можно определить связывание и выведение/период полувыведения FcRn in vivo с использованием способов, известных в данной области техники (см., например, Petkova et al. Intl. Immunol. 18 (12): 1759-1769, 2006).
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или более из остатков 238, 265, 269, 270, 297, 327 и 329 Fc-области (патент США №6737056). Такие Fc-мутанты включают Fc-мутантов с заменами в двух или более аминокислотных положениях 265, 269, 270, 297 и 327, включая так называемые Fc-мутанты "DANA" с заменой остатков 265 и 297 на аланин (патент США №7332581).
Описаны некоторые варианты антител с усиленным или ослабленным связыванием с FcR. См., например, США №6737056; WO 2004/056312 и Shields et al. J. Biol. Chem. 9(2): 6591-6604, 2001.
В некоторых вариантах реализации изобретения вариант антитела содержит Fc-область с одной или более аминокислотными заменами, улучшающими ADCC, например, заменами в положениях 298, 333 и 334 Fc-области (ЕС-нумерация остатков).
В некоторых вариантах реализации изобретения вносят изменения в Fc-область, что приводит к изменению (т.е. усилению или ослаблению) связывания C1q и/или комплемент-зависимой цитотоксичности (CDC), например, как описано в патенте США №6194551, WO 99/51642 и Idusogie et al. J. Immunol. 164: 4178-4184, 2000.
Антитела с увеличенным периодом полувыведения и усиленным связыванием с неонатальным Fc-рецептором (FcRn), который отвечает за передачу IgG матери плоду (Guyer et al. J. Immunol. 117: 587,1976 и Kim et al., J. Immunol. 24: 249, 1994), описаны в патентной заявке США №2005/0014934. Указанные антитела содержат Fc-область с одной или более заменами, которые усиливают связывание Fc-области с FcRn. Такие варианты Fc включают варианты с заменами в одном или более остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, заменой остатка 434 Fc-области (патент США №7371826). См. также Duncan et al. Nature. 322: 738-740, 1988; патенты США №5648260 и 5624821; и WO 94/29351 относительно других примеров вариантов Fc-области.
d) Варианты антител, сконструированные с использованием остатков цистеина
В некоторых вариантах реализации изобретения может быть желательно создать антитела, сконструированные с использованием остатков цистеина, например, "тиоМАт", в которых один или более остатков замещены остатками цистеина. В конкретных вариантах реализации изобретения замещенные остатки расположены в доступных сайтах антитела. За счет замены этих остатков на цистеин в доступных сайтах антитела располагаются реакционноспособные тиоловые группы, которые можно использовать для конъюгирования антитела с другими фрагментами, например, молекулами лекарственного препарата или молекулами "линкер-лекарственный препарат" с целью создания иммуноконъюгата, как описано далее в настоящем документе. В некоторых вариантах реализации изобретения можно заменить на цистеин один или более из следующих остатков: V205 (нумерация по Кэботу) легкой цепи; А118 (ЕС-нумерация) тяжелой цепи; и S400 (ЕС-нумерация) Fc-области тяжелой цепи. Антитела, сконструированные с использованием остатков цистеина, можно получить, как описано, например, в патенте США №7521541.
e) Производные антител
В некоторых вариантах реализации изобретения антитело анти-PD-L1 по изобретению (например, SP142), предложенное в настоящем документе, можно дополнительно модифицировать, внедрив в него дополнительные небелковые фрагменты, легкодоступные и известные в данной области техники. Фрагменты, пригодные для получения производных антитела, включают водорастворимые полимеры, но не ограничиваются ими. Неограничивающие примеры водорастворимых полимеров включают полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля и пропиленгликоля, карбоксиметилцеллюлозу, декстран. поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан. поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (гомополимеры или случайные сополимеры) и декстран или поли(п-винилпирролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси, но не ограничиваются ими. Пропионовый альдегид полиэтиленгликоля может обладать преимуществами при производстве из-за его стабильности в воде. Указанный полимер может обладать любой молекулярной массой и быть разветвленным или неразветвленным. Количество молекул полимера, присоединенных к антителу, может меняться, и при присоединении более чем одного полимера они могут представлять собой одинаковые или разные молекулы. В целом, количество и/или тип полимеров, используемых для получения производных, можно определить, исходя из соображений, включающих конкретные свойства или функции антител, подлежащие улучшению, возможность применения производных антитела в терапии при определенных состояниях и т.д., но не ограничивающихся этим.
В еще одном варианте реализации изобретения предлагаются конъюгаты антитела и небелкового фрагмента, которые можно селективно нагревать за счет облучения. В одном варианте реализации изобретения небелковый фрагмент представляет собой углеродную нанотрубку (Kam et al. Proc. Natl. Acad. Sci. USA. 102: 11600-11605, 2005). Длина волны излучения может быть любой и включает длины волн, не повреждающие обычные клетки, но нагревающие небелковый фрагмент до температуры, вызывающей гибель клеток, расположенных поблизости от антитела с небелковым фрагментом.
В. Рекомбинантные методики и композиции
Антитела можно получить с использованием рекомбинантного методик и композиций, например, как описано в патенте США №4816567. В одном варианте реализации изобретения предлагается выделенная нуклеиновая кислота, кодирующая антитело анти-PD-L1, описанное в настоящем документе (например, SP142). Такая нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL и/или аминокислотную последовательность, содержащую VH антитела (например, легкую и/или тяжелую цепи антитела). В дополнительном варианте реализации изобретения предлагаются один или более векторов (например, экспрессионных векторов), содержащих такую нуклеиновую кислоту. В дополнительном варианте реализации изобретения предлагается клетка-хозяин, содержащая такую нуклеиновую кислоту. В одном из таких вариантов реализации изобретения клетка-хозяин содержит (например, трансформирована с помощью): (1) вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, кодирующую аминокислотную последовательность, содержащую VH антитела. В одном варианте реализации изобретения клетка-хозяин является эукариотической, например, клеткой яичника китайского хомяка (СНО) или лимфоидной клеткой (например, клеткой YO, NSO, Sp20). В одном варианте реализации изобретения предлагается способ получения антитела анти-PD-L1, включающий культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую антитело, как предложено выше, в условиях, подходящих для экспрессии антитела, и, при необходимости, выделение антитела из клетки-хозяина (или культуральной среды клетки-хозяина).
Для рекомбинантной продукции антитела анти-PD-L1 (например, SP142) нуклеиновую кислоту кодирующую антитело, например, как описано выше, выделяют и внедряют в один или более векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Такую нуклеиновую кислоту легко выделить и секвенировать с использованием общепринятых процедур (например, с использованием олигонуклеотидных зондов, способных специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Пригодные клетки-хозяева для клонирования или экспрессии векторов, кодирующих антитело, включают прокариотические или эукариотические клетки, описанные в настоящем документе. Например, антитела можно продуцировать в бактериях, в частности, если не нужны гликозилирование и Fc-эффекторные функции. Информацию об экспрессии фрагментов антитела и полипептидов в бактериях см., например, в патентах США №5648237, 5789199 и 5840523. См. также Charlton. Methods in Molecular Biology. Vol. 248, pp. 245-254, B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003, где описана экспрессия фрагментов антитела в Е. coli. После экспрессии антитела можно выделить из бактериальной биомассы в растворимую фракцию и подвергать дальнейшей очистке.
В дополнение к прокариотам, пригодными хозяевами для клонирования или экспрессии векторов, кодирующих антитело, являются эукариотические микроорганизмы, например, мицелиальные грибы или дрожжи, включая штаммы грибов и дрожжей с "гуманизированными" путями гликозилирования, что приводит к продукции антитела с профилем гликозилирования, частично или полностью характерным для человека. См. Gerngross. Nat. Biotech. 22: 1409-1414, 2004 и Li et al. Nat. Biotech. 24: 210-215, 2006.
Пригодные для экспрессии гликозилированного антитела клетки-хозяева также происходят от многоклеточных организмов (беспозвоночных и позвоночных). Примеры клеток беспозвоночных включают клетки растений и насекомых. Выявлены многочисленные штаммы бакуловирусов, которые можно использовать в комбинации с клетками насекомых, особенно для трансфекции клеток Spodoptera frugiperda.
Кроме того, в качестве хозяев можно использовать культуры клеток растений. См., например, патенты США №5959177, 6040498, 6420548, 7125978 и 6417429 (где описана технология продукции антител в трансгенных растениях PLANTIBODIES™).
Кроме того, в качестве хозяев можно использовать клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, адаптированные к росту в суспензии. Другие примеры пригодных линий клеток-хозяев млекопитающих представляют собой линию клеток почки обезьяны CV1, трансформированных SV40 (COS-7); эмбриональную линию клеток почки человека (клетки 293 или 293, как описано, например, в статье Graham et al. J. Gen Virol. 36:59 (1977)); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (клетки ТМ4, как описано, например, в Mather, Biol. Reprod. Biol. Reprod. 23: 243-251, 1980); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK; клетки печени крысы линии buffalo (BRL 3А); клетки легких человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TR1, как описано, например, в Mather et al. Annals N.Y. Acad. Sci. Sci. 383: 44-68, 1982; клетки MRC 5; и клетки FS4. Другие пригодные линии клеток-хозяев млекопитающих включают клетки яичника китайского хомяка (СНО), в том числе DHFR"- клетки СНО (Urlaub et al. Proc. Natl. Acad. Sci. USA. 77: 4216 (1980)); и линии миеломных клеток, такие как Y0, NS0 и Sp2/0. Обзор некоторых линий клеток-хозяев млекопитающих, пригодных для продукции антител, см., например, Yazaki et al. Methods in Molecular Biology. Vol. 248, pp. 255-268, B.K.C. Lo, ed., Flumana Press, Totowa, NJ, 2003.
С. Анализы
Антитела анти-PD-L1, которые предлагаются в настоящем документе, можно идентифицировать, подвергать скринингу, или исследовать их физические/химические свойства и/или биологическую активность с помощью различных анализов, известных в данной области техники.
1. Анализы связывания и другие анализы
В одном аспекте исследуют антигенсвязывающую активность антитела согласно изобретению, например, с помощью таких известных методов, как твердофазный иммуноферментный анализ (твердофазный ИФА), иммуноблоттинг (например, Вестерн-блоттинга), проточной цитометрии (например, FACS™), иммуногистохимия, иммунофлюоресценция и т.д.
В еще одном аспекте для выявления антитела, конкурирующего с любым из антител, описанных в настоящем документе, за связывание с PD-L1 (например, антитела SP142 анти-PD-L1), можно использовать конкурентные анализы. В некоторых вариантах реализации изобретения такое конкурирующее антитело связывается с тем же эпитопом (например, линейным или конформационным эпитопом), что и антитело, которое связывается с каким-либо одним из антител по настоящему изобретению (например, антителом SP142 анти-PD-L1). Подробные примеры способов картирования эпитопа, с которым связывается антитело, представлены в Morris (1996) "Epitope Mapping Protocols," в Methods in Molecular Biology Vol. 66 (Humana Press, Totowa, NJ, 1996).
В типичном конкурентном анализе иммобилизованный PD-L1 инкубируют в растворе, содержащем первое меченное антитело, связывающееся с PD-L1 (например, антитело SP142 анти-PD-L1), и второе немеченное антитело, тестируемое на предмет способности конкурировать с первым антителом за связывание с PD-L1. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный PD-L1 инкубируют в растворе, содержащем первое меченное антитело, но не содержащем второе немеченное антитело. После инкубирования в условиях, благоприятных для связывания первого антитела с PD-L1, удаляют избыток несвязанного антитела и измеряют количество метки, связанной с иммобилизованным PD-L1. Если количество метки, связанной с иммобилизованным PD-L1, существенно снижается в тестируемом образце по сравнению с контрольным образцом, то это указывает на то, что второе антитело конкурирует с первым антителом за связывание с PD-L1. См., например, Harlow et al. Antibodies: A Laboratory Manual. Ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1988).
2. Анализы обнаружения
В одном аспекте изобретения предлагаются анализы для идентификации антитела анти-PD-L1, используемые для обнаружения наличия PD-L1, например с помощью иммуногистохимии (ИГХ), иммунофлуоресценции (ИФ), иммуноблоттинга (например, Вестерн-блоттинга), проточной цитометрии (например, FACT™), или твердофазного иммуноферментного анализ (твердофазный ИФА). В некоторых вариантах реализации изобретения антитело по настоящему изобретению тестируют на наличие такой активности.
D. Иммуноконъюгаты
В настоящем изобретении также предлагаются иммуноконъюгаты, содержащие антитело анти-PD-L1, конъюгированное с одной или более метками и/или агентами, такими как радиоактивные изотопы.
В одном варианте реализации изобретения иммуноконъюгат содержит антитело, как описано в настоящем документе, конъюгированное с радиоактивным атомом с образованием радиоконъюгата. Для получения радиоконъюгатов доступны разнообразные радиоактивные изотопы. Примеры включают At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu. В случаях, когда иммуноконъюгат используют для обнаружения, он может содержать радиоактивный атом для сцинтиграфических исследований, например, tc99m или I123,, или спиновую метку для ядерной магнитно-резонансной (ЯМР) визуализации (также известной как магнитно-резонансная визуализация, МРВ), например, иод-123 и в этом случае тоже, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела анти-PD-L1 и метки или агента могут быть получены с использованием множества бифункциональных агентов, связывающих белок, таких как N-сукцинимидил-3-(2-пиридилтио)пропионат (SPDP), сукцинимидил 4-(N-малеимидметил)циклогексан-1-карбоксилат (SMCC), иминтиолан (IT), бифункциональных производных имидоэфиров (таких как диметиладипимидат-HCl), активных сложных эфиров (таких как дисукцинимидилсуберат), альдегидов (таких как глутаральдегид), бис-азидосоединений таких как бис-(р-азидбензоил)гександиамин). производных бис-диазония (таких как бис-(р-диазонийбензоил)-этилендиамин), диизоцианатов (таких как толуол-2,6-диизоцианата), и бис-производных активного фтора (таких как 1,5-дифтор-2,4-динитробензола). Например, иммунотоксин рицина может быть получен, как описано в Vitetta et al., Science 238:1098 (1987). 1-Изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA), меченая углеродом-14, представляет собой типичный хелатирующий агент для конъюгирования радионуклеотида с антителом. См. WO 94/11026. Линкер может представлять собой "отщепляемый линкер", облегчающий высвобождение метки или агента. Например, можно использовать кислотно-лабильный линкер, пептидаза-чувствительный линкер, фотолабильный линкер или дисульфидсодержащий линкер (Chari et al., Cancer Res. 52: 127-131 (1992); патент США №5208020).
В настоящем документе непосредственно предлагаются иммуноконъюгаты без ограничения такими конъюгатами, которые получены с помощью поперечно-сшивающих реагентов, включая, но не ограничиваясь ими. BMPS. EMCS, GMBS, HBVS, LC-SMCC. MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC, а также сульфо-SMPB. и SVSB (сукцинимидил-(4-винилсульфон)бензоат), которые являются коммерчески доступными (например, от Pierce Biotechnology, Inc., Рокфорд, Иллинойс, США).
Е. Способы и композиции для диагностики и обнаружения
В некоторых вариантах реализации изобретения антитела анти-PD-L1, предложенные в настоящем документе (например, SP142 или любые другие антитела анти-PD-L1, описанные, например, выше в разделе A, "Типичные антитела анти-PD-L1"), пригодные для обнаружения PD-L1 в биологическом образце. Термин "обнаружение" в настоящем документе охватывает количественное или качественное обнаружение.
В одном случае предлагается антитело анти-PD-L1 (например, SP142) для применения в способе диагностики или обнаружения. В другом случае настоящее изобретение относится к использованию антитела анти-PD-L1 (например, SP142) в производстве реагента для применения в способе диагностики или обнаружения.
В одном случае, например, предлагается способ обнаружения наличия PD-L1 в биологическом образце, описанный ниже. В некоторых вариантах реализации изобретения указанный способ включает приведение в контакт биологического образца с антителом анти-PD-L1, описанным в настоящем документе, в условиях, допускающих связывание антитела анти-PD-L1 с PD-L1 и определение образования комплекса между антителом анти-PD-L1 и PD-L1. Такой способ можно осуществлять in vitro или in vivo. Антитела анти-PD-L1 по настоящему изобретению (например, SP142) можно использовать, например, в иммунологических анализах, включая, например, иммуногистохимию (ИГХ), иммунофлуоресценцию (ИФ), иммуноблоттинг (например, Вестерн-блоттинга), проточной цитометрии (например, FACT™) или твердофазный иммуноферментный анализ (твердофазный ИФА). В одном варианте реализации изобретения антитело анти-PD-L1 применяют для выбора субъектов, подходящих для лечения с помощью антитела анти-PD-L1, например, если PD-L1 является биомаркером для отбора пациентов. Кроме того, настоящее изобретение относится к применению антитела анти-PD-L1 в способе диагностики нарушения у субъекта (например, рака или иммунной дисфункции), причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела.
Например, способ относится к применению антитела анти-PD-L1 в способе диагностики рака у субъекта, причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела. В некоторых случаях образец выбирают из группы, состоящей из образца ткани, образца цельной крови, образца сыворотки и образца плазмы. В некоторых случаях образец ткани представляет собой опухолевый образец. В некоторых случаях опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки и любую их комбинацию.
Кроме того, настоящее изобретение относится к использованию антитела анти-PD-L1 в изготовлении реагента, применяемого в способе диагностики нарушения у пациента (например, рака или иммунной дисфункции), причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела.
Например, способ относится к применению антитела анти-PD-L1 в изготовлении реагента, применяемого в способе диагностики рака у субъекта, причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела. В некоторых случаях образец выбирают из группы, состоящей из образца ткани, образца цельной крови, образца сыворотки и образца плазмы. В некоторых случаях образец ткани представляет собой опухолевый образец. В некоторых случаях опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки и любую их комбинацию.
В другом случае в настоящем изобретении предлагается способ идентификации субъекта, страдающего от нарушения (например, рака или иммунной дисфункции), причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела, причем наличие или уровень экспрессии PD-L1 в образце указывает на то, что субъект, вероятно, будет отвечать на лечение.
Например, в настоящем изобретении предлагается способ идентификации субъекта, страдающего от рака, который, вероятно, будет отвечать на лечение противораковыми препаратами, причем указанный способ включает:
определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образна с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела, причем наличие или уровень экспрессии PD-L1 в образце указывает на то, что субъект, вероятно, будет отвечать на лечение противораковыми препаратами. В некоторых случаях образец выбирают из группы, состоящей из образца ткани, образца цельной крови, образца сыворотки и образца плазмы. В некоторых случаях образец ткани представляет собой опухолевый образец. В некоторых случаях опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки и любую их комбинацию.
Еще в одном случае в настоящем изобретении предлагается способ прогнозирования ответа на лечение индивидуума, страдающего от нарушения (например, рака или иммунной дисфункции), причем способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела, причем наличие или уровень экспрессии PD-L1 в образце указывает на то, что субъект с большей вероятностью будет отвечать на лечение.
Например, в настоящем изобретении предлагается способ прогнозирования ответа индивидуума, страдающего от рака, на лечение противораковыми препаратами, причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела, причем наличие или уровень экспрессии PD-L1 в образце указывает на то, что субъект с большей вероятностью будет отвечать на лечение противораковыми препаратами. В некоторых случаях образец выбирают из группы, состоящей из образца ткани, образца цельной крови, образца сыворотки и образца плазмы. В некоторых случаях образец ткани представляет собой опухолевый образец. В некоторых случаях опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки и любую их комбинацию.
В еще одном дополнительном случае в настоящем изобретении предлагается способ определения вероятности того, что субъекта, страдающего от нарушения (например, рака или иммунной дисфункции), причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела, причем наличие или уровень экспрессии PD-L1 в образце указывает на то, что субъект, вероятно, будет отвечать на лечение.
Например, в настоящем изобретении предлагается способ идентификации субъекта, страдающего от рака, у которого лечение противораковыми препаратами будет эффективным, причем способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела, причем наличие или уровень экспрессии PD-L1 в образце указывает на вероятность того, что у субъекта лечение противораковыми препаратами будет эффективным. В некоторых случаях образец выбирают из группы, состоящей из образца ткани, образца цельной крови, образца сыворотки и образца плазмы. В некоторых случаях образец ткани представляет собой опухолевый образец. В некоторых случаях опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки и любую их комбинацию.
В другом случае в настоящем изобретении предлагается способ выбора препарата для субъекта, страдающего от нарушения (например, рака или иммунной дисфункции), причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела; а также и выбор противоракового препарата для субъекта на основании наличия или уровня экспрессии PD-L1 в образце.
Например, в настоящем изобретении предлагается способ выбора препарата для субъекта, страдающего от рака, причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела; а также и выбор противоракового препарата для субъекта на основании наличия или уровня экспрессии PD-L1 в образце. В некоторых случаях образец выбирают из группы, состоящей из образца ткани, образца цельной крови, образца сыворотки и образца плазмы. В некоторых случаях образец ткани представляет собой опухолевый образец. В некоторых случаях опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки и любую их комбинацию.
В любом из предыдущих способов опухолевый образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим около 1% или более (например, около 1% или более, около 2% или более, около 3% или более, около 4% или более, около 5% или более, около 10% или более, около 15% или более того, около 20% или более, около 25% или более, около 30% или более, около 35% или более, около 40% или более, около 50% или более, около 55% или более, около 60% или более, около 65% или более, около 70% или более, около 80% или более, около 85% или более, около 90% или более, около 95% или более, или около 99% или более) опухолевого образца, например, по площади. Например, в некоторых случаях опухолевый образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим от около 1% до менее чем около 99% (например, от около 1% до менее чем около 95%, от около 1% до менее чем около 90%, от около 1% до менее чем около 85%, от около 1% до менее чем около 80%, от около 1% до менее чем около 75%, от около 1% до менее чем около 70%, от около 1% до менее чем около 65%, от около 1% до менее чем около 60%, от около 1% до менее чем около 55%, от около 1% до менее чем около 50%, от около 1% до менее чем около 40%, от около 1% до менее чем около 35%, от около 1% до менее чем около 30%, от около 1% до менее чем около 25%, от около 1% до менее чем около 20%, от около 1% до менее чем около 15%, от около 1% до менее чем около 10%, от около 1% до менее чем около 5%, от около 5% до менее чем около 95%, от около 5% до менее чем около 90%, от около 5% до менее чем около 85%, от около 5% до менее чем около 80%, от около 5% до менее чем около 75%, от около 5% до менее чем около 70%, от около 5% до менее чем около 65%, от около 5% до менее чем около 60%, от около 5% до менее чем около 55%, от около 5% до менее чем около 50%, от около 5% до менее чем около 40%, от около 5% до менее чем около 35%, от около 5% до менее чем около 30%, от около 5% до менее чем около 25%, от около 5% до менее чем около 20%, от около 5% до менее чем около 15%, от около 5% до менее чем около 10%, от около 10% до менее чем около 95%, от около 10% до менее чем около 90%, от около 10% до менее чем около 85%, от около 10% до менее чем около 80%. от около 10% до менее чем около 75%, от около 10% до менее чем около 70%, от около 10% до менее чем около 65%, от около 10% до менее чем около 60%, от около 10% до менее чем около 55%, от около 10% до менее чем около 50%, от около 10% до менее чем около 40%, от около 10% до менее чем около 35%, от около 10% до менее чем около 30%, от около 10% до менее чем около 25%, от около 10% до менее чем около 20%, от около 10% до менее чем около 15%) опухолевого образца, например, по площади. Например, в некоторых случаях опухоль может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим от около 1% или более до менее чем 5% опухолевого образца, например, по площади. В других случаях, опухоль может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим от около 5% или более до менее чем 10% опухолевого образца, например, по площади. В других случаях, опухоль может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим от около 10% или более опухолевого образца, например, по площади.
В любом из предыдущих способов опухолевый образец имеет обнаруживаемый уровень экспрессии PD-L1 в около 1% или более (например, около 1% или более, около 2% или более, около 3% или более, около 4% или более, около 5% или более, около 10% или более, около 15% или более того, около 20% или более, около 25% или более, около 30% или более, около 35% или более, около 40% или более, около 50% или более, около 55% или более, около 60% или более, около 65% или более, около 70% или более, около 80% или более, около 85% или более, около 90% или более, около 95% или более, или около 99% или более) опухолевых клеток в опухолевом образце. Например, в некоторых случаях опухолевый образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в от около 1% до менее чем около 99% (например, от около 1% до менее чем около 95%, от около 1% до менее чем около 90%, от около 1% до менее чем около 85%, от около 1% до менее чем около 80%, от около 1% до менее чем около 75%, от около 1% до менее чем около 70%, от около 1% до менее чем около 65%, от около 1% до менее чем около 60%, от около 1% до менее чем около 55%, от около 1% до менее чем около 50%, от около 1% до менее чем около 40%, от около 1% до менее чем около 35%, от около 1% до менее чем около 30%, от около 1% до менее чем около 25%, от около 1% до менее чем около 20%, от около 1% до менее чем около 15%, от около 1% до менее чем около 10%, от около 1% до менее чем около 5%, от около 5% до менее чем около 95%, от около 5% до менее чем около 90%, от около 5% до менее чем около 85%, от около 5% до менее чем около 80%, от около 5% до менее чем около 75%, от около 5% до менее чем около 70%, от около 5% до менее чем около 65%, от около 5% до менее чем около 60%, от около 5% до менее чем около 55%, от около 5% до менее чем около 50%, от около 5% до менее чем около 40%, от около 5% до менее чем около 35%, от около 5% до менее чем около 30%. от около 5% до менее чем около 25%, от около 5% до менее чем около 20%, от около 5% до менее чем около 15%, от около 5% до менее чем около 10%, от около 10% до менее чем около 95%, от около 10% до менее чем около 90%, от около 10% до менее чем около 85%, от около 10% до менее чем около 80%, от около 10% до менее чем около 75%, от около 10% до менее чем около 70%, от около 10% до менее чем около 65%, от около 10% до менее чем около 60%, от около 10% до менее чем около 55%, от около 10% до менее чем около 50%, от около 10% до менее чем около 40%, от около 10% до менее чем около 35%, от около 10% до менее чем около 30%, от около 10% до менее чем около 25%, от около 10% до менее чем около 20%, от около 10% до менее чем около 15%) опухолевых клеток в опухолевом образце. Например, в некоторых случаях опухолевый образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в около 1% или более до менее чем 5% опухолевых клеток в опухолевом образце. В других случаях опухоль может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в около 5% или более до менее чем 10% опухолевых клеток в опухолевом образце. В некоторых случаях опухоль образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в около 10% или более опухолевых клетках в опухолевом образце.
В любом из предыдущих способов рак может представлять собой немелкоклеточный рак легкого (НМКРЛ), плоскоклеточный рак (включая аденокарциному легкого и плоскоклеточный рак легкого), мелкоклеточный рак легкого, рак органов брюшной полости, гепатоцеллюлярный рак, рак органов желудочно-кишечного тракта, рак поджелудочной железы, глиому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, лейкоз и рак головы и шеи. В некоторых случаях рак представляет собой НМКРЛ. В некоторых вариантах реализации изобретения НМКРЛ представляет собой аденокарциному легкого или плоскоклеточную карциному легкого. В некоторых вариантах реализации изобретения НМКРЛ представляет собой НМКРЛ из плоского эпителия или НМКРЛ не из плоского эпителия.
Эффективность и/или ответ на лечение по любому из предыдущих способов, может быть любым известным в данной области техники и/или описанным в настоящем документе процессом, например: (1) ингибирование, до некоторой степени, прогрессирования заболевания (например, прогрессирование рака), включая замедление и полное подавление; (2) уменьшение размера опухоли; (3) ингибирование (т.е. уменьшение, замедление или полное прекращение) инфильтрации раковых клеток в прилегающих периферических органах и/или тканях; (4) ингибирование (т.е. уменьшение, замедление или полное прекращение) метастазирования; (5) купирование, до некоторой степени, одного или более симптомов, связанных с заболеванием или нарушением (например, раком); (6) увеличение или продолжение периода выживаемости, включая общую выживаемость и выживаемость без прогрессирования; и/или (9) снижение смертности в данный момент времени после лечения. В некоторых случаях такая эффективность включает любой один или более из процессов: увеличение выживаемости (включая общую выживаемость и выживаемость без прогрессирования); полученный объективный ответ (включая полный ответ или частичный ответ); или купирование признаков или симптомов рака.
Любой из предыдущих способов может дополнительно включать введение субъекту терапевтически эффективного количества противоракового препарата на основании уровня экспрессии PD-L1 в образце. В некоторых случаях противораковый препарат содержит антагонист, связывающий ось PD-1. Антагонист, связывающий ось PD-1, может быть любым антагонистом, связывающим ось PD-1, и известным в данной области техники или описанным в данном документе.
Например, в некоторых случаях антагонист, связывающий ось PD-1, выбирают из группы, состоящей из антагониста, связывающего PD-L1, антагониста, связывающего PD-1, и антагониста, связывающего PD-L2. В некоторых случаях антагонист, связывающий ось PD-1, представляет собой антагонист, связывающий PD-L1. В некоторых случаях антагонист, связывающий PD-L1, ингибирует связывание PD-L1 с одним или более его партнерами по связыванию лиганда. В других случаях антагонист, связывающий PD-L1, ингибирует связывание PD-L1 с PD-1. В некоторых других случаях антагонист, связывающий PD-L1, ингибирует связывание PD-L1 с В7-1. В некоторых случаях антагонист, связывающий PD-L1, ингибирует связывание PD-L1 с как PD-1, так и с В7-1. В некоторых случаях антагонист, связывающий PD-L1, представляет собой антитело. В некоторых вариантах реализации изобретения антитело выбирают из группы, состоящей из: YW243.55.S70, MPDL3280A (атезолизумаб), MDX-1105, MEDI4736 (дурвалумаб) и MSB0010718C (авелумаб).
В некоторых случаях антагонист, связывающий ось PD-1, представляет собой антагонист, связывающий PD-1. Например, в некоторых случаях антагонист, связывающий PD-1, ингибирует связывание PD-1 с одним или более его партнерами по связыванию лиганда. В некоторых случаях антагонист, связывающий PD-1, ингибирует связывание PD-1 с PD-L1. В других случаях антагонист, связывающий PD-1, ингибирует связывание PD-L1 с PD-L2. В некоторых других случаях антагонист, связывающий PD-1, ингибирует связывание PD-1 с как PD-L1, так и с PD-L2. В некоторых случаях антагонист, связывающий PD-1, представляет собой антитело. В некоторых случаях антитело выбирают из группы, состоящей из: MDX 1106 (ниволумаб), МК-3475 (пембролизумаб), СТ-011 (пидилизумаб), MEDI-0680 (АМР-514), PDR001, REGN2810 и BGB-108. В некоторых случаях антагонист, связывающий PD-1, представляет собой Fc-слитый белок. Например, в некоторых случаях Fc-слитый белок представляет собой АМР-224.
В некоторых случаях способ дополнительно включает введение указанному пациенту эффективного количества второго терапевтического агента. В некоторых случаях второй терапевтический агент выбирают из группы, состоящей из цитотоксического агента, агента, ингибирующего рост, агента лучевой терапии, антиангиогенного агента, а также их комбинации.
Образец, используемый в любом из предыдущих вариантов реализации изобретения, может быть таким, как описано ниже в разделе F. "Биологические образцы". В некоторых вариантах реализации изобретения опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки или любую их комбинацию. В любом из предыдущих вариантов реализации изобретения опухолевый образец может быть опухолевым образцом, фиксированным формалином и залитым парафином (ФФЗП), архивным опухолевым образцом, свежим опухолевым образцом или замороженным опухолевым образцом.
В некоторых вариантах реализации настоящего изобретения наличие и/или уровень экспрессии/ количество PD-L1 в образце может быть определено с использованием ИГХ и протоколов окрашивания. Показано, что ИГХ-окрашивание срезов тканей является надежным методом определения или обнаружения наличия белков в образце. В одном варианте реализации настоящего изобретения уровень экспрессии PD-L1 определяется с использованием способа, включающего: (а) выполнение ИГХ-анализа образца (например, опухолевого образца, полученного от субъекта) с антителом анти-PD-L1 согласно изобретению, например, SP142; и (b) определение наличия и/или уровня экспрессии PD-L1 в указанном образце. В некоторых вариантах реализации изобретения интенсивность ИГХ-окрашивания определяется относительно эталона. В некоторых вариантах реализации изобретения эталоном является эталонное значение. В некоторых вариантах реализации изобретения эталоном является эталонный образец (например, контрольный образец окрашенной линии клеток, образец ткани от пациента без рака, эталонный образец с известным заданным уровнем экспрессии PD-L1 (например, эталонный образец с определенным ИК % или ОК %), или образец PD-L1-отрицательной опухоли).
ИГХ-анализ можно проводить в комбинации с дополнительными методиками, такими как морфологическое окрашивание и/или гибридизация in situ (например, FISH). Доступны два основных способа ИГХ: прямые и опосредованные анализы. В соответствии с первым анализом связывание антитела с антигеном-мишенью определяется непосредственно. В этом прямом анализе используют меченый реагент, такой как флуоресцентная метка или первичное антитело, меченное ферментом, которые можно визуализировать без дополнительного взаимодействия антител. В типичном опосредованном анализе, неконъюгированное первичное антитело связывается с антигеном, а затем меченое вторичное антитело связывается с первичным антителом. В случаях, когда вторичное антитело конъюгируют с ферментной меткой, для обеспечения визуализации антигена добавляют хромогенный или флуорогенный субстрат. Усиление сигнала происходит из-за того, что несколько вторичных антител могут взаимодействовать с различными эпитопами на первичном антителе.
Первичное и/или вторичное антитело, используемое для ИГХ, обычно метят обнаруживаемым фрагментом. Доступно множество меток, которые могут быть в общем разделены на следующие категории: (а) радиоизотопы, такие как 35S, 14С, 125I, 3Н и 131I; (b) коллоидные частицы золота; (с) флуоресцентные метки, включая, но не ограничиваясь ими, редкоземельные хелаты (хелаты европия), техасский красный, родамин, флуоресцеин, дансильную, лиссамин, умбеллиферон, фикокритерин, фикоцианин, или коммерчески доступные флуорофоры, такие как SPECTRUM ORANGE7 и SPECTRUM GREEN7 и/или производные любого одного или более из указанных выше элементов; (d) различные фермент-субстратные метки, которые являются доступными; причем в патенте США №4275149 приведен обзор некоторых из них. Примеры ферментных меток включают люциферазы (например, люциферазу светлячка и бактериальную люциферазу; см., например, патент США №4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, такую как пероксидаза хрена (ПХ), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы углеводов (например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу), оксидазы гетероциклических соединений (такие как уриказа и ксантиноксидаза), лактопероксидазу, микропероксидазу и т.п.
Примеры фермент-субстратных комбинаций включают, например, пероксидазу хрена (ПХ) с перекисью водорода в качестве субстрата; щелочную фосфатазу (ЩФ) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; и β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, р-нитрофенил-β-D-галактозидазой) или флуорогенным субстратом (например, 4-метилумбеллиферил-β-D-галактозидазой). Общий обзор этих веществ, см., например, в патентах США №4275149 и 4318980.
Образцы могут быть получены, например, вручную или с использованием прибора для автоматического окрашивания (например, прибора Ventana BenchMark XT или Benchmark ULTRA). Образцы, полученные таким образом, могут быть фиксированы и заключены под покровную пленку. Затем осуществляли оценку препаратов, например, с помощью микроскопа, при этом могли использовать критерии интенсивности окрашивания, обычно применяемые в данной области техники. При одном из вариантов реализации изобретения следует понимать, что, когда клетки и/или ткани из опухоли исследуют с помощью ИГХ, окрашивание, как правило, определяется или оцепивается в опухолевой клетке (ах) и/или ткани (в отличие от стромальных или окружающих тканей, которые могут присутствовать в образце). При одном из вариантов реализации изобретения следует понимать, что, когда клетки и/или ткани из опухоли исследуют с помощью ИГХ, окрашивание включает определение или оценку в иммунных клетках, проникающих в опухоль, в том числе внутриопухолевых или перитуморальных иммунных клетках. В некоторых вариантах реализации настоящего изобретения наличие PD-L1 обнаруживают с помощью ИГХ в >0% образца, в по меньшей мере 1% образца, в по меньшей мере 5% образца, в в по меньшей мере 10% образца, в в по меньшей мере 15% образца, в по меньшей мере 15% образца, в по меньшей мере 20% образца, в по меньшей мере 25% образца, в по меньшей мере 30% образца, в по меньшей мере 35% образец, в по меньшей мере 40% выборки, в по меньшей мере 45% образца, в по меньшей мере 50% образца, в по меньшей мере 55% образца, в по меньшей мере 60% образца, в на не менее 65% выборки, в по меньшей мере 70% выборки, в по меньшей мере 75% образца, в по меньшей мере 80% выборки, в по меньшей мере 85% образца, в по меньшей мере 90% образец, в по меньшей мере 95% образца или более. Образцы могут быть проанализированы с использованием любого из критериев, описанных в настоящем документе, например, патоморфологом или с помощью автоматизированного анализа изображений.
В некоторых вариантах реализации любого из указанных выше способов, уровень экспрессии PD-L1 обнаруживают в опухолевых клетках, проникающих в опухоль иммунных клетках или их комбинациях, например, с помощью ИГХ. Проникающие в опухоль иммунные клетки включают, но не ограничиваются ими, внутриопухолевые иммунные клетки, перитуморальные иммунные клетки или любые их комбинации, а также другие опухолевые стромальные клетки (например, фибробласты). Такими проникающими в опухоль иммунными клетками могут быть Т-лимфоциты (такие как CD8+ Т-лимфоциты и/или CD4+ Т-лимфоциты), В-лимфоциты или другие клетки, дифференцирующиеся в костном мозге, в том числе гранулоциты (нейтрофилы, эозинофилы, базофилы), моноциты, макрофаги, дендритные клетки (например, интердигитальные дендритные клетки), гистиоциты и натуральные клетки-киллеры. В некоторых вариантах реализации изобретения окрашивание для выявления PD-L1 определяется как окрашивание мембраны, окрашивание цитоплазмы и их комбинации. В некоторых вариантах реализации изобретения отсутствие PD-L1 определяется как отсутствие окрашивания или неокрашивание в образце. В некоторых вариантах реализации изобретения способ включает определение процента площади опухоли, покрытой проникающими в опухоль иммунными клетками, экспрессирующими обнаруживаемое количество PD-L1, например, как описано в настоящем описании (см., например, ИК %, как описано в Примере 5). В некоторых вариантах реализации изобретения способ включает определение процента опухолевых клеток в опухолевом образце, экспрессирующих обнаруживаемое количество PD-L1, например, как описано в настоящем описании (см., например, Пример 5).
В некоторых случаях предлагаются меченые антитела анти-PD-L1. Метки включают, но не ограничиваются ими, метки или молекулы, обнаруживаемые непосредственно (например, флуоресцентные, хромофорные, электронно-плотные, хемилюминесцентные и радиоактивные метки), а также такие молекулы, как ферменты или лиганды, обнаруживаемые косвенно, например, с помощью ферментативной реакции или молекулярных взаимодействий. Типичные метки включают, но не ограничиваются ими, радиоизотопы 32Р, 14С, 125I, 3Н, and 131I, флуорофоры, такие как хелаты редкоземельных элементов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люциферазу светлячка и бактериальную люциферазу (патент США №4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидазу хрена (ПХ), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, оксидазы углеводов, например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу, оксидазы гетероциклических соединений, например, уриказу и ксантиноксидазу, в сочетании с ферментом, который использует пероксид водорода для окисления предшественника красителя, например, ПХ, лактопероксидазой или микропероксидазой. биотин/авидин, спиновые метки, метки-бактериофаги, стабильные свободные радикалы и т.п.
Следует также понимать, что любой из указанных выше способов для диагностики и/или обнаружения может быть осуществлен с использованием иммуноконъюгата по настоящему изобретению, как описано выше, вместо или в дополнение к неконъюгированному антителу анти-PD-L1.
F. Биологические образцы
В некоторых вариантах реализации антитело анти-PD-L1 по настоящему изобретению (например, SP142 или любые другие антитела анти-PD-L1, описанные, например, выше в разделе A, "Типичные антитела анти-PD-L1"), могут быть пригодными для обнаружения PD-L1 в биологическом образце с использованием способов, известных в данной области техники или описанных в настоящем документе.
В некоторых случаях биологический образец может включать тканевой или клеточный образец. Например, биологический образец может включать клетку или ткань здоровых пациентов или пациентов с раком, такую как, например, нормальная и раковая ткань молочной железы, поперечно ободочной кишки, легких, почек, костей, головного мозга, мышц, желудка, поджелудочной железы, мочевого пузыря, яичников, матки, сердца, а также эмбриональная и плацентарная ткань.
В некоторых случаях источником тканевого или клеточного образца может быть солидная ткань, например, из свежего, замороженного и/или консервированного органа или тканевого образца или биопсии или аспирата; кровь или любые составные элементы крови; биологические жидкости, такие как спинномозговая жидкость, амниотическая жидкость, перитонеальная жидкость, или межклеточная жидкость; клетки любого термина гестации или развития субъекта. В некоторых вариантах реализации изобретения биологический образец может быть получен из ткани или клеточной культуры in vitro. Примеры биологических образцов по данному изобретению включают, но не ограничиваются ими, образцы опухолевых биопсий, циркулирующие опухолевые клетки, сыворотку или плазму, циркулирующие белки плазмы, асцитическую жидкость, первичные клеточные культуры или клеточные линии, полученные из опухолей или проявляющие опухолеподобные свойства, а также опухолевые образцы с консервантами, такие как фиксированные формалином и залитые парафином (ФФЗП) опухолевые образцы или замороженные опухолевые образцы.
В некоторых вариантах реализации изобретения биологический образец может содержать соединения, которые не смешанные с тканью в природе естественным образом, такие как консерванты, антикоагулянты, буферы, питательные вещества, антибиотики, или тому подобное. В некоторых вариантах реализации изобретения биологический образец подвергался воздействию и/или содержит один или более фиксаторов. Фиксаторы, которые могут быть использованы в способах и композициях по настоящему изобретению, включают формалин, глутаровый альдегид, тетраоксид, уксусную кислоту, этанол, ацетон, пикриновую кислоту хлороформ, бихромат калия и хлорид ртути и/или стабилизацию путем микроволнового нагрева или замораживания.
В некоторых вариантах реализации изобретения биологический образец получают от субъекта, имеющего иммунную дисфункцию, предрасположенного или обследованного на ее наличие. В некоторых вариантах реализации изобретения иммунная дисфункция представляет собой Т-клеточное дисфункциональное нарушение. В некоторых вариантах реализации изобретения Т-клеточное дисфункциональное нарушение представляет собой неразрешенную острую инфекцию, хроническую инфекцию или невосприимчивость опухоли. В некоторых вариантах реализации изобретения иммунная дисфункция представляет собой аутоиммунное заболевание. В некоторых вариантах реализации изобретения аутоиммунное заболевание представляет собой аутоиммунную ревматическую патологию (включая ревматоидный артрит, синдром Шегрена, склеродермию, волчанку, такую как СКВ и волчаночный нефрит, полимиозит-дерматомиозит, криоглобулинемию, синдром антифосфолипидного антитела и псориатический артрит), аутоиммунные желудочно-кишечные и печеночные нарушения включая воспалительные заболевания кишечника (например, неспецифический язвенный колит и болезнь Крона), аутоиммунный гастрит и пернициозную анемию, аутоиммунный гепатит, первичный билиарный цирроз печени, первичный склерозирующий холангит и целиакию), васкулит (включая АНЦА-негативный васкулит и АНЦА-ассоциированный васкулит, включая васкулит Черджа-Стросса, гранулематоз Вегенера и микроскопический полиангиит), аутоиммунные неврологические нарушения (включая рассеянный склероз, опсо-миоклональный синдром, миастению, оптиконевромиелит, болезнь Паркинсона, болезнь Альцгеймера и аутоиммунные полинейроиатии), патологии почек (включая гломерулонефрит, синдром Гудпасчера и болезнь Бергера), аутоиммунные нарушения со стороны кожы (включая псориаз, уртикарную сыпь, крапивницу, пузырчатку обыкновенную, буллезный пемфигоид и кожную красную волчанку), гематологические нарушения (включая тромбоцитопеническую пурпуру, тромботическую тромбоцитопеническую пурпуру, посттрансфузионную пурпуру и аутоиммунную гемолитическую анемию), атеросклероз, увеит, аутоиммунные заболевания органа слуха (включая патологии внутреннего уха и потерю слуха), болезнь Бехчета, синдром Рейно, трансплантацию органов и аутоиммунные эндокринные нарушения (включая аутоиммунные заболевания, связанные с диабетом, такие как инсулин-зависимый сахарный диабет (ИЗСД), болезнь Аддисона и аутоиммунные заболевания щитовидной железы (включая болезнь Грейвса и тиреоидит)).
В некоторых вариантах реализации изобретения биологический образец получают от субъекта, имеющего рак, предрасположенного или обследованного на предмет его наличия. В некоторых вариантах реализации изобретения рак представляет собой немелкоклеточный рак легкого (НМКРЛ), плоскоклеточный рак (включая аденокарциному легкого и плоскоклеточный рак легкого), карциному, лимфому (включая ходжкинскую и неходжкинскую лимфомы), бластому, саркому, лейкоз, плоскоклеточный рак, мелкоклеточный рак легкого, рак органов брюшной полости, гепатоцеллюлярный рак, рак органов желудочно-кишечного тракта, рак поджелудочной железы, глиому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, лейкоз и другие лимфопролиферативные нарушения или различные типы рака головы и шеи. В конкретных вариантах реализации изобретения рак представляет собой НМКРЛ. В некоторых вариантах реализации изобретения НМКРЛ представляет собой аденокарциному легкого или плоскоклеточную карциному легкого. В некоторых вариантах реализации изобретения НМКРЛ представляет собой НМКРЛ из плоского эпителия или НМКРЛ не из плоского эпителия.
G. Терапевтические способы, основанные на наличии и/или уровне экспрессии PD-L1
В настоящем изобретении предлагаются способы лечения субъекта, имеющего нарушение (например, рак или иммунную дисфункцию), на основании наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта, что установлено с помощью антитела анти-PD-L1 согласно изобретению. В некоторых случаях способы включают лечение (например, введение противоракового препарата) на основании наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта, что установлено с помощью антитела анти-PD-L1 согласно изобретению. В некоторых случаях терапевтические способы включают корреляцию между наличием или уровнем экспрессии PD-L1 в образце, полученном от субъекта, что установлено с помощью антитела анти-PD-L1 согласно изобретению, и вероятностью эффективности или ответа на противораковую терапию у субъекта, например, как описано в настоящем документе.
Способ предусматривает способ лечения субъекта, имеющего нарушение (например, рак или иммунную дисфункцию), причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела; и введение терапевтически эффективного количества препарата субъекту.
Например, в настоящем изобретении предлагается способ лечения субъекта, имеющего рак, причем указанный способ включает: определение наличия или уровня экспрессии PD-L1 в образце, полученном от субъекта путем приведения в контакт образца с антителом анти-PD-L1 согласно настоящему изобретению (например, SP142) и обнаружение наличия связанного антитела; а также введение субъекту терапевтически эффективного количества противоракового препарата. В некоторых случаях образец выбирают из группы, состоящей из образца ткани, образца цельной крови, образца сыворотки и образца плазмы. В некоторых случаях образец ткани представляет собой опухолевый образец. В некоторых случаях опухолевый образец включает проникающие в опухоль иммунные клетки, опухолевые клетки, стромальные клетки и любую их комбинацию. В любом из предыдущих способов опухолевый образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим около 1% или более (например, около 1% или более, около 2% или более, около 3% или более, около 4% или более, около 5% или более, около 10% или более, около 15% или более того, около 20% или более, около 25% или более, около 30% или более, около 35% или более, около 40% или более, около 50% или более, около 55% или более, около 60% или более, около 65% или более, около 70% или более, около 80% или более, около 85% или более, около 90% или более, около 95% или более, или около 99% или более) опухолевого образца, например, по площади. Например, в некоторых случаях опухолевый образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим от около 1% до менее чем около 99% (например, от около 1% до менее чем около 95%, от около 1% до менее чем около 90%, от около 1% до менее чем около 85%, от около 1% до менее чем около 80%, от около 1% до менее чем около 75%, от около 1% до менее чем около 70%, от около 1% до менее чем около 65%, от около 1% до менее чем около 60%, от около 1% до менее чем около 55%, от около 1% до менее чем около 50%, от около 1% до менее чем около 40%, от около 1% до менее чем около 35%, от около 1% до менее чем около 30%, от около 1% до менее чем около 25%, от около 1% до менее чем около 20%, от около 1% до менее чем около 15%, от около 1% до менее чем около 10%, от около 1% до менее чем около 5%, от около 5% до менее чем около 95%, от около 5% до менее чем около 90%, от около 5% до менее чем около 85%, от около 5% до менее чем около 80%, от около 5% до менее чем около 75%, от около 5% до менее чем около 70%, от около 5% до менее чем около 65%, от около 5% до менее чем около 60%, от около 5% до менее чем около 55%, от около 5% до менее чем около 50%, от около 5% до менее чем около 40%, от около 5% до менее чем около 35%, от около 5% до менее чем около 30%, от около 5% до менее чем около 25%, от около 5% до менее чем около 20%, от около 5% до менее чем около 15%. от около 5% до менее чем около 10%, от около 10% до менее чем около 95%, от около 10% до менее чем около 90%, от около 10% до менее чем около 85%, от около 10% до менее чем около 80%, от около 10% до менее чем около 75%, от около 10% до менее чем около 70%, от около 10% до менее чем около 65%, от около 10% до менее чем около 60%, от около 10% до менее чем около 55%, от около 10% до менее чем около 50%, от около 10% до менее чем около 40%, от около 10% до менее чем около 35%, от около 10% до менее чем около 30%, от около 10% до менее чем около 25%, от около 10% до менее чем около 20%, от около 10% до менее чем около 15%) опухолевого образца, например, по площади. Например, в некоторых случаях опухоль может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим от около 1% или более до менее чем 5% опухолевого образца, например, по площади. В других случаях, опухоль может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим от около 5% или более до менее чем 10% опухолевого образца, например, по площади. В других случаях, опухоль может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в проникающих в опухоль иммунных клетках, составляющим от около 10% или более опухолевого образца, например, по площади.
В любом из предыдущих способов опухолевый образец имеет обнаруживаемый уровень экспрессии PD-L1 в около 1% или более (например, около 1% или более, около 2% или более, около 3% или более, около 4% или более, около 5% или более, около 10% или более, около 15% или более того, около 20% или более, около 25% или более, около 30% или более, около 35% или более, около 40% или более, около 50% или более, около 55% или более, около 60% или более, около 65% или более, около 70% или более, около 80% или более, около 85% или более, около 90% или более, около 95% или более, или около 99% или более) опухолевых клеток в опухолевом образце. Например, в некоторых случаях опухолевый образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в от около 1% до менее чем около 99% (например, от около 1% до менее чем около 95%, от около 1% до менее чем около 90%, от около 1% до менее чем около 85%, от около 1% до менее чем около 80%, от около 1% до менее чем около 75%, от около 1% до менее чем около 70%, от около 1% до менее чем около 65%, от около 1% до менее чем около 60%, от около 1% до менее чем около 55%, от около 1% до менее чем около 50%, от около 1% до менее чем около 40%, от около 1% до менее чем около 35%, от около 1% до менее чем около 30%, от около 1% до менее чем около 25%, от около 1% до менее чем около 20%, от около 1% до менее чем около 15%, от около 1% до менее чем около 10%, от около 1% до менее чем около 5%, от около 5% до менее чем около 95%, от около 5% до менее чем около 90%, от около 5% до менее чем около 85%, от около 5% до менее чем около 80%, от около 5% до менее чем около 75%, от около 5% до менее чем около 70%, от около 5% до менее чем около 65%, от около 5% до менее чем около 60%, от около 5% до менее чем около 55%, от около 5% до менее чем около 50%, от около 5% до менее чем около 40%, от около 5% до менее чем около 35%, от около 5% до менее чем около 30%, от около 5% до менее чем около 25%, от около 5% до менее чем около 20%, от около 5% до менее чем около 15%, от около 5% до менее чем около 10%, от около 10% до менее чем около 95%, от около 10% до менее чем около 90%, от около 10% до менее чем около 85%, от около 10% до менее чем около 80%, от около 10% до менее чем около 75%, от около 10% до менее чем около 70%, от около 10% до менее чем около 65%, от около 10% до менее чем около 60%, от около 10% до менее чем около 55%, от около 10% до менее чем около 50%, от около 10% до менее чем около 40%, от около 10% до менее чем около 35%, от около 10% до менее чем около 30%, от около 10% до менее чем около 25%, от около 10% до менее чем около 20%, от около 10% до менее чем около 15%) опухолевых клеток в опухолевом образце. Например, в некоторых случаях опухолевый образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в около 1% или более до менее чем 5% опухолевых клеток в опухолевом образце. В других случаях опухоль может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в около 5% или более до менее чем 10% опухолевых клеток в опухолевом образце. В некоторых случаях опухоль образец может характеризоваться обнаруживаемым уровнем экспрессии PD-L1 в около 10% или более опухолевых клетках в опухолевом образце.
В любом из предыдущих способов рак может представлять собой немелкоклеточный рак легкого (НМКРЛ), плоскоклеточный рак (включая аденокарциному легкого и плоскоклеточную карциному легкого), плоскоклеточный рак, мелкоклеточный рак легкого, рак органов брюшной полости, гепатоцеллюлярный рак, рак органов желудочно-кишечного тракта, рак поджелудочной железы, глиому, рак шейки матки, рак яичника, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак ободочной кишки, колоректальный рак, карциному эндометрия или матки, карциному слюнных желез, рак почки, рак печени, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, лейкоз и рак головы и шеи. В некоторых случаях рак представляет собой НМКРЛ. В некоторых вариантах реализации изобретения НМКРЛ представляет собой аденокарциному легкого или плоскоклеточную карциному легкого. В некоторых вариантах реализации изобретения НМКРЛ представляет собой НМКРЛ из плоского эпителия или НМКРЛ не из плоского эпителия.
В любом из предыдущих способов противораковый препарат может содержать антагонист, связывающий ось PD-1. В некоторых случаях способ может включать введение субъекту терапевтически эффективного количества антагониста, связывающего ось PD-1, на основании уровня экспрессии PD-L1 в опухолевых клетках и/или проникающих в опухоль иммунных клетках в опухолевом образце. Антагонист, связывающий ось PD-1, может быть любым антагонистом, связывающим ось PD-1, и известным в данной области техники или описанным в данном документе.
Например, в некоторых случаях антагонист, связывающий ось PD-1, включает антагониста, связывающего PD-1, антагониста, связывающего PD-L1, и антагониста, связывающего PD-L2. PD-1 (белок программированной гибели 1) также упоминается в данной области техники как "белок программированной гибели клеток 1", "PDCD1", "CD279" и "SLEB2". Типичный человеческий PD-1 приведен в UniProtKB/Swiss-Prot под инвентарным номером Q15116. PD-L1 (лиганд белка программированной гибели 1) также упоминается в данной области техники как "лиганд 1 белка программированной гибели клеток 1", "PDCD1LG1", "CD274", "В7-Н" и "PDL1". Типичный человеческий PD-L1 приведен в UniProtKB/Swiss-Prot под инвентарным номером Q9NZQ7.1. PD-L2 (лиганд белка программированной гибели 2) также упоминается в данной области техники как "лиганд 1 белка программированной гибели клеток 2", "PDCD1LG2", "CD273", "B7-DC", "Btdc" и "PDL2". Типичный человеческий PD-L2 приведен в UniProtKB/Swiss-Prot под инвентарным номером Q9BQ51. В некоторых вариантах реализации изобретения PD-1, PD-L1 и PD-L2 являются человеческими PD-1, PD-L1 и PD-L2.
В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, представляет собой молекулу, которая ингибирует связывание PD-1 с одним или более его партнерами по связыванию лиганда. В конкретных аспектах изобретения партнерами по связыванию лиганда PD-1 являются PD-L1 и/или PD-L2. В других вариантах реализации изобретения антагонист, связывающий PD-L1, представляет собой молекулу, которая ингибирует связывание PD-L1 с его связывающими лигандами. В конкретных аспектах изобретения партнерами по связыванию PD-L1 являются PD-1 и/или В7-1. В другом варианте реализации изобретения антагонист, связывающий PD-L2, представляет собой молекулу, которая ингибирует связывание PD-L2 с одним или более его партнерами по связыванию лиганда. В конкретных аспектах изобретения партнером по связыванию лиганда PD-L2 является PD-1. Антагонист может представлять собой антитело, антигенсвязывающий фрагмент, иммуноадгезин, слитый белок или олигопептид.
В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, представляет собой антитело анти-PD-1 (например, человеческое антитело, гуманизированное антитело или химерное антитело), например, как описано ниже. В некоторых вариантах реализации изобретения антитело анти-PD-1 выбирают из группы, состоящей из MDX 1106 (ниволумаб), МК-3475 (пембролизумаб), СТ-011 (пидилизумаб), MED1-0680 (АМР-514), PDR001, REGN2810 и BGB-108. MDX-1106, также известный как MDX 1106-04, ONO-4538, BMS-936558 или ниволумаб, представляет собой антитело анти-PD-1, описанное в WO 2006/121168. МК-3475, также известный как пембролизумаб или ламбролизумаб, представляет собой антитело анти-PD-1, описанное в WO 2009/114335. СТ-011, также известный как hBAT, hBAT-1 или пидилизумаб, представляет собой антитело анти-PD-1, описанное в WO 2009/101611. В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, представляет собой иммуноадгезин (например, иммуноадгезин, содержащий внеклеточную или PD-1-связывающую часть PD-L1 или PD-L2, слитую с константной областью (например, Fc-областью последовательности иммуноглобулина). В некоторых вариантах реализации изобретения антагонист, связывающий PD-1, представляет собой АМР-224. МР-224, известный также как B7-DCIg, является PD-L2-Fc-слитным растворимым рецептором, описанным в WO 2010/027827 и WO 2011/066342.
В некоторых вариантах реализации изобретения антитело анти-PD-1 представляет собой MDX-1106. Альтернативные названия для "MDX-1106" включают MDX-1106-04, ONO-4538, BMS-936558 и ниволумаб. В некоторых вариантах реализации изобретения антитело анти-PD-1 представляет собой ниволумаб (регистрационный номер CAS: 946414-94-4).
В некоторых вариантах реализации изобретения антагонист, связывающий ось PD-1, представляет собой антагонист, связывающий PD-L2. В некоторых вариантах реализации изобретения антагонист, связывающий PD-L2, представляет собой антитело анти-PD- L2 (например, человеческое антитело, гуманизированное антитело или химерное антитело). В некоторых вариантах реализации изобретения антагонист, связывающий PD-L2, представляет собой иммуноадгезин.
В некоторых вариантах реализации изобретения антагонист, связывающий PD-L1, представляет собой антитело анти-PD-L1. В некоторых вариантах реализации изобретения антитело анти-PD-L1 способно ингибировать связывание между PD-L1 и PD-1 и/или между PD-L1 и В7-1. В некоторых вариантах реализации изобретения антитело анти-PD-L1 представляет собой моноклональное антитело. В некоторых вариантах реализации изобретения антитело анти-PD-L1 представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab'-SH, Fv, scFv и (Fаb’)2-фрагментов. В некоторых вариантах реализации изобретения антитело анти-PD-L1 представляет собой гуманизированное антитело. В некоторых вариантах реализации изобретения антитело анти-PD-L1 представляет собой человеческое антитело. В некоторых вариантах реализации изобретения антитело анти-PD-L1 выбирают из группы, состоящей из YW243.55.S70, MPDL3280A (атезолизумаб), MDX-1105, MEDI4736 (дурвалумаб) и MSB0010718C (авелумаб). Антитело YW243.55.S70 представляет собой антитело анти-PD-L1, описанное в WO 2010/077634 и патенте США №8217149, содержание каждого из которых включено в настоящее описание посредством ссылки. MDX-1105, также известный как BMS-936559, представляет собой антитело анти-PD-1, описанное в WO 2007/005874. MEDI4736 представляет собой моноклональное антитело анти-PD-L1, описанное в WO 2011/066389 и US 2013/034559. Примеры антител анти-PD-L1, используемых в способах настоящего изобретения, а также способы их получения описаны в патентной заявке РСТ WO 2010/077634. WO 2007/005874, WO 2011/066389 и патенте США №8217149 и US 2013/034559, содержание каждого из которых включено в настоящее описание посредством ссылки.
В любом из предыдущих вариантов реализации изобретения выделенное антитело анти-PD-L1 может связываться с человеческим PD-L1, например человеческим PD-L1, как показано в UniProtKB/Swiss-Prot, инвентарный №Q9NZQ7.1, или его вариантом.
В еще одном дополнительном варианте вариантов реализации изобретения предлагается выделенная нуклеиновая кислота, кодирующая любое из антител, описанных в настоящем документе. В некоторых вариантах реализации изобретения нуклеиновая кисло та дополнительно содержит вектор, пригодный для экспрессии нуклеиновой кислоты, кодирующей любое из ранее описанных антител анти-PD-L1. В еще одном дополнительном конкретном аспекте вектор находится в клетке-хозяине, пригодной для экспрессии нуклеиновой кислоты. В еще одном дополнительном конкретном аспекте клетка-хозяин является эукариотической клеткой или прокариотической клеткой. В еще одном дополнительном конкретном аспекте эукариотическая клетка представляет собой клетку млекопитающего, такую как клетка яичника китайского хомячка (СНО).
Антитело или его антигенсвязывающий фрагмент могут быть получены с использованием способов, известных в данной области техники, например, с помощью способа, включающего культивирование клетки-хозяина, содержащей нуклеиновую кислоту, кодирующую любое из описанных выше антител анти-PD-L1 или его антигенсвязывающий фрагмент в форму, пригодную для экспрессии, в условиях, подходящих для получения такого антитела или его фрагмента, и выделение антитела или его фрагмента. Следует четко понимать, что такие антагонистические антитела, связывающие ось PD-1 (например, антитела анти-PD-L1, антитела анти-PD-1 и антитела анти-РD-L2), или другие антитела, описанные в данном документе (например, антитела анти-PD-L1 для обнаружения уровней экспрессии PD-L1), при использовании в любом из вариантов реализации изобретения, перечисленных выше, могут характеризоваться любым из признаков, по отдельности или в комбинации, которые описаны в подпунктах 1-5 раздела A "Типичные антитела анти-PD-L1".
В некоторых случаях любой из предыдущих способов дополнительно включает введение указанному пациенту эффективного количества второго терапевтического агента. В некоторых случаях второй терапевтический агент выбирают из группы, состоящей из цитотоксического агента, агента, ингибирующего рост, агента лучевой терапии, антиангиогенного агента, а также их комбинации.
Композиции, используемые в способах, описанных в настоящем документе (например, противораковые терапевтические агенты), можно вводить любым подходящим способом, включая, например, внутривенный, внутримышечный, подкожный, внутрикожный, чрезкожный, внутриартериальный, внутрибрюшинный, внутриочаговый, интракраниальный, внутрисуставной, внутринростатический, внутриплевральный, интратрахеальный, интратекальный, назальный, вагинальный, ректальный, местный, внутриопухолевый, брюшинный, субконъюнктивальный, внутрипузырный, через слизистую оболочку, интраперикардиальный, внутрипуповинный, внутриглазной, интраорбитальный, пероральный, местный, трансдермальный, интравитральный (например, путем инъекции в стекловидное тело), в глазных каплях, при вдыхании, путем инъекции, путем имплантации, путем инфузии, путем непрерывной инфузии, путем непосредственного омывания клеток-мишеней при локализованной перфузии, с помощью катетера, путем промывания, в кремах, или в липидных композициях. Композиции, используемые в способах, описанных в настоящем документе, можно также вводить системно или локально. Способ введения может изменяться в зависимости от различных факторов (например, соединения или композиции для введения, степени тяжести состояния, заболевания или нарушения, подлежащего лечению). В некоторых вариантах реализации изобретения противораковый препарат (например, антагонист, связывающий ось PD-1) вводят внутривенно, внутримышечно, подкожно, местно, перорально. транедермально, внутрибрюшинно, интраорбитально, путем имплантации, при вдыхании, интратекально, интравентрикулярно или интраназально. Введение дозы может быть осуществлено любым пригодным способом, например, с помощью инъекций, таких как внутривенные или подкожные инъекции, частично в зависимости от того, является ли введение кратковременным или длительным. В настоящем документе рассмотрены различные схемы введения доз, включая одно или множество введений в различные моменты времени, болюсное введение и пульс-терапию, но не ограничиваясь ими.
Терапевтические агенты (например, антагонисты, связывающие ось PD-1 (например, антитело, связывающее полипептид, и/или малую молекулу)), описанные в настоящем документе, могут быть изготовлены, дозированы и введены в соответствии с принципами надлежащей медицинской практики. Факторы, которые следует учитывать в данном контексте, включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние отдельного пациента, причину нарушения, область доставки агента, способ введения, схему введения и другие факторы, известные врачам-практикам. Терапевтический агент (например, антагонист, связывающий ось PD-1) не обязательно, но в некоторых случаях составляют и/или вводят одновременно с одним или более агентами, используемыми в настоящее время для предотвращения или лечения рассматриваемого нарушения. Эффективное количество таких других агентов зависит от количества терапевтического агента (например, антагониста, связывающего ось PD-1), присутствующего в составе, вида нарушения или способа лечения, а также других факторов, описанных выше. Как правило, другие агенты применяют в тех же дозах и посредством того же пути введения, как описано в настоящем документе, или в дозах, составляющих от около 1 до 99% количества доз, описанных в настоящем документе, или в любой дозе и посредством любого пути введения, эмпирически/клинически считающихся подходящими.
Для профилактики или лечения рака (например, немелкоклеточного рака легкого), подходящая доза терапевтического агента (например, антагониста, связывающего ось PD-1), описанного в настоящем документе (при использовании отдельно или в комбинации с одним или более других дополнительных терапевтических агентов), будет зависеть от типа заболевания, подлежащего лечению, тяжести и течения заболевания, от того, вводят терапевтический агент (например, (например, антагонист, связывающий ось PD-1) в профилактических или терапевтических целях, предшествующей терапии, анамнеза болезни и ответа пациента на терапевтический агент (например, (например, антагонист, связывающий ось PD-1) и решения лечащего врача. Терапевтический агент (например, антагонист, связывающий ось PD-1) соответствующим образом вводят пациенту однократно или в ходе курсов лечения. Типичная ежедневная доза может находиться в диапазоне от около 1 мкг/кг до 100 мг/кг или более в зависимости от вышеупомянутых факторов. При повторном введении в течение нескольких дней или дольше, в зависимости от состояния, лечение обычно следует продолжать до желаемого подавления симптомов заболевания. Такие дозы можно вводить с перерывами, например, каждую неделю или каждые три недели (например, таким образом, что пациент получает, например, от около двух до около двадцати, или, например, около шести доз терапевтического агента (например, (например, антагониста, связывающего ось PD-1)). Можно вводить начальную повышенную нагрузочную дозу, за которой следует одна или более пониженные дозы. Однако, можно применять другие схемы лечения. Ход лечения можно контролировать с помощью обычных методик и анализов.
Например, в качестве общей схемы, терапевтически эффективное количество антагонистического антитела (например, антагонистического антитела, связывающего ось PD-1), вводимое человеку, будет находиться в диапазоне от около 0,01 до около 50 мг/кг веса тела пациента, вне зависимости от того, это будет одно или более введений. В некоторых вариантах реализации изобретения антитело вводят в дозе от около 0,01 мг/кг до около 45 мг/кг, от около 0,01 мг/кг до около 40 мг/кг, от около 0,01 мг/кг до около 35 мг/кг, от около 0,01 мг/кг до около 30 мг/кг, от около 0,01 мг/кг до около 25 мг/кг, от около 0,01 мг/кг до около 20 мг/кг, от около 0,01 мг/кг до около 15 мг/кг, от около 0,01 мг/кг до около 10 мг/кг, около 0,01 мг/кг до около 5 мг/кг или около 0,01 мг/кг до около 1 мг/кг, например, ежедневно, еженедельно, раз в две недели, раз в три недели или раз в месяц, В некоторых вариантах реализации изобретения антитело вводят в дозе 15 мг/кг. Однако, можно применять другие схемы лечения. В одном варианте реализации изобретения антагонистическое антитело (например, антагонистическое антитело, связывающее ось PD-1), описанное в настоящем документе, вводят человеку в дозе около 100 мг, около 200 мг, около 300 мг, около 400 мг, около 500 мг, около 600 мг, около 700 мг, около 800 мг, около 900 мг, около 1000 мг, около 1100 мг, около 1200 мг, около 1300 мг, около 1400 мг, около 1500 мг, около 1600 мг, около 1700 мг, или около 1800 мг в 1-й день цикла, составляющего 21 день (каждые три недели, 1 раз/3 недели). Дозу можно вводить в виде разовой дозы или в виде многократных доз (например, 2 или 3 дозы), например, в инфузиях. Доза вводимого антитела при комбинированной терапии может быть уменьшена по сравнению с монотерапией. Ход лечения можно контролировать с помощью обычных методик.
В некоторых вариантах реализации изобретения способы дополнительно включают введение указанному пациенту эффективного количества второго терапевтического агента. В некоторых вариантах реализации изобретения второй терапевтический агент выбирают из группы, состоящей из цитотоксического агента, химиотерапевтического агента, агента, ингибирующего рост, агента лучевой терапии, антиангиогенного агента, а также их комбинаций. В некоторых вариантах реализации изобретения терапевтический агент (например, антагонист, связывающий ось PD-1) можно вводить в комбинации с химиотерапией или химиотерапевтическим агентом. В некоторых вариантах реализации изобретения терапевтический агент (например, антагонист, связывающий ось PD-1) можно вводить в комбинации с агентом лучевой терапии. В некоторых вариантах реализации изобретения терапевтический агент (например, антагонист, связывающий ось PD-1) можно вводить в комбинации с таргетной терапией или таргетным терапевтическим агентом. В некоторых вариантах реализации изобретения терапевтический агент (например, антагонист, связывающий ось PD-1) можно вводить в комбинации с иммунотерапией или иммунотерапевтическим агентом, например, моноклональным антителом.
Такие варианты комбинированной терапии, описанные выше, включают совместное введение (когда два или более терапевтических агентов содержатся в одном и том же или отдельных составах), а также раздельное введение, при котором введение терапевтического агента (например, антагониста, связывающего ось PD-1) может осуществляться до, одновременно и/или после введения дополнительного терапевтического агента и/или агентов. В одном варианте реализации изобретения введение терапевтического агента (например, антагониста, связывающего ось PD-1) и введение дополнительного терапевтического агента осуществляется с интервалом около одного месяца, или около одной, двух или трех недель, или около одного, двух, трех, четырех, пяти или шести дней.
Терапевтические составы терапевтических агентов (например, антагонистов, связывающих ось PD-1), используемые согласно настоящему изобретению, готовят для хранения путем смешивания антагониста, имеющего желаемую степень чистоты, с необязательными фармацевтически приемлемыми носителями, вспомогательными веществами или стабилизаторами в виде лиофилизированных композиций или водных растворов. Для получения общей информации, касающейся составов, см., например, Gilman et al. (eds.) The Pharmacological Bases of Therapeutics, 8th Ed., Pergamon Press, 1990; A. Gennaro (ed.), Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co., Pennsylvania, 1990; Avis et al. (eds.) Pharmaceutical Dosage Forms: Parenteral Medications Dekker, New York, 1993; Lieberman et al. (eds.) Pharmaceutical Dosage Forms: Tablets Dekker, New York, 1990; Lieberman et al. (eds.) Pharmaceutical Dosage Forms: Disperse Systems Dekker, New York, 1990; and Walters (ed.) Dermatological and Transdermal Formulations (Drugs and the Pharmaceutical Sciences), Vol 119, Marcel Dekker, 2002.
Приемлемые носители, вспомогательные вещества или стабилизаторы в используемых дозах и концентрациях являются нетоксичными для реципиентов и включают буферы, такие как фосфатный, цитратный буфер и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония, хлорид бензетония; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцин; циклогексанол; 3-пентанол и м-крезол); низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; сольобразующий противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы); и/или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ).
Состав, описанный в настоящем документе, также может содержать более одного активного соединения, предпочтительно, соединения с взаимодополняющими активностями, не оказывающие нежелательного действия друг на друга. Тип и эффективные количества таких лекарственных средств зависят, например, от количества и типа антагониста, присутствующего в составе, а также клинических параметров субъектов.
Активные ингредиенты можно также заключить в микрокапсулы, полученные, например, с помощью методик коацервации или межфазной полимеризации, например, микрокапсулы гидроксиметилцеллюлозы или желатина и полиметилметакрилата, соответственно, в коллоидные системы доставки лекарств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методики описаны в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Можно приготовить препараты замедленного высвобождения. Подходящие примеры препаратов замедленного высвобождения включают полупроницаемые матриксы твердых гидрофобных полимеров, содержащие антагонист, матриксы которого присутствуют виде формованных изделий, например, пленок или микрокапсул. Примеры матриксов с замедленным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поли(винилалкоголь)), полилактиды (описаны в патенте США №3773919), сополимеры L-глутаминовой кислоты и γ- этил-L-глутамат, не разлагаемый этилен-винилацетат, разлагаемые сополимеры молочной кислоты и гликолевой кислоты, такой как LUPRON DEPOT™ (микросферы для инъекций, состоящие из сополимера молочной кислоты и гликолевой кислоты и ацетата лейпролида), и поли-D-(-)-3-гидроксимасляную кислоту.
Составы для введения in vivo должны быть стерильными. Стерильности легко достичь путем фильтрации через мембраны для стерильной фильтрации.
Следует понимать, что любое из указанных выше изделий может включать иммунокон ьюгат, описанный в настоящем документе, вместо или в дополнение к антителу, например, антителу анти-PD-L1 или антителу анти-PD-1.
III. ПРИМЕРЫ
Ниже приведены примеры способов и композиций согласно настоящему изобретению. Следует понимать, что учитывая общее описание, представленное выше, можно осущест вить различные другие варианты реализации настоящего изобретения.
Пример 1. Получение антител анти-PD-L1
Кроличьи моноклональные антитела анти-PD-L1 получали согласно схемы, приведенной на Фигуре 1. Вкратце, синтезировали пептидный фрагмент N-концевой цитоплазматической области (аминокислотные остатки 279-290) человеческого PD-L1 (SKKQSDTHLEET; SEQ ID NO: 1). Фрагмент 12 аминокислот, предназначенный для иммунизации, конъюгировали с гемоцианином лимфы улитки (KLH), широко применяемым белком-носителем для стимулирования выраженного иммунного ответа посредством продукции антител. Добавляя две аминокислоты (Cys-Gly) к природному N-концу последовательности, получали возможность конъюгации с белком-носителем KLH. Новозеландских белых кроликов иммунизировали KLH, конъюгированным с антигеном PD-L1, эмульгированным с помощью полного адъюванта Фрейнда, с последующей серией бустера антигена PD-L1, эмульгированного с помощью неполного адъюванта Фрейнда. Клетки, экспрессирующие антитела, подвергали скринингу с помощью твердофазного иммуноферментного анализа (твердофазного ИФА) с использованием антигена PD-L1. Все ELISA-положительные клоны дополнительно скринировали с помощью иммуногистохимии (ИГХ) и выбирали клон, продуцирующий антитело с самой высокой специфичностью. Для рекомбинантного получения антител анти-PD-L1, клонировали кДНК, кодирующую последовательности тяжелой цепи и легкой цепи антитела, экспрессировали с помощью котрансфекции и подвергали скринингу на связывание с PD-L1 (SEQ ID NO: 1) с помощью ИГХ. С использованием этих способов получали моноклональное антитело (SP142) анти-PD-L1, которое затем очищали с помощью для аффинной хроматографии протеина А. Последовательности вариабельной области тяжелой и легкой цепи антитела SP142 являются следующими.
Вариабельная область тяжелой цепи:

Пример 2. Диагностическое применение антител анти-PD-L1
Антитело SP142 анти-PD-L1 в дальнейшем использовали для анализов ИГХ и вестерн-блотинга. Для проведения ИГХ-анализов тканевые срезы инкубировали с SP142 в течение 16 минут с последующим стандартным промыванием и вторичным обнаружением с козьим антикроличьим биотинилированным антителом. Специфичность SP142 оцепивали на фиксированных формалином и залитых парафином (ФФЗП) клетках с различными уровнями экспрессии PD-L1 (клетки НЕК-293 почки эмбриона человека, трансфицированные пустым вектором в качестве контроля (отрицательный контроль), а также DOR-13 (экспрессия от низкого до среднего уровня), клетки RKO рака ободочной кишки (средний уровень экспрессии) и PD-L1, трансфицированного клетками 293 (высокий уровень экспрессии); см. Фигуры 2A-2D) или из различных типов тканей (плацентарной ткани, ткани миндалин и лимфомы Ходжкина (НК); см. Фигуры 3А-3С). Для дополнительного определения специфичности SP142, проводили анализ вестерн-блота на клеточных лизатах из клеточных линий с различными уровнями экспрессии PD-L1 (клеточная линия N1H Н820 аденокарциномы легкого (высокий уровень экспрессии), клеточная линия Karpas 299 Т-клеточной лимфомы (средний уровень экспрессии) и клеточная линия Calu-3 аденокарциномы легкого (отрицательный контроль); см. Фигуру 4).
Пример 3. Сравнение антитела SP142 анти-PD-L1 с антителом E1L3N анти-PD-L1
Антитело SP142 анти-PD-L1 сравнивали с антителом E1L3N анти-PD-L1 (Cell Signaling Technology) в ИГХ-анализе нормальных и опухолевых срезах тканей, включая ткани пациентов с немелкоклеточным раком легкого (НМКРЛ). Вкратце, для экспериментов ИГХ, как антитела анти-PD-L1 как SP142, так и E1L3N, серийно разводили (0,11-28 мкг/мл). Микроскопические препараты срезов тканей депарафинировали с использованием заменителя ксилола и спирта повышающейся концентрации. Извлечение антигена достигали путем кипячения срезов ткани в буфере ЭДТА (рН 8,0) в течение 10 минут с последующим охлаждением при комнатной температуре в течение 20 минут. Тканевые срезы инкубировали с SP142 или E1L3N в течение 10 минут с последующим стандартным промыванием и вторичным обнаружением с козьим антикроличьим антителом в течение 15 минут. Окончательную инкубацию с молекулой-репортером 3,3'-диаминобензидина (DAB) проводили в течение 10 минут. Для оценки чувствительности различные концентрации E1L3N и SP142 сравнивали на ФФЗП-срезах ткани плаценты (см. Фигуры 5A-5J). Специфичность E1L3N и SP142 определяли с использованием нормальных и опухолевых типов тканей (эпителиальная ткань желудка, нервные ткани, ткани почек, ткани переходно-клеточной карциномы (ПКК) мочевого пузыря, карциномы протоков молочной железы (Са) и плоскоклеточной карциномы легкого (ПлКК легкого); см. Фигуры 6А-6Т и Фигуры 7A-7J). ИГХ-анализ также проводили на срезах различных типов ФФЗП-тканей, окрашенных либо E1L3N, либо SP142 (ткань миндалин, плоскоклеточной карциномы (ПлКК) шейки матки, лимфомы Ходжкина (лимфома НК), аденокарциномы поджелудочной железы, аденокарциномы предстательной железы, и ПлКК кожи; см. Фигуру 8А-8L).
Обнаруженную экспрессию PD-L1 с помощью E1L3N и SP142 затем сравнивали в ФФЗП-срезах ткани от пациентов с НМКРЛ. С помощью E1L3N обнаружено 50 PD-L1-положительных препаратов из 119 образцов НМКРЛ с ранее неопределенным статусом PD-L1, а с помощью SP142 обнаружено 58 PD-L1-положительных образцов, при этом 5% или более опухолевых клеток, окрашенных положительно, расцепивались как свидетельствующие о PD-L1- положительно случае. Для дальнейшей оценки обнаружения PD-L1 с помощью этих антител ФФЗП-срезы ткани от пациентов с НМКРЛ последовательно окрашивали как E1L3N, так и SP142 (Фигуры 9A-9J). Степень мембранной иммунореактивности (т.е. балл Н) затем рассчитывали на 119 срезах тканей пациентов с НМКРЛ, окрашенных E1L3N или SP142. Балл Н для PD-L1 рассчитывали по следующей формуле: Балл H = 3 (процент сильного окрашивания мембраны) + 2 (процент умеренного окрашивания мембраны) + 1 (процент слабого окрашивания мембраны), таким образом получая диапазон балла Н от 0 до 300. Средний балл Н этих 119 препаратов НМКРЛ был значительно ниже для E1L3N (56±8), чем для SP142 (100±11). Эти общие данные свидетельствуют о том, что SP142 является более чувствительным и специфичным, чем E1L3N.
Пример 4. Использование антитела SP142 анти-PD-L1 в ИГХ анализе демонстрирует окрашивание PD-L1 в иммунных клетках (ИК) и опухолевых клетках (ОК)
С помощью антитела SP142 анти-PD-L1 обнаруживали экспрессию PD-L1 в иммунных клетках (ИК), проникающих в опухоль, и опухолевых клетках в репрезентативных случаях всех исследуемых видов рака (около 28-30 видов), включая, но не ограничиваясь ими, немелкоклеточный рак легкого (НМКРЛ), плоскоклеточную карциному шейки матки, лимфому НК, аденокарциному поджелудочной железы, аденокарциному предстательной железы и плоскоклеточную карциному кожи (см., например, Фигуры 8A-8L, 9A-9J, 10, 11, 15А-15В, 16А-16Н и 18A-18F).
Иммунные клетки (ИК)
Иммунные клетки (ИК) представляют собой иммунные клетки, проникающие в опухоль, которые находятся в внутриопухолевой и прилегающей перитуморальной строме и включают морфологически гетерогенную популяцию типов клеток, в том числе лимфоциты, макрофаги, дендритные клетки, а также клетки с сетчатой морфологией. ИГХ-анализ срезов опухолевых тканей проводили с использованием антитела SP142. В срезах опухолевых тканей PD-L1-положительные ИК часто демонстрировали темно-коричневый пунктирное или прерывистое окрашивания мембраны совместно с лимфоцитами (Фигура 10). Как правило, PD-L1-положительные ИК определялись в виде агрегатов в внутриопухолевой и перитуморальной строме и/или в виде одной клетки или диффузного распространения среди групп опухолевых клеток (группирование опухолевых клеток осущесвляли на основани локализации в опухолевом срезе PD-L1-положительно окрашенные ИК также наблюдали на границе опухоли и стромы, а ретикулярное окрашивание - в третичных лимфоидных структурах.
Опухолевые клетки (ОК)
В дополнение к PD-L1-положительным ИК, описанным выше, PD-L1-положительные опухолевые клетки (ОК) также определялись в опухолевых образцах при ИГХ-анализах с использованием антитела SP142. Как правило, PD-L1-положительные ОК характеризовались мембранным окрашиванием (Фигура 11), которое иногда сочеталось с цитоплазматическим окрашиванием.
Результаты продемонстрировали, что антитело SP-142 можно использовать для получения чувствительного и специфичного PD-L1-окрашивания срезов опухолевых тканей при выполнении ИГХ анализа экспрессии PD-L1, а также подтвердили наличие PD-L1-положительных ИК, как и PD-L1-положительных ОК в срезах опухолевой ткани.
Материалы и методы
ФФЗП-срезы ткани депарафинировали и нагревали в ЭДТА-буфере для извлечения антигена до добавления кроличьего анти-человеческого PD-L1 (SP142) моноклонального антитела к срезам тканей. ИГХ выполняли с автоматической системой окрашивания (BenchMark ULTRA, Roche) или полуавтоматической системой окрашивания (Autostainer, Thermo Scientific). В Таблице 2 приведен протокол, используемый для системы BenchMark ULTRA.
Пример 5. Определение PD-IJ-положительности в ИК, ОК и их комбинациях
Ткани, окрашенные антителами анти-PD-L1 (например, любым из антител анти-PD-L1 согласно настоящему изобретению, например, SP142), могли быть проанализированы на наличие PD-L1-положительных ИК, ОК, или комбинации ИК и ОК, с использованием различных пороговых значений (например, 1%, 5%, 10% и т.д.). Эти различные пороговые значения можно использовать для стратификации пациентов, например, для отбора пациентов, которые, вероятно, будут отвечать на определенные виды противоопухолевого лечения (например, противораковую терапию, включающую препарат антагониста, связывающего ось PD-1).
Способ подсчета иммунных клеток
ИК можно подсчитать по экспрессии PD-L1 на основании процента площади опухоли, которая покрыта PD-LI-положительных ИК любой интенсивности (что также называется в настоящем документе как "ИК %"). В данном контексте термин "площадь опухоли" относится к площади (например, площади опухолевого среза), занимаемой опухолевыми клетками, а также связанной с ними внутриопухолевой и прилегающей перитуморальной стромой (Фигуры 12А-12С). Площадь опухоли была выбрана в качестве меры при этом подходе подсчета, поскольку ИК присутствовали не только в строме, но также, в некоторых случаях, в виде отдельных или диффузно распространенных клеток среди опухолевых клеток. Как описано ниже, в некоторых случаях ИК определялись в виде агрегатов в пределах опухолевого среза, в то время как в других случаях ИК определялись как очаги одной или нескольких клеток, которые распространялись по опухолевому срезу.
Типовый алгоритм определения ИК % в образце опухоли показан на Фигуре 13. В некоторых случаях серийные срезы образца опухоли окрашивали либо гематоксилин-эозином, либо антителом анти-PD-L1 (например, SP142), как указано выше. Первым этапом алгоритма было рассмотрение препаратов, окрашенных гематоксилин-эозином на предмет наличия опухоли, некроза и/или ИК. После этого исследовали соответствующий PD-L1-окрашенный препарат при малом увеличении (например, объектив 2х или 4х; общее увеличение 20х-40х), например, с помощью микроскопа, и в общем оцепивали профиль PD-L1-окрашивания. Например, указанное определение можно осуществить для того, чтобы узнать, демонстрирует ли ли срез опухолевой ткани PD-L1-окрашивание в ИК, ОК, как в ИК, так и в ОК, или демонстрирует ли срез опухолевой ткани значительное PD-L1-окрашивание. После этого исследовали PD-L1-окрашенный препарат при более высоком увеличении (например, объектив 10х или 20х; увеличение 100х-200х) для изучения стромы и группы опухолевых клеток на предмет наличия окрашивания ИК. Использование более высокого увеличения давало возможность удостовериться в наличии ИК при слабом их окрашивании и отличить ИК при сильном окрашивании ОК. Наконец, исследовали PD-L1-окрашенный препарат при более низком увеличении (например, объектив 2х или 4х; общее увеличение 20х-40х) с целью определения или оценки процента PD-L1-положительных ИК (процент площади опухоли, которая покрыта PD-L1-положительными ИК любой интенсивности).
Процент площади опухоли, которая покрыта PD-L1-положительными ИК любой интенсивности PD-L1-окрашивания, можно определить при более низком увеличении (например, объектив 2х или 4х; общее увеличение 20х-40х) с последующим рассмотрением и подтверждением окрашивания при большем увеличении, например, как показано на рисунке Фигуре 14. В тех случаях, когда профиль окрашивания ИК характеризуется единичным распространением клеток, в целях сравнения могут применяться эталонные изображения для конкретных диапазонов окрашивания ИК (например, 1%, 5%, 10%), чтобы оцепить или определить процент площади опухоли, которая покрыта PD-L1-положительными ИК, имеющими любую интенсивность PD-L1-окрашивания (см., например, Фигуры 15А и 15В и 16А-16Н).
Способ подсчета опухолевых клеток
Опухолевые клетки (ОК) можно подсчитать по экспрессии PD-L1 на основании процента от общего количества опухолевых клеток с любым различимым PD-L1-окрашиванием мембраны любой интенсивности (что также называется в настоящем документе как "ОК %"). ОК легко отличить от ИК на основании морфологии клеток при окрашивании препаратов гематоксилин-эозином и при ИГХ. См., например, Фигуры 17А-17С. Окрашивание мембраны должно визуализироваться в виде линейного окрашивания (т.е. расположено вдоль контура клеточной мембраны), даже в случаях, связанных с зернистостью. На Фигурах 18A-18F продемонстрированы примеры PD-L1-окрашенных срезов опухолевой ткани НМКРЛ, которые проявляли определенные диапазоны PD-L1-окрашивания ОК (т.е. ОК % составлял от <5%, ≥5 до <50% или ≥50%).
Другие варианты реализации изобретения
Хотя для ясности понимания некоторые детали настоящего исследования описаны посредством иллюстраций и примеров, не следует считать, что описание и примеры ограничивают рамки настоящего изобретения. Описания всех патентов и научной литературы, процитированные в настоящем документе, явным образом полностью включены в настоящий документ посредством ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЖЕНЕНТЕК, ИНК. И ДР.
<120> АНТИТЕЛА АНТИ-PD-L1 И СПОСОБЫ ИХ ДИАГНОСТИЧЕСКОГО ПРИМЕНЕНИЯ
<130> 50474-093WO2
<150> US 62/023741
<151> 2014-07-11
<160> 18
<170> PatentIn версии 3.5
<210> 1
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 1
Ser Lys Lys Gln Ser Asp Thr His Leu Glu Glu Thr
1 5 10
<210> 2
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 2
Ser Asn Gly Leu Thr
1 5
<210> 3
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 3
Thr Ile Asn Lys Asp Ala Ser Ala Tyr Tyr Ala Ser Trp Ala Lys Gly
1 5 10 15
<210> 4
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 4
Ile Ala Phe Lys Thr Gly Thr Ser Ile
1 5
<210> 5
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 5
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Lys Pro Asp Glu Thr
1 5 10 15
Leu Thr Ile Thr Cys Thr Val Ser Gly Ile Asp Leu Ser
20 25
<210> 6
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 6
Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Ile Gly
1 5 10
<210> 7
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 7
Arg Leu Thr Ile Ser Lys Pro Ser Ser Thr Lys Val Asp Leu Lys Ile
1 5 10 15
Thr Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Gly Arg
20 25 30
<210> 8
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 8
Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 9
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 9
Gln Ala Ser Glu Ser Val Tyr Ser Asn Asn Tyr Leu Ser
1 5 10
<210> 10
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 10
Leu Ala Ser Thr Leu Ala Ser
1 5
<210> 11
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 11
Ile Gly Gly Lys Ser Ser Ser Thr Asp Gly Asn Ala
1 5 10
<210> 12
<211> 23
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 12
Ala Ile Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys
20
<210> 13
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 13
Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 14
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 14
Gly Val Pro Ser Arg Phe Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr
1 5 10 15
Leu Thr Ile Ser Gly Val Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys
20 25 30
<210> 15
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 15
Phe Gly Gly Gly Thr Glu Val Val Val Arg
1 5 10
<210> 16
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 16
Gln Ser Leu Glu Glu Ser Gly Gly Arg Leu Val Lys Pro Asp Glu Thr
1 5 10 15
Leu Thr Ile Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Ser Asn Gly
20 25 30
Leu Thr Trp Val Arg Gln Ala Pro Gly Glu Gly Leu Glu Trp Ile Gly
35 40 45
Thr Ile Asn Lys Asp Ala Ser Ala Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Leu Thr Ile Ser Lys Pro Ser Ser Thr Lys Val Asp Leu Lys Ile
65 70 75 80
Thr Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Gly Arg Ile
85 90 95
Ala Phe Lys Thr Gly Thr Ser Ile Trp Gly Pro Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 17
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая конструкция
<400> 17
Ala Ile Val Met Thr Gln Thr Pro Ser Pro Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Glu Ser Val Tyr Ser Asn
20 25 30
Asn Tyr Leu Ser Trp Phe Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu
35 40 45
Leu Ile Tyr Leu Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe
50 55 60
Lys Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val
65 70 75 80
Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Ile Gly Gly Lys Ser Ser
85 90 95
Ser Thr Asp Gly Asn Ala Phe Gly Gly Gly Thr Glu Val Val Val Arg
100 105 110
<210> 18
<211> 290
<212> БЕЛОК
<213> Homo sapiens
<400> 18
Met Arg Ile Phe Ala Val Phe Ile Phe Met Thr Tyr Trp His Leu Leu
1 5 10 15
Asn Ala Phe Thr Val Thr Val Pro Lys Asp Leu Tyr Val Val Glu Tyr
20 25 30
Gly Ser Asn Met Thr Ile Glu Cys Lys Phe Pro Val Glu Lys Gln Leu
35 40 45
Asp Leu Ala Ala Leu Ile Val Tyr Trp Glu Met Glu Asp Lys Asn Ile
50 55 60
Ile Gln Phe Val His Gly Glu Glu Asp Leu Lys Val Gln His Ser Ser
65 70 75 80
Tyr Arg Gln Arg Ala Arg Leu Leu Lys Asp Gln Leu Ser Leu Gly Asn
85 90 95
Ala Ala Leu Gln Ile Thr Asp Val Lys Leu Gln Asp Ala Gly Val Tyr
100 105 110
Arg Cys Met Ile Ser Tyr Gly Gly Ala Asp Tyr Lys Arg Ile Thr Val
115 120 125
Lys Val Asn Ala Pro Tyr Asn Lys Ile Asn Gln Arg Ile Leu Val Val
130 135 140
Asp Pro Val Thr Ser Glu His Glu Leu Thr Cys Gln Ala Glu Gly Tyr
145 150 155 160
Pro Lys Ala Glu Val Ile Trp Thr Ser Ser Asp His Gln Val Leu Ser
165 170 175
Gly Lys Thr Thr Thr Thr Asn Ser Lys Arg Glu Glu Lys Leu Phe Asn
180 185 190
Val Thr Ser Thr Leu Arg Ile Asn Thr Thr Thr Asn Glu Ile Phe Tyr
195 200 205
Cys Thr Phe Arg Arg Leu Asp Pro Glu Glu Asn His Thr Ala Glu Leu
210 215 220
Val Ile Pro Glu Leu Pro Leu Ala His Pro Pro Asn Glu Arg Thr His
225 230 235 240
Leu Val Ile Leu Gly Ala Ile Leu Leu Cys Leu Gly Val Ala Leu Thr
245 250 255
Phe Ile Phe Arg Leu Arg Lys Gly Arg Met Met Asp Val Lys Lys Cys
260 265 270
Gly Ile Gln Asp Thr Asn Ser Lys Lys Gln Ser Asp Thr His Leu Glu
275 280 285
Glu Thr
290
<---