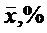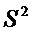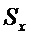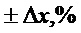Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ МИЦЕЛИЯ ТРУТОВИКА ЛИСЬЕГО, ОБОГАЩЕННОГО 6-(3,4-ДИГИДРОКСИСТИРИЛ)-4-ГИДРОКСИ-2-ПИРОНОМ (ГИСПИДИНОМ)
Вид РИД
Изобретение
Изобретение относится к области фармации и касается способа получения лекарственного сырья грибного происхождения, содержащего 6-(3,4-дигидроксистирил)-4-гидрокси-2-пирон (гиспидин).
Гиспидин представляет собой биологически активный метаболит некоторых видов базидиальных грибов, обладающий высокой эффективностью в качестве ингибитора ДНК полимеразы β (DNA polymerase, beta, POLB), которая является перспективной мишенью для адъювантной терапии опухолевых заболеваний [1], в связи с тем, что ингибирование POLB усиливает цитотоксичность агентов, повреждающих ДНК, используемых для химиотерапии рака [2]. Грибы рода Inonotus проявляют широкий диапазон биологической активности [3-5], что обусловлено присутствием полифенольных пигментов стирилпиронов, в том числе гиспидина и его производных [6]. Несмотря на многочисленность представителей данного рода, они имеют узкий ареал распространения, что повышает актуальность биотехнологического получения мицелия. К настоящему времени не существует технологии получения мицелия Inonotus rheades, обогащенного гиспидином, однако известны способы получения мицелия других видов рода Inonotus. Мицелий I. tamaricis культивировали в колбах Эрленмейера объемом 250 мл на твердой кукурузной среде в течение 28 дней, с конечным выходом гиспидина 0,5 г/л, что составляло 0,05% от общей массы [7]. Мицелий I. hispidus выращивали на жидкой среде, содержащей: глюкозу 15 г, дрожжевой экстракт 0,5 г, K2PO4 0,5 г, MgSO4×7H20, 0,05 г, NaC1 0,05 г, CaC12×2H20 0,11 г на 1 л воды при 25°С в течение 13 дней с использованием светового освещения, с наибольшим выходом гиспидина при облучении синим и белым светом [8], что составило 0,021% и 0,019% соответственно. Мицелий I. xeranticus BS064 культивировали на жидкой в среде с картофельно-декстрозным бульоном при 28°С в течение 10 дней, для выделения гиспидина использовали культуральную жидкость с выходом 0,094 г/л [9]. Известные способы получения мицелия грибов рода Inonotus характеризуются малой эффективностью и низким содержанием гиспидина в мицелии.
Задачей изобретения является создание технологии получения мицелия I. rheades, содержащего гиспидин, а также повышение биологического действия за счет более высокого содержания действующего вещества.
Техническим результатом изобретения является повышенное содержание гиспидина в мицелии I. rheades, полученного заявленным способом.
Для достижения указанного технического результата получали семисуточный вегетативный мицелий поверхностно-твердофазным способом на чашках Петри с сусло-агаровой питательной средой, следующего состава: 750 мл/л воды очищенной, 250 мл/л сусла, 10 г/л сахарозы, 10 г/л глюкозы. Следующим этапом являлась инокуляция древесного субстрата. Предварительно высушенные древесные диски (влажность не более 10%) диаметром 5-7 см и высотой 2-4 см заливали водой очищенной, вымачивали в течение 16 часов при температуре 20°С. Вымоченные древесные диски Betula pendula Roth (Betulaceae) автоклавировировали при 0,9 атм. в течение 60 минут. На дно стерильной камеры размером 100×150×20 см с отверстиями для дыхания стерильным пинцетом помещали 20 древесных дисков, на каждый из которых переносили кусочки вегетативного мицелия размером 2×2 см, весом 2,3 г (вместе с агаром) и сверху накрывали вторыми дисками. Камеру закрывали и переносили в термостат с температурой 25±2°C с закрытыми отверстиями для дыхания, инкубирование на данном этапе проводили в темноте в течение 5-7 суток до начала видимого обрастания древесного субстрата. Далее инкубирование продолжали с непрерывным облучением, в качестве которого используют светодиоды с длиной волны 467,5 нм, интенсивностью 48,3-144,9 мкмоль/м2*с в течение 30 суток при открытых отверстиях для дыхания. Далее полученную мицелиальную массу вынимали из стерильных камер и отделяли путем отрезания скальпелем от древесных дисков. Полученную мицелиальную массу помещали в сушильный шкаф, где сушили при температуре 40°С в течение 12 ч и затем фасовали. Выход готового продукта (мицелия) составляет 20% от полученной сырой мицелиальной массы.
Выявленные отличительные признаки позволили сделать вывод о соответствии предлагаемого технологического решения критерию “новизна”.
Предложенный способ позволяет получить мицелий в виде порошка желтовато-коричневого цвета со слабым специфическим запахом и слабым грибным вкусом водного извлечения. Потеря массы при высушивании - 5%.
Способ иллюстрируется нижеследующими примерами.
Пример 1. Семисуточным вегетативным мицелием I. rheades размером 2×2 см, весом 2,3 г (вместе с агаром), полученным поверхностно-твердофазным способом на чашках Петри с сусло-агаровой питательной средой (750 мл/л воды очищенной, 250 мл/л сусла, 10 г/л сахарозы, 10 г/л глюкозы), инокулировали древесный субстрат. Предварительно высушенные древесные диски (влажность не более 10%) диаметром 7 см и высотой 4 см заливали водой очищенной, вымачивали в течение 16 часов при температуре 20°С. Вымоченные древесные диски автоклавировировали при 0,9 атм. в течение 60 минут. На дно стерильной камеры размером 100×150×20 см с отверстиями для дыхания стерильным пинцетом помещали 20 древесных дисков, на каждый из которых переносили кусочки вегетативного мицелия размером 2×2 см и сверху накрывали вторыми дисками. Камеру закрывали и переносили в термостат с температурой 25±2°C с закрытыми отверстиями для дыхания, инкубирование на данном этапе проводили в темноте в течение 7 суток до начала видимого обрастания древесного субстрата. Далее инкубирование продолжали с непрерывным облучением, в качестве которого используют светодиоды с длиной волны 467,5 нм, интенсивностью 48,3 мкмоль/м2*с в течение 30 суток при открытых отверстиях для дыхания. Далее полученную мицелиальную массу вынимали из стерильных камер и отделяли путем отрезания скальпелем от древесных дисков. Полученную мицелиальную массу помещали в сушильный шкаф, где сушили при температуре 40°С в течение 12 ч и затем фасовали. Выход готового продукта (мицелия) составил 200±6 г.
Пример 2. Семисуточным вегетативным мицелием I. rheades размером 2×2 см, весом 2,3 г (вместе с агаром), полученным поверхностно-твердофазным способом на чашках Петри с сусло-агаровой питательной средой (750 мл/л воды очищенной, 250 мл/л сусла, 10 г/л сахарозы, 10 г/л глюкозы), инокулировали древесный субстрат. Предварительно высушенные древесные диски (влажность не более 10%) диаметром 7 см и высотой 2 см заливали водой очищенной, вымачивали в течение 16 часов при температуре 20°С. Вымоченные древесные диски автоклавировировали при 0,9 атм. в течение 60 минут. На дно стерильной камеры размером 100×150×20 см с отверстиями для дыхания стерильным пинцетом помещали 20 древесных дисков, на каждый из которых переносили кусочки вегетативного мицелия размером 2×2 см и сверху накрывали вторыми дисками. Камеру закрывали и переносили в термостат с температурой 25±2°C с закрытыми отверстиями для дыхания, инкубирование на данном этапе проводили в темноте в течение 7 суток до начала видимого обрастания древесного субстрата. Далее инкубирование продолжали с непрерывным облучением, в качестве которого используют светодиоды с длиной волны 467,5 нм, интенсивностью 96,8 мкмоль/м2*с в течение 30 суток при открытых отверстиях для дыхания. Далее полученную мицелиальную массу вынимали из стерильных камер и отделяли путем отрезания скальпелем от древесных дисков. Полученную мицелиальную массу помещали в сушильный шкаф, где сушили при температуре 40°С в течение 12 ч и затем фасовали. Выход готового продукта (мицелия) составил 203±4 г.
Пример 3. Семисуточным вегетативным мицелием I. rheades размером 2×2 см, весом 2,3 г (вместе с агаром), полученным поверхностно-твердофазным способом на чашках Петри с сусло-агаровой питательной средой (750 мл/л воды очищенной, 250 мл/л сусла, 10 г/л сахарозы, 10 г/л глюкозы), инокулировали древесный субстрат. Предварительно высушенные древесные диски (влажность не более 10%) диаметром 6 см и высотой 2 см заливали водой очищенной, вымачивали в течение 16 часов при температуре 20°С. Вымоченные древесные диски автоклавировировали при 0,9 атм. в течение 60 минут. На дно стерильной камеры размером 100×150×20 см с отверстиями для дыхания стерильным пинцетом помещали 20 древесных дисков, на каждый из которых переносили кусочки вегетативного мицелия размером 2×2 см и сверху накрывали вторыми дисками. Камеру закрывали и переносили в термостат с температурой 25±2°C с закрытыми отверстиями для дыхания, инкубирование на данном этапе проводили в темноте в течение 7 суток до начала видимого обрастания древесного субстрата. Далее инкубирование продолжали с непрерывным облучением, в качестве которого используют светодиоды с длиной волны 467,5 нм, интенсивностью 144,9 мкмоль/м2*с в течение 30 суток при открытых отверстиях для дыхания. Далее полученную мицелиальную массу вынимали из стерильных камер и отделяли путем отрезания скальпелем от древесных дисков. Полученную мицелиальную массу помещали в сушильный шкаф, где сушили при температуре 40°С в течение 12 ч и затем фасовали. Выход готового продукта (мицелия) составил 198±7 г.
Химический состав мицелия.
Химические исследования готового продукта (мицелия) проводили с применением метода ВЭЖХ-УФ, идентификацию соединений проводили по данным хроматографической подвижности, спектров поглощения, спектральных отношений и метода добавок [10]. В результате в трех образцах 70% этиловых экстрактов из мицелия I. rheades, было установлено присутствие феллинина A1/A2, 1,1-дистирилпирилэтана, транс-биснорянгонина, цис-биснорянгонина, 3-биснорянгонил-14′-гиспидина, 3,14′-бисгиспидинила, транс-гиспидина, цис-гиспидина, гифоломина B и реадинина. Было показано, что гиспидин является доминирующим компонентом во всех вариациях условий культивирования, содержание которых в мицелии составило 5,94-6,01 мг/г (табл. 1).
Таблица 1
Содержание стирилпиронов и бис(стирилпиронов) в мицелии I. rheades, выращенного с применением синего света различной интенсивности, мг/г
|
Количественный анализ и показатели качества средства
Для осуществления химической стандартизации мицелии разработана методика количественного анализа гиспидина методом ВЭЖХ-УФ.
Методика количественного анализа гиспидина в мицелии методом ВЭЖХ.
Приготовление растворов. Раствор СО гиспидина. Около 10,0 мг (точная навеска) СО гиспидина растворяли в спирте 96% в мерной колбе вместимостью 10 мл, доводили объем раствора до метки и перемешивают. Срок годности раствора не более 1 мес. при хранении в плотно укупоренной таре в прохладном, защищенном от света месте.
Проверка пригодности хроматографической системы. Хроматографическая система считается пригодной, если выполняются следующие условия:
- фактор асимметрии пика гиспидина должен находиться в пределах от 0,8 до 1,5;
- эффективность хроматографической колонки должна быть не менее 5000 теоретических тарелок.
Приготовление испытуемого раствора. Аналитическую пробу сырья измельчали до величины частиц, проходящих сквозь сито с отверстиями размером 1 мм. Около 40 мг (точная навеска) измельченного сырья помещали в пробирку Эппендорфа вместимостью 2 мл, прибавляли 1 мл спирта 70% и нагревали в ультразвуковой ванне при 50°С в течение 40 мин. После охлаждения пробирку центрифугировали. Около 100 мкл супернатанта фильтровали через нейлоновый фильтр (с размером пор 0,45 мкм) (испытуемый раствор).
Условия хроматографирования. Колонка: нержавеющая сталь, 70×2 мм, эндкеппированный октадецилсиликагель (С18) для хроматографии (5 мкм). Подвижная фаза: элюент А [0,2 М LiClO4 в 0,006 М HClO4], элюент В [MeCN]; режим элюирования 50-100% В (0-10 мин), 100% (10-20 мин). Скорость потока 0,15 мл/мин, Т 35°С. Детектор: УФ-спектрофотометрический или диодная матрица. Длина волны 250 нм. Объем вводимой пробы 1 мкл. Время регистрации хроматограммы 20 мин.
Хроматографировали попеременно испытуемый раствор и раствор СО, получая не менее 3 хроматограмм. Результаты считаются достоверными если выполняются требования теста «Проверка пригодности хроматографической системы». Расчет содержания гиспидина проводили методом внешнего стандарта.
Содержание гиспидина в абсолютно сухом сырье в процентах (Х) вычисляли по формуле:
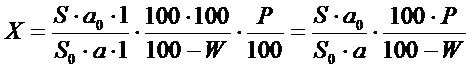 ,
,
где S - площадь пика гиспидина на хроматограмме испытуемого раствора;
S0 - площадь пика гиспидина на хроматограмме СО гиспидина;
а - навеска сырья, мг;
а0 - навеска СО гиспидина, мг;
Р - содержание основного вещества в СО гиспидина, %;
W - влажность сырья, %.
Валидационный анализ показал, что зависимость площади хроматографического пика от концентрации гиспидина в диапазоне концентрации 5-1000 мкг/мл описывалась линейной регрессией со значением коэффициента детерминации 0,9999. Метрологический анализ разработанной методики показал, что относительная ошибка определения гиспидина методом ВЭЖХ не превышает 1,5% (табл. 2). Полученные результаты свидетельствуют об удовлетворительных валидационных параметрах методик, что указывает на возможность их использования в практике фармакопейного анализа для определения показателей качества разработанного средства.
Таблица 2
Метрологические характеристики методик количественного анализа гиспидина
(n = 5, P = 0,95, tP,f = 2,78)
|
По данным проведенных исследований определены общие показатели качества мицелия, обобщенные в таблице 3. Для стандартизации мицелия I. rheades сухого было предложено определение внешнего вида, подлинности, потери в массе при высушивании, золы общей, тяжелых металлов, количественное определение гиспидина (ВЭЖХ) и микробиологической чистоты.
Таблица 3
Показатели качества мицелия трутовика лисьего сухого
|
Предлагаемый способ, по сравнению с известными, позволяет получить мицелий с более выраженной биологической активностью за счет более высокого содержания действующего вещества (гиспидина).
Рассчитать экономическую целесообразность предлагаемого способа в настоящее время не представляется возможным, однако вышеуказанные преимущества в сочетании с простой схемой получения способствуют рациональному использованию лекарственного грибного сырья и определяют перспективность внедрения данного способа в фармацевтическую промышленность.
Источники информации
1. https://pubchem.ncbi.nlm.nih.gov/compound/hispidin#section=BioAssay-Results
2. Gao Z., Maloney D.J, Dedkova L.M., Hecht S.M. Inhibitors of DNA polymerase beta: activity and mechanism. Bioorg. Med. Chem., 2008, Vol. 16, No 8, p. 4331-4340. DOI: 10.1016/j.bmc.2008.02.071.
3. Glamoclija J., Ciric A., Nikolic M., Fernandes A, Barros L., Calhelha R C., Ferreira I. C.F.R., Sokovic M., Griensven L.J.L.D. Chemical characterization and biological activity of Chaga (Inonotus obliquus), a medicinal “mushroom”. J. Ethnopharmacology, 2015, Vol. 162, p. 323-332. DOI: 10.1016/j.jep.2014.12.069.
4. Awadh Alia N.A., Mothanaa R.A.A., Lesnauc A., Pilgrima H., Lindequist U. Antiviral activity of Inonotus hispidus. Fitoterapia, 2003 Vol. 74, p. 483-485. DOI: 10.1016/S0367-326X(03)00119-9.
5. Arunachalam S., Kim S.Y, Lee S.H., Lee Y.H., Kim M.S., Yun B.S., Yi H.K., Hwang P.H. Davallialactone protects against adriamycin-induced cardiotoxicity in vitro and in vivo. J. Nat. Med., 2012, Vol. 66, p. 149-157. DOI: 10.1007/s11418-011-0567-1.
6. Lee I.K., Yun B.S. Styrylpyrone-class compounds from medicinal fungi Phellinus and Inonotus spp., and their medicinal importance. J. Antibiotics, 2011, Vol. 64, p. 349-359. DOI: 10.1038/ja.2011.2.
7. Singh S.B., Jayasuriya H., Dewey R., Polishook J.D., Dombrowski A.W., Zink D.L., Guan Z., Collado J., Platas G., Pelaez F., Felock P.J., Hazuda D.J. Isolation, structure, and HIV-1-integrase inhibitory activity of structurally diverse fungal metabolites. J. Ind. Microbiol. Biotechnol, 2003, Vol. 30, p. 721-731. DOI: 10.1007/s10295-003-0101-x.
8. Vance C.P., Nambudiri A.M.D., Tregunna E.B. Styrylpyrone biosynthesis in Polyporus hispidus: I. Action spectrum and photoregulation of pigment and enzyme formation. Biochim. Biophys. Acta, 1974, Vol. 343, I. 1. р. 138-147. DOI: 10.1016/0304-4165(74)90245-1.
9. Jung J.Y., Lee I.K., Seok S.J., Lee H.J., Kim Y.H., Yun B.S. Antioxidant polyphenols from the mycelial culture of the medicinal fungi Inonotus xeranticus and Phellinus linteus. J. Applied Microbiology, 2008, Vol. 104, p. 1824-1832. DOI: 10.1111/j.1365-2672.2008.03737.x.
10. Olennikov, D.N. Gornostai T.G., Penzina T.A. Rheadinin, a new bis(styrylpyrone) from mycelium of Inonotus rheades. Chem. Nat. Comp., 2017, Vol. 53, N 4, р. 629-631. DOI: 10.1007/s10600-017-2076-2.
Способ получения лекарственного сырья грибного происхождения, содержащего 6-(3,4-дигидроксистирил)-4-гидрокси-2-пирон (гиспидин), путем культивирования мицелия трутовика лисьего, отличающийся тем, что предварительно высушенные древесные диски Roth (Betulaceae) с влажностью не более 10%, диаметром 5-7 см и высотой 2-4 см вымачивают в течение 16 часов в воде, очищенной при температуре 20°С, затем автоклавировируют при 0,9 атм. в течение 60 минут и далее подвергают инокуляции семисуточным вегетативным мицелием следующим образом: на дно стерильной камеры размером 100×150×20 см с отверстиями для дыхания стерильным пинцетом помещают 20 древесных дисков, на каждый из которых переносят кусочки вегетативного мицелия размером 2×2 см, весом 2,3 г вместе с агаром, и сверху накрывают вторыми дисками, после чего камеру закрывают и далее инкубирование проводят при температуре 25±2°C в темноте в течение 5-7 суток с закрытыми отверстиями для дыхания, затем инкубирование продолжают с непрерывным облучением, в качестве которого используют светодиоды с длиной волны 467,5 нм, интенсивностью 48,3-144,9 мкмоль/мс, в течение 30 суток при открытых отверстиях для дыхания, полученную мицелиальную массу вынимают из стерильных камер и отделяют путем отрезания скальпелем от древесных дисков, затем сушат при температуре 40°С в течение 12 ч, фасуют.