Результат интеллектуальной деятельности: КОМПОЗИЦИЯ ДВУХСЛОЙНОЙ ТАБЛЕТКИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к композиции двухслойной таблетки, содержащей композицию метформина с замедленным высвобождением (XR) или композицию метформина уменьшенного веса XR в качестве первого слоя, композицию ингибитора натрий-зависимого транспортера глюкозы (SGLT2) в качестве второго слоя и, необязательно пленочную оболочку. Настоящее изобретение обеспечивает способы получения композиций двухслойных таблеток и способы лечения заболеваний и расстройств, связанных с активностью SGLT2, с применением композиций двухслойных таблеток.
Уровень техники
Диабет второго типа является наиболее распространенной формой диабета, на которую приходится 90% случаев диабета. Более 100 миллионов человек во всем мире страдают диабетом 2-го типа (около 17 миллионов в США), и распространенность заболевания резко увеличивается как в развитых, так и развивающихся странах. Диабет II типа является заболеванием, продолжающимся на протяжении всей жизни, которое обычно начинается в среднем возрасте или позже, но может начаться в любом возрасте. Пациенты с диабетом 2-го типа не реагируют должным образом на инсулин, гормон, который обычно позволяет организму преобразовывать глюкозу в крови в энергию и хранить ее в клетках для дальнейшего использования. Проблемой диабета 2-го типа является состояние, которое называется резистентностью к инсулину, при котором организм вырабатывает инсулин в нормальных или даже больших количествах, но некоторые механизмы препятствуют активности инсулина по перемещению глюкозы в клетки. Поскольку организм не использует инсулин должным образом, уровень глюкозы повышается в крови до опасных значений, это состояние известно как гипергликемия.
Со временем устойчивая гипергликемия приводит к глюкотоксичности, которая ухудшает резистентность к инсулину и способствует дисфункции бета-клеток поджелудочной железы. Степень устойчивой гипергликемии напрямую связана с микрососудистыми осложнениями при диабете, а также может способствовать развитию макрососудистых осложнений. Таким образом, гипергликемия продолжает цикл вредных последствий, которые осложняют контроль над диабетом 2-го типа и усугубляют осложнения.
В настоящее время широко известно, что гликемический контроль имеет большое значение для больных сахарным диабетом II типа. Целью терапии сахарного диабета на сегодня является достижение и поддержание наиболее близкого к нормальному уровня глюкозы для предотвращения долгосрочных микрососудистых и макрососудистых осложнений, связанных с повышенным уровнем глюкозы в крови. Применяемые для лечения сахарного диабета второго типа пероральные лекарственные средства включают такие соединения как сульфонилмочевины, бигуаниды (метформин), тиазолидиндионы и ингибиторы альфа-глюкозидазы. Активные агенты каждого класса, как правило, вводят пациентам по отдельности. Однако, если монотерапии становится недостаточно, комбинированная терапия становится привлекательным и рациональным подходом для лечения гипергликемии, несмотря на известный побочный эффект увеличения веса, связанный с терапией сульфонилмочевиной и тиазолидиноном.
В последнее время был открыт новый класс противодиабетических агентов, известных как ингибиторы натрий-зависимого переносчика глюкозы-2 (SGLT2). Ингибиторы SGLT2 предотвращают реабсорбцию глюкозы в кровь почками. Почки непрерывно фильтруют глюкозу через клубочек в капсулу, однако, почти вся эта глюкоза реабсорбируется. SGLT2 представляет собой белок, ответственный за большую часть реабсорбции глюкозы, помогающий организму удерживать глюкозу для своих потребностей в энергии. Для пациентов с сахарным диабетом сохранение избыточной глюкозы этим путем способствует постоянной гипергликемии. Подавление активности SGLT2 ингибирует почечную реабсорбцию глюкозы в организме, что приводит к выведению глюкозы с мочой.
Соответственно, настоящее изобретение обеспечивает композиции двухслойных таблеток, которые состоят из метформина и ингибитора SGLT2, для перорального введения для лечения заболевания или расстройства, связанного с активностью SGLT2, без увеличения веса, связанного с другими способами лечения. Первый слой двухслойной таблетки представляет собой композицию метформина с замедленным высвобождением (XR) или композицию метформина уменьшенного веса XR. Второй слой представляет собой композицию ингибитора SGLT2. Двухслойные таблетки метформин/SGLT2 по настоящему изобретению обеспечивают противодиабетическую терапию для пациентов, которая является удобной и эффективной для контроля уровня глюкозы в крови.
Раскрытие изобретения
Настоящее изобретение обеспечивает двухслойные таблетки, включающие (1) композицию метформина XR или композицию метформина уменьшенного веса XR в качестве первого слоя, (2) композицию ингибитора SGLT2 в качестве второго слоя и (3), необязательно, пленочной оболочки, которая охватывает оба слоя. Метформин может быть в форме фармацевтически приемлемой соли, где предпочтительным является гидрохлорид (HCl) метформина. Предпочтительный ингибитор SGLT2 представляет собой дапаглифлозин или его фармацевтически приемлемую соль, дапаглифлозин (S) пропиленгликольгидрат (1:1:1) или дапаглифлозин (R) пропиленгликольгидрат (1:1:1). Наиболее предпочтительный ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) пропиленгликольгидрат (1:1:1). Композиция ингибитора SGLT2 представляет собой композицию с немедленным освобождением или композицию с замедленным высвобождением, где композиция с немедленным освобождением является предпочтительной.
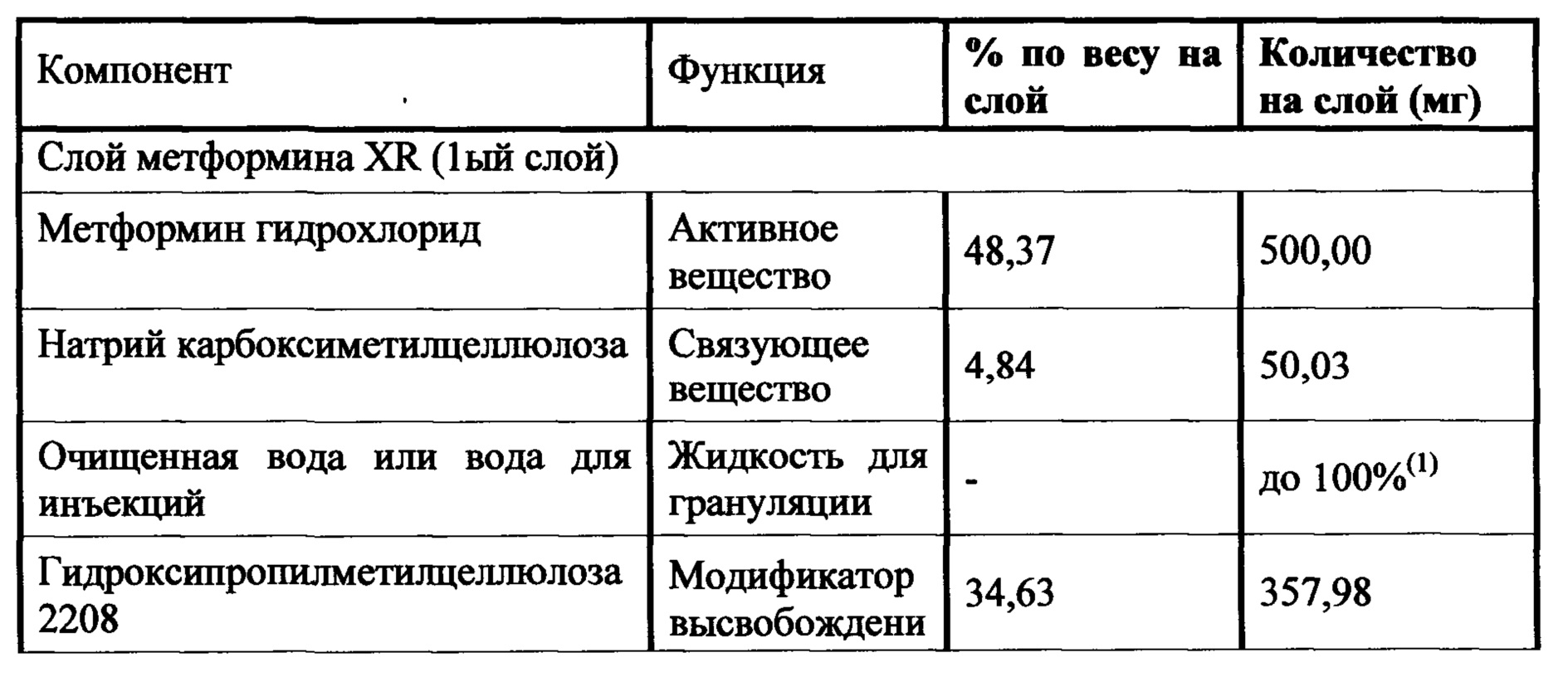
Слой метформина XR (1000 мг) включает метформин, связующее вещество, модификатор высвобождения, смазывающее вещество, и, необязательно, вещество, способствующее скольжению. Предпочтительным связующим является натрий-карбоксиметилцеллюлоза. Гидроксипропилметилцеллюлоза 2208 является предпочтительным модификатором высвобождения. Стеарат магния является предпочтительным смазывающим веществом, и диоксид кремния или коллоидный диоксид кремния являются предпочтительными веществами, способствующими скольжению. Слой ингибитора SGLT2 включает ингибитор SGLT2, два или три наполнителя, разрыхлитель, вещество, способствующее скольжению, и смазывающее вещество. Предпочтительным наполнителем является безводная лактоза, микрокристаллическая целлюлоза 302, прежелатинизированный крахмал и маннитол. Предпочтительным разрыхлителем является кросповидон. Диоксид кремния является предпочтительным веществом, способствующим скольжению, и стеарат магния является предпочтительным смазывающим веществом. Гидроксипропилцеллюлоза EXF является предпочтительным связующим.
Слой метформина XR (500 мг) содержит метформин, связующее вещество, по меньшей мере, один модификатор высвобождения, наполнитель, смазывающее вещество, и, необязательно, вещество, способствующее скольжению. Предпочтительным связующим является натрий-карбоксиметилцеллюлоза. Гидроксипропилметилцеллюлоза 2208 в сочетании с гидроксипропилметилцеллюлозой 2910 является предпочтительным модификатором высвобождения. Стеарат магния является предпочтительным смазывающим веществом, и диоксид кремния или коллоидный диоксид кремния являются предпочтительными веществами, способствующими скольжению. Слой ингибитора SGLT2 включает ингибитор SGLT2, два или три наполнителя, разрыхлитель, вещество, способствующее скольжению, и смазывающее вещество. Предпочтительными наполнителями являются безводная лактоза, микрокристаллическая целлюлоза 302, прежелатинизированный крахмал и маннитол. Предпочтительным разрыхлителем является кросповидон. Диоксид кремния является предпочтительным веществом, способствующим скольжению, и стеарат магния является предпочтительным смазывающим веществом. Гидроксипропилцеллюлоза EXF является предпочтительным связующим.
В другом аспекте настоящее изобретение предусматривает способы лечения заболеваний или нарушений, связанных с активностью SGLT2, включающие введение млекопитающим, нуждающимся в таком лечении, терапевтически эффективного количества двухслойных таблеток, включающих метформин XR или метформин уменьшенного веса XR, ингибитор SGLT2 и, необязательно, пленочную оболочку. Композиция двухслойной таблетки по настоящему изобретению может быть введена млекопитающему, предпочтительно человеку, для лечения целого ряда состояний и нарушений, связанных с активностью SGLT2, включая, но не ограничиваясь лечением или замедлением прогрессирования или начала сахарного диабета (в том числе диабета I типа и диабета II типа), нарушением толерантности к глюкозе, резистентностью к инсулину и диабетическими осложнениями, такими как нефропатия, ретинопатия, нейропатия и катаракта, гипергликемия, гиперинсулинемия, гиперхолестеринемия, дислипидемия, повышенный уровень свободных жирных кислот и глицерина в крови, гиперлипидемия, гипертриглицеридемия, ожирение, замедленное заживление ран, ишемия тканей, атеросклероз и гипертония. Композиции настоящего изобретения также могут быть использованы для увеличения содержания липопротеинов высокой плотности (HDL) в крови. Кроме того, состояния, заболевания и расстройства, обобщенно упоминаемые как "синдром X" или метаболический синдром, как описано Johannsson, J. Clin. Endocrinol. Metab., 82, 727-34 (1997), можно лечить с использованием композиций по настоящему изобретению.
В другом аспекте в настоящем изобретении предусмотрены способы получения двухслойной таблетки, содержащей метформин XR или метформин уменьшенного веса XR, ингибитор SGLT2, и, необязательно, пленочную оболочку.
Раскрытие изобретения
Изготовление двухслойной таблетки со значительно отличающимся весом двух слоев может привести к образованию трещин в области контакта слоев, разделению слоев или даже перекрестному загрязнению двух слоев. Большая разница в весе между слоями метформина и ингибитора SGLT2 в Примерах 4-15 обуславливает проблемы, связанные с поддержанием содержания действующего вещества и однородностью содержимого слоя меньшего веса, слоя ингибитора SGLT2. Кроме того, было установлено, что во множестве пробных композиций в слое SGLT2 на поверхности таблеток, в области, прилегающей к области контакта слоев, но не в самой области контакта, параллельно области контакта слоев образовывались трещины. Композиции со слоем SGLT2, содержащим повышенный уровень микрокристаллической целлюлозы, характеризовались, например, уменьшением или отсутствием трещин, разделения и перекрестного загрязнения двух слоев, при сохранении содержания действующего вещества и однородности второго слоя. Кроме того, для замены части микрокристаллической целлюлозы могут быть использованы прежелатинизированный крахмал, гидроксипропилцеллюлоза EXF или маннитол. Наконец, доведение общего веса второго слоя до около 300 мг - 400 мг способствовало уменьшению или устранению трещин, разделения и перекрестного загрязнения двух слоев. Предпочтительный вес второго слоя составляет 300 мг. Соответственно, настоящее изобретение обеспечивает композиции двухслойной таблетки, в которых уменьшены или устранены трещины, разделение и перекрестное загрязнение слоев метформина и SGLT2 и сохранены или улучшены содержание действующего вещества и однородность слоя SGLT2.
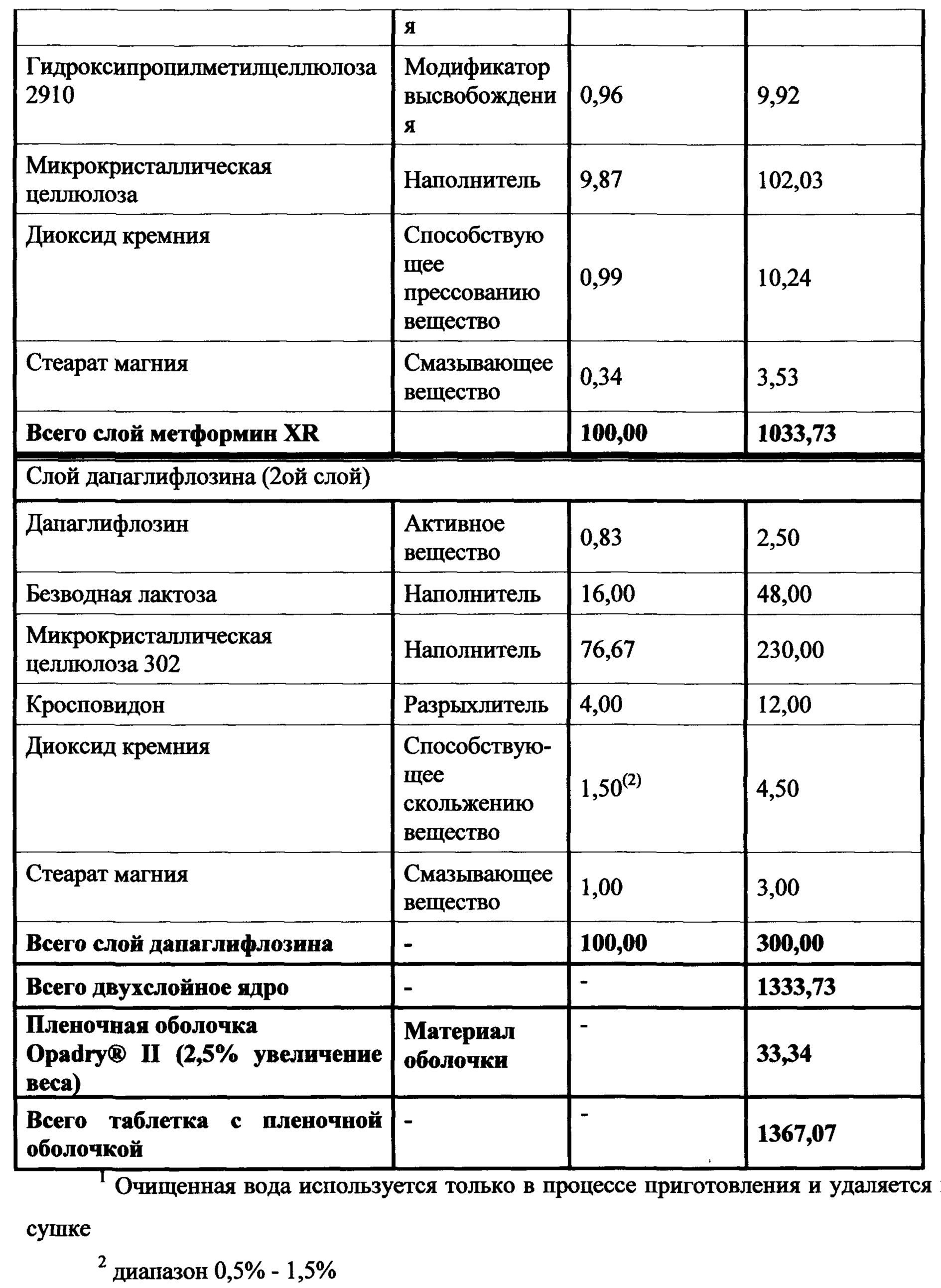
Настоящее изобретение относится к двухслойной таблетке, содержащей композиции метформина XR (1000 мг), композиции ингибитора SGLT2 (2,5, 5,0 или 10,0 мг), и, необязательно, пленочную оболочку. Композиция метформина XR включает гидрохлорид (HCl) метформина, натриевую соль карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозу, стеарат магния. Композиция SGLT2 включает в себя ингибитор SGLT2, безводную лактозу, микрокристаллическую целлюлозу, кросповидон, диоксид кремния, стеарат магния. Для второго слоя для замены части микрокристаллической целлюлозы могут быть использованы прежелатинизированный крахмал, гидроксипропилцеллюлоза EXF или маннитол (pearlitol SD 200). Кроме того, общий вес второго слоя составляет от около 300 мг до около 400 мг. Предпочтительный вес второго слоя составляет 300 мг. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин, дапаглифлозин (S) PGS или дапаглифлозин (R) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 50-87% гидрохлорида (HCl) метформина, около 1-10% натрий-карбоксиметилцеллюлозы, около 10-40% гидроксипропилметилцеллюлозы, 0,1-75% стеарата магния и около 0-2% диоксида кремния или около 0-1,5% коллоидного диоксида кремния. Композиция ингибитора SGLT2 содержит около 0,1-10% ингибитора SGLT2, около 5-30% безводной лактозы, около 40-90% микрокристаллической целлюлозы, около 0-25% прежелатинизированного крахмала, около 0-20% гидроксипропилцеллюлозы, около 0-25% маннитола, около 1-10% кросповидона, около 0,1-5% диоксида кремния и около 0,1-5% стеарата магния. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 64-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-30% гидроксипропилметилцеллюлозы, 0,1-75% стеарата магния и около 0-2% диоксида кремния или около 0-1,5% коллоидного диоксида кремния. Композиция ингибитора SGLT2 содержит около 0,5-4% ингибитора SGLT2, около 14-18% безводной лактозы, около 50-80% микрокристаллической целлюлозы, около 0-20% прежелатинизированного крахмала, около 0-15% гидроксипропилцеллюлозы, около 0-20% маннитола, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,49-2% стеарата магния. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 67-71% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 25-29% гидроксипропилметилцеллюлозы 2208 и около 0,1-75% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозин (S) PGS, около 14-18% безводной лактозы, около 72-80% микрокристаллической целлюлозы 302, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 67-71% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 25-29% гидроксипропилметилцеллюлозы 2208 и около 0,1-75% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 50-70% микрокристаллической целлюлозы 302, около 10-22% прежелатинизированного крахмала, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,1-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 67-71% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 25-29% гидроксипропилметилцеллюлозы 2208 и около 0,1-75% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 60-70% микрокристаллической целлюлозы 302, около 5-15% гидроксипропилцеллюлозы EXF, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,1-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 67-71% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 25-29% гидроксипропилметилцеллюлозы 2208 и около 0,1-75% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 55-65% микрокристаллической целлюлозы 302, около 10-20% маннитола, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,1-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозин (S) PGS, около 16% безводной лактозы, около 57-77% микрокристаллической целлюлозы 302, около 0-19% прежелатинизированного крахмала, около 0-10% гидроксипропилцеллюлозы EXF, около 0-15% маннитола, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,8% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 77% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 76% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 3,4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 74% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 64% микрокристаллической целлюлозы 302, около 13% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 57% микрокристаллической целлюлозы 302, около 19% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 66% микрокристаллической целлюлозы 302, около 10% гидроксипропилцеллюлозы EXF, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 61% микрокристаллической целлюлозы 302, около 15% маннитола, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 67-73% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 25-30% гидроксипропилметилцеллюлозы 2208 и около 0,08-0,2% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина (S) PGS, около 14-18% безводной лактозы, около 55-70% микрокристаллической целлюлозы 302, около 10-25% прежелатинизированного крахмала, около 3-5% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-2% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина (S) PGS, около 16% безводной лактозы, около 56-64% микрокристаллической целлюлозы 302, около 13-19% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 67-73% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 25-30% гидроксипропилметилцеллюлозы 2208 и около 0,08-0,2% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина (S) PGS, около 14-18% безводной лактозы, около 55-70% микрокристаллической целлюлозы 302, около 5-20 гидроксипропилцеллюлозы EXF, около 3-5% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-2% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина (S) PGS, около 16% безводной лактозы, около 66% микрокристаллической целлюлозы 302, около 10% гидроксипропилцеллюлозы EXF, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 67-73% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 25-30% гидроксипропилметилцеллюлозы 2208 и около 0,08-0,2% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина (S) PGS, около 14-18% безводной лактозы, около 55-70% микрокристаллической целлюлозы 302, около 5-25 маннитола, около 3-5% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-2% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 69% гидрохлорида (HCl) метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,49% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина (S) PGS, около 16% безводной лактозы, около 61% микрокристаллической целлюлозы 302, около 15% маннитола, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
Настоящее изобретение также относится к двухслойным таблеткам, содержащим композиции метформина XR (500 мг), композиции ингибиторов SGLT2 (2,5, 5,0, или 10,0 мг), и, необязательно, пленочную оболочку. Композиция метформина XR включает гидрохлорид (HCl) метформина, натрий-карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу, микрокристаллическую целлюлозу, стеарат магния. Композиция ингибитора SGLT2 включает в себя ингибитор SGLT2, безводную лактозу, микрокристаллическую целлюлозу, кросповидон, диоксид кремния, стеарат магния. Для второго слоя для замены части микрокристаллической целлюлозы могут быть использованы прежелатинизированный крахмал, гидроксипропилцеллюлоза EXF или маннитол (pearlitol SD 200). Кроме того, общий вес второго слоя составляет от около 300 мг до около 400 мг. Предпочтительный вес второго слоя составляет 300 мг. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин, дапаглифлозин (S) PGS или дапаглифлозин (R) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 40-60% гидрохлорида (HCl) метформина, около 1-10% натрий-карбоксиметилцеллюлозы, около 20-45% гидроксипропилметилцеллюлозы, 5-15% микрокристаллической целлюлозы, около 0,1-0,75% стеарата магния и около 0-2% диоксида кремния или около 0-1,5% коллоидного диоксида кремния. Композиция ингибитора SGLT2 содержит около 0,1-10% ингибитора SGLT2, около 5-30% безводной лактозы, около 40-90% микрокристаллической целлюлозы, около 0-25% прежелатинизированного крахмала, около 0-20% гидроксипропилцеллюлозы, около 0-25% маннитола, около 1-10% кросповидона, около 0,1-5% диоксида кремния и около 0,1-5% стеарата магния. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 42-55% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы, 5-15% микрокристаллической целлюлозы, около 0,1-0,75% стеарата магния и около 0-2% диоксида кремния или около 0-1,5% коллоидного диоксида кремния. Композиция ингибитора SGLT2 содержит около 0,5-4% ингибитора SGLT2, около 14-18% безводной лактозы, около 65-80% микрокристаллической целлюлозы, около 0-20% прежелатинизированного крахмала, около 0-15% гидроксипропилцеллюлозы, около 0-20% маннитола, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,49-2% стеарата магния. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 46-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы, около 0,1-0,75% стеарата магния и около 0-2% диоксида кремния или около 0-1,5% коллоидного диоксида кремния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) PGS, около 14-18% безводной лактозы, около 72-80% микрокристаллической целлюлозы 302, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 46-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы и около 0,1-0,75% стеарата магния Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 50-70% микрокристаллической целлюлозы 302, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 46-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы и около 0,1-0,75% стеарата магния Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 60-70% микрокристаллической целлюлозы 302, около 5-15% гидроксипропилцеллюлозы EXF, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 46-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы и около 0,1-0,75% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 55-65% микрокристаллической целлюлозы 302, около 10-20% маннитола, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 48-49% гидрохлорида (HCl) метформина, около 4,5-5% натрий-карбоксиметилцеллюлозы, около 34,5-35% гидроксипропилметилцеллюлозы 2208, около 0,8-1,2% гидроксипропилметилцеллюлозы 2910, около 9,75-10,25% микрокристаллической целлюлозы и около 0,34% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 72-77% микрокристаллической целлюлозы 302, около 0-19% прежелатинизированного крахмала, около 0-10% гидроксипропилцеллюлозы EXF, около 0-15% маннитола, около 4% кросповидона, около 0,5-1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 48-49% гидрохлорида (HCl) метформина, около 4,5-5% натрий-карбоксиметилцеллюлозы, около 34,5-35% гидроксипропилметилцеллюлозы 2208, около 0,8-1,2% гидроксипропилметилцеллюлозы 2910, около 9,75-10,25% микрокристаллической целлюлозы и около 0,34% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) PGS, около 16% безводной лактозы, около 12-11% микрокристаллической целлюлозы 302, около 4% кросповидона, около 0,5-1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
Композиции с уменьшенным весом слоя метформина XR по сравнению с известными или доступными в настоящее время композициями метформина XR без уменьшения количества активного ингредиента являются предпочтительными, так как эти композиции обеспечивают меньшее различие веса между двумя слоями, тем самым уменьшая или устраняя проблемы, связанные с производством двухслойной таблетки (трещины, разделение слоев, перекрестное загрязнение). Кроме того, двухслойные таблетки меньше по размеру и больше подходят для перорального применения пациентами. Изобретение обеспечивает снижение веса композиций метформина XR, которые включают диоксид кремния или коллоидный диоксид кремния и уменьшенное количество гидроксипропилметилцеллюлозы. Содержание гидроксипропилметилцеллюлозы снижено с около 27% до около 18%. Указанные композиции характеризуются улучшенной компактностью и уменьшенным с около 4,8: 1 до около 4,4: 1 отношением веса слоев при сохранении аналогичной скорости высвобождения метформина.
Соответственно, настоящее изобретение обеспечивает двухслойные таблетки, содержащие композиции метформина уменьшенного веса XR (1000 мг), композиции ингибитора SGLT2 (2,5, 5,0, 10,0 мг) и, необязательно, пленочную оболочку. Композиции метформина уменьшенного веса XR включают метформин-HCl, натрий-карбоксиметилцеллюлозу, гидроксипропилметилцеллюлозу, диоксид кремния или коллоидный диоксид кремния, стеарат магния. Композиции ингибитора SGLT2 включают ингибитор SGLT2, безводную лактозу, микрокристаллическую целлюлозу, кросповидон, диоксид кремния, стеарат магния. Для второго слоя для замены части микрокристаллической целлюлозы могут быть использованы прежелатинизированный крахмал, гидроксипропилцеллюлоза или маннитол. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин, дапаглифлозин (S) PGS или дапаглифлозин (R) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 70-85% гидрохлорида (HCl) метформина, около 2-6% натрий-карбоксиметилцеллюлозы, около 15-27% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,05-5% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,1-10% ингибитора SGLT2, около 5-30% безводной лактозы, около 40-90% микрокристаллической целлюлозы 302, около 0-25% прежелатинизированного крахмала, около 0-20% гидроксипропилцеллюлозы EXF, около 0-25% маннитола (pearlitol SD 200), около 4% кросповидона, около 0,1-5% диоксида кремния и около 0,1-5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 72-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,1-10% ингибитора SGLT2, около 5-30% безводной лактозы, около 40-90% микрокристаллической целлюлозы 302, около 0-25% прежелатинизированного крахмала, около 0-20% гидроксипропилцеллюлозы EXF, около 0-25% маннитола (pearlitol SD 200), около 1-10% кросповидона, около 0,1-5% диоксида кремния и около 0,1-5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 72-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 72-80% микрокристаллической целлюлозы 302, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 72-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 50-70% микрокристаллической целлюлозы 302, около 10-22% прежелатинизированного крахмала, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 72-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 60-70% микрокристаллической целлюлозы 302, около 5-15% гидроксипропилцеллюлозы EXF, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 72-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 55-65% микрокристаллической целлюлозы 302, около 10-20% маннитола, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 72-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 56-64% микрокристаллической целлюлозы 302, около 13-19% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 72-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 66% микрокристаллической целлюлозы 302, около 10% гидроксипропилцеллюлозы, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 72-82% гидрохлорида (HCl) метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 61% микрокристаллической целлюлозы 302, около 15% маннитола, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 76,6% гидрохлорида (HCl) метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25% -0,75% коллоидного диоксида кремния и около 0,53% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,8% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 77% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 76,6% гидрохлорида (HCl) метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 76% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 76,6% гидрохлорида (HCl) метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25% -0,75% коллоидного диоксида кремния и около 0,53% стеарата магния. Композиция ингибитора SGLT2 содержит около 3,4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 74% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 76,6% гидрохлорида (HCl) метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 64% микрокристаллической целлюлозы 302, около 13% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 76,6% гидрохлорида (HCl) метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 57% микрокристаллической целлюлозы 302, около 19% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 76,6% гидрохлорида (HCl) метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 66% микрокристаллической целлюлозы 302, около 10% гидроксипропилцеллюлозы EXF, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (1000 мг) XR содержит около 76,6% гидрохлорида (HCl) метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния, около 0,25%-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния. Композиция ингибитора SGLT2 содержит около 1,7% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 61% микрокристаллической целлюлозы 302, около 15% маннитола, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет около 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
Настоящее изобретение относится к двухслойной таблетке, содержащей композиции метформина XR (500 мг), композиции ингибитора SGLT2 (2,5, 5,0 или 10,0 мг), и, необязательно, пленочная оболочка. Композиция метформина XR 500 мг включает гидрохлорид (HCl) метформина, натриевую соль карбоксиметилцеллюлозы, гидроксипропилметилцеллюлозу, стеарат магния. Композиция SGLT2 включает в себя ингибитор SGLT2, безводную лактозу, микрокристаллическую целлюлозу, кросповидон, диоксид кремния, стеарат магния. Для второго слоя для замены части микрокристаллической целлюлозы могут быть использованы прежелатинизированный крахмал, гидроксипропилцеллюлоза EXF или маннитол (pearlitol SD 200). Кроме того, общий вес второго слоя составляет от около 300 мг до около 400 мг.Предпочтительный вес второго слоя составляет 300 мг. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин, дапаглифлозин (S) PGS или дапаглифлозин (R) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 40-60% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,05-5% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,1-10% ингибитора SGLT2, около 5-30% безводной лактозы, около 40-90% микрокристаллической целлюлозы, около 0-25% прежелатинизированного крахмала, около 0-20% гидроксипропилцеллюлозы EXF, около 0-25% маннитола (pearlitol SD 200), около 1-10% кросповидона, около 0,1-5% диоксида кремния и около 0,1-5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет 300 мг. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 45-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,05-5% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,1-10% ингибитора SGLT2, около 5-30% безводной лактозы, около 40-90% микрокристаллической целлюлозы, около 0-25% прежелатинизированного крахмала, около 0-20% гидроксипропилцеллюлозы EXF, около 0-25% маннитола (pearlitol SD 200), около 1-10% кросповидона, около 0,1 -5% диоксида кремния и около 0,1-5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет 300 мг. Дополнительная пленочная оболочка может представлять собой оболочку Opadry® II. В предпочтительном варианте ингибитор SGLT2 представляет собой дапаглифлозин или дапаглифлозин (S) PGS.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 45-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,05-5% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 72-80% микрокристаллической целлюлозы 302, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 45-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,05-5% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 50-70% микрокристаллической целлюлозы 302, около 10-22% прежелатинизированного крахмала, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 45-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15%о микрокристаллической целлюлозы, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,05-5% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 60-70% микрокристаллической целлюлозы 302, около 5-15% гидроксипропилцеллюлозы EXF, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 45-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,05-5% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 55-65% микрокристаллической целлюлозы 302, около 10-20% маннитола, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
В другом аспекте настоящее изобретение предусматривает двухслойные таблетки, в которых композиция метформина (500 мг) XR содержит около 45-50% гидрохлорида (HCl) метформина, около 4-6% натрий-карбоксиметилцеллюлозы, около 30-40% гидроксипропилметилцеллюлозы 2208, около 0,1-1,5% гидроксипропилметилцеллюлозы 2910, около 5-15% микрокристаллической целлюлозы, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,05-5% стеарата магния. Композиция ингибитора SGLT2 содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 16% безводной лактозы, около 74-77% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния. Общий вес слоя ингибитора SGLT2 составляет от около 300 мг до около 400 мг, где предпочтительный вес составляет 300 мг. Пленочная оболочка может представлять собой оболочку Opadry® II.
Приведенное выше процентное содержание SGLT2 соответствует содержанию активного вещества. Предпочтительное активное вещество представляет собой дапаглифлозин или дапаглифлозин (S) пропиленгликольгидрат. Следует понимать, что приведенное выше процентное содержание (количество) для дапаглифлозина в форме пропиленгликольгидрата будет выше по сравнению с дапаглифлозином не в форме сольвата/гидрата.
Для применения в композициях двухслойных таблеток по настоящему изобретению подходят различные формы противодиабетического лекарственного средства метформина, включая его фармацевтически приемлемые соли, такие как гидрохлорид, гидробромид, фумарат, сукцинат, п-хлорфеноксиацетат или эмбонат. Соли фумарат и сукцинат метформина предпочтительно представляют собой метформин (2:1) фумарат и метформин (2:1) сукцинат. Метформин гидрохлорид является предпочтительным.
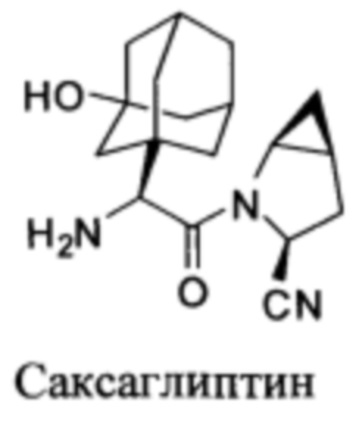
Настоящее изобретение также предусматривает двухслойные таблетки, покрытые оболочкой, где оболочка содержит саксаглиптин или его фармацевтически приемлемую соль. Саксаглиптин предпочтительно присутствует в форме свободного основания, моногидрата или в форме гидрохлорида. Таблетка, покрытая оболочкой, включает ядро таблетки, первую оболочку, вторую оболочку и, необязательно, третью оболочку. Ядро таблетки включает метформин, предпочтительно гидрохлорид метформина. Первая и вторая оболочки необязательно включает саксаглиптин, где, по меньшей мере, только первая или вторая оболочка включает саксаглиптин. Третья оболочка является необязательным наружным защитным покрытием. Саксаглиптин, описанный ниже, может быть получен, как описано в патенте США 6395767, описание которого во всей своей полноте включено в настоящее изобретение посредством ссылки. Первую и вторую оболочки готовят таким же образом, как внутренний изолирующий слой оболочки или средний (лекарственный) слой оболочки, как описано в WO 2005/117841, описание которого во всей своей полноте включено в настоящее изобретение посредством ссылки. Третью оболочку готовят таким же образом, как внешний защитный слой оболочки, как описано в WO 2005/117841.
Первая оболочка включает до 95% полимера в пересчете на вес первой оболочки. Композиция содержит, по меньшей мере, один полимер для оболочки и растворитель для оболочки, предпочтительно растворитель представляет собой воду, используемую для нанесения оболочки и удаляемую в процессе сушки. Полимер для первой оболочки может представлять собой гидроксипропилметилцеллюлозу, поливиниловый спирт (ПВС), этилцеллюлозу, метакриловый полимер или гидроксипропилцеллюлозу, предпочтительно, ПВС. Первая оболочка необязательно включает саксаглиптин в диапазоне от около 0,5% до около 70%, предпочтительно от около 30% до около 50% в пересчете на вес второй оболочки. Первая оболочка может необязательно включать пластификатор, такой как триацетин, диэтилфталат, трибутилсебакат или полиэтиленгликоль (ПЭГ), предпочтительно ПЭГ; антиадгезивное вещество или вещество, способствующее скольжению, такое как тальк, коллоидная двуокись кремния или стеарат магния, и замутнитель, такой как диоксид титана. Слой оболочки также может включать красители на основе окиси железа. Материал для оболочки имеется в продаже под торговыми марками Opadry® HP или Opadry® II white.
Вторая оболочка близка по составу к первой оболочке и предпочтительно включает саксаглиптин.
Третья оболочка близка по составу первой оболочке, но не включает саксаглиптин.
Таким образом, в одном аспекте настоящее изобретение обеспечивает двухслойные таблетки, которые включают: (1) ядро двухслойной таблетки, включающее два слоя, где первый слой содержит метформин, а второй слой содержит ингибитор SGLT2, где вес второго слоя составляет от около 300 до около 400 мг, (2) первую оболочку, которая покрывает ядро двухслойной таблетки и необязательно включает в себя саксаглиптин, (3) вторую оболочку, которая покрывает первую оболочку и необязательно включает в себя саксаглиптин, и (4) необязательно третью оболочку, которая покрывает вторую оболочку, где, по меньшей мере, первая оболочка или вторая оболочка включает в себя саксаглиптин.
Таким образом, в одном аспекте настоящее изобретение обеспечивает двухслойные таблетки, которые включают: (1) ядро двухслойной таблетки, включающее два слоя, где первый слой содержит около 64-82% гидрохлорида метформина, около 3-5% натрий- карбоксиметилцеллюлозы, около 15-30% гидроксипропилметилцеллюлозы, около 0,1-0,75% стеарата магния и около 0 2% диоксида кремния или 0-1,5% коллоидного диоксида кремния, а второй слой содержит около 0,5-4% дапаглифлозина или дапаглифлозина (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 50-80% микрокристаллической целлюлозы, около 0-20% прежелатинизированного крахмала, около 0-20% маннитола, около 0-15% гидроксипропилцеллюлозы, около 2-6% кросповидона, 0,5-2,5% диоксида кремния и около 0,5-2% стеарата магния, где вес второго слоя составляет от около 300 мг до около 400 мг (2) первую оболочку, включающую полимер на основе поливинилового спирта (3) вторую оболочку, включающую саксаглиптин и полимер на основе поливинилового спирта и (4) третью оболочку, включающую полимер на основе поливинилового спирта.
В одном аспекте настоящее изобретение обеспечивает двухслойные таблетки, которые включают:
(1) ядро двухслойной таблетки, в котором первый слой содержит около 67-71% гидрохлорида метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 25-29% гидроксипропилметилцеллюлозы 2208, около 0,1-0,75% стеарата магния, а второй слой содержит:
(A) около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 72-80% микрокристаллической целлюлозы 302, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния;
(B) около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 50-70% микрокристаллической целлюлозы 302, около 10-22% прежелатинизированного крахмала, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния;
(C) около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 60-70% микрокристаллической целлюлозы 302; около 5-15% гидроксипропилцеллюлозы EXF, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния, или
(D) около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 55-65% микрокристаллической целлюлозы 302, около 10-20% маннитола, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния, где вес второго слоя составляет от около 300 мг до около 400 мг;
(2) первую оболочку, включающую Opadry® HP, (3) вторую оболочку, включающую саксаглиптин и Opadry® HP, и (4) третью оболочку, включающую Opadry® HP.
В одном аспекте настоящее изобретение обеспечивает двухслойные таблетки, которые включают:
(1) ядро двухслойной таблетки, в котором первый слой содержит около 69% гидрохлорида метформина, около 3,5% натрий-карбоксиметилцеллюлозы, около 27% гидроксипропилметилцеллюлозы 2208 и около 0,48% стеарата магния, а второй слой содержит:
(A) около 0,8%о дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 77% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(B) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 76% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(C) около 3,4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 74% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(D) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 64% микрокристаллической целлюлозы 302, около 13% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(E) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 57% микрокристаллической целлюлозы 302, около 19% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(F) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 66% микрокристаллической целлюлозы 302, около 10% гидроксипропилцеллюлозы EXF, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния, или
(G) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 61% микрокристаллической целлюлозы 302, около 15% маннитола, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния, где вес второго слоя составляет от около 300 мг до около 400 мг,
(2) первую оболочку, включающую Opadry® HP, (3) вторую оболочку, включающую саксаглиптин и Opadry® HP, и (4) третью оболочку, включающую Opadry® HP.
В одном аспекте настоящее изобретение обеспечивает двухслойные таблетки, которые включают:
(1) ядро двухслойной таблетки, в котором первый слой содержит около 72-82% гидрохлорида метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния, а второй слой содержит:
(A) около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 72-80% микрокристаллической целлюлозы 302, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния;
(B) около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 50-70% микрокристаллической целлюлозы 302, около 10-22% прежелатинизированного крахмала, около 2-6,00% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния;
(C) около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 60-70% микрокристаллической целлюлозы 302; около 5-15% гидроксипропилцеллюлозы EXF, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния, или
(D) около 0,5-4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 14-18% безводной лактозы, около 55-65% микрокристаллической целлюлозы 302, около 10-20% маннитола, около 2-6% кросповидона, около 0,5-2,5% диоксида кремния и около 0,5-1,5% стеарата магния, где вес второго слоя составляет от около 300 мг до около 400 мг;
(2) первую оболочку, включающую Opadry® HP, (3) вторую оболочку, включающую саксаглиптин и Opadry® HP, и (4) третью оболочку, включающую Opadry® HP.
В одном аспекте настоящее изобретение обеспечивает двухслойные таблетки, которые включают:
(1) ядро двухслойной таблетки, в котором первый слой содержит около 76,6% гидрохлорида метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния, а второй слой содержит:
(A) около 0,8% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 77% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(B) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 76% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(C) около 3,4% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 74% микрокристаллической целлюлозы 302, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(D) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 64% микрокристаллической целлюлозы 302, около 13% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(E) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 57% микрокристаллической целлюлозы 302, около 19% прежелатинизированного крахмала, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния;
(F) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 66% микрокристаллической целлюлозы 302, около 10% гидроксипропилцеллюлозы EXF, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния, или
(G) около 1,7% дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, около 16% безводной лактозы, около 61% микрокристаллической целлюлозы 302, около 15% маннитола, около 4% кросповидона, около 1,5% диоксида кремния и около 1% стеарата магния, где вес второго слоя составляет от около 300 мг до около 400 мг
(2) первую оболочку, включающую Opadry® HP, (3) вторую оболочку, включающую саксаглиптин и Opadry® HP, и (4) третью оболочку, включающую Opadry® HP.
В одном аспекте настоящее изобретение обеспечивает таблетку, покрытую оболочкой, которая включает ядро таблетки, покрытое первой оболочкой, необязательно содержащей саксаглиптин, второй оболочкой, необязательно содержащей саксаглиптин, и необязательно третьей оболочкой. Ядро таблетки содержит метформин, где гидрохлорид метформина является предпочтительным. По меньшей мере, первая и вторая оболочка содержит саксаглиптин. Первую и вторую оболочки готовят таким же образом, как внутренний изолирующий слой оболочки или средний (лекарственный) слой оболочки, как описано в WO 2005/117841, описание которого во всей своей полноте включено в настоящее изобретение посредством ссылки. Третью оболочку готовят таким же образом, как внешний защитный слой оболочки, как описано в WO 2005/117841.
В другом аспекте настоящее изобретение обеспечивает таблетку, покрытую оболочкой, включающую: (1) ядро таблетки, которое содержит метформин, (2) первую оболочку, которая покрывает ядро таблетки и необязательно включает в себя саксаглиптин, (3) вторую оболочку, которая покрывает первую оболочку и необязательно включает в себя саксаглиптин, и (4) необязательно третью оболочку, которая покрывает вторую оболочку, где, по меньшей мере, первая оболочка или вторая оболочка включает саксаглиптин.
В другом аспекте настоящее изобретение обеспечивает таблетку, покрытую оболочкой, включающую: (1) ядро таблетки, которое содержит около 72-82% гидрохлорида метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния, (2) первую оболочку, включающую полимер на основе поливинилового спирта (3) вторую оболочку, включающую саксаглиптин и полимер на основе поливинилового спирта и (4) третью оболочку, включающую полимер на основе поливинилового спирта.
В другом аспекте настоящее изобретение обеспечивает таблетку, покрытую оболочкой, включающую: (1) ядро таблетки, которое содержит около 76,6% гидрохлорида метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния, (2) первую оболочку, включающую Opadry® HP, (3) вторую оболочку, включающую саксаглиптин и Opadry® HP, и (4) третью оболочку, включающую Opadry® HP.
В другом аспекте настоящее изобретение обеспечивает таблетку, покрытую оболочкой, включающую: (1) ядро таблетки, которое содержит около 76,6% гидрохлорида метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 1% диоксида кремния и около 0,53% стеарата магния, (2) первую оболочку, включающую Opadry® HP, (3) вторую оболочку, включающую саксаглиптин и Opadry® HP, и (4) третью оболочку, включающую Opadry® HP.
В другом аспекте настоящее изобретение обеспечивает таблетку, покрытую оболочкой, включающую: (1) ядро таблетки, которое содержит около 76,6% гидрохлорида метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 1% диоксида кремния и около 0,53% стеарата магния, (2) первую оболочку, включающую около 2% Opadry® HP, (3) вторую оболочку, включающую около 1,25% саксаглиптина и 10% Opadry® HP, и (4) третью оболочку, включающую около 2% Opadry® HP
В другом аспекте настоящее изобретение обеспечивает комбинированную терапию, которая включает двухслойные таблетки по настоящему изобретению в сочетании с одним или более лекарственными средствами, выбранными из: противодиабетических агентов, противогипергликемических агентов; гиполипидемических/снижающих уровень липидов агентов, агентов против ожирения; антигипертензивных агентов, агентов, подавляющих аппетит; стимуляторов секреции инсулина, агентов, повышающих чувствительность к инсулину, активаторов глюкокиназы, антагонистов глюкокортикоидов, ингибиторов фруктозо-1,6-бис-фосфатазы, активаторов AMP киназы, модуляторов пути инкретина, таких как активаторы секреции инкретина, таких как агонисты GPR119 или GPR40, имитаторов инкретина, таких как Byetta, усилителей действия инкретина, агентов, усиливающих экскрецию желчных кислот, или агонистов рецепторов желчных кислот, таких как агонисты TGR5, агонистов дофаминовых рецепторов, таких как Cycloset, ингибиторов альдозоредуктазы, агонистов PPARγ, агонистов PPARα, антагонистов или агонистов PPARδ, двойных агонистов PPARα/γ, ингибиторов 11-β-HSD-1, ингибиторов дипептидилпептидазы IV (DPP4), отличных от саксаглиптина, ингибиторов SGLT2, отличных от дапаглифлозина, глюкагон-подобного пептида-1 (GLP-1), агонистов GLP-1 и ингибиторов РТР-IB. Кроме того, могут быть использованы снижающие вес агенты, действующие через снижение потребления пищи, такие как сибутримин, антагонисты СВ1, агонисты 5НТ2С, антагонисты MCHR1, а также агенты, которые уменьшают всасывание питательных веществ (например, ингибиторы липазы (орлистат)), и агенты, которые увеличивают расход энергии, такие как тиромиметики, или которые замедляют подвижность желудочно-кишечного тракта, такие как миметиков амилина или антагонисты грелина.
Примеры подходящих антидиабетических агентов для использования в сочетании с композициями по настоящему изобретению включают, но не ограничиваются, ингибиторами альфа-глюкозидазы (акарбоза или миглитол), инсулином (в том числе активаторами секреции инсулина или агентами, повышающими чувствительность к инсулину), меглитинидами (репаглинидом), сульфонилмочевиной (глимепиридом, глибенкламидом, гликлазидом, хлорпропамидом и глипизидом), комбинациями бигуанид/глибурид (Glucovance®), тиазолидиндионами (например, троглитазоном, розиглитазоном и пиоглитазоном), агонистами PPAR-альфа, агонистами PPAR-гамма, двойными агонистами PPAR альфа/гамма, ингибиторами гликогенфосфорилазы, ингибиторами связывающего жирные кислоты белка (аР2), модуляторами GPR-119, модуляторами GPR 40, ингибиторами глюкокиназы, глюкагон-подобным пептидом-1 (GLP-1) и другими агонистами рецепторов GLP-1, ингибиторами SGLT2, отличными от дапаглифлозина, и ингибиторами дипептидилпептидазы IV (DPP4), отличными от саксаглиптина.
Другие подходящие тиазолидиндионы включают, но не ограничиваются МСС-555 (описанным в патенте США №5594016, Mitsubishi), фараглитазаром (GI-262 570, Glaxo-Wellcome), энглитазоном (СР-68722, Pfizer) или дарглитазоном (CP-86325, Pfizer, изаглитазоном, MIT/Johnson & Johnson), реглитазаром (JTT-501 (JPNT/Pharmacia & Upjohn), ривоглитазоном (R-l 19702, Sankyo/WL), лираглутидом (NN-2344, доктор Reddy/NN) и (Z) 1,4-бис-4-[(3,5-диоксо-1,2,4-оксадиазолидин-2-ил-метил)]феноксибут-2-еном (YM-440, Yamanouchi).
Примеры агонистов PPAR-альфа, агонистов PPAR-гамма и двойных агонистов PPAR альфа/гамма включают, но не ограничиваются мураглитазаром, пелиглитазаром, тезаглитазаром AR-H039242 (Astra/Zeneca), GW-501516 (Glaxo-Wellcome), KRP297 (Kyorin Merck), а также агентами, раскрытыми Murakami et al., в "A Novel Insulin Sensitizer Acts As a Coligand for Peroxisome Proliferation - Activated Receptor Alpha (PPAR alpha) and PPAR gamma. Effect on PPAR alpha Activation on Abnormal Lipid Metabolism in Liver of Zucker Fatty Rats", Diabetes 47, 1841-1847 (1998); в WO 01/21602 и в патенте США №6414002 и патенте США №6653314, описание которых во всей своей полноте включено в настоящее изобретение посредством ссылки, причем могут быть использованы дозы, приведенные в настоящем документе. В одном из вариантов соединения, указываемые как предпочтительнее в приведенных ссылках, являются предпочтительными для применения в настоящем документе.
Подходящие ингибиторы аР2 включают, но не ограничиваются агентами, которые описаны в заявке США номер 09/391,053, поданной 7 сентября 1999, и в патенте США №6548529, описание которых во всей своей полноте включено в настоящее изобретение посредством ссылки, причем могут быть использованы дозы, приведенные в указанных документах.
Подходящие ингибиторы DPP4 включают, но не ограничиваются ситаглиптином и вилдаглиптином, а также агентами, раскрытыми в WO 99/38501, WO 99/46272, WO 99/67279 (PROBIODRUG), WO 99/67278 (PROBIODRUG), WO 99/61431 (PROBIODRUG) NVP-DPP728A (1-[[[2-[(5-цианопиридин-2-ил)амино]этил]амино]ацетил]-2-циано-(8)-пирролидином) (Novartis), как раскрыто Hughes et al, Biochemistry, 38(36), 11597-11603, 1999, TSL-225 (триптофил-1,2,3,4-тетрагидроизохинолин-3-карбоновой кислотой (раскрыта Yamada et al, Bioorg. & Med. Chem. Lett. 8 (1998) 1537-1540), 2-цианопирролидидами и 4-цианопирролидидами, как раскрыто Ashworth et al, Bioorg. & Med. Chem. Lett., Vol.6, No. 22, pp 1163-1166 and 2745-2748 (1996), соединениями, описанными в заявке США номер 10/899,641, описания которых во всей своей полноте включены в настоящее изобретение посредством ссылки, причем могут быть использованы дозы, приведенные в указанных ссылках.
Подходящие для предусмотренных покрытых оболочкой двухслойных таблеток по настоящему изобретению и для комбинированной терапии двухслойными таблетками по настоящему изобретению ингибиторы SGLT2 включают серглифлозин, ремоглифлозин, ремоглифлозин этабонат, канаглифлозин, BI-10773 и BI-44847, ASP-1941, Р-7201, LX-4211, YM-543, ПР 2268, TS-033 или SGL-0100, а также соединения, раскрытые в US7589193, WO2007007628, ЕР2009010, WO200903596, US2009030198, US7288528 и US2007/0197623, описания которых во всей своей полноте включены в настоящее изобретение посредством ссылки. Следующие ингибиторы SGLT2 являются предпочтительными
Подходящие меглитиниды включают натеглинид (Novartis) или KAD1229 (PF/Kissei).
Примеры подходящих для использования в сочетании с композициями по настоящему изобретению противогипергликемических агентов включают, но не ограничиваются глюкагон-подобными пептидами-1 (GLP-1), такими как амид GLP-1 (1-36), амид GLP-1 (7-36), GLP-1 (7-37) (как описано в патенте США №5614492, включенном в настоящий документ в качестве ссылки в полном объеме), а также эксенатидом (Amylin/Lilly), LY-315902 (Lilly), МК-0431 (Merck), лираглутидом (NovoNordisk), ZP-10 (Zealand Pharmaceuticals A/S), CJC-1131 (Conjuchem Inc), и соединениями, описанными в WO 03/033671, описание которой во всей своей полноте включено в настоящее изобретение посредством ссылки.
Примеры подходящих для использования в сочетании с композициями по настоящему изобретению гиполипидемических/снижающих уровень липидов агентов включают один или несколько агентов, выбранных из ингибиторов МТР, ингибиторов HMG-CoA-редуктазы, ингибиторов скваленсинтетазы, производных фиброевой кислоты, ингибиторов АСАТ, ингибиторов липоксигеназы, ингибиторов поглощения холестерина, ингибиторов котранспортера Na+ и желчных кислот подвздошной кишки, активаторов LDL рецепторов, агентов, усиливающих экскрецию желчных кислот, ингибиторов белка-переносчика эфиров холестерина (например, ингибиторы СЕТР, такие как торцетрапиб (СР-529414, Pfizer) и JTT-705 (Akros Pharma)), агонистов PPAR (как описано выше) и/или никотиновой кислоты и ее производных. Гиполипидемический агент может представлять собой активатор рецепторов LD2, такой как 3-(13-окси-10-оксотетрадецил)-5,7-диметокси-1(3Н)-изобензофуранон (MD-700, Taisho Pharmaceutical Co. Ltd) и 4-(2-пропенил)-(3а, 4а, 5а)-холестан-3-ол (LY295427, Eli Lilly). Предпочтительные гиполипидемические агенты включают, например, правастатин, ловастатин, симвастатин, аторвастатин, флувастатин, церивастатин, атавастатин и розувастатин (ZD-4522).
Примеры ингибиторов МТР, которые могут быть использованы, как описано выше, включают, но не ограничиваются ингибиторами, раскрытыми в патенте США №5595872, патенте США №5739135, патенте США №5712279, патенте США №5760246, патенте США №5827875, патенте США №5885983 и патенте США №5962440, описания которых во всей своей полноте включены в настоящее изобретение посредством ссылки.
Примеры ингибиторов HMG-CoA-редуктазы, которые могут быть использованы в сочетании с композициями по настоящему изобретению, включают, но не ограничиваются мевастатином и родственными соединениями, как описано в патенте США №3983140, ловастатином (мевинолином) и родственными соединениями, как описано в патенте США №4231938, правастатином и родственными соединениями, как описано в патенте США №4346227, симвастатином и родственными соединениями, как описано в патентах США №№4448784 и 4450171. Другие подходящие ингибиторы HMG-CoA-редуктазы, которые могут быть использованы здесь, включают, но не ограничиваются флувастатином, раскрытым в патенте США №5354772, церивастатином, раскрытым в патентах США №№5006530 и 5177080, аторвастатином, раскрытым в патентах США №№4681893, 5273995, 5385929 и 5686104, атавастатином (нисвастатином Nissan/Sankyo (NK-104)), раскрытым в патенте США №5011930, розувастатином (Shionogi-Astra/Zeneca (ZD-4522)), раскрытым в патенте США №5260440, и родственными статину соединениями, раскрытыми в патенте США №5753675, аналогами производных мевалонолактона на основе пиразола, раскрытыми в патенте США №4613610, аналогами производных мевалонолактона на основе индена, раскрытыми в заявке РСТ WO 86/03488, 6-[2-(замещенный пиррол-1-ил)-алкил)пиран-2-онами и их производными, раскрытыми в патенте США №4647576, дихлорацетатом SC-45355 Searle (3-замещенным производным пентандионовой кислоты), аналогами мевалонолактона на основе имидазола, раскрытыми в заявке РСТ WO 86/07054, 3-карбокси-2-гидроксипропан-фосфоновой кислотой, как описано во французском патенте №2596393, 2,3-замещенными производными пиррола, фурана и тиофена, как описано в Европейской патентной заявке №0221025, аналогами мевалонолактона на основе нафтила, как описано в патенте США №4686237, октагидронафталинами, как описано в патенте США №4499289, кето аналогами мевинолина (ловастатином), как описано в Европейской патентной заявке №0142146 А2 и производными хинолина и пиридина, как описано в патентах США №5506219 и 5691322. Все приведенные здесь в качестве ссылки документы включены в настоящий документ во всей их полноте. Кроме того, фосфиновые кислоты, применяемые для ингибирования HMG-CoA-редуктазы, например, описанные в GB 2205837, пригодны для использования в сочетании с композициями по настоящему изобретению.
Примеры ингибиторов скваленсинтетазы, подходящие для использования по настоящему документу, включают, но не ограничиваются α-фосфоносульфонатами, раскрытыми в патенте США №5712396, раскрытыми Biller et al., J. Med. Chem., 1988, Vol. 31, No. 10, pp. 1869-1871, в том числе изопреноид(фосфинил-метил)фосфонатами, а также другими известными ингибиторами скваленсинтетазы, например, раскрытыми в патентах США №4871721 и 4924024 и Biller, S.A., Neuenschwander, К., Ponpipom, М.М., Poulter, CD., Current Pharmaceutical Design, 2, 1-40 (1996). Другие ингибиторы скваленсинтетазы, пригодные для использования в настоящем документе, включают терпеноид пирофосфаты, раскрытые P. Ortiz de Montellano et al, J. Med. Chem., 1977, 20, 243-249; аналог А фарнезил дифосфата и аналоги пресквален пирофосфата (PSQ-PP), раскрытые Corey and Volante, J. Am. Chem. Soc, 1976, 98, 1291-1293; фосфинилфосфонаты, ракрытые McClard, R.W. et al, J.A.C.S., 1987, 109, 5544; и циклопропаны, раскрытые Capson, T.L., PhD dissertation, June, 1987, Dept. Med. Chem. U of Utah, Abstract, Table of Contents, pp 16, 17, 40-43, 48-51, Summary. Все приведенные здесь в качестве ссылки документы включены в настоящий документ во всей их полноте.
Примеры производных фиброевой кислоты, которые могут быть использованы в сочетании с композициями по изобретению включают, но не ограничиваются фенофибратом, гемфиброзилом, клофибратом, безафибратом, ципрофибратом, клинофибратом и подобными веществами, пробуколом и родственными соединениями, как раскрыто в патенте США №3674836, агентами, усиливающими экскрецию желчных кислот, такими как холестирамин, колестипол и ДЭАЭ-сефадекс (Secholex®, Policexide®), а также липостабилом (Rhone-Poulenc), Eisai Е-5050 (N-замещенным производным этаноламина), иманиксилом (НОЕ-402), тетрагидролипстатином (THL), истигмастанилфосфорилхолином (SPC, Roche), аминоциклодекстрином (Tanabe Seiyoku), Ajinomoto AJ-814 (производное азулена), мелинамидом (Sumitomo), Sandoz 58-035, American Cyanamid CL-277,082 и CL-283,546 (дизамещенное производное мочевины), никотиновой кислотой, аципимоксом, ацифраном, неомицином, п-аминосалициловой кислотой, аспирином, производными поли(диаллилметиламина), например, раскрытыми в патенте США №4759923, четвертичными аминами поли(диаллилдиметиламмонийхлоридом) и ионенами, например, раскрытыми в патенте США №4027009, и другими известными в уровне техники снижающими уровень холестерина в крови агентами. В одном варианте производное фиброевой кислоты представляет собой пробукол или гемфиброзил. Все приведенные здесь в качестве ссылки документы включены в настоящий документ во всей их полноте.
Примеры ингибиторов АСАТ, которые могут быть использованы в сочетании с композициями по настоящему изобретению, включают, но не ограничиваются ингибиторами, которые описаны в Drugs of the Future 24, 9-15 (1999), (Avasimibe); а также в статьях "The АСАТ inhibitor, Cl-1011 is effective in the prevention and regression of aortic fatty streak area in hamsters", Nicolosi и др., Atherosclerosis (Shannon, Irel) (1998), 137(1), 77-85; "The pharmacological profile of FCE 27677: a novel ACAT inhibitor with potent hypolipidemic activity mediated by selective suppression of the hepatic secretion of ApoB100-containing lipoprotein", Ghiselli, Giancarlo, Cardiovasc. Drug Rev. (1998), 16(1), 16-30; "RP 73163: a bioavailable alkylsulfinyl-diphenylimidazole ACAT inhibitor", Smith, С.и др., Bioorg. Med. Chem. Lett. (1996), 6(1), 47-50; "ACAT inhibitors: physiologic mechanisms for hypolipidemic and anti-atherosclerotic activities in experimental animals", Krause и др., под редакцией Ruffolo, Robert R. Jr.; Hollinger, Mannfred A., Inflammation: Mediators and Pathways (1995), 173-98, издательство: CRC, Boca Raton, Флорида; "ACAT inhibitors: potential anti-atherosclerotic agents", Sliskovic и др., Curr. Med. Chem. (1994), 1(3), 204-25; "Inhibitors of acyl-CoA:holesterol O-acyl transferase (ACAT) as hypocholesterolemic agents. The first water-soluble ACAT inhibitor with lipid-regulating activity. Inhibitors of acyl-CoA:holesterol acyltransferase (ACAT). Development of a series of substituted N-phenyl-N'-[(l-phenylcyclopentyl)methyl]ureas with enhanced hypocholesterolemic activity", Stout и др., Chemtracts: Org. Chem. (1995), 8(6), 359-62, или TS-962 (Taisho Pharmaceutical Co. Ltd). Все приведенные материалы во всей своей полноте включены в настоящее изобретение посредством ссылки.
Примеры подходящих для использования в сочетании с композициями по настоящему изобретению ингибиторов поглощения холестерина включают, но не ограничиваются SCH48461 (Schering-Plough), а также ингибиторами, раскрытыми в статьях в журналах Atherosclerosis 115, 45-63 (1995) и J. Med. Chem. 41, 973 (1998), которые во всей своей полноте включены в настоящее изобретение посредством ссылки.
Примеры подходящих для использования в сочетании с композициями по настоящему изобретению ингибиторов котранспортеров Na+ и желчных кислот подвздошной кишки включают, но не ограничиваются, соединениями, раскрытыми в статье журнала Drugs of the Future, 24, 425-430 (1999), которая во всей своей полноте включена в настоящее изобретение посредством ссылки.
Примеры подходящих для использования в сочетании с композициями по настоящему изобретению ингибиторов липоксигеназы включают, но не ограничиваются ингибиторами 15-липоксигеназы (15-LO), такими как производные бензимидазола, например, раскрытыми в WO 97/12615, ингибиторами 15-LO, например, раскрытыми в WO 97/12613, изотиазолонами, например, раскрытыми в WO 96/38144, и ингибиторами 15-LO, описанными Sendobry и др., "Attenuation of diet-induced atherosclerosis in rabbits with a highly selective 15-lipoxygenase inhibitor lacking significant antioxidant properties", Brit. J. Pharmacology (1997) 120, 1199-1206, и Cornicelli и др., "15-Lipoxygenase and its Inhibition: A Novel Therapeutic Target for Vascular Disease", Current Pharmaceutical Design, 1999, 5, 11-20. Все приведенные материалы во всей своей полноте включены в настоящее изобретение посредством ссылки.
Примеры подходящих для использования в сочетании с композициями по настоящему изобретению антигипертензивных агентов включают, но не ограничиваются бета-адреноблокаторами, блокаторами кальциевых каналов (каналок L-типа и Т-типа, например, дилтиаземом, верапамилом, нифедипином, амлодипином и мибефрадилом), диуретиками (например, хлортиазидом, гидрохлортиазидом, флуметиазидом, гидрофлуметиазидом, бендрофлюметиазидом, метилхлортиазидом, трихлорметиазидом, политиазидом, бензтиазидом, этакриновой кислотой, трикринафеном, хлорталидоном, фуросемидом, музолимином, буметанидом, триамтрененом, амилоридом, спиронолактоном), ингибиторами ренина, ингибиторами АСЕ (например, каптоприлом, зофеноприлом, фозиноприлом, эналаприлом, цераноприлом, цилазоприлом, делаприлом, пентоприлом, квинаприлом, рамиприлом, лизиноприлом), антагонистами рецепторов АТ-1 (например, лозартаном, ирбесартаном, валсартаном), антагонистами рецепторов ЕТ (например, ситаксентаном, атрсентаном и соединениями, описанными в патентах США №№5612359 и 6043265), двойными антагонистами ЕТ/АП (например, соединениями, описанными в WO 00/01389), ингибиторами нейтральной эндопептидазы (NEP), ингибиторами вазопептидазы (двойными ингибиторами NEP-ACE) (например, омапатрилатом и гемопатрилатом) и нитратами. Все приведенные материалы во всей своей полноте включены в настоящее изобретение посредством ссылки.
Примеры подходящих для использования в сочетании с композициями по настоящему изобретению агентов для лечения ожирения включают, но не ограничиваются агонистами бета3-адренергических рецепторов, ингибиторами липазы, ингибиторами обратного захвата серотонина (и дофамина), лекарственными средствами, влияющими на тиреоидный рецептор бета, агонистами 5НТ2С, (например, Arena APD-356); антагонистами MCHR1, такими как Synaptic SNAP-7941 и Takeda Т-226926, агонистами рецепторов меланокортина (MC4R), антагонистами рецепторов меланин-обогатительного гормона (MCHR) (например, Synaptic SNAP-7941 и Takeda Т-226926), модуляторами рецепторов галанина, антагонистами орексина, агонистами ССК, антагонистами NPY1 или NPY5, модуляторами NPY2 и NPY4, агонистами рилизинг-фактора кортикотропина, модуляторами рецептора гистамина 3 (Н3), ингибиторами 11-бета-HSD-l, модуляторами рецепторов адинопектина, ингибиторами обратного захвата моноаминов или агентами, вызывающими высвобождение моноаминов, цилиарными нейротрофическими факторами (CNTF, такими как AXOKINE® от Regeneron), BDNF (мозговым нейротрофическим фактором), лептином и модуляторами рецепторов лептина, антагонистами каннабиноидного рецептора 1 (например, SR-141716 (Sanofi) или SLV-319 (Solvay)) и анорексигенными агентами.
Агонисты бета3-адренорецепторов, подходящих для использования в сочетании с композициями по настоящему изобретению включают, но не ограничиваются AJ9677 (Takeda/Dainippon), L750355 (Merck), СР331648 (Pfizer) и другими известными бета3-агонистами, например, раскрытыми в патентах США №№5541204, 5770615, 5491134, 5776983 и 5488064, которые во всей своей полноте включены в настоящее изобретение посредством ссылки.
Примеры ингибиторов липазы, которые могут быть использованы в сочетании с композициями по настоящему изобретению включают, но не ограничиваясь орлистатом и ATL-962 (Alizyme).
Ингибиторы обратного захвата серотонина (и дофамина) (или агонисты серотониновых рецепторов), которые могут быть использованы в сочетании с композициями по настоящему изобретению, включают, но не ограничиваются BVT-933 (Biovitrum), сибутрамином, топираматом (Johnson&Johnson) и аксокином (Regeneron).
Примеры соединений, влияющих на тиреоидный рецептор бета, которые могут быть использованы в сочетании с композициями по настоящему изобретению включают, но не ограничиваются, лигандами тиреоидных рецепторов, например, раскрытыми в WO 97/21993 (The University of California, San Francisco), WO 99/00353 (KaroBio) и WO 00/039077 (KaroBio), описания которых во всей своей полноте включены в настоящее изобретение посредством ссылки.
Примеры ингибиторов обратного захвата моноаминов, которые могут быть использованы в сочетании с композициями по настоящему изобретению включают, но не ограничиваются, фенфлюрамином, дексфенфлурамином, флувоксамином, флуоксетином, пароксетином, хлорфентермином, клофорексом, клортермином, пицилорексом, сибутрамином, дексамфетамином, фентермином, фенилпропаноламином и мазиндолом.
Анорексигенные агенты, которые могут быть использованы в сочетании с композициями по настоящему изобретению включают, но не ограничиваются топираматом (Johnson&Johnson), дексамфетамином, фентермином, фенилпропаноламином и мазиндолом.
Указанные патенты и патентные заявки включены в настоящий документ во всей своей полноте посредством ссылки.
Если какую-либо из композиций по изобретению используют в сочетании с другим терапевтическим агентом (агентами), то другой терапевтический агент (агенты) может быть использован в количествах, например, указанных в энциклопедии лекарственных препаратов Physician's Desk Reference, или указанных в приведенных выше патентах и патентных заявках, или известных из других источников и используемых специалистом в данной области.
Настоящее изобретение обеспечивает двухслойные таблетки, которые включают (1) композицию метформина уменьшенного веса, (2) композицию канаглифлозина и (3), необязательно, оболочку. Таким образом, в одном аспекте настоящее изобретение относится к двухслойной таблетке, где (1) первый слой включает в себя около 72-82% гидрохлорида метформина, около 3-5% натрий-карбоксиметилцеллюлозы, около 15-22% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,1-0,6% стеарата магния, (2) второй слой включает канаглифлозин и (3) необязательно присутствующая оболочка включает Opadry® II.
В другом аспекте настоящее изобретение обеспечивает двухслойные таблетки, где (1) первый слой включает в себя около 76,6% гидрохлорида метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния, (2) второй слой включает канаглифлозин и (3) необязательно присутствующая оболочка включает Opadry® II.
В другом аспекте настоящее изобретение обеспечивает двухслойные таблетки, где (1) первый слой включает в себя около 76,6% гидрохлорида метформина, около 3,84% натрий-карбоксиметилцеллюлозы, около 18% гидроксипропилметилцеллюлозы 2208, около 0,75-1,25% диоксида кремния или около 0,25-0,75% коллоидного диоксида кремния и около 0,53% стеарата магния, (2) второй слой включает канаглифлозин и (3) необязательно присутствующая оболочка включает Opadry® II.
Примеры подходящих для использования в настоящем изобретении наполнителей или наполняющих агентов включают, но не ограничиваются, производными целлюлозы, такими как микрокристаллическая целлюлоза или древесная целлюлоза (в том числе микрокристаллическая целлюлоза 302), лактоза, безводная лактоза, сахароза, крахмал, прежелатинизированный крахмал, глюкоза, маннит (в том числе маннитол Pearlitol SD 200), фруктоза, ксилит, сорбит, кукурузный крахмал, модифицированный кукурузный крахмал, неорганические соли, такие как карбонат кальция, фосфат кальция, дикальцийфосфат, сульфат кальция, декстрин/декстраты, мальтодекстрин, прессованный сахар и другие известные наполняющие агенты или наполнители и/или смеси двух или более из них. Для использования в описанных в настоящем документе композициях подходят несколько типов микрокристаллической целлюлозы, например, микрокристаллическая целлюлоза, выбранная из Avicel® типа РН101, РН102, РН103, РН105, 112 РН, РН113, РН200, РН301, и другие виды микрокристаллической целлюлозы, такие как силикатированная микрокристаллическая целлюлоза. Для использования в описанных в настоящем документе композициях подходят несколько типов лактозы, например, выбранных из группы, состоящей из безводной лактозы, моногидрата лактозы, лактозы Fast Flo, безводной лактозы прямого прессования и моногидрата модифицированной лактозы.
Примеры подходящих для использования в настоящем изобретении связующих включают, но не ограничиваются карбоксиметилцеллюлозой (в том числе натрий-карбоксиметилцеллюлозой), гидроксипропилцеллюлозой (в том числе гидроксипропилцеллюлозой EXF), кукурузным крахмалом, прежелатинизированным крахмалом, модифицированным кукурузным крахмалом, поливинилпирролидоном (PVP), гидроксипропилметилцеллюлозой (НРМС) (в том числе гидроксипропилметилцеллюлозой 2208), лактозой, гуммиарабиком, этилцеллюлозой, ацетатом целлюлозы, а также воском, таким как карнаубский воск, парафин, спермацет, полиэтилен или микрокристаллический воск, а также другими традиционными связующими и/или смесями двух или более из них.
Примеры подходящих для использования в настоящем изобретении разрыхлителей включают, но не ограничиваются кроскармеллозой натрия, кросповидоном, крахмалом, картофельным крахмалом, прежелатинизированным крахмалом, кукурузным крахмалом, крахмалгликолатом натрия, микрокристаллической целлюлозой, низкозамещенной гидроксипропилцеллюлозой и другими известными разрыхлителями. Для использования в композициях, описанных в настоящем документе, подходят несколько конкретных типов разрыхлителей. Например, может быть использован любой вид кросповидона, включая, например, кросповидон XL-10, включая кросповидон, выбранный из группы, состоящей из Kollidon CL®, Polyplasdone XL®, Kollidon CL-M®, Polyplasdone XL-10® и Polyplasdone INF-10®. В одном из вариантов разрыхлитель гранулированной массы, если он присутствует в композиции, представляет собой крахмалгликолат натрия, кроскармеллозу натрия и/или кросповидон.
Примеры подходящих для использования в настоящем изобретении смазывающих веществ включают, но не ограничиваются стеаратом магния, стеаратом цинка, стеаратом кальция, тальком, карнаубским воском, стеариновой кислотой, пальмитиновой кислотой, стеарилфумаратом натрия, лаурилсульфатом натрия, глицерилпальмитостеаратом, пальмитиновой кислотой, миристиновой кислотой и гидрогенизированными растительными маслами и жирами, а также другими известными смазывающими веществами и/или смесями двух или более из них.
Примеры подходящих для использования в настоящем изобретении способствующих скольжению веществ и/или анти-адгезивных агентов включают, но не ограничиваются диоксидом кремния, коллоидным диоксидом кремния, силикатом магния, трисиликатом магния, тальком и другими формами диоксида кремния, такими как агрегированные силикаты и гидратированный диоксид кремния.
Примеры подходящих модификаторов высвобождения включают, но не ограничиваются гидроксипропилметилцеллюлозой, поливиниловым спиртом (ПВС), этилцеллюлозой, метакриловыми полимерами, гидроксипропилцеллюлозой, крахмалом, камедями, эфирами целлюлозы, полученными из белков материалами, нейлоном, акриловыми смолами, полимолочной кислотой, поливинилхлоридом, поливинилпирролидоном и ацетофталатом целлюлозы.
В одном аспекте настоящее изобретение относится к способам лечения заболеваний или нарушений, связанных с активностью SGLT2, включающим введение млекопитающим, предпочтительно человеку, нуждающимся в таком лечении, терапевтически эффективного количества двухслойной таблетки, содержащей композицию метформина XR или композицию метформина XR уменьшенного веса, композицию ингибитора SGLT2 и, необязательно, пленочную оболочку. Двухслойные таблетки по настоящему изобретению, как описано здесь, могут быть введены млекопитающим, предпочтительно человеку, для лечения диабета (включая диабет I типа и II типа), нарушения толерантности к глюкозе, инсулинорезистентности и диабетических осложнений, таких как нефропатия, ретинопатия, нейропатия и катаракта, гипергликемия, гиперинсулинемия, гиперхолестеринемия, дислипидемия, повышенный уровень свободных жирных кислот и глицерина в крови, гиперлипидемия, гипертриглицеридемия, ожирение, заживления ран, лечения ишемии тканей, атеросклероза и гипертонии. В предпочтительном варианте композиции двухслойной таблетки по настоящесу изобретению вводят человеку для лечения сахарного диабета II типа.
В другом аспекте настоящее изобретение обеспечивает применение двухслойной таблетки, содержащей композицию метформина XR или композицию метформина XR уменьшенного веса, композицию ингибитора SGLT2 и, необязательно, пленочную оболочку, для приготовления или для изготовления лекарственного средства для лечения сахарного диабета (включая диабет I типа и II типа), нарушения толерантности к глюкозе, инсулинорезистентности и диабетических осложнений, таких как нефропатия, ретинопатия, нейропатия и катаракта, гипергликемия, гиперинсулинемия, гиперхолестеринемия, дислипидемия, повышенный уровень свободных жирных кислот и глицерина в крови, гиперлипидемия, гипертриглицеридемия, ожирение, для заживления ран, лечения ишемии тканей, атеросклероза и гипертонии.
Определения
Термин "около", используемый в настоящем документе, означает отклонение в пределах 10%, более предпочтительно в пределах 5%, еще более предпочтительно в пределах 2% от указываемого числа.
Термин "дапаглифлозин", используемый в настоящем документе, означает соединение по Примеру 1 и включает в себя его фармацевтически приемлемые соли.
Термин "дапаглифлозин (S) PGS", используемый в настоящем документе, означает соединение по Примеру 2 дапаглифлозин (S) пропиленгликольгидрат (1:1:1).
Термин "дапаглифлозин (R) PGS", используемый в настоящем документе, означает соединение по Примеру 3 дапаглифлозин (R) пропиленгликольгидрат (1:1:1).
Термин "метформин замедленного высвобождения" или "метформин XR", используемый в настоящем документе, относится к некоторому количеству метформина HCl, который присутствует в лекарственной форме, которая позволяет осуществлять оральную доставку с контролируемым высвобождением, высвобождая лекарственное средство (метформин HCl) в течение длительного периода времени после введения, поддерживаяя при этом желаемый уровень уровень лекарственного средства в плазме.
Термин "Opadry® II», используемый в настоящем документе, означает пленочную оболочку для таблеток, в том числе двухслойных таблеток, которая включает поливиниловый спирт, диоксид титана, полиэтиленгликоль (ПЭГ) и тальк. Opadry® II white 85F18422 включает поливиниловый спирт, диоксид титана, полиэтиленгликоль, тальк. Opadry® II Yellow 85F92582 включает поливиниловый спирт, диоксид титана, полиэтиленгликоль, тальк и желтый оксид железа.
Термин "Opadry® HP", используемый в настоящем документе, означает пленочную оболочку для таблеток, которая включает 40% поливинилового спирта, 20% полиэтиленгликоля, 15% талька и 25% диоксида титана.
Исследования на человеке
В ходе 24 недельной 3 фазы клинического исследования комбинация метформина и дапаглифлозина, ингибитора SGLT2, снижала уровень гликозилированного гемоглобина (HbAlc) и глюкозы в плазме крови, взятой натощак, (FPG) у больных диабетом II типа. Уровень гликозилированного гемоглобина и глюкозы в плазме крови, взятой натощак, недостаточно контролируется при монотерапии метформином, как показало введение плацебо плюс метформин. Исследование также показало, что у пациентов, получающих дапаглифлозин, наблюдалось статистически большее среднее снижение массы тела по сравнению с пациентами, принимающими плацебо.
Исследование было проведено для оценки эффективности и безопасности применения дапаглифлозина как дополнения к метформину в течение 24 недель у пациентов с недостаточно контролируемым диабетом 2 типа. Данные представляют собой результаты рандомизированного двойного слепого плацебо-контролируемого исследования 546 пациентов с сахарным диабетом 2 типа, у которых уровень HbAlc был выше или равен 7,0 процентам и меньше или равен 10 процентам в начале исследования. После двухнедельной вступительной стадии пациентов случайно распределяли в одну из четырех отдельных групп лечения: дапаглифлозин 2,5 мг (n=137), дапаглифлозин 5 мг (n=137), дапаглифлозин 10 мг (n=135) или плацебо (n=137). Пациенты всех групп также получали метформин (в дозе большей или равной 1500 мг/сут). В первичной конечной точке исследования сравнивали изменение уровня HbAlc от исходного уровня для каждой группы после 24 недель лечения дапаглифлозином по сравнению с плацебо. Вторичные конечные точки включали изменение FPG от исходного уровня и изменение массы тела на 24-й неделе по сравнению с плацебо, и скорректированный процент получавших дапаглифлозин пациентов, которые достигли уровня HbAlc менее 7 процентов в течение 24 недель. Поисковые конечные точки включали снижение массы тела, большее или равное 5 процентам или большее или равное 10 процентам, а также процентное изменение массы тела по сравнению с исходной массой.
После 24 недель пациенты, получавшие дапаглифлозин 2,5 мг, 5 мг и 10 мг плюс метформин, продемонстрировали статистически значимое скорректированное изменение среднего уровня HbAlc от исходного уровня в 0,67 процента, 0,70 процента и 0,84 процента соответственно по сравнению с 0,30 процента в группе плацебо. Пациенты, получавшие дапаглифлозин, на 24-й неделе показали статистически значимое скорректированное изменение среднего уровня FPG, вторичной конечной точки, по сравнению с исходным уровнем: -17,8 мг/дл для 2,5 мг дапаглифлозина, -21,5 мг/дл для 5 мг дапаглифлозина и -23,5 мг/дл для 10 мг дапаглифлозина по сравнению с -6,0 мг/дл для плацебо.
В ходе исследования также оценивали возможное влияние дапаглифлозина на потерю веса. Наблюдения включали измерение изменений общей массы тела в течение 24-недельного периода исследования. На 24 неделе изменение общей массы тела в кг, вторичная конечная точка, составило 2,21 кг для 2,5 мг дапаглифлозина, 3,04 кг для 5 мг дапаглифлозина и 2,86 кг для 10 мг дапаглифлозина по сравнению с 0,89 кг в группе, получавшей плацебо. В целом, больше пациентов, получавших дапаглифлозин, достигли потери веса, большей или равной 5 процентам, поисковой конечной точки, по сравнению с группой плацебо.
Эти результаты показывают, что комбинация ингибитора SGLT2, в частности дапаглифлозина или дапаглифлозин (S) пропиленгликольгидрата, с метформином эффективно лечит гипергликемию у пациентов с диабетом II типа, не вызывая увеличение веса.
Пример 1
Дапаглифлозин (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-этоксибензил)фенил)-6-(гидроксиметил)тетрагидро-2Н-пиран-3,4,5-триол
Дапаглифлозин может быть получен с использованием процедур, аналогичных описанным в патенте США №6515117 или международных заявках WO 03/099836 и WO 2008/116179, описания которых во всей своей полноте включены в настоящее изобретение посредством ссылки. SGLT2 ЕС50=1,1 нМ.

Пример 2
Дапаглифлозин (S) PGS (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-этоксибензил)фенил)-6-(гидроксиметил)тетрагидро-2Н-пиран-3,4,5-триол
(S)-пропан-1,2-диол гидрат (1:1:1)
Дапаглифлозин (S) пропиленгликольгидрат (1:1:1) может быть получен с использованием процедур, аналогичных описанным в международных заявках WO 08/002824 и WO 2008/116179, описания которых во всей своей полноте включены в настоящее изобретение посредством ссылки. SGLT2 ЕС50=1,1 нМ.

Пример 3
Дапаглифлозин (R) PGS (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-этоксибензил)фенил)-6-(гидроксиметил)тетрагидро-2Н-пиран-3,4,5-триол (R)-пропан-1,2-диол гидрат (1:1:1)
Дапаглифлозин (R) пропиленгликольгидрат (1:1:1) может быть получен с использованием процедур, аналогичных описанным в международных заявках WO 08/002824 и WO 2008/116179, описания которых во всей своей полноте включены в настоящее изобретение посредством ссылки. SGLT2 ЕС50=1,1 нМ.
Пример 4
Были приготовлены двухслойные таблетки, содержащие композицию метформина (1000 мг) замедленного высвобождения и композицию дапаглифлозина (S) PGS (5,00 мг) немедленного высвобождения, как описано ниже.
|
Грануляция метформина (1000 мг)
Метформин HCl, 0,5% стеарата магния и натрий карбоксиметилцеллюлозу объединяли и смешивали в грануляторе с большим усилием сдвига в течение одной минуты. Очищенную воду добавляли через распылитель при перемешивании в течение одной минуты. Влажный гранулят пропускали через мельницу, а затем высушивали до содержания влаги 1,0% или менее. Сухой материал, содержащий метформин HCl, 0,5% стеарата магния и натрий карбоксиметилцеллюлозу, пропускали через мельницу и распределяли в барабаны с полиэтиленовым покрытием, получая измельченную гранулированную массу метформина 1 г.
Гидроксипропилметилцеллюлозу 2208 USP (100000 сантипуазов) (Methocel К100М Premium) переносили в бункерный смеситель и перемешивали 60 оборотов. Материал пропускали через мельницу, распределяли, получая измельченную гидроксипропилметилцеллюлозу 2208 USP.
Метформин (1 г измельченной гранулированной массы), гидроксипропилметилцеллюлозу 2208 USP (измельченную), гидроксипропилметилцеллюлозу 2208 USP (не измельченную) и стеарат магния добавляли бункерный смеситель и перемешивали 60 оборотов. Приготовленный материал распределяли в в барабаны с полиэтиленовым покрытием, получая гранулированную массу метформина 1 г с замедленным высвобождением.
Грануляции дапаглифлозина (2,5, 5,0, 10,0 мг)
Дапаглифлозин (S) PGS смешивали с микрокристаллической целлюлозой, безводной лактозой, частью кросповидона и частью диоксида кремния в подходящем барабанном смесителе и пропускали через подходящую коническую мельницу. Часть стеарата магния (просеянный) смешивали с полученной смесью, которую затем уплотняли с помощью соответствующего роликового уплотнителя. Уплотненную смесь измельчали до образования гранул. Гранулы смешивали с оставшимся количеством двуокиси кремния и кросповидона в подходящем барабанном смесителе. Затем гранулы смешивали с оставшимся количеством стеарата магния в подходящем барабанном смесителе.
Прессование двухслойных таблеток
Первый бункер пресс для двухслойных таблеток быд заполнен композицией метформина XR или композицией метформина XR уменьшенного веса, в второй бункер - композицией ингибитора SGLT2, представляющей собой гранулированную массу дапаглифлозина (S) PGS (содержание 2,5 мг, 5 мг или 10 мг). Таблеточный пресс была настроен для получения первого слоя желаемого веса (метформин XR или метформин XR). Второй бункер был открыт и таблеточный пресс настроили для получения желаемого веса двухслойных таблеток дапаглифлозина и метформина XR или дапаглифлозина и метформина XR уменьшенного веса. После настройки желаемого веса пресс настраивали для получения желаемой твердости. После настройки желаемой твердости изготавливаемые таблетки периодически проверяли на вес первого слоя, а также вес, твердость, размер и рыхлость всей таблетки. Получаемые двухслойные таблетки были покрыты пленкой Opadry® II PVA (поливиниловый спирт).
Пример 5
Двухслойные таблетки, содержащие композицию метформина (1000 мг) замедленного высвобождения и композицию дапаглифлозина (S) PGS (2,5 мг) немедленного высвобождения, были приготовлены таким же образом, как описано в Примере 4.
|
Пример 6
Двухслойные таблетки, содержащие композицию метформина (1000 мг) замедленного высвобождения и композицию дапаглифлозина (S) PGS (10,00 мг) немедленного высвобождения, были приготовлены таким же образом, как описано в Примере 4.
|
|
Пример 7
Двухслойные таблетки, содержащие композицию метформина (1000 мг) уменьшенного веса замедленного высвобождения и композицию дапаглифлозина (S) PGS (5,00 мг) немедленного высвобождения, были приготовлены, как описано ниже.
|
Метформин HCl, 0,5% стеарата магния и натрий карбоксиметилцеллюлозу объединяли и смешивали в грануляторе с большим усилием сдвига в течение одной минуты. Очищенную воду добавляли через распылитель при перемешивании в течение одной минуты. Влажный гранулят пропускали через мельницу, а затем высушивали до содержания влаги 1,0% или менее. Сухой материал, содержащий метформин HCl, 0,5% стеарата магния и натрий карбоксиметилцеллюлозу, пропускали через мельницу и распределяли в барабаны с полиэтиленовым покрытием, получая измельченную гранулированную массу метформина 1 г.
Метформин (1 г измельченной гранулированной массы), гидроксипропилметилцеллюлозу 2208 USP (100000 сантипуазов) (Methocel К100М Premium) и диоксид кремния добавляли бункерный смеситель и перемешивали 120 оборотов. Затем добавляли стеарат магния и после 60 оборотов приготовленный материал распределяли в барабаны с полиэтиленовым покрытием, получая гранулированную массу метформина 1 г уменьшенного веса с замедленным высвобождением.
Грануляцию дапаглифлозина (S) PGS и процедуру прессования двухслойных таблеток проводили, как описано в Примере 4.
Пример 8
Двухслойные таблетки, содержащие композицию метформина (1000 мг) уменьшенного веса замедленного высвобождения и композицию дапаглифлозина (S) PGS (2,5 мг) немедленного высвобождения, были приготовлены, как описано в Примере 7.
|
Пример 9
Двухслойные таблетки, содержащие композицию метформина (1000 мг) уменьшенного веса замедленного высвобождения и композицию дапаглифлозина (S) PGS (10,00 мг) немедленного высвобождения, были приготовлены, как описано в Примере 7.
|
|
Для приготовления двухслойных таблеток по настоящему изобретению могут быть использованы другие композиции IR ингибиторов SGLT2, описанные в Таблице 2. Композиции, приведенные в Таблице 2, совместимы с композициями метформина XR или композициями метформина XR уменьшенного веса, описанными в настоящем документе. Двухслойные таблетки, приготовленные из композиции IR ингибитора SGLT2, описанного в Таблице 2, характеризуются уменьшением или отсутствием трещин, разделения и/или перекрестного загрязнения со слоем метформина XR и слоем метформина XR уменьшенного веса.
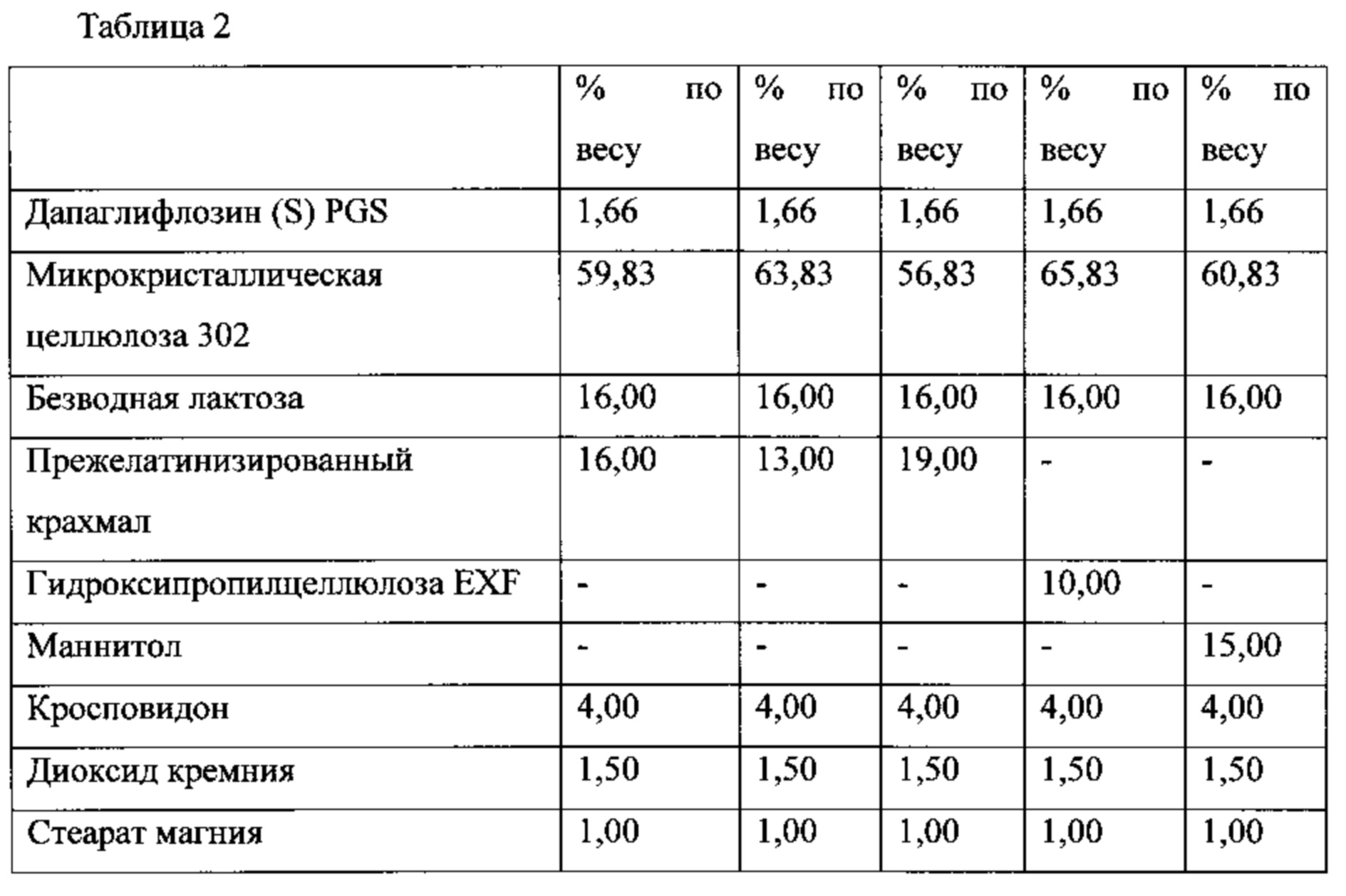
Пример 10
Двухслойные таблетки, содержащие композицию метформина (500 мг) уменьшенного веса замедленного высвобождения и композицию дапаглифлозина (S) PGS (5,00 мг) немедленного высвобождения, были приготовлены, как описано в Примере 13, с тем исключением, что в слой метформина не добавляли диоксид кремния.
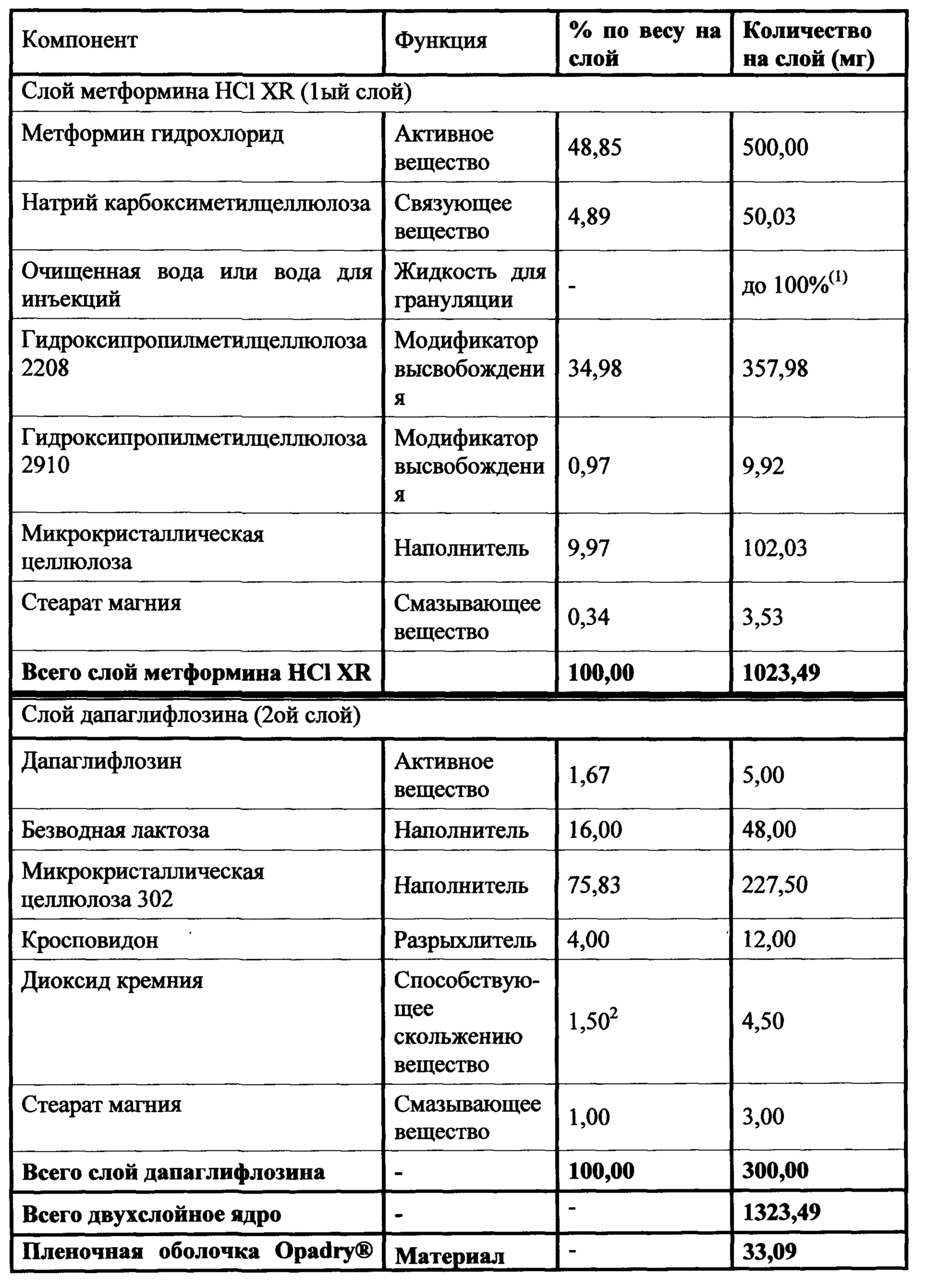
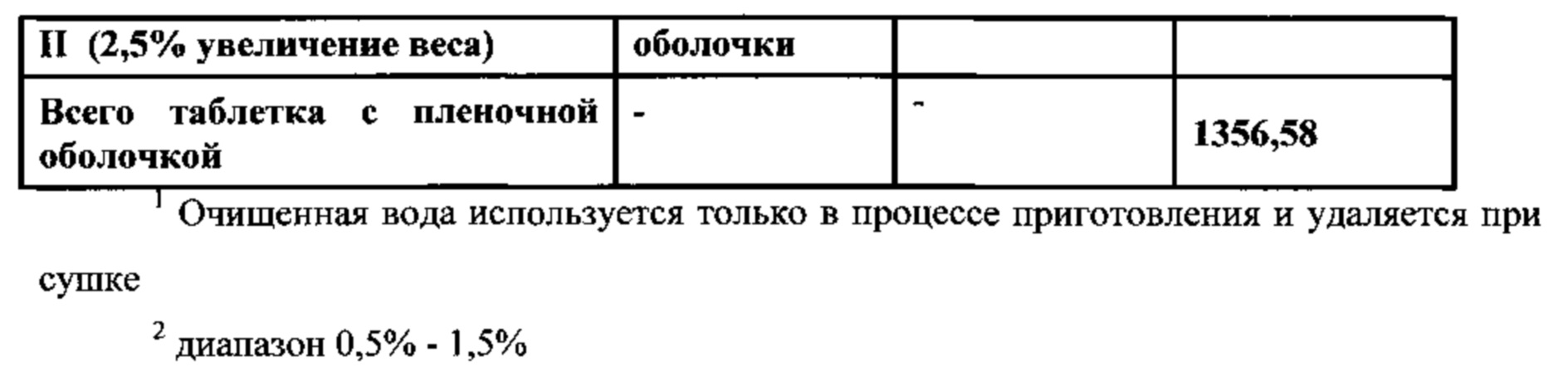
Пример 11
Двухслойные таблетки, содержащие композицию метформина (500 мг) замедленного высвобождения и композицию дапаглифлозина (S) PGS (10,0 мг) немедленного высвобождения, были приготовлены, как описано в Примере 13, с тем исключением, что в слой метформина не добавляли диоксид кремния.
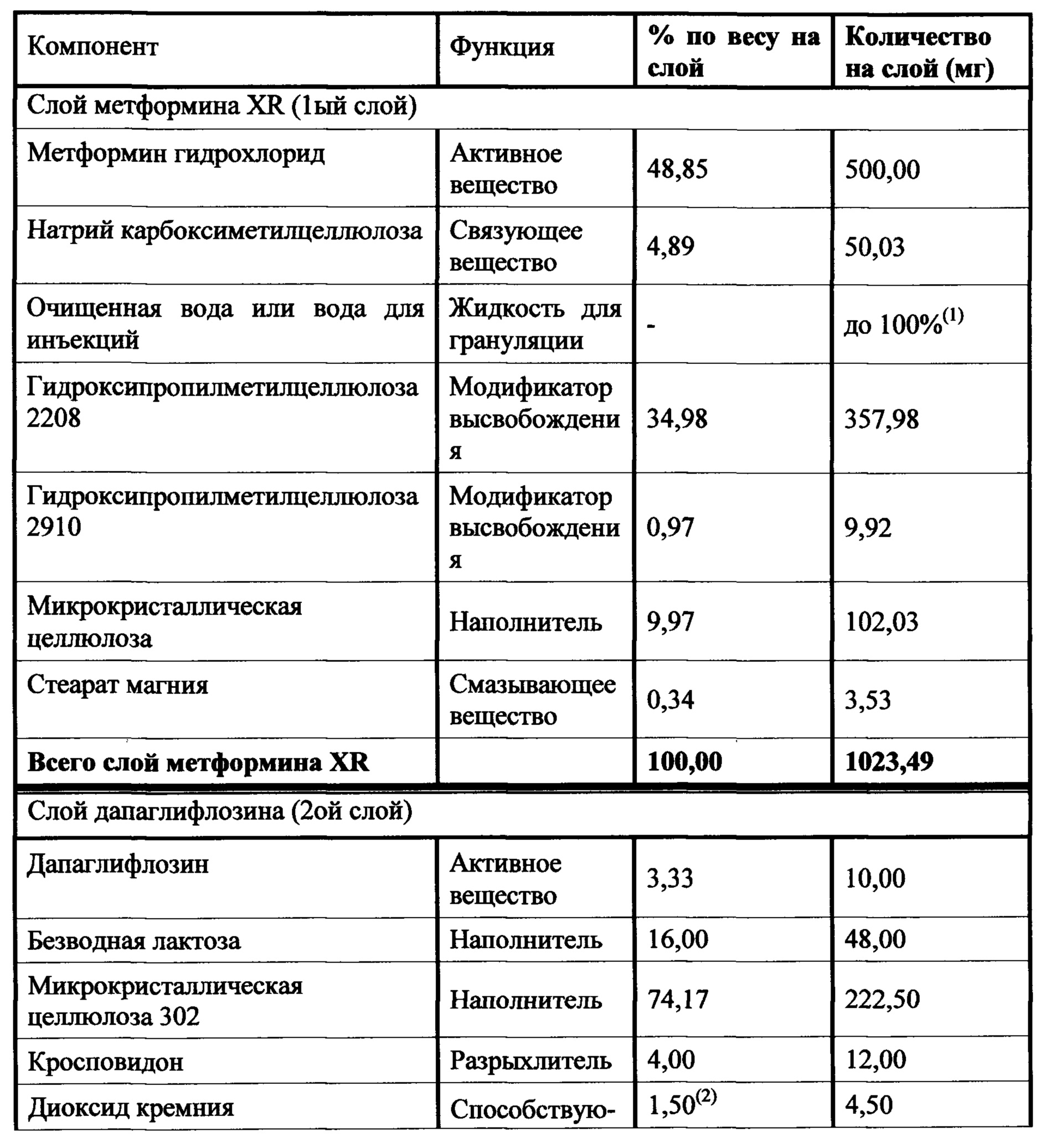
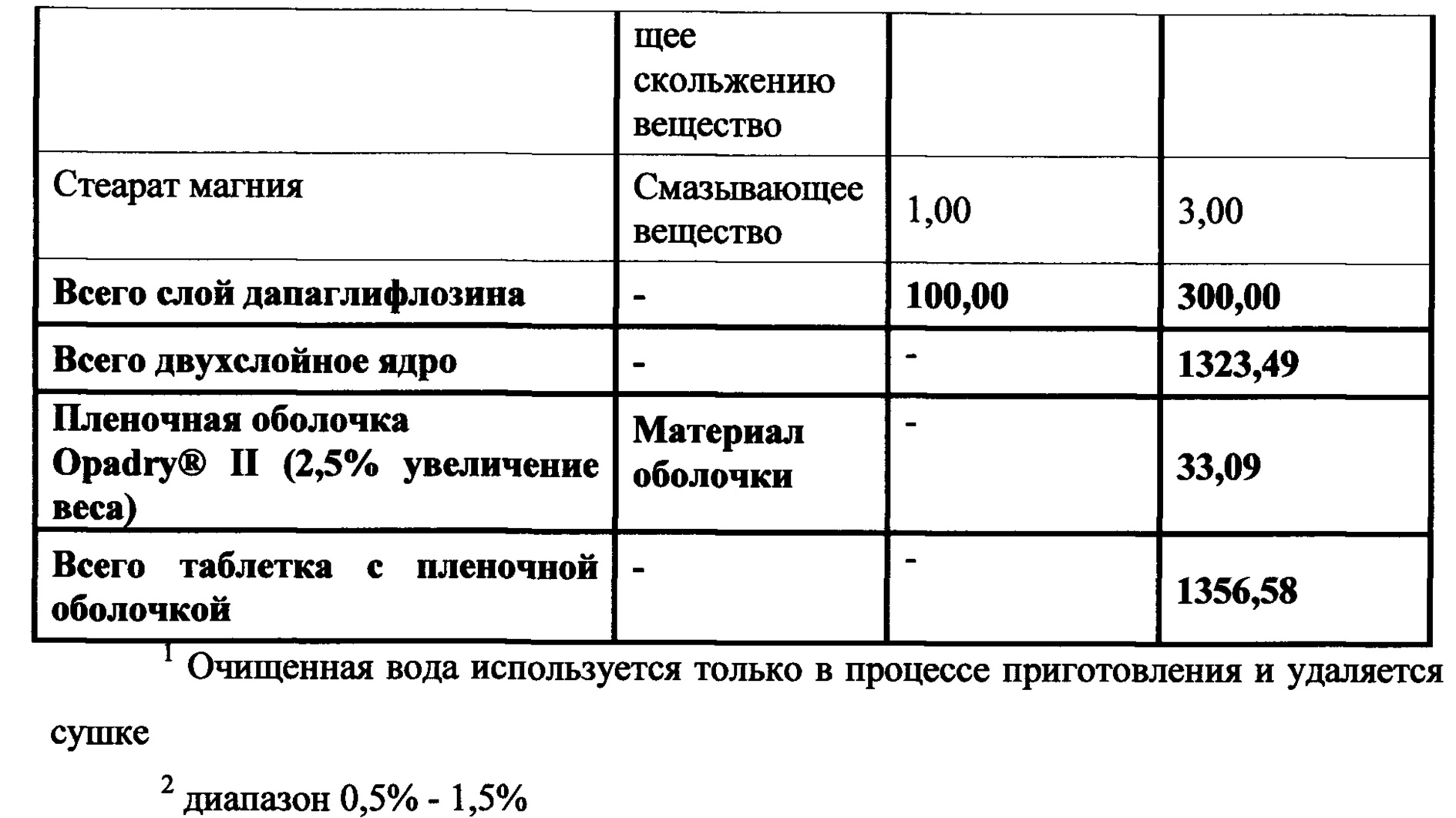
Пример 12
Двухслойные таблетки, содержащие композицию метформина (500 мг) замедленного высвобождения и композицию дапаглифлозина (S) PGS (2,50 мг) немедленного высвобождения, были приготовлены, как описано в Примере 13, с тем исключением, что в слой метформина не добавляли диоксид кремния.
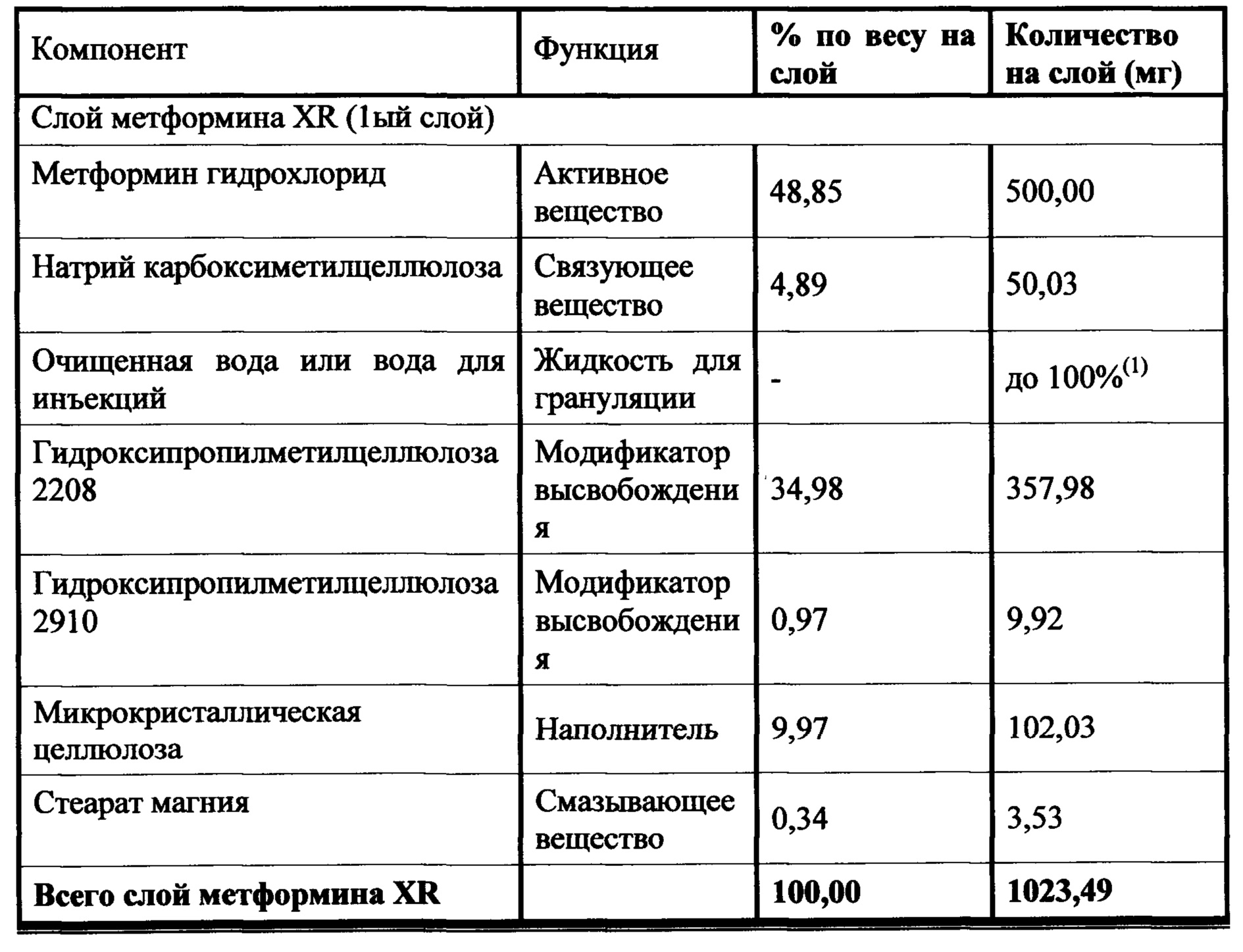
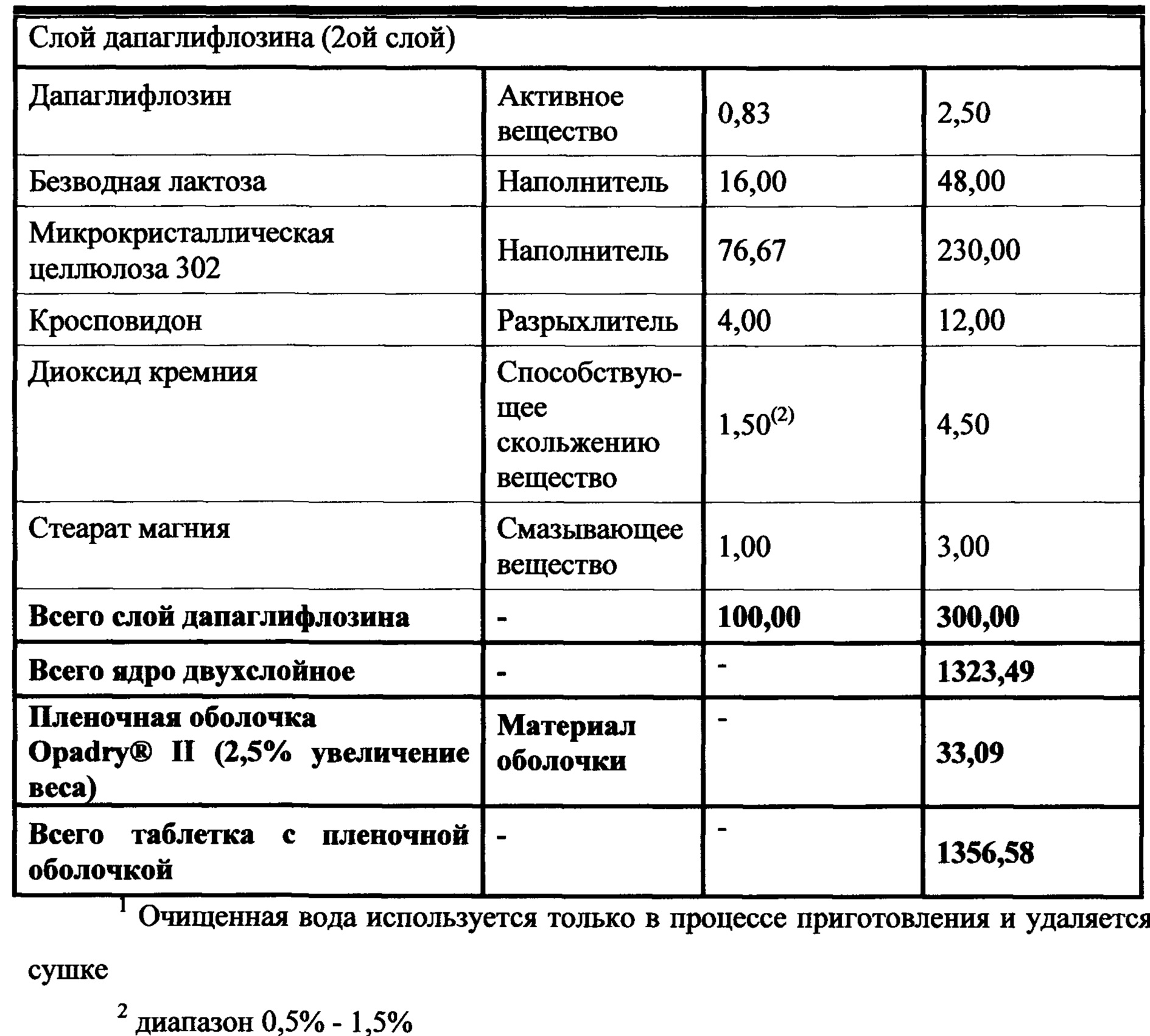
Пример 13
Двухслойные таблетки, содержащие композицию метформина (500 мг) замедленного высвобождения и композицию дапаглифлозина (S) PGS (5,0 мг) немедленного высвобождения, были приготовлены, как описано ниже.

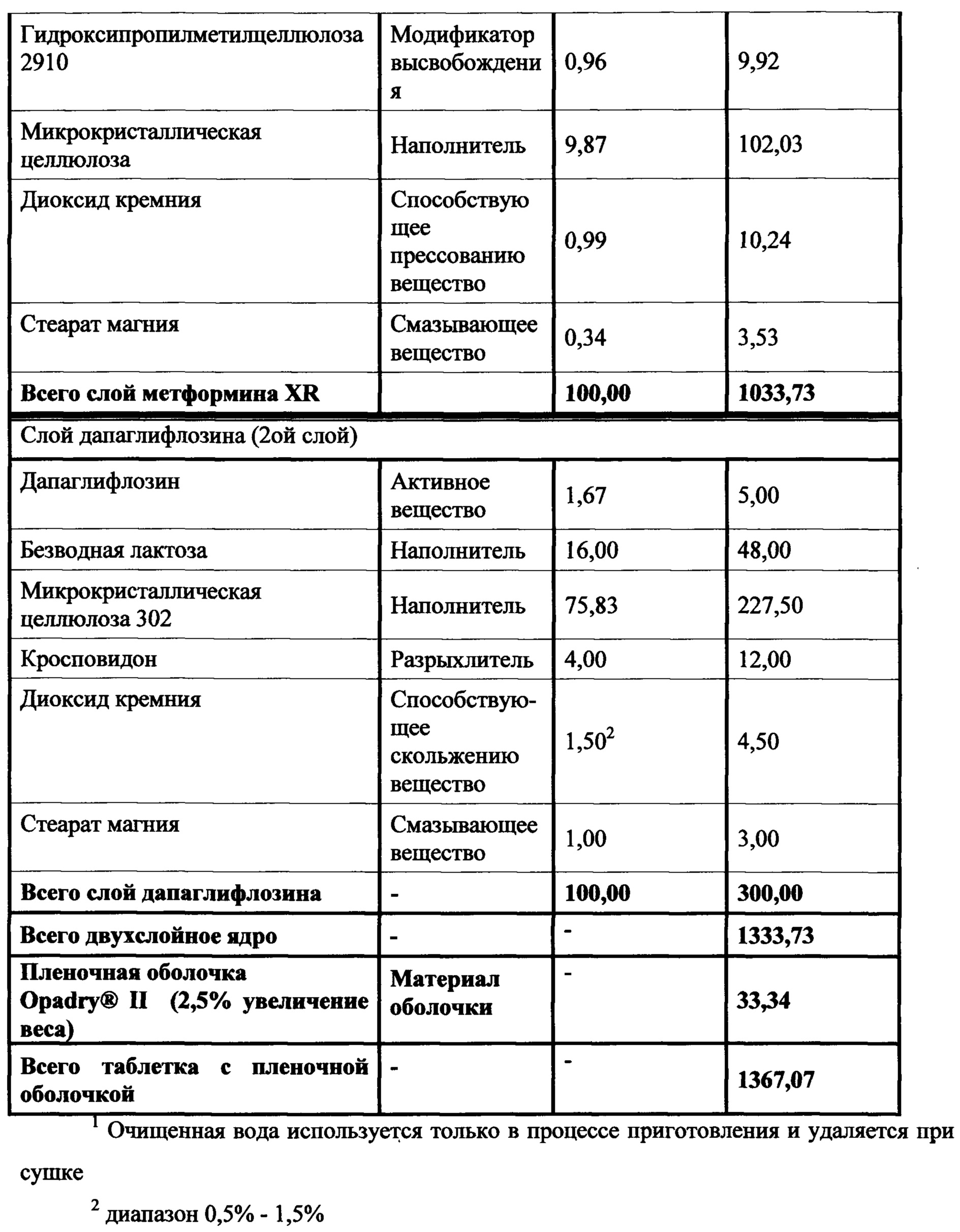
Метформин HCl, 0,5% стеарата магния и натрий карбоксиметилцеллюлозу объединяли и смешивали в грануляторе с большим усилием сдвига в течение одной минуты. Очищенную воду добавляли через распылитель при перемешивании в течение одной минуты. Влажный гранулят пропускали через мельницу, а затем высушивали до содержания влаги 1,0% или менее. Сухой материал, содержащий метформин HCl, 0,5% стеарата магния и натрий карбоксиметилцеллюлозу, пропускали через мельницу и распределяли в барабаны с полиэтиленовым покрытием, получая измельченную гранулированную массу метформина 500 мг.
Измельченную гранулированную массу метформина 500 мг, гидроксипропилметилцеллюлозу 2208, гидроксипропилметилцеллюлозу 2910 и диоксид кремния добавляли бункерный смеситель и перемешивали 240 оборотов. Затем добавляли стеарат магния и после 60 оборотов приготовленный материал распределяли в барабаны с полиэтиленовым покрытием, получая гранулированную массу метформина 500 мг с замедленным высвобождением.
Грануляцию дапаглифлозина (S) PGS и процедуру прессования двухслойных таблеток проводили, как описано в Примере 4.
Пример 14
Двухслойные таблетки, содержащие композицию метформина (500 мг) замедленного высвобождения и композицию дапаглифлозина (S) PGS (10,0 мг) немедленного высвобождения, были приготовлены, как описано в Примере 13.
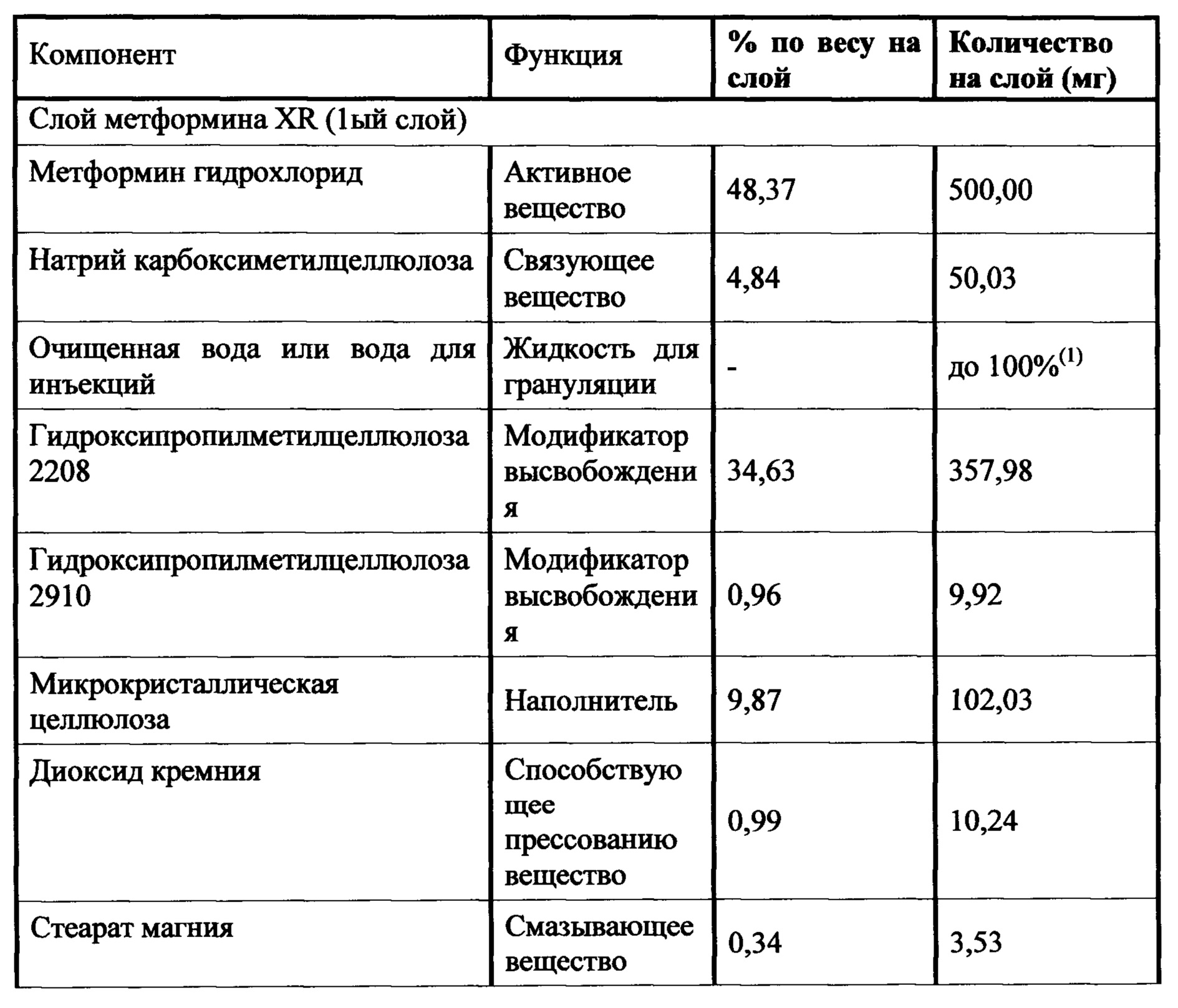
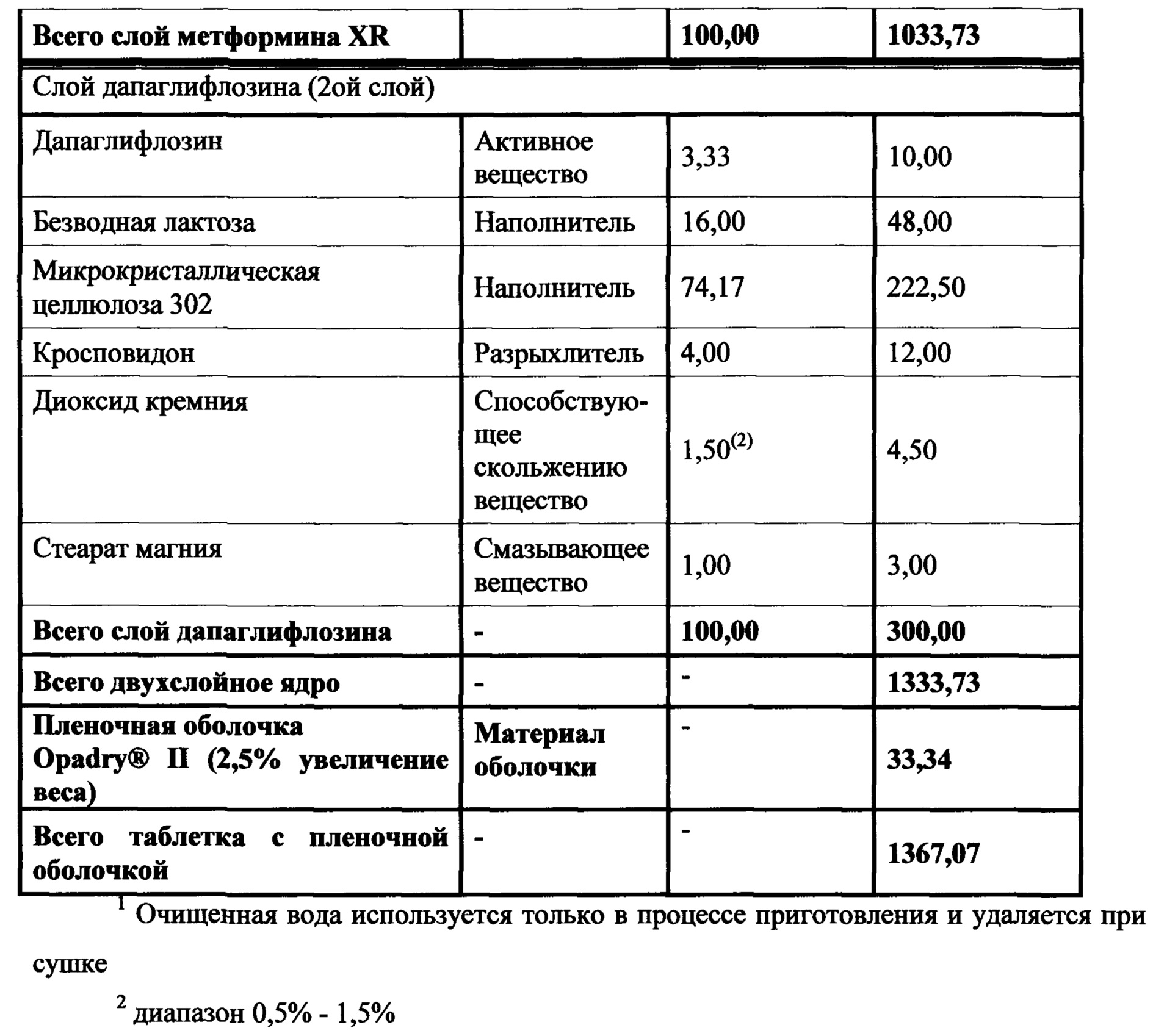
Пример 15
Двухслойные таблетки, содержащие композицию метформина (500 мг)
замедленного высвобождения и композицию дапаглифлозина (S) PGS (2,50 мг) немедленного высвобождения, были приготовлены, как описано в Примере 13.