Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА КОЛЛАГЕНАЗЫ В ГЕЛЕ НА ОСНОВЕ ПИЩЕВОГО ХИТОЗАНА И СУКЦИНАТА ХИТОЗАНА
Вид РИД
Изобретение
Изобретение относится к биотехнологии и может быть использовано в химико-фармацевтической промышленности, медицинской практике и ветеринарии.
Известны многочисленные методы иммобилизации различных ферментов, включая коллагеназу. Коллагеназы (КФ 3.4.22.32) относятся к небольшой группе матриксных металлопротеаз, являются высокоспецифичными ферментами, способными вызывать гидролитическое расщепление молекул коллагена. В отличие от коллагеназ млекопитающих, которые расщепляют спираль коллагена на одном участке, бактериальные коллагеназы разрывают связи нескольких узлов вдоль спирали. Бактерия Clostridium histolyticum синтезирует семь типов коллагеназ, которые были изучены на сегодняшний день. Эти ферменты являются одними из самых эффективных для расщепления коллагена. Из-за высокой каталитической способности коллагеназа Clostridium histolyticum активно используется для изоляции конкретных типов клеток от сопутствующей соединительной ткани.
Коллагеназы используются в качестве размягчителя в пищевой промышленности, т.к. именно коллаген отвечает за прочность красных мясных продуктов. Коллагеназы можно применять в косметологии для обеспечения равномерного изменения цвета кожи при приобретении загара. Однако наиболее распространенной областью применения этих ферментов является медицина. Коллагеназы используются для лечения ожогов и язв, для устранения рубцовой ткани и играют важную роль при трансплантации [Патент RU 2265052, МПК C12N 9/48, C12N 9/64, опубл. 27.11.2005; Daboor, S. Budge, A. Ghaly, S. Brooks, D. Dave Extraction and Purification of Collagenase Enzymes: A Critical Review // American Journal of Biochemistry and Biotechnology. - 2010. - V. 6 (4). - P. 239-263; Susagawara R., Harper E. Publication and characterization of three forms of collagenase from Clostridium histolyticum // Biochemistry. - 1984. - V. 23. - P. 5175-5182].
Известен ферментный препарат коллаза (Collasum), представляющий собой смесь двух изоферментов сериновой коллагенолитической протеазы А и С, обладающий некролитической активностью, а также фибринолитическими и тромболитическими свойствами. Однако смесь этих двух протеаз не способна полностью гидролизовать многие полипептидные субстраты, например, коллагеновые волокна гидролизуются лишь частично, и раны, содержащие поврежденные коллагеновые волокна, очистить с помощью коллазы представляется проблематичным [Патент RU 2365623, МПК C12N 9/48, A61K 38/48, А61Р 17/02, опубл. 27.08.2009].
Нативные ферменты быстро инактивируются при введении их в рану, поэтому целесообразно использовать иммобилизованные энзимы. Известны многочисленные методы иммобилизации различных ферментов, включая коллагеназу. Основным недостатком этих способов является использование преимущественно синтетических полимеров, которые невозможно применять в пищевой и медицинской промышленности.
Известны примеры использования в виде носителей для иммобилизации хитозана. Хитозан - это аминополисахарид животного происхождения, получаемый из хитина панцирей членистоногих. Хитозан обладает ценными свойствами, благодаря которым он является перспективным носителем. Он характеризуется нетоксичностью, неантигенностью, обладает высокой сорбционной способностью, совместим с большинством лекарственных средств, проявляет антибактериальное и противогрибковое действие, биосовместим с тканями человека, влияет на процессы регенерации поврежденных кожных покровов, биодеградируем естественным метаболическим путем. Хитозан широко используется в биотехнологии, фармакологии и является основным компонентом многих лекарственных средств и косметических препаратов. Биосовместимость с живыми тканями, близость по функциональным качествам к компонентам дермы in vivo, биоинертность, биоразлагаемость, биоцидные и другие свойства хитозана определяют перспективность разработки на его основе новых материалов медико-биологического назначения [Гамзазаде А.И. Производные хитина/хитозана контролируемой структуры в качестве потенциально новых биоматериалов // Дис д. хим. н. - Москва. - 2005. - 363 с; Скрябин К.Г. Хитин и хитозан: Получение, свойства и применение / Под ред. К.Г. Скрябина, Г.А. Вихоревой, В.П. Варламова. - М.: Наука, 2002. - 368 с; Патент RU 2424812, МПК A61K 31/722, A61K 38/47, А61Р 17/02, опубл. 27.07.2011].
Коллагеназа и хитозан применялись в одном препарате при создании бальзама для ног [Патент RU 2112500, МПК A61K 7, опубл. 10.06.1998], где использовались как смесь компонентов. Было отмечено, что переносимость бальзама удовлетворительна, раздражающее и аллергизирующее действия отсутствовали. Под влиянием бальзама у пациентов уменьшалась потливость ног, гиперкератоз и омозолелость стоп, исчезал неприятный запах (дезодорирующее действие). Он хорошо снимал явления воспаления и шелушения, способствовал заживлению трещин, потертости и микроэрозий.
Технический результат заявленного изобретения заключается в увеличении скорости ферментативной реакции и повышении эффективности использования препарата на основе коллагеназы и хитозана, в том числе при осуществлении реакции на твердых поверхностях.
В своей работе мы использовали в виде носителей для иммобилизации пищевой хитозан с молекулярной массой менее 100 кДа и его производное -сукцинат хитозана [Неклюдов А.Д., Иванкин А.Н. Экологические основы биотехнологии. - М: ГОУ ВПО МГУЛ, 2006, С. 164-180], а коллагеназу иммобилизовали методом включения в гель, благодаря чему ферменты становятся более стабильными, обладают пролонгированным действием.
Технический результат достигается тем, что в способе получения препарата коллагеназы в геле на основе пищевого хитозана или сукцината хитозана, включающем иммобилизацию коллагеназы в буферном растворе на матрицу пищевого хитозана с молекулярной массой менее 100 кДа или сукцината хитозана в соотношении 20 мл раствора фермента в концентрации 1 мг/мл на 1 г носителя; в качестве буферного раствора для иммобилизации используют 0.05 М ацетатный буфер с рН 5.8 или 0.05 М глициновый буфер с рН 9.0; инкубирование при комнатной температуре с периодическим перемешиванием в течение 2 часов, промывку образовавшегося осадка 50 мМ трис-HCl буфером (рН 7.5) до отсутствия в промывных водах белка.
Применение хитозана с указанной молекулярной массой в совокупности с использованием 0.05 М ацетатного буфера позволило получить гелеобразный препарат. Гелеобразный препарат, в отличие от порошкового, позволяет проводить ферментативные реакции не только в растворах, но и на твердых субстратах, что в свою очередь облегчает нанесение препарата в область раны или ожога, увеличивает эффективность.
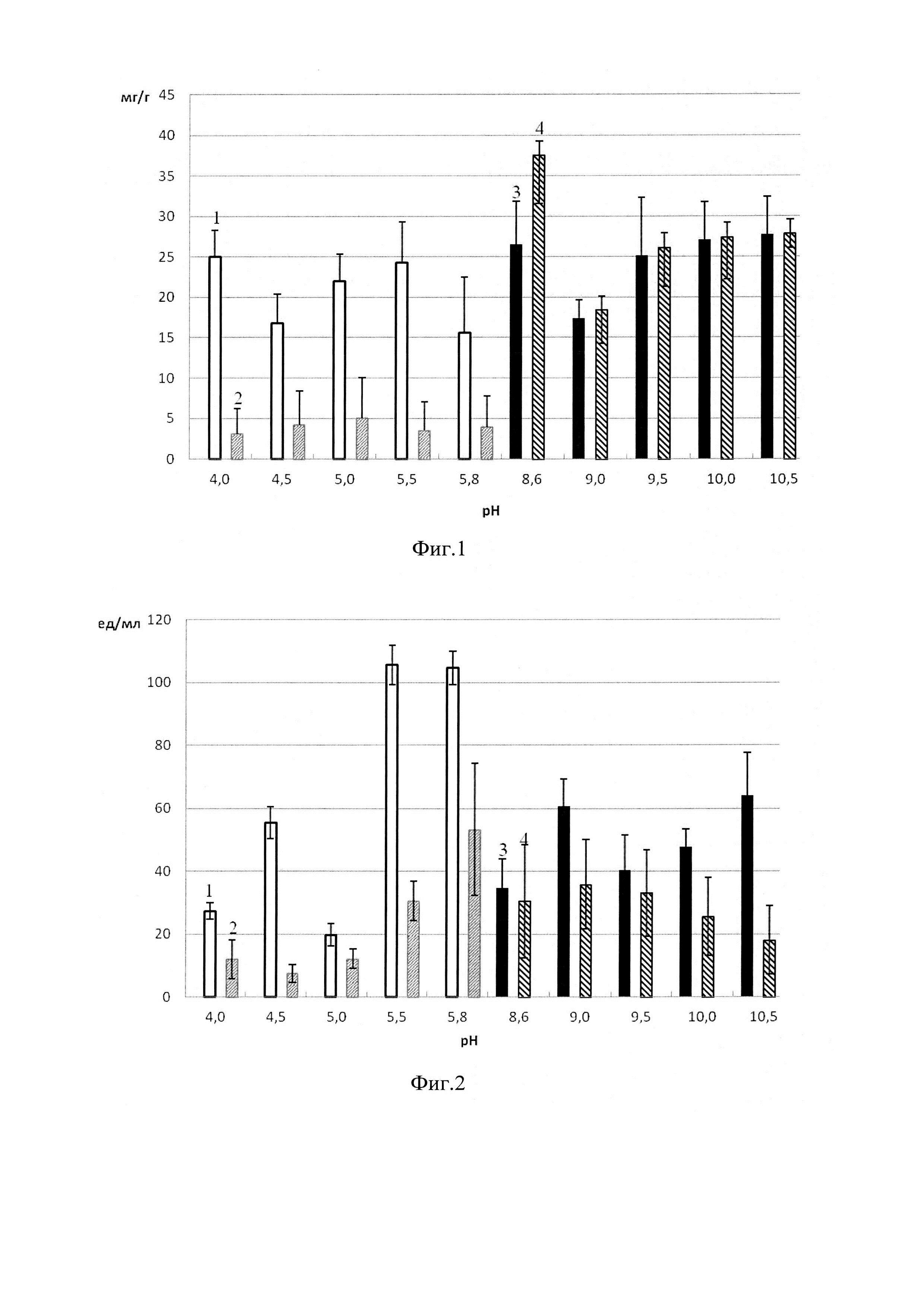
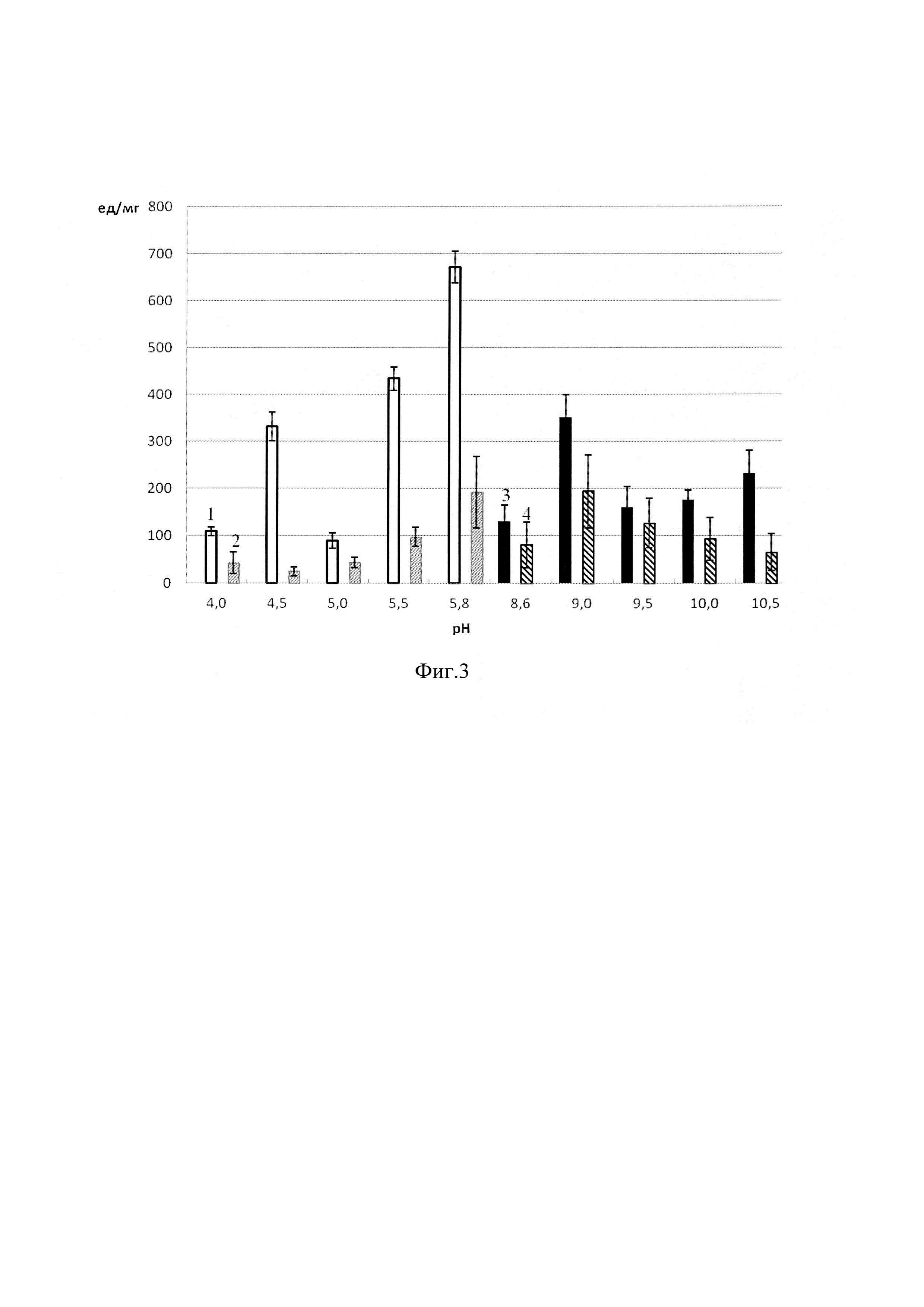
На фиг. 1 приведена диаграмма значений содержания белка (в мг на 1 г носителя) в препаратах иммобилизованной коллагеназы, на фиг. 2 -диаграмма значений общей активность (в ед на 1 мл раствора), на фиг. 3 - диаграмма значений удельной активности (в ед на 1 мг белка в пробе), где 1 - коллагеназа, иммобилизованная на сукцинате хитозана с использованием ацетатного буфера; 2 - коллагеназа, иммобилизованная на пищевом хитозане с использованием ацетатного буфера; 3 - коллагеназа, иммобилизованная на сукцинате хитозана с использованием глицинового буфера; 4 - коллагеназа, иммобилизованная на пищевом хитозане с использованием глицинового буфера.
Пример реализации способа.
В качестве объекта была выбрана коллагеназа из Clostridium histolyticum фирмы «Sigma-Aldrich», субстратом для гидролиза служил азоказеин фирмы «Sigma-Aldrich». В качестве носителей для иммобилизации применяли два вида хитозана (ЗАО «Биопрогресс»): хитозан пищевой с молекулярной массой менее 100 кДа и сукцинат хитозана.
Иммобилизацию коллагеназы на матрице хитозана осуществляли путем включения в гель. К 1 г хитозана добавляли 20 мл раствора фермента (в концентрации 1 мг/мл), инкубировали в течение 2 часов. После окончания инкубации образовавшийся осадок (в виде геля) промывали 50 мМ трис-HCl буфером (рН 7.5) до отсутствия в промывных водах белка (контроль осуществляли на спектрофотометре СФ-2000 при λ=280 нм).
Содержание белка в иммобилизованных препаратах коллагеназы определяли методом Лоури [Lowry О.Н., Rosebrough N.J., Faar A.L., Randall R.J. Protein measurement with folin-phenol reagent // J. Biol. Chem. - 1951. - V. 193. - P. 265-275]. Определение протеолитической активности фермента проводили на субстрате азоказеине (Fluka). К 50 мг образца добавляли 200 мкл трис-HCl буфера (рН 7.5), 800 мкл азоказеина (0.5% в 50 мМ трис-HCl буфере, рН 7.5) и инкубировали 2 часа при 37°С. Далее добавляли 800 мкл ТХУ (5%), инкубировали 10 минут при -4°С, затем центрифугировали в течение 3 мин при 13000 об/мин для удаления негидролизованного азоказеина. К 1200 мкл супернатанта добавляли 240 мкл 3% NaOH для нейтрализации кислоты, после чего измеряли оптическую плотность опытной пробы при 410 нм в 1 см кювете. Контрольная проба содержала 800 мкл азоказеина, 800 мкл ТХУ, 50 мг образца и 200 мкл трис-HCl буфера. За единицу каталитической активности принимали количество фермента, которое в условиях эксперимента гидролизует 1 мкМ субстрата за 1 мин. Удельную протеолитическую активность коллагеназы рассчитывали по формуле:
ПА=D*1000/120/200/Ср,
где ПА - протеолитическая активность, мкМ/мин на 1 мг белка, D - оптическая плотность пробы при 410 нм, Ср - концентрация белка в пробе, мг/мл, измеренная по методу Лоури, 120 - время инкубации в минутах, 200 - объем пробы, 1000 - пересчет в мкМ.
Статистическую обработку полученных результатов проводили при уровне значимости 5% с использованием t-критерия Стьюдента.
На первом этапе экспериментов для получения гетерогенных биокатализаторов на основе коллагеназы, иммобилизованной путем включения в гель на основе сукцината хитозана и пищевого хитозана, в качестве иммобилизационной среды мы использовали 0.05 М ацетатные буферные растворы с рН в диапазоне от 4.0 до 5.8 и 0.05 М глициновые буферные растворы с рН в диапазоне от 8.6 до 10.5. Результаты для наиболее подходящих буферных систем отражены на фиг. 1-3.
Анализ содержания белка в гетерогенных препаратах показал, что наибольшее количество коллагеназы (в мг на г носителя), иммобилизованной путем включения в гель на основе пищевого хитозана, наблюдается при использовании глицинового буфера с рН 8.6. При иммобилизации на сукцинате хитозана количество коллагеназы оказалось выше при использовании глицинового буфера с рН 8.6, 9.5, 10.0, 10.5 и ацетатного буфера с рН 4.0, 5.5 (фиг. 1).
Общая активность (в ед на мл раствора) коллагеназы, иммобилизованной путем включения в гель на основе пищевого хитозана, оказалась выше при использовании глицинового буфера с рН 8.6-10.0 и ацетатного буфера с рН 5.8. При иммобилизации на матрице сукцината хитозана общая активность коллагеназы оказалась выше при использовании глицинового буфера с рН 9.0, 10.5, а также ацетатного буфера с диапазоном рН 5.5-5.8 (фиг. 2).
Наибольшую удельную активность показали препараты коллагеназы, иммобилизованные путем включения в гель на основе пищевого хитозана и сукцината хитозана при использовании 0.05 М глицинового буфера с рН 9.0 и 0.05 М ацетатного буфера с рН 5.8 (фиг. 3).
Метод иммобилизации путем включения коллагеназы в гель имеет ряд преимуществ над другими способами связывания фермента с матрицей носителя. Благодаря такому методу иммобилизации фермент фактически не прикреплен к носителю, следовательно, отсутствуют стерические препятствия, препарат защищен от многих неблагоприятных факторов среды, в т.ч. от инактивации вследствие бактериального заражения, также можно создавать иммобилизованные препараты любой геометрической конфигурации. Мы сравнили полученные результаты по определению каталитической активности и содержания белка для препаратов коллагеназы, иммобилизованных на матрицах сукцината хитозана и пищевого хитозана. Оптимальное соотношение содержания белка (мг на г носителя), общей активности (в ед на мл раствора) и удельной активности (в ед на мг белка) выявлено при иммобилизации коллагеназы путем включения в гель на основе пищевого хитозана или сукцината хитозана при применении в качестве иммобилизационной среды 0.05 М глицинового буфера с рН 9.0 или 0.05 М ацетатного буфера с рН 5.8. При использовании препаратов в медицине или аналитической практике необходим компромисс между высокой активностью и стабильностью катализатора.
Из вышеизложенного материала следует, что среди апробированных нами вариантов иммобилизации для создания гетерогенных препаратов на основе коллагеназы и хитозана наиболее перспективным является включение фермента в гель на основе сукцината хитозана или пищевого хитозана при использовании 0.05 М глицинового буфера с рН 9.0 или 0.05 М ацетатного буфера с рН 5.8.
Таким образом, была разработана методика получения гетерогенного биокатализатора на основе коллагеназы, иммобилизованной на матрице пищевого хитозана или сукцината хитозана путем включения в гель.
Способ получения препарата коллагеназы в геле на основе пищевого хитозана или сукцината хитозана, включающий иммобилизацию коллагеназы в буферном растворе на матрицу пищевого хитозана с молекулярной массой менее 100 кДа или сукцината хитозана в соотношении 20 мл раствора фермента в концентрации 1 мг/мл на 1 г носителя; в качестве буферного раствора для иммобилизации используют 0.05 М ацетатный буфер с рН 5.8 или 0.05 М глициновый буфер с рН 9.0; инкубирование при комнатной температуре с периодическим перемешиванием в течение 2 часов, промывку образовавшегося осадка 50 мМ трис-HCl буфером (рН 7.5) до отсутствия в промывных водах белка.