Результат интеллектуальной деятельности: Спироконденсированные производные 2,3-дигидроиндола, их применение в офтальмологии
Вид РИД
Изобретение
Изобретение относится к новым спироконденсированным производным 2,3-дигидроиндола, обладающих свойствами лигандов мелатонинового рецептора подтипов МТ1, МТ2 и фермента - хинонредуктазы 2 (МТ3), ингибиторов MT3 подтипа мелатониновых рецепторов и их применению для лечения офтальмологических заболеваний.
В настоящее время во многих странах выпускаются препараты мелатонина, которые либо являются лекарственными средствами, либо относятся к БАД. Известная лекарственная форма биогенного амина мелатонина (N-ацетил-5-метокситриптамин) - мелаксен, используется при нарушении сна у больных с нарушением мозгового кровообращения, применяется при комплексной противопухолевой терапии, при лечении артериальной гипертензии и нейродегенеративных заболеваний. Более широкому внедрению использования мелатонина является его быстрый метаболизм в организме, особенно в светлое время суток, а также не селективное действие, связанное с наличием в организме многочисленных сайтов связывания мелатонина. У животных выделяют 3 подтипа мелатониновых рецепторов: трансмембранные GPCR рецепторы МТ1 и МТ2 и низкоафинный рецептор МТ3, который согласно некоторым исследованиям представляет собой фермент - хинонредуктазу 2. Кроме того, мелатонин способен связываться с ядерными рецепторами ROR/RZR. Несмотря на многочисленные исследования, вопрос, какие именно физиологические функции мелатонин регулирует, до сих пор остается открытым.
Известно, что местное применение мелатонина в виде инстилляций оказывает эффективное действие при воспалительных заболеваниях сосудистой оболочки глаза различного генеза, часто затрагивающее и другие структуры глаза, в том числе, сетчатку, и приводящее к слепоте (см. Н. Б. Чеснокова и др. Эффективность местного применения мелатонина в виде инстилляций при экспериментальном увеите у кроликов, VIII Российский общенациональный офтальмологический форум, Сборник научных трудов научно-практической конференции с международным участием, под редакцией В.В. Нероева, Москва, 22-24 сентября, 2015, т. 2, стр. 929-933).
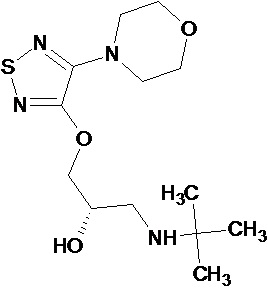
В EA005409B1 /A61K31/437, опубл. 24.02.2005/, описываются спироконденсированные производные бензамидопиперидина и способ их получения с использованием N-(1'-метил-5'-метокси-2'-оксоcпиро[циклоалкан-1,3'-индолин]-6'-ил]изоникотинамидов. Соединения обладают свойствами антагонистов NK-1 рецептора и могут быть использованы, например, для лечения глазных и офтальмологических заболеваний.
J. Benjamin Garcia-Vazquez et al. (Structure elucidation of configurational isomers of nitrile-substituted spirocyclopropyloxindoles by NMR spectroscopy, molecular modeling, and X-ray crystallography, Magnetic Resonance in Chemistry (2015), 53(12), 1061-1070) описывает диастереомерные чистые формы нитрилзамещенных спироциклопропилоксиндолов общей формулы
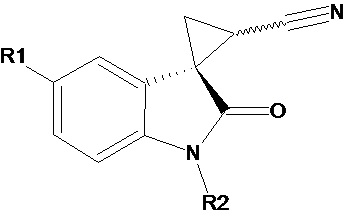
где R1 и R2 соответственно означают (а) R1 означает F, R2 означает Me; б) R1 означает F, R2 означает бензил; в) R1 означает F, R2 означает п-метоксибензил; г) R1 означает MeO, R2 означает бензил; д) R1 означает MeO, R2 означает п-метоксибензил; е) R1 означает Me, R2 означает Me. Описывается также способ их получения. Соединения могут быть использованы в качестве промежуточных продуктов и как соединения с биологическими и фармакологическими свойствами.
Marta S. Morales-Rios et al. (One -Pot synthesis of conformationally restricted spirooxindoles, Tetrahedron, 2007,63,7702-7707) описывает получение диастереомерных 1'-метил-2'-оксо-1',2'-дигидроспиро[С3-С7циклоалкан-1,3'-индол]-2-карбонитрилов, как соединений с биоактивной молекулой, имеющейся во множестве натуральных продуктов. Соединения получают по схеме
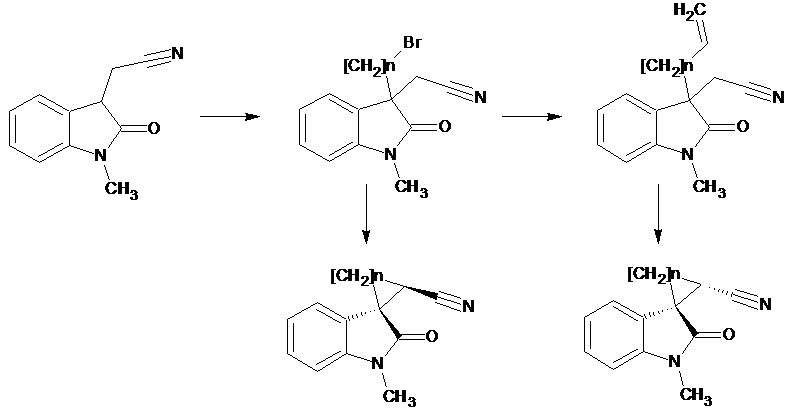
где n = 1, 2, 3, 4.
WO2013006738А1 /C07D401/12, опубл. 10.01.2013/ описывает 2'-оксоспиро[циклопропан-1,3'-индолин]карбоксамиды для получения гетероциклических соединений, которые могут быть использованы для лечения и профилактики вирусных заболеваний.
В WO201107039A2 /H01L33/00, опубл. 21.06.2012/ описываются стереоизомерные формы производных 2-фенил-1'-алкилспиро[циклопропан-1,3'-индолин]-2'-она в качестве медиаторов АМРК для лечения таких заболеваний, как ожирение, гиперглицемия, дилипидемия, диабет и рак.
WO 2004037247 А1 /C07D209/96, опубл. 06.05.2004/описывает производные спиро[циклопропан-1,3'-индолин]-2'-она для лечения вирусных заболеваний, в частности для лечения HIV инфекции, и способ их получения. Соединения соответствуют общей формуле
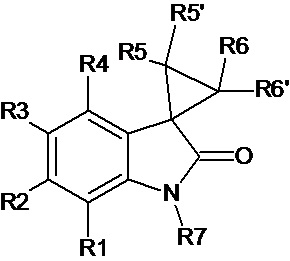
где R1, R2, R3 и R4 независимо выбираются из водорода, замещенного или незамещенного алкила, OR8, NO2, CN и галогена, R8 выбирается из H и замещенного или незамещенного алкила; R5 и R5’ независимо выбираются из Н, замещенного или незамещенного алкила, CN, SR9 и C(O)R9, где R9 независимо выбираются из Н, замещенного или незамещенного алкила, NR10R11 и OR1 l , где R10 независимо выбираются из Н, замещенного или незамещенного алкила и OR12, где R11 и R12 могут независимо выбираться из Н, замещенного или незамещенного алкила. R6 и R6’ независимо выбираются из Н, замещенного или незамещенного алкила и C(O)R16, где R16 может быть выбран из NR17R18 и OR17
Govindaraju Karthik et al. (Catalyst and solvent-free cyclopropanation of electron-deficient olefins with cyclic diazoamides for the synthesis of spiro[cyclopropane-1,3'-indolin]-2'-one derivatives. Tetrahedron Letters (2014), 55(51), 7064-7067) описывают способ получения 1',2'-дигидро-2'-оксоспиро[циклопропан-1,3'-индолин]-2-карбоновой кислоты и ее метилового эфира. Синтез проводят циклопропанированием диазосоединений по схеме: 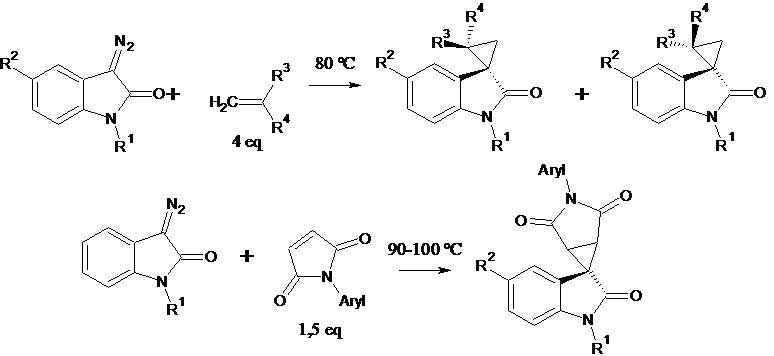
где R1 = H, Alk , R2 = Hal, Alk
Lozinskaya N.A. et al. (Syntheses of spiroindole melatonin analogues via 2-(indolin-3-ylidene)acetonitrile cycloadditions, Mendeleev Communications, 2014, 24 (5), р. 260-261) описывают синтез спироиндольных аналогов мелатонина путем циклоропанирования 2-(2-оксо-1,2-дигидро-3H-индол-3-илиден)ацетонитрилов с использованием диaзометана по следующей схеме
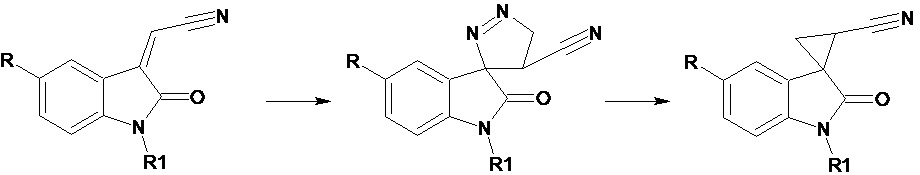
R - H, OMe, R1 - H.
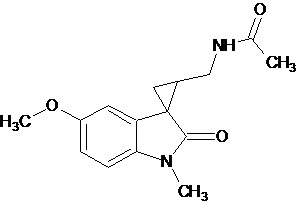
Gonzales-Juarex Daphne E et al. (Stereochemistry modulated the catalyst hydrogenolysis of nitrile-substituted cyclopropanes, Tetrahedron, 68 (35), 7187-7195) описывает региоселективный способ получения диастереомерных N-[[1’-метил-1’,2’-дигидро-2’-оксоспиро[циклопропан-1,3’-[3H]-индол]-2-ил]метил]ацетамида, которые могут быть замещены в положении 5 индола метокси-группой. Синтез осуществляют путем каталитического гидрогенолиза син-диастереомеров соответствующих нитрилзамещенных спироциклопропилоксиндолов.
Известно, что активация мелатониновых рецепторов глаза дает начало сигнальному каскаду, вызывающему снижению внутриглазного давления, что важно для лечения и профилактики глаукомы.
Учитывая большой потенциал аналогов лигандов мелатониновых рецепторов, разработка новых мелатониновых лигандов различных подтипов и их синтез, а также изучение активности является актуальной задачей.
Настоящее изобретение относится к изысканию и разработке способа получения новых спироконденсированных производных индолинона, обладающих свойствами лигандов подтипов МТ1, МТ2 и МТ3 (фермента хинонредуктазы 2) мелатонинового рецептора и к их применению для лечения офтальмологических заболеваний, в частности для лечения глаукомы.
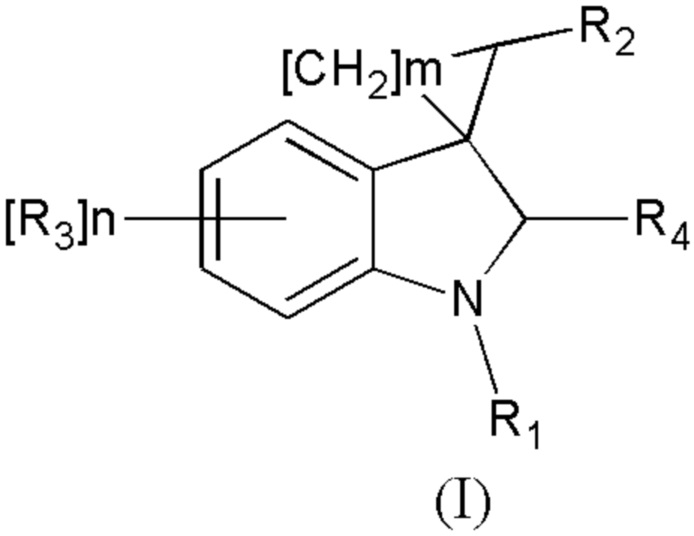
Спироконденсированные производные индолинона настоящего изобретения соответствуют общей формуле (I) или их стереоизомеры и фармацевтически приемлемые соли,
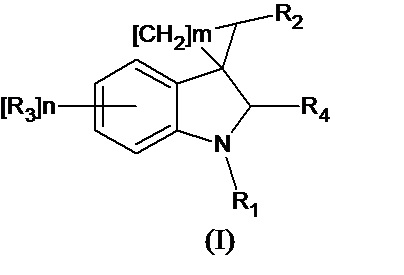
где R1 означает H, С1-С4алкил, бензил;
R2 означает -CH2NH(CO)СН3 (при условии, что R3 не означает Н, 5-метокси, 5-бром или 6,7-диметил), -CH2NH(CO)С2-С4алкил, -CH2NH(CO)С3-С6циклоалкил, - CH2NH(CO)С1-С4алкокси, -CH2NH(CO)галоалкил; -CH2NH(CO)(6-членный арил); - CH2NH(CO)(5-6-членный гетероарил), содержащий 1-2 атома кислорода, азота или серы;
R3 означает Н, галоген, С1-С4алкокси, С1-С4алкил, -NHС(О)С1-С4алкил,-NHC(O)OC1-C4алкил, -NH(CO)(6-членный арил); -NH(CO)(5-6-членный гетероарил), содержащий 1-2 атома кислорода, азота или серы; -NHС(О)-С3-С6циклоалкил, -NHС(О)СF3;
R4 означает =О, H2
n означают целое число от 1 по 2,
m означают целое число 1, 4.
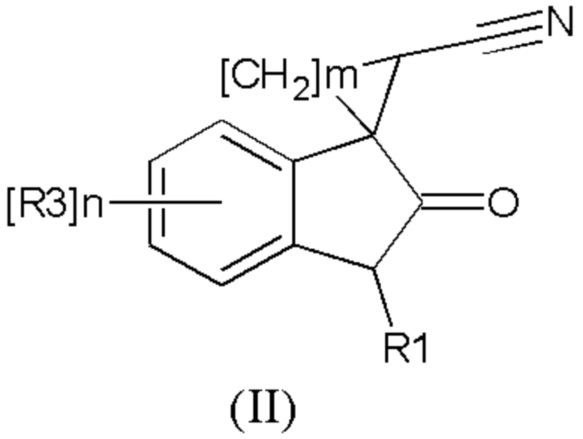
Изобретение также относится к применению соединения общей формулы (II) или его стереоизомеров и фармацевтически приемлемых солей,
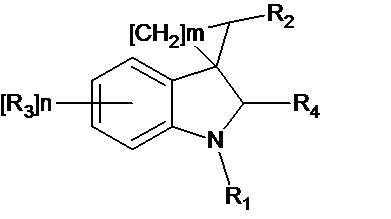
(II)
где R1 означает H, С1-С4алкил, бензил;
R2 означает -CH2NH(CO)С1-С4алкил,- -CH2NH(CO)С3-С6циклоалкил, - CH2NH(CO)С1-С4алкокси,- -CH2NH(CO)СF3; -CH2NH(CO)(6-членный арил); - CH2NH(CO)(5-6-членный гетероарил), содержащий 1-2 атома азота, кислорода или серы; CN; СOR5, где R5 означает OH, OС1-С4алкил, NH2, N(С1-С4алкил)2
R3 означает Н, галоген, С1-С4алкокси, С1-С4алкил, С1-С4галоалкил, -NHС(О)С1-С4алкил,-NHC(O)OC1-C4алкил, -NH(CO)(6-членный арил); -NH(CO)(5-6-членный гетероарил), содержащий 1-2 атома азота, кислорода или серы; -NHС(О)-С3-С6циклоалкил, -NHС(О)галоалкил;
R4 означает =О или H2
n означают целое число от 1 по 2,
m означают целое число 1, 4.
в качестве лекарственного средства для лечения и профилактики офтальмологических заболеваний, например, при глаукоме.
Изобретение также относится к фармацевтической композиции, включающей эффективное количество соединения формулы (I) и традиционно применяемые для лечения офтальмологических заболеваний эксципиенты, такие как растворитель или носитель, консерванты.
Композиция может быть выполнена в виде капель. Растворяющей средой может быть вода. Композиция может также содержать, например, физиологически толерантный буфер, полиэтиленгликоль.
Способ получения соединений формулы (I), где R4 означает =О, R2 означает -NH(CO)С1-С4алкил, -NH(CO)С3-С6циклоалкил, -NH(CO)С1-С4алкокси, -NH(CO)СF3; -NH(CO)6-членный арил; -NH(CO)5-6-членный гетероарил, содержащий 1-2 атома азота или серы, заключается в том, что проводят селективное восстановление нитрильной группы в соответствующем соединении формулы (II), где R4 означает =О, R2 означает CN водородом на катализаторе в среде карбоновой кислоты R6COOH с одновременным ацилированием образующегося амина при добавлении ангидрида соответствующей кислоты (R6CO)2O или R6C(O)Hal, для получения ацилированного амина согласно следующей схеме:
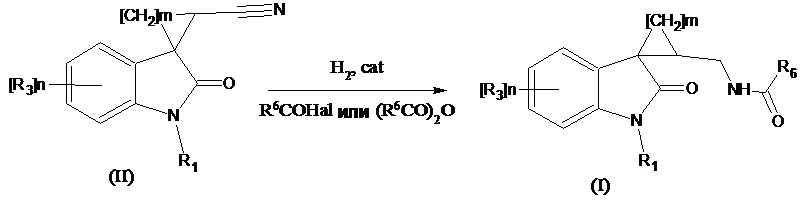
где значения R1, R3, m и n указаны выше, R6 означает -С1-С4алкил, -С3-С6циклоалкил, -С1-С4алкокси, -СF3; -6-членный арил; –5-6-членный гетероарил, содержащий 1-2 атома азота или серы, cat означает PtO2, Pt, Pd, в том числе и на инертном носителе. Способ позволяет получать продукты с высоким выходом с отсутствием побочных реакций. При проведении синтеза в указанных условиях можно проводить восстановление нитрилов, содержащих несколько амидных групп.
Получение соединений формулы (I), где R4 означают =О, R2 означает -NH(CO)С1-С4алкил, -NH(CO)С3-С6циклоалкил, -NH(CO)С1-С4алкокси, -NH(CO)СF3; -NH(CO)6-членный арил; -NH(CO)5-6-членный гетероарил, содержащий 1-2 атома азота или серы, также можно проводить восстановлением нитрильной группы в соответствующем соединении формулы (II) где R4 означает =О, R2 означает CN боргидридом металла в присутствии безводного хлорида никеля, с последующим ацилированием образующегося амина при добавлении ангидрида кислоты (R6C(O))2O или R6C(O)Hal согласно схеме:
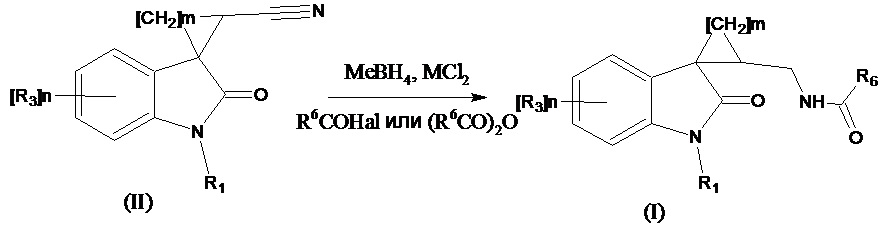
где значения R1, R3, m и n указаны выше, R6 означает -С1-С4алкил, -С3-С6циклоалкил, -С1-С4алкокси, -СF3; -6-членный арил; –5-6-членный гетероарил, содержащий 1-2 атома азота или серы, Me означает Li, Na, K, Al и др, Me означает Ni, Co. Этот способ позволяет более широко варьировать ацилирующие агенты.
Получение соединений формулы (I), где R4 означает Н2, проводится восстановлением соединений формулы (II), где R4 означает =О, R2 означает CN боргидридом металла в присутствии иода в среде безводного растворителя, с добавлением соответствующего ацилирующего агента (R6CO)2O или R6COHal согласно следующей схеме:
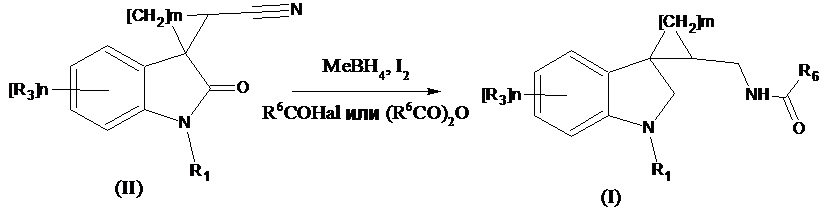
где значения R1, R3, m и n указаны выше, R6 означает -С1-С4алкил, -С3-С6циклоалкил, -С1-С4алкокси, -СF3; -6-членный арил; -5-6-членный гетероарил, содержащий 1-2 атома азота или серы Me означает Li, Na, K, Al и др. Соединение формулы (I’), где R3 означает метокси-группу, R1 означает метил, R2 означает -С1-С4алкил может быть также получено при длительном хранении соединения формулы (III) при 25°С в течение 10-30 дней в диметилсульфоксиде по схеме:
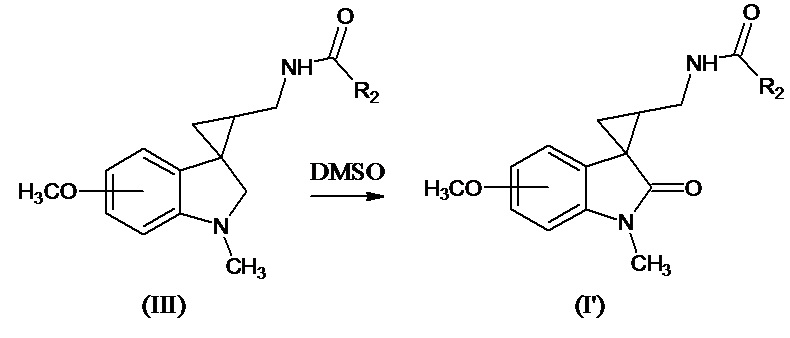
Стереоизомеры соединений формулы (I) получают методом стереоселективного каталитического гидрогенолиза соответствующего нитрила с последующим ацилированием образующегося амина при добавлении ангидрида кислоты (R6C(O))2O или R6C(O)Hal.
Для получения соединений формулы (I), где R3 означает группу -NHС(О)С1-С4алкил, -NHC(O)OC1-C4алкил, -NHC(O)NHC1-C4алкил, -NHC(O)6-членный арил; -NHC(O)5-6-членный гетероарил, содержащий 1-2 атома азота, кислорода или серы; -NHС(О)-С3-С6циклоалкил, -NHС(О)СF3 используют соединение формулы (II), где R3 означает нитрогруппу, где R4 означает =О, R2 означает CN. При этом проводят сначала каталитическое восстановление нитрогруппы под действием водорода. После этого в полученном соединении восстанавливают нитрильную группу, в условиях, указанных выше, с одновременной модификацией полученного амино-соединения.
Одним из предпочтительных способов является способ получения соединений формулы (II), где m =1, заключающийся в циклоприсоединении избытка диазометана к соединению (III), с последующим термическим разложением образующихся спиродиазолинов формулы (IV). Способ осуществляют по следующей схеме 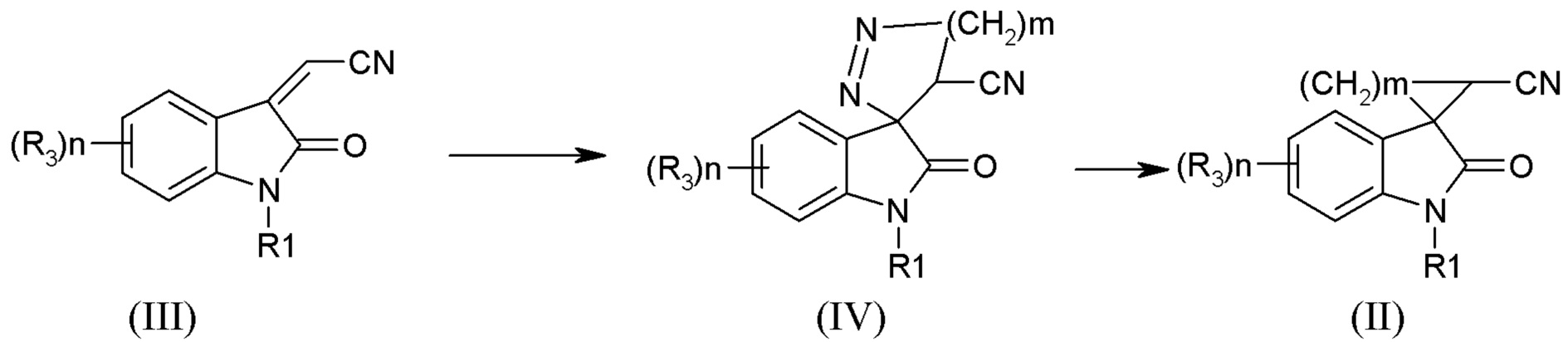
где R1 означает H, С1-С4алкил, бензил,
R3 означает Н, галоген. С1-С4алкил, С1-С4алкокси, галоген, нитро.
Соединение формулы (II), где R1 означает H, подвергают алкилированию или бензилированию соответствующим галогенидом, преимущественно иодидом в присутствии гидрида щелочного металла.
Вышеуказанный способ предпочтителен для получения нитрилов спироциклопропан-индолов формулы (III), из которых затем получают наиболее предпочтительные соединения формулы (I) согласно схеме
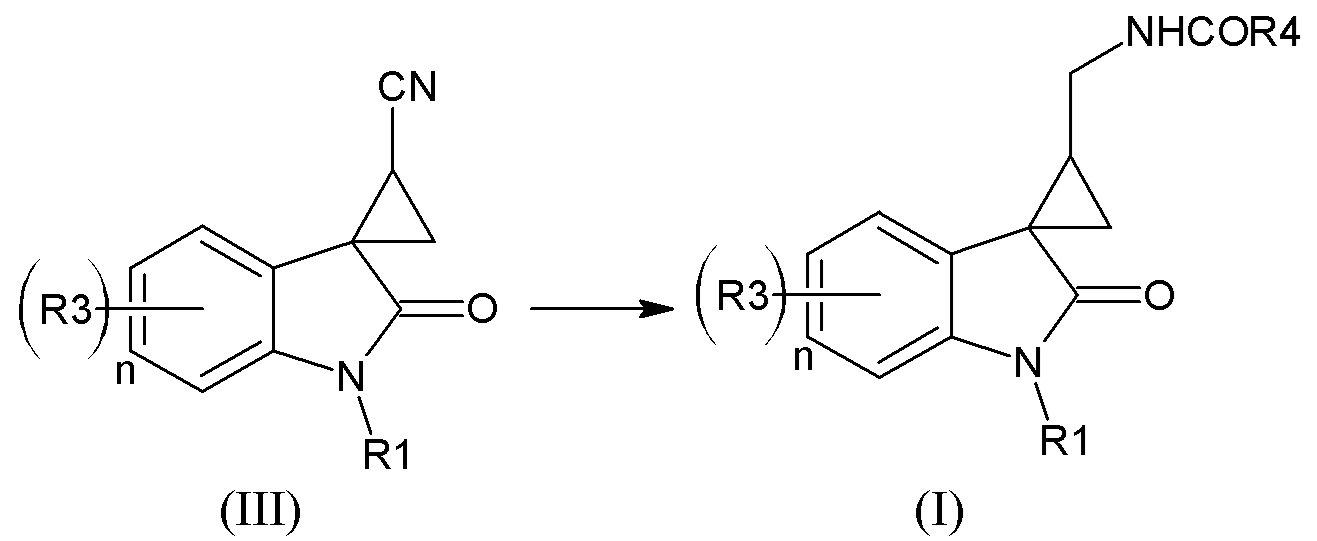
Для получения соединений формулы (II) со значением m=1, 4 также может быть использован метод спироциклизации описанный в Marta S. Morales-Rios et al. Способ заключается в алкилировании 2-(1-алкил-2-оксо-2,3-дигидроиндол-3-ил)ацетонитрила соответствующим дигалогеналканом в присутствии гидрида щелочного металла в диметилформамиде при комнатной температуре, с последующей циклизацией полученного соответствующего ацетонитрила замещенного в положении 3 индола галогеналкильной группой.
Либо может быть использован способ циклоприсоединения соответствующих диенов с терминальной алкеновой группой к циан(2-оксиндолин-3-илиден)уксусной кислоте в присутствии иодида цинка или без него, с последующим декарбоксилированием и восстановлением ненасыщенной двойной связи.
Соединения формулы (II) могут быть получены в виде стереомерных форм cо стереоселективной конфигурацией и превращены в соединения формулы (I) путем региоселективного каталитического гидрогенолиза.
Для определения конфигурации были использованы данные 1H-ЯМР-спектроскопии.
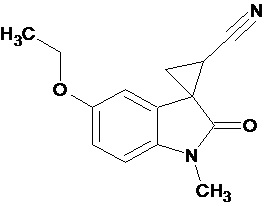
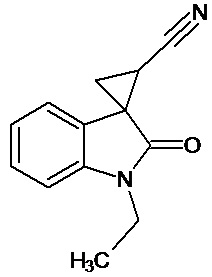
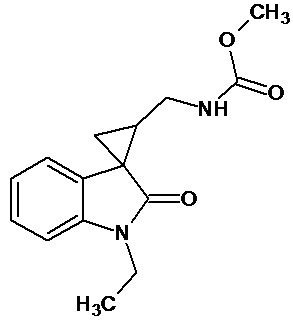
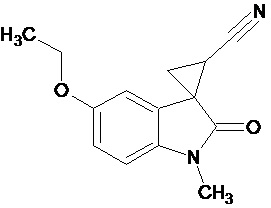
Пример 1. Получение 1'-метил-5'-этокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила.
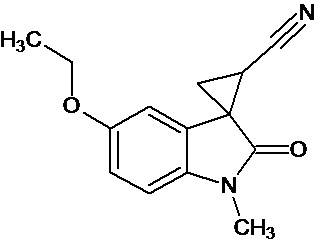
В колбу помещали раствор 0,22 моль гидроксида калия в 33 мл воды и 100 мл диэтилового эфира, прибавляли небольшими порциями 0,074 моль N-нитрозометилмочевины. К 0,0065 моль 1-метил-5-этокси-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила прибавили, фильтруя через слой безводного сульфата натрия, полученный раствор диазометана. Смесь перемешивали в течение 12-ти часов при комнатной температуре и кипятили в 30 мл толуола 8 часов. В результате был получен продукт в виде бежевого порошка. Выход составил 78%.
Спектр ЯМР 1Н (СDCl3, δ, м.д., J, Гц): 1.53(т, J = 5.0, 3Н), 1,88 (дд., J = 5,0, 6,8, 1Н), 2,14 (дд., J = 4,9, 9.35, 1H), 2,46 (дд., J = 6,9, 9,35, 1H), 3,29 (с., 3Н), 3,82 (кв., J = 5.0, 2Н), 6,82 (д., J = 2,26, 1H), 6,87 (д., J = 8,59, 1H), 6,92 (дд., J = 2,28, 8,46, 1H).
Спектр ЯМР 13С (СDCl3, δ, м.д.): 14,75, 15.25, 21,29, 26,66, 31,92, 55,81, 108,24, 109,08, 113,22, 116,93, 137,50, 156,03, 172,51.
Пример 2. Получение 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила
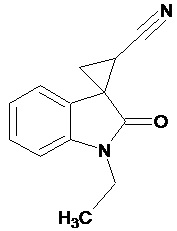
В колбу помещали раствор 15,2 г (0,27 моль) гидроксида калия в 41 мл воды и 124 мл диэтилового эфира, прибавляли небольшими порциями 7,5 г (0,085 моль) N-нитрозометилмочевины. К 1,5 г 1-этил-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила прибавили, фильтруя через слой безводного сульфата натрия, полученный раствор диазометана. Смесь перемешивали в течение 12-ти часов при комнатной температуре и кипятили в 30 мл толуола 8 часов. В результате реакции был получен продукт в виде светло-бежевого порошка. Выход составил 0,94 г (58%).
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 1.57 (т, J = 5, 3Н), 1,91 (дд., J = 5,05, 6,82, 1Н), 2,14 (дд., J = 5,06, 9,48, 1H), 2,45 (дд., J = 7,07, 9,46, 1H), 3,31 (кв, J = 5, 2Н), 6,98 (д., J = 7,71, 1H), 7,16 (т., J = 7,45, 1H), 7,22 (д., J = 6,83, 1H), 7,40 (т., J = 7,48, 1H).
Спектр ЯМР 13С (ДМСО-d6, δ, м.д.): 14,81, 15.28, 21,34, 26,88, 31,73, 108,71, 116,91, 118,88, 120,93,120,90, 128,85, 144,14, 172,96.
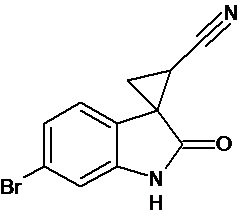
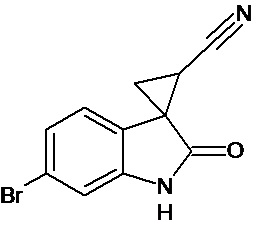
Пример 3. Получение 6'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила
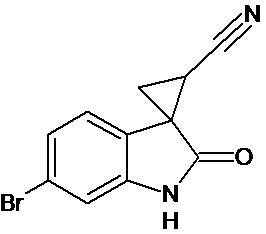
Аналогично примеру 1, используя 0,0027 моль 6-бром-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила получали 1'-метил-6'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрил с выходом 78%.
Спектр ЯМР 1Н (СDCl3, δ, м.д., J, Гц): 1,89 (дд., J = 5,1, 7.0, 1Н), 2,18 (дд., J = 4,9, 9.5, 1H), 2,5 (дд., J = 7.0, 9,5, 1H), 7.01 (д., J = 2,16, 1H), 7.25 (д., J = 8,7, 1H), 7.34 (дд., J = 2,16, 8,7, 1H), 9,89 (с, 1Н).
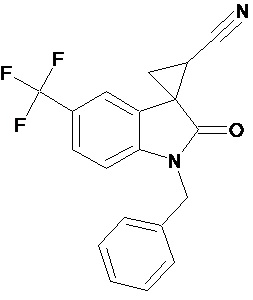
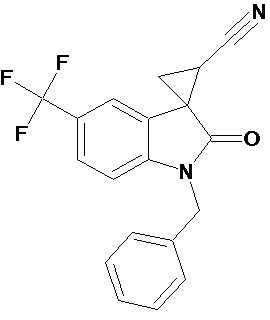
Пример 4. Получение 1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила
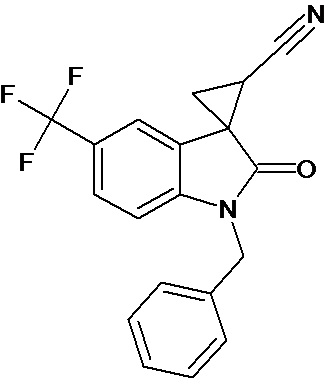
Аналогично примеру 1, используя 0,008 моль 1-бензил-5-трифторметил-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила получали 1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3’-индол]-3-карбонитрил с выходом 90%.
Спектр ЯМР 1Н (СDCl3, δ, м.д., J, Гц): 1,90 (дд., J = 5,0, 6,2, 1Н), 2,10 (дд., J = 4,9, 9.33, 1H), 2,5 (дд., J = 6,2, 9,33, 1H), 3,30 (с., 3Н), 4,8 (с, 2Н), 8.17 (д., J = 2,2, 1H), 7.31 (д., J = 8,59, 1H), 7,36 (м, 2Н), 7,45 (м, 3Н), 7.69 (дд., J = 2,2, 8,46, 1H), 8.17 (д., J = 2,2, 1H).
Спектр ЯМР 13С (СDCl3, δ, м.д.): 14,75, 15.25, 21,29, 26,66, 31,92, 44.82, 55,81, 108,24, 109,08, 113,22, 116,93, 122 (кв, J = 313), 124,39, 127,42, 128.54, 137,50, 156,03, 172,51.
Пример 5. Получение 6',7'-Диметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила и 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила 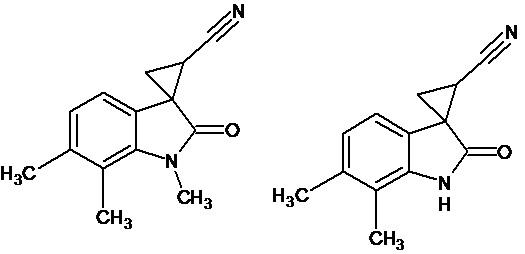
В колбу помещали раствор 0,18 моль гидроксида калия в 27 мл воды и 80 мл диэтилового эфира, прибавляли небольшими порциями 0,06 моль N-нитрозометилмочевины. К 0,006 моль 6,7-диметил-2-оксо-2,3-дигидро-1Н-индол-3-илиден-3-ацетонитрила прибавили, фильтруя через слой безводного сульфата натрия, полученный раствор диазометана. Смесь перемешивали в течение 12-ти часов при комнатной температуре и кипятили в 25 мл толуола 8 часов. Полученная в результате смесь продуктов была разделена методом колоночной хроматографии. Таким образом, были выделены следующие продукты:
1) Продукт 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила в виде белого порошка. Rf=0,25 (Элюент петролейный эфир: этилацетат 8:2). Выход составил 0,3 г (25%). Характеристики полученного вещества полностью совпадают с характеристиками продукта.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 1,80** (д.д., J = 5,0, 6,95, 1Н), 1,89* (д.д., J = 4.9, 9.2, 1H), 2.05** (д.д., J = 4,5, 9,4, 1H), 2.10* (д.д., J = 2,28, 5,05, 1H), 2,24* (д.д., J = 7,3, 9,1, 1H), 2,30** (с., 3Н), 2,32*(с., 3Н), 2,36** (д.д., J = 6,9, 9,4, 1H), 3,55** (с., 3Н), 3,59*(с., 3Н), 6,53* (д., J = 7,46, 1H), 6,84* (д., J = 7,46, 1H), 6,89** (д., J = 7,50, 1H), 6,94** (д., J = 7,50, 1H); ** - основной диастереомер, * - минорный диастереомер. Согласно спектру ПМР, соотношение диастереомеров составляет 3:1.
Спектр ЯМР 13С (ДМСО-d6, δ, м.д., J, Гц): 13,96, 15,09, 20,84, 21,26, 30,87, 38,65, 117,94, 119,70, 124,18, 129,69, 130,91, 138,62, 142,12, 173,98.
Элементный анализ: найдено (%): С 74,40, Н 6,36, N 12,42, вычислено для С14Н14N2О (%): С 74.31, Н 6.24, N 12.38.
1) Продукт 6',7'-диметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрил в виде бежевого порошка. Rf=0,1 (Элюент петролейный эфир: этилацетат 8:2). Выход составил 0,378 г (34%).
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 1,87 (дд., J = 5,05, 6,72, 1Н), 2,12 (дд., J = 4,93, 9,48, 1H), 2,23 (с., 3Н), 2,32 (с., 3Н), 2,44 (дд., J = 6,95, 9,47, 1H), 6,94 (д., J = 2,5, 2H), 9,87 (с., 1Н).
Спектр ЯМР 13С (СDCl3, δ, м.д.): 13,21, 14,80, 19,89, 20,94, 35,72, 118,04, 119,18, 123,88, 137,75, 138,71, 140,85, 142,10, 176,28.
Селективное восстановление нитрильной группы с одновременным ацилированием, типовые методики
Метод А. Исходный ацетонитрил гидрируют водородом в присутствии катализатора PtO2 и уксусного ангидрида при атмосферном давлении и комнатной температуре в растворе ледяной уксусной кислоты. Об окончании реакции судят по изменению объема затраченного на гидрирование водорода. По окончании реакции отфильтровывают осадок платинового катализатора и удаляют избыток уксусной кислоты в вакууме роторного испарителя. Остаток нейтрализуют насыщенным раствором гидрокарбоната натрия и экстрагируют хлористым метиленом.
Метод В. Исходный ацетонитрил растворяют в метаноле, в раствор вносят расчетное количество уксусного ангидрида и безводного хлорида никеля, затем при охлаждении медленно прибавляют боргидрид натрия. Реакционную смесь оставляют при интенсивном перемешивании на 4 суток. По окончании реакции избыток метанола удаляют в вакууме роторного испарителя, осадок промывают насыщенным раствором карбоната калия и экстрагируют хлористым метиленом.
По данным методикам были получены следующие соединения:
Пример 6. Получение N-[1'-метил-5'-этокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-ил-метил]ацетамида.
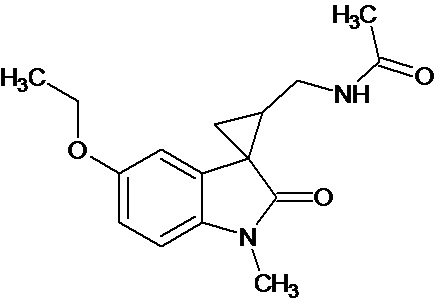
В смесь 0,485 ммоль 1'-метил-5'-этокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила, 25 мл ледяной уксусной кислоты, 0,98 ммоль уксусного ангидрида, 0,00004 моль PtO2 пропускают водород при атмосферном давлении и комнатной температуре в течение 4-х часов(до прекращения поглощения водорода. Продукт частично выпадает в осадок. Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход продукта 89%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,55 (т, J=5, 3H), 1,95 (с, 3Н); 1,98-2,09 (м, 1Н); 2,17-2,24 (м, 1Н); 3,41-3,51 (м, 2Н); 3,21 (с, 3Н), 3,77 (кв, 2Н); 6,58 (ушир. с, 1Н, NH); 6,72-6,75 (дд, J = 10,6, J = 6,4, 1Н); 6,79-6,81 (д, J = 8,4, 1Н); 6,9 (с, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 15.32, 23,04, 29,94, 36,96, 44,75, 47,56, 55,76, 110,38, 111,09, 112,75, 130,59, 135,01, 155,76, 170,82, 180,47.
Пример 7. Получение метил [1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]карбамат.
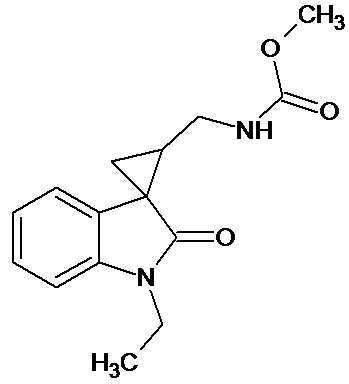
Перемешивали при комнатной температуре в течение 4 суток 0,00054 молей 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила, 10 мл метанола, 14 мл метилхлороформата, 0,00012 ммоль свежеприготовленного безводного NiCl2, 0,0053 моль NaBH4. Добавляли дополнительно 2 раза в сутки по 0,0024 ммолей NaBH4. Выход продукта 66%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,28 (т, J=5, 3H), 1,90 (с, 3Н); 1,96-2,1 (м, 1Н); 2,18-2,27 (м, 1Н); 3,40-3,50 (м, 2Н); 3,21 (кв, 2Н); 3,76 (c, 3Н); 6,87 (ушир. с, 1Н, NH); 6,92 (дд, J = 10,6, J = 6,4, 1Н); 7.1 (д, J = 8,4, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 15.43, 22,04, 30,01, 44,75, 47,56, 58.75, 111,38, 110,2, 113,82, 130,74, 136,01, 154,53, 171,09, 181,64.
Пример 8. Получение N-[1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]ацетамида
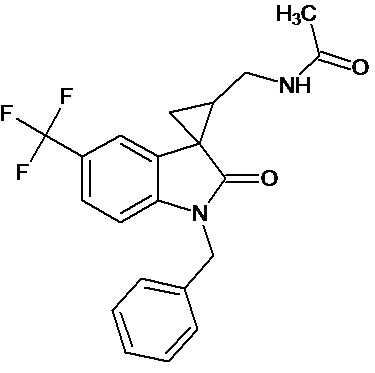
0,0039 моль 1'-бензил-5'-трифторметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила растворяли в 15 мл уксусной кислоты, и добавляли 0,069 моль уксусного ангидрида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход продукта 76%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.84 (м, 1H), 1,18 (м, 1H), 1,51 (м, 1Н); 2.18 (с, 3Н); 3.14 (м, 2Н); 3,21 (кв, 2Н), 4,8 (с, 2Н), 6,87 (ушир. с, 1Н, NH); 6.92 (дд, J=6,2, 2.3, 1 Н), 7,23-7,59 (м, 5Н), 7.98 (д, J = 2.3, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 22.32, 23.43, 25,04, 32,05, 41.97, 45,72, 47,56, 111,38, 110,2, 113,82, 122,43 (кв, J= 312), 124,39, 127,42, 128.54, 130,74, 136,01, 154,53, 176,15, 189,25.
Пример 9. Получение N-[1'-метил-5'-трифторацетамидо-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]трифторметилацетамида
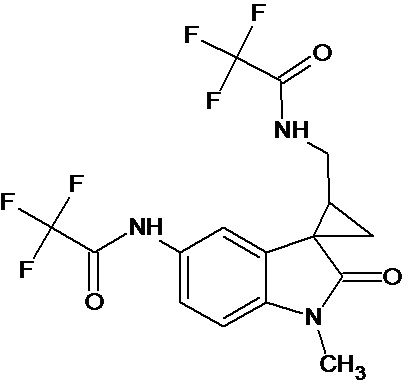
0,0021 моль 1'-метил-5'-нитро-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила растворяли в 15 мл трифторуксусной кислоты, и добавляли 0,069 моль трифторуксусного ангидрида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход N-[1'-метил-5'-трифторацетамидо-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]трифторметилацетамида 45%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0.96 (м, 1H), 1,37 (м, 1H), 1,72 (м, 1Н); 3.17 (с, 3Н), 3.46 (м, 2Н), 6,87 (ушир. с, 1Н, NH); 6.89 (дд, J=7,2, 2.1, 1 Н), 7,91 (д, J=7,2, 1Н), 8.37 (д, J = 2.1, 1Н), 8.45 (с, 1Н), 8, 47(с, 1Н)
Спектр 13С (CDCl3, δ, м.д., J, Гц): 19.15, 28.10, 29,47, 31,80, 37.97, 109,56, 116,82 (кв, J= 247), 117,43 (кв, J= 247), 120,32, 125,36, 128.96, 135,61, 138,14, 155,53 (кв, J= 162), 157,093 (кв, J= 162), 176,4.
Пример 10. Получение N-[1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]циклопропанкарбоксамида
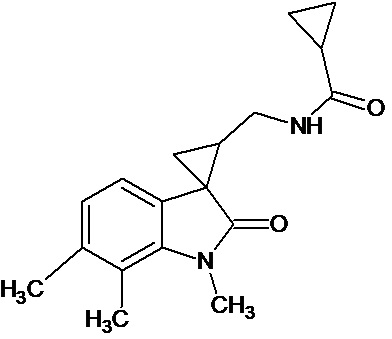
Аналогично примеру 8, используя 0,0028 моль 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрил получают N-[1',6',7'-триметил -2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]циклопропанкарбоксамида с выходом 78%.
Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J, Гц): 0,82-0,89 (м, 4Н), 1,69 (м, 1Н), 1,87 (дд., J = 5,05, 6,72, 1Н), 2,12 (дд., J = 4,93, 9,48, 1H), 2,23 (с., 3Н), 2,26 (с., 3Н), 3.26 (с., 3Н), 6,54 (д, J = 6,95, 1H), 7.11 (д., J = 6,95, 2H).
Спектр ЯМР 13С (СDCl3, δ, м.д.): 13,21, 14,80, 19,89, 20,94, 35,72, 118,04, 119,18, 123,88, 137,75, 138,71, 140,85, 142,10, 176,28.
Пример 11. Получение N-[1'-бензил-5'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]бензамида
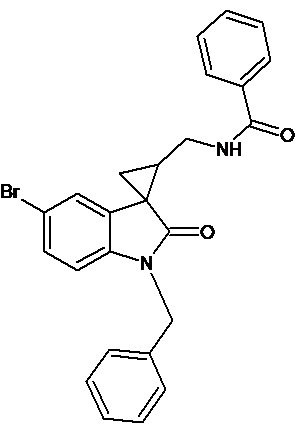
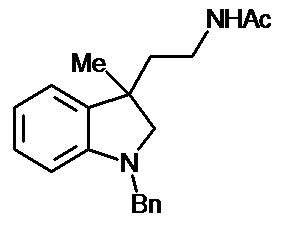
Аналогично примеру 7, используя 0,00054 моль 1'-бензил-5'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-ил]-3-карбонитрила и бензоил хлорид получали N-[1'-метил-6'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-бензамид с выходом 45%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,78-1,99 (м, 1Н); 2,15-2,21 (м, 1Н); 3,41-3,51 (м, 2Н); 4,82 (с, 2Н), 3,77 (кв, 2Н); 6,58 (ушир. с, 1Н, NH); 6,73 (дд, J = 9,6, J = 2.01, 1Н); 7.23-7.29 (м, 11Н); 7.59 (д, J = 2.01,1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 24,04, 28,84, 42,91, 44,75, 45,56, 113,09, 114,75, 124,92, 126,45, 128,37, 128,54,130,98, 131,38, 134,77, 135,01, 137,29, 140,49, 166,82, 176,15.
Пример 12. Получение N-[1'-метил-5'-фураноиламидо-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]фураноиламида
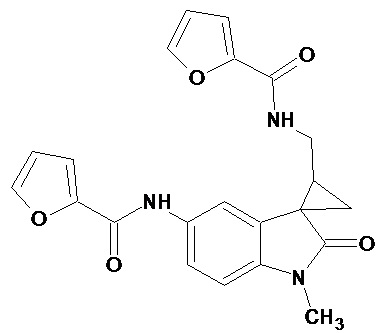
0,0021 моль 1'-метил-5'-нитро-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-карбонитрила растворяли в 15 мл фуранкарбоновой кислоты, и добавляли 0,069 моль фураноил хлорида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход N-[1'-метил-5'-фураноиламидо-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]фураноиламида 35%.
Спектр ЯМР 1H (CDCl3, δ, м.д., J, Гц): 0.96 (м, 1Н), 1,37 (м, 1Н), 1,72 (м, 1Н); 3.17 (с, 3Н), 3,31-3.39 (м, 2Н), 6,43 (ушир. с, 1Н, NH); 6.49 (м, 2 Н), 6,99 (д, J=8.7, 1Н) 7,38-7,42 (м, 2Н), 7,58 (дд, J=8.7, J=2.1Н), 8.14 (с, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 19.15, 28.10, 29,47, 31, 80, 38.79, 109,56, 110,70, 111,53, 114,33, 114,67, 118,24, 123,13, 133,59, 138,28, 142,00, 143,12, 147,78, 149,46, 171,10, 173,11, 176,40
Пример 13.1 Получение N-(2-циан-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-ил)ацетамида
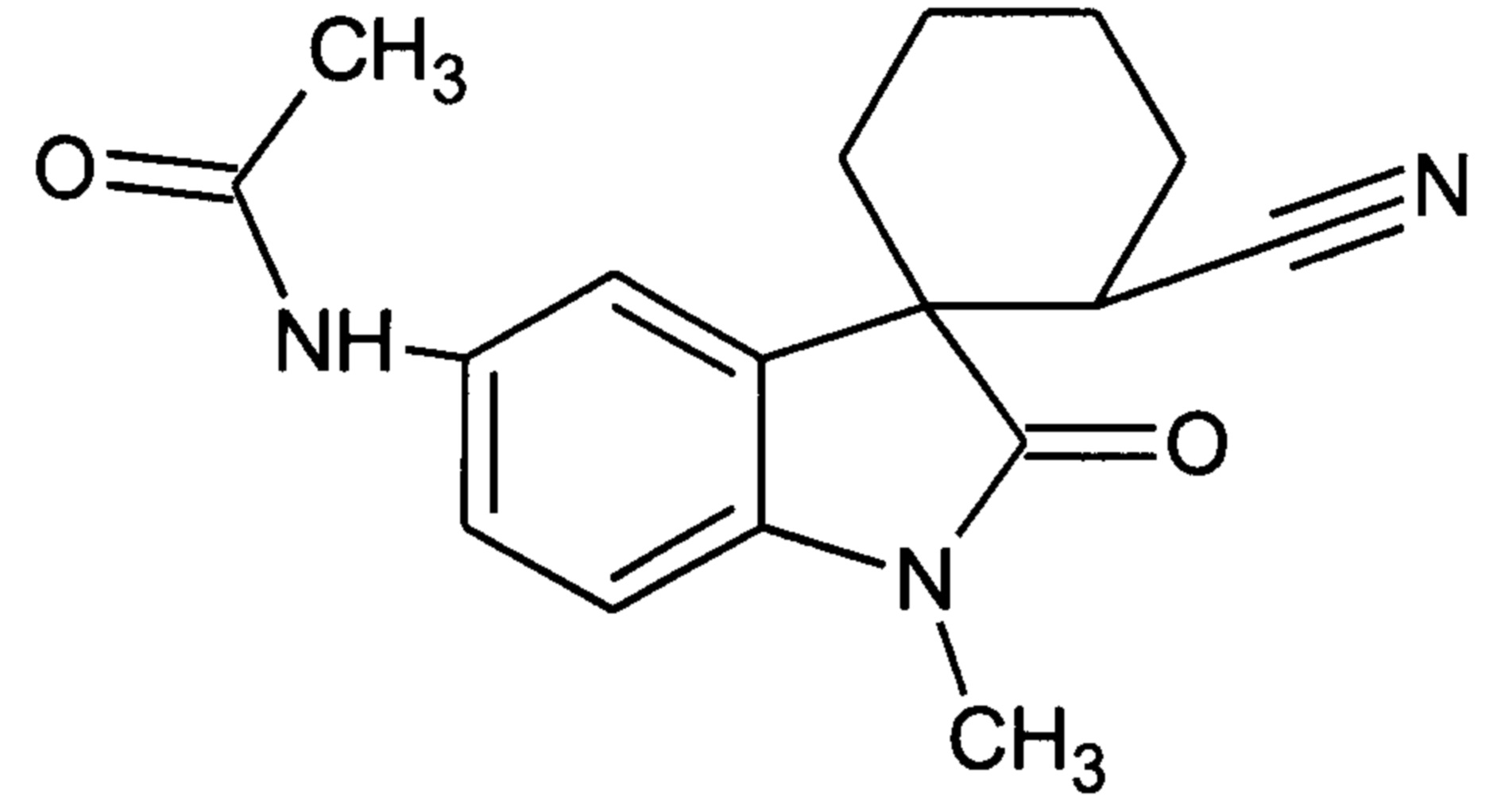
0,121 ммоль Pd/C (10%-ный), добавляли к раствору 2,42 ммоль (1'-метил-5'-нитро-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-3-ил)карбонитрила в этилацетате. Смесь перемешивали при 70°C в атмосфере водорода в течение 48 часов. Катализатор отфильтровывали и получали продукт с выходом 67%. Полученный амин обрабатывали в уксусной кислоте ацетилхлоридом или уксусным ангидридом и получали N-(2-циан-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-илацетамид с выходом 82%.
Спектр ЯМР 1H (CDCl3, δ, м.д., J, Гц): 1,64-1,75 (м, 4Н), 1,92-2,13 (м, 4Н), 2,12 (с, 3Н), 2, 49-2, 53 (м, 1Н); 3.17 (с, 3Н), 6,43 (ушир. с, 1Н, NH); 7.04 (д, J=8.7, 2 Н), 7.62 (дд, J=8.7, J=2.1Н 1Н), 8.12 (д, J=2.1H, 1H).
Спектр 13C (CDCl3, δ, м.д., J, Гц): 23,98, 24,69, 25,78, 28.10, 29,25, 31,80, 32.33, 54,14, 109,30, 122,35, 124,26, 129,65, 133,46, 138,28, 142,95, 168,15, 177,19
Пример 13.2 Получение N-(2-(ацетиламинометил)-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-ил)ацетамида
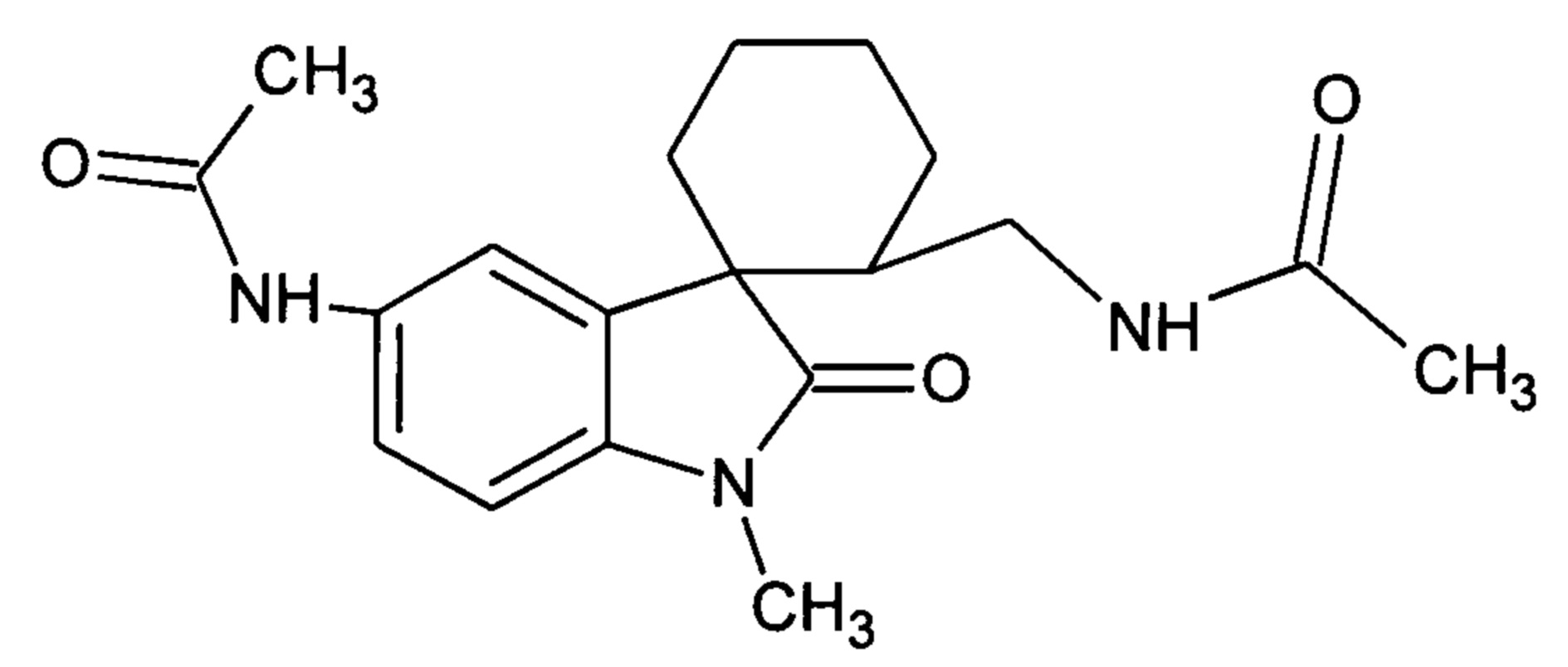
0,0021 моль N-(2-циан-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-ил)ацетамида растворяли в 15 мл уксусной кислоты, и добавляли 0,069 моль уксусного ангидрида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход N-(2-(ацетиламинометил)-1'-метил-2'-оксо-1',2'-дигидроспиро[циклогексан-1,3'-индол]-5'-ил)ацетамида 35%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,64-1,75 (м, 4H), 1,92-2,13 (м, 4H), 2,12 (с, 3Н), 2,49-2,53 (м, 1Н); 3.17 (с, 3Н), 6,43 (ушир. с, 1Н, NH); 7.04 (д, J = 8.7, 2 Н), 7.62 (дд, J = 8.7, J = 2.1Н 1Н), 8.12 (д, J = 2.1Н, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 23,98, 24,69, 25,78, 28.10, 29,25, 31,80, 32.33, 36,11, 54,14, 109,30, 121.45, 122,35, 128,79, 134,99, 142,05, 168,15, 170,71, 175.57
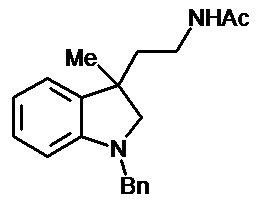
Пример 14. N-{1'-метил-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
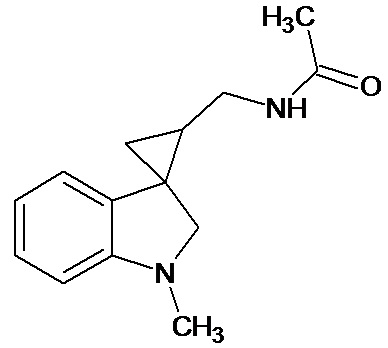
В трехгорлую колбу объемом 100 мл поместили 0,8 г (0,004 моль) 1'-метил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-2-карбонитрила, 30 мл абсолютного TГФ и 0,912 г (0,024 моль) боргидрида натрия. Постепенно прибавили 2,2 г (0,0086 моль) йода, растворенного в 7 мл ТГФ, кипятили 10 часов. По окончании кипячения реакционную смесь погасили 10 мл разбавленной соляной кислоты, экстрагировали метиленом и внесли 0,6 мл (0,0055 моль) уксусного ангидрида. В результате реакции соединение было выделено методом колоночной хроматографии (Rf=0,28, элюент - этилацетат) в виде красноватого масла. Выход 76 % (0,71 г).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,27 (м., 1Н); 1,70 (с., 3Н); 1,81 (с., 1Н); 1,87 (с., 1Н); 2,61 (с., 3Н); 2,88 (м., 1Н); 3,04 (д, J = 8,47, 1Н); 3,16 (д, J = 8,46, 1Н); 3,34 (м., 1Н); 6,38 (д., J = 7,83, 1Н); 6,4 (с., 1Н); 6,51 (т., J = 7,45, 1Н); 6,63 (д., J = 7,20, 1Н); 6,93 (т., J = 7,58, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 21,88, 22,69, 25,11, 27,94, 35,92, 38,42, 65,45, 107,29, 117,74, 120,93, 127,28, 130,38, 134,51, 154,57, 170,46.
Масс-спектр (HRMS-ESI): 253,1311, С14H18N2O(М+nNa), рассчитано: 253,1313, С14H18N2ONa
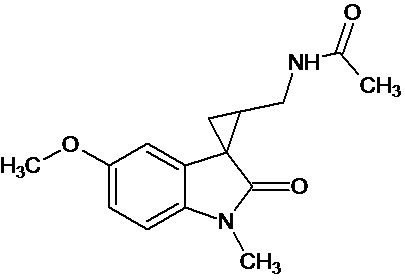
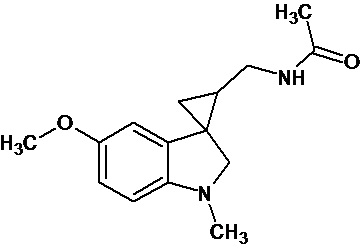
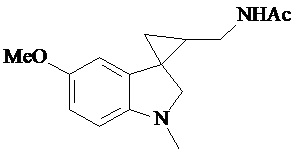
Пример 15. N-{1'-метил-5'-метокси-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
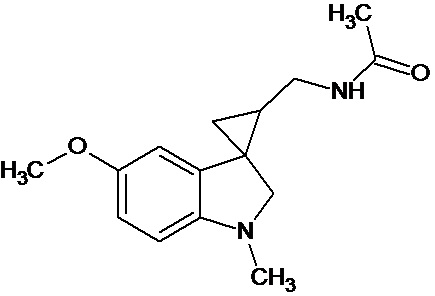
В трехгорлую колбу объемом 100 мл поместили 1,0 г (0,0045 моль) 1'-метил-5'-метокси-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-2-карбонитрила,20 мл абсолютного TГФ и 1,0 г (0,026 моль) боргидрида натрия. Постепенно прибавили 2,44 г (0,009 моль) йода, растворенного в 10 мл ТГФ, кипятили 16 часов. По окончании кипячения реакционную смесь погасили 10 мл разбавленной соляной кислоты, экстрагировали метиленом и внесли 1,0 мл (0,001 моль) уксусного ангидрида. В результате реакции соединение было выделено методом колоночной хроматографии в виде красноватого масла. Выход 77 % (0,9 г).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,26 (т., J = 7,20, 1Н); 1,89 (м., 2Н); 1,94 (с., 3Н); 2,06 (с., 3Н); 2,91 (дд., J = 14,5, 7,5, 1Н); 3,03 (дд., J = 14,5, 5,5, 1Н); 3,47 (м., 2Н); 3,87 (c., 3H); 5,95 (с., 1Н); 6,88 (дд., J = 8,9, 2,27, 1Н); 7,13 (д., J = 2,28, 1Н); 7,16 (д., J = 8,85, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 20,84, 21,91, 22,65, 29,54, 32,59, 37,27, 55,77, 70,85, 109,11, 109,88, 111,62, 128,29, 132,55, 153,69, 173,74.
Пример 16. N-{5'-бром-1'-метил-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
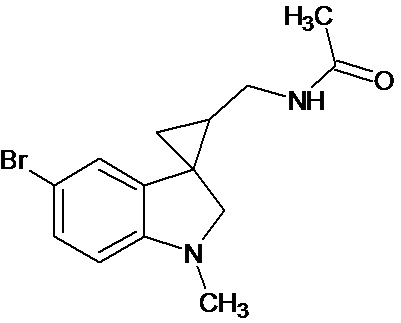
В трехгорлую колбу объемом 100 мл поместили 0,5 г (0,0018 моль) 1'-метил-5'-бром-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-2-карбонитрила, 25 мл абсолютного TГФ и 0,42 г (0,011 моль) боргидрида натрия. Постепенно прибавили 0,92 г (0,036 моль) йода, растворенного в 5 мл ТГФ, кипятили 15 часов. По окончании кипячения реакционную смесь погасили 10 мл разбавленной соляной кислоты, экстрагировали метиленом и внесли 0,8 мл (0,008 моль) уксусного ангидрида. В результате реакции соединение было выделено методом колоночной хроматографии (Rf=0,18, элюент - этилацетат) в виде темно-оранжевого масла. Выход 37 % (0,21 г).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0,99 (т., J = 6,10, 1Н); 1,10 (дд., J = 8,88, 5,83, 1Н); 1,43 (м., 1Н); 1,85 (с., 3Н); 1,98 (м., 1Н); 2,04 (с., 3Н); 2,74 (с., 3Н); 2,85 (м., 1Н); 3,19 (д., J = 8,61, 1Н); 3,36 (д, J = 8,61, 1Н); 3,70 (м., 2Н); 5,64(с., 1Н); 6,37 (д., J = 8,21, 1Н); 6,79 (с., 1Н); 7,17 (д., J = 8,21, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 15,74, 21,04, 23,12, 28,63, 35,91, 38,45, 65,56, 108,50, 109,50, 123,73, 130,07, 132,92, 153,83, 170,35.
Пример 17. N-{1',6',7'-триметил-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
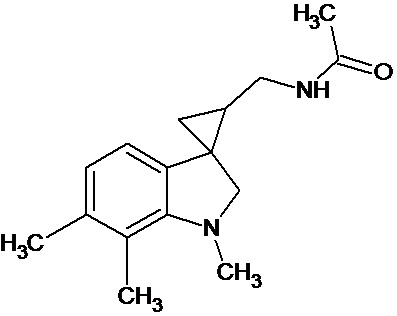
В трехгорлую колбу объемом 100 мл поместили 1,37 г (0,006 моль) 1',6',7'-триметил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол]-2-карбонитрила, 20 мл абсолютного TГФ и 1,16 г (0,036 моль) боргидрида натрия. Постепенно прибавили 3,08 г (0,012 моль) йода, растворенного в 20 мл ТГФ, кипятили 24 часа. По окончании кипячения реакционную смесь погасили 10 мл разбавленной соляной кислоты, экстрагировали метиленом и внесли 0,9 мл (0,009 моль) уксусного ангидрида. В результате реакции соединение было выделено методом колоночной хроматографии (Rf=0,36, элюент - этилацетат) в виде желтого масла. Выход 35 % (0,538 г).
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 0,95 (т., J = 5,81, 1Н); 1,04 (м., 1Н); 1,34 (м., 1Н); 1,80 (с., 3Н); 2,18 (с., 3Н); 2,22 (с., 3Н); 2,60 (м., 1Н); 2,87 (с., 3Н); 2,90 (м., 1Н); 3,15 (д, J = 9,8, 1Н); 3,42 (д, J = 9,7, 1Н); 3,55 (м., 1Н); 5,89 (с., 1Н); 6,52 (д., J = 7,45, 1Н); 6,66 (д., J = 7,50, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 14,28, 20,07, 20,73, 21,89, 27,43, 29,61, 37,17, 42,01, 71,96, 116,04, 121,28, 127,85, 129,58, 136,28, 142,49, 171,38.
Масс-спектр (HRMS-ESI): 258,1727, С16H22N2O(М), рассчитано: 258,1732, С14H20N2O
Пример 18. Получение N-(1'-бензил-5'-метокси-1',2'-дигидроспиро[циклогексан-1,3'-индол]-2-ил)трифторацетамида
0,0021 моль 1'-бензил-5'-метокси-1',2'-дигидроспиро[циклогексан-1,3'-индол]-2-карбонитрила растворяли в 15 мл трифторуксусной кислоты, и добавляли 0,069 моль трифторуксусного ангидрида, 10 мг (0,00004 моль) PtO2 и пропускали водород при атмосферном давлении и комнатной температуре в течение 3-х часов (до прекращения поглощения водорода). Реакционную смесь фильтруют через слой силикагеля для отделения катализатора и осадка. Продукт смывают с силикагеля горячим этанолом и высаживают добавлением этилового эфира. Суммарный выход N-(1'-бензил-5'-метокси-1',2'-дигидроспиро[циклогексан-1,3’-индол]-2-ил)трифторацетамида 41%.
Спектр ЯМР 1Н (CDCl3, δ, м.д., J, Гц): 1,64-1,75 (м, 4H), 1,92-2,13 (м, 4H), 2,12 (с, 3Н), 2,49-2,53 (м, 1Н); 3.17 (с, 3Н), 6,43 (ушир. с, 1Н, NH); 7.04 (д, J = 8.7, 2 Н), 7.62 (дд, J = 8.7, J = 2.1Н 1Н), 8.12 (д, J = 2.1Н, 1Н).
Спектр 13С (CDCl3, δ, м.д., J, Гц): 23,98, 24,69, 25,78, 28.10, 29,25, 31,80, 32.33, 36,11, 54,14, 109,30, 121.45, 122,35, 128,79, 134,99, 142,05, 168,15, 170,71, 175.57
Пример 19. Получение гидрохлорида 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила
К раствору 1'-этил-2'-оксо-1',2'-дигидроспиро[циклопропан-1,3'-индол-2-илметил]-3-карбонитрила в тетрагидрофуране при охлаждении по каплям добавляют насыщенный раствор газообразного хлороводорода в диэтиловом эфире. Целевую соль получают после удаления растворителя в вакууме роторного испарителя. Выход количественный
Пример 20. Получение гидрохлорида N-{1'-метил-5'-метокси-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид
К раствору N-{1'-метил-5'-метокси-1',2'-дигидроспиро[циклопропан-1,3'-индол]-3-илметил}ацетамид в тетрагидрофуране при охлаждении по каплям добавляют насыщенный раствор газообразного хлороводорода в диэтиловом эфире. Целевую соль получают после удаления растворителя в вакууме роторного испарителя. Выход количественный
Изучение биологической активности новых производных мелатонина.
Проведены исследования афинности предлагаемых соединений общей формулы (I)по отношению к подтипам МТ1 и МТ2 мелатонинового рецептора и изучение антиглаукомной активности in vivo.
Исследования афинности проводились методом конкурентного ингибирования с использованием [125] иод-мелатонина, в качестве радиолиганда на СНО-К1 клетках, содержащих рекомбинантные МТ1 и МТ2 мелатониновые рецепторы человека. Было изучено связывание новых соединений по сравнению с мелатонином. Показатели по связыванию МТ1 и МТ2 приведены в таблице 2.
В таблице 1 приведены данные по антиглаукомной активности. Способность мелатонина и его синтезированных аналогов снижать ВГД оценивали на нормотензивных кроликах породы Шиншилла, самцах, массой около 2кг. Для всех исследованных веществ использовали концентрацию 0,1% (масса/объем), что для мелатонина составляет 4,3мкМ. Все вещества растворяли в 0,05М фосфатном буферном растворе рН7,4, содержащем 1% ДМСО (объем). Навеску растворяли в ДМСО и затем разводили до требуемой концентрации буферным раствором.
Растворы закапывали с помощью автоматического дозатора по 50 мкл в оба глаза. ВГД измеряли до закапывания и далее в течение 6 часов с интервалом в 1час с помощью автоматического тонометра для ветеринарии Tonovet (Icare, Финляндия). Оценку гипотензивного действия каждого вещества проводили в группе из 3 животных (6 глаз). Для введения поправки на нормальные суточные колебания ВГД одновременно проводили измерение ВГД у 3 интактных животных (6 глаз). В следующий опыт животных брали после перерыва не менее, чем в 7 дней. Поскольку скорость снижения ВГД у разных животных ВГД отличается, в ходе исследования мы ориентировались на максимальное снижение ВГД в каждом глазу, а не на среднее снижение в конкретной временной точке.
Таблица 1. Cнижение внутриглазного давления соединениями формулы (I)
|
Афинности соединений формулы (I) по отношению к мелатониновым рецепторам МТ1, МТ2 и МТ3 (хинонредуктаза 2) подтипов измеряли in vitro. Исследования афинности проводились методом конкурентного ингибирования с использованием 2-[125]иод-мелатонина, в качестве радиолиганда на СНО-К1 клетках, содержащих рекомбинантные МТ1 и МТ2 мелатониновые рецепторы человека (таблица 2).
Таблица 2. Афинность соединений формулы (I) по отношению к мелатониновым рецепторам MT1 и MT2 подтипов
|
*концентрация веществ, необходимая для 50%-ного ингибирования активности рецептора
**условия измерения: МТТ = 200 μМ, концентрация хинонредуктазы 2 = 0,015 μМ, рН 8, длина волны 612 нм.
Измерение ингибирующей способности соединений формулы (I) по отношению к МТ3 подтипу мелатонинового рецептора (фермент хинонредуктаза 2) проводились спектрофотометрическим МТТ методом (таблице 3).
Таблица 3. Ингибирующая способность соединений формулы (I) по отношению к МТ3 подтипу мелатонинового рецептора (фермент хинонредуктаза 2)
|
*условия измерения: МТТ = 200 μМ, концентрация хинонредуктазы 2 = 0,015 μМ, рН 8, длина волны 612 нм.
Исследования гипотензивной активности мелатонина и соединений формулы (I) по отношению к ангиотензинпревращающему ферменту показали, что все они не активны при концентрации до 1 мкМ.