Результат интеллектуальной деятельности: Способ получения комплекса технеция-99м с производным октреотида для диагностики нейроэндокринных опухолей
Вид РИД
Изобретение
Изобретение относится к области фармацевтической химии, а именно к получению радиофармацевтических лекарственных препаратов медицинского назначения для радионуклидной диагностики нейроэндокринных опухолей.
Известен способ получения комплекса технеция-99м с октреотидом для диагностики нейроэндокринных опухолей [RU 2655392 C1, МПК (2006.01) C07K 7/06, C07F 13/00, A61K 51/08, A61K 103/10, опубл. 28.05.2018], выбранный в качестве прототипа, включающий модификацию октреотида хелатирующим агентом сукцинимид-1-ил 6-(бис(пиридин-2-илметил)амино)гексаноат в среде диметилформамида в присутствии триэтиламина при комнатной температуре в течение не менее 24 ч при перемешивании, очистку полученного раствора полупрепаративно, используя жидкостную хроматографию, проведение методом лиофилизации отгонки летучих растворителей и высушивания, добавление к DPAH-модифицированному октреотиду, цитрата натрия и олова (II) дихлорида дигидрата, смешивание их, получение жидкого реагента, который стерилизуют фильтрацией и лиофилизируют с предварительной заморозкой до -50°С, добавление к полученному лиофилизату натрия пертехнетата с концентрацией технеция-99м 1 ГБк/мл и инкубирование в течение не менее 30 мин при комнатной температуре.
Выход DPAH-модифицированного октреотида (DPAH-октреотида) составляет 60,15%, а радиохимическая чистота готового продукта (комплекса технеция-99м с DPAH-октреотидом) составляет 96,2%.
При получении DPAH-модифицированного октреотида проводится прямая модификация октреотида хелатирующим агентом путем образования амидной связи. В данном случае реакция не является специфичной, поскольку в структуре октреотида можно выделить помимо целевой амино-группы D-фенилаланина, также амино-группу L-лизина, которая более доступна для образования амидной связи. Следовательно, невысокий выход в данном способе объясняется образованием побочного продукта.
При получении комплекса технеция-99м с DPAH-модифицированным октреотидом для диагностики нейроэндокринных опухолей при взаимодействии семивалентного технеция-99м с двухвалентным оловом в водной среде происходит образование технеция четырех и пятивалентого, для прочного связывания которого пригодны хелатные группы N2S2,, N3S1, N1S3, и т.д. Тридентантный (N3) хелатирующий агент DPAH не способен прочно связывать технеций-99м указанной валентности, и комплекс разрушается при разбавлении его водой, физиологическим раствором, буферными растворами и т.д., что делает его применение ограниченным для биологических исследований in vitro/ in vivo по сроку годности.
Технический результат, на решение которого направлено предлагаемое изобретение, заключается в разработке способа получения комплекса технеция-99м для диагностики нейроэндокринных опухолей, позволяющего повысить радиохимическую чистоту получаемого продукта.
Предложенный способ получения комплекса технеция-99м с производным октреотида для диагностики нейроэндокринных опухолей, также как в прототипе, включает модификацию октреотида хелатирующим агентом сукцинимид-1-ил-6-(бис(пиридин-2-илметил)амино)гексаноатом в среде диметилформамида в присутствии триэтиламина при перемешивании при комнатной температуре, очистку полученного раствора полупрепаративно, используя жидкостную хроматографию, проведение методом лиофилизации отгонки летучих растворителей и высушивание, связывание полученного реагента с технецием-99м с активностью 1 ГБк и инкубирование.
Согласно изобретению сначала смешивают фосфатно-буферный раствор октреотида с рН 7,5–9,0 и раствор ацетонитрила, содержащий 9-флуоренилметилоксикарбонилхлорид (Fmoc-Cl), в мольном соотношении 1:1–1,2, перемешивают в течение 15–60 мин при температуре 20–60°С, проводят очистку полупрепаративно жидкостной хроматографией. Фракции, соответствующие Fmoc-(L-Lys)-октреотиду, объединяют и лиофилизируют. Затем полученный Fmoc-(L-Lys)-октреотид растворяют в диметилформамиде и добавляют сукцинимид-1-ил-6-(бис(пиридин-2-илметил)амино)гексаноат в присутствии триэтиламина, перемешивают и инкубируют в течение 6–10 часов, проводят очистку полупрепаративно жидкостной хроматографией. Фракции, соответствующие DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотиду, объединяют и лиофилизируют. Полученный DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотид гидролизуют, растворяя его в смеси диметилформамида и пиперидина в течение не менее 30 мин при комнатной температуре, проводят очистку полупрепаративно жидкостной хроматографией и лиофилизируют. К полученному DPAH-(D-Phe)-октреотиду добавляют раствор карбонильного технеция-99м с активностью технеция-99м 1 ГБк. Смесь инкубируют при 40°С в течение 60 мин, проводят твердофазную экстракцию, элюируют этанолом, разбавляют раствором натрия хлорида.
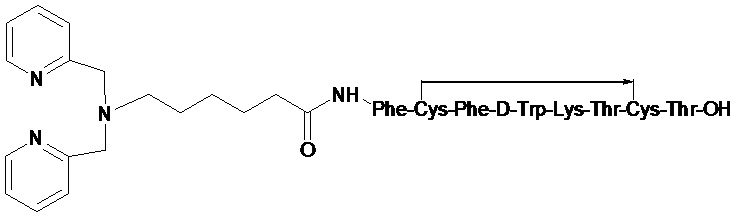
Полученный комплекс технеция-99м с DPAH-октреотидом имеет следующую формулу
DPAH-октреотид синтезируют с применением подхода Fmoc-защиты нецелевой аминогруппы L-лизина. Оптимальным для достижения высоких выходов является на первой стадии использование сред с рН 7,5-9,0 и мольного соотношения октреотида и реагентов 1:1–1,2 поскольку отклонение этих параметров приводит к защите другой целевой амино-группы в D-фенилаланине. На второй стадии оптимальным является время реакции 6–10 часов для образования амидной связи, уменьшение времени реакции приводит к снижению выхода целевого продукта, увеличение времени реакции существенно не влияет на выход.
Использование карбонильного технеция-99-м [99mTc(H2O)3(CO)3]+способствует образованию прочных связей в полученном комплексе, что перспективно для широкого использования при производстве лекарственных радиофармпрепартов.
Предлагаемый способ получения комплекса технеция-99м с производным октреотида для диагностики нейроэндокринных опухолей позволяет получать DPAH-модифицированный октреотид с выходом до 90,2%, а также стабильный комплекс технеция-99м с производным октреотида (готовый продукт) с высокой радиохимической чистотой - 98%.
Технический результат предлагаемого изобретения состоит в повышении радиохимической чистоты комплекса технеция-99м с DPAH-модифицированным октреотидом. Кроме того, повышен выход DPAH-модифицированного октреотида, что позволяет использовать его в большем количестве для получения комплекса технеция-99м, что в свою очередь приводит к удешевлению получаемого продукта.
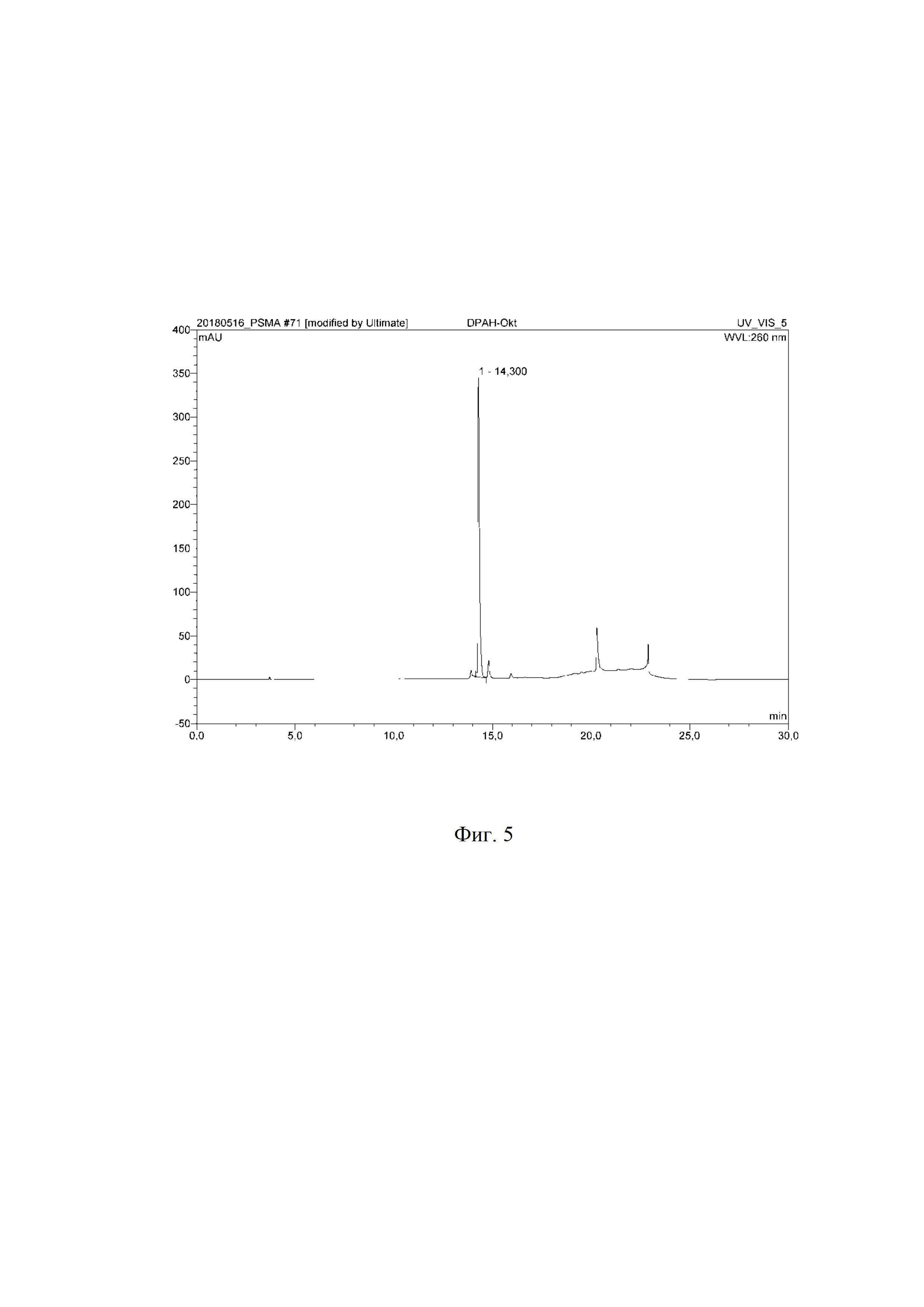
На фиг. 1 представлена ВЭЖ-хроматограмма Fmoc-(L-Lys)-октреотида.
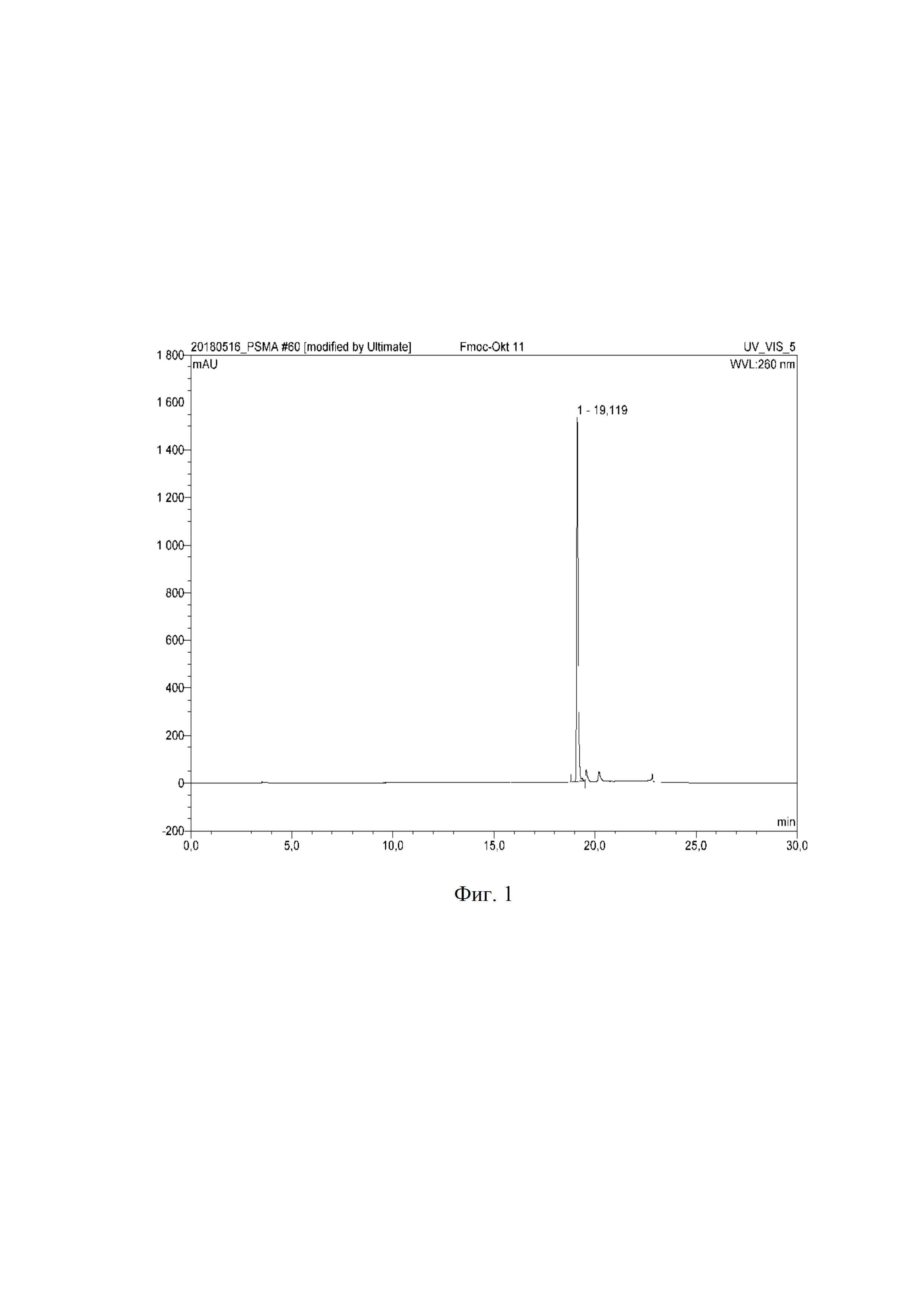
На фиг. 2 показан масс-спектр полученного Fmoc-(L-Lys)-октреотида.
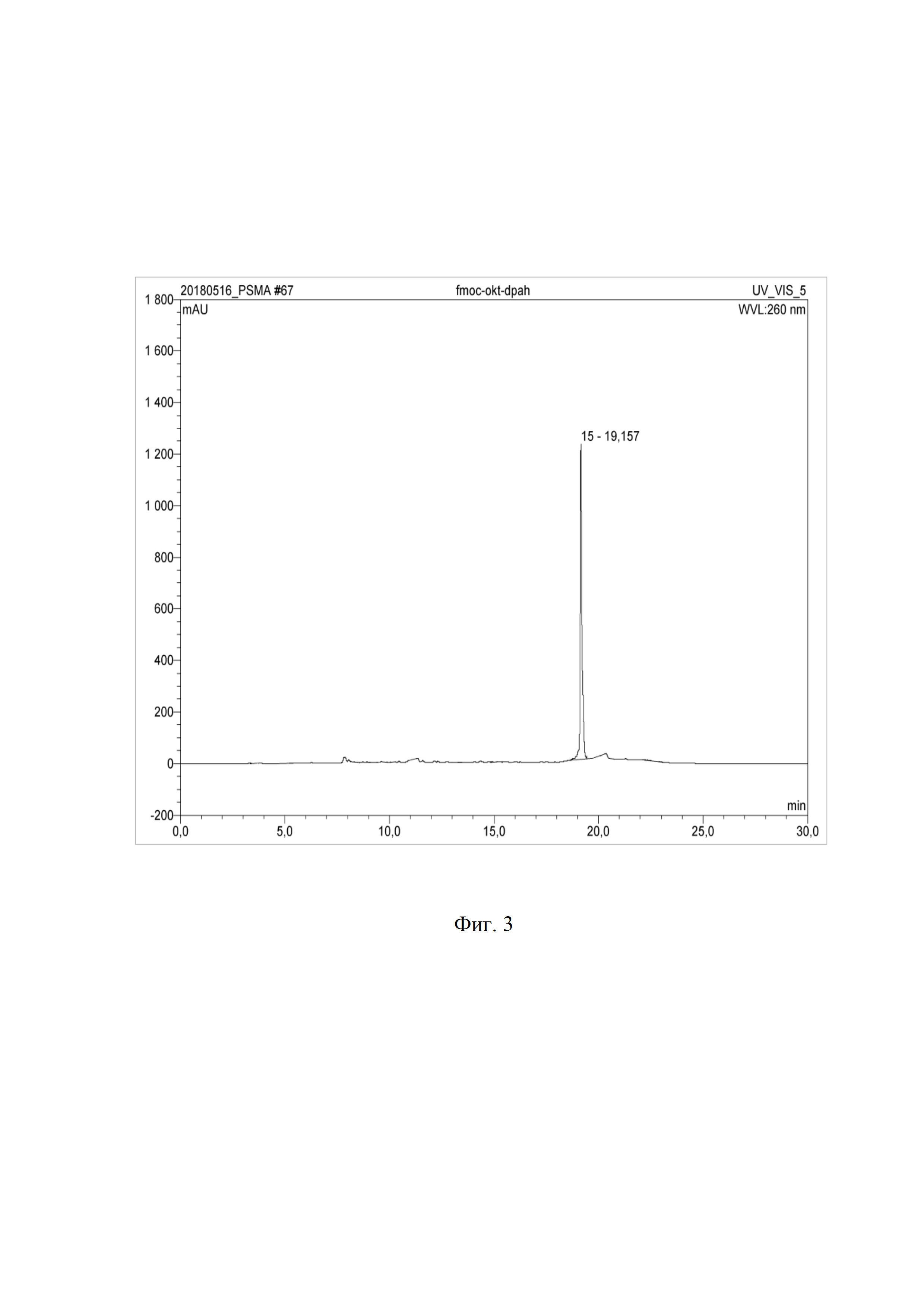
На фиг. 3 представлена вэж хроматограмма DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида.
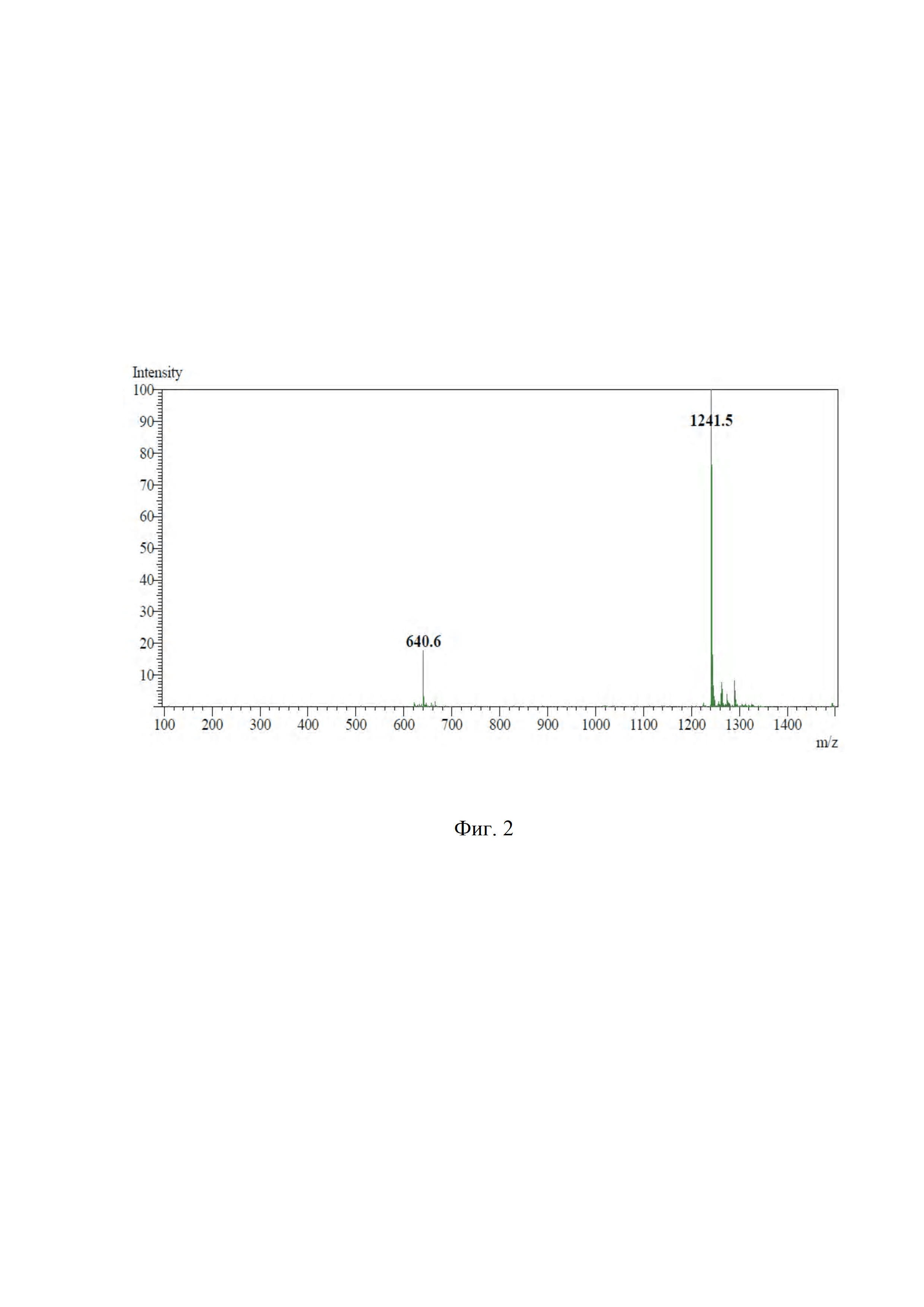
На фиг. 4 показан масс-спектр (M+H+) DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида.
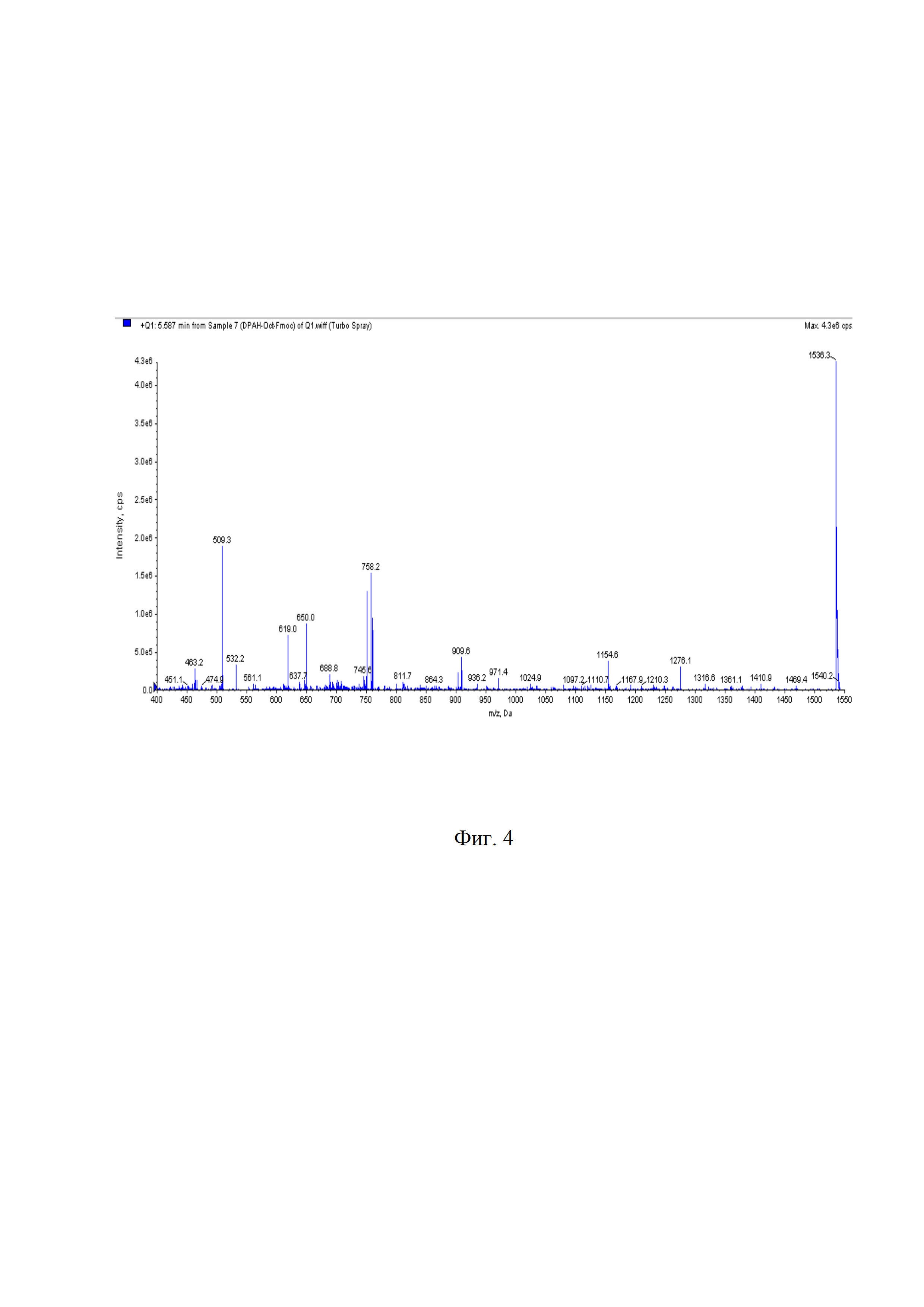
На фиг. 5 представлена вэж хроматограмма DPAH-(D-Phe)-октреотида.
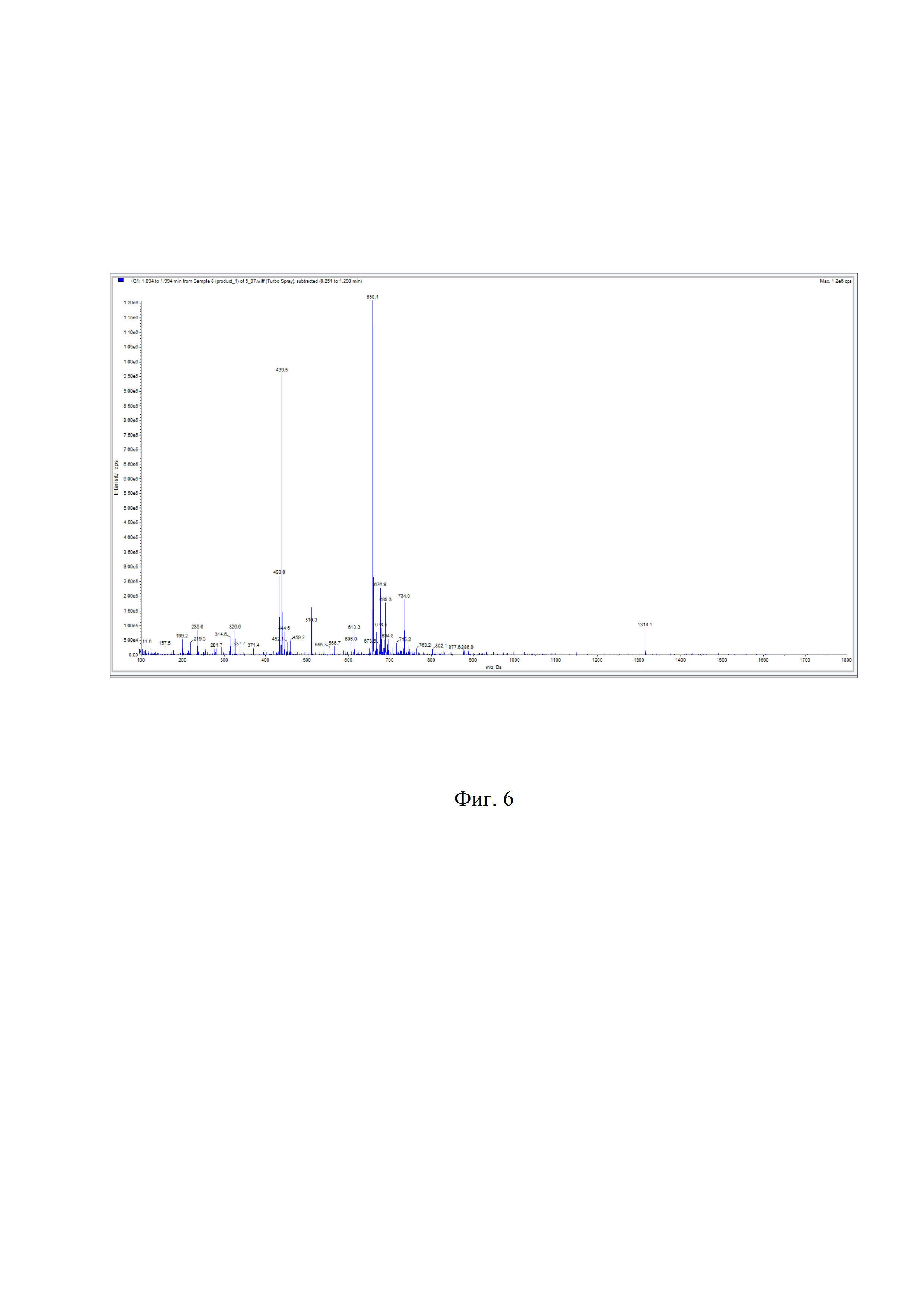
На фиг. 6 показан масс-спектр DPAH-(D-Phe)-октреотида.
Пример 1. Синтез Fmoc-(L-Lys)-октреотида.
9,8⋅10-3 ммоль (10 мг) октреотида (производитель АО «Фарм-синтез») растворили в 1 мл 100 ммоль фосфатно-буферного раствора (рН=8,4), добавили 10,8⋅10-3 ммоль (2,8 мг) 9-флуоренилметилоксикарбонилхлорида (Fmoc-Cl, Arcos organics) в 1 мл ацетонитрила, перемешивали и инкубировали при температуре 60°С в течение 30 минут. Контроль за ходом реакции осуществляли по аналитической ВЭЖ-хроматограмме, представленной на фиг. 1 (tR = 19,119 мин, система ВЭЖХ Ultimate 3000, колонка С18(2) Luna 5 мкм, 100 А°, 250×4.6 мм, градиент концентрации: 0 мин 100% A (0% B), 5 мин 80% A (20% B), 10 мин 65% A (35% B), 15 мин 50% A (50% B), 25 мин 20% A (80% B), 30 мин 0% A (100% B), 32 мин 95% A (5% B), где система А – 0,1% TFA и система Б – 0,1% TFA/ацетонитрил, скорость потока 1 мл/мин). Очистку продукта проводили полупрепаративной ВЭЖХ (система ВЭЖХ Ultimate 3000, колонка С18(2) Luna 10 мкм, 100 А°, 250×10 мм, градиент концентрации 0 мин 100% A (0% B), 5 мин 80% A (20% B), 10 мин 65% A (35% B), 15 мин 50% A (50% B), 25 мин 20% A (80% B), 30 мин 0% A (100% B), 32 мин 95% A (5% B), где система А – 0,1% TFA и система Б – 0,1% TFA/ацетонитрил, скорость потока 12 мл/мин). Фракции, соответствующие Fmoc-(L-Lys)-октреотида, объединили и лиофилизировали. Выход продукта после очистки составил 90,1 %, m/z 1241,5. Масс-спектр Fmoc-(L-Lys)-октреотида представлен на фиг. 2.
Пример 2. Синтез Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили также, как и в примере 1 с тем отличием, что добавляли Fmoc-Cl в количестве 12,7⋅10-3 ммоль (3,3 мг). Выход продукта составил 71,1%.
Пример 3. Синтез Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили также, как и в примере 1 с тем отличием, что добавляли Fmoc-Cl в количестве 9,8⋅10-3 ммоль (2,6 мг). Выход продукта составил 84,2 %.
Пример 4. Синтез Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 1 с тем отличием, что использовали фосфатно-буферный раствор с рН=7,5. Выход продукта составил 85,2%.
Пример 5. Синтез Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 1 с тем отличием, что использовали фосфатно-буферный раствор с рН=9,0. Выход продукта составил 90,2%.
Пример 6. Синтез Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 1 с тем отличием, что смесь перемешивали и инкубировали при температуре 20°С. Выход продукта составил 85,1%.
Пример 7. Синтез Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 1 с тем отличием, что смесь перемешивали и инкубировали при температуре 40°С. Выход продукта составил 89,1%.
Пример 8. Синтез Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 1 с тем отличием, что смесь перемешивали и инкубировали 15 минут. Выход продукта составил 75,2 %.
Пример 9. Синтез Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 1 с тем отличием, что смесь перемешивали и инкубировали 45 минут. Выход продукта составил 90,1%.
Пример 10. Синтез DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида.
4⋅10-3 ммоль (5 мг) Fmoc-(L-Lys)-октреотида растворили в 1 мл диметилформамида, добавили 10 мкл триэтиламина, 8⋅10-3 ммоль (3,3 мг) сукцинимид-1-ил-6-(бис(пиридин-2-илметил)амино)гексаноата, перемешивали и инкубировали при комнатной температуре 6 часов. Контроль за ходом реакции осуществляли по аналитической ВЭЖ-хроматограмме, представленной на фиг. 3 (tR = 19,157 мин, условия примера 1). Очистку продукта проводили полупрепаративной ВЭЖХ (условия примера 1). Фракции, соответствующие DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотиду, объединяли и лиофилизировали. Выход продукта после очистки составил 92,2% (чистота более 99%), m/z 1536,3. Масс-спектр (M+H+) DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида представлен на фиг. 4.
Пример 11. Синтез DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 10 с тем отличием, что время инкубации составило 8 часов. Выход продукта составил 92,0%.
Пример 12. Синтез DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 10 с тем отличием, что время инкубации составило 10 часов. Выход продукта составил 92,0%.
Пример 13. Синтез DPAH-октреотида путем гидролиза DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида.
2,6⋅10-3 ммоль (4 мг) DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида растворили в 400 мкл диметилформамида, добавили 100 мкл пиперидина, смесь инкубировали при комнатной температуре 30 мин. Контроль за ходом реакции осуществляли по аналитической ВЭЖ-хроматограмме, представленной на фиг. 5 (tR = 14,300 мин, условия примера 1). Очистку продукта проводили полупрепаративной ВЭЖХ (условия примера 1). Фракции, соответствующие DPAH-(D-Phe)-октреотиду, объединяли и лиофилизировали. Выход продукта после очистки составил 91,2%, m/z 1314,4. Масс-спектр DPAH-(D-Phe)-октреотида представлен на фиг. 6.
Пример 14. Синтез DPAH-октреотида путем гидролиза DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотида.
Реакционную смесь готовили так же, как и в примере 19 с тем отличием, что время инкубации составило 45 минут. Выход продукта составил 91,2%.
Пример 15. Получение комплекса технецием-99м [99mTc(H2O)3(CO)3]+ с DPAH-октреотидом.
Во флакон, содержащий 100 мкг DPAH-октреотида, полученного в примере 13, добавляли 1 мл раствора карбонильного технеция-99м [99mTc(H2O)3(CO)3]+ активностью 1 ГБк, смесь инкубировали при 40°С в течение 60 мин. Очистку проводили, используя картридж Sep-Pak C18 (360 мг), предварительно промытый 10 мл этанола, 10 мл воды; полученный комплекс технеция-99м с DPAH-(D-Phe)-октреотидом (DPAH-модифицированным октреотидом) элюировали 1 мл этанола и разбавляли 9 мл 0,9% раствора натрия хлорида.
Радиохимическая чистота комплекса технеция-99м с DPAH-модифицированным октреотидом составила 98,0%.
Способ получения комплекса технеция-99м с производным октреотида для диагностики нейроэндокринных опухолей, включающий модификацию октреотида хелатирующим агентом сукцинимид-1-ил-6-(бис(пиридин-2-илметил)амино)гексаноатом в среде диметилформамида в присутствии триэтиламина при перемешивании при комнатной температуре, очистку полученного раствора полупрепаративно, используя жидкостную хроматографию, проведение методом лиофилизации отгонки летучих растворителей и высушивание, связывание полученного реагента с технецием-99м с концентрацией 1 ГБк/мл и инкубирование, отличающийся тем, что смешивают фосфатно-буферный раствор октреотида с рН 7,5–9,0 и раствор ацетонитрила, содержащий 9-флуоренилметилоксикарбонилхлорида (Fmoc-Cl), в мольном соотношении 1:1–1,2, перемешивают в течение 15–60 мин при температуре 20–60°С, проводят очистку полупрепаративно жидкостной хроматографией, фракции, соответствующие Fmoc-(L-Lys)-октреотиду, объединяют и лиофилизируют, затем полученный Fmoc-(L-Lys)-октреотид растворяют в диметилформамиде и добавляют сукцинимид-1-ил-6-(бис(пиридин-2-илметил)амино)гексаноат в присутствии триэтиламина при перемешивании в течение 6–10 ч, проводят очистку полупрепаративно жидкостной хроматографией, фракции, соответствующие DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотиду, объединяют и лиофилизируют; полученный DPAH-(D-Phe)-Fmoc-(L-Lys)-октреотид гидролизуют, растворяя его в смеси диметилформамида и пиперидина и инкубируют в течение не менее 30 мин при комнатной температуре, проводят очистку полупрепаративно жидкостной хроматографией и лиофилизируют, затем к полученному DPAH-(D-Phe)-октреотиду добавляют раствор карбонильного технеция-99м с активностью технеция-99м 1 ГБк, смесь инкубируют при 40°С в течение 60 мин, проводят твердофазную экстракцию, элюируют этанолом и разбавляют раствором натрия хлорида.