Результат интеллектуальной деятельности: СПОСОБ ВЫБОРА ЭФФЕКТИВНОГО АНТИАРИТМИЧЕСКОГО ПРЕПАРАТА ДЛЯ БОЛЬНЫХ С ЭКСТРАСИСТОЛИЕЙ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к кардиологии, в частности к способам выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией.
В широко распространенном способе выбора эффективного антиаритмического препарата для больных с экстрасистолией учитывается основное заболевание, на фоне которого развилась аритмия, характер экстрасистолии (желудочковая или наджелудочковая), ее прогностическая оценка, например, в отношении развития жизнеугрожающих аритмий или внезапной смерти, наличия противопоказаний и возможное развитие побочных эффектов [Мазур Н.А. Пароксизмальные тахикардии. - М.: ИД Медпрактика - М, 2005. - 252 с., Кардиология: национальное руководство / под ред. Е.В. Шляхто. - 2 издание дополненное и переработанное. М.: ГЭОТАР - Медиа, 2015. - 800 с.].
Известен также способ выбора дифференцированной антиаритмической терапии (ААТ) желудочковых нарушений сердечного ритма в зависимости от механизма их развития, заключающегося в том, что при выявлении триггерного механизма желудочковой экстрасистолии наиболее эффективными для ее купирования являются препараты II(IV) классов, а при определении reentry - препараты III(I) классов [А.И. Олесин, А.В. Шабров, А.В. Козий, К.А. Полянская, Е.В. Семенова Возможность выбора дифференцированной терапии желудочковых нарушений сердечного ритма в зависимости от механизма их развития // Вестник СПбГМА им. И.И. Мечникова. - 2005. - №4. - С. 66-69].
Недостатком аналогов является отсутствие независимых предикторов для выбора наиболее эффективного антиаритмического препарата для больных с экстрасистолией.
В качестве прототипа по наиболее близкой технической сущности нами выбран способ выбора эффективного антиаритмического препарата для больных с экстрасистолией, заключающийся в тестировании антиаримических препаратов. Проводят суточное мониторирование электрокардиограммы (ЭКГ) до приема больным противоаритмического препарата и через 3-4 дня после его приема. Препаратом выбора является тот, после приема которого наблюдается уменьшение числа экстрасистол на 75% и более, в сравнении с их исходной частотой, а также устранение парных, групповых экстрасистол, причем при отсутствие эффекта одного препарата, каждый последующий препарат тестируется, как минимум, через 5 периодов полувыведения предыдущего [Кушаковский М.С. Аритмии сердца: руководство для врачей / М.С. Кушаковский. - 3-е изд, испр. и доп. - СПб.: Фолиант, 2004. - 672 с.].
Недостатком способа, выбранного нами в качестве прототипа, является длительность эффективного антиаритмического препарата для больных с экстрасистолией, составляющая, включая суточное мониторирование ЭКГ до и после его приема, для тестирования одного препарата от 5 до 7 дней.
Техническим результатом изобретения является сокращение времени выбора одного или нескольких эффективных антиаритмических препаратов для больных с экстрасистолией.
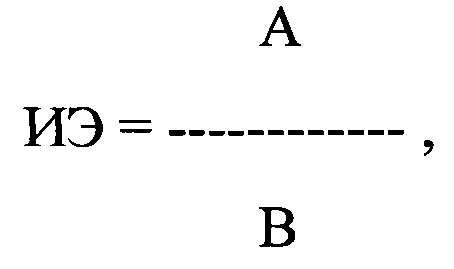
Технический результат изобретения достигается тем, что больному с экстрасистолией поочередно многократно применяют тестируемые антиаритмические препараты, до введения каждого из тестируемых антиаритмических препаратов и после начала их действия, определяемого как полупериод его полувыведения, проводят ЭКГ исследование и определяют линейное отклонение (ЛО) корригированного предэктопического интервала (ПДИкор.) отдельно для лево- и правожелудочковой экстрасистолии (ЛЖЭ и ПЖЭ), наджелудочковой экстрасистолии (НЭ) не менее чем в 20 экстрасистолах. Затем рассчитывают индекс экстрасистолии по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ЛЖЭ, ПЖЭ, НЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час,
затем рассчитывают ΔИЭ по формуле: ΔИЭ = [(ИЭn - ИЭисх.)÷Эисх.]÷N, где ΔИЭ (в ед.) - изменение ИЭ после каждого приема одного препарата, через полупериод его полувыведения, в сравнении с исходными данными, ИЭисх. - значения ИЭ до использования препарата, ИЭn - значения ИЭ через полупериод полувыведения после первого, второго, третьего и последующих приемов препарата, N - количество приемов препарата и при увеличении значений ΔИЭ≥2 ед. после, как минимум, двух последовательных приемов препарата, определяют тестируемый антиаритмический препарат как эффективный для больных с экстрасистолией.
Способ осуществляется следующим образом:
Больному с экстрасистолией поочередно многократно применяют тестируемые антиаритмические препараты. До введения каждого из тестируемых антиаритмических препаратов и после начала их действия, определяемого как полупериод его полувыведения, больному проводят ЭКГ исследование. Затем определяют ЛО ПДИкор. отдельно для ЛЖЭ, ПЖЭ и НЭ не менее чем в 20 экстрасистолах. Затем рассчитывают ИЭ отдельно для ЛЖЭ, ПЖЭ и НЭ по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ЛЖЭ, ПЖЭ, НЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час, затем рассчитывают ΔИЭ по формуле: ΔИЭ = [(ИЭn - ИЭисх.)÷ИЭисх.]÷N, где ΔИЭ (в ед.) - изменение ИЭ после каждого приема одного препарата, через полупериод его полувыведения, в сравнении с исходными данными, ИЭисх. - значения ИЭ до использования препарата, ИЭn - значения ИЭ через полупериод полувыведения после первого, второго, третьего и последующих приемов препарата, N - количество приемов препарата
и при увеличении значений ΔИЭ≥2 ед. после, как минимум, двух последовательных приемов препарата, определяют тестируемый антиаритмический препарат как эффективный для больных с экстрасистолией.
Существенные отличительные признаки заявляемого способа и причинно-следственная связь между ними и достигаемым результатом:
 у больного с экстрасистолией определяют ЛО ПДИкор. отдельно для ЛЖЭ, ПЖЭ и НЭ не менее чем в 20 экстрасистолах;
у больного с экстрасистолией определяют ЛО ПДИкор. отдельно для ЛЖЭ, ПЖЭ и НЭ не менее чем в 20 экстрасистолах;
 ИЭ рассчитывают отдельно для ЛЖЭ, ПЖЭ и НЭ до введения каждого из тестируемых антиаритмических препаратов и после начала их действия, определяемого как полупериод его полувыведения, по формуле:
ИЭ рассчитывают отдельно для ЛЖЭ, ПЖЭ и НЭ до введения каждого из тестируемых антиаритмических препаратов и после начала их действия, определяемого как полупериод его полувыведения, по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ЛЖЭ, ПЖЭ, НЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час;
 рассчитывают ΔИЭ по формуле: ΔИЭ = [(ИЭn - ИЭисх.)÷ИЭисх.]÷N, где ΔИЭ (в ед.) - изменение ИЭ после каждого приема одного препарата, через полпериода его полувыведения, в сравнении с исходными данными, ИЭисх. - значения ИЭ до использования препарата, ИЭn - значения ИЭ через полупериод полувыведения после первого, второго, третьего и последующих приемов препарата, N - количество приемов препарата;
рассчитывают ΔИЭ по формуле: ΔИЭ = [(ИЭn - ИЭисх.)÷ИЭисх.]÷N, где ΔИЭ (в ед.) - изменение ИЭ после каждого приема одного препарата, через полпериода его полувыведения, в сравнении с исходными данными, ИЭисх. - значения ИЭ до использования препарата, ИЭn - значения ИЭ через полупериод полувыведения после первого, второго, третьего и последующих приемов препарата, N - количество приемов препарата;
 выбор одного или нескольких эффективных антиаритмических препаратов для больных с экстрасистолией;
выбор одного или нескольких эффективных антиаритмических препаратов для больных с экстрасистолией;
 при увеличении значений ΔИЭ≥2 ед. после, как минимум, двух последовательных приемов препарата, определяют тестируемый антиаритмический препарат как эффективный для больных с экстрасистолией.
при увеличении значений ΔИЭ≥2 ед. после, как минимум, двух последовательных приемов препарата, определяют тестируемый антиаритмический препарат как эффективный для больных с экстрасистолией.
В настоящее время известно, что любые заболевания кардиоваскулярной системы могут вызвать прогрессирующее «структурное и/или электрическое ремоделирование» миокарда предсердий и/или желудочков, способствующее появлению желудочковой и/или НЭ [Braunwald's Heart Disease: a textbook of cardiovascular medicine / Ed. by P. Libby et al. - Phyladelfhia, W.B. Saunders Company, 2018. - 2040 р.]. Развитие желудочковой и/или наджелудочковой экстрасистолии может быть обусловлено различными клеточными механизмами: наличием триггерной активности (ранней или задержанной постдеполяризации), re-entry и т.д. [Antzelevitch С, Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card. Electrophysiol. Clin. 2011; 3(1):23-45., Braunwald's Heart Disease: a textbook of cardiovascular medicine / Ed. by P.Libby et al. - Phyladelfhia, W.B. Saunders Company, 2018. - 2040 р.]. Эктопия, обусловленная задержанной постдеполяризацией, обычно связана с гиперполяризацией клеточных мембран кардиомиоцитов в пределах 60-70 mV, что косвенно отражает обратимый характер нарушения функции кардиомиоцитов, причем ее индукция может являться результатом стресса, вегетативного или электролитного дисбаланса, ишемии миокарда и т.д., а после устранения причины ее частота, как правило, уменьшается или она купируется [Antzelevitch С., Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card. Electrophysiol. Clin. 2011; 3(1):23-45., Braunwald's Heart Disease: a textbook of cardiovascular medicine / Ed. by P.Libby et al. - Phyladelfhia, W.B. Saunders Company, 2018. - 2040 р.]. При прогрессирующей гиперполяризации мембран кардиомиоцитов отмечается локальное замедление распространения возбуждения с формированием в этой области однонаправленного блока проведения, приводящего к развитию re-entry. Возникновение этого механизма аритмии в большинстве случаев связано с более глубокими метаболическими нарушениями и/или в результате органического поражения кардиомиоцитов, которые, в конечном итоге, могут сформировать анатомический субстрат в предсердиях или желудочков, предрасполагающий появлению экстрасистолии [Antzelevitch С, Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card. Electrophysiol. Clin. 2011; 3(1):23-45., Braunwald's Heart Disease: a textbook of cardiovascular medicine / Ed. by P.Libby et al. - Phyladelfhia, W.B. Saunders Company, 2018. - 2040 р.]. Кроме того, источником ПЭ может быть эктопический очаг в миокарде предсердий или легочных венах [Бокерия Л.А. Лекции по кардиологии / Л.А. Бокерия, Е.З. Голухова. - М., 2002. - 296 с.]. Уменьшение соотношения ЛО ПДИкор. не менее чем в 20 НЭ, отнесенное к числу НЭ, используемых для исследования, выраженное в количестве экстрасистол в час, свидетельствует о наличии фиксированного эктопического очага в предсердиях и(или) развития циркуляции возбуждения (re-entry) в миокарде предсердий, причем использование определения ПДИкор. в не менее чем 20 экстрасистолах обусловлено тем, что это количество интервалов ПДИкор., взятых для исследования, исключает наличие ложноположительных данных в оценке ЛО ПДИкор. НЭ [Гланц С. Медико-биологическая статистика. Пер. с англ. - М., Практика, 1998. - 459 с.]. Ранее проведенные клинико-экспериментальные исследования показали, что выявленные показатели ЛО ПДИкор. экстрасистолии, например ≤ 10 мс, косвенно подтверждают механизмы re-entry и/или формирование патологического эктопического очага, а большая вариабельность этого показателя - наличие триггерных механизмов [Олесин А.И., Коновалова О.А., Козий А.В. и соавт. Желудочковая экстрасистолия у больных острым коронарным синдромом без подъема сегмента ST: оценка риска развития жизнеугрожающих желудочковых аритмий (клинико-экспериментальное исследование). Российский кардиологический журнал. 2009; 1:24-31]. После формирования фронта волны возбуждения, например, при развитии экстрасистолии по механизму «re-entry», после использования противоаритмических средств она фракционируется, разделяется на дочерние волны, каждая из которых становится независимой, что приводит к появлению на ЭКГ различных ПДИкор. экстрасистолии и затем, когда, в конечном итоге, вместо одностороннего блока развивается полный блок проведения, аритмия купируется или наблюдается урежение экстрасистолии, в то время как применение антиаритмической терапии (ААТ) на эктопический очаг обычно неэффективно [Antzelevitch С., Burashnikov A. Overview of Basic Mechanisms of Cardiac Arrhythmia. Card. Electrophysiol. Clin. 2011; 3(1):23-45., Braunwald's Heart Disease: a textbook of cardiovascular medicine / Ed. by P.Libby et al. - Phyladelfhia, W.B. Saunders Company, 2018. - 2040 p.].
В широко распространенном методе выбора эффективного антиаритмического препарата для больных с экстрасистолией учитывается основное заболевание, на фоне которого развилась аритмия, характер экстрасистолии (желудочковая или наджелудочковая), ее прогностическая оценка, например, в отношении развития жизнеугрожающих аритмий или внезапной смерти, наличия противопоказаний и возможное развитие побочных эффектов [Мазур Н.А. Пароксизмальные тахикардии. - М.: ИД Медпрактика-М, 2005. - 252 с., Кардиология: национальное руководство / под ред. Е.В. Шляхто. - 2 издание дополненное и переработанное. М.: ГЭОТАР-Медиа, 2015. - 800 с.]. Следует отметить, что у больных с однородной аритмией и сходной основной патологией индивидуальная чувствительность к антиаритмическим препаратам различная [Кардиология: национальное руководство/ под ред. Е.В. Шляхто. - 2 издание дополненное и переработанное. М.: ГЭОТАР-Медиа, 2015. - 800 с.].
Начало действия фармакологических антиаритмических препаратов определяют как полупериод их полувыведения, так как положительный клинический антиаритмический эффект начинает проявляться в течение полупериода полувыведения после применения противоаритмических средств [Braunwald's Heart Disease: a textbook of cardiovascular medicine / Ed. by P.Libby et al. - Phyladelfhia, W.B. Saunders Company, 2007. - Р. 799-830].
Совокупность отличительных существенных признаков является новой и позволила сократить время выбора одного или нескольких эффективных антиаритмических препаратов для больных с экстрасистолией.
Для иллюстрации заявляемого способа приводим примеры из клинической практики:
Пример 1. Больной М., 26 лет, поступил в дневной стационар 11.09.2018 г. по направлению участкового врача по поводу частой желудочковой экстрасистолии. Из анамнеза известно, что в последние 1,5 месяца стал отмечать появление перебоев в работе сердца. При суточном мониторировании ЭКГ, выполненном амбулаторно 02.09.2018 г., было выявлено 22165 одиночных мономорфных ПЖЭ в среднем с частотой до 896 экстрасистол в час. При обследовании структурных изменений сердца, а также экстракардиальной патологии выявлено не было. На второй день пребывания больного в стационаре в 10 ч была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ в течение 5 минут было выявлено 47 ПЖЭ. Затем было рассчитано ЛО ПДИкор., составившее 11 мс и ИЭ по формуле:
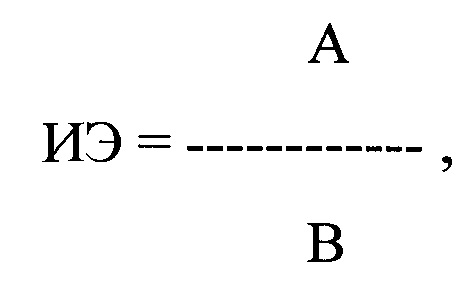
где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.

где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 11 мс в 45 ПЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 564 в час.
Больному был назначен пропафенон в дозе 150 мг × 3 раза в день (450 мг/сутки) с последующей регистрацией ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ через 3 ч после первого и второго применения пропафенона в течение 10 минут было выявлено 66 и 36 ПЖЭ. Затем было рассчитано ЛО ПДИкор., составившее 32 и 39 мс соответственно, и ИЭ после каждого приема препарата по формуле:
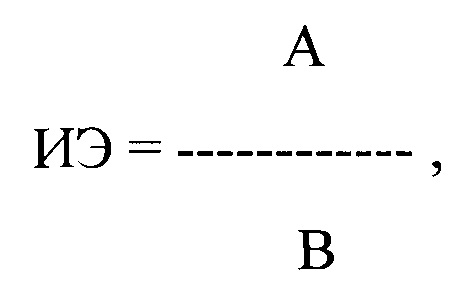
где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.
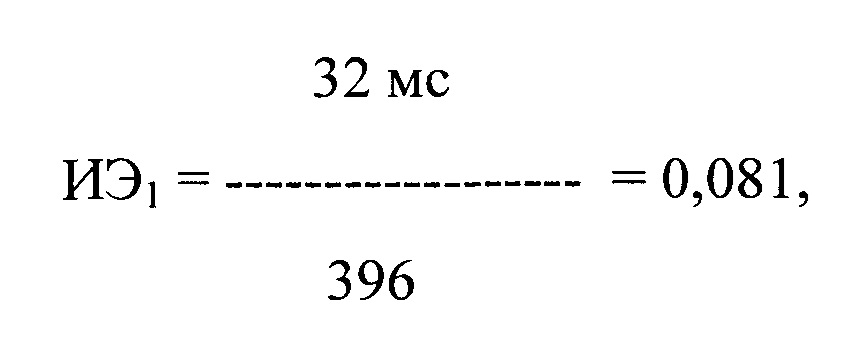
где ИЭ1 - индекс экстрасистолии после первого приема препарата, в числителе - ЛО ПДИкор., составившее 32 мс в 33 ПЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 396 в час.

где ИЭ2 - индекс экстрасистолии после второго приема препарата, в числителе - ЛО ПДИкор., составившее 39 мс в 36 ПЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 216 в час.
Затем рассчитали ΔИЭ по формуле: ΔИЭ = [(ИЭn-ИЭисх.)÷ИЭисх.]÷N, где ΔИЭ (в ед.) - изменение ИЭ после каждого приема одного препарата, через полупериод его полувыведения, в сравнении с исходными данными, ИЭисх. - значения ИЭ до использования препарата, ИЭn - значения ИЭ через полупериод полувыведения после первого, второго и последующих приемов препарата, N - количество приемов препарата;


где ΔИЭ1 и ΔИЭ2 - изменение ИЭ в сравнении с исходными данными после первого и второго приема препарата, ИЭисх. составил 0,02, ИЭ1 и ИЭ2 после первого и второго приема препарата составил 0,081 и 0,181.
После применения пропафенона ΔИЭ1 и ΔИЭ2 после первого и второго приема препарата составило 3,05 и 4,025.
Затем больному М., 26 лет последовательно, ежедневно было проведено тестирование противоаритмических препаратов - пропранолол в дозе 40 мг, метопролол в дозе 25 мг, карведиол в дозе 25 мг, аллапинин в дозе 25 мг, дизопирамид в дозе 200 мг в сутки, этацизин в дозе 50 мг, соталол в дозе 40 мг, амиодарон в дозе 400 мг. Все препараты принимались перорально 3 раза в день в течение не более 3 дней, т.к., согласно прототипу, для оценки эффективности антиаритмического средства его принимают в течение 3-4 дней [Кушаковский М.С.Аритмии сердца: руководство для врачей / М.С. Кушаковский. - 3-е изд, испр. и доп. - СПб.: Фолиант, 2004. - 672 с.]. Следует отметить, что каждый последующий препарат тестировался, как минимум, через три периода полувыведения предыдущего. При выявлении значений ΔИЭ ≥ 2 ед. после, как минимум, двух последовательных приемов препарата, определяли тестируемое антиаритмическое средство как эффективное для больных с экстрасистолией.
Результаты тестирования антиаритмических препаратов у больного М., 26 лет представлены в таблице №1.


Как видно из представленных данных, наибольшее увеличение ΔИЭ≥2 после двух последовательных применения препарата отмечалось при тестировании пропафенона, аллапинина, этацизина, соталола. Длительность выбора наиболее эффективного антиаритмического препарата у больного М., 26 лет составляет 26,7 дней.
В последующем было проведено тестирование противоаритмических препаратов, согласно прототипу: пропранолол в дозе 120 мг в сутки, метопролол дозе 100 в сутки соответственно, карведиол в дозе 50 мг в сутки, аллапинин в дозе 75 мг в сутки, этацизин в дозе 150 мг, дизопирамид в дозе 400 мг в сутки, соталол в дозе 160 мг в сутки, пропафенон в дозе 450 мг в сутки и в последнюю очередь - амиодарона в дозе 800 мг в сутки. Длительность тестирования каждого из антиаритмических препаратов, кроме амиодарона, составила 5 дней, а амиодарона - 10 дней. Таким образом, длительность тестирования 9 антиаритмических препаратов по прототипу, с учетом проведения суточного ЭКГ мониторирования после применения каждого препарата и 5 периодов полувыведения перед применением последующего антиаритмического средства, составила 106 дней.
Наилучший эффект был выявлен при тестировании пропафенона в дозе 450 мг в сутки - при проведении суточного мониторирования ЭКГ, было выявлено 155 ПЖЭ или около 6 экстрасистол в час, что соответствует уменьшению количества экстрасистол на 99,30% (табл. №2). 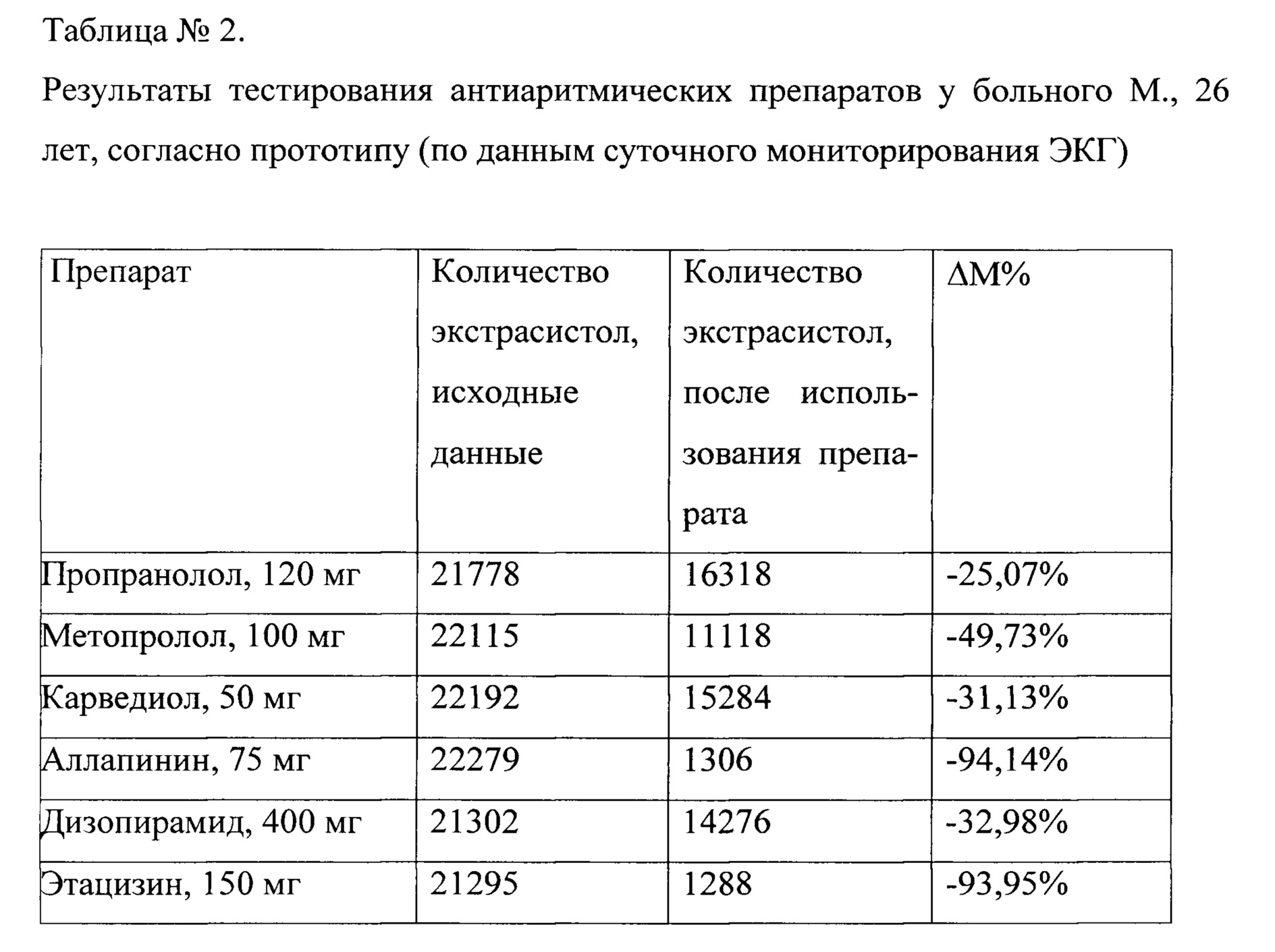

Сокращение времени выбора наиболее эффективного антиаритмического препарата, согласно предлагаемому способу, в сравнении с прототипом, определялось по формуле:

где СВ - сокращение времени выбора наиболее эффективного антиаритмического препарата (в %), n - количество исследуемых препаратов, А - длительность тестирования каждого препарата, согласно прототипу (в сутках), В - продолжительность полувыведения каждого препарата, согласно заявляемому способу (в сутках), Б - продолжительность проведения мониторирования ЭКГ (в сутках), С - длительность тестирования каждого препарата, согласно предлагаемому способу (в сутках),.

Таким образом, использование заявляемого способа, в сравнении с прототипом, позволяет в 2,97 раза (или на 297%) сократить время определения наиболее эффективного противоаритмического препарата для устранения ПЖЭ.
Пример 2. Больной К., 29 лет, поступил в дневной стационар 17.01.2019 г. по направлению участкового врача по поводу частой желудочковой экстрасистолии. Из анамнеза известно, что при диспансерном обследовании в декабре 2018 года была выявлена ПЖЭ. При суточном мониторировании ЭКГ, выполненном амбулаторно 24.12.2018 г., было выявлено 36278 одиночных мономорфных ПЖЭ в среднем с частотой до 1503 экстрасистол в час. При обследовании структурных изменений сердца, а также экстракардиальной патологии выявлено не было. На второй день пребывания больного в стационаре в 09 ч утра была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ в течение 5 минут было выявлено 121 ПЖЭ. Затем было рассчитано ЛО ПДИкор., составившее 14 мс и ИЭ по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.
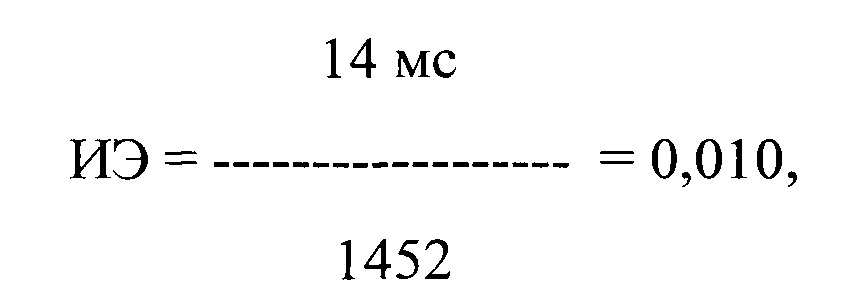
где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 14 мс в 121 ПЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 1452 в час.
Больному был назначен пропафенон в дозе 150 мг × 3 раза в день (450 мг/сутки) с последующей регистрацией ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ через 3 ч после первого и второго применения пропафенона в течение 5 минут было выявлено 78 и 57 ПЖЭ. Затем было рассчитано ЛО ПДИкор., составившее 22 и 33 мс соответственно, и ИЭ после каждого приема препарата по формуле:
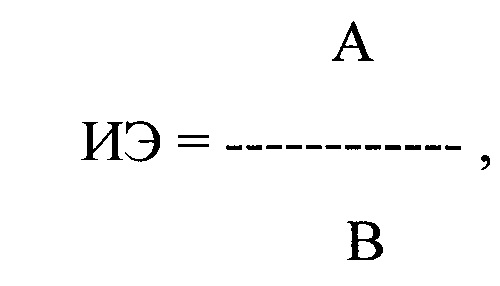
где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.
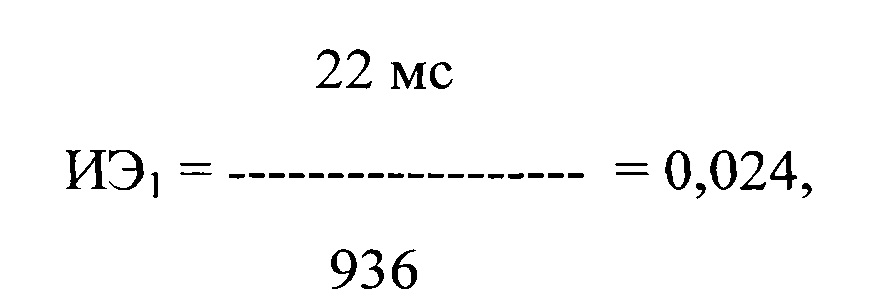
где ИЭ1 - индекс экстрасистолии после первого приема препарата, в числителе - ЛО ПДИкор., составившее 22 мс в 78 ПЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 936 в час.

где ИЭ2 - индекс экстрасистолии после второго приема препарата, в числителе - ЛО ПДИкор., составившее 33 мс в 57 ПЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 684 в час.
Затем рассчитали ΔИЭ по формуле: ΔИЭ=[(ИЭn - ИЭисх.)÷ИЭисх.]÷N, где ΔИЭ (в ед.) - изменение ИЭ после каждого приема одного препарата, через полпериода его полувыведения, в сравнении с исходными данными, ИЭисх. - значения ИЭ до использования препарата, ИЭn - значения ИЭ через полпериода полувыведения после первого, второго и последующих приемов препарата, N - количество приемов препарата;
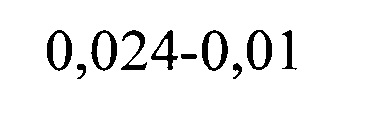

где ΔИЭ1 и ΔИЭ2 - изменение ИЭ в сравнении с исходными данными после первого и второго приема препарата, ИЭисх. составил 0,01, ИЭ1 и ИЭ2 после первого и второго приема препарата составил 0,024 и 0,048.
После применения пропафенона АИЭ1 и АИЭ2 после первого и второго приема препарата составило 1,4 и 1,9.
Затем больному К., 29 лет последовательно, ежедневно было проведено тестирование противоаритмических препаратов - пропранолол в дозе 40 мг, метопролол в дозе 25 мг, карведиол в дозе 25 мг, аллапинин в дозе 25 мг, ди-зопирамид в дозе 200 мг в сутки, этацизин в дозе 50 мг, соталол в дозе 40 мг, амиодарон в дозе 400 мг. При отсутствии эффекта монотерапии использовалась комбинация препаратов I и III классов, например, соталол + пропафенон, соталол + этацизин и т.д. Все препараты принимались перорально 3 раза в день в течение не более 3 дней, т.к. согласно прототипу для оценки эффективности антиаритмического средства его принимают в течение 3-4 дней [Кушаковский М.С. Аритмии сердца: руководство для врачей / М.С. Кушаковский. - 3-е изд, испр. и доп. - СПб.: Фолиант, 2004. - 672 с.]. Следует отметить, что каждый последующий препарат тестировался, как минимум, через три периода полувыведения предыдущего. При выявлении значений ΔИЭ≥2 ед. после, как минимум, двух последовательных приемов препарата, определяли тестируемое антиаритмическое средство как эффективное для больных с экстрасистолией.
Результаты тестирования антиаритмических препаратов у больного К., 29 лет представлены в таблице №3.


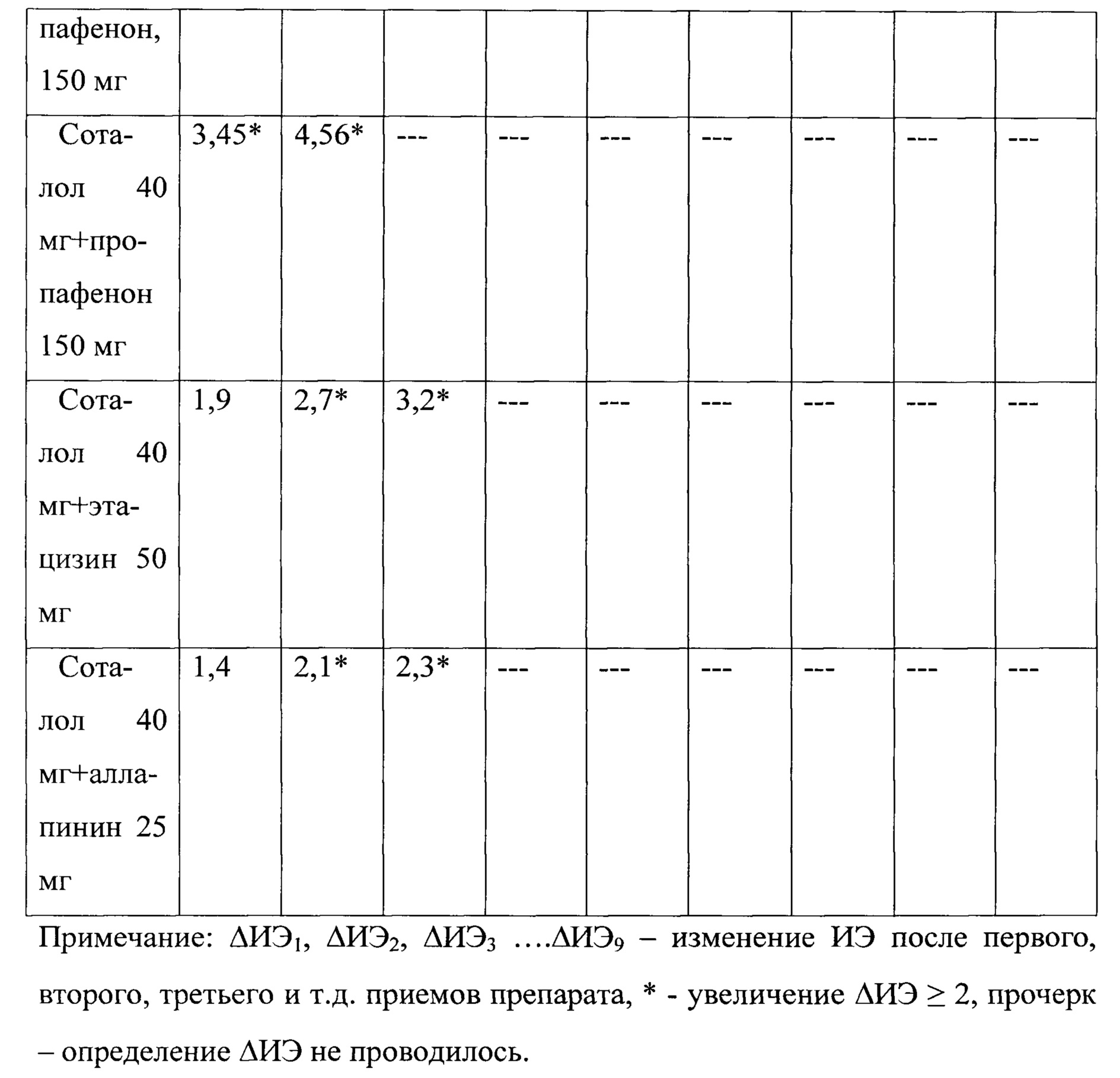
Как видно из представленных данных, наибольшее увеличение ΔИЭ≥2 после двух последовательных применения препарата отмечалось при тестировании комбинации соталол + пропафенон, соталол + аллапинин, соталол + этацизин. Длительность выбора наиболее эффективного антиаритмического препарата у больного К., 29 лет составляет 41,2 дней.
В последующем было проведено тестирование противоаритмических препаратов, согласно прототипу: пропранолол в дозе 120 мг в сутки, метопролол дозе 100 в сутки соответственно, карведиол в дозе 50 мг в сутки, аллапинин в дозе 75 мг в сутки, этацизин в дозе 150 мг, дизопирамид 400 мг в сутки, соталол в дозе 160 мг в сутки, пропафенон в дозе 450 мг в сутки, комбинации соталол в дозе 160 мг в сутки + пропафенон в дозе 450 мг в сутки, соталол в дозе 160 мг в сутки + аллапинин в дозе 75 мг в сутки и в последнюю очередь - амиодарона в дозе 800 мг в сутки, а также комбинации препаратов: соталол в дозе 160 мг в сутки + этацизин в дозе 150 мг в сутки. Длительность тестирования каждого из антиаритмических препаратов, кроме амиодарона, составила 5 дней, а амиодарона - 10 дней. Таким образом, длительность тестирования 12 антиаритмических препаратов по прототипу, с учетом проведения суточного ЭКГ мониторирования после применения каждого препарата и 5 периодов полувыведения перед применением последующего антиаритмического средства, составила 146 дней.
Длительность тестирования каждого из антиаритмических препаратов, кроме амиодарона, составила 5 дней), а амиодарона - 10 дней. Таким образом, длительность тестирования 12-ти антиаритмических препаратов по способу прототипу составила 65 дней. Наилучший эффект был выявлен при тестировании соталола в дозе 160 мг в сутки + пропафенона в дозе 450 мг в сутки - при проведении суточного мониторирования ЭКГ, было выявлено 1245 ПЖЭ или около 51 экстрасистол в час, что соответствует уменьшению количества экстрасистол на 96,54% (табл. №4).
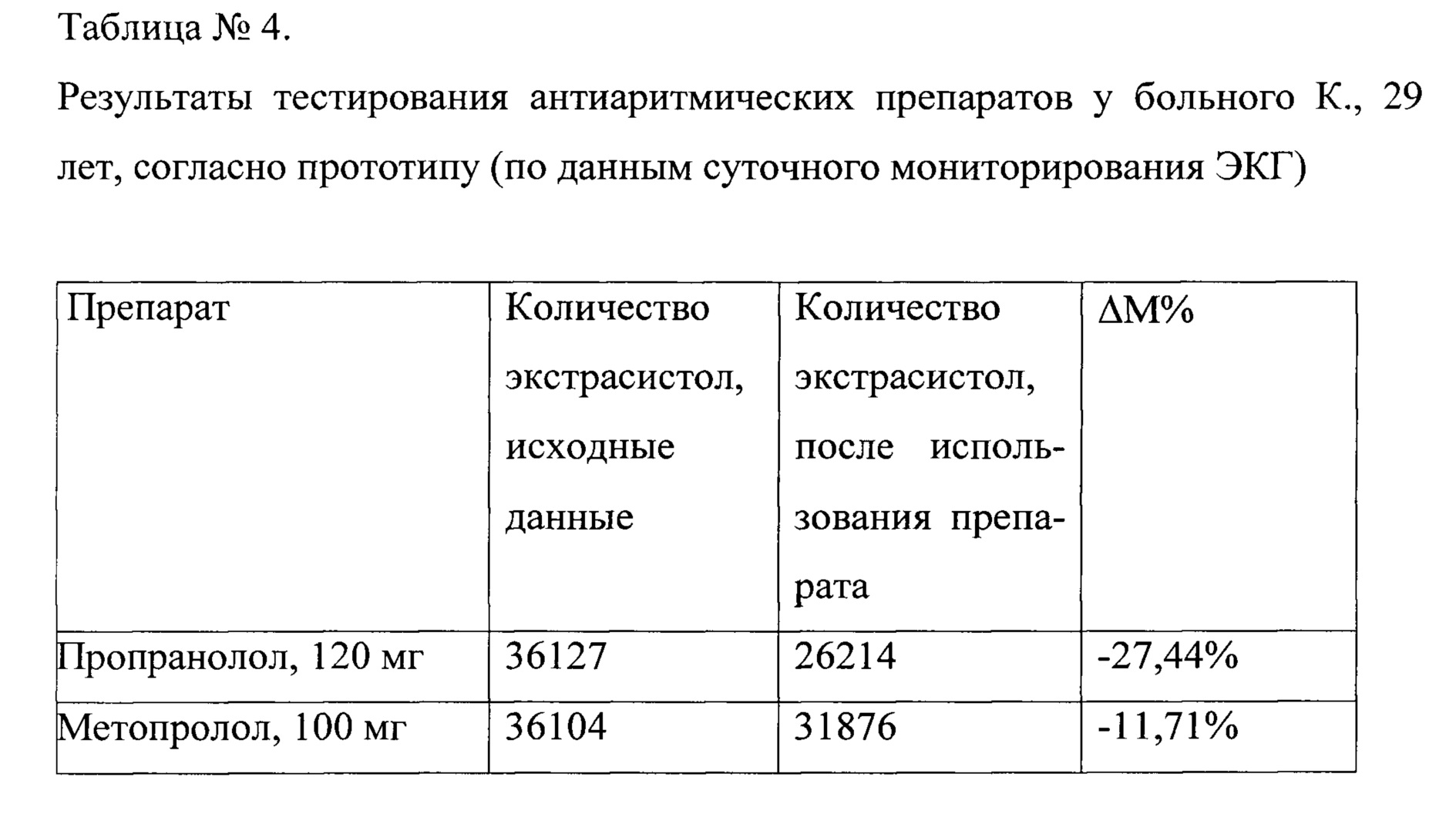
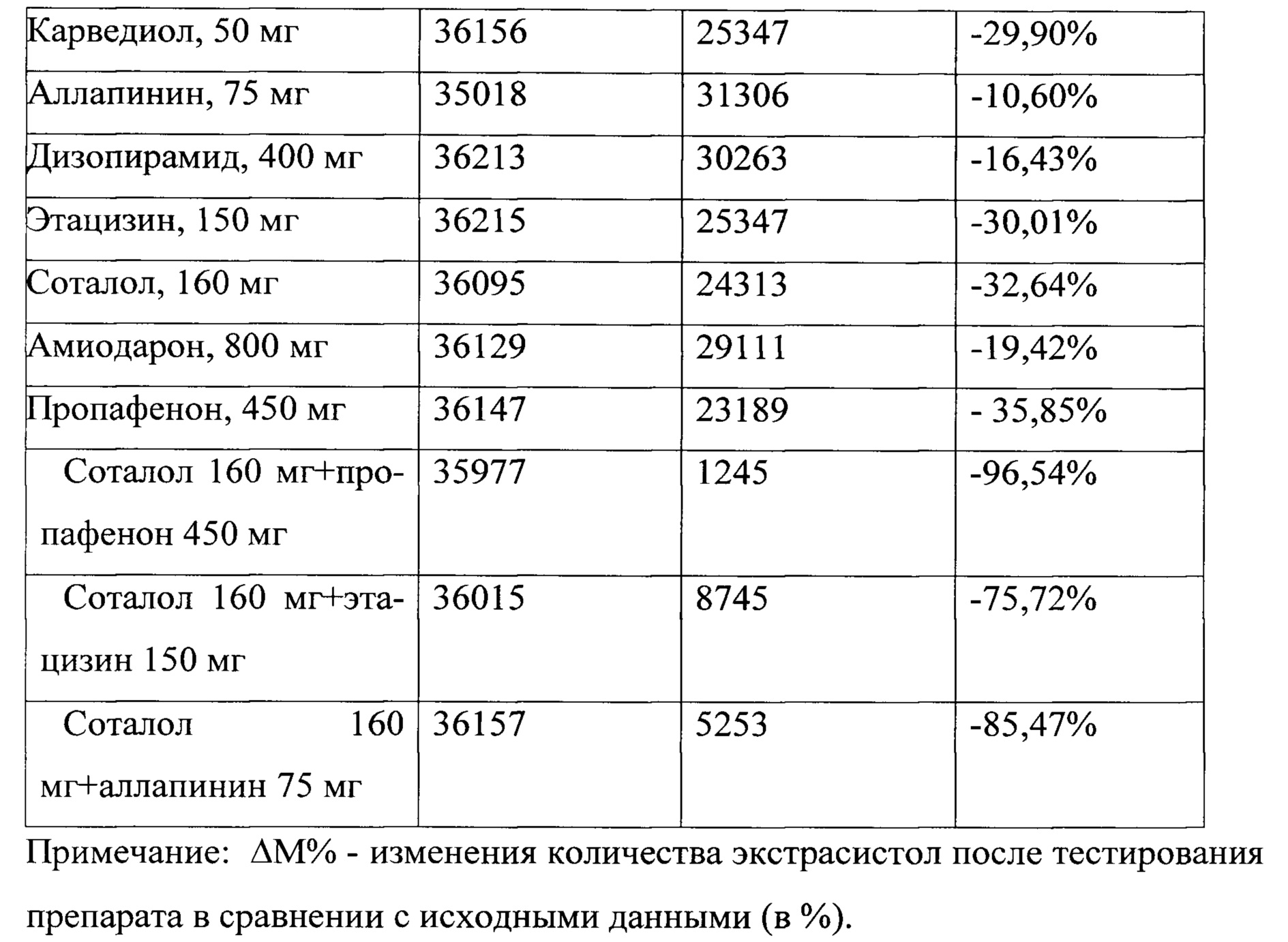
Сокращение времени выбора наиболее эффективного антиаритмического препарата, согласно предлагаемому способу, в сравнении с прототипом, определялось по формуле:
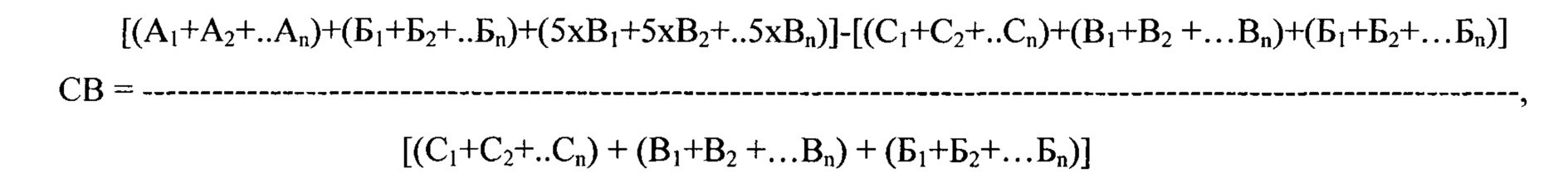
где СВ - сокращение времени выбора наиболее эффективного антиаритмического препарата (в %), n - количество исследуемых препаратов, А - длительность тестирования каждого препарата, согласно прототипу (в сутках), В - продолжительность полувыведения каждого препарата, согласно заявляемому способу (в сутках), Б - продолжительность проведения мониторирования ЭКГ (в сутках), С - длительность тестирования каждого препарата, согласно предлагаемому способу (в сутках),.


Таким образом, использование заявляемого способа, в сравнении с прототипом, позволяет в 2,54 раза (или на 254%) сократить время определения наиболее эффективного противоаритмического препарата для устранения ПЖЭ.
Пример 3. Больной Ф., 47 лет, поступил в дневной стационар 15.09.2018 г. направлению участкового врача по поводу частой желудочковой экстрасистолии. Из анамнеза известно, что больной страдает гипертонической болезнью в течение последних 14-16 лет. Постоянно принимает индапамид 2,5 мг в сутки, эналаприл 10 мг в сутки. В последние 3-4 недель стал отмечать появление перебоев в работе сердца. При суточном мониторировании ЭКГ, выполненном амбулаторно 04.09.2018 г., было выявлено 17344 одиночных мономорфных ЛЖЭ в среднем с частотой до 711 экстрасистол в час. На второй день пребывания больного в стационаре в 09 ч утра была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ в течение 5 минут было выявлено 61 ЛЖЭ. Затем было рассчитано ЛО ПДИкор., составившее 12 мс и ИЭ по формуле:
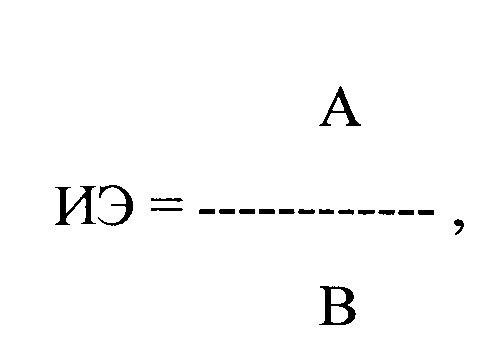
где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ЛЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.
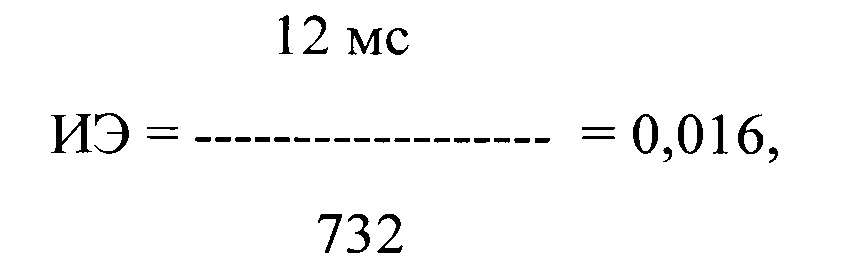
где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 12 мс в 61 ЛЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 732 в час.
Больному был назначен соталол в дозе 40 мг × 3 раза в день (120 мг/сутки) с последующей регистрацией ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ через 3 ч после первого и второго применения соталола в течение 5 минут было выявлено 42 и 27 ЛЖЭ. Затем было рассчитано ЛО ПДИкор., составившее 23 и 36 мс соответственно, и ИЭ после каждого приема препарата по формуле:

где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.
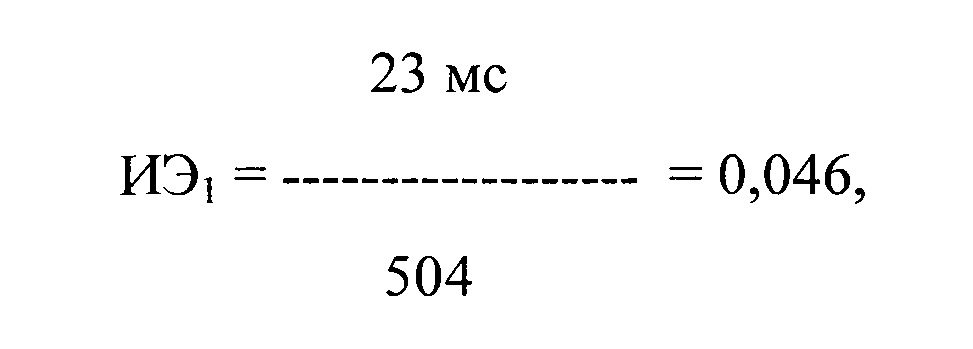
где ИЭ1 - индекс экстрасистолии после первого приема препарата, в числителе - ЛО ПДИкор., составившее 22 мс в 78 ЛЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 504 в час.

где ИЭ2 - индекс экстрасистолии после второго приема препарата, в числителе - ЛО ПДИкор., составившее 33 мс в 57 ЛЖЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 324 в час.
Затем рассчитали ΔИЭ по формуле: ΔИЭ=[(ИЭn - ИЭисх.)÷ИЭисх.]÷N, где ΔИЭ (в ед.) - изменение ИЭ после каждого приема одного препарата, через полпериода его полувыведения, в сравнении с исходными данными, ИЭисх. - значения ИЭ до использования препарата, ИЭn - значения ИЭ через полпериода полувыведения после первого, второго и последующих приемов препарата, N - количество приемов препарата;
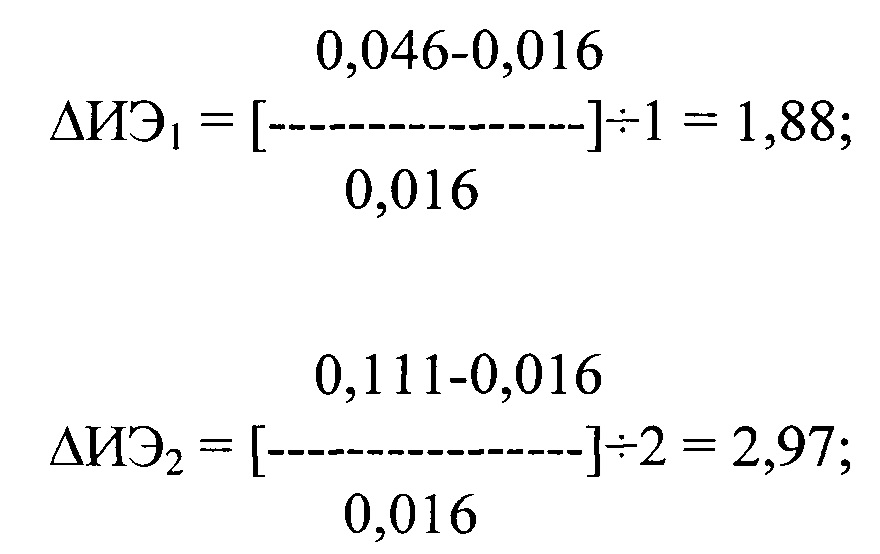
где ΔИЭ1 и ΔИЭ2 - изменение ИЭ в сравнении с исходными данными после первого и второго приема препарата, ИЭисх. составил 0,01 соответственно, ИЭ1 и ИЭ2 после первого и второго приема препарата составил 0,024 и 0,048 соответственно.
После применения пропафенона ΔИЭ1 и ΔИЭ2 после первого и второго приема препарата составило 1,88 и 2,97 соответственно.
Затем больному Ф., 47 лет последовательно, ежедневно было проведено тестирование противоаритмических препаратов - пропранолол в дозе 40 мг, метопролол в дозе 25 мг, карведиол в дозе 25 мг, аллапинин в дозе 25 мг, дизопирамид в дозе 200 мг в сутки, этацизин в дозе 50 мг, соталол в дозе 40 мг, амиодарон в дозе 400 мг. Все препараты принимались перорально 3 раза в день в течение не более 3 дней, т.к. согласно прототипу для оценки эффективности антиаритмического средства его принимают в течение 3-4 дней [Кушаковский М.С. Аритмии сердца: руководство для врачей / М.С. Кушаковский. - 3-е изд, испр. и доп. - СПб.: Фолиант, 2004. - 672 с.]. Следует отметить, что каждый последующий препарат тестировался, как минимум, через три периода полувыведения предыдущего. При выявлении значений ΔИЭ≥2 ед. после, как минимум, двух последовательных приемов препарата, определяли тестируемое антиаритмическое средство как эффективное для больных с экстрасистолией.
Результаты тестирования антиаритмических препаратов у больного Ф., 47 лет представлены в таблице №5.


Как видно из представленных данных, наибольшее увеличение ΔИЭ≥2 после двух последовательных применения препарата отмечалось при тестировании пропронолола, метопролола, карведиола, амиодарона и соталола. Длительность выбора наиболее эффективного антиаритмического препарата у больного Ф., 47 лет составляет 24,3 дней.
В последующем было проведено тестирование противоаритмических препаратов, согласно прототипу: пропранолол в дозе 120 мг в сутки, метопролол дозе 100 в сутки соответственно, карведиол в дозе 50 мг в сутки, аллапинин в дозе 75 мг в сутки, этацизин в дозе 150 мг, дизопирамид в дозе 400 мг в сутки, соталол в дозе 160 мг в сутки, пропафенон в дозе 450 мг в сутки, и в последнюю очередь - амиодарона в дозе 800 мг в сутки. Длительность тестирования каждого из антиаритмических препаратов, кроме амиодарона, составила 5 дней, а амиодарона - 10 дней. Таким образом, длительность тестирования 9 антиаритмических препаратов по прототипу, с учетом проведения суточного ЭКГ мониторирования после применения каждого препарата и 5 периодов полувыведения перед применением последующего антиаритмического средства, составила 104 дня. Наилучший эффект был выявлен при тестировании соталола в дозе 160 мг в сутки - при проведении суточного мониторирования ЭКГ, было выявлено 1245 ЛЖЭ или около 51 экстрасистол в час, что соответствует уменьшению количества экстрасистол на 96,54% (табл. №6).


Сокращение времени выбора наиболее эффективного антиаритмического препарата, согласно предлагаемому способу, в сравнении с прототипом, определялось по формуле:

где СВ - сокращение времени выбора наиболее эффективного антиаритмического препарата (в %), n - количество исследуемых препаратов, А - длительность тестирования каждого препарата, согласно прототипу (в сутках), В - продолжительность полувыведения каждого препарата, согласно заявляемому способу (в сутках), Б - продолжительность проведения мониторирования ЭКГ (в сутках), С - длительность тестирования каждого препарата, согласно предлагаемому способу (в сутках),.
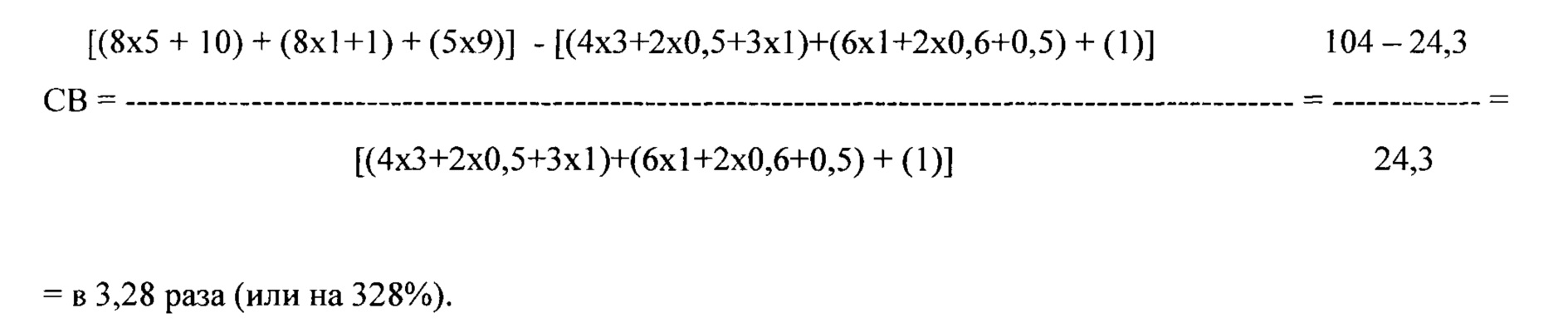
Таким образом, использование заявляемого способа, в сравнении с прототипом, позволяет в 3,28 раза (или на 328%) сократить время определения наиболее эффективного противоаритмического препарата для устранения ЛЖЭ.
Пример 4.
Больной К., 56 лет, поступил в дневной стационар 16.10.2018 г. по направлению участкового врача по поводу частой предсердной экстрасистолии (ПЭ). Из анамнеза известно, что больной страдает гипертонической болезнью, ожирением II степени в течение последних 10 лет. Постоянно принимает индапамид 2,5 мг в день. В последние 3-4 недели стал отмечать появление перебоев в работе сердца. При суточном мониторировании ЭКГ, выполненном амбулаторно 10.10.2018 г., было выявлено 22356 одиночных ПЭ или в среднем с частотой до 927 экстрасистол в час.
На второй день пребывания больного в стационаре в 10 ч утра была проведена регистрация ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ в течение 5 минут было выявлено 75 ПЭ. Затем было рассчитано ЛО ПДИкор., составившее 14 мс и ИЭ по формуле:
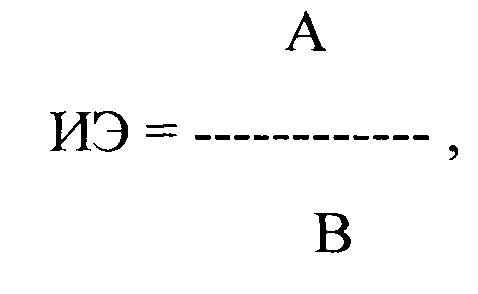
где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЖЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.

где ИЭ - индекс экстрасистолии, в числителе - ЛО ПДИкор., составившее 14 мс в 75 ПЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 900 в час.
Больному был назначен метопролол в дозе 25 мг × 3 раза в день (75 мг/сутки) с последующей регистрацией ЭКГ одновременно в 12 стандартных отведениях с помощью компьютерного комплекса «Полиспектр-ритм» (фирма «Нейрософт», г. Иваново). При регистрации ЭКГ через 3 ч после первого и второго применения соталола в течение 5 минут было выявлено 51 и 23 ПЭ.
Затем было рассчитано ЛО ПДИкор., составившее 32 и 48 мс соответственно, и ИЭ после каждого приема препарата по формуле:
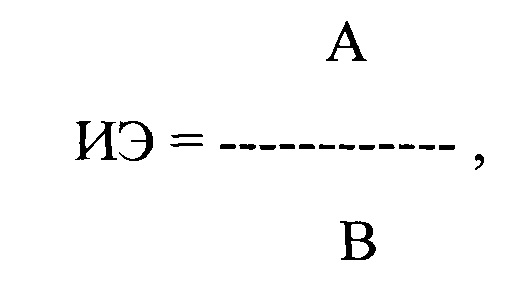
где ИЭ - индекс экстрасистолии, А - ЛО ПДИкор. не менее чем в 20 ПЭ, В - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час.

где ИЭ1 - индекс экстрасистолии после первого приема препарата, в числителе - ЛО ПДИкор., составившее 32 мс в 51 ПЭ, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 612 в час.

где ИЭ2 - индекс экстрасистолии после второго приема препарата, в числителе - ЛО ПДИкор., составившее 48 мс в 23 П, в знаменателе - число экстрасистол, используемых для исследования, выраженное в количестве экстрасистол в час и составившее 276 в час.
Затем рассчитали ΔИЭ по формуле: ΔИЭ=[(ИЭn - ИЭисх.)÷ИЭисх.]÷N, где ΔИЭ (в ед.) - изменение ИЭ после каждого приема одного препарата, через полпериода его полувыведения, в сравнении с исходными данными, ИЭисх. - значения ИЭ до использования препарата, ИЭn - значения ИЭ через полпериода полувыведения после первого, второго и последующих приемов препарата, N - количество приемов препарата;
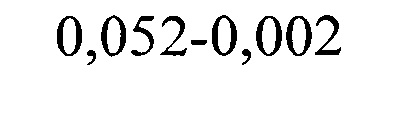
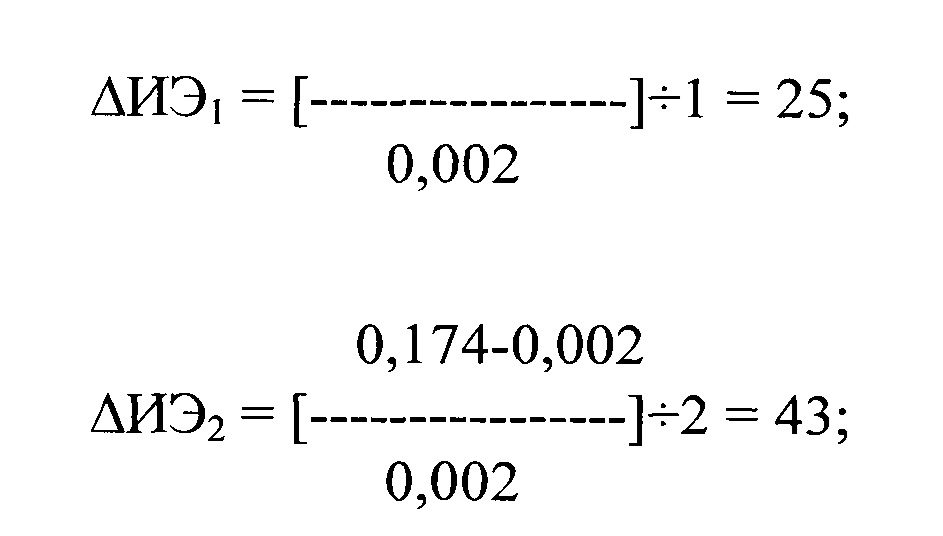
где ΔИЭ1 и ΔИЭ2 - изменение ИЭ в сравнении с исходными данными после первого и второго приема препарата, ИЭисх. составил 0,002, ИЭ1 и ИЭ2 после первого и второго приема препарата составил 0,052 и 0,174 соответственно.
После применения метопролола после первого и второго его приема ΔИЭ1 и ΔИЭ2 составили 25 и 43 соответственно.
Затем больному К., 56 лет последовательно, ежедневно было проведено тестирование противоаритмических препаратов - пропранолол в дозе 40 мг, метопролол в дозе 25 мг, карведиол в дозе 25 мг, аллапинин в дозе 25 мг, дизопирамид в дозе 200 мг в сутки, этацизин в дозе 50 мг, верапамил в дозе 40 мг, соталол в дозе 40 мг, амиодарон в дозе 400 мг. Все препараты принимались перорально 3 раза в день в течение не более 3 дней, т.к. согласно прототипу для оценки эффективности антиаритмического средства его принимают в течение 3-4 дней [Кушаковский М.С. Аритмии сердца: руководство для врачей / М.С. Кушаковский. - 3-е изд, испр. и доп.- СПб.: Фолиант, 2004. - 672 с.]. Следует отметить, что каждый последующий препарат тестировался, как минимум, через три периода полувыведения предыдущего. При выявлении значений ΔИЭ≥2 ед. после, как минимум, двух последовательных приемов препарата, определяли тестируемое антиаритмическое средство как эффективное для больных с экстрасистолией. Результаты тестирования антиаритмических препаратов у больного К., 56 лет представлены в таблице №7.

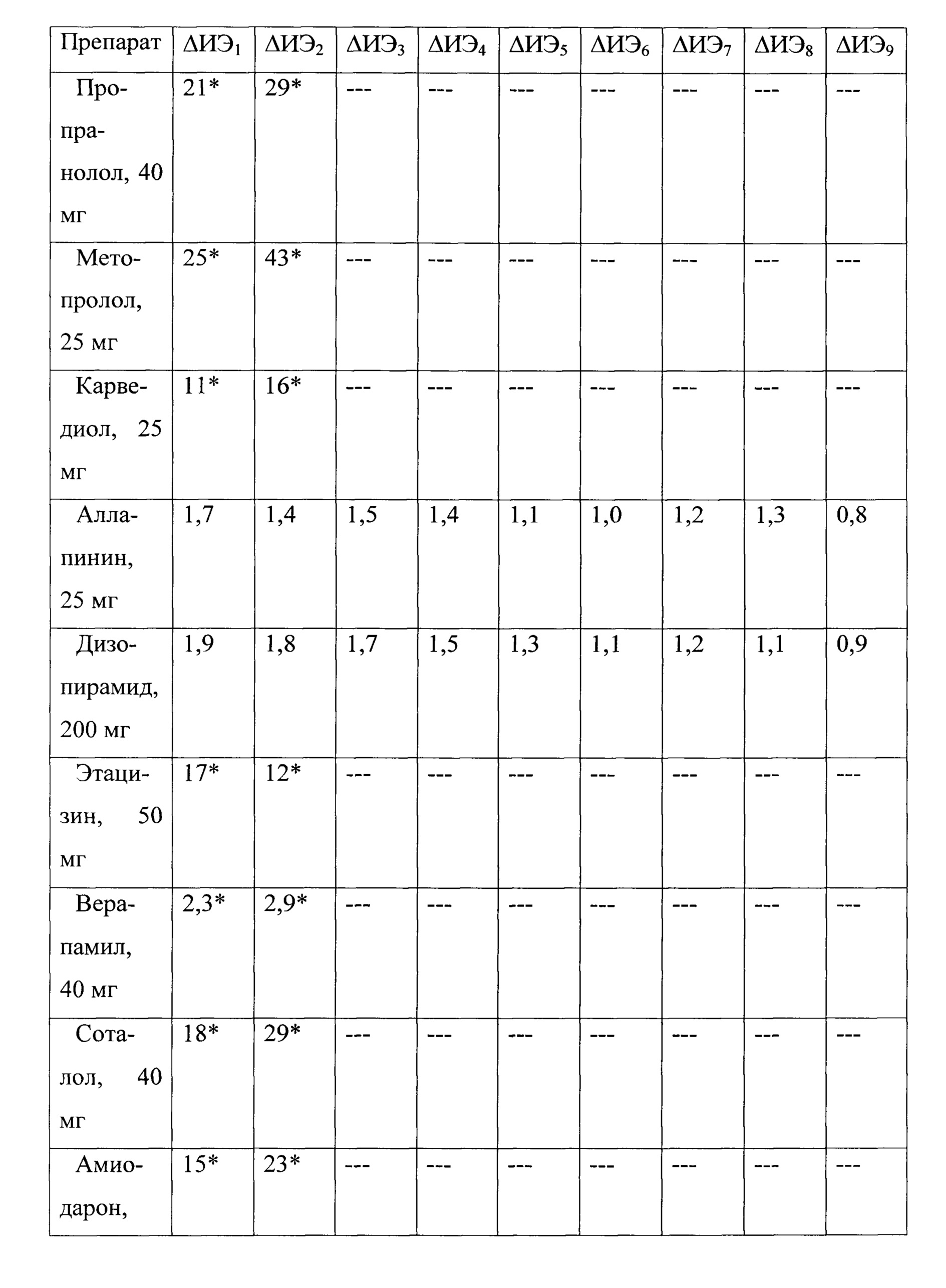

Как видно из представленных данных, наибольшее увеличение ΔИЭ≥2 после двух последовательных применения препарата отмечалось при тестировании всех препаратов, за исключением аллапинина и дизопирамида. Длительность выбора наиболее эффективного антиаритмического препарата у больного К., 56 лет составляет 13,7 дней.
В последующем было проведено тестирование противоаритмических препаратов, согласно прототипу: пропранолол в дозе 120 мг в сутки, метопролол дозе 100 в сутки соответственно, карведиол в дозе 50 мг в сутки, аллапинин в дозе 75 мг в сутки, этацизин в дозе 150 мг, дизопирамида в дозе 400 мг в сутки, соталол в дозе 160 мг в сутки, пропафенон в дозе 450 мг в сутки, верапамила в дозе 160 мг в сутки и в последнюю очередь - амиодарона в дозе 800 мг в сутки. Длительность тестирования каждого из антиаритмических препаратов, кроме амиодарона, составила 5 дней, а амиодарона - 10 дней. Таким образом, длительность тестирования 10 антиаритмических препаратов по прототипу, с учетом проведения суточного ЭКГ мониторирования после применения каждого препарата и 5 периодов полувыведения перед применением последующего антиаритмического средства, составила 115 дней. Наилучший эффект был выявлен при тестировании метопролола в дозе 100 мг в сутки - при проведении суточного мониторирования ЭКГ, было выявлено 984 ПЭ или около 41 экстрасистол в час, что соответствует уменьшению количества экстрасистол на 95,55% (табл. №8).
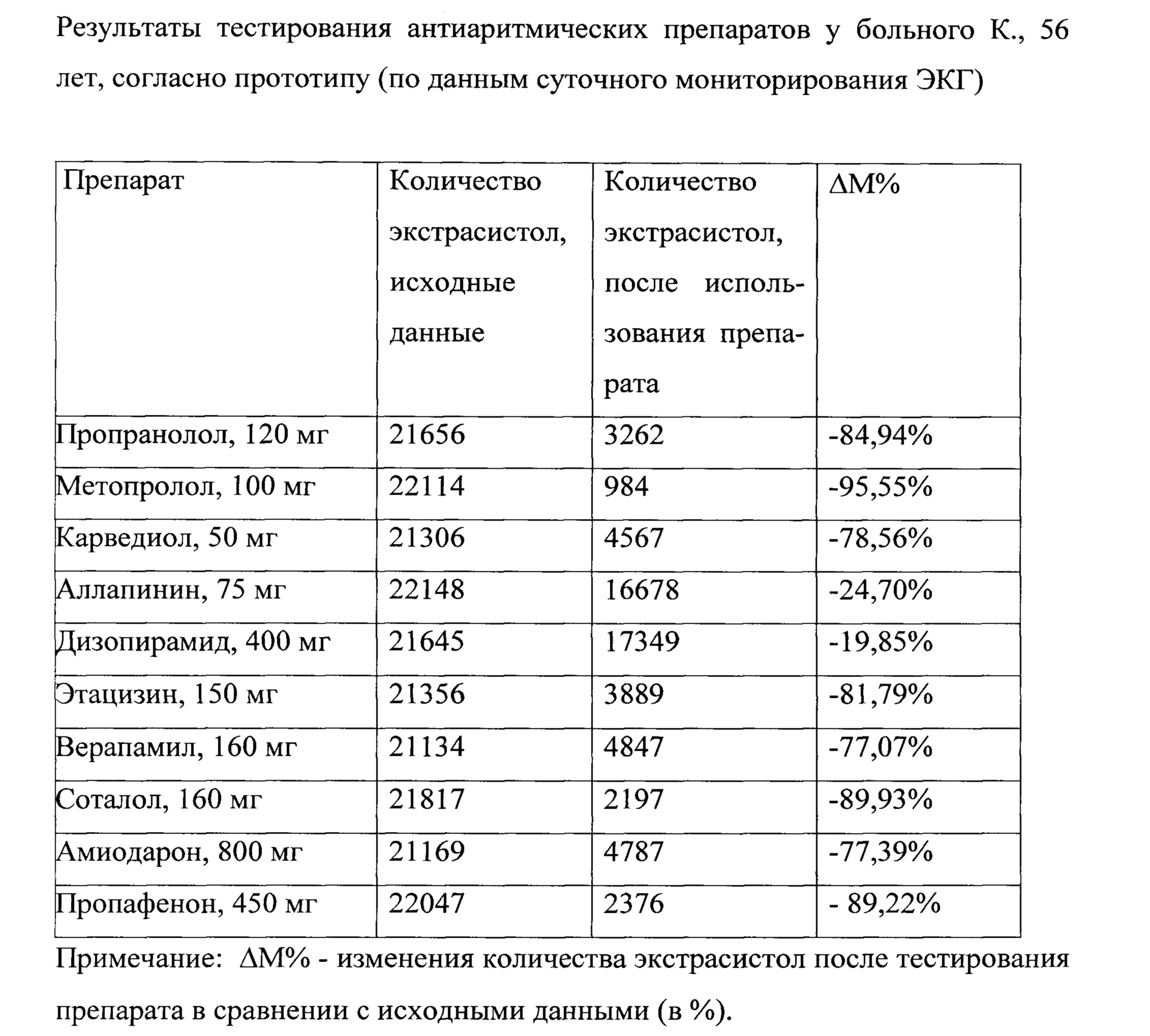
Сокращение времени выбора наиболее эффективного антиаритмического препарата, согласно предлагаемому способу, в сравнении с прототипом, определялось по формуле:
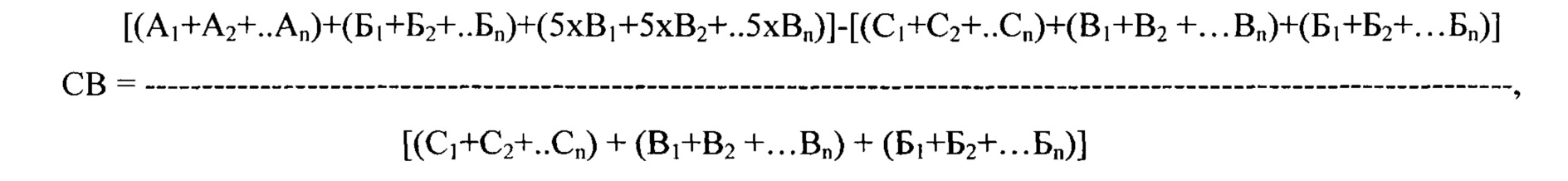
где СВ - сокращение времени выбора наиболее эффективного антиаритмического препарата (в %), n - количество исследуемых препаратов, А - длительность тестирования каждого препарата, согласно прототипу (в сутках), В - продолжительность полувыведения каждого препарата, согласно заявляемому способу (в сутках), Б - продолжительность проведения мониторирования ЭКГ (в сутках), С - длительность тестирования каждого препарата, согласно предлагаемому способу (в сутках),.

Таким образом, использование заявляемого способа, в сравнении с прототипом, позволяет в 7,39 раза (или на 739%) сократить время определения наиболее эффективного противоаритмического препарата для устранения ПЭ.
Наблюдалось 128 больных: в их число вошло 53(41,41%) - гипертонической болезнью, 29(22,48%)) - постмиокардитическим кардиосклерозом, у остальных - структурных изменений сердца выявлено не было. Всем больным гипертонической болезнью проводилась терапия антиагрегантами, ингибиторами ангиотензин превращающего фермента (ренитек, эналоприл, энап). У 45(35,15%) больных была выявлена ПЖЭ, у 48(37,50%) - ЛЖЭ, у остальных - ПЭ. Антиаритмические препараты до включения в исследование не назначались. Всем больным вначале использовались препараты II класса, а при их неэффективности - применялись средства I класса (Ia и Ic) или III, IV класса, а при их неэффективности - комбинации препаратов этих классов. Выбор антиаритмического препарата для устранения аритмии зависел от характера основного заболевания и формы экстрасистолии (Кушаковский М.С. Аритмии сердца: руководство для врачей / М.С. Кушаковский. - 3-е изд., испр. и доп. - СПб.: Фолиант, 2004. - 672 с.), Мазур Н.А. Пароксизмальные тахикардии. - М.: ИД Медпрактика-М, 2005. - 252 с.).
У всех больных определение эффективности ААТ экстрасистолии проводилось по заявляемому способу и прототипу. При проведении терапии, по заявляемому способу, антиаритмические препараты использовались перорально трехкратно, например, пропранолол в дозе 20-40 мг, метопролол в дозе 25-50 мг, карведиол в дозе 50 мг, аллапинин в дозе 25 мг, этацизин в дозе 50 мг, соталол в дозе 40-80 мг, дизопирамид в дозе 200-400 мг, этмозин в дозе 25-50 мг, дилтиазем в дозе 90 мг, пропафенон в дозе 150 мг, верапамил в дозе 40 мг, амиодарон в дозе 150-300 мг. Следует отметить, что каждый последующий препарат тестировался через 3-5 периодов полувыведения предыдущего. По результатам тестирования, согласно заявляемому способу, определились один или несколько эффективных антиаритмических препаратов. Тестирование антиаритмических препаратов, согласно прототипу, проводилось при использовании следующих препаратов: пропранолол в дозе 120-160 мг в сутки, метопролол дозе 100-150 в сутки, карведиол в дозе 50 мг в сутки, аллапинин в дозе 75 мг в сутки, этацизин в дозе 150 мг в сутки, дизопирамид в дозе 400 мг в сутки, пропафенон в дозе 450 мг в сутки, соталол в дозе 160 мг в сутки, верапамил в дозе 160 мг в сутки и в последнюю очередь - применялся амиодарон в дозе 800 мг в сутки. Длительность тестирования антиаритмических средств составила 5 дней, а амиодарона - 10 дней. Затем до и после тестирования препаратов проводилось суточное мониторирование ЭКГ, причем критерием положительного эффекта является уменьшение числа экстрасистол на 75% и более в сравнении с их исходной частотой, а также устранение парных, групповых экстрасистол, причем при отсутствие эффекта одного препарата, каждый последующий препарат тестируется, как минимум, через 5 периодов полувыведения предыдущего (Кушаковский М.С. Аритмии сердца: руководство для врачей / М.С. Кушаковский. - 3-е изд., испр. и доп. - СПб.: Фолиант, 2004. - 672 с.).
Сокращение времени выбора антиаритмического препарата, согласно предлагаемому способу, в сравнении с прототипом, определялось по формуле:
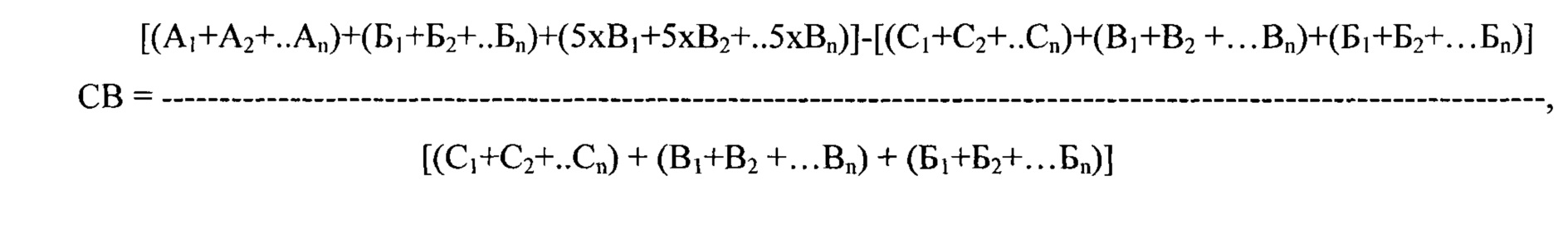
где СВ - сокращение времени выбора наиболее эффективного антиаритмического препарата (в %), n - количество исследуемых препаратов, А - длительность тестирования каждого препарата, согласно прототипу (в сутках), В - продолжительность полувыведения каждого препарата, согласно заявляемому способу (в сутках), Б - продолжительность проведения мониторирования ЭКГ (в сутках), С - длительность тестирования каждого препарата, согласно предлагаемому способу (в сутках),.
Статистический анализ полученных результатов проведен, используя стандартные компьютерные пакеты программ SPSS, версия 11,0.
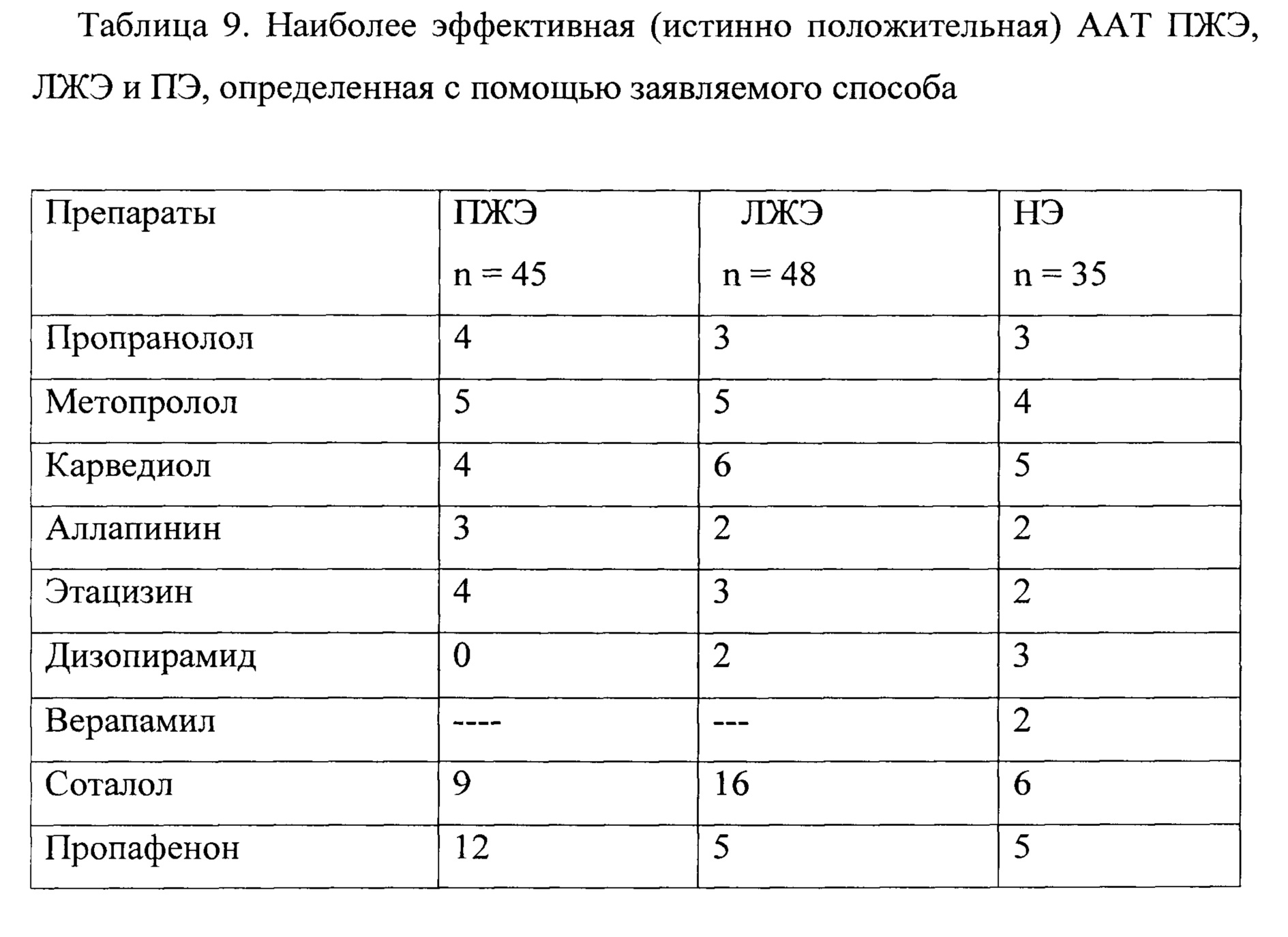
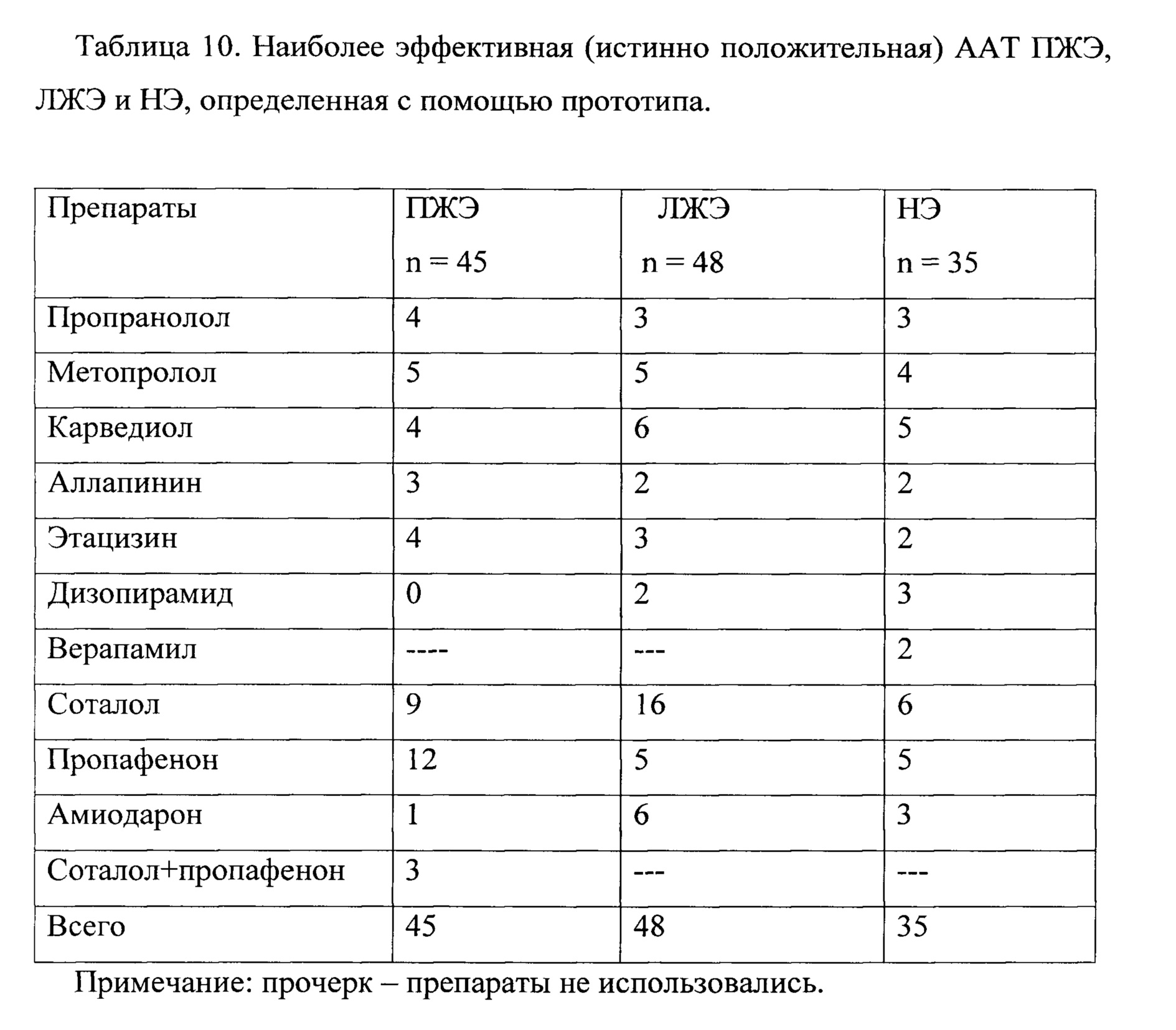
Наиболее эффективная (истинно эффективная) ААТ ПЖЭ, ЛЖЭ и ПЭ, определенная с помощью заявляемого способа, представлены в таблицах 9, 10. Как видно из представленных данных, выбор наиболее эффективного препарата, определенного с помощью заявляемого способа и прототипа, совпадает. Ложноположительный и истинно отрицательный выбор ААТ ПЖЭ, ЛЖЭ и ПЭ, определенной согласно прототипу, представлен в таблице №11.



Время выбора наиболее эффективного препарата для одного пациента, определенного с помощью заявляемого способа и прототипа, с учетом ложно положительных и истинно отрицательных результатов прототипа, для ПЖЭ в среднем составило 32,3±0,5 суток и 118±4 суток, для ЛЖЭ - 19,2±0,4 суток и 111±3 суток и для ПЭ - 29,5±0,3 суток и 127±5 суток. Сокращение времени выбора наиболее эффективного антиаритмического препарата с помощью предлагаемого способа в сравнении с прототипом составило:


СВ - сокращение выбора наиболее эффективного антиаритмического препарата с помощью предлагаемого способа в сравнении с прототипом отдельно для ПЖЭ, ЛЖЭ и ПЭ.
Таким образом, выбор наиболее эффективного антиаритмического препарата по заявляемому способу, в сравнении с прототипом, сокращается отдельно для ПЖЭ в среднем 2,65 раза, для ЛЖЭ - в 4,78 раза, для НЭ - в 3,31 раза.