Результат интеллектуальной деятельности: Мутантная рекомбинантная термостабильная фитаза
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, а именно к получению новых термостабильных фитаз методами генетической инженерии.
Фитазы представляют собой ферменты, катализирующие последовательный гидролиз фитатов до мио-инозитола и неорганического фосфата.
Известно, что более 70% фосфора, содержащегося в растительных кормах для цыплят бройлеров, находится в форме фитиновой кислоты и ее солей фитатов. Так как животные с однокамерным желудком не способны усваивать фитатный фосфор, то не усвоенные фитаты, попадая в почву и водоемы, вызывают загрязнение окружающей среды. Кроме того, фитаты уменьшают доступность белков и микроэлементов в кормах.
В связи с этим, фитазы, отщепляющие фосфатные группы от фитатов, с успехом используют в животноводстве в качестве кормовой добавки, значительно повышая усвояемость фосфора.
Для практического использования препараты фитаз должны быть устойчивы к высушиванию и действию высоких температур (60-80°С) в процессе приготовления комбикормов, а также обладать высокой удельной активностью и эффективно функционировать при температуре, соответствующей физиологической температуре животных.
Получить термостабильные варианты фитаз можно путем замены аминокислотных остатков в последовательности ферментов, применяя различные методы мутагенеза.
Известно [J. Mol. Biol, 1998, v. 278, р. 279-289], что вклад аминокислоты в формирование третичной структуры фермента определяется не только ее природой, но и ее положением в аминокислотной последовательности и, следовательно, осуществляя точечные замены аминокислот, находящихся в значимых положениях аминокислотной последовательности, можно добиться изменения структурных свойств белка (и его термостабильности). Однако, увеличение термостабильности белка приводит к снижению его удельной активности, поэтому создание ферментов с оптимальным соотношением значений активности и термостабильности является актуальной задачей.
Так, методом насыщающего мутагенеза были заменены некоторые аминокислотные остатки в аминокислотной последовательности фитазы Escherichia coli и была получена мутантная термостабильная фитаза [US 20060183213]. Такая фитаза способна работать в условиях низких рН в гастроэнтеральном тракте животных, однако имеет небольшую удельную активность (800 ед/мг белка при 37°С) и термостабильность (сохраняет 40% активности после воздействия на нее температуры 60°С в течение 30 минут).
Известна мутантная термостабильная фитаза [Appl Microbiol Biotechnol, 2008, v. 79, p. 69-75], полученная путем применения метода error-prone PCR к гену, кодирующему фитазу аррА E.coli. Фитаза сохраняет 60% активности после воздействия на нее температуры 80°С в течение 10 минут, однако также имеет небольшую удельную активность (905 ед/мг белка при 37°С), и способна работать только в очень узком диапазоне рН (2,5-4,0).
Известна [Биотехнология, 2003, №2, с. 3-10, AAR89622.1, GenBank] фитаза PhyCf, выделенная из бактерий Citrobacter freundii. Удельная активность рекомбинантного фермента, экспрессированного в дрожжах Pichia pastoris, составляет 2770 ед/мг белка Определение устойчивости такой фитазы к действию высокой температуры показало, что после прогрева в течение 10 минут при 60°С фермент сохраняет около 10% активности, а после прогрева в течение 10 минут при 80°С фермент инактивируется полностью, т.е. термостабильность фермента низка [Гордеева Т.Л. Разработка молекулярно-генетических подходов для оптимизации промышленно-важных характеристик фитазы Citrobacter freundii. Автореферат на соискание ученой степени кандидата биологических наук, Москва, 2010, с. 17.].
Путем замены некоторых аминокислотных остатков в аминокислотной последовательности фитазы из Citrobacter freundii методом мутагенеза были получены различные варианты этой фитазы с повышенной термостабильностью [Патент №2472855, US 9.273,295 В2 DuPont Nutrition Biosciences APS]. Была получена мутантная фитаза с аминокислотными заменами V41D/K46M/P128S остаточная активность которой после прогрева при 80°С в течение 10 минут составляла 35% [Гордеева Т.Л. Разработка молекулярно-генетических подходов для оптимизации промышленно-важных характеристик фитазы Citrobacter freundii. Автореферат на соискание ученой степени кандидата биологических наук, Москва, 2010, с. 17].
Задачей заявляемого изобретения является расширение арсенала термостабильных фитаз.
Поставленная задача решена тем, что получена мутантная рекомбинантная термостабильная фитаза PhyCf-t, имеющая аминокислотную последовательность, соответствующую аминокислотной последовательности фитазы PhyCf из Citrobacter freundii [AAR89622.1, GenBank],, в которой аминокислотный остаток лизина в положении 46, соответствующий в зрелой части белка положению 24, заменен на аминокислотный остаток метионина, а аминокислотный остаток лизина в положении 138, соответствующий в зрелой части белка положению 116, заменен на аминокислотный остаток глутаминовой кислоты.
Для получения мутантной фитазы синтетический ген phyCf-mod, имеющий нуклеотидную последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 1, и кодирующий фитазу PhyCf из бактерий Citrobacter freundii, подвергают сайт-направленному мутагенезу [Archives of Biochemistry and Biophysics, 2000, v. 382, №1, p. 105-112], и получают мутантный синтетический ген phyCf-t SEQ ID NO: 2 кодирующий мутантную рекомбинантную фитазу PhyCf-t, начиная с 23 аминокислотного остатка последовательности SEQ ID NO: 3.
Полученный ген phyCf-t клонируют в вектор, подходящий для ее трансформации в клетки Pichia pastor is. Так как в силу «вырожденности» генетического кода одна и та же аминокислотная последовательность может кодироваться большим числом нуклеотидных последовательностей, для клонирования может быть использована не только сама вышеуказанная нуклеотидная последовательность (ген phyCf-t), но и все ее формы, определяемые вырожденностью генетического кода.
Полученной рекомбинантной плазмидой осуществляют трансформацию штамма-реципиента и получают трансформанты. Отбирают клон, продуцирующий термостабильную фитазу, наличие которой определяют в культуральной жидкости по методу Фиске-Суббароу [J. Biol. Chem., v. 66, p. 376-400].
Пример 1. Конструирование рекомбинантной плазмиды pP10-PhyCf-ts
1. Получение мутантного гена phyCf-ts
Мутантный ген phyCf-ts, содержащий нуклеотидные замены в положениях А71/Т и A346/G, получают применяя метод сайт-направленного мутагенеза к синтетическому гену phyCf-mod, кодирующему фитазу PhyCf.
Для этого ПЦР методом синтезируют три фрагмента ДНК, используя следующие праймеры (нуклеотидные замены в приведенных последовательностях подчеркнуты):
а) Для синтеза первого фрагмента
прямой -PhyCf-ts-D (5'-aggaattcGAAGAACAAAATGGTATGAA-3')
обратный - А71/Т-r (5'-TCATGATTGGAGTGAATATGGTA-3')
в) Для синтеза второго фрагмента
прямой - А71/T-f (5'-GTTCGTGCACCTACCATATTCA-3')
обратный - A346/G-r (5'-GTCTTTTCCTCGTCCTCTTGGTA-3')
с) Для синтеза третьего фрагмента
прямой - A346/G-f (5'-ATTCAAGTACACTACCAAGAGGA-3')
обратный - PhyCf-ts-R (5'-agcggccgcAGTGTGCAGTAACGGAATAA-3').
В качестве матрицы для проведения полимеразной цепной реакции используют синтетическую ДНК последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 1, имеющую размер 1236 п.н.
Для проведения полимеразной цепной реакции используют 100 мкл реакционной смеси содержащей 0,5 нг ДНК-матрицы, по 1 мкМ соответствующего прямого и обратного праймеров, 2,5 ед. Pfu-полимеразы, 10 мкл 10х Pfu-буфера, 0,8 мМ dNTP. Реакцию осуществляют по следующей схеме: 94°С - денатурирование (1 мин.), 57°С -отжиг (1 мин.), 72°С - полимеризация (50 сек.). Всего проводят 30 циклов амплификации. Амплифицированные фрагменты ДНК очищают в агарозном геле и затем при помощи «DNA extraction KIT» (Thermd Scientific). Наработанные фрагменты имеют следующие размеры:
- первый фрагмент 88 пар нуклеотидов;
- второй фрагмент 308 пар нуклеотидов;
- третий фрагмент 909 пар нуклеотидов
Мутантный ген phyCf-t синтезируют методом полимеразной цепной реакции из трех вышеописанных фрагментов. Для проведения ПЦР используют 100 мкл реакционной смеси содержащей 0,2 нг каждого ДНК-фрагмента, по 2 мкМ соответствующего прямого PhyCf-t-D и обратного PhyCf-t-R праймеров, 2,5ед. Pfu-полимеразы, 10 мкл 10x Pfu-буфера, 0,8 мМ dNTP. Реакцию осуществляют по следующей схеме: 94°С - денатурирование (1 мин.), 57°С - отжиг (1 мин.), 72°С - полимеризация (1 мин.). Всего проведено 30 циклов амплификации. Из агарозного геля выделен амплифицированный фрагмент ДНК, размером 1236 пар нуклеотидов, соответствующий мутантному гену phyCf-ts, который очищен при помощи «DNA extraction KIT»
2. Конструирование плазмиды pP10-PhyCf-ts.
Полученный фрагмент ДНК phyCf-t гидролизуют эндонуклеазами рестрикции EcoR1 и Not1 (Thermo Scientific), очищают в агарозном геле и лигируют с вектором рР10 (описан в RU 2388823), который в качестве сайта интеграции содержит последовательность ДНК, кодирующую область 18S рРНК, в качестве селективного маркера для отбора трансформантов в клетках Escherichia coli содержит селективный маркер bla, в качестве сайта начала репликации содержит pUC ori, в состав экспрессионной кассеты входит промотор GAP, терминатор транскрипции АОХ1, селективный маркер HIS4, а в качестве сигнального пептида вектор содержит 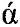 -амилазный сигнальный пептид.
-амилазный сигнальный пептид.
Предварительно вектор рР10 расщепляют ферментами рестрикции по сайтам EcoR1-Not1. Лигазной смесью трансформируют компетентные клетки E.coli С600 [Т.Маниатис, Э.Фрич, Дж.Сэмбрук, Молекулярное клонирование, Москва, "Мир", 1984, с. 84], приготовленные накануне обработкой хлористым кальцием. После стандартной процедуры трансформации (0°С - 40 мин, 42°С - 2 мин, 0°С - 5 мин) клетки разводят в 10 раз средой LB [Т.Маниатис, Э.Фрич, Дж.Сэмбрук, Молекулярное клонирование, Москва, "Мир", 1984, с. 84], подращивают в течение одного часа и высевают на плотную агаризованную среду LB [Т.Маниатис, Э.Фрич, Дж.Сэмбрук, Молекулярное клонирование, Москва, "Мир", 1984, с. 84], содержащую ампициллин в концентрации 50 мкг/мл. Посевы инкубируют при 37°С.
На следующие сутки выросшие устойчивые к ампициллину колонии тестируют с помощью вышеприведенных праймеров и отбирают позитивные клоны, из которых выделяют плазмидную ДНК по стандартной методике (Т.Маниатис, Э.Фрич, Дж.Сэмбрук, Молекулярное клонирование, Москва, "Мир", 1984, с. 89). Выделенные плазмидные ДНК гидролизуют эндонуклеазами рестрикции EcoR1 и Not1, размер полученных фрагментов определяют с помощью гель-электрофореза. Затем отбирают клон, плазмидная ДНК которого содержит последовательность, соответствующую размеру последовательности (1236 пар нуклеотидов), кодирующей ген phyCf-t.
Из отобранного клона выделяют рекомбинантную плазмиду рР10-PhyCf-t. Ген phyCf-t секвенируют. Нуклеотидная последовательность гена phyCf-t соответствует последовательности, приведенной в перечне последовательностей под номером SEQ ID NO: 2, и кодирует аминокислотную последовательность, соответствующую зрелой части фитазы PhyCf-t (с 23 аминокислотного остатка), приведенную в перечне последовательностей под номером SEQ ID NO: 3, отличающуюся от последовательности фитазы из Citrobacter freundii заменой в позициях 46 и 138.
Пример 2. Конструирование штамма Pichia pas tor is PhyCf-ts - продуцента заявляемой фитазы
Для получения штамма Pichia pastoris PhyCf-t, клетки штамма Pichia pastoris GS115 (his4-) ВКПМ Y-2837 трансформируют плазмидой рР10-PhyCf-t которую предварительно гидролизуют рестриктазой Bglll.
1 мл ночной культуры клеток Pichia pastoris Y-2837 выращивают в 100 мл среды YEPD [https://ru.wikipedia.org/wiki/YEPD] при 30°С до достижения культурой оптической плотности, соответствующей 2 ед. поглощения при длине волны 600 нм. Клетки дважды промывают стерильной водой, после чего суспендируют в 0,3 мл 100 мМ раствора ацетата лития и инкубируют при 30°С в течение 30 мин. К 50 мкл полученной суспензии клеток добавляют 1 мкг плазмидной ДНК, 50 мкг ДНК спермы лосося, предварительно денатурированной нагреванием (10 мин при 100°С), и 0,3 мл раствора 100 мМ ацетата лития, содержащего 40% полиэтиленгликоля 4000. Далее пробу инкубируют 30 мин при 30°С и 20 минут при 42°С, помещают на 15 секунд в ледяную баню и отделяют клетки центрифугированием в течение 10 секунд при 10000 об/мин. Клетки суспендируют в 1 мл стерильной воды и высевают на твердую среду М9 [Т.Маниатис, Э.Фрич, Дж.Сэмбрук, Молекулярное клонирование, Москва, "Мир", 1984, с. 84] без источника гистидина с добавлением 0,3 об. % микроэлементов). Клоны трансформантов выращивают 2 суток.
Полученные трансформанты высевают в жидкую среду YEPD и выращивают при 30°С до стационарной фазы роста в течение 2 суток. Далее клетки осаждают центрифугированием при 10000 об/мин в течение 5 минут, отбирают 100 мкл супернатанта и определяют фитазную активность по накоплению в реакционной среде свободного фосфат-иона, детектируемого методом Фиске-Субарроу. Одна единица активности фермента соответствует высвобождению 1 мкМоль фосфата за 1 минуту. Активность фермента измеряют при помощи спектрофотометра при длине волны 700 нм.
Трансформант, показавший наибольшую фитазную активность культуральной жидкости 11-3, выбран для наработки фермента фитазы с целью определения ее термостабильности.
Пример 3. Оценка свойств заявляемой фитазы
Посевную культуру трансформанта 11-3 выращивают в 5 мл жидкой среды YEPD при 30°С в течение ночи. Полученную ночную культуру переносят в колбу Эрленмейера, объемом 750 мл, содержащую 100 мл среды YEPD, в соотношении 1:100. Культуру инкубируют при 30°С и интенсивном встряхивании (240 об/мин) до достижения стационарной фазы в течение 2 суток. Фитазную активность трансформанта измеряют как описано выше. Активность составляет 200 ед/мл культуральной жидкости.
Для определения удельной активности фитазу PhyCf-t очищают, используя метод гель-хроматографии [Юркевич В.В., Малый практикум по биохимии. Издательство МГУ, 1979. стр. 159-175.]. Образцы готовят с помощью диализа против буфера (50 тМ Tris-HCl, рН 7.0, 1М NaCl) в течение ночи и наносят на колонку Superdex 75-HR, уравновешенную при помощи того же буфера. Колонку предварительно калибруют с использованием белковых маркеров #SM0431 (Thermo Scientific). Количество белка на выходе колонки измеряют при помощи УФ-детектора при длине волны 280 нм. От солей буфера образец фитазы очищают диализом против воды в течение ночи. Количество белка определяют по методу Бредфорда согласно инструкции к Bradford Reagent В 6916 (Sigma) [https://www.sigmaaldrich.com/catalog/product/sigma/b6916?lang=en®ion=RU].
Затем отбирают аликвоту, содержащую 30 мкг очищенного фермента и измеряют его фитазную активность по методу Фиске-Субарроу.
Активность отобранного образца составила 69,1 единиц, т.е. удельная активность фермента PhyCf-t равна 2303 ед/мг белка.
Для определения устойчивости к действию высокой температуры образец фитазы PhyCf-t инкубируют при температуре 80°С в течение 10 мин, а затем при 5°С в течение 30 мин с целью ренатурации белка. Остаточная удельная активность составляет 875 ед/мг белка, т.е. мутантная термостабильная фитаза PhyCf-t после прогрева при температуре 80°С в течение 10 минут сохраняет 38% активности.
Мутантная рекомбинантная термостабильная фитаза PhyCf-t, зрелая часть которой имеет аминокислотную последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 3, начиная с 23 аминокислотного остатка, отличающуюся от последовательности фитазы PhyCf из Citrobacter freundii заменой аминокислотного остатка лизина в положении 46, соответствующего в зрелой части белка положению 24, на аминокислотный остаток метионина, и заменой аминокислотного остатка лизина в положении 138, соответствующего в зрелой части белка положению 116, на аминокислотный остаток глутаминовой кислоты.




