Результат интеллектуальной деятельности: ЭКСПРЕСС-СПОСОБ ОПРЕДЕЛЕНИЯ ИНГИБИТОРОВ БУТИРИЛХОЛИНЭСТЕРАЗЫ В ВОДЕ И ВОДНЫХ ЭКСТРАКТАХ
Вид РИД
Изобретение
Изобретение относится к области контроля загрязнений окружающей среды, а именно к методам интегрального анализа наличия в воде и водных экстрактах (в том числе в вытяжках из почв, овощей и фруктов) ингибиторов бутирилхолинэстеразы, включая фосфорорганические пестициды.
В настоящее время известно около 40 способов определения пестицидов с помощью ферментных систем на основе холинэстераз [1]. Данные методы отличаются друг от друга типом используемой холинэстеразы, способом измерения и объектом анализа.
Аналогом предлагаемого изобретения является способ определения соединений антихолинэстеразного действия, основанный на измерении скорости ферментативного гидролиза субстрата бутирилтиохолина йодистого холинэстеразой сыворотки крови лошади. Для этого в пробирку последовательно вносят анализируемую пробу воды, раствор холинэстеразы, раствор индикатора - 4,4'-бис-(2-гидрокси-6,8-дисульфо-1-нафтилазо) фенилдисульфида тетракалиевая соль и раствор субстрата бутирилтиохолина йодистого [2]. Далее измеряют скорость ферментативного гидролиза субстрата бутирилтиохолина йодистого фотометрическим методом по зависимости оптической плотности анализируемого раствора на длине волны 575 нм от времени измерения. Концентрацию соединения антихолинэстеразного действия определяют по предварительно установленной зависимости степени ингибирования холинэстеразы от концентрации анализируемого соединения.
Одним из недостатков данного способа является короткий срок хранения раствора фермента - одни сутки при комнатной температуре и двое суток при температуре 4°С. Существенным недостатком также является длительность проведения анализа. Согласно изобретению, перед измерением тангенса угла наклона начального участка на кинетической кривой ферментативного гидролиза субстрата, необходима инкубация фермента в исследуемой пробе в течение 900 секунд. Более того, использование растворимой бутирилхолинэстеразы для анализа воды (водных экстрактов) накладывает существенные ограничения на характеристики проб, пригодных для анализа данным способом. Так, например, при для проведения анализа водных экстрактов, имеющих экстремальные значения pH, необходимо проводить их предварительную нейтрализацию, так как pH-оптимум для растворимой бутирилхолинэстеразы находится в довольно узком диапазоне значений (от 7 до 8 pH).
Прототипом изобретения является способ определения ингибиторов холинэстеразы в пробах воды и водных экстрактах с использованием холинэстераз из различных источников: пропионилхолинэстеразы из мозговой ткани (ПХЭ), ацетилхолинэстеразы из эритроцитов человека (АХЭ) и холинэстеразы сыворотки крови лошади (ЛХЭ) [3]. Данный способ представляет собой определение скорости ферментативного гидролиза ацетилтиохолина йодистого соответствующей холинэстеразой в анализируемой пробе. Для этого анализируемую пробу воды (водного экстракта) смешивают с соответствующей холинэстеразой и 5,5''-дитиобис-(2-нитробензойной кислотой) в среде фосфатного буфера (pH 7,5) с последующим добавлением субстрата ацетилтиохолина йодистого, при ферментативном гидролизе которого выделяется тиохолин. Тиохолин взаимодействует с 5,5''-дитио-бис-(2-нитробензойной кислотой) с образованием окрашенного в желтый цвет аниона 2-нитро-5-меркаптобензойной кислоты. Регистрация изменения оптической плотности проб проводится на спектрофотометре при длине волны 412 нм.
Однако способ-прототип сложен в исполнении и трудоемок. К числу недостатков способа-прототипа следует отнести использование фосфатного буфера для приготовления анализируемой пробы, что приводит к ее разбавлению и, как следствие, снижению точности определения наличия ингибиторов бутирилхолинэстеразы в ней. Еще одним недостатком способа-прототипа является необходимость приготовления большого числа растворов и их последовательное смешивание при приготовлении контрольной и анализируемой проб, что существенно усложняет процедуру эксперимента и существенно увеличивает время его проведения. Помимо этого, препараты холинэстеразы ПХЭ и АХЭ в виде рабочих растворов отличаются низкой стабильностью и хранятся не более 8-ми часов при температуре 25°С.
Техническим результатом данного изобретения является разработка высокочувствительного экспрессного метода интегральной оценки ингибиторов холинэстеразы в воде и водных экстрактах, основанного на применении стабильного при хранении и использовании ферментативного препарата иммобилизованной бутирилхолинэстеразы.
Указанный результат достигается тем, что в методе определения ингибиторов холинэстеразы в воде и водных экстрактах, включающем приготовление контрольной и анализируемой проб на основе бутирилхолинэстеразы и измерение скорости ферментативного гидролиза бутирилтиохолина, новым является то, что при приготовлении контрольной и анализируемой проб используют стабильный высокочувствительный ферментный препарат, на основе совместно иммобилизованной бутирилхолинэстеразы и индикатора на тиоловую группу 5,5'-дитио-бис (2-нитробензойную кислоту), с добавлением дистиллированной воды (контроль) или анализируемого образца воды (водного экстракта), выдерживают обе пробы в течение 30-300 секунд в присутствии 18-20 единиц активности α-амилазы, запускают реакцию в обеих пробах раствором S-бутирилтиохолина-I (S-BuCh-I), причем соотношение объемов раствора S-бутирилтиохолина-I в концентрации 2 мМ и контрольного или анализируемого раствора составляет 1:10, измеряют скорость ферментативного гидролиза субстрата в обеих пробах, при этом критерием наличия ингибиторов бутирилхолинэстеразы в анализируемой пробе является снижение на 20% и более величины скорости ферментативного гидролиза бутирилтиохолина, измеряемой в анализируемой пробе по сравнению с данным параметром в контрольной пробе.
Интегральную оценку воды и водных экстрактов на содержание веществ антихолинэстеразного действия выполняют следующим образом: Для измерения скорости ферментативного гидролиза S-BuCh-I в контрольной пробе в кювету спектрофотометра помещают один иммобилизованный препарат (диск) и 900 мкл дистиллированной воды, 100 мкл раствора α-амилазы (18-20 единиц активности), выдерживают в течение 30-300 секунд, затем тщательно перемешивают. Запускают реакцию 100 мкл 2 мМ раствора S-BuCh-I. Для измерения скорости ферментативного гидролиза S-BuCh-I в анализируемой пробе в кювету спектрофотометра помещают один иммобилизованный препарат (диск) и 800 мкл дистиллированной воды, 100 мкл раствора α-амилазы (18-20 единиц активности) и 100 мкл анализируемой воды (водного экстракта), выдерживают в течение 30-300 секунд, затем тщательно перемешивают. Запускают реакцию 100 мкл 2 мМ раствора S-BuCh-I. Измерения проводят на спектрофотометре в течение 3-5 минут.
Критерием наличия в анализируемой пробе веществ антихолинэстеразного действия является снижение на 20% и более скорости ферментативного гидролиза S-BuCh-I бутирилхолинэстеразой в анализируемой пробе по сравнению со скоростью ферментативного гидролиза S-BuCh-I бутирилхолинэстеразой в контрольной пробе. Скорость ферментативного гидролиза S-BuCh-I бутирилхолинэстеразой определяют, как тангенс угла наклона прямой зависимости оптической плотности раствора при длине волны поглощения 412 нм от времени. Коэффициент ингибирования рассчитывают по формуле:

где А0 - активность BuChE (скорость ферментативного гидролиза S-BuCh-I) в контрольной пробе; А - активность BuChE (скорость ферментативного гидролиза S-BuCh-I) в анализируемой пробе.
Пример 1
Для измерения скорости ферментативного гидролиза в контрольной пробе в кювету спектрофотометра последовательно вносили один диск препарата бутирилхолинэстеразы, иммобилизованной совместно с индикатором 5,5'-дитио-бис (2-нитробензойной кислотой), 900 мкл дистиллированной воды и 100 мкл раствора α-амилазы (18 единиц активности), выдерживали 300 секунд, тщательно перемешивали и добавляли 50 мкл 2 мМ раствора S-BuCh-I. Далее кювету помещали в спектрофотометр и измеряли изменение оптической плотности раствора при длине волны 412 нм в течение 180 секунд, затем рассчитывали тангенс угла наклона кинетической кривой ферментативного гидролиза S-BuCh-I (активность бутирилхолинэстеразы в контрольной пробе А0). Для измерения скорости ферментативного гидролиза S-BuCh-I в анализируемой пробе в кювету спектрофотометра помещали один диск препарата бутирилхолинэстеразы, иммобилизованной совместно с индикатором 5,5'-дитио-бис (2-нитробензойной кислотой), 800 мкл дистиллированной воды, 100 мкл раствора α-амилазы (18-20 единиц активности) и 100 мкл раствора пиримифосметила, выдерживали в течение 30-300 секунд, затем тщательно перемешивали. Запускали реакцию 100 мкл 2 мМ раствора S-BuCh-I. Далее кювету помещали в спектрофотометр и измеряли изменение оптической плотности раствора при длине волны 412 нм в течение 180 секунд, затем рассчитывали тангенс угла наклона кинетической кривой ферментативного гидролиза S-BuCh-I (активность бутирилхолинэстеразы в анализируемой пробе А). Коэффициент ингибирования рассчитывали по формуле: КИ=[(А0-А)/А0]*100%.
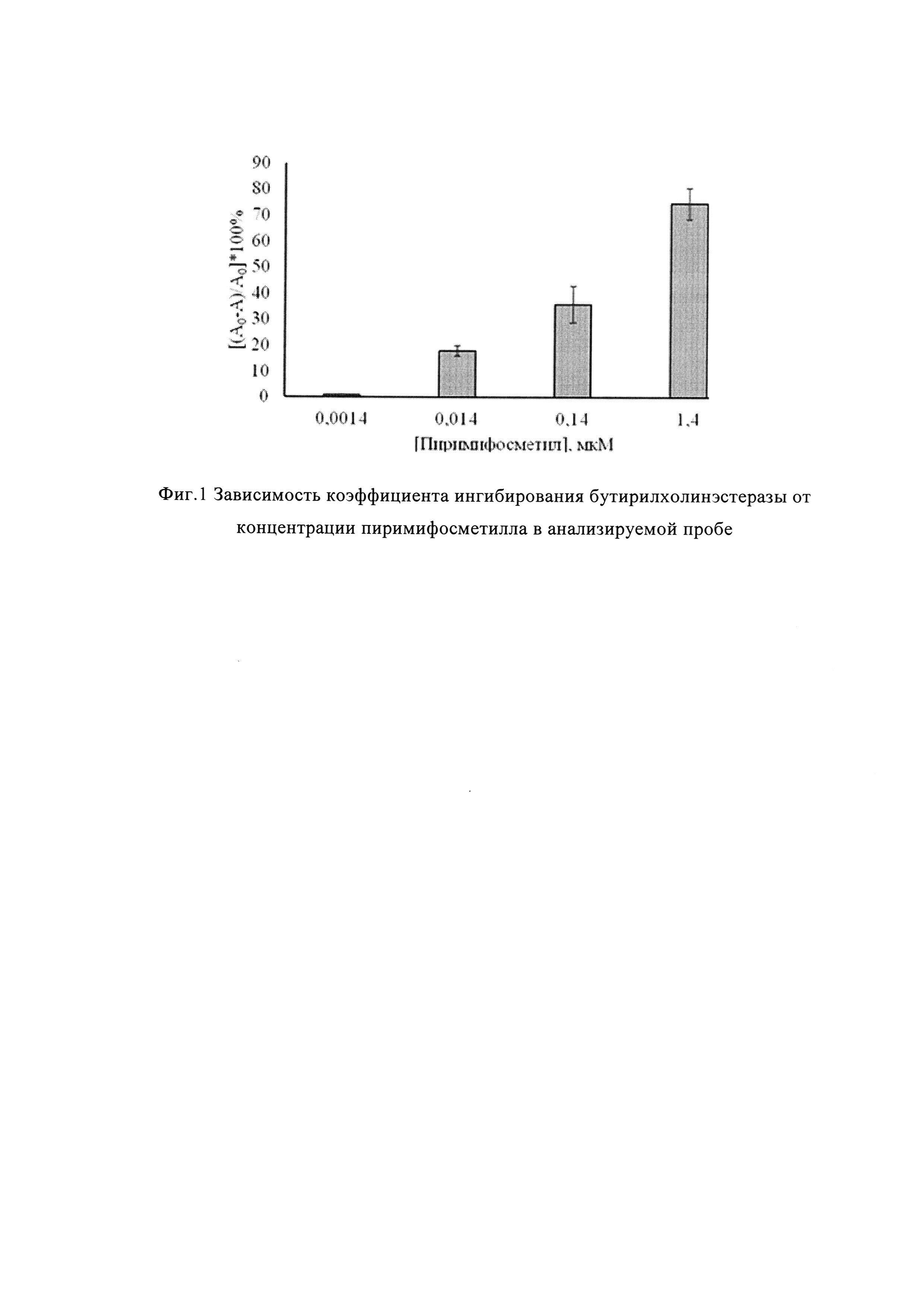
На фиг. 1 представлены результаты анализа водных растворов пиримифосметила с заданными концентрациями
Видно, что результаты анализа зависят от концентрации пиримифосметила в водном растворе. При увеличении концентрации пиримифосметила в анализируемом водном растворе активность препарата BuChE снижается. В растворе, с концентрацией пиримифосметила 0,014 мкМ, КИ составляет около 20%, что означает изменение активности BuChE на 20%. Концентрация пиримифосметила 0,014 мкМ является близкой к предельно допустимой в воде.
Список литературы:
[1] Евтюгин Г.А. Проблемы аналитической химии. Отделение химии и наук о материалах РАН. Биохимические методы анализа, Москва, Наука, 2010, Т. 12, 391 с.
[2] Патент на изобретение RU 2157850 С1 «Способ определения соединений антихолинэстеразного действия в воде и водных экстрактах», опубл. 20.10.2000.
[3] Методики определения микроконцентраций фосфорорганических отравляющих веществ вероятного противника с использованием препаратов холинэстеразы из различных источников. Главное управление по производству бактериальных и вирусных препаратов. Министерство здравоохранения СССР. Пермь, 1978 г.
Способ определения соединений антихолинэстеразного действия в воде и водных экстрактах, включающий приготовление контрольной и анализируемой проб на основе бутирилхолинэстеразы и измерение скорости ферментативного гидролиза бутирилтиохолина, отличающийся тем, что при приготовлении контрольной и анализируемой проб используют стабильный высокочувствительный ферментный препарат, на основе совместно иммобилизованных бутирилхолинэстеразы и индикатора на тиоловую группу 5,5'-дитио-бис(2-нитробензойной кислоты), в качестве растворителя используют дистиллированную воду, выдерживают обе пробы в течение 30-300 секунд в присутствии 18-20 единиц активности α-амилазы, запускают реакцию в обеих пробах раствором S-бутирилтиохолина-I (S-BuCh-I), причем соотношение объемов раствора S-бутирилтиохолина-I в концентрации 2 мМ и контрольного или анализируемого раствора составляет 1:10, измеряют скорость ферментативного гидролиза субстрата в обеих пробах, при этом критерием наличия ингибиторов бутирилхолинэстеразы в анализируемой пробе является снижение на 20% и более величины скорости ферментативного гидролиза бутирилтиохолина, измеряемой в анализируемой пробе, по сравнению с данным параметром в контрольной пробе.