Результат интеллектуальной деятельности: СПОСОБ ХРАНЕНИЯ СЫВОРОТОК КРОВИ С АНТИТЕЛАМИ К ВОЗБУДИТЕЛЯМ ПАРАЗИТАРНЫХ БОЛЕЗНЕЙ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области медицины, в частности, предназначено для оптимизации условий длительного хранения сыворотки крови и направлено на повышение стабильности диагностических параметров антител к возбудителям паразитарных болезней (токсокароз, эхинококкозы) при длительном хранении в низкотемпературных условиях.
Уровень техники
Необходимость повторного использования диагностических сывороток крови больного обусловлена длительностью медицинского наблюдения: при эхинококкозе - пять и более лет, а при альвеококкозах - пожизненно. Высокий процент возобновления паразитарного процесса у реконвалесцентов в прогностическом периоде определяет направленность поисков новых методологических приемов для разработки персонифицированных подходов к лабораторной диагностике заболеваний, сохранения образцов сывороток крови предыдущих исследований от больного для постановки сравнительных анализов, а также для мониторинга за уровнем индивидуального и популяционного иммунитета населения, проживающего на территориях повышенного риска заражения паразитарными болезнями.
Установлено, что активность антител сывороток крови при длительном их хранении в условиях низких температур снижается в связи с наступающим гидролизом аналита, разрушением дисульфидных или пептидных связей и образованием димеров и олигомеров молекул. В образцах сыворотки наступают необратимые изменения их физико-химического состояния, в результате антитела утрачивают функциональные свойства.
В этой связи актуальной задачей является разработка способа стабилизации диагностических аналитов (сохраняющего до 95% образцов с исходным антительным ответом) в условиях их длительного хранения для применения в рутинной лабораторной практике и созданием базы криогенной продукции для производства иммуноферментных тест-наборов для диагностики паразитарных болезней.
Стабилизирующий состав должен, во-первых, способствовать сохранению активности антител в условиях низких и ультранизких температур (-20°С, -40°С, -196°С), во-вторых, предотвращать появление ложноположительного сигнала за счет неспецифической сорбции компонентов сыворотки и роста патогенной микрофлоры, в-третьих оказывать протекцию от повреждающего действия перекисных радикалов, образующихся в закрытом контейнере при длительном хранении.
По своей химической природе круг веществ, используемых для стабилизации антител, достаточно широк и разнообразен, начиная от небольших по молекулярной массе соединений, заканчивая биомакромолекулами.
Однако по отдельности такие стабилизаторы не обеспечивают длительное хранение сывороток, содержащих антитела к тканевым паразитарным болезням, в частности, они не обеспечивают стабильное сохранение сигнала в иммуноферментном анализе (ИФА). Для полноценного криопротекторного действия на сыворотки необходимо добавление высоких процентов стабилизаторов.
Все известные в научной литературе и на практике способы стабилизации функциональных белковых молекул объединены в три основные группы: 1) направленное изменение первичной структуры белковой молекулы с использованием приемов сайт-направленного мутагенеза; 2) ковалентная химическая модификация белковой молекулы; 3) использование модифицирующих добавок, изменяющих конформацию или гидратную оболочку белковой молекулы при ее нахождении в водном растворе (Романенко Н.А. Дерябин Д.Г. Эль-Регистан Г.И. 2010 г.).
По совокупности существенных признаков способы, использующие последний принцип, могут быть охарактеризованы как аналоги заявляемого изобретения.
В частности, из уровня техники известно решение по патенту на изобретение RU 2573324, представляющее собой стабилизирующую композицию для сухого хранения биологических материалов. Композиция включает углеводную смесь дисахаридов, олигосахаридов и полисахаридов, составляющую от 0,5% до 90%, гидролизованный белок, составляющий от 0,5% до 40% от общей массы композиции, и соль карбоновой кислоты. Изобретение позволяет защитить биологические материалы в стеклообразной структуре с сохранением их существенной активности.
Однако данное изобретение не определяет активность диагностических антител в общей структуре белковых фракций при их длительном хранении.
Известны стабилизирующие составы для получения лиофилизированных препаратов положительных сывороток крови, включающие углеводы, например сахарозу и глюкозу (Подольский М.В. Высушивание препаратов крови и кровезаменителей. М.: Медицина, 1973, с. 101-102).
Однако такие стабилизирующие составы в составе указанных препаратов затрудняют достижение заданной влажности препаратов (1-3%) в процессе их лиофильной сушки, требуют специальных режимов досушивания, что значительно усложняет технологический процесс получения препарата. Кроме того, они не обеспечивают должное сохранение сигналов в иммуно-ферментном анализе (ИФА).
Известен стабилизирующий состав для получения лиофилизированных контрольных положительных сывороток крови на IgG-антитела к вирусу иммунодефицита человека (ВИЧ-1), включающий пептидные и/или смесь пептидных и углеводных компонентов (Экспериментально производственный регламент. Тест-система иммуноферментная для выявления антител к вирусу иммунодефицита человека "Рекомбинат ВИЧ". - НПО "Вектор", Новосибирск, 1988, с. 1-7). В качестве пептидных компонентов используют отрицательную сыворотку крови человека, не содержащую специфические антитела к ВИЧ - 7% и сахарозу - 4,7%.
Однако такие стабилизаторы не обеспечивают длительное хранение сухих препаратов, содержащих IgG- и IgM-антитела, при положительных температурах, в частности, они не обеспечивают сохранение сигнала в иммуноферментном анализе (ИФА).
Раскрытие изобретения
Технической проблемой, решаемой заявляемым изобретением, является создание простого и надежного способа стабилизации сывороток крови больных тканевыми паразитозами без дополнительной обработки, позволяющего обеспечить сохранность до 95% образцов с исходным титром при длительном их хранении (12 месяцев) в условиях низких температур.
Техническим результатом изобретения является сохранение до 95% образцов проб сыворотки крови с исходным антительным ответом к возбудителям паразитарных болезней при длительном хранении (12 месяцев) в условиях низких температур (-20°С, -40°С, -196°С).
Технический результат достигается за счет разработки стабилизирующего состава для сохранения сывороток крови, содержащих антитела к тканевым паразитозам, включающего криопротектор, в качестве которого использован глицерин (ч.д.а. - чистый для анализов), антиоксидант, в качестве которого использована аскорбиновая кислота, бактериостатик - мертиолят натрия, а также высокоэтерифицированный пектин, при следующем соотношении компонентов, об. % в зависимости от температуры замораживания и хранения сыворотки:


В качестве основного стабилизатора был выбран глицерин (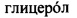 , пропантриол-1,2,3).
, пропантриол-1,2,3).
Из уровня техники известно, что глицерин обладает высокой криопротекторной активностью на различных биологических объектах (Федотенков А.Г. Криоконсервирование костного мозга II Пробл. гематологии и переливания крови. - 1981. - 26, №4. - С. 45-52; Цуцаева А.А. Криоконсервирование клеточных суспензий. - Киев: Наук. Думка, 1983. - 240 с.; Лоевский М.М., Белоус A.M. Биологическое и криозащитное действие 1,2-пропандиола II Криобиология, - 1986. - №2. - С. 20-23; Холодный B.C. Осмотическое поведение и транспортные характеристики плазматических мембран ядросодержащих клеток кордовой крови человека в гипертонических растворах проникающих криопротекторов II Пробл. криобиологии. - 2002. - №1, - С. 120-122.)
Благодаря наличию ОН-радикала, глицерин образует водородные связи с молекулами воды, растворяется в ней в любых соотношениях, за счет чего предотвращает образование водородных связей между молекулами воды и снижает температуру замерзания внутри жидкости. В то же время, в доступной литературе отсутствуют данные о влиянии глицерина на функциональную стабильность антител при их длительном нахождении в условиях низких температур, неизвестны зависимости формирующихся эффектов от концентрации глицерина, времени и температуры совместной инкубации.
Известно использование 50-70% глицерина (ч.д.а., ГОСТ 6259-75) с относительной плотностью 1,248, в качестве криопротектора для концентрата эритроцитов, концентрата лейкоцитов, концентрата тромбоцитов, гемопоэтических стволовых клеток периферической, пуповинной крови или ядерных клеток костного мозга. Раствор глицерина стерилизуют автоклавированием при 1,2 атм в стеклянных флаконах на 250 мл в течение 45 мин. Стерильный препарат глицерина хранят при комнатной температуре в темном помещении до 2 месяцев.
Однако известные из уровня техники концентрации глицерина (50-70%) направлены на сохранение клеток крови, а не антител, и не подтверждаются экспериментальными данными о сохранности образцов сывороток крови, содержащих антитела к возбудителям тканевых паразитозов в течение 12 мес.
Было установлено, что изменение концентрации глицерина меняет концентрацию антител в сыворотке, изменяя исходные диагностические параметры образцов сыворотки крови (изменяя антительный ответ), при этом для решения поставленной задачи необходима такая концентрация, которая будет оказывать максимальное криозащитное действие, существенно не изменяя начальной концентрации антител в сыворотке крови пациентов больных тканевыми паразитозами. В результате проведения исследований по различному содержанию концентрации глицерина в сыворотке крови было выявлено, что только в заявленных интервалах концентрации глицерина достигается заявляемый результат.
При этом для обеспечения оптимальной концентрации глицерина (усиления его свойств) и создания стойкой гелеобразной структуры был использован комплекс из дополнительных компонентов, включающих пектин (pectin) - кислый растительный полисахарид, построенный из мономеров галактуроновой кислоты, соединенных альфа-1,4-гликозидной связью. Наиболее практически ценным свойством пектинов является склонность к образованию гелей. Эти свойства усиливаются в присутствии гидрофильного компонента - глицерина. В результате проведенных исследований было выявлено, что введение в состав пектина позволило добиться криозащитного эффекта при меньшей концентрации глицерина, что является важным для достижения заявляемого результата. Кроме того, для достижения заявленного технического результата (95% образцов проб сыворотки крови с исходным антительным ответом) необходимо введение бактериостатика мертиолята натрия и антиоксиданта аскорбиновой кислоты.
Осуществление изобретения
Было исследовано количественное содержание отдельных компонентов в составе криопротекторного средства. Исследования проводили на 10 образцах сывороток крови с антителами к паразитарным болезням, при этом каждый из компонентов добавляли в образцы сыворотки крови в исследуемых концентрациях для достижения конечного объема 100 мкл. Затем образцы подвергали замораживанию и выдерживали при температурах -20°С, -40°С, -196°С в течение месяца.
В серии экспериментальных исследований по подбору эффективных разведений стабилизирующих добавок оптимальные результаты были получены при содержании глицерина в пределах его разведения от 4-7 об. % до 16-19 об. %. При этом для критериальной оценки параметров сохранности образцов сыворотки крови при разных температурах хранения нижний порог был определен на уровне не ниже 60% (табл. 1).

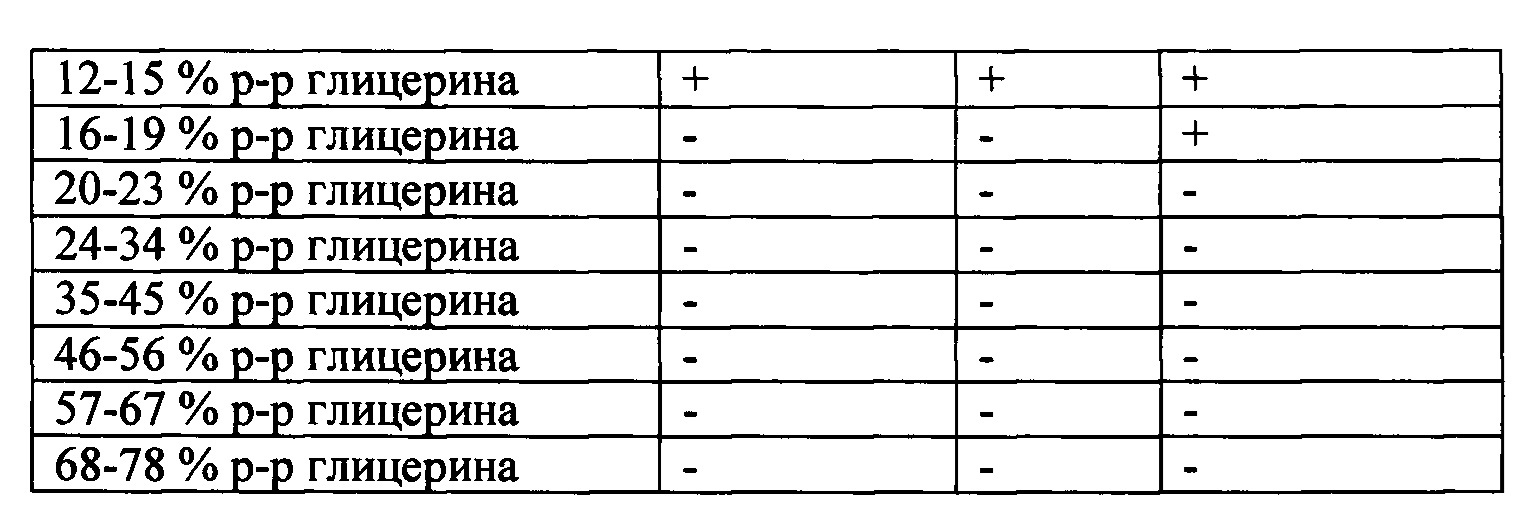
По итогам проведенных экспериментов было обнаружено, что высокие концентрации глицерина, несмотря на сильное криопротективное действие, нарушают исходное соотношение антител в сыворотке и значительно изменяют количественные показатели анализа. Наилучшие результаты достигаются при концентрации глицерина в интервале 8-15 об. %. При этом с понижением температуры хранения образцов сыворотки крови необходимо повышать концентрации глицерина в составе стабилизирующего раствора. Например, при температуре -20°С оптимально применение 4-7 об. % глицерина; при -40°С - до 8-11 об. %; при -196°С - 16-19 об. % (табл. 1).
Для пролонгирования эффекта криоконсервации при использовании меньшего процента основного криопротектора было предложено использование пектина. Для определения действующей концентрации вещества также была проведена серия опытов по воздействию пектина на сыворотки крови с антителами к тканевым паразитозам при разных температурах.

Было установлено, что для достижения нижнего порога параметров сохранности образцов крови с сохранным антительным ответом (60%.), в зависимости от температуры хранения, необходимо использовать разные концентрации пектина. Так, при температуре - 20°С действующая концентрация пектина составила 0,16-0,26 об. %; при -40°С действующая концентрация пектина составила 0,27-0,37 об. %; концентрация пектина в 0,38-0,48 об. % была оптимальной при всех температурных режимах хранения сывороток крови (-20, -40, -196°С).
Определившись с диапазоном действующих интервалов криопротекторов, были проведены испытания совместного использования этих веществ в различных концентрациях, которые продемонстрировали синергетический эффект от совместного использования заявляемых компонентов (таблица 3).

Из представленной таблицы видно, что совместное использование глицерина и пектина позволяет уменьшить концентрации криопротекторов для достижения большего криопротективного эффекта. Применяя предложенные проценты консервантов удалось увеличить долю сывороток с исходным антительным ответом до 85% в сравнении с 60% при моно применении реагентов.
При добавлении в стабилизирующую основу пектина достигнута сохранность 85% испытуемых образцов сыворотки крови. Кроме того, концентрация глицерина 1,0-3,0 об. % показала высокую эффективность - достигнуто сохранение 80% образцов сыворотки крови при -20°С (табл. 3).
При этом заявляемый комплекс компонентов, дополнительно включающий аскорбиновую кислоту и мертиолят натрия (помимо глицерина и пектина), обеспечивал дальнейшую стабилизацию сывороток.
В условиях хранения в закрытом флаконе при постоянных рН и температуре основным повреждающим фактором для молекул иммуноглобулинов являются, по-видимому, перекисные радикалы. Антиоксиданты, направленные на ограничение развития окислительных процессов, увеличивают сохранность антител.
Для ограничения окислительных процессов и повышения сохранности диагностических антител в образцах сыворотки крови в состав стабилизирующего раствора вносилась аскорбиновая кислота с разной степенью разведении от 0, 0001 до 0,1%.
В качестве бактериостатика был использован мертиолят натрия (тиомерсал, орто-этилртутьтиосалицилат натрия, C9H9HgNaO2S) в концентрациях от 0,001 до 0, 25 об. %.
Оптимальные разведения и соотношения компонентов в стабилизирующем растворе определялись опытным путем (табл. 4).
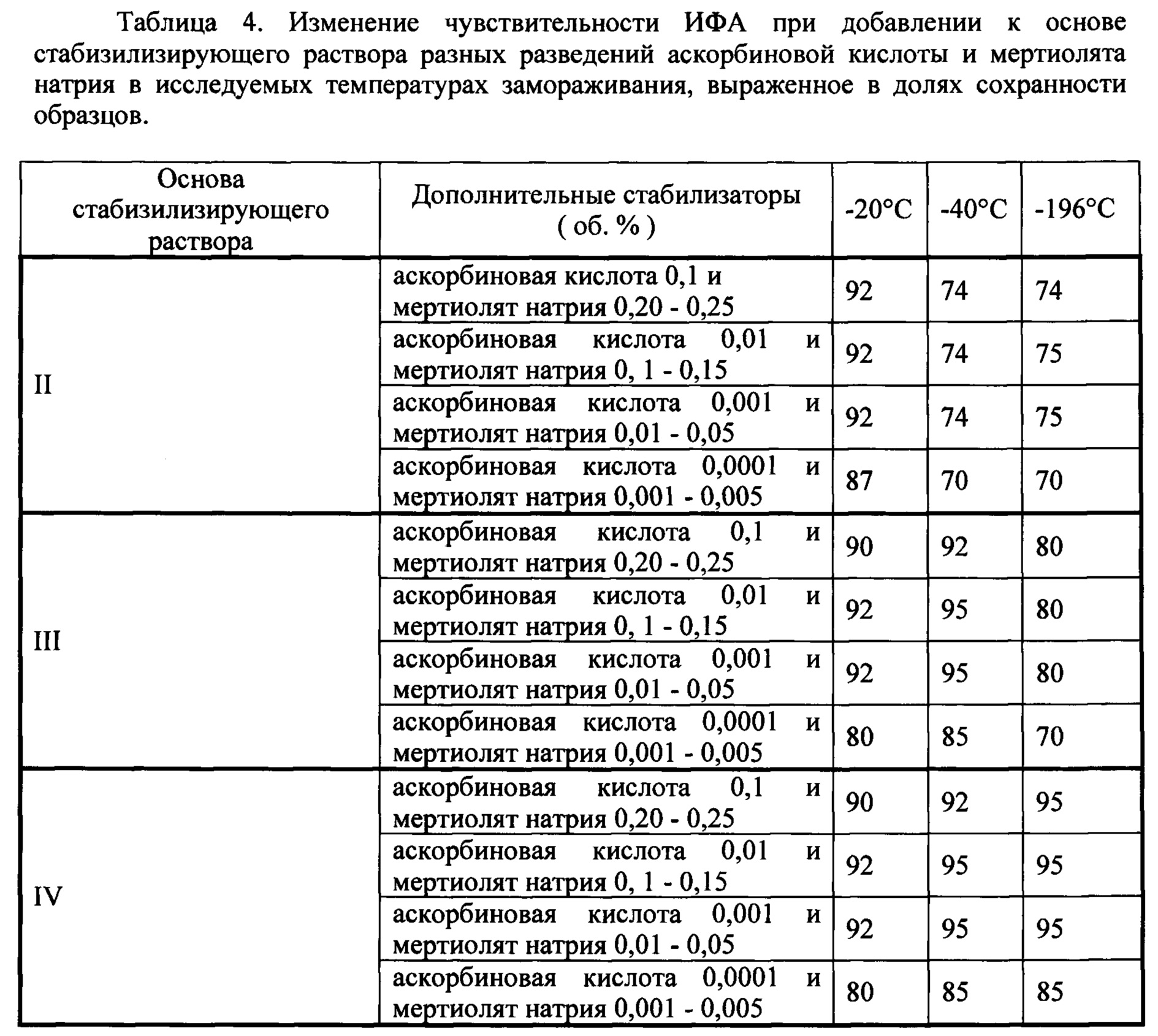
Эффективность аскорбиновой кислоты для улучшения сохранности образцов диагностических сывороток крови оптимальна при концентрации 0,01-0,001 об. %, мертиолят натрия - при 0,01-0,15 об. %.
При формировании стабилизирующего раствора в составе глицерина, пектина, аскорбиновой кислоты, мертиолята натрия, была достигнута сохранность исходных титров сывороток крови от 80 до 95% образцов в зависимости от разных условий низкотемпературных режимов их хранения.
Ниже представлено подробное описание способа подготовки проб сывороток крови с антителами к возбудителям паразитарных болезней к консервации в условиях низких температур (-20°С, -40°С, -196°С) на определенный период времени (12 месяцев), обеспечивающий сохранность 95% сывороток с исходным антительным ответом.
Лабораторные исследования образцов сыворотки проводили методом иммуноферментного анализа в параллельной постановке серийных испытаний. Объем испытуемой пробы сыворотки составлял 2 мл (МУ 3.2.1173-02).
Пробы сывороток аликвотировали в пробирки типа эппендорф объемом 100 мкл в количестве, обеспечивающем получение конечного объема 100 мкл после добавления в пробу сыворотки стабилизирующего состава.
Глицерин (ч.д,а.) стерилизовали и добавляли в каждый образец сыворотки в соотношении:
1-3 мкл для хранения при температуре -20°С;
4-7 мкл для хранения при температуре -40°С;
8-11 мкл для хранения при температуре -196°С.
Разводили порошок пектина дистиллированной водой до достижения 5% раствора, инкубировали 30 мин. при температуре 37°С постоянно помешивая. Полученный раствор пектина добавляли в образцы сыворотки с глицерином в следующей концентрации, в зависимости от температуры хранения:
1-3 мкл (что соответствовало 0,05-0,15 об. %) для хранения при температуре -20°С;
3,2-5,2 мкл (что соответствовало 0,16-0,26 об. %) для хранения при температуре -40°С;
5,4-7,4 мкл (что соответствовало 0,27-0,37 об. %) для хранения при температуре -196°С.
Затем во все диагностические образцы добавляли 2 мкл 5% раствора аскорбиновой кислоты (что соответствовало 0,01-0,001 об. %), и 2 мкл 5% раствора мертиолята натрия (что соответствовало 0,01-0,15 об. %). Сыворотку тщательно перемешивали.
Соответствующие испытываемые образцы (с введенными концентрациями компонентов под определенные отрицательные температуры) закладывали на хранение при температуре минус 20°С, минус 40°С, минус 196°С, на 1 год.
Были проведены исследования 300 образцов сывороток крови больных эхинококкозом с исходными параметрами 30- 100АЕ. Диагностические сыворотки были аликвотированы по расчетному количеству испытаний в пробирки типа эпендорфы.
Для исследования были сформированы экспериментальные группы наблюдений: контрольная - без добавления заявляемого стабилизирующего средства и опытная - с добавлением стабилизирующего средства.
Опытную группу разделили на подгруппы в зависимости от концентрации компонентов стабилизирующего средства и температуры хранения, об. % (таблица 5).


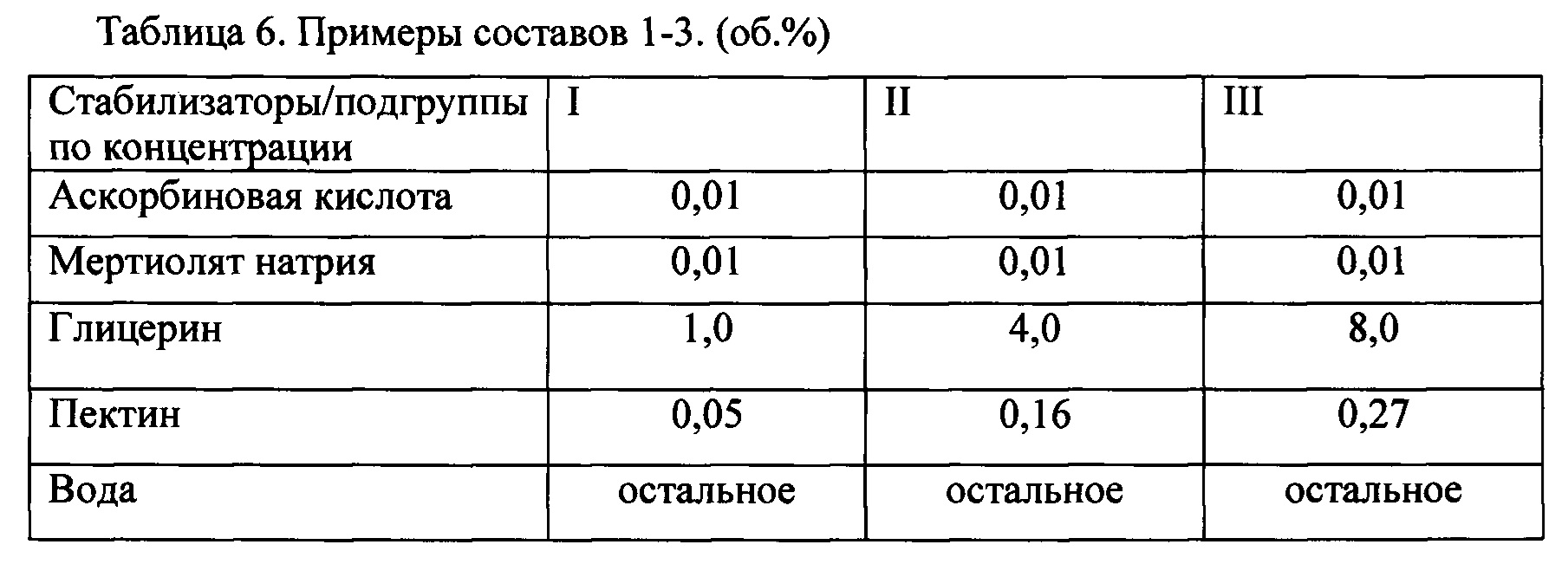
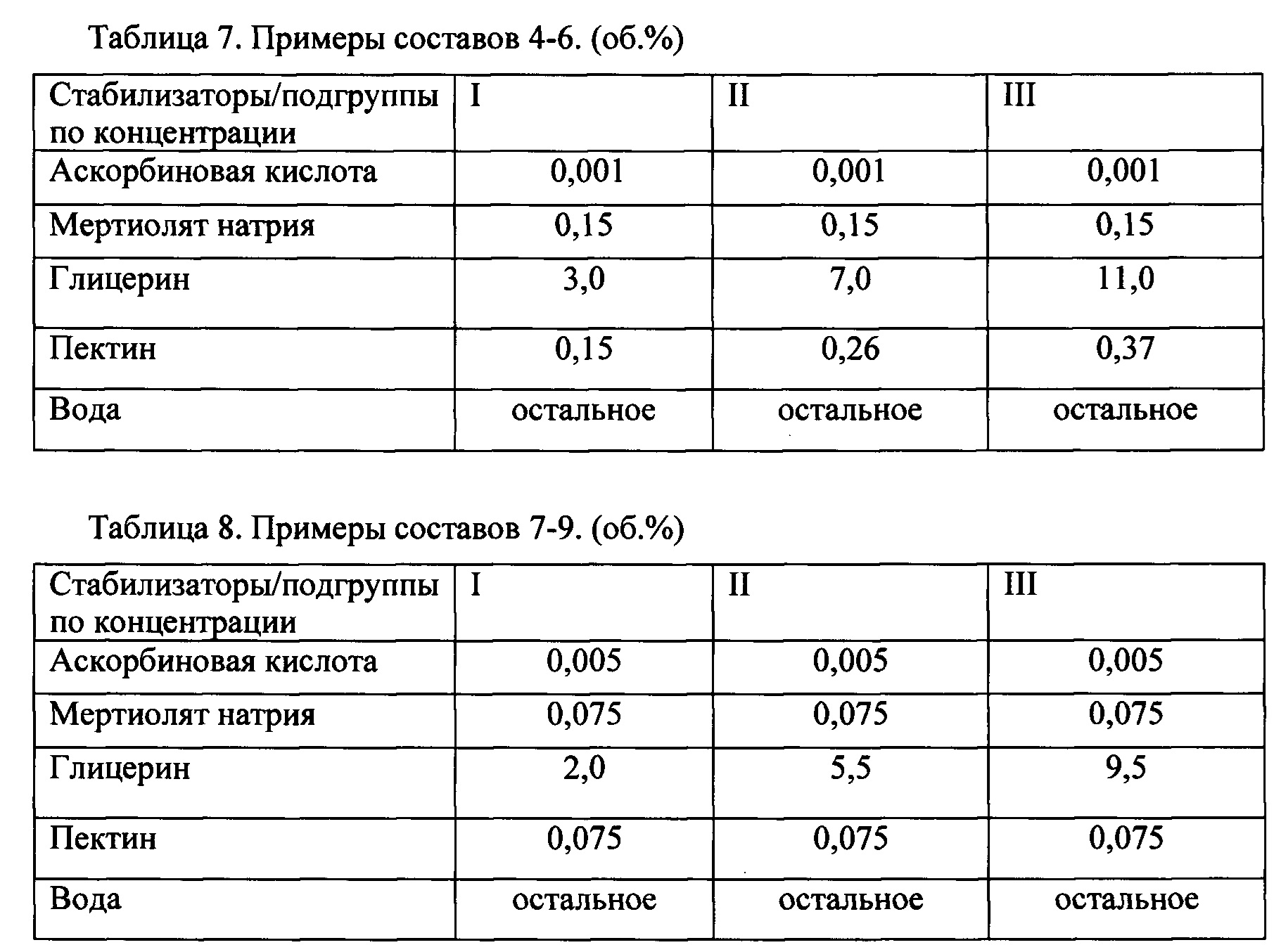
В каждой подгруппе были проведены испытания для 4 вариантов составов заявляемого стабилизирующего средства (таблицы 6-9).


В равных количествах все образцы были размещены на заморозку при температуре - 20°С, -40°С, -196°С. Срок инкубации составил 12 месяцев.
По итогам проведенного исследования были получены следующие результаты:
1 группа испытаний (без добавления консерванта): сохранность диагностических сывороток с исходными параметрами антительных единиц составила:
 30% сывороток при температуре -20°С;
30% сывороток при температуре -20°С;
 50% сывороток при температуре -40°С;
50% сывороток при температуре -40°С;
 57% сывороток при температуре -196°С;
57% сывороток при температуре -196°С;
2 группа (с добавлением консерванта):
Составы 1-3:
I
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 74% сывороток при температуре -40°С;
74% сывороток при температуре -40°С;
 75% сывороток при температуре -196°С
75% сывороток при температуре -196°С
II
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 95% сывороток при температуре -40°С;
95% сывороток при температуре -40°С;
 80% сывороток при температуре -196°С
80% сывороток при температуре -196°С
III
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 95% сывороток при температуре -40°С;
95% сывороток при температуре -40°С;
 95% сывороток при температуре -196°С
95% сывороток при температуре -196°С
Составы 4-6:
I
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 74% сывороток при температуре -40°С;
74% сывороток при температуре -40°С;
 75% сывороток при температуре -196°С
75% сывороток при температуре -196°С
II
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 95% сывороток при температуре -40°С;
95% сывороток при температуре -40°С;
 80% сывороток при температуре -196°С
80% сывороток при температуре -196°С
III
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 95% сывороток при температуре -40°С;
95% сывороток при температуре -40°С;
 95% сывороток при температуре -196°С
95% сывороток при температуре -196°С
Составы 7-9:
I
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 74% сывороток при температуре -40°С;
74% сывороток при температуре -40°С;
 75% сывороток при температуре -196°С
75% сывороток при температуре -196°С
II
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 95% сывороток при температуре -40°С;
95% сывороток при температуре -40°С;
 80% сывороток при температуре -196°С
80% сывороток при температуре -196°С
III
 92% сывороток при температуре -20°С;
92% сывороток при температуре -20°С;
 95% сывороток при температуре -40°С;
95% сывороток при температуре -40°С;
 95% сывороток при температуре -196°С
95% сывороток при температуре -196°С
Составы 10-12:
I
 55% сывороток при температуре -20°С;
55% сывороток при температуре -20°С;
 60% сывороток при температуре -40°С;
60% сывороток при температуре -40°С;
 65% сывороток при температуре -196°С
65% сывороток при температуре -196°С
II
 80% сывороток при температуре -20°С;
80% сывороток при температуре -20°С;
 80% сывороток при температуре -40°С;
80% сывороток при температуре -40°С;
 75% сывороток при температуре -196°С
75% сывороток при температуре -196°С
III
 60% сывороток при температуре -20°С;
60% сывороток при температуре -20°С;
 62% сывороток при температуре -40°С;
62% сывороток при температуре -40°С;
 65% сывороток при температуре -196°С
65% сывороток при температуре -196°С
Таким образом, применение концентраций стабилизаторов, выходящих за пределы предложенных интервалов, не обеспечивало заявленный технический результат - процент сохранности образцов проб сыворотки крови с исходными параметрами диагностических антител к возбудителям паразитарных болезней не превышал 80% при -20°С и -40°С и 75% при -196°С.
Полученные данные подтверждают высокую сохранность диагностических сывороток с добавлением стабилизирующего состава (95%) по сравнению с сыворотками без добавления криопротекторов (57%). Использование предлагаемого стабилизирующего состава позволяет хранить сыворотки крови пациентов, больных паразитарными болезнями, в течение длительного времени (12 месяцев), превышающего сроки хранения, рекомендованные в нормативно-методических документах (ГОСТ Р 53079.4-2008).

