Результат интеллектуальной деятельности: Способ изготовления полуфабрикатов иммуноглобулиновых и альбуминовых биопрепаратов из боенской, трупной крови животных, абортной и плацентарной крови человека
Вид РИД
Изобретение
Изобретение относится к биологической или медицинской промышленности, в частности, к заготовке сырья (крови человека и животных) в нестерильных условиях и его транспортировке в форме полуфабрикатов без использования режима «холодовой цепи» для промышленного фракционирования и обеспечения серийного выпуска иммуноглобулиновых и альбуминовых биопрепаратов.
Техническое решение изобретения направлено на заготовку сырья в нестерильных условиях по месту сбора крови и ее сепарирования за счет инактивации бактериальной микрофлоры и ингибирования протеаз в индивидуальных или пулированных образцах плазмы или сыворотки по мере их изготовления.
Технико-технологическое оформление заготовки донорских кроводач человека устраняет проблематику бактериальной обсемененности индивидуальных образцов крови и сопряженного производства контаминированных образцов плазмы крови. Аналогичные условия в промышленном масштабе невозможно создать для заготовки абортной, плацентарной крови человека, или боенской крови сельскохозяйственных животных, или трупной крови пушных зверей. Одним из негативных свойств бактериальной обсемененности крови является приобретение пирогенных свойств плазмой (сывороткой) крови и переход пирогенов в состав фармацевтических биопрепаратов.
Известны методы обеззараживания индивидуальных и пулированных образцов плазмы. Обработка метиленовым голубым и облучение видимым светом с подобранными величинами освещенности и экспозиции используются для инактивации инфекционности вирусных агентов [1]. Guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products // WHO Technical Report, Series №.924, 2004, p. 151-219; 2. Панов В.П. Принципы обеспечения вирусной безопасности продуктов крови (обзор). // Хим.-фарм. журнал. 2004, т. 38, №3, с. 39-47]. Сольвент-детергентный способ основан на внесении в состав исходной плазмы крови органического растворителя и неионного детергента [3. Horowitz В. Investigations into the application of tri(n-butyl)phosphate/detergent mixtures to blood derivatives. Current Studies in Hematology and Blood Transfusion, 1989, p. 83-96]. Предлагается также ультрафиолетовое облучение свежезамороженной плазмы и изготовленных из обработанной плазмы факторов свертывания [4. Као К.J. Effects of leukocyte depletion and UVB irradiation on allogenecity of major histocompatibility antigens in platelet concentrates: a comparative study // Blood, 1992, p. 2931-2937].
Одним из наиболее эффективных способов обеззараживания плазмы считается обработка низкомолекулярным электрофильным соединением (Инактивин), йодоацетальдегидом в условиях сольвент-детергентного инкубирования [5. Guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products // WHO Technical Report, Series №924, 2004, p. 151-219; 2. Панов В.П. Принципы обеспечения вирусной безопасности продуктов крови (обзор). // Хим.-фарм. журнал. 2004, т. 38, №3, с. 39-47]. На стадии НИОКР отрабатывается инактивация бактериальных и вирусных агентов на основе сверхбыстрой (миллисекунды) низкотемпературной (50-55)°C пастеризации/стерилизации (МСТ-технология).
Недостатком перечисленных методов является использование плазмы, которая производится в условиях, исключающих бактериальную контаминацию донорских кроводач. Эффективность обеззараживающих подходов оценивается при незначительном уровне контаминации индивидуальных образцов плазмы, изготовленных в стерильных условиях с последующим хранением при температуре от (-20)°C до (-65)°C, обеспечивающей бактериостатические условия.
Известны способы транспортировки и хранения плазмы в режиме холодовой цепи. Допускается низкотемпературное хранение плазмы крови при температуре (-20)°C и ниже в течение не более 7 лет [6. Сборник «Препараты крови. Инструктивно-методические материалы по контролю и производству» под редакцией Буренкова С.П. М: Изд-во Минздрава СССР, 1976, с. 203-218; 7. Русанов В.Н., Скобелев Л.И. «Фракционирование белков плазмы в производстве препаратов крови». - М: Медицина, 1983, с. 49-83; 8. Руководство по организации, обслуживанию и использованию оборудования холодовой цепи для крови. Женева: Всемирная организация здравоохранения, 2009 г., с. 8-9]. За счет быстрого замораживания плазмы до температур (-35)°C или (-40)°C возможно увеличить срок хранения плазмы крови человека без потери физиологической активности целевых белков с гемостатическим или иммуномодулирующим, или комплексным механизмом действия [9. Жибурт Е.Б. «Трансфузиология: учебник». СПб: Питер, 2002, 736 с.]. Показана возможность удлинения сроков хранения иммуносыворотки при температуре (-5 - -10)°C без потери активности антител, если ее заморозку осуществляли при (-196)°C [10. Патент RU №2151617, А61М 1/38, опубл. 27.06.2000; 11. Чард Т. «Радиоиммунологические методы». М.: Мир, 1981, с. 48].
Недостатком методов низкотемпературной транспортировки и хранения донорской плазмы (сыворотки) крови является их энергоемкость, которая для обеспечения надлежащего режима требует стационарных помещений. Не допускается оттаивание и повторное замораживание плазмы по техническим причинам, поскольку такого рода технологические нарушения оказывают негативное влияние на физиологическую активность целевых белков [11. Чард Т. «Радиоиммунологические методы». М.: Мир, 1981, с. 48]. При этом для боенской (трупной) плазмы (сыворотки) крови животных, либо для абортной и плацентарной крови человека в настоящее время не представляется возможным технически организовать получение стерильных кроводач и производство стерильных образцов индивидуальных заготовок стерильной плазмы крови.
Известны способы инактивации микрофлоры в составе плазмы (сыворотки) крови за счет использования этанола на самых первых стадиях технологии производства фармацевтических биопрепаратов. За счет увеличения концентрации этанола и варьирования рН осуществляется выделение и очистка целевых белков из плазмы (сыворотки) крови. В процессе этанольного фракционирования используются бактериостатические (8%) и бактерицидные (17-40%) концентрации этанола [6. Сборник «Препараты крови. Инструктивно-методические материалы по контролю и производству» под редакцией Буренкова С.П. М.: Изд-во Минздрава СССР, 1976, 384 с.; 7. Русанов В.Н., Скобелев Л.И. «Фракционирование белков плазмы в производстве препаратов крови». - М.: Медицина, 1983, с. 75-111]. Однако, бактериально-контаминированная плазма содержит в своем составе пирогены. Удаление пирогенов бактериальной природы требует дополнительных стадий очистки целевого белка [12. Зубкова Н. Б. Биотехнологические аспекты эффективной и безопасной переработки донорской плазмы: проблемы и перспективы // Биопрепараты. - 2014, №1, с. 4-10; 13. Исрафилов А.Г. и др. Опыт получения апирогенных препаратов // Тезисы докладов IV Российского национального конгресса «Человек и лекарство», Москва 8-12 апреля 1997 г.: сборник «Человек и лекарство». Российский нац. конгр. (4; 1997; Москва). - М.: "ФАРМЕДИНФО", 1997. - с. 54].
Недостатком известных методов этанольного фракционирования является использование донорской стерильной плазмы и невозможность удаления бактериальных пирогенов из состава биопрепаратов на основе стандартных технологических процессов.
Рекомендуется использование риванола в технологии фракционирования плазмы (сыворотки) крови с учетом его бактериостатического действия [14. Zhurina N.A., Shatskaia Т.L., Katushkina N.V. The virological safety and bacterial sterility of a method for fractionating blood plasma proteins with rivanol // Zh. Mikrobiol. Epidemiol. Immunobiol. 1993, 1: p. 45-48]. С аналогичных позиций обсуждается бактериостатический эффект сульфата аммония или каприловой кислоты в технологии производства фармацевтических биопрепаратов.
Недостатком известных схем фракционирования с использованием реагентов-материалов, обладающих бактерицидно-бактериостатическим эффектом, является невозможность их применения на самых первых этапах заготовки сырья и его первичной переработки.
Представлены материалы и методы физико-химической инактивации инфекционных агентов в составе полупродуктов плазмы. Пастеризация полупродуктов альбумина, других полупродуктов плазмы и концентратов физиологически активных белков и их модифицированных форм осуществляется за счет термической обработки в сухом и влажном вариантах [15. Colvin В.Т. Effect of dry heating of coagulation factor concentrates at 80°C for 72 hours on transmission of non-A, non-B hepatitis // Lancet. - 1988. - p. 814-816; 7. Русанов В.H., Скобелев Л.И. «Фракционирование белков плазмы в производстве препаратов крови». - М.: Медицина, 1983, с. 211; 16. Brackmann Н.Н., Egli Н. Acute hepatitis В infection after treatment with heatinactivated factor VIII concentrate // Lancet, 1988, p. 967].
Недостатком известных методов является инактивация потенциально возможных инфекционных агентов в основном на заключительных стадиях технологического процесса производства фармацевтических биопрепаратов. Обеззараживающее воздействие на поздних стадиях техпроцесса обеспечивает накопление в составе полупродуктов бактериальных и вирусных антигенов, в т.ч. фрагментов распада бактериальных клеток с потенциально-возможным пирогенным эффектом.
Известны методы противовирусной обработки донорской плазмы с помощью псоралена в сочетании с облучением ультрафиолетом [17. Wages D., Smith D., Walsh J. et all. Virally inactivated fresh frozen plasma transfusion in normal volunteers // Vox Sang 1998; 74, Suppl 1: p. 1290].
Недостатком указанных методов является отсутствие сведений о бактерицидных эффектах, сопутствующих целенаправленным противовирусным воздействиям. Донорские кроводачи и производство индивидуальных образцов плазмы осуществляется в стерильных условиях, что исключает микробную контаминацию плазмы и клеточных компонентов крови.
Наиболее близким техническим решением для инактивации бактериальной микрофлоры в плазме или сыворотке крови является последовательное внесение 40% фенола в глицерине до его конечной концентрации (0,7±0,2)% и, далее, через 5 дней инкубирования фенолизированной плазмы, внесение сухого сульфата аммония [18. Патент RU №2338375. Способ хранения плазмы или сыворотки крови для получения иммуноглобулиновых и альбуминовых биопрепаратов. Опубл. 20.11.2008 г. Бюл. №32] (прототип).
Недостаток известного метода состоит в хранении контаминированной микрофлорой плазмы в нестерильном помещении в процессе ее накопления до объема реакторной закладки по мере сепарирования контаминированных микрофлорой индивидуальных образцов крови. Только затем следует стадия инактивации за счет внесения 40% раствора фенола в глицерине, которая продолжается в течение 5 суток при охлаждении до температуры (10±1)°C. Далее в фенолизированную плазму вносят порошок сульфата аммония до концентрации 50% от насыщения. Например, для убойных пунктов крупных сельскохозяйственных животных, технологически адаптированных к обработке животных в течение 20-30 минут, производство бактериально-контаминированной плазмы крови составляет 15-10 литров в 1 час, т.е. производство бактериально-контаминированной плазмы до объема 150 литров осуществляется за 10-15 часов, в течение которых плазма хранится в плазмоприемнике, расположенном в нестерильных помещениях по месту заготовки крови и ее сепарирования. Еще более длительный процесс характерен для производства плазмы (сыворотки) из абортной, плацентарной крови человека или из трупной крови пушных зверей. В известном способе процесс инактивации бактериальной микрофлоры требует внесения концентрированного 40% раствора фенола в условиях охлаждения сырья до (10±1)°C и инкубирования фенолизированной плазмы в течение 5 суток. Последующее внесение сухого сульфата аммония ограничено концентрацией 50% от насыщения, которая превышает известную концентрацию 33% от насыщения и содействует осаждению белков из альбумин-трансферриновой фракции в состав гамма-глобулинов. Таким образом, инактивация бактериальной микрофлоры в сырьевой заготовке осуществляется только через 10-15 часов после получения плазмы (сыворотки) крови в нестерильных помещениях. Кроме того, бактерицидные условия достигаются за счет внесения в состав плазмы или сыворотки крови 40% раствора фенола, который обладает в указанной концентрации локальным белок-денатурирующим эффектом, а сам процесс экспозиции фенолизированной плазмы требует охлаждения до температуры (10±1)°C и продолжается в течение 5 суток. Последующее внесение сульфата аммония до концентрации 50% от насыщения определяется, также, созданием бактерицидно-бактериостатических условий, которые нарушают распределение белков плазмы (сыворотки) крови по фракциям гамма-глобулинов и альбуминов, под действием указанной концентрации сульфата аммония.
Задача изобретения состоит в создании способа инактивации микрофлоры за счет использования бактерицидно-фракционирующих свойств фенольно-сульфатных растворов, в которых инкубируются плазма или сыворотка крови по мере сепарирования индивидуальных или пулированных кроводач в нестерильных помещениях. За счет дробного внесения образцов плазмы или сыворотки крови осуществляется разведение фенольно-сульфатных растворов до конечных концентраций сульфата аммония 27% или 33% от насыщения (1,09 и 1,34 моль/л) и бактериостатических концентраций фенола до 0,3-0,4%.
Длительность инкубирования плазмы или сыворотки в фенольно-сульфатном растворе определяется интенсивностью сепарирования крови и изготовления индивидуальных или пулированных образцов. В промышленном варианте без изменений локализации целевых белков и белкового спектра нехроматографических фракций процесс загрузки сырья может продолжаться в течение 5-13 часов при интенсивности дробного разведения от 1,079 до 1,011 исходных концентратов фенольно-сульфатных растворов образцами плазмы или сыворотки с интервалом 10-30 минут по мере их изготовления сепарированием крови. В лабораторном варианте белковый спектр фракций и содержание целевых белков также носят постоянный характер при порционном либо одновременном внесении сырьевой заготовки. После отделения центрифугированием гамма-глобулинов в надосадочный раствор вносят сухой порошок сульфата аммония до концентрации 75% от насыщения (3,04 моль/л) и снижают рН до 4,6±0,1. После отделения осадка альбуминов в безбелковый центрифугат добавляют фенол до расчетной концентрации 1,0% и используют его для суспендирования осадков гамма-глобулинов (полуфабрикаты иммуноглобулиновых биопрепаратов) и осадков альбумина (полуфабрикаты альбуминовых биопрепаратов).
Поставленная задача решается за счет использования сульфатно-фенольных растворов, обладающих бактерицидно-бактериостатическим и фракционирующим свойствами. Для инкубирования образцов плазмы (сыворотки) крови исходно используется 80% или 100% от насыщения (3,24 или 4,05 моль/л) раствор сульфата аммония с (1,0±0,1)% фенола, который разбавляется до концентрации сульфата аммония 27% или 33% от насыщения (1,09 или 1,34 моль/л) и (0,35±0,05)% фенола за счет внесения образцов плазмы (сыворотки) по мере сепарирования крови. Альбуминовые фракции плазмы (сыворотки) крови осаждают за счет внесения сухого сульфата аммония до концентрации 75% от насыщения (3,04 моль/л) при остаточной концентрации фенола (0,35±0,05) % и доведения значения рН до 4,6±0,1. Для суспендирования осадков используется фенольно-сульфатный центрифугат, полученный после осаждения альбумина, в который вносят дополнительное количество фенола. Таким образом, в фенольно-сульфатных суспензиях полуфабрикатов биопрепаратов конечная концентрация фенола составляет (0,8±0,3)%, а сульфата аммония более 50% от насыщения (2,03 моль/л) в пределах 61-75% от насыщения.
Изложенный подход апробирован в лабораторном варианте для изготовления и хранения видовых заготовок плазмы (сыворотки) лабораторных животных объемом от 125 мл до 1250 мл и в промышленных условиях до объемов 125-250 литров плазмы (сыворотки) крови сельскохозяйственных животных и пушных зверей.
Из анализа уровня техники следует, что фенол в концентрациях 0,5-5% используется для дезактивации бактерий и вирусов [19. Avram N., Paunescu G.Н., Gradinary D. et al. La resistance du virus de la leucose bovine (VLB) a certains agents physiques et chimiques / Bull. Acad. Sc. Agr. Forest, 1980, 10, p. 205-209; 20. Европейская заявка №0281978 «Инактивирование вируса СПИД в содержащих белок растворах при помощи фенола». Опубликовано РЖ ИСМ 44-65-89; 21. Красильников А.П. «Справочник по антисептике», Минск: «Вышэйшая школа», 1995, с. 122-123]. Опубликованы также условия фракционирования белков плазмы (сыворотки) крови с помощью внесения насыщенных растворов сульфата аммония до необходимых концентраций в составе инкубационной среды [22. Suomela Н. An Ion Exchange Method for Immunoglobulin G production. In: Methods of Plasma Protein Fractionation / Ed. J.M. Curling. Academic Press, London, UK, 1980, p. 107-116; 23. Скоупс P.K. Методы очистки белков. M.: Мир, 1985, 358 с; 24. Черкасов А.Н., Пасечник В.А. Мембраны и сорбенты в биотехнологии. - Л.: Химия, 1991, 240 с.]. Традиционный способ фракционирования коллоидных растворов, сложных по составу индивидуальных белков, основан на капельно-струйном внесении насыщенного раствора сульфата аммония до его конечных концентраций в инкубационной среде, но не наоборот, когда насыщенный раствор сульфата аммония разбавляют до необходимой концентрации плазмой или сывороткой крови. В известном способе концентрированный (40%) раствор фенола, способный вызвать локальную денатурацию белка, вносят в состав плазмы или сыворотки крови. Снижение максимальной концентрации фенола в процессе заготовки до (1,0±0,1)% создает условия для исключения белок-денатурирующих эффектов, индуцированных высокой концентрацией дезинфектанта. После обработки фенолом в состав плазмы или сыворотки крови в известном способе вносят сухой порошок сульфата аммония до концентрации 50% от насыщения, что не позволяет в полной мере реализовать принципы фракционирования белков под действием сульфата аммония. Использование насыщенного раствора сульфата аммония с рН 7,0±0,1 и снижение концентрации фракционирующего реагента (сульфата аммония) до 33% или 27% от насыщения за счет разведения образцами плазмы или сыворотки позволяет достичь надлежащего уровня селективности фракционирования. В известном способе экспозиция фенолизированной плазмы осуществляется в течение 5 дней и температуре (10±1)°C. Однако, используемые концентрации фенола (0,7±0,2)% не оказывают существенного действия на активность протеаз и, как следствие этого, известное техническое решение обеспечивает в течение не менее 5 дней нежелательный фермент-индуцированный процесс гидролиза белков плазмы или сыворотки крови [18. Патент RU №2338375. Способ хранения плазмы или сыворотки крови для получения иммуноглобулиновых и альбуминовых биопрепаратов. Опубл. 20.11.2008 г. Бюл. №32] (прототип).
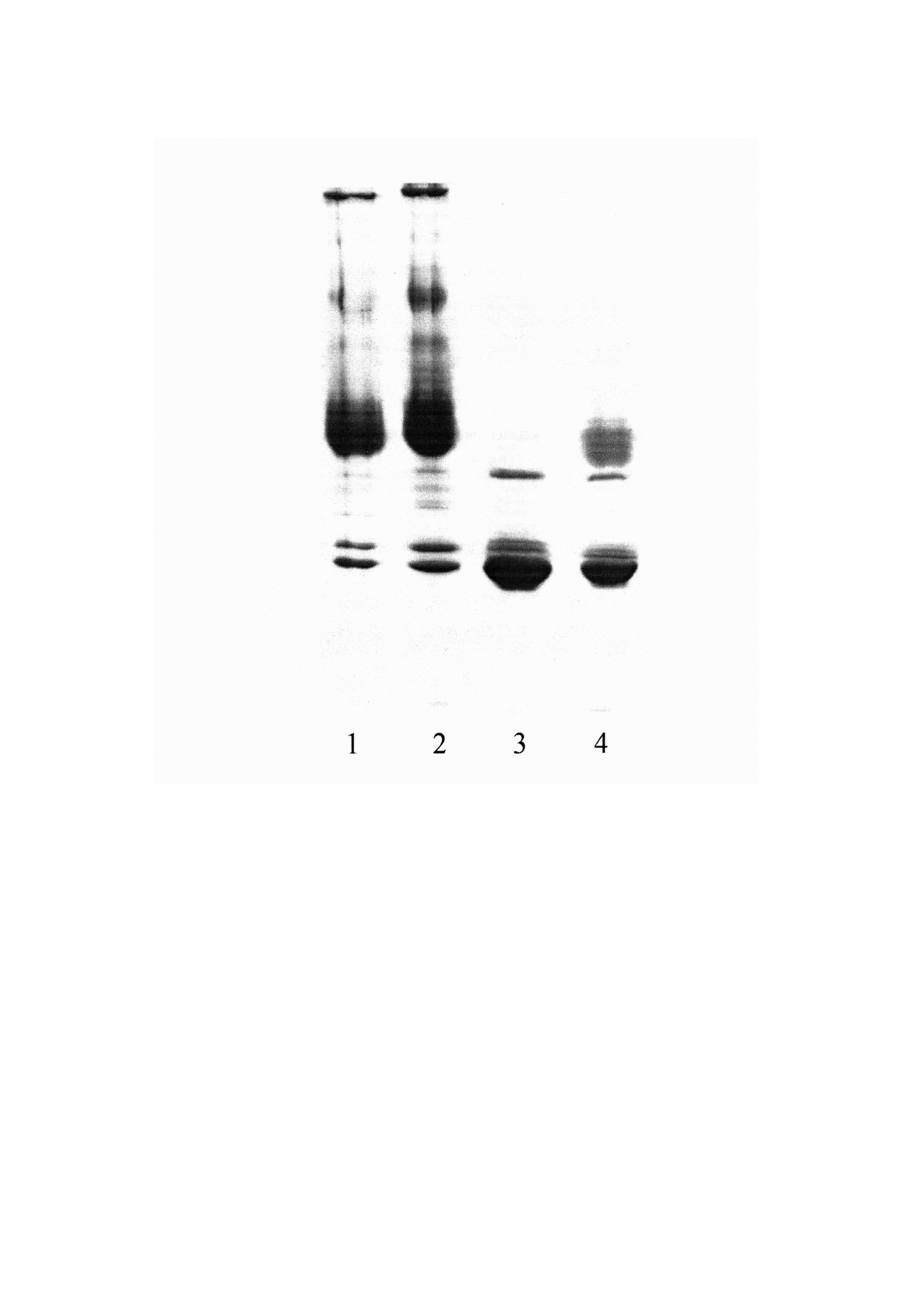
На современном этапе развития науки и техники не известны использование фенольно-сульфатных растворов и их составы для инкубирования индивидуальных или пулированных образцов плазмы или сыворотки по мере их изготовления в нестерильных помещениях по месту заготовки и сепарирования крови с целью получения гамма-глобулиновой и альбуминовой фракций. При этом практически сразу же за счет использования высоких концентраций сульфата аммония ингибируется активность протеаз плазмы или сыворотки крови (см. Таблицы 1, 2, 3). Использование в исходном растворе концентрации сульфата аммония 100% от насыщения не позволяет примеси альбуминов из гамма-глобулиновой фракции (II класс вирусной опасности) переводить в альбуминовые полуфабрикаты (III класс вирусной опасности). При концентрации сульфата аммония 80% от насыщения в альбуминовой фракции (III класс вирусной опасности) регистрируются примеси IgG, которые по принципу «от чистого в грязное» возможно на последующих стадиях фракционирования переводить в состав полупродуктов иммуноглобулиновых биопрепаратов. В качестве примера (см. Фигура) приведен белковый спектр фракций гамма-глобулинов (1, 2) и альбумина (3, 4) и соответствующих полуфабрикатов, полученных из плазмы крови крупного рогатого скота, в условиях загрузки индивидуальных образцов в фенольно-сульфатные растворы при исходных концентрациях сульфата аммония 100% (2, 3) и 80% (1, 4) от насыщения. Последующее суспендирование осадков гамма-глобулинов и альбуминов в постальбуминовом центрифугате при концентрации сульфата аммония более 50% от насыщения и фенола (0,8±0,3)% обеспечивает ингибирование протеаз и инактивирование микрофлоры (см. Таблицы 3 и 4). Функциональную активность целевых белков оценивали по активности антител в составе иммуноглобулиновых полуфабрикатов после их хранения в течение 220 дней, в т.ч. при температуре (20±5)°C в течение 40 дней и (10±1)°C в течение 180 дней. Отсутствие достоверных различий в активности антител по результатам иммуноферментного анализа контрольных и опытных образцов свидетельствуют об отсутствии влияния схемы производства полуфабрикатов и состава консервирующего раствора на структуру-функцию IgG (см. Таблица 5). Очищенные формы IgG в электрофоретически гомогенной и хроматографически мономерной форме концентрировали до содержания белка 100 мг/мл, подвергали стерилизующей фильтрации и закладывали на хранение в течение 12 месяцев при температуре (5±3)°C. Наличие выявленных олигомеров в пределах до 5% и отсутствие фрагментированных форм IgG (см. Таблица 6) позволяет утверждать, что схема производства полуфабрикатов и условия их эксплуатации не влияют на структурные особенности видовых IgG, т.е. белков, наиболее склонных к олигомеризации, индуцированной качеством технологического процесса. В техническом решении изобретения реализован, также, энергосберегающий эффект. Не используются энергоемкие холодовые установки на всех стадиях производства полуфабрикатов, в т.ч. их хранение и транспортировка в течение 40 дней осуществляется без применения режима «холодовой цепи». Важно также, что процесс заготовки сырья по способу полуфабрикатов, организованный в отдаленных регионах России (на расстояниях транспортировки в течение 40 дней), обеспечивает распределение белков по фракциям, избирательно обогащенным IgG и альбумином. Последнее обстоятельство позволяет сортировать сырьевую заготовку по месту изготовления полуфабрикатов с целью определения допустимого уровня микробной контаминации и наличия вирусных геномов или антител к вирусспецифическим белкам с помощью непрямых схем иммуноферментного анализа или ПНР-диагностики. Возможность определения указанных выше показателей качества уже на стадии получения гамма-глобулиновой фракции является основанием для совершенствования приборно-методической базы внутризаводской системы контроля с целью обеспечения инфекционной безопасности при транспортировке полуфабрикатов и производстве на их основе фармацевтических биопрепаратов, целевые белки которых представлены конформационно нативными формами.
Пример реализации предлагаемого способа
Стадия 1. Подготовка бактерицидно-фракционирующего раствора. Готовят бактерицидно-фракционирующий раствор на основе 80% (3,24 моль/л) или 100% (4,05 моль/л) от насыщения раствора сульфата аммония с 1% фенолом. Для этого в лабораторном варианте в мерную колбу объемом 1000 мл набирают 500 мл дистиллированной воды с температурой 25-30°C, взвешивают 10 г кристаллического фенола и при перемешивании на магнитной мешалке растворяют навеску фенола в воде. После полного растворения фенола взвешивают сульфат аммония 427 г для 80%-насыщенного (3,24 моль/л) раствора или 534,0 г для 100%-насыщенного (4,05 моль/л) раствора и при перемешивании вышеуказанным способом добавляют порционно навеску сульфата аммония. Далее доводят уровень дистиллированной водой до 1000 мл в мерной колбе и продолжают перемешивание до полного растворения сульфата аммония. При уменьшении уровня раствора, его доводят до 1000 мл дистиллированной водой.
В промышленном варианте в емкость с мерником заливают 35 л дистиллированной воды с температурой 25-30°C. Взвешивают 630 г кристаллического фенола и добавляют в емкость с водой при перемешивании якорной мешалкой на скорости 60-70 об/мин. Перемешивание ведут до полного растворения фенола. После полного растворения фенола взвешивают сульфат аммония 26,9 кг для 80%-насышенного (3,24 моль/л) раствора или 33,6 кг для 100%-насыщенного (4,05 моль/л) раствора и при перемешивании вышеуказанным способом добавляют порционно навеску сульфата аммония. Далее доводят уровень дистиллированной водой до 63 л и продолжают перемешивание до полного растворения сульфата аммония. При уменьшении уровня раствора, его доводят до 63 л дистиллированной водой.
Стадия 2. Подведение значения рН бактерицидно-фракционирующего раствора. По окончании растворения отбирают в химический стакан объемом 25 мл 1 мл раствора и разводят 19 мл дистиллированной воды. Измеряют значение рН раствора на рН-метре типа Radelkis ОР-271/1. Затем титруют раствор 1М NaHCO3 до рН 7,0-7,5. Объем 1М NaHCO3, потребовавшийся на титрование, умножают на соотношение исходного объема и объема, взятого на титрование. Полученный объем 1М NaHCO3 при перемешивании вышеуказанным способом добавляют в инактивирующий раствор. Перемешивают 10 минут и контролируют рН ранее описанным способом.
Стадия 3. Контроль показателей качества бактерицидно-фракционирующего раствора. Приготовленный раствор контролируют по концентрации фенола и сульфата аммония в соответствии с известными методами [25. ГОСТ 31940-2012 - Вода питьевая. Методы определения содержания сульфатов; 26. Методические указания МУК 4.1/4.2.588-96 - Методы контроля медицинских иммунобиологических препаратов, вводимых людям].
Стадия 4. Внесение или загрузка образцов плазмы в процессе сепарирования индивидуальных или объединенных кроводач. К бактерицидно-фракционирующему раствору приливают плазму (сыворотку) крови порционно или однократно (для целей лабораторных исследований), либо порционно в условиях промышленного производства.
В лабораторном варианте нами апробированы нижеследующие объемы: от 63 мл до 630 мл бактерицидно-фракционирующего раствора и от 125 мл до 1250 мл плазмы (сыворотки) крови. Плазму (сыворотку) крови вносят в бактерицидно-фракционирующий раствор порционно или одновременно при перемешивании на магнитной или механической мешалке и перемешивают дополнительно в течение 2 ч при температуре 18-25°C.
В промышленном варианте в реактор емкостью 200 л, наполненный 63 л бактерицидно-фракционирующего раствора, плазму (сыворотку) крови вносят порционно от 1 до 5 литров с интервалом 10 минут до конечного объема загруженной плазмы (сыворотки) - 125 л, при перемешивании якорной мешалкой на скорости 60-70 об/мин. Дополнительное время перемешивания после полного объема загрузки (125 л) плазмы (сыворотки) крови составляет 2 часа.
Стадия 5. Осаждение гамма-глобулиновой фракции. Суспензию подвергают центрифугированию в лабораторных условиях на центрифугах типа РС-6 при напряженности гравитационного поля 4200 g в течение 30 минут или в промышленном варианте с помощью промышленных центрифуг типа ОТР-1 при напряженности гравитационного поля 10000-16000 g при скорости потока 60 л/час.
При лабораторном фракционировании в состав гамма-глобулиновой фракции переходит 30-60% от общего белка плазмы (сыворотки) крови.
При промышленном фракционировании осадки гамма-глобулиновой фракции собирают, вес сырого осадка составляет 20-50 кг, а концентрация белка 50-200 г/кг осадка.
В надосадочном растворе альбуминовой фракции концентрация белка колеблется в пределах 20-50 мг/мл.
При промышленном фракционировании объем альбуминовой фракции составляет 130-160 литров.
Стадия 6. Получение осадка альбуминовой фракции. Осаждение альбуминовой фракции осуществляют внесением в надосадочный раствор сухого порошка сульфата аммония из расчета 250-290 г/л на 1 л раствора. Сульфат аммония добавляют порционно или одновременно при постоянном перемешивании. После растворения сульфата аммония значение рН инкубационной среды доводят до 4,6±0,1 с помощью 1 моль/л раствора соляной кислоты в соответствии с методикой, описанной выше. Время дополнительного перемешивания составляет 2 часа.
Суспензию центрифугируют в лабораторных условиях на центрифугах типа РС-6 при напряженности гравитационного поля 4200 g в течение 30 мин. В промышленном варианте используют проточные центрифуги типа ОТР-1, при скорости потока 60 л/час и напряженности гравитационного поля 10000-16000 g.
В лабораторном варианте масса осадков значения не имеет. При промышленном фракционировании вес осадков составляет 20-50 кг, а концентрация белка 40-150 г/кг сырого осадка.
Стадия 7. Приготовление консервирующего раствора из надосадочной жидкости, полученной после осаждения белков альбуминовой фракции (постальбуминовый центрифугат). В надосадочном растворе концентрация белка не должна превышать 1 мг/мл.
Для приготовления консервирующего раствора к раствору центрифугата (постальбуминовый центрифугат) добавляют необходимое количество 40% раствора фенола в глицерине до конечной концентрации 1,0%. Далее раствор перемешивают в течение 30 минут. Затем значение рН инкубационной среды доводят до 6,0±0,1 с помощью 1 моль/л раствора гидроксида натрия в соответствии с методикой, описанной выше.
Стадия 8. Приготовление полуфабрикатов иммуноглобулиновых и альбуминовых биопрепаратов. Сырые осадки гамма-глобулина и альбумина суспендируют в консервирующем растворе из расчета на 1 весовую часть сырого осадка добавляют 2 объема консервирующего раствора и перемешивают в течение 2 часов до образования однородной суспензии.
Информация, использованная при подготовке заявки на патент
1. Guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products // WHO Technical Report, Series №.924, 2004, p. 151-219;
2. Панов В.П. Принципы обеспечения вирусной безопасности продуктов крови (обзор). // Хим.-фарм. журнал. 2004, т. 38, №3, с. 39-47;
3. Horowitz В. Investigations into the application of tri(n-butyl)phosphate/detergent mixtures to blood derivatives. Current Studies in Hematology and Blood Transfusion, 1989, p. 83-96;
4. Kao K.J. Effects of leukocyte depletion and UVB irradiation on allogenecity of major histocompatibility antigens in platelet concentrates: a comparative study // Blood, 1992, p. 2931-2937;
5. Guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products // WHO Technical Report, Series №924, 2004, p. 151-219;
6. Сборник «Препараты крови. Инструктивно-методические материалы по контролю и производству» под редакцией Буренкова С.П. М: Изд-во Минздрава СССР, 1976, с. 203-218;
7. Русанов В.Н., Скобелев Л.И. «Фракционирование белков плазмы в производстве препаратов крови». - М.: Медицина, 1983, с. 49-83;
8. Руководство по организации, обслуживанию и использованию оборудования холодовой цепи для крови. Женева: Всемирная организация здравоохранения, 2009 г., с. 8-9;
9. Жибурт Е.Б. «Трансфузиология: учебник». СПб: Питер, 2002, 736 с.;
10. Патент RU №2151617, А61М 1/38, опубл. 27.06.2000;
11. Чард Т. «Радиоиммунологические методы». М.: Мир, 1981, с. 48;
12. 3убкова Н.Б. Биотехнологические аспекты эффективной и безопасной переработки донорской плазмы: проблемы и перспективы // Биопрепараты. - 2014, №1, с. 4-10;
13. Исрафилов А.Г. и др. Опыт получения апирогенных препаратов // Тезисы докладов IV Российского национального конгресса «Человек и лекарство», Москва 8-12 апреля 1997 г.: сборник «Человек и лекарство». Российский нац. конгр. (4; 1997; Москва). - М.: "ФАРМЕДИНФО", 1997. - с. 54;
14. Zhurina N.A., Shatskaia Т.L., Katushkina N.V. The virological safety and bacterial sterility of a method for fractionating blood plasma proteins with rivanol // Zh. Mikrobiol. Epidemiol. Immunobiol. 1993, 1: p.45-48;
15. Colvin В.T. Effect of dry heating of coagulation factor concentrates at 80°C for 72 hours on transmission of non-A, non-B hepatitis // Lancet. - 1988. - p. 814-816;
16. Brackmann H.H., Egli H. Acute hepatitis В infection after treatment with heatinactivated factor VIII concentrate // Lancet, 1988, p. 967;
17. Wages D., Smith D., Walsh J. et all. Virally inactivated fresh frozen plasma transfusion in normal volunteers // Vox Sang 1998; 74, Suppl 1: p. 1290;
18. Патент RU №2338375. Способ хранения плазмы или сыворотки крови для получения иммуноглобулиновых и альбуминовых биопрепаратов. Опубл. 20.11.2008 г. Бюл. №32 (прототип);
19. Avram N., Paunescu G.Н., Gradinary D. et al. La resistance du virus de la leucose bovine (VLB) a certains agents physiques et chimiques / Bull. Acad. Sc. Agr. Forest, 1980, 10, p. 205-209;
20. Европейская заявка №0281978 «Инактивирование вируса СПИД в содержащих белок растворах при помощи фенола». Опубликовано РЖ ИСМ 44-65-89;
21. Красильников А.П. «Справочник по антисептике», Минск: «Вышэйшая школа», 1995, с. 122-123;
22. Suomela Н. An Ion Exchange Method for Immunoglobulin G production. In: Methods of Plasma Protein Fractionation / Ed. J.M. Curling. Academic Press, London, UK, 1980, p. 107-116;
23. Скоупс P.К. Методы очистки белков. M.: Мир, 1985, 358 с.;
24. Черкасов А.Н., Пасечник В.А. Мембраны и сорбенты в биотехнологии. - Л.: Химия, 1991, 240 с.;
25. ГОСТ 31940-2012 - Вода питьевая. Методы определения содержания сульфатов;
26. Методические указания МУК 4.1/4.2.588-96 - Методы контроля медицинских иммунобиологических препаратов, вводимых людям.







Примечание: М - средняя арифметическая; ±m - стандартное отклонение; Р - уровень значимости различий; n=5; К - контрольные образцы готовили, отбирая часть из сырых осадков γ-глобулиновой фракции плазмы крови, формирующейся при конечных концентрациях сульфата аммония и фенола, соответственно 33% от насыщения и 0,3%. Осадки суспендировали (вес/объем) в 9 объемах раствора сульфата аммония 50% от насыщения, рН (7,0±0,1) и помещали на хранение при температуре (5±3)°C. О - полуфабрикаты (опытные образцы), представлены теми же γ-глобулиновыми фракциями, которые суспендировали в фенольно-сульфатных растворах (конечные концентрации сульфата аммония - 50% от насыщения и фенола - 1±0,1%) в соотношении (вес/объем) 1:2 при рН (7,0±0,1) и хранили в течение 40 дней при температуре (15-25)°C и далее 180 дней при температуре (10±1)°C.
В контрольных и опытных образцах, представленных растворами γ-глобулинов или IgG, выделенных из их состава по ранее опубликованной методике («Прикладная биохимия и биотехнология», 2009, том 45, №3, с. 378-383), определяли активность антител. Общую концентрацию белка в исследуемых образцах устанавливали в пределах (15±1) мг/мл. Анализ выполняли в соответствии с инструктивно-методическими указаниями для иммуноферментного выявления антител к вирусу лейкоза крупного рогатого скота (Veri Test, ООО «Ветбиохим»), вирусу инфекционного ринотрахеита крупного рогатого скота (ИРТ-Серотест, ООО «Ветбиохим») и иммуноглобулинов класса G к вирусу клещевого энцефалита (Векто ВКЭ-IgG, ЗАО «Вектор-Бест»). О сохранности активности антител судили по величине оптической плотности контрольных и опытных образцов при разведении их в 26 раз «Veri Test» или в 100 раз «ИРТ-Серотест» и «Векто ВКЭ-IgG». Отсутствие достоверных различий в величинах ОП между контрольными и опытными образцами свидетельствует о сохранности функциональной активности антител из класса IgG в составе полуфабрикатов при концентрации фенола (1±0,1) % и концентрации сульфата аммония в пределах 50-75% от насыщения в течение 220 дней хранения, в т.ч. в течение 40 дней при температуре (20±5)°C.
n (количество экспериментов)=3, ЛКРС - лейкоз крупного рогатого скота, ИРТ - инфекционный ринотрахеит, КЭ - клещевой энцефалит.

Уровень олигомеризации IgG определяли следующим образом. Исходно получали фенольно-сульфатный полуфабрикат согласно описанной методике в настоящем патенте. Далее, после удаления сульфат ионов (патент №2338375 «Способ хранения плазмы или сыворотки крови для получения иммуноглобулиновых и альбуминовых биопрепаратов»), из полученных полуфабрикатов выделяли электрофоретически гомогенные и хроматографически мономерные образцы IgG (Прикладная биохимия и биотехнология», 2009, том 45, №3, с. 378-383). Полученные образцы IgG концентрировали до 100 мг/мл, вносили стабилизатор и подвергали стерилизующей фильтрации, далее отбирали контрольные образцы и оставляли их на хранение при температуре (5±3)°С в течение 12 мес. Уровень олигомеризации IgG определяли в соответствии с Методическими указаниями МУК 4.1/4.2.588-96 «Методы контроля медицинских иммунобиологических препаратов, вводимых людям», с. 25.