Способ выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней
Вид РИД
Изобретение
Изобретение относится к ветеринарной вирусологии, а именно к средствам диагностики вирусных и инфекционных заболеваний у животных, в частности к методам выявления РНК вируса репродуктивно-респираторного синдрома свиней (РРСС).
Известно использование метода ПЦР для генотипирования в способе определения нуклеотидной последовательности представляющей интерес нуклеиновой кислоты в образце, включающем получение п образцов, амплификацию, где пару или множество пар индексированных праймеров используют для каждого образца, причем каждая пара индексированных праймеров состоит из прямого индексированного праймера и обратного индексированного праймера, представляющие собой вырожденные праймеры и/или где метод секвенирования второго поколения представляет собой парно-концевой метод (патент РФ 2587606, кл. C12Q 1/68, C12N 15/11, 2016 г.).
Известен способ диагностики вирусных заболеваний методом ПЦР, известный из документа WO/2012/053666, в котором для проведения ПЦР используют так называемые «вырожденные», или «дегенеративные» праймеры, которые фактически представляют собой смесь олигонуклеотидов различной структуры, в той или иной степени специфичных к вирусной ДНК различных генотипов.
Наиболее близким по технической сущности является техническое решение (КОЗЛОВА А.Д., автореферат «Разработка ПЦР-тест-систем для идентификации парвовируса и генотипирования вируса репродуктивно-респираторного синдрома свиней, Москва, 2014 г., стр. 10-13) включающее выделение РНК из биологического материала инфицированных свиней сорбционным методом, синтез кДНК на матрице РНК путем постановки одноэтапной мультиплексной реакции обратной транскрипции и полимеразной цепной реакции с добавлением внутреннего контрольного образца на основе бактериофага MS2 и положительного контрольного образца, состоящего из внутреннего контрольного образца на основе бактериофага MS2, европейского и американского генотипов вируса репродуктивно-респираторного синдрома свиней, проведение 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома вируса репродуктивно-респираторного синдрома свиней олигонуклеотидных праймеров, флуоресцентно-меченных зондов и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией.
Недостатком известного технического решения является отсутствие возможности получения достоверной диагностики репродуктивно-респираторного синдрома свиней и выявление различных серотипов вируса.
Техническим результатом является обеспечение достоверной диагностики репродуктивно-респираторного синдрома свиней и выявление различных серотипов вируса.
Технический результат достигается тем, что в способе выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней, включающем выделение РНК из биологического материала инфицированных свиней сорбционным методом, синтез кДНК на матрице РНК путем постановки одноэтапной мультиплексной реакции обратной транскрипции и полимеразной цепной реакции с добавлением внутреннего контрольного образца на основе бактериофага MS2 и положительного контрольного образца, состоящего из внутреннего контрольного образца на основе бактериофага MS2, европейского и американского генотипов вируса репродуктивно-респираторного синдрома свиней, проведение 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома вируса репродуктивно-респираторного синдрома свиней олигонуклеотидных праймеров, флуоресцентно-меченных зондов и контрольных образцов, измерение накопления флуоресцентного сигнала по каналам соответствующих флуоресцентных красителей и интерпретацию результатов на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, согласно изобретению для внутреннего контрольного образца используют суспензию бактериофага MS2 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, а для положительного контрольного образца используют смесь содержащую фрагменты нуклеиновых кислот европейского и американского генотипов вируса репродуктивно-респираторного синдрома свиней и фрагмент генома нативного бактериофага MS2 взятых в соотношении 1:1:1, со следующими нуклеотидными последовательностями:
EU-F: 5'-GCTGCYGAAGAYGAYATYCG-3' - прямой праймер
EU-R: 5'-AAGCRACGCAGTYCCYGC-3' - обратный праймер
EU-P: FAM-5'-CTGYTTGCAATCGATYCAGACDGC-3' - BHQ1
NA-F: 5'-GCTGGCRTTCTTSAGRCATCYC-3' - прямой праймер
NA-R: 5'-GRTCRCCCTAAMTGAATAGGTG-3' - обратный праймер
NA-P: НЕХ-5'-TGTGGTKAAYGGCACTGATTGACA-3' - BHQ1
MS2F: 5'-TGGCACTACCCCTCTCCGTATTCAC-3' - прямой праймер
MS2R: 5'-GTACGGGCGACCCCACGATGAC-3' - обратный праймер
MS2P: Су5-5'-CACATCGATAGATCAAGGTGCCTACAAGC-3' - BHQ2,
при этом накопление флуоресцентного сигнала измеряют по каналам: FAM/Green для специфического сигнала европейского генотипа вируса репродуктивно-респираторного синдрома свиней; JOE/Yellow для специфического сигнала американского генотипа этого же вируса и Cy5/Red для сигнала внутреннего контроля, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считают положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Новизна заявляемого технического решения заключается в том, что для получения достоверной диагностики репродуктивно-респираторного синдрома свиней, инфекции, вызываемой вирусом PRRSV используют метод ПЦР с использованием вырожденных праймеров и зондов, что позволяет выявлять различные серотипы вируса. Также для получения достоверной диагностики вируса РРСС используют две последовательные реакции: обратной транскрипции вирусной РНК для получения кДНК и полимеразной цепной реакции для амплификации фрагмента полученной кДНК матрицы. Обе реакции проводятся последовательно в одной ПЦР-пробирке (one-tube) с применением разных видов контроля для которых используют различные формы материала бактериофага MS2: суспензия и фрагмент генома со специфическими к нему праймерами и зондом. Такая постановка ОТ-ПЦР в реальном времени сокращает и упрощает процедуру анализа, снижает риск контаминации и возможность ошибки при переносе кДНК в другую пробирку для ПЦР. Кроме того, детекция продуктов амплификации осуществляется с использованием принципа выщепления флуоресцентной метки на 5' конце олигонук-леотидного зонда.
Признаки, отличающие заявляемое техническое решение от прототипа, направлены на достижение технического результата и не выявлены при изучении данной и смежной областей науки и техники и, следовательно, соответствуют критерию «изобретательский уровень».
Заявляемый способ рекомендовано использовать в ветеринарной вирусологии, а именно к средствам выявления и генотипирования вируса РРСС, что соответствует критерию «промышленная применимость».
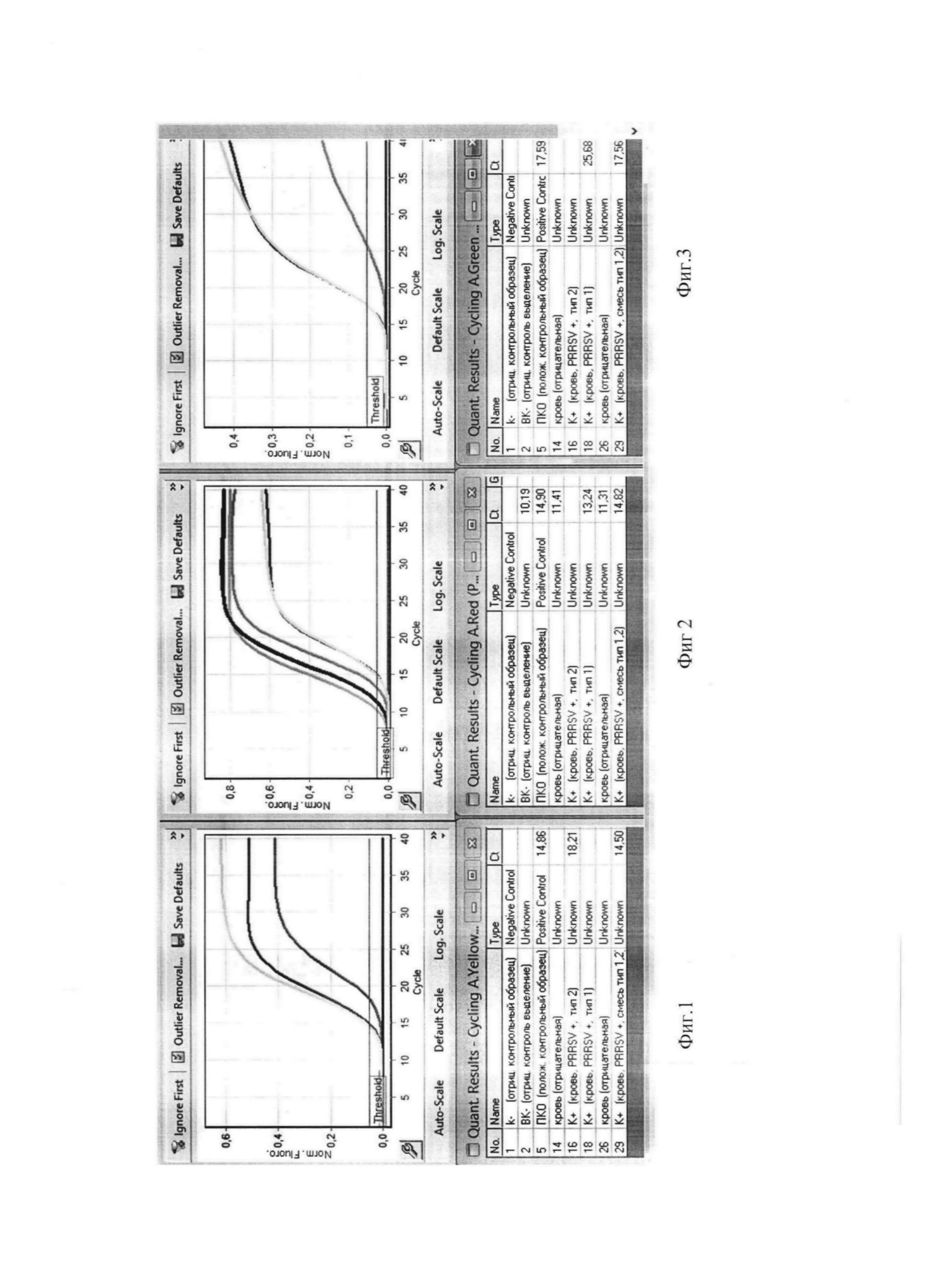
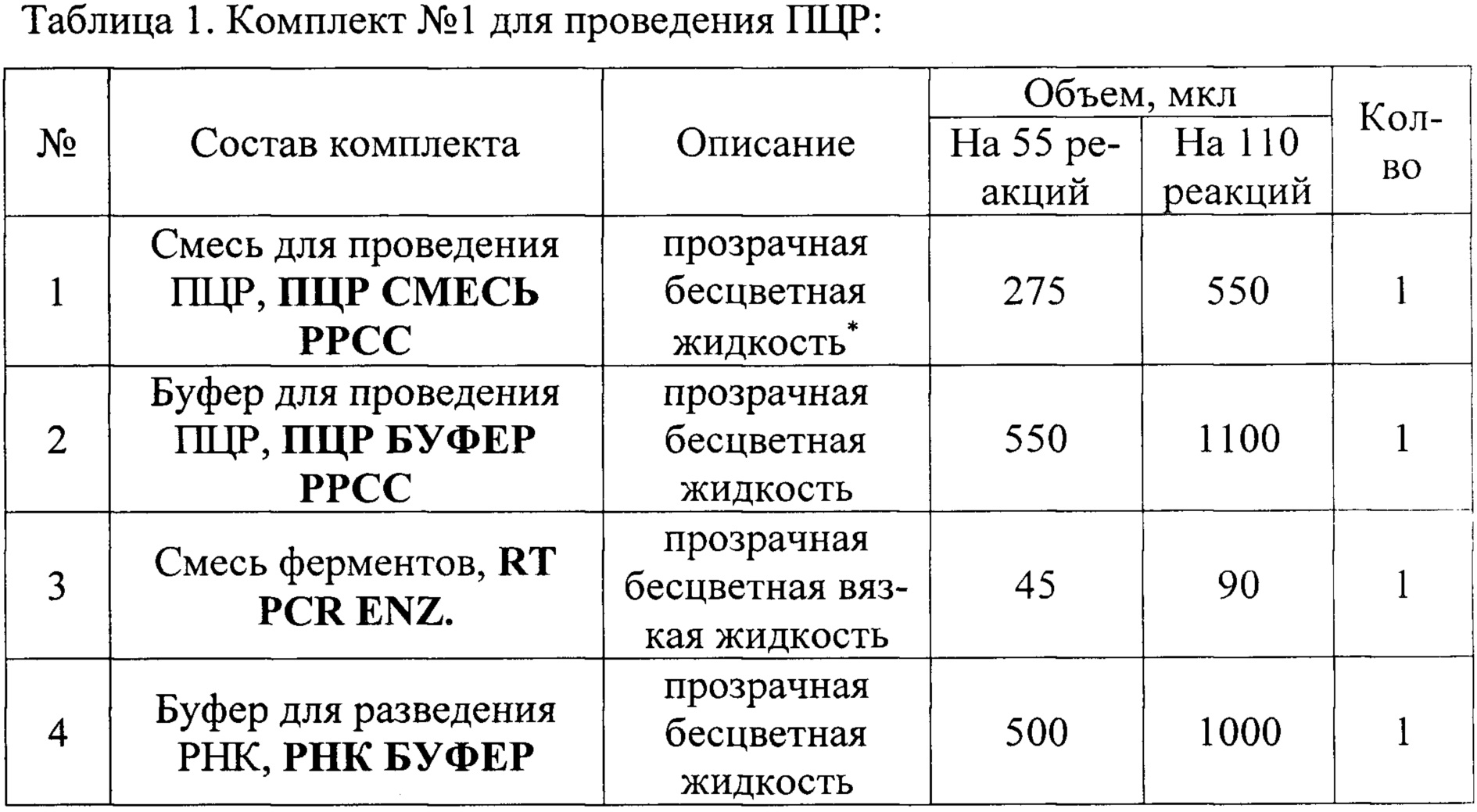
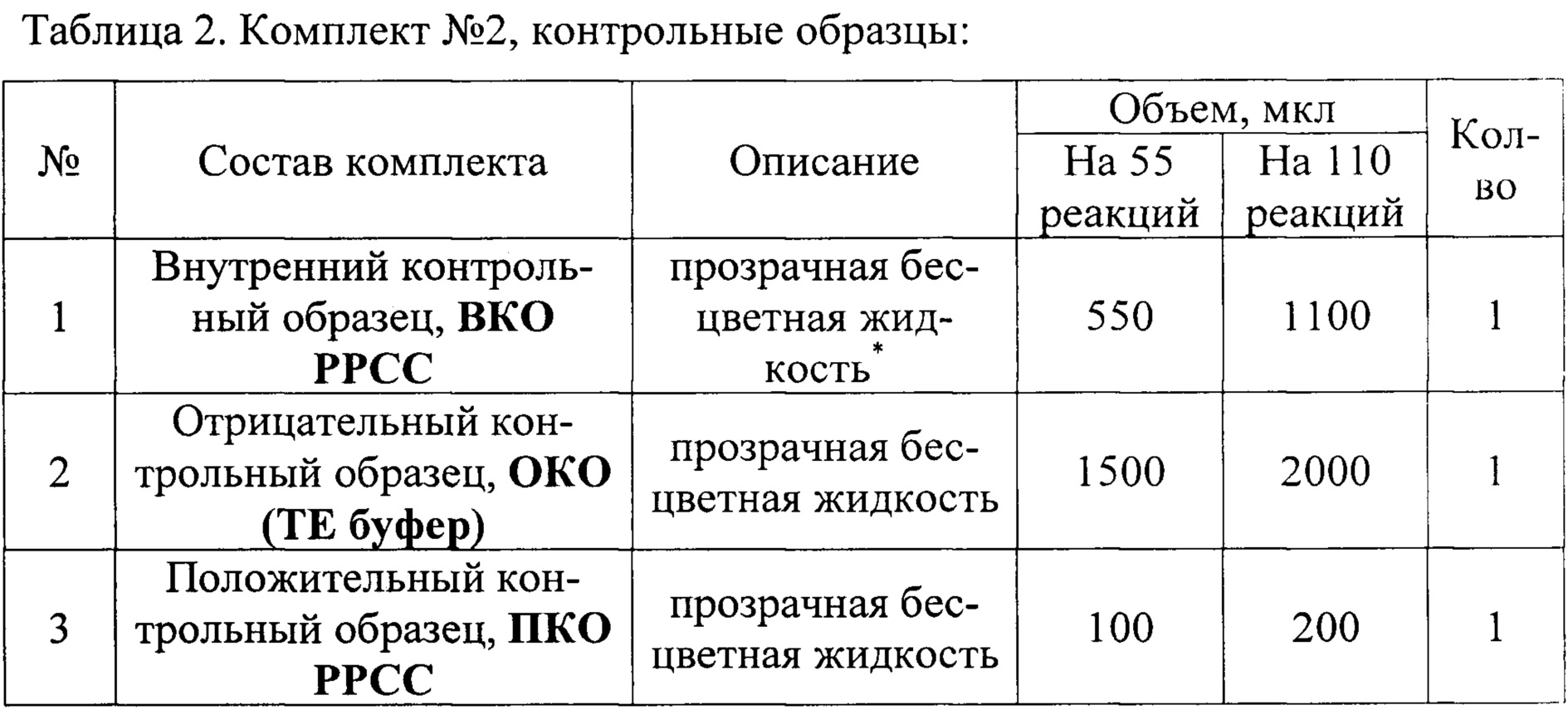
Сущность изобретения поясняется чертежом, где представлены скриншоты графиков: на фиг. 1 - представлен канал JOE/Yellow для специфического сигнала американского генотипа (тип 1) вируса репродуктивно-респираторного синдрома свиней; на фиг. 2 представлен канал Cy5/Red - для тестирования сигнала внутреннего контрольного образца (ВКО); на фиг. 3 - FAM/Green для специфического сигнала европейского генотипа (тип 2) этого же вируса.
Способ выявления и генотипирования РНК вируса репродуктивно-респираторного синдрома свиней осуществляется следующим образом Предварительно выделяют РНК из биологического материала инфицированных свиней сорбционным методом. В качестве биологического материала по выбору могут быть использованы:
 плазма крови, сыворотка крови;
плазма крови, сыворотка крови;
 мазки со слизистой глотки;
мазки со слизистой глотки;
 сперма;
сперма;
 плацента и плодовые оболочки от абортировавших животных;
плацента и плодовые оболочки от абортировавших животных;
 фрагменты тканей и органов павших животных (миндалины, селезенка, легкие, печень и др.).
фрагменты тканей и органов павших животных (миндалины, селезенка, легкие, печень и др.).
Далее осуществляют синтез кДНК на матрице РНК путем постановки одноэтапной мультиплексной реакции обратной транскрипции и полимеразной цепной реакции с добавлением внутреннего контрольного образца на основе бактериофага MS2 и положительного контрольного образца, состоящего из внутреннего контрольного образца, европейского и американского генотипов вируса репродуктивно-респираторного синдрома свиней. Для внутреннего контрольного образца используют суспензию бактериофага MS2 с концентрацией 5×103 копий нуклеотидных последовательностей на 1 мкл, если концентрация копий нуклеотидных последовательностей отклоняется в большую или меньшую сторону, то наблюдаются повторности сомнительных образцов. Для положительного контрольного образца используют смесь содержащую фрагменты нуклеиновых кислот европейского и американского генотипов вируса репродуктивно-респираторного синдрома свиней и фрагмент генома нативного бактериофага MS2 взятых в соотношении 1:1:1, если не будут соблюдаться данные соотношения, то будут наблюдаться повторности сомнительных образцов. Фрагменты нуклеиновых кислот европейского и американского генотипов вируса репродуктивно-респираторного синдрома свиней и фрагмент генома нативного бактериофага MS2 представлены следующими нуклеотидными последовательностями:
EU-F: 5'-GCTGCYGAAGAYGAYATYCG-3' - прямой праймер
EU-R: 5'-AAGCRACGCAGTYCCYGC-3' - обратный праймер
EU-P: FAM-5'-CTGYTTGCAATCGATYCAGACDGC-3' - BHQ1
NA-F: 5'-GCTGGCRTTCTTSAGRCATCYC-3' - прямой праймер
NA-R: 5'-GRTCRCCCTAAMTGAATAGGTG-3' - обратный праймер
NA-P: НЕХ-5'-TGTGGTKAAYGGCACTGATTGACA-3' - BHQ1
MS2F: 5'-TGGCACTACCCCTCTCCGTATTCAC-3' - прямой праймер
MS2R: 5'-GTACGGGCGACCCCACGATGAC-3' - обратный праймер
MS2P: Су5-5'-CACATCGATAGATCAAGGTGCCTACAAGC-3' - BHQ2.
Использование нативного бактериофага MS2, т.е. неповрежденного при исследовании обеспечивает стабильное состояние РНК, что улучшает синтез кДНК.
Проводят 40 циклов амплификации с детекцией в реальном времени с использованием специфичных для участка генома вируса репродуктивно-респираторного синдрома свиней олигонуклеотидных праймеров, флуоресцентно-меченных зондов и контрольных образцов. Накопление флуоресцентного сигнала измеряют по каналам: FAM/Green для специфического сигнала европейского генотипа вируса репродуктивно-респираторного синдрома свиней; JOE/Yellow для специфического сигнала американского генотипа этого же вируса и Cy5/Red для сигнала внутреннего контроля, если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считают положительным (РНК вируса репродуктивно-респираторный синдрома свиней присутствует), а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Пример конкретного осуществления способ выявления и генотипирования
РНК вируса репродуктивно-респираторного синдрома свиней
Для исследования по выбору используют следующий материал:
 Плазма крови, сыворотка крови. Кровь забирается в пробирку с 6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают. Для получения сыворотки забирают кровь в пробирку без антикоагулянта;
Плазма крови, сыворотка крови. Кровь забирается в пробирку с 6% ЭДТА из расчета 50 мкл раствора ЭДТА на 1 мл крови, закрытую пробирку с кровью несколько раз переворачивают. Для получения сыворотки забирают кровь в пробирку без антикоагулянта;
 Мазки со слизистой глотки и трахеи берут сухими ватными зондами. Зонд с материалом помещают для транспортировки в пробирки со стерильным физиологическим раствором (конец отламывают, что бы пробирку можно было закрыть);
Мазки со слизистой глотки и трахеи берут сухими ватными зондами. Зонд с материалом помещают для транспортировки в пробирки со стерильным физиологическим раствором (конец отламывают, что бы пробирку можно было закрыть);
 Сперму в объеме не менее 2 мл, в стерильную посуду;
Сперму в объеме не менее 2 мл, в стерильную посуду;
 Плацента и плодовые оболочки от абортировавших животных берут на исследование целиком;
Плацента и плодовые оболочки от абортировавших животных берут на исследование целиком;
 Фрагменты тканей и органов павших животных (миндалины, селезенка, легкие, печень и др.) отбирают в стерильный контейнер.
Фрагменты тканей и органов павших животных (миндалины, селезенка, легкие, печень и др.) отбирают в стерильный контейнер.
Мазки и смывы, цельную кровь используют для выделения РНК без предварительной подготовки.
Для получения плазмы пробирку с цельной кровью центрифугируют в течение 10 мин при 1000 g (если кровь стояла при температуре от 2°С до 8°С более 1 ч после ее взятия, то пробирку следует аккуратно несколько раз перевернуть для равномерного перемешивания крови). Переносят плазму в количестве не менее 1 мл одноразовыми наконечниками с фильтром в стерильные пробирки объемом 1,5 мл.
Для получения сыворотки пробирки с кровью (без антикоагулянта) отстаивают при комнатной температуре в течение 30 минут до полного образования сгустка. Затем центрифугируют при 600-1600 g (3000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 10 минут при комнатной температуре. Сыворотку переносят отдельными наконечниками с фильтром в стерильные пробирки объемом 1,5 мл.
К образцу спермы добавляют 4 объема стерильного физиологического раствора, тщательно перемешивают и центрифугируют 5 мин при 10000 тыс/оборотов (на центрифуге MiniSpin, Eppendorf, Германия). Для экстракции РНК используют 100 мкл надосадочной жидкости.
Исследуемые пробы тканей и органов (небольшие кусочки до 1 г весом) гомогенизируют с использованием стерильных фарфоровых ступок и пестиков или автоматических гомогенизаторов. Затем готовят 10% суспензию на стерильном физиологическом растворе или фосфатном буфере. Суспензию переносят в пробирку объемом 1,5 мл и центрифугируют при 600-1600 g (3000 об./мин на центрифуге «MiniSpin», Eppendorf, Германия) в течение 2 мин. Аликвоту надосадочной жидкости (0,1 мл) используют для экстракции РНК.
Для проведения анализа используют набора реагентов «ПЦР-РРСС-ФАКТОР».
Исследование состоит из трех этапов:
 экстракция нуклеиновых кислот (НК), на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»;
экстракция нуклеиновых кислот (НК), на этом этапе дополнительно используют реактивы для экстракции, например набор «ДНК/РНК-С-ФАКТОР»;
 проведение ОТ-ПЦР РВ;
проведение ОТ-ПЦР РВ;
 учет результатов анализа.
учет результатов анализа.
Набор позволяет специфически амплифицировать фрагмент генома вируса РРСС и генома внутреннего положительного контроля (бактериофага MS2) в мультиплексной полимеразной цепной реакции.
Набор состоит из комплекта реагентов для проведения мультиплексной ПЦР (комплект №1) и комплекта контрольных образцов (комплект №2).
Набор выпускается в двух вариантах:
1) Для анализа 55 образцов (включая контрольные образцы)
2) Для анализа 110 образцов (включая контрольные образцы). Состав набора приведен в Таблицах 1 и 2.
Наборы используются в соответствии с инструкцией по применению набора реагентов «ПЦР-РРСС-ФАКТОР» для выявления РНК вируса репродуктивно-респираторного синдрома свиней в биологическом материале методом совмещенной реакции обратной транскрипции и полимеразной цепной реакции (ПЦР) с флуоресцентной детекцией в режиме реального времени (ОТ ПЦР РВ) ТУ 21.10.60-131-51062356-2017, для диагностики in vitro http://www.vetfaktor.ru/.
* Возможна легкая опалесценция
Реакция ОТ-ПЦР РВ проводится в одной пробирке.
Экстракция (выделение) НК из исследуемых проб
Отбирают необходимое количество одноразовых пробирок объемом 1,5 мл, включая отрицательный контроль выделения. Вносят во все пробирки с исследуемыми образцами, включая пробирку для отрицательного контрольного образца (ОКО), по 10 мкл внутреннего контрольного образца (ВКО), в качестве которого используют суспензию бактериофага MS2 с концентраци-ей 5×103 копий нуклеотидных последовательностей на 1 мкл РРСС.
Вносят исследуемые пробы в объеме согласно инструкции к набору для выделения НК, в пробирку отрицательного контроля выделения вместо исследуемой пробы вносят ОКО (пробирку обозначить как ВК-).
Выделяют НК из анализируемых и контрольных образцов согласно протоколу инструкции производителя набора для выделения НК.
Выделенную РНК можно хранить до 3 часов при температуре от 2°С до 8°С или в течение месяца при температуре не выше минус 70°С.
Подготовка образцов к проведению ПЦР
Общий объем реакционной смеси - 25 мкл, объем РНК-пробы - 10 мкл.
Успешное прохождение реакции контролируют использованием положительного контрольного образца (ПКО) РРСС, ВКО РРСС и РНК буфера.
В отдельной пробирке смешивают компоненты набора из расчета на каждую реакцию:
10 мкл ПЦР БУФЕР РРСС
5 мкл ПЦР СМЕСЬ РРСС
0,75 мкл RT PCR ENZ.
Перемешивают смесь на вортексе и сбрасывают капли кратковременным центрифугированием. Отбирают необходимое количество пробирок для амплификации НК исследуемых и контрольных проб и вносят по 15 мкл приготовленной реакционной смеси.
Используя наконечники с фильтром в подготовленные пробирки вносят:
а) в пробирку отрицательного контроля ПЦР (К-) 10 мкл РНК буфера;
б) в ряд пробирок для исследуемых проб - в каждую вносят по 10 мкл НК соответствующей пробы (включая пробу ВК-);
в) в пробирку с положительным контролем ПЦР (К+) 10 мкл ПКО РРСС.
Проведение реакции ПЦР РВ с флуоресцентной детекцией осуществляют с помощью прибора «Rotor-Gene Q»
Параметры температурно-временного режима амплификации на этом приборе представлены в таблице 3.

Далее помещают подготовленные для проведения ПЦР пробирки в ячейки амплификатора, программируют прибор согласно инструкции производителя.
Интерпретация результатов анализа
Полученные данные - кривые накопления флуоресцентного сигнала анализируются с помощью программного обеспечения используемого прибора для проведения ПЦР в соответствии с инструкцией производителя к прибору.
Накопление флуоресцентного сигнала измеряли по каналам: FAM/Green для специфического сигнала европейского генотипа (тип 1) вируса репродуктивно-респираторного синдрома свиней; JOE/Yellow для специфического сигнала американского генотипа (тип 2) этого же вируса и Су5/Red для сигнала внутреннего контроля. Учет результатов ОТ-ПЦР РРСС РВ проводится по наличию или отсутствию пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (что соответствует наличию или отсутствию значения порогового цикла «Ct» для исследуемого образца), если кривые накопления флуоресцентного сигнала выходят до 35 цикла, то результат реакции считают положительным, а если кривые не пересекают пороговую линию или пересекают ее после 35 цикла, то результат реакции - отрицательный.
Результат считается достоверным в случае корректного прохождения положительных и отрицательных контролей амплификации и экстракции НК в соответствии с таблицей 4 и фиг. 1, 2, 3).
Появление любого значения Ct в таблице результатов для отрицательного контроля этапа экстракции ВК- на каналах FAM/Green, JOE (HEX)/Yellow и для отрицательного контроля этапа ПЦР К - на любом из каналов свидетельствует о наличии контаминации реактивов или образцов. В этом случае результаты анализа по всем пробам считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
Образцы, для которых по каналу Cy5/Red значение Ct отсутствует или превышает 35 цикл (при этом по всем каналам FAM/Green, JOE (HEX)/Yellow и отсутствует значение Ct) требуют повторного проведения исследования. Задержка в значениях пороговых циклов для исследуемых образцов на канале Cy5/Red указывает на присутствие ингибиторов в пробе(ах) или на ошибки при постановке реакции ОТ-ПЦР РРСС РВ. Требуется провести исследование, начиная с этапа экстракции НК.
Результат амплификации кДНК вируса РРСС европейского генотипа (тип 1) регистрируется на канале FAM/Green, результат амплификации кДНК вируса РРСС американского генотипа (тип 2) регистрируется на канале JOE/Yellow, результат амплификации экзогенного ВКО регистрируется на канале Cy5/Red.
Образец считается положительным (РНК вируса репродуктивно-респираторный синдрома свиней присутствует) если наблюдается экспотенциальный рост сигнала на хотя бы одном из каналов FAM/Green, JOE (HEX)/Yellow, при этом значение Ct на данном канале, соответствующем амплификации кДНК вируса РРСС, определяется не позднее 37 цикла, a Ct контрольных образцов находятся в пределах нормы (табл. 4, фиг. 1, 2, 3).
Если для исследуемого образца по каналу (каналам) детектирующим наличие вируса РРРС (FAM/Green, JOE (HEX)/Yellow) значение Ct определяется позднее 37 цикла при корректном прохождении положительных и отрицательных контролей - он считается спорным и исследуется повторно с этапа выделения НК. Если при повторной постановке наблюдается схожий результат (Ct), тогда требуется повторное взятие материала от того же животного для проведения ПЦР-исследования и (или) использование альтернативных методов диагностики.
При получении сомнительных результатов рекомендуется исследование смывов с поверхностей в лаборатории для исключения риска внутри лабораторной контаминации.
Образец считается отрицательным (НК вируса репродуктивно-респираторный синдрома свиней отсутствует) если не наблюдается рост сигнала флуоресценции ни на одном из каналов - FAM/Green, JOE (HEX)/Yellow, при этом значения Ct контрольных образцов находятся в пределах нормы (см. Табл. 4, фиг. 1, 2, 3).
Для доказательства эффективности использования ПЦР с флуоресцентной детекцией в режиме реального времени с применением разных видов контроля с различными формами материала бактериофага MS2: суспензии и фрагмента генома со специфическими к нему праймерами и зондом проводился сравнительный анализ чувствительности и специфичности заявляемого с прототипом. В результате исследований чувствительность и специфичность заявляемого способа на 1,5-2% выше, чем у прототипа, а именно имеет чувствительность 104 коп/мл РНК вируса РРСС в крови, сыворотке крови, суспензии внутренних органов и 7×103 коп/мл в сперме.