Результат интеллектуальной деятельности: Рекомбинантный белок, обладающий протективным действием в отношении менингококков (варианты), полинуклеотид, кодирующий рекомбинантный белок, рекомбинантная плазмидная ДНК, содержащая указанный полинуклеотид, клетка-хозяин, содержащая указанную рекомбинантную плазмидную ДНК, способ получения рекомбинантного белка
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области биотехнологии, в частности, генной инженерии, и касается получения нового рекомбинантного белка SEQ ID NO: 2 или его варианта SEQ ID NO: 4, обладаюшего протективным действием в отношении менингококков различных серогрупп, состоящего из полипептидных фрагментов первичной структуры полноразмерной IgA протеазы Neisseria meningitidis серогруппы В, соединенных в единую полипептидную цепь; нового полинуклеотида SEQ ID NO: 1 или его варианта SEQ ID NO: 3, кодирующего рекомбинантный белок; новой рекомбинантной плазмидной ДНК pET28-IgA1-11-3, содержащей полинуклеотид SEQ ID NO: 1 или ее варианта рекомбинантной плазмидной ДНК рЕТ28-IgA1-13-1, содержащей полинуклеотид SEQ ID NO: 3; клетки-хозяина, прежде всего нового штамма бактерий Escherichia coli BL21(DE3)/pET28-IgA1-11-3, продуцирующего рекомбинантный белок SEQ ID NO: 2 или его варианта BL21(DE3)/pET28-IgA1-13-1, продуцирующего рекомбинантный белок SEQ ID NO: 4; и способа получения рекомбинантного белка SEQ ID NO: 2 или SEQ ID NO: 4, предназначенного для использования при получении монокомпонентной вакцины для защиты человека от менингококковой инфекции.
Уровень техники
Бактериальный менингит, инфекционное заболевание, приводящее к воспалению оболочек мозга человека и высших приматов, характеризуется тяжелым течением, многочисленными осложнениями и высокой летальностью. Возбудителями бактериального менингита являются менингококки, пневмококки и гемофильные палочки (93%) и другие возбудители инфекций. Основными возбудителями менингококкового менингита являются бактерии N. meningitidis: из 12 выявленных серогрупп N. meningitidis шесть - А, В, С, W, X и Y, являются эпидемически опасными. Для профилактики заболевания существует несколько полисахаридных и конъюгированных вакцин. Полисахаридные вакцины доступны в двухвалентных (А, С), трехвалентных (А, С, W135) и четырехвалентных (А, С, W135, Y) составах, конъюгированные - в одновалентных (А или С) и четырехвалентных (А, С, W135, Y) составах, а также в комбинациях (N.
meningitidis серогруппа С и Haemophilus influenzae типа b) (Crum-Cianflone N., Sullivan E. Infect Dis Ther, 5:89-112, 2016). Полисахаридные вакцины для защиты от менингококков серогруппы В отсутствуют из-за особенностей структуры их капсульного полисахарида, но существуют две поликомпонентные вакцины на основе поверхностных белков этого патогена (Bianchi A. et al. J prev med hyg, 56: E140-E143, 2015; Gandhi A. et al. Postgraduate medicine, 128(6): 548-556, 2016; Donald R.G.K. et al. Hum vaccine immunother, 13(2): 255-265,2017). Вакцины против менингококков серогруппы X отсутствуют, но поиск антигенов, способных обеспечить защиту от менингококков данной серогруппы, продолжается (RU 2015100889, 14.06.2013 Пицца М. и др.). Большинство используемых в настоящее время вакцин имеют узкую направленность против конкретного возбудителя инфекции. Чтобы обеспечить защиту человека от всего многообразия циркулирующих и непрерывно мутирующих штаммов менингококка, необходимо использовать поликомпонентные вакцины, что приводит к высокой иммунной нагрузке на организм. Таким образом, несмотря на существование значительного количества противоменингококковых вакцин, разработка монокомпонентной вакцины против широкого спектра возбудителей менингококка, в частности, против менингококка серогруппы В, по-прежнему остается актуальной. Использование для этой цели IgAl протеаз (или их фрагментов), секретируемых рядом грамотрицательных (N. meningitidis, Н. influenzae, N. gonorrhoeae) и грамположительных (Str. pneumoniae, Str. sanguis, Str. oralis) бактерий и являющихся одним из основных факторов вирулентности этих бактерий, представляется весьма перспективным.
IgA1 протеазы обладают уникальной специфичностью в отношении иммуноглобулинов А1: расщепляют пептидные связи пролил-серии или пролил-треонин в шарнирных участках сывороточного (IgA1) и секреторного (sIgA1) иммуноглобулинов А1 человека и высших приматов (Plaut A.G., Bachovchin W.W. Methods Enzymol, 244: 137-151, 1994; Kilian M. et al. Mol Immunol, 20: 1051-1058,1983). Поверхность слизистых оболочек человека содержит значительное количество sIgA1, которые подавляют адгезию бактерий и вирусов на клетках слизистой оболочки и являются первой линией защиты организма от чужеродных агентов. Считается, что IgA1 протеазы, секретируемые патогенными бактериями, заселяющими слизистую оболочку человека, расщепляют sIgA1 и способствуют, тем самым, адгезии патогенных бактерий на поверхности слизистой оболочки и возникновению воспалительного процесса. Нейтрализация IgA1 протеаз на этой стадии инвазии может стать препятствием для развития инфекций, вызываемых
патогенами, секретирующими этот фермент, затрудняя адгезию бактерий на поверхности слизистой.
IgA1 протеазы серинового типа синтезируются в виде белков-предшественников - полноразмерных IgA протеаз, аутотранспортеров грамотрицательных бактерий, состоящих из трех функциональных доменов: N-концевого сигнального пептида (СП), транспортируемого домена и С-концевого транслокаторного домена (ТД). Транспортируемый домен локализован между СП и ТД и содержит протеазный субдомен, γ- и α-пептиды. На внешней мембране бактерии транспортируемый домен полноразмерной IgA протеазы подвергается аутокаталитическому процессингу по связям пролил-серин, локализованным в случае полноразмерной IgA протеазы N. meningitidis, штамм Н44/76 с общей последовательностью Met1-(Lys2-Phe1568), в участке аминокислотной последовательности γ-пептида Val975-Pro1006 (Van Ulsen P. and Tommassen J. FEMS Microbiol Rev., 30:292-319, 2006), формируя зрелый фермент - IgA1 протеазу (около 1000 аминокислотных остатков). Нумерация аминокислотных остатков фрагментов IgA протеазы здесь и далее в тексте соответствует последовательности полноразмерной IgA протеазы N. meningitidis Н44/76, приведенной на сайте http://www.ncbi.nlm.nih.gov/protein/ADC80147).
Анализ первичных структур бактериальных IgA протеаз из N. meningitidis, N. gonorrhoeae и Н. Influenza свидетельствует об их высокой гомологии (до 70%) (Lomholt Н. et al. Mol. Microbiol. 15:495-506. 1995). Наиболее консервативные участки этих белков находятся в транслокаторном домене и протеазном субдомене. Гомология аминокислотных последовательностей IgA протеаз из N. meningitidis и N. gonorrhoeae на участке Ala28-Pro1004 первичной структуры полноразмерной иммуноглобулин А протеазы N. meningitidis серогруппы В, штамм Н44/76, включающем протеазный домен и γ-пептид, выбранном нами для исследований в качестве базовой структуры, составляет более 90% Известны варианты нативной и рекомбинантной менингококковой IgA1 протеазы из N. meningitidis серогрупп А и В, которые обеспечивают защиту мышей от заражения вирулентной культурой менингококков серогрупп А, В и С (Ягудаева Е.Ю. и др. Биоорган, химия, 36:96-105, 2010; Серова О.В. и др. Биофарм. журнал, 3(6): 42-47, 2011; Котельникова О.В. и др. Биомед. хим. 60: 479-486, 2014; Zinchenko А.А. et al. J. Meningitis, 2015, 1:102). Методом ИФА было показано, что протективные антитела, образующиеся при иммунизации животных IgA1 протеазой, способны связываться с ферментом не только в растворе, но и с ферментом, экспонированным на поверхности убитых клеток менингококка (Котельникова О.В. и др. Бюллетень экспериментальной биологии и медицины, 161(3): 369-372, 2016). Полученные результаты в совокупности с высокой гомологией участка аминокислотной последовательности Ala28-Pro1004 первичной структуры полноразмерных иммуноглобулин А протеаз из различных источников позволили нам рассматривать IgA1 протеазу в качестве перспективной основы противоменингококковой моновакцины.
В предшествующем уровне техники описаны множественные композиции, конъюгаты и кандидатные вакцины на основе липополисахаридов, капсулярных олигосахаридов и/или полипептидов ряда поверхностных белков менингококка для иммунизации людей против менингита, вызываемого патогенными бактериями N. meningitidis различных серогрупп (пат. US 9561269, G.W. Zlotnick и др. 07.02.2017; пат. US 9724402, A.S. Anderson и др. 08.08.2017; пат. US 9475864, S. Ram и др. 25.10.2016). Однако указанные композиции являются многокомпонентными и не обеспечивают эффективную защиту от менингококковой инфекции серогруппы В.
Известно получение иммуногенных композиций против N. meningitidis серогруппы В (пат. RU 2498815 Конторни М. и др), содержащих в различных контейнерах адъювант, включающий эмульсию типа масло-в-воде и коктейль лиофилизованных антигенов, мембранных белков менингококков серогруппы В, который может включать конъюгированные полисахариды из N. meningitidis серогрупп А, С, W135 и/или Y, а также природные мембранные везикулы, рекомбинантные белки и липополисахариды из N. meningitidis серогрупп В; известно также получение полипептидных вакцин (пат. RU 2333007, Пицца М, 10.09.2008), представляющих собой композиции из пяти антигенов (белок NadA, белок 741, белок 936, белок 953 и белок 287) наружной мембраны N. meningitidis, и способных индуцировать гуморальный иммунный ответ против некоторых сверхвирулентных рядов поколений А4, ЕТ5 и ряда поколений 3 N. meningitidis серогруппы В.
Недостатками вышеперечисленных композиций являются сложность изготовления, многокомпонентность и в результате - высокая иммунная нагрузка на организм человека, узкая направленность действия на менингококки определенной серогруппы.
Перечисленные композиции не используют менингококковую IgA1 протеазу или ее фрагменты.
Известно получение иммуногенных в отношении менингококковых инфекций полипептидов, нуклеиновых кислот, кодирующих эти полипептиды, и антител,
связывающихся с этими полипептидами на основе белковых антигенов штамма М004-240196 N. meningitidis серогруппы В, имеющих не менее 95% гомологии с белками менингококков серогрупп А и С (пат. RU 2450019 Раппуоли Р.И др., 10.05 2012), или полипептидов на основе белка Neisseria ORF2086 (пат. US 08563006, B.J. Metcalf и др. 22.11.2013), которые могут быть использованы для лечения или профилактики болезней, вызываемых N. meningitidis. Полипептиды авторы рассматривают, главным образом, в качестве дополнительных компонентов для применения в усовершенствованных вакцинах для профилактики и/или лечения менингококкового менингита. Среди источников иммуногенных пептидов IgA1 протеаза или ее компоненты отсутствуют.
Известно получение рекомбинантных химерных белков, созданных на основе фрагментов антигенных доменов трех различных семейств поверхностного белка NMB1870 N. meningitidis, экспрессированных в структуре одной молекулы, для формирования иммунитета против заболеваний и/или инфекций, вызываемых менингококками, в частности, серогруппы В. (пат. RU 2375374 Мазиньяни В. и др., 10.12 2009). Авторы приводят несколько вариантов рекомбинантных химерных белков и композиций на их основе, способных индуцировать гуморальный бактерицидный ответ против штаммов менингококков серогруппы В и, как минимум, одной из серогрупп А, С, W или Y.
Химерные белки авторы рассматривают как кандидатные вакцины, однако они достаточно узконаправленные и для получения эффективной универсальной противоменингококковой вакцины необходимо использовать нескольких компонентов. Известно получение фрагментов IgA1 протеазы (пат. US 7235242, М. Achtman и др., 26.06.2007), которые используют в качестве пептидов-носителей углеводных компонентов клеточных стенок различных микроорганизмов: Neisseria, Streptococcus, Klebsiella, Salmonella, Shigella и Haemophilus. Описан синтез N-концевых фрагментов IgA1-протеазы из N. meningitidis серогруппы А, содержащих от 40 до 104 аминокислотных остатков.
Однако конъюгация этих пептидов с полисахаридами менингококков других серогрупп не приводит к расширению спектра действия полученных композиций, они обеспечивают защиту от менингококка только одной серогруппы.
Известен способ получения белка предшественника IgA1 протеазы. В статье (S. Vitovski and J.R. Sayers, Infection and Immunity, 75(6):2875-2885, 2007), описано клонирование полноразмерного гена, кодирующего сигнальный пептид, секретируемую форму протеазы и транспортный домен, изучен механизм аутопроцессинга IgA1 протеазы из ее предшественника, создан ряд мутированных форм IgA протеазы N. meningitides
серогруппы В. Было установлено, что указанные мутанты не обладают аутопротеолитической активностью и не секретируют зрелую протеазу. В данной работе белки предшественники IgA1 протеазы получали только с целью исследования механизма аутокаталитической активации фермента, в очищенном состоянии не выделялись, иммуногенные и протективные свойства белков не исследовались, возможность их использования с целью создания вакцины не рассматривалась.
Известно получение бактериальных IgA1 протеаз и их применение для лечения заболеваний, связанных с накоплением IgA1 в тканях и органах организма (пат. US 7407653, Plaut и др., 05.08.2008). Растворимые IgA1 протеазы, содержащие различные метки, получали с использованием методов рекомбинантной ДНК. Полученные препараты использовали в качестве фермента для лечения аутоиммунных заболеваний, связанных с накоплением IgA1. Однако полученный рекомбинантный белок обладал ферментативной активностью и его использование в качестве вакцины в патенте не обсуждалось.
В статье (Gupta SK et al, Vaccine. 28:7092-7097, 2010) описаны результаты компьютерного анализа потенциальных Т-клеточных эпитопов трех белков менингококка серогруппы В: белка А, стимулирующего Т-клетки (TspA), аутотранспортного белка A (AutA) и IgA1 протеазы. В результате исследования выявлены шесть девятичленных Т-клеточных эпитопов. Авторы полагают, что эти пептиды могут быть использованы в качестве перспективных агентов для защиты от менингококков серогруппы В, но экспериментальные данные, подтверждающие эту гипотезу, в работе не приведены и возможность получения вакцины на их основе не обсуждается.
Известны способы получения с применением технологии рекомбинантной ДНК ферментативно активной (Серова О.В. и др. Биофарм. журнал, 3(6): 42-47, 2011; пат. RU 2453599, Румш Л.Д. и др. 20.06.2012), или неактивной (мутантной по остатку серина активного центра, Ser267Ala) менингококковой IgA1 протеазы (Котельникова О.В. и др. Биомед. хим. 60: 479-486, 2014; пат. RU 2486243, Румш Л.Д. и др. 27.06.2013). В работе было описано получение полинуклеотидов, кодирующих указанные белки, рекомбинантных плазмидных ДНК, включающих эти полинуклеотиды, и клеток, трансформированных соответствующими рекомбинантными плазмидными ДНК, для получения очищенных целевых белков, обладающих высокой иммуногенностью и эффективным протективным действием в отношении менингококковой инфекции
основных эпидемических серогрупп А, В и С, с целью использования их в качестве перспективных агентов для защиты от менингококков различных серогрупп. Однако, высокая молекулярная масса (более 100 кДа), значительное количество В- и Т-клеточных антигенных детерминант в структуре этих ферментов и, соответственно, высокая антигенная нагрузка на организм при иммунизации, низкая растворимость рекомбинантных вариантов IgA1 протеазы, как в активной, так и в мутантной формах, а также способность IgA1 протеазы связывать С1-ингибитор системы комплемента человека (пат. RU 2475756, Козлов Л.В. и др. 20.02.2013), что может приводить к неконтролируемой активации комплемента человека по классическому пути в процессе иммунизации, ограничивают возможность использования IgA1 протеаз в качестве основы противоменингококковой моновакцины.
Известен способ получения с применением технологии рекомбинантной ДНК двух вариантов рекомбинантной IgA1 протеазы Met1-(Lys2-Asn963)-Leu-Glu-His6 и Met1-(Ala28-Asn963)-Leu-Glu-His6 из N. meningitidis серогруппы В, штамм H44/76 и низкомолекулярного рекомбинантного белка Met1-(Glu135-His328)-Leu-Glu-His6 с мол. массой 23 367 Да, фрагмента N-концевого участка этого фермента с высокой плотностью В-клеточных эпитопов (Zinchenko А.А. et al. J. Meningitis, 2015, 1:102). Все три белка были иммуногенны и обеспечивали высокую выживаемость иммунизированных ими мышей после заражения вирулентным штаммом Н44/76 N. meningitidis серогруппы В. В работе высказано предположение о том, что низкомолекулярный рекомбинантный белок Met1-(Glu135-His328)-Leu-Glu-His6 может быть использован в качестве основы противоменингококковой вакцины, однако данные по защите животных от заражения менингококками других серогрупп не приведены. Кроме того, при исследовании поведения иммунокомпетентных клеток CD4+, CD8+, CD19 в крови животных, иммунизированных этим соединением, выяснилось, что иммунорегуляторный индекс, CD4+/CD8+, через 6 месяцев после иммунизации заметно возрастал (1,28±0,10) в сравнении с контролем (1,00±0,07). Это свидетельствует о нежелательных сдвигах в состоянии общего гомеостаза иммунизированных животных, что является серьезным недостатком для кандидатной вакцины. Способ получения укороченного рекомбинантного белка (Zinchenko А.А. et al. J. Meningitis, 2015, 1:102) на основе первичной структуры IgA1 протеазы N. meningitidis серогруппы В, штамм Н44/76 как ближайший уровень техники был выбран в качестве прототипа.
Раскрытие изобретения
Изобретение решает задачу получения иммуногенных рекомбинантных белков на основе аминокислотной последовательности фрагмента Ala28-Pro1004 первичной структуры полноразмерной IgA протеазы N. meningitidis серогруппы В штамм Н44/76, обладающих эффективным иммуногенным и протективным действием в отношении менингококков различных серогрупп, в том числе в отношении менингококков серогруппы В, сопоставимым с действием рекомбинантной IgA1 протеазы, содержащей последовательность Ala28-Pro1004, не приводящих к нежелательным изменениям общего гомеостаза организма иммунизированных этими белками животных, для использования в качестве основного компонента моновакцины для защиты от инфекций, вызываемых менингококками различных серогрупп и другими патогенами, вирулентность которых обусловлена IgA1 протеазой.
Для решения этой задачи с помощью сервиса http://www.iedb.org
в последовательности Ala28-Pro1004, выбранной нами для исследований в качестве базовой структуры, было изучено распределение В- и Т-клеточных эпитопов и показано, что наибольшая плотность антигенных детерминант сосредоточена в трех участках базовой структуры: N-концевом (Ser120-Thr360), центральном (Lys415-Val710) и C-концевом (Gly820-Ser990). Учитывая результаты исследования на животных иммуногенных и протективных свойств низкомолекулярных рекомбинантных белков, полученных на основе структуры этих участков, которые показали, что эффективным протективным действием в отношении менингококка серогруппы В обладали только рекомбинантный белок Met1-(Glu135-His328)-Leu-Glu-His6 с мол. массой 23 367 Да, полученный на основе аминокислотной последовательности из N-концевого участка базовой молекулы Ser120-Thr360 (Zinchenko А.А. et al. J. Meningitis, 2015, 1:102), в то время как рекомбинантные белки на основе последовательностей Lys415-Val710 или Gly820-Ser990: Met1-(Trp329-His622)-Leu-Glu-His6, мол. масса 33 460 Да и Met1-(His835-Pro1004)-Leu-Glu-His6, мол. масса 19 808 Да, слабо защищали животных от заражения менингококками серогруппы В (уровень бактериемии в группе мышей, иммунизированных этими белками составлял 80 и 60%, соответственно), мы выбрали полипептидные фрагменты из N-концевого участка базовой структуры с высокой протективной активностью в отношении менингококков (Trp140-His328 или Trp140-Gln299) и из участков с низким протективным действием: Trp412-Asp604 и Tyr866-Pro1004, и затем в различных комбинациях соединили их в единую полипептидную цепь. Фрагменты были
выбраны таким образом, чтобы каждый из выбранных полипептидных фрагментов содержал в своей структуре один из трех Т-клеточных эпитопов базовой структуры, способных связываться с наибольшим количеством HLA-DR аллелей http://www.iedb.org. В результате были сконструированы и с применением технологии рекомбинантной ДНК получены рекомбинантный белок с последовательностью SEQ ID NO: 2, состоящий из трех соединенных в единую полипептидную цепь фрагментов базовой последовательности Ala28-Pro1004 IgA протеазы: Trp140-His328, Trp412-Asp604 и Tyr866-Pro1004 (молмасса 59 407 Да) и вариант рекомбинантного белка с последовательностью SEQ ID NO: 4, состоящий из двух соединенных в единую полипептидную цепь фрагментов базовой последовательности: Trp140-Gln299 и Tyr866-Pro1004 (молмасса 34 690 Да). Кроме того, была сконструирована и получена рекомбинантная IgA1 протеаза с последовательностью SEQ ID NO: 11 (белок сравнения), содержащей базовую последовательность Ala28-Pro1004.
Полученные комбинированные рекомбинантные белки SEQ ID NO: 2 и SEQ ID NO: 4 обладали эффективным протективным действием в отношении менингококков различных серогрупп, в том числе, в отношении бактерий N. meningitidis серогруппы В, не уступающим рекомбинантной IgA1 протеазе SEQ ID NO: 11. Рекомбинантные белки SEQ ID NO: 2 и SEQ ID NO: 4 не изменяли иммунорегуляторный индекс, CD4+/CD8+, иммунизированных животных, сохранив его на уровне контроля. Таким образом, полученные рекомбинантные белки SEQ ID NO: 2 и SEQ ID NO: 4 могут рассматриваться как основа монокомпонентной вакцины для защиты от менингококковой инфекции и других патогенов, вирулентность которых обусловлена IgA1 протеазой.
Полученные рекомбинантные белки SEQ ID NO: 2 и SEQ ID NO: 4 с различной молекулярной массой представляют собой объекты одного вида, так как содержат участки одной и той же базовой последовательности Ala28-Pro1004 IgA протеазы N meningitidis серогруппы В, причем белок SEQ ID NO: 4 является составной частью не только рекомбинантной протеазы SEQ ID NO: 11, но и белка SEQ ID NO: 2. Белки SEQ ID NO: 2 и SEQ ID NO: 4 - объекты одного назначения: оба предназначены для использования в качестве основного компонента монокомпонентной вакцины для профилактики заболеваний, вызываемых менингококками различных серогрупп, в том числе менингококком серогруппы В и других патогенов, вирулентность которых обусловлена IgA1 протеазой.
Белки SEQ ID NO: 2 и SEQ ID NO: 4 обеспечивают получение одного результата: оба иммуногенны, обладают протективным действием в отношении менингококков различных серогрупп, в том числе, в отношении бактерий N. meningitidis серогруппы В, не уступающим рекомбинантной IgA1 протеазе SEQ ID NO: 11, и не изменяют иммунорегуляторный индекс, CD4+/CD8+, иммунизированных животных.
Поставленная задача решается за счет:
А: рекомбинантного белка SEQ ID NO: 2 с молекулярной массой 59 407 Да, рассчитанной изоэлектрической точкой 8.75, с аминокислотной последовательностью из 530 аминокислотных остатков, полученного из трех соединенных в единую полипептидную цепь участков фрагмента Ala28-Pro1004 первичной структуры полноразмерной IgA протеазы N. meningitidis серогруппы В штамм Н44/76: Trp140-His328, Trp412-Asp604 и Tyr866-Pro1004, кодируемого нуклеотидной последовательностью SEQ ID NO: 1, обладающего высоким уровнем протективного действия в отношении менингококков различных серогрупп, не изменяющего иммунорегуляторный индекс, CD4+/CD8+, иммунизированных животных, предназначенного для получения монокомпонентной вакцины для профилактики менингококковых инфекций, вызываемых возбудителями различных серогрупп, в том числе бактериями N. meningitidis серогруппы В, и другими патогенами, вирулентность которых обусловлена IgA1 протеазой;
полинуклеотида (SEQ ID NO: 1), кодирующего рекомбинантный белок SEQ ID NO: 2; рекомбинантной плазмидной ДНК pET28-IgA1-11-3, включающей нуклеотидную последовательность SEQ ID NO: 1 и обеспечивающей экспрессию рекомбинантного белка SEQ ID NO: 2 в клетке-хозяине, характеризующейся следующими признаками:
длина цепи составляет 6799 п.о.;
кодирует рекомбинантный гибридный белок SEQ ID NO: 2 с гексагистидиновой меткой на С-конце белка;
нуклеотидную последовательность SEQ ID NO: 1, кодирующую рекомбинантный белок SEQ ID NO: 2 в плазмиде pET28-IgA1-11-3, на 3'-конце фланкирует уникальный сайт рестрикции эндонуклеазой XhoI;
нуклеотидная последовательность SEQ ID NO: 1, кодирующая рекомбинантный белок SEQ ID NO: 2 в плазмиде pET28-IgA1-11-3, содержит уникальный сайт рестрикции эндонуклеазой AgeI;
содержит T7lac-промотор транскрипции;
генетическим маркером служит нуклеотидная последовательность (kan), определяющая устойчивость трансформированных плазмидой pET28-IgA1-11-3 клеток бактерий к канамицину;
клетки-хозяина, прежде всего штамма-продуцента Е. coli BL21(DE3)/pET28-IgA1-11-3, содержащего рекомбинантную плазмидную ДНК, продуцирующего рекомбинантный белок SEQ ID NO: 2;
а также за счет способа получения рекомбинантного белка SEQ ID NO: 2, заключающегося в том, что клетку-хозяина трансформируют рекомбинантной плазмидной ДНК рЕТ28-IgA1-11-3, содержащей полинуклеотид SEQ ID NO: 1, кодирующий рекомбинантный белок SEQ ID NO: 2, культивируют штамм-продуцент, получают тельца включения, из которых выделяют и очищают целевой продукт, используя сочетание хроматографических методов.
Поставленная задача решается также за счет:
Б) варианта рекомбинантного белка SEQ ID NO: 4 с молекулярной массой 34 690 Да, рассчитанной изоэлектрической точкой 8.7, с аминокислотной последовательностью из 308 аминокислотных остатков SEQ ID NO: 4, полученного из двух соединенных в единую полипептидную цепь участков фрагмента Ala28-Pro1004 первичной структуры IgA протеазы N. meningitidis серогруппы В штамм Н44/76: Trp140-Gln299 и Tyr866-Pro1004, кодируемого нуклеотидной последовательностью SEQ ID NO: 3, обладающего высоким уровнем протективного действия в отношении менингококков различных серогрупп, не изменяющего иммунорегуляторный индекс, CD4+/CD8+, иммунизированных животных, предназначенного для получения монокомпонентной вакцины для профилактики менингококковых инфекций, вызываемых возбудителями различных серогрупп, в том числе бактериями N. meningitidis серогруппы В, и другими патогенами, вирулентность которых обусловлена IgA1 протеазой;
полинуклеотида SEQ ID NO: 3, кодирующего рекомбинантный белок SEQ ID NO: 4, рекомбинантной плазмидной ДНК рЕТ28-IgA1-13-1, включающей нуклеотидную последовательность SEQ ID NO: 3 и обеспечивающей экспрессию рекомбинантного белка SEQ ID NO: 4 в клетке-хозяине, характеризующейся следующими признаками:
длина цепи составляет 6133 п.о.;
кодирует рекомбинантный белок SEQ ID NO: 4 с гексагистидиновой меткой на С-конце белка;
нуклеотидную последовательность SEQ ID NO: 3, кодирующую рекомбинантный белок SEQ ID NO: 4 в плазмиде pET28-IgA1-13-1, на 3'-конце фланкирует уникальный сайт рестрикции эндонуклеазой XhoI;
нуклеотидная последовательность SEQ ID NO: 3, кодирующая SEQ ID NO: 4 в плазмиде pET28-IgA1-13-1, содержит уникальный сайт рестрикции эндонуклеазой AgeI;
содержит T7lac-промотор транскрипции;
генетическим маркером служит нуклеотидная последовательность (kan), определяющая устойчивость трансформированных плазмидой pET28-IgA1-13-1 клеток бактерий к канамицину;
клетки-хозяина, прежде всего штамма-продуцента Е. coli BL21(DE3)/pET28-IgA1-13-1, содержащего рекомбинантную плазмидную ДНК, который продуцирует рекомбинантный белок SEQ ID NO: 4;
а также за счет способа получения рекомбинантного белка SEQ ID NO: 4, заключающегося в том, что клетку-хозяина трансформируют рекомбинантной плазмидной ДНК рЕТ28-IgA1-13-1, содержащей полинуклеотид SEQ ID NO: 3, кодирующий рекомбинантный белок SEQ ID NO: 4, культивируют штамм-продуцент, получают тельца включения, из которых выделяют и очищают целевой продукт, используя сочетание хроматографических методов.
В качестве белка сравнения используют рекомбинантную IgA1 протеазу SEQ ID NO: 11, содержащую аминокислотную последовательность фрагмента Ala28-Pro1004 первичной структуры полноразмерной IgA протеазы N. meningitidis серогруппы В штамм Н44/76. Один объект настоящего изобретения включает рекомбинантный белок SEQ ID NO: 2 с молекулярной массой 59 407 Да, рассчитанной изоэлектрической точкой 8,75, с аминокислотной последовательностью из 530 аминокислотных остатков, состоящий из трех соединенных в единую полипептидную цепь участков фрагмента Ala28-Pro1004 первичной структуры IgA протеазы N. meningitidis серогруппы В штамм Н44/76: Trp140-His328, Trp412-Asp604 и Tyr866-Pro1004, кодируемый полинуклеотидом SEQ ID NO: 1, получаемый указанным выше способом и предназначенный для использования в качестве основного компонента моновакцины для профилактики менингококковых инфекций различных серогрупп (А, В, С и др.), а также любых других инфекций, патогенность которых обусловлена секретируемой ими IgA1 протеазой, таких как: Neisseria meningitidis, Neisseria gonorrhoeae, Haemophilus influenzae, Haemophilus aegyptius, а также Streptococcus pneumonia, Streptococcus sanguis, Streptococcus oralis, Streptococcus mitis, Streptococcus viridans, Streptococcus canis, Streptococcus suis, Staphylococcus aureus, Staphylococcus epidermidis, Clostridium ramosum, Bacteroides melaninogenicus, Capnocytophaga ochracea, Moraxella catarrhalis, Helicobacter pylori, Campylobacter jejuni.
Еще один объект настоящего изобретения включает полинуклеотид SEQ ID NO: 1, кодирующий аминокислотную последовательность рекомбинантного белка SEQ ID NO: 2. Для получения нуклеотидной последовательности SEQ ID NO: 1, кодирующей рекомбинантный белок SEQ ID NO: 2, был использован метод мегапраймеров. Для этого были сконструированы специфические праймеры f1 (SEQ ID NO: 5), f2 (SEQ ID NO: 6), f3 (SEQ ID NO: 7) и f4 (SEQ ID NO: 8), кодирующие фрагменты нуклеотидной последовательности (https://www.ncbi.nlm.nih.gov/nuccore/GU190729.1) IgA протеазы N. meningitidis H44/76 с делецией нуклеотидов, кодирующих аминокислотную последовательность Trp329-Val411 (SEQ ID NO: 6), и нуклеотидов, кодирующих аминокислотную последовательность остатков Trp605-Gln865 (SEQ ID NO: 7). В праймер (SEQ ID NO: 8) для последующего лигирования с вектором рЕТ-28(а+) была введена последовательность сайта узнавания рестриктазы XhoI, имеющейся в полилинкере вектора. Строение праймера SEQ ID NO: 8 позволяет получать рекомбинантный белок, модифицированный в С-концевой области гексагистидиновой меткой.
Амплификацию фрагмента гена рекомбинантного белка проводили в три этапа методом ПЦР, используя в качестве матрицы плазмидную ДНК рЕТ31-IgA1-1004 и описанную в дополнительном примере 1 SEQ ID NO: 10, в результате был получен целевой фрагмент ДНК около 1570 п.о.
Еще один объект настоящего изобретения включает рекомбинантную плазмидную ДНК, содержащую нуклеотидную последовательность SEQ ID NO: 1 и обеспечивающую экспрессию белка SEQ ID NO: 2 в клетке-хозяине. Фрагмент ДНК длиной около 1570 п.о. был клонирован в вектор рЕТ-28а(+) (Novagen, кат. №69864-3) с использованием уникальных сайтов рестрикции NcoI (затупленного) и XhoI таким образом, чтобы продуцируемый белок содержал гексагистидиновую метку в С-концевой области для последующей очистки белка с помощью металл-хелатной хроматографии.
Секвенирование полученной ДНК подтвердило соответствие целевой структуре. Полученная рекомбинантная плазмидная ДНК была названа pET28-IgA1-11-3. Еще один объект настоящего изобретения включает клетку-хозяина, прежде всего штамм Е. coli, продуцирующий рекомбинантный белок SEQ ID NO: 2. В качестве клетки-хозяина использован штамм Е. coli BL21(DE3), на основе которого был получен штамм-продуцент BL21(DE3)/pET28-IgA1-11-3, описанный ниже.
Еще один объект настоящего изобретения включает способ получения рекомбинантного белка SEQ ID NO: 2, заключающийся в том, что клетку-хозяина Е. coli BL21(DE3) трансформируют описанной выше рекомбинантной плазмидной ДНК pET28-IgA1-11-3 с полинуклеотидом SEQ ID NO: 1, кодирующей рекомбинантный белок SEQ ID NO: 2, культивируют штамм-продуцент, как описано ниже, а затем выделяют и очищают целевой продукт.
Другой объект настоящего изобретения включает вариант рекомбинантного белка SEQ ID NO: 4 с молекулярной массой 34 690 Да, рассчитанной изоэлектрической точкой 8,7, с аминокислотной последовательностью из 308 аминокислотных остатков, состоящий из двух соединенных в единую полипептидную цепь участков фрагмента Ala28-Pro1004 первичной структуры IgA протеазы N. meningitidis Н44/76: Trp140-Gln299 и Tyr866-Pro1004, кодируемый полинуклеотидом SEQ ID NO: 3, получаемый указанным выше способом и предназначенный для использования в качестве основного компонента моновакцины для профилактики менингококковых инфекций различных серогрупп (А, В, С и др.), а также любых других инфекций, патогенность которых обусловлена секретируемой ими IgA1 протеазой, таких как: Neisseria meningitidis, Neisseria gonorrhoeae, Haemophilus influenzae, Haemophilus aegyptius, а также Streptococcus pneumonia, Streptococcus sanguis, Streptococcus oralis, Streptococcus mitis, Streptococcus viridans, Streptococcus canis, Streptococcus suis, Staphylococcus aureus, Staphylococcus epidermidis, Clostridium ramosum, Bacteroides melaninogenicus, Capnocytophaga ochracea, Moraxella catarrhalis, Helicobacter pylori, Campylobacter jejuni.
Еще один объект настоящего изобретения включает полинуклеотид SEQ ID NO: 3, кодирующий аминокислотную последовательность рекомбинантного белка SEQ ID NO: 4.
Для получения нуклеотидной последовательности SEQ ID NO: 3, кодирующей рекомбинантный белок SEQ ID NO: 4, был использован метод мегапраймеров. Для этого были сконструированы специфические праймеры f1 SEQ ID NO: 5, f4 SEQ ID NO: 8 и f5 SEQ ID NO: 9, кодирующие фрагменты нуклеотидной последовательности (https://www.ncbi.nlm.nih.gov/nuccore/GU190729.1) IgA протеазы N. meningitidis Н44/76 с делецией нуклеотидов, кодирующих аминокислотную последовательность Glu300-Gln865 SEQ ID NO: 9. В праймер SEQ ID NO: 8 для последующего лигирования с вектором рЕТ-28(а+) была введена последовательность сайта узнавания рестриктазы XhoI, имеющаяся в полилинкере вектора. Строение праймера SEQ ID NO: 8 позволяет получать рекомбинантный белок, модифицированный в С-концевой области гексагистидиновой меткой.
Амплификацию фрагмента гена рекомбинантного белка проводили в два этапа методом ПЦР, используя в качестве матрицы плазмидную ДНК рЕТ31-IgA1-1004 и описанную в дополнительном примере 1 SEQ ID NO: 10, в результате был получен целевой фрагмент ДНК около 900 п.о.
Еще один объект настоящего изобретения включает рекомбинантную плазмидную ДНК, содержащую нуклеотидную последовательность SEQ ID NO: 3 и обеспечивающую экспрессию белка SEQ ID NO: 4 в клетке-хозяине. Фрагмент ДНК длиной около 900 п.о. был клонирован в вектор рЕТ-28(а+) (Novagen, кат. №69864-3) с использованием уникальных сайтов рестрикции NcoI (затупленного) и XhoI таким образом, чтобы продуцируемый белок содержал гексагистидиновую метку в С-концевой области для последующей очистки белка с помощью металл-хелатной хроматографии. Секвенирование полученной ДНК подтвердило соответствие целевой структуре. Полученная рекомбинантная плазмидная ДНК была названа pET28-IgA1-13-1. Еще один объект настоящего изобретения включает клетку-хозяина, прежде всего штамм Е. coli, продуцирующий рекомбинантный белок SEQ ID NO: 4. В качестве клетки-хозяина использовали штамм Е. coli BL21(DE3), на основе которого был получен штамм BL21(DE3)/pET28-IgA1-13-1, описанный ниже.
Еще один объект настоящего изобретения включает способ получения рекомбинантного белка SEQ ID NO: 4, заключающийся в том, что клетку-хозяина Е. coli BL21(DE3) трансформируют описанной выше рекомбинантной плазмидной ДНК pET28-IgA1-13-1 с полинуклеотидом SEQ ID NO: 3, кодирующей рекомбинантный белок SEQ ID NO: 4, культивируют штамм-продуцент, как описано ниже, а затем выделяют и очищают целевой продукт.
Для получения штамма-продуцента рекомбинантного белка SEQ ID NO: 2 или варианта рекомбинантного белка SEQ ID NO: 4 компетентные клетки Escherichia coli BL21(DE3) (Е. coli В F- dcm ompT hsdS(rB- mB-) gal λ(DE3)) (Stratagene Cat. No 200131) трансформируют соответствующей плазмидной ДНК pET28-IgA1-11-3 или pET28-IgA1-13-1.
Полученный штамм, названный Е. coli BL21(DE3)/pET28-IgA1-11-3 или вариант штамма Е. coli BL21(DE3)/pET28-IgA1-13-1, характеризуются следующими свойствами.
Культурально-морфологические признаки.
Клетки мелкие, палочковидной формы, грамотрицательные, 1×3,5 мкм, подвижные. Штамм хорошо растет на обычных питательных средах (LB-бульон, LB-агар). При росте на агаризованной среде LB колонии округлые, гладкие, полупрозрачные, блестящие, желтоватого цвета. Край ровный, диаметр колоний 2-3 мм, консистенция пастообразная. Рост в жидкой среде LB характеризуется ровным помутнением, осадок легко седиментирует.
Физиолого-биохимические признаки.
Клетки растут при 4-42°С, оптимум рН 6,8-7,6. В качестве источника азота используют минеральные соли аммония и органические соединения: аминокислоты, пептон, триптон, дрожжевой экстракт.
Генетические признаки.
Клетки проявляют устойчивость к канамицину (до 100 мкг/мл), обусловленную наличием гена устойчивости к антибиотику в рекомбинантной плазмидной ДНК рЕТ28-IgA1-11-3 и варианте рЕТ28-IgA1-13-1.
Условия хранения.
Штамм бактерий E. coli BL21(DE3)/pET28-IgA1-11-3 или вариант E. coli BL21(DE3)/pET28-IgA1-13-1 хранят на чашках и косяках при 4°С. Пересевы на свежие среды проводят один раз в месяц. Может храниться не менее одного года в среде LB, содержащей 15% глицерина, при -70°С.
Устойчивость к антибиотикам.
Клетки штаммов-продуцентов проявляют устойчивость к канамицину (до 100 мкг/мл), обусловленную наличием гена устойчивости в рекомбинантной плазмидной ДНК рЕТ28-IgA1-11-3 или рЕТ28-IgA1-13-1.
В качестве клетки-хозяина для получения рекомбинантного белка SEQ ID NO: 2 или варианта рекомбинантного белка SEQ ID NO: 4 можно использовать клетки эукариот (например, дрожжевые клетки, растительные клетки, животные клетки и клетки человека), или клетки прокариот (например, бактериальные клетки и т.п.), или клетки, которые индуцируют иммунный ответ. Специалистам в данной области известно множество указанных клеток и клеточных линий (высших) эукариот, например, 293Т (линия эмбриональных клеток почек), HeLa (клетки карциномы шейки матки человека), СНО (клетки яичника китайского хомячка) и другие клеточные линии, включая указанные клетки и клеточные линии, разработанные для лабораторных исследований, такие как, например, клетки hTERT-MSC, HEK293, Sf9 или COS. Пригодные клетки можно получить аналогичным образом из эукариотических микроорганизмов, таких как дрожжи, например, Saccharomyces cerevisiae (Stinchcomb D.T. et al. Nature, 282(5734):39-43,1979), Schizosaccharomyces pombe, Candida, Pichia и гифомицеты родов Aspergillus, Penicillium и т.п. Пригодные клетки аналогичным образом включают клетки прокариот, таких как, например, клетки бактерий, например Escherichia coli, или бактерий рода Bacillus, Lactococcus, Lactobacillus, Pseudomonas, Streptomyces, Streptococcus, Staphylococcus, предпочтительно E. coli, и т.п.
Техническим результатом изобретения является получение высокоочищенного рекомбинантного белка SEQ ID NO: 2 с молекулярной массой 59 407 Да и чистотой не менее 93% по данным ДДС-электрофореза в ПААГ и варианта высокоочищенного рекомбинантного белка SEQ ID NO: 4 с молекулярной массой 34 690 Да и чистотой не менее 95%. Рекомбинантный белок SEQ ID NO: 2 и его вариант SEQ ID NO: 4 являются иммуногенными и характеризуются высокой протективной активностью в отношении менингококков различных серогрупп, сравнимой с активностью рекомбинантной IgA1 протеазы SEQ ID NO: 11. Полученные белки обладают противомикробным действием, защищая животных от менингококковой инфекции различных серогрупп А, В и С.
Значительное уменьшение молекулярной массы полученных рекомбинантных белков (59 407 Да и 34 690 Да в сравнении с 109 019 Да для рекомбинантной IgA1 протеазы SEQ ID NO: 11) и, как следствие, уменьшение числа В- и Т-клеточных эпитопов при сохранении иммуногенных свойств и протективного действия в отношении менингококков различных эпидемических серогрупп позволит использовать каждый из этих белков в качестве основного компонента моновакцины и понизить иммунную нагрузку на организм человека в процессе иммунизации. Кроме того, белки SEQ ID NO: 2 и SEQ ID NO: 4 не изменяют иммунорегуляторный индекс (CD4+/CD8+) в крови иммунизированных животных (1,00±0,08) и (1,02±0,05), соответственно, что является важным показателем для кандидатной вакцины.
Изобретение иллюстрируют графические материалы.
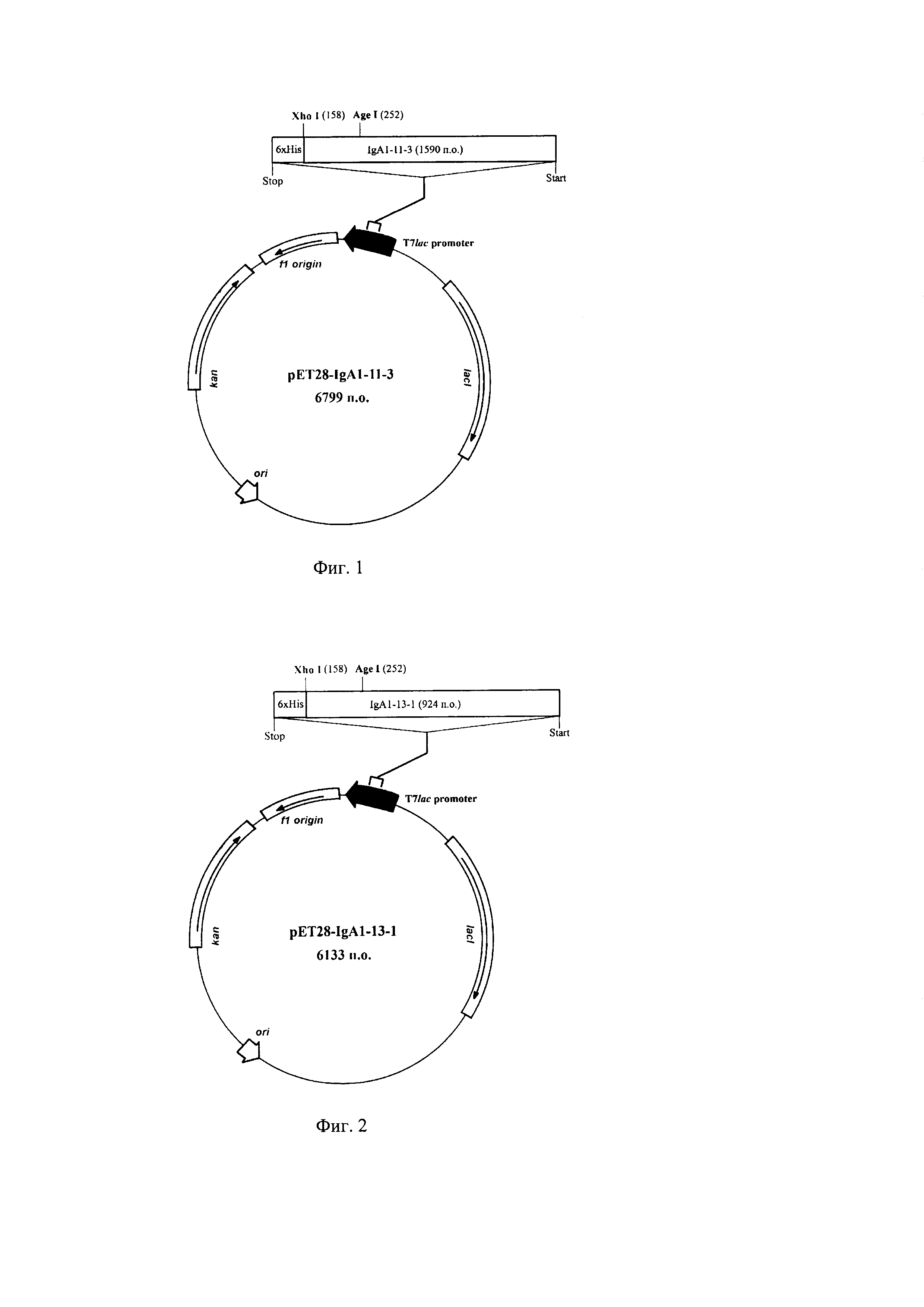
Фиг. 1. Физическая карта рекомбинантной плазмидной ДНК pET28-IgA1-11-3.
Рекомбинантная плазмидная ДНК pET28-IgA1-11-3, содержащая 6799 п.о., кодирующая рекомбинантный белок SEQ ID NO: 2, состоящая из:IgA1-11-3 - область, кодирующая рекомбинантный белок SEQ ID NO: 2 и гексагистидиновую метку, фланкируемая уникальным сайтом рестрикции эндонуклеазы XhoI(158) (нумерация приведена в соответствии с нумерацией в векторе рЕТ-28а), IgA1-11-3 содержит также уникальный сайт рестрикции эндонуклеазой AgeI (252), ori - участок инициации репликации рекомбинантной плазмидной ДНК, T7lac promoter - гибридный промотор транскрипции, Stop - терминатор транскрипции рибосомного оперона Е. coli, kan - ген, определяющий устойчивость микроорганизма к канамицину, ƒ1 origin - участок, позволяющий получать одноцепочечную ДНК, lacI - область, кодирующая lac репрессор.
Фиг. 2. Физическая карта рекомбинантной плазмидной ДНК pET28-IgA1-13-1.
Рекомбинантная плазмидная ДНК pET28-IgA1-13-1, содержащая 6133 п.о., кодирующая рекомбинантный белок SEQ ID NO: 4, состоящая из:
IgA1-13-1 - область, кодирующая рекомбинантный белок SEQ ID NO: 4 и гистидиновую метку, фланкируемая уникальным сайтом рестрикции эндонуклеазы XhoI (158) (нумерация приведена в соответствии с нумерацией в векторе рЕТ-28а), IgA1-13-1 содержит также уникальный сайт рестрикции эндонуклеазой AgeI (252), ori - участок инициации репликации рекомбинантной плазмидной ДНК, T7lac promoter - гибридный промотор транскрипции, Stop - терминатор транскрипции рибосомного оперона Е. coli, kan - ген, определяющий устойчивость микроорганизма к канамицину, ƒ1 origin - участок, позволяющий получать одноцепочечную ДНК, lacI - область, кодирующая lac репрессор.
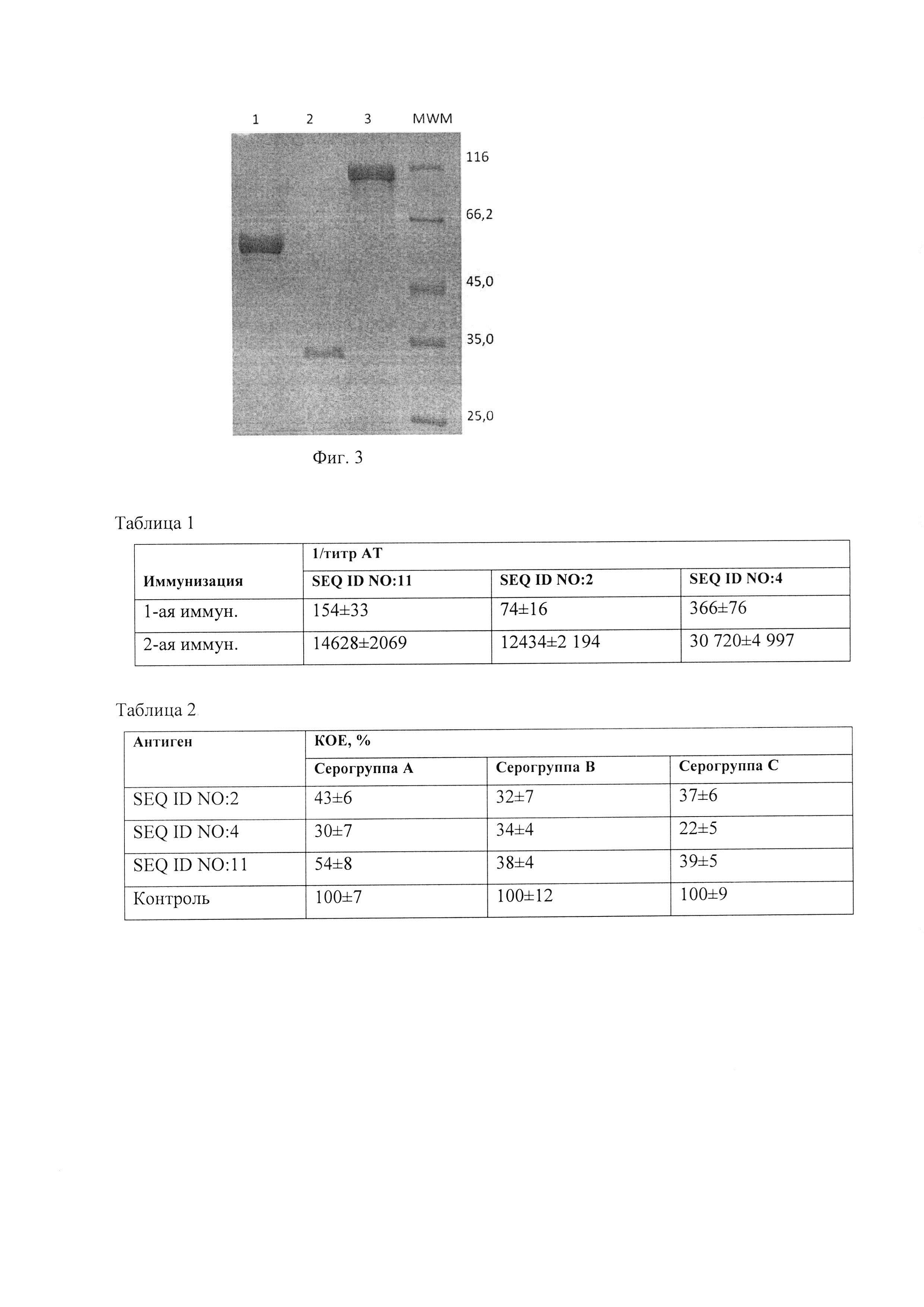
Фиг. 3. Электрофоретический анализ чистоты полученных рекомбинантных белков методом ДДС-ПААГ (10% полиакриламидный гель, не восстанавливающие условия). 1 - SEQ ID NO: 2 (93%), 2 - SEQ ID NO: 4 (95%), 3 - SEQ ID NO: 11 (90%), 4 - MWM - белки-маркеры молекулярных масс (Thermo Scientific), кДа.
Таблица 1. Уровень антител (AT) к рекомбинантной IgA1 протеазе SEQ ID NO: 11 в сыворотке мышей, иммунизированных рекомбинантными белками SEQ ID NO: 2, SEQ ID NO: 4 или рекомбинантной IgA1 протеазой SEQ ID NO: 11.
Таблица 2. Число КОЕ (%) в крови мышей, иммунизированных рекомбинантными белками SEQ ID NO: 2, SEQ ID NO: 4 или рекомбинантной IgA1 протеазой SEQ ID NO: 11, при заражении менингококком серогрупп А, В и С.
Осуществление изобретения
Изобретение иллюстрируют следующие примеры:
Пример 1
Получение полинуклеотида SEQ ID NO: 1, кодирующего аминокислотную последовательность рекомбинантного белка SEQ ID NO: 2
На основании известной последовательности гена iga штамма Н44/76, кодирующего полноразмерную IgA протеазу (https://www.ncbi.nlm.nih.gov/nuccore/GU190729.1), конструируют праймеры для получения нуклеотидной последовательности SEQ ID NO: 1, кодирующей аминокислотную последовательность рекомбинантного белка SEQ ID NO: 2, и последующего лигирования ее с вектором. Выбранная структура праймеров позволяет амплифицировать продукт полимеразной цепной реакции (ПЦР), пригодный для последующего встраивания в экспрессионные векторы семейства рЕТ (Novagen), используемые для получения рекомбинантных белков в штаммах Е. coli, лизогенных по бактериофагу Т7.
Для получения нуклеотидной последовательности SEQ ID NO: 1, используют метод мегапраймеров. Для этого конструируют специфические праймеры f1, f2, f3, f4 (f1 - прямой - 5'-TGGCATCACGGAAATCAAGGTC-3' SEQ ID NO: 5, f2 - обратный - 5'-CCATTCGGATTTTTGACTTGCCAATGATGTTCTCCATTACCTTTGAT-3' SEQ ID NO: 6, f3 - обратный - 5'-TGATTGATTTTGAGCGTGTGGTAGTCGTTATTTTCTGTTACACCGT-3' SEQ ID NO: 7, f4 - обратный - 5'-GCGCTCGAGAGGCGGTGCGACGACGATAT-3' SEQ ID NO: 8. Праймер f2 кодирует фрагмент нуклеотидной последовательности (https://www.ncbi.nlm.nih.gov/nuccore/GU190729.1) полноразмерной IgA протеазы N. meningitidis серогруппы В Н44/76 с делецией нуклеотидов, кодирующих аминокислотную последовательность Trp329-Val411, праймер f3 кодирует фрагмент нуклеотидной последовательности IgA протеазы с делецией остатков Trp605-Gln865. В праймер f4 для последующего лигирования с вектором рЕТ-28(а+) вводят последовательность сайта узнавания рестриктазы XhoI, имеющейся в полилинкере вектора. Строение праймера f4, не содержащего терминирующих кодонов, позволяет получать рекомбинантный белок, модифицированный в С-концевой области гексагистидиновой меткой.
Амплификацию фрагмента гена рекомбинантного белка проводят в три этапа методом ПЦР, используя в качестве матрицы плазмидную ДНК рЕТ31-IgA1-1004, описанную в дополнительном примере 1 (SEQ ID NO: 10). На первом этапе проводят амплификацию фрагмента этого гена, используя праймеры f1 и f2, в результате получают фрагмент ДНК длиной около 590 п.о. Полученный фрагмент ДНК выделяют из агарозного геля и используют в качестве первого праймера на втором этапе ПЦР, в качестве второго праймера второго этапа ПЦР используют праймер f3. При этом получают фрагмент ДНК около 1170 п.о. На третьем этапе ПЦР используют в качестве праймеров фрагмент ПЦР, полученный на втором этапе, и праймер f4. В результате получают целевой фрагмент ДНК около 1570 п.о.
Целевой фрагмент ДНК обрабатывают рестриктазой XhoI и клонируют в вектор рЕТ28(а+) (Novagen, кат. №69864-3), при использовании сайта рестрикции NcoI (затупленного) и XhoI таким образом, чтобы продуцируемый белок содержал гексагистидиновую метку в С-концевой области. Амплификацию фрагментов нуклеиновой кислоты проводят по стандартному протоколу за 25 циклов ПЦР. Температуру отжига праймеров подбирают экспериментально. Обработку ПЦР-фрагмента и вектора рестриктазами, лигирование и трансформацию компетентных клеток ТОР10 проводят по стандартным процедурам. Секвенированием полученной ДНК подтверждено соответствие целевой структуре SEQ ID NO: 2. Полученная плазмидная ДНК названа pET28-IgA1-11-3.
Пример 2
Получение рекомбинантной плазмидной ДНК pET28-IgA1-11-3 и штамма-продуцента Е. coli BL21(DE3)/pET28-IgA1-11-3
Рекомбинантную плазмидную ДНК получают из ночной культуры клеток Е. coli ТОР10 стандартным щелочным методом (Maniatis, Т., Fritsch, E.F. and Sambrook, J. 1982. Molecular Cloning: a Laboratory Manual, Cold Sping Harbor Laboratory Press). Физическая карта рекомбинантной плазмидной ДНК pET28-IgA1-11-3 приведена на фиг. 1. Штамм Е. coli BL21(DE3)/pET28-IgA1-11-3 получают путем введения плазмидной ДНК рЕТ28-IgA1-11-3 в компетентные клетки Е. coli BL21(DE3) с помощью метода теплового шока. Для получения компетентных клеток, бактериальные клетки исходного штамма Escherichia coli BL21(DE3) (Е. coli В F- dcm ompT hsdS (rB- mB-) gal λ(DE3) выращивают в жидкой среде LB в течение ночи при 37°С и используют для засева 100 мл той же среды в соотношении 1:100. Культуру выращивают до ранней логарифмической фазы на качалке при интенсивной аэрации (до оптической плотности при 600 нм, равной 0.4÷0.5 ОЕ), быстро охлаждают во льду, клетки осаждают центрифугированием в течение 10 мин при 5000 об/мин при +4°С. Осадок дважды промывают в 50 мл 100 мМ CaCl2. Осажденные клетки ресуспендируют в 2 мл 100 мМ CaCl2, с добавлением глицерина до 10%. Разделяют на аликвоты по 50 мкл, быстро замораживают и хранят при -70°С.
Для введения плазмидной ДНК pET28-IgA1-11-3 в компетентные клетки к 50 мкл суспензии компетентных клеток добавляют 100 нг - 1 мкг плазмидной ДНК и инкубируют в течение 40 мин на льду. Полученную смесь инкубируют при 42°С в течение 2 мин, затем во льду в течение 2 мин, добавляют 1 мл среды LB и инкубируют в течение 1 ч при 37°С. Дискриминацию клеток (штамм), содержащих рекомбинантную плазмидную ДНК рЕТ28-IgA1-11-3, проводят на агаризованной среде LB с канамицином. Для этого 100 мкл суспензии бактериальных клеток высевают на чашки Петри с агаром в среде LB, содержащим 50 мкг/мл канамицина. Чашки инкубируют в течение ночи при 37°С, бактериальные клетки нескольких выросших колоний используют для независимого засева микробиологических пробирок с 5 мл жидкой среды LB, содержащей 50 мкг/мл канамицина, с последующим выращиванием бактериальных клеток на качалке при 37°С в течение ночи (ночная культура). После этого в пробирки добавляют глицерин до конечной концентрации 15%, суспензию клеток разливают в пластиковые пробирки и хранят при -70°С.
Пример 3
Определение продуктивности штамма-продуцента рекомбинантного белка SEQ ID NO: 2 Е. coli BL21(DE3)/pET28-IgA1-11-3
В 15 мл жидкой среды LB, содержащей 50 мкг/мл канамицина, вносят 1% инокулята ночной культуры клеток и выращивают при 37°С на качалке при 180 об/мин в течение 2 ч до оптического поглощения (ОП) 0,8. Затем добавляют индуктор изопропилтиогалактопиранозид (ИПТГ) до конечной концентрации 0,5 мМ и продолжают инкубацию в тех же условиях в течение 2,0 ч. Отбирают пробу 1 мл и центрифугируют в течение 6 мин при 12000 об/мин, после чего клетки суспендируют в 100 мкл деионизированной воды, добавляют 33 мкл буферного раствора, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия (SDS), 3% меркаптоэтанол и 0,01% бромфеноловый синий, нагревают в течение 10 мин до 95°С. Отбирают аликвоту и анализируют электрофорезом в 10% полиакриламидном геле, содержащем 0,1% SDS. Гель окрашивают Кумасси R250 и сканируют на лазерном сканере. Продуктивность штамма Е. coli BL21(DE3)/pET28-IgA1-11-3 составляет 40% рекомбинантного белка SEQ ID NO: 2 от суммарного клеточного белка.
Пример 4
Получение, выделение и очистка рекомбинантного белка SEQ ID NO: 2
A) Культивирование штамма Е. coli BL21(DE3)/ pET28-IgA1-11-3
По 10 мл соответствующего инокулята ночной культуры клеток вносят в 1 л жидкой среды LB, содержащей 50 мкг/мл канамицина, и выращивают клетки при +37°С на качалке при 200 об/мин до оптической плотности равной 0,8 при 600 нм. Затем добавляют индуктор изопропилтиогалактопианозид (ИПТГ) до конечной концентрации 0,5 мМ и продолжают инкубацию клеток при +37°С на качалке в течение в двух часов.
Б) Разрушение клеток и фракционирование лизата
Для сбора клеток центрифугируют 1 л культуры штамма-продуцента Е. coli BL21(DE3)/ pET28-IgA1-113 (10 мин, 3.5 тыс. об./мин) и осажденные клетки суспендируют в семикратном объеме буферного раствора 20 мМ Трис-HCl, 0,15 М NaCl, рН 8.5, содержащего лизоцим (0.002%), а затем выдерживают 30 мин при комнатной температуре. Суспензию клеток (2 г клеток с 1 л культуры) пятикратно обрабатывают ультразвуком, подвергают центрифугированию (1 час, 20000 g) и получают фракции растворимых белков (бесклеточный экстракт) и нерастворимую часть клеточного лизата (дебрис и нерастворимые белки). Согласно результатам электрофоретического анализа целевой белок формирует нерастворимые тельца включения (ТВ) независимо от температурных условий индукции культуры и типа буфера, использованного при разрушении клеток. Осадок, содержащий ТВ после центрифугирования, промывают буферным раствором (60 мл 20 мМ Трис-HCl, рН 8.5, 1% Triton Х-100, 0.1% SDS) и центрифугируют 40 мин 10000 g. Вновь полученный осадок промывают буфером (60 мл 20 мМ Трис-HCl, 1 М NaCl) и центрифугируют 40 мин, 10000 g. Выход отмытых ТВ рекомбинантного белка SEQ ID NO: 2 - 0,96 г. Отмытые осадки ТВ рекомбинантного белка SEQ ID NO: 2 используют для проведения хроматографии на Ni-агарозе в денатурирующих условиях.
B) Очистка растворенных тел включения рекомбинантного белка SEQ ID NO: 2 с помощью металл-хелатной хроматографии на Ni-агарозном сорбенте ТВ, выделенные из 2 г клеток Е. coli BL21(DE3)/ pET28-IgA1-11-3, растворяют в 100 мл 50 мМ Трис-HCl буферного раствора, содержащего 8 М мочевину, 0,15 М хлористый натрий и 0,02 М имидазол, рН 7,0. После центрифугирования и фильтрования полученный раствор наносят на предупакованную колонку с Ni-агарозой (HiTrap Chelating HP, GE Healthcare, 2×5 мл), уравновешенную исходным буферным раствором, и сорбент промывают 50 мл исходного буферного раствора. Связавшиеся белки элюируют имидазолом в градиенте концентрации от 20 до 400 мМ в исходном буферном растворе. Фракции, содержащие очищенный белок SEQ ID NO: 2, объединяют и используют на стадии ренатурации и очистки на Q-сефарозе.
Г) Ренатурация и очистка рекомбинантного белка SEQ ID NO: 2 на Q-сефарозе
Объединенный элюат рекомбинантного белка SEQ ID NO: 2, полученный после хроматографии на Ni-агарозе (концентрация белка 0,35 мг/мл), подвергают ступенчатому диализу, постепенно снижая концентрацию мочевины до значения 1,5 М в 20 мМ Трис-HCl буферном растворе, содержащем 0,15 М хлористый натрий, рН 7,0. Полученный раствор центрифугируют (30 мин, 5000 g), фильтруют через мембрану с размером пор 0.2 мкм и наносят на предупакованную колонку с Q-сефарозой (GE 5 млХ2), уравновешенную в 20 мМ Трис-HCl буферном растворе, содержащем 0,15 М хлористый натрий и 1,5 М мочевину, рН 7,0. Целевой белок, не связавшийся с сорбентом, собирают единой фракцией, добавляют сорбит (5% масс.), фильтруют через стерильную мембрану с размером пор 0,2 мкм и фасуют в стерильные емкости по 2 мг. Чистота целевого белка составляет около 93% по данным электрофоретического анализа (фиг. 3), концентрация белка - 0,2 мг/мл, выход - 67 мг из 2 г биомассы клеток.
Пример 5
Получение полинуклеотида SEQ ID NO: 3, кодирующего аминокислотную последовательность рекомбинантного белка SEQ ID NO: 4
На основании известной последовательности гена iga штамма Н44/76, кодирующего полноразмерную IgA протеазу (https://www.ncbi.nlm.nih.gov/nuccore/GU190729.1) конструируют праймеры для получения нуклеотидной последовательности SEQ ID NO: 3, кодирующей рекомбинантный белок SEQ ID NO: 4, и последующего лигирования ее с вектором. Выбранная структура праймеров позволяет амплифицировать продукт полимеразной цепной реакции (ПЦР), пригодный для последующего встраивания в экспрессионные векторы семейства рЕТ (Novagen). Далее эти векторы используют для получения рекомбинантных белков в штаммах Е. coli, лизогенных по бактериофагу Т7. Для получения нуклеотидной последовательности SEQ ID NO: 3, рекомбинантного белка SEQ ID NO: 4, используют метод мегапраймеров. Для этого конструируют специфические праймеры f1, f4, f5 (f1 - прямой - 5'-TGGCATCACGGAAATCAAGGTC-3' SEQ ID NO: 5, f4 - обратный - 5'-GCGCTCGAGAGGCGGTGCGACGACGATAT-3' SEQ ID NO: 8, f5 - обратный - 5'-ATGATTGATTTTGAGCGTGTGGTATTGCCAAGAGTTTTTTTGATAGCC-3' SEQ ID NO: 9). Праймер f5 кодирует фрагмент нуклеотидной последовательности (https://www.ncbi.nlm.nih.gov/nuccore/GU190729.1) IgA протеазы N. meningitidis Н44/76 с делецией нуклеотидов, кодирующих аминокислотную последовательность Glu300-Gln865. В праймер f4 для последующего лигирования с вектором рЕТ-28(а+) вводят последовательность сайта узнавания рестриктазы XhoI, имеющейся в полилинкере вектора. Строение праймера f4, не содержащего терминирующих кодонов, позволяет получать белок, модифицированный в С-концевой области гексагистидиновой меткой. Амплификацию фрагмента гена проводят в два этапа, используя в качестве матрицы плазмидную ДНК рЕТ31-IgA1-1004, описанную в дополнительном примере 1 (SEQ ID NO: 10). На первом этапе проводят реакцию амплификации фрагмента гена, используя праймеры f1 и f5, в результате получают фрагмент ДНК длиной около 480 п.о. Полученный фрагмент ДНК выделяют из агарозного геля и используют в качестве первого праймера на втором этапе ПЦР, в качестве второго праймера на втором этапе ПЦР используют праймер f4. Получают целевой фрагмент ДНК около 900 п.о. Целевой фрагмент обрабатывают рестриктазой XhoI и клонируют в вектор рЕТ28(а+) (Novagen, кат. №69864-3), при использовании сайта рестрикции NcoI (затупленного) и XhoI таким образом, чтобы продуцируемый белок содержал гексагистидиновую метку в С-концевой области. Амплификацию фрагментов нуклеиновой кислоты проводят по стандартному протоколу за 25 циклов ПЦР. Температуру отжига праймеров подбирают экспериментально. Обработку ПЦР-фрагмента и вектора рестриктазами, лигирование и трансформацию компетентных клеток ТОР10 проводят по стандартным процедурам. Секвенированием полученной ДНК подтверждено соответствие целевой структуре (SEQ ID NO: 4). Полученная плазмидная ДНК названа pET28-IgA1-13-1.
Пример 6
Получение рекомбинантной плазмидной ДНК pET28-IgA1-13-1 и штамма-продуцента Е. coli BL21 (DE3)/pET28-IgA1-13-1
Рекомбинантную плазмидную ДНК получают из ночной культуры клеток Е. coli ТОР10 стандартным щелочным методом (Maniatis, Т., Fritsch, E.F. and Sambrook, J. 1982. Molecular Cloning: a Laboratory Manual, Cold Sping Harbor Laboratory Press). Физическая карта рекомбинантной плазмидной ДНК pET28-IgA1-13-1 приведена на фиг. 2. Штамм Е. coli BL21(DE3)/pET28-IgA1-13-1 получают путем введения плазмидной ДНК рЕТ28-IgA1-13-1 в компетентные клетки Е. coli BL21(DE3) с помощью метода теплового шока. Для получения компетентных клеток, бактериальные клетки исходного штамма Escherichia coli BL21(DE3) (Е. coli В F- dcm ompT hsdS (rB- mB-) gal λ(DE3) выращивают в жидкой среде LB в течение ночи при 37°С и используют для засева 100 мл той же среды в соотношении 1:100. Культуру выращивают до ранней логарифмической фазы на качалке при интенсивной аэрации (до оптической плотности при 600 нм, равной 0.4÷0.5 ОЕ), быстро охлаждают во льду, клетки осаждают центрифугированием в течение 10 мин при 5000 об/мин при +4°С. Осадок дважды промывают в 50 мл 100 мМ CaCl2. Осажденные клетки ресуспендируют в 2 мл 100 мМ CaCl2 с добавлением глицерина до 10%. Разделяют на аликвоты по 50 мкл, быстро замораживают и хранят при -70°С.
Для введения плазмидной ДНК pET28-IgA1-13-1 в компетентные клетки к 50 мкл суспензии компетентных клеток добавляют 100 нг - 1 мкг плазмидной ДНК и инкубируют в течение 40 мин на льду. Полученную смесь инкубируют при 42°С в течение 2 мин, затем во льду в течение 2 мин, добавляют 1 мл среды LB и инкубируют в течение 1 ч при 37°С. Дискриминацию клеток (штамм), содержащих рекомбинантную плазмидную ДНК рЕТ28-IgA1-13-1, проводят на агаризованной среде LB с канамицином. Для этого 100 мкл суспензии бактериальных клеток высевают на чашки Петри с агаром в среде LB, содержащим 50 мкг/мл канамицина. Чашки инкубируют в течение ночи при 37°С, бактериальные клетки нескольких выросших колоний используют для независимого засева микробиологических пробирок с 5 мл жидкой среды LB, содержащей 50 мкг/мл канамицина, с последующим выращиванием бактериальных клеток на качалке при 37°С в течение ночи (ночная культура). После этого в пробирки добавляют глицерин до конечной концентрации 15%, суспензию клеток разливают в пластиковые пробирки и хранят при -70°С.
Пример 7
Определение продуктивности штамма-продуцента рекомбинантного белка SEQ ID NO: 4 Е. coli BL21 (DE3)/pET28-IgA1-13-1
В 15 мл жидкой среды LB, содержащей 50 мкг/мл канамицина, вносят 1% инокулята ночной культуры клеток и выращивают при 37°С на качалке при 180 об/мин в течение 2 ч до оптического поглощения 0,8 ОЕ. Затем добавляют индуктор изопропилтиогалактопиранозид (ИПТГ) до конечной концентрации 0,5 мМ и продолжают инкубацию в тех же условиях в течение 2,0 ч. Отбирают пробу 1 мл и центрифугируют в течение 6 мин при 12000 об/мин, после чего клетки суспендируют в 100 мкл деионизированной воды, добавляют 33 мкл буферного раствора, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия (SDS), 3% меркаптоэтанол и 0,01% бромфеноловый синий, нагревают в течение 10 мин до 95°С. Отбирают аликвоту и анализируют электрофорезом в 10% полиакриламидном геле, содержащем 0,1% SDS. Гель окрашивают Кумасси R250 и сканируют на лазерном сканере. Продуктивность штамма Е. coli BL21(DE3)/pET28-IgA1-13-1 составляет 35% рекомбинантного белка SEQ ID NO: 4 от суммарного клеточного белка.
Пример 8
Получение, выделение и очистка рекомбинантного белка SEQ ID NO: 4
А) Культивирование штамма E. coli BL21(DE3)/pET28-IgA1-13-1
По 10 мл соответствующего инокулята ночной культуры клеток вносят в 1 л жидкой среды LB, содержащей 50 мкг/мл канамицина, и выращивают клетки при +37°С на качалке при 200 об/мин до оптической плотности равной 0,8 ОЕ при 600 нм. Затем добавляют индуктор изопропилтиогалактопианозид (ИПТГ) до конечной концентрации 0,5 мМ и продолжают инкубацию клеток при +37°С на качалке в течение двух часов.
Б) Разрушение клеток и фракционирование лизата
Для сбора клеток центрифугируют 1 л культуры штамма-продуцента Е. coli BL21(DE3)/pET28-IgA1-13-1 (10 мин, 3.5 тыс. об./мин) и осажденные клетки суспендируют в семикратном объеме буферного раствора 20 мМ Трис-HCl, 0,15 М NaCl, рН 8.5, содержащем лизоцим (0.002%), выдерживают 30 мин при комнатной температуре. Суспензию клеток (2 г клеток с 1 л культуры) пятикратно обрабатывают ультразвуком, центрифугируют (1 час, 20000 g) и получают фракции растворимых белков (бесклеточный экстракт) и нерастворимую часть клеточного лизата (дебрис и нерастворимые белки). Согласно результатам электрофоретического анализа целевой белок формирует нерастворимые тельца включения (ТВ) независимо от температурных условий индукции культуры и типа буфера, использованного при разрушении клеток. Осадок, содержащий ТВ после центрифугирования, промывают буферным раствором 60 мл 20 мМ Трис-HCl, 1% Triton Х-100, 0.1% SDS, рН 8,5 и центрифугируют 40 мин 10000 g. Вновь полученный осадок промывают буферным раствором 60 мл 20 мМ Трис-HCl, 1 М NaCl и центрифугируют 40 мин, 10000 g. Выход отмытых ТВ рекомбинантного белка SEQ ID NO: 4 - 0,64 г. Отмытые осадки ТВ рекомбинантного белка SEQ ID NO: 4 используют для проведения хроматографии на Ni-агарозе в денатурирующих условиях.
В) Очистка растворенных тел включения рекомбинантного белка SEQ ID NO: 4 с помощью металл-хелатной хроматографии на Ni-агарозном сорбенте ТВ, выделенные из 2 г клеток Е. coli BL21(DE3)/pET28-IgA1-13-1, растворяют в 100 мл 50 мМ Трис-HCl буферного раствора, содержащего 8 М мочевину, 0,15 М хлористый натрий и 0,02 М имидазол, рН 9,0. После центрифугирования и фильтрования раствор наносят на предупакованную колонку с Ni-агарозой (HiTrap Chelating HP, GE Healthcare, 2×5 мл), уравновешенную исходным буферным раствором и сорбент промывают 50 мл исходного буферного раствора. Связавшиеся белки элюируют имидазолом в градиенте концентрации от 20 до 400 мМ в исходном буферном растворе, объем градиента 70 мл (35×35). Фракции, содержащие очищенный белок SEQ ID NO: 4, объединяют и используют на стадии рефолдинга и очистки на Q-сефарозе.
Г) Ренатурация и очистка рекомбинантного белка SEQ ID NO: 4 на Q-сефарозе
Объединенный элюат рекомбинантного белка SEQ ID NO: 4, полученный после хроматографии на Ni-агарозе (концентрация белка 0,4 мг/мл), подвергают ступенчатому диализу, постепенно снижая концентрацию мочевины до значения 1,5 М в 20 мМ Трис-HCl буферном растворе, содержащем 0,15 М хлористый натрий, рН 7,8. Полученный раствор центрифугируют (30 мин, 5000 g), фильтруют через мембрану с размером пор 0.2 мкм и наносят на предупакованную колонку с Q-сефарозой (GE 5 мл ×2), уравновешенную в 20 мМ Трис-HCl буферном растворе, содержащем 0,15 М хлористый натрий и 1,5 М мочевину, рН 7,8.
Целевой белок, не связавшийся с сорбентом, собирают единой фракцией, добавляют сорбит (5% масс.), фильтруют через стерильную мембрану с размером пор 0,2 мкм и фасуют в стерильные емкости по 1 мг. Чистота целевого белка составляет около 95% по данным электрофоретического анализа (фиг. 3), концентрация белка - 0,2 мг/мл, выход - 33 мг из 2 г биомассы клеток.
Пример 9
Определение иммуногенной и протективной активности рекомбинантных белков
Иммуногенную и протективную активность рекомбинантных белков SEQ ID NO: 2, SEQ ID NO: 4 и рекомбинантной IgA1 протеазы SEQ ID NO: 11 оценивают на самках мышей линии Balb/C (16-18 г) из питомника «Пущино», Московская область. Мышей содержат в соответствии с протоколом IACUC (IBCH 58а, 15.05.15). Экспериментальных животных распределяют на 4 группы по 21 мыши в каждой - три группы иммунизируют рекомбинантным белком SEQ ID NO: 2, полученным как описано в примере 4, или рекомбинантным белком SEQ ID NO: 4, полученным как описано в примере 8, или рекомбинантной IgA1 протеазой SEQ ID NO: 11, полученной как описано в дополнительном примере 1, одну группу оставляют для контроля (не иммунизированные мыши). Мышей иммунизируют внутривенно введением белков в дозе 40 мкг на мышь в ретро-орбитальный синус. Антигены вводят два раза с интервалами между инъекциями 45 суток. Показателем иммуногенности полученных рекомбинантных белков служит нарастание уровня специфических антител. Уровни специфических антител в сыворотках мышей определяют на 30-й день после первой иммунизации и 10-й день после повторной иммунизации методом твердофазного ИФА с сорбированным на микропланшеты рекомбинантной IgA1 протеазой SEQ ID NO: 11, используя конъюгат пероксидазы хрена с антителами козы против суммарных иммуноглобулинов мыши (Котельникова О.В. и др. Бюллетень экспериментальной биологии и медицины, 161(3): 369-372, 2016). Оптическую плотность определяют с помощью микропланшетного ридера для иммуноферментного анализа при длине волны 492 нм. Титры антител рассчитывают исходя из оптических плотностей, полученных для сывороток иммунизированных мышей в сравнении с соответствующими значениями, полученными при тировании сывороток не иммунизированных животных.
Значения уровней антител (1/титр антител) в сыворотке мышей, иммунизированных исследованными рекомбинантными белками, приведены в Таблице 1. Из Таблицы 1 видно, что после первой иммунизации уровень специфических антител к рекомбинантной IgA1 протеазе SEQ ID NO: 11 невысок у всех трех препаратов, однако после повторной иммунизации титры антител возрастают на два порядка, что свидетельствует о выработке у животных иммунологической памяти, причем самый высокий уровень антител - у самого короткого рекомбинантного белка SEQ ID NO: 4.
Протективную активность рекомбинантных белков оценивают на 12-й день после повторной иммунизации животных. Мышей, иммунизированных каждым из препаратов (21 животное), разделяют на подгруппы по 7 животных для интраперитонеального заражения живыми вирулентными культурами менингококка серогрупп А (штамм А208), В (штамм Н44/76) или С (штамм С0638), наиболее часто встречающимися среди циркулирующих на территории России, в дозе 0,25×106 микробных клеток. Через 4 ч после заражения менингококковой культурой проводят посев крови индивидуально для каждого животного в 12-луночные планшеты с твердой питательной средой.
Протективную активность препаратов оценивают по уровню бактериемии (числу колониеобразующих клеток - КОЕ) у иммунизированных мышей в сравнении с контрольными (не иммунизированными) животными.
Статистическую обработку результатов проводят с применением программного обеспечения MS Office Excel Software при использовании Probit Analysis и t-критерия Стьюдента. Результаты представлены как средние величины ± стандартное отклонение для p≤0,05 (%).
В Таблице 2 представлен уровень бактериемии у мышей, иммунизированных указанными выше рекомбинантными белками, после заражения менингококком серогрупп А, В и С по сравнению с контрольными, не иммунизированными животными (в % от числа КОЕ в контрольной группе мышей). Из Таблицы 2 видно, что уровень бактериемии в группе мышей, иммунизированных рекомбинантными белками SEQ ID NO: 2 и SEQ ID NO: 4, сопоставим или ниже, чем у контрольной рекомбинантной IgA1 протеазы SEQ ID NO: 11 и составляет не более 40% от контроля.
Пример 10
Определение иммунорегуляторного индекса (CD4+/CD8+) у мышей, иммунизированных рекомбинантными белками SEQ ID NO: 2 и SEQ ID NO: 4
Популяционный состав лимфоцитов (CD4+ Т-хелперов и CD8+ цитотоксических Т-лимфоцитов) и иммунорегуляторный индекс иммунитета (CD4+/CD8+) в крови мышей, иммунизированных рекомбинантными белками SEQ ID NO: 2 и SEQ ID NO: 4, оценивают методом проточной цитометрии с соответствующими моноклональными антителами (Biolegend, США) на проточном цитометре FACScan (BD Biosciences, США) через 6 месяцев после повторной иммунизации животных. Анализ полученных данных проводят с помощью программы Flowing Software 2.5.1 (Turku Centre for Biotechnology, Финляндия). Иммунорегуляторный индекс представляют в виде отклонения от контроля. Иммунорегуляторный индекс (CD4+/CD8+) в крови мышей, иммунизированных рекомбинантными белками SEQ ID NO: 2 и SEQ ID NO: 4, составляет (1,00±0,08) и (1,02±0,05), соответственно, а в крови контрольных мышей - (1,00±0,05), что свидетельствует об отсутствии нарушений общего гомеостаза в организме иммунизированных животных после иммунизации животных полученными рекомбинантными белками.
Дополнительный пример 1
А) Получение нуклеотидной последовательности SEQ ID NO: 10, кодирующей рекомбинантную IgA1 протеазу SEQ ID NO: 11
На основе известной последовательности гена iga штамма Н44/76, кодирующего полноразмерную IgA протеазу N. meningitidis серогруппы В штамм Н44/76 (https://www.ncbi.nlm.nih.gov/nuccore/GU190729.1) конструируют праймеры для получения нуклеотидной последовательности SEQ ID NO: 10, кодирующей рекомбинантную IgA1 протеазу SEQ ID NO: 11, и последующего ее лигирования с вектором. Выбранная структура праймеров позволяет амплифицировать продукт полимеразной цепной реакции (ПЦР), пригодный для последующего встраивания в экспрессионные векторы семейства рЕТ (Novagen) и используемые для получения белков в штаммах Е. coli, лизогенных по бактериофагу Т7. Для лигирования с вектором рЕТ-31 (b+) (Novagen Cat. No. 69952-3) в праймеры (f6 - прямой - 5'-CGAGACAGCCATATGGCATTGGTCAGAGACGATGTC-3', SEQ ID NO: 12, и f4 - обратный - 5'-GCGCTCGAGAGGCGGTGCGACGACGATAT-3', SEQ ID NO: 8), фланкирующие целевой участок гена iga штамма Н44/76, вводят последовательности сайтов узнавания рестриктаз NdeI и XhoI (соответственно, в f6 и f4), имеющихся в полилинкере вектора. Строение праймера f4, не содержащего терминирующих кодонов, позволяет получать рекомбинантную IgA1 протеазу, модифицированную в С-концевой области гексагистидиновой меткой. Амплификацию фрагмента нуклеиновой кислоты проводят по стандартному протоколу за 25 циклов ПЦР, используя в качестве матрицы геномную ДНК штамма Н44/76. Температуру отжига праймеров подбирают экспериментально. Обработку ПЦР-фрагмента и вектора рестриктазами, их лигирование и трансформацию компетентных клеток Е. coli ТОР10 вектором, содержащим нуклеотидную последовательность SEQ ID NO: 10, проводят по стандартным процедурам. Секвенированием полученной плазмидной ДНК подтверждено соответствие целевой структуре рекомбинантного белка SEQ ID NO: 11. Полученная плазмидная ДНК названа рЕТ31-IgA1-1004.
Б) Получение рекомбинантной плазмидной ДНК pET28-IgA1-11-3 и штамма-продуцента Е. coli BL21(DE3)/pET31-IgA1-1004
Рекомбинантную плазмидную ДНК получают из ночной культуры клеток E. coli ТОР10 стандартным щелочным методом (Maniatis, Т., Fritsch, E.F. and Sambrook, J. (1982) Molecular Cloning: a Laboratory Manual, Cold Sping Harbor Laboratory Press) и используют для введения в компетентные клетки BL21 (DE3) с помощью теплового шока.
Для получения компетентных клеток, бактериальные клетки исходного штамма Е. coli BL21(DE3) (Е. coli В F- dcm ompT hsdS(rB- mB-) gal λ(DE3)) выращивают в жидкой среде LB в течение ночи при 37°С и используют для засева 100 мл той же среды в соотношении 1:100. Культуру выращивают до ранней логарифмической фазы на качалке при интенсивной аэрации (до оптической плотности при 600 нм, равной 0,4-0,5 ОЕ), быстро охлаждают во льду, клетки осаждают центрифугированием в течение 10 мин при 5000 об/мин при +4°С. Осадок дважды промывают в 50 мл 100 мМ CaCl2. Осажденные клетки ресуспендируют в 2 мл 100 мМ CaCl2 с добавлением глицерина до 10%, разделяют на аликвоты по 50 мкл, быстро замораживают и хранят при -70°С.
Штамм Е. coli BL21(DE3)/pET31-IgA1-1004 получают путем введения плазмидной ДНК рЕТ31-IgA1-1004 в компетентные клетки Е. coli BL21(DE3) с помощью метода теплового шока. Для этого к 50 мкл суспензии компетентных клеток добавляют 100 нг - 1 мкг плазмидной ДНК и инкубируют в течение 40 мин на льду. Полученную смесь инкубируют при 42°С в течение 2 мин, затем - во льду в течение 2 мин, добавляют 1 мл среды LB и инкубируют в течение 1 ч при 37°С. Генетическим маркером в векторе рЕТ31 служит нуклеотидная последовательность (amp), определяющая устойчивость трансформированных плазмидой рЕТ31-IgA1-1004 клеток бактерий к ампициллину. После этого 100 мкл суспензии бактериальных клеток высевают на чашки Петри с агаром в LB среде, содержащим 100 мкг/мл ампициллина. Чашки инкубируют в течение ночи при 37°С, бактериальные клетки нескольких выросших колоний используют для независимого засева микробиологических пробирок с 5 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина, с последующим выращиванием бактериальных клеток на качалке при 37°С в течение ночи (ночная культура). После этого в пробирки добавляют глицерин до конечной концентрации 15%, суспензию клеток разливают в пластиковые пробирки и хранят при -70°С.
В) Определение продуктивности штамма-продуцента рекомбинантной IgA1 протеазы SEQ ID NO: 11 Е. coli BL21(DE3)/pET31-IgA1-1004
В 15 мл жидкой среды LB, содержащей 50 мкг/мл ампициллина, вносят 1% инокулят ночной культуры клеток и выращивают при 37°С на качалке при 180 об/мин в течение 2 ч до ОП 0,8. Затем добавляют индуктор изопропилтиогалактопиранозид (ИПТГ) до конечной концентрации 0,5 мМ и продолжают инкубацию в тех же условиях в течение 2,0 ч. Отбирают пробу 1 мл и центрифугируют в течение 6 мин при 12000 об/мин, после чего клетки суспендируют в 100 мкл деионизированной воды, добавляют 33 мкл буферного раствора, содержащего 125 мМ Трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол и 0,01% бромфеноловый синий, нагревают в течение 10 мин до 95°С. Отбирают аликвоту и анализируют электрофорезом в 10% ПААГ, содержащем 0,1% додецилсульфат натрия. Гель окрашивают Кумасси R250 и сканируют на лазерном сканере. Продуктивность штамма Е. coli BL21(DE3)/pET31-IgA1-1004 составляет 40% рекомбинантного белка от суммарного клеточного белка.
Г) Получение, выделение и очистка рекомбинантной IgA1 протеазы SEQ ID NO: 11
1) Культивирование штамма Е. coli BL21(DE3)/pET31-IgA1-1004
По 10 мл соответствующего инокулята ночной культуры клеток вносят в 1 л жидкой среды LB, содержащей 100 мкг/мл ампициллина, и выращивают клетки при +37°С на качалке при 200 об/мин до оптической плотности равной 0,8 ОЕ при 600 нм. Затем добавляют индуктор изопропилтиогалактопианозид (ИПТГ) до конечной концентрации 0,5 мМ и продолжают инкубацию клеток при +37°С на качалке в течение в двух часов.
2) Разрушение клеток и фракционирование лизата.
Для сбора клеток центрифугируют 1 л культуры штамма-продуцента Е. coli
BL21(DE3)/pET31-IgA1-1004 (10 мин, 3,5 тыс. об./мин) и осажденные клетки суспендируют в семикратном объеме буферного раствора 20 мМ Трис-HCl, 0,15 М NaCl, рН 8,5, содержащем лизоцим (0.002%), выдерживают 30 мин при комнатной температуре. Суспензию клеток (2 г из 1 л индуцированной культуры) пятикратно обрабатывают ультразвуком и подвергают центрифугированию (1 час, 20000 g) в результате чего получают супернатант и осадок. Супернатант содержит растворимые белки (бесклеточный экстракт) и осадок - нерастворимую часть клеточного лизата (дебрис и нерастворимые белки). По результатам электрофоретического анализа целевой белок является нерастворимым белком и формирует ТВ, независимо от температурных условий индукции культуры и типа буфера, использованного при разрушении клеток. Осадок, содержащий ТВ после центрифугирования, промывают буферным раствором 60 мл 20 мМ Трис-HCl, 1% Triton Х-100, 0.1% SDS, рН 8,5 и вновь центрифугируют 40 мин 10000 g. Полученный осадок промывают буферным раствором 60 мл буфера 20 мМ Трис-HCl, I М NaCl, рН 8,5, центрифугируют 40 мин, 10000 g. Полученный после центрифугирования осадок используют для проведения хроматографии на Ni-агарозе в денатурирующих условиях.
3) Очистка растворенных тел включения рекомбинантной IgA1 протеазы SEQ ID NO: 11 с помощью металл-хелатной хроматографии на Ni-агарозном сорбенте ТВ, выделенные из 2 г клеток Е. coli BL21(DE3)/pET31-IgA1-1004, растворяют в 100 мл 20 мМ Трис-HCl буферного раствора, содержащего 0,15 М NaCl, 8 М мочевину и 0,02 М имидазол, рН 8,1. После центрифугирования и фильтрования раствор наносят на предупакованную колонку с Ni-агарозой (HiTrap Chelating HP, GE Healthcare, 2×5 мл), уравновешенную исходным буферным раствором и сорбент промывают 50 мл исходного буферного раствора. Связавшиеся белки элюируют имидазолом в градиенте концентрации от 20 до 400 мМ в исходном буферном растворе, объем градиента 100 мл (50×50).
Фракции, содержащие очищенный белок SEQ ID NO: 11, объединяют и используют на стадии ренатурации и очистки на Q-сефарозе.
4) Ренатурация и очистка рекомбинантной IgA1 протеазы SEQ ID NO: 11 на Q-сефарозе
Объединенный элюат рекомбинантной протеазы SEQ ID NO: 11, полученный после хроматографии на Ni-агарозе (концентрация белка 0,3 мг/мл), подвергают ступенчатому диализу, постепенно снижая концентрацию мочевины до значения 1,5 М в 20 мМ Трис-HCl буферном растворе, содержащем 0,15 М хлористый натрий, рН 7,0. Полученный раствор центрифугируют (30 мин, 5000 g), фильтруют через мембрану с размером пор 0,2 мкм и наносят на предупакованную колонку с Q-сефарозой (GE Healthcare 2×5 мл), уравновешенную в 20 мМ Трис-HCl буферном растворе, содержащем 0,15 М хлористый натрий и 1,5 М мочевину, pH 7,0. Целевой белок, не связавшийся с сорбентом, собирают единой фракцией, добавляют сорбит (5% масс.), фильтруют через стерильную мембрану с размером пор 0,2 мкм и фасуют в стерильные емкости по 2 мг. Чистота целевого белка составляет около 90% по данным электрофоретического анализа (фиг. 3), концентрация белка - 0,25 мг/мл, выход - 34 мг из 2 г биомассы клеток.
Таким образом, впервые получены рекомбинантные белки, состоящие из трех SEQ ID NO: 2 или двух SEQ ID NO: 4 (вариант) полипептидов из различных участков фрагмента Ala28-Pro1004 первичной структуры IgA протеазы N. meningitidis серогруппы В, штамм Н44/76, объединных в единую полипептидную цепь, способные защищать животных от заражения живой вирулентной культурой менингококков основных эпидемических сергрупп А, В и С и формировать иммунологическую память так же эффективно, как и рекомбинантная IgA1 протеаза SEQ ID NO: 11. Эти данные, в совокупности с отсутствием нарушений общего гомеостаза в организме животных, иммунизированных рекомбинантными белками SEQ ID NO: 2 и SEQ ID NO: 4, свидетельствуют о возможности использования любого из этих белков в качестве основы потенциальной
монокомпонентной вакцины для защиты от менингококковой инфекции и других патогенов, вирулентность которых обусловлена IgA1 протеазой.