Результат интеллектуальной деятельности: Способ получения ковалентных конъюгатов антитело-олигонуклеотид на основе реакции промотируемой напряженностью циклооктинового цикла
Вид РИД
Изобретение
1. Область техники.
Изобретение относится к области биотехнологии, а именно к разработке способа получения ковалентных конъюгатов антитело-олигонуклеотид на основе реакции промотируемой напряженностью циклооктинового цикла. Ковалентные конъюгаты находят свое применение, в частности, в иммуно-ПЦР в реальном времени, где используется уникальная чувствительность ПЦР в реальном времени и высокая специфичность антител.
2. Уровень техники.
Иммуно-ПЦР является высокочувствительным и высокоспецифичным методом определения токсинов, прионов, опухолевых маркеров, антител в сложных матрицах (Malou N, Raoult D., 2011). Впервые предложен Sano Т. с соавт. в 1992 году. Модифицированный формат иммуно-ПЦР был предложен Zhou Н. с соавт. и назван универсальным иммуно-ПЦР (Zhou, Н. et al, 1993). Он основан на использовании детектирующих антител, несущих молекулу биотина, с последовательным присоединением к иммунному комплексу антиген-антитело стрептавидина и биотинилированной ДНК-метки. ДНК-метка в свою очередь подвергается амплификации с последующей детекцией различными методами, а именно гель-электрофорезом или ПЦР в реальном времени. Что в сути повторяет протокол ИФА, при этом изменяется способ детекции образующихся иммунных комплексов.
Протокол «универсального иммуно-ПЦР» в сэндвич-формате для детекции антигена состоит из следующих этапов:
1. сорбция первичных (связывающих) антител в лунках планшета
2. блокировка вакантных сайтов сорбции
3. внесение образца, содержащего искомый антиген
4. внесение биотинилированных вторичных (детектирующих) антител
5. внесение стрептавидина
6. внесение биотинилированной ДНК
7. проведение ПЦР
после каждого этапа производятся множественные отмывки для удаления избытков реагентов: 1-5 для этапов с 1 по 5 и до 15 отмывок после этапа 6. Столь большое число отмывок после внесения ДНК способствует наиболее полному удалению ДНК из лунки, что в свою очередь снижает фоновый сигнал.
Предварительное приготовление комплексов стрептавидина и биотинилированной ДНК позволяет сократить протокол на одну стадию. В патенте US 20100255558 A1 описаны надмолекулярные комплексы, формируемые из биотинилированных с двух концов фрагментов двухцепочечной ДНК, стрептавидина и антител. Использование подобных надмолекулярных комплексов позволяет усилить специфический сигнал за счет того, что на одну молекулу детектирующих антител приходятся сотни молекул ДНК-метки.
Ковалентное присоединение ДНК метки к детектирующему антителу, в свою очередь, позволяет объединить стадии 4-6, значительно сократить количество операций и общее время постановки протокола.
В патенте US 20050079520 A1 ковалентное присоединение ДНК метки к детектирующему антителу позволяет перейти к мультиплексированию иммуно-ПЦР, где несколько детектирующих антител с разной специфичностью, конъюгированные с разными ДНК меткам, вносятся одновременно. Здесь проводится элюция связавшихся детектирующих антител с последующим разделением смеси и проведением ПЦР в разных пробирках с соответствующим набором праймеров. При использовании ПЦР в реальном времени амплификация ДНК-меток может проводится уже в одной пробирке с визуализацией накопления соответствующих ампликонов в разных каналах детекции.
Большое распространение для получения конъюгатов для иммуно-ПЦР получил бифункциональный кросслинкер N-сукцинимидил 4-(малеидометил) циклогексанкарбоксилат (SMCC). Сукцинимидный эфир химически связывается с первичными аминами, а малиемидная группа связывается с тиольной группой. При этом описано два подхода: в первом используются аминогруппы антитела и олигонуклеотид модифицированный тиольной группой (Sims, P.W., et al, 2000), во втором - тиольная группа получается восстановлением антитела, например, с помощью ДТТ, а в олигонуклеотид вводится аминогруппа (Liang H,. et al, 2003 Singh N, et al, 2015). Недостатком такого подхода является последовательность процесса, а также склонность тиольных производных к димеризации, что снижает выходы конъюгатов и воспроизводимость мечения.
Assarsson Е, с соавт (Assarsson Е, et al., 2014) использовали SMCC получения 94 пар проб Антитело-ДНК, которые успешно использовали в proximity extension assay (PEA). В методе PEA для каждой мишени используется два антитела, конъюгированные с разными олигонуклеотидами, имеющими комплементарные 3' концы (обычно 6 нуклеотидов). Только в случае наличия искомого антигена антитела сближаются настолько, что связанные с ними олигонуклеотиды образуют дуплекс, который в дальнейшем достраивается до двуцепочечной молекулы и в дальнейшем амплифицируется в ПЦР. Авторы использовали олигонуклеотиды модифицированные тиольной группой в 10-кратном избытке по отношению к антителу. При этом авторы были вынуждены ввести в процесс получения конъюгатов дополнительную обработку олигонуклеотидов дитиотреитолом для разрушения димеров олигонуклеотидов с последующей очисткой, что несомненно усложняет и удорожает процесс.
Также в этих целях используется succinimidyl 4-hydrazinonicotinate acetone hydrazone (SANH) (Mocanu, M.M., et al). Антитело и аминопроизводное олигонуклеотида модифицируются отдельно: вводятся ароматический альдегид и ароматический гидразин. Активированные молекулы сливаются в присутствии катализатора - анилинового буферного раствора, и образуют сравнительно устойчивую связь (стабильна до 92°С и в диапазоне рН от 2 до 10). Преимуществами метода являются независимое мечение антитела и олигонуклеотида, также отсутствует необходимости окислять или восстанавливать антитело. К минусам относится необходимость катализа для прохождения реакции.
На основе вышеописанного способа реализован коммерческий набор Solulink Antibody-Oligonucleotide All-in-One Conjugation Kit.
Существует также коммерческий набор для изготовления ковалентных конъюгатов для иммуно-ПЦР: Thunder-Link®, Innova Biosciences.
Известен также способ конъюгации антитела и олигонуклеотида на основе реакции промотируемой напряженностью циклооктинового цикла (Haibiao Gong с соавт. (2016)). Это техническое решение является наиболее близким к заявляемому по совокупности существенных признаков (прототип).
Согласно прототипу, антитело модифицируется дибензоциклооктином через аминогруппы антитела и сукцинимидную группу реагента DBCO-PEG5-NHS. В свою очередь олигонуклеотид модифицируется азидогруппой, по-видимому, также через аминогруппу синтетического олигонуклеотида при взаимодействии с реагентом 5' Azide-NHS Ester.
В прототипе конъюгаты антитело-олигонукеотид используются в «реакции удлинения олигонуклеотидов», что выше описано как «proximity extenction assay» (PEA). Используются олигонуклеотиды длиной 45 нуклеотидов. Азидо группа вводится в 5' конец олигонуклеотида для того, чтобы оставался вакантным 3' конец олигонуклеотида, удлинение которого критично для метода PEA. Антитело модифицируется реагентом DBCO-PEG5-NHS, полиэтиленгликольный (PEG5) линкер которого повышает водорастворимость реактива для модифицирования. Степень мечения DBCO определяли после отделения продукта на центрифужном фильтре-концентраторе 50 кДа по поглощению продукта при 309 и 280 нм используя коэффициенты экстинкции 12000 М-1 сm-1 для DBCO на 309 нм и 204000 М-1 cm-1 для антитела на 280 нм. Степень мечения антитела олигонуклеотидом определялась только в модельном эксперименте с олигонуклеотидом, меченным Су5, по площадям пиков на хроматограмме разделения продуктов реакции. Очистка конъюгатов от избытка олигонуклеотида осуществлялась также на центрифужном фильтре-концентраторе 100 кДа.
Недостатки метода: сравнительно низкая стабильность дибензоциоклооктиновой производной антитела при хранении, высокие требования к качеству реактива, содержащего дибензоциоклооктин. Таким образом труднодостижима воспроизводимая степень мечения антитела. При этом в своей работе Haibiao Gong с соавт. показали, что степень мечения влияет на фоновые значения (фон растет при увеличении степени мечения).
Задачей технического решения является создание простого и удобного метода для получения конъюгатов антитело-олигонуклеотид с контролируемым составом антитело-олигонуклеотид (коэффициентом мечения).
Результат достигается за счет: 1) получения и дальнейшего использования азидопроизводной антитела, что 1а) повышает стабильность при хранении по сравнению с дибензоциоклооктиновой производной, 1б) не вносит в состав антитела большого гидрофобного домена, который может способствовать агрегации антител, 1в) легко стандартизуется для получения необходимого коэффициента мечения азидогруппой, 2) получения дибензоциоклооктиновой производной олигонуклеотида, что намного предпочтительней ввиду возможности многократной заморозки модифицированного олигонуклеотида, заниженным требованиям к активности модифицированного олигонуклеотида ввиду использования последнего в избытке по отношению к антителу.
3. Описание изобретения.
Способ получения ковалентных конъюгатов антитело-олигонуклеотид на основе реакции промотируемой напряженностью циклооктинового цикла осуществляется следующим образом:
1 этап - Антитело переводится в бикарбонатный буферный раствор рН 8 с помощью центрифужного фильтра-концентратора 50 кДа. Концентрация антитела доводится до 5 мг/мл. Вводится рассчитанное количество азидирующего реактива (например, активированный эфир Azide-PEG-NHS Ester). После инкубации 2 часа при комнатной температуре с помощью центрифужного фильтра-концентратора 50 кДа меченое антитело переводится в фосфатный буферный раствор рН 7 и отделяется от избытка реактива. Степень мечения подтверждается спектрофотометрически после реакции с DBCO-sulfo-Су5.
2 этап - сухой синтетический олигонуклеотид (66 нуклеотидов, 6 из которых увеличивают расстояние от антитела до смысловой части олигонуклеотида, которая будет матрицей для ПЦР) с аминогруппой растворяется в бикарбонатном буферном растворе рН 8 (вода/ДМСО=50/50) до концентрации 1 мМ. Вводится 5-кратный избыток дибензоциоклооктинового реактива (например, активированный эфир DBCO-NHS Ester), в данном случае водорастворимость реактива не имеет значения. После инкубации 1 час избыток реагента удаляется двукратным переосаждением олигонуклеотида в растворе перхлората лития в ацетоне. Олигонуклеотид растворяют в фосфатном буферном растворе рН 7 до концентрации 1 мМ. Активность активированного олигонуклеотида определяется спектрофотометрически после реакции с Су5-азидом.
3 этап - Азидированное антитело и активированный олигонуклеотид смешивают в соотношении 1 к 5 (соответственно). Инкубация реакционной смеси проводится 12 часов при температуре от 2 до 8°С в темноте.
4 этап - двухступенчатая очистка полученных конъюгатов. Ионно-обменная хроматография позволяет отделить возможную примесь непрореагировавшего антитела. Гель-фильтрация позволяет отделить избыток олигонуклеотида.
5 этап - концентрирование конъюгатов на центрифужном фильтре-концентраторе 50 кДа.
4. Реализация изобретения
Получение мономеченных конъюгатов антитело-олигонуклеотид
Для получения мономеченных конъюгатов B1F8-ODN2014 (1 молекула олигонуклеотида ODN2014 на 1 молекулу антитела В1F8) были проведены исследования по определению необходимого избытка реагента Azide-PEG-NHS Ester по отношению к антителу для получения коэффициента мечения 1,1.
Для этого небольшие количества (20 мкг) антитела в бикарбонатном буферном растворе рН 8 в концентрации 5 мг/мл вводили в реакцию с азидирующим реагентом в безводном ДМСО (2, 4, 6 и 8 кратный избыток). Антитела очищали от избытка азидирующего на центрифужных фильтрах-концентраторах 50 кДа. Добавляли 10-кратный избыток DBCO-sulfo-Cy5 в фосфатном буферном растворе рН 7. Избыток флуоресцентного красителя удаляли на центрифужных фильтрах-концентраторах 50 кДа. Коэффициент мечения рассчитывали по поглощению на 280 и 560 нм (Табл. 1).
 Исходя из полученных данных для азидирования 1 мг антитела был использован избыток азидирующего реагента равный 3,8. Небольшая аликвота полученного антитела была использована для определения коэффициента мечения, который составил 1,1.
Исходя из полученных данных для азидирования 1 мг антитела был использован избыток азидирующего реагента равный 3,8. Небольшая аликвота полученного антитела была использована для определения коэффициента мечения, который составил 1,1.
Антитело было смешано с 5-кратным избытком активированного олигонуклеотида, время инкубации при температуре от 2 до 8°С составило 12 часов.
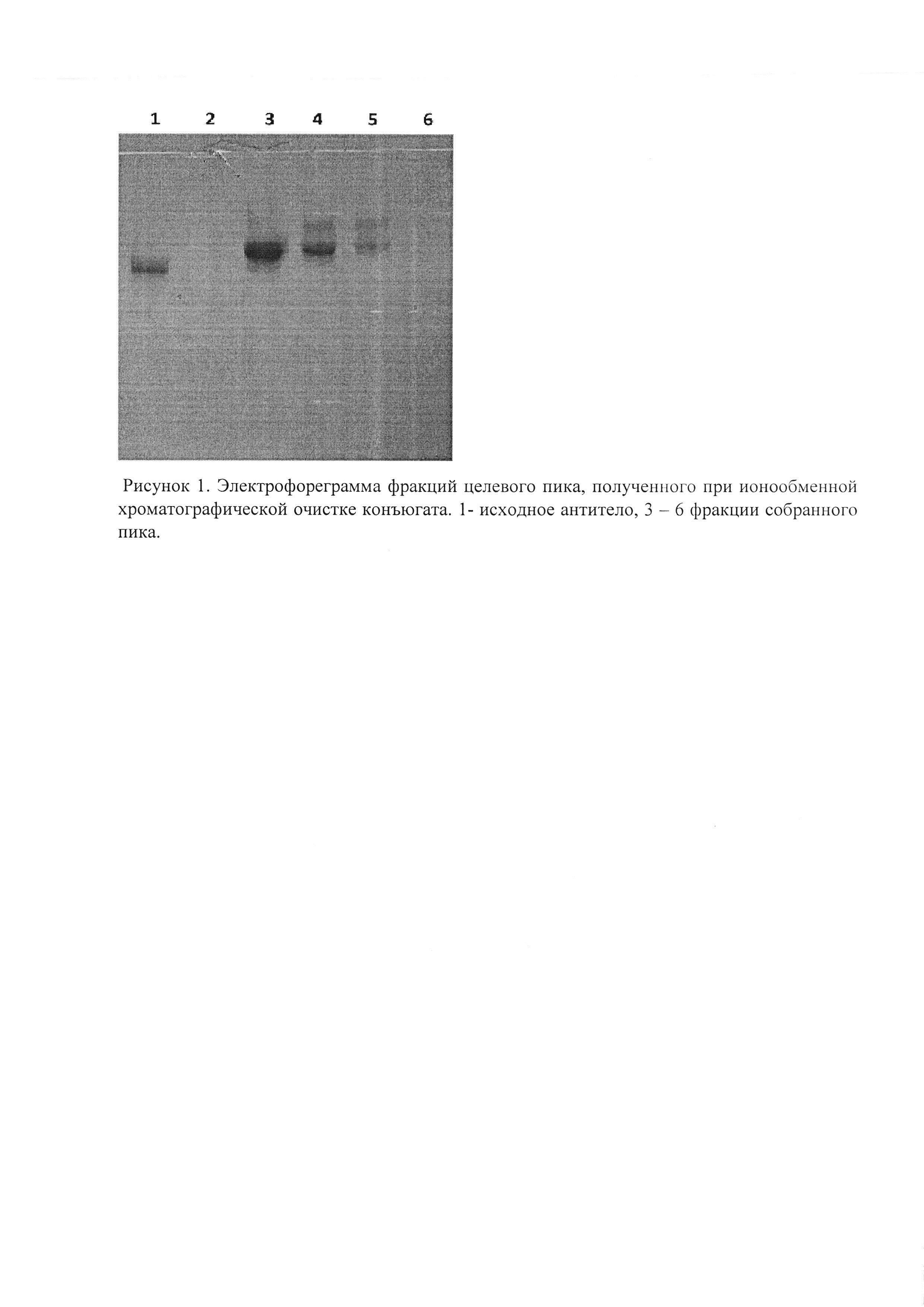
На ионообменной хроматограмме отмечается отсутствие пика, соответствующего непрореагировавшему антителу, отмечается единственный пик, соответствующий конъюгату и непрореагировавшему избытку олигонуклеотида. На нативном белковом гель-электрофорезе фракций собранного пика (рис. 1) без разведения фракции наблюдается требуемый искомый продукт (фракция 3) а также фракции 4 и 5 представляющие собой смесь конъюгатов с 1 и 2 олигонуклеотидами на одно антитело. Фракция 6 полностью состоит из олигонуклеотида, взятого в избытке.
Список литературы:
Malou N, Raoult D. Immuno-PCR: a promising ultrasensitive diagnostic method to detect antigens and antibodies. Trends Microbiol. 2011, 19(6), 295-302.
Sano T, Smith CL, Cantor CR. Immuno-PCR: very sensitive antigen detection by means of specific antibody-DNA conjugates. Science. 1992, 258(5079), 120-122.
Zhou, H. et al. Universal immuno-PCR for ultra-sensitive target protein detection. Nucleic Acids Res. 1993, 21, 6038-6039
Niemeyer, СМ., Adler, M., Pigna taro, B, Lenhert, S., Gao, S., Lifeng, C, Fuchs, H., Dietmar, B. Selfassembly of DNA-streptavidin nanostructures and their use as rea gents in immuno-PCR, Nucleic Acids Res., 1999, 27, 4553-4561.
Sims, P.W., Vasser, M., Wong, W.L., Williams, P.M., Meng Y-J.G. Immunopolymerase Chain Reaction Using Real-Time Polymerase Chain Reaction for Detection, Analytical Biochemistry, 2000, 281, 230-232.
Liang H, Cordova SE, Kieft TL, Rogelj S. A highly sensitive immuno-PCR assay for detecting Group A Streptococcus. J Immunol Methods 2003, 279, 101-110
Haibiao Gong, Ilona Holcomb, Aik Ooi, et al. Simple Method To Prepare Oligonucleotide-Conjugated Antibodies and Its Application in Multiplex Protein Detection in Single Cells Bioconjugate Chem. 2016, 27, 217-225
Mocanu, M. M., Varadi, Т., Szollosi, J., and Nagy, P. Comparative analysis of fluorescence resonance energy transfer (FRET) and proximity ligation assay (PLA). Proteomics 2011, 11, 2063-2070.
Kazane SA, Sok D, Cho EH, et al. Site-specific DNA-antibody conjugates for specific and sensitive immuno-PCR. Proceedings of the National Academy of Sciences of the United States of America. 2012, 109(10), 3731-3736.
Assarsson E, Lundberg M, Holmquist G, Bjo" rkesten J, Bucht Thorsen S. et al. Homogenous 96-Plex PEA Immunoassay Exhibiting High Sensitivity, Specificity, and Excellent Scalability. PLoS ONE, 2014, 9(4): e95192.
Патент US 20100255558 A1 С.M. Niemeyer, Ch. R. Cantor, T. Sano, C. L. Smith Supramolecular bioconjugates
Патент US 20050079520 A1 Jie Wu. Multiplexed analyte detection
Способ получения ковалентных конъюгатов антитело-олигонуклеотид на основе реакции промотируемой напряженностью циклооктинового цикла, отличающийся тем, что включает модификацию антитела азидогруппой путем инкубации антитела с 2-, 4-, 6- или 8-кратным избытком азидо-ПЭГ-сукцинимидного эфира, удаление избытка азидирующего реактива, модификацию олигонуклеотида циклоактиновой производной путем инкубации олигонуклеотида с 5-кратным избытком ДБЦО-сукцинимидного эфира, смешивание азидированного антитела и активированного олигонуклеотида в соотношении 1 к 5 и инкубацию реакционной смеси, очистку полученного конъюгата.