Новые составы N-карбамоилметил-4-фенил-2-пирролидона
Вид РИД
Изобретение
Изобретение относится к области медицины, фармакологии и химико-фармацевтической промышленности, а именно к новым составам, содержащим N-карбамоилметил-4-фенил-2-пирролидон (фонтурацетам) и, по меньшей мере, одно дополнительное соединение, выбранное из группы, включающей 4-фенилпирролидон-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту, этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат и их оптические изомеры и фармацевтически приемлемые соли, фармацевтической композиции на основе упомянутых составов и лекарственному средству на основе упомянутой фармацевтической композиции.
Ноотропы, или нейрометаболические стимуляторы, – лекарственные средства, предназначенные для оказания специфического воздействия на высшие психические функции мозга. Считается, что ноотропы способны стимулировать умственную деятельность, активизировать когнитивные функции, улучшать память и увеличивать способность к обучению. Предполагается, что ноотропы увеличивают устойчивость мозга к разнообразным вредным воздействиям, таким как чрезмерные нагрузки или гипоксия.
К ноотропным лекарственным средствам нового поколения относится препарат с МНН фонтурацетам (N-карбамоил-метил-4-фенил-2-пирролидон), который зарегистрирован и разрешен к промышленному производству Минздравом России в 2003 г. В отличие от других ноотропных лекарственных средств он имеет наиболее широкий спектр фармакологической активности [Патент РФ № 2539375, опубл. 20.01.2015].
Фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) давно и прочно зарекомендовал себя как эффективный препарат для лечения заболеваний ЦНС различного генеза, особенно связанных с сосудистыми заболеваниями и нарушениями обменных процессов в мозге, интоксикацией (в частности, при посттравматических состояниях и явлениях хронической цереброваскулярной недостаточности), сопровождающихся ухудшением интеллектуально-мнестических функций, снижением двигательной активности; лечения невротических состояний, проявляющихся вялостью, повышенной истощаемостью, снижением психомоторной активности, нарушением внимания, ухудшением памяти; лечения нарушений процесса обучения; лечения психоорганических синдромов, проявляющихся интеллектуально-мнестическими нарушениями и апатико-абулическими явлениями, а также вялоапатических состояний при шизофрении; лечения судорожных состояний; лечения ожирения (алиментарно-конституционального генеза); профилактики гипоксии, повышения устойчивости к стрессу; коррекции функционального состояния организма в экстремальных условиях профессиональной деятельности с целью предупреждения развития утомления и для повышения умственной и физической работоспособности; коррекции суточного биоритма, при инверсии цикла сон-бодрствование; для лечения хронического алкоголизма (с целью уменьшения явлений астении, депрессии, интеллектуально-мнестических нарушений) [Статья «Фенотропил», Справочник лекарственных препаратов, Интернет-сайт «Регистр лекарственных средств России» Rlsnet.ru, https://www.rlsnet.ru/tn_index_id_27152. htm].
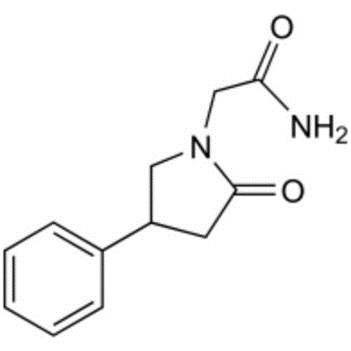
N-карбамоилметил-4-фенил-2-пирролидон (фонтурацетам)
Фонтурацетам обладает выраженным антиамнестическим действием, оказывает прямое активирующее влияние на интегративную деятельность головного мозга, способствует консолидации памяти, улучшает концентрацию внимания и умственную деятельность, облегчает процесс обучения, повышает скорость передачи информации между полушариями головного мозга и устойчивость тканей мозга к гипоксии и токсическим воздействиям, обладает противосудорожным действием и анксиолитической активностью [Патент РФ № 2050851, опубл. 27.12.1995]; оказывает положительное влияние на обменные процессы и кровообращение мозга, стимулирует окислительно-восстановительные процессы, повышает энергетический потенциал организма за счет утилизации глюкозы, улучшает регионарный кровоток в ишемизированных участках мозга [Патент РФ № 2183117, опубл. 10.06.2002]; повышает содержание норадреналина, дофамина и серотонина в мозге, не влияет на уровень содержания ГАМК, не связывается с GABAA и GABAB рецепторами, не оказывает заметного влияния на спонтанную биоэлектрическую активность мозга; проявляет умеренно выраженный стимулирующий эффект, проявляющийся в отношении двигательных реакций, повышении физической работоспособности, выраженном антагонизме каталептическому действию нейролептиков, а также ослаблении выраженности снотворного действия этанола и гексобарбитала; проявляет адаптогенное действие в повышении устойчивости организма к стрессу в условиях чрезмерных психических и физических нагрузок, при утомлении, гипокинезии и иммобилизации, при низких температурах; стимулирует выработку антител в ответ на введение антигена, что указывает на иммуностимулирующие свойства, но в то же время не способствует развитию гиперчувствительности немедленного типа и не изменяет аллергическую воспалительную реакцию кожи, вызванную введением чужеродного белка; не обладает тератогенными, мутагенными, канцерогенными и эмбриотоксичными свойствами; имеет низкую токсичность.
Умеренный психостимулирующий эффект препарата сочетается с анксиолитической активностью, он улучшает настроение, оказывает некоторый анальгезирующий эффект, повышая порог болевой чувствительности. На фоне приема препарата отмечено улучшение зрения, которое проявляется в увеличении остроты, яркости и полей зрения [Cтатья «Фенотропил», Справочник лекарственных препаратов, Интернет-сайт «Регистр лекарственных средств России» Rlsnet.ru, https://www.rlsnet.ru/tn_index_id_27152.htm].
Из уровня техники известна фармацевтическая композиция, обладающая ноотропной активностью, включающая в качестве действующего вещества N-карбамоил-метил-4-фенил-2-пирролидон [Патент РФ № 2240783, опубл. 27.11.2004].
Из уровня техники известна фармацевтическая композиция, обладающая ноотропным действием, в виде раствора для инъекций, содержащая фонтурацетам и воду для инъекций, отличающаяся тем, что она дополнительно содержит 2-гидроксипропил-β-циклодекстрин [Патент РФ № 2414898, опубл. 27.03.2011].
Из уровня техники известна фармацевтическая композиция в форме раствора для инъекций, обладающая ноотропной активностью, характеризующаяся тем, что она включает в качестве активного начала N-карбамоилметил-4-фенил-2-пирролидон, в качестве вспомогательных веществ гидроксиэтилкрахмал 200/0.5 и воду для инъекций [Патент РФ № 2524651, опубл. 27.07.2014].
Из уровня техники известна фармацевтическая композиция в форме таблетки, содержащая N-карбамоил-метил-4-фенил-2-пирролидон и вспомогательные компоненты, отличающаяся тем, что она содержит в качестве вспомогательных компонентов моногидрат лактозы, карбоксиметилцеллюлозу, поливинилпирролидон и соль стеариновой кислоты [Патент РФ № 2560691, опубл. 20.08.2015].
Из уровня техники также известен состав (RS)-2-(2-оксо-4-фенилпирролидин-1-ил)ацетамида, обладающий модуляторной активностью с соразмерным влиянием, способ получения фармацевтической субстанции, отличающийся тем, что полученное сырье подвергают очистке, кристаллизации, стабилизации путем обработки состава деминерализованной водой и изотермической кристаллизации из пропанола с последующей сушкой, что обеспечивает увеличение эффективности, безопасности, стабильности и широты терапевтического применения [Патент РФ № 2480214, опубл. 27.04.2013].
При этом известны аналоги фонтурацетама 2-(2-оксо-4-фенилпирролидин-1-ил)уксусная кислота и этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат, которые являются активаторами когнитивных функций [US4144246, опубл. 13.03.1979].
Известно также соединение 4-фенилпирролидон-2, являющееся структурно родственным фонтурацетаму, однако его биологическая активность не описана.
Авторы настоящего изобретения неожиданно обнаружили, что новые составы, включающие фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и, по меньшей мере, одно дополнительное соединение, выбранное из группы, включающей 4-фенилпирролидон-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту и этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат, имеют лучшие свойства, чем субстанция-порошок фонтурацетама, используемый в фармацевтической промышленности в настоящее время, и выбранный авторами настоящего изобретения в качестве прототипа.
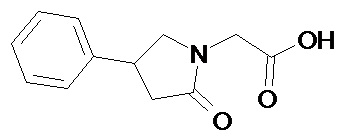
2-(2-оксо-4-фенилпирролидин-1-ил)уксусная кислота
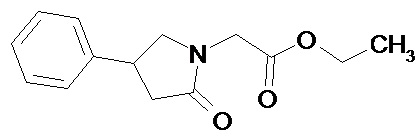
этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат

4-фенилпирролидон-2
Ниже приведены определения терминов, которые используются в описании настоящего изобретения.
«Лекарственное начало» (лекарственная субстанция, лекарственное вещество) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Фармацевтическая композиция» обозначает композицию, включающую в себя новый состав N-карбамоил-метил-4-фенил-2-пирролидона и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, дезинтегранты, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от их природы, способа введения композиции и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также иные фармацевтически приемлемые поверхностно-активные вещества, и смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как бензиловый спирт, уротропин, этилендиаминтетрауксусная кислота, бензойная кислот, хлорбутанол, сорбиновая кислота, парабены, алкилпиридиний, бензетоний и их фармацевтически приемлемые соли и подобные им соединения. Композиция может включать также изотонические агенты, например, сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например, таких как гидрофильные полимерные замедлители высвобождения, например, производные целлюлозы, полиэтиленоксид, желатин, поливиниловый спирт, поливинилпирролидон, альгинаты, карбомеры, гидрофобные замедлители высвобождения, такие как глицерилбегенат, моностеарат алюминия. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, буферные растворы, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Для регулирования pH могут быть использованы различные органический и неорганические кислоты, такие как яблочная, аскорбиновая, лимонная, уксусная, янтарная, винная, фумаровая, молочная, аспарагиновая, глутаровая, глутаминовая, сорбиновая кислоты. Примерами диспергирующих агентов и распределяющих средств являются крахмал, альгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, коллоидный диоксид кремния, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или получены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (Подробное описание свойств таких солей дано в Berge S.M., et al., “Pharmaceutical Salts”// J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты – лизин, орнитин и аргинин.
Задачей настоящего изобретения является разработка стабильного при хранении, негигроскопичного, хорошо растворимого, экономически целесообразного, промышленно реализуемого, препаративного состава фонтурацетама (N-карбамоил-метил-4-фенил-2-пирролидона).
Стабильность в твердом состоянии и срок хранения активных компонентов являются очень важными факторами. Лекарственное соединение и композиции, включающие его, должны обладать способностью храниться в течение значительных периодов времени, не проявляя значительного изменения физико-химических свойств активного компонента (например, его химического состава, плотности, гигроскопичности и растворимости).
Таким образом, авторы изобретения неожиданно обнаружили, что присутствие 4-фенилпирролидона-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты, этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата, или их оптических изомеров и фармацевтически приемлемых солей, в субстанции фонтурацетама улучшает некоторые свойства субстанции фонтурацетама.
Технические результаты настоящего изобретения:
- повышение стабильности (времени хранения) состава согласно настоящему изобретению по сравнению с прототипом;
- повышение скорости растворения состава по сравнению с прототипом;
- снижение гигроскопичности состава по сравнению с прототипом;
- расширение арсенала средств, обладающих ноотропной активностью;
- повышение активности заявленного состава по сравнению с прототипом.
Поставленная задача решается, а технический результат достигается созданием состава, обладающего ноотропной активностью, включающего N-карбамоилметил-4-фенил-2-пирролидон (фонтурацетам) и по меньшей мере одно дополнительное соединение, выбранное из группы, включающей 4-фенилпирролидон-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту, этил-2-(2-оксо-4-фенилпирроли-дин-1-ил)ацетат и/или их оптические изомеры и/или их фармацевтически приемлемые соли, причем упомянутый состав содержит 4-фенилпирролидон-2 в количестве от 0,25% до 20,00%, и/или 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту в количестве не более 20,00% мас и/или этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат в количестве не более 20,00% мас.
Согласно предпочтительным вариантам реализации указанный технический результат также достигается тем, что:
- дополнительное соединение представляет собой 4-фенилпирролидон-2 в количестве от 0,25 до 1,00% мас.;
- упомянутый состав содержит 4-фенилпирролидон-2 в количестве от 0,30 до 0,60% мас.;
- упомянутый состав содержит 4-фенилпирролидон-2 в количестве от 0,50 до 0,60% мас.;
- дополнительное соединение представляет собой 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту в количестве от 0,01 до 1,00% мас.;
- упомянутый состав содержит 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту в количестве от 0,10 до 0,50% мас.;
- упомянутый состав содержит 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту в количестве от 0,10 до 0,20% мас.;
- дополнительное соединение представляет собой этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат в количестве от 0,01 до 1,00% мас.;
- упомянутый состав содержит этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат в количестве от 0,10 до 0,50% мас.;
- упомянутый состав содержит этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат в количестве от 0,10 до 0,20% мас.
Поставленная задача также осуществляется, а технический результат достигается созданием фармацевтической композиции, обладающей ноотропной активностью, причем упомянутая композиция содержит в терапевтически эффективном количестве любой вышеупомянутый состав и по меньшей мере один фармацевтически приемлемый носитель.
Поставленная задача также осуществляется, а технический результат достигается созданием лекарственного средства, обладающего ноотропной активностью, в виде таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку, причем упомянутое средство содержит в терапевтически эффективном количестве любой вышеупомянутый состав или вышеупомянутую фармацевтическую композицию.
Предметом данного изобретения также является новая фармацевтическая композиция, обладающая ноотропной активностью, которая содержит терапевтически эффективное количество упомянутого состава, включающего фонтурацетам и, по меньшей мере, одно дополнительное соединение, выбранное из группы, включающей 4-фенилпирролидон-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту, этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат и их оптические изомеры и фармацевтически приемлемые соли, и по меньшей мере, один фармацевтически приемлемый носитель.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемым эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с составом, включающим фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и, по меньшей мере, одно дополнительное соединение, выбранное из группы, включающей 4-фенилпирролидон-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту, этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат и их оптические изомеры и фармацевтически приемлемые соли, по настоящему изобретению может включать и другие активные субстанции, в том числе обладающие активностью, при условии, что они не вызывают нежелательных эффектов.
При необходимости использования фармацевтической композиции по настоящему изобретению в клинической практике она может смешиваться с традиционными фармацевтическими носителями.
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в частности, в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Предметом данного изобретения также является лекарственное средство, обладающее ноотропной активностью, в виде таблеток, капсул или раствора для инъекций, помещенных в фармацевтически приемлемую упаковку, содержащее в терапевтически эффективном количестве состав, включающий фонтурацетам и, по меньшей мере, одно дополнительное соединение, выбранное из группы, включающей 4-фенилпирролидон-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту, этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат и их оптические изомеры и фармацевтически приемлемые соли, или фармацевтическую композицию по настоящему изобретению.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка средства, содержащего новый состав N-карбамоилметил-4-фенил-2-пирролидона по настоящему изобретению, у пациентов может корректироваться в зависимости от терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10-500 мг, предпочтительно – 50-300 мг. Поэтому во время получения из фармацевтической композиции лекарственного средства по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10-500 мг нового состава N-карбамоилметил-4-фенил-2-пирролидона по настоящему изобретению, предпочтительно – 50-300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно – от одного до шести раз).
Представленные ниже примеры осуществления изобретений иллюстрируют, но не ограничивают заявленную группу изобретений.
Пример 1. Получение фонтурацетама (N-карбамоилметил-4-фенил-2-пирролидона)
Синтез целевого продукта осуществляют по методике [Ворона М., Вейнберг Г., Викайнис С., Кузнецов Е., Лебедев А., Пономарёв Ю., Чернобровый А., Звейниеце Л., Дамброва М. Новые методы синтеза 2-[(4-R)-2-оксо-4-фенилпирролидин-1-ил]ацетамида ((R)-фенотропила). ХГС. 2012. Т. 48. № 5. С. 775 - 778], в которой использована способность N-алкилированных эфиров 4-аминомасляной кислоты циклизоваться в N-алкилпирролидин-2-оны.
К раствору 7,50 г (27,6 ммоль) гидрохлорида н-бутилового эфира 4-амино-3-фенилмасляной кислоты и 5,61 г (30,3 ммоль) иодацетамида в 150 мл ДМФА добавляют 19,07 г (82,8 ммоль) K3PO4·H2O и 10 г молекулярных сит 4Å. Полученную суспензию перемешивают при комнатной температуре в течение 24 ч, фильтруют, фильтрат упаривают в вакууме досуха.
Для проведения циклизации полученный в остатке н-бутиловый эфир 4-карбамоилметиламино-3-фенилмасляной кислоты растворяют в 150 мл толуола, к раствору добавляют 2 г (8,68 ммоль) K3PO4·H2O и 0,05 г (0,15 ммоль) Bu4NBr. Суспензию кипятят в течение 2 ч с обратным холодильником, охлаждают, фильтруют, фильтрат упаривают досуха, осадок промывают водой обессоленной, охлажденной до температуры от 0 до 5ºС. Влажный N-карбамоилметил-4-фенил-2-пирролидон сушат при температуре от 60 до 65ºС до потери в массе при высушивании не более 0,5%. Конечный продукт очищают от примесей колоночной хроматографией. Выход 3,55 г (63%). Т. пл. для рацемического продукта 129–130 °C.
Пример 2. Определение содержания 4-фенилпирролидона-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты и этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата в составе фонтурацетама
Состав фонтурацетама исследовали на содержание 4-фенилпирролидона-2, 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты и этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата методом ВЭЖХ с использованием стандартов.
Подвижная фаза (ПФ) А. 1,0 мл трифторуксусной кислоты помещают в мерную колбу вместимостью 1000 мл, прибавляют 500 мл воды для хроматографии и перемешивают, затем доводят объем раствора водой для хроматографии до метки и дегазируют любым удобным способом.
Срок годности раствора 1 мес.
Подвижная фаза (ПФ) В. Ацетонитрил для хроматографии.
Испытуемый раствор. Около 750 мг (точная навеска) порошка субстанции фонтурацетама помещают в мерную колбу вместимостью 250 мл, растворяют в 150 мл воды для хроматографии, помещают на ультразвуковую баню и выдерживают в течение 5 мин. Затем после охлаждения до комнатной температуры доводят объем раствора водой для хроматографии до метки и перемешивают. Полученный раствор фильтруют через мембранный фильтр с диаметром пор 0,45 мкм, отбрасывая первые 2 мл фильтрата.
Стандартный раствор (а). Около 25 мг (точная навеска) стандартного образца фонтурацетама помещают в мерную колбу вместимостью 25 мл и растворяют в 15 мл воды для хроматографии, доводят объем раствора этим же растворителем до метки и перемешивают.
Cтандартный раствор (b). 1,0 мл стандартного раствора (а) помещают в мерную колбу вместимостью 25 мл, доводят объем раствора водой для хроматографии до метки и перемешивают. 1,0 мл полученного раствора помещают в мерную колбу вместимостью 20 мл, доводят объем раствора водой для хроматографии до метки и перемешивают.
Таблица 1. Хроматографические условия
|
Элюирование осуществляется в градиентном режиме в соответствии с таблицей 1.
Таблица 2. Условия элюирования
|
Хроматографируют стандартный раствор (b) не менее 5 раз. Время регистрации хроматограммы 8 мин. Все пики хорошо различимы. Время удерживания пика фонтурацетама – около 4,0 мин. Времена удерживания пика 4-фенилпирролидона-2 относительно пика фонтурацетама составляет около 1,9, пика 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты около 1,6 и пика этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата около 2,4.
Хроматографируют испытуемый раствор и стандартный раствор, получая не менее 3 хроматограмм. Не учитывают пики, площади которых составляет менее 30 % площади пика фонтурацетама на хроматограмме стандартного раствора (b).
Пример 3. Получение образцов фонтурацетама, содержащих дополнительные соединения
Образцы состава фонтурацетама с содержанием 4-фенилпирролидона-2 0,25%, 0,3%, 0,5%, 0,6%, 1,0% и 20,0% мас. были получены из образца, полученного в примере 1, путем добавления к образцу расчетного количества 4-фенилпирролидона-2 и тщательного перемешивания полученного состава.
Образцы состава фонтурацетама с содержанием 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты 0,01%, 0,6%, 1,0% и 20,0% мас. были получены из образца, полученного в примере 1, путем добавления к образцу расчетного количества 2-(2-оксо-4-фенилпирролидин-1-ил) уксусной кислоты и тщательного перемешивания полученного состава.
Образцы состава фонтурацетама с содержанием этил-2-(2-оксо-4-фенилпирролидин-1-ил) ацетат 0,01%, 0,6%, 1,0% и 20,0% мас. были получены из образца, полученного в примере 1, путем добавления к образцу расчетного количества этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата и тщательного перемешивания полученного состава.
Пример 4. Определение кинетики растворения новых составов, включающих фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и 4-фенилпирролидон-2, фонтурацетам и 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту, и фонтурацетам и этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат
Кинетику растворения нового состава N-карбамоилметил-4-фенил-2-пирролидона, полученного в примере 3, оценивают по содержанию субстанции N-карбамоилметил-4-фенил-2-пирролидона и сравнивают с кинетикой растворения прототипа. Прибор для определения скорости растворения представляет собой трехгорлый сосуд емкостью 1 л. В один из тубусов вводят термометр, в другой – стеклянную трубку для взятия проб и их комплексирования, а в третий – основную деталь прибора – цилиндрическую корзинку высотой 3,6 см и диаметром 2,5 см, сделанную из нержавеющей стали в виде сетки с отверстиями диаметром 40 меш (около 0,351 мм). Корзинка насажена на ось мотора.
В сосуд наливают растворяющую среду (1000 мл), в данном эксперименте щелочной раствор панкреатина, что соответствует среде слюны человека и является важным для определения растворимости сублингвальных (ородисперсных) лекарственных форм. Исследуемый образец помещают в цилиндрическую корзинку, которую устанавливают на расстоянии 2 см от дна сосуда.
Температуру растворяющей среды во время опыта поддерживают постоянной (37±0,5°С). Скорость вращения корзинки в среде регулируют с точностью ±5%, она составляет 200 об/мин. Через установленные интервалы времени отбирают для анализа пробы по 1-2 мл для определения содержания растворенного вещества. Взятый объем растворителя тотчас же восполняют новым. Контроль растворения проводят по выбранному компоненту – N-карбамоилметил-4-фенил-2-пирролидону.
Для сравнительных образцов 1-4 используют 200 мг нового состава, включающего фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и 0,25%, 0,6 %, 1,0% и 20,0% мас. 4-фенилпирролидона-2, соответственно, а для сравнительного образца 5 – 200 мг прототипа.
Для сравнительных образцов 6-9 используют 200 мг нового состава, включающего фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и 0,01%, 0,6%, 1,0% и 20,0% мас. 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты, соответственно.
Для сравнительных образцов 10-13 используют 200 мг нового состава, включающего фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и 0,01%, 0,6%, 1,0% и 20,0% мас. этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата, соответственно.
Температуру растворяющей среды во время опыта поддерживают постоянной (37±0,5°С). Скорость вращения корзинки в среде регулируют с точностью ±5%, она составляет 200 об/мин. Через установленные интервалы времени отбирают для анализа пробы по 1-2 мл для определения содержания лекарственного вещества. Взятый объем растворителя тотчас же восполняют новым.
Полученные результаты в процентах растворенного действующего вещества от максимальной концентрации приведены в таблицах 3-5.
Таблица 3. Кинетика растворения N-карбамоилметил-4-фенил-2-пирролидона с 4-фенилпирролидоном-2
|
Таблица 4. Кинетика растворения N-карбамоилметил-4-фенил-2-пирролидона с 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислотой
|
Таблица 5. Кинетика растворения N-карбамоилметил-4-фенил-2-пирролидона этил-2-(2-оксо-4-фенилпирролидин-1-ил) ацетатом
|
Результаты демонстрируют, что скорость растворения новых составов N-карбамоилметил-4-фенил-2-пирролидона выше, чем скорость растворения прототипа. В частности, время, в течение которого происходит 50 % растворение новых композиций N-карбамоилметил-4-фенил-2-пирролидона, статистически значительно меньше, чем для сравнительного образца прототипа, что может быть особенно полезным для получения таблеток в ородисперсной форме.
Пример 5. Исследование стабильности при хранения нового состава
Стабильность новых составов N-карбамоилметил-4-фенил-2-пирролидона, полученных в примере 3, оценивают по содержанию субстанции, и сравнивают со стабильностью прототипа методом ускоренного старения.
Все образцы хранили в стеклянных флаконах, укупоренных резиновыми пробками с алюминиевыми колпачками, в климатической камере в условия ускоренных испытаний. Содержание действующего вещества определяют методом ВЭЖХ с использованием стандартов.
Метод «ускоренного старения» заключается в выдерживании испытуемого лекарственного средства при температурах и влажности, превышающих температуру и влажность его хранения в процессе обращения. При повышенных температурах, как правило, ускоряются протекающие в лекарственных средствах физико-химические процессы, приводящие со временем к нежелательным изменениям качества. Таким образом, при повышенной температуре промежуток времени, в течение которого контролируемые показатели качества лекарственного средства сохраняются в допустимых пределах (экспериментальный срок годности), искусственно сокращается в сравнении со сроком годности при температуре хранения. Это позволяет значительно сократить время, необходимое для установления срока годности.
По результатам, полученным в процессе «ускоренного старения» лекарственного средства, можно решить также обратную задачу, т.е. установить температуру хранения, обеспечивающую какой-либо заданный срок годности.
Срок годности (С) при температуре хранения (tхр) связан с экспериментальным сроком годности (СЭ) при повышенной температуре экспериментального хранения (tэ) следующей зависимостью:
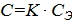 ,
,
где коэффициент соответствия  .
.
Температурный коэффициент скорости химической реакции (A) принят равным 2,5. Приведенная зависимость основана на правиле Вант-Гоффа о 2-4-кратном росте скоростей химических реакций при увеличении температуры на 10°С.
В соответствии с общей фармакопейной статьей ОФС.1.1.0009.15 значение коэффициента соответствия (K) в зависимости от выбранного температурного интервала (tэ-tхр), равного 30°С, составляет 15,6. Срок экспериментального хранения при выбранном сроке годности 3 года составляет 71 сутки.
Статистическую обработку параметров и оформление результатов исследования проводят в соответствии с Правилами надлежащей клинической практики Евразийского экономического союза с помощью статистического пакета SPSS Statistics°19.0.
Показано, что новые составы N-карбамоилметил-4-фенил-2-пирролидона согласно изобретению, а именно: 0,25%, 0,6 %, 1,0% и 20,0% мас. 4-фенилпирролидона-2 (образцы 1-4, соответственно), 0,01%, 0,6%, 1,0% и 20,0% мас. 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты (образцы 6-9, соответственно), и 0,01%, 0,6%, 1,0% и 20,0% мас. этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата (образцы 10-13, соответственно) - обладают статистически достоверно увеличенной стабильностью при хранении по сравнению с прототипом. Результаты представлены ниже в таблицах 6-8.
Установлено, что после 71 суток хранения в условиях метода ускоренного старения новые составы N-карбамоилметил-4-фенил-2-пирролидона по настоящему изобретению обладают статистически достоверно увеличенной стабильностью. Субстанция прототипа остаётся стабильной в течение менее 10 суток, далее содержание N-карбамоилметил-4-фенил-2-пирролидона уменьшается более чем на 4°%. То есть новые составы N-карбамоилметил-4-фенил-2-пирролидона по настоящему изобретению являются значительно более стабильным при хранении по сравнению с прототипом.
Таблица 6. Оценка стабильности состава с 4-фенилпирролидоном-2 методом ускоренного старения в сравнении с прототипом
|
Таблица 7. Оценка стабильности состава с 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислотой методом ускоренного старения в сравнении с прототипом
|
Таблица 8. Оценка стабильности состава с этил-2-(2-оксо-4-фенилпирролидин-1-ил) ацетатом методом ускоренного старения в сравнении с прототипом
|
Пример 6. Определение гигроскопичности
Пониженная гигроскопичность является большим преимуществом новых составов N-карбамоилметил-4-фенил-2-пирролидона при получении и хранении субстанции.
Гигроскопичность оценивали при хранении твердого соединения в камерах с постоянной относительной влажностью при комнатной температуре в течение 96 часов. Сравнение безводных новых составов N-карбамоилметил-4-фенил-2-пирролидона с содержанием 0,25%, 0,6 %, 1,0% и 20,0% мас. 4-фенилпирролидона-2 (образцы 1-4, соответственно), 0,01%, 0,6%, 1,0% и 20,0% мас. 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты (образцы 6-9, соответственно), и 0,01%, 0,6%, 1,0% и 20,0% мас. этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата (образцы 10-13, соответственно) и прототипа при комнатной температуре показало, что прототип является гигроскопичным и обнаруживает большое увеличение влажности, начиная с 60 % относительной влажности. Новые составы N-карбамоилметил-4-фенил-2-пирролидона не обнаруживают никакого существенного увеличения влажности за исключением хранения при относительной влажности выше 90 %. Результаты представлены ниже в таблицах 9-11.
Таблица 9. Оценка гигроскопичности при комнатной температуре (96 ч) состава с 4-фенилпирролидоном-2 в сравнении с прототипом
|
Таблица 10. Оценка гигроскопичности при комнатной температуре (96 ч) состава с 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислотой в сравнении с прототипом
|
Таблица 11. Оценка гигроскопичности при комнатной температуре (96 ч) состава с этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетатом в сравнении с прототипом
|
Пример 7. Исследование общетоксического действия новых составов, включающего фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и 20,0% мас. 4-фенилпирролидона-2, фонтурацетам и 20,0% мас. 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты, и фонтурацетам и 20,0% мас. этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата
Цель исследования: определение переносимых, токсических и летальных доз и причин наступления гибели животных, оценка степени повреждающего действия препарата при его длительном введении на мелких лабораторных животных, выявление наиболее чувствительных органов и систем организма и исследование степени обратимости вызываемых повреждений
Изучение острой токсичности:
Материалы и методы:
Изучение острой токсичности заявленного состава, содержащего фонтурацетам и 20,00% мас. 4-фенилпирролидона-2, при однократном внутрижелудочном введении проведено на 20 белых нелинейных мышах-самцах весом 18-20 г, содержащихся в стандартных условиях вивария со свободным доступом к воде и корму. Испытывали дозы препарата 180, 250, 320 и 390 мг (по фонтурацетаму)/кг массы тела. На протяжении 14 дней оценивали общее состояние животных. О токсичности препаратов судили по гибели животных и общей картине интоксикации. Статистический анализ выполнялся с помощью программного обеспечения Statistica 6.0.
Параметры острой токсичности дали следующие результаты:
DL50 = 418 мг/кг, DL16 = 334 мг/кг, DL84= 581 мг/кг.
Таким образом, исследованный препарат по параметрам острой токсичности по классификации Hodge и Sterner (1943) может быть отнесен к умеренно токсичным соединениям.
Субхроническую токсичность препарата исследовали на 25 белых нелинейных крысах-самцах весом 168-229 г, содержащихся в стандартных условиях вивария со свободным доступом к воде и корму. Животным опытных групп в течение 30 дней ежедневно один раз в день вводили исследуемый препарат внутрижелудочно в дозах 6 и 60 мг (по фонтурацетаму)/кг массы тела в виде взвеси в 2% крахмальном геле, что соответственно, равно и в 10 раз превышает терапевтическую дозу для человека с учетом межвидового пересчета. После окончания эксперимента всех животных умерщвляли для проведения дальнейшего патоморфологического исследования внутренних органов и тканей.
Местно-раздражающее действие оценивали при макроскопическом и микроскопическом исследовании мест введения препаратов – желудочно-кишечного тракта.
Статистическое сравнение опытных и контрольных групп проводили по t-критерию Стьюдента.
Результаты
В группах животных, получавших внутрижелудочно суспензии исследуемого препарата в дозе 60 мг/кг, наблюдалась тенденция к снижению скорости прироста массы тела, незначительное, но достоверное увеличение активности трансаминаз крови и снижение спонтанной двигательной активности животных. Изученный препарат в дозах 6 и 60 мг/кг не вызывал отклонений биохимических и гематологических показателей. Не наблюдалось изменения суточного диуреза для групп животных, получавших опытный препарат, по отношению к группе контрольных животных, получавших внутрижелудочно 2% крахмальный гель в аналогичном объеме.
Патоморфологическое и микроскопическое исследование внутренних органов свидетельствуют об отсутствии в испытанных дозах выраженных признаков токсического действия препарата на внутренние органы, однако указывают на возможное проявление его местнораздражающего действия на слизистую оболочку желудка после 30 дней внутрижелудочного введения в дозе, в 10 раз превышающей терапевтическую с учетом межвидового пересчета доз.
Аналогично исследуют составы, включающие фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и 20,0% мас. 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты, и фонтурацетам и 20,0% мас. этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата.
Заявленные новые составы, включающие фонтурацетам (N-карбамоилметил-4-фенил-2-пирролидон) и 4-фенилпирролидон-2, фонтурацетам и 2-(2-оксо-4-фенилпирролидин-1-ил)уксусную кислоту, и фонтурацетам и этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетат, не проявляют мутагенных свойств в опытах на дрозофилах, не обладают аллергенностью, не обладают репродуктивной токсичностью.
Пример 8. Получение лекарственного средства в форме таблеток
Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг состава фонтурацетама согласно настоящему изобретению, содержащий 0,6 мас.% 4-фенилпирролидона-2, и спрессовывают в брусок. Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая.
Пример 9. Получение лекарственного средства в форме таблеток замедленного высвобождения
В установку для грануляции и сушки технологией псевдоожижения загружают просеянные гидроксипропилметилцеллюлозу низкой вязкости и состав фонтурацетама согласно настоящему изобретению, содержащий 0,1 мас.% 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты и 0,1 мас.% этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата и запускают процесс гранулирования, используя в качестве увлажнителя воду. Процесс сушки продолжают до достижения показателя «потери в массе при высушивании» значения 2,0±0,5 %.
По окончании процесса гранулирования полученный сухой гранулят калибруют через металлическое сито с диаметром отверстий 0,8 мм.
В смеситель барабанного типа загружают просеянную микрокристаллическую целлюлозу, откалиброванный гранулят и просеянную лактозу. Перемешивают в течение 2-4 минут. Затем загружают просеянный тальк, кремния диоксид коллоидный, перемешивают в течение 2-3 минут, затем загружают просеянный магния стеарат, гидроксипропилметилцеллюлозу высокой вязкости, перемешивают в течение 1-2 минут.
Таблеточную массу прессуют на ротационном прессе, используя пуансоны круглой формы (глубокая сфера) диаметром 8,0 ± 0,2 мм.
Пример 10. Получение лекарственного средства в форме капсул
Тщательно смешивают состав фонтурацетама согласно настоящему изобретению, содержащий 20% мас.% этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата, с порошком лактозы в соотношении 2 к 1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 11. Получение лекарственного средства в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций
Смешивают 500 мг состава фонтурацетама согласно настоящему изобретению, содержащего 0,5 мас.% 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты и 0,1 мас.% этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата, с 300 мг хлорбутанола, 2 мл пропиленгликоля, 4 мл ПАВ Твин-80 и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Пример 12. Исследование антиамнестической активности
Антиамнестическую активность новых составов, включающих фонтурацетам с содержанием 0,25%, 1,0% и 20,0% мас. 4-фенилпирролидона-2 (образцы 1, 3, 4, соответственно), 0,01%, 1,0% и 20,0% мас. 2-(2-оксо-4-фенилпирролидин-1-ил)уксусной кислоты (образцы 6, 8, 9, соответственно), и 0,01%, 0,6%, 1,0% и 20,0% мас. этил-2-(2-оксо-4-фенилпирролидин-1-ил)ацетата (образцы 10, 12, 13, соответственно) исследуют на модели условного рефлекса пассивного избегания (УРПИ) у самцов крыс линии Wistar массой 180-250 г. Для этого используют установку "Passive avoidence" фирмы "Lafauette instrument company" (США), состоящую из камеры с электродным полом, освещенной гильотинообразно закрывающимся отверстием с ярко освещенной платформой. Для выработки УРПИ крысу помещают на платформу хвостом к отверстию в камеру с электродным полом. В течение 180 с регистрируют латентное время первого захода животного в камеру. Через 3 мин после помещения животного в камеру в момент, когда животное находилось в ней, а не на платформе, отверстие закрывают и наносят через пол неустранимое электроболевое раздражение (8 электроимпульсов амплитудой 0,5 мА и длительностью 1 с каждый, интервал между импульсами 2 с). После этого животное извлекают из камеры. Сохранность УРПИ проверяют через 24 ч после его выработки, помещая крысу на платформу установки таким же образом, как и при обучении. В течение 180 с регистрируют латентное время первого захода в камеру. Если крыса не заходит в нее, латентное время считали равным 180 с.
В качестве амнестических факторов используют электросудорожный шок (ЭСШ 120 В, 300 мс), наносимый через корниальные электроды непосредственно после выработки УРПИ, или скополамин, вводимый подкожно в дозе 1 мг/кг за 60 мин до выработки УРПИ.
Новый состав фонтурацетама в дозе 25, 50 и 100 мг/кг, препарат сравнения пирацетам в дозе 100 и 300 мг/кг или 0,9%-ный раствор натрия хлорида вводят внутрибрюшинно за 45 мин до обучения.
Как следует из данных, приведенных в таблицах 12-14, использование новых составов N-карбамоилметил-4-фенил-2-пирролидона снижает выраженность постконвульсионной ретроградной амнезии. Выраженность эффекта проявляет прямую зависимость от дозы. Пирацетам проявляет антиамнестический эффект в дозе не менее 300 мг/кг, превышающей минимальную выявленную антиамнестическую дозу новых составов N-карбамоилметил-4-фенил-2-пирролидона (25 мг/кг) в 12 раз. Помимо этого, новые составы N-карбамоилметил-4-фенил-2-пирролидона в дозах от 25 до 100 мг/кг снижают выраженность амнезии, вызванной скополамином. При этом в указанных минимальных дозах новые составы N-карбамоилметил-4-фенил-2-пирролидона увеличивают латентный период захода в "опасную" камеру в 4,5 раза по сравнению с латенцией захода в нее амнезированных ЭСШ крыс, которым был введен не препарат, а изотонический раствор натрия хлорида. Следовательно, антиамнестический эффект новых составов фонтурацетама выше, и он эффективен в меньших дозах, чем пирацетам.
Таблица 12. Выраженность постконвульсионной ретроградной амензии состава с 4-фенилпирролидоном-2
|
* - p < 0,05 по сравнению с группой «Натрия хлорид + ЭСШ»
Таблица 13. Выраженность постконвульсионной ретроградной амензии состава с 2-(2-оксо-4-фенилпирролидин-1-ил) уксусной кислотой
|
* - p < 0,05 по сравнению с группой «Натрия хлорид + ЭСШ»
Таблица 14. Выраженность постконвульсионной ретроградной амензии состава с этил-2-(2-оксо-4-фенилпирролидин-1-ил) ацетатом
|
* - p <0,05 по сравнению с группой «Натрия хлорид + ЭСШ»
Изобретение может быть использовано в медицине, химии, фармакологии и химико-фармацевтической промышленности.

